一种筛选拮抗立枯丝核菌的固氮蓝藻的方法及其应用与流程
本发明涉及植物病害的生物防控领域和微生物筛选领域,特别一种筛选拮抗立枯丝核菌的固氮蓝藻的方法及其应用。
背景技术:
水稻纹枯病是真菌侵染引起的一种土传真菌性病害。其病原为瓜亡革菌thanatephoruscucumeris(frank)donk.,属担子菌亚门真菌,无性态rhizoctoniasolanikühn称立枯丝核菌,属半知菌亚门真菌。水稻纹枯病病原菌形成的菌核抗逆性强,在土壤中可以长期存活,发病时还可借助植物叶片进行横向传播,兼具土传和叶传能力,使其成为一种难以防治的顽固性病害(杨迎青等,2014)。近年来,随着高产、矮秆、多蘖、耐肥水稻品种的应用推广,耕作方式和气候条件的变化,水稻纹枯病的发生日益严重,是当前水稻生产上的主要病害之一(谢宗华等,2012)。对于水稻纹枯病防治,目前主要依靠种植抗病品种和施用化学农药。由于病原菌寄主范围宽,至今尚未找到对纹枯病免疫的水稻种质,抗性品种也非常稀少,给抗病育种增加了难度(srinivasacharyetal.,2011)。而抗病品种抗性容易退化,且优质丰产品种一般抗性较低。井冈霉素是纹枯病的特效药物,是我国稻田主要的防治药物,但长期单一使用井冈霉素防治其潜在的生态环境和人类健康风险高(mewetal.,2004)。欧盟自2004年起正式禁止井冈霉素销售。寻找生防菌资源,利用植物根际有益生物,探索防治水稻纹枯病环保和价格低廉的生物防治方法,对农业可持续发展具有重要意义(khokharetal.,2012)。近年来,国内外研究者已经发现了一些对水稻纹枯病病原菌-立枯丝核菌具有拮抗作用的真菌、细菌和放线菌(nagarajanetal.,2013)。但由于生防菌的变异性以及其在田间应用受多种复杂环境和生物因素的影响,导致防治效果不稳定,阻碍了其大规模商业化应用,因此,急需进一步研究和开发效果更好的生防菌。
继1939年印度科学家首次报道用蓝藻肥田后,许多国家相继开展了相关研究,研究证明在水稻田中接种蓝藻可增产。上世纪50年代开始黎尚豪在我国南方部分省区进行了稻田养藻的试验,结果表明水稻增产达10~30%(黎尚豪等,1962)。在全球变暖和水体富营养化日益严重的今天,利用生物多样性发展稻田低碳农业和控制农业面源污染具有重要意义(jacksonetal.,2007)。利用蓝藻进行生物固氮正好切合这一趋势。稻田放养蓝藻不但能为作物提供氮素(固氮)和有机质(固碳)、提高产量、降低化肥用量和生产成本、提高磷酸盐溶解度、减少水土污染,还能向作物根部供氧、分泌植物激素、氨基酸、维生素等生长调节剂、抑制杂草生长,从而可达到维持生态平衡和促进农业可持续发展的目的(prasannaetal.,2013;singhetal.,2011)。而singh等(2014)等认为蓝藻在作物保护方面也可能扮演重要角色,关于蓝藻抑制纹枯病病原菌已有一些报道,如chaudhary等(2012)等的实验室研究表明某些种类的念珠藻和鱼腥藻的培养液或藻细胞提取物可以抑制r.solani在内的很多有害微生物。
通常评判微生物竞争作用的经典方法为平板对峙实验,通过对峙实验可以清楚的观察到两种或多种微生物间的相互作用。但是,由于藻类和细菌的培养基配方差异很大,不能在同一个平板上进行生长对峙实验。现有筛选拮抗病原微生物藻类的方法一般采用藻提取物或胞外分泌物的平板生长抑制法,此方法只能间接评判藻与微生物的相互作用效果。并且,实验需要预先培养藻,制备藻提取物或胞外分泌物,用不同溶剂提取的藻体有效成分或胞外分泌物加入适合于病原微生物生长的培养基中制备平板,操作过程复杂,筛选通量低,还由于使用有机溶剂提取造成污染。
技术实现要素:
本发明的首要目的在于克服现有技术不能评估藻和菌的直接相互作用的缺点,提供一种筛选拮抗立枯丝核菌的固氮蓝藻的方法。
本发明的另一目的在于提供上述筛选拮抗立枯丝核菌的固氮蓝藻的方法的应用。
本发明的目的通过下述技术方案实现:一种筛选拮抗立枯丝核菌的固氮蓝藻的方法,包括如下步骤:
(1)分别配制bg110固体培养基和pda固体培养基;将灭菌后尚在液态的pda固体培养基和bg110固体培养基混合,得到混合培养基;
(2)在无菌的具有分格的培养皿的分格中分别倒入混合培养基和pda固体培养基,混合培养基和pda固体培养基相邻;在培养皿中的混合培养基和pda固体培养基的高度与培养皿中形成分格的隔断物的高度一样;
(3)在倒有混合培养基的分格的中心区域接种待筛选的藻,置于人工气候箱中培养,培养至待筛选的藻在培养基上稳定生长,再在倒有pda固体培养基的分格的中心区域接种立枯丝核菌;
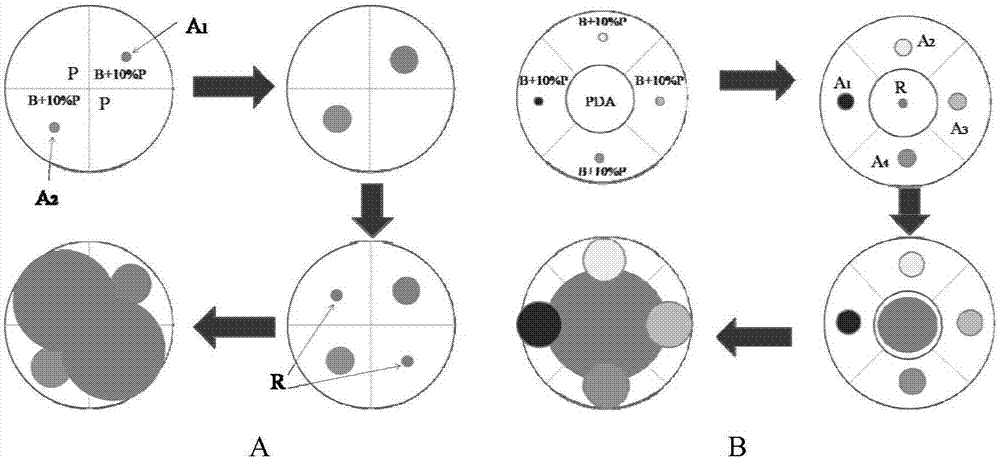
(4)培养;待对照培养皿中的立枯丝核菌长满培养皿时进行观察和测量,如观察到藻可以正常生长,且能抑制病菌向藻所在区域的扩散,即认为该藻具有拮抗立枯丝核菌的能力,并根据抑菌圈的大小判断抑菌强弱,如果被立枯丝核菌丝覆盖则表明没有抗性,如图1所示。
步骤(1)中所述的bg110固体培养基的组成如下:k2hpo4.3h2o0.04g/l、mgso4.7h2o0.075g/l、cacl2.2h2o0.036g/l、柠檬酸0.006g/l、柠檬酸铁铵0.006g/l、edta0.001g/l、na2co30.02g/l、微量元素a51ml/l、琼脂15~20g/l;
微量元素a5的组成如下:h3bo32.860g/l、namoo4.2h2o0.021g/l、mncl2.4h2o1.810g/l、znso4.7h2o0.222g/l、cuso4.5h2o0.079g/l、niso4.6h2o0.479g/l。
步骤(1)中所述的pda固体培养基的组成如下:200g新鲜马铃薯去皮切碎煮沸的提取物,葡萄糖20g,琼脂15~20g,纯水定容至1l,自然ph。
步骤(1)中所述的灭菌的条件优选为115~121℃灭菌15~30min;更优选为121℃灭菌15~20min。
步骤(1)中所述的pda培养基和所述的bg110培养基按1:2~18配比混合;更优选为按体积比1:10配比混合。
步骤(2)中所述的培养皿优选为直径是90mm的培养皿。
步骤(3)中所述的藻的接种量优选按形成直径为3~10mm的藻团量计算;更优选按形成直径为5mm的藻团量计算。
步骤(3)中所述的培养的条件优选为于23~30℃、光照2500~3200lx培养3~5天;更优选为于25~28℃、光照3000lx培养4天。
步骤(3)中所述的立枯丝核菌的接种量优选按接种直径3~8mm的立枯丝核菌计算;更优选按接种直径5mm的立枯丝核菌计算。
步骤(4)中所述的培养的条件优选为于23~30℃、光照2500~3200lx培养;更优选为于25~28℃、3000lx培养。
上述筛选拮抗立枯丝核菌的固氮蓝藻的方法在筛选拮抗立枯丝核菌的固氮蓝藻中的应用。
本发明相对于现有技术具有如下的优点及效果:
本发明通过优化培养基使两类培养条件差异很大的微生物能在同一个培养皿内实现较优的生长,实现了模拟实际情况下两者的相互作用,提供的方法能直接观察到藻类和立枯丝核菌的生长对峙状况。同时,使用本方法在4分格培养皿中可同时筛查2个藻,采用更多分格培养皿则可以同时筛查4~8个藻。相比传统的提取液平板生长抑制实验的1个平皿只能筛查1个藻且必须提取藻类有效成分进行试验。因此,本发明提供的方法大大提高了筛选效率,减少了环境污染。同时,更重要的是,实验结果更接近实际条件下的藻菌互作情况,所以筛选的有效性更强。
附图说明
图1是本发明的原理图;其中,图a为使用四分格培养皿,图b为使用5分格培养皿;a1~a4代表不同的蓝藻,r代表立枯丝核菌,p代表pda培养基,b代表bg110培养基。
图2是不同pda:bg110体积配比培养基上立枯丝核菌的生长状况照片图。
图3是不同pda:bg110配比培养基上两种代表性固氮蓝藻的生长状况照片图。
图4是混合培养基上固氮蓝藻与立枯丝核菌对峙实验结果照片图;其中,第1个平皿为pda对照。
图5是水泥池实验照片图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例中所用的材料:
蓝藻:念珠藻(nostocsp.)fachb-85、沼泽念珠藻(nostocpaludosum)fachb-89、念珠藻(nostocsp.)fachb-131、多变鱼腥藻(anabaenavariabilis)fachb-164和稻田鱼腥藻(anabaenaoryzae)fachb-604,中国科学院淡水藻种库的;本实验室分离纯化保藏的藻株池生念珠藻(nostocpiscinale)scau-003(保藏编号为cctccno:m2018194,保藏日期为2018年4月11日,保藏单位为位于中国武汉武汉大学的中国典型培养物保藏中心,已在专利申请201810397659.3中公开)。
立枯丝核菌,编号gim3.512,购自广东省微生物研究所菌种库,为水稻纹枯病致病菌。
实施例1:混合培养基的筛选
(1)分别配制含1.5%琼脂的bg110固体培养基和pda固体培养基;将灭菌(121℃灭菌15min)后尚在液态的pda固体培养基和bg110固体培养基按不同体积比配比混合(1:2、1:6、1:10、1:14、1:18),得到混合培养基。
(2)将步骤(1)得到的pda固体培养基、bg110固体培养基和不同配比的混合培养基倒平板,在平板上分别接种微藻和立枯丝核菌,于28℃、3000lx光照环境下进行培养。
(3)实验结果表明,测试发现所用的上述6种蓝藻均无法在纯pda培养基上正常生长,而立枯丝核菌gim3.512在bg110培养基上生长效果也比较差。pda培养基和bg110培养基按步骤(1)中配比得到的混合培养基上,与对照相比,除了1:14和1:18以外,均能覆盖培养皿的绝大部分区域,见图2,图2中pda培养基和混合培养基在4分格的直径为9cm的培养皿中依次排布,pda培养基和pda培养基之间为混合培养基,立枯丝核菌接种于pda上,对照组(ck)的4个分格中均为pda培养基。图2的结果说明,从利于立枯丝核菌生长的角度来看,pda与bg110培养基的比例为1:0~10合适。同时,考虑到pda培养基对藻生长的不利影响,对两种典型固氮蓝藻(nostocsp.fachb-131和anabaenavariabilisfachb-164)在不同比例混合培养基上的生长状况进行评估,结果如图3所示,表明在1:2和1:6两种混合培养基上,两种藻生长明显比纯bg110培养基的对照差,1:10的混合培养基上藻生长与bg110对照相当,可见,对于固氮蓝藻而言,pda与bg110培养基的比例为1:10~18合适。因此,后续均选择pda与bg110培养基的比例为1:10配比的混合培养基。
实施例2:拮抗立枯丝核菌的微藻的筛选
(1)培养基的配制,同实施例1步骤(1),其区别在于,混合培养基是pda培养基和bg110液体培养基按体积比1:10混合。
(2)用四分格培养皿,在分格内倒入培养基,2个分格内倒入混合培养基,2个分格内倒入pda培养基,其中,混合培养基和混合培养基通过pda培养基隔开。分格中培养基的高度与分格之间的隔断物高度一致。
(3)将预先在bg110固体培养基培养的藻接种到步骤(2)平皿中的含混合培养基的分格中心区域,藻团直径为5mm,28℃、光照强度3000lx环境下培养4天。然后在步骤(2)平皿中的含pda培养基的分格中心区域接种活化好的立枯丝核菌(直径为5mm的菌饼)。继续于相同光照和温度下培养。
(4)待对照平皿中的菌丝长满平皿后,观察藻与菌接近的区域有无抑菌带。如有抑菌带即测量其宽度,通过其宽度大小确定藻的拮抗能力大小。
最终的实验结果见图4,左边第1个皿为对照(ck),其他3个为藻与立枯丝核菌的对峙实验平皿,每个皿的左下和右上各一个藻株;结果显示,藻scau-003周边出现了明显的抑菌圈,而fachb-85、fachb-131和fachb-89虽然没有抑菌圈但是没有完全没菌丝覆盖,而fachb-604和fachb-164则完全被立枯丝核菌覆盖。
实施例3:拮抗立枯丝核菌固氮蓝藻的水泥池验证实验
(1)2017年3月-8月,地点为华南农业大学生态农场。根据上述平板实验结果试验选择4个不同效果的藻(藻株scau-003、fachb-85、fachb-89和fachb-604)处理和1个不加藻对照ck,每组三个重复,共15个水泥池(1m×1m)。
(1)在实验室用bg110培养基培养4种藻,纱绢过滤收集,称重后用水稀释到500ml均匀后在水稻(黄华占,购自深圳隆平金谷种业有限公司)开始分蘖时撒施入池。每个水泥池添加6g湿藻。待藻生长1周后,加入用pdb液体培养基无菌培养12天的立枯丝核菌菌液50ml。pdb培养基配方为:200g新鲜马铃薯去皮切碎煮沸的提取物,葡萄糖20g,纯水1l,不加琼脂,自然ph。待水稻抽穗30天后调查病级。实验现场见图5。
实验结果表明,水泥池环境中放养scau-003抑制水稻纹枯病的效果明显,相比ck抑制率37%,而fachb-85和fachb-89均有一定的抑制效果,fachb-604则表现为促进纹枯病发展,这都与前述平板实验结果一致。这说明本发明提供的平板对峙法筛选结果是可靠的。
表1水泥池固氮蓝藻抗病实验结果
注:ck为基准,负数表示与ck相比促进菌的侵染
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!