一种脐带间充质干细胞分离方法与流程
本发明涉及细胞分离培养技术领域,具体而言,涉及一种脐带间充质干细胞分离方法。
背景技术:
间充质干细胞(mesenchymalstemcells,msc)是中胚层来源的、具有高度自我更新能力和多向分化潜能的多能干细胞。事实上,msc广泛存在于全身多种组织中,几乎来源于机体所有的组织器官,如骨髓、骨膜、脂肪组织、牙髓、滑膜、脐带、胎盘、羊水及胎儿组织等。不同来源的间充质干细胞具有相似的形态,表达相同的表面标记,具有相似的生物学特性方面,如可在体外培养扩增,并能在特定条件下分化为包括神经细胞、成骨细胞、软骨细胞、肌肉细胞、脂肪细胞在内的多组织系统的细胞。msc除了具有多向组织细胞分化能力之外,还在造血、免疫炎症反应、血管新生等人体重要功能中起重要调节作用。
脐带间充质干细胞是指存在于新生儿脐带组织中的一种多功能干细胞。脐带间充质是一类低免疫原性细胞,且具有很强的免疫调节功能。脐带间充质干细胞拥有msc的全部特性,并且含量丰富,易于分离培养。
与其他来源的msc相比,uc-msc更原始,是介于胚胎干细胞和成体干细胞之间的干细胞,其增殖和分化能力比胚胎干细胞低,但明显高于成体干细胞。
脐带间充质干细胞具有多分化潜能,在特定的诱导条件下,uc-msc不仅能分化为骨、软骨、脂肪、肌腱等中胚层细胞,而且能够向内胚层组织细胞(如心肌细胞、肝细胞)和外胚层组织细胞(如神经细胞)分化。uc-msc不具致瘤性,能在不同的诱导条件及合适的体内生长微环境中,安全地定向分化为不同的组织细胞系,具有修复各种组织和器官的能力。
人脐带是一种胶状的结缔组织,如何高效地从脐带中分离脐带间充质干细胞是一直以来的难题。原代脐带间充质干细胞的最常见分离方法包括酶消化法和组织块培养法。酶消化培养法的经济成本高,通常需要使用专用的消化设备,消化设备比较昂贵。消化时间时间很长,一般4~5h,且消化程度不易把控,消化不够,无法得到足够数量的细胞,消化时间过久,使用的酶对细胞的损伤太大,细胞会大量死亡。且由于消化液为黏稠液体,离心时不易分离出细胞。组织块培养法过程简便易行,且经济成本低,但原代培养时间太长,通常需要14~20d才能够得到数量不多的原代细胞。
有鉴于此,特提出本发明。
技术实现要素:
本发明的主要目的是结合使用酶消化法和组织块法,优化脐带间充质干细胞(mesenchymalstemcells,msc)的分离方法,提高分离效率和细胞数量。
为了实现本发明的上述目的,特采用以下技术方案:
本发明涉及一种脐带间充质干细胞分离方法,包括:
将清理后的脐带剪成8mm3~64mm3大小的组织块后,依次用1.1g/l~1.4g/l胰酶消化10min~30min,0.06wt%~0.09wt%胶原酶消化40min~80min;
将消化完成的组织块清洗后进行培养。
与现有技术相比,本发明的有益效果为:
本发明所提供的方法综合了组织块法和消化法二者的优点,能快速高效分离msc,原代培养时间大大缩短,培养第3~4天即可看到细胞从组织块中爬出,细胞爬出时间较单纯组织块法大大缩短。且爬出的细胞非常多,细胞状态良好,生长速度非常快。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
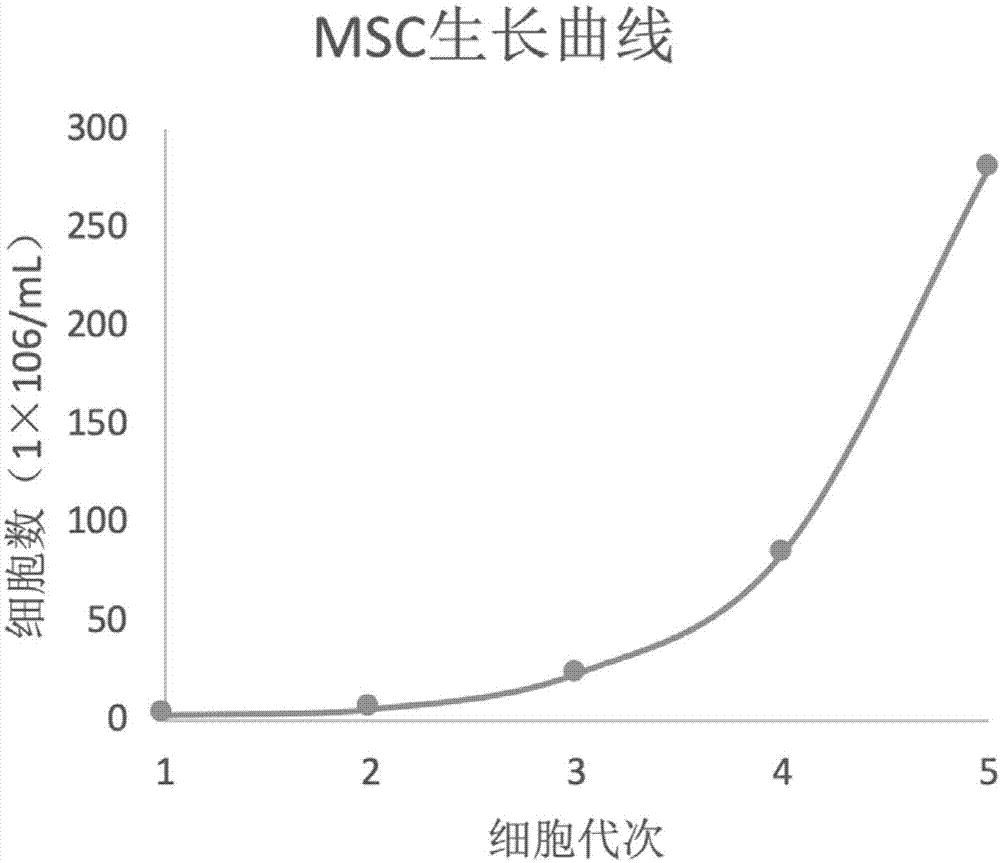
图1为本发明一个实施例中所培养得到的msc的生长曲线;
图2为本发明一个实施例中所培养得到的msc的细胞图像。
具体实施方式
本发明可通过后续对于本发明一些实施方案描述以及其中所包括的实施例的详细内容而更容易被了解。
在进一步叙述本发明之前,应明了本发明不会被局限于所述特定实施方案中,因为这些实施方案必然是多样的。亦应明了本说明书中所使用的用语仅是为了阐述特定实施方案,而非作为限制,因为本发明的范围将会被仅仅界定在所附的权利要求中。
具体的,本发明涉及一种脐带间充质干细胞分离方法,该方法包括:
将清理后的脐带剪成8mm3~64mm3大小的组织块后,依次用1.1g/l~1.4g/l胰酶消化10min~30min,0.06wt%~0.09wt%胶原酶消化40min~80min;
将消化完成的组织块清洗后进行培养。
在一些实施方式中,组织块的大小为8mm3~64mm3,也可以选择15mm3、20mm3、27mm3、35mm3、45mm3、55mm3。
在一些实施方式中,在进行胰酶消化时,用1.2g/l~1.3g/l胰酶消化15min~25min。
在一些实施方式中,在进行胰酶消化时,用1.25g/l胰酶消化20min。
在一些实施方式中,在进行胶原酶消化时,用0.07wt%~0.08wt%胶原酶消化50min~70min。
在一些实施方式中,在进行胶原酶消化时,用0.075wt%胶原酶消化60min。
适宜大小的组织块,配合适宜浓度的胰酶和胶原酶处理,可兼具缩短消化时间、缩小原代培养时间与减小细胞损伤的作用。
在一些实施方式中,脐带的清理方法为:
无菌条件下剥离脐带外膜,去除脐动脉和脐静脉,清洗除去残余血液和其他杂质。
在一些实施方式中,胰酶消化过程在36℃~38℃下,通过将脐带静置浸泡进行。
在一些实施方式中,胶原酶消化过程在36℃~38℃下,震荡中进行;
在一些实施方式中,震荡频率为100r/min~250r/min。
在一些实施方式中,所述胶原酶为ii型胶原酶。
ii型胶原酶能很好地用于脐带组织的消化,且其分子颗粒小于i型胶原酶,所以更容易被除去。
在一些实施方式中,所述消化完成的组织块清洗的方法包括:
a)900rpm~1100rpm离心3min~7min;
b)弃去上清液,沉淀重悬后900rpm~1100rpm离心3min~7min;
可选的,重复步骤b)一次或多次。
在一些实施方式中,所述消化完成的组织块清洗的方法包括:
a)1000rpm离心5min;
b)弃去上清液,沉淀重悬后1000rpm离心5min。
在一些实施方式中,沉淀重悬所用的溶液为含8%~12%fbs的α-mem培养基;
或为含10%fbs的α-mem培养基。
在一些实施方式中,所述培养所采用的培养基中含有0.8w/v%~1.2w/v%谷氨酰胺、bfgf15~25ng/ml,egf15~25ng/ml;
在一些实施方式中,所述培养所采用的培养基中含有0.9w/v%~1.1w/v%谷氨酰胺、bfgf17~23ng/ml,egf17~23ng/ml;
在一些实施方式中,所述培养所采用的培养基中含有1.0w/v%谷氨酰胺、bfgf20ng/ml,egf20ng/ml。
在一些实施方式中,所述培养基中的基础成分为含8%~12%fbs的α-mem培养基;
在一些实施方式中,所述培养基中的基础成分为含10%fbs的α-mem培养基。
在一些实施方式中,在进行所述培养时,使组织块半浸泡于培养基中,于36℃~38℃下培养。
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
本实施例提供了一种脐带间充质干细胞分离方法
1)无菌条件下剥离脐带外膜,去除脐动脉和脐静脉,用无菌pbs充分冲洗,去掉残余血液和其他杂质。
2)将脐带剪成2mm×2mm×2mm大小组织块,放入离心管内。
3)加入1.1g/l的胰酶,至脐带组织块完全浸泡于其中,在培养箱中37℃消化30min,用fbs终止消化。
4)弃去消化液,加入0.06wt%ii型胶原酶,至脐带组织块完全浸泡于其中,密封离心管。
5)摇床内37℃低速振荡消化80min。
6)900rpm,离心7min,弃去上清液。
7)沉淀用含8%fbs的α-mem清洗,1100rpm,离心3min。
8)将组织块均匀接种至培养瓶中,缓慢加入适量完全培养基,避免组织块浮起。放入co2培养箱中37℃下贴壁培养。
完全培养基配方:α-mem,8%fbs,0.8w/v%谷氨酰胺,bfgf15ng/ml,egf25ng/ml。
实施例2
本实施例提供了一种脐带间充质干细胞分离方法
1)无菌条件下剥离脐带外膜,去除脐动脉和脐静脉,用无菌pbs充分冲洗,去掉残余血液和其他杂质。
2)将脐带剪成4mm×4mm×4mm大小组织块,放入离心管内。
3)加入1.4g/l的胰酶,至脐带组织块完全浸泡于其中,在培养箱中37℃消化10min,用fbs终止消化。
4)弃去消化液,加入0.09wt%ii型胶原酶,至脐带组织块完全浸泡于其中,密封离心管。
5)摇床内37℃低速振荡消化40min。
6)1100rpm,离心3min,弃去上清液。
7)沉淀用含12%fbs的α-mem清洗,900rpm,离心7min。
8)将组织块均匀接种至培养瓶中,缓慢加入适量完全培养基,避免组织块浮起。放入co2培养箱中37℃下贴壁培养。
完全培养基配方:α-mem,12%fbs,1.2w/v%谷氨酰胺,bfgf25ng/ml,egf15ng/ml。
实施例3
本实施例提供了一种脐带间充质干细胞分离方法
1)无菌条件下剥离脐带外膜,去除脐动脉和脐静脉,用无菌pbs充分冲洗,去掉残余血液和其他杂质。
2)将脐带剪成2.5mm×2.5mm×2.5mm大小组织块,放入离心管内。
3)加入1.2g/l的胰酶,至脐带组织块完全浸泡于其中,在培养箱中37℃消化15min,用fbs终止消化。
4)弃去消化液,加入0.08wt%ii型胶原酶,至脐带组织块完全浸泡于其中,密封离心管。
5)摇床内37℃低速振荡消化70min。
6)950rpm,离心6min,弃去上清液。
7)沉淀用含9%fbs的α-mem清洗,1100rpm,离心4min。
8)将组织块均匀接种至培养瓶中,缓慢加入适量完全培养基,避免组织块浮起。放入co2培养箱中37℃下贴壁培养。
完全培养基配方:α-mem,11%fbs,0.9w/v%谷氨酰胺,bfgf18ng/ml,egf22ng/ml。
实施例4
本实施例提供了一种脐带间充质干细胞分离方法
1)无菌条件下剥离脐带外膜,去除脐动脉和脐静脉,用无菌pbs充分冲洗,去掉残余血液和其他杂质。
2)将脐带剪成3mm×3mm×3mm大小组织块,放入离心管内。
3)加入1.25g/l的胰酶,至脐带组织块完全浸泡于其中,在培养箱中37℃消化20min,用fbs终止消化。
4)弃去消化液,加入0.075%ii型胶原酶,至脐带组织块完全浸泡于其中,密封离心管。
5)摇床内37℃低速振荡消化1h。
6)1000rpm,离心5min,弃去上清液。
7)沉淀用含10%fbs的α-mem清洗,1000rpm,离心5min。
8)将组织块均匀接种至培养瓶中,缓慢加入适量完全培养基,避免组织块浮起。放入co2培养箱中37℃下贴壁培养。
完全培养基配方:α-mem,10%fbs,1%谷氨酰胺,bfgf20ng/ml,egf20ng/ml。
该实施例培养得到的msc生长曲线如图1所示,从图1中可知,使用本发明所提供的方法,在培养第3~4天开始细胞就已经开始快速生长。培养第5天得到的msc细胞图像如图2所示,可见细胞生长状况良好。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!