一种调控转录激活因子以降低黄酒酵母尿素积累的方法与流程
本发明涉及一种调控转录激活因子以降低黄酒酵母尿素积累的方法,属于遗传工程领域。
背景技术:
酿酒酵母对氮源的利用存在偏好性,优先利用偏好型氮源(如谷氨酰胺、谷氨酸等),对非偏好型氮源(如尿素、脯氨酸等)的利用滞后,这种现象被称为氮代谢物阻遏效应。调控因子gln3和gat1是酿酒酵母氮代谢阻遏效应全局调控因子之一,对氮源利用相关基因其转录激活作用。在偏好型氮源存在的情况下,gln3和gat1定位于细胞质,无法进入细胞核激活非偏好型氮源利用相关基因的表达,导致非偏好型氮源利用被抑制,最终在发酵体系中积累。
黄酒发酵过程中,酿酒酵母发挥主要作用。受氮代谢物阻遏效应的影响,在黄酒发酵过程中,尿素利用滞后,最终在发酵体系中积累。积累的尿素会与体系中乙醇发生自发反应,生成2a类潜在致癌物质氨基甲酸乙酯,严重影响黄酒产品的安全性。因此通过调控转录激活因子定位于细胞核,可以有效减弱氮代谢阻遏效应对尿素利用的抑制作用,降低发酵过程中尿素的积累,提高黄酒产品的品质。
技术实现要素:
本发明提供了一种降低黄酒酵母尿素积累的方法,所述方法通过调控转录激活因子定位于细胞核,调控氮代谢阻遏效应转录激活因子不受氮源条件影响,降低黄酒酵母发酵过程中尿素的积累。
在本发明的一种实施方式中,所述转录激活因子包括但不限于gln3、gat1。
本发明的第二个目的是提供一种构建尿素积累能力降低的黄酒酵母的方法,所述方法是在重组黄酒酵母jnz01(mata,δura3,δtrp1,tor1s1972r,δfpr1)的基因组上融合表达gln3、fkbp12或gat1、fkbp12,并在质粒上融合表达spt15、frb,并通过在含雷帕霉素的体系中培养,使fkbp12和frb结合使gln3和gat1在细胞核定位蛋白spt15的作用下转移到细胞核。
在本发明的一种实施方式中,所述方法包括如下步骤:
(1)构建gln3、fkbp12和gat1、fkbp12重组框;
(2)将gln3、fkbp12和gat1、fkbp12重组框分别整合到重组黄酒酵母jnz01(mata,δura3,δtrp1,tor1s1972r,δfpr1)基因组上gln3和gat1基因之后;
(3)消除crispr-cas9系统质粒,得到重组黄酒酵母jnz02和jnz03;
(4)构建spt15、frb融合表达框;
(5)将spt15、frb融合表达框转化至重组黄酒酵母jnz02和jnz03中,得到重组黄酒较慢jnz04和jnz05;
(6)在步骤(5)获得的在重组黄酒酵母的培养过程中,向培养基中添加雷帕霉素,诱导gln3和gat1定位于细胞核。
在本发明的一种实施方式中,所述重组黄酒酵母jnz01的构建方法为:以黄酒酵母xz-11为出发菌株,敲除其fpr1基因,并突变tor1基因编码的蛋白第1972位丝氨酸残基为精氨酸。
在本发明的一种实施方式中,所述尿素积累能力降低的黄酒酵母具体的构建方法如下:
(1)通过融合pcr构建gln3、fkbp12和gat1、fkbp12重组框;
(2)通过crispr-cas9系统将gln3、fkbp12和gat1、fkbp12重组框分别整合到重组黄酒酵母jnz01(mata,δura3,δtrp1,tor1s1972r,δfpr1)基因组上gln3和gat1基因之后。
(3)通过在ypd培养基中传代,消除crispr-cas9系统质粒,在5-foa和5-faa平板上进行筛选,得到重组黄酒酵母jnz02(mata,δura3,δtrp1,tor1s1972r,δfpr1,gln3::fkbp12)和jnz03(mata,δura3,δtrp1,tor1s1972r,δfpr1,gat1::fkbp12)。
(4)通过融合pcr构建spt15、frb融合表达框;
(5)通过酶切连接将spt15、frb融合表达框插入高拷贝游离表达质粒prs426-tef-ura3中,得到重组质粒prs426-tef-spt15-frb-ura3,分别转化重组黄酒酵母jnz02和jnz03,分别得到重组黄酒酵母jnz04(mata,δura3,δtrp1,tor1s1972r,δfpr1,gln3::fkbp12,prs426-tef-spt15-frb-ura3)和jnz05(mata,δura3,δtrp1,tor1s1972r,δfpr1,gat1::fkbp12,prs426-tef-spt15-frb-ura3)。
(6)通过向重组黄酒酵母jnz04和jnz05培养基中添加雷帕霉素,诱导gln3和gat1定位于细胞核。
本发明的第三个目的是保护应用所述方法构建获得的尿素积累能力降低的黄酒酵母。
本发明还要求保护所述黄酒酵母在食品领域的应用。
在本发明的一种实施方式中,所述应用包括作为发酵菌株制备酒精饮品。
在本发明的一种实施方式中,所述应用包括作为发酵菌株制备黄酒。
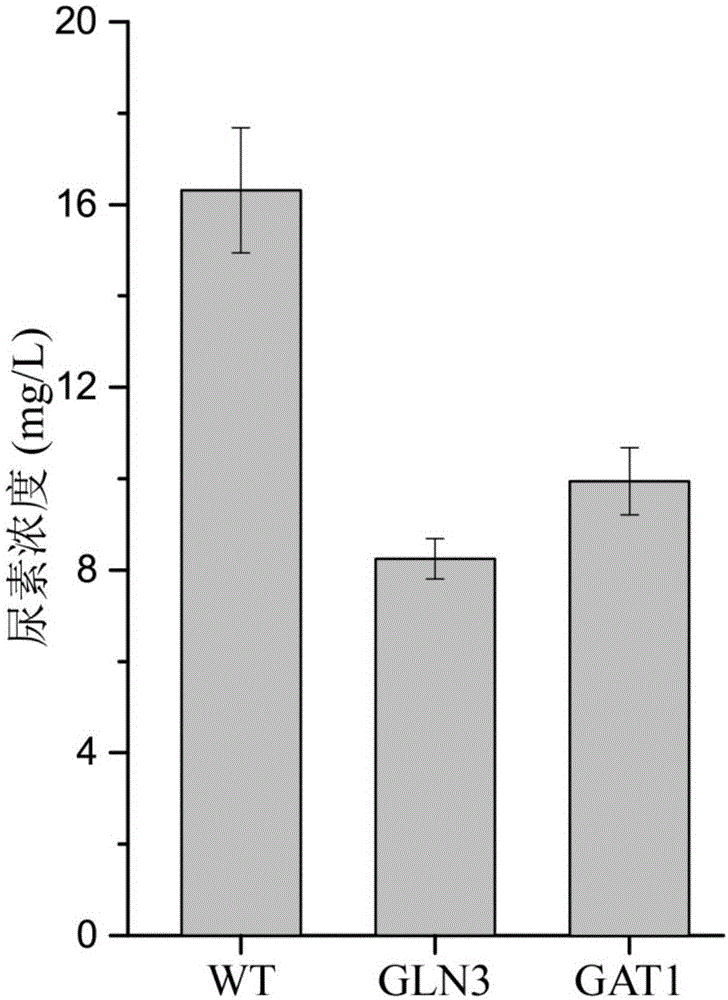
有益效果:本发明提供了一种调控氮代谢阻遏效应全局转录激活因子gln3和gat1定位于细胞核的方法,通过该方法构建的重组黄酒酵母可使发酵体系中尿素浓度分别降低49.45%和38.98%,降低到8.25mg/l和9.95mg/l,具有重要的工业应用前景。
附图说明
图1为调控氮代谢阻遏效应转录激活因子gln3和gat1定位于细胞核对菌株尿素积累的影响;
图2为偏好型氮源条件下调控氮代谢阻遏效应转录激活因子gln3和gat1定位于细胞核对菌株尿素代谢相关基因表达的影响。
具体实施方式
实施例1适用于雷帕霉素介导调控蛋白亚细胞定位的黄酒酵母的构建
(1)拆分用于黄酒生产的二倍体酿酒酵母菌株xz-11获得单倍体菌株
按论文“wudh,lixm,shenc,etal.isolationofahaploidfromanindustrialchinesericewineyeastformetabolicengineeringmanipulation[j].journaloftheinstituteofbrewing,2013,119(4):288-293.”中所述方法及步骤获得不含抗性基因的单倍体xz-11a菌株。
(2)构建营养缺陷型单倍体黄酒酵母jnz01
以黄酒酵母xz-11菌株基因组为模板,分别扩增ura3基因上、下游300bp序列,通过融合pcr将上述两个扩增片段融合得到ura3基因敲除框。将ura3敲除框转化xz-11a菌株,在5-foa平板(ynb1.7g/l,硫酸铵5g/l,葡萄糖20g/l,尿嘧啶25mg/l,5-foa1g/l,琼脂粉20g/l)上筛选,获得尿嘧啶缺陷型菌株xz-11a-ura3。以黄酒酵母xz-11菌株基因组为模板,分别扩增trp1基因上、下游300bp序列,通过融合pcr将上述两个扩增片段融合得到trp1基因敲除框。将trp1敲除框转化xz-11a-ura3菌株,在5-faa平板(ynb1.7g/l,硫酸铵5g/l,葡萄糖20g/l,尿嘧啶25mg/l,色氨酸25mg/l,5-faa1g/l,琼脂粉20g/l)上筛选,获得尿嘧啶和色氨酸二重营养缺陷性菌株jnz01(mataδura3,δtrp1)。
(3)构建prs426-tor1sgrna-fpr1sgrna-ura3质粒
首先根据yeastriction(http://yeastriction.tnw.tudelft.nl/#!/)设计运用crispr-cas9系统编辑基因组上fpr1和tor1位点所需的20nt序列(fpr1:ttggttaccattcattacac;tor1:tgttatgttcaacgaaaaat)。以质粒p426-snr52p-grna.can1.y-sup4t(addgene编号43803)为模板,通过融合pcr分别获得fpr1sgrna和tor1sgrna编码框,并将原定位到can1位点的20nt序列分别替换为定位到fpr1和tor1的20nt序列。通过酶切连接,分别将fpr1sgrna和tor1sgrna克隆到质粒prs426-ura3的kpni和xhoi、spei和saci位点,得到质粒prs426-fpr1sgrna-tor1sgrna-ura3。
(4)构建fpr1基因敲除框和tor1基因点突变重组框
以基因组为模板,分别扩增fpr1基因上下游各200bp的片段,通过融合pcr得到fpr1基因的敲除框。以基因组为模板,分别扩增tor1基因5801~5923bp和5911~6000bp间序列,在引物中将5914~5919bp区域的序列由原始的agccgc突变为cgtcga,将1972位的丝氨酸突变为精氨酸,同时在1973位上引入同义突变产生一个sali酶切位点。通过融合pcr,将两段片段融合为tor1基因点突变重组框。
(5)crispr-cas9系统一步敲除fpr1基因和点突变tor1基因
将质粒p414-tef1p-cas9-cyc1t(addgene编号43802)转化到出发菌株黄酒酵母xz-11中,在sc-trp1平板(ynb1.7g/l,硫酸铵5g/l,葡萄糖20g/l,尿嘧啶25mg/l,琼脂粉20g/l)筛选阳性转化子。将质粒p426-fpr1sgrna-tor1sgrna-ura3、fpr1基因敲除框和tor1基因点突变重组框一起转化带有p414-tef1p-cas9-cyc1t质粒的出发菌,在sc平板(ynb1.7g/l,硫酸铵5g/l,葡萄糖20g/l,琼脂粉20g/l)上筛选。通过菌落pcr筛选同时敲除fpr1基因和点突变tor1基因的重组菌,得到阳性转化子jnz0(mata,δura3,δtrp1,tor1s1972r,δfpr1,p426-fpr1sgrna-tor1sgrna-ura3,p414-tef1p-cas9-cyc1t)。
(6)消除crispr-cas9系统质粒
将筛选得到的阳性转化子于ypd培养基(酵母膏10g/l,蛋白胨20g/l,葡萄糖20g/l)中传代培养,每培养24h后以10%接种量转接到新鲜的ypd培养基中。每次转接同时在含有5-foa和5-faa的平板(ynb1.7g/l,硫酸铵5g/l,葡萄糖20g/l,尿嘧啶25mg/l,色氨酸25mg/l,5-foa1g/l,5-faa1g/l,琼脂粉20g/l)上划线,直至在含有5-foa和5-faa的平板上获得转化子。通过菌落pcr验证转化子中p426-fpr1sgrna-tor1sgrna-ura3和p414-tef1p-cas9-cyc1t已消除,得到重组黄酒酵母jnz01(mata,δura3,δtrp1,tor1s1972r,δfpr1)。
实施例2融合pcr构建融合表达gln3、fkbp12和gat1、fkbp12重组框
首先通过全质粒pcr将(ggggs)3linker引入到高拷贝质粒载体prs426-tef-ura3上bamhi位点之后,得到prs426-tef-gs-ura3。通过基因合成获得n端融合4个sv40核定位序列的fkbp12蛋白,通过酶切连接克隆到载体prs426-tef-gs-ura3的ecori和xhoi位点,得到prs426-tef-gs-sv40-fkbp12-ura3。分别从基因组上扩增得到gln3和gat1末尾不含终止密码子的500bp序列,分别通过酶切连接克隆到载体prs426-tef-gs-sv40-fkbp12-ura3的spei和bamhi位点,得到prs426-tef-gln3d-gs-sv40-fkbp12-ura3和prs426-tef-gat1d-gs-sv40-fkbp12-ura3。然后以得到的质粒为模板,进行pcr扩增,通过在上游引物中引入gln3和gat1下游50bp序列,分别得到融合表达gln3、fkbp12重组框和gat1、fkbp12重组框。
实施例2通过crispr-cas9系统在重组黄酒酵母jnz01基因组上整合融合表达gln3、fkbp12和gat1、fkbp12重组框
首先根据yeastriction(http://yeastriction.tnw.tudelft.nl/#!/)设计运用crispr-cas9系统编辑基因组上gln3和gat1位点所需的20nt序列(gln3:ataatgataatgataatacg;gat1:aattcagattcaaccaatcc)。以质粒p426-snr52p-grna.can1.y-sup4t(addgene编号43803)为模板,通过全质粒pcr将20nt序列替换掉原质粒上定位到can1位点的20nt序列,分别得到p426-gln3sgrna和p426-gat1sgrna。将质粒p414-tef1p-cas9-cyc1t(addgene编号43802)转化到重组黄酒酵母jnz01中,在sc-trp1平板(ynb1.7g/l,硫酸铵5g/l,葡萄糖20g/l,尿嘧啶25mg/l,琼脂粉20g/l)筛选阳性转化子,得到菌株jnz01-cas9。将质粒p426-gln3sgrna和融合表达gln3、fkbp12重组框一起转化菌株jnz01-cas9,在sc平板(ynb1.7g/l,硫酸铵5g/l,葡萄糖20g/l,琼脂粉20g/l)上筛选。通过菌落pcr筛选融合表达gln3、fkbp12重组框整合到基因组上的阳性转化子。将质粒p426-gat1sgrna和融合表达gat1、fkbp12重组框一起转化菌株jnz01-cas9,在sc平板(ynb1.7g/l,硫酸铵5g/l,葡萄糖20g/l,琼脂粉20g/l)上筛选。通过菌落pcr筛选融合表达gat1、fkbp12重组框整合到基因组上的阳性转化子。
实施例3消除crispr-cas9系统质粒
将筛选得到的阳性转化子于ypd培养基(酵母膏10g/l,蛋白胨20g/l,葡萄糖20g/l)中传代培养,每培养24h后以10%接种量转接到新鲜的ypd培养基中。每次转接的同时在5-foa和5-faa平板(ynb1.7g/l,硫酸铵5g/l,葡萄糖20g/l,尿嘧啶25mg/l,色氨酸25mg/l,5-foa1g/l,5-faa1g/l,琼脂粉20g/l)上划线,直至在5-foa和5-faa平板上获得转化子。通过菌落pcr验证转化子中p426-gln3sgrna、p426-gat1sgrna和p414-tef1p-cas9-cyc1t已消除,得到重组黄酒酵母jnz02(mata,δura3,δtrp1,tor1s1972r,δfpr1,gln3::fkbp12)和jnz03(mata,δura3,δtrp1,tor1s1972r,δfpr1,gat1::fkbp12)。
实施例4融合表达spt15、frb
通过基因合成获得n端融合4个sv40核定位序列的frb,通过酶切连接克隆到载体prs426-tef-gs-ura3的ecori和xhoi位点,得到prs426-tef-gs-sv40-frb-ura3。从重组黄酒酵母jnz01(mata,δura3,δtrp1,tor1s1972r,δfpr1)基因组上扩增得到不含终止密码子的spt15基因序列,通过酶切连接克隆到载体prs426-tef-gs-sv40-frb-ura3的spei和bamhi位点,得到prs426-tef-spt15-gs-sv40-frb-ura3。将质粒prs426-tef-spt15-gs-sv40-frb-ura3分别转化重组黄酒酵母jnz02和jnz03,在sc-ura3培养基(ynb1.7g/l,硫酸铵5g/l,葡萄糖20g/l,色氨酸25mg/l,琼脂粉20g/l)筛选阳性转化子,分别得到重组黄酒酵母jnz04(mata,δura3,δtrp1,tor1s1972r,δfpr1,gln3::fkbp12,prs426-tef-spt15-frb-ura3)和jnz05(mata,δura3,δtrp1,tor1s1972r,δfpr1,gat1::fkbp12,prs426-tef-spt15-frb-ura3)。
实施例5应用jnz04和jnz05菌株进行发酵降低发酵液中尿素积累量
在发酵培养基(ynb1.7g/l,硫酸铵5g/l,葡萄糖20g/l,20种必需氨基酸各5g/l,尿素5g/l,雷帕霉素1μg/ml)中用jnz04、jnz05和jnz01进行发酵。30℃220rpm培养48h后,利用高效液相色谱检测发酵液中尿素含量。最终调控gln3或gat1定位于细胞核后,发酵液中尿素含量分别降低为8.25mg/l和9.95mg/l,比出发菌分别降低49.45%和38.98%。检测方法同论文“zhangw,chengy,liy,etal.adaptiveevolutionrelievesnitrogencataboliterepressionanddecreasesureaaccumulationinculturesofthechinesericewineyeaststrainsaccharomycescerevisiaexz-11[j].jagricfoodchem,2018,66(34):9061-9069.”中的方法。
实施例6应用jnz04和jnz05菌株在黄酒模拟发酵体系中降低尿素
以jnz04、jnz05和jnz01进行黄酒模拟发酵。取100g糯米,在室温中浸渍2-3天;经常压蒸煮后,添加17.4g麦曲(生麦曲13.5g,熟麦曲3.4g)、170g水,并将经活化后的jnz04、jnz05和jnz01菌株按10%(v/v)的接种量接种,加入雷帕霉素至终浓度为1μg/ml。摇瓶加发酵栓后于30℃静置发酵,每日称重,当日失重小于2g时结束前酵。将摇瓶置于15℃继续静置发酵,15天后结束后酵。检测发酵体系中尿素含量,结果显示,调控gln3或gat1定位于细胞核后,发酵体系中尿素含量分别降低为7.32mg/l和8.97mg/l,比出发菌分别降低45.33%和33.01%。
实施例7调控gln3和gat1定位于细胞核强化尿素代谢途径
通过定量pcr技术谷氨酰胺+尿素(偏好性氮源)为氮源条件下检测尿素途径相关基因和ncr调控因子表达上下调情况。将在平板上活化的酵母菌株接种到ynb-ura培养基中,30℃,220rpm中过夜培养。将活化后的酵母稀释至od600=0.2-0.3,转接到偏好型氮源培养基(ynb1.7g/l,葡萄糖20g/l,谷氨酰胺5g/l,尿素5g/l,雷帕霉素1μg/ml)中进行培养。培养结束后离心收集菌体,用超纯水洗涤2次,保存于液氮中或-80℃冰箱待用。酵母总rna提取按照酵母总rna提取试剂盒的说明书操作,提取的酵母总rna随即按照takara反转录试剂盒的说明书合成cdna,cdna用于荧光定量pcr,荧光定量pcr所用引物由软件beacondesigner7设计并经过hplc纯化,退火温度设定为55℃,片段长度为120~150bp。利用2×sybrpremixextaq在lightcycler480荧光定量pcr仪上进行扩增和数据采集。act1基因为内参基因。表2定量pcr所用引物。
表2定量pcr引物
结果如图2所示,在偏好型培养基中,gln3和gat1核定位菌株的尿素降解酶编码基因dur1,2表达上调幅度分别是jnz01的7.73倍和6.17倍,尿素转运蛋白编码基因dur3分别是jnz01的4.31倍和3.48倍,精氨酸降解酶编码基因car1分别是jnz01的4.68倍和3.66倍,广谱型氨基酸转运蛋白编码基因gap1分别是jnz01的3.74倍和2.69倍。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种调控转录激活因子以降低黄酒酵母尿素积累的方法
<160>5
<170>patentinversion3.3
<210>1
<211>20
<212>dna
<213>人工序列
<400>1
ttggttaccattcattacac20
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
tgttatgttcaacgaaaaat20
<210>3
<211>15
<212>prt
<213>人工序列
<400>3
glyglyglyglyserglyglyglyglyserglyglyglyglyser
151015
<210>4
<211>20
<212>dna
<213>人工序列
<400>4
ataatgataatgataatacg20
<210>5
<211>20
<212>dna
<213>人工序列
<400>5
aattcagattcaaccaatcc20
- 还没有人留言评论。精彩留言会获得点赞!