一种基于巢式PCR的检测沙门氏菌的引物组、用途、包含该引物组的试剂盒及其检测方法与流程
本发明属于细菌检测
技术领域:
,具体涉及一种基于巢式pcr的检测沙门氏菌的引物组、同时涉及该引物组的用途、利用该引物组制备的试剂盒及该使用试剂盒检测肠道血清型沙门氏菌的检测方法。
背景技术:
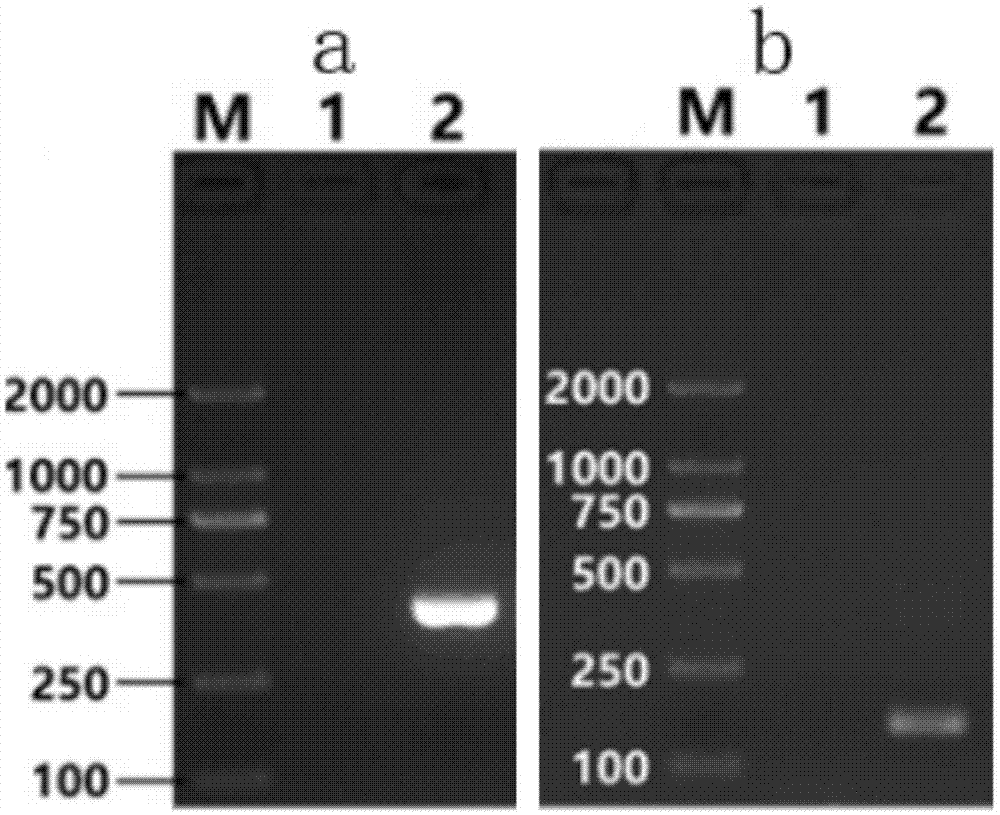
:沙门氏菌(salmonellaspp.)是一大群寄生于人类和动物肠道内的革兰氏阴性杆菌(g-),是肠杆菌科中最常见的人畜共患型致病菌。目前已知的沙门氏菌血清型超过2500种,除了不到10种罕见的血清型属于邦戈尔沙门氏菌外,其余血清型都属于肠道沙门氏菌,因此几乎所有的沙门氏菌都能引起严重的食物中毒事件。入侵作用是沙门氏菌进入机体,引起机体患病主要的关键因素,有毒力的沙门氏菌能入侵小肠粘膜上皮细胞,并穿越细胞层进入血液体循环。世界卫生组织(wto)将沙门氏菌列入具有严重危害和中等危害的食物传播性病原菌。据统计,目前世界上54%的食源性致病是由沙门氏菌引起的,位居于前列且在过去16年发病率从未降低。然而,引起沙门氏菌中毒的食品中,约90%是肉、蛋、奶等畜产品,是人们生活中极为常见并且必须的食品,沙门氏菌的污染严重影响着人们的生活。沙门氏菌是肠杆菌科中的一个重要菌属,是人和动物的常见食源性病原菌,可引起人患多种疾病,如菌血症、肠热症、食物中毒、胃肠炎等。目前,对沙门氏菌的检测主要是以传统的细菌分离、血清型实验和生化鉴定等方法为主,通常需要5-7天的检测周期,存在操作繁琐、灵敏度低和准确率不高等缺陷,不能满足及时有效的质量监测和疾病控制需求。同时,市面上也存在灵敏度更高的检测方法,如常规pcr检测技术,该方法也是诊断机体或食物中检测沙门氏菌最常用的方法,但是该方法特异性低、在复杂样品中对pcr扩增存在抑制作用,扩增时容易产生假阳性。另外,食物中的沙门氏菌浓度较低,往往容易导致产生漏检,但食物中的低浓度沙门氏菌也足以引起机体患病,因此,开发一种灵敏度高、检测周期短的检测方法迫在眉睫。因此急待开发精确、灵敏、快速、无污染的临床病原微生物检验方法。技术实现要素:为了解决现有技术存在的上述问题,本发明目的在于提供一种灵敏度高的基于巢式pcr的检测沙门氏菌的引物组、同时提供该引物组的用途、利用该引物组制备的试剂盒及该使用试剂盒检测沙门氏菌的检测方法。本发明所采用的技术方案为:本发明提供了一种基于巢式pcr的检测沙门氏菌的引物组,所述引物组包括两对引物,其中外引物为f1和r1,内引物为f2和r2,所述f1的核苷酸序列如seqidno.1所示,所述r1的核苷酸序列如seqidno.2所示;所述f2的核苷酸序列如seqidno.3所示,所述r2的核苷酸序列如seqidno.4所示。本发明还提供了一种检测沙门氏菌的试剂盒,包括前述的引物组、pcr扩增试剂、阳性质控品和阴性质控品,所述阳性质控品为沙门氏菌标准株基因组dna,即肠炎沙门氏菌标准株atcc13076,所述阴性质控品为双蒸水。具体的,上述检测沙门氏菌的试剂盒,所述pcr扩增试剂为浓度为2×的pcrmix。本发明还提供了一种用前述试剂盒检测沙门氏菌的检测方法,包括以下步骤:(1)准备待测dna样品:按常规dna提取方法提取待测样本的dna;(2)配制三组pcr的反应液:包括检测组、阴性对照组和阳性对照组,三组pcr的反应液中均包括pcr扩增试剂、前述的外引物、模板一和双蒸水,所述检测组、阳性对照组和阴性对照组的模板一分别依次为待测dna样品、阳性质控品和双蒸水;(3)首轮pcr反应:将步骤(2)中配制好的三组pcr反应液分别离心混匀,进行首轮pcr,分别得到三组pcr反应液一;(4)配制第二轮pcr的反应液:所述检测组、阳性对照组和阴性对照组的第二轮pcr的反应液包括pcr扩增试剂、前述的内引物、模板二和双蒸水,所述检测组、阳性对照组和阴性对照组中的模板二分别依次为所述检测组、阳性对照组和阴性对照组的pcr反应液一稀释后的pcr反应液;(5)第二轮pcr反应:将步骤(4)中配制好的第二轮pcr的反应液分别离心混匀,进行第二轮pcr,分别得到三组pcr反应液二;(6)检测:将三组pcr反应液二分别检测,判断结果。具体的,所述检测沙门氏菌的检测方法,所述步骤(3)中首轮pcr的反应条件为,94℃预热2min,94℃保持45s,60℃保持45s,72℃保持45s,共35个循环,末次延伸至72℃,保持4min。具体的,所述检测沙门氏菌的检测方法,所述步骤(5)中第二轮pcr的反应条件为,94℃预热2min,94℃保持10s,65℃保持15s,72℃保持15s,共35个循环,末次延伸至72℃,保持4min。具体的,所述检测沙门氏菌的检测方法,所述步骤(2)中首轮pcr和步骤(4)中第二轮pcr的pcr反应液的体积均为25μl;每组pcr反应液中各组分的加样量为,2×的pcrmix为12.5μl,10μmol/l的f1或f2各1μl,10μmol/l的r1或r2各1μl,模板为1μl,余量用双蒸水补齐。具体的,所述检测沙门氏菌的检测方法,所述模板二由pcr反应液一稀释100倍制备而成。本发明还提供了一种前述引物组在检测沙门氏菌或制备检测沙门氏菌的试剂盒中的应用。具体的,所述引物组用于制备检测沙门氏菌的试剂盒。本发明的有益效果为:本发明提供的基于巢式pcr的检测沙门氏菌的引物组特异性好,利用该引物组制备的试剂盒特异性好、灵敏度高,最低可检测出102cfu/ml的沙门氏菌;利用该引物组的检测方法用于检测沙门氏菌操作简单、成本低,可应用于临床、食品和复杂样品的准确灵敏的检测。附图说明图1是本发明中的检测沙门氏菌的引物组的特异性检测结果;图2是本发明的试验例6中本发明提供的试剂盒的特异性检测结果图;图3是本发明的试验例7中本发明提供的试剂盒的灵敏度的检测结果图。具体实施方式下面结合附图及具体试验例对本发明做进一步阐释。试验例1本试验例的目的在于提供用于检测沙门氏菌的两对特异性引物。依据ncbi上公开的沙门氏菌的基因组序列(genbankaccessionnumberu25352),根据引物设计原则和巢式pcr扩增技术原理设计两对引物,外引物为f1和r1,内引物为f2和r2,所述f1的核苷酸序列如seqidno.1所示,所述r1的核苷酸序列如seqidno.2所示;所述f2的核苷酸序列如seqidno.3所示,所述r2的核苷酸序列如seqidno.4所示。将设计的两对特异性引物送至生物公司合成,分别得到f1/r1及f2/r2,对所得到的f1/r1及f2/r2进行基因测序验证确认。表1引物名称seq序列号引物序列(5’-3’)f1seqidno.1gcgagattgtgagtaaaaacaccr1seqidno.2ctgcccggagatataataatcgf2seqidno.3acccgctgtatttatgccttacr2seqidno.4atcgccaatgtatgagtcgtag试验例2本试验例的目的在于验证试验例1提供的引物的特异性。(1)准备样品dna:以沙门氏菌标准株基因组dna为样品dna;如取180-220mg待测样品放入1.5mlep管中,加入200μlpbs溶液浸没样品,充分混匀后,用细菌基因组dna提取试剂盒进行样品dna提取;(2)取2只pcr反应管,用于阳性样品的扩增pcr反应管,标为“+”,用于阴性样品的扩增pcr反应管,标为“-”;阳性样品:标号为“+”,向pcr反应管中加入试验例1提供的引物组(包括外引物f1和r1)、2×pcrmix和样品dna,总体积为25μl,余量用双蒸水补齐;阴性样品:标号为“-”,向pcr反应管中加入的试剂包括试验例1提供的引物组(包括外引物f1和r1)和2×pcrmix,总体积为25μl,余量用双蒸水补齐;具体加样体系如下表所示:表2试剂加样量(μl)2×pcrmix12.5f1(10um)1r1(10um)1样品dna1ddh2o9.5(3)将步骤(2)中的两只pcr管分别离心混匀后,进行第一轮外引物f1/r1扩增,扩增反应条件为:94℃预热2min;94℃保持45s,60℃保持45s,72℃保持45s,该步骤进行共35个循环;末次延伸至72℃,保持4min,得到pcr反应液一;(4)取2只pcr反应管,用于阳性样品的扩增pcr反应管,标为“+”,用于阴性样品的扩增pcr反应管,标为“-”,以pcr反应液一用双蒸水稀释100倍后作为第二轮pcr反应的模板:阳性样品:标号为“+”,向pcr反应管中加入试验例1提供的引物组(包括内引物f2和r2)、2×pcrmix,同时加入步骤(3)中得到的阳性样品的pcr反应液一稀释100倍得到的模板,总体积为25μl,余量用双蒸水补齐;阴性样品:标号为“-”,向pcr反应管中加入的试剂包括试验例1提供的引物组(包括内引物f2和r2)和2×pcrmix,同时加入步骤(3)中得到的阴性样品的pcr反应液一稀释100倍得到的模板,总体积为25μl,余量用双蒸水补齐;具体加样体系如下表所示:表3试剂加样量(μl)2×pcrmix12.5内引物f2(10um)1内引物r2(10um)1稀释后的第一轮pcr产物dna1ddh2o9.5(5)将步骤(4)中的两只pcr分别离心混匀后,进行第二轮内引物扩增,扩增反应条件为:94℃预热2min;94℃保持10s,65℃保持15s,72℃保持15s,该步骤进行共35个循环;末次延伸至72℃,保持4min,得到pcr反应液二;(6)结果判定:各取pcr反应液一和取pcr反应液二5μl,使用2%浓度琼脂糖凝胶电泳检测鉴定。结果如图1所示:图1中a图为第一轮外引物pcr(pcr反应液一)的凝胶电泳图,m为2000bpmarker,1为阴性样品,2为阳性样品沙门氏菌,阳性样品对应的泳道具有明显的目的条带413bp,而阴性样品对应的泳道未见目的条带,将目的条带回收后测序,测序证明即为沙门氏菌,表明本发明提供的外引物的特异性较好,可特异性检测出沙门氏菌。图1中b为第二轮内引物pcr的凝胶电泳图,m为2000bpmarker,1为阴性样品的二次pcr后的产物,2为阳性样品沙门氏菌的二次pcr后的产物,阳性样品对应的泳道具有明显的目的条带152bp,而阴性样品对应的泳道未见目的条带,将目的条带回收后测序,测序证明即为沙门氏菌,表明本发明提供的内引物的特异性较好,可特异性检测出沙门氏菌。试验例3本试验例的目的在于提供一种用于检测沙门氏菌的试剂盒。一种用于检测沙门氏菌的试剂盒,包括试验例1的引物组、pcr扩增试剂、阳性质控品和阴性质控品,其中阳性质控品为沙门氏菌标准株基因组dna,阴性质控品为双蒸水,其中pcr扩增试剂为现有技术中所有可用于巢式pcr的pcr扩增酶。试验例4本试验例的目的在于提供一种用于检测沙门氏菌的试剂盒。一种用于检测沙门氏菌的试剂盒,包括以下组分:(1)引物组:f1/r1及f2/r2两对引物,各引物序列参见表1,各引物的浓度为10μmol/l;(2)pcr扩增试剂:2×pcrmix(2xtsingkemastermix);(3)阳性质控品为沙门氏菌标准株基因组dna;(4)阴性质控品为双蒸水。试验例5本试验例的目的在于验证试验例4提供的试剂盒的使用方法,即用前述试剂盒检测沙门氏菌的检测方法。具体步骤如下:(1)准备待测dna样品:按常规dna提取方法提取待测样本的dna,如取180-220mg待测样品放入1.5mlep管中,加入200μlpbs溶液浸没样品,充分混匀后,用细菌基因组dna提取试剂盒进行样品dna提取。(2)配制三组pcr的反应液:待测样品组:按待测样品个数编号,向pcr反应管中加入试验例1的引物组(包括内引物和外引物)、2×pcrmix和待测样品dna,总体积为25μl,余量用双蒸水补齐;阳性样品:标号为“+”,向pcr反应管中加入试验例1提供的引物组(包括外引物f1和r1)、2×pcrmix和样品dna,总体积为25μl,余量用双蒸水补齐;阴性样品:标号为“-”,向pcr反应管中加入的试剂包括试验例1提供的引物组(包括外引物f1和r1)和2×pcrmix,总体积为25μl,余量用双蒸水补齐;具体加样体系如表2所示;(3)将步骤(2)中配制好的三组pcr反应液分别混匀离心,进行第一轮外引物f1/r1扩增,扩增反应条件为:94℃预热2min;94℃保持45s,60℃保持45s,72℃保持45s,该步骤进行共35个循环;末次延伸至72℃,保持4min,得到pcr反应液一;(4)以pcr反应液一用双蒸水稀释100倍后作为第二轮pcr反应的模板:待测样品:按待测样品个数编号,向pcr反应管中加入试验例1提供的引物组(包括内引物f2和r2)、2×pcrmix,同时加入步骤(3)中得到的各个待测样品的pcr反应液一稀释100倍得到的模板,总体积为25μl,余量用双蒸水补齐;阳性样品:标号为“+”,向pcr反应管中加入试验例1提供的引物组(包括内引物f2和r2)、2×pcrmix,同时加入步骤(3)中得到的阳性样品的pcr反应液一稀释100倍得到的模板,总体积为25μl,余量用双蒸水补齐;阴性样品:标号为“-”,向pcr反应管中加入的试剂包括试验例1提供的引物组(包括内引物f2和r2)和2×pcrmix,同时加入步骤(3)中得到的阴性样品的pcr反应液一稀释100倍得到的模板,总体积为25μl,余量用双蒸水补齐;具体加样体系如表3所示;(5)将步骤(4)中的反应体系分别离心混匀后,进行第二轮内引物扩增,扩增反应条件为:94℃预热2min;94℃保持10s,65℃保持15s,72℃保持15s,该步骤进行共35个循环;末次延伸至72℃,保持4min,得到pcr反应液二;(6)结果判定:取pcr反应液二5μl,使用2%浓度琼脂糖凝胶电泳检测鉴定。试验例6本试验例的目的在于验证试验例4提供的试剂盒的特异性。具体步骤如下:(1)被检样品dna的提取:取180-220mg待测样品放入1.5mlep管中,加入200μlpbs溶液浸没样品,充分混匀后,用细菌基因组dna提取试剂盒进行样品dna提取。待测样品包括:肠炎沙门氏菌(atcc13076)、鼠伤寒沙门氏菌(atcc23566)、鸡白痢沙门氏菌(atcc13036)、纽坡特沙门氏菌(atcc27869)、加利福尼亚沙门氏菌(atcc23201)、德尔卑沙门氏菌(atcc6960)、伤寒沙门氏菌(cmcc(b)50071)、大肠杆菌(atcc25922)、金黄色葡萄球菌(atcc25923)和志贺氏菌(cmcc51252)。(3)配制三组pcr的反应液:待测样品组:取10个pcr反应管,按待测样品编号为2~11,2~11中的待测样品dna分别依次为肠炎沙门氏菌、鼠伤寒沙门氏菌、鸡白痢沙门氏菌、纽坡特沙门氏菌、加尼福尼亚沙门氏菌、德尔卑沙门氏菌、伤寒沙门氏菌、大肠杆菌、金黄色葡萄球菌和志贺氏菌的dna;向pcr反应管中加入试验例1的外引物、2×pcrmix和待测样品dna,总体积为25μl,余量用双蒸水补齐;阴性样品:标号为1,向pcr反应管中加入试验例1提供的引物组(包括外引物f1和r1)、2×pcrmix和样品dna,总体积为25μl,余量用双蒸水补齐;具体加样体系如表2所示;(3)将步骤(2)中配制好的三组pcr反应液分别混匀离心,进行第一轮外引物f1/r1扩增,扩增反应条件为:94℃预热2min;94℃保持45s,60℃保持45s,72℃保持45s,该步骤进行共35个循环;末次延伸至72℃,保持4min,得到pcr反应液一;(4)以pcr反应液一用双蒸水稀释100倍后作为第二轮pcr反应的模板:待测样品:取10个pcr反应管,按待测样品编号为2~11,向pcr反应管中加入试验例1提供的引物组(包括内引物f2和r2)、2×pcrmix,编号为2~11的pcr反应管中分别对应加入步骤(3)中得到的肠炎沙门氏菌、鼠伤寒沙门氏菌、鸡白痢沙门氏菌、纽坡特沙门氏菌、加尼福尼亚沙门氏菌、德尔卑沙门氏菌、伤寒沙门氏菌、大肠杆菌、金黄色葡萄球菌和志贺氏菌的dna的pcr反应液一稀释100倍得到的模板,总体积为25μl,余量用双蒸水补齐;阴性样品:取1个pcr反应管,标号为1,向pcr反应管中加入试验例1提供的引物组(包括内引物f2和r2)、2×pcrmix,同时加入步骤(3)中得到的阳性样品的pcr反应液一稀释100倍得到的模板,总体积为25μl,余量用双蒸水补齐;具体加样体系如表3所示;(5)将步骤(4)中的反应体系分别离心混匀后,进行第二轮内引物扩增,扩增反应条件为:94℃预热2min;94℃保持10s,65℃保持15s,72℃保持15s,该步骤进行共35个循环;末次延伸至72℃,保持4min,得到pcr反应液二;(6)结果判定:第二轮pcr扩增程序结束后,从1~11号的反应液中取等量的pcr产物5μl进行2%琼脂糖凝胶电泳鉴定。图2中第二轮外引物pcr(pcr反应液二)的凝胶电泳图,m为2000bpmarker,1为阴性样品,2~11中的待测样品dna分别依次为肠炎沙门氏菌、鼠伤寒沙门氏菌、鸡白痢沙门氏菌、纽坡特沙门氏菌、加尼福尼亚沙门氏菌、德尔卑沙门氏菌、伤寒沙门氏菌、大肠杆菌、金黄色葡萄球菌和志贺氏菌的dna的pcr反应液二,2~8的pcr反应液二具有明显的目的条带152bp,而阴性样品1和9~11号细菌的pcr反应液二对应的泳道未见目的条带,表明本发明提供的试剂盒的特异性较好,可特异性检测出血清型沙门氏菌,对其他非沙门氏菌呈现阴性反应,说明本发明所建立的方法的特异性较好。试验例7本试验例的目的在于研究试验例4的检测方法的最低检出浓度。操作步骤如下:(1)制备待测dna样品:按试验例4中的方法制备沙门氏菌dna样品,利用nanodrop2000分光光度计测量沙门氏菌dna样品浓度,按表4所示,制备9组不同浓度的沙门氏菌dna样品,分别编号为1~9。(2)配制三组pcr的反应液:待测样品组:取9个pcr反应管,按待测样品编号为2~10,2~10中的待测样品dna分别依次为表4中所示浓度的沙门氏菌dna样品;向pcr反应管中加入试验例1的外引物、pcr扩增试剂和待测样品dna,总体积为25μl,余量用双蒸水补齐;表4编号浓度1109cfu/ml2108cfu/ml3107cfu/ml4106cfu/mll5105cfu/ml6104cfu/ml7103cfu/ml8102cfu/ml9101cfu/ml阴性样品:取1个pcr反应管,标号为1,向pcr反应管中加入试验例1提供的引物组(包括外引物f1和r1)、2×pcrmix和样品dna,总体积为25μl,余量用双蒸水补齐;具体加样体系如表2所示;(3)将步骤(2)中配制好的三组pcr反应液分别混匀离心,进行第一轮外引物f1/r1扩增,扩增反应条件为:94℃预热2min;94℃保持45s,60℃保持45s,72℃保持45s,该步骤进行共35个循环;末次延伸至72℃,保持4min,得到pcr反应液一;(4)以pcr反应液一用双蒸水稀释100倍后作为第二轮pcr反应的模板:待测样品:取9个pcr反应管,按待测样品编号为2~11,向pcr反应管中加入试验例1提供的引物组(包括内引物f2和r2)、2×pcrmix,编号为2~11的pcr反应管中分别对应加入步骤(3)中得到的肠炎沙门氏菌、鼠伤寒沙门氏菌、鸡白痢沙门氏菌、纽坡特沙门氏菌、加尼福尼亚沙门氏菌、德尔卑沙门氏菌、伤寒沙门氏菌、大肠杆菌、金黄色葡萄球菌和志贺氏菌的dna的pcr反应液一稀释100倍得到的模板,总体积为25μl,余量用双蒸水补齐;阴性样品:取1个pcr反应管,标号为1,向pcr反应管中加入试验例1提供的引物组(包括内引物f2和r2)、2×pcrmix,同时加入步骤(3)中得到的阳性样品的pcr反应液一稀释100倍得到的模板,总体积为25μl,余量用双蒸水补齐;具体加样体系如表3所示;(5)将步骤(4)中的反应体系分别离心混匀后,进行第二轮内引物扩增,扩增反应条件为:94℃预热2min;94℃保持10s,65℃保持15s,72℃保持15s,该步骤进行共35个循环;末次延伸至72℃,保持4min,得到pcr反应液二;(6)结果判定:第二轮pcr扩增程序结束后,从1~11号组的反应液中取等量的pcr产物5μl进行2%琼脂糖凝胶电泳鉴定。pcr反应:按照试验例4中所述方法进行反应。图3中a图为第一轮外引物pcr(pcr反应液一)的凝胶电泳图,m为2000bpmarker,1为阴性样品,2~11中的待测样品dna分别依次为109cfu/ml、108cfu/ml、107cfu/ml、106cfu/mll、105cfu/ml、104cfu/ml、103cfu/ml、102cfu/ml和101cfu/ml的沙门氏菌dna的pcr反应液一,2~7的pcr反应液一对应的泳道具有明显的目的条带413bp,而阴性样品和8~10的pcr反应液一对应的泳道未见目的条带,表明本发明提供的外引物的最低能检测出104cfu/ml的沙门氏菌;图3中b图第二轮外引物pcr(pcr反应液二)的凝胶电泳图,m为2000bpmarker,1为阴性样品,2~11中的待测样品dna分别依次为109cfu/ml、108cfu/ml、107cfu/ml、106cfu/mll、105cfu/ml、104cfu/ml、103cfu/ml、102cfu/ml和101cfu/ml的沙门氏菌dna的pcr反应液二,2~9的pcr反应液二具有明显的目的条带152bp,而阴性样品和10的pcr反应液二对应的泳道未见目的条带,表明本发明提供的外引物的最低能检测出102cfu/ml的沙门氏菌;由以上结果可知,本发明提供的试剂盒或检测方法灵敏度较高,高于常规pcr方法100倍,能检测102cfu/ml的沙门氏菌。本发明的试验例1中用于检测沙门氏菌的引物组可以用于沙门氏菌的检测,例如用于检测食品(例如畜禽肉品)中是否有沙门氏菌、用于科研实验等活动中沙门氏菌的检测。进一步的,试验例3~4中提供的试剂盒可用于,例如用于检测食品(例如畜禽肉品)中是否有沙门氏菌、用于科研实验等活动中沙门氏菌的检测,以便于各种合适场合检测沙门氏菌。进一步的,试验例5提供的检测方法可用于非临床沙门氏菌的各种检测场合。本发明不局限于上述可选的实施方式,任何人在本发明的启示下都可得出其他各种形式的产品。上述具体实施方式不应理解成对本发明的保护范围的限制,本发明的保护范围应当以权利要求书中界定的为准,并且说明书可以用于解释权利要求书。序列表<110>四川大学<120>一种基于巢式pcr的检测沙门氏菌的引物组、用途、包含该引物组的试剂盒及其检测方法<160>4<170>siposequencelisting1.0<210>1<211>23<212>dna<213>人工序列(artificialsequence)<400>1gcgagattgtgagtaaaaacacc23<210>2<211>22<212>dna<213>人工序列(artificialsequence)<400>2ctgcccggagatataataatcg22<210>3<211>22<212>dna<213>人工序列(artificialsequence)<400>3acccgctgtatttatgccttac22<210>4<211>22<212>dna<213>人工序列(artificialsequence)<400>4atcgccaatgtatgagtcgtag22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1