利用铁粉和钴粉水热还原二氧化碳产长链烷烃的方法与流程
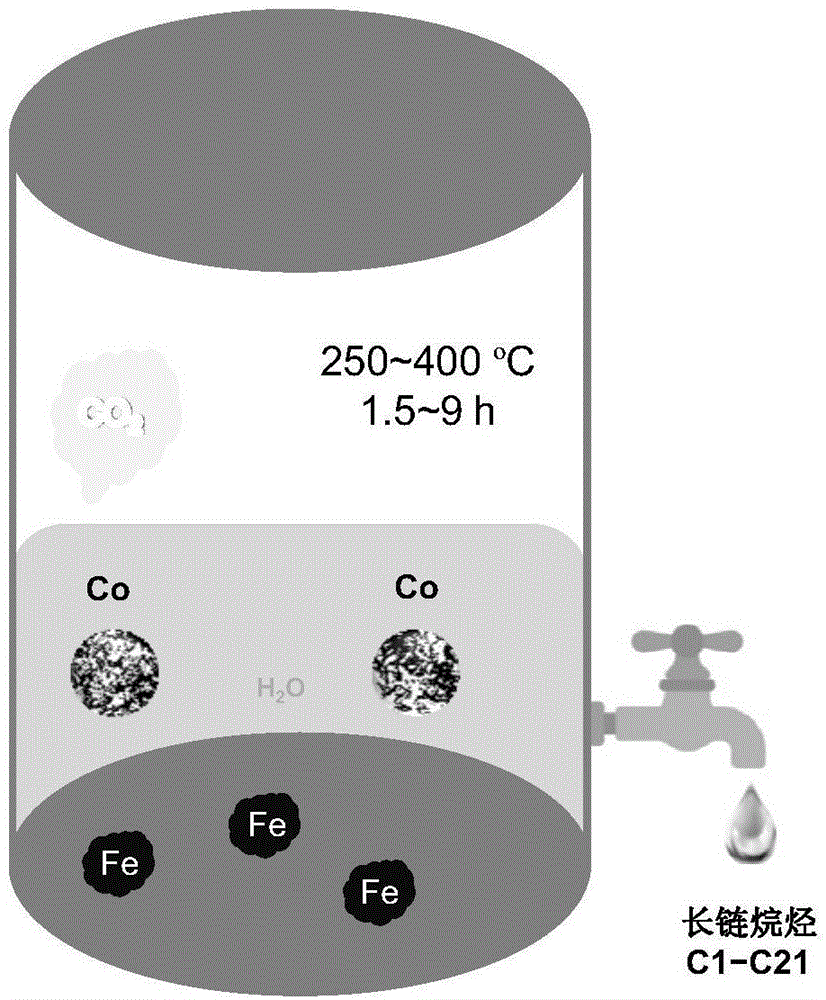
本发明涉及一种利用铁粉和钴粉水热还原二氧化碳产长链烷烃的新方法,属环境工程技术领域和二氧化碳资源化利用技术领域。
背景技术:
现代社会的快速发展消耗了大量的珍贵的化石燃料能源(煤、石油、天然气等),产生了大量的温室气体二氧化碳进入到大气,由此引发了温室效应等一连串迫在眉睫的全球气候环境问题。将二氧化碳进行还原转化生成高附加值的精细化学品或能源燃料,既可以“变废为宝”、减少二氧化碳的排放,又可以将可再生能源如电能转化为高能量密度的能源燃料储存,具有重要的科学价值和现实意义。
目前,主要的二氧化碳的还原技术主要包括:热能加氢催化还原法、电化学能加氢还原法、光能催化加氢还原法和水热还原法等。
二氧化碳催化加氢还原成有机物是二氧化碳资源化利用最成熟的技术,它是通过加昂贵的氢源氢气,在高温高压的条件下,使氢和二氧化碳分子在过渡金属催化剂活性表面发生氧化还原反应来生成高附加值的化工产品。氢气作为一种稳定且容易燃烧的气体,在其生产、运输以及储存过程中会消耗额外的能量。且采用清洁能源作为原料会导致能源的浪费。同时,该法所采用的催化剂多为复合催化剂或贵金属催化剂如pd,rh,ir和ru,在气相反应中也容易产生积碳,造成催化剂的毒化,使得制作工艺复杂或者使用成本较高。电化学加氢还原法主要是一种克服co2/co2-的高还原电化学电位的有效方法之一,通过电化学加氢还原法得到的产物以c1化合物为主,高于两个碳的有机化合物难以生成或产物的法拉第效率不高,且氢气还原过程为其主要的竞争反应。光催化加氢还原法是利用光线使半导体催化功能材料吸收光能并刺激光生电子和光生空穴的产生,从而直接或间接地与二氧化碳反应生成有机化合物的一种方法。光催化加氢还原法是直接使用光能并且不需要其它形式的能量,可以说是二氧化碳加氢还原的最佳的方法,制约着光催化加氢还原法实际应用的关键问题是它的还原效率太低。
目前,水热由于其独特的优势,正在迅速成为化学,环境,材料,能源等各个领域最热门的技术之一,其广泛用于精细化学品的合成和晶体合成控制,特别是合成多孔纳米材料。水热反应还用于生物降解塑料废物处理,塑料回收,煤炭液化和生物废物处理。通过这些实际应用,可以看出,水热技术在环保和能源转化领域具有独特的优势和自身的优异特点,具有很大的潜力和广阔的实际应用前景。且水热技术效率高,可实现大批量合成。水热反应具有低的介电常数、高的离子积、高的等温压缩性和能加速酸碱催化反应等一系列的优点,将水热反应技术与二氧化碳还原相结合必将开辟一个新的资源化转化方向。与此同时,高温高压水作为原位氢源,利用廉价的金属粉末从水中置换出原位氢从而与二氧化碳反应得到有机物,因此不需要外加昂贵的氢源,避免了氢气的存储运输等一系列问题。由于该催化反应的过程是发生在水相体系,解决了之前气相加氢还原过程中金属催化剂表面活性位点容易生成积碳而导致催化剂的快速失活的缺点。因此,利用水热技术处理二氧化碳还原来获得高附加值的有机物质具有非常广泛的研究意义。
目前的水热法还原二氧化碳的报道中其主要产物大多为c1化合物,如甲酸、甲烷和甲醇等,两个碳以上的化合物比较困难。因此,将二氧化碳转化成长链烷烃是一个需要努力突破的方向。
技术实现要素:
本发明的目的是公开一种利用铁粉和钴粉水热还原二氧化碳产长链烷烃的方法。该方法利用铁粉为还原剂,钴粉为催化剂,在150~400℃的水热条件下,二氧化碳与原位氢反应0.5~12h可以得到长链烷烃(c1-c21)。钴粉在适当的ph和氢气模板诱导下重塑为蜂窝状纳米片,成为催化长链烷烃生成的活性中心。
本发明的目的是通过以下技术方案来实现的:
本发明涉及一种利用铁粉和钴粉水热还原二氧化碳产长链烷烃的方法,其特征在于,将铁粉、钴粉与co2/hco3-源按照物质的量1:(0.1~10):(0.5~10)的比例加入到水热反应釜中,加入水,使得所述水热反应釜填充率为10%~80%,ph为8~12;然后,在150~400℃下反应0.5~12h,体系压力为1~42mpa,即可获得碳c1-c22的长链烷烃。
当铁粉、钴粉与co2/hco3-源的摩尔比过小时,原位氢的生成量少,体系的压力低,不利于二氧化碳加氢反应。当铁粉、钴粉与co2/hco3-源的摩尔比过大时,体系的压力过大,对反应器不利;因而,本发明的体系选用铁粉、钴粉与co2/hco3-源的摩尔比为1:(0.1~10):(0.5~10)。
此外,反应体系中,当ph小于8时,铁粉的氧化速度降低;当ph大于12时,体系主要含co32-,反应速度下降。
优选的,所述铁粉为纳米铁、商业铁粉、含有铁的金属合金粉或含铁生活垃圾破碎形成的粉末。
优选的,所述的商业铁粉指的是不同厂家生产的不同颗粒大小的商业铁粉。
优选的,所述含有铁的金属合金包括铁镁合金,铁锰合金等。
优选的,所述含铁生活垃圾包括含铁易拉罐等。
优选的,所述铁粉的粒径为100~400目。该粒径范围的铁粉有利于反应的进行。
优选的,所述钴粉为商业钴粉、含有钴的金属合金粉或含钴的城市电子垃圾破碎形成的粉末。
优选的,所用的商业钴粉可以为不同厂家生产的不同颗粒大小的商业钴粉。
优选的,所述含有钴的金属合金包括钨钴合金等。
优选的,所述含钴的城市电子垃圾包括印刷电路板等。
优选的,所述钴粉的粒径为100~200目,该较大的目数有利于反应的进行。
优选的,所述co2/hco3-源为li2co3、lihco3、na2co3、nahco3、k2co3、khco3、rb2co3、rbhco3、cs2co3或cshco3,或是将二氧化碳通入到含有lioh,naoh,koh,rboh或csoh溶液中。
优选的,所述钴粉在反应中重塑为蜂窝状钴纳米片,成为催化长链烷烃生成的活性中心。
优选的,所述钴粉循环利用。
与现有的二氧化碳加氢转化技术相比,本发明具有如下有益效果:
1、不需要使用h2,避免了h2的运输、贮存及纯度要求;
2、使用的铁粉还原剂存量巨大、成本低廉,且生成的铁氧化物可以被生物质还原为零价铁继续使用;
3、钴粉在水热条件下重构成蜂窝状纳米片,加速反应的进行;
4、该方法简单高效,有望进一步工业化应用,为二氧化碳资源化利用提供了新思路。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为本发明的反应示意图;
图2为反应前后钴催化剂的扫描电镜图对比图;反应条件为:fe:8~800mmol,nahco3:8~800mmol,co:4~400mmol,容器填充率:10~80%,1~6h,300℃;
图3为反应后二氯甲烷萃取液的gc-ms谱图,反应条件为:fe:8~800mmol,nahco3:8~800mmol,co:4~400mmol,容器填充率:10~80%,1~6h,300℃;其中,a为总的gc-ms谱图;b为直链和支链c12烷烃以及不饱和c12烯烃的gc-ms谱图;
图4为反应的动力学曲线,反应条件为:fe:8~800mmol,nahco3:8~800mmol,co:4~400mmol,容器填充率:10~80%,1~6h,300℃;其中,a为甲烷,乙烷和丙烷的产量随时间的变化;b为c6-c21的产量随时间的变化;
图5为钴粉的循环利用对烷烃产率的影响示意图;其中,a为甲烷,乙烷和丙烷的产量随钴粉循环利用次数的变化;b为c6-c21的产量随钴粉循环利用次数的变化;
图6为不同厂家钴粉反应后的形貌及相应的长链烷烃gc-ms图;其中,a为aladdin钴粉反应后的形貌及相应的长链烷烃gc-ms图;b为alfaaesar钴粉反应后的形貌及相应的长链烷烃gc-ms图;c为macklin钴粉反应后的形貌及相应的长链烷烃gc-ms图。
具体实施方式
下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。
实施例1、商业铁粉和钴粉还原二氧化碳为烷烃
如图1所示,将铁粉、钴粉与碳酸氢钠按照物质的量100mmol、200mmol、400mmol加入到间歇式反应釜中,再加入水,容器的填充率为40%。反应釜密封后置于诱导加热炉中,在250℃下反应6h,体系压力为20mpa。反应后气体主要含有甲烷、乙烷和丙烷。液体中加入二氯甲烷萃取出长链烷烃。烷烃的产率为~1%,选择性为3~6%。萃取后的液体中含有甲酸、乙酸等有机酸,经过分馏,可得到相应化学品。
图2为反应前后钴催化剂的扫描电镜图对比图;由图2可见,反应前钴催化剂呈现为大的颗粒状;经过水热反应后,钴催化剂的表面呈现蜂窝状的纳米片;由此可见,钴粉颗粒原位生成为蜂窝状纳米片,成为催化长链烷烃生成的活性中心。
图3为反应后二氯甲烷萃取液的gc-ms谱图,由图3可知,萃取液中含有长链烷烃,烷烃的链长最高可达21;除了直链烷烃外,还有少量的支链烷烃和不饱和烯烃。
实施例2、商业铁粉和钴粉还原二氧化碳为烷烃
将铁粉、钴粉与碳酸氢钠按照物质的量40mmol、4mmol、20mmol加入到间歇式反应釜中,再加入水,容器的填充率为10%。反应釜密封后置于诱导加热炉中,在150℃下反应12h,体系压力为1mpa。反应后气体主要含有甲烷、乙烷和丙烷。液体中加入二氯甲烷萃取出长链烷烃。烷烃的产率为~1%,选择性为3~6%。萃取后的液体中含有甲酸、乙酸等有机酸,经过分馏,可得到相应化学品。
图4为反应的动力学曲线,由图4可知,在1.5h之前,反应速率比较慢;之后反应速率加快且在3h之后趋于平衡。
实施例3、商业铁粉和钴粉还原二氧化碳为烷烃
将铁粉、钴粉与碳酸氢钠按照物质的量40mmol、400mmol、400mmol加入到间歇式反应釜中,再加入水,容器的填充率为80%。反应釜密封后置于诱导加热炉中,在400℃下反应0.5h,体系压力为42mpa。反应后气体主要含有甲烷、乙烷和丙烷。液体中加入二氯甲烷萃取出长链烷烃。烷烃的产率为~1%,选择性为3~6%。萃取后的液体中含有甲酸、乙酸等有机酸,经过分馏,可得到相应化学品。
实施例4、商业铁粉和钴粉还原二氧化碳为烷烃
本实施例的目的在于考察钴粉的循环利用对烷烃产率的影响。本实施例基本同实施例1,所不同之处在于,采用的钴粉为实施例1反应结束后回收的钴粉。反应后气体主要含有甲烷、乙烷和丙烷。液体中加入二氯甲烷萃取出长链烷烃。烷烃的产率为~1%,选择性为3~6%。萃取后的液体中含有甲酸、乙酸等有机酸,经过分馏,可得到相应化学品。
图5为钴粉的循环利用对烷烃产率的影响示意图;由图5可知,反应后的钴粉可以再循环利用,烷烃的产量基本保持不变。
实施例5、商业铁粉和钴粉还原二氧化碳为烷烃
本实施例的目的在于采用不同厂家钴粉还原二氧化碳为烷烃的情况对比。本实施例基本同实施例1,所不同之处在于,分别选用aladdin、alfaaesar、macklin的钴粉参与反应。反应后气体主要含有甲烷、乙烷和丙烷。液体中加入二氯甲烷萃取出长链烷烃。烷烃的产率为~1%,选择性为3~6%。萃取后的液体中含有甲酸、乙酸等有机酸,经过分馏,可得到相应化学品。
图6为不同厂家钴粉反应后的形貌及相应的长链烷烃gc-ms图;由图6可知,采用不同厂家的钴粉均可得到长链烷烃,且反应后钴粉都变为蜂窝状的纳米片。
实施例6、铁易拉罐和钴粉还原二氧化碳为烷烃
铁易拉罐为常见的生活废弃资源,且铁易拉罐数量日益增多,成为潜在的金属还原剂。在实际应用中将铁易拉罐破碎至粒径为1mm以下后再投入反应器使用。将破碎的铁易拉罐、钴粉与碳酸氢钠按照物质的量80mmol、100mmol、200mmol加入到间歇式反应釜中,再加入25ml的水,容器的填充率为60%。反应釜密封后置于诱导加热炉中,在300℃下反应3h,体系压力为30mpa。反应后气体主要含有甲烷、乙烷和丙烷。液体中加入二氯甲烷萃取出长链烷烃。萃取后的液体中含有甲酸、乙酸等有机酸,经过分馏,可得到相应化学品。
此外,需要说明的是:尽管以上实施例仅列举了co2/hco3-源为nahco3的情况,但由于二氧化碳在溶液中的反应活性为cs+>rb+>k+>na+>li+;因此,co2/hco3-源也可以为li2co3、lihco3、na2co3、k2co3、khco3、rb2co3、rbhco3、cs2co3或cshco3,或是将二氧化碳通入到含有lioh,naoh,koh,rboh或csoh溶液中。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- 还没有人留言评论。精彩留言会获得点赞!