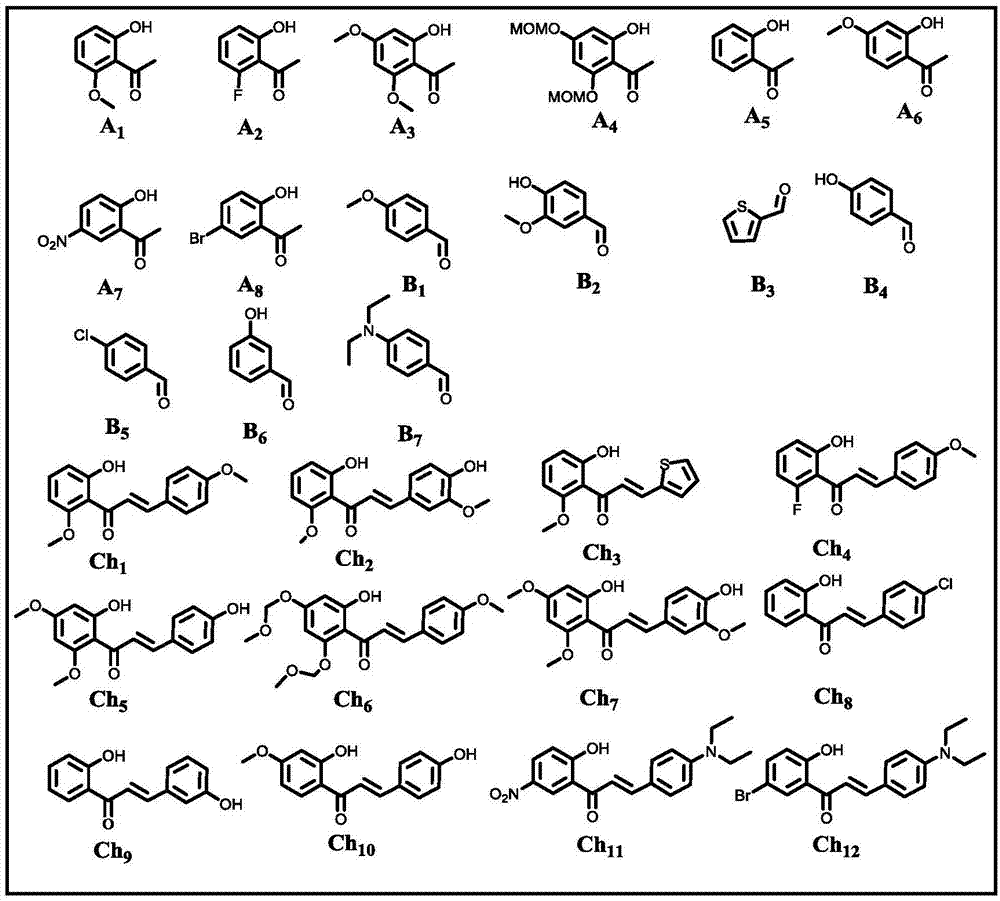
本发明属于化学合成领域,具体涉及一种3-羟基黄酮及其衍生物的水相一锅合成方法。
背景技术:
:3-羟基黄酮类化合物(也称为黄酮醇)是一类结构独特的黄酮类化合物,不仅结构复杂多样,而且数量繁多。3-羟基黄酮及其衍生物具有丰富多样的生物活性,如抗氧化、抗癌、保护心血管、抗菌、抗病毒、抗炎等,在医药研发领域和人类的健康保障方面有着巨大的应用。3-羟基黄酮广泛分布于植物界中,如银杏、诃子、沙棘以及日常生活中所食用的蔬菜(西红柿、豆类、西兰花、洋葱等)、水果(葡萄、苹果等)以及茶叶等。但天然3-羟基黄酮的数量及种类有限,而且提取分离困难,故化学合成是大量获得结构多样性3-羟基黄酮的重要手段。根据构建3-羟基黄酮骨架的策略不同,3-羟基黄酮的合成方法主要有以下几种方式。(1)苯并呋喃二溴代物重排反应,反应式如下:(2)afo反应即查尔酮氧化环化,反应式如下:(3)黄酮氧化反应(lda法),反应式如下:(4)碘苯乙酸氧化法,反应式如下:(5)dmdo氧化法,反应式如下:(6)baker-venkataraman重排反应,反应式如下:但以上合成方法普遍存在原料制备难度大、底物适应性差、反应条件苛刻、对5-取代3-羟基黄酮合成的选择性及收率差、工艺路线较长、成本较高、大量使用有机溶剂、环境污染较大等问题。此外,liu等人报道了吡硌烷催化对二乙胺基苯甲醛与2-羟基-5ˊ-硝基苯乙酮或2-羟基-5ˊ-溴苯乙酮在乙醇中反应分别得到两个3-羟基黄酮化合物,反应式如下:该方法存在如下局限性:(1)产物收率较低(46.3%,41.6%);(2)仅报道了含有供电子基的醛和含有吸电子基的苯乙酮,其它底物适应性未知,尤其是从6-位有取代基的苯乙酮合成5-取代的3-羟基黄酮的适应性未知;(3)反应机理未知;(4)空气环境下,有机溶剂中不利于中间体亚胺离子朝着生成黄酮醇的方向进行,容易产生橙酮及过氧化物等副产物。因此,提供一种高效、环保、适应性强、成本低的3-羟基黄酮合成的新方法具有重要意义。技术实现要素:本发明的目的是提供一种高效、环保、适应性强、成本低的3-羟基黄酮合成的水相一锅合成新方法。为实现上述发明目的,本发明所采用的技术方案是:一种3-羟基黄酮及其衍生物的合成方法,以2-羟基苯乙酮及其衍生物与苯甲醛及其衍生物为反应底物,或以2-羟基查耳酮及其衍生物为反应底物,以水或乙醇水溶液作溶剂,在有氧条件下、20~100℃,反应得到3-羟基黄酮或其衍生物。优选的,所述2-羟基苯乙酮及其衍生物的结构通式为:其中,r1、r2、r3、r4为芳基、酰基、酰胺基、酯基、磺酸基、磺酸胺基、磺酸酯基、亚磺酸基、亚磺酸胺基、亚磺酸酯基、腈基、烷基、环烷基、烯基、炔基、卤素、烷氧基、氨基、胺基、硫醚基、硝基、磷酸酯基中的任意一种。优选的,所述苯甲醛及其衍生物的结构通式为:其中,r1ˊ、r2ˊ、r3ˊ、r4ˊ、r5ˊ为芳基、酰基、酰胺基、酯基、磺酸基、磺酸胺基、磺酸酯基、亚磺酸基、亚磺酸胺基、亚磺酸酯基、腈基、烷基、环烷基、烯基、炔基、卤素、烷氧基、氨基、胺基、硫醚基、硝基、磷酸酯基中的任意一种。优选的,所述2-羟基查耳酮及其衍生物的结构通式为:其中,r1、r2、r3、r4、r1ˊ、r2ˊ、r3ˊ、r4ˊ、r5ˊ为芳基、酰基、酰胺基、酯基、磺酸基、磺酸胺基、磺酸酯基、亚磺酸基、亚磺酸胺基、亚磺酸酯基、腈基、烷基、环烷基、烯基、炔基、卤素、烷氧基、氨基、胺基、硫醚基、硝基、磷酸酯基中的任意一种。优选的,在所述溶剂中加入碱,再加入反应底物;所述碱为有机胺类化合物。优选的,按摩尔比,所述2-羟基苯乙酮及其衍生物:苯甲醛及其衍生物:碱:溶剂=1:1.1:(2~16):(5.5~100)。优选的,在溶剂中加入碱,混匀后,缓慢加入2-羟基苯乙酮及其衍生物,强烈搅拌至溶解后,再缓慢加入苯甲醛及其衍生物,搅拌反应≥24h,即得。优选的,按摩尔比,2-羟基查耳酮及其衍生物:碱:溶剂=1:(2~16):(5.5~100)。优选的,在溶剂中加入碱,混匀后,缓慢加入2-羟基查耳酮及其衍生物,搅拌反应≥24h,即得。相应的,一种利用所述合成方法合成的化合物,所述化合物的结构式为:本发明具有以下有益效果:(1)本发明提供一种高效、绿色环保、底物适应性强、经济成本低的3-羟基黄酮合成新方法。合成方法的底物适应性好,合成工艺简单,合成条件简单易控,对生产设备要求不高,终产品纯化处理简单,大部分纯度≥98%的终产品可以直接由过滤后的粗产品经重结晶获得。(2)本发明的原料既能从自然界中直接获取,也能通过常规的有机合成手段获得,方便易得;反应介质为水或醇水混合溶剂,氧化剂为大气或氧气,绿色环保。(3)本发明提供了一种全新的反应机理,采用苯甲醛及其衍生物和2-羟基苯乙酮及其衍生物或2-羟基查耳酮及其衍生物为原料,质子溶剂水(或水+醇的混合溶剂)为介质,大气(氧气)为氧化剂和有机碱吡咯烷催化,开发了一种高效、便捷、广阔底物适应性的3-羟基黄酮合成新方法。该反应不会产生如afo反应所致的过渡氧化产物;构建5-取代3-羟基黄酮的选择性受苯乙酮的6-位取代基的影响较小;反应具有很好的底物适应性,无论是供电子取代、吸电子取代2-羟基苯乙酮还是羟基取代苯甲醛或其它类型取代苯甲醛,反应都能以较好收率得到目标产物。整体上本方法特别适用于5-取代的3-羟基黄酮及其衍生物的工业化合成。(4)利用本发明提供的方法,还合成了一种全新的3-羟基黄酮衍生物:化合物c2,该化合物具有丰富的生物活性,可以在医药领域发挥重要作用。附图说明图1为本发明的实施例中各原料a、原料b和原料ch的结构式示意图;图2为本发明的实施例中制备的各终产物c的结构式示意图。具体实施方式本发明的基本反应式如下:其中,结构式a是2-羟基苯乙酮及其衍生物通式,2-羟基苯乙酮及其衍生物还包括稠环的2-羟基苯乙酮及其衍生物;结构式b是苯甲醛及其衍生物为原料通式,苯甲醛及其衍生物还包括稠环的苯甲醛衍生物;结构式ch是2-羟基查耳酮及其衍生物通式,2-羟基查耳酮及其衍生物还包括稠环的2-羟基查耳酮及其衍生物。结构式c是3-羟基黄酮及其衍生物通式。其中r1、r2、r3、r4、r1ˊ、r2ˊ、r3ˊ、r4ˊ、r5ˊ为芳基、酰(胺)基、酯基、磺酸(胺、酯)基、亚磺酸(胺、酯)基、腈基、(环)烷基、烯基、炔基、卤素、烷氧基、氨基、胺基、硫醚基、硝基、磷酸酯基中任意一种。即,本发明以原料a和原料b为共同的原材料,或以原料ch为原材料,最终获得终产物c;原料ch可以理解为原料a和原料b反应生成终产物c时的中间产物,可以以ch为原料直接获得产物c。本发明的具体反应机理为:由于1o2在不同溶剂中寿命不同,因而其氧化产物比例会有所不同。因此,以吡咯烷作碱和催化剂,大气(氧气)为氧化剂合成3-羟基黄酮。苯甲醛及其衍生物和2-羟基苯乙酮及其衍生物在吡咯烷作用下发生缩合生成相应的亚胺离子,再进一步反应得到终产物c。本发明的具体方案如下:1、基础反应体系:原料、碱、反应介质、氧化剂(大气(氧气)),其中,原料是苯甲醛及其衍生物(原料a)和2-羟基苯乙酮及其衍生物(原料b),也可以是2-羟基查耳酮及其衍生物(原料ch),碱为有机胺类化合物,反应介质为水(或水+醇的混合溶剂),氧化剂为大气(氧气)。按摩尔比,所述原料a:原料b:碱:反应介质=1:1.1:(2~16):(5.5~100);或,按摩尔比,所述原料ch:碱:反应介质=1:(2~16):(5.5~100)。所述氧化剂为大气中氧气,亦可直接是纯的氧气氛围。2、反应及提纯过程:(1)称取所需的原料、碱、反应介质,混合即得反应体系,将所述反应体系在有氧条件下(大气氛围或纯氧氛围)常温或加热搅拌,保持≥24h,反应结束。(2)反应结束后,按常规方法提取粗品即可。例如使用有机或无机酸将反应体系酸化至ph≤7.0,直接过滤不溶固体,即得粗品。所述无机酸可以选用0.5mol/l~6.0mol/l的盐酸。当然,也可以使用有机溶剂萃取提取粗产品。(3)将粗产品在乙醇或甲醇中重结晶或经硅胶柱层析即可获得纯化的终产物。个别5-取代的3-羟基黄酮终产品无法在乙醇或甲醇中结晶,可以直接经硅胶柱层析纯化得到,例如以石油醚与乙酸乙酯或氯仿混合物(v/v=(10~1):1)进行纯化。下面结合具体实施例,对本发明进行进一步的阐释。实施例一使用图1中的原料a1和b1进行反应。反应体系包括:原料a1(1.0mmol)、b1(1.1mmol)、碱、反应介质(10.0ml),其反应体系与大气相通。按摩尔比,a1:b1:碱=1:1.1:(2~16)。反应过程为:在10ml反应介质中加入碱后,缓慢加入a1(1.0mmol),强烈搅拌溶解后再缓慢加入b1(1.1mmol),然后常温反应或加热反应,其反应体系与大气或氧气相通,保持搅拌24h,反应结束。反应结束后,反应体系经6.0mol/l的盐酸水溶液调节至ph≤7.0,过滤不溶固体得到粗产品。该粗产品经硅胶柱层析(石油醚:乙酸乙酯=4:1)获得终产品c1(结构式如图2所示)。其中,反应过程中的具体参数及收率如表1所示。表1反应参数及收率表组别碱的种类用碱量反应介质反应温度时间c1收率(%)组1正丙胺10mmol甲醇室温24h0组2二乙胺10mmol甲醇室温24h0组3吡咯10mmol甲醇室温24h0组4哌啶10mmol甲醇室温24htrace组5吡咯烷10mmol甲醇室温24h40组6l-脯氨酸10mmol甲醇室温24h0组7tbd10mmol甲醇室温24htrace组8三乙胺10mmol甲醇室温24hn.d组9吡咯烷10mmol乙醇室温24h35组10吡咯烷10mmol乙腈室温24h8组11吡咯烷10mmol水室温24h63组12吡咯烷10mmol四氢呋喃室温24h11组13吡咯烷10mmol二甲基亚砜室温24h15组14吡咯烷10mmol甲苯室温24htrace组15吡咯烷10mmol二氯甲烷室温24htrace组16吡咯烷2mmol水室温24h10组17吡咯烷6mmol水室温24h42组18吡咯烷16mmol水室温24h64组19吡咯烷10mmol水50℃24h65组20吡咯烷10mmol水80℃24h60其中,trace表示有微量c1生成;n.d表示小于检测限值,即未检出。实施例二除反应原料不同外,基于成本以及环保方面的考虑,我们选择耗能较低、有机碱用量较少、且收率相差不大的实施例一组11的具体反应条件进行本实施例的反应。本实施例所用的原料a、b的结构式具体如图1所示,生产的各终产物c的结构式具体如图2所示。反应体系具体为:原料a(1.0mmol)、b(1.1mmol)、吡咯烷(10.0mmol)、水(20.0ml)。本实施例各组所用的具体原料a、b,生产的产物c及收率如表2所示。表2反应体系及收率对照表组别原料a原料b终产物c收率(%)组1a1b1c165组2a1b2c288组3a1b3c376组4a2b1c481组5a3b4c582组6a4b1c688组7a3b2c782组8a5b5c885组9a5b6c991组10a6b4c1085实施例三除反应原料不同外,选择实施例一组11的相同条件进行本实施例的反应。本实施例所用的各原料ch的结构式具体如图1所示,生产的各终产物c的结构式具体如图2所示。反应体系具体为:原料ch(1.0mmol)、吡咯烷(10.0mmol)、水(20.0ml)。本实施例各组所用的具体原料ch,生产的产物c及收率如表3所示。表3反应体系及收率对照表组别原料ch终产物c收率(%)组1ch1c172组2ch2c289组3ch3c379组4ch4c485组5ch5c587组6ch6c690组7ch7c785组8ch8c888组9ch9c993组10ch10c1087组11ch11c1170组12ch12c1276实施例四本实施例记载以含有胺基的苯甲醛原料b反应体系下实施的合成试验。由于该类原料生反应的中间体在水中或纯的有机溶剂中不利于向目标产物转化,导致目标产物的收率偏低,因此采用混合溶剂进行反应。反应体系包括:原料a(1.0mmol)、原料b(1.1mmol)、吡咯烷(10.0mmol);反应介质为:乙醇(16.0ml)+水(4.0ml);其反应体系与大气相通或者与氧气相通。按摩尔比,原料a:原料b:吡咯烷=1:1.1:10。原料a、b的结构式如图1所示,生产的终产物c的结构式如图2所示。反应过程为:在反应介质中,在吡咯烷存在下缓慢加入原料a,强烈搅拌溶解后再缓慢加入原料b,常温反应(也可加热反应,为方便操作,本实施例统一常温反应),其反应体系与大气相通,保持搅拌24h。反应结束后反应液经6.0mol/l的盐酸水溶液调节至ph=7.0,过滤不溶固体,即得到粗产品。其粗产品在乙醇-水(乙醇:水=100:1)的热饱和溶液中重结晶后,过滤得到的黄色固体干燥后即为相应的3-羟基黄酮及其衍生物终产品。具体反应原料、终产物及收率如表4所示。表4反应体系及收率对照表组别原料a原料b终产物c收率(%)组1a7b7c1179组2a8b7c1281为进一步证明本发明确实实现了发明目的,下面提供本发明生产的终产物c1-c12的核磁共振数据,其中c2为全新合成的化合物。化合物c1:黄色固体。1hnmr(400mhz,cdcl3)δ8.23(d,j=8.8hz,2h),7.59(t,j=8.3hz,1h),7.37(s,1h),7.16(d,j=8.5hz,1h),7.06(d,j=8.8hz,2h),6.80(d,j=8.1hz,1h),4.05(s,3h),3.91(s,3h).13cnmr(101mhz,cdcl3)δ172.68,160.86,159.52,157.17,142.97,137.86,133.68,129.19,123.42,114.06,111.45,110.30,104.91,56.46,55.41.化合物c2:黄色固体。1hnmr(400mhz,dmso-d6)δ9.71(s,1h),8.99(s,1h),7.79(d,j=2.0hz,1h),7.72(dd,j=8.5,2.0hz,1h),7.67(t,j=8.4hz,1h),7.28(d,j=8.5hz,1h),6.97(s,2h),3.90(s,3h),3.86(s,3h).13cnmr(101mhz,dmso-d6)δ172.18,159.47,156.79,148.88,147.89,143.21,138.48,134.20,122.56,121.73,116.03,112.05,111.79,110.48,106.14,56.64,56.20.化合物c3:黄色固体。1hnmr(400mhz,cdcl3)δ7.98(d,j=3.8hz,1h),7.60(dd,j=10.2,6.7hz,2h),7.25(m,1h),7.16(d,j=8.5hz,1h),6.81(d,j=8.2hz,1h),4.05(s,3h).13cnmr(101mhz,cdcl3)δ172.11,159.60,156.99,140.30,136.48,133.87,132.77,129.36,128.85,128.06,111.66,110.29,105.21,56.50.化合物c4:黄色固体。1hnmr(400mhz,cdcl3)δ8.24(d,j=8.6hz,2h),7.64(dd,j=13.4,7.8hz,1h),7.41(d,j=8.2hz,1h),6.99-7.23(m,4h),3.93(s,3h).13cnmr(101mhz,cdcl3)δ171.34,161.22,156.15,144.48,137.87,133.41,133.30,129.45,123.02,114.16,114.10,110.83,110.63,55.43.化合物c5:黄色固体。1hnmr(400mhz,dmso-d6)δ10.01(s,1h),8.78(s,1h),8.06(d,j=8.8hz,2h),6.94(d,j=8.8hz,2h),6.82(d,j=2.1hz,1h),6.48(d,j=2.1hz,1h),3.91(s,3h),3.87(s,3h).13cnmr(101mhz,dmso-d6)δ171.48,164.08,160.56,159.10,158.50,142.70,137.86,129.29,122.35,115.87,106.74,96.10,93.25,56.65,56.42.化合物c6:黄色固体。1hnmr(400mhz,cdcl3)δ8.21(d,j=9.0hz,2h),7.34(s,1h),7.05(d,j=9.0hz,2h),6.87(d,j=2.2hz,1h),6.76(d,j=2.2hz,1h),5.40(s,2h),5.29(s,2h),3.91(s,3h),3.60(s,3h),3.55(s,3h).13cnmr(101mhz,cdcl3)δ171.86,161.52,160.71,158.32,157.83,142.61,137.39,129.00,123.49,114.01,107.44,100.72,96.62,95.31,94.39,56.65,56.56,55.40.化合物c7:黄色固体。1hnmr(400mhz,dmso-d6)δ9.26(s,1h),8.84(s,1h),7.71(d,j=2.1hz,1h),7.66(dd,j=8.6,2.0hz,1h),7.08(d,j=8.7hz,1h),6.78(d,j=1.7hz,1h),6.48(d,j=1.7hz,1h),3.91(s,3h),3.87(s,3h),3.86(s,3h).13cnmr(101mhz,dmso-d6)δ171.50,164.15,160.59,158.52,149.29,146.71,142.31,138.30,124.18,119.45,114.74,112.27,106.72,96.12,93.15,56.65,56.42,56.09.化合物c8:黄色固体。1hnmr(400mhz,cdcl3)δ8.28-8.19(m,3h),7.72(ddd,j=8.7,7.1,1.7hz,1h),7.59(d,j=8.5hz,1h),7.54-7.48(m,2h),7.43(ddd,j=8.1,7.1,1.0hz,1h),7.07(s,1h).13cnmr(101mhz,cdcl3)δ173.43,155.40,143.77,138.50,136.23,133.86,129.56,129.03,128.93,125.54,124.69,120.61,118.27.化合物c9:黄色固体。1hnmr(400mhz,dmso-d6)δ9.75(s,1h),9.59(s,1h),8.13(dd,j=8.0,1.4hz,1h),7.85-7.78(m,1h),7.75(d,j=8.3hz,1h),7.72-7.64(m,2h),7.51-7.45(m,1h),7.37(t,j=8.0hz,1h),6.92(ddd,j=8.1,2.4,0.8hz,1h).13cnmr(101mhz,dmso-d6)δ173.44,157.75,154.99,145.69,139.53,134.23,132.87,130.01,125.27,125.02,121.71,118.91,118.83,117.51,115.02.化合物c10:黄色固体。1hnmr(400mhz,dmso-d6)δ8.11(d,j=7.7hz,2h),7.69(d,j=8.6hz,1h),7.44(s,1h),7.38(d,j=8.1hz,1h),6.95(d,j=7.8hz,2h),3.88(s,3h).13cnmr(101mhz,dmso-d6)δ172.55,159.53,156.31,149.77,146.40,137.90,129.98,123.54,122.52,122.33,120.33,115.88,104.31,56.14.化合物c11:黄色固体。1hnmr(400mhz,dmso-d6)δ9.61(s,1h),8.78(d,j=2.3hz,1h),8.58–8.42(m,1h),8.14(d,j=8.9hz,2h),7.97(d,j=9.2hz,1h),6.82(d,j=9.0hz,2h),3.45(dd,j=13.4,6.6hz,4h),1.15(t,j=6.8hz,6h).13cnmr(101mhz,dmso)δ171.29,157.53,149.28,148.56,144.01,137.87,130.04,127.40,121.96,121.33,120.73,116.66,111.30,44.22,12.92.化合物c12:黄色固体。1hnmr(400mhz,dmso)δ9.32(s,1h),8.14(d,j=2.1hz,1h),8.10(d,j=8.9hz,2h),7.88(dd,j=8.9,2.1hz,1h),7.71(d,j=8.9hz,1h),6.79(d,j=9.0hz,2h),3.43(dd,j=13.8,6.8hz,4h),1.14(t,j=6.9hz,6h).13cnmr(101mhz,dmso-d6)δ170.94,153.53,149.07,148.09,137.69,135.90,129.88,127.00,123.59,121.25,117.10,116.99,111.23,44.19,12.91。当前第1页12
