用于人源粪便DNA甲基化分析的核酸纯化方法与流程
本发明涉及核酸纯化领域,具体地,本发明涉及用于人源粪便dna甲基化分析的核酸纯化的方法,更具体地,本发明涉及获得用于dna甲基化分析的核酸样本的方法。
背景技术:
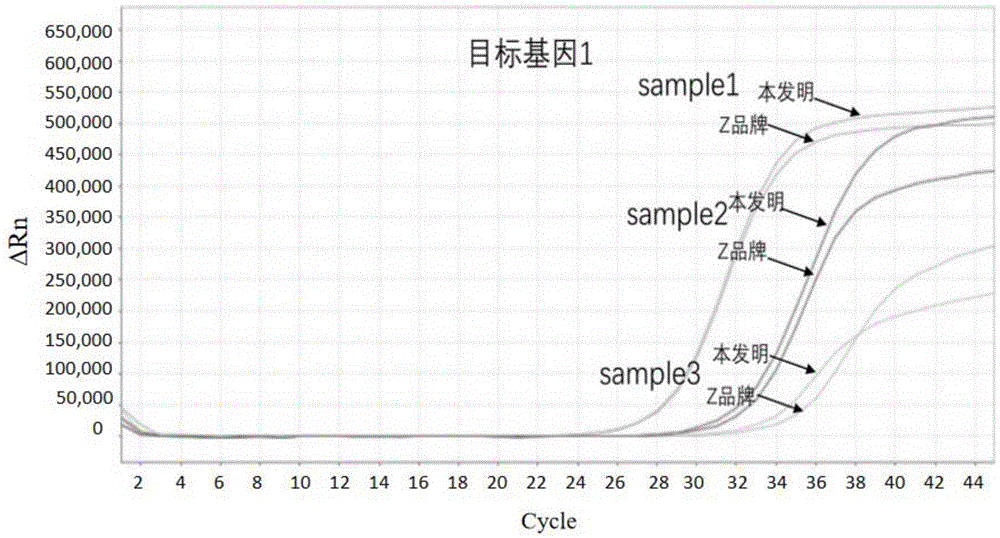
:dna甲基化(dnamethylation)是指在dna甲基化转移酶(dnmt)的催化下,以s-腺苷甲硫氨酸为甲基供体,将活性甲基转移至dna链中特定碱基上的化学修饰过程。在人类表观遗传学研究中,最常见的就是cpg二核苷酸中胞嘧啶的甲基化修饰,其主要过程是:在cpg甲基化结合蛋白(methyl-cpgbindingproteins,mbds)和dna甲基化转移酶(dnamethyltransferases,,dnmts)的作用下,使cpg二核苷酸5’端的胞嘧啶转变成5’甲基胞嘧啶。在基因组的某些区域中,通常是基因的启动子区域、5’端非翻译区和第一个外显子区,cpg序列密度非常高,超过均值5倍以上,成为鸟嘌呤和胞嘧啶的富集区,称之为cpg岛(cpgislands,cgis)。健康人的基因组中,cpg岛中的cpg位点一般处于非甲基化状态,而cpg岛外的cpg位点通常是被甲基化的。dna甲基化状态与基因表达呈负相关,其调控作用主要在转录水平抑制基因的表达。在肿瘤研究中,许多肿瘤的重要基因表达的异常主要通过dna甲基化实现。癌基因的去甲基化和抑癌基因的甲基化状态可导致致癌基因激活、抑癌基因的失活。癌基因的低甲基化和抑癌基因的高度甲基化改变,是肿瘤细胞的一个重要特征。结直肠癌是全球最常见的恶性肿瘤之一,结直肠上皮细胞更新很快,平均3-4天更新一次,正常细胞和肿瘤细胞会脱落进入肠道并随粪便排出体外,检测肿瘤细胞中的基因甲基化水平,可以方便快捷地达到辅助诊断的目的。针对肿瘤dna甲基化的分析方法有很多种,从基因组甲基化水平(methylationcontent)的分析就包括高效液相色谱(high-performanceliquidchromatography,hplc)和高效毛细管电泳法(high-performancecapillaryelectrophoresis,hpce),这两种方法虽然能够明确检测出目的序列中所有cpg位点的甲基化状况,但并不能对甲基化位点进行定位。而对候选基因甲基化分析主要包括甲基化敏感性限制性内切酶-pcr/southern法(methylation-sensitiverestrictionendonuclease-pcr/southern,msre-pcr/southern)、重亚硫酸盐测序法(bisμlphitesequencing)、甲基化特异性的pcr(methylation-specificpcr,ms-pcr)、甲基化荧光法(methylight)焦磷酸测序(pyrosequencing)等;除此之外,还包括差异甲基化杂交(differentialmethylationhybridization,dmh)和甲基化dna免疫沉淀法(methylateddnaimmunoprecipitation,medip)等多种手段。但是研究最广泛的仍是经过重亚硫酸盐处理的方法,即需要提前将dna进行亚硫酸盐转化后,使未甲基化的胞嘧啶转化为尿嘧啶,而甲基化的胞嘧啶不会被转化。然而,目前市场上的重亚硫酸盐转化法还需进一步研究。技术实现要素:本申请是基于发明人对以下事实和问题的发现和认识作出的:目前市场上常见的亚硫酸盐转化法的基本步骤为:dna氢氧化钠变性、亚硫酸盐变温转化及脱磺酸基、脱盐和洗脱。发明人发现,该方法还存在很多问题,具体如下:1)现有方法中,将dna主要进行氢氧化钠变性,而后进行长时间的转化及变温过程,同时需要氢氧化钠溶液进行脱磺酸基。在此过程中,会导致dna的严重降解及片段化;2)现有技术中,多数采用离心柱方法进行产物纯化,部分试剂盒还需要carrierrna,造成dna损耗高、回收效率降低,难于实现自动化操作。3)尽管目前市场上出现了磁珠法进行产物纯化,性能比离心柱法有提升,但是转化效率和实验重复性仍无法满足对粪便样本的处理需求。以上因素使得目前的商业化试剂盒对于人源粪便dna的亚硫酸盐处理的ct转化率和回收率都比较低,严重影响后续的甲基化分析。因此,目前尚不存在能够有效用于人源粪便dna甲基化分析的核酸纯化方法,本发明的目的在于针对现有技术的不足,提供一种适用于人源粪便dna甲基化分析的核酸纯化的方法,同时也可进行石蜡样本和血浆样本等的甲基化分析。本发明对变性方法、转化方法及纯化方法进行了优化改进,采用热碱变性法在94~96℃条件5-15分钟后,可冰置5~10分钟防止复性,然后将dna在75℃~80℃进行转化40~50分钟,之后采用磁珠法以及含peg(聚乙二醇)的洗液对转化dna进行纯化,能够得到高转化率、高质量的转化后的dna,并有利于甲基化研究的全自动化及标准化操作,用于后续dna样本中基因的甲基化水平分析。为此,在本发明的第一方面,本发明提出一种核酸纯化方法。根据本发明的实施例,所述方法包括:将初始核酸样本进行变性处理;将变性处理产物在温度为75~80℃,如76、77、78或79℃的条件下进行40~50分钟,如42、44、46或48分钟的转化处理,所述转化处理过程中,变性处理产物中未甲基化的胞嘧啶转化为尿嘧啶,甲基化的胞嘧啶仍为胞嘧啶;将转化处理产物进行纯化处理,以便获得用于dna甲基化分析的核酸样本;其中,所述转化处理是在亚硫酸氢钠、亚硫酸钠以及保护剂存在的条件下进行的。需要说明的是,初始核酸样本指的是利用核酸提取试剂盒提取获得的待处理dna样品。亚硫酸钠和亚硫酸氢钠用于将变性处理产物中未甲基化的胞嘧啶转化为尿嘧啶,而甲基化的胞嘧啶仍为胞嘧啶。保护剂用于保护亚硫酸钠和亚硫酸氢钠免于遭受氧化而导致转化效率下降。发明人发现,若转化处理的温度过低或时间过短,核酸的转化不完全或转化效率过低;若转化处理的温度过高或时间过长,可能导致核酸的化学结构发生不可控的改变,如导致核酸发生降解或片段化。在温度为75~80℃的条件下进行40~50分钟的转化处理时,核酸的转化更完全,转化效率更高,且核酸的化学结构不会发生更多不可控的变化,有利于后续的甲基化分析。根据本发明实施例的方法能够有效用于低含量人源dna样本的甲基化分析,如人源粪便dna甲基化分析,得到高转化率、高质量的转化后的dna,有利于甲基化研究的全自动化及标准化操作。根据本发明的实施例,上述方法还可进一步包括如下附加技术特征至少之一:根据本发明的实施例,所述变性处理是在温度为94~96℃,如94.3、94.5、94、8、95、95.3、95.5或95.8℃的条件下进行5~15分钟,如7、9、10、11或13分钟。发明人发现,若变性处理的温度过低或时间过短,初始核酸样本变性不完全;若变性处理的温度过高或时间过长,可能导致初始核酸样本的化学结构发生改变,如导致核酸发生降解或片段化。在温度为94~96℃的条件下进行5~15分钟的变性处理,初始核酸样本的变性更完全,且不会发生化学结构的改变,有利于后续的转化处理以及最终的甲基化分析。根据本发明实施例的方法能够进一步有效用于低含量人源dna样本的甲基化分析,如人源粪便dna甲基化分析,得到高转化率、高质量的转化后的dna,有利于甲基化研究的全自动化及标准化操作。根据本发明的实施例,所述变性处理是在热高温与氢氧化钠存在的条件下进行的。发明人发现,所述氢氧化钠可以在热变性处理中发挥辅助作用,变性处理的效率更高。根据本发明的实施例,进行所述变性处理前,预先将所述初始核酸样本与亚硫酸盐试剂进行第一混合处理,所述亚硫酸盐试剂包括所述亚硫酸氢钠、所述亚硫酸钠和所述氢氧化钠。进而,根据本发明实施例的方法的操作更加快速简便。根据本发明的实施例,所述亚硫酸盐试剂是以溶于水的形式提供的。在一些实施例中,基于所述亚硫酸盐试剂水溶液的总体积,所述亚硫酸氢钠的质量体积分数为40-50%,如为42、44、45、46或48%;所述亚硫酸钠的质量体积分数为8-12%,如为9、10或11%;所述氢氧化钠的浓度为0.1-0.2mol/l,如为0.12、0.14、0.15、0.16或0.18mol/l。在一些实施例中,所述亚硫酸盐试剂水溶液的总体积为150-300μl,如为180、200、230、250或280μl。需要说明的是,所述亚硫酸氢钠、亚硫酸钠的质量分数表示所述亚硫酸氢钠、亚硫酸钠的质量与所述亚硫酸盐试剂水溶液的总体积的比值,表示质量体积浓度。发明人发现,所述亚硫酸盐试剂对变性处理产物的转化效果更优。根据本发明的实施例,所述保护剂是6-羟基-2,5,7,8甲基-苯并二氢吡喃-2-羧酸和对苯二酚的二乙二醇二甲醚溶液。在一些实施例中,基于所述保护剂的总体积,所述6-羟基-2,5,7,8甲基-苯并二氢吡喃-2-羧酸的质量体积分数为8-12%,如为9、10或11%;所述对苯二酚的质量体积分数为5~10%,如为6、7、8或9%。在一些实施例中,所述保护剂的总体积为25-50μl,如30、40或45μl。需要说明的是,所述6-羟基-2,5,7,8甲基-苯并二氢吡喃-2-羧酸、对苯二酚的质量分数表示所述6-羟基-2,5,7,8甲基-苯并二氢吡喃-2-羧酸、对苯二酚的质量与所述保护剂的总体积的比值,表示质量体积浓度。发明人发现,所述保护剂的保护效果更优。根据本发明的实施例,所述变性处理后、转化处理前,进一步包括将变性处理产物置于冰上进行5~10分钟,如6、7、8或9分钟的冷却处理。发明人发现,所述冷却处理可以有效防止变性处理产物发生复性。根据本发明的实施例,所述初始核酸样本是以将dna溶于te缓冲液的形式提供的。在一些实施例中,所述初始核酸样本的质量为0.1~2μg,如0.5、0.7、0.9、1.0、1.3、1.5、1.7或1.9μg。在一些实施例中,所述初始核酸样本的体积为10~100μl,如30、40、50、70或90μl。在一些实施例中,所述初始核酸样本的浓度为1~200ng/μl,如1、5、7、9、10、30、50、70、90、100、130、150、170或190ng/μl。根据本发明的实施例,所述纯化处理是通过如下方式进行的:将转化处理产物与磁珠以及第一洗液进行第二混合处理;将第二混合处理产物进行第一孵育处理;将第一孵育处理产物进行第一离心处理,以便获得第一离心沉淀物;将所述第一离心沉淀物与第二洗液进行第三混合处理;将第三混合处理产物进行第二离心处理,以便获得第二离心沉淀物;将所述第二离心沉淀物与洗脱液进行第三混合处理;将第三混合处理产物进行第二孵育处理;将第二孵育处理产物进行第三离心处理,以便获得上清液,所述上清液中包含用于dna甲基化分析的核酸样本。发明人发现,所述纯化处理可以得到高转化率、高质量的转化后的dna,有利于甲基化研究的全自动化及标准化操作。根据本发明的实施例,所述磁珠是以分散于水中的形式提供的。在一些实施例中,所述磁珠的水分散液的总体积为50~100μl,如60、70、80或90μl。在一些实施例中,基于所述磁珠的水分散液的总体积,所述磁珠的质量体积浓度为45~55mg/ml,如47、48、49、49.5、50、50.5、51、52或53mg/ml。在一些实施例中,所述磁珠包括选自超顺四氧化三铁颗粒、超顺三氧化二铁颗粒的至少之一。在一些实施例中,所述二氧化硅修饰有羧基。需要说明的是,所述磁珠的质量体积浓度指所述磁珠的质量与所述磁珠的水分散液的总体积的比值;所述磁珠可以通过市售途径获得。发明人发现,所述磁珠可以有效特异性吸附转化后的核酸,从而将转化处理产物进行有效纯化,有利于甲基化研究的全自动化及标准化操作,克服了现有技术中使用离心柱进行纯化时难以实现自动化以及需要进行氢氧化钠去磺化的不足。根据本发明的实施例,所述第一洗液的总体积为800-1000μl,如830、850、870、900、930、950或970μl。在一些实施例中,基于所述第一洗液的总体积,所述第一洗液包括5-20%,如7、9、10、11、13、15、17或19%的聚乙二醇,5-10%,如6、7、8或9%的氯化钠,0.1-0.2mol/l,如0.13、0.15、0.17或0.19mol/l的乙酸钠,2-5mmol/l,如2.5、2.7、2.9、3.0、3.5、3.7、3.9、4.0、4.5、4.7或4.9mmol/l的乙二胺四乙酸,2-5mmol/l,如2.5、2.7、2.9、3.0、3.5、3.7、3.9、4.0、4.5、4.7或4.9mmol/l的三羟甲基氨基甲烷,10-20mmol/l,如13、15、17或19mmol/l的异硫氰酸胍,40-50%,如43、45、47或49%的无水乙醇以及余量的水。需要说明的是,所述聚乙二醇、氯化钠的质量分数表示所述聚乙二醇、氯化钠的质量与所述第一洗液的总体积的比值,为质量体积浓度。所述无水乙醇的质量分数表示所述无水乙醇的体积与所述第一洗液的总体积的比值,为体积浓度。发明人惊喜地发现,所述聚乙二醇可以使磁珠的分散更加均匀,从而促进转化后的核酸与磁珠的结合,磁珠富集效率更高。进而,添加有所述聚乙二醇的第一洗液可以辅助磁珠进一步有效富集氧化后的核酸,有效除去未转化的核酸以及其他杂质,从而将转化处理产物进行有效纯化,有利于甲基化研究的全自动化及标准化操作。根据本发明的实施例,所述第二洗液为体积浓度为70-80%(体积浓度),如73、75、77或79%的无水乙醇的水溶液。在一些实施例中,所述第二洗液的总体积为400~600μl,如450、500或550μl。发明人发现,所述第二洗液可以进一步有效洗涤除去未转化的核酸,从而将转化处理产物进行进一步有效纯化。根据本发明的实施例,所述洗脱液为无核酸酶depc水。在一些实施例中,所述洗脱液的体积为45~55μl,如47、49、50、51或53μl。需要说明的是,所述无核酸酶depc水指用碳酸二乙酯(depc)化学处理产生的无核酸酶的水。发明人发现,所述洗脱液可以将磁珠吸附的转化后的核酸有效洗涤脱附,从而获得用于dna甲基化分析的核酸样本。根据本发明的实施例,所述第一孵育处理是在温度为21~25℃,如22、23或24℃,转速为900~1100rpm,如950、1000、1050rpm的条件下恒温进行45~60分钟,如48、50、52、54、56或58分钟。发明人发现,在上述条件下进行第一孵育处理,可以进一步有效富集转化后的核酸,进一步有效除去未转化的核酸或其他杂质,从而将转化处理产物进行进一步有效纯化,有利于甲基化研究的全自动化及标准化操作。根据本发明的实施例,所述第二孵育处理是在室温条件下进行5~10分钟,如7、8或9分钟。发明人发现,若第二孵育处理的温度过高或时间过长,容易发生核酸的降解,影响甲基化分析效率;若第二孵育处理的温度过低或时间过短,可能导致核酸的洗脱不充分,降低回收效率。在室温条件下进行5~10分钟的第二孵育处理时,核酸的回收效率更高,且核酸的化学结构不会发生更多不可控的变化,有利于后续的甲基化分析。发明人发现,在上述条件下进行第二孵育处理,可以将磁珠吸附的转化的核酸进一步有效洗涤脱附,从而获得用于dna甲基化分析的核酸样本。根据本发明的实施例,所述第二离心处理后、第三混合处理前,进一步包括将所述第二离心处理沉淀物进行干燥处理。在一些实施例中,所述干燥处理为在室温条件下静置3~5分钟,如4分钟。发明人发现,所述干燥处理可以干燥除去第一洗液和第二洗液,有利于后续的脱附纯化。在本发明的第二方面,本发明提出了一种获得用于dna甲基化分析的核酸样本的方法。根据本发明的实施例,所述方法包括:将初始核酸样本与亚硫酸盐试剂以及保护剂进行第一混合处理;将第一混合处理产物在温度为94~96℃的条件下进行5~15分钟的变性处理;将变性处理产物在温度为75~80℃的条件下进行40~50分钟的转化处理;将转化处理产物与磁珠以及第一洗液进行第二混合处理;将第二混合处理产物在温度为21~25℃、转速为900~1100rpm的条件下进行45~60分钟的第一孵育处理;将第一孵育处理产物进行第一离心处理,以便获得第一离心沉淀物;将所述第一离心沉淀物与第二洗液进行第三混合处理;将第三混合处理产物进行第二离心处理,以便获得第二离心沉淀物;将所述第二离心处理沉淀物在室温条件下静置干燥3~5分钟;将干燥处理产物与洗脱液进行第三混合处理;将第三混合处理产物在室温条件下进行5~10分钟的第二孵育处理;将第二孵育处理产物进行第三离心处理,以便获得上清液,所述上清液中包含用于dna甲基化分析的核酸样本;其中,所述初始核酸样本是以将dna溶于水或te缓冲液的形式提供的,所述初始核酸样本的质量为0.1~2μg,所述初始核酸样本的体积为10~100μl;所述亚硫酸盐试剂是以溶于水的形式提供的,基于所述亚硫酸盐试剂水溶液的总体积,所述亚硫酸氢钠的质量体积分数为40-50%,所述亚硫酸钠的质量体积分数为8-12%,所述氢氧化钠的浓度为0.1-0.2mol/l,所述亚硫酸盐试剂水溶液的总体积为150-300μl;所述保护剂是6-羟基-2,5,7,8甲基-苯并二氢吡喃-2-羧酸和对苯二酚的二乙二醇二甲醚溶液,基于所述保护剂的总体积,所述6-羟基-2,5,7,8甲基-苯并二氢吡喃-2-羧酸的质量体积分数为8-12%,所述对苯二酚的质量体积分数为5~10%,所述保护剂的总体积为25-50μl;所述磁珠是以分散于水中的形式提供的,所述磁珠的水分散液的总体积为50~100μl,基于所述磁珠的水分散液的总体积,所述磁珠的质量体积浓度为45~55mg/ml,所述磁珠为超顺四氧化三铁颗粒或超顺三氧化二铁颗粒,所述磁珠的外表面包被有二氧化硅,所述二氧化硅修饰有羧基;所述第一洗液的总体积为800-1000μl,基于所述第一洗液的总体积,所述第一洗液包括5-20%的聚乙二醇,5-10%的氯化钠,0.1-0.2mol/l的乙酸钠,2-5mmol/l的乙二胺四乙酸,2-5mmol/l的三羟甲基氨基甲烷,10-20mmol/l的异硫氰酸胍,40-50%的无水乙醇以及余量的水;所述第二洗液为体积浓度为70-80%的无水乙醇的水溶液,所述第二洗液的总体积为400~600μl;所述洗脱液为无核酸酶depc水,所述洗脱液的体积为45~55μl。根据本发明实施例的方法能够进一步有效用于低含量dna样本的甲基化分析,如人源粪便dna甲基化分析,得到高转化率、高质量的转化后的dna,有利于甲基化研究的全自动化及标准化操作。附图说明图1为根据本发明实施例的方法与z品牌商品化试剂盒方法来转化及纯化人粪便3个样本目标基因1的实时荧光pcr检测图,其中,sample1、sample2、sample3分别表示样本1、样本2、样本3,横坐标cycle表示扩增循环数,纵坐标表示荧光δrn值;图2为根据本发明实施例的方法与z品牌商品化试剂盒方法来转化及纯化人粪便3个样本目标基因2的实时荧光pcr检测图,其中,sample1、sample2、sample3分别表示样本1、样本2、样本3,横坐标cycle表示扩增循环数,纵坐标表示荧光δrn值;图3为根据本发明实施例的方法与z品牌商品化试剂盒方法来转化及纯化石蜡样本目标基因1的实时荧光pcr检测图,其中,横坐标cycle表示扩增循环数,纵坐标表示荧光δrn值;图4为根据本发明实施例的方法与z品牌商品化试剂盒方法来转化及纯化石蜡样本目标基因2的实时荧光pcr检测图,其中,横坐标cycle表示扩增循环数,纵坐标表示荧光δrn值;图5为根据本发明实施例的方法与z品牌商品化试剂盒方法来转化及纯化血浆样本游离dna目标基因1的实时荧光pcr检测图,其中,横坐标cycle表示扩增循环数,纵坐标表示荧光δrn值;图6为根据本发明实施例的方法与z品牌商品化试剂盒方法来转化及纯化血浆样本游离dna目标基因2的实时荧光pcr检测图,其中,横坐标cycle表示扩增循环数,纵坐标表示荧光δrn值;以及图7是根据本发明实施例的获得用于dna甲基化分析的核酸样本的方法的流程示意图,其中,bis-dna指转化后的dna。具体实施方式下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。本发明公开了一种适用于人源粪便dna甲基化分析的核酸纯化的方法,还可适用于多种样本来源的dna(如石蜡样本和血浆样本等)的甲基化分析,该方法利用恒温混匀仪完成转化过程,首先通过热碱变性使得dna由双链变为单链,然后进行恒温条件孵育完成转化过程;转化反应结束后,采用特异羧基磁珠法进行富集回收,在纯化过程中省略了目前市场上均采用的氢氧化钠进行去磺化步骤,具体流程参考图7。为提高磁珠富集效率,用添加了适当比例的聚乙二醇乙醇洗液进行清洗,然后再使用含一定比例的乙醇洗液清洗完毕,最后用不含任何核酸酶的depc水进行洗脱,能够得到高转化率、高产量、高质量、高纯度的dna。本发明的方法具有操作快速简便、适用样本类型多、仪器设备简单、转化效率高等优点。具体地,本发明涉及一种用于人源粪便dna甲基化分析的核酸纯化的方法,包括如下步骤:(1)在1.5ml离心管或2.0ml离心管中加入0.1-2μg的待处理dna,推荐input(加入)体积范围为10-100μl;(2)加入150-300μl亚硫酸盐转化溶液、25-50μl保护溶液盖紧离心管后,上下颠倒混匀,瞬离心;(3)将离心管密闭置于恒温振荡孵育器中,95℃静置孵育5-15分钟;为防止dna复性,可立即将离心管取出,放置冰上5分钟;(4)将离心管取出,颠倒混匀,瞬离心,将离心管置于恒温振荡孵育器中,75-80℃静置孵育45±5分钟;(5)瞬离心上述反应后的2ml离心管,向其中加入800-1000μl洗液ⅰ、50-100μl混匀(新鲜重悬)的羧基磁珠溶液(磁珠预先混匀且室温平衡至少30分钟),上下颠倒混匀;(6)将离心管置于23±2℃的恒温振荡孵育器中,转速1000±100rpm,孵育45-60分钟;(7)瞬离心后将离心管置于dynamagtm-2磁性试管架2-5分钟,待磁珠分离后,弃除上清;(8)将样品从磁力架上取下,加入400-600μl洗液ⅱ;上下颠倒混匀后重复(7)步骤;(9)瞬离心后将离心管置于磁力架2-5分钟,用10-100μl枪头尽量去除残留液体;(10)打开离心管管盖,将离心管放置于室温静置3-5分钟,待磁珠干燥但避免过分干燥;(11)将离心管移至无磁性试管架上;加入50μl洗脱液后混匀重悬磁珠;将离心管于室温条件孵育5-10分钟;(12)瞬离心后离心管置于磁力架2-5分钟,将洗脱液转移至新的无dnase与rnase酶的1.5ml离心管中备用;可2~8℃储存2小时,或-80℃保存不超过7天备用。在一些实施例中,所述的转化溶液为含40-50%(m/v)a组分、8-12%(m/v)b组分及0.1-0.2m的c组分的水溶液。其中a组分为亚硫酸氢钠,b组分为亚硫酸钠,c组分为氢氧化钠。在一些实施例中,所述的保护溶液为按比例配置的d组分(8-12%)(m/v)和e组分(5-10%)(m/v)溶解于f组分。其中d组分为6-hydroxy-2,5,7,8-tetramethyl-chroman-2-carboxylicacid(6-羟基-2,5,7,8甲基-苯并二氢吡喃-2-羧酸),e组分为hydroquinone(对苯二酚),f组分为diethyleneglycoldimethylether(二乙二醇二甲醚)。在一些实施例中,所述的洗液ⅰ为:含5-20%的g组分(m/v)、5-10%的h组分(m/v)、0.1-0.2m的i组分、2-5mm的j组分、2-5mm的k组分、10-20mm的l组分和40-50%m组分(v/v)的水溶液,其中g组分为聚乙二醇,h组分为氯化钠,i组分为乙酸钠,j组分为乙二胺四乙酸(ethylenediaminetetraaceticacid),k组分为三羟甲基氨基甲烷,l组分为异硫氰酸胍,m组分为无水乙醇。在一些实施例中,所述的洗液ⅱ为含体积浓度为70-80%m组分的水溶液。在一些实施例中,所述的洗脱液为无核酸酶depc水。在一些实施例中,所述的磁珠溶液为含浓度为50mg/ml纳米磁性颗粒的水溶液,具体为超顺四氧化三铁或超顺三氧化二铁颗粒,且外表由表面修饰有羧基的二氧化硅包被。本发明涉及的用于dna甲基化分析的核酸纯化的方法,其可应用于后续dna样本中相关基因甲基化水平的分析。本发明的方法具有如下优势:1、本发明涉及的甲基化转化试剂,是针对人源粪便样本dna甲基化分析的需求来研发的,不同于现有的主流naoh碱变性转化方法,而是热变性为主碱变性为辅、恒温混匀仪特定条件转化且不降解片段化dna,整个转化时间只需要60分钟左右;所需仪器设备简单,操作更简便。2、本发明涉及的磁珠特异性吸附dna,涉及的洗液ⅰ与磁珠一起时,溶液环境可增加转化后单链dna与磁珠的结合能力。并且不需要去磺化步骤,也不需要carrierrna,操作更简便,更能节省整个实验操作时间。3、本发明涉及的用于dna甲基化分析的核酸纯化的方法,所有环节均可以实现自动化平台搭建,完成流程的标准化操作。4、本发明涉及的用于dna甲基化分析的核酸纯化的方法,可实现高范围的dna负荷量以及高效的回收及ct转化效率。5、本发明除了可用于人源粪便dna的甲基化分析,还可用于石蜡组织和血液,性能远超过市面上的重亚硫酸盐处理产品。下面将结合具体实施例对本发明进行进一步地详细说明。需要说明的是,目标基因1为actb,目标基因2为ndrg4。实施例1人源粪便总dna的本发明方法与z品牌商品化亚硫酸盐转化试剂盒方法对比人源粪便总dna的获取:选择数例结直肠癌患者的粪便样本,通过核酸提取试剂盒(上海锐翌生物科技有限公司生产,沪闵械备20180535号),取得目的基因高度甲基化的人粪便总dna。一、本发明的用于dna甲基化分析的核酸纯化的方法具体实施步骤:(1)在2.0ml离心管中加入2μg的待处理dna(sample1,2,3),控制input体积范围为20-100μl;(2)加入190μl亚硫酸盐转化溶液、30μl保护溶液盖紧离心管后,上下颠倒混匀,瞬离心;(3)将离心管密闭置于恒温振荡孵育器中,95℃静置孵育10分钟;为防止dna复性,可立即将离心管取出,放置冰上5分钟;(4)将离心管取出,颠倒混匀,瞬离心,将离心管置于恒温振荡孵育器中,80℃静置孵育45分钟;(5)瞬离心上述反应后的离心管,向其中加入800μl洗液ⅰ、100μl混匀(新鲜重悬)的羧基磁珠溶液(磁珠预先混匀且室温平衡至少30分钟),上下颠倒混匀;(6)将离心管置于23℃的恒温振荡孵育器中,转速1000rpm,孵育45分钟;(7)瞬离心后将离心管置于dynamagtm-2磁性试管架2-5分钟,待磁珠分离后,弃除上清;(8)将样品从磁力架上取下,加入400μl洗液ⅱ;上下颠倒混匀后重复(7)步骤;(9)瞬离心后将离心管置于磁力架2分钟,用10-100μl枪头尽量去除残留液体;(10)打开离心管管盖,将离心管放置于室温静置3分钟,待磁珠干燥但避免过分干燥;(11)将离心管移至无磁性试管架上;加入50μl洗脱液后混匀重悬磁珠;将离心管于室温条件孵育10分钟;(12)瞬离心后离心管置于磁力架2分钟,将洗脱液转移至新的无核酸酶的1.5ml离心管中备用;可2~8℃储存2小时,或-80℃保存不超过7天备用。所述亚硫酸盐转化溶液为含45%(m/v)a组分、10%(m/v)b组分和0.1m的c组分的水溶液。其中a组分为亚硫酸氢钠,b组分为亚硫酸钠,c组分为氢氧化钠。所述的保护溶液为按比例配置的d组分(8%)(m/v)和e组分(5%)(m/v)溶解于f组分。其中d组分为6-hydroxy-2,5,7,8-tetramethyl-chroman-2-carboxylicacid,e组分为hydroquinone,f组分为diethyleneglycoldimethylether。所述的洗液ⅰ为:10%的g组分(m/v)、10%的h组分(m/v)、0.1m的i组分、5mm的j组分、2mm的k组分、10mm的l组分和40-50%m组分(v/v)的水溶液,其中g组分为聚乙二醇,h组分为氯化钠,i组分为乙酸钠,j组分为乙二胺四乙酸(ethylenediaminetetraaceticacid),k组分为三羟甲基氨基甲烷,l组分为异硫氰酸胍,m组分为无水乙醇。所述的洗液ⅱ为含体积浓度为70-80%m组分的水溶液。所述的洗脱液为无核酸酶depc水。所述的磁珠溶液为含浓度为50mg/ml纳米磁性颗粒的水溶液,具体为超顺四氧化三铁或超顺三氧化二铁颗粒,且外表由表面修饰有羧基的二氧化硅包被。本发明涉及的用于dna甲基化分析的核酸纯化的方法,其可应用于后续dna样本中相关基因甲基化水平的分析。二、z品牌商品化试剂盒的亚硫酸盐转化及纯化具体实施步骤:1.向pcr管中加入130μllightningconversionreagent(转化试剂)和20μl的待处理dna(sample1,2,3)(各2μg),混匀离心,确保管盖上没有液滴残留。2.将离心后的pcr管放入pcr仪,设置转化程序如下表1。表1:转化程序98℃8min54℃1h4℃1min~20h3.先将600μl的m-bindingbuffer和10μl的magbinding(磁珠)加入到1.5ml的离心管中,上下颠倒混匀。4.将转化完成的样本转移到含m-bindingbuffer和磁珠的1.5ml离心管中,震荡混匀后室温孵育5-10min,期间每隔2-3min颠倒混匀或震荡混匀,以使磁珠处于悬浮状态。5.孵育完成后,低速瞬离后将离心管置于磁力架上磁分离3min,小心移除上清。6.从磁力架上取下离心管,加入400μlm-washingbuffer,vortexing(涡流)≤3000rpm重悬磁珠,低速瞬离后将离心管置于磁力架上磁分离3min,小心移除上清。7.从磁力架上取下离心管,加入200μll-desμlphonationbuffer,vortexing≤3000rpm重悬磁珠后室温孵育20min,期间每隔5min通过摇晃或震荡,使磁珠保持悬浮。8.打开金属浴,设置温度为55℃。9.孵育完成后,瞬离,将离心管置于磁力架上磁分离3min,小心移除上清。10.取下离心管,加入400μlm-washingbuffer,vortexing≤3000rpm重悬磁珠,低速瞬离后将离心管置于磁力架上磁分离3min,小心移除上清。重复此步骤。11.简单离心后,再次将离心管置于磁力架上,尽可能多地移除残留液体,但不要吸到磁珠。此步可选做,目的为缩短磁珠烘干时间,并使磁珠在烘干时有良好的聚集性。12.将离心管开盖后6min。可观察到磁珠颜色由亮黑色变为红棕色。13.烘干完成后加入50μlm-elutionbuffer,重悬磁珠后置于55℃1500rpm洗脱4min。完成后置于磁力架磁分离,转移上清于新的1.5ml离心管。三、本发明及z品牌商品化试剂盒转化得到的dna采用实时荧光pcr进行甲基化检测,检测结果见下表2。表2:实时荧光pcr进行甲基化检测检测结果从上表2的检测结果来看,本发明的纯化方法与z品牌商品化试剂盒转化的产物,采用实时荧光pcr方法,使用msp引物检测甲基化情况,z品牌商品化试剂盒转化后的产物进行检测存在假阴性现象;且本发明的ct值情况优于z品牌商品化试剂盒;详见图1,图2。实施例2石蜡dna的本发明方法与z品牌商品化亚硫酸盐转化试剂盒方法对比石蜡dna的提取采用石蜡包埋组织dna提取试剂盒(dnaffpetissue,56404),获得ffpe-dna。一、本发明的用于dna甲基化分析的核酸纯化的方法具体实施步骤:(1)在2.0ml离心管中加入500ng的待处理ffpe-dna,input体积约为50μl;(2)加入200μl亚硫酸盐转化溶液、50μl保护溶液盖紧离心管后,上下颠倒混匀,瞬离心;(3)将离心管密闭置于恒温振荡孵育器中,95℃静置孵育5分钟;为防止dna复性,可立即将离心管取出,放置冰上5分钟;(4)将离心管取出,颠倒混匀,瞬离心,将离心管置于恒温振荡孵育器中,75℃静置孵育45±5分钟;(5)瞬离心上述反应后的离心管,向其中加入800μl洗液ⅰ、50μl混匀(新鲜重悬)的羧基磁珠溶液(磁珠预先混匀且室温平衡至少30分钟),上下颠倒混匀;(6)将离心管置于23℃的恒温振荡孵育器中,转速1000rpm,孵育45分钟;(7)瞬离心后将离心管置于dynamagtm-2磁性试管架2-5分钟,待磁珠分离后,弃除上清;(8)将样品从磁力架上取下,加入400μl洗液ⅱ;上下颠倒混匀后重复(7)步骤;(9)瞬离心后将离心管置于磁力架2分钟,用10-100μl枪头尽量去除残留液体;(10)打开离心管管盖,将离心管放置于室温静置3分钟,待磁珠干燥但避免过分干燥;(11)将离心管移至无磁性试管架上;加入50μl洗脱液后混匀重悬磁珠;将离心管于室温条件孵育10分钟;(12)瞬离心后离心管置于磁力架2-5分钟,将洗脱液转移至新的无核酸酶的1.5ml离心管中备用;可2~8℃储存2小时,或-80℃保存不超过7天备用。所述的转化溶液为含50%(m/v)a组分、8%(m/v)b组分及0.2m的c组分的水溶液。其中a组分为亚硫酸氢钠,b组分为亚硫酸钠,c组分为氢氧化钠。所述的保护溶液为按比例配置的d组分(10.5%)(m/v)和e组分(5%)(m/v)溶解于f组分。其中d组分为6-hydroxy-2,5,7,8-tetramethyl-chroman-2-carboxylicacid,e组分为hydroquinone,f组分为diethyleneglycoldimethylether。所述的洗液ⅰ为:15%的g组分(m/v)、5%的h组分(m/v)、0.2m的i组分、2mm的j组分、5mm的k组分、10mm的l组分和50%m组分(v/v)的水溶液,其中g组分为聚乙二醇,h组分为氯化钠,i组分为乙酸钠,j组分为乙二胺四乙酸(ethylenediaminetetraaceticacid),k组分为三羟甲基氨基甲烷,l组分为异硫氰酸胍,m组分为无水乙醇。所述的洗液ⅱ为含体积浓度为80%m组分的水溶液。所述的洗脱液为无核酸酶depc水。所述的磁珠溶液为含浓度为50mg/ml纳米磁性颗粒的水溶液,具体为超顺四氧化三铁或超顺三氧化二铁颗粒,且外表由表面修饰有羧基的二氧化硅包被。本发明涉及的一种用于dna甲基化分析的核酸纯化的方法,其可应用于脱氧核糖核酸转化及后续纯化,所纯化的转化dna可用于后续dna中相关基因甲基化的分析。二、z品牌商品化试剂盒的亚硫酸盐转化及纯化具体实施步骤:1.向pcr管中加入130μllightningconversionreagent(转化试剂)和20μl的dna样本(500ng),混匀离心,确保管盖上没有液滴残留。2.将离心后的pcr管放入pcr仪,设置转化程序如下表3。表3:转化程序98℃8min54℃1h4℃1min~20h3.先将600μl的m-bindingbuffer和10μl的magbinding(磁珠)加入到1.5ml的离心管中,上下颠倒混匀。4.将转化完成的样本转移到含m-bindingbuffer和磁珠的1.5ml离心管中,震荡混匀后室温孵育5min,期间每隔2min颠倒混匀或震荡混匀,以使磁珠处于悬浮状态。5.孵育完成后,低速瞬离后将离心管置于磁力架上磁分离3min,小心移除上清。6.从磁力架上取下离心管,加入400μlm-washingbuffer,vortexing≤3000rpm重悬磁珠,低速瞬离后将离心管置于磁力架上磁分离3min,小心移除上清。7.从磁力架上取下离心管,加入200μll-desμlphonationbuffer,vortexing≤3000rpm重悬磁珠后室温孵育20min,期间每隔5min通过摇晃或震荡,使磁珠保持悬浮。8.打开金属浴,设置温度为55℃。9.孵育完成后,瞬离,将离心管置于磁力架上磁分离3min,小心移除上清。10.取下离心管,加入400μlm-washingbuffer,vortexing≤3000rpm重悬磁珠,低速瞬离后将离心管置于磁力架上磁分离3min,小心移除上清。重复此步骤。11.简单离心后,再次将离心管置于磁力架上,尽可能多地移除残留液体,但不要吸到磁珠。此步可选做,目的为缩短磁珠烘干时间,并使磁珠在烘干时有良好的聚集性。12.将离心管开盖后于55℃烘干,2min即可。可观察到磁珠颜色由亮黑色变为红棕色。13.烘干完成后加入50μlm-elutionbuffer,重悬磁珠后置于55℃1500rpm洗脱4min。完成后置于磁力架磁分离,转移上清于新的1.5ml离心管。三、本发明及z品牌商品化试剂盒转化得到的dna采用实时荧光pcr进行甲基化检测,检测结果见下表4。表4:实时荧光pcr进行甲基化检测检测结果从上表4的检测结果来看,本发明的纯化方法与z品牌商品化试剂盒转化的石蜡样本dna产物,采用实时荧光pcr方法,使用msp引物检测甲基化情况,本发明的ct值情况明显优于z品牌商品化试剂盒;详见图3,图4。实施例3血浆游离dna的本发明方法与z品牌商品化亚硫酸盐转化试剂盒方法对比血浆dna的提取采用外周血游离dna提取试剂盒(vahtsserum/plasmacircμlatingdnakit,n902-01),获得cfdna。一、本发明的用于dna甲基化分析的核酸纯化的方法具体实施步骤:(1)在2.0ml离心管中加入20ng的待处理dna,体积为50μl;(2)加入280μl亚硫酸盐转化溶液、50μl保护溶液盖紧离心管后,上下颠倒混匀,瞬离心;(3)将离心管密闭置于恒温振荡孵育器中,95℃静置孵育5分钟;为防止dna复性,可立即将离心管取出,放置冰上5分钟;(4)将离心管取出,颠倒混匀,瞬离心,将离心管置于恒温振荡孵育器中,80℃静置孵育45±5分钟;(5)瞬离心上述反应后的离心管,向其中加入1000μl洗液ⅰ、100μl混匀(新鲜重悬)的羧基磁珠溶液(磁珠预先混匀且室温平衡至少30分钟),上下颠倒混匀;(6)将离心管置于23℃的恒温振荡孵育器中,转速1000rpm,孵育45分钟;(7)瞬离心后将离心管置于dynamagtm-2磁性试管架2-5分钟,待磁珠分离后,弃除上清;(8)将样品从磁力架上取下,加入600μl洗液ⅱ;上下颠倒混匀后重复(7)步骤;(9)瞬离心后将离心管置于磁力架2分钟,用10-100μl枪头尽量去除残留液体;(10)打开离心管管盖,将离心管放置于室温静置3-5分钟,待磁珠干燥但避免过分干燥;(11)将离心管移至无磁性试管架上;加入50μl洗脱液后混匀重悬磁珠;将离心管于室温条件孵育10分钟;(12)瞬离心后离心管置于磁力架2分钟,将洗脱液转移至新的无核酸酶的1.5ml离心管中备用;可2~8℃储存2小时,或-80℃保存不超过7天备用。所述亚硫酸盐转化溶液为含45%(m/v)a组分、8%(m/v)b组分和0.2m的c组分的水溶液。其中a组分为亚硫酸氢钠,b组分为亚硫酸钠,c组分为氢氧化钠。所述的保护溶液为按比例配置的d组分(8%)(m/v)和e组分(5%)(m/v)溶解于f组分。其中d组分为6-hydroxy-2,5,7,8-tetramethyl-chroman-2-carboxylicacid,e组分为hydroquinone,f组分为diethyleneglycoldimethylether。所述的洗液ⅰ为:10%的g组分(m/v)、10%的h组分(m/v)、0.2m的i组分、5mm的j组分、2mm的k组分、10mm的l组分和50%m组分(v/v)的水溶液,其中g组分为聚乙二醇,h组分为氯化钠,i组分为乙酸钠,j组分为乙二胺四乙酸(ethylenediaminetetraaceticacid),k组分为三羟甲基氨基甲烷,l组分为异硫氰酸胍,m组分为无水乙醇。所述的洗液ⅱ为含体积浓度为70%m组分的水溶液。所述的洗脱液为无核酸酶depc水。所述的磁珠溶液为含浓度为50mg/ml纳米磁性颗粒的水溶液,具体为超顺四氧化三铁或超顺三氧化二铁颗粒,且外表由表面修饰有羧基的二氧化硅包被。本发明涉及的用于dna甲基化分析的核酸纯化的方法,其可应用于后续dna样本中相关基因甲基化水平的分析。二、z品牌商品化试剂盒的亚硫酸盐转化及纯化具体实施步骤:1.向pcr管中加入130μllightningconversionreagent(转化试剂)和20μl的dna样本(20ng),混匀离心,确保管盖上没有液滴残留。2.将离心后的pcr管放入pcr仪,设置转化程序如下表5。表5:转化程序98℃8min54℃1h4℃1min~20h3.先将600μl的m-bindingbuffer和10μl的magbinding(磁珠)加入到1.5ml的离心管中,上下颠倒混匀。4.将转化完成的样本转移到含m-bindingbuffer和磁珠的1.5ml离心管中,震荡混匀后室温孵育5min,期间每隔2min颠倒混匀或震荡混匀,以使磁珠处于悬浮状态。5.孵育完成后,低速瞬离后将离心管置于磁力架上磁分离3min,小心移除上清。6.从磁力架上取下离心管,加入400μlm-washingbuffer,vortexing≤3000rpm重悬磁珠,低速瞬离后将离心管置于磁力架上磁分离3min,小心移除上清。7.从磁力架上取下离心管,加入200μll-desμlphonationbuffer,vortexing≤3000rpm重悬磁珠后室温孵育20min,期间每隔5min通过摇晃或震荡,使磁珠保持悬浮。8.打开金属浴,设置温度为55℃。9.孵育完成后,瞬离,将离心管置于磁力架上磁分离3min,小心移除上清。10.取下离心管,加入400μlm-washingbuffer,vortexing≤3000rpm重悬磁珠,低速瞬离后将离心管置于磁力架上磁分离3min,小心移除上清。重复此步骤。11.简单离心后,再次将离心管置于磁力架上,尽可能多地移除残留液体,但不要吸到磁珠。此步可选做,目的为缩短磁珠烘干时间,并使磁珠在烘干时有良好的聚集性。12.将离心管开盖后于55℃烘干,2min即可。可观察到磁珠颜色由亮黑色变为红棕色。13.烘干完成后加入50μlm-elutionbuffer,重悬磁珠后置于55℃1500rpm洗脱4min。完成后置于磁力架磁分离,转移上清于新的1.5ml离心管。三、本发明及z品牌商品化试剂盒转化得到的dna采用实时荧光pcr进行甲基化检测,检测结果见下表6。表6:实时荧光pcr进行甲基化检测检测结果处理方式目标基因1的ct值目标基因2的ct值本发明27.8627.86z品牌32.6131.7从上表6的检测结果来看,本发明的纯化方法与z品牌商品化试剂盒转化的血浆样本dna产物,采用实时荧光pcr方法,使用msp引物检测甲基化情况,本发明的ct值情况明显优于z品牌商品化试剂盒;详见图5,图6。在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1