用于早期胃癌诊断的分子标志物及其应用的制作方法
本发明涉及一种分子标志物及其应用,特别涉及一种用于早期胃癌诊断的分子标志物及其应用,本发明属于医药
技术领域:
。
背景技术:
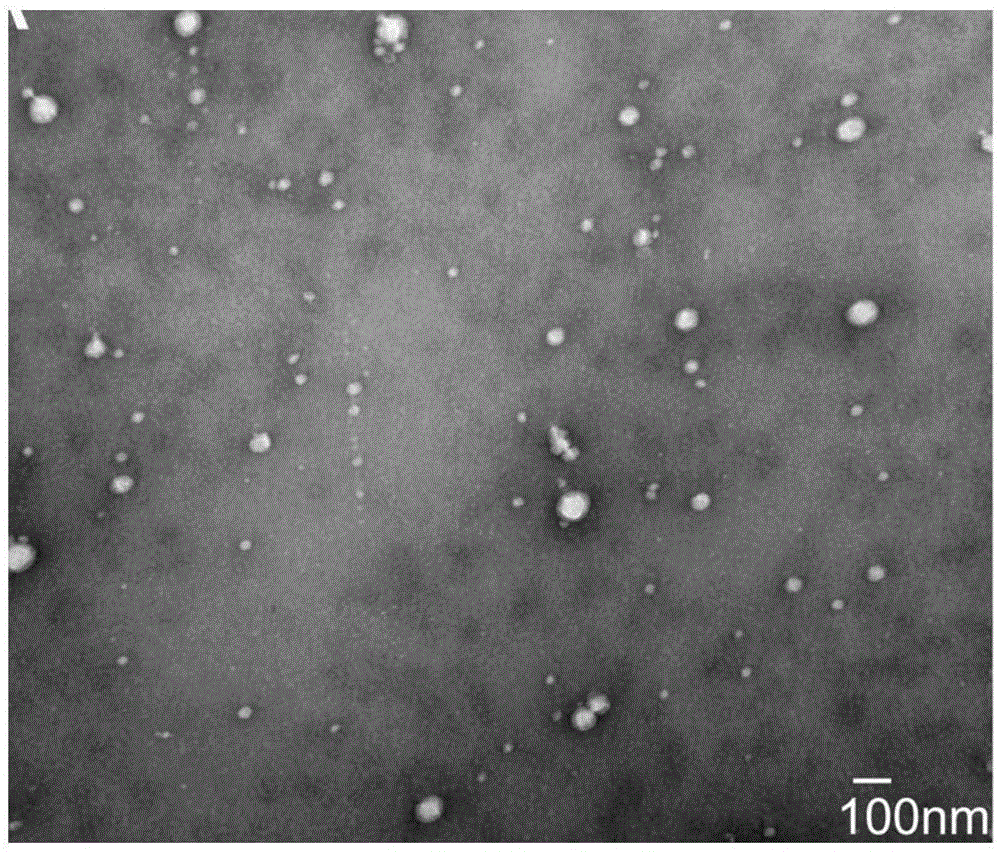
:众所周知胃癌是常见的严重威胁生命的消化系统恶性肿瘤。根据美国癌症学会的统计,截止至2012年胃癌已成为是全球第五大常见的恶性肿瘤、第三大致死性癌症。2012年全球有近100万例胃癌新增病例、70余万患者死亡。发展中国家男性及女性的胃癌发病率及死亡率均较发达国家更高,目前全球70%的新发病例发生在亚洲的发展中国家,其中的一半主要发生在我国,2015年中国癌症统计数据显示胃癌位居我国癌症发病率及死亡率的第二位。尽管近年来胃癌的发病率有所下降,然而其死亡率仍居高不下,缺乏早期诊断的方法以及容易产生耐药是其高致死率背后的主要原因。晚期胃癌的5年生存率仅为30%-50%,而早期胃癌的5年生存率可达90%以上。胃癌的早期诊断也可以有效地降低患者的死亡率,因此早期诊断对提高胃癌疗效非常重要。胃癌早期诊断一直是人们关注的重点问题,目前传统的胃镜检查仍是胃癌诊断最可靠的手段,然而胃镜检查属侵入性检查,不适宜作为常规筛选检查。目前用于临床的胃癌标志物主要有cea、ca199、ca724等,但这些指标诊断的灵敏度和特异性均较低,用于临床诊断价值有限。因此,为规避常规诊断的短板,迫切需要一种新的、简便易行的、高敏感及高特异性的非侵入性标志物,来提高胃癌早期甚至是超早期诊断或预后评估。exosome是来源于细胞内体、经由多管状小体与细胞浆膜融合而释放到细胞外环境中的双层膜性结构,直径在30-100nm,几乎可以由所有种类的细胞分泌,并存在于人体内几乎所有的体液中,如:血浆,血清,唾液,尿液,腹水等。exosome能够作为一种“运输工具”,在细胞间转运蛋白质和rna参与许多细胞内过程,介导癌症进展、肿瘤微环境改变、血管生成、免疫反应调节、转移和耐药等。血液是exosome在循环系统中的重要分布地点,血清exosome被证实是循环系统中mirna的主要来源。在exosome的双层膜结构的保护下,血液中大量存在的rna酶被充分隔离,使得mirna免于被降解而保持稳定;另外,有了exosome的保护,物理因素如冻融所导致的血液中rna含量的波动不会影响其在exosome中的水平,即使mirna被转移到远离原始细胞的位置时也仍能保持其原有的功能。相比于血液中总mirna的弱稳定状态,exosomemirnas稳定性更强,即使是在长期冻存的样本中也能方便的提取;另外,exosomes中的mirnas还有选择性富集和特异的特点。本发明首次发现,与正常人相比,早期胃癌患者循环血中的exo-mir-92b-3p及exo-let7g-5p含量显著升高,较常规的肿瘤标志物--cea指标有更高的诊断效率。且exo-mir-92b-3p和exo-let7g-5p的联合及其联合cea指标后均能够显著提高诊断率,exo-mir-92b-3p及exo-let7g-5p是早期胃癌的可靠循环生物标志物。技术实现要素:针对现有用于早期胃癌诊断的分子标志物诊断阳性率、灵敏度和特异性均较低的问题,本发明提出了一种用于早期胃癌诊断的分子标志物及其应用。为了达到上述目的,本发明采用了以下技术手段:本发明提出了一种用于早期胃癌诊断的分子标志物,该子标志物为外泌体mirnaexo-mir-92b-3p及/或exo-let7g-5p,其中exo-mir-92b-3p的核苷酸序列如序列表中seqidno:1所示,exo-let7g-5p的核苷酸序列如序列表中seqidno:2所示。进一步的,本发明还提出了所述的分子标志物以及用于检测外泌体mirnaexo-mir-92b-3p及/或exo-let7g-5p表达水平的试剂用于制备用于诊断早期胃癌的试剂盒中的应用。其中,优选的,所述的试剂为引物,更优选的,用于外泌体mirnaexo-mir-92b-3p表达水平检测的上游引物为如序列表中seqidno:3所示,用于外泌体exo-let7g-5p表达水平检测的上游引物为如序列表中seqidno:4所示,下游引物均为通用引物。其中,优选的,所述的通用引物为miscriptuniversalprimer。更进一步的,本发明还提出了一种用于诊断早期胃癌的试剂盒,所述试剂盒中含有用于检测外泌体mirnaexo-mir-92b-3p及/或exo-let7g-5p表达水平的引物,优选的,用于外泌体mirnaexo-mir-92b-3p表达水平检测的上游引物如序列表中seqidno:3所示,用于外泌体exo-let7g-5p表达水平检测的上游引物如序列表中seqidno:4所示,下游引物均为通用引物。其中,优选的,所述的通用引物为miscriptuniversalprimer。其中,优选的,所述的试剂盒中还含有真空采血管-分离胶/促凝剂管、真空采血针组件、外泌体分离试剂、外泌体mirna提取试剂、反转录试剂、实时荧光定量pcr试剂以及用于检测内参hsa-mir-30e-5p表达水平的引物,其中上游引物如序列表中seqidno:5所示,下游引物为通用引物。其中,优选的,使用本发明所述的试剂盒用于早期胃癌诊断时,按照以下步骤进行:(1)血清exosome分离及其rna提取采用外泌体分离试剂分离血清中的exosomes,再用外泌体mirna提取试剂提取exosomes中的小rna;(2)外泌体rna逆转录成cdna采用反转录试剂将外泌体rna逆转录成cdna;(3)pcr扩增cdna以逆转录成的cdna为模板,采用实时荧光定量pcr试剂按照以下方法中的任一种进行pcr扩增;1)采用用于检测外泌体mirnaexo-mir-92b-3p及内参hsa-mir-30e-5p的引物进行扩增;2)采用用于检测外泌体mirnahsa-let7g-5p及内参hsa-mir-30e-5p的引物进行扩增;3)采用用于检测外泌体mirnaexo-mir-92b-3p、hsa-let7g-5p及内参hsa-mir-30e-5p的引物进行联合扩增;(4)结果判定:荧光定量检测结果分析:以hsa-mir-30e-5p的表达量为参照,计算mirna表达量时,mirna的相对定量以δct值显示,δct=ct(mirna)-ct(hsa-mir-30e-5p),其中在方法1)中,将hsa-mir-92b-3p的相对表达量δct<1.690判定为表达阳性,反之为表达阴性;表达阳性者诊断为胃癌;方法2)中,将hsa-let7g-5p的相对表达量δct<4.184判定为表达阳性,反之为表达阴性;表达阳性者诊断为胃癌;方法3)中,将hsa-mir-92b-3p的相对表达量δct<1.690、hsa-let7g-5p的相对表达量δct<4.184判定为表达阳性,反之为阴性;当hsa-mir-92b-3p及hsa-let7g-5p任一指标表达阳性时,诊断为早期胃癌。相较于现有技术,本发明的有益效果:本发明首次发现,与正常人相比,早期胃癌患者循环血中的exo-mir-92b-3p及exo-let7g-5p含量显著升高,较常规的肿瘤标志物--cea指标有更高的诊断效率,且exo-mir-92b-3p和exo-let7g-5p的联合及其联合cea指标后均能够显著提高诊断率,exo-mir-92b-3p及exo-let7g-5p是早期胃癌的可靠循环生物标志物。早期胃癌患者血清cea、ca199、ca724的诊断阳性率分别为:9.1%、11.4%及2.3%。而本发明中早期胃癌患者血清exo-mir-92b-3p的诊断阳性率为42%;早期胃癌患者血清exo-let7g-5p的诊断阳性率为46%。早期胃癌患者血清exo-mir-92b-3p及exo-let7g-5p联合诊断后阳性率为60%。诊断阳性率显著高于现有的cea、ca199、ca724。目前胃癌标志物研究大部分局限于循环血rna检测,然而循环血rna稳定性差,极易降解,对血样采集及处理要求极高。而血清中的exosomes因具有双层膜的保护,稳定不易被降解,对保存环境和检测时间要求低。克服了以往早期胃癌循环血mirnas稳定性差及检出率低的缺点。本发明改变了胃癌早期诊断手段少的现状,为胃癌早期诊断提供了一种新的、简便易行的、高敏感及高特异性的非侵入性标志物,提高了胃癌早期甚至是超早期诊断率。同时exosomes内的蛋白、核酸等均为细胞主动或被动分泌,在癌症发生发展过程中提供必要性的功能物质,因此更具诊断价值。而本发明通过提取血清中的exosomes,检测exo-mir-92b-3p及exo-let7g-5p,可保证结果的稳定和可靠。本发明的肿瘤标志物exo-mir-92b-3p及exo-let7g-5p,在小规模临床样本中即可证实适合作为消化系统肿瘤的诊断标志物,较传统cea、ca199、ca724等均具有更好的敏感性和特异性,可作为人群普查的肿瘤标志物。早期胃癌患者血清cea诊断的敏感性及特异性分别为:70%,42%。而本发明中早期胃癌患者血清exo-mir-92b-3p诊断的敏感性及特异性分别为:80%,58%;早期胃癌患者血清exo-let7g-5p诊断的敏感性及特异性分别为:88%,54%。早期胃癌患者血清exo-mir-92b-3p及exo-let7g-5p联合诊断后敏感性及特异性分别为:82%,60%。本发明使用外泌体mirna分子标记物检测早期胃癌,避免了传统有创检查(如胃镜)对身体带来的伤害。在对患者使用血清检测胃癌cea、ca199和ca724任一结果为阳性,再使用本发明提供的检测试剂盒进行辅助检测,可以有效去除血清学检测的假阳性结果,从而避免给患者带来巨大的精神压力和财产损失;同时针对血清检测胃癌cea、ca199和ca724的结果为阴性,再使用本发明提供的检测试剂盒进行辅助检测,可以有效发现血清学检测的假阴性结果,从而及时挽救患者生命。本发明发现两种新的高效能的针对于早期胃癌的特异性外泌体mirna分子标志物,为基于外周血外泌体mirna作为胃癌早期诊断标志物的研发提供了新思路和理论依据。附图说明图1为透射电镜下血清外泌体形态;图2为血清外泌体rna大小分布凝胶电泳图;图3为血清exo-mir-92b-3p在早期胃癌患者及正常人中的表达水平及差异;图4为血清exo-let7g-5p在早期胃癌患者及正常人中的表达水平及差异;图5为血清cea在早期胃癌患者及正常人中的表达水平及差异;图6为血清exo-mir-92b-3p的roc曲线;图7为血清exo-let7g-5p的roc曲线;图8为血清cea的roc曲线;图9为血清exo-mir-92b-3p和exo-let7g-5p组合的roc曲线;图10为血清exo-mir-92b-3p和cea组合的roc曲线;图11为血清exo-let7g-5p和cea组合的roc曲线;图12为血清exo-mir-92b-3p、exo-let7g-5p及cea组合的roc曲线;图13为血清exo-mir-92b-3p与胃癌神经浸润的关系;图14为血清exo-let7g-5p与胃癌神经浸润的关系;图15为血清exo-mir-92b-3p与胃癌低黏附性的关系;图16为血清exo-let7g-5p与胃癌低黏附性的关系;图17为血清exo-mir-92b-3p与胃癌分化程度的关系;图18为血清exo-let7g-5p与胃癌分化程度的关系;图19为以术后病理检查为标准,对比血清学检测、外泌体mirnas检测及胃镜检测等检测方法的准确性。具体实施方式下面对本发明的实施例做详细说明,以下实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方案和具体的操作过程,但本发明的保护范围不限于下述的实施例。以下实施例中所述室温均指25℃。实施例1:与早期胃癌相关度较高外泌体mirna的筛选1、病人和样本纳入:在本实验中,共纳入了36个早期胃癌患者和12个正常人对照。肿瘤患者的入选和排除标准包括:1)首诊患者;2)采血时患者既往未使用任何针对胃癌的治疗性药物,也未经受任何辐射性检查及治疗;3)无既往或伴随其他消化道肿瘤病史;4)经术后病理证实为早期胃癌;5)患者临床病理资料完整;6)没有其他急性疾病或者系统性疾病例如自身免疫性疾病、糖尿病、冠心病等。将符合上述条件的患者血样编入病例组。正常对照组源于数量和年龄与病例组相匹配的、体检正常的人群(年龄中位值相差<1%)。2、样品收集采集3ml新鲜外周血液置于黄头真空采血管-分离胶/促凝剂管中,在4℃静置30min,再于tomymx-307冷冻离心机4℃3000×g离心30min。吸取上层的淡黄色血清,以260μl/管分装到洁净的1.5ml塑料离心管中,-80℃保存备用。为确保血清中不含细胞碎片,离心管中至少保留0.5cm高的血清;为保证实验操作的均一性,需确保整个血清制备过程在两小时内全部完成。3、血清exosomes分离及其rna提取1)exosomes提取:外泌体的提取借助sbi公司exoquicktmexosomeprecipitationsolution试剂盒(cat.#exoq20a-1),提取方法具体如下:将260μl血清置于冰上解冻,再于tomymx-307冷冻离心机4℃3000×g离心30min。吸取上层的淡黄色血清250μl/管分装到洁净的1.5ml塑料离心管中。加入25μltromboplatind,混匀。置于37℃水浴锅中孵育15min。随后于tomymx-307冷冻离心机25℃10000×g离心5min,吸取上清液到洁净的1.5ml塑料离心管中。向离心管中加入75μlexoquick试剂,混匀,并置于4℃冰箱中过夜。过夜处理的样品于tomymx-307冷冻离心机4℃1500×g离心30min离心,吸弃上清液,再次tomymx-307冷冻离心机4℃1500×g离心5min离心,吸弃上清液,ep管下方黄色的沉淀即为血清exosomes。加入1×pbs50μl将黄色沉淀混悬成为均匀的淡黄色混合液。2)exosomes电镜下检测:exosomes溶液在2%多聚甲醛溶液中固定,然后用蒸馏水连续稀释。将5μl稀释混合物转移到清洁的硅晶片上。经超声处理后,硅晶片按顺序在乙醇和蒸馏水分别浸泡5分钟。通风罩下吹干固定微囊泡。然后将硅片安装在sem平台上。为了使表面导电,在用扫描电子显微镜(s-4700,日本)成像之前,通过溅射(spi-modulesputter,edeninstruments,法国)涂覆2-5nm金-钯合金的涂层。电镜扫描在低光束能量(5.0-10.0kv)条件下进行。为呈现扫描电镜下最佳囊泡形态,将新鲜分离的exosomes固定,并在分离后立即成像。使用imagej软件处理照片。结果见图1。用exoquicktm试剂盒分离并提取血清中的外泌体,在透射电子显微镜检查观察到在放大80000×下提取物的粒径分布主要为直径100nm左右圆形微囊泡,符合外泌体的形态学表现,证实该提取方法能够成功提取血清中的外泌体。3)外泌体rna提取外泌体rna的提取借助qiagen公司mirneasymicrokit试剂盒(cat.#217084),提取方法如下:①加入700μlqiazol至离心管中,将沉淀重悬裂解完全,室温静置5分钟。再加入140μl氯仿(上海沪试化工),盖紧离心管盖。剧烈震荡15秒,室温静置3分钟。②tomymx-307冷冻离心机4℃12,000×g离心15min。③小心将离心管中上层水相350μl转移至新的洁净1.5ml塑料离心管离心管中。加入525μl100%乙醇溶液,轻柔混合均匀。④抽取③得到的混合液700μl加入rneasyminelutespincolumn中,hitachict15re冷冻离心机22℃500×g离心30s→22℃800×g离心30s,弃流出液。⑤重复,即hitachict15re冷冻离心机22℃500×g离心30s→22℃800×g离心30s,弃流出液。⑥在rneasyminelutespincolumn中加入700μlbufferrwt,盖好盖子,hitachict15re冷冻离心机22℃8000×g离心15s,弃流出液。⑦在rneasyminelutespincolumn中加入500μlbufferrpe,盖好盖子,hitachict15re冷冻离心机22℃8000×g离心15s,弃流出液。⑧在rneasyminelutespincolumn中加入500μl80%乙醇溶液,盖好盖子,hitachict15re冷冻离心机22℃8000×g离心15s,弃流出液。再hitachict15re冷冻离心机22℃21000×g离心2min。⑨将rneasyminelutespincolumn放入试剂盒提供的新的洁净1.5ml塑料离心管离心管中,并置于超净台中干燥。⑩在rneasyminelutespincolumn中心加入14μl无核酸酶去离子水(即试剂盒提供的rnasefreewater),盖好盖子,室温静置5min,hitachict15re冷冻离心机22℃2000×g离心30s→21000×g、22℃离心2min,流出液即为exosomesrna。将含有exosomesrna的离心管置于冰上,分装1.2μl至洁净200μl塑料离心管中,并将两部分均冷冻于-80℃冰箱中。4)外泌体rna含量检测应用lifetechnologies(abi)公司agilentsmallrnakit试剂盒(cat.#5067-1548)检测外泌体rna含量。检测结果见图2,通过agilentsmallrnakit试剂盒测定外泌体中提取出的rna含量和片段大小。250μl血浆中mirna产量为9至30ng,产量丰富,其主要分布在长度为18-28nt的范围内,22nt达到峰值,符合mirna的分子大小,证实外泌体内提取的rna主要为mirna。外泌体rna提取方法稳定、提取出rna含量富足。4、建库、二代测序及数据分析1)建库借助neb公司multiplexsmallrnalibraryprepsetfor(set1)试剂盒(neb#e7300s)进行外泌体rna的建库,随后应用qiagen公司qiaquickpcrpurificationkit试剂盒(cat.#28104)对获得的cdna进行提纯处理,提纯后的cdna于5%page胶100v40mins电泳分离,于bio-rad显色仪(usa,en61010-1)的紫外灯下显色,切割大小为140bp~160bp区域的条带,进一步对目的胶块提纯处理以获取小rna对应的目的cdna文库:将所有目的样本均稀释至20ng/μl,分装5.5μl至新的洁净无核酸酶的1.5ml塑料离心管中,干冰送检公司行二代测序。2)二代测序结果及分析采用illumina公司的hiseq2000genomeanalyzer平台进行高通量序列鉴定。测序策略定为单向读取、50个测序循环方式。由于mirna分子的长度不超过23nt,读取50个碱基的测序策略能完全覆盖文库中插入的mirna分子的全长。应用经过我们优化的perl脚本来处理测序数据。首先提取序列信息并进行数据修剪,将插入片段大于16nt的序列提取出来并整合。应用经过优化的bowtie软件将合并后的序列文件与人类成熟mirna序列库及基因组rna序列库进行同源性比对,参考数据来自于mirnbase最新版本(rlease19,更新中)和ncbi最近更新的库文件。mirna转录水平通过比较其测定读数可比对的mirna总读数所得来的值来进行标准化。标准化读数绝对值≥5的mirna进行差异性分析。选取表达上调、auc≥8、敏感性及特异性均大于80%的有差异性的mirnas进行验证,部分二代测序初筛出的早期胃癌血清exosomes表达上调的mirnas及其诊断情况见表1。共计选中6个mirna分子进行验证:hsa-mir92b-3p,hsa-mir-21-5p,hsa-let7c-5p,hsa-let7g-5p,hsa-mir-26a-5p,hsa-mirna-101-3p(ms00032144,ms00009079,ms00003129,ms00008337,ms00029239,ms00008372,qiagen,usa)。mirna-30e-5p(ms00009401,qiagen,usa)作为内源性内参同时针对每个样本进行扩增。表1二代测序初筛出的早期胃癌血清exosomes表达上调的mirnas及其诊断情况实施例2:与早期胃癌相关度较高外泌体mirnas的验证1.病人和样本纳入:在本实验中,共纳入了50个早期胃癌患者和50个正常人作为对照。肿瘤患者的入选和排除标准同实施例1。2.样品收集、血清外泌体分离及其rna提取方法均同实施例1。3.外泌体rna逆转录成cdna外泌体rna的逆转录借助qiagen公司miscriptiirtkit试剂盒(cat.#218161),具体操作方法如下:①在冰上融化外泌体rna,室温下融化5xmiscriptrtbuffer和rnasefreewater。轻弹每个小管使其充分混匀,然后短暂离心以收集管壁和管盖上的液体,最后放置在冰上。②在每个pcr管中加入4ngrna,并加入无核酸酶去离子水(即试剂盒提供的rnasefreewater)至总体积为9μl。③在冰上配制reverse-transcriptionmastermix,取一个新的洁净1.5ml塑料离心管,加入330μl5xmiscripthispecbuffer、165μl10xmiscriptnucleicsmix及165μlmiscriptreversetranscriptasemix,混匀离心,即为miscriptreverse-transcriptionmastermix。配好后混合并放置在冰上。④取6μlmiscriptreversetranscriptasemix加入步骤②得到的液体中,混匀离心。⑤于pcr仪(appliedbiosystems,pcrsystem9700)37℃孵育1h→95℃孵育5mins以灭活miscriptreversetranscriptasemix,反转录产物-20℃冰箱保存。3)pcr扩增cdna外泌体cdna的pcr过程借助qiagen公司mirnapcrarray试剂盒(cat.#218076),具体操作方法如下:①冰上融化cdna样本,加入无核酸酶去离子水1:9比例稀释。②以1板384孔板为例,配置反应液:取一个新的洁净无核酸酶的5ml塑料离心管,向其中加入1950μl2xquantitectsybrgreenpcrmastermix、390μl10xmiscriptuniversalprimer及390μl10xmiscriptprimerassay,混匀离心,取7μl/孔加入384孔板中。其中10×miscriptprimerassay中所含有的引物为引物hsa-mir-92b-3p、hsa-let7g-5p或hsa-mir-30e-5p。10×miscriptuniversalprimer为qiagen公司设计并合成的通用下游引物,该引物包含在qiagen公司的miscriptsybrgreenpcrkit试剂盒中。hsa-mir-92b-3p:5'tattgcactcgtcccggc3’(seqidno.3)hsa-let7g-5p:5'tgaggtagtagtttgtac3’(seqidno.4)hsa-mir-30e-5p:5'tgtaaacatccttgactg3’(seqidno.5)③依次加入稀释后的cdna样本3μl,每个cdna样本重复3个孔。④加样结束后,将384孔板放置于labnetc1000离心机25℃1000xg离心1min。⑤安装至罗氏480pcr仪中运行pcr程序,具体程序设置如下:表2⑥pcr结束后保存数据,导出,分析。结果如下:应用qrt-pcr检测50对早期胃癌患者及正常对照血清exo-mir-92b-3p(seqidno.1)、exo-let7g-5p(seqidno.2)相对表达水平,结果见图3-图5。在相对定量分析中,qrt-pcr的结果以δct值显示:δct=ct(mirna)-ct(hsa-mir-30e-5p)其中,δct值为每个反应管内荧光信号达到设定的阈值时所需要的循环数的差值,δct值越大,表达量越低。应用u检验比较各指标在早期胃癌及正常对照组间的表达差异。结果显示,早期gc组血清exo-mir-92b-3p的δct值[1.380(0.234,2.315)]显著低于正常对照组[2.480(1.722,3.122),u=714,p=0.0002];早期gc组血清exo-let7g-5p的δct值[4.101(2.348,5.365)]显著低于正常对照组[5.617(4.835,6.327),u=611,p<0.0001];早期gc组血清cea表达水平[1.915(1.083,2.538)]与正常对照组无统计学差异[1.780(1.150,2.445),u=1200,p=0.7329]。结果提示:血清cea指标在早期胃癌及正常人中并无显著差异,并不适宜作为胃癌早期诊断的标志物,而血清exo-mir-92b-3p及exo-let7g-5p较血清cea能够更好的区分早期胃癌患者及正常人,能够作为gc早诊标志物。为了确定血清exo-mir-92b-3p、exo-let7g-5p及常规肿瘤标志物cea对早期gc的诊断能力,用检测的血清exo-mir-92b-3p、exo-let7g-5p及血清cea数据绘制roc曲线来评估其辅助诊断的价值,如图6-图8所示。结果显示,血清exo-mir-92b-3p的auc值为0.714(p=0.0002,95%ci:0.613~0.815);其敏感性及特异性分别为:80%、58%;血清exo-let7g-5p的auc值为0.756(p<0.0001,95%ci:0.659~0.892),其敏感性及特异性分别为:88%、54%;血清cea的auc值为0.520(95%ci:0.569~0.779),其敏感性及特异性分别为:70%、42%,但无统计学意义(p=0.7329);结果表明对早期gc的诊断,血清exo-mir-92b-3p、exo-let7g-5p较血清cea具有更高的诊断效率,且诊断具有统计意义。血清exo-mir-92b-3p、exo-let7g-5p及cea组合的roc曲线如图9-图12所示。血清exo-mir-92b-3p联合exo-let7g-5p、血清exo-mir-92b-3p联合血清cea、血清exo-let7g-5p联合血清cea、血清exo-mir-92b-3p联合exo-let7g-5p联合血清cea均可提高早期gc的诊断效能,auc值分别为:0.777、0.722、0.760、0.784,且均具有统计学意义(p<0.05);其中血清exo-mir-92b-3p及exo-let7g-5p联合后敏感性及特异性分别提高至82%及60%。结果提示:不仅血清exo-mir-92b-3p及exo-let7g-5p的联合能够提高各自的诊断效能,血清exo-mir-92b-3p、exo-let7g-5p分别及组合与血清cea联合后均能够使cea的诊断效能提高,且具有统计学意义,血清exo-mir-92b-3p及exo-let7g-5p不仅能够作为gc的早诊独立标志物,也可作为常规血清标志物cea的辅助诊断标志物。应用u检验进一步对血清exo-mir-92b-3p、exo-let7g-5p与早期gc临床病理特征进行分析,结果如图13-图18所示。结果显示,血清exo-mir-92b-3p表达水平与早期胃癌的神经浸润具有相关性,存在神经浸润的患者的血清exo-mir-92b-3p的δct值[4.830(2.994,5.923)]显著高于未发生神经浸润者[3.164(1.880,4.774),u=185,p=0.0234],即未发生神经浸润的早期胃癌患者的血清exo-mir-92b-3p的表达水平显著高于存在神经浸润者;血清exo-let7g-5p表达水平与早期胃癌的低黏附性相关,存在肿瘤低粘附性的早期胃癌患者的血清exo-let7g-5p的δct值[2.610(0.952,3.167)]显著高于无低黏附性的早期胃癌患者[1.273(0.047,1.873),u=116.5,p=0.0021],即无低黏附性的早期胃癌患者的血清exo-let7g-5p的表达水平显著高于存在肿瘤低粘附性者;而血清exo-mir-92b-3p表达水平与早期胃癌的低黏附性及分化程度无相关性(p>0.05),血清exo-let7g-5p表达水平与神经浸润及分化程度均无相关性(p>0.05)。实施例3:早期胃癌血清exo-mir-92b-3p及exo-let7g-5p检测鉴定试剂盒的制备和使用1、试剂盒本实施例所提供的试剂盒,由引物、真空采血管-分离胶/促凝剂管和真空采血针组件、外泌体分离试剂、外泌体mirna提取试剂、反转录试剂和实时荧光定量pcr试剂组成。用于扩增hsa-mir-92b-3p(seqidno.1)、hsa-let7g-5p(seqidno.2)、hsa-mir-30e-5p(seqidno.6,内参)的实时定量pcr的上游引物由qiagen公司合成。引物如下表3:表3引物序列(5'-3’)seqidno.hsa-mir-92b-3ptattgcactcgtcccggc3hsa-let7g-5ptgaggtagtagtttgtac4hsa-mir-30e-5ptgtaaacatccttgactg5下游引物为qiagen公司设计并合成的通用下游引物,该引物包含在qiagen公司的miscriptsybrgreenpcrkit试剂盒中。外泌体分离试剂来自sbi公司exoquicktmexosomeprecipitationsolution试剂盒(cat.#exoq20a-1)。外泌体mirna提取试剂来自qiagen公司mirneasymicrokit试剂盒(cat.#217084)。rna逆转录试剂来自qiagen公司的miscriptiirtkit试剂盒(cat.#218161)。实时荧光定量pcr试剂来自qiagen公司的miscriptsybrgreenpcrkit试剂盒(cat.#218076)。2、使用本实施例所提供试剂盒进行血清学检测结果的验证:对患者使用血清血检测胃癌血清肿瘤标志物cea、ca199和ca724的任一结果为阳性或者检测结果为全阴性后,使用本试剂盒进一步进行检测,判断血清学检测的结果。试剂盒操作方法如下:1)血清exosome分离及其rna提取①在真空采血管-分离胶/促凝剂管中收集3ml新鲜外周血液,在4℃静置30min,再于thermost16r冷冻离心机4℃3000×g离心30min,收集血清。②取260μl血清,于thermost16r冷冻离心机4℃3000×g离心30min。吸取上层250μl血清,加入25μltromboplatind,混匀,37℃水浴锅孵育15min,thermost16r冷冻离心机25℃10000×g离心5min,吸取上清液至洁净的1.5ml塑料离心管中。向离心管中加入75μlexoquick试剂,混匀,并置于4℃冰箱中过夜。过夜处理的样品于thermost16r冷冻离心机4℃1500×g离心30min离心,吸弃上清液,再次thermost16r冷冻离心机4℃1500×g离心5min离心,吸弃上清液,ep管下方黄色的沉淀即为血清exosomes。加入1×pbs50μl将黄色沉淀混悬成为均匀的淡黄色混合液。③向样品中加入700μlqiazol,沉淀重悬裂解,室温静置5mins后加入140μl氯仿(上海沪试化工),盖紧离心管盖,剧烈震荡15秒,室温静置3mins。④thermost16r冷冻离心机4℃12,000×g离心15mins。⑤小心分离350μl离心管中上层水相,转移至新的洁净1.5ml塑料离心管离心管中。加入525μl100%乙醇溶液,轻柔混合均匀。⑥抽取⑤得到的混合液700μl加入rneasyminelutespincolumn(简称柱子)中,termomicro21r冷冻离心机22℃500×g离心30s→22℃800×g离心30s,弃流出液→termomicro21r冷冻离心机22℃500×g离心30s→22℃800×g离心30s,弃流出液。⑦在柱子中加入700μlbufferrwt,termomicro21r冷冻离心机22℃8000×g离心15s,弃流出液。⑧在柱子中加入500μlbufferrpe,termomicro21r冷冻离心机22℃8000×g离心15s,弃流出液。⑨在柱子中加入500μl80%乙醇溶液,盖好盖子,termomicro21r冷冻离心机22℃8000×g离心15s,弃流出液。再termomicro21r冷冻离心机22℃21000×g离心2mins。⑩将柱子放入试剂盒提供的新的洁净1.5ml塑料离心管离心管中,并置于超净台中干燥。在柱子中心加入14μl无核酸酶去离子水(即试剂盒提供的rnasefreewater),盖好盖子,室温静置5min,termomicro21r冷冻离心机22℃2000×g离心30s→21000×g、22℃离心2min,流出液即为exosomesrna,分装少量rna用于检测rna浓度,剩余放置于冰上。2)外泌体rna逆转录成cdna①在每个pcr管中加入4ngrna,并加入无核酸酶去离子水(即试剂盒提供的rnasefreewater)至总体积为9μl。②在冰上配制reverse-transcriptionmastermix,取一个新的洁净1.5ml塑料离心管离心管,加入330μl5xmiscripthispecbuffer、165μl10xmiscriptnucleicsmix及165μlmiscriptreversetranscriptasemix,混匀离心,即为miscriptreverse-transcriptionmastermix。配好后混合并放置在冰上。③取6μlmiscriptreversetranscriptasemix加入步骤①得到的液体中,混匀离心。④于pcr仪(appliedbiosystems,pcrsystem9700)37℃孵育1h→95℃孵育5mins以灭活miscriptreversetranscriptasemix,分装部分反转录产物放置于冰上,剩余产物-20℃冰箱保存可用于复检。3)pcr扩增cdna①以每个样本的pcr管为例,在洁净的pcr管中加入5μl2xquantitectsybrgreenpcrmastermix、1μl10×miscriptuniversalprimer、1μl10×miscriptprimerassay、1μlcdna样本及2μl无核酸酶去离子水(即试剂盒提供的rnasefreewater),每个primerassay样本重复3个孔。其中10×miscriptprimerassay中含有引物hsa-mir-92b-3p、hsa-let7g-5p或hsa-mir-30e-5p。10×miscriptuniversalprimer为qiagen公司设计并合成的通用下游引物,该引物包含在qiagen公司的miscriptsybrgreenpcrkit试剂盒中。hsa-mir-92b-3p:5'tattgcactcgtcccggc3’(seqidno.3)hsa-let7g-5p:5'tgaggtagtagtttgtac3’(seqidno.4)hsa-mir-30e-5p:5'tgtaaacatccttgactg3’(seqidno.5)②将384孔板放置于labnetc1000离心机上25℃1000xg离心1min。③安装至罗氏480pcr仪中运行pcr程序,具体程序设置方法如下:表4④pcr结束后保存数据,导出,分析。4)荧光定量检测结果分析以hsa-mir-30e-5p的表达量为参照,计算mirna表达量时,mirna的相对定量以δct值显示,δct=ct(mirna)-ct(hsa-mir-30e-5p)。胃癌血清exo-mir-92b-3p及exo-let7g-5p检测鉴定试剂盒的检测方法,所述方法为:(1)血清学检测:提取待测血液,利用血清学肿瘤标志物检测(cea、ca199及ca724);(2)试剂盒检测:利用外泌体分离试剂提取待测血液中的外泌体、外泌体mirna提取试剂和反转录试剂制备待测血液外泌体cdna作为实时荧光定量pcr模板,加入引物和实时荧光定量pcr试剂进行反应,95℃15mins→94℃15s,55℃30s,70℃30s,40个循环→4℃∞,获得mirnas的表达量,与自身血清外泌体中mir-30e-5p的表达量相比;(3)结果判断:①当待测血液血清学检测为阳性时,若试剂盒检测患者血清外泌体内的hsa-mir-92b-3p或hsa-let7g-5p表达量上调,除去hsa-mir-30e-5p内参引物后,hsa-mir-92b-3p的相对表达量δct<1.690或hsa-let7g-5p的相对表达量δct<4.184,或两者均满足,则判断血清学检测阳性为正确;②当待测血液血清学检测阴性时,若试剂盒检测hsa-mir-92b-3p和hsa-let7g-5p表达量下调,hsa-mir-92b-3p的相对表达量δct≥1.690且hsa-let7g-5p的相对表达量δct≥4.184,则判断血清学检测阴性为正确;若试剂盒检测hsa-mir-92b-3p且hsa-let7g-5p表达量上调,除去hsa-mir-30e-5p内参引物后hsa-mir-92b-3p的相对表达量δct<1.690且hsa-let7g-5p的相对表达量δct<4.184,则判断血清学检测阴性为假阴性;若出现其他结果,认为血清学判断一致,无需对检测结果进一步判断。3、使用本实施例所提供试剂盒进行早期胃癌诊断:(1)样本的选择:在本实验中,共纳入未经任何治疗的50个早期胃癌患者。肿瘤患者的入选和排除标准包括:1)首诊患者;2)采血时患者既往未使用任何针对胃癌的治疗性药物,也未经受任何辐射性检查及治疗;3)无既往或伴随其他消化道肿瘤病史;4)患者术前曾行胃镜下活检检查;5)经术后病理证实为早期胃癌;6)患者临床病理资料完整;7)无其他急性疾病或者系统性疾病病史。(2)血清exosome分离及其rna提取采用真空采血针组件采集患者外周血液,在真空采血管-分离胶/促凝剂管中收集新鲜外周血液,并收集血清。采用外泌体分离试剂盒分离血清exosomes,再用外泌体mirna提取试剂盒提取exosomes中的小rna。具体操作方法同上。(3)外泌体rna逆转录成cdna采用反转录试剂盒将外泌体rna逆转录成cdna。具体操作方法同上。(4)pcr扩增cdna以逆转录成的cdna为模板,采用实时荧光定量pcr试剂进行pcr扩增。分为3个实验组,实验组1采用引物hsa-mir-92b-3p及内参引物hsa-mir-30e-5p扩增,实验组2采用引物hsa-let7g-5p及内参引物hsa-mir-30e-5p扩增,实验组3采用引物hsa-mir-92b-3p和hsa-let7g-5p联合及内参引物hsa-mir-30e-5p扩增。具体操作方法同上。实际操作中我们发现如果进行绝对定量pcr会有以下问题:1.操作步骤会更加繁琐,导致结果的准确度会相应降低;2.绝对定量时需应用的agilentsmallrnakit试剂盒(cat.#5067-1548)检测外泌体rna含量后再进行接下来的逆转录及pcr步骤,而agilentsmallrnakit试剂盒具有费用高、储存期短,且操作难度高的缺点。鉴于以上问题,我们改进了操作,将绝对定量pcr改为相对定量pcr检验exo-mir-92b-3p、exo-let7g-5p的表达水平。内参exo-mir30e-5p用于相对定量。(5)结果判定:荧光定量检测结果分析:以hsa-mir-30e-5p的表达量为参照,计算mirna表达量时,mirna的相对定量以δct值显示,δct=ct(mirna)-ct(hsa-mir-30e-5p),其中在实验组1中,将hsa-mir-92b-3p的相对表达量δct<1.690判定为表达阳性,反之为表达阴性;表达阳性者诊断为胃癌。实验组2中,将hsa-let7g-5p的相对表达量δct<4.184判定为表达阳性,反之为表达阴性;表达阳性者诊断为胃癌。实验组3中,将hsa-mir-92b-3p的相对表达量δct<1.690、hsa-let7g-5p的相对表达量δct<4.184判定为表达阳性,反之为阴性;当hsa-mir-92b-3p及hsa-let7g-5p任一指标表达阳性时,诊断为早期胃癌。血清肿瘤标志物cea、ca19-9和ca724检测结果分析:以cea>5ng/ml、ca199>37u/ml、ca724>6.9u/ml判定为表达阳性,反之为表达阴性;任意血清肿瘤标志物为表达阳性时,诊断为早期胃癌。(6)以术后病理检查为标准,对比血清学检测、外泌体mirnas检测及胃镜检测等检测方法的准确性。结果:具体结果如图19。血清肿瘤标志物cea、ca199及ca724在早期胃癌中的诊断阳性率分别为10%、0%及14%;早期胃癌患者血清exo-mir-92b-3p的诊断阳性率为42%;早期胃癌患者血清exo-let7g-5p诊断阳性率为46%;早期胃癌患者血清exo-mir-92b-3p及exo-let7g-5p联合诊断后阳性率为60%;传统有创性胃镜检查在早期胃癌中的诊断阳性率为88%。结果说明:经检测,传统有创性胃镜检查在早期胃癌中的诊断阳性率可达88%,尽管胃镜检查有着较高的阳性诊断率,但其创伤性大、花费高等特点限制了广泛临床应用价值。而作为传统的非侵入性标志物检查方式--cea、ca199及ca724,其在早期胃癌中的诊断阳性率仅分别为10%、0%及14%,这些指标对早期胃癌的临床诊断价值非常有限。血清exo-mir-92b-3p及exo-let7g-5p作为本发明发现的一种新的、简便易行的、高敏感及高特异性的非侵入性标志物,显示出了具有较传统血液肿瘤标志物更好的诊断优势,其中早期胃癌患者血清exo-mir-92b-3p的诊断阳性率为42%;早期胃癌患者血清exo-let7g-5p诊断阳性率为46%;显著优于传统血清标志物检查。同时,早期胃癌患者血清exo-mir-92b-3p及exo-let7g-5p联合诊断后阳性率可达60%,较血清exo-mir-92b-3p、exo-let7g-5p单独检测明显提高。序列表<110>哈尔滨医科大学<120>用于早期胃癌诊断的分子标志物及其应用<130>klpi180879<160>6<170>patentinversion3.3<210>1<211>22<212>rna<213>hsa-mir-92b-3p<400>1uauugcacucgucccggccucc22<210>2<211>22<212>rna<213>hsa-let7g-5p<400>2ugagguaguaguuuguacaguu22<210>3<211>18<212>dna<213>artificialsequence<400>3tattgcactcgtcccggc18<210>4<211>18<212>dna<213>artificialsequence<400>4tgaggtagtagtttgtac18<210>5<211>18<212>dna<213>artificialsequence<400>5tgtaaacatccttgactg18<210>6<211>22<212>rna<213>hsa-mir-30e-5p<400>6uguaaacauccuugacuggaag22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1