一种钌配合物荧光探针、制备方法和用途与流程
本发明属于生物检测领域,具体是涉及到一种钌配合物荧光探针、制备方法和用途。
背景技术:
g-四链体dna结构是一种非传统的核酸结构,是由富含鸟嘌呤碱基(guanine)的单链dna在一价阳离子(如k+和na+)的稳定下通过g碱基间hoogsteen氢键作用形成g-平面并进一步堆积形成的四链体螺旋结构。g-四链体通常位于基因组许多重要的生物学功能区域,如一些重要的原癌基因的启动子区。g-四链体在调控这些基因的转录、复制和重组以及调节端粒的稳定性方面具有重要作用。因此g-四链体结构被认为是起到分子开关的功能,其形成和拆散可能涉及到信号传导、细胞凋亡和细胞增殖等一系列体内重要的生理过程。所以,在体内或者体外试验中,能够特异性地检测出g-四链体结构的存在或者形成,为进一步了解g-四链体结构在人类细胞基因组中的分布、功能和机制奠定基础,也可能为靶向g-四链体的肿瘤治疗方法提供新的思路。因此,开发设计快速、简单、具有高选择性的g-四链体识别探针已显得特别重要。
dnag-四链体识别探针研究进展,张素格,孙红霞,唐亚林,化学通报2016年第79卷第5期,387页,描述了常见的dnag-四链体识别探针的种类及设计原理,其中一种为利生物大分子主体-有机小分子配体相互作用的策略,筛选或合成能特异性结合g-四链体的有机荧光小分子配体,当小分子独立存在时和小分子配体结合于g-四链体上时,产生较大的荧光增强或猝灭的信号差异,从而使g-四链体结构被检测到。这些荧光探针具有平面芳环共轭结构,使其能够与g-四链体通过末端π-π堆积的方式进行特异性识别;较高的荧光量子产率。其列举了一些荧光探针,但是这些探针的选择性都不是非常理想。
钌配合物一般作为稳定g-四链体dna的物质,近年来有文献报道其可以作为g-四链体dna的分子光开关,比如中国专利申请号为201010533717.4,其公开了一种钌配合物,但是其没有选择性,与其它二级结构dna也会导致荧光信号的增强。
一般来讲,分子关开关有作为荧光探针的潜力,但不一定能成为荧光探针,因为要具有识别选择性。作为荧光探针,需要两方面,首先要具有光开关性能,(关-开或开-关),而最重要的要具有识别选择性。
钌配合物与g-四链体dna的相互作用研究进展,赵晓珑等,化学通报2015年第78卷第10期,报道了多种钌配合物可以稳定g-四链体dna,其同时报道了多种可以作为分子光开关的钌配合物,但是其同时也指出,钌配合物与g-四链体dna作用的选择性和特异性还有待提高,钌配合物作为体内g-四链体dna结构探针,尚未开发设计出以g-四链体dna为靶点的钌类抗肿瘤药物,其化合物23,24,25对g-四链体dna表现了一定的选择性。这些配合物尽管表现了光开关效应,但是对g-四链体dna识别来说,选择性差,且它们具有强的荧光背景,不利于裸眼检测。
技术实现要素:
本发明要解决的技术问题是提供一种钌配合物荧光探针、制备方法和用途,其可以选择性的检测g-四链体dna。
本发明的钌配合物荧光探针,以2-(3-甲基,4-硝基)苯基-咪唑并[1,10]-邻菲咯啉为主配体,以2,2’-联吡啶或者1,10-邻菲咯啉为辅助配体,具有如下结构,
本发明提供一种钌配合物荧光探针的制备方法,包括如下步骤,
将化合物1、3-甲基-4-硝基苯甲醛和乙酸铵溶于有机溶剂中,有机溶剂优选为无水乙酸,在保护气下回流,冷却,调节ph值,加入高氯酸钠或六氟磷酸钾,过滤,洗涤,干燥,分离纯化得到钌配合物荧光探针,所述化合物1为[ru(bpy)2phendione]2+或者[ru(phen)2phendione]2+。所述化合物1、3-甲基-4-硝基苯甲醛和乙酸铵的摩尔比优选为1:1:25。
所述化合物1的制备方法为,将化合物2和邻菲咯啉5,6-二酮溶于有机溶剂中,有机溶剂优选为乙醇水溶液,在保护气下回流,冷却,加入高氯酸钠或六氟磷酸钾,过滤,洗涤,干燥,分离纯化,所述化合物2为cis-[ru(bpy)2cl2]或者cis-[ru(phen)2cl2]。
所述化合物2的制备方法为,将三氯化钌、氯化锂和化合物3溶于有机溶剂中,有机溶剂优选为n,n-二甲基甲酰胺,回流,冷却后加入丙酮,-4℃以下保温,过滤,所述化合物3为2,2’-联吡啶或者1,10-邻菲咯啉。
本发明的上述制备方法简单易行,不需合成主配体,较前之由主配体合成后,然后再合成配合物的方法,本发明简单易行,产率高,生产成本大大降低。
本发明还提供一种钌配合物荧光探针在选择性识别g-四链体dna中的用途。
本发明以2-(3-甲基,4-硝基)苯基-咪唑并[1,10]-邻菲咯啉为主配体,以2,2’-联吡啶为辅助配体,所述的配合物的化学式为[ru(bpy)2mnpip]2+。以2-(3-甲基,4-硝基)苯基-咪唑并[1,10]-邻菲咯啉为主配体,以邻菲咯啉为辅助配体,所述的配合物的化学式为[ru(phen)2mnpip]2+。
本发明的有益效果是,由于g-四链体并非单独存在,而是嵌在基因组dna的双螺旋二级结构之间,因此优良的g-四链体dna荧光探针应仅能识别g-四链体结构而不响应双螺旋结构。相比有机小分子探针,金属钌配合物具有大的斯托克斯位移(stokesshifts),可使用可见光激发,长的激发寿命等优良的光物理性质、低细胞毒性、易合成、好的水溶性等优点,而常被用作荧光探针松检测生理小分子。然而,由于细胞内大量双螺旋dna的存在以及复杂的细胞内环境,钌配合物在g-四链体dna识别及检测中通常表现了差的选择性,本发明设计一种新的结构(其于硝基保护策略实现对g-四链体dna的选择性识别),避免了上述缺陷,选择性好。
本发明的主配体的设计基于硝基的存在,由于硝基作为吸电子基团,会有效地降低配合物荧光,因而,在钌配合物探针设计中一般不会引入硝基。但钌配合物中硝基易受溶剂化效应影响,配合物在水溶液中没有或表现弱的荧光,在有机溶剂中或硝基受保护则有荧光。为了增强配合物荧光,我们引入了甲基给电子基。因此,本探针设计思路首先基于硝基取代钌配合物在水溶液中易受水分子进攻,表现弱的荧光,当硝基被保护不受水分子进攻(如在有机溶剂中)可发出荧光,使配合物具有“关-开”的光开关可能性;另一方面是基于g-四链体dna与双链及单链dna结构的差异,g-四链体dna具有四碱基平面可有效保护配合物上硝基免受水分子的进攻,表现强的荧光;而双链和单链dna与配合物结合时不能保护硝基,表现弱的荧光,从而体现选择性,为了使硝基的保护程度差异增大,硝基应位于苯基的4位(对位)。迄今为止,还没文献报道采用硝基取代钌配合物用于g-四链体dna的选择性识别及检测。
对本配合物而言,配合物应只对g-四链体dna有响应,对其它双链dna和单链dna没有响应或响应弱。
配合物合成步骤简单,产率高,无污染。合成的硝基取代钌配合物由于硝基的存在,硝基基团的溶剂化效应对硝基取代钌配合物荧光影响显著,水存在时荧光弱,无水或与g-四链体dna作用时荧光增强,这一特点结合g-四链体dna大的碱基平面特性可设计基于硝基溶剂化的钌配合物g-四链体dna选择性荧光探针。
本发明首次发现通过g-四链体dna与硝基取代钌配合物结合,其四碱基平面可有效保护配合物上硝基免受水分子的进攻,达到配合物的恢复,而与其它单链和双链dna结合时,其小的碱基平面不能有效保护硝基,水分子导致配合物荧光的降低,从而实现对g-四链体dna的选择性检测。
本发明的探针具有较弱的荧光背景,对g-四链体dna识别表现了优良的选择性,可用于裸眼检测。同时本发明的物质结构更简单,合成步骤简单,产率较高,易于合成,且起始反应物廉价易得,生产周期短,生产成本低。
附图说明
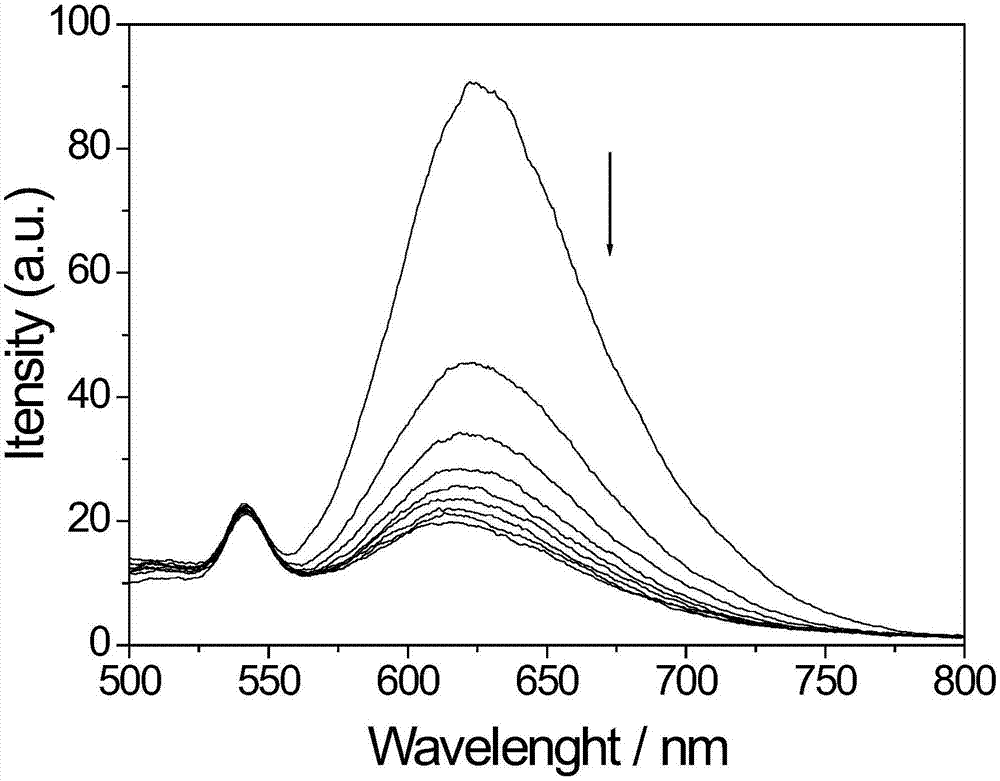
图1为荧光探针(10μm)在10mmtris-kcl缓冲溶液(ph=7.0)中与亚铁氰化钾作用的荧光光谱图谱。
图2为荧光探针(10μm)在10mmtris-kcl缓冲溶液及8mm亚铁氰化钾存在下(ph=7.0)中与22agdna作用的荧光光谱图谱。
图3为荧光探针(10μm)在10mmtris-kcl缓冲溶液及及8mm亚铁氰化钾存在下(ph=7.0)中与ht-dna作用的荧光光谱图谱。
图4为荧光探针(10μm)在10mmtris-kcl缓冲溶液(ph=7.0)中及8mm亚铁氰化钾存在下与小牛胸腺dna作用的荧光光谱图谱。
图5为本荧光探针(10μm)在10mmhepes缓冲溶液中及8mm亚铁氰化钾存在下分别与不同二级结构dna作用的荧光强度柱状图。
图6为本荧光探针(10μm)在10mmhepes缓冲溶液中紫外光照(365nm)下的荧光图片(从左到右依次为:探针空白,ct-dna,dsdna,a13,t13,22ag,ht-dna,c-ymc)。
图7为[ru(bpy)2pip]2+与ct-dna(a)的荧光光谱图。
图8为[ru(bpy)2pip]2+与22ag(b)的荧光光谱图。
具体实施方式
实施例1
本发明包括如下步骤:
(1)cis-[ru(bpy)2cl2].2h2o
按1:1:2的摩尔比称取rucl3·3h2o、一水合氯化锂和辅助配体2,2’-联吡啶,加入dmf溶解得到溶液,140℃回流加热得到固液混合物,冷却至室温后加入丙酮,-4℃下保存15~30h,抽滤得到紫黑晶体,待用;
(2)邻菲咯啉5,6-二酮
邻菲咯啉4g与溴化钾4g,磁力搅拌下加入冰冷的浓硫酸40ml与浓硝酸20ml的混合溶液,20分钟内加完混酸,保持在80-85℃,回流3h。反应完毕后,让溴逸去,向完全冷却橙黄色反应物中加入冰,用naoh中和至ph小于7,中和后混合物直接用氯仿萃取,所得萃取液用无水硫酸钠干燥过液,蒸去氯仿,得黄色针状晶体3.39g。
(3)[ru(bpy)2phendione]2+
将步骤(1)所得产品与将步骤(2)所得产品溶于乙醇:水(体积比为2:1)中,保护气(保护气为惰性气体,包括氩气、氮气、氦气)下120℃回流2-3h,得深红色澄清溶液,冷却至室温,加40ml水,加入适量的高氯酸钠或六氟磷酸钾,产生沉淀,抽滤,用水跟乙醚洗涤,真空干燥得粗产品,待用。
(4)[ru(bpy)2mnpip]2+
将步骤(3)所得产品、3-甲基-4-硝基苯甲醛及乙酸铵按摩尔比1:1:25溶于冰乙酸中,保护气下120℃回流2-3h,得深红色澄清溶液,冷却至室温,倒入冰中,浓氨水中和到ph约为中性,加入适量的高氯酸钠或六氟磷酸钾,产生沉淀,抽滤,用水跟乙醚洗涤,真空干燥得粗产品。中性氧化铝柱层析分离得纯产品,洗脱剂为乙腈和甲苯,乙腈和甲苯的比例为乙腈:甲苯=4:1。
本发明的合成步骤简单易行,不需合成主配体。较前之由主配体合成再合成配合物,主法简单易行,降低生产成本。
对所得配合物进行了氢谱(1hnmr)和电喷雾质谱(es-ms)表征,结果如下:
[ru(bpy)2mnpip](pf6)2:1hnmr[(cd3)2so]:9.03(d,2h),8.86(dd,4h),8.45(s,1h),8.40(d,1h),8.20(td,3h),8.10(t,2h),7.89(m,4h),7.81(t,2h),7.60(td,4h),7.36(t,2h),2.68(s,3h).
esi-ms(ch3cn):m/z=384.5([m-2pf6]2+)。
实施例2
采用与实施例1类似的制备方法,具体包括以下几个步骤:
(1)cis-[ru(phen)2cl2].2h2o
按1:1:2的摩尔比称取rucl3·3h2o、一水合氯化锂和辅助配体邻菲咯啉,加入dmf溶解得到溶液,140℃回流加热得到固液混合物,冷却至室温后加入丙酮,-4℃下保存15~30h,抽滤得到紫黑晶体,待用;
(2)邻菲咯啉5,6-二酮
邻菲咯啉4g与溴化钾4g,磁力搅拌下加入冰冷的浓硫酸40ml与浓硝酸20ml的混合溶液,20分钟内加完混酸,保持在80-85℃,回流3h。反应完毕后,让溴逸去,向完全冷却橙黄色反应物中加入冰,用naoh中和至ph小于7,中和后混合物直接用氯仿萃取,所得萃取液用无水硫酸钠干燥过液,蒸去氯仿,得黄色针状晶体3.39g。
(3)[ru(phen)2phendione]2+
将步骤(1)所得产品与将步骤(2)所得产品溶于乙醇:水(体积比为2:1)中,保护气(保护气为惰性气体,包括氩气、氮气、氦气)下120℃回流2-3h,得深红色澄清溶液,冷却至室温,加40ml水,加入适量的高氯酸钠或六氟磷酸钾,产生沉淀,抽滤,用水跟乙醚洗涤,真空干燥得粗产品,待用。
(4)[ru(phen)2mnpip]2+
将步骤(3)所得产品、3-甲基-4-硝基苯甲醛及乙酸铵按摩尔比1:1:25溶于冰乙酸中,保护气下120℃回流2-3h,得深红色澄清溶液,冷却至室温,倒入冰中,浓氨水中和到ph约为中性,加入适量的高氯酸钠或六氟磷酸钾,产生沉淀,抽滤,用水跟乙醚洗涤,真空干燥得粗产品。中性氧化铝柱层析分离得纯产品,洗脱剂为乙腈和甲苯,乙腈和甲苯的比例为乙腈:甲苯=4:1。
对所得配合物进行了氢谱(1hnmr)和电喷雾质谱(es-ms)表征,结果如下:
[ru(phen)2mnpip](pf6)2:1hnmr[(cd3)2so]:1hnmr(dmso-d6):8.96(d,2h),8.79(d,4h),8.41(s,4h),8.32(s,1h),8.30(d,1h),8.20(d,2h),8.15(d,3h),7.98(d,2h),7.81(m,4h),7.73(t,2h),2.60(s,3h).esi-ms(ch3cn):m/z=408.4([m-2pf6]2+)。
实施例3
探针分子的应用
1.tris-hcl缓冲液:
缓冲液a:10mmtris,100mmkcl,ph=7.0;
一般配制方法:准确称取0.303gtris盐,1.865gkcll,用60ml灭菌三重蒸馏水完全溶解,用稀盐酸缓慢调节ph值至7.0,转入250ml容量瓶,用三重蒸馏水定容,混合均匀后备用。
2.配合物溶液的配制:
准确称取2~3mg配合物(视配合物分子量而定,本文所配制的钌配合物预期浓度为200μm,体积为10ml,配制容器为10ml容量瓶,所以需要称量的理论值是:分子量/1000*2mg),先用50-100μldmso溶解,再用纯水定容至10ml,即得200μm的配合物储备液。
3.本实验所用双链dna有两种,一为小牛胸腺dna(ct-dna,cas号为91080-16-9)及另一种为dsdna(seqidno.1):5’-(gaattgtgagcgctcacaattc)-3’。
4.本实验所用单链dna序列分别为:
t13:5’-ttttttttttttt(seqidno.2)
a13:5’-aaaaaaaaaaaaa-3’(seqidno.3)
5.本实验所用g-四链体dna序列分别为:
htdna:5’-ttagggttagggttagggttagggtta-3’(seqidno.4)
c-myc:5’-tgagggtgggtagggtgggtaa-3’(seqidno.5)
22ag:5’-agggttagggttagggttaggg-3’(seqidno.6)
6.dna溶液的配制及浓度的测定:
(1)单链dna及g-四链体dna配制方法:取约10od的dna,用对应体积的缓冲液溶解,密封后用水浴加热到90℃并保持5分钟,缓慢冷却至室温后放入4℃冰箱中冷藏24小时以上,备用。
(2)小牛胸腺dna配制方法:称取10mgdna溶于适量缓冲液中,紫外光谱法测定其浓度。
7.荧光光谱测试:取50μl的配合物储备液(200μm),1000μl缓冲液tris-kclph7.0至10mm×10mm石英比色皿中,震荡混匀,置于荧光光谱仪样品池。扫描记录曲线。之后分别向样品池中加40ul的200mm亚铁氰化钾和dna溶液(10mmtris盐缓冲液),加完混匀,扫描记录所得曲线。重复操作至荧光不再变化,说明滴定达到饱和。保存数据,origin作图,结果如图1-5所示。
如图1-5,为了降低背景荧光,通过加入亚铁氰化钾,配合物荧光被淬灭(图1)。而探针与不同二级结构dna的荧光滴定实验结果显示,加入三种不同g-四链体dna的荧光增强幅度明显大于双链dna和单链dna的荧光增强幅度(图2,3,4,5)。其中以htdna增强幅度最大,达到9.63倍。其余两种g-四链体22ag和c-myc荧光强度分别增强6.94和5.16倍。而双链核酸ct-dna和dsdna与配合物作用后荧光几乎没有变化,仅为起始荧光的1.32倍和1.40倍,单链核酸t13和a13仅为起始荧光的1.01倍和1.03倍。上述结果说明探针只对g-四链体dna结构表现了荧光信号的“关-开”性能,同时表现了良好的g-四链体dna识别选择性,对其它二级结构dna没有明显的荧光信号变化,可用于g-四链体dna的检测。8.裸眼检测:取50μl的配合物储备液(200μm),1000μl缓冲液tris-kclph7.0至10mm×10mm石英比色皿中,震荡混匀。之后分别向样品池中加入不同结构dna溶液(10mmtris盐缓冲液),加完混匀。在365nm紫外光照下,拍摄照片。结果如图6所示,左到右依次为:探针空白、ct-dna、dsdna、a13、t13、22ag、ht-dna、c-ymc,探针空白(1)的颜色为无色,ct-dna(2)、dsdna(3)、a13(4)、t13(5)的颜色为近乎无色,22ag(6)、ht-dna(7)、c-ymc(8)为红褐色,直接裸眼就可观测到。
对比例1
中国专利申请号为201010533717.4,其公开了一种钌配合物,结构为:
文献报道,该配合物与g-四链体dna(22ag)结合后,其荧光增强2.46倍,与双链dna结合后荧光增强2.03倍,表现了对g-四链体dna差的选择性。而且,该配合物有较强背景荧光,不利于裸眼检测。而本发明中在水相中荧光较弱,与g-四链体dna结合荧光显著增强,而与其它结构dna荧光变化小,表现了优良的g-四链体dna选择性。
对比例2
为了说明本发明的苯基上的硝基和甲基的作用,本发明设计了如下对比例2,其结构如下所示。
以本探针母体[ru(bpy)2pip]2+和不同的dna做荧光实验,以得到对比实验结果,如图7-8所示。[ru(bpy)2pip]2+本身有强荧光,与双链dna(ct-dna)结合后,荧光增强约1.67倍;与g-四链体dna(22ag)结合后,荧光增强约1.72倍。这说明没有硝基基团的母体表现了差的g-四链体dna识别选择性,不能用于检测g-四链体dna。而且,该配合物有较强背景荧光,也不能用于裸眼检测。
- 还没有人留言评论。精彩留言会获得点赞!