检测小麦抗白粉病基因Pm2a的诊断性分子标记及其应用的制作方法
本发明涉及植物遗传学和小麦分子育种领域,具体为检测小麦抗白粉病基因pm2a的诊断性分子标记及其应用。
背景技术:
普通小麦(tritiumaestivuml.)是全球种植面积最大、食用人数最多的粮食作物,全世界约有35%~40%的人口将其作为主要食物来源,提供了全球消费热量的20%,以及每年约7000万吨的蛋白质。增加小麦籽粒产量有助于大幅度提高食用蛋白质的总量及能量供给,但小麦籽粒产量和蛋白质含量很容易受到外部环境条件的影响,尤其是由禾本科布氏革兰菌侵染引起的小麦白粉病,每年都会给小麦种植区造成严重的产量损失。
白粉病是一种由专性寄生真菌blumeriagraminisf.sp.tritici(bgt)引起的叶部病害,广泛发生于各个小麦种植区,特别是在大量使用氮肥和种植半矮秆小麦品种的国家盛行。中国受白粉病影响的小麦种植面积已达600~800万公顷,每年损失小麦30万吨。小麦白粉病的病原菌为禾本科布氏革兰菌小麦专化型,具有多个生理小种,在不同地理生态环境中与寄主互作过程中变异速度快,目前一些生产上大面积种植品种已逐渐丧失抗性,因此白粉病害处于随时大面积流行的严重态势。农药防治对防控白粉病起到了一定的作用,但是会耗费大量的人力和财力资源,不利于生态环境。种植抗病品种是控制病害最有效的方法。利用现代生物技术,通过分子标记辅助选择的分子育种技术已在小麦抗病品种选育与抗病基因利用中发挥越来越重要的作用。
迄今为止,国内外已发现100多个基因或数量性状位点(qtl)与白粉病的抗性相关,包括77个正式命名和30个临时命名的基因或qtls。但被克隆的只有极少数几个基因,包括pm3b,pm8,pm21,pm60和pm2a。小麦新品系ch1357来源于杂交组合“中8701//冀麦26/小偃7430”,其中中8701和冀麦26为普通小麦品种,小偃7430是源于十倍体长穗偃麦草(th.ponticum)的八倍体小偃麦(2n=8x=56)。利用在山东、河南、河北、陕西、山西、北京等地采集并分离的32个白粉病菌株接种ch1357和台长29,结果发现ch1357对其中27个菌株免疫,1个菌株近免疫,1个菌株高抗,其它3个菌株为感病,而台长29对32个菌株都表现为感病。表明ch1357对中国上述地区的白粉病菌株表现出了广谱抗性,对于改善这些地区小麦品种的白粉病抗性具有重要价值。使用图位克隆的方法对ch1357中的抗白粉病基因进行了克隆,最终结果表明,ch1357携带一个显性抗白粉病基因pm2a。在育种实践中,加快利用抗性较好的抗病基因pm2a,对于提高新育成小麦品种的白粉病抗性,延长抗病品种使用时间,减缓抗性“丧失”进程,提高抗病持久性具有重要意义。
技术实现要素:
本发明解决小麦育种中难以准确检测和有效利用抗白粉病基因pm2a的问题,提供一种用于准确鉴定待测小麦植株的基因组dna中是否含有抗白粉病基因pm2a的诊断性分子标记。
本发明是通过以下技术方案实现的:一种检测小麦抗白粉病基因pm2a的诊断性分子标记,所述分子标记是显性indel标记sxac-m,所述分子标记的核苷酸序列如下:
sxac-m-f:5'-ggtttgaatccaagagatgatgcatatttgat-3';
sxac-m-r:5'-taagtggtaatagctcaatctgagaacctt-3'。
一种小麦抗白粉病基因pm2a的鉴定方法,包括如下操作步骤:
(1)pcr反应体系配制:以待检测小麦植株的基因组dna为模板,以上述分子标记sxac-m为引物,进行pcr扩增;pcr反应体系为10μl,所述反应体系包含50-80ng/μl小麦基因组dna1.0μl,10×pcrbuffer1.0μl,10mmdntp0.1μl,10mmmgcl21.0μl,5utaq聚合酶0.1μl,2μm引物1.5μl,无菌去离子水5.3μl;
(2)pcr扩增程序为:95℃预变性5min;95℃变性30s,55℃复性30s,72℃延伸4min,共40个循环;72℃延伸10min;4℃保存备用;
(3)pcr扩增产物检测:在6%变性聚丙烯酰胺凝胶(acrylamide/bisacrylamide=19/1)上进行电泳,将上述pcr产物和5μl上样缓冲液混合后,取4μl混合物点样,300v恒压下电泳2.5-3h,硝酸银染色后拍照;
(4)分析鉴定,如果能扩增出219bp的特异条带,说明待测小麦种质中存在抗白粉病基因pm2a,否则,待测小麦种质中不存在小麦抗白粉病基因pm2a。
与现有技术相比,本发明具有以下优点:本发明利用图位克隆的方法克隆了抗白粉病基因pm2a,并获得了其诊断性分子标记sxac-m。该标记是显性indel标记,可以准确鉴定小麦材料中pm2a基因的存在与否并预测其白粉病抗性,从而加快对抗小麦白粉病基因pm2a的利用。
附图说明
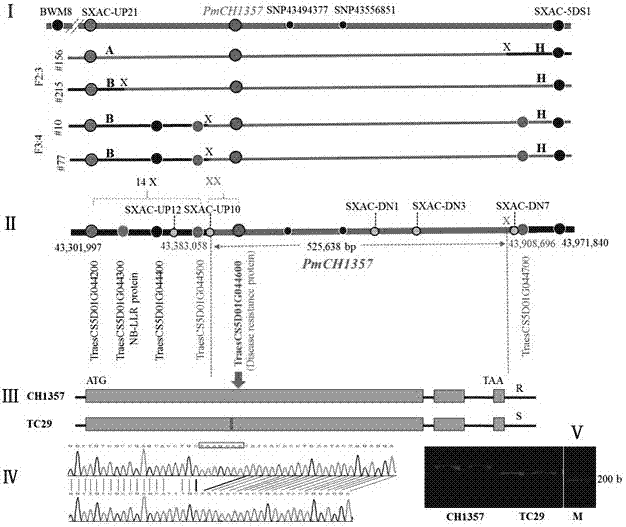
图1为pmch1357/pm2a的克隆及其等位变异;
图1-ⅰ:f2:3和f3:4群体中筛选到的4个重组株在qpm.sxac-5d区域的重组位置;图中a表示ch1357的基因型,b表示台长29的基因型,h表示ch1357和台长的杂合基因型,x表示两个两邻标记的交叉点;
图1-ⅱ:pmch1357的物理图谱;pmch1357被定位于traescs5d01g044500和traescs5d01g044700之间的525,638bp区间内;
图1-ⅲ:台长29在traescs5d01g044600位置出现7bp碱基的缺失;
图1-ⅳ:基于7bp碱基插入/缺失设计诊断性分子标记sxac-m;
图1-ⅴ:分子标记sxac-m在ch1357(219bp)和台长29(212bp)中的扩增结果;
图2为诊断性标记sxac-m在中国和美国部分品种中检测pm2a基因存在与否的pcr扩增结果;m表示marker;1~22表示部分检测品种;箭头所指219bp条带表示含有pm2a基因;箭头所指212bp条带表示不含pm2a基因。
具体实施方式
下面用实施例进一步描述本发明,以利于对本发明及其优点、效果更好地了解,但所述实施例仅用于说明本发明而不是限制本发明。
本实施例所用方法如无特别说明均为本领域技术人员所知晓的常规方法,所用的试剂等材料,如无特殊说明,均为市售购买产品。以抗病小麦亲本ch1357与台长29杂交、回交产生后代的分离群体f1、f2、bc1、f2:3和f3:4家系,构成遗传作图群体;
一、苗期白粉病鉴定分析
白粉菌株e09是中国中部和北部地区发现的广谱白粉菌株,利用e09在人工气候室对“台长29×ch1357”后代分离群体f1、f2、bc1、f2:3和f3:4家系植株进行白粉病抗性鉴定。人工气候室温度控制在白天22℃,晚上16℃,光周期为12h,湿度为65%-70%。种子于湿润滤纸上发芽后,将幼苗转移到盛有育苗基质的育苗盘上进一步生长。幼苗长到一叶一心期后,采用人工扫抹法将新鲜白粉菌接菌到该材料幼苗上,每个材料处理5株苗,实验重复鉴定3次。接菌后幼苗保持在湿度为65%-70%的人工气候室以促进白粉菌生长。
接菌12天后对植株进行白粉病表型抗性鉴定,按照1-6级分级标准进行,其中1级代表免疫(无明显症状);2级代表近免疫(有过敏性坏死斑点);3级代表高抗(有少量坏死斑和少量失绿组织);4级代表中抗(有少量坏死斑和大量失绿组织);5级代表中感(有大量坏死斑和少量孢子);6级代表高感(有大量坏死斑和大量新鲜孢子)。表型鉴定试验重复三次。
结果表明,杂交组合的f1单株对菌株e09表现为免疫或近免疫(it=1~2),与ch1357的反应型一致,说明ch1357中的白粉病抗性受显性基因控制。杂交后代bc1f1的抗性分离比为1:1,说明抗病基因由单个基因控制。利用白粉菌株e09接种台长29×ch1357的483个f2植株,其中抗病植株为351株(it=1~4),感病植株为132株(it=5~6),卡方检验符合单显性基因的分离比例3:1(χ2=1.398,p=0.237)。为进一步验证该结果,利用同一白粉菌株e09接种上述f2群体产生的483个f2:3家系,其中纯合抗病家系为120个,发生抗性分离的家系为231个,纯合感病家系为132个,分离比例符合1:2:1(χ2=1.509,p=0.47),进一步证实抗病基因受单个显性基因的控制。
上述台长29×ch1357杂交组合后代的表型鉴定结果表明ch1357对白粉菌株e09的抗性由一对显性基因控制,暂命名为pmch1357。
二、f2:3及f3:4群体的分子标记分析
1、总dna的提取采用ctab法;
2、分子标记分析:pcr反应体系为10μl,扩增程序为:95℃预变性5min;95℃变性30s,55℃复性30s,72℃延伸4min,共40个循环,72℃延伸10min,4℃保存备用。扩增产物用6%聚丙烯酰胺凝胶电泳分离。
三、pmch1357图位克隆与诊断性分子标记的开发
利用483个台长29×ch1357杂交组合f2:3家系作图群体,将ch1357携带的抗白粉病基因pmch1357定位于小麦5ds染色体上标记sxac-up21(43,300,735)和标记sxac-5ds1(43,971,728)之间,物理区间为679,993bp。
为了将定位的679,993bp区间进一步缩短,将台长29×ch1357杂交组合f2、f3中在该位点抗性发生分离的单株种植下去,共获得2,252个f3:4家系可供在标记sxac-up21和sxac-5ds1间筛选新的交换株。两个标记间共筛选到15个交换株。随后开发了4个中间标记sxac-up10、sxac-up12、sxac-dn1和sxac-dn3用于f2:3和f3:4家系中所有交换株的精细定位。其中14个交换株定位到标记sxac-up21和sxac-up12间的85-kb区域内,然而在标记sxac-5ds1和traescs5d01g044600(位置为43,406,783)的566-kb区域内没有筛选到新的交换株。说明含有pmch1357的基因组区域内的重组频率严重不均匀。
f3:4家系中标记sxac-up10和traescs5d01g044600间发生交换的两个交换株10#和77#,标记sxac-up10检测其基因型为纯合感,traescs5d01g044600处其基因型为杂合带型,但是两交换株的表型发生抗性分离,因此,pmch1357与traescs5d01g044600共分离。开发新的标记确定单株156#的精确位置,表明其位于标记sxac-dn3和sxac-dn7之间,而sxac-dn7代表了候选基因traescs5d01g044700。通过分析单株156#,traescs5d01g044700作为pmch1357的候选基因被排除,因为标记sxac-dn3检测其基因型为纯合抗病带型,标记sxac-dn7检测其基因型为杂合带型,而156#后代对白粉病菌株e09表现为抗(见图1-ⅰ)。
基于中国春基因组序列,最终将pmch1357定位于traescs5d01g044500和traescs5d01g044700间的525,821bp区域内(见图1-ⅱ)。该区域内仅存在一个候选基因traescs5d01g044600。traescs5d01g044600的基因注释表明它编码一个与抗病性相关的含421个氨基酸的蛋白质,因此,它被认为是pmch1357的唯一候选基因。
基于中国春基因组序列(iwgscv1.0),开发了基因特异性引物pmch1357-f2和pmch1357-r1,利用one-shotpcr扩增ch1357、台长29、中国春和ulka/8*cc(pm2a原始供体品种)中基因traescs5d01g044600的全长序列,并对扩增产物进行测序。结果表明,该候选基因在台长29中感病的等位基因与中国春是相同的,而在ch1357中的等位基因与pm2a是相同的,说明本研究图位克隆的pmch1357与pm2a为同一个基因,而且与台长29中的traescs5d01g044600具有等位关系。同时,测序结果还表明,在感病材料台长29中含有7bp缺失,导致外显子1处的终止密码子提前终止,使其由1277个氨基酸组成的nb-lrr蛋白损失了856个氨基酸,剩余的421个氨基酸丧失了大部分nb结构域和所有lrr结构域,因而易感白粉病。根据traescs5d01g044600序列开发了一个针对7bp插入/缺失(indel)的诊断性分子标记以区别抗病材料ch1357和感病材料台长29中的等位基因,并将该indel标记命名为sxac-m。
四、pm2a诊断性分子标记的应用
利用分子标记sxac-m对目前中国小麦育种中广泛用作微核心种质的261份种质材料进行pcr扩增,并利用白粉菌株e09进行抗病性鉴定。结果显示其中253份种质材料只能扩增出212bp的条带,而扩增不出219bp的目标条带,且对e09均表现为感病,说明它们不含有pm2a基因。有8份种质对e09表现为抗病,其中3份种质材料兴义4号、红春麦和红冬麦-1可以扩增出219bp的目标条带,它们含有pm2a基因,其它5份种质复壮30、火麦、贵农10、偃展1号和紫秸红也扩增不出219bp的目标条带,它们的抗病性可能是由于含有其它抗病基因的原因。
同时对中国中部和北部广泛种植的164个品种及美国南部大平原的70个品种进行了分子标记检测和抗病性鉴定,仅发现6个中国品种绵麦41、中麦175、济麦22、太1113、菏泽2号、良星66和1个美国品种grn*5/nd614-a含有ch1357的抗病等位基因pm2a,且对菌株e09表现为抗病。196个品种只能扩增出212bp的条带,而扩增不出219bp的目标条带,且对e09均表现为感病,说明它们不含有pm2a基因。剩余的31个品种虽然对菌株e09表现为抗病,但扩增不出219bp的目标条带,说明它们不含有pm2a基因,它们的抗病性可能是由于含有其它抗病基因的原因。同时这些结果也进一步说明,pmch1357/pm2a抗病基因在中国中部、北部或美国南部大平原小麦品种中的分布较少,对于这些地区小麦品种的抗病改良具有重要价值。
序列表
<110>山西省农业科学院作物科学研究所
<120>检测小麦抗白粉病基因pm2a的诊断性分子标记及其应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>32
<212>dna
<213>小麦(triticumaestivum)
<400>1
ggtttgaatccaagagatgatgcatatttgat32
<210>2
<211>30
<212>dna
<213>小麦(triticumaestivum)
<400>2
taagtggtaatagctcaatctgagaacctt30
- 还没有人留言评论。精彩留言会获得点赞!