一种高纤维素酶活的复配酶制剂及其制备方法和应用与流程
本发明涉及一种高纤维素酶活的复配酶制剂及其制备方法和应用。
背景技术:
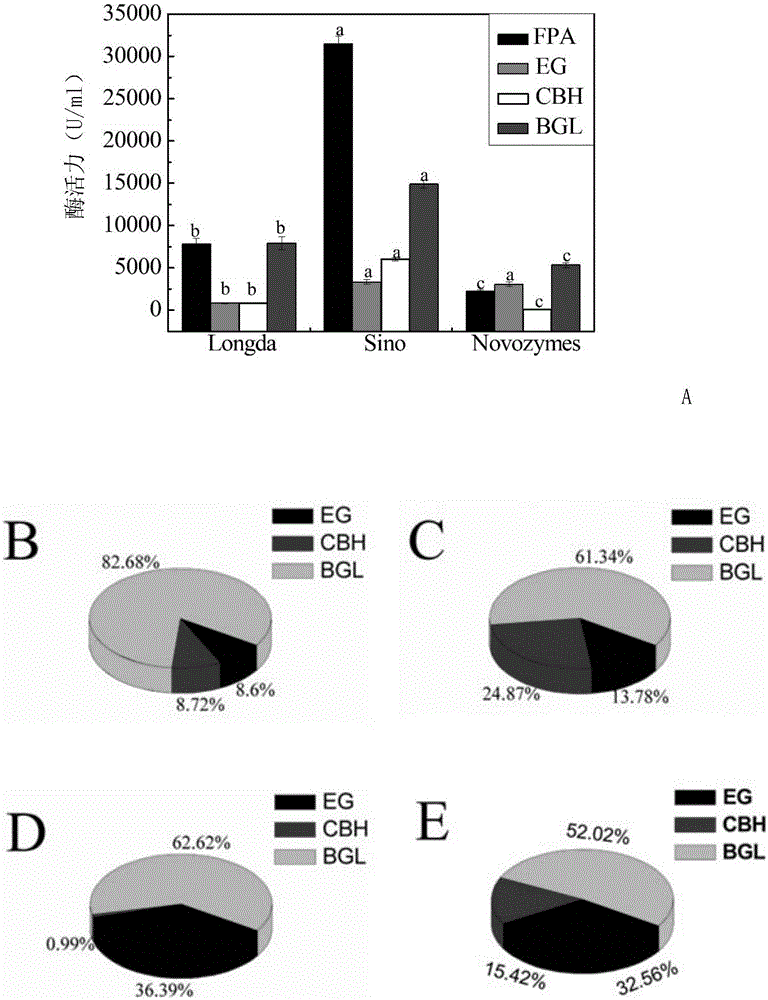
:木质纤维素是一类蕴藏量丰富的可再生生物质资源,主要由纤维素,半纤维素和木质素组成,其中,纤维素是葡萄糖通过β-1,4糖苷键连接而成的线性大分子,是木质纤维素的主要成分,约占其50%左右,也是纤维素酶的主要作用底物。纤维素酶是一类复合诱导酶系,由内切葡聚糖酶(ec3.2.1.4,eg)、外切葡聚糖酶(ec3.2.1.91,cbh)及β-葡萄糖苷酶(ec3.2.1.21,bgl)三个组分组成,三个组分之间协同作用把纤维素类底物降解为葡萄糖。在水解过程中,首先eg结合在非结晶区随机切割多聚糖内部的β-1,4糖苷键,极大地降低纤维素的聚合度,从而产生还原性末端和非还原性末端的纤维低聚糖,随后cbh作用于纤维低聚糖主要产生纤维二糖,最后bgl将其水解生成葡萄糖完成整个水解过程,在此过程中纤维二糖作为中间产物过多积累会反馈抑制cbh的活性,降低整个酶解反应的速率,因此bgl作为纤维素酶高效转化纤维素为可发酵糖的限速步骤,对纤维素的水解产率影响重大,也是目前纤维素作为能源物质分解利用的瓶颈之一。目前最新的研究报道称,真菌所产生的纤维素酶大都存在纤维二糖酶缺乏症,主要表现在纤维素酶中缺少最佳比例的bgl,因此有研究通过基因工程的手段对bgl的功能基因过表达或者构建高产bgl的酵母载体,从而获得高产bgl的菌株以提高纤维素酶对生物质原料的转化率,以及有研究用两种菌株进行混合发酵以提高酶活及用不同来源的四种酶,包括纤维素外切酶(cel7a)、纤维素内切酶(cel7b)和bgl以及内切β-1,4-木聚糖酶按一定比例重组得到对甘蔗渣分解效果显著的混合纤维素酶,但未见通过复配模型对有bgl缺乏的纤维素酶进行bgl比例的复配以提高木质纤维素的生物转化的研究。技术实现要素:本发明的目的是提供一种高纤维素酶活的复配酶制剂及其制备方法和应用。本发明保护一种复配酶制剂的制备方法,包括如下步骤:以初始酶制剂和β-葡萄糖苷酶为原料进行复配,得到复配酶制剂;复配酶制剂的β-葡萄糖苷酶酶活比例为58%-68%。复配酶制剂的β-葡萄糖苷酶酶活比例为具体可为58.45%-65.84%。复配酶制剂的β-葡萄糖苷酶酶活比例为具体可为58.45%。复配酶制剂的纤维素内切酶酶活比例为25%-35%。复配酶制剂的纤维素内切酶酶活比例为具体可为25.71%-33.35%。复配酶制剂的纤维素内切酶酶活比例为具体可为33.35%。复配酶制剂的纤维素外切酶酶活比例为6%-9%。复配酶制剂的纤维素外切酶酶活比例为具体可为6.89%-8.2%。复配酶制剂的纤维素外切酶酶活比例为具体可为8.2%。初始酶制剂和β-葡萄糖苷酶工作液的配比具体可为100ml初始酶制剂:15ml-33ml工作液,更具体可为100ml初始酶制剂:15ml-23ml工作液,更具体可为100ml初始酶制剂:15ml工作液。工作液中β-葡萄糖苷酶的浓度为1g/100ml。所述初始酶制剂为市售纤维素酶或自制纤维素酶。自制纤维素酶的制备方法具体可包括如下步骤:(1)用生理盐水悬浮绿色木霉突变株my,得到1×106cfu/ml的菌液;(2)取步骤(1)得到的菌液,接种至种子培养基(每1ml菌液配比25ml种子培养基),30℃、200rpm振荡培养16h,得到种子液;(3)取步骤(2)得到的种子液,接种至发酵培养基(每1ml种子液配比20ml发酵培养基),30℃、200rpm振荡培养168h-240h;(4)完成步骤(3)后,取整个培养体系,用6层纱布过滤并收集滤液;(5)取步骤(4)得到的滤液,4℃、4000rpm离心10min,收集上清液,即为自制纤维素酶。所述β-葡萄糖苷酶为市售β-葡萄糖苷酶或自制β-葡萄糖苷酶。所述β-葡萄糖苷酶的β-葡萄糖苷酶酶活比例为60%以上。所述β-葡萄糖苷酶的β-葡萄糖苷酶酶活比例为70%以上。如果不考虑成本,β-葡萄糖苷酶的β-葡萄糖苷酶酶活比例越高越好。如果考虑成本,所述β-葡萄糖苷酶的β-葡萄糖苷酶酶活比例可为70-75%,例如70.6%。所述β-葡萄糖苷酶的β-葡萄糖苷酶酶活为15000u/g以上或15000u/ml以上,具体可为15000-16000u/g或15000-16000u/ml。所述β-葡萄糖苷酶的纤维素内切酶酶活为6000u/g以下或6000u/ml以下。所述β-葡萄糖苷酶的纤维素外切酶酶活为2000u/g以下或2000u/ml以下。以上所述方法中,按照特定模型计算β-葡萄糖苷酶的加入量;特定模型由式3、式4和式5组成;r=y1/(y1+a+b)(式4)y=y1-y0(式5)y=7.559bgl/n+3.4255(式3)r为预设的复配酶制剂的β-葡萄糖苷酶酶活比例的理论值;y1为复配酶制剂的β-葡萄糖苷酶酶活的理论值;a为初始酶制剂的纤维素内切酶酶活实测值;b为初始酶制剂的纤维素外切酶酶活实测值;y0为初始酶制剂的β-葡萄糖苷酶酶活实测值;y为与初始酶制剂相比复配酶制剂β-葡萄糖苷酶酶活增加值;bgl为商品β-葡萄糖苷酶的β-葡萄糖苷酶酶活实测值;n为复配时商品β-葡萄糖苷酶的稀释倍数。以上所述方法中,按照特定模型计算β-葡萄糖苷酶的加入量;特定模型由式3、式4、式5和式6组成;r=y1/(y1+a+b)(式4)y=y1-y0(式5)y=7.559bgl/n+3.4255(式3)(100+c)/c=n(式6)r为预设的复配酶制剂的β-葡萄糖苷酶酶活比例的理论值;y1为复配酶制剂的β-葡萄糖苷酶酶活的理论值;a为初始酶制剂的纤维素内切酶酶活实测值;b为初始酶制剂的纤维素外切酶酶活实测值;y0为初始酶制剂的β-葡萄糖苷酶酶活实测值;y为与初始酶制剂相比复配酶制剂β-葡萄糖苷酶酶活增加值;bgl为商品β-葡萄糖苷酶的β-葡萄糖苷酶酶活实测值;n为复配时商品β-葡萄糖苷酶的稀释倍数;c为100ml初始酶制剂中商品β-葡萄糖苷酶的加入量。以上任一所述方法制备得到的复配酶制剂也属于本发明的保护范围。本发明还保护一种复配酶制剂,由初始酶制剂和β-葡萄糖苷酶两种原料组成;复配酶制剂的β-葡萄糖苷酶酶活比例为58%-68%。复配酶制剂的β-葡萄糖苷酶酶活比例为具体可为58.45%-65.84%。复配酶制剂的β-葡萄糖苷酶酶活比例为具体可为58.45%。复配酶制剂的纤维素内切酶酶活比例为25%-35%。复配酶制剂的纤维素内切酶酶活比例为具体可为25.71%-33.35%。复配酶制剂的纤维素内切酶酶活比例为具体可为33.35%。复配酶制剂的纤维素外切酶酶活比例为6%-9%。复配酶制剂的纤维素外切酶酶活比例为具体可为6.89%-8.2%。复配酶制剂的纤维素外切酶酶活比例为具体可为8.2%。初始酶制剂和β-葡萄糖苷酶工作液的配比具体可为100ml初始酶制剂:15ml-33ml工作液,更具体可为100ml初始酶制剂:15ml-23ml工作液,更具体可为100ml初始酶制剂:15ml工作液。工作液中β-葡萄糖苷酶的浓度为1g/100ml。所述初始酶制剂为市售纤维素酶或自制纤维素酶。自制纤维素酶的制备方法具体可包括如下步骤:(1)用生理盐水悬浮绿色木霉突变株my,得到1×106cfu/ml的菌液;(2)取步骤(1)得到的菌液,接种至种子培养基(每1ml菌液配比25ml种子培养基),30℃、200rpm振荡培养16h,得到种子液;(3)取步骤(2)得到的种子液,接种至发酵培养基(每1ml种子液配比20ml发酵培养基),30℃、200rpm振荡培养168h-240h;(4)完成步骤(3)后,取整个培养体系,用6层纱布过滤并收集滤液;(5)取步骤(4)得到的滤液,4℃、4000rpm离心10min,收集上清液,即为自制纤维素酶。所述β-葡萄糖苷酶为市售β-葡萄糖苷酶或自制β-葡萄糖苷酶。所述β-葡萄糖苷酶的β-葡萄糖苷酶酶活比例为60%以上。所述β-葡萄糖苷酶的β-葡萄糖苷酶酶活比例为70%以上。如果不考虑成本,β-葡萄糖苷酶的β-葡萄糖苷酶酶活比例越高越好。如果考虑成本,所述β-葡萄糖苷酶的β-葡萄糖苷酶酶活比例可为70-75%,例如70.6%。所述β-葡萄糖苷酶的β-葡萄糖苷酶酶活为15000u/g以上或15000u/ml以上,具体可为15000-16000u/g或15000-16000u/ml。所述β-葡萄糖苷酶的纤维素内切酶酶活为6000u/g以下或6000u/ml以下。所述β-葡萄糖苷酶的纤维素外切酶酶活为2000u/g以下或2000u/ml以下。以上任一所述商品β-葡萄糖苷酶可为江苏锐阳生物科技有限公司产品目录号为9001-22-3的产品。本发明还保护以上任一所述复配酶制剂在降解纤维素中的应用。所述降解纤维素的目的为制备还原糖或者制备乙醇等。所述纤维素具体可为微晶纤维素。本发明还保护以上任一所述复配酶制剂在降解含有纤维素的生物材料中的应用。所述降解秸秆的目的为制备还原糖或者制备乙醇等。所述生物材料具体可为秸秆。本发明通过分析longda,sino,novozymes三种商品纤维素酶制剂各组分比例,和自制的纤维素酶的组分相比较,初步得出纤维素酶中bgl最适比例范围,建立纤维素酶中bgl比例复配模型,理论计算指导自制纤维素酶的复配,从而最大程度地弥补自制纤维素酶中bgl的缺乏症,以提高纤维素酶的fpa以及对木质纤维的分解能力,从而为生物质资源高效水解为平台糖,为燃料乙醇、生物炼制以及其他化工产品的开发提供新的解决方案。附图说明图1为实施例3的步骤一中纤维素酶组分分析的结果。图2为实施例3的步骤二中酶制剂0、复配酶制剂1、复配酶制剂2、复配酶制剂3、复配酶制剂4、复配酶制剂5的滤纸酶酶活、纤维素内切酶酶活、β-葡萄糖苷酶酶活、纤维素外切酶酶活。图3为实施例3的步骤二中酶制剂0、复配酶制剂1、复配酶制剂2、复配酶制剂3、复配酶制剂4、复配酶制剂5的纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例、纤维素外切酶酶活比例。图4为实施例4中自制纤维素酶ii、复配酶制剂a、复配酶制剂b复配酶制剂c中,纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例。图5为实施例6中转化率的结果。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。实验数据用spss21.0进行单因素方差分析,并用origin8.0进行图表处理,每组设三个平行,结果用平均值±标准误表示,p<0.05表示差异显著,p<0.01表示差异极显著。longda纤维素酶(产品形态:液态):山东隆科特酶制剂有限公司生产的酸性纤维素酶,产品规格为20万u/ml。网址链接:http://www.longda-enzyme.com/product01/id/26.html。sino纤维素酶(产品形态:固态):白银赛诺生物科技有限公司;产品批号为20180308301zcxwb1f3.2。网址链接:http://www.sinoenzymes.com/a/chanpinzhongxin/shipinyongmeixilie/20171125/102.html。novozymes纤维素酶(产品形态:液态):诺维信公司;产品批号为ktn02251。商品β-葡萄糖苷酶(产品形态:固态):江苏锐阳生物科技有限公司,产品目录号为9001-22-3。网址链接:http://www.ruiyang-biotech.com/product/277637093。实施例1、酶活测定方法式1为od540nm值和还原糖量的线性回归线方程。y=3.4485x-0.1311(式1)式1中,y为还原糖的质量(mg),x是od540nm值,r2=0.998。式2为纤维素酶酶活计算公式。纤维素酶酶活包括滤纸酶酶活(fpa)、纤维素内切酶(eg)酶活、β-葡萄糖苷酶(bgl)酶活、纤维素外切酶(cbh)酶活。酶活力单位定义:以每毫升酶制剂在每分钟内水解反应体系中的底物生成每微克葡萄糖的酶量定义为1个酶活单位(u)。式2中,δy为还原糖的生成量(mg),df为稀释倍数,t为酶和底物作用时间(min),v为待测液体积(ml)。待测液为酶制剂或稀释后酶制剂,稀释用溶剂为ph4.8、0.05m的柠檬酸-柠檬酸钠缓冲液。滤纸是一类聚合度和结晶度处于“中等”程度的纤维材料,实验中常以其为原料经纤维素酶水解生成还原糖的量来衡量纤维素酶总的糖化能力,它反映了纤维素酶中eg、bgl和cbh三个酶组分的协同作用能力,体现了纤维素酶的总酶活。纤维素内切酶酶活比例=纤维素内切酶酶活÷(纤维素内切酶酶活+β-葡萄糖苷酶酶活+纤维素外切酶酶活)×100%。β-葡萄糖苷酶酶活比例=β-葡萄糖苷酶酶活÷(纤维素内切酶酶活+β-葡萄糖苷酶酶活+纤维素外切酶酶活)×100%。纤维素外切酶酶活比例=纤维素外切酶酶活÷(纤维素内切酶酶活+β-葡萄糖苷酶酶活+纤维素外切酶酶活)×100%。一、滤纸酶(fpa)酶活的测定方法实验组:将滤纸剪成宽1cm、长6cm的长方形(重约50±0.5mg),折成m型,置于25ml具刻度试管中,加入0.5ml待测液和1.5mlph4.8、0.05m的柠檬酸-柠檬酸钠缓冲液,50℃水浴60min,然后加入3mldns试剂,沸水浴煮沸5min,然后迅速冷却至室温,用蒸馏水定容到25ml,然后用酶标仪在540nm波长下测od值。空白组:去除了“50℃水浴60min”的步骤,其他同实验组。根据od540nm值、式1和式2计算滤纸酶酶活。二、纤维素内切酶(eg)酶活的测定方法实验组:取25ml具刻度试管,加入0.5ml待测液和1.5mlcmc-na溶液(cmc-na溶液:溶剂为ph4.8、0.05m的柠檬酸-柠檬酸钠缓冲液,cmc-na浓度为2g/100ml),50℃水浴30min,然后加入3mldns试剂,摇匀,沸水浴煮沸5min,然后迅速冷却至室温,用蒸馏水定容到25ml,然后用酶标仪在540nm波长下测od值。空白组:去除了“50℃水浴30min”的步骤,其他同实验组。根据od540nm值、式1和式2计算纤维素内切酶酶活。三、β-葡萄糖苷酶(bgl)酶活的测定方法实验组:取25ml具刻度试管,加入1ml待测液和1ml水杨素溶液(水杨素溶液:溶剂为ph4.8、0.05m的柠檬酸-柠檬酸钠缓冲液,水杨素浓度为1g/100ml),50℃水浴30min,然后加入3mldns试剂,摇匀,沸水浴煮沸5min,然后迅速冷却至室温,用蒸馏水定容到25ml,然后用酶标仪在540nm波长下测od值。空白组:去除了“50℃水浴30min”的步骤,其他同实验组。根据od540nm值、式1和式2计算β-葡萄糖苷酶酶活。四、纤维素外切酶(cbh)酶活的测定方法实验组:取25ml带有刻度的具塞试管,加入1ml微晶纤维素溶液(微晶纤维素溶液:溶剂为ph4.8、0.1m的乙酸-乙酸钠缓冲液,微晶纤维素的浓度为1g/100ml)和1ml待测液,50℃反应2h,离心取上清,加入3mldns试剂,摇匀,沸水浴煮沸5min,然后迅速冷却至室温,用蒸馏水定容到25ml,然后用酶标仪在540nm波长下测od值。空白组:去除了“50℃反应2h”的步骤,其他同实验组。根据od540nm值、式1和式2计算纤维素外切酶酶活。实施例2、自制纤维素酶的制备绿色木霉突变株my记载于如下文献:additionofaluminumoxidemicroparticlestotrichodermaviridemyprecultureenhancescellulaseproductionandinfluencesfungalmorphology,eng.lifesci.2018,0,1–6。在文献中的名称为t.viridemy,t.viridemy为t.viridestraingstcc62010(nm01)进行12c6+离子辐射得到的突变株。t.viride即trichodermaviride的缩写。种子培养基:50g蔗糖、5g蛋白胨、0.3gmgso4·7h2o、4g(nh4)2so4、2gkh2po4、0.3gcacl2·2h2o、0.005gfeso4·7h2o、0.0016gmnso4·h2o、0.0014gznso4·7h2o、0.002gcocl2·6h2o,蒸馏水定容至1000ml;发酵培养基:50g蔗糖、3g蛋白胨、0.4gmgso4·7h2o、5g(nh4)2so4、2gkh2po4,蒸馏水定容至1000ml。一、自制纤维素酶ⅰ的制备1、用生理盐水悬浮绿色木霉突变株my,得到1×106cfu/ml的菌液。2、取步骤1得到的菌液,接种至种子培养基(每1ml菌液配比25ml种子培养基),30℃、200rpm振荡培养16h,得到种子液。3、取步骤2得到的种子液,接种至发酵培养基(每1ml种子液配比20ml发酵培养基),30℃、200rpm振荡培养168h。4、完成步骤3后,取整个培养体系,用6层纱布过滤并收集滤液。5、取步骤4得到的滤液,4℃、4000rpm离心10min,收集上清液,即为自制纤维素酶ⅰ。二、自制纤维素酶ⅱ的制备1、用生理盐水悬浮绿色木霉突变株my,得到1×106cfu/ml的菌液。2、取步骤1得到的菌液,接种至种子培养基(每1ml菌液配比25ml种子培养基),30℃、200rpm振荡培养16h,得到种子液。3、取步骤2得到的种子液,接种至发酵培养基(每1ml种子液配比20ml发酵培养基),30℃、200rpm振荡培养240h。4、完成步骤3后,取整个培养体系,用6层纱布过滤并收集滤液。5、取步骤4得到的滤液,4℃、4000rpm离心10min,收集上清液,即为自制纤维素酶ⅱ。实施例3、纤维素酶复配模型的建立一、纤维素酶组分分析供试酶制剂分别为:longda纤维素酶、sino纤维素酶(溶液)、novozymes纤维素酶和自制纤维素酶ⅰ。sino纤维素酶的产品形态为固态,为了与其它纤维素酶平行,用ph4.8、0.05m的柠檬酸-柠檬酸钠缓冲液作为溶剂,制备0.1g/100ml的溶液。检测供试酶制剂的滤纸酶酶活、纤维素内切酶酶活、β-葡萄糖苷酶酶活、纤维素外切酶酶活。longda纤维素酶、sino纤维素酶、novozymes纤维素酶的酶活检测结果见图1a。图1a中,小写字母相同表示差异不显著(p>0.05),字母不同表示差异显著(p<0.05)。滤纸酶酶活:sino纤维素酶最高,longda纤维素酶居中,novozymes纤维素酶最低。longda纤维素酶的纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图1b,cbh/eg≈1:1。sino纤维素酶的纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图1c,cbh/eg≈2:1。novozymes纤维素酶的纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图1d,cbh/eg≈1:36。cbh/eg比值显著影响纤维素酶的总体酶活(fpa),cbh/eg值和fpa呈正相关。bgl是三种商购纤维素酶中的主要成分,三种商购纤维素酶的β-葡萄糖苷酶酶活比例均为60%以上。自制纤维素酶ⅰ的纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图1e。自制纤维素酶ⅰ中bgl仅占47%,比例较小。在纤维素酶分解纤维素的过程中,eg会结合到纤维素的非结晶区域切割纤维素产生还原性末端,急剧降低纤维素的聚合度,紧接着cbh主要会从还原性末端水解低聚纤维素从而产生纤维二糖,而过多纤维二糖将会负反馈抑制eg和cbh的作用,因此需要大量的纤维二糖水解酶(β-葡萄糖苷酶)及时分解释放的纤维二糖,以提高酶的活性。二、纤维素酶复配模型的建立商品β-葡萄糖苷酶的产品形态为固态,用ph4.8、0.05m的柠檬酸-柠檬酸钠缓冲液作为溶剂,制备0.1g/100ml的溶液。检测商品β-葡萄糖苷酶(溶液)的滤纸酶酶活、纤维素内切酶酶活、β-葡萄糖苷酶酶活、纤维素外切酶酶活,然后除以0.1g/100ml。结果见表1。商品β-葡萄糖苷酶的主要成分是β-葡萄糖苷酶(β-葡萄糖苷酶酶活比例为70.67%),eg和cbh含量较低。商品β-葡萄糖苷酶的滤纸酶酶活较低。纤维素酶是一类复合酶系,其三种成分(eg、cbh、bgl)分子量和酶学特性差别较小,尤其是eg和cbh之间分离纯化极其困难,虽然市场有纯度很高的β-葡萄糖苷酶,但其价格昂贵不适于工业的生产,尤其是在燃料乙醇等大规模用酶行业。此商品β-葡萄糖苷酶纯度为70.6%,属于食品级,成本相对较低,可大规模使用,因其eg、cbh含量较低,若将其稀释合适的倍数,在自制复配酶制剂的过程中,可极大地降低商品β-葡萄糖苷酶中eg和cbh对酶制剂中相应组分的影响。表1商品β-葡萄糖苷酶的酶活酶类酶活(u/g)标准误滤纸酶酶活718.2180.97纤维素内切酶酶活5108.12152.08纤维素外切酶酶活1403.7759.75β-葡萄糖苷酶酶活15662.33854.85准确称取1g商品β-葡萄糖苷酶(固态),用ph4.8、0.05m的柠檬酸-柠檬酸钠缓冲液溶解并定容至100ml,即为商品β-葡萄糖苷酶的工作液,简称工作液。酶制剂0:自制纤维素酶ⅰ。复配酶制剂1的制备方法:1体积份工作液与100体积份自制纤维素酶ⅰ混匀。复配酶制剂2的制备方法:2体积份工作液与100体积份自制纤维素酶ⅰ混匀。复配酶制剂3的制备方法:3体积份工作液与100体积份自制纤维素酶ⅰ混匀。复配酶制剂4的制备方法:4体积份工作液与100体积份自制纤维素酶ⅰ混匀。复配酶制剂5的制备方法:5体积份工作液与100体积份自制纤维素酶ⅰ混匀。检测酶制剂0、复配酶制剂1、复配酶制剂2、复配酶制剂3、复配酶制剂4、复配酶制剂5的滤纸酶酶活、纤维素内切酶酶活、β-葡萄糖苷酶酶活、纤维素外切酶酶活,分析商品β-葡萄糖苷酶的添加量和各酶活的关系。结果见图2。图2中,0代表酶制剂0,1代表复配酶制剂1、2代表复配酶制剂2、3代表复配酶制剂3、4代表复配酶制剂4、5代表复配酶制剂5。相较于酶制剂0,复配酶制剂的滤纸酶酶活显著(p<0.05)升高,纤维素内切酶酶活和纤维素外切酶酶活增加不显著。在复配过程中,随着商品β-葡萄糖苷酶添加量的增加,复配酶制剂的滤纸酶酶活先升高再降低最后基本不变,复配酶制剂2的滤纸酶酶活最高,当工作液与自制纤维素酶ⅰ的体积配比高于3%时,复配酶制剂的滤纸酶酶活下降较快。因此,复配时,工作液与自制纤维素酶ⅰ的体积配比优选值为1%-3%。酶制剂0的纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图3a。复配酶制剂1的纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图3b。复配酶制剂2的纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图3c。复配酶制剂3的纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图3d。复配酶制剂4的纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图3e。复配酶制剂5的的纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图3f。复配酶制剂中,β-葡萄糖苷酶酶活比例优选值为61.35%-65.84%,可以实现较高的滤纸酶酶活。复配酶制剂中,滤纸酶酶活是纤维素内切酶、β-葡萄糖苷酶和纤维素外切酶协同作用体现出来的,商品β-葡萄糖苷酶的添加引起的复配酶制剂中β-葡萄糖苷酶酶活比例的增加值并非简单地是其理论添加量的换算。对商品β-葡萄糖苷酶的稀释倍数和复配酶制剂中β-葡萄糖苷酶酶活增加值进行函数拟合,得到式3。y=7.559bgl/n+3.4255(式3)式3中,y为与初始酶制剂相比复配酶制剂β-葡萄糖苷酶酶活增加值,bgl为商品β-葡萄糖苷酶的β-葡萄糖苷酶酶活实测值,n为复配时商品β-葡萄糖苷酶的稀释倍数,r2=0.9878。建立用于制备复配酶制剂的模型,由式3、式4、式5和式6组成;r=y1/(y1+a+b)(式4)y=y1-y0(式5)y=7.559bgl/n+3.4255(式3)(100+c)/c=n(式6)r为预设的复配酶制剂的β-葡萄糖苷酶酶活比例的理论值;y1为复配酶制剂的β-葡萄糖苷酶酶活的理论值;a为初始酶制剂的纤维素内切酶酶活实测值(单位为u/ml);b为初始酶制剂的纤维素外切酶酶活实测值(单位为u/ml);y0为初始酶制剂的β-葡萄糖苷酶酶活实测值(单位为u/ml);y为与初始酶制剂相比复配酶制剂β-葡萄糖苷酶酶活增加值;bgl为商品β-葡萄糖苷酶的β-葡萄糖苷酶酶活实测值,当商品β-葡萄糖苷酶为固体时单位为u/g,当商品β-葡萄糖苷酶为液体时单位为u/ml;n为复配时商品β-葡萄糖苷酶的稀释倍数;c为100ml初始酶制剂中商品β-葡萄糖苷酶的加入量,当商品β-葡萄糖苷酶为固体时加入量以g计,当商品β-葡萄糖苷酶为液体时加入量以ml计。该模型假设复配不引起纤维素内切酶酶活和纤维素外切酶酶活变化。模型的使用方法:按照最优区间设定复配酶制剂中β-葡萄糖苷酶酶活比例的理论值(r);检测获得初始酶制剂的β-葡萄糖苷酶酶活实测值(y0)、纤维素内切酶酶活实测值(a)和纤维素外切酶酶活实测值(b);检测获得商品β-葡萄糖苷酶的β-葡萄糖苷酶酶活实测值(bgl);按照式4计算得到复配酶制剂的β-葡萄糖苷酶酶活的理论值(y1);按照式5计算得到与初始酶制剂相比复配酶制剂β-葡萄糖苷酶酶活增加值(y);按照式3计算得到n;按照式6计算得到c。根据c值进行初始酶制剂和商品β-葡萄糖苷酶的复配。实施例4、应用实施例3建立的模型制备复配酶制剂一、纤维素酶组分分析初始酶制剂为:自制纤维素酶ⅱ。检测初始酶制剂的滤纸酶酶活、纤维素内切酶酶活、β-葡萄糖苷酶酶活、纤维素外切酶酶活。自制纤维素酶ⅱ中,滤纸酶酶活为362.18u/ml,纤维素内切酶酶活为186.66u/ml,纤维素外切酶酶活为69.42u/ml,β-葡萄糖苷酶酶活为203.36u/ml。自制纤维素酶ⅱ中,纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图4a,β-葡萄糖苷酶酶活比例为44.26%。商品β-葡萄糖苷酶即为实施例3中的商品β-葡萄糖苷酶。二、应用实施例3的模型制备复配酶制剂a=186.66u/ml。b=69.42u/ml。y0=203.36u/ml。bgl=15662.33u/g。复配酶制剂a。将r设定为60%。按照式4计算,y1=384.12u/ml。按照式5计算,y=180.76u/ml。按照式3计算,n=667.617144266。按照式6计算,c=0.15。由于实施例3中配制的工作液中商品β-葡萄糖苷酶的浓度为1g/100ml,因此100ml初始酶制剂和15ml工作液进行复配,得到复配酶制剂a。复配酶制剂b。将r设定为65%。按照上述步骤依次进行计算。按照式4计算,y1=475.577u/ml。按照式5计算,y=272.217u/ml。按照式3计算,n=440.459。按照式6计算,c=0.23。由于实施例3中配制的工作液中商品β-葡萄糖苷酶的浓度为1g/100ml,因此100ml初始酶制剂和23ml工作液进行复配,得到复配酶制剂b。复配酶制剂c。将r设定为70%。按照上述步骤依次进行计算。按照式4计算,y1=597.52u/ml。按照式5计算,y=394.16u/ml。按照式3计算,n=302.997。按照式6计算,c=0.33。由于实施例3中配制的工作液中商品β-葡萄糖苷酶的浓度为1g/100ml,因此100ml初始酶制剂和33ml工作液进行复配,得到复配酶制剂c。三、纤维素酶组分分析供试酶制剂为:自制纤维素酶ⅱ、复配酶制剂a、复配酶制剂b或复配酶制剂c。检测供试酶制剂的滤纸酶酶活、纤维素内切酶酶活、β-葡萄糖苷酶酶活、纤维素外切酶酶活。供试酶制剂的滤纸酶酶活、纤维素内切酶酶活、β-葡萄糖苷酶酶活、纤维素外切酶酶活结果见表2。随着工作液添加量的增加,复配酶制剂的β-葡萄糖苷酶酶活极显著提高,纤维素内切酶酶活显著升高,纤维素外切酶酶活基本不变。工作液与初始酶制剂的配比为15%至23%时,滤纸酶酶活显著升高,工作液与初始酶制剂的配比为15%时滤纸酶酶活最高,较初始酶制剂提高了14.8%,工作液与初始酶制剂的配比为33%时滤纸酶酶活的升高不显著。表2注:表中*表示处理组和对照相比差异显著(p<0.05),**表示处理组和对照相比差异极显著(p<0.01),下同。复配酶制剂a中,纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图4b。复配酶制剂b中,纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图4c。复配酶制剂c中,纤维素内切酶酶活比例、β-葡萄糖苷酶酶活比例和纤维素外切酶酶活比例见图4d。工作液与初始酶制剂的配比为15%时,β-葡萄糖苷酶酶活比例为58.45%。工作液与初始酶制剂的配比为23%时,β-葡萄糖苷酶酶活比例为67.4%。与初始酶制剂相比,复配酶制剂c(β-葡萄糖苷酶酶活比例为69.52%)的滤纸酶酶活无显著增加。结果表明,在复配过程中,将适量β-葡萄糖苷酶加入初始酶制剂,得到的复配酶制剂的滤纸酶酶活可以显著提高。复配酶制剂中β-葡萄糖苷酶酶活比例优选值确定为58.45%-65.84%。实施例5、应用实施例4制备的复配酶制剂进行微晶纤维素的分解实验微晶纤维素(mcc)在结构上是以β-1,4-葡萄糖苷键结合的直链多糖,由天然纤维素水解至极限聚合度得到,因此与天然纤维素在化学反应特性上相类似,实验中常以一定反应时间内,纤维素酶分解微晶纤维素产生葡萄糖量多少来衡量纤维素酶对天然纤维素的分解能力。供试酶制剂为:自制纤维素酶ⅱ、复配酶制剂a、复配酶制剂b或复配酶制剂c。待测液为酶制剂或稀释后酶制剂,稀释用溶剂为ph4.8、0.05m的柠檬酸-柠檬酸钠缓冲液。100mg/ml的微晶纤维素溶液:取微晶纤维素,用ph4.8、0.05m的柠檬酸-柠檬酸钠缓冲液溶解并定容,得到100mg/ml的微晶纤维素溶液。取100mg/ml的微晶纤维素溶液5ml、ph4.8、0.05m的柠檬酸-柠檬酸钠缓冲液2ml,待测液1ml,混匀即为初始体系(8ml),50℃、200rpm振荡反应8小时,然后离心取上清,加入3mldns试剂,摇匀,沸水浴煮沸5min,然后迅速冷却至室温,用蒸馏水定容到25ml,然后用酶标仪在540nm波长下测od值。根据od540nm值和式1计算还原糖量。转化率(%)=生成的还原糖量(g)×0.9×100÷初始纤维素的量(g)。结果见表3。工作液与初始酶制剂的配比为15%时,分解微晶纤维素所产生的还原糖最多,较自制纤维素酶ⅱ提高了15%,即该复配显著提高了酶制剂对微晶纤维素的分解能力。工作液与初始酶制剂的配比为23%和33%时,分解微晶纤维素生成的还原糖量较自制纤维素酶ⅱ略高(p>0.05)。各种复配酶制剂对微晶纤维素的转化率均显著高于自制纤维素酶ⅱ。工作液与初始酶制剂的配比为15%时,转化率显著高于自制纤维素酶ⅱ(p<0.01)及其余两组复配形式的转化率。复配有利于提高其对微晶纤维素的降解转化率。表38ml体系中还原糖的含量(mg/ml)标准误转化率(%)标准误自制纤维素酶ⅱ17.130.0624.670.18复配酶制剂a19.70*0.1928.37**0.27复配酶制剂b17.740.5525.55*0.32复配酶制剂c17.890.3425.76*0.33实施例6、对甜高粱木质纤维素的转化实验秸秆粉的制备:种植于中国科学院近代物理研究所武威现代产业园的甜高粱,待其成熟后刈割收获秸秆,105℃烘箱烘干至恒质量(约48h),粉碎后过20目筛。供试酶制剂分别为自制纤维素酶ⅱ和复配酶制剂a。一、复配酶制剂对甜高粱秸秆木质纤维素的水解效果1、前处理磷酸处理:秸秆粉和85%的h3po4溶液混合,2℃放置24h,然后用蒸馏水彻底直至中性,过滤收集固相,即为前处理的产物。每1g秸秆粉配比30mlh3po4溶液。h2o处理:秸秆粉和水混合,2℃放置24h,然后用蒸馏水彻底直至中性,过滤收集固相,即为前处理的产物。每1g秸秆粉配比30ml水。两种前处理后产物的酸性洗涤纤维含量、酸性洗涤木质素含量和纤维素含量见表4。纤维素含量=酸性洗涤纤维(aciddetergentfiber,adf)含量-酸性洗涤木质素(aciddetergentlignin,adl)含量。磷酸处理后产物中的纤维素含量显著高于h2o处理,有助于水解产生更多的还原糖。表4中,100g均是以秸秆粉干重计。表42、取100ml三角瓶,加入前处理的产物和蒸馏水,封装后121℃灭菌,然后冷却。3、取供试酶制剂,用0.22μm滤膜过滤除菌,收集滤液。4、完成步骤2后,取所述三角瓶,加入步骤3得到的滤液,50℃、150rpm振荡培养,分别于0h、12h、24h、36h、48h、60h取样,稀释后检测还原糖含量。步骤2中蒸馏水的加入量、步骤4中滤液的加入量均根据进行前处理以前的秸秆粉的干重而定。每g秸秆粉配比10毫升蒸馏水以及0.3ml滤液。设置不加入滤液的对照。每1ml样本稀释液加入3mldns试剂,摇匀,沸水浴煮沸5min,然后迅速冷却至室温,用蒸馏水定容到25ml,然后用酶标仪在540nm波长下测od值。根据od540nm值和式1计算还原糖量。取样样本液中的还原糖浓度(mg/ml)以及还原糖生成量(mg/ml)结果见表5。rs指还原糖浓度。δrs指还原糖生成量。结果见表5。表5中,ck为不加入滤液的对照,1表示磷酸处理以及加入自制纤维素酶ⅱ的组别,2表示磷酸处理以及加入复配酶制剂a的组别,3表示h2o处理以及加入自制纤维素酶ⅱ的组别,4表示h2o处理以及加入复配酶制剂a的组别。水解体系中还原糖的产生是纤维素酶对秸秆粉中纤维素作用的结果。采用h2o处理,采用复配酶制剂a的还原糖生成量显著高于采用自制纤维素酶ⅱ。采用磷酸处理,采用复配酶制剂a的还原糖生成量显著高于采用自制纤维素酶ⅱ。表5表5中,同一列的不同小写字母表示差异显著(p<0.05)。转化率(%)=生成的还原糖量(g)×0.9×100÷初始纤维素的量(g)。结果见图5。图4中,1、2、3、4的表示同表5。采用h2o处理,采用复配酶制剂a的转化率显著高于采用自制纤维素酶ⅱ。采用磷酸处理,采用复配酶制剂a的转化率显著高于采用自制纤维素酶ⅱ。因此,在初始酶制剂中加入β-葡萄糖苷酶进行复配,使复配酶制剂的β-葡萄糖苷酶酶活比例至优选比例可显著提高其水解秸秆纤维素所产还原糖的量,极大地促进秸秆中纤维素转化成可发酵的糖,从而生产燃料乙醇等化工产品。水解体系在48h以后转化率趋于平缓,不再明显增加。48h时,复配酶制剂a对磷酸前处理的秸秆纤维素的转化率高达21.48%,对h2o浸泡的秸秆纤维素转化率为19.26%,较自制纤维素酶ⅱ的转化率(16.34%)显著提高。二、不同酶负载量下纤维素酶对甜高粱木质纤维素的转化实验1、前处理磷酸处理:秸秆粉和85%的h3po4溶液混合,2℃放置24h,然后用蒸馏水彻底直至中性,过滤收集固相,即为前处理的产物。每1g秸秆粉配比30mlh3po4溶液。2、取100ml三角瓶,加入前处理的产物和蒸馏水,封装后121℃灭菌,然后冷却。3、取供试酶制剂,用0.22μm滤膜过滤除菌,收集滤液。4、完成步骤2后,取所述三角瓶,加入步骤3得到的滤液,50℃、150rpm振荡培养,分别于24h、48h、72h、96h、108h、120h取样,稀释后检测还原糖含量。步骤2中蒸馏水的加入量、步骤4中滤液的加入量均根据进行前处理以前的秸秆粉的干重而定。每g秸秆粉配比10毫升蒸馏水以及不同iu的滤液(0.6iu、1.2iu、1.8iu、2.4iu或3iu)。1iu的计算方式:滤纸酶酶活(u)除以180。每1ml样本稀释液加入3mldns试剂,摇匀,沸水浴煮沸5min,然后迅速冷却至室温,用蒸馏水定容到25ml,然后用酶标仪在540nm波长下测od值。根据od540nm值和式1计算还原糖量。转化率(%)=生成的还原糖量(g)×0.9×100÷初始纤维素的量(g)。结果见表6。108h后,水解基本结束。同时,在108h时,复配酶制剂a负载量为1.8iu/g时对秸秆的转化率达到31.09%,而自制纤维素酶需要负载量为3.0iu/g才能达到该转化率。因此,在初始酶制剂中加入β-葡萄糖苷酶进行复配,使复配酶制剂的β-葡萄糖苷酶酶活比例至优选比例有助其提高对木质纤维素甜高粱秸秆的糖化能力,并且显著降低酶的负载量,即用更少的酶水解生产更多的可发酵糖,从而降低了生物燃料的生产成本。表6当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1