本发明涉及一种基于单分子力谱探测核酸末端结构的方法,具体是一种用于探测核酸自由末端高级结构的单分子力谱方法,属于生物大分子二级以上三维构象或高级结构的力学精密测量领域。
背景技术:
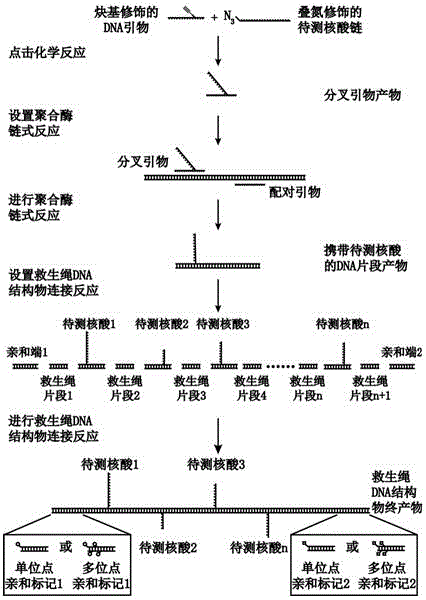
:核酸自由末端的高级结构动态组装研究是rna结构与功能、染色质损伤修复通路以及端粒生物学领域的重要内容。如果能够精密、实时、主动和可重复探测核酸自由末端的高级结构的分子动态,就可以预测rna加工、染色质损伤的修复和易位,以及染色体数目异常等细胞事件,从而深入理解核酸相关疾病或者端粒综合征的病理生理过程和分子生物学机制。目前可用于核酸自由末端高级结构动态组装研究的主要实验手段有:双向凝胶电泳、荧光原位杂交、电镜、超分辨显微镜、原子力显微镜和单分子荧光共振能量转移等。其中电泳和杂交等技术方法能够分离核酸高级结构的不同构象,并且探测核酸自由末端形成的拓扑结构,但是无法达到精密的时空分辨率,也无法对大分子施加外部能量进行可重复的主动探测。电镜、超分辨显微镜和原子力显微镜可以对众多大分子进行精密成像,通过多样本统计进而分析高级结构的非均一组份,但是无法进行实时监测,也无法进行可重复的主动探测。单分子荧光共振能量转移可以高通量探测核酸自由末端的动态构象变化,实现毫秒时间分辨率,但是荧光共振能量转移的适用距离是1-10纳米,不能探测大尺度的分子构象动态,也无法对目标分子施加外力进行可重复的主动探测。单分子力谱是精密、实时、主动、重复探测大分子多态构象变化的最有效手段之一。常用的单分子力谱技术有光镊、原子力显微镜和磁镊等。单分子力谱可以表征多态大分子的非均一构象,尤其是超出荧光共振能量转移检测距离的长链核酸或蛋白。单分子力谱通常能够以毫秒和纳米的时空分辨率探测分子的动态变化。更重要的是,单分子力谱可对目标分子施加外力,从而进行主动探测。单分子力谱目前仅有重复探测末端固定的核酸结构的实验方案,没有简便易行的可重复探测核酸自由末端高级结构动态的实验方法。中国专利cn200710065562.4公开了一种结合磁镊观测生物大分子的全反射近场显微镜,在高分辨率、高精度下实时快速的观察生物大分子。到目前为止,基于单分子力谱探测核酸末端动态的结构的方法未见报道。技术实现要素:本发明的目的在于提供一种基于单分子力谱探测核酸末端结构的方法,可以精密、实时、主动和可重复探测核酸自由末端高级结构。通过结合反应,合成携带待测核酸序列的分叉引物,然后使用分叉引物进行聚合酶链式反应,从而可将两条以上的待测核酸序列锚定于dna救生绳结构上。多条核酸链的自由末端相互作用,形成待测高级结构。通过亲和反应,将携带待测核酸链的dna救生绳结构物固定于两个表面之间。通过对救生绳施加外力,从而获得待测核酸高级构象变化的力学动态轨迹。以轨迹的空间变量作为外力或者时间的函数,本发明可用于探测核酸自由末端高级结构的动态机制。本发明提供的基于单分子力谱探测核酸末端结构的方法具体包括如下步骤:1)待测核酸链的一端携带能进行结合反应的修饰基团,用于锚定在dna救生绳上;无修饰的另一端为核酸的自由末端,将形成待探测的结构;dna引物中间位置的修饰基团与待测核酸链进行结合反应,产物是分叉引物;2)分叉引物经分离、纯化后用于聚合酶链式反应;3)救生绳dna片段为不携带待测核酸链的聚合酶链式反应产物;4)救生绳结构物终产物的制备是将携带待测核酸的聚合酶链式反应产物与救生绳dna片段相间排列,使用连接酶进行共价连接,位于结构物终产物两端的救生绳片段携带亲和性修饰,用于在探测表面锚定结构物;所述的探测表面是微球表面、玻璃表面、原子力显微镜探针或基底表面。5)单分子力谱对锚定于两个表面之间的救生绳dna结构物施加外力,探测待测核酸形成的高级结构,收集包含三维空间位置、力和时间的轨迹数据。步骤1)所述的结合反应是点击化学、酶促连接或者亲和结合。修饰基团取决于选取的结合反应。分叉引物包含两条单链核酸,其一是待测核酸链,其二是可以进行聚合酶链式反应的dna引物。步骤2)所述的聚合酶链式反应的引物之一为分叉引物,携带待测核酸单链。步骤2)所述分离的技术常选凝胶电泳,例如含有7m尿素的聚丙烯酰胺凝胶电泳。纯化技术可以是切胶回收和乙醇沉淀。链式反应的聚合酶有多种选择,优选takara公司的dna聚合酶(primestargxldnapolymerase)。分叉引物及其配对引物确定dna产物长度。待测核酸和聚合酶链式反应dna产物之间无特异性相互作用。步骤3)所述救生绳片段是双链dna,所述的救生绳dna片段的数目大于待测核酸链条数;救生绳dna片段长于其构象持续长度或相关长度,也要长于待测核酸多态构象的最大长度。步骤4)所述的结构物是指单分子力学实验中将操控辅助核酸片段与待测核酸结构连接制备的核酸分子。救生绳结构物两端的亲和性修饰是单位点或者多位点修饰,可选用生物素或地高辛,所述救生绳结构物终产物的共价连接可选用t4dna连接酶。单位点修饰通过引物标记实现。在脱氧核苷酸混合液中掺入生物素或地高辛修饰的脱氧尿嘧啶核苷三磷酸,通过聚合酶链式反应可在救生绳dna片段的多个位点引入修饰。探测表面可以是微球表面、玻璃表面、原子力显微镜探针或者基底表面。步骤5)所述的单分子力谱是但不限于磁镊、光镊和原子力显微镜。所述的待测核酸形成的高级结构是但不限于t-loop、d-loop或r-loop。本发明提供了一种基于单分子力谱探测核酸末端结构的方法,设计了救生绳dna,可以精密、实时、主动和可重复探测核酸自由末端高级结构,拓展了单分子力谱的应用范围。附图说明图1是以点击化学为例制备携带多条待测核酸的救生绳dna结构物流程图。图2是点击化学反应和救生绳dna结构物连接反应的凝胶电泳结果图。(a)是分叉引物1制备结果图。待测核酸链1和中间炔基修饰dna引物1进行点击化学反应,然后使用聚丙烯酰胺变性凝胶(8%,7m尿素)进行电泳分离,经乙醇沉淀获得分叉引物1。(b)是分叉引物2制备结果图。待测核酸链2和中间炔基修饰dna引物2进行点击化学反应,然后使用聚丙烯酰胺变性凝胶(8%,7m尿素)进行电泳分离,经乙醇沉淀获得分叉引物2。(c)是将分叉引物2与生物素修饰上游引物进行分叉聚合酶链式反应获得单位点生物素修饰且携带待测核酸2的dna片段,分叉引物1与地高辛修饰下游引物进行分叉聚合酶链式反应获得单位点地高辛修饰且携带待测核酸1的dna片段,以及救生绳片段。通过限制性内切酶酶切后,t4dna连接酶连接形成救生绳dna结构物。图3是以单分子磁镊为例重复、主动和实时探测核酸末端高级结构的实验设置示意图和两种轨迹数据。(a)是磁镊实验中分子结构示意图。当救生绳dna结构物分子不受力时,待测核酸1和待测核酸2配对形成t-loop高级结构(右图)。当施加足够大的力时,t-loop高级结构被打开,即待测核酸1和待测核酸2分开成为2条单链。(b)是对同一个救生绳dna结构物分子进行5次反复拉伸。(c)的上图是待测核酸1和待测核酸2形成普通的双链配对,力跳实验时双链迅速分开;中图为待测核酸1和待测核酸2形成t-loop高级结构,力跳实验时产生停顿信号;下图为力跳实验时,力随时间变化的形式。具体实施方式下面结合具体实施例对本发明作进一步详细说明。实施例中未注明具体条件的实验方法,通常按照常规条件以及手册中所述的条件,或按照制造厂商所建议的条件;所用的通用设备、材料、试剂等,如无特殊说明,均可从商业途径得到。实施例采用点击化学、两条待测单链dna、生物素和地高辛单位点修饰以及单分子磁镊详述本发明。表1寡核苷酸名称及序列信息寡核苷酸名称序列(5′—3′)备注待测核酸链1ttttatcagattttagggttagggttagggttagggttagggttagatgtagtatgttgagtgt5′叠氮修饰中间炔基修饰dna引物1gcatcgcacgagcatcatacctduccgagcatttdu携带炔基修饰待测核酸链2ctaaccctaaccctaaccctaaccctaaccctaaaatctgataatt3′叠氮修饰中间炔基修饰dna引物2gcatcggctgaggacgagaaacgduaaaatgatatdu携带炔基修饰生物素修饰上游引物agctgcgtcgtttgacatcact5′生物素修饰地高辛修饰下游引物attctggataccaccactta5′地高辛修饰救生绳dna片段上游引物gcatcgcctcagctggcgattattatcttcagg无修饰救生绳dna片段下游引物gcatcgctcgtggatttcgccaacatcattcg无修饰第一步:待测核酸链1是5′末端叠氮修饰的单链dna,其长度为64个碱基。中间修饰了炔基基团的dna引物1,长度为33个碱基。三[(1-苄基-1h-1,2,3-三唑-4-基)甲基]胺(tbta,货号:678937,西格玛奥德里奇中国公司)作为配体,经一价铜离子催化,单链dna的叠氮和炔基通过点击化学反应形成1,3-二取代三唑。点击化学反应的基本配方是11.3ml纯水、5ml10×磷酸缓冲液(ph7.4)、5ml100mmtbta(二甲基亚砜溶解)、2.5ml50mm硫酸铜和6.2ml160mm抗坏血酸钠。基本配方避光反应10分钟后,再加入10ml500mm待测核酸链1和10ml500mm中间炔基修饰dna引物1。反应在30°c下震荡(220转/分)1小时后,再补充添加5ml100mmtbta,2.5ml50mm硫酸铜,6.2ml160mm抗坏血酸钠。点击化学反应在30°c下避光震荡(220转/分),继续进行3小时。最后添加1ml0.5medta终止反应,产物即为分叉引物1。按上述方式,点击化学反应的核酸链底物更换为3′末端叠氮修饰待测核酸链2和中间炔基修饰dna引物2,即可获得分叉引物2。第二步:点击化学反应液离心(12000转/分)10分钟,收集上清液。50ml纯水洗沉淀3次,回收上清。使用8%或者15%的聚丙烯酰胺变性凝胶(8%或15%,7m尿素)进行电泳分离,电压120伏,时间30分钟(8%凝胶)或60分钟(15%凝胶)。使用胶红(gelred)染料显色后,在蓝光切胶仪上切下凝胶中的目标条带,获得含分叉引物1或分叉引物2的胶块。在盛有胶块的离心管中加入0.3m乙酸钠(ph5.2)溶液,盖过胶面,37ºc下震荡(220转/分)4小时以上,也可振荡12小时。将离心管离心(12000转/分)30分钟,收集含有分叉引物1或分叉引物2的胶块上清液,加入2.5倍体积的无水乙醇,-20ºc冷冻1小时。在4ºc下离心(12000转/分)30分钟,收集核酸白色沉淀,并使用1ml70%乙醇漂洗3次,60ºc烘干,纯水溶解,标定浓度至10mm。至此获得分离纯化的分叉引物1和分叉引物2。单位点地高辛修饰且携带待测核酸1的dna片段通过分叉聚合酶链式反应制备。配方如下,在反应管中加入1ml10mm的分叉引物1和与其配对的地高辛修饰下游引物,5ml5ng/ml的链式反应模板λdna(货号:sd0011,赛默飞世尔公司),10ml5´primestargxl缓冲液,4ml2.5mmdntp以及1mlprimestargxldna聚合酶(货号:r050a,宝生物工程公司)和28ml纯水。分叉聚合酶链式反应温控循环为:98ºc1分钟,98ºc10秒,41ºc或者50.4ºc15秒,68ºc60秒,循环32次,最后68ºc5min并终止在4ºc。使用qiaquick试剂盒(货号:28104,qiagen公司)进行产物纯化即可获得含单位点地高辛修饰且携带待测核酸1的dna片段。单位点生物素修饰且携带待测核酸2的dna片段也通过分叉聚合酶链式反应制备。配方如下,在反应管中加入1ml10mm分叉引物1和与其配对的生物素修饰上游引物,5ml5ng/ml的模板λdna,25mlkadaq2´pcrmastermix(货号:g-497,abm公司)和18ml纯水。之后进行分叉聚合酶链式反应。分叉聚合酶链式反应温控循环为:94ºc3分钟,94ºc30秒,41ºc30秒,72ºc50秒,循环35次,最后72ºc5min并终止在4ºc。使用qiaquick试剂盒进行产物纯化即可获得含单位点生物素修饰且携带待测核酸2的dna片段。第三步:救生绳dna片段是不携带待测核酸链的聚合酶链式反应产物。对λdna进行序列分析,选取与待测核酸链无相互作用的区域为模板,设计引物对以确定产物长度,并引入bbvci或bsssai酶切连接位点,进行常规聚合酶链式反应。配方如下:在反应管中加入1ml10mm的救生绳dna片段上游引物和下游引物,5ml5ng/ml的模板λdna,25ml2´taqmastermix(货号:gr501,诺维赞公司)和18ml纯水。聚合酶链式反应温控循环为:94ºc3分钟,94ºc30秒,56ºc30秒,72ºc50秒,循环35次,最后72ºc5min并终止在4ºc。使用qiaquick试剂盒进行产物纯化即可获得救生绳dna片段。第四步:救生绳结构物终产物的制备是将携带待测核酸的聚合酶链式反应产物与救生绳dna片段进行限制性酶切,进而相间排列并使用连接酶进行连接。酶切方案如下,使用10u的bsssai限制性内切酶(货号:r0680l,neb公司)对2mg含单位点地高辛修饰且携带待测核酸1的dna片段在37ºc酶切14小时;使用10u的bbvci限制性内切酶(货号:r0601l,neb公司)对2.63mg含单位点生物素修饰且携带待测核酸2的dna片段在37ºc酶切14小时;使用bsssai和bbvci限制性内切酶(10u)对5.56mg救生绳dna片段在37ºc双酶切14小时。使用cycle-pure试剂盒(货号:d6492-02,e.z.n.a.,omega公司)对酶切产物进行纯化,然后按照如下配方设置连接反应。按照摩尔比例1:0.8:1混合携带待测核酸1的dna片段、救生绳dna片段和携带待测核酸2的dna片段,使用t4dna连接酶在25ºc反应8小时,或者在16ºc连接12-14小时。经2%琼脂糖凝胶电泳分离并切胶后,使用试剂盒(货号:d2500-02,omega公司)纯化回收凝胶中的目标产物。至此获得携带待测核酸的救生绳dna结构物终产物,可用于单分子力谱探测。第五步:单分子力谱探测待测核酸高级结构使用天津光影微纳科技有限公司生产的磁镊装置。救生绳dna结构物固定于两个表面之间。表面之一是抗地高辛抗体包被的盖玻片基底,制备方案如下。使用两片60mm´24mm的洁净盖玻片,制作微流控反应池,中间夹封口膜形成反应孔道。融化于反应孔道玻璃基底上的小球,用作消零和降噪的参照物。玻璃基底上涂布了10ml0.1%硝酸纤维素层,并在室温下浸于100ml100mg/ml抗地高辛抗体(货号:11214667001,西格玛奥德里奇中国公司)。孵育2个小时后,使用100ml5mg/ml牛血清白蛋白进行封闭,4ºc12小时。表面之二是链霉亲和素包被的超顺磁小球(货号:65305,m270,invitrogen公司)。救生绳dna结构物一端通过地高辛-抗体结合于玻璃基底,另一端通过生物素-亲和素结合于小球表面。磁镊施加磁场于超顺磁小球,从而对救生绳dna结构物施加主动的外力(0.01pn–150pn)。磁镊施加的主动外力,大于破坏结构的关键力时,待测核酸自由末端形成的高级结构发生解折叠。磁镊降低外力后,可接近0pn,待测核酸自由末端可再次重复形成高级结构。本例中对同一个救生绳dna结构物分子进行了150次力升和力降的重复主动探测。磁镊的照相机对超顺磁小球进行拍照(频率400赫兹,单张照片曝光时间是2.5毫秒),实时记录小球三维空间位置。至此单分子力谱可重复、主动和实时探测待测核酸自由末端形成的高级结构,并获取了包含三维空间位置、力和时间的轨迹数据,及其长度-力、长度-时间、以及力-时间之间的关系。图1是以点击化学为例制备携带多条待测核酸的救生绳dna结构物流程示意图。通过点击化学反应将叠氮修饰的待测核酸链和中间炔基修饰的dna引物环加成在一起,形成分叉引物产物。之后分叉引物再与其配对引物进行分叉聚合酶链式反应,获得携带待测核酸的dna片段产物。通过普通的pcr扩增获得救生绳片段。所有dna片段经过酶切,将待测核酸和救生绳片段交叉排列,最后在t4dna连接酶的作用下形成救生绳dna结构物终产物。图2是点击化学反应和救生绳dna结构物连接反应的凝胶电泳结果图。图2中(a)是分叉引物1制备结果图。待测核酸链1和中间炔基修饰dna引物1进行点击化学反应,然后使用聚丙烯酰胺变性凝胶(8%,7m尿素)进行电泳分离,经乙醇沉淀获得分叉引物1。图2中(b)是分叉引物2制备结果图。待测核酸链2和中间炔基修饰dna引物2进行点击化学反应,然后使用聚丙烯酰胺变性凝胶(8%,7m尿素)进行电泳分离,经乙醇沉淀获得分叉引物2。图2中(c)是将分叉引物2与生物素修饰上游引物进行分叉聚合酶链式反应获得单位点生物素修饰且携带待测核酸2的dna片段,分叉引物1与地高辛修饰下游引物进行分叉聚合酶链式反应获得单位点地高辛修饰且携带待测核酸1的dna片段,以及救生绳片段。通过限制性内切酶酶切后,t4dna连接酶连接形成救生绳dna结构物。图3是以单分子磁镊为例重复、主动和实时探测核酸末端高级结构的实验设置示意图和两种轨迹数据。图3中,(a)是磁镊实验中分子结构示意图。当救生绳dna结构物分子不受力时,待测核酸1和待测核酸2配对形成t-loop高级结构(右图)。当施加足够大的力时,t-loop高级结构被打开,待测核酸1和待测核酸2分开成为2条单链。图3中,(b)是对同一个救生绳dna结构物分子进行5次反复拉伸。图3中:(c)的上图是待测核酸1和待测核酸2形成普通的双链配对,力跳实验时双链迅速分开;(c)的中图是待测核酸1和待测核酸2形成t-loop高级结构,力跳实验时产生停顿信号;(c)的下图是力跳实验时,力随时间变化的形式。以上所述,仅为本发明的一个实施例,任何根据本发明专利的技术方案及其发明专利构思加以等同替换,都属于本发明专利的保护范围。sequencelisting<110>南开大学<120>基于单分子力谱探测核酸末端结构的方法<130>20181220<160>8<170>patentinversion3.3<210>1<211>64<212>dna<213>人工序列<220><221>gene<222>(1)..(64)<400>1ttttatcagattttagggttagggttagggttagggttagggttagatgtagtatgttga60gtgt64<210>2<211>32<212>dna<213>人工系列<220><221>gene<222>(1)..(32)<400>2gcatcgcacgagcatcatacctccgagcattt32<210>3<211>46<212>dna<213>人工系列<220><221>gene<222>(1)..(46)<400>3ctaaccctaaccctaaccctaaccctaaccctaaaatctgataatt46<210>4<211>33<212>dna<213>人工系列<220><221>gene<222>(1)..(33)<400>4gcatcggctgaggacgagaaacgaaaatgatat33<210>5<211>22<212>dna<213>人工系列<220><221>gne<222>(1)..(22)<400>5agctgcgtcgtttgacatcact22<210>6<211>20<212>dna<213>人工系列<220><221>gene<222>(1)..(20)<400>6attctggataccaccactta20<210>7<211>33<212>dna<213>人工系列<220><221>gene<222>(1)..(33)<400>7gcatcgcctcagctggcgattattatcttcagg33<210>8<211>32<212>dna<213>人工系列<220><221>geng<222>(1)..(32)<400>8gcatcgctcgtggatttcgccaacatcattcg32当前第1页12
