一种调节植物表面蜡质合成的方法与流程
本发明涉及一种调节植物表面蜡质合成的方法,属于分子生物学领域。
背景技术:
植物叶片蒸腾作用包括气孔蒸腾和角质蒸腾。在严重缺水的条件下,植物叶片表皮气孔关闭,气孔导度下降,角质蒸腾成为植物失水的重要途径。角质层是覆盖于陆生植物暴露于地面部分的一个连续的脂类结构疏水层,其表面的表皮蜡质层是植物抵抗外界环境刺激的第一道屏障,通过非水溶性的蜡质限制植物的蒸腾能力,延缓细胞失水速度,防止植物非气孔性水分丧失,从而使其地上组织适应干旱环境及其它非生物和生物逆境。
叶表面蜡质的厚度和超微结构均会影响水分的通透和运输,使角质蒸腾受到影响。而表皮蜡质的不同结构和组成是由蜡质合成基因决定的。近年来随着植物分子生物学技术研究的发展,克隆了许多角质层蜡质合成基因,对植物蜡质基因在植物抗逆性尤其是耐旱方面的作用有了较深入了解。但这些蜡质合成基因的表达调控机制尚未被揭示。因此从蜡质合成的角度出发,利用过表达转基因植物及t-dna插入或rnai突变体研究植物角质层作用,鉴定和筛选能显著提高植物蜡质合成的关键基因,培育耐逆性作物,成为了提高重要作物对干旱等非生物逆境的耐受性的新策略。
技术实现要素:
本发明旨在提供一种调节植物表面蜡质合成的方法,在拟南芥体内过表达des1蛋白,从而使植物叶片和茎的表面蜡质合成增强。
本发明通过转基因技术,调控不同组织和器官的表面蜡质合成,从而建立了在非生物胁迫下存活率更高的转基因植物。
本发明提供了一种调节植物表面蜡质合成的方法,在植物细胞体内过表达des1蛋白,从而使植物叶片和茎的表面蜡质合成增强。
上述方法具体包括以下步骤:
a.在植物细胞中引入半胱氨酸脱巯基酶des1的重组构建体,所述酶的编码基因为at5g28030,可操作性地连接至35s启动子;
b.表达所述基因以调节植物体蜡质合成的水平;
c.将所述植物种植在干旱条件下。
进一步地,所述植物细胞为拟南芥。所述构建体为过表达构建体。本发明通过过表达拟南芥半胱氨酸脱巯基酶编码基因des1,获得了其促使植物表面合成蜡质的新方法。通过对35s::des1的转基因,增强植物不同组织和器官表面的蜡质合成,从而建立了在干旱等非生物胁迫下存活率更高的转基因植物。
本发明提供了采用上述方法产生的转基因植物。
所述的转基因植物,当与未转化的植物和敲除植物相比时,所述植物叶片和茎的蜡质层均显著增加;所述植物具有降低的对干旱胁迫或对非生物胁迫的敏感性。
所述的转基因植物与未转化的植物相比时,所述植物叶片蜡质层厚度增加26-54%,茎蜡质层厚度增加24-42%;
所述的转基因植物与基因敲除植物相比时,所述植物叶片蜡质层厚度增加68-105%,茎蜡质层厚度增加15-31%。
本发明的有益效果:
在正常和干旱条件下,转基因拟南芥植株与未经转化的野生型和该基因的敲除植株相比,具有更厚的蜡质层及更强的抗旱性。
附图说明
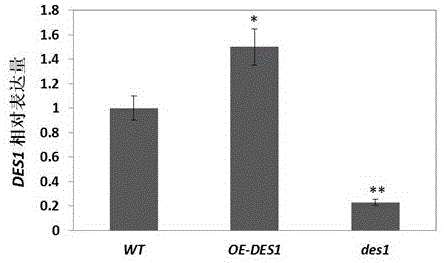
图1为des1基因表达量在oe-des1中显著升高,在des1中显著下降的示意图。
图2为蜡质合成基因的表达量在oe-des1中显著升高,在des1中显著下降的示意图。
图3为叶片表皮细胞厚度在oe-des1中显著增加,在des1中显著减小的微观形貌图。
图4为叶片表皮细胞厚度在oe-des1中显著增加,在des1中显著减小的测量统计分析图。
图5为茎表皮细胞厚度在oe-des1中显著增加,在des1中显著减小的微观形貌图。
图6为茎表皮细胞厚度在oe-des1中显著增加,在des1中显著减小的测量统计分析图。
图7为叶片相对含水量在oe-des1中显著升高,在des1中显著下降的测量统计分析图。
图8为oe-des1抗旱性显著增强,des1抗旱性显著减弱的示意图。
其中:wt为野生型,oe-des1为des1过表达植株,des1为des1敲除突变体。
具体实施方式
下面通过实施例来进一步说明本发明,但不局限于以下实施例。
实施例包括由前述方法产生的植物,包括:des1基因过表达后的转基因植物oe-des1,与未经转化的植物wt和敲除植物des1进行比较时,该植物的叶片和茎表面蜡质显著增加;其中该植物具有降低的对干旱胁迫的敏感性。
实验材料的准备:克隆des1基因(at5g28030),构建35s::des1载体,蘸花法转化拟南芥,潮霉素筛选得到阳性株。单株收种,鉴定,得t3代纯合阳性苗(oe-des1)用于实验;在abrc网站购买des1基因的纯合突变株(salk-205358c),经种植鉴定得纯合敲除突变体(des1);野生型植株(wt,col-0)。
实验材料的鉴定:取生长4周的莲座叶,提取总rna(trizol提取试剂盒,takara公司),反转录为cdna(去基因组反转录试剂盒,abm公司),以看家基因actin为内参,qrt-pcr得到不同材料中des1基因的表达量。des1表达量在oe-des1中显著升高在des1中显著下降(见图1)。
如图1所示,以生长4周的叶片为实验材料,提取总rna,反转录为cdna作为模板。以actin为内参,对des1基因进行荧光定量pcr。对三次独立实验的计算结果进行统计分析,与wt相比,des1的表达量在oe-des1体内显著增加,在des1体内的表达量极显著降低。因此,三种材料符合需要,可用于后续实验。
以下给出本发明的非限定实施例。
实施例1:
增加蜡质合成基因表达量的实验。取生长4周的莲座叶,提取总rna(trizol提取试剂盒,takara公司),反转录为cdna(去基因组反转录试剂盒,abm公司),以肌动蛋白编码基因actin为内参,qrt-pcr得到不同材料中5个主要蜡质合成基因的表达量。蜡质合成基因的表达量在oe-des1中显著升高在des1中显著下降(见附图2)。
如图2所示,以上述得到的cdna为模板,以actin为内参,对蜡质合成途径中的关键基因进行荧光定量pcr。对三次独立实验的计算结果进行统计分析,与wt相比,蜡质合成基因myb94、shn1、wax2和cer1的表达量在oe-des1体内显著增加,cer10的表达量极显著增加;相反,在des1体内基因cer10和cer1的表达量显著降低。说明过量表达des1蛋白可以显著诱导蜡质合成基因的表达。
实施例2:
增加叶片表皮蜡质的实验。取生长4周的莲座叶,faa固定液固定,石蜡切片,番红固绿染色,显微观察拍照(olympus),测量表皮细胞厚度(imagej)。结果显示突变体des1的叶片表皮厚度最小,其次是野生型wt,而oe-des1的叶片表皮厚度最大。经spss统计分析,三种材料的表皮细胞厚度均有显著差异(见附图3和4)。即des1基因显著增加叶片表皮蜡质的厚度。
如图3所示,以生长4周的植物叶片为实验材料,faa固定液固定,利用石蜡切片法进行切片,番红固绿染色后进行显微观察。发现所有的表皮细胞外面都包被一层蜡质,oe-des1的蜡质层最丰富,wt次之,突变体des1的最少;如图4所示,为了便于操作,测量表皮细胞及其表面蜡质层的总厚度。选取3个独立植株的叶片,共100个视野进行测量,然后spss统计分析。与wt相比,oe-des1的叶片表皮及蜡质层厚度极显著增加,增加约40%;与wt相比,des1的表皮及蜡质层厚度显著减小,降低约25%。即des1蛋白的过量表达可以显著增加叶片表面蜡质的合成;反之,会显著抑制蜡质合成。
实施例3:
增加茎表皮蜡质的实验。取生长4周的茎,faa固定液固定,石蜡切片,番红固绿染色,显微观察拍照(olympus),测量表皮细胞及其蜡质层额厚度(imagej)。结果显示突变体des1的茎表皮厚度最小,其次是野生型wt,而oe-des1的茎表皮厚度最大。经spss统计分析,三种材料的表皮细胞厚度具有显著差异(见附图5和6)。即des1基因显著增加茎表皮蜡质的厚度。
如图5所示,以生长4周植物的茎为实验材料,faa固定液固定,利用石蜡切片法进行切片,番红固绿染色后进行显微观察。发现所有的表皮细胞外面均包被一层蜡质,与叶片相比较蜡质较少。但仍然oe-des1的蜡质层最丰富,wt次之,突变体des1的最少;如图6所示,为了便于操作,测量表皮细胞及其表面蜡质层的总厚度。选取3个独立植株的茎,共100个视野进行测量,然后spss统计分析。与wt相比,oe-des1的茎表皮及蜡质层厚度显著增加,增加约30%;与wt相比,des1的表皮及蜡质层厚度无显著变化。即des1蛋白的过量表达可以显著增加茎表面蜡质的合成。
实施例4:
增加相对含水量的实验。取生长4周的莲座叶片,立即称其鲜重,保证叶片完整,立即浸入蒸馏水中,密闭,保持黑暗,23℃,浸泡5-8h,然后去掉叶片表面的水,称重,即为饱和鲜重,将该叶片放入沸水中,杀青30min,后80℃烘干至质量不再变化,称重,此时为干重,根据公式计算相对含水量(rwc)=(鲜重-干重)/(饱和鲜重-干重)×100%。结果显示,oe-des1的相对含水量较wt显著增加,而des1的显著降低(见附图7)。即des1基因显著增加叶片的相对含水量。
如图7所示,以生长4周的叶片为实验材料,进行相对含水量的计算,对三次独立实验的结果进行统计分析。结果显示,与wt相比,oe-des1的叶片相对含水量显著增加,而des1的显著降低。即des1蛋白的过量表达显著增加叶片的相对含水量,反之叶片相对含水量显著减少。
实施例5:
增强植物抗旱性的实验。生长6周的植株,连续干旱10天,拍照。结果显示,wt叶片萎蔫,oe-des1叶片生长正常,des1叶片严重萎蔫(见附图8)。即des1基因显著增强植株的抗旱性。
如图8所示,生长6周的植株,浇足水后连续干旱10天,观察拍照。结果显示,wt叶片发生卷曲,开始失绿;oe-des1叶片生长正常,des1叶片严重萎蔫,且大部分叶片变黄。即des1蛋白的过量表达显著增强植株的抗旱性。
由以上结果可知,des1基因能显著增加蜡质合成基因的表达,显著促进叶片和茎的表皮蜡质合成,显著增加相对含水量,从而显著增强植物的抗旱性。
在上述实施例中,对本发明的实施方式做了描述,很显然,在本发明的发明构思下,仍可作出很多变化的应用。如蜡质增加可以降低植物遭受病虫害威胁的几率。因此,在本发明构思下做出的任何改变都将属于本发明的保护范围。
序列表
<110>山西大学
<120>一种调节植物表面蜡质合成的方法
<160>1
<170>siposequencelisting1.0
<210>1
<211>972
<212>dna
<213>拟南芥(arabidopsisthaliana)
<400>1
atggaagaccgcgtcttgatcaagaacgatgtcactgaattgataggtaacacaccaatg60
gtgtatctaaataaaattgtggatggttgtgtggctcgtattgctgccaagcttgagatg120
atggagccttgctctagcatcaaagatagaatcgcatatagtatgatcaaagatgctgaa180
gacaaaggattgattactccgggaaagagtacattgattgaggcaacgggtggtaacacc240
gggattggtttagccagcatcggggcttcaagaggttataaagtgatccttttgatgcct300
tcaacaatgagtttagaaaggagaatcattctaagagcattaggtgcagaggttcatctc360
actgacattagcataggcattaaaggacagttggagaaagctaaagagatattaagcaaa420
actcccggtggttacataccacaccagtttattaatcctgaaaatccagagattcattat480
agaaccacgggtccggagatttggagagattcagcagggaaagtagatatcttagtcgcc540
ggtgttggaactggtggaacggttactggaacagggaagtttcttaaagaaaagaacaaa600
gatattaaggtttgtgtggtggaaccttccgaaagtgcggtactcagcggaggaaaacca660
ggtccacatttgatccaaggaataggctctggtgaaattccagccaatttggacttaagc720
attgttgatgaaatcattcaagtgactggtgaggaagctattgaaacaaccaagcttctt780
gctatcaaagaaggattattggttggaatatcctctggagcctcagctgcggctgcgtta840
aaggttgcaaagcggcctgaaaacgtagggaaactcattgtggttatttttcctagtgga900
ggagaacgttatttatcgactgaattgttcgagtcagtcagatatgaagctgagaatttg960
ccagttgaatga972
- 还没有人留言评论。精彩留言会获得点赞!