TDP-43蛋白病诊断和治疗的新靶点的制作方法
本发明涉及医药技术领域,特别是涉及一种用于开发tdp-43蛋白病(tdp-43proteinopathies)诊断手段及治疗药物的新靶点。
背景技术:
tdp-43蛋白病(tdp-43proteinopathies),是一组致命性的、累及多种神经元包括运动神经元的神经退行性疾病。铜/锌超氧化物歧化酶1(cu/znsod1)基因在家族性肌萎缩侧索硬化症(amyotrophiclateralsclerosis,als)患者中发生突变,是第一个被鉴定出的als相关基因。接下来又发现了十几个与als有关联的基因,其中包括rna/dna结合蛋白tdp-43和fus。tdp-43全称为tardna-bindingprotein43kda。许多神经系统疾病检测到具有tdp-43免疫阳性的包涵体,因此从病理角度讲,这些疾病可以归类为tdp-43蛋白病。这些疾病在遗传上和临床上都是异质性的。根据累及的区域不同,tdp-43蛋白病可以表现为运动神经元疾病(如als-tdp-43)、额颞叶变性病(frontotemporallobardegeneration/dementia,ftld-tdp-43)、包涵体肌病(inclusionbodymyopathy,ibm)和部分的阿尔茨海默病(alzheimer’sdisease,ad)。有意思的是,尽管在als-tdp患者中发现了40多个tdp-43基因突变,但是在绝大多数散发性或家族性ftld-tdp-43病例中还没有检测到任何tdp-43本身的基因突变。近来研究发现,超过50%的ad病例中有tdp-43蛋白的异常沉积,说明tdp-43包涵体形成可能是多种神经退行性疾病的共同病理机制。
目前已建立的几个模型可用来模拟tdp-43蛋白病,这些模型包括从单细胞的酵母到多细胞的果蝇及脊椎动物。对于tdp-43蛋白病的诊断和治疗,仍然需要继续进行深入研究。
技术实现要素:
发明人对tdp-43蛋白病进行了研究,发现了对于所述疾病的新的诊断、预防和/或治疗方法及新的靶点。
在一些实施方案中,本发明提供tdp-43蛋白病的诊断、预防和/或治疗方法,所述方法包括向有此需要的受试者施用有效量的tdp-43基因及其产物和衍生物的结合剂和/或调节剂。
在一些实施方案中,本发明提供tdp-43基因及其产物和衍生物的结合剂和/或调节剂用于诊断、预防和/或治疗tdp-43蛋白病的诊断剂和/或药物的用途。tdp-43基因及其产物和衍生物的结合剂和/或调节剂(或称为结合因子和/或调控因子,本文中有时简称为tdp-43结合剂和/或调节剂,或者tdp-43结合因子和/或调控因子)包括例如tdp-43基因、tdp-43基因产物或其衍生物的结合剂和/或调节剂,包括例如降低tdp-43基因表达的调节剂,包括例如降低tdp-43基因产物或其衍生物含量的调节剂、降解tdp-43基因产物或其衍生物的蛋白酶、核酸酶及相关因子,包括例如线粒体蛋白酶lonp1及相关调控因子,例如提高lonp1基因表达的调节剂,提高lonp1蛋白含量或其活性的调节剂。在一些实施方案中,鉴于能够结合和/或调节lonp1基因及其产物和衍生物来间接结合和/或调节tdp-43基因及其产物和衍生物,本文所述tdp-43基因及其产物和衍生物的结合剂和/或调节剂在广泛意义上包括lonp1基因及其产物和衍生物的结合剂和/或调节剂。在一些实施方案中,tdp-43和/或lonp1基因产物(tdp-43和/或lonp1蛋白)的衍生物包括tdp-43和/或lonp1蛋白变体,例如与野生型tdp-43蛋白和/或lonp1蛋白(例如seqidno:1所示的tdp-43蛋白和/或seqidno:4所示的lonp1蛋白)相比具有一个或多个氨基酸置换、缺失和/或插入产生的蛋白变体。在一些实施方案中,所述衍生物与野生型蛋白相比具有例如1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、15个、20个或更多个氨基酸置换,例如保守置换。在一些实施方案中,所述衍生物与野生型蛋白相比具有例如1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、15个、20个或更多个氨基酸可以被去除或添加到天然肽序列上。在一些实施方案中,lonp1蛋白衍生物保留了野生型蛋白的活性,或与野生型蛋白相比提高的活性,例如酶活性和/或降解tdp-43的活性。在一些实施方案中,tdp-43蛋白衍生物导致线粒体损伤和/或tdp-43蛋白病。
在一些实施方案中,tdp-43和/或lonp1基因产物(tdp-43和/或lonp1蛋白)的衍生物或变体与参比蛋白(例如野生型蛋白或亲本蛋白)可以具有一个或多个保守氨基酸置换。保守氨基酸置换是氨基酸残基被带有具有相似理化性质的侧链的氨基酸残基置换。本领域中已知具有相似侧链的氨基酸残基,例如带有碱性侧链的氨基酸(例如,赖氨酸、精氨酸、组氨酸),带有酸性侧链的氨基酸(例如,天冬氨酸、谷氨酸),带有不带电荷的极性侧链的氨基酸(例如,甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸),带有非极性侧链的氨基酸(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸),带有β分支侧链的氨基酸(例如,苏氨酸、缬氨酸、异亮氨酸)和带有芳香族侧链的氨基酸(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)。在一些实施方案中,tdp-43和/或lonp1基因产物(tdp-43和/或lonp1蛋白)的衍生物或变体与参比蛋白(例如野生型蛋白或亲本蛋白)可以具有至少约50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的氨基酸同一性。序列同一性可以通过本领域已知的程序例如gap、bestfit、fasta、clustalw、blast使用默认参数比对。
在一些实施方案中,当用于诊断时,本发明可以采用tdp-43结合剂。在一些实施方案中,tdp-43结合剂以最广意义上使用,可以包括例如特异性结合tdp-43和/或lonp1的试剂如抗体。在一些实施方案中,已经发现能够通过检测tdp-43或其衍生物的存在(例如其在线粒体中的存在)来诊断tdp-43蛋白病和/或确定所述疾病的进展和/或治疗效果。在一些实施方案中,已经发现tdp-43蛋白病患者中lonp1蛋白水平显著上调,因此能够通过检测lonp1蛋白水平来诊断tdp-43蛋白病,或确定疾病进展,或确定疾病治疗效果。在一些实施方案中,本发明涉及通过特异性结合lonp1蛋白的试剂如抗体来诊断tdp-43蛋白病和/或确定所述疾病的进展和/或治疗效果。在一些实施方案中,已经利用免疫共沉淀方法检测发现tdp-43蛋白lonp1蛋白存在直接相互作用。因此,在一些实施方案中,可以通过检测lonp1的存在间接检测tdp-43的存在和含量。在一些实施方案中,本发明所述tdp-43结合剂包括特异性结合lonp1的试剂例如抗体。在一些实施方案中,所述结合剂包括特异性结合tdp-43和lonp1二者的试剂如抗体。在一些实施方案中,所述结合剂用于检测线粒体内tdp-43蛋白或其衍生物的存在。在一些实施方案中,所述抗体可以通过可检测的标记物进行检测和/或定量。在一些实施方案中,可检测的标记物没有特别限制,例如用荧光标记物如吖啶酯标记,例如通过接头如生物素-亲和素与荧光标记物如吖啶酯标记。在一些实施方案中,所述标记可以包括但不限于荧光标记,发色团标记,电子致密标记,化学发光标记,和放射性标记,以及间接标记如酶或配体,例如,通过酶促反应或分子相互作用来间接检测。在一些实施方案中,示例性标记包括但不限于放射性同位素,荧光团,罗丹明及其衍生物,荧光素酶,荧光素,辣根过氧化物酶(hrp),碱性磷酸酶,β-半乳糖苷酶,葡糖淀粉酶,溶菌酶,糖类氧化酶,例如,葡萄糖氧化酶,半乳糖氧化酶,和葡萄糖-6-磷酸脱氢酶,生物素/抗生物素蛋白,自旋标记,噬菌体标记等等。
在一些实施方案中,本发明包括用于诊断tdp-43蛋白病的试剂盒。在一些实施方案中,所述试剂盒可以包括例如固相,如磁性颗粒,胶乳粒子和微量滴定板;tdp-43和/或lonp1的试剂如抗体或其片段,如fab,fab′,f(ab′)2,fd,fv,互补决定区(cdr)片段,单链抗体(例如,scfv),双价抗体或结构域抗体。在一些实施方案中,可以将抗体包被固相如磁珠,然后用标记的抗体与结合在反应板上的抗原再次结合,经显色后读取结果。在一些实施方案中,本发明的抗体可以用于包被固相如磁珠或用作标记的第二抗体。在一些实施方案中,抗体或其抗原结合片段固定到一个表面上,例如固相支持物上,例如塑料、膜如硝酸纤维素膜、玻璃、磁珠或金属支持物。在一些实施方案中,来自受试者的样品与所述固相支持物接触,然后接触带有可检测标记的抗体指示剂显色。在一些实施方案中,来自受试者的样品可以包括健康或病理状态的生物组织、细胞或体液,例如血液样品,例如血浆、血清、血制品等。
在一些实施方案中,本发明包括tdp-43蛋白病的预防和/或治疗方法或相应用途。在一些实施方案中,tdp-43蛋白病的预防和/或治疗可以通过施用tdp-43结合剂和/或调节剂(例如抑制剂)来进行。在一些实施方案中,本发明所述tdp-43结合剂和/或调节剂以最广泛意义使用,可以包括小分子化合物、tdp-43蛋白抗体、lonp1蛋白抗体、融合蛋白或基因药物,例如降低tdp-43基因表达的调节剂包括例如rnai、利用同源重组进行基因敲除、利用crispr/cas9进行基因编辑的试剂;例如降低tdp-43基因产物或其衍生物的调节剂包括小分子化合物,tdp-43蛋白抗体、lonp1蛋白抗体或融合蛋白;例如降解tdp-43基因产物或其衍生物的蛋白酶包括线粒体蛋白酶lonp1,例如seqidno:4所示的线粒体蛋白酶lonp1,例如提高lonp1基因表达的调节剂,提高lonp1蛋白含量或其酶活性的调节剂。在一些实施方案中,所述tdp-43调节剂以最广意义使用,包括例如降低tdp-43蛋白或其衍生物的含量(例如线粒体内tdp-43蛋白或其衍生物的含量)的物质(包括例如lonp1蛋白本身),也包括通过激活lonp1蛋白或增加lonp1蛋白的表达而间接调节tdp-43的物质。在一些实施方案中,所述调节剂与不含所述调节剂的对照或其它对照试剂(如已知用于治疗tdp-43蛋白病的对照药物)相比能够降低tdp-43蛋白的含量(例如线粒体内tdp-43蛋白的含量),例如降低5%,10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或更多。
在一些实施方案中,本发明所述tdp-43基因产物或其衍生物包括tdp-43蛋白野生型(wt)或其变体,例如als突变型(a315t,a315e及其他als相关突变),例如seqidno:1所示的tdp-43蛋白野生型序列,seqidno:2所示的tdp-43蛋白a315t突变体序列,seqidno:3所示的tdp-43蛋白a315e突变体序列。
在一些实施方案中,本发明所述tdp-43结合剂和/或调节剂降低线粒体中tdp-43蛋白或其衍生物的含量。在一些实施方案中,所述结合剂和/或调节剂1)特异性结合和/或调节tdp-43基因或蛋白,2)特异性结合和/或调节lonp1基因或蛋白,或者3)特异性结合和/或调节tdp-43蛋白和lonp1蛋白二者;例如a)在线粒体中特异性结合和/或调节上述基因和/或蛋白,例如b)由此检测tdp-43蛋白或其衍生物的存在和/或含量,例如c)由此降低tdp-43蛋白或其衍生物的含量,例如d)由此提高lonp1基因的表达,或者提高lonp1的含量或活性,例如e)由此诊断tdp-43蛋白病,例如f)由此治疗tdp-43蛋白病。在一些实施方案中,本发明尤其涉及通过lonp1基因和/或蛋白的结合和/或调节来诊断、预防和/或治疗tdp-43蛋白病。
在一些实施方案中,本发明所述tdp-43蛋白病可以包括下述一种或多种:1)在细胞质中出现tdp-43蛋白免疫阳性的包涵体,2)线粒体中tdp-43蛋白积累和/或导致线粒体损伤或损伤加重;和/或3)tdp-43蛋白野生型或其变体如a315t-突变型过量表达,导致线粒体缺陷。
在一些实施方案中,本发明包括检测线粒体内tdp-43蛋白和lonp1蛋白之间的相互作用,例如直接相互作用,以诊断tdp-43蛋白病;或者通过所述lonp1蛋白调节例如降低所述tdp-43蛋白的含量,例如在线粒体内的含量,以治疗tdp-43蛋白病。
在一些实施方案中,本发明所述tdp-43蛋白病可以包括tdp-43相关的神经退行性疾病,其可以是tdp-43突变和/或表达异常导致的疾病。在一些实施方案中,所述疾病包括例如tdp-43相关的痴呆、认知障碍(包括阿尔茨海默病(ad)和额颞叶退行性变(ftld-tdp))、运动神经元疾病(如肌萎缩性侧索硬化(als-tdp))和包涵体肌病(ibm)。
在一些实施方案中,本发明所述tdp-43结合剂和/或调节剂能够:1)与tdp-43蛋白和/或lonp1蛋白结合;2)增强tdp-43蛋白与lonp1蛋白之间的相互作用;3)降低tdp-43蛋白或其衍生物含量和/或提高lonp1蛋白含量;和/或4)降低tdp-43基因和/或提高lonp1基因的表达。
在一些实施方案中,本发明所述tdp-43结合剂和/或调节剂可以以lonp1蛋白为对象,例如可以是提高lonp1基因表达或其蛋白酶活性的小分子药物。
在一些实施方案中,本发明提供用于诊断、预防和/或治疗tdp-43蛋白病的试剂盒,其包含本文描述的tdp-43结合剂和/或调节剂。
在一些实施方案中,在一些实施方案中,本发明提供药物组合物和/或试剂盒,其包括1)tdp-43结合剂和/或调节剂,和2)药用载体。在一些实施方案中,tdp-43结合剂和/或调节剂可以与另外的治疗剂联合使用。在一些实施方案中,另外的治疗剂包括治疗tdp-43蛋白病治疗剂。在一些实施方案中,本发明提供药物组合物和/或试剂盒还可以包括一种或多种另外的tdp-43蛋白病治疗剂。在一些实施方案中,例如试剂盒可以包括容器,和使用说明书。在一些实施方案中,合适的容器包括例如瓶子或注射器。在一些实施方案中,组合物和/或试剂盒可以包括含有tdp-43结合剂和/或调节剂的第一容器,和含有其它组合物的第二容器,和任选的含有更多其它组合物的更多容器。在一些实施方案中,制品、组合物或试剂盒还可以包含含有药用缓冲液、稀释剂、载体的容器。在一些实施方案中,还可包括其他材料,如滤器、针头和注射器。在一些实施方案中,药用载体是指药物中不同于活性成分的成分,其对个体是无毒的。在一些实施方案中,药用载体包括缓冲剂、赋形剂、稳定剂或防腐剂。
在一些实施方案中,本发明所述的治疗包括改变被治疗的个体的临床进程,并且可以包括预防或临床病理水平改善。治疗包括但不限于防止疾病发生或复发,缓和症状,消除疾病的直接或间接病理后果,降低疾病进展速率,改善或减轻疾病状态,和改善的预后。在一些实施方案中,本发明的药物用于治疗和/或预防相关疾病,和/或用于延缓疾病的发生或减缓疾病的进展。
在一些实施方案中,为了预防或治疗疾病,本发明的药物的合适剂量可以通过待治疗疾病的类型、疾病的严重性和进程、药物以预防目的给药还是以治疗目的给药、以前的治疗、患者的临床病史和对所述药物的应答等因素确定。药物可以通过一次或多次分别给药,或通过连续输注。治疗的进展可以通过常规技术和测定来监测。
本发明的药物可以通过任何适当的方法使用,包括例如口服、静脉内、胃肠外、经皮、皮下、阴道内、腹膜内、鼻内、粘膜、舌下、局部或直肠给药以及它们的任何组合。在一些实施方案中,给药途径包括静脉内、肌内、皮内、腹膜内、皮下、或其它不经肠道的施用途径,例如通过注射或输注。在一些实施方案中,注射途径包括但不限于静脉内、肌内、动脉内、硬膜内、眶内、心内、皮内、腹膜内、经气管的、皮下、表皮下、关节内、蛛网膜下、脊柱内、硬膜外和胸骨内的注射和输注。在一些实施方案中,可以通过局部的、表皮的或粘膜的施用途径给药。
在一些实施方案中,本发明提供一种诊断、预防和/或治疗tdp-43蛋白病的方法,所述方法包括向有此需要的受试者施用tdp-43结合剂和/或调节剂。在一些实施方案中,本发明涉及tdp-43结合剂和/或调节剂用于预防和/或治疗tdp-43蛋白病的用途。在一些实施方案中,本发明涉及tdp-43结合剂和/或调节剂,其用于诊断、预防和/或治疗tdp-43蛋白病。在一些实施方案中,本发明涉及tdp-43结合剂和/或调节剂在制备诊断、预防和/或治疗tdp-43蛋白病的试剂、制品、组合物、制剂和/或试剂盒中的用途。
本发明提供了一种用于开发tdp-43蛋白病(tdp-43proteinopathies)诊断手段及治疗药物的新靶点。
在一些实施方案中,在tdp-43蛋白病(tdp-43proteinopathies)的病理样本中,线粒体出现损伤或损伤加重,这些损伤的线粒体中有tdp-43蛋白形成的电子致密物出现;在体内过表达野生型wt-或a315t/e-突变型tdp-43蛋白,导致线粒体缺陷。
在一些实施方案中,所述tdp-43蛋白和所述lonp1蛋白之间的相互作用是在线粒体内发生的;所述tdp-43蛋白和所述lonp1蛋白之间的相互作用为直接相互作用;所述lonp1蛋白可降解所述tdp-43蛋白;所述lonp1蛋白对所述tdp-43蛋白在线粒体内的含量有调节作用。
在一些实施方案中,所述tdp-43蛋白在线粒体内积累,引发线粒体膜电位降低、呼吸链复合物i和iv活性下降、活性氧升高,神经细胞的线粒体尺寸变小、嵴肿胀等形态异常,并引发神经退行性疾病的发生。
在一些实施方案中,本发明的新靶点开发的诊断手段及治疗药物能用于诊断、预防和治疗tdp-43蛋白病。
在一些实施方案中,所述药物为小分子化合物、tdp-43蛋白抗体、lonp1蛋白抗体、融合蛋白或基因药物。
在一些实施方案中,所述药物能与tdp-43蛋白或lonp1蛋白结合、增强tdp-43蛋白与lonp1蛋白之间的相互作用,或者降低tdp-43基因,或者提高lonp1基因的表达。
在一些实施方案中,所述药物包括以所述lonp1蛋白为对象,合成增强lonp1基因表达或提高lonp1蛋白酶活性的小分子药物。
本发明发现在多种tdp-43蛋白病(tdp-43proteinopathies)患者脑组织中tdp-43蛋白定位于线粒体,引发线粒体碎片化或损伤,进而发生神经退行性疾病,如肌萎缩侧索硬化症(amyotrophiclateralsclerosis,als-tdp)及额颞叶痴呆(ftld-tdp)和约50%的阿尔茨海默病(ad)等tdp-43蛋白病(tdp-43proteinopathies)。
本发明提供的数据显示,在tdp-43蛋白病(tdp-43proteinopathies)患者脑组织中线粒体出现损伤,tdp-43蛋白形成的聚集物出现在损伤的线粒体中;并且als疾病相关基因突变导致tdp-43蛋白进入线粒体内的量增加,而线粒体蛋白酶lonp1参与调节线粒体内tdp-43的含量,这与tdp-43蛋白病(tdp-43proteinopathies)的发生密切相关。以该tdp-43蛋白和/或lonp1蛋白为靶点可以开发tdp-43蛋白病(tdp-43proteinopathies)的诊断手段及治疗药物。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图,其中:
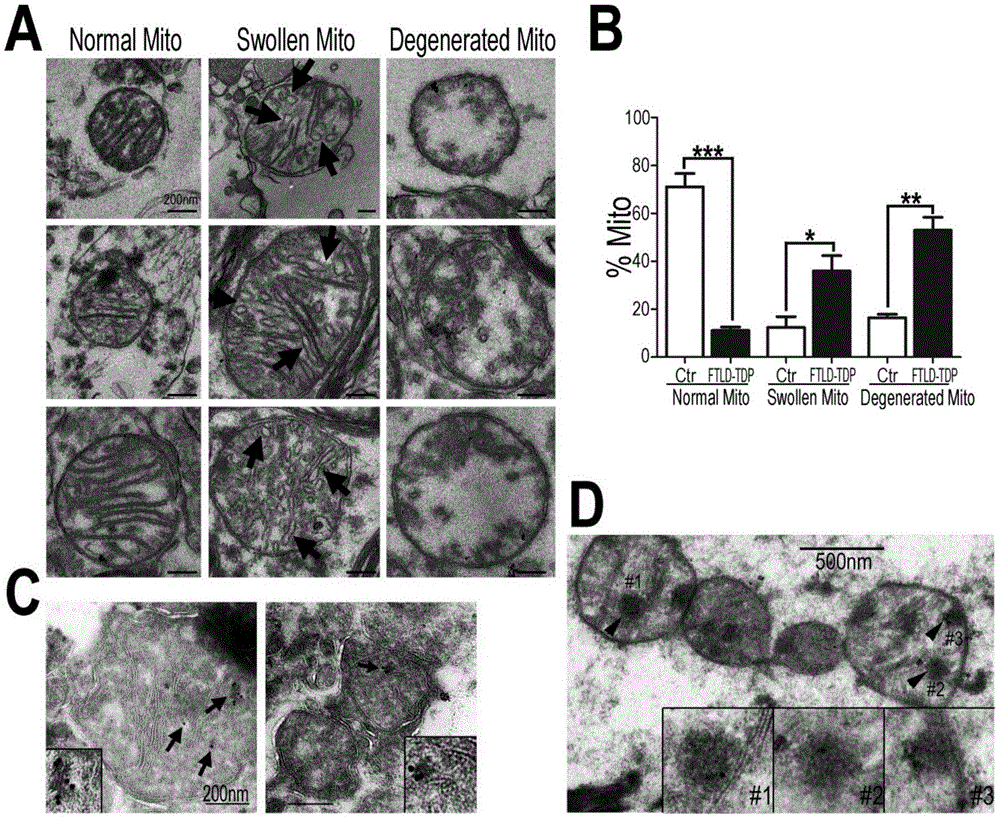
图1是本发明中在五例tdp-43蛋白病(tdp-43proteinopathies)患者脑组织样本中出现线粒体损伤,表现为线粒体嵴肿胀、内膜结构丢失等;且tdp-43蛋白形成的电子致密物定位于损伤的线粒体内。图1a为对照组及ftld-tdp患者组脑样本电镜图像,标尺为200nm;图1b为图1a的统计结果,相较于对照组脑样本,ftld-tdp患者中,嵴肿胀或内膜结构退化的线粒体明显增加,而正常形态的线粒体明显减少。每例脑样本至少统计了100个线粒体,数据统计分析使用student′s-t检验方法,*:p<0.05;**:p<0.01;图1c为免疫电镜检测ftld-tdp病理样本,显示tdp-43蛋白(10nm免疫胶体金颗粒))可以定位于线粒体内(黑色箭头指示位置);图1d为电镜下发现,在部分ftld-tdp病理样本的线粒体内可以检测到tdp-43抗体标记的电子致密结构(黑色箭头指示位置)。
图2是本发明中在哺乳动物细胞中表达野生型或突变型(a315t)tdp-43蛋白基因,观察到tdp-43蛋白定位于线粒体,并导致细胞线粒体内部形态结构变化,且线粒体合成atp的能力显著降低。图2a向hek293稳定细胞株培养基中添加1μ定/ml四环素诱导野生型(wt)或als疾病突变型(a315t)tdp-43蛋白表达36h,纯化线粒体后进行westernblot检测发现,外源的tdp-43可以在线粒体组分中被检测到。线粒体的纯度由westernblot检测,其组分中只含有线粒体的指示蛋白atp5a1,但不含有细胞质指示蛋白gapdh。细胞内源性表达的tdp-43也被检测到定位于线粒体上(endo指示处);图2b向hek293稳定细胞株培养基中添加1μ定/ml四环素诱导野生型(wt)或als疾病突变型(a315t)tdp-43蛋白表达24h,对细胞进行常规电镜观察;图2c定量统计结果显示,表达tdp-43蛋白的细胞线粒体横截面积变小,这种变化在表达突变型(a315t)tdp-43蛋白的细胞中更加明显。每组至少统计了100个线粒体,数据分析使用的是one-wayanova,继之以bonferroni多重比较,***:p<0.001。图2d统计结果显示,表达tdp-43蛋白的细胞有更多的线粒体呈现为异常形态(主要表现为线粒体嵴肿胀),这种现象在表达突变型(a315t)tdp-43蛋白的细胞中尤为明显。数据代表三次重复实验结果,数据分析使用的是one-wayanova,继之以bonferroni多重比较,***:p<0.001。图2e线粒体atp合成实验显示,tdp-43蛋白的表达导致线粒体合成atp的速率明显下降。数据代表三次重复实验结果,数据分析使用的是one-wayanova,继之以bonferroni多重比较,***:p<0.001。图2f全细胞atp检测实验显示,tdp-43蛋白的表达对细胞整体的atp水平没有明显影响。数据代表三次重复实验结果,数据分析使用的是one-wayanova,继之以bonferroni多重比较,nc:p>0.05。
图3是本发明中在哺乳动物细胞中表达野生型或突变型(a315t)tdp-43蛋白的基因,使线粒体呼吸链复合物i和iv的活性受到抑制。图3a为线粒体呼吸链复合物i活性实验,tdp-43蛋白表达导致呼吸链复合物i活性显著抑制。图3b为线粒体呼吸链复合物ii活性实验,tdp-43蛋白表达未对呼吸链复合物ii的活性产生明显影响。图3c为线粒体呼吸链复合物iii活性实验,tdp-43蛋白表达未对呼吸链复合物iii的活性产生明显影响。图3d为线粒体呼吸链复合物iv活性实验,tdp-43蛋白表达导致呼吸链复合物iv的活性受到一定程度的影响,其中疾病突变型(a315t)tdp-43蛋白的表达对于呼吸链复合物iv的影响更显著些。图3e为线粒体呼吸链复合物v(atp合成酶)活性实验,tdp-43蛋白表达未对呼吸链复合物v的活性产生明显影响。数据代表三次重复实验结果,数据分析使用的是one-wayanova,继之以bonferroni多重比较,nc:p>0.05;*:p<0.05;***:p<0.001。
图4是本发明中在果蝇的运动神经元细胞中表达野生型或突变型(a315t)tdp-43蛋白基因,导致细胞中的线粒体碎片化(mitochondrialfragmentation)等线粒体损伤表型。图4a为激光共聚焦显微镜视野下,果蝇三龄幼虫的胸节神经节(vnc)中线粒体绿色荧光蛋白(mitogfp)标记的运动神经元胞体内线粒体图像。绿色通道(mito):线粒体定位的绿色荧光蛋白标记的线粒体;红色通道(rfp):红色荧光蛋白或红色荧光蛋白标记的tdp-43蛋白。图4b对果蝇幼虫运动神经元胞体内线粒体形态进行统计发现,表达人源tdp-43蛋白导致更多的运动神经元胞体线粒体网络呈现异常形态,这种现象在表达疾病相关突变型(a315t)tdp-43蛋白的果蝇幼虫中尤其明显。每组统计了至少20只果蝇幼虫。图4c激光共聚焦显微镜视野下,果蝇三龄幼虫的a3体节段运动神经元轴突束中线粒体绿色荧光蛋白标记的线粒体图像。白色虚线标记出轴突束区域。图4d对果蝇幼虫运动神经元轴突束内线粒体长度分布进行统计发现,表达人源tdp-43蛋白导致长线粒体数量减少而短线粒体数量增加,这种现象在表达疾病相关突变型(a315t)tdp-43蛋白的果蝇幼虫中尤其明显。每组至少统计了30只果蝇幼虫。图4e对果蝇幼虫运动神经元轴突束内线粒体平均长度进行统计发现,表达人源tdp-43蛋白导致线粒平均长度变短,这种现象在表达疾病相关突变型(a315t)tdp-43蛋白的果蝇幼虫中尤其明显。每组至少统计了30只果蝇幼虫。图4f对果蝇幼虫运动神经元轴突束内线粒体分布区域所占比例进行统计发现,表达人源tdp-43蛋白导致长线粒体分布密度显著降低,这种现象在表达疾病相关突变型(a315t)tdp-43蛋白的果蝇幼虫中尤其明显。每组至少统计了30只果蝇幼虫。数据代表三次重复实验结果,数据分析使用的是one-wayanova,继之以bonferroni多重比较,*:p<0.05;**:p<0.01;***:p<0.001。果蝇基因型:ctr:ok371-gal4/uas-rfp/uas-mitogfp;wt:ok371-gal4/uas-wt-tdp-43-rfp/uas-mitogfp:a315t:ok371-gal4/uas-a315t-tdp-43-rfp/uas-mitogfp。
图5是本发明中在果蝇的视杆神经元表达野生型或突变型(a315t)tdp-43蛋白基因,导致视小杆结构异常,线粒体内膜系统受到严重损伤。图5a为透射电镜低倍镜视野下,果蝇视感神经元的图像(nu指示区域为视杆神经元的细胞核区域;黑色箭头指示区域为视杆神经元内的线粒体结构)。图5b为透射电镜高倍镜视野下,果蝇视感神经元内线粒体的微观形态结构图像(黑框内为黑色箭头指示的线粒体的放大图像)。图5c对线粒体横截面积统计显示,tdp-43蛋白表达导致果蝇视杆神经元中线粒体横截面积显著减小,线粒体呈现严重的片段化现象。每组至少统计了100个线粒体。图5d对线粒体形态统计显示,tdp-43蛋白表达导致果蝇视杆神经元中损伤的线粒体数量显著增加。每组至少统计了三只果蝇。数据分析使用的是one-wayanova,继之以bonferroni多重比较,***:p<0.001。果蝇基因型:ctr:gmr-gal4/uas-rfp;wt:gmr-gal4/uas-wt-tdp-43-rfp;a315t:gmr-gal4/uas-a315t-tdp-43-rfp。
图6是本发明中在细胞模型和果蝇模型中表达野生型或突变型(a315t)tdp-43蛋白基因,导致线粒体去折叠蛋白反应(uprmt)相关基因mrna上调。图6a为qpcr实验检测,在tdp-43稳定细胞系中表达tdp-43蛋白导致线粒体非折叠蛋白反应(uprmt)通路相关基因表达上调(atf5,hspa9,hsp60,lonp1)。图6b为qpcr实验检测,在果蝇神经系统诱导表达tdp-43蛋白导致线粒体非折叠蛋白反应(uprmt)通路相关基因表达上调(hsp60a,hsc70-5,cg5045,lon的两个可变剪接产物ra和rc)。果蝇基因型:ctr:elav-gal4/tub-gal80ts/uas-rfp;wt:elav-gal4/tub-gal80ts/uas-wt-tdp-43-rfp;a315t:elav-gal4/tub-gal80ts/uas-a315t-tdp-43-rfp。实验代表三次实验重复结果。数据分析使用的是one-wayanova,继之以bonferroni多重比较,*:p<0.05;**:p<0.01;***:p<0.001。
图7是本发明中在七例ftld-tdp患者脑样本组织中lonp1蛋白酶的蛋白水平比对照组显著上调。图7a为westernblot实验检测,ftld-tdp患者脑样本中lonp1,hspa9(mthsp70),hsp60蛋白水平的变化。图7b为westernblot实验结果定量分析,lonp1蛋白在ftld-tdp患者脑样本中明显上调,而hspa9和hsp60蛋白未有明显改变。对照组和患病组各检测7例样本,数据统计分析使用student′s-t检验方法,*:p<0.05。
图8是本发明中在细胞中表达野生型或突变型(a315t)tdp-43蛋白基因,与线粒体内的lonp1蛋白酶有相互作用;同时内源表达的tdp-43也与线粒体内的lonp1蛋白酶发生相互作用;细菌表达和纯化的lonp1蛋白酶可对哺乳动物细胞中表达的野生型或突变型(a315t)tdp-43蛋白进行降解,此降解过程随着lonp1浓度的增大而活性增强,且此过程依赖于atp分子的存在。图8a为hek293细胞中,coip实验结果显示tdp-43蛋白与线粒体蛋白酶lonp1存在相互作用,实验结果代表三次重复实验。图8b为细胞内源性表达的tdp-43和lonp1也存在co-ip可检测的相互作用,实验结果代表三次重复实验。图8c为ftld-tdp患者脑样本的免疫电镜实验,使用小鼠anti-tdp-43抗体和兔anti-lonp1抗体对样本进行双重标记后,再通过6nm和15nm的免疫胶体金颗粒二抗分别标记tdp-43和lonp1,通过免疫电镜对tdp-43蛋白和lonp1蛋白酶的定位关系进行检测,黑框内的图像为黑色箭头指示区域的放大图像。图8d为hek293中下调lonp1对tdp-43的影响,westernblot结果显示,下调lonp1导致线粒体内的tdp-43积累明显增加,而对细胞质中的tdp-43蛋白没有明显的影响。数据代表四次重复实验结果,数据统计分析使用student′s-t检验方法,*:p<0.05;**:p<0.01。图8e为纯化的lonp1对野生型或突变型(a315t)tdp-43蛋白的降解,lonp1是在大肠杆菌中表达和纯化的带有his标签的融合蛋白,野生型或突变型(a315t)tdp-43蛋白是在hek293中表达并初步纯化的带有his/myc标签的融合蛋白,将lonp1和tdp-43蛋白混合,并加入atp和镁离子启动lonp1的蛋白酶活力,1小时后终止酶解反应,通过westernblot检测未被降解的tdp-43蛋白的量。随着lonp1浓度的逐渐增大,tdp-43蛋白的野生型或突变型(a315t)未被降解的蛋白量逐渐减少。数据代表三次不同批次纯化蛋白的重复实验结果。
图9是本发明中tdp-43蛋白参与tdp-43蛋白病(tdp-43proteinopathies)发生的原理示意图,tdp-43蛋白的表达导致线粒体损伤,并启动线粒体非折叠蛋白反应(uprmt),被激活的线粒体蛋白酶lonp1通过降解tdp-43蛋白参与调解其在线粒体中的含量。
图10是本发明中在表达tdp-43蛋白的果蝇中,利用rnai降低lonp1同源基因lon的表达,可显著加重tdp-43诱导的神经退行性表型。图10a为透射电镜低倍镜视野下,果蝇视觉感受器的图像。图10b为透射电镜高倍镜视野下,果蝇视杆神经元内线粒体图像。图10c为对果蝇单个小眼的视小杆数量进行统计分析,下调lon蛋白酶进一步加重了这种因表达tdp-43蛋白而导致的视小杆丢失的现象。每组检测了两只果蝇,至少100个小眼。图10d为对果蝇视杆神经元线粒体横截面积进行统计分析,下调lon蛋白酶进一步加重了这种因tdp-43蛋白而导致的线粒体横截面积减小的现象。每组检测了两只果蝇,至少100个线粒体。图10e为对果蝇视杆神经元线粒体形态进行统计分析,下调lon蛋白酶进一步加重了这种因表达tdp-43蛋白而导致的线粒体形态异常。每组检测了两只果蝇,至少100个线粒体。图10a-e所用的果蝇基因型:ctr:gmr-gal4/tub-gal80ts/uas-rfp;wt:gmr-gal4/tub-gal80ts/uas-wt-tdp-43-rfp;wt&silon:gmr-gal4/tub-gal80ts/uas-wt-tdp-43-rfp/uas-silon;a315t:gmr-gal4/tub-gal80ts/uas-a315t-tdp-43-rfp:a315t&silon:gmr-gal4/tub-gal80ts/uas-a315t-tdp-43-rfp/uas-silon。图10f和g为对果蝇组织进行细胞组分分离后进行westernblot实验确定tdp-43蛋白的量,发现下调lon蛋白酶导致更多的tdp-43蛋白在线粒体内积累,而对细胞整体以及细胞浆内的tdp-43蛋白未有明显的影响。果蝇基因型:wt:gmr-gal4/uas-wt-tdp-43-rfp;wt&silon:gmr-gal4/uas-wt-tdp-43-rfp/uas-silon;a315t:gmr-gal4/uas-a315t-tdp-43-rfp;a315t&silon:gmr-gal4/uas-a315t-tdp-43-rfp/uas-silon。数据代表三次重复实验结果,数据分析使用的是one-wayanova,继之以bonferroni多重比较,*:p<0.05;**:p<0.01;***:p<0.001。
具体实施方式
发明人团队建立了tdp-43蛋白病的转墓因果蝇模型,在果蝇特定亚群神经元细胞中表达人源tdp-43蛋白野生型和als突变型,导致年龄依赖的神经退化和功能缺失,表现出与tdp-43蛋白病相一致的典型特征。
通过化学合成方法,发明人获得了tdp-43蛋白c端不同长度的多肽,包括q286-q331的46个氨基酸组成的多肽,以及m307-n319的13个氨基酸组成的多肽。这两种长度的多肽,不管是野生型还是a315t或a315e疾病相关突变型,均可在体外形成thioflavin-t结合荧光、负染电镜和原子力显微镜可检测到的淀粉样纤维。利用免疫电镜技术,发明人对确诊为tdp-43异常引起的额颞叶变性病(ftld-tdp)患者脑组织样本进行实验,在用tdp-43特异性一抗和携带胶体金颗粒的二抗标记神经细胞时,可观察到神经细胞中的tdp-43蛋白形成纤维样沉淀,这些tdp-43免疫阳性的纤维样结构与用负染电镜在体外观察到的tdp-43多肽形成的淀粉样纤维非常相似。而且,在ftld-tdp患者脑组织样本中,tdp-43形成纤维样沉淀的神经细胞中,线粒体出现严重损伤;在表达tdp-43野生型和突变体的hek293细胞中,也发现免疫电镜可见的线粒体形态变化。此外,使用免疫电镜检测5例ftld-tdp患者脑组织样本时,定位于神经细胞线粒体内的tdp-43蛋白会形成一种电子致密结构,与文献发表的线粒体内蛋白聚集体结构相似,提示tdp-43蛋白不仅在细胞质中形成蛋白聚集体,还可进入线粒体并在其中形成与细胞质包涵体相似的蛋白聚集体。
为了揭示tdp-43蛋白进入线粒体后引起线粒体损伤的机制,发明人在tdp-43蛋白病的细胞模型和果蝇模型中检测了线粒体去折叠蛋白反应(mitochondrialunfoldedproteinresponse,uprmt)的活性水平。rt-qpcr实验结果显示,tdp-43蛋白的异常表达显著激活了uprmt相关基因的mrna表达水平,包括atf5(uprmt通路上游转录调控因子),hspa9,(编码线粒体分子伴侣蛋白mthsp70,辅助线粒体内异常折叠的蛋白质进行正确折叠),hsp60(编码分子伴侣蛋白hsp60,辅助线粒体内异常折叠的蛋白质进行正确折叠)和lonp1(编码线粒体内蛋白酶lonp1)。而且,与野生型tdp-43蛋白相比,表达疾病相关突变体a315t-tdp-43时,uprmt激活效应更加显著,这与疾病相关突变体a315t-tdp-43表达引起线粒体损伤更显著的结果相一致。同时,发明人检测了7例ftld-tdp患者及7例对照组脑样本中的uprmt相关基因的蛋白表达水平,westernblot检测结果显示,与对照组相比,lonp1蛋白酶在ftld-tdp患者脑样本中显著上调,而hspa9和hsp60蛋白水平没有明显变化。进一步的免疫电镜实验分析ftld-tdp患者病理样本中tdp-43蛋白和lonp1蛋白酶在线粒体内的定位关系,结果显示tdp-43抗体标记的免疫信号与lonp1抗体标记的信号存在共定位关系,且这种共定位经常出现在电子致密的聚集体样区域。
在细胞模型中进行免疫共沉淀实验,结果显示tdp-43蛋白与lonp1蛋白酶存在相互作用。在细胞中上调lonp1的表达量,可显著降低tdp-43蛋白产生的细胞毒性,这种效应在表达疾病相关突变体a315t-tdp-43的细胞中更加显著。这些结果提示,lonp1蛋白酶可降低tdp-43蛋白的细胞毒性,对细胞起保护作用。通过表达shrna靶向下调lonp1的细胞实验中,表达tdp-43蛋白的细胞活性明显下降,且线粒体组分中tdp-43蛋白的积累显著增加,而细胞质组分中tdp-43蛋白量无明显变化。这说明lonp1蛋白酶是通过调节线粒体内tdp-43蛋白的量,对细胞起保护作用。
进一步的生化实验证明,在细菌中表达和纯化的lonp1蛋白酶,可降解细胞中表达的野生型和a315t突变型tdp-43蛋白,随着lonp1浓度增大,其降解tdp-43蛋白的活性也增大,并且此降解过程是atp依赖的,这表明lonp1蛋白酶是通过降解线粒体内tdp-43蛋白,从而减少tdp-43对细胞的毒性作用。
lonp1蛋白属于aaa+(atpaseassociatedwithavarietyofcellularactivities)蛋白超家族,它们通常都含有一段保守的蛋白序列组成的元件,通过水解atp分子发生构象变化而行使其功能。lonp1是lon蛋白酶家族中的线粒体同源蛋白,在人体中有lonp1基因编码。lonp1存在于线粒体基质中,形成桶状的同源六聚体复合物,在线粒体蛋白发生错误折叠或其他压力条件下被激活,对大部分损伤的蛋白质进行降解。lonp1也是一个dna结合蛋白,参与线粒体dna(mtdna)完整性的维持及基因表达调控。因此,lonp1在线粒体蛋白质量控制(qualitycontrol,qc)中起至关重要的重要。lon蛋白酶的单个亚基由3个结构域组成,n端是蛋白底物识别区,中间是aaa+元件负责atp结合和水解,c端的p-结构域负责蛋白底物降解。大脑眼牙耳骨骼综合症(cerebral,ocular,dental,auricular,skeletalsyndrome,简称codassyndrome)是一种多系统发育疾病,以广泛的临床症状为特征,包括张力减退、上下眼睑、运动延迟、听力丧失、产后白内障、骨骼及牙齿异常等。这是一种常染色体隐性遗传的罕见病,研究发现这种疾病患者的lonp1基因,即lonp1,存在基因突变。绝大多数是错义突变,多位于aaa+结构域,导致氨基酸替换,使其形成同源多聚体的能力受损并影响其对某些底物的水解活性。
als中的线粒体损伤已有广泛研究,特别是在sod1动物模型中。过表达tdp-43的转基因小鼠,在其运动神经元中观察到线粒体发生聚集。六例散发型als-tdp患者的脊髓样本运动神经元和四例散发型ftld-tdp脑样本皮层神经元的免疫荧光和免疫电镜研究显示,细胞内的tdp-43与线粒体标记物共定位;与对照组相比,在疾病患者样本神经元中,tdp-43在线粒体内的积累更显著。利用细胞模型和小鼠模型的实验表明,als疾病相关突变a315t可增加tdp-43进入线粒体,并影响线粒体的形态和功能。这些研究说明线粒体损伤可能是als-tdp和ftld-tdp的共同特征。尽管tdp-43的表达造成线粒体损伤已有报道,发明人的研究数据也显示,线粒体的片段化不仅在体外培养的神经元细胞中发生,在tdp-43转基因果蝇的运动神经元中也存在。发明人的研究还发现,ftld-tdp患者脑组织样本中的神经细胞表现出明显的线粒体损伤,tdp-43蛋白形成的电子致密物就出现在损伤的线粒体中;同时在其中四例样本中检测到线粒体蛋白酶lonp1的表达上升。在细胞模型中,野生型tdp-43(wt-fus)和als突变型tdp-43(a315t-tdp-43)都与lonp1相互作用;使用rnai技术沉默培养细胞中的lonp1,则导致线粒体中tdp-43蛋白水平的上升。而在tdp-43转基因果蝇中,通过rnai下调lon蛋白酶,则进一步加重表达tdp-43导致的神经退行性表型和细胞中线粒体形态的异常。因此,tdp-43蛋白进入线粒体并引起线粒体损伤可能是ftld-tdp的显著病理特征。发明人的实验数据还揭示了一种以前未被发现的tdp-43调控方式,即线粒体蛋白酶lonp1通过降解tdp-43从而参与调节tdp-43在线粒体中的含量。发明人的研究结果说明,通过调节tdp-43在线粒体中的含量是治疗tdp-43蛋白病、防止tdp-43诱发线粒体损伤的一条途径。
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
一、实验材料来源
lon-rnai等转基因果蝇品系来自vienna果蝇中心,rabbit-anti-gfp购自millipore公司,rabbit-anti-tdp-43、rabbit-anti-immt、rabbit-anti-lonp1、rabbit-anti-clpp、rabbit-anti-atp5a1、rabbit-anti-hspa9和rabbit-anti-tom20购自proteintechgroup公司;monoclonalmurineanti-myc和anti-gapdh购自康维世纪公司,monoclonalmurineanti-tdp-43和anti-actin购自proteintechgroup公司;monoclonalmurineanti-hdp60购自bd公司。实验中所用到的二抗:anti-mousehrp和anti-rabbithrp购买自gehealthcare公司;轻链二抗anti-mousehrp和anti-rabbithrp购买自jacksonimmunoresearchlaboratories公司;免疫电镜标记所用的6nm,10nm,15nm的免疫胶体金二抗购买自electronmicroscopyscience公司。proteina/g琼脂糖树脂购买自gehealthcare公司。
二、实验方法
免疫电镜(immuno-electronmicroscopy(iem)orem)方法:收集稳定表达gfp、表达野生型tdp-43-gfp、表达a315t突变型tdp-43-gfp的hek293细胞,以含有4%pfa和2.5%戊二醛的pbs(ph为7.2)室温固定3小时。清洗和固定之后,在4℃,用2.3m蔗糖渗透过夜,制备明胶包埋块。在-120℃的低温切片机中用干石英刀片进行超薄切片,厚度为70nm。超薄切片经封闭后,用tdp-43单克隆抗体和偶联有胶体金颗粒的二抗进行免疫标记,然后进行醋酸双氧铀和柠檬酸铅染色。
人脑组织的免疫电镜样品制备:对健康人的和ftld-tdp患者的尸检额叶皮质样本,首先用2%pfa和0.2%戊二醛室温固定3小时,然后用12%明胶包埋。免疫染色程序同上。
果蝇眼睛的电镜样品制备和观察:对成年果蝇的头部进行切片并用含有4%pfa和2.5%戊二醛的pbs(ph为7.4)在4℃固定12小时,然后在含1%四氧化锇的pbs(ph为7.4)中室温浸泡2小时。以10、25、40、55、70、85和100%的乙醇溶液对样品依次脱水,每次30分钟,再用环氧树脂包埋。使用超薄切片机对树脂块进行切片,厚度为70nm,超薄切片附着于铜网后可用透射电镜检查。
免疫沉淀(immunoprecipitation):使用hek293t细胞进行转染和蛋白质-蛋白质相互作用分析。转染48小时之后收集细胞并用pbs洗涤。冰上裂解30分钟后,收集可溶性细胞裂解组分,用特异性抗体和蛋白a-琼脂糖树脂在4℃进行免疫共沉淀。免疫共沉淀产物用westernblotting检测。
细胞活性和毒性测定:细胞活性和细胞毒性测定使用的是promega公司的cytotox-onetmhomogeneousmembraneintegrity试剂盒。具体方法:通过测定荧光产物9-羟基-3-异吩-唑酮的荧光值(激发光波长:560nm;发射光波长:590nm)分别测定细胞内(细胞裂解后)和释放到细胞培养基中乳酸脱氢酶的活性。两者比值代表存活细胞与没有活性的细胞(细胞膜完整性丢失)比值。
染料检测细胞线粒体膜电位:实验前48h,将稳定表达对照组、野生型(wt)或突变型(a315t)tdp-43的hek293细胞种在6孔板上。之后,1μg/ml四环素(tetracycline)诱导处理细胞0h,24h或48h。胰酶消化细胞后,pbs缓冲溶液洗细胞一次,用含有5μmjc1染料的pbs缓冲溶液重悬细胞,37℃染色20min。染色结束后,将细胞离心,pbs缓冲溶液洗细胞一次后,使用500μlpbs缓冲溶液重悬细胞,使用calibur流式细胞系检测488nm和594nm两通道荧光信号。数据分析和作图使用flowjo软件,594nm荧光值/488nm荧光值代表线粒体膜电位水平。实验重复四次,每组样品分析至少20,000细胞。
mitosoxred染料检测细胞线粒体活性氧(mitoros)水平:实验前48h,将稳定表达对照组、野生型(wt)或突变型(a315t)tdp-43的hek293细胞种在6孔板上。之后,1μg/ml四环素(tetracycline)诱导处理细胞0h,24h或48h。胰酶消化细胞后,pbs缓冲溶液洗细胞一次,用含有5μmmitosoxred染料的pbs缓冲溶液重悬细胞,37℃染色20min。pbs缓冲溶液洗细胞一次后,4%pfa室温固定10min。pbs缓冲溶液洗细胞一次后,使用500μlpbs缓冲溶液重悬细胞,使用ariaiii流式细胞系检测萤光信号。数据分析和作图使用flowjo软件,实验重复四次,每组样品分析至少20,000细胞。
果蝇杂交和培养:收集小于5天的处女蝇和小于10天的雄蝇进行杂交。杂交时,小管放入10-20只父母本果蝇,大瓶放入40-80只父母本果蝇,雌雄蝇比例为2∶1到3∶1。杂交后,每两天将果蝇转移到新的培养管或培养瓶中。在25℃培养箱中培养,湿度保持在40-60%范围内,12h光照/12h黑暗交替。
果蝇三龄幼虫运动神经元胞体和轴突成像:沿幼虫背侧中轴线将幼虫剖开,清除内脏,用细针将幼虫体壁撑开,暴露出腹侧神经索(vnc)。用4%pfa固定幼虫20min。pbs缓冲溶液洗三次,将幼虫剖开一侧朝上放置于载玻片上,滴加一滴防荧光淬灭封片剂,盖上盖玻片封片保存。使用leicasp8激光共聚焦荧光显微镜对幼虫腹侧神经索内运动神经元胞体和轴突进行拍照成像。
果蝇组织线粒体纯化:将果蝇麻醉,每组切取60个果蝇头并收集转移到匀浆器中,加入提前预冷过的isolationbuffer,研磨果蝇组织。在4℃,经600gx10min离心两次,再8,000gx10min离心后,使用washbuffer清洗沉淀并离心,最后将清洗完的沉淀(即线粒体组分)用适量washbuffer重悬,加loadingbuffer煮样或-80℃保存。
细胞线粒体纯化:收集细胞,用pbs清洗两次,加入预冷的bufferh,后面过程与果蝇组织提取线粒体步骤相同。
线粒体呼吸链复合物活性测定:纯化后的10ug线粒体加入到100ul呼吸链复合物i反应体系中(30mmkpo4ph7.2,5mmmgcl2,2.5mg/mlbsa,0.3mmkcn,0.13mmnadh,2μg/mlantimycina,97.5umubiquinone-1)。将nadh氧化酶在不添加鱼藤酮测得的总活性减去添加鱼藤酮测得的活性即为呼吸链复合物i的活性。将线粒体加入到呼吸链复合物ii反应体系中(30mmkpo4(ph7.2),5mmmgcl2,2.5mg/mlbsa,0.3mmkcn,50umdcpip,20mmsuccinate,2μg/mlantimycinaand65umdecylubiquinone)。将泛醌还原酶在没有丙二酸的时测得的总活性减去添加丙二酸时测得的活性即为呼吸链复合物ii的活性。呼吸链复合物iii和iv的活性是通过分别测定细胞色素c被还原或被氧化的速率实现的(od550)。
果蝇组织rna提取:冰上收集果蝇组织,加入适量trizol试剂(1mltrizol试剂用于约20只果蝇)冰上研磨。在4℃,经13,000rpmx10min离心后,取上清加入0.2倍体积三氯甲烷,剧烈摇晃后室温静置。经13,000rpmx15min离心后,取上清加入等体积的异丙醇沉淀rna,混匀后室温下放置5min。经13,000rpmx15min离心后,取沉淀用70%乙醇洗涤rna沉淀,13,000rpmx10min离心后,将rna沉淀晾干,加入20-50μl的depc水溶解rna。取少量rna,使用紫外分光光度计在260nm测光吸收以测定rna浓度,经琼脂糖凝胶电泳鉴定rna抽提质量。
细胞rna提取:除不需要研磨外,其他过程与果蝇组织提取rna步骤相同。
逆转录反应:逆转录体系(25μl)包括:
rna2μg
2.5mm的dntp混合物4μl
oligodt(18)引物2μl
100mmm-mlv逆转录酶1μl
5xrtbuffer5μl
depc水将反应体系补齐到25μl
反应条件为45℃;1小时。70℃;15min灭活逆转录酶。
qrt-pcr反应:qrt-pcr使用康维世纪公司的ultrasybrmixture(lowrox)试剂盒,反应体系如下(20μl):
pcr反应程序:预变性95℃,10min;变性95℃,15s,退火/延伸60℃,1min。35个循环。根据需要设置融解曲线程序以分析引物结合的特异性。
三、结果分析
1、tdp-43蛋白病(tdp-43proteinopathies)患者样本中线粒体损伤情况分析。
为了分析tdp-43蛋白病(tdp-43proteinopathies)患者样本中相关细胞和分子的损伤情况,发明人从美国西北大学的认知神经学和阿尔茨海默症研究中心收集了五例ftld-tdp患者和三例正常对照的脑样本,该样本适合进行电镜检测。
发明人利用免疫电镜检测样本,其中一抗为tdp-43抗体,二抗带有金标记。在对照样品中,大多数线粒体呈现正常的形态特征,表现为规则、紧密排列的线粒体嵴结构(图1a左列图像;normalmito),而在ftld-tdp患者脑样本中,部分线粒体呈现呈现泡状或肿胀状嵴结构(图1a中列图像中黑色箭头指示区域;swollenmito),还有更多的线粒体丢失掉完整的内膜结构(图1a右列图像;degeneratedmito)。统计结果显示,相较于对照组脑样本,ftld-tdp患者中,嵴肿胀或内膜结构退化的线粒体明显增加,而正常形态的线粒体明显减少(图1b)。
ftld-tdp病理样本的免疫电镜检测还显示,tdp-43蛋白(10nm免疫胶体金颗粒)定位于线粒体内(图1c,黑色箭头指示位置),而且在部分患者脑样本的线粒体内可以检测到tdp-43抗体标记的电子致密的聚集体结构(图1d,黑色箭头指示位置)。
2、tdp-43基因在哺乳动物细胞中表达对线粒体的影响。
为了检测tdp-43蛋白过表达是否影响哺乳动物细胞的线粒体,发明人构建了通过添加四环素(tetracycline,tet)诱导表达表达野生型(wt-)或a315t-突变型tdp-43蛋白的hek293稳定细胞株。在诱导表达tdp-43蛋白36h后,将hek293细胞破碎离心获得线粒体,通过westernblott检测发现,诱导表达的tdp-43蛋白出现在线粒体富集的组分中(图2a)。以anti-tdp-43的抗体为探针,使用免疫电镜(immuno-electronmicroscopyiem)方法检测,也进一步证明诱导表达野生型(wt-)或a315t-突变型tdp-43蛋白定位在线粒体内,且与对照组相比这些细胞的线粒体呈现出异常的形态,主要表现为线粒体横截面积变小、线粒体嵴损伤严重,这种现象在表达a315t突变型tdp-43的细胞中更加严重(图2b-d)。
为了检测细胞能量代谢是否受到影响,检测了tdp-43蛋白的表达是否能影响线粒体合成atp。在诱导表达tdp-43蛋白36h后,细胞中线粒体合成atp的能力出现了显著下降,表达野生型wt-tdp-43蛋白的细胞线粒体atp合成速率下降了~20%,而表达疾病相关突变型a315t-tdp-43蛋白的细胞线粒体atp合成速率下降了~25%(图3-2e),而全细胞atp水平未见有明显影响(图2e和f)。通过分别检测表达tdp-43蛋白的稳定细胞系中,线粒体呼吸链五个复合物的活性,发明人发现tdp-43蛋白的表达使呼吸链复合物i的活性受到严重抑制,呼吸链复合物iv的活性受到部分抑制,而其他三个呼吸链复合物的活性未见明显变化(图3)。以上实验结果提示,tdp-43蛋白的表达对线粒体能量代谢功能的影响可能是通过抑制呼吸链复合物i和iv的活性实现的。
为了进行在体实验,检测过表达tdp-43蛋白是否影响线粒体,发明人检测了tdp-43转基因果蝇三龄幼虫的胸节神经节(vnc),使用线粒体绿色荧光蛋白(mito-gfp)特异性标记线粒体,红色荧光蛋白标记tdp-43蛋白。结果显示与正常果蝇相比,tdp-43转基因果蝇运动神经元的线粒体长度变短、密度降低,胞体线粒体网络呈现异常形态,这种现象在表达疾病相关突变型(a315t)tdp-43蛋白的果蝇幼虫中更明显。以上这些结果说明,在神经细胞内和模型动物体内过表达wt-或a315t-突变型tdp-43蛋白,均会导致线粒体缺陷,见图4。
使用gmr-gal4驱动子,在果蝇视杆神经元中表达野生型wt-tdp-43蛋白或疾病相关的突变型a315t-tdp-43蛋白,通过常规透射电镜可观测视杆神经元的结构是否发生改变。在低倍镜下,对照组中果蝇每个单眼有七个结构完整、规则排列的视小杆,而在表达tdp-43蛋白的果蝇眼睛中,视小杆结构完全丢失(图5a;nu指示区域为视杆神经元的细胞核区域;黑色箭头指示区域为视杆神经元内的线粒体结构)。在高倍镜下,对照组中果蝇视杆神经元内线粒体呈现结构清晰、排列规则、堆叠紧密的嵴结构,而在表达tdp-43蛋白的视杆神经元内线粒体横截面积显著减小,线粒体嵴呈现明显的泡状肿胀特征,损伤的线粒体数量明显增加(图5b-d;黑框内为黑色箭头指示的线粒体的放大图像),这些实验结果与发明人在ftld-tdp患者病理细胞(图1)以及表达tdp-43蛋白的细胞模型中(图2)检测到的线粒体形态改变是一致的。
3、tdp-43蛋白异常表达诱导线粒体去折叠蛋白反应(uprmt)并激活线粒体蛋白酶lonp1。
为了阐述tdp-43蛋白表达并在线粒体内积累是否启动线粒体质量控制与修复机制,发明人在tdp-43蛋白病细胞模型和果蝇模型中,检测了线粒体去折叠蛋白反应(uprmt)的活性水平。
在hek293稳定细胞株中诱导表达tdp-43蛋白0、36、48、72小时后,提取细胞rna进行反转录定量pcr分析(rt-qpcr),对atf5(uprmt通路上游的转录调控因子)、hspa9(编码mthsp70分子伴侣蛋白,辅助线粒体内异常构象的蛋白进行正确折叠)、hsp60(编码分子伴侣蛋白hsp60,辅助线粒体内异常构象的蛋白正确折叠)和lonp1(编码线粒体内蛋白酶lonp1)的mrna水平进行检测。实验结果显示,tdp-43蛋白表达显著上调线粒体去折叠蛋白反应(uprmt)相关基因的表达(图6a)。值得注意的是,与野生型(wt)tdp-43蛋白相比,疾病相关突变型(a315t)tdp-43蛋白表达对线粒体去折叠蛋白反应(uprmt)的激活更显著,这与疾病相关突变型(a315t)tdp-43蛋白表达引起的线粒体损伤更显著、细胞毒性更强烈的效应一致。
在tdp-43蛋白病转基因果蝇模型中,也检测到线粒体去折叠蛋白反应(uprmt)相关基因的上调。通过温度调控(28℃热激4小时/天)诱导外源tdp-43蛋白在果蝇全神经系统表达15天或30天后,分别收集雌雄蝇头部,提取rna进行反转录定量pcr分析(rt-qpcr),对hsp60a(hsp60在果蝇中的同源基因)、hsc70-5(hspa9在果蝇中的同源基因)、cg5045(线粒体蛋白酶clpp在果蝇中的同源基因)、lon-ra和lon-rc(lonp1蛋白酶在果蝇中的同源基因lon的两个可变剪接产物)的mrna水平进行检测。实验结果显示,在雌蝇中,a315t-tdp-43蛋白表达15天后,hsp60a基因表达已显著上调,在tdp-43蛋白表达30天后,所有四个urpmt相关基因的表达都明显上调;而在雄蝇中,tdp-43蛋白(特别是疾病相关的突变型(a315t)tdp-43蛋白)表达15天后,所有四个基因的表达都明显上调,但到tdp-43蛋白表达30天后,只有hsp60a基因的表达是持续上调的,其余三个基因的表达变化不明显(图6b)。
以上实验说明,在tdp-43蛋白病的细胞模型和果蝇模型中,线粒体去折叠蛋白反应(uprmt)通路被激活,而且这种激活效应在表达疾病相关突变型(a315t)tdp-43蛋白是更明显。
4、tdp-43蛋白异常表达激活线粒体蛋白酶lonp1。
根据细胞模型和果蝇模型中线粒体去折叠蛋白反应(uprmt)通路的相关基因mrna被激活这一结果,发明人检测了ftld-tdp患者脑样本中线粒体去折叠蛋白反应(uprmt)通路相关基因的蛋白水平变化。westernblot结果显示,与七例对照组脑样本相比,在七例ftld-tdp患者脑样本中的lonp1蛋白酶水平显著上调,而hspa9和hsp60蛋白未有明显变化(图7a和b)。
在稳定表达tdp-43蛋白的hek293细胞中,发明人利用免疫共沉淀方法检测tdp-43蛋白是否与lonp1蛋白酶存在相互作用。首先将带有myc标签的wt-或a315t-突变型tdp-43质粒转染细胞,只含有myc的质粒作为对照。利用lonp1特异性抗体进行免疫共沉淀的结果表明,wt-或a315t-突变型tdp-43蛋白均与lonp1蛋白相互作用(图8a)。同样,在细胞中使用tdp-43特异性抗体和lonp1特异性抗体进行免疫共沉淀,内源性tdp-43蛋白和lonp1蛋白也发生相互作用(图8b)。
为了检测tdp-43蛋白和lonp1蛋白酶相互作用是否发生在线粒体内,发明人对ftld-tdp患者脑样本进行双重免疫标记(分别用小鼠anti-tdp-43抗体和兔anti-lonp1抗体标记tdp-43蛋白和lonp1蛋白),通过免疫电镜分析病理样本中tdp-43蛋白和lonp1蛋白酶在线粒体内的定位关系。免疫电镜检测结果显示,在ftld-tdp患者脑样本中,tdp-43抗体标记的免疫信号(6nm免疫胶体金颗粒)和lonp1抗体标记的免疫信号(15nm免疫胶体金颗粒)存在共定位关系,而且这种共定位信号经常出现在电子致密的蛋白聚集样区域中(图8c,黑色箭头指示区域)。
在hek293细胞中,先通过转染shrna质粒靶向敲低lonp1的表达量,然后添加四环素诱导tdp-43蛋白表达,36小时后收集细胞并对细胞组分进行分离。westernblot检测显示,lonp1蛋白酶的下调导致线粒体内tdp-43蛋白的积累显著增加,而对细胞浆组分中的tdp-43蛋白没有明显影响(图8d)。这说明lonp1蛋白酶参与调解线粒体定位的tdp-43蛋白的含量,并对细胞起保护作用。
为了检测tdp-43是否被lonp1蛋白酶降解,发明人建立了一套体外检测方法。在hek293中表达的野生型和a315t突变型tdp-43蛋白,均可被大肠杆菌中表达并纯化的线粒体蛋白酶lonp1降解,并且随着lonp1浓度的增加,tdp-43蛋白被降解的更快,而且这一降解过程是atp依赖的(图8e)。这些结果说明,lonp1蛋白酶通过其降解活力参与调节tdp-43在线粒体内的含量。
5、tdp-43蛋白参与tdp-43蛋白病(tdp-43proteinopathies)发生的机理
上述实验结果说明,在tdp-43蛋白病(tdp-43proteinopathies)发生过程中,tdp-43蛋白异常表达,引发神经细胞的线粒体出现碎片化、膜电位降低和活性氧升高,并激活线粒体去折叠蛋白反应,参与疾病的发生过程。线粒体蛋白酶lonp1与tdp-43蛋白相互作用,通过其降解活力参与调节tdp-43在线粒体内的含量,对tdp-43蛋白诱导的退行性病变有调控作用,见图9。
6、以此发明的新靶点开发tdp-43蛋白病(tdp-43proteinopathies)诊断手段及治疗药物的示例。
利用果蝇为模式动物,在其体内过表达tdp-43蛋白,建立tdp-43蛋白病(tdp-43proteinopathies)疾病模型。低倍透射电镜检测显示,果蝇单眼的视杆神经元出现明显的视小杆丢失现象,而通过表达的小rna片段下调lon蛋白酶表达后(silon),这种因表达tdp-43蛋白而导致的视小杆丢失现象进一步加重。高倍透射电镜进一步检测显示,tdp-43蛋白表达造成果蝇视杆神经元中出现大量形态异常的线粒体(包括过度片段化的线粒体以及嵴形态异常的线粒体),而下调lon蛋白酶明显加重了这种因表达tdp-43蛋白而导致线粒体形态异常的现象,同时线粒体的横截面积进一步变小(图9a-e)。在对照果蝇中,给予silon后,视感神经元的视小杆和其中的线粒体没有明显变化。这说明沉默lonp1基因在tdp-43果蝇模型中的同源基因lon,可使该动物模型中的退行性表型更加严重。
westernblot检测显示,下调lon蛋白酶后,线粒体内积累的tdp-43蛋白显著增加,而总细胞组分、细胞浆组分中的tdp-43蛋白水平未见明显变化(图9f和g),这与哺乳动物细胞实验结果一致(见图8d),表明lon蛋白酶在降解线粒体内tdp-43蛋白的功能上是保守的。
以上实验表明,在tdp-43蛋白病模型中,lon蛋白酶对降解线粒体内的tdp-43蛋白、维持线粒体形态及功能和降低tdp-43蛋白毒性发挥重要作用。这进一步证明以该发明专利所述的靶点开发出针对lonp1的小分子药物,上调lonp1蛋白酶的表达或者增强其降解活力,可显著提高开发tdp-43蛋白病(tdp-43proteinopathies)治疗药物的可行性。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等效结构或等效流程变换,或直接或间接运用在其它相关的技术领域,均同理包括在本发明的专利保护范围内。
序列表
- 还没有人留言评论。精彩留言会获得点赞!