薄壳山核桃MSAP技术体系的建立方法与流程
本发明涉及分子标记
技术领域:
,尤其是涉及一种薄壳山核桃msap技术体系的建立方法。
背景技术:
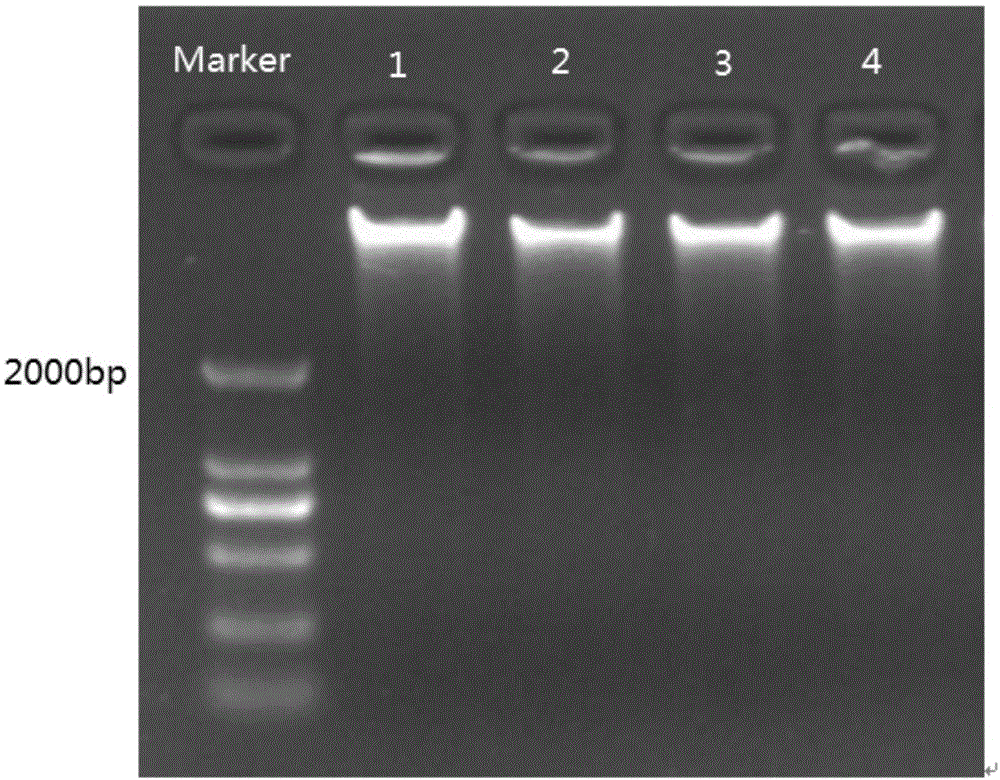
:薄壳山核桃(caryaillinoensiskoch),又名美国山核桃或长山核桃,俗称“碧根果”,是胡桃科山核桃属植物,原产美国和墨西哥北部,是世界上著名的干果树种之一。薄壳山核桃其坚果个大、壳薄,出仁率高,取仁容易,产量高,同时果仁色美味香、无涩味、营养丰富,是理想的保健食品或面包、糖果等食品的添加材料。此外,薄壳山核桃亦是重要的木本油料植物,种仁油脂含量高在70%以上,其中不饱和脂肪酸含量高达97%,有很好的贮藏性,是上等的烹调用油和色拉油。薄壳山核桃在我国引种栽培已具有100多年的历史,由于长期存在的不科学的育种及种植方法,我国薄壳山核桃产业存在优良品种缺乏、扩繁技术落后、配套管理技术不完善等问题。因此,对薄壳山核桃的研究越来越得到国家和农林科技人员的重视。目前在薄壳山核桃遗传育种改良方面已经开展了同属不同种间的杂交育种、选择育种和分子标记辅助育种等工作,其中将传统的杂交育种技术同不断发展的生物技术结合来获得优良性状是遗传改良的工作重点。目前虽然已在薄壳山核桃遗传育种改良方面开展了相关工作,但是从dna甲基化这一表观遗传调控层面出发并应用于分子标记辅助育种方面的研究尚未见报道。dna甲基化是最早发现的表观遗传修饰途径之一,能引起染色质结构、dna构象、dna稳定性及dna与蛋白质相互作用方式的改变,进而影响基因表达,是大多数生物体生长发育过程中不可缺少的一部分。甲基化敏感扩增多态性(methylationsensitiveamplificationpolymorphism,msap)技术是一种对基因组dna甲基化进行分析的相对简单且较常用的方法。根据hpaii及mspi这两种酶对基因组中“5’-ccgg-3’”位点中胞嘧啶甲基化状态不同而具有不同的酶切活性,可以酶切产生多态性的dna片段并最终通过比较pcr扩增产物电泳图谱来分析dna甲基化状况。因此,建立一套科学准确的薄壳山核桃dna甲基化分析技术体系,进而在未知基因组序列的情况下对薄壳山核桃全基因组甲基化开展研究,变得十分必要和迫切。有鉴于此,特提出本发明。技术实现要素:本发明的第一目的在于提供一种薄壳山核桃msap技术体系的建立方法,所述薄壳山核桃msap技术体系建立后可以在未知基因组序列的情况下对薄壳山核桃全基因组甲基化开展研究,通过遗传学分子标记的方法,对研究、培育抗病抗逆性强的新薄壳山核桃品种具有非常现实的意义。本发明提供的一种薄壳山核桃msap技术体系的建立方法,所述方法包括以下步骤:首先将薄壳山核桃基因组dna双酶切得到酶切产物,将得到的酶切产物与接头引物进行连接,得到连接产物;随后将连接产物进行预扩增得到预扩增产物,并将预扩增产物进行选择扩增;最后对选择扩增的产物进行凝胶电泳及银染显色。进一步的,所述将薄壳山核桃基因组dna双酶切的酶切体系为:400ngdna、0.3μlecori-hf、0.3μlmspi或0.3μlhpaⅱ、2μlcutsmartbuffer、无菌水补足至20μl。更进一步的,所述酶切分为4~6个时间梯度,每一时间梯度酶切结束后放入65~70℃温浴20min;优选的,所述酶切的温度为35~37℃。进一步的,所述酶切产物与接头引物进行连接的反应体系为:酶切产物20μl、0.1μlt4dnaligase、2.5μlatp、eadaptor和h/madaptor均为0.5μl,无菌水补足至25μl;优选的,所述e-adaptor接头引物,其上游引物为:5’-ctcgtagactgcgtacc-3’,下游引物为:5’-aattggtacgcagtctac-3’;所述h/madaptor接头引物,其上游引物为:5’-gacgatgagtctagaa-3’,下游引物为:5’-cgttctagactcatc-3’。进一步的,所述预扩增反应体系为:0.5~2.5μl连接产物,0.1~0.3μlextaq酶、1~3μldntp、预扩增引物pre-e和pre-h/m各0.5`2.5μl,2.5μl10×extaqbuffer,无菌水补足至25μl。更进一步的,所述预扩增引物pre-e为:5’-gactgcgtaccaattca-3’,预扩增引物pre-h/m为:5’-gatgagtctagaacggt-3’。进一步的,所述选择扩增反应体系为:稀释0~200倍的预扩增产物0.5~2.5μl,extaq酶0.1~0.3μl,0.5~2.5μldntp选择扩增引物en0.3~2μl,选择扩增引物hmn0.3~2μl,2.5μl10×extaqbuffer,无菌水补足至25μl。更进一步的,所述选择扩增引物en序列为:5’-gactgcgtaccaattcaxx-3’,所述选择扩增引物hmn序列为:5’-gatgagtctagaacggtxx-3’,所述引物序列中x代表a,t,c,g四种碱基中的任意一种。进一步的,所述方法还包括对引物进行筛选的步骤。进一步的,所述薄壳山核桃的品种为‘波尼’和‘绍兴’。与现有技术相比,本发明的有益效果为:本发明薄壳山核桃msap技术体系的建立方法,首先将薄壳山核桃基因组dna双酶切得到酶切产物,将得到的酶切产物与接头引物进行连接,得到连接产物;随后将连接产物进行预扩增得到预扩增产物,并将预扩增产物进行选择扩增;最后对选择扩增的产物进行凝胶电泳及银染显色。通过上述方法可为开展薄壳山核桃dna甲基化遗传机理研究、基因表达的dna甲基化调控及外界环境变化引起dna甲基化变化提供分析依据,进而通过建立一套客观、科学、准确的薄壳山核桃dna甲基化分析技术体系,可以获得银染背景低、目的条带清晰的dna甲基化图谱,具有可在未知基因组序列的情况下对全基因组甲基化开展研究且甲基化位点易于检测的优点。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为本发明实施例1提供的提取后薄壳山核桃基因组dna的电泳图;图2为本发明实施例2提供的薄壳山核桃基因组dna用mspi进行双酶切后的电泳图;图3为本发明实施例3提供的双酶切产物与接头引物进行连接后的连接产物电泳图;图4为本发明实施例4提供的薄壳山核桃预扩增反应后的预扩增产物电泳图;图5为本发明实施例5提供的预扩增产物稀释后的凝胶电泳图;图6为本发明实施例5提供的薄壳山核桃选择性扩增反应后的选扩产物银染显色图;图7为本发明实施例6提供的引物筛选银染显色图;图8为本发明实施例6提供的引物对e1-h/m1(e1:5’-gactgcgtaccaattcaac-3’,h/m1:5’-gatgagtctagaacggtac-3’)选扩增的结果。具体实施方式下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。根据本发明的一个方面,一种薄壳山核桃msap技术体系的建立方法,所述方法包括以下步骤:首先将薄壳山核桃基因组dna双酶切得到酶切产物,将得到的酶切产物与接头引物进行连接,得到连接产物;随后将连接产物进行预扩增得到预扩增产物,并将预扩增产物进行选择扩增;最后对选择扩增的产物进行凝胶电泳及银染显色。本发明提供的薄壳山核桃msap技术体系的建立方法可为开展薄壳山核桃dna甲基化遗传机理研究、基因表达的dna甲基化调控及外界环境变化引起dna甲基化变化提供分析依据,适用于薄壳山核桃种质分析及鉴定、dna甲基化分子标记开发、基因表达与dna甲基化关联分析。进而通过建立一套客观、科学、准确的薄壳山核桃dna甲基化分析技术体系,可以获得银染背景低、目的条带清晰的dna甲基化图谱,具有可在未知基因组序列的情况下对全基因组甲基化开展研究且甲基化位点易于检测的优点。进一步的,本发明提供的薄壳山核桃msap技术体系的建立方法,在提取了薄壳山核桃基因组dna并检测质量后分别优化了双酶切时间及酶量、预扩增模板浓度及扩增反应程序、选择扩增模板浓度和引物用量、引物选择性碱基个数及选择扩增反应程序、银染时间及银染试剂的组成,确定了酶切体系及时间、预扩增及选择扩增的扩增反应体系及反应程序、pcr产物经变性聚丙烯酰胺凝胶电泳及银染显色的条件。在本发明的一种优选实施方式中,所述将薄壳山核桃基因组dna双酶切的酶切体系为:400ngdna、0.3μlecori-hf、0.3μlmspi或0.3μlhpaⅱ、2μlcutsmartbuffer、无菌水补足至20μl。在上述优选实施方式中,所述酶切分为4~6个时间梯度,每一时间梯度酶切结束后放入65~70℃温浴20min;作为一种优选的实施方式,上述酶切分为4~6个时间梯度,每一时间梯度酶切结束后放入65~70℃温浴20min,可以在每一个酶切阶段后对酶切酶进行灭活。优选的,所述酶切的温度为35~37℃。优选的,通过实验得到酶切时间为5h时能保证酶切充分且耗时少。在本发明的一种优选实施方式中,所述酶切产物与接头引物进行连接的反应体系为:酶切产物20μl、0.1μlt4dnaligase、2.5μlatp、eadaptor和h/madaptor均为0.5μl,无菌水补足至25μl;优选的,所述e-adaptor接头引物,其上游引物为:5’-ctcgtagactgcgtacc-3’,下游引物为:5’-aattggtacgcagtctac-3’;所述h/madaptor接头引物,其上游引物为:5’-gacgatgagtctagaa-3’,下游引物为:5’-cgttctagactcatc-3’。优选的,通过实验得到5h为最佳连接时间,能保证连接充分且耗时少。在本发明的一种优选实施方式中,所述预扩增反应体系为:0.5~2.5μl连接产物,0.1~0.3μlextaq酶、1~3μldntp、预扩增引物pre-e和pre-h/m各0.5`2.5μl,2.5μl10×extaqbuffer,无菌水补足至25μl。在上述优选实施方式中,所述预扩增引物pre-e为:5’-gactgcgtaccaattca-3’,预扩增引物pre-h/m为:5’-gatgagtctagaacggt-3’。在本发明的一种优选实施方式中,所述选择扩增反应体系为:稀释0~200倍的预扩增产物0.5~2.5μl,extaq酶0.1~0.3μl,0.5~2.5μldntp选择扩增引物en0.3~2μl,选择扩增引物hmn0.3~2μl,2.5μl10×extaqbuffer,无菌水补足至25μl。在上述优选实施方式中,所述选择扩增引物en序列为:5’-gactgcgtaccaattcaxx-3’,所述选择扩增引物hmn序列为:5’-gatgagtctagaacggtxx-3’,所述引物序列中x代表a,t,c,g四种碱基中的任意一种。在本发明的一种优选实施方式中,所述方法还包括对引物进行筛选的步骤。在本发明的一种优选实施方式中,所述薄壳山核桃的品种为‘波尼’和‘绍兴’。下面将结合实施例对本发明的技术方案进行进一步地说明。实施例1提取薄壳山核桃基因组dna的提取如图1所示,分别采集薄壳山核桃‘波尼’和‘绍兴’品种雄花和叶片(从下往上第5对)样品,采用试剂盒提取基因组dna(提取试剂盒购自上海生工植物基因组),其中泳道1、2、3和4分别为波尼叶、波尼雄花、绍兴叶和绍兴雄花的dna样品。随后将提取得到的薄壳山核桃基因组dna等质量混合,进行后续体系优化。实施例2薄壳山核桃基因组dna双酶切用ecorⅰ和mspⅰ,对薄壳山核桃基因组dna样品分别进行双酶切反应。取6份实施例1得到的混合dna样品,酶切体系为:400ngdna,0.3μlecori-hf(20u/μl),0.3μlmspi(20u/μl)或0.3μlhpaⅱ(20u/μl),2μlcutsmartbuffer,无菌水补足至20μl。37℃水浴进行酶切,酶切时间分为6个时间梯度,分别为1h、2h、5h、8h、11h和14h,每一时间梯度酶切结束后放入pcr仪65℃20分钟对酶灭活。图2为薄壳山核桃基因组dna用mspi进行双酶切后的电泳图。如图2所示,在第1h、2h、5h、8h、11h和14h分别为对混合dna样品酶切1h、2h、5h、8h、11h和14h后的状态。其结果表明5h酶切时间能保证酶切充分且耗时少。实施例3将双酶切产物与接头引物进行连接从实施例1混合dna样品中重新取5份dna样品,应用实施例2的酶切方法进行5h的酶切,同时设置5管20μl无菌水作为空白对照进行37℃水浴。酶切结束后进行连接,体系为:酶切产物20μl,0.1μlt4(400u/μl),2.5μlatp(10mm),eadaptor(上下游接头混合,均为50μm)和h/madaptor(上下游接头混合,均为50μm)均为0.5μl,无菌水补足至25μl。对照每管各加0.5μleadaptor和0.5μlh/madaptor,无菌水补足至25μl。连接时间设5个梯度,分别为2h、5h、8h、11h和14h,每一时间梯度连接结束后65℃加热10分钟对连接酶灭活。如图3所示,图3中m为2000bpmarker,b2、b5、b8、b11和b14分别为连接2h、5h、8h、11h和14h的空白对照,l2、l5、l8、l11和l14分别为连接2h、5h、8h、11h和14h的状态,p2、p5、p8、p11和p14分别为以2h、5h、8h、11h和14h连接产物为模板的预扩产物。其结果表明5h为最佳连接时间,能保证连接充分且耗时少。实施例4预扩增反应将实施例3得到的连接产物进行预扩增得到预扩增产物,所述预扩增反应体系为:1.5μl连接产物、0.2μlextaq酶、2μldntp、预扩增引物pre-e和pre-h/m各1.5μl,2.5μl10×extaqbuffer,无菌水补足至25μl。所述薄壳山核桃预扩增反应各因素体积水平如表1所示:表1薄壳山核桃预扩增反应各因素体积水平上述预扩增反应条件为:72℃缓冲5min,94℃预变性3min;94℃变性30s,56℃退火30s,72℃延伸80s,共30个循环;72℃延伸10min,10℃保存。随后对薄壳山核桃预扩增反应的因素水平进行试验,其结果如表2所示:表2薄壳山核桃预扩增反应的因素水平试验如图4所示,上述薄壳山核桃预扩增反应的因素水平进行试验结果表明5号体系效果最优。实施例5选择性扩增反应因预扩产物的量会影响选扩的效果,因此先对预扩产物进行稀释倍数的优化,设置1倍、10倍、20倍、40倍、60倍、80倍100倍和200倍等8个稀释倍数梯度,进行选扩增反应,根据扩增效果,筛选最优稀释倍数。如图5所示,预扩产物以稀释60倍为最佳。随后,将稀释60倍的预扩增产物进行选择性扩增,所述选择扩增反应体系为:稀释60倍的预扩增产物1.5μl、extaq酶0.2μl、1.5μldntp、选择扩增引物en1.5μl、选择扩增引物hmn1.5μl、2.5μl10×extaqbuffer,无菌水补足至25μl。所述薄壳山核桃选择性扩增反应各因素体积水平如表3所示:表3薄壳山核桃选扩增反应各因素体积水平上述选择性扩增的反应条件为94℃变性3min;94℃变性30s,65℃退火30s,72℃延伸80s,每轮递减0.7℃,13个循环;94℃变性30s,56℃退火30s,72℃延伸80s,共25轮;72℃延伸10min;10℃保存。随后对薄壳山核桃选择性扩增反应的因素水平进行试验,其结果如表4所示:表4薄壳山核桃选扩增反应的因素试验如图6所示,上述薄壳山核桃选择性扩增反应的因素水平进行试验结果表明13号体系效果最优。实施例6对选择扩增的产物进行凝胶电泳及银染显色。(1)制胶:将大、小(一端凹形)两块玻璃板用水冲洗干净,水擦干后用纸擦两遍酒精。在大板上涂两遍亲和硅烷溶液(2ml无水乙醇,15ul冰醋酸和15ul亲和硅烷混匀),在小板上涂一遍剥离硅烷,待两块板晾干后,在大板两边放上边条,将两块玻璃板对齐放在一起,夹上夹子。配制凝胶(75ml5%pa胶(丙烯酰胺47.5g,甲叉双丙烯酰胺2.5g,尿素420g,10×tbe50ml,超纯水定容至1l),160μl10%过硫酸铵,80μltemed),混匀后沿灌胶口灌进,同时轻轻敲打玻璃板,待胶流动到底部,在灌胶口轻轻插入梳子(梳齿的背面插入两个玻璃中间),夹上夹子,放至胶凝固(聚合时间一个小时以上)。(2)电泳:将胶上到电泳槽上,两边拧紧,注入1×tbe。启动电源(电压3000v,电流200ma,功率90w,恒功率电泳),每隔五分钟用洗耳球或移液枪吹吸一次,以驱赶多余的尿素和气泡(吹吸的时候关闭电源,吹吸结束重新启动电泳,进行五次左右),预电泳约半小时。预电泳结束后,将梳子齿端插入胶中(插梳子时每个梳齿都进到玻璃中间,再均衡用力,一点一点插入梳子)。吸取2μlpcr样品和10μlloadingbuffer混匀,放入pcr仪中加热变性五分钟,取出后立即冰浴待用。用移液枪吸取3μl样品上样,两边点入20bpmarker,进行90w恒功率电泳,至第一条loadingbuffer带至胶板的另一端时停止电泳(一个小时左右)。(3)银染:将胶取出后,把两块玻璃分开,边条取下。将粘附胶的大板放入超纯水中置于摇床上摇晃约3分钟后,放入染色液中(3.5g硝酸银溶于2l超纯水中)摇晃3分钟,取出后放入超纯水中冲一下拿出,再放入显影液中(28g的氢氧化钠于2l超纯水中溶解,再加入8ml的甲醛混匀)直到条带染出,将胶立即拿出,用水冲洗3次。然后置于室温下自然干燥,晾干后用扫描仪扫描,保存图片。图7为引物筛选银染显色图,从图7可以看到清晰的dna甲基化多态性扩增条带。根据不同的引物组合的电泳图谱条带多态性,采用酶切的预扩增产物进行masp筛选,从90对masp引物组合中,筛选出42对条带清晰且稳定多态的引物组合(表5中打√部分)。所述引物筛选结果如表5所示:表5:薄壳山核桃msap引物筛选结果h/m1h/m2h/m3h/m4h/m5h/m6h/m7h/m8h/m9e1123456789√√√√√√e2101112131415161718√√√√√e3192021222324252627√√√√e4282930313233343536√√√√√e5373839404142434445√√√e6464748495051525354√√e7555657585960616263√√√√e8646566676869707172√√√√e9737475767778798081√√√√√e10828384858687888990√√√√图8为引物对e1-h/m1(e1:5’-gactgcgtaccaattcaac-3’,h/m1:5’-gatgagtctagaacggtac-3’)选扩增的结果。其中:编号1为波尼叶,2为波尼雄花,3为绍兴叶,4为绍兴雄花;h和m分别为ecori/hpaii和ecori/mspi的酶切产物对应的选扩产物;typei(1,1),typeii(1,0),typeiii(0,1)和typeiv(0,0)为产生的4种模式,分别表示未甲基化、半甲基化、全甲基化和超甲基化(或位点变异)。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1