一种鸭瘟病毒UL41基因无痕缺失株CHv-BAC-G-ΔUL41及其构建方法与流程
本发明属于基因工程技术领域,具体涉及一种鸭瘟病毒ul41基因无痕缺失株chv-bac-g-δul41及其构建方法。
背景技术:
细菌人工染色体(bacterialartificialchromosome,bac)是一种承载dna大片段的克隆载体系统,1997年以来,成功引入疱疹病毒研究领域,与其他载体系统相比,它具有转化效率高、嵌合体少、插入片段易回收,高覆盖率、稳定性强,并且具有易分离和操作等特性等优点,这种优势使它迅速成为人类基因组文库构建和图谱分析等的有力工具。
bac构建的基础是e.coli及f因子。将完整病毒基因组dna分子插入bac载体,利用该载体编码的最小生育力因子复制子(minimalfertilityfactorreplicon,mini-f)获得分子克隆化病毒,并结合大肠杆菌中成熟的基因定位修饰技术,从而实现在原核系统中病毒基因的缺失及外源基因的插入。目前较为常用的大肠杆菌基因定位修饰技术主要包括red/et介导的同源重组技术、reca蛋白介导的同源重组技术、cre/loxp介导的同源重组技术以及tn转座子介导的随机插入和突变技术。利用分子克隆化技术手段现已获得成熟的细菌人工染色体鸭瘟病毒拯救系统平台,同时利用大肠杆菌基因定位修饰red/et介导的同源重组技术可在细菌人工染色体鸭瘟病毒拯救系统平台上进行鸭瘟病毒基因的缺失和外源基因的插入,该成果极大的推动了鸭瘟病毒基因功能的研究进程。
鸭瘟(duckplague,dp)是由鸭瘟病毒(duckplaguevirus,dpv)感染鸭、鹅和天鹅等其他雁形目禽类引起的一种急性、热性、败血性传染病,其发病率高,致病性强,常常导致严重的发病和死亡、鸭群产蛋下降,经济损失严重。且该病在我国华南、华中和华东等养鸭业较为发达的地区流行,给我国的养鸭业造成了严重的经济损失。因此深入了解鸭瘟病毒基因功能、加强对鸭瘟疫病的研究对确保我国养鸭业健康、可持续发展尤为重要。
鸭瘟病毒属于α-疱疹病毒亚科,具有疱疹病毒典型结构,由dna核心、衣壳、皮层和囊膜组成,其中皮层是位于核衣壳与囊膜之间一层无固定形状的蛋白层,皮层主要由20多种不同的蛋白质组成,在病毒进入和病毒体的形态发生期间发挥重要的作用,当病毒与细胞质膜融合后,外膜蛋白与衣壳进入细胞并且协助宿主细胞来影响病毒粒子的成熟,还能影响病毒颗粒在细胞内的运输、病毒组装与释放、对病毒或宿主基因转录与表达的调控以及病毒免疫逃逸等。因此探究皮层蛋白在鸭瘟病毒生命周期及免疫逃逸等方面的作用对深入探究鸭瘟病毒基因功能及开展鸭瘟疫病防治工作至关重要。
现有技术中利用以bac为平台分子克隆化病毒的技术,将鸭瘟病毒基因组重组到含有bac的病毒转移载体中,构建细菌人工染色体重组鸭瘟病毒拯救系统平台dpvchv-bac-g。同时结合red/et修饰技术,在原核系统中通过成熟的基因操作手段完成鸭瘟病毒基因缺失和外源基因插入。但利用red/et修饰技术在细菌人工染色体重组鸭瘟病毒拯救系统平台上对鸭瘟病毒基因缺失后,会在缺失基因处残余两处frt位点。frt外源位点的残留对基因功能的探究、减毒活疫苗的开发和许可存在影响。
技术实现要素:
针对现有技术中的上述不足,本发明提供一种鸭瘟病毒ul41基因无痕缺失株chv-bac-g-δul41及其构建方法,可有效解决缺失鸭瘟病毒基因时在缺失位点残留碱基的问题。
为实现上述目的,本发明解决其技术问题所采用的技术方案是:
一种鸭瘟病毒ul41基因无痕缺失株chv-bac-g-δul41的构建方法,包括以下步骤:
(1)将pbac-dpv质粒转化到gs1783大肠杆菌感受态中,获得gs1783-pbac-dpv菌株,然后制备gs1783-pbac-dpv感受态;
(2)以pepkan-s为模板,以gs1783-bac-δul41-f和gs1783-bac-δul41-r为引物,通过pcr方法扩增包含i_scei酶切位点和kana元件的碱基片段以及ul41基因上游和下游各40bp同源臂的打靶片段i_scei-kana-δul41,切胶回收,获得i_scei-kana-ul41片段;
(3)将i_scei-kana-ul41片段转化到gs1783-pbac-dpv感受态中,经筛选及pcr鉴定,获得阳性克隆子gs1783-pbac-dpv-ul41-kana;
(4)去掉阳性克隆子gs1783-pbac-dpv-ul41-kana中的i_scei-kana片段,经抗生素及pcr筛选,测序鉴定后获得阳性克隆子gs1783-pbac-dpv-δul41;
(5)从阳性克隆子gs1783-pbac-dpv-δul41中提取pbac-dpv-δul41质粒,用pbac-dpv-δul41质粒转染def细胞,通过克隆筛选,获得鸭瘟病毒缺失ul41基因的无痕缺失株chv-bac-g-δul41。
进一步地,步骤(2)中pcr扩增体系为:ddh2o22μl、
进一步地,步骤(2)中pcr扩增条件为:98℃预变性2min、98℃变性10s、55℃退火15s、72℃延伸5s,共30个循环,最后72℃延伸10min。
进一步地,步骤(2)中引物序列为:
gs1783-bac-δul41-f:5’-attacgggacaacagcgccgaaacgtaagacgacaatacatagggataacagggtaatcgattt-3’;
gs1783-bac-δul41-r:5’-ctattaatagtttaaataaaaactcttacaacagttaatctgtattgtcgtcttacgtttcggcgctgttgtcccgtaatgccagtgttacaaccaat-3’。
上述方法制备得到的鸭瘟病毒ul41基因无痕缺失株chv-bac-g-δul41。
本发明的有益效果为:
本发明在细菌人工染色体重组鸭瘟病毒拯救系统平台的基础上,利用red-based修饰技术,即利用含有可同时编码red操纵子和i_scei酶基因序列的gs1783大肠杆菌菌株及含有编码卡那抗性及i_scei酶切位点的质粒pepkan-s,在细菌人工染色体重组鸭瘟病毒拯救系统平台上经两次同源重组缺失鸭瘟病毒ul41基因,首次完成了无外源碱基残留的鸭瘟病毒无痕缺失株的构建;解决了缺失鸭瘟病毒基因时在缺失位点残留碱基的问题,为准确探究鸭瘟病毒基因功能及减毒活疫苗的构建提供了充分的技术支持。
附图说明
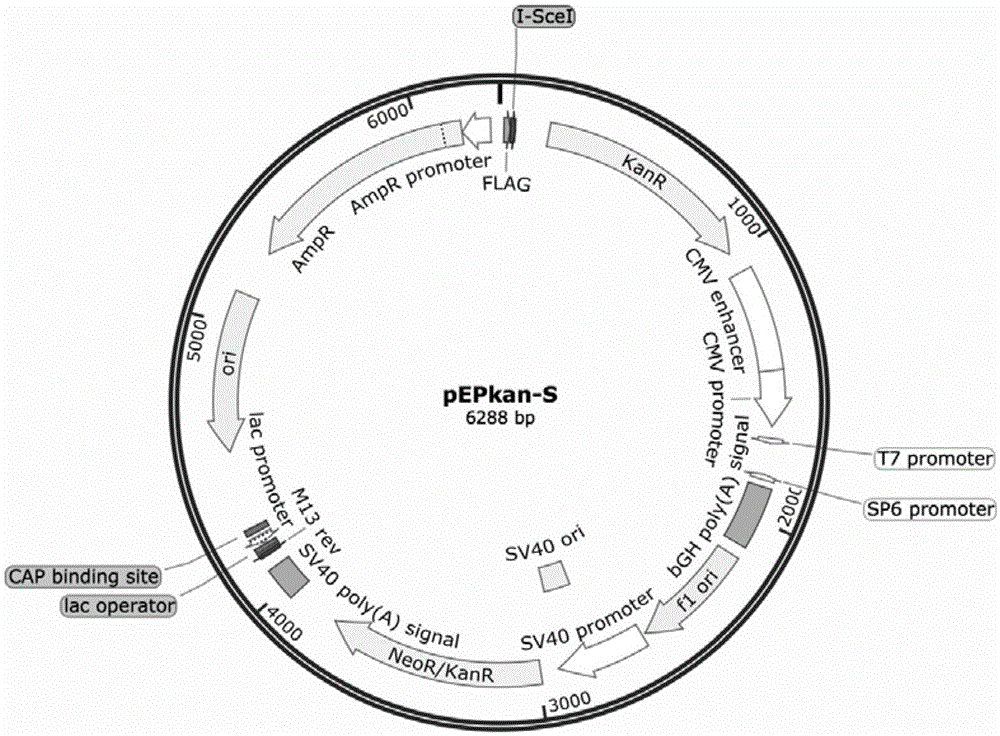
图1为pepkan-s质粒图谱;
图2为利用red-based修饰技术在细菌人工染色体重组鸭瘟病毒拯救系统平台上进行ul41基因缺失的操作流程图;
图3为将i_scei-kana-ul41打靶片段电击转化到gs1783-pbac-dpv感受态中阳性克隆鉴定图;
图4为将阳性克隆子gs1783-pbac-dpv-ul41-kana中的i_scei-kana片段去掉后的鉴定图;
图5为ul41基因无痕缺失株chv-bac-g-δul41病毒拯救后荧光斑图片;
图6为抽提chv-bac-g-δul41病毒基因组dna后的pcr图;其中,图6a为chv-bac-g-δul41病毒基因组的pcr图;图6b为chv-bac-g病毒基因组的pcr图。
具体实施方式
下面对本发明的具体实施方式进行描述,以便于本技术领域的技术人员理解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保护之列。
一种鸭瘟病毒ul41基因无痕缺失株dpvchv-bac-g-δul41,构建过程所用材料及试剂如下:
1、实验材料
(1)细胞、菌株、病毒毒株、质粒
原代鸭胚成纤维细胞由10-11日龄非免疫受精鸭胚按常规方法制备;gs1783菌株由四川农业大学实验室保存;pbac-dpv质粒由四川农业大学实验室构建并保存;pepkan-s质粒由四川农业大学实验室保存。
2、分子生物学试剂
质粒小提试剂盒购自tiangen公司;qiagenplasmidmidikit购自qiagen公司;普通琼脂糖凝胶dna回收试剂盒购自tiangen公司;
3、实验所用溶液及其配制
lb液体培养基:称取tryptone10g、yeastextract5g、氯化钠10g溶于800ml去离子水中,充分搅拌,定容至ll,高温高压灭菌。
lb固体培养基:在定容至1l的lb液体培养基中加入15g琼脂粉,高温高压灭菌后,冷却至60℃左右,加入1.5ml氯霉素(储存浓度25mg/ml)或1.5ml卡那霉素(储存浓度50mg/ml),铺制平板,待凝固后,4℃保存。
mem:将9.6gmem干粉和2.2g碳酸氢钠溶于800ml去离子水,充分搅拌,调节ph值至7.4,定容至ll,过滤除菌,4℃保存。
实施例1制备鸭瘟病毒ul41基因无痕缺失株chv-bac-g-δul41
构建鸭瘟病毒ul41基因无痕缺失株chv-bac-g-δul41,其构建方法包括以下步骤:
1、制备gs1783电转感受态,电转化pbac-dpv质粒
(1)将带有pbac-dpv质粒的大肠杆菌置于含有氯霉素的lb固体培养基中复苏,37℃培养过夜;挑取单菌落接种于含有氯霉素的lb液体培养基中,37℃培养过夜;
(2)按照qiagenplasmidmidikit(购自qiagen公司)操作说明提取pbac-dpv质粒;
(3)于lb固体培养基中复苏gs1783冻存菌,30℃培养过夜;
(4)挑取gs1783单菌落接种于5mllb液体培养基中,30℃培养过夜,获得种子液;
(5)将5ml种子液加入100mllb液体培养基中,30℃摇至od600值在0.5~0.7之间;
(6)将步骤(5)所得菌液立即放入冰水混合物中冷却20min;
(7)取步骤(6)所得菌液,4℃、4500×g离心10min去上清;
(8)用预冷超纯水在冰上反复清洗步骤(7)菌体沉淀;
(9)向步骤(8)所得菌体中加入超纯水将菌液定容至500μl,每管100μl分装至预冷ep管,获得gs1783电转感受态;
(10)在100μlgs1783电转感受态中加入20ngpbac-dpv质粒,混匀后将感受态和质粒一起加入2mm预冷的电击杯底部,在15kv/cm的条件下进行电击;
(11)取100μllb液体培养基重悬电击后菌体,30℃摇菌1h后,4500×g离心菌体2min,弃上清,采用200μllb液体培养基悬浮沉淀,涂布在含有氯霉素的lb固体培养基上,30℃培养24h,获得gs1783-pbac-dpv菌株。
2、扩增i_scei-kana-ul41打靶片段
(1)将带有pepkan-s质粒的大肠杆菌置于含有卡那霉素的lb固体培养基中复苏,37℃培养过夜;挑取单菌落接种于含有卡那霉素的lb液体培养基中,37℃培养过夜,采用质粒小提试剂盒提取pepkan-s质粒(pepkan-s质粒图谱见图1);
(2)以pepkan-s质粒为模板,设计用于进行pcr扩增的引物gs1783-bac-δul41-f和gs1783-bac-δul41-r,扩增包含i_scei酶切位点和kana元件的碱基片段以及ul41基因上游和下游各40bp同源臂的打靶片段i_scei-kana-ul41,采用普通琼脂糖凝胶dna回收试剂盒(购自tiangen公司)回收扩增片段,获得i_scei-kana-ul41片段;引物具体序列如下:
gs1783-bac-δul41-f:5’-attacgggacaacagcgccgaaacgtaagacgacaatacatagggataacagggtaatcgattt-3’(seqidno:1)
gs1783-bac-δul41-r:5’-ctattaatagtttaaataaaaactcttacaacagttaatctgtattgtcgtcttacgtttcggcgctgttgtcccgtaatgccagtgttacaaccaat-3’(seqidno:2)
pcr扩增体系为:ddh2o22μl、
pcr扩增条件为:98℃预变性2min、98℃变性10s、55℃退火15s、72℃延伸5s,共30个循环,最后72℃延伸10min,于16℃保存。
利用red-based修饰技术在细菌人工染色体重组鸭瘟病毒拯救系统平台上进行ul41基因缺失的操作流程见图2,具体过程包括步骤3和步骤4。
3、制备gs1783-pbac-dpv电转感受态进行打靶片段打靶
(1)将gs1783-pbac-dpv冻存菌置于含有氯霉素的lb固体培养基中复苏,30℃培养过夜;
(2)挑取gs1783-pbac-dpv单菌落接种于5ml含氯霉素的lb液体培养基中,30℃培养过夜,获得种子液;
(3)将5ml种子液加入100ml含氯霉素的lb液体培养基中,置于30℃摇至od600值在0.5~0.7之间;
(4)将步骤(3)所得菌液于42℃培养15min后立即放入冰水混合物中冷却20min;
(5)取50ml步骤(4)所得菌液,于4℃4500×g离心10min,去上清;
(6)用预冷超纯水在冰上反复清洗步骤(5)菌体沉淀;
(7)向步骤(6)所得菌体中加入超纯水将菌液定容至500μl,每管100μl分装至预冷ep管,获得gs1783-pbac-dpv电转感受态;
(8)在100μl电转感受态中加入200ngi_scei-kana-ul41打靶片段,混匀后将感受态和打靶片段一起加入2mm预冷的电击杯底部,在15kv/cm的条件下进行电击;
(9)取100μllb液体培养基重悬电击后菌体,30℃摇菌1h后,于4500×g离心菌体2min,弃上清,200μllb液体培养基悬浮沉淀,涂布于含有卡那霉素和氯霉素双抗生素抗性的lb固体培养基,于30℃培养48h;
(10)pcr鉴定步骤(9)所得单菌落,获得阳性菌落gs1783-pbac-dpv-ul41-kana,以步骤(9)中生长的单菌落重悬液为模板,利用扩增i_scei-kana-ul41打靶片段上游引物seqidno:1和鉴定ul41基因下游引物ul41-r鉴定阳性菌落,获得阳性克隆子gs1783-pbac-dpv-ul41-kana(图3);引物具体序列如下:
ul41-r:5’-ttccctctggcgtttat-3’(seqidno:3)
pcr扩增体系为:ddh2o22μl、
pcr扩增条件为:98℃预变性2min、98℃变性10s、55℃退火15s、72℃延伸5s,共30个循环,最后72℃延伸10min,于16℃保存。
4、去掉i_scei-kana片段
(1)挑取gs1783-pbac-dpv-ul41-kana单菌落接种于2ml含氯霉素的lb液体培养基中,30℃培养过夜,获得种子液;
(2)取10μl步骤(1)所得种子液接种于2ml含氯霉素的lb液体培养基中,30℃培养2h至菌液呈现轻微云雾状;
(3)向步骤(2)所得菌液中加入1ml含氯霉素的lb液体培养基和5m终浓度为2%的l-阿拉伯糖,30℃培养1h;
(4)将步骤(3)所得菌液立即放入42℃水浴中培养30min;
(5)将步骤(4)所得菌液置于30℃培养2h后,取1μl菌液加入200μllb液体培养基中混匀后涂布到含有氯霉素的lb固体培养基,30℃培养24h~48h;
(6)挑取步骤(5)中所得单菌落在含氯霉素和卡那霉素双抗性lb固体培养基和氯霉素单抗性lb固体培养基上进行平行筛选,将氯霉素和卡那霉素双抗性lb固体培养基不生长,氯霉素单抗性lb固体培养基生长的菌落通过pcr方法利用ul41基因鉴定引物seqidno:3和ul41-f鉴定,获得阳性克隆子gs1783-pbac-dpv-δul41(图4);引物序列如下:
ul41-f:5’-caactctggctatttaacc-3’(seqidno:4)
ul41-r:5’-ttccctctggcgtttat-3’(seqidno:3)
pcr扩增体系为:ddh2o22μl、
pcr扩增条件为:98℃预变性2min、98℃变性10s、55℃退火15s、72℃延伸5s,共30个循环,最后72℃延伸10s,于16℃保存。
5、拯救病毒
(1)将gs1783-pbac-dpv-δul41冻存菌置于于含有氯霉素的lb固体培养基中复苏,30℃培养过夜;
(2)按照qiagenplasmidmidikit操作说明提取pbac-dpv-δul41质粒;
(3)制备鸭胚成纤维细胞(def)并接种于12孔板,37℃,5%co2培养24h后,按照lipofectamine3000(购自invitrogen公司)操作说明转染pbac-dpv-δul41质粒,72h后观察荧光斑,收集病毒,反复冻融三次后接种于长满def的6空斑,72h后观察荧光斑,获得ul41基因无痕缺失株chv-bac-g-δul41(见图5)。
实施例2chv-bac-g-δul41病毒基因组dna特性
(1)制备鸭胚成纤维细胞(def)并接种于6孔板,37℃,5%co2培养24h后,分别用dpvchv-bac-g和ul41基因无痕缺失株chv-bac-g-δul41感染def细胞,37℃,5%co2孵育2h后,换维持液(2%小牛血清)继续在37℃,5%co2中培养至48h,按照tianampvirusdna/rnakit(购自tiangen公司)操作说明书抽提细胞中的病毒基因组dna;
(2)分别以上述基因组dna为模板,分别用dpv-gc上下游引物gc-f和gc-r,bac元件sopb、repe上下游引物sopb-f、sopb-r、repe-f、repe-r,ul41鉴定引物seqidno:3和seqidno:4做pcr鉴定(图6,其中,图6a为chv-bac-g-δul41病毒基因组的pcr图;图6b为chv-bac-g病毒基因组的pcr图),引物具体序列如下:
gc-f:5’-cggaattccaaaacgccgcacagatgac-3’(seqidno:5)
gc-r:5’-ccctcgaggtattcaaataatattgtctgc-3’(seqidno:6)
sopb-f:5’-attcgttaattgcgcgcgtagg-3’(seqidno:7)
sopb-r:5’-gaatattcaggccagttatgct-3’(seqidno:8)
repe-f:5’-catggcggaaacagcggttatc-3’(seqidno:9)
repe-r:5’-atgtatgagaggcgcattggag-3’(seqidno:10)
pcr扩增体系为:ddh2o22μl、
pcr扩增条件为:98℃预变性2min、98℃变性10s、55℃退火15s、72℃延伸5s,共30个循环,最后72℃延伸10s,于16℃保存。
实施例3无痕缺失株chv-bac-g-δul41生长曲线的测定
1、一步生长曲线的测定
将亲本病毒dpvchv-bac-g和ul41基因无痕缺失株chv-bac-g-δul41分别以2moi接种def细胞,接毒后6h、12h、18h、24h收集上清和细胞,每个时间点做三次重复。待收集完全后,反复冻融2次,于96孔板检测病毒滴度,结果表明ul41基因的缺失部分影响dpvchv病毒的复制。
2、多步生长曲线的测定
将亲本病毒dpvchv-bac-g和ul41基因无痕缺失株chv-bac-g-δul41分别以0.01moi接种def细胞,接毒后12h、24h、48h、72h收集上清和细胞,每个时间点做三次重复。待收集完全后,反复冻融2次,于96孔板检测病毒滴度,结果表明ul41基因的缺失显著影响dpvchv病毒的增殖情况。
实施例4无痕缺失株chv-bac-g-δul41空斑形成实验
将亲本病毒dpvchv-bac-g和ul41基因无痕缺失株chv-bac-g-δul41分别以0.01moi接种布满def细胞的6孔板,37℃、5%co2吸附2h后,去上清,加入2ml1%甲基纤维素,37℃、5%co2培养48h后,去1%甲基纤维素,pbs洗涤3次,4%多聚甲醛4℃固定过夜,pbs洗涤3次,加入h2o2和甲醇以体积比为1:50混合的混合液,室温孵育30min,蒸馏水洗涤3次,加入5%bsa封闭液,室温孵育30min,加入兔抗dpv,4℃孵育过夜,pbs洗涤3次,加入生物素化山羊抗兔igg,37℃孵育30min,pbs洗涤3次,滴加sabc底物,37℃孵育30min,pbs洗涤3次,dab显色液避光显色,封片,结果表明ul41基因的缺失可能影响dpvchv病毒在细胞内增殖及传播情况。
本发明还对鸭瘟病毒ul41基因无痕缺失株chv-bac-g-δul41进行了遗传稳定性实验。
遗传稳定性:鸭瘟病毒ul41基因无痕缺失株chv-bac-g-δul41在def细胞上传代20代,所有蚀斑均有绿色荧光,表明所获得的鸭瘟病毒ul41基因无痕缺失株chv-bac-g-δul41稳定遗传。
序列表
<110>四川农业大学
<120>一种鸭瘟病毒ul41基因无痕缺失株chv-bac-g-δul41及其构建方法
<160>10
<170>siposequencelisting1.0
<210>1
<211>64
<212>dna
<213>人工序列(artificialsequence)
<400>1
attacgggacaacagcgccgaaacgtaagacgacaatacatagggataacagggtaatcg60
attt64
<210>2
<211>98
<212>dna
<213>人工序列(artificialsequence)
<400>2
ctattaatagtttaaataaaaactcttacaacagttaatctgtattgtcgtcttacgttt60
cggcgctgttgtcccgtaatgccagtgttacaaccaat98
<210>3
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>3
ttccctctggcgtttat17
<210>4
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>4
caactctggctatttaacc19
<210>5
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>5
cggaattccaaaacgccgcacagatgac28
<210>6
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>6
ccctcgaggtattcaaataatattgtctgc30
<210>7
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>7
attcgttaattgcgcgcgtagg22
<210>8
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>8
gaatattcaggccagttatgct22
<210>9
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>9
catggcggaaacagcggttatc22
<210>10
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>10
atgtatgagaggcgcattggag22
- 还没有人留言评论。精彩留言会获得点赞!