一种传染性肌肉坏死病毒的检测方法与流程
本发明属于病毒检测技术领域,具体涉及一种传染性肌肉坏死病毒的检测方法。
背景技术:
水产养殖是指在人为控制的条件下繁养、培育并且收获水生动植物的生产活动。病毒性疾病是水产养殖中影响产量的重要因素,密集和多样的养殖方式使得许多病毒有了可乘之机,传染性肌肉坏死病毒(imnv)就是其中之一,南美白对虾是已知imnv的最易感虾种,在生长的各个阶段均可被感染。该病第一次于2002年出现于巴西的凡纳滨对虾养殖厂,2006年传入印度尼西亚,感染虾出现体色发白、腹节发红、尾部肌肉组织呈点状或扩散状,体表有不规则黑斑的症状,死亡率在40%~70%不等。
imnv为双链rna病毒,主要侵染南美白对虾的横纹肌组织,检测手段是发现感染性疾病的方法之一,针对该病毒核酸序列的研究使建立灵敏、特异的检测方法、发展有效的治疗措施成为可能。imnv病毒核酸为双链不分节段的rna,不同株的总核苷酸数有些许差别,但大约为8226-8230bp,具有两个不重叠的开放阅读框(orf),orf1编码rna结合蛋白、主要衣壳蛋白,orf2编码rna依赖的rna聚合酶,是相对保守的区域。截止到目前为止,genbank中共有该病毒的序列共有18个结果,其中nc-007915与ay570982相同,全基因组序列7个,10个imnv的部分基因序列。
imnv的检测方法包括免疫学检测方法和以核酸为基础的检测方法,免疫学检测方法的原理是利用特异的抗原抗体反应来检测病毒的方法,不同于病毒的分离培养,免疫学的方法用时短,不需要特定的实验室条件,可以发展为商品化的试剂盒,方便快捷,适合于塘边检测。以核酸为基础的检测方法由于高灵敏度和高特异性的特点,已经广泛用于实验室检测。目前我国尚未报道imnv感染对虾的案例,但随着经济全球化进程的不断深入,跨境交流越来越频繁,外来疫病的传入的风险也随之扩大,控制风险的主要方式是加强入境动物的检疫,准确、灵敏、重复性好,且易于标准化的检测方法是出入境对虾检疫所迫切需要的。现有imnv的荧光定量pcr检测方法将研究重点放在灵敏度和特异性上,而忽略了重复性,重复性差导致无法获得准确的检测结果。
技术实现要素:
本发明的目的在于提供一种传染性肌肉坏死病毒的检测方法,该检测方法设计特异性引物和探针,检测灵敏度高、特异性强,且检测结果的可重复性高,对操作人员技术要求低,易于实现标准化。
本发明采用的技术方案如下:
一种传染性肌肉坏死病毒的检测方法,包括以下步骤:
(1)引物设计:查找genbank中的传染性肌肉坏死病毒的全基因序列,以全基因组的5’-3’的第835个碱基至第901个碱基为目的序列,使用primrpremier软件设计特异性引物与taqman探针,序列如下,方向5’→3’:
正向引物:gaagcctaaatacacatcgac;
反向引物:ctgcttcgctaaaacctg;
探针:aaaaccggagctgaccac,5’端用fam标记,3’端用bhq-1标记;
(2)优化荧光定量pcr反应体系和反应条件;
(3)提取含有目的序列的质粒标准品,作为荧光定量pcr阳性模板,进行质粒浓度检测,计算出重组质粒的拷贝数,以10倍稀释度将质粒进行倍比稀释,将其作为标准质粒模板,并设立无模板对照,进行荧光定量pcr扩增,获得扩增曲线和标准曲线;
(4)提取待测样品的病毒rna,进行荧光定量pcr扩增,检测所提取病毒是否为传染性肌肉坏死病毒阳性。
进一步地,步骤(3)中,荧光定量pcr反应体系为:反应总体积25μl,其中
进一步地,荧光定量pcr的条件为:94℃预变性5min,95℃变性15s,60℃退火延伸1min,40个循环。
进一步地,步骤(4)中,荧光定量pcr反应体系为:反应总体积为25μl,其中2*onesteprt-pcrbufferiii12.5μl、takaraextaqhs0.5μl、primescriptrtenzymemixii0.5μl、正向引物1μl、反向引物1μl、探针0.7μl、ddh206.8μl,模板2μl。
进一步地,荧光定量pcr的条件为:42℃预变性5min,95℃变性10s,95℃退火10s,60℃延伸1min,40个循环。
进一步地,步骤(3)中,将质粒标准品稀释成108-101拷贝/μl的8个浓度梯度作为标准质粒模板。
进一步地,步骤(3)中,采用ddh2o作为无模板对照。
进一步地,步骤(3)中,含有目的序列的质粒标准品为:使用步骤(1)中的特异性引物扩增出目的序列,将目的序列连入puc57-simple载体,然后转化到大肠杆菌中进行扩繁,从大肠杆菌中提取所需含有目的序列的质粒标准品。
综上所述,由于采用了上述技术方案,本发明的有益效果是:
1、本发明以全基因组的5’-3’的第835个碱基至第901个碱基为目的序列,设计特异性引物和探针,检测灵敏度高、特异性强,且检测结果的重复性高,准确可靠,对操作人员技术要求低,易于实现标准化,尤其适用于出入境对虾的检疫;
2、本发明在荧光体系中增加逆转录酶,同时实现逆转录和荧光定量pcr扩增,简化操作步骤,提高检测效率。
附图说明
图1为质粒标准品扩增结果;
图2为质粒标准品扩增产物的琼脂糖凝胶电泳结果;
图3为退火,延伸温度优化结果;
图4为引物浓度优化结果;
图5为探针浓度优化结果;
图6为特异性实验扩增结果(dna组);
图7为特异性实验扩增结果(rna组);
图8为灵敏度测定结果;
图9为定量标准曲线。
具体实施方式
本说明书中公开的所有特征,除了互相排斥的特征和/或步骤以外,均可以以任何方式组合。
使用本发明设计的特异性引物扩增出目的序列,将目的序列连入puc57-simple载体,然后转化到大肠杆菌中进行扩繁,该携带有目的序列质粒的大肠杆菌由华大基因生物技术有限公司合成并提供。
实施例1
含有目的序列的质粒标准品的提取过程为:
将携带有目的序列质粒的大肠杆菌转移至装有5ml含氨苄青霉素的lb液体培养基的试管中,置于恒温水浴摇床,37℃震荡16h,250rpm。
按照质粒小提试剂盒离心柱型(tianprepminiplasmidkit,dp103,天根)的使用说明提取质粒标准品。柱平衡步骤:吸附柱cp3放入收集管中,向吸附柱中加入500μl的平衡液bl,12000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。取3mllb液体培养基的菌液加入离心管中,使用台式离心机,12000rpm离心1min,吸除上清,向留有菌体沉淀的离心管中加入250μl含有rnasea的溶液p1,使用涡旋振荡器使细菌沉淀彻底悬浮,然后向离心管中加入250μl溶液p2,缓慢地上下翻转6-8次使菌体充分裂解,翻转步骤在5min之内完成,然后向离心管中加入350μl溶液p3,立刻缓慢地上下翻转6-8次,充分混匀,此时出现白色絮状沉淀,12000rpm离心10min,收集上清液,转移到吸附柱cp3中,12000rpm离心50s,倒掉收集管中的废液,重新将吸附柱cp3放入收集管中。向吸附柱cp3中加入600μl含有无水乙醇的漂洗液pw,12000rpm离心50s,倒掉收集管中的废液,重新将吸附柱cp3放入收集管中,重复两次后,12000离心2min,去除吸附柱中残余的漂洗液,将吸附柱cp3置于一个干净的离心管中,向吸附膜的中间部位滴加100μl洗脱缓冲液eb,室温放置2min,12000rpm离心2min,将质粒溶液收集到离心管中,使用微量核酸蛋白仪测定所提核酸的浓度为118.40ng/μl,于-36℃保存,分装,避免反复冻融。
本实施例中,含氨苄青霉素的lb液体培养基:蛋白胨10g,酵母粉5g,nacl10g,放入1l烧杯,加去离子水约800ml,充分搅拌至溶质溶解,用5mol/lnaoh调ph至7.0,加水至1l,于121℃高压蒸汽灭菌20min,lb灭菌后冷至50℃时加入氨苄青霉素,摇匀,氨苄青霉素终浓度100μg/ml,于4℃保存。
本实施例中,采用thermo恒温水浴摇床,vortex-genie2漩涡混匀仪,thermo落地式冷冻离心机,以及scandrop100微量核酸蛋白仪。
实施例2
实施例1中提取的质粒标准品使用ddh2o稀释成103、104拷贝/μl,作为模板,并进行荧光定量pcr扩增,反应体系为:反应总体积25μl,其中
将扩增后的产物进行琼脂糖凝胶电泳鉴定。配制1%的琼脂糖凝胶,称量琼脂糖1g,放入干净的三角瓶中,加入1×tae,轻轻混匀,使用微波炉加热熔化至澄清,取出后加入3‰的gelred。倒胶,在制胶模的适当位置插上梳子,胶稍凉后,倒入制胶模。连接电泳槽的电源,设置电压为100v,时间30min。胶冷却后,垂直向上拔出梳子,将胶放入电泳槽,点样孔靠近负极,在电泳槽中加入1×tae没过胶,避免产生气泡影响跑胶进程。在点样前,将样液5μl与1μl6×loadingbuffer在干净手套上混匀后加入梳孔,设置两个平行孔。按start键,看到负极有均匀的小气泡产生证明已经开始电泳,电泳结束后尽快成像。
本实施例中,采用biorodcfx96荧光定量pcr仪,德国耶拿凝胶电泳检测系统,美国bio-red化学发光凝胶成像系统。扩增产物的凝胶电泳图如图2(m:dl2000marker;1-2:质粒标准品扩增产物)所示,结果表明,片段在100bp左右,符合目的片段长度67bp。
实施例3
本实施例中,荧光定量pcr反应体系为:反应总体积25μl,其中
反应体系和反应条件的优化:
退火、延伸温度的优化:采用两步法扩增,不同的退火温度使用荧光定量pcr仪梯度温度功能设置,前期程序仍为:94℃预变性5min,95℃变性15s,温度分别设置为55℃,55.5℃,56.6℃,58.2℃,60.1℃,61.7℃,62.6℃,63.0℃,循环数均设置为40,同时采用ddh2o作为无模板对照孔。
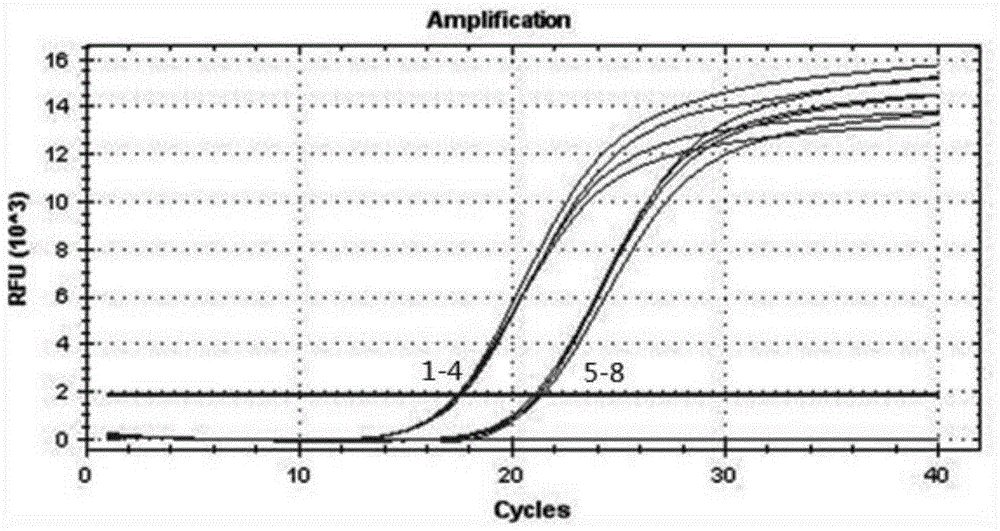
结果如图3所示,横坐标为40时,对应的曲线,从上至下温度依次为60.1℃、61.7℃、58.2℃、56.6℃、55.5℃、55℃、62.6℃、63℃,其中,60.1℃和61.7℃对应的曲线部分重合。结果表明,无模板对照孔无扩增,在55-63℃范围内均出现明显扩增,并采集到较强荧光信号,cq值均在21.69左右,差异不大,相对荧光强度在60.1℃达到13000,较为适中。因此,退火、延伸温度最优为60℃。
引物浓度的优化:体系配制时,使用浓度均为10μmol/l的正向引物和反向引物,正向引物和反向引物分别加入0.6μl,0.8μl,1.0μl,1.2μl,因此,正向引物和反向引物的终浓度分别为0.24μmol/l,0.32μmol/l,0.40μmol/l,0.48μmol/l。每个浓度设立两个平行孔,并采用ddh2o作为无模板对照孔。荧光定量pcr的条件为:94℃预变性5min,95℃变性15s,60℃退火延伸1min,40个循环。
结果如图4所示,横坐标为40时,对应的曲线,从上至下浓度依次为0.48μmol/l、0.48μmol/l、0.40μmol/l、0.24μmol/l、0.32μmol/l、0.24μmol/l,其中,0.40μmol/l对应的两条曲线重合,0.32μmol/l对应的两条曲线重合。结果表明,无模板对照孔无扩增,在上述引物浓度条件下,均能出现扩增曲线,并采集到相应荧光信号,当引物浓度为0.48μmol/l时,cq值最小,为21.21,并且相对荧光强度达到12000,因此引物浓度最优为0.48μmol/l。
探针浓度的优化:首先进行探针浓度预实验,分别加入10μmol/l的探针0.2,0.5,0.8μl,分析cq值与相对荧光强度。正式实验选用10μmol/l的探针0.4μl,0.5μl,0.6μl,0.7μl,探针的终浓度分别为0.16μmol/l,0.20μmol/l,0.24μmol/l,0.28μmol/l,每个浓度设立两个平行孔,引物浓度为0.48μmol/l,并采用ddh2o作为无模板对照孔。荧光定量pcr的条件为:94℃预变性5min,95℃变性15s,60℃退火延伸1min,40个循环。
预实验结果显示,加入0.8μl探针时,相对荧光强度与cq值与加入1.0μl时差异不大。正式实验结果如图5所示,横坐标为40时,对应的曲线,从上至下浓度依次为0.24μmol/l、0.24μmol/l、0.28μmol/l、0.20μmol/l、0.20μmol/l、0.16μmol/l、0.16μmol/l,其中,0.28μmol/l对应的两条曲线重合。结果表明,无模板对照孔无扩增,探针终浓度为0.24μmol/l时,相对荧光强度最高,且cq值最小,因此本方法中,探针浓度最优为0.24μmol/l。
实施例4
荧光定量pcr特异性验证:采用磁珠法病毒dna/rna提取试剂盒提取白斑综合症疫苗、猪瘟病毒疫苗、猪繁殖与呼吸综合征病毒疫苗、口蹄疫疫苗、h5亚型禽流感疫苗的核酸样本,作为rna组模板,以及牛呼吸道合胞体病毒疫苗、鲤科疱疹病毒ii型疫苗、圆环病毒ii型疫苗的核酸样本,作为dna组模板,进行荧光定量pcr,将实施例1获得的质粒标准品稀释至104-103拷贝/μl的2个浓度梯度,作为阳性对照,并采用ddh2o作为无模板对照。
dna组、阳性对照和无模板对照的荧光定量pcr采用实施例2中的反应体系和优化条件,rna组的荧光定量pcr反应体系为:反应总体积25μl,其中2*onesteprt-pcrbufferiii12.5μl、takaraextaqhs0.5μl、primescriptrtenzymemixii0.5μl、正向引物1μl、反向引物1μl、探针0.7μl、ddh206.8μl,模板2μl。荧光定量pcr的条件为:42℃预变性5min,95℃变形10s,95℃退火10s,60℃延伸1min,40个循环。
结果如图6、图7所示,dna组:无模板对照无扩增,质粒标准品cq值为23.32,其他样品无扩增。rna组:无模板对照无扩增,质粒标准品cq值为25.12,其他样品无扩增。该引物对已有的8种病毒核酸无扩增,特异性良好。
实施例5
荧光定量pcr灵敏度检测:重新对实施例1提取的质粒标准品进行质粒浓度检测,浓度为90.30ng/μl,根据拷贝数
实施例6
荧光定量pcr重复性检测:对实施例1提取的质粒标准品以10倍稀释度将质粒进行倍比稀释,稀释成103、105、107拷贝/μl的3个浓度梯度,作为模板,并采用ddh2o作为无模板对照,进行荧光定量pcr扩增,采用实施例2中的反应体系和反应条件,每个浓度重复三次。
表1重复性实验结果
结果见表1,无模板对照孔无扩增,三个稀释度的cq值变异系数均小于1%,远远低于现有病毒检测方法5%左右的变异系数,表明该方法的重复性良好。
实施例7
取15批样品,包括14批南美白对虾,1批斑节对虾,每批南美白对虾样品随机取15-20只的肌肉组织置于装有magnalysergreenbeads的15ml离心管,加入2~4mlpbs,在样品匀浆器上打至顺滑匀浆,放入-70℃冰箱冷冻,再拿出常温融化,重复操作3-4次,以释放细胞内病毒,然后10000rpm离心5min,取上清液进行提取。采用实施例4中的方法,使用试剂盒以及核酸提取仪对上清液进行提取,得到100μl左右核酸,共15个样品,以其为模板采用本发明方法进行荧光定量pcr扩增,采用实施例4中rna组的荧光定量pcr反应体系和反应条件,每个样品设置两个平行孔,同时以质粒标准品为阳性对照,以ddh2o作为无模板对照,阳性对照和无模板对照采用实施例2中的荧光定量pcr反应体系和反应条件。
结果显示,无模板对照无扩增,在14批南美白对虾和1批斑节对虾样品中均未检出imnv,同时,以质粒标准品作为模板的阳性对照孔出现明显扩增曲线。
如上所述即为本发明的实施例。本发明不局限于上述实施方式,任何人应该得知在本发明的启示下做出的结构变化,凡是与本发明具有相同或相近的技术方案,均落入本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!