一种利用细胞工厂制备临床级脐带间充质干细胞的工艺的制作方法
本发明属于生物研究技术领域,涉及一种脐带间充质干细胞的制备工艺,特别涉及一种利用细胞工厂制备临床级脐带间充质干细胞的工艺。
背景技术:
细胞工厂(cellfactory)是一种设计精巧的细胞培养装置,其材质为符合《美国药典》规定的聚苯乙烯材料,培养表面经亲水处理提高了细胞的吸附性,确保细胞贴壁更均一、更稳定,在大规模培养中更容易操作,更符合gmp的要求,且由于其工艺操作的精简化,大大降低了培养过程细胞的污染风险,增强了污染的可控性。在生产过程中,细胞工厂可以在有限的空间内最大限度利用培养表面,节约培养箱使用面积(一个10层细胞工厂的培养面积=36.2个t175培养瓶的培养面积,而一个培养箱可放置4个10层细胞工厂,或者50个t175培养瓶,即使用细胞工厂可减少培养箱的使用面积一半以上),无需进行任何厂房改造即可实现扩大产能的目的。如果与细胞工厂自动化操作设备结合使用,可全面实现细胞培养自动化,从而大大降低劳动强度和密集度,快速替代传统的细胞瓶培养技术,实现大规模细胞培养,增强对生产环境的质量可控性,同时能够降低批间差异。
人脐带间充质干细胞(humanumbilicalcord-mesenchymalstemcells,huc-mscs)是指存在于新生儿脐带组织中的一种多功能干细胞。huc-mscs形态、免疫表型以及多向分化潜能等多种生物学特性与骨髓mscs极为相似,并且huc-mscs表达ssea4、oct-4、nanog和sox-2等胚胎干细胞标志物,可能是一群更为原始的干细胞。此外,huc-mscs还有取材方便、安全无病毒感染风险;脐带内含量高,细胞增殖能力稳定,可在短时间内大量扩增,易于工业化制备;不表达/低表达hla-i类分子、不表达hla-ii类分子及共刺激分子,因此免疫原性极低,不易引起免疫排斥反应;回输体内后在组织局部微环境中能定向分化成多种组织细胞,具有安全性高和成瘤性低、不受伦理和法律限制等优势。外源性huc-mscs可作为种子细胞参与受损组织的再生修复;huc-mscs可分泌大量细胞因子,通过旁分泌作用调节受损组织细胞的修复,甚至促进受损组织本身的干细胞的增殖和活化;并且还具有免疫调节作用,能调节多种先天性或获得性免疫功能异常;同时具有趋化作用,可以阻止炎性介质的释放,减轻炎症反应,减轻组织损伤,有利于阻止炎症性疾病病情发展。huc-mscs的这些特性使其在再生医学行业和免疫性疾病的治疗上拥有广阔的前景。
随着以干细胞为主的细胞治疗研究的迅速发展,其在治疗退行性疾病、缺血性心脑血管疾病、肝硬化及糖尿病、自身免疫性疾病等领域已开展了多项临床试验研究,国内也建立了多家产业化基地,取得了突破性的成绩。国外已有多项干细胞注射剂获得药品批号,国内也有多家生物公司提交干细胞注射剂的新药申报,干细胞新药的产业化格局正在形成。在干细胞产业化的进程中,干细胞质量稳定性是质量控制的关键环节,要获得稳定质量的干细胞,干细胞的大规模批量生产的产量、生产工艺稳定性是前提条件。使用传统的t175培养瓶生产huc-mscs存在着产能低、人员能耗高、易污染、各瓶细胞间的差异大、稳定性不易控制、生产车间大、质控点多等问题。细胞工厂尤其是10层/40层的细胞工厂,一次培养可生产大量干细胞,不仅减少生产场地,同时也大大减少技术人员的操作环节,减少污染的可能性,并且一个细胞工厂生产的细胞可作为一个质量均一的产品,大大减少质控人员的工作量和工作成本,同时,细胞工厂与自动化设备结合将实现全自动化生产,是未来的产业化方向。
技术实现要素:
本发明为了解决传统干细胞培养方法在转向临床应用时细胞数量不足、产品质量不均一和稳定性不够的问题,提供了一种利用细胞工厂制备临床级脐带间充质干细胞的工艺。本发明可以规模化培养干细胞,生产的干细胞不仅仅细胞产量大、工艺稳定、产品质量易控制,而且可以节约人员开支、厂房建设,如果结合细胞工厂自动化摇床等设备,可实现进液、细胞混匀、消化出液等自动化操作,可自动、高效的进行大规模干细胞培养,减少繁重的人力操作与人为因素带来的误差,是未来产业化的方向。
本发明的目的是通过以下技术方案实现的:
一种利用细胞工厂制备临床级脐带间充质干细胞的工艺,包括如下步骤:
步骤(1)、细胞接种:
在干细胞种子库中取1支装5~10×106cells/ml/管的p2代脐带间充质干细胞,将其复苏后按5~10×103cells/cm2的密度接种到1个2层细胞工厂(nest,catno.771101)中进行干细胞扩增培养,其中:每个2层细胞工厂接种的干细胞来源于同一支细胞冻存管内的细胞,每个2层细胞工厂接种细胞总数为6.395×106个,每层加入的细胞悬液体积为150~200ml,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;
步骤(2)、细胞工厂制备干细胞:
待细胞融合度达90~95%时,将2层细胞工厂的干细胞消化下来,按5~10×103cells/cm2的密度接种到1个10层细胞工厂中进行干细胞扩增培养,其中:每个10层细胞工厂接种的干细胞来源于同一2层细胞工厂培养的干细胞,每个10层细胞工厂接种的细胞总数为3.17×107个,每层加入的细胞悬液体积为150~200ml,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;
步骤(3)、干细胞产品制备:
待10层细胞工厂中细胞融合度达到90~95%时,将干细胞消化下来,得到大量的干细胞。
本发明中,所述步骤(2)和步骤(3)的干细胞在2层细胞工厂和10层细胞工厂培养时,接种密度控制在30%,使干细胞3~5天达到90~95%融合度,中间无需换液。
本发明中,所述方法还包括步骤(4):将步骤(3)中每个10层细胞工厂生产的干细胞取样、送有资质的第三方做质控检测后,使用无血清细胞冻存液(zenoaq,catno:cellbanker2)重悬,然后按5~10×106cells/ml/管用细胞冻存管进行分装,使用程序降温盒在-80℃放置至少24小时后置液氮罐中储存,建立干细胞工作库。
本发明中,所述干细胞种子库的建立方法如下:
(1)无菌条件下获取经检测合格的脐带组织(产妇检查乙丙梅艾、torch、htlv病毒、eb病毒、地贫基因分型、肝肾功能等无异常),同时取10ml脐带血送检(乙丙梅艾、torch、htlv病毒、eb病毒、无菌性检测),脐带组织保存至4℃无菌生理盐水中、密封,4h内冷链运输至gmp车间;
(2)生物安全柜中,将脐带转至10cm培养皿中,浸于75~80%乙醇中消毒2~5min,氯化钠注射液清洗3~5次,去除血渍;无菌剪刀剪去脐带两端手术结扎线,然后将制备用脐带剪至2~3cm数段,按血管螺旋走向剔除2条脐动脉和1条脐静脉;用有齿镊将位于羊膜与血管间的白色组织wharton胶质剥离下来,氯化钠注射液洗涤胶体3~5次;
(3)将获得的胶体转移至50ml离心管,加入20~30ml氯化钠注射液,离心5~10min,弃上清液,称重记录,加入1~2ml培养基,用无菌组织剪将胶体剪至1~4mm3组织匀浆块;加入培养基使组织匀浆块浓度定为0.5~1.0g/ml,电动移液器吹打均匀后,每个t175培养瓶中接种2.33ml组织匀浆,即1.17gwharton胶质,补加25ml培养基;
(4)原代培养5~6天后进行培养基全量换液,9~10天后吸掉半量培养基,补足等量新鲜培养基进行半量换液;根据细胞生长状态,培养至12~13天再进行一次半量换液,培养至第14~17天,待细胞克隆团面积百分比达80~85%时,用胰酶消化后收获细胞(p0代);
(5)将细胞按5~10×103/cm2的密度接种至2层细胞工厂(nest,catno.771101)中进行干细胞扩增培养,其中:每个2层细胞工厂接种的干细胞来源于同一t175培养瓶内的细胞,每个2层细胞工厂接种细胞总数为6.395×106个,每层加入的细胞悬液体积为150~200ml,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;培养3~5天后当细胞融合至90~95%,将干细胞(p1代)消化,继续按5~10×103/cm2的密度接种至10层细胞工厂(nest,catno.771302)中进行干细胞扩增培养,其中:每个10层细胞工厂接种的干细胞来源于同一2层细胞工厂培养的干细胞,每个10层细胞工厂接种的细胞总数为3.17×107个,每层加入的细胞悬液体积为150~200ml,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;培养3~5天后当细胞融合至90~95%,将干细胞(p2代)消化,每个10层细胞工厂生产的干细胞取样、做质控检测,然后用无血清细胞冻存液(zenoaq,catno:cellbanker2)重悬、按5~10×106cells/ml/管的密度分装于细胞冻存管中,在-80℃放置至少24小时后置于液氮罐中深低温保存,建立干细胞种子库(p2代),并按中国药典(2015版)进行种子库的检定;
(6)复苏干细胞,离心去除冻存液后,氯化钠注射液洗涤细胞沉淀1次后,按5~10×103/cm2的密度将干细胞接种于2层细胞工厂中进行干细胞扩增培养,其中:每个2层细胞工厂接种的干细胞来源于同一细胞冻存管内的细胞,每个2层细胞工厂接种细胞总数为6.395×106个,每层加入的细胞悬液体积为150~200ml,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;培养3~5天后当细胞融合至90~95%时,将干细胞消化(p3代)、吹打混匀后,将单细胞悬液按5~10×103/cm2的密度接种于10层细胞工厂中进行干细胞扩增培养,其中:每个10层细胞工厂接种的干细胞来源于同一2层细胞工厂培养的干细胞,每个10层细胞工厂接种的细胞总数为3.17×107个,每层加入的细胞悬液体积为150~200ml,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;待细胞融合度达到90~95%,将干细胞消化,回收干细胞(p4代),每个10层细胞工厂生产的干细胞取样、做质控检测,然后用无血清细胞冻存液(zenoaq,catno:cellbanker2)重悬、按5~10×106cells/ml/管分装,冻存,建立干细胞工作库(p4代),并按中国药典(2015版)进行干细胞工作库的检定。
本发明,所述干细胞是脐带间充质干细胞。
本发明,所述细胞冻存管是经过软件编辑、生成二维码后打印粘贴于冻存管上,每管细胞有独特的id,复苏时经扫码核对后发放。
本发明中,所述培养基为添加了2%血清替代物的无血清间充质干细胞培养基,即:ultraculturesfmedium(lonza,catno:12-725f)+2%ultroserg血清替代物(pall,catno:15950-017)。
相比于现有技术,本发明具有如下优点:
1、本发明利用细胞工厂来大规模制备干细胞产品,取代传统的t瓶培养方式,在有限的空间内利用了最大限度的培养面积,节省了大量的厂房空间,低成本实现扩大产能的目的,并且可节省大量实验室技术人员,同时避免在狭窄的生物安全柜中操作大量t175培养瓶时带来的细胞污染的风险,且生产的间充质干细胞数量与相同培养表面积的培养瓶培养的干细胞总数相比无显著性差异,线性放大不会改变细胞生长的动力学条件,同一细胞工厂内生产的干细胞能保持更高的同一性,避免了在大量不同培养瓶中各瓶间干细胞的差异性,并可避免各瓶间细胞质量的不稳定性。
2、本发明具有较好的稳定性,且生产的干细胞仍然保持了很好的干细胞特性,将其应用于一些慢性病治疗中具有很好的治疗效果,同时将细胞工厂设定为10层,可达到人工操作的最大产量(40层细胞工厂不易人工操作),满足了生物制品三批样的生产原则,为干细胞作为药品申报的生产工艺的开发及商业化应用奠定了基础。
3、本发明在细胞工厂中培养干细胞时全程使用无血清间充质干细胞培养基并添加血清替代物,避免动物源性血清中成分引起人体免疫反应及动物源性病原体污染的可能性,提高了产品的安全性,且符合药典要求。
附图说明
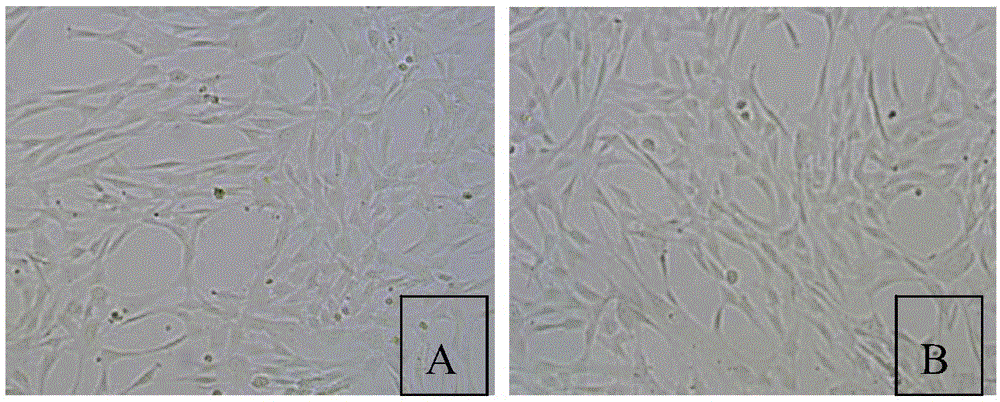
图1为t175培养瓶与细胞工厂培养下的uc-mscs形态对比,图1a:t175培养瓶培养的干细胞;图1b:10层细胞工厂培养的干细胞;
图2为10层细胞工厂培养的干细胞的流式检测结果,图2a:uc-mscscd19/cd34/cd14空白对照;图2b:uc-mscscd19/cd34/cd14样品检测;图2c:uc-mscscd45/hla-dr空白对照;d:uc-mscscd45/hla-dr样品检测;
图3为10层细胞工厂培养的p4代干细胞三系分化实验结果,图3a:msc分化前后形态对比,a:未分化huc-msc(day0)、成骨分化6天(day6)、9天(day9)的brightfield形态图,b:未分化huc-msc(day0)、成脂分化6天(day6)、9天(day9)的brightfield形态图,c:未分化huc-msc(day0)、成软骨分化6天(day6)、9天(day9)的brightfield形态图;图3b:huc-msc成骨细胞诱导分化鉴定,a:未分化huc-mscbrightfield形态图,b:huc-msc未分化时,茜素红s染色,c:huc-msc诱导分化后茜素红s染色;图3c:huc-msc成软骨细胞诱导分化鉴定,a:未分化huc-mscbrightfield形态图,b:未分化huc-msc阿辛蓝(alcianblue)染色阴性对照,c:诱导分化14天阿辛蓝(alcianblue)染色结果(400倍),d:诱导分化12天阿辛蓝(alcianblue)染色结果(200倍);图3d:huc-msc成脂肪细胞诱导分化鉴定,a-g:huc-msc成脂分化14天后,油红o染色(100倍,400倍),h:huc-msc成脂分化14天后,可见明显脂滴形成(100倍,400倍);
图4为等培养面积下的t175培养瓶与1个10层细胞工厂的细胞收获量对比;
图5为rt-pcr检测10层细胞工厂培养的p4代脐带间充质干细胞的nanog(n)、oct-4(o)、sox-2(s)基因表达。
具体实施方式
下面结合附图对本发明的技术方案作进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。
实施例1
本实施例提供了一种建立安全有效、数量足够的细胞库的方法,细胞库中的细胞通过专业的第三方鉴定合格,且按中国药典(2015版)进行干细胞种子库/工作库的检定,并且细胞量能够满足临床研究的不断供给。
新生儿出生后获得脐带组织,其中捐献者必须经过严格体检,包括各项病毒检测、传染病检测,签署知情同意书和捐赠协议。在无菌手术室,从人体新鲜分离后的脐带迅速转移至4℃无菌氯化钠注射液中、密封,4h内通过冷链运送到专业的细胞制备中心。
本实施例中,细胞库的具体建立步骤如下:
(1)将脐带组织转移至药品级别gmp车间,经严格处理,75%乙醇消毒,转移至事先已照紫外线30分钟的生物安全柜中。
(2)生物安全柜中,将脐带转至10cm培养皿中,浸于75%乙醇中消毒2min,氯化钠注射液清洗3次,去除血渍。无菌剪刀剪去脐带两端手术结扎线,然后将制备用脐带剪至2~3cm数段,按血管螺旋走式剔除2条脐动脉和1条脐静脉。用有齿镊将位于羊膜与血管间的白色组织wharton胶质剥离下来,氯化钠注射液洗涤胶体3次。
(3)获得的胶体转移至50ml离心管,加入20~30ml氯化钠注射液,840g离心5min,弃上清液,称重记录,加入1~2ml培养基,用无菌组织剪将胶体剪至1~4mm3组织匀浆块。加入适量培养基将组织匀浆块浓度定为约0.5g/ml,电动移液器吹打均匀后,每个t175培养瓶中接种2.33ml组织匀浆,即1.17gwharton胶质,补加25ml培养基。
(4)原代培养5~6天后进行培养基全量换液,9~10天后吸掉半量培养基,补足等量新鲜培养基进行半量换液。根据细胞生长状态,培养至12~13天再进行一次半量换液,培养至第14~17天,待细胞克隆团面积百分比达80%左右时,用0.125%胰酶消化后收获细胞(p0代)。
(5)将细胞按5~10×103/cm2的密度接种至2层细胞工厂(nest,catno.771101)中进行干细胞扩增培养,其中:每个2层细胞工厂接种的干细胞来源于同一t175培养瓶内的细胞,每个2层细胞工厂接种细胞总数为6.395×106个,每层加入的细胞悬液体积为150~200ml,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;培养3~5天后当细胞融合至90%左右时,将干细胞(p1代)消化,继续按5~10×103/cm2的密度接种至10层细胞工厂(nest,catno.771302)中进行干细胞扩增培养,其中:每个10层细胞工厂接种的干细胞来源于同一2层细胞工厂培养的干细胞,每个10层细胞工厂接种的细胞总数为3.17×107个,每层加入的细胞悬液体积为150~200ml,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;培养3~5天后当细胞融合至90%左右时,将干细胞(p2代)消化,每个10层细胞工厂生产的干细胞取样、做质控检测,然后按5~10×106cells/ml/管的密度用无血清细胞冻存液(zenoaq,catno:cellbanker2)重悬、分装于细胞冻存管中,置于程序降温盒中在-80℃冻存至少24小时后置于液氮罐中深低温保存,建立干细胞种子库(p2代),并按中国药典(2015版)进行种子库的检定。
(6)复苏干细胞,离心去除冻存液后,氯化钠注射液洗涤细胞沉淀1次后,按5~10×103/cm2的密度将干细胞接种于2层细胞工厂中进行干细胞扩增培养,其中:每个2层细胞工厂接种的干细胞来源于同一细胞冻存管内的细胞,每个2层细胞工厂接种细胞总数为6.395×106个,每层加入的细胞悬液体积为150~200ml,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;培养3~5天后当细胞融合至90%左右时,将干细胞消化(p3代)、吹打混匀后,将单细胞悬液按5~10×103/cm2的密度接种于10层细胞工厂中进行干细胞扩增培养,其中:每个10层细胞工厂接种的干细胞来源于同一2层细胞工厂培养的干细胞,每个10层细胞工厂接种的细胞总数为3.17×107个,每层加入的细胞悬液体积为150~200ml,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;待细胞融合度达到90%左右时,胰酶消化,用真空负压管路吸引回收干细胞(p4代),每个10层细胞工厂生产的干细胞取样、做质控检测,然后用无血清细胞冻存液(zenoaq,catno:cellbanker2按5~10×106cells/ml/管重悬、分装,冻存,建立干细胞工作库(p4代),并按中国药典(2015版)进行干细胞工作库的检定。
本实施例中,所述干细胞是脐带间充质干细胞;使用的培养基为ultraculturesfmedium+2%ultroserg血清替代物。干细胞专用培养基+血清替代物可最大程度保持干细胞的未分化状态,避免加入胎牛血清造成的动物源性病原体污染和人体针对动物源性蛋白的免疫反应,为临床应用做准备。
本实施例中,使用的细胞冻存管是经过软件编辑、生成二维码后打印粘贴于冻存管上,每管细胞有独特的id,复苏时经扫码核对后发放。
本实施例中,每次干细胞的接种密度控制在30%,3~5天可达到90~95%融合度,中途无需换液。
实施例2
本发明的另一个重要技术难点为临床级脐带间充质干细胞的大量制备及干细胞质量鉴定,主要利用细胞工厂进行细胞产品的大规模制备后,每个10层细胞工厂生产的干细胞取样、送有资质的第三方做质控检测,并应用流式细胞术检测干细胞表面标志物,同时利用rt-pcr方法鉴定胚胎干细胞分子标志物,并检测干细胞三系分化能力,按2006年,国际细胞治疗协会(internationalsocietyforcellulartherapy,isct)制定的间充质干细胞的最低鉴定标准进行干细胞质量鉴定后,最终制备出临床级干细胞产品。
本实施例中,利用细胞工厂制备临床级脐带间充质干细胞的具体步骤如下:
(1)在干细胞种子库中取1支装5~10×106cells/ml/管的p2代脐带间充质干细胞,将其复苏后按5~10×103/cm2的密度接种到1个2层细胞工厂(nest,catno.771101)中进行干细胞扩增培养,使干细胞在扩增至一定数量(p3代),其中:每个2层细胞工厂接种的干细胞来源于同一支细胞冻存管内的细胞,每个2层细胞工厂接种细胞总数为6.395×106个,每层加入的细胞悬液体积为150~200ml,,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;
(2)待细胞融合度达90%左右时,将2层细胞工厂的干细胞消化下来,按5~10×103/cm2的密度接种到1个10层细胞工厂中进行干细胞扩增培养,其中:每个10层细胞工厂接种的干细胞来源于同一2层细胞工厂培养的干细胞,每个10层细胞工厂接种的细胞总数为3.17×107个,每层加入的细胞悬液体积为150~200ml,培养条件为:在37℃、5%co2和饱和湿度的培养箱中贴壁培养3~5天;
(3)待10层细胞工厂中细胞融合度达到90%左右时,胰酶消化,用真空负压管路吸引回收干细胞(p4代),得到大量的干细胞。
本实施例中,培养过程中使用的培养基为ultraculturesfmedium+2%ultroserg血清替代物。培养过程中全程使用间充质干细胞培养基并添加血清替代物,避免临床应用中动物源性血清中成分的潜在不安全性(如病毒、真菌污染、动物源性蛋白等)。
2006年,国际细胞治疗协会(internationalsocietyforcellulartherapy,isct)确定了间充质干细胞的鉴定标准为:
(1)在塑料培养皿内贴壁生长,在含血清的培养基内高度增殖;
(2)表达细胞表面标志cd105、cd73、cd90,不表达cd45、cd34、cd14或cd11b、cd79a或cd19;
(3)在体外可以分化为成骨细胞、脂肪细胞、软骨细胞。
本实施例依据此最低标准进行干细胞的表型鉴定。
10层细胞工厂中干细胞增殖融合至90%后,使用多层细胞培养器观察台观察细胞形态,如图1b所示,图1a为t175培养瓶培养的干细胞形态,从图1a和图1b可以看出,两者都呈贴壁生长,梭形,为正常干细胞形态,无差异,细胞工厂生产的干细胞符合间充质干细胞的最低鉴定标准的形态学标准。
图2结果显示,细胞工厂培养的干细胞cd73+、cd90+、cd105+≥95.0%,cd14-、cd19-、cd34-、cd45-、hla-dr-≤2.0%,符合干细胞的最低标准中的细胞表面标志物的鉴定标准。
图3结果显示,干细胞在特定培养条件下可以定向分化为成骨细胞、成软骨细胞、成脂肪细胞,符合干细胞最低鉴定标准中的三系分化标准。
将10层细胞工厂中的干细胞收集计数,同时为了与常规t175瓶培养的细胞收获量相比较,同样收集相同培养条件、相同培养表面积的t175瓶中的干细胞(1个nest10层细胞工厂=36.2个t175培养瓶),两组平行测试,计数作对比。如图4所示,相同培养表面积下,10层细胞工厂的细胞收获量与t瓶接近,两组间无显著性差异(p>0.05),同时节约了大量培养空间和人力成本。并且由于每个10层细胞工厂生产的干细胞只需取样一份做质控检测,相比36.2个t175培养瓶生产的细胞需每瓶取样做质控检测,大大减少了质控人员的工作量和试剂耗材的使用。
图5结果显示,细胞工厂生产的p4代干细胞强表达oct-4、nanog和sox-2等胚胎干细胞标志物,显示经过细胞工厂的培养,干细胞仍然保持其良好的未分化状态,为其临床应用提供了可靠依据。
- 还没有人留言评论。精彩留言会获得点赞!