一种选择性肌松拮抗药舒更葡萄糖钠的制备方法与流程
本发明属于药物合成领域,尤其是涉及一种选择性肌松拮抗药舒更葡萄糖钠的制备方法。
背景技术:
舒更葡萄糖钠(sugammadexsodium)是首个和唯一的选择性松弛拮抗剂,其结构式如式(1)所示,它用于逆转常规使用的神经肌肉阻断药罗库溴铵或维库溴铵作用。舒更葡萄糖钠是一种改良的γ-环糊精,水溶性极好,属于新型的甾类非去极化肌松药拮抗药,它能与甾体类肌松药如罗库溴铵以及维库溴铵形成1:1的无活性包合物,从而阻碍甾体类肌松药在神经接头处的功能,影响甾体类肌松药的再分布,加速甾体类肌松药在体内的代谢分解,从而拮抗不同深度的神经肌肉阻滞。
舒更葡萄糖钠是20年来麻醉药领域第一个重大进展药物,其原研公司为organonbiosciences,2007年organonbiosciences被schering-plough收购,2009年schering-plough与msd合并,舒更葡萄糖钠为msd拥有并销售,商品名bridion。2008年7月5日欧洲批准舒更葡萄糖钠上市,2015年12月15日,美国fda批准舒更葡萄糖钠上市。
目前舒更葡萄糖钠的合成制备方法主要是以γ-cd为起始原料,先选择性地将6位羟基进行卤取代(碘代、溴代或氯代)得到6-全脱氧-6-全卤代-γ-环糊精,再在相应的碱性条件下与3-巯基丙酸连接得到舒更葡萄糖钠。中国专利cn1188428c、美国专利us6670340以及世界专利wo0140316a1均报道了舒更葡萄糖钠的合成方法,采用合成策略均是先反应得到得到6-全脱氧-6-全卤代-γ-环糊精,再在相应的碱性条件下与3-巯基丙酸连接得到舒更葡萄糖钠,但是相应方法的收率低,最终产物舒更葡萄糖钠的纯化需要进行柱层析或透析进行纯化,产物纯度较低,不利于其工业化放大生产。
技术实现要素:
有鉴于此,本发明旨在提出一种选择性肌松拮抗药舒更葡萄糖钠的制备方法,以解决现有的方法收率低,最终产物舒更葡萄糖钠的纯化需要进行柱层析或透析进行纯化,产物纯度较低,不利于其工业化放大生产的问题。
为达到上述目的,本发明的技术方案是这样实现的:
一种选择性肌松拮抗药舒更葡萄糖钠的制备方法,见式a,包括如下步骤:
(1)在溶剂中,在碱的作用下,使用卤代试剂对γ-环糊精的6位羟基进行卤取代反应,反应完全后经过后处理得到6-全脱氧-6-全卤代-γ-环糊精;
(2)在溶剂中,在碱的作用下,加入3-巯基丙酸与步骤(1)得到的6-全脱氧-6-全卤代-γ-环糊精进行反应至反应完全;
(3)对步骤(2)得到的反应液进行后处理,得到舒更葡萄糖钠粗品,进一步结晶精制可得到纯度≥98%的舒更葡萄糖钠。
采用上述技术方案,本发明的创新之处在于:(1)制备6-全脱氧-6-全卤代-γ-环糊精加入了碱进行反应使得该步反应的收率>90%;(2)舒更葡萄糖钠的纯化采用了结晶纯化的方式,避免了使用柱层析或透析进行纯化的方法,最终得到的产品纯度高(紫外检测器检测hplc纯度≥98%)且反应总收率高。
进一步的,步骤(1)中,反应所用溶剂为dmf、dmso、苯、甲苯、氯苯、二甲苯中的一种或两种;反应所用碱为吡啶、dmap、咪唑、三乙胺、二异丙基乙胺、dbu中的一种或两种;反应所用卤取代试剂为三氯化磷、五氯化磷、三溴化磷、溴单质、碘单质中的一种;反应在加热状态下进行,γ-环糊精与碱以及卤取代试剂的摩尔比为1:8:8~1:50:50,反应温度在50~90℃,反应时间在3-15h。
进一步的,步骤(1)中,反应所用溶剂优选dmf,反应所用碱优选dmap,γ-环糊精与碱以及卤取代试剂的摩尔比优选1:20:20~1:35:35,反应温度优选60~80℃;反应时间优选5-12h。
进一步的,步骤(2)中,反应所用溶剂为dmf、dmso、甲苯、乙基、甲醇、乙醇、异丙醇中的一种或两种;所用碱为氢化钠、氢化锂、吡啶、dmap、咪唑、三乙胺、乙醇钠、甲醇钠中的一种或两种;反应在加热状态下进行,6-全脱氧-6-全卤代-γ-环糊精与碱以及3-巯基丙酸的摩尔比为1:8:8~1:80:80,反应温度在50~90℃,反应时间在3-15h。
进一步的,步骤(2)中,反应溶剂优选dmf和甲醇组成的混合溶剂,所用dmf和甲醇的体积比优选1:1~1:3,反应所用碱优选甲醇钠,6-全脱氧-6-全卤代-γ-环糊精与碱以及3-巯基丙酸的摩尔比优选1:15:15~1:55:55,反应温度优选60~80℃;反应时间优选5-12h。
进一步的,步骤(3)中,后处理的步骤包括:
s1、向反应后的反应液中加溶剂搅拌后过滤,收集得到的固体;
s2、将得到的固体溶于溶剂中并加入活性炭进行脱色;
s3、脱色结束后将反应液过滤,收集得到的滤液并将其溶剂旋去得到固体,即舒更葡萄糖钠的粗品;
s4、对得到的固体粗品进行重结晶操作,得到纯度≥98%的舒更葡萄糖钠。
进一步的,步骤(1)中,后处理的步骤包括:将反应液的溶剂旋去,加入用甲醇或乙醇对反应后的剩余物进行溶解,之后用碱调节ph至7-9,之后将体系过滤,收集得到的固体,用甲醇或乙醇对其进行洗涤,最后将洗涤后的固体干燥,得到6-全脱氧-6-全卤代-γ-环糊精。
进一步的,后处理的步骤中调节ph所用的碱为甲醇钠、乙醇钠、氢化钠、氢化锂、氢氧化钠、氢氧化钾中的一种。
优选地,调节ph所用的碱为甲醇钠。
进一步的,步骤(1)中,若反应采用碘单质进行碘代反应,则反应体系中还需加入三苯基膦,碘单质与三苯基膦的摩尔比为1:1~1:3。
进一步的,步骤s1中的溶剂为甲醇或乙醇;步骤s2中的溶剂为水、甲醇、乙醇、乙腈、丙酮中的一种或两种,活性炭的用量为反应时所用6-全脱氧-6-全卤代-γ-环糊精质量的10%-90%,脱色时的时间为1-6h,脱色温度40~80℃;步骤s4中的重结晶时的溶剂为水、甲醇、乙醇、乙腈、丙酮、dmf、dmso中的一种或两种。
进一步的,步骤s2中的溶剂优选水和甲醇组成的混合溶剂,水和甲醇的体积比优选1:1~1:3,活性炭的用量为反应时所用6-全脱氧-6-全卤代-γ-环糊精质量的90%,步骤s4中的重结晶时的溶剂优选dmso和水以及乙醇和水,水和乙醇的体积比优选1:1~1:3,水和dmso的体积比优选1:1~1:3。
进一步的,合成过程是在惰性气体保护下进行的。
相对于现有技术,本发明所述的选择性肌松拮抗药舒更葡萄糖钠的制备方法具有以下优势:
本发明涉及的制备方法操作简单,收率高,得到的舒更葡萄糖钠纯度高,易于工业化放大生产。
附图说明
图1为实施例1得到的6-全脱氧-6-全碘代-γ-环糊精的1h-nmr谱图;
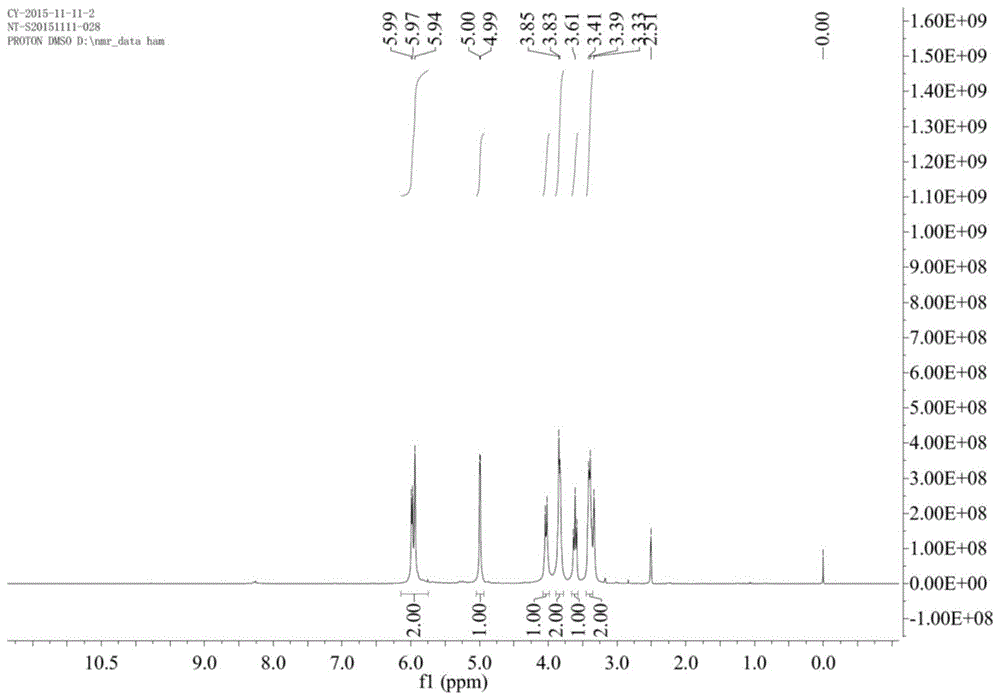
图2为实施例2得到的舒更葡萄糖钠的1h-nmr谱图;
图3为实施例2得到的舒更葡萄糖钠的13c-nmr谱图。
具体实施方式
除有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的试验试剂,如无特殊说明,均为常规生化试剂;所述实验方法,如无特殊说明,均为常规方法。
本发明挑选6-全脱氧-6-全碘代-γ-环糊精的合成以及相应的舒更葡萄糖钠的制备来对本发明的合成路线进行说明,但不意味着限制本发明制备方法的应用。
下面结合实施例及附图来详细说明本发明。
实施例1
6-全脱氧-6-全碘代-γ-环糊精的制备:
将30.3g三苯基膦溶于200毫升dmf中,体系于0度低温反应釜中冷却,之后加入14.1gdmap,搅拌溶解后加入30.3g碘单质,继续搅拌10min,之后加入5gγ-cd,之后75度,ar保护反应7h,反应结束后,将体系用旋转蒸发仪除去dmf,之后加入200毫升甲醇搅拌20min,之后用甲醇钠的甲醇溶液调ph至8,之后将析出的固体过滤收集,用大量甲醇洗涤得到白色固体,之后将洗涤后的固体干燥后称量为7.6g,即6-全脱氧-6-全碘代-γ-环糊精,如图1所示,为得到的6-全脱氧-6-全碘代-γ-环糊精的1h-nmr谱图收率为92%,紫外检测器检测hplc纯度为98%。
实施例2
舒更葡萄糖钠的制备:
将4.8毫升3-巯基丙酸溶于30毫升无水甲醇中,之后逐渐加入7.4g甲醇钠,体系搅拌30min,之后加入上述制备得到的6g6-全脱氧-6-全碘代-γ-环糊精的30毫升dmf溶液,之后75度,ar保护反应7h,反应结束后,将体系冷却至室温,加入200毫升甲醇搅拌30min,之后过滤收集得到的白色固体,接着用甲醇洗涤得到的固体3次(每次约200毫升甲醇),洗涤完毕后,收集得到白色固体,将固体溶于50毫升水中,体系呈茶黄色透明,之后加入50毫升甲醇以及5.4g活性碳粉,体系于ar保护下,75度加热脱色3h,脱色结束后,将体系冷却至室温,将活性炭粉过滤除去,收集滤液,呈无色透明,将滤液旋干得到白色固体,即舒更葡萄糖钠的粗品,之后加入30毫升乙醇进行搅拌,体系呈乳白色浑浊,之后将体系加热至70度,之后逐渐加入水约15毫升时,体系变透明,之后关闭加热将体系置于室温下冷却,体系逐渐析出针状晶体,待结晶结束后将体系过滤收集得到的白色固体,用同样的方式采用dmso和水进行二次结晶,结晶后将所得产品收集,干燥后得到4.8g白色固体,即精制后的舒更葡萄糖钠,如图2所示,为得到的舒更葡萄糖钠的1h-nmr谱图,如图3所示,得到的舒更葡萄糖钠的13c-nmr谱图,收率为80%,紫外检测器检测hplc纯度为98%。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!