基于拉曼光谱和微液滴技术的单克隆抗体制备方法与流程
本发明涉及一种用于单克隆抗体制备的细胞分选及鉴定的技术方法。
背景技术:
单克隆抗体技术是现代生命科学和医学研究和治疗的重要工具,1975年koehler和milstein创立了体外杂交瘤技术,得到了鼠来源的单克隆抗体,该技术于1984年获得诺贝尔医学奖和生理学奖。1986年,美国fda批准了第一个单克隆抗体药物上市,距今已快30年。目前,全世界共有超过40个治疗用抗体药物被批准上市,每年实现超过数百亿美元的销售额。在国际及国内形成了抗体药物开发热潮。
巨大的市场前景和现存的技术问题及壁垒并存的现实不可避免地引发抗体药物新一轮技术革命,而其结果又将毫无疑问地改变抗体药物的市场格局。抗体不管是作为检测试剂,还是作为具有巨大市场前景的治疗药物。首先,我们都需要通过筛选找到单克隆抗体。传统的单克隆抗体制备方法主要是杂交瘤技术。这是目前比较成熟,技术难度比较低,大多数实验室仍然在使用的方法。该方法在科学研究领域仍然是制备单克隆抗体最主要的方法,而在治疗性单克隆抗体的研发方面,虽然有大量基于噬菌体展示技术等人源化抗体技术,但由于已有大量通过该方法研发的治疗性抗体上市,再考虑其稳定性和广泛结合性,通过杂交瘤制备单克隆抗体技术仍是本领域的主流技术。
当然基因工程重组表达抗体技术已非常成熟,如能不通过杂交瘤技术,即得到抗体的基因序列对药物开发流程来说更为便捷。
利用杂交瘤技术制备单克隆抗体的基本原理是根据以下三个原则:①一种淋巴细胞克隆只产生一种抗体;②细胞融合技术产生的杂交瘤细胞可以保持双方亲代细胞的特性;③利用代谢缺陷补救机理筛选出杂交瘤细胞,并进行克隆化,然后大量培养增殖,制备所需的单克隆抗体。
在通过杂交瘤制备单克隆抗体制备过程中,有两次筛选过程,第一次是使用选择性培养基选出杂交瘤细胞;第二次就是进一步选出能产生需要的抗原特异性抗体的杂交瘤细胞。第二次筛选过程极为复杂,需要大量的人力来完成亚细胞克隆的分离工作。
以下为对两次筛选方法原理的简述:
第一次筛选的原理和方法:
细胞融合后,杂交瘤细胞的选择性培养是第一次筛选的关键。普遍采用的hat选择性培养液是在普通的动物细胞培养液中加入次黄嘌呤、氨基蝶呤和胸腺嘧啶核苷酸。在hat培养液中,未融合的b细胞及两个b细胞的融合产物的d途径被氨基蝶呤阻断,虽s途径正常,但因缺乏在体外培养液中的增殖能力,一般在10天左右会死亡。对于骨髓瘤细胞以及自身融合细胞而言,由于通常采用的骨髓瘤细胞是次黄嘌呤-鸟嘌呤磷酸核苷转移酶(hgprt)缺陷细胞,因此自身没有s途径,且d途径又被氨基蝶呤阻断,所以在hat培养液中也不能增殖而很快死亡。只有骨髓瘤细胞与b细胞相互融合的杂交瘤细胞,既具有b细胞的s途径,又具有骨髓瘤细胞在体外培养液中长期增殖的特性,因此能在hat培养液中选择性存活下来,并不断增殖。
第二次筛选的原理和方法:
在单克隆抗体的生产过程中,由于b淋巴细胞的特异性是不同的,经hat培养液第一次筛选出的杂交瘤细胞产生的抗体存在多样性,必须对杂交瘤细胞群进行第二次筛选,才能选出针对目标抗原具有特异性的杂交瘤细胞。二次筛选通常采用有限稀释法,将杂交瘤细胞多倍稀释,接种在多孔细胞培养板上,使每孔不超过一个细胞,通过培养让其增值。然后检测各孔上清液中细胞分泌的抗体的特异性(常用elisa方法),上清液可与特定抗原结合的培养孔为阳性孔。阳性孔中细胞还不能保证是来自单个细胞,需要继续进行有限稀释,一般重复3-4次,直至确信每个孔中增值的细胞为单克隆细胞。第二次筛选也是鉴定特异性亲和力的过程。
有限稀释法对于筛选杂交瘤来说是最普通的方法,在许多实验室中都在使用。但是,作为相对旧的技术,已经不能满足当今的需求。方法自身具有许多缺点:
1、人工操作,操作及重复的步骤太多,不可避免容易出错。2、速度慢,效率低。只能保证30-40%的孔有细胞生长。对于高通量筛选来说,不能满足要求。3、不能保证单克隆,需要亚克隆3-4次,所以,人工和耗时都较多。4、有限稀释在elisa检测前,并不知道哪一个克隆满足抗原特异性的要求。所以,需要对所有克隆,都要最少做一次elisa鉴定。
除了有限稀释方法,现在相对先进的细胞分选技术也得到普遍应用。一般就是细胞分选仪或者流失细胞技术对杂交瘤细胞进行筛选。其原理是先将细胞分散开,没有细胞结团。通过在细胞表面或细胞内标记荧光信号。当单个细胞在压力作用下单个通过玻璃毛细管的时候,仪器可以自动检测单个细胞的荧光信号强度。荧光信号强度反应这个细胞的相应抗体表达水平。最后,将高荧光信号强度的细胞收集,再通过有限稀释得到高水平表达的单克隆;或者也可以使用单细胞收集器收集高水平表达的单个杂交瘤细胞。
这种技术也在很多实验室中使用,但是根据其筛选原理,有一些不可避免的缺陷。1、这种对细胞的筛选标准还不是针对真正的单个细胞检测抗体表达量。
2、由于必须要对细胞表面或内部使用荧光标记,所以,一般主要使用于胞内表达的蛋白或者膜表达蛋白。对于分泌表达的杂交瘤细胞来说,使用具有局限性。
3、具体检测的是单个细胞在某个时间点的荧光强度。所以,检测结果容易受细胞周期的影响。而且,单个细胞的表达水平也不能很好反应后期生产阶段细胞群体的表达水平。
4、流式筛选技术只是对荧光信号强的所有细胞作出划分,后期需要复筛的细胞数目仍然很多,下游工作量仍然比较大。
5、由于对单个细胞使用压力操作,剪切力会降低细胞存活率。所以,低成活率也成为这个技术的一个主要缺陷。
5、流式筛选需要对管路系统充分清洗消毒才能确保细胞不会污染,污染的风险较高。
与上述技术方法相似,又出现了利用半固体培养基分离细胞的方法,再通过机械臂和调头对特定的荧光点就行操作的阳性细胞克隆分选方式。但是该方法在使用中缺点也非常明显,首先杂交瘤要能在半固体培养基上生长良好,而很多细胞是无法达到这个要求的。其次,克隆的大小和密度对于自动化挑取克隆的精确性有很大影响,克隆太小太密,都会影响识别和挑取,进而降低挑到克隆的单克隆性。
随着技术进步,我们也迫切需要一种更先进的筛选技术。能够满足高通量,自动化,高效率的要求。
鉴于对单克隆抗体的广泛应用的需要日益增长,然而传统杂交瘤方法操作有十分复杂,尤其是单株化选殖的过程,不仅需花费大量时间,同时也必须消耗很多的人力,而操作者的熟练度也会影响结果,因此往往实验之成败决定於此步骤,即使是通过荧光技术结合机械臂挑取,仍然不是直接检测到单个细胞表达抗体量的技术,技术复杂性过高,而时效性却很低。
技术实现要素:
本发明目的在于提供一种能够可以直接检测单个细胞抗体表达量,并以此为衡量标准对融合后的细胞进行分选,得到表达特定抗原对应抗体的单细胞克隆。
本发明中采用的主要技术为基于单细胞分析的表面增强拉曼光谱(surface-enhancedramanspectroscopy,sers)和微流控液滴技术(microfluidicdroplet),包括以下步骤:
s1:制备特定抗原用于免疫动物,动物的免疫通常共有三次,在最后一次免疫后取脾,制备脾细胞悬液;
s2:利用骨髓瘤细胞与步骤s1中的脾细胞进行细胞融合制备杂交瘤细胞;
s3:搭建微流控平台
s4:制备具有拉曼信号的探针;
s5:拉曼光谱检测;
s6:单细胞培养和测序;
基于以上描述,其中步骤s1和s2为单抗制备的传统方法。也可以不通过杂交瘤融合技术使细胞永生化,直接将步骤s1中的脾细胞悬液,用于执行s3步骤。最终s6步骤得到的细胞进行测序得到抗体序列。
以上所描述的步骤s3包含以下步骤:
s3a:将负性光致抗蚀剂旋涂到干净的硅晶片上,并进行图案化曝光到385nmled阵列光源。因此,具有掩模图案的微通道结构被转移到膜。然后,将sylga聚二甲基硅氧烷与交联剂(比例为10:1)混合并彻底脱气,将其倾倒在光刻胶图案上,并在80℃下固化至少3小时。将pdms复制品从晶片上剥离。在将pdms粘合到载玻片上之前,进行pdms和玻璃表面的氧等离子体活化;
s3b:以上部件在高压和加热条件下粘合。然后用aquapel溶液填充微流体通道以改善它们对氟化油的润湿性。内径为0.8mm,外径为1.6mm的聚乙烯管通过注射泵连接到通道;
以上所描述的步骤s4包含以下步骤:
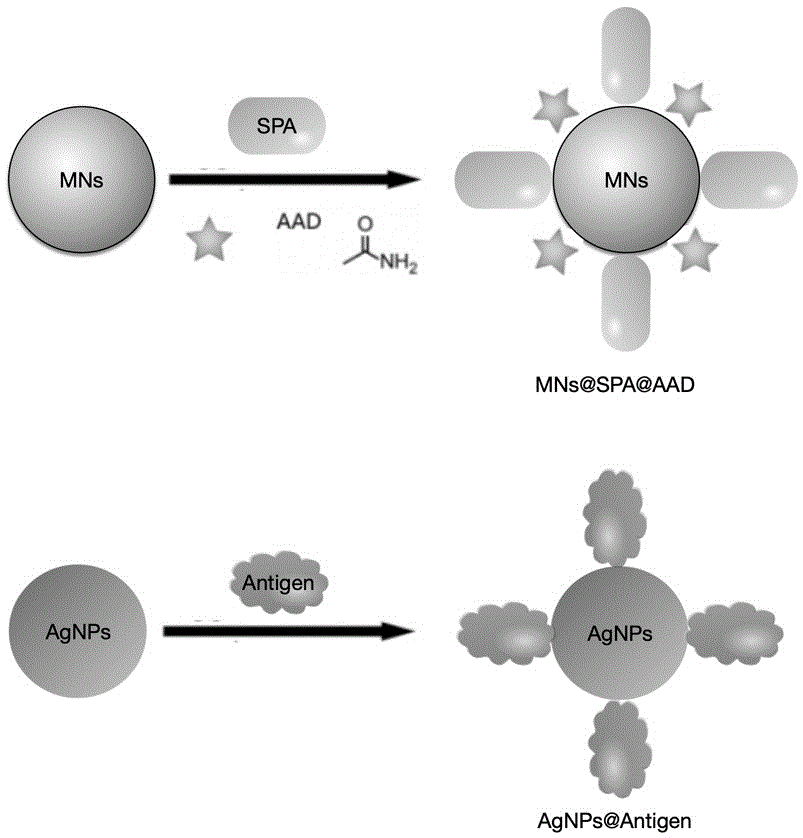
s4a:将可特异性结合抗体fc片段葡萄球菌a蛋白(spa)偶联磁珠(mns@spa,约500nm),在其上修饰有拉曼信号报告分子;
s4b:将免疫动物的抗原偶联银纳米粒(agnps@antigen,约48nm)。
以上所描述的步骤s5包含以下步骤:
s5a:利用微流控芯片实现了高通量的油水两项液滴,每个油滴中含有一个独立的细胞和两种s4步骤中合成的探针(如图2所示),然后由采集室阵列通道捕获用于sers测量。
s5b:在单个克隆细胞分泌的抗体存在的情况下,agnps@antigen可以通过上面的抗原识别抗体而抗体与mns@spa的表面spa结合,如图2所示的结构。
s5c:由于agnps的靠近,使得在mns上的拉曼报告分子的sers信号得到明显的增强。另外,从磁场诱导聚集效应设计对sers信号产生进一步放大,可进一步提高sers信号(图4)。此外,针对细胞所分泌表达的单克隆抗体的包裹,使得分析物随着反应时间的增加而积累效应。由于双重信号增强和积累作用,单个细胞分泌的少量抗体可被探测,检测限可达到1fg。
在以上所描述的步骤s6中,将具有拉曼信号达到预设检测要求的液滴分离到细胞培养工具中,待检。
本发明的优点在于:
1.大幅缩短单抗制备所需的时间,在单抗制备中最为耗费时间的阶段就是表达抗原相应抗体单克隆细胞的分离阶段,通常需要2-3个月,而本发明中仅需要十几个小时;
2.如只需要抗体的基因序列,则可省去杂交瘤细胞融合和单克隆分离过程;
3.能够实现高通量,可将能够分离得到所有产生抗体的细胞克隆,为药物开发提供更多选择;
本方法将大幅降低人力成本和抗体价格,带来行业变革。
附图说明
图1两种免疫颗粒示意图。抗原偶联银纳米粒(agnps@antigen,约48nm)和spa偶联磁珠(mns@spa,约500nm)。磁珠表面用拉曼报告分子修饰用星型表示。
图2抗体/抗原之间的免疫识别作用连接到spa偶联磁珠的表面作用示意图。
图3基于拉曼光谱和微液滴技术的单克隆抗体制备平台示意图。
图4左侧为拉曼检测信号图,右侧为抗体含量与拉曼报告分子对应关系。
具体实施方式
基于单细胞分析的表面增强拉曼光谱和微流控液滴技术鉴定单个细胞抗体表达量并以此为衡量标准对融合后的细胞进行分选的方法,以下实施内容中,以人表皮生长因子受体2(her2)的胞外域为抗原,制备抗her2的单克隆抗体。包括以下步骤:
s1:制备特定抗原用于免疫动物,动物的免疫通常共有三次,在最后一次免疫后取脾,制备脾细胞悬液;
利用基因工程重组表达的her2胞外域作为抗原,免疫6周龄的balb/c小鼠,三次添加佐剂免疫,免疫时间相隔三周,在最后一次免疫后第三天取脾,用于细胞融合实验;
s2:利用骨髓瘤细胞与步骤s1中的脾细胞进行细胞融合制备杂交瘤细胞;
制备骨髓瘤细胞,利用rpmi1640培养基培养小鼠骨髓瘤,血清浓度15%,当细胞生长至对数生长期中后段时,按照1:4的比例进行传代,在传代期间使用8-氮鸟嘌呤处理,保持活细胞对hat的均已敏感性。同时使用小鼠腹腔细胞作为饲养细胞。
以下为本实施方式进行细胞融合的方法:将骨髓瘤细胞与脾细胞按照1:10的比例进行混合,至于50ml离心管,采用无血清营养缺陷型培养基进行冲洗,离心800g十分钟,弃上清,洗净残留液体,轻微震动使细胞沉淀松动;用吸管在45秒内加热40℃的50%peg(ph8.0)液体中,用吸管在两分钟内将30ml预热的缺陷培养基,终止peg的作用,在25℃静置10分钟;1000g离心5分钟,弃掉上清液,加入5mlhat培养基,轻轻吹打沉淀细胞,使这些细胞悬浮并混匀,然后加入含有腹腔细胞的hat培养基至100ml加入饲养层细胞;然后将培养板置于37℃,6%co2培养箱内。于第6天置换出二分之一的hat培养基,八天后用ht培养基置换hat培养基,仍有数百个细胞存活,准备进行微流控液滴拉曼光谱检测和分选。
s3:搭建微流控平台
s4:制备具有拉曼信号的探针;
s5:拉曼光谱检测;
以下为微流控检测平台和拉曼光谱检测原理的图1
首先制备了两种免疫颗粒(图1),抗原偶联银纳米粒(agnps@antigen,约48nm)和spa偶联磁珠(mns@spa,约500nm)。磁珠表面也用拉曼报告分子修饰(星型表示)。
利用微流控芯片实现了高通量的油水两项液滴,每个油滴中含有一个独立的细胞和两种免疫颗粒,然后由采集室阵列通道捕获用于sers测量。在细胞分泌表达抗体的情况下,agnps@antigen可以通过抗体/抗原之间的免疫识别作用连接到mns@spa的表面(如图2所示)。由于agnps的靠近,使得在mns上的拉曼报告分子的sers信号得到明显的增强。另外,从磁场诱导聚集效应设计对sers信号产生进一步放大,可进一步提高sers信号75倍(图3)。此外,不断表达的抗体分子在分离液滴中的包裹使得分析物随着反应时间的增加而积累效应。由于双重信号增强和积累作用,单个细胞分泌的少量抗体可被探测。
首先验证该传感方法。将液滴内包裹不同浓度的mns@spa+agnps@antigen,进行检测。结果如图4所示,抗体含量与拉曼报告分子呈线性相关,证明该方法可行。在液滴中,包裹两种种粒子,并将抗体加入液滴,浓度从低到高改变,sers检测结果显示拉曼报告分子aad的特征峰1178cm-1。对峰强度对检测物浓度进行回归分析,r2=0.993,为较好的线性结果。在接下来的实施过程中,我们检测了大量单个细胞的液滴中,确定检测浓度可达到了1.0fg/ml的极限。
s6:单细胞培养和测序,该步骤中可获得高表达抗体的脾细胞(未进行s2步骤的操作)或杂交瘤细胞,可进行培养,获得大量抗体,或进行单细胞测序,得到抗体序列。
具体实施例是对本发明进行进一步说明,但本发明并不局限于这些具体的实施方式。
- 还没有人留言评论。精彩留言会获得点赞!