药物筛选用器官芯片的制作方法
本实用新型涉及组织工程技术领域,尤其是涉及一种药物筛选用器官芯片。
背景技术:
器官芯片为细胞或组织培养、病理学研究以及药物筛选等工作提供了一个新型的培养平台,其主要特色是能够更有效的模拟人体内器官的交互作用。器官芯片多由一个包含多通道流体芯片的三维培养系统,以及在线实时观察细胞或组织生长状态的成像器件组成。
然而,目前的器官芯片研究仍未成熟,现有器官芯片的器官组织贴壁生长于芯片的组织培养模块,这种设计会因为细胞的大量增殖、脱落导致细胞的死亡率增加或使微流道堵塞。
技术实现要素:
有鉴于此,本实用新型的目的在于提供药物筛选用器官芯片,避免了直接在器官芯片内打印的技术困难,同时,解决了细胞脱落的问题,避免了微流道的堵塞,并提高了细胞的存活率。
第一方面,本实用新型实施例提供了一种药物筛选用器官芯片,包括:转运单元、器官芯片主体,所述转运单元可拆卸的嵌入在所述器官芯片主体的里面,方便器官芯片主体中的培养基进入到转运单元,实现试验组织筛选待筛选药物;
所述器官芯片主体用于放置包含待筛选药物的培养基;
所述转运单元用于放置试验组织,试验组织为含细胞的生物3D打印组织。
结合第一方面,本实用新型实施例提供了第一方面的第一种可能的实施方式,其中,所述转运单元包括转运单元主体和转运单元底盘;所述转运单元主体与所述转运单元底盘为一个整体,或所述转运单元主体与所述转运单元底盘相扣合。
结合第一方面,本实用新型实施例提供了第一方面的第二种可能的实施方式,其中,所述转运单元主体的侧面包括有小孔,或者所述转运单元底盘包括有小孔。
结合第一方面,本实用新型实施例提供了第一方面的第三种可能的实施方式,其中,所述转运单元底盘包括有半透膜,以使所述培养基通过所述半透膜渗透入所述转运单元内部。
结合第一方面,本实用新型实施例提供了第一方面的第四种可能的实施方式,其中,所述转运单元的顶部包括有檐和在檐上的定位口。
结合第一方面,本实用新型实施例提供了第一方面的第五种可能的实施方式,其中,所述器官芯片还包括:透明顶盖,所述透明顶盖覆盖在所述器官芯片主体上,或者透明塞子,所述透明塞子覆盖在所述器官芯片主体的培养室上。
所述透明塞子顶部有肝素帽,可以通过带针头的注射器,针头穿过肝素帽,用注射器向培养室中添加液体或从培养室中提取液体。
结合第一方面,本实用新型实施例提供了第一方面的第六种可能的实施方式,其中,所述器官芯片主体还用于与驱动系统相连,所述驱动系统用于驱动所述培养基在所述器官芯片主体内流动。
结合第一方面,本实用新型实施例提供了第一方面的第七种可能的实施方式,其中,所述器官芯片主体中还包括有进液口和出液口,以使所述培养基从所述进液口进入到所述器官芯片主体中,以使所述培养基从所述出液口输出所述器官芯片主体外。
结合第一方面,本实用新型实施例提供了第一方面的第八种可能的实施方式,其中,所述器官芯片主体包括:硬质顶层、微流道层、透明底层、传感芯片,所述微流道层设置在所述硬质顶层和所述透明底层之间,所述传感芯片设置在所述微流道层和所述透明底层之间;
所述硬质顶层包括至少一个培养室、气体通道、顶面凹槽、底面凹槽、检测区域;所述底面凹槽用于放置所述微流道层;
所述微流道层包括至少一个培养室、微流道、单向阀、驱动凹槽、储液凹槽、分割凹槽、栅栏状阀门、软质薄膜、进液口、出液口;所述微流道将所述至少一个培养室、驱动凹槽、储液凹槽、分割凹槽连接起来;所述栅栏状阀门将所述分割凹槽隔断开;所述软质薄膜将驱动凹槽与储液凹槽、分割凹槽分隔开;
其中,所述转运单元与所述硬质顶层中的至少一个培养室、所述微流道层中的至少一个培养室匹配。
结合第一方面,本实用新型实施例提供了第一方面的第九种可能的实施方式,其中器官芯片主体的形状可为长方体或六面体。
本实用新型实施例带来了以下有益效果:可以在器官芯片主体上添加转运单元,转运单元可拆卸的嵌入在器官芯片主体的里面,当在转运单元嵌入在器官芯片主体的里面时,所述器官芯片主体中的培养基进入到转运单元,实现试验组织筛选待筛选药物,完成药物筛选,通过由于转运单元能够承载生物3D打印组织,在生物3D打印机和器官芯片之间提供了转运的手段,避免了直接在器官芯片内打印的技术困难,同时,采用生物3D打印组织承载试验组织,解决了细胞脱落的问题,避免了微流道的堵塞,并提高了细胞的存活率。
本实用新型的其他特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本实用新型而了解。本实用新型的目的和其他优点在说明书以及附图中所特别指出的结构来实现和获得。
为使本实用新型的上述目的、特征和优点能更明显易懂,下文特举较佳实施例,并配合所附附图,作详细说明如下。
附图说明
为了更清楚地说明本实用新型具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本实用新型的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1a为本实用新型一个实施例提供的药物筛选用器官芯片的结构图;
图1b为本实用新型另一个实施例提供的药物筛选用器官芯片的结构图;
图2a为本实用新型实施例提供的第一种转运单元的结构图;
图2b为本实用新型实施例提供的第二种转运单元的结构图;
图2c为本实用新型实施例提供的第三种转运单元的结构图;
图2d为本实用新型实施例提供的第四种转运单元的结构图;
图3a为本实用新型实施例提供的透明顶盖的结构示意图;
图3b为本实用新型实施例提供的透明塞子的结构示意图;
图4a为本实用新型实施例提供的第一种微流道层的正面的结构图;
图4b为本实用新型实施例提供的微流道层的反面的结构图;
图5为本实用新型实施例提供的微流道层中的单向阀的工作的结构示意图;
图6a为本实用新型一个实施例提供的药物筛选用器官芯片中的培养基进行控制原理的示意图;
图6b为本实用新型另一个实施例提供的药物筛选用器官芯片中的培养基进行控制原理的示意图;
图7为本实用新型实施例提供的药物筛选用器官芯片中的培养基更新原理的示意图;
图8为本实用新型实施例提供的第二种微流道层的正面的结构图;
图9为本实用新型实施例提供的第三种微流道层的正面的结构图。
具体实施方式
为使本实用新型实施例的目的、技术方案和优点更加清楚,下面将结合附图对本实用新型的技术方案进行清楚、完整地描述,显然,所描述的实施例是本实用新型一部分实施例,而不是全部的实施例。基于本实用新型中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本实用新型保护的范围。
目前的器官芯片研究仍未成熟,现有器官芯片的器官组织贴壁生长于芯片的组织培养模块,这种设计会因为细胞的大量增殖、脱落导致细胞的死亡率增加或使微流道堵塞,基于此,本实用新型实施例提供的一种药物筛选用器官芯片,可以在器官芯片主体上添加转运单元,转运单元可拆卸的嵌入在器官芯片主体的里面,当在转运单元嵌入在器官芯片主体的里面时,所述器官芯片主体中的培养基进入到转运单元,实现试验组织筛选待筛选药物,完成药物筛选,通过由于转运单元能够承载生物3D 打印组织,在生物3D打印机和器官芯片之间提供了转运的手段,避免了直接在器官芯片内打印的技术困难,同时,采用生物3D打印组织承载试验组织,解决了细胞脱落的问题,避免了微流道的堵塞,并提高了细胞的存活率。
为便于对本实施例进行理解,首先对本实用新型实施例所公开的一种药物筛选用器官芯片进行详细介绍,
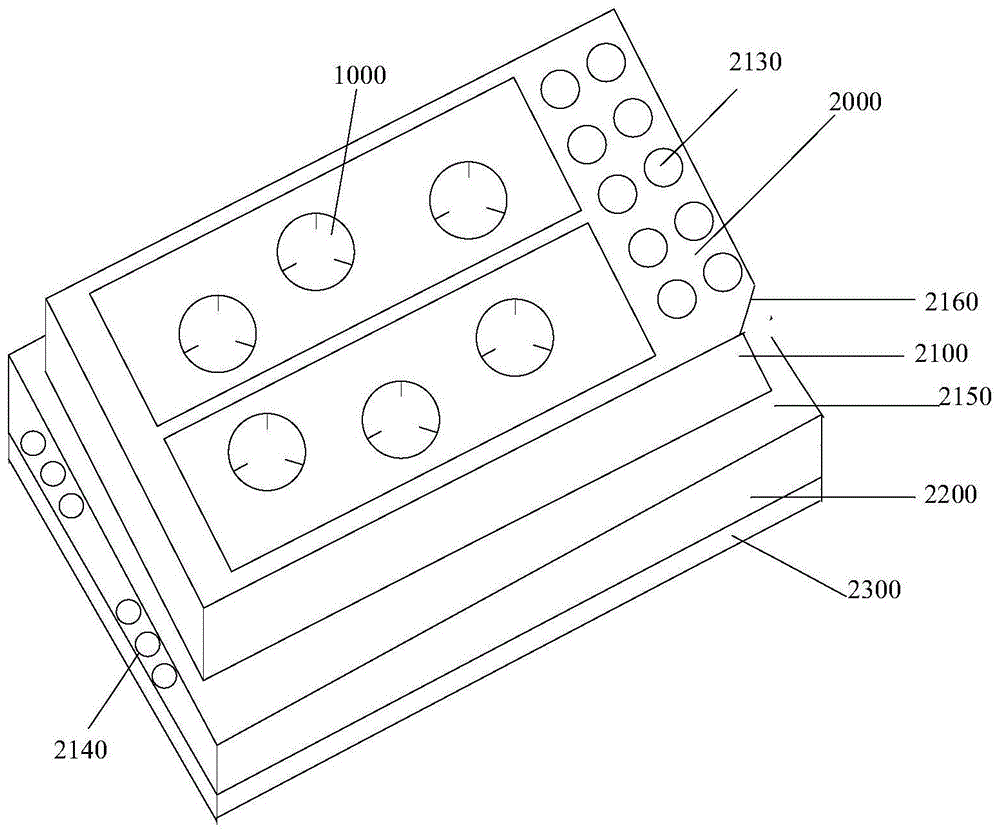
结合图1a所示,本实用新型实施例提供了一种药物筛选用器官芯片,药物筛选用器官芯片的形状为长方形,芯片包括:转运单元1000、器官芯片主体2000,转运单元1000可拆卸的嵌入在器官芯片主体2000的里面。作为一个实际应用的示例,当用户开始做实验时,用户取出一个转运单元 1000,将生物3D打印组织放置在转运单元1000,然后,在将装有生物3D 打印组织的转运单元1000以嵌入的方式安装到器官芯片主体2000。
其中,器官芯片主体2000用于放置包含待筛选药物的培养基;转运单元1000用于放置试验组织,在转运单元1000嵌入在器官芯片主体2000的里面,方便器官芯片主体2000中的培养基进入到转运单元1000,实现试验组织筛选待筛选药物,所述试验组织包括:生物3D打印组织。
具体来讲,在试验时,将生物3D打印组织放置在转运单元1000中,携带有生物3D打印组织的转运单元1000嵌入在器官芯片主体2000的里面,器官芯片主体2000中的培养基,其中,培养基中可以包括待筛选的药物,将生物3D打印组织浸泡在培养基中,即生物3D打印组织浸泡在待筛选的药物中,这样,经过一段时间,就可以通过观察生物3D打印组织中细胞的情况,来评估药物对生物3D打印组织的作用,从而筛选药物。
本实用新型进一步限定了转运单元的结构,具体来说,转运单元可以是一个整体结构,同时,转运单元包括小孔1300,可以通过小孔使得器官芯片主体2000中的培养基进入到转运单元1000中。另一种方式是,转运单元1000还可以是分体的结构,具体包括转运单元主体1100和转运单元底盘1200;转运单元主体1100与转运单元底盘1200相扣合。此时,小孔 1300可以位于转运单元主体的侧面或者转运单元底盘上。进一步的,在转运单元底盘1200包括有半透膜1400,将器官芯片主体2000中的培养基可以通过半透膜渗透入转运单元1000内部。其中,转运单元的形状可以为长方体、正方体、圆通型、多面体等。
作为以上限定的转运单元的结构特征,可以存在以下几种形式的转运单元1000。
结合图2a~图2d所示,公开了四种类型的转运单元1000,转运单元a 类型是,结合图2a所示,转运单元1000的侧面包括有小孔1300。这样,器官芯片主体中的培养基可以通过小孔1300进入到转运单元1000中。
结合图2b~图2d所示,公开了转运单元1000为分体式的结构,具体的,转运单元1000包括转运单元主体1100和转运单元底盘1200;转运单元主体1100与转运单元底盘1200相扣合。
然而,3种结构不同点在于,结合图2b所示,转运单元b型,所述转运单元主体的侧面包括有小孔1300,其中,转运单元底盘1200可以有底盘卡条,当转运单元主体1100与转运单元底盘1200安装时,通过挤压转运单元主体使之形变后,与转运单元底盘扣合。可以利用侧面的小孔与底盘卡条的位置对应,底盘卡条的面积小于侧面小孔面积,使得底盘卡条未能嵌入侧面小孔部分形成一个可供液体流动的小孔。
结合图2c所示,转运单元c型,所述转运单元主体的侧面包括有小孔 1300,其中,所述转运单元底盘包括有底盘卡条1200和半透膜1400,可以通过挤压转运单元主体1100使之形变后,与转运单元底盘1200扣合,且侧面的小孔与底盘卡条位置对应,底盘卡条完全与侧面小孔贴合使转运单元侧面密封,只通过半透膜将培养基渗透入转运单元1000 内部。
结合图2d所示,转运单元d型,在转运单元主体1100不做任何改变,转运单元底盘1200上包含有小孔1300,可以通过转运单元底盘1200中的小孔将培养基流入转运单元1000内部。
结合图2a~图2d所示,本实用新型实施例限定了转运单元1000的顶部包括有檐1500和在檐上的定位口1600。
作为一个示例,当器官芯片主体包括有硬质顶层和微流道层时,硬质顶层中包括有定位点,转运单元的定位口1600可与硬质顶层中的培养室的定位点吻合,底部有若干小孔,并且所述转运单元的定位口 1600与硬质顶层的定位点吻合,器官芯片主体搭配使用时,转运单元的小孔或者半透膜的位置应与微流道层的培养室和微流道相连接的位置对应。当转运单元具有定位口的和檐时,更加能够使转运单元更加安稳且固定的放置在器官芯片主体,与器官芯片主体内部的器件匹配使用。
可选的,所述器官芯片还包括:透明顶盖,所述透明顶盖覆盖在所述器官芯片主体上,或者透明塞子,所述透明塞子覆盖在所述器官芯片主体培养室上。
结合图3a所示,透明顶盖3000包括透气口3100、倒角3200。
结合图3b所示,透明塞子3010包括肝素帽3011、定位口3012。
其中,透明顶盖可以为经过倒角处理的长方形透明硬质塑料盖,其中一个定位倒角的形状与其他三个不同,以提供定位,透明顶盖的尺寸、外形与硬质顶层相吻合,硬质顶层中可以包括定位倒角2160 和透明顶盖卡槽2150,通过这两个定位用的点,方便了透明顶盖3000 覆盖硬质顶层2100中所有的培养室的开口时,可以将透明顶盖安装到透明顶盖卡槽2150上。另外,透明顶盖还可以有透气口3100与外界进行气体交换;或者可以使用透明塞子代替透明顶盖上到密封培养室的作用,硬质顶层有定位点和定位檐,可与透明塞子上的定位口 3012相吻合。
再结合图1a所示,所述器官芯片主体2000包括:硬质顶层2100、微流道层2200、透明底层2300、传感芯片,微流道层2200设置在硬质顶层 2100和透明底层2300之间,传感芯片设置在微流道层2200和透明底层2300 之间。
其中,硬质顶层2100是由透明、对细胞无毒的材料制成,材料可以包括但不限于聚苯乙烯塑料(PS)、聚碳酸酯(PC)、环烯烃类共聚物塑料(COC塑料)、聚乙烯(PE)、聚丙烯(PP)。
硬质顶层2100包括至少一个培养室、定位点、定位檐、气体通道、顶面凹槽、底面凹槽、检测区域2130、透明顶盖卡槽2150、培养室编号;底面凹槽用于放置微流道层。
硬质顶层2100中含有的至少一个培养室可放置细胞、组织或生物3D 打印组织等等用于试验的试验组织,也可以放置含有细胞、组织或生物3D 打印组织的转运单元;并且定位点和定位檐设置在培养室上,可以和转运单元的定位口吻合。
顶面凹槽可以区分不同微流道层,并配合所述培养室编号进行使用。检测区域2130,可放置96孔板酶标条,对取出的培养基进行分析检测,或直接在检测区域进行检测。
另外,培养室编号主要是为了区分使用,由于器官芯片主体可以包括多个培养室,可以同时培养不同种类的试验组织,所以,培养室编号能够使得用户在试验时做好区分工作。定位倒角的作用是为了与透明顶盖匹配安装,并方便在使用时快速找到透明顶盖正确的安装方向。
微流道层2200包括至少一个培养室、微流道、单向阀、驱动凹槽、储液凹槽、分割凹槽、栅栏状阀门、软质薄膜、进液口、出液口;所述微流道将所述至少一个培养室、驱动凹槽、储液凹槽、分割凹槽连接起来;所述栅栏状阀门将所述分割凹槽隔断开;所述软质薄膜将驱动凹槽与储液凹槽、分割凹槽分隔开。
微流道层由聚二甲基硅氧烷(PDMS)或包含聚二甲基硅氧烷的软质且对细胞生长无害的材料构成,并且其两侧通过氧等离子体处理,不可逆键合方式与硬质顶层和透明底层相键合。
结合图4a和图4b所示,微流道2220连接微流道层中的培养室2210,流道宽度梯度、分割凹槽2240、储液凹槽2230、驱动凹槽2260,并在分割凹槽2240中被栅栏状阀门2250隔断,或,结合图5所示,微流道2220中可以通过添加单向阀2270以实现流向的控制和遏制回流。具体拉锁,器官芯片主体2000上的微流道2220采用垂直结构,培养基从微流道2220通过单向阀2270后进入微流道层的培养室2210,再通过另一个单向阀2270离开微流道层的培养室2210进入垂直方向上的另一段微流道2220;将培养基加入培养室2210中后并充满整个微流道2220。微流道的直径≤1mm,为微流道层的培养室提供循环流动的液体培养基,为细胞、组织或生物3D打印组织的生长提供营养,并排出代谢废物;
可选的,微流道2220中具有一段宽度渐变的微流道,可以称为流道宽度梯度,流道宽度梯度在靠近培养室一端的宽度大于靠近微流道一端的宽度,或所述微流道和培养室通过垂直流道连接时,则所述流道宽度梯度为一段直径渐变的微流道。
结合图6a所示,所述器官芯片主体2000还用于通过管道3500与驱动系统5000相连,所述驱动系统5000用于驱动所述培养基在所述器官芯片主体内流动。
由于驱动系统5000使用气压的不同来控制培养基在器官芯片主体2000 中流动的,同时,培养基主要在硬质顶层2100、微流道层2200中,那么先介绍硬质顶层2100的气路。本实用新型中硬质顶层2100包括气体通道,气体通道包括气管接口与气体输出口,气管接口与气体输出口可以通过导管联通共同组成为一个气体通道,气体输出口可以与微流道层的驱动凹槽 2260相连接;气管接口2140可以通过管道3500与驱动系统5000相连接,硬质顶层上的气体输出口与微流道层中的驱动凹槽2260的位置、形状相对应。在微流道层2200中,可以软质薄膜将驱动凹槽2260与分割凹槽2240 或储液凹槽2230分隔开;驱动凹槽2260与硬质顶层上的气体输出口位置、形状相对应,并驱动系统5000通过管道3500向器官芯片主体输出气体,器官芯片主体中,气管接口2140与管道3500相连,在通过气管接口2140 输送到器官芯片主体,可通过改变气体通道中的气压使软质薄膜发生形变,导致分割凹槽2240和储液凹槽2230的体积发生变化,实现栅栏状阀门2250 的开闭和储液凹槽2230中液体体积的控制,从而实现培养基在所述器官芯片主体内流动。
在器官芯片主体2000中的培养基内部循环的情况下,微流道层2200 还可以具有以下结构,再结合图4a所示,微流道2220可为闭环流道,微流道内的培养基通过驱动系统5000进行自循环,并通过人工定期更换培养基来实现培养基的更新。人工定期更换的方式可以为,先倒掉原培养基,再使用可以盛放液体的工具将新培养基放到器官芯片主体2000中。
或所述微流道2220可制作成在一个或多个高度维度内,即培养基既可以在流道的同一个平面中流动,也可以通过一个垂直的通道进入另一个高度维度的流道中继续循环。
当使用驱动系统5000进行器官芯片主体2000中的培养基的更新时,结合图7所示,驱动系统5000可以通过管道与储液池6100、废液池6200 相连,同时,硬质顶层表面可以根据需要增加进液口2110和出液口2120,驱动系统5000与在器官芯片主体2000中的进液口2110和出液口2120相连,新的培养基在驱动系统驱使下,通过管道进入进液口2110,在器官芯片主体2000内完成循环后从出液口2120通过管道离开器官芯片主体2000。
在完成器官芯片主体2000中的培养基的更新的情况下,微流道层还可以具有以下结构,结合图8所示,微流道2220可为开环流道,在微流道中设有进液口2221和出液口2222,且与硬质顶层的进液口 2110和出液口2120位置对应,驱动系统5000将储液池内的新鲜培养基,通过管道驱动至硬质顶层进液口2110,进入微流道2220,培养基在微流道2220内完成循环后,通过微流道中的出液口2222离开微流道,并通过与硬质顶层出液口2120连接的管道排入废液池,培养基进入废液池6200后被提取分析或弃置。
其中,所述转运单元与所述硬质顶层中的至少一个培养室、所述微流道层中的至少一个培养室匹配。
其中,硬质顶层2100,微流道层2200,透明底层2300通过氧等离子处理,以不可逆键合方式键合而成,并且在键合过程中硬质顶层 2100的培养室,要与微流道层2200的培养室对应匹配,并且微流道层2200和透明底层2300在键合过程中将传感芯片固定在微流道层 2200和透明底层2300之间,并能与微流道层2200的微流道2220中的培养基相接触,器官芯片主体2000作为一个整体进行使用。
透明底层2300可由透明硬质的玻璃或其他透明硬质的材料组成,与微流道层通过不可逆方式键合,为微流道层2200提供基底,并包含传感芯片。
传感芯片为表面功能化有生物标记物的生物芯片,被置于微流道、硬质顶层或微流道层中培养室的顶端或底端并与培养基接触;根据所选传感原理及传感芯片所需的传感条件,器官芯片主体上设有为传感条件进出器官芯片主体的通道,并使其与传感芯片相连通;所述传感条件包括但不限于光、电流、电压、磁场,并且进出器官芯片主体时的各方面特征被实时地检测和记录。
结合图1b所述,本实用新型另一个实施例提供了一种药物筛选用器官芯片,可制作为六面体,硬质顶层2100中的培养室2110用透明塞子3010 进行密封,透明塞子3010顶部有肝素帽,可以通过带针头的注射器,针头穿过肝素帽3011,用注射器向培养室中添加液体或从培养室中提取液体。
结合图6a所示,本实用新型还包括打印喷头4000,打印喷头4000可以直接打印生物3D打印组织,放入到转运单元1000中。
结合图6b所述,本实用新型器官芯片可与驱动系统5000组合为一个整体,驱动系统5000与显示控制装置5100连接,通过显示控制装置5100 进行控制操作。
结合图6b所述的器官芯片的运行的情况下,微流道2220可以具有以下结构,结合图9所示,微流道层2200含有一条微流道2220,与硬质顶层2100中连通所有培养室的微流道相连,微流道层2200通过不可逆的键合与硬质顶层2100密封。使用时,用透明塞子3010对培养室进行密封,并将器官芯片主体2000与驱动系统5000相连接,使驱动系统5000周期性挤压微流道层2200的微流道2220,驱动培养基在器官芯片内完成循环;药物筛选过程中,通过带针头的注射器从透明塞子3010的肝素帽3011中添加含所筛选药物的培养基或提取含代谢产物的检测样本。
以下介绍几个利用本实用新型提供的药物筛选用器官芯片的实际应用的示例。
示例1,用转运单元a型接收打印喷头打印4000的生物3D打印组织,盛放有生物3D打印组织的转运单元a型放入培养基中,对生物3D打印组织进行培养;培养一定时间后,通过定位口1600将转运单元a型定位放入到器官芯片主体2000中,将培养基加入培养室中后并充满整个微流道2220,将透明顶盖3000置于透明顶盖卡槽2150上,然后将驱动系统5000与气管接口2140用管道3500连接起来,进而对生物3D打印组织进行药物筛选。
或用转运单元a型接收打印喷头4000打印的生物3D打印组织,盛放有生物3D打印组织的转运单元a型放入培养基中,对生物3D打印组织进行培养;培养一定时间后,将带有生物3D打印组织的转运单元a型放入器官芯片主体2000上培养室2110中;将培养基加入培养室中后并充满整个微流道2220,用透明塞子将培养室密封,然后将驱动系统5000与气管接口 2140用管道3500连接起来,进而对生物3D打印组织进行药物筛选。
示例2,用转运单元a型接收打印喷头4000打印的生物3D打印组织,两者一起放入培养基中,对生物3D打印组织进行培养;培养一定时间后,将带有生物3D打印组织的转运单元a型放入器官芯片主体2000上培养室中,将培养基加入培养室中后并充满整个微流道2220,用透明塞子将所有培养室进行密封,然后将器官芯片主体2000,驱动系统5000,储液池6100,废液池6200,通过管道连接起来,并且储液池6100和硬质顶层2100的进液口2110用管道相连,硬质顶层出液口2120与废液池6200通过管道相连,使用时,驱动系统5000将储液池6100中的培养基通过管道驱动进进液口 2110,随后培养基通过微流道层的进液口2221进入微流道2220,完成循环后通过微流道层的出液口2222离开微流道2220,再通过出液口2120进入管道,随后被通入废液池6200,进而对生物3D打印组织进行药物筛选。
示例3,用转运单元b型的转运单元底盘接收打印喷头4000打印的生物3D打印组织,然后用手指挤压转运单元b型的转运单元主体1100,使其变形,将其与转运单元b型的转运单元底盘1200对齐,使底盘卡条和侧面的小孔1300吻合,松开手指使转运单元b型的转运单元主体1100恢复原形并使其与转运单元b型的转运单元底盘1200固定;将固定后的带有生物3D打印组织的转运单元b型放入培养基中培养;培养一定时间后,将带有生物3D打印组织的转运单元b型放入器官芯片主体2000上培养室中;将培养基加入培养室中后并充满整个微流道2220,将透明顶盖3000置于透明顶盖卡槽2150,然后将驱动系统5000与气管接口2140用管道3500连接起来,进而对生物3D打印组织进行药物筛选。
或用转运单元c型的转运单元底盘接收打印喷头4000打印的生物3D 打印组织,然后用手指挤压转运单元c型的转运单元主体1100,使其变形,将其与转运单元c型的转运单元底盘1200对齐,使底盘卡条和侧面的小孔1300吻合,松开手指使转运单元c型的转运单元主体1100恢复原形并使其与转运单元c型的转运单元底盘1200固定;将固定后的带有生物3D打印组织的转运单元c型放入培养基中培养;培养一定时间后,将带有生物3D 打印组织的转运单元c型放入器官芯片主体2000上培养室中,将培养基加入培养室中后并充满整个微流道2220,将透明顶盖3000置于透明顶盖卡槽 2150,然后将驱动系统5000与气管接口2140用管道3500连接起来,进而对生物3D打印组织进行药物筛选。
或用转运单元d型的转运单元底盘接收打印喷头4000打印的生物3D 打印组织,然后用手指挤压转运单元d型的转运单元主体1100,使其变形,将其与转运单元d型的转运单元底盘1200对齐,松开手指使转运单元d型的转运单元主体1100恢复原形并使其与转运单元d型的转运单元底盘1200 固定;将固定后的带有生物3D打印组织的转运单元d型放入培养基中培养;培养一定时间后,将带有生物3D打印组织的转运单元d型放入器官芯片主体2000上培养室中;将培养基加入培养室中后并充满整个微流道2220,将透明顶盖3000置于透明顶盖卡槽2150,然后将驱动系统5000与气管接口 2140用管道3500连接起来,进而对生物3D打印组织进行药物筛选。
示例4,用转运单元接收打印喷头打印的生物3D打印组织,两者一起放入培养基中,对生物3D打印组织进行培养;培养一定时间后,将带有生物3D打印组织的转运单元1000放入器官芯片主体2000上培养室中;该器官芯片主体2000上的微流道2220采用垂直结构,培养基从微流道2220通过单向阀后进入培养室,再通过另一个单向阀离开培养室进入另一段微流道2220;将培养基加入培养室中后并充满整个微流道2220,将透明顶盖3000 置于透明顶盖卡槽2150,然后将驱动系统5000与气管接口2140用管道3500 连接起来,进而对生物3D打印组织进行药物筛选。
示例5,按照上述示例开始药物筛选后,将培养室内的培养基用移液枪取出,加入检测区域2130中,或在检测区域2130中放置酶标条后将培养室中取出的培养基加入酶标条;向培养基中添加荧光标记物,将透明顶盖 3000置于透明顶盖卡槽2150,然后将器官芯片主体2000放入酶标仪中进行培养基成分的分析。
除非另外具体说明,否则在这些实施例中阐述的部件和步骤的相对步骤、数字表达式和数值并不限制本实用新型的范围。
在这里示出和描述的所有示例中,任何具体值应被解释为仅仅是示例性的,而不是作为限制,因此,示例性实施例的其他示例可以具有不同的值。
应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中不需要对其进行进一步定义和解释。
另外,在本实用新型实施例的描述中,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本实用新型中的具体含义。
在本实用新型的描述中,需要说明的是,术语“中心”、“上”、“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本实用新型和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本实用新型的限制。此外,术语“第一”、“第二”、“第三”仅用于描述目的,而不能理解为指示或暗示相对重要性。
最后应说明的是:以上所述实施例,仅为本实用新型的具体实施方式,用以说明本实用新型的技术方案,而非对其限制,本实用新型的保护范围并不局限于此,尽管参照前述实施例对本实用新型进行了详细的说明,本领域的普通技术人员应当理解:任何熟悉本技术领域的技术人员在本实用新型揭露的技术范围内,其依然可以对前述实施例所记载的技术方案进行修改或可轻易想到变化,或者对其中部分技术特征进行等同替换;而这些修改、变化或者替换,并不使相应技术方案的本质脱离本实用新型实施例技术方案的精神和范围,都应涵盖在本实用新型的保护范围之内。因此,本实用新型的保护范围应所述以权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!