使用具有多特异性的嵌合T细胞受体蛋白治疗癌症的制作方法
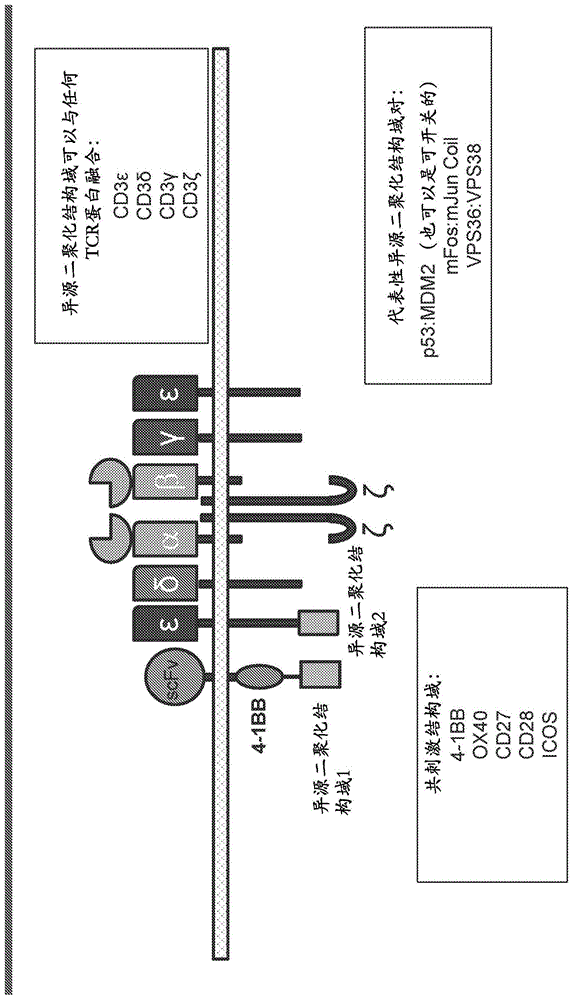
相关申请本申请要求2017年1月31日提交的美国序列号62/452601的优先权,将其内容通过引用以其整体并入本文。序列表本申请包含按ascii格式以电子方式提交并特此通过援引以其全文并入的序列表。创建于2018年1月31日的所述ascii副本名为n2067-7147wo_sl.txt且大小为231,229字节。本发明总体上涉及经工程化以表达嵌合膜蛋白的免疫效应细胞(例如,t细胞、nk细胞)在治疗与肿瘤抗原表达相关的疾病中的用途。
背景技术:
:使用用嵌合抗原受体(car)转导的自体t细胞的过继性细胞转移(act)疗法在血液癌症试验中显示出前景。本领域对于用于act的改善的嵌合分子存在需要。技术实现要素:本发明至少部分涉及经工程化以表达多于一种与如本文描述的肿瘤抗原结合的嵌合多肽的免疫效应细胞(例如t细胞、nk细胞)在治疗与所述一种或多种肿瘤抗原表达相关的癌症中的用途。在第一方面,本发明提供了一种系统,所述系统包含:第一嵌合膜蛋白,所述第一嵌合膜蛋白包含细胞外结构域、跨膜结构域、和细胞内结构域,所述细胞外结构域包含第一抗原结合结构域和源自cd3γ、δ、或ε的细胞外结构域的第一细胞外结构域,所述细胞内结构域包含源自除了cd3γ、δ、或ε之外的蛋白的第一细胞内共刺激结构域;以及第二嵌合膜蛋白,所述第二嵌合膜蛋白包含细胞外结构域、跨膜结构域、和任选的细胞内结构域,所述细胞外结构域包含第二抗原结合结构域和源自cd3γ、δ、或ε的细胞外结构域的第二细胞外结构域,所述细胞内结构域包含源自除了cd3γ、δ、或ε之外的蛋白的第二细胞内共刺激结构域;其中所述第一抗原结合结构域和所述第二抗原结合结构域不相同,并且其中cd3γ、δ、或ε的第一细胞外结构域和cd3γ、δ、或ε的第二细胞外结构域不相同。在实施例中,所述第一cd3γ、δ、或ε细胞外结构域包含整个cd3γ、δ、或ε细胞外结构域。在实施例(包括上述实施例)中,所述第二cd3γ、δ、或ε细胞外结构域包含整个cd3γ、δ、或ε细胞外结构域。在实施例中,包括在上述实施例中,a)第一嵌合蛋白包含整个cd3ε细胞外结构域,并且第二嵌合蛋白包含整个cd3γ细胞外结构域;b)第一嵌合蛋白包含整个cd3ε细胞外结构域,并且第二嵌合蛋白包含整个cd3δ细胞外结构域;或c)第一嵌合蛋白包含整个cd3δ细胞外结构域,并且第二嵌合蛋白包含整个cd3γ细胞外结构域。在实施例中,包括在上述实施例中,第一嵌合蛋白包含整个cd3γ、δ、或ε蛋白。在实施例中,包括在上述实施例中,第二嵌合蛋白包含整个cd3γ、δ、或ε蛋白。在其他实施例中,包括在上述实施例中,第一嵌合蛋白不包括任何源自cd3γ、δ、或ε蛋白的细胞内结构域。在实施例中,包括在上述实施例中,第二嵌合蛋白不包括任何源自cd3γ、δ、或ε蛋白的细胞内结构域。在实施例中,包括在上述实施例中,第一嵌合蛋白和/或第二嵌合蛋白的跨膜结构域并不包含cd3γ、δ、或ε的跨膜结构域。在实施例中,包括在上述实施例中,第一抗原结合结构域位于所述源自cd3γ、δ、或ε的第一细胞外结构域的n-末端。在实施例中,包括在上述实施例中,第二抗原结合结构域位于所述源自cd3γ、δ、或ε的第二细胞外结构域的n-末端。在实施例中,包括在上述实施例中,第一嵌合蛋白、第二嵌合蛋白、或第一嵌合蛋白和第二嵌合蛋白两者包含位于所述第一和/或第二抗原结合结构域的n-末端的第三抗原结合结构域。在实施例中,包括在上述实施例中,第一抗原结合结构域和所述源自cd3γ、δ、或ε的第一细胞外结构域由第一接头连接,和/或第二抗原结合结构域和所述源自cd3γ、δ、或ε的第二细胞外结构域由第二接头连接。在实施例中,所述第一接头和/或第二接头包括,例如由以下组成:(ggggs)n,例如其中n是从0至10的整数,(seqidno:68),例如其中n是4。在实施例中,包括在上述实施例中,所述第二嵌合膜蛋白包含源自除了cd3γ、δ、或ε之外的蛋白的第二细胞内共刺激结构域。在其他实施例中,包括在上述实施例中,所述第二嵌合膜蛋白不包含源自除了cd3γ、δ、或ε之外的蛋白的第二细胞内共刺激结构域。在实施例中,包括在上述实施例中,系统不包括第二细胞内共刺激结构域。在实施例中,包括在上述实施例中,系统包括第一细胞内共刺激结构域和第二细胞内共刺激结构域两者。在实施例中,包括在上述实施例中,第一嵌合膜蛋白包含位于第一细胞内共刺激结构域的c-末端的源自除了cd3γ、δ、或ε之外的蛋白的第三细胞内共刺激结构域。在实施例中,包括在上述实施例中,所述细胞内共刺激结构域(例如如果存在,第一细胞内共刺激结构域和/或第二细胞内共刺激结构域,和/或如果存在,第三细胞内共刺激结构域)中的一个或多个是选自由以下组成的组的蛋白的功能性信号传导结构域:mhci类分子、tnf受体蛋白、免疫球蛋白样蛋白、细胞因子受体、整联蛋白、信号传导淋巴细胞活化分子(slam蛋白)、激活性nk细胞受体、btla、toll配体受体、ox40、cd2、cd7、cd27、cd28、cd30、cd40、cds、icam-1、lfa-1(cd11a/cd18)、4-1bb(cd137)、b7-h3、cds、icam-1、icos(cd278)、gitr、baffr、light、hvem(lightr)、kirds2、slamf7、nkp80(klrf1)、nkp44、nkp30、nkp46、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、nkg2d、nkg2c、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、cd19a和与cd83特异性结合的配体,或其功能变体,例如包括本文描述的共刺激结构域。在实施例中,包括在上述实施例中,第一抗原结合结构域结合肿瘤抗原。在实施例中,第一抗原结合结构域结合b细胞抗原,例如cd5、cd10、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd27、cd30、cd34、cd37、cd38、cd40、cd53、cd69、cd72、cd73、cd74、cd75、cd77、cd79a、cd79b、cd80、cd81、cd82、cd83、cd84、cd85、cd86、cd123、cd135、cd138、cd179、cd269、flt3、ror1、bcma、fcrn5、fcrn2、cs-1、cxcr4、cxcr5、cxcr7、il-7/3r、il7/4/3r、或il4r,例如cd19、cd20、cd22、fcrn5、fcrn2、bcma、cs-1、或cd138。在实施例中,包括在上述实施例中,第二抗原结合结构域结合肿瘤抗原。在实施例中,第二抗原结合结构域结合b细胞抗原,例如,与第一抗原结合结构域结合的相同的b细胞抗原,但是,是在抗原上不同的结合表位或区域。在其他实施例中,第二抗原结合结构域结合b细胞抗原,例如与第一抗原结合结构域结合的b细胞抗原不同的b细胞抗原。在实施例中,第二抗原结合结构域结合的b细胞抗原是cd5、cd10、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd27、cd30、cd34、cd37、cd38、cd40、cd53、cd69、cd72、cd73、cd74、cd75、cd77、cd79a、cd79b、cd80、cd81、cd82、cd83、cd84、cd85、cd86、cd123、cd135、cd138、cd179、cd269、flt3、ror1、bcma、fcrn5、fcrn2、cs-1、cxcr4、cxcr5、cxcr7、il-7/3r、il7/4/3r、或il4r,例如是cd19、cd20、cd22、fcrn5、fcrn2、bcma、cs-1、或cd138。在实施例中,a)第一抗原结合结构域结合cd19并且第二抗原结合结构域结合cd20;b)第一抗原结合结构域结合cd19并且第二抗原结合结构域结合cd22;或c)第一抗原结合结构域结合cd20并且第二抗原结合结构域结合cd22。在实施例中,第二抗原结合结构域结合实体瘤抗原,如本文描述,例如egfrviii、间皮素、gd2、tn抗原、stn抗原、tn-o-糖肽、stn-o-糖肽、psma、cd97、tag72、cd44v6、cea、epcam、kit、il-13ra2、leguman、gd3、cd171、il-11ra、psca、mad-ct-1、mad-ct-2、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、叶酸受体α、erbb(例如erbb2)、her2/neu、muc1、egfr、ncam、肝配蛋白b2、caix、lmp2、sle、hmwmaa、o-乙酰基-gd2、叶酸受体β、tem1/cd248、tem7r、fap、legumain、hpve6或e7、ml-iap、cldn6、tshr、gprc5d、alk、多唾液酸、fos相关抗原、嗜中性粒细胞弹性蛋白酶、trp-2、cyp1b1、精子蛋白17、β人绒毛膜促性腺激素、afp、甲状腺球蛋白、plac1、globoh、rage1、mn-caix、人端粒酶逆转录酶、肠羧基酯酶、muthsp70-2、na-17、ny-br-1、upk2、havcr1、adrb3、panx3、ny-eso-1、gpr20、ly6k、or51e2、tarp、gfrα4和mhc上呈递的这些抗原的任一个的肽,例如,选自由以下组成的组的实体瘤抗原:cldn6、间皮素和egfrviii。在实施例中,a)第一抗原结合结构域结合cd19并且第二抗原结合结构域结合间皮素;b)第一抗原结合结构域结合cd19并且第二抗原结合结构域结合egfrviii;或c)第一抗原结合结构域结合cd19并且第二抗原结合结构域结合cldn6。在第二方面,本发明提供了编码上述方面和实施例中任一项所述的系统的核酸构建体。在实施例中,核酸构建体是rna,例如mrna。在其他实施例中,核酸构建体是dna。在第三方面,本发明提供了包含先前方面所述的核酸构建体的载体。在实施例中,所述载体是慢病毒载体、腺病毒载体、或逆转录病毒载体。在实施例中,当所述第一和第二嵌合膜蛋白表达时,所述蛋白被表达为单mrna转录物,例如,其中编码所述第一和第二嵌合膜蛋白的核酸序列由编码自切割位点或内部核糖体进入位点的核酸分开。在第四方面,本发明提供了细胞,例如,如本文描述,包含先前核酸构建体方面和实施例方面中任一项所述的核酸构建体、上述载体方面和实施例中任一项所述的载体、或上述方面和实施例中任一项所述的系统。在实施例中,所述细胞选自nk细胞或t细胞。在第五方面,本发明提供了治疗患有增殖性障碍的受试者的方法,所述方法包括施用上述细胞方面和实施例中任一项所述的细胞。在实施例中,所述受试者患有肿瘤并且所述施用向所述受试者提供了针对所述肿瘤的免疫。在实施例中,所述细胞是t细胞或nk细胞并且是所述受试者自体的。在其他实施例中,所述细胞是同种异体t细胞或nk细胞。在实施例中,所述受试者是人类。尽管以上描述了系统的嵌合膜蛋白的特征,但是以下将描述系统的嵌合膜蛋白的另外方面。因此,在相关方面,本发明的特征在于包括cd3γ、δ、或ε结构域和细胞内共刺激结构域的嵌合膜蛋白,其中cd3结构域包含源自cd3γ、δ、或ε的细胞外结构域的细胞外结构域,并且细胞内共刺激结构域不源自cd3γ、δ、或ε。在相关方面,本发明的特征在于包括cd3γ、δ、或ε结构域和第一细胞内二聚化结构域的嵌合膜蛋白,其中cd3γ、δ、或ε结构域包含源自cd3γ、δ、或ε的细胞外结构域的细胞外结构域。在这个方面,蛋白可以任选地进一步包括细胞内共刺激结构域。在又另一个方面,本发明的特征在于包括抗原结合结构域和cd3γ、δ、或ε结构域的嵌合膜蛋白,其中cd3γ、δ、或ε结构域包含源自cd3γ、δ、或ε的细胞外结构域的细胞外结构域。在前述方面中的任一项中,cd3γ、δ、或ε结构域包含整个cd3γ、δ、或ε细胞外结构域(例如整个蛋白)或cd3γ、δ、或ε结构域的一部分。在某些方面,其中它只是细胞外结构域的一部分,截短的结构域保留了与剩余tcr多肽相关联的能力。在某些方面,嵌合膜蛋白并不包含源自cd3γ、δ、或ε的任何细胞内结构域和/或跨膜结构域。在前述方面中的任一项中,蛋白还包括位于cd3γ、δ、或ε结构域的n-末端的抗原结合结构域。在另一个方面,本发明的特征在于包含前述嵌合膜蛋白中任一项的细胞(例如nk细胞或t细胞)。在另一个方面,本发明的特征在于编码前述嵌合膜蛋白中任一项的核酸(例如dna或mrna)。本发明的特征还在于包含此类核酸的载体(例如慢病毒载体、腺病毒载体、或逆转录病毒载体)。在前述细胞中任一项的某些中,嵌合膜蛋白包含cd3γ、δ、或ε结构域和细胞外二聚化结构域,并且细胞进一步包含第二嵌合蛋白,所述第二嵌合蛋白包含细胞内共刺激结构域和第二细胞内二聚化结构域。在某些实施例中,当在细胞中表达时,第一和第二二聚化结构域构成异源二聚化对并且异源二聚化(例如p53和mdm2、mfos和mjuncoil、以及vps36和vps28)。在其他实施例中,当仅在二聚化化合物存在的情况下在细胞中表达时,每一和第二二聚化结构域构成异源二聚化对并且异源二聚化。例如第一和第二二聚化结构域中的一个可以包括与fkbp具有至少85%同一性的雷帕霉素类似物结合序列,并且任选地,第一和第二二聚化结构域中的另一个包括与frp具有至少85%同一性的雷帕霉素类似物结合序列。在另一实例中,第一和第二二聚化结构域中的一个包括来自fkbp的雷帕霉素类似物结合序列。此处,第一和第二二聚化结构域中的另一个可以任选地包括来自frp的雷帕霉素类似物结合序列。在某些实施例中,雷帕霉素类似物结合序列包括来自fkbp或frp的ap21967结合序列。其他示例性异源二聚化对包括基于gyrb-gyrb的开关、基于gai-gid1的开关、或基于halo-标签/snap-标签的开关。第二嵌合蛋白可以是例如嵌合膜蛋白,并且可以例如进一步包括细胞外抗原结合结构域。在其他方面,前述细胞中的某些可以例如包含cd3γ、δ、或ε结构域和细胞内二聚化结构域,并且细胞可以例如进一步包含第二嵌合蛋白(例如嵌合膜蛋白),所述第二嵌合膜蛋白包含细胞外抗原结合结构域、细胞内共刺激结构域、以及cd3γ、δ、或ε结合结构域(其例如结合细胞内或细胞外cd3结构域)。此类结合结构域可以例如源自抗cd3γ、δ、或ε抗体(例如scfv或vhh结构域)。在这些实施例的某些中,第二嵌合蛋白的细胞外抗原结合结构域(例如抗体的抗原结合结构域或其片段)与第二嵌合蛋白的细胞内共刺激信号传导结构域是异源的,和/或是抑制性分子的细胞外结构域。可替代地,第二嵌合蛋白的细胞外抗原结合结构域与第二嵌合蛋白的细胞内共刺激信号传导结构域是天然相关的。在以上方面的某些中,第二嵌合蛋白可以例如被表达为细胞内蛋白。在前述方面的某些中,第一和第二嵌合蛋白两者包含源自相同或不同的内源蛋白的细胞内共刺激结构域。在另一个方面,本发明的特征在于编码前述第一和第二嵌合蛋白中任一项的核酸和包含此类核酸的载体。此类载体可以被配置,使得当第一和第二嵌合蛋白表达后,这些蛋白被表达为单mrna转录物,其中第一和第二嵌合蛋白由编码自切割位点或内部核糖体进入位点的核酸分开。在前述实施例中的任一项中,细胞内共刺激结构域中的一个或多个是选自包括以下项的组的蛋白的功能性信号传导结构域:mhci类分子、tnf受体蛋白、免疫球蛋白样蛋白、细胞因子受体、整联蛋白、信号传导淋巴细胞活化分子(slam蛋白)、激活性nk细胞受体、btla、toll配体受体、ox40、cd2、cd7、cd27、cd28、cd30、cd40、cds、icam-1、lfa-1(cd11a/cd18)、4-1bb(cd137)、b7-h3、cds、icam-1、icos(cd278)、gitr、baffr、light、hvem(lightr)、kirds2、slamf7、nkp80(klrf1)、nkp44、nkp30、nkp46、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、nkg2d、nkg2c、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、cd19a和与cd83特异性结合的配体,或其功能变体。在又另一个方面,本发明的特征在于用前述细胞中的任一项治疗受试者(例如人类)(例如其中受试者患有增殖性障碍(例如癌症))。在某些实施例中,受试者患有肿瘤并且施用向受试者提供了针对肿瘤的免疫。细胞可以是例如受试者自体的或同种异体的t细胞或nk细胞。嵌合蛋白编码核酸因此,在一个方面,本发明涉及编码包含以下中的一个或多个的嵌合膜蛋白的分离的核酸分子:结合如本文描述的肿瘤抗原的抗原结合结构域(例如抗体或抗体片段、tcr或tcr片段)、跨膜结构域(例如本文描述的跨膜结构域)、以及细胞内信号传导结构域(例如包含共刺激结构域(例如本文描述的共刺激结构域)和/或初级信号传导结构域(例如本文描述的初级信号传导结构域)的细胞内信号传导结构域)。在一些实施例中,所述肿瘤抗原选自以下中的一种或多种:cd19;cd123;cd22;cd30;cd171;cs-1(也称为cd2子集1、cracc、slamf7、cd319和19a24);c型凝集素样分子-1(cll-1或clecl1);cd33;表皮生长因子受体变体iii(egfrviii);神经节苷脂g2(gd2);神经节苷脂gd3(aneu5ac(2-8)aneu5ac(2-3)bdgalp(1-4)bdglcp(1-1)cer);tnf受体家族成员b细胞成熟(bcma);tn抗原((tnag)或(galnacα-ser/thr));前列腺特异性膜抗原(psma);受体酪氨酸激酶样孤儿受体1(ror1);fms样酪氨酸激酶3(flt3);肿瘤相关糖蛋白72(tag72);cd38;cd44v6;癌胚抗原(cea);上皮细胞粘附分子(epcam);b7h3(cd276);kit(cd117);白细胞介素-13受体亚基α-2(il-13ra2或cd213a2);间皮素;白细胞介素11受体α(il-11ra);前列腺干细胞抗原(psca);蛋白酶丝氨酸21(睾蛋白或prss21);血管内皮生长因子受体2(vegfr2);lewis(y)抗原;cd24;血小板衍生的生长因子受体β(pdgfr-β);阶段特异性胚胎抗原-4(ssea-4);cd20;叶酸受体α;受体酪氨酸蛋白激酶erbb2(her2/neu);黏蛋白1,细胞表面相关的(muc1);表皮生长因子受体(egfr);神经细胞粘附分子(ncam);前列腺酶;前列腺酸性磷酸酶(pap);突变的延伸因子2(elf2m);肝配蛋白b2;成纤维细胞活化蛋白α(fap);胰岛素样生长因子1受体(igf-i受体),碳酸酐酶ix(caix);蛋白酶体(prosome,macropain)亚基,β型,9(lmp2);糖蛋白100(gp100);由断裂点簇集区(bcr)和abelson鼠白血病病毒致癌基因同源物1(abl)组成的致癌基因融合蛋白(bcr-abl);酪氨酸酶;肝配蛋白a型受体2(epha2);岩藻糖基gm1;唾液酸lewis粘附分子(sle);神经节苷脂gm3(aneu5ac(2-3)bdgalp(1-4)bdglcp(1-1)cer);转谷氨酰胺酶5(tgs5);高分子量-黑素瘤相关抗原(hmwmaa);o-乙酰基-gd2神经节苷脂(oacgd2);叶酸受体β;肿瘤内皮标记1(tem1/cd248);肿瘤内皮标记7相关的(tem7r);密封蛋白6(cldn6);促甲状腺激素受体(tshr);g蛋白偶联受体c类5组,成员d(gprc5d);染色体x开放阅读框61(cxorf61);cd97;cd179a;间变性淋巴瘤激酶(alk);聚唾液酸;胎盘特异性1(plac1);globoh糖基神经酰胺(globoh)的六糖部分;乳腺分化抗原(ny-br-1);尿溶蛋白2(upk2);甲型肝炎病毒细胞受体1(havcr1);肾上腺素受体β3(adrb3);泛连接蛋白3(panx3);g蛋白偶联受体20(gpr20);淋巴细胞抗原6复合物,基因座k9(ly6k);嗅觉受体51e2(or51e2);tcrγ替代性阅读框蛋白(tarp);肾母细胞瘤蛋白(wt1);癌/睾丸抗原1(ny-eso-1);癌/睾丸抗原2(lage-1a);黑色素瘤相关抗原1(mage-a1);ets易位变异基因6,位于染色体12p上(etv6-aml);精子蛋白17(spa17);x抗原家族,成员1a(xage1);血管生成素结合细胞表面受体2(tie2);黑素瘤癌睾丸抗原-1(mad-ct-1);黑素瘤癌睾丸抗原-2(mad-ct-2);fos相关的抗原1;肿瘤蛋白p53(p53);p53突变体;前列腺特异性蛋白(prostein);存活蛋白(surviving);端粒酶;前列腺癌肿瘤抗原-1(pcta-1或半乳糖蛋白8)、t细胞1识别的黑色素瘤抗原(melana或mart1);大鼠肉瘤(ras)突变体;人端粒酶逆转录酶(htert);肉瘤易位断点;黑素瘤细胞凋亡抑制剂(ml-iap);erg(跨膜蛋白酶、丝氨酸2(tmprss2)ets融合基因);n-乙酰葡糖胺基转移酶v(na17);配对盒蛋白pax-3(pax3);雄激素受体;细胞周期蛋白b1;v-myc禽类骨髓细胞瘤病毒致癌基因神经母细胞瘤来源同源物(mycn);ras同源物家族成员c(rhoc);酪氨酸酶相关蛋白2(trp-2);细胞色素p4501b1(cyp1b1);ccctc-结合因子(锌指蛋白)样(boris或印记位点调节因子样蛋白(brotheroftheregulatorofimprintedsites)),t细胞3识别的鳞状细胞癌抗原(sart3);配对盒蛋白pax-5(pax5);前顶体蛋白结合蛋白sp32(oy-tes1);淋巴细胞特异性蛋白酪氨酸激酶(lck);激酶锚蛋白4(akap-4);滑膜肉瘤,x断点2(ssx2);晚期糖基化终产物受体(rage-1);肾遍在蛋白1(ru1);肾遍在蛋白2(ru2);legumain;人乳头状瘤病毒e6(hpve6);人乳头状瘤病毒e7(hpve7);肠羧酸酯酶;突变的热休克蛋白70-2(muthsp70-2);cd79a;cd79b;cd72;白细胞相关的免疫球蛋白样受体1(lair1);iga受体的fc片段(fcar或cd89);白细胞免疫球蛋白样受体亚家族a成员2(lilra2);cd300分子样家族成员f(cd300lf);c型凝集素结构域家族12成员a(clec12a);骨髓基质细胞抗原2(bst2);含egf样模块的粘蛋白样激素受体样2(emr2);淋巴细胞抗原75(ly75);磷脂酰肌醇蛋白聚糖-3(gpc3);fc受体样5(fcrl5);以及免疫球蛋白λ样多肽1(igll1)。在一些实施例中,编码的分子结合的肿瘤抗原选自以下中的一个或多个:tshr、cd171、cs-1、cll-1、gd3、tnag、flt3、cd38、cd44v6、b7h3、kit、il-13ra2、il-11ra、psca、prss21、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、muc1、egfr、ncam、caix、lmp2、epha2、岩藻糖基gm1、sle、gm3、tgs5、hmwmaa、o-乙酰基-gd2、叶酸受体β、tem1/cd248、tem7r、cldn6、gprc5d、cxorf61、cd97、cd179a、alk、聚唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、or51e2、tarp、wt1、etv6-aml、精子蛋白17、xage1、tie2、mad-ct-1、mad-ct-2、fos相关抗原1、p53突变体、htert、肉瘤易位断点、ml-iap、erg(tmprss2ets融合基因)、na17、pax3、雄性激素受体、细胞周期蛋白b1、mycn、rhoc、cyp1b1、boris、sart3、pax5、oy-tes1、lck、akap-4、ssx2、cd79a、cd79b、cd72、lair1、fcar、lilra2、cd300lf、clec12a、bst2、emr2、ly75、gpc3、fcrl5、和igll1。在某些实施例中,编码的car分子结合的肿瘤抗原选自以下中的一个或多个:tshr、cldn6、gprc5d、cxorf61、cd97、cd179a、alk、聚唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、和or51e2。在某些实施例中,抗原结合结构域中的一个或多个结合b细胞抗原,示例性b细胞抗原:cd5、cd10、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd27、cd30、cd34、cd37、cd38、cd40、cd53、cd69、cd72、cd73、cd74、cd75、cd77、cd79a、cd79b、cd80、cd81、cd82、cd83、cd84、cd85、cd86、cd123、cd135、cd138、cd179、cd269、flt3、ror1、bcma、fcrn5、fcrn2、cs-1、cxcr4、cxcr5、cxcr7、il-7/3r、il7/4/3r、和il4r。特别优选的b细胞抗原包括:cd19、cd20、cd22、fcrn5、fcrn2、bcma、cs-1和cd138。在实施例中,b细胞抗原是cd19。在实施例中,b细胞抗原是cd20。在实施例中,b细胞抗原是cd22。在实施例中,b细胞抗原是bcma。在实施例中,b细胞抗原是fcrn5。在实施例中,b细胞抗原是fcrn2。在实施例中,b细胞抗原是cs-1。在实施例中,b细胞抗原是cd138。在一些实施例中,编码的分子的抗原结合结构域包含抗体、抗体片段、scfv、fv、fab、(fab’)2、单结构域抗体(sdab)、vh或vl结构域、或骆驼科动物vhh结构域。在一些实施例中,编码的分子的跨膜结构域包含选自以下的跨膜结构域的跨膜结构域:t细胞受体的α、β或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154、kirds2、ox40、cd2、cd27、lfa-1(cd11a、cd18)、icos(cd278)、4-1bb(cd137)、gitr、cd40、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、il2rβ、il2rγ、il7rα、itga1、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、pag/cbp、nkp44、nkp30、nkp46、nkg2d、和/或nkg2c、或其功能变体。在其他实施例中,核酸分子编码细胞内信号传导结构域,所述信号传导结构域包含编码初级信号传导结构域的序列和/或编码共刺激信号传导结构域的序列。在一些实施例中,细胞内信号传导结构域包含编码初级信号传导结构域的序列。在一些实施例中,细胞内信号传导结构域包含编码共刺激信号传导结构域的序列。在一些实施例中,细胞内信号传导结构域包含编码初级信号传导结构域的序列和编码共刺激信号传导结构域的序列。在某些实施例中,编码的初级信号传导结构域包含选自由以下组成的组的蛋白的功能性信号传导结构域:cd3ζ、cd3γ、cd3δ、cd3ε、常见fcrγ(fcer1g)、fcrβ(fcεr1b)、cd79a、cd79b、fcγriia、dap10、和dap12。在一个实施例中,编码的初级信号传导结构域包含cd3ζ的功能性信号传导结构域。在某些优选实施例中,编码的细胞内信号传导结构域包含编码共刺激信号传导结构域的序列。例如,细胞内信号传导结构域可以包含编码初级信号传导结构域的序列和编码共刺激信号传导结构域的序列。在一些实施例中,编码的共刺激信号传导结构域包含选自以下中的一种或多种的蛋白质的功能性信号传导结构域:cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、与cd83特异性地结合的配体、cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46、或nkg2d、或其功能变体。在一些实施例中,核酸分子进一步包含前导序列。在某些实施例中,编码的抗原结合结构域具有10-4m至10-8m的结合亲和力kd。在一个实施例中,编码的抗原结合结构域是本文描述的抗原结合结构域,例如用于以上提供的靶标的本文描述的抗原结合结构域。在一个实施例中,编码的分子包含抗原结合结构域,所述抗原结合结构域对于靶抗原具有10-4m至10-8m,例如10-5m至10-7m,例如10-6m或10-7m的结合亲和力kd。在一个实施例中,该抗原结合结构域的结合亲和力比参考抗体(例如本文描述的抗体)的结合亲和力低至少5倍、10倍、20倍、30倍、50倍、100倍或1,000倍。在一个实施例中,编码的抗原结合结构域的结合亲和力比参考抗体(例如,该抗原结合结构域所来源的抗体)的结合亲和力低至少5倍。在另一个方面,本文提供了一种系统,所述系统包括:第一嵌合膜蛋白,所述第一嵌合膜蛋白包含细胞外结构域、跨膜结构域、和细胞内结构域,所述细胞外结构域包含第一抗原结合结构域和源自cd3γ、δ、或ε的细胞外结构域的第一细胞外结构域,所述细胞内结构域包含源自除了cd3γ、δ、或ε之外的蛋白的第一细胞内共刺激结构域;以及第二嵌合膜蛋白,所述第二嵌合膜蛋白包含细胞外结构域、跨膜结构域、和任选的细胞内结构域,所述细胞外结构域包含第二抗原结合结构域和源自cd3γ、δ、或ε的细胞外结构域的第二细胞外结构域,所述细胞内结构域包含源自除了cd3γ、δ、或ε之外的蛋白的第二细胞内共刺激结构域;其中所述第一抗原结合结构域和所述第二抗原结合结构域不相同,并且其中所述源自cd3γ、δ、或ε的细胞外结构域的第一细胞外结构域和所述源自cd3γ、δ、或ε的细胞外结构域的第二细胞外结构域不相同。在一个实施例中,第一细胞外结构域包含cd3γ、δ、或ε的细胞外结构域、或其功能变体,任选地,其中第一细胞外结构域包含seqidno:88、83、或78的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一细胞外结构域包含seqidno:88的氨基酸序列。在一个实施例中,第一细胞外结构域包含seqidno:83的氨基酸序列。在一个实施例中,第一细胞外结构域包含seqidno:78的氨基酸序列。在一个实施例中,第二细胞外结构域包含cd3γ、δ、或ε的细胞外结构域、或其功能变体,任选地,其中第二细胞外结构域包含seqidno:88、83、或78的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第二细胞外结构域包含seqidno:88的氨基酸序列。在一个实施例中,第二细胞外结构域包含seqidno:83的氨基酸序列。在一个实施例中,第二细胞外结构域包含seqidno:78的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含cd3γ的细胞外结构域、或其功能变体,并且第二嵌合膜蛋白包含cd3δ的细胞外结构域、或其功能变体。在一个实施例中,第一嵌合膜蛋白包含seqidno:88的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列),并且第二嵌合膜蛋白包含seqidno:83的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一嵌合膜蛋白包含seqidno:88的氨基酸序列,并且第二嵌合膜蛋白包含seqidno:83的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含cd3γ的细胞外结构域、或其功能变体,并且第二嵌合膜蛋白包含cd3ε的细胞外结构域、或其功能变体。在一个实施例中,第一嵌合膜蛋白包含seqidno:88的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列),并且第二嵌合膜蛋白包含seqidno:78的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一嵌合膜蛋白包含seqidno:88的氨基酸序列,并且第二嵌合膜蛋白包含seqidno:78的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含cd3δ的细胞外结构域、或其功能变体,并且第二嵌合膜蛋白包含cd3γ的细胞外结构域、或其功能变体。在一个实施例中,第一嵌合膜蛋白包含seqidno:83的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列),并且第二嵌合膜蛋白包含seqidno:88的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一嵌合膜蛋白包含seqidno:83的氨基酸序列,并且第二嵌合膜蛋白包含seqidno:88的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含cd3δ的细胞外结构域、或其功能变体,并且第二嵌合膜蛋白包含cd3ε的细胞外结构域、或其功能变体。在一个实施例中,第一嵌合膜蛋白包含seqidno:83的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列),并且第二嵌合膜蛋白包含seqidno:78的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一嵌合膜蛋白包含seqidno:83的氨基酸序列,并且第二嵌合膜蛋白包含seqidno:78的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含cd3ε的细胞外结构域、或其功能变体,并且第二嵌合膜蛋白包含cd3γ的细胞外结构域、或其功能变体。在一个实施例中,第一嵌合膜蛋白包含seqidno:78的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列),并且第二嵌合膜蛋白包含seqidno:88的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一嵌合膜蛋白包含seqidno:78的氨基酸序列,并且第二嵌合膜蛋白包含seqidno:88的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含cd3ε的细胞外结构域、或其功能变体,并且第二嵌合膜蛋白包含cd3δ的细胞外结构域、或其功能变体。在一个实施例中,第一嵌合膜蛋白包含seqidno:78的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列),并且第二嵌合膜蛋白包含seqidno:83的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一嵌合膜蛋白包含seqidno:78的氨基酸序列,并且第二嵌合膜蛋白包含seqidno:83的氨基酸序列。在一个实施例中,第一嵌合膜蛋白的跨膜结构域包含cd3γ、δ、或ε的跨膜结构域、或其功能变体。在一个实施例中,第一嵌合膜蛋白的跨膜结构域包含seqidno:89、84、或79的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一嵌合膜蛋白的跨膜结构域不包含cd3γ、δ、或ε的跨膜结构域。在一个实施例中,第二嵌合膜蛋白的跨膜结构域包含cd3γ、δ、或ε的跨膜结构域、或其功能变体。在一个实施例中,第二嵌合膜蛋白的跨膜结构域包含seqidno:89、84、或79的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第二嵌合膜蛋白的跨膜结构域不包含cd3γ、δ、或ε的跨膜结构域。在一个实施例中,第一嵌合膜蛋白包含cd3γ、δ、或ε蛋白、或其功能变体。在一个实施例中,第一嵌合膜蛋白包含seqidno:90、85、或80的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一嵌合膜蛋白包含seqidno:90的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含seqidno:85的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含seqidno:80的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含seqidno:87、82、或77的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一嵌合膜蛋白包含seqidno:87的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含seqidno:82的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含seqidno:77的氨基酸序列。在一个实施例中,第二嵌合膜蛋白包含cd3γ、δ、或ε蛋白、或其功能变体。在一个实施例中,第二嵌合膜蛋白包含seqidno:90、85、或80的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第二嵌合膜蛋白包含seqidno:90的氨基酸序列。在一个实施例中,第二嵌合膜蛋白包含seqidno:85的氨基酸序列。在一个实施例中,第二嵌合膜蛋白包含seqidno:80的氨基酸序列。在一个实施例中,第二嵌合膜蛋白包含cd3γ、δ、或ε蛋白、或其功能变体,任选地,其中第二嵌合膜蛋白包含seqidno:87、82、或77的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第二嵌合膜蛋白包含seqidno:87的氨基酸序列。在一个实施例中,第二嵌合膜蛋白包含seqidno:82的氨基酸序列。在一个实施例中,第二嵌合膜蛋白包含seqidno:77的氨基酸序列。在一个实施例中,第一嵌合膜蛋白不包含源自cd3γ、δ、或ε蛋白的任何细胞内结构域。在一个实施例中,第二嵌合膜蛋白不包含源自cd3γ、δ、或ε蛋白的任何细胞内结构域。在一个实施例中,第一抗原结合结构域位于所述源自cd3γ、δ、或ε的细胞外结构域的第一细胞外结构域的n-末端。在一个实施例中,第二抗原结合结构域位于所述源自cd3γ、δ、或ε的细胞外结构域的第二细胞外结构域的n-末端。在一个实施例中,第一嵌合膜蛋白、第二嵌合膜蛋白、或第一和第二嵌合膜蛋白两者包含位于所述第一和/或第二抗原结合结构域的n-末端的第三抗原结合结构域。在一个实施例中,第一抗原结合结构域和所述源自cd3γ、δ、或ε的细胞外结构域的第一细胞外结构域由第一接头连接,和/或第二抗原结合结构域和所述源自cd3γ、δ、或ε的细胞外结构域的第二细胞外结构域由第二接头连接。在一个实施例中,第一接头和/或第二接头包括,例如由以下组成:(ggggs)n,例如其中n是从0至10的整数,例如其中n=1、2、或4。在一个实施例中,n=1。在一个实施例中,n=2。在一个实施例中,n=4。在一个实施例中,所述第二嵌合膜蛋白包含源自除了cd3γ、δ、或ε之外的蛋白的第二细胞内共刺激结构域。在一个实施例中,所述第二嵌合膜蛋白不包含源自除了cd3γ、δ、或ε之外的蛋白的第二细胞内共刺激结构域。在一个实施例中,系统不包括第二细胞内共刺激结构域。在一个实施例中,系统包括第一细胞内共刺激结构域和第二细胞内共刺激结构域两者。在一个实施例中,第一嵌合膜蛋白包含位于第一细胞内共刺激结构域的c-末端的源自除了cd3γ、δ、或ε之外的蛋白的第三细胞内共刺激结构域。在一个实施例中,包括在上述实施例中,所述细胞内共刺激结构域(例如如果存在,第一细胞内共刺激结构域和/或第二细胞内共刺激结构域,和/或如果存在,第三细胞内共刺激结构域)中的一个或多个是选自由以下组成的组的蛋白的功能性信号传导结构域:mhci类分子、tnf受体蛋白、免疫球蛋白样蛋白、细胞因子受体、整联蛋白、信号传导淋巴细胞活化分子(slam蛋白)、激活性nk细胞受体、btla、toll配体受体、ox40、cd2、cd7、cd27、cd28、cd30、cd40、cds、icam-1、4-1bb(cd137)、b7-h3、icos(cd278)、gitr、baffr、light、hvem(lightr)、kirds2、slamf7、nkp80(klrf1)、nkp44、nkp30、nkp46、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、itgb7、nkg2d、nkg2c、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、cd19a和与cd83特异性结合的配体,或其功能变体。在一个实施例中,所述细胞内共刺激结构域(例如如果存在,第一细胞内共刺激结构域和/或第二细胞内共刺激结构域,和/或如果存在,第三细胞内共刺激结构域)中的一个或多个是4-1bb的功能性信号传导结构域、或其功能变体,任选地,其中所述细胞内共刺激结构域(例如如果存在,第一细胞内共刺激结构域和/或第二细胞内共刺激结构域,和/或如果存在,第三细胞内共刺激结构域)中的一个或多个包含seqidno:50的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,所述细胞内共刺激结构域(例如如果存在,第一细胞内共刺激结构域和/或第二细胞内共刺激结构域,和/或如果存在,第三细胞内共刺激结构域)中的一个或多个包含seqidno:50的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含seqidno:91、86、或81的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一嵌合膜蛋白包含seqidno:91的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含seqidno:86的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含seqidno:81的氨基酸序列。在一个实施例中,第二嵌合膜蛋白包含seqidno:91、86、或81的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一嵌合膜蛋白包含seqidno:91的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含seqidno:86的氨基酸序列。在一个实施例中,第一嵌合膜蛋白包含seqidno:81的氨基酸序列。在一些实施例中,第一抗原结合结构域结合肿瘤抗原。在一些实施例中,第一抗原结合结构域结合b细胞抗原。在一个实施例中,第一抗原结合结构域结合的b细胞抗原是cd5、cd10、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd27、cd30、cd34、cd37、cd38、cd40、cd53、cd69、cd72、cd73、cd74、cd75、cd77、cd79a、cd79b、cd80、cd81、cd82、cd83、cd84、cd85、cd86、cd123、cd135、cd138、cd179、cd269、flt3、ror1、bcma、fcrn5、fcrn2、cs-1、cxcr4、cxcr5、cxcr7、il-7/3r、il7/4/3r、或il4r。在一个实施例中,第一抗原结合结构域结合的b细胞抗原是cd19、cd20、cd22、fcrn5、fcrn2、bcma、cs-1、或cd138。在一些实施例中,第二抗原结合结构域结合肿瘤抗原。在一些实施例中,第二抗原结合结构域结合b细胞抗原。在一个实施例中,第二抗原结合结构域结合与第一抗原结合结构域结合的b细胞抗原不同的b细胞抗原。在一个实施例中,第二抗原结合结构域结合的b细胞抗原是cd5、cd10、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd27、cd30、cd34、cd37、cd38、cd40、cd53、cd69、cd72、cd73、cd74、cd75、cd77、cd79a、cd79b、cd80、cd81、cd82、cd83、cd84、cd85、cd86、cd123、cd135、cd138、cd179、cd269、flt3、ror1、bcma、fcrn5、fcrn2、cs-1、cxcr4、cxcr5、cxcr7、il-7/3r、il7/4/3r、或il4r。在一个实施例中,第二抗原结合结构域结合的b细胞抗原是cd19、cd20、cd22、fcrn5、fcrn2、bcma、cs-1、或cd138。在一个实施例中,第一抗原结合结构域结合cd19并且第二抗原结合结构域结合cd20。在一个实施例中,第一抗原结合结构域结合cd19并且第二抗原结合结构域结合cd22。在一个实施例中,第一抗原结合结构域结合cd20并且第二抗原结合结构域结合cd22。在一个实施例中,第一抗原结合结构域结合cd20并且第二抗原结合结构域结合cd19。在一个实施例中,第一抗原结合结构域结合cd22并且第二抗原结合结构域结合cd19。在一个实施例中,第一抗原结合结构域结合cd22并且第二抗原结合结构域结合cd20。在一个实施例中,第一抗原结合结构域结合cd19并且第二抗原结合结构域结合cd22,任选地,其中:(i)第一嵌合膜蛋白包含seqidno:70的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列),并且第二嵌合膜蛋白包含seqidno:75或76的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列);(ii)第一嵌合膜蛋白包含seqidno:71的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列),并且第二嵌合膜蛋白包含seqidno:73、74、75或76的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列);或(iii)第一嵌合膜蛋白包含seqidno:72的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列),并且第二嵌合膜蛋白包含seqidno:73或74的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。在一个实施例中,第一或第二抗原结合结构域结合实体瘤抗原。在一个实施例中,实体瘤抗原是egfrviii、间皮素、gd2、tn抗原、stn抗原、tn-o-糖肽、stn-o-糖肽、psma、cd97、tag72、cd44v6、cea、epcam、kit、il-13ra2、leguman、gd3、cd171、il-11ra、psca、mad-ct-1、mad-ct-2、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、叶酸受体α、erbb(例如erbb2)、her2/neu、muc1、egfr、ncam、肝配蛋白b2、caix、lmp2、sle、hmwmaa、o-乙酰基-gd2、叶酸受体β、tem1/cd248、tem7r、fap、legumain、hpve6或e7、ml-iap、cldn6、tshr、gprc5d、alk、多唾液酸、fos相关抗原、嗜中性粒细胞弹性蛋白酶、trp-2、cyp1b1、精子蛋白17、β人绒毛膜促性腺激素、afp、甲状腺球蛋白、plac1、globoh、rage1、mn-caix、人端粒酶逆转录酶、肠羧基酯酶、muthsp70-2、na-17、ny-br-1、upk2、havcr1、adrb3、panx3、ny-eso-1、gpr20、ly6k、or51e2、tarp、gfrα4或mhc上呈递的这些抗原的任一个的肽。在一个实施例中,所述实体瘤抗原选自由以下组成的组:cldn6、间皮素和egfrviii。在一个实施例中,第一抗原结合结构域结合cd19并且第二抗原结合结构域结合间皮素。在一个实施例中,第一抗原结合结构域结合cd19并且第二抗原结合结构域结合egfrviii。在一个实施例中,第一抗原结合结构域结合cd19并且第二抗原结合结构域结合cldn6。在一个实施例中,第一抗原结合结构域结合间皮素并且第二抗原结合结构域结合cd19。在一个实施例中,第一抗原结合结构域结合egfrviii并且第二抗原结合结构域结合cd19。在一个实施例中,第一抗原结合结构域结合cldn6并且第二抗原结合结构域结合cd19。在一个方面,本发明提供了编码上述方面和实施例中任一项所述的系统的核酸构建体。在实施例中,核酸构建体是rna,例如mrna。在其他实施例中,核酸构建体是dna。在一个实施例中,核酸构建体包含编码第一嵌合膜蛋白的第一核酸分子和编码第二嵌合膜蛋白的第二核酸分子。在一个实施例中,第一和第二核酸分子布置在单个核酸分子上。在一个实施例中,第一和第二核酸分子布置在分开的核酸分子上。在一个方面,本发明提供了包含先前方面所述的核酸构建体的载体。在实施例中,所述载体是慢病毒载体、腺病毒载体、或逆转录病毒载体。在实施例中,当所述第一和第二嵌合膜蛋白表达时,所述蛋白被表达为单mrna转录物,例如,其中编码所述第一和第二嵌合膜蛋白的核酸序列由编码自切割位点或内部核糖体进入位点的核酸分开。在一个方面,本发明提供了细胞,包含上述核酸构建体方面和实施例方面中任一项所述的核酸构建体、上述载体方面和实施例中任一项所述的载体、或上述方面和实施例中任一项所述的系统。在实施例中,细胞是t细胞或nk细胞。在一个实施例中,细胞进一步包含第一抑制剂,其中:(i)所述第一嵌合膜蛋白包含源自cd3γ的细胞外结构域的第一细胞外结构域,并且所述第一抑制剂减少细胞中内源cd3γ的表达;(ii)所述第一嵌合膜蛋白包含源自cd3δ的细胞外结构域的第一细胞外结构域,并且所述第一抑制剂减少细胞中内源cd3δ的表达;或(iii)所述第一嵌合膜蛋白包含源自cd3ε的细胞外结构域的第一细胞外结构域,并且所述第一抑制剂减少细胞中内源cd3ε的表达。在一个实施例中,第一抑制剂并不减少或基本上不减少细胞中第一嵌合膜蛋白的表达(例如,与不存在第一抑制剂的第一嵌合膜蛋白的表达相比,第一抑制剂以不多于2%、5%、10%、15%、或20%的水平减少第一嵌合膜蛋白的表达)。在一个实施例中,细胞进一步包含第二抑制剂,其中:(i)所述第二嵌合膜蛋白包含源自cd3γ的细胞外结构域的第二细胞外结构域,并且所述第二抑制剂减少细胞中内源cd3γ的表达;(ii)所述第二嵌合膜蛋白包含源自cd3δ的细胞外结构域的第二细胞外结构域,并且所述第二抑制剂减少细胞中内源cd3δ的表达;或(iii)所述第二嵌合膜蛋白包含源自cd3ε的细胞外结构域的第二细胞外结构域,并且所述第二抑制剂减少细胞中内源cd3ε的表达。在一个实施例中,第二抑制剂并不减少或基本上不减少细胞中第二嵌合膜蛋白的表达(例如,与不存在第二抑制剂的第二嵌合膜蛋白的表达相比,第二抑制剂以不多于2%、5%、10%、15%、或20%的水平减少第二嵌合膜蛋白的表达)。在一个实施例中,第一或第二抑制剂是介导rna干扰的试剂,例如sirna或shrna、或编码sirna或shrna的核酸分子。在一个实施例中,第一或第二抑制剂是基因编辑系统(例如crispr/cas9系统、锌指核酸酶系统、talen系统、或大范围核酸酶系统)或编码基因编辑系统的一种或多种组分的核酸。在一个方面,本发明提供了治疗患有增殖性障碍的受试者的方法,所述方法包括向受试者施用上述细胞方面和实施例中任一项所述的细胞。在实施例中,所述受试者患有肿瘤并且所述施用向所述受试者提供了针对所述肿瘤的免疫。在一个方面,本发明提供了在患有癌症的受试者中提供抗癌免疫应答的方法,所述方法包括向受试者施用上述细胞方面和实施例中任一项所述的细胞。在一个实施例中,所述细胞是t细胞或nk细胞并且是所述受试者自体的。在其他实施例中,所述细胞是同种异体t细胞或nk细胞。在实施例中,所述受试者是人类。在一个实施例中,受试者患有癌症。在一个实施例中,癌症选自间皮瘤(例如恶性胸膜间皮瘤),例如在对至少一种先前标准疗法已经进展的受试者中;肺癌(例如非小细胞肺癌、小细胞肺癌、鳞状细胞肺癌、或大细胞肺癌);胰腺癌(例如胰腺导管腺癌、或转移性胰腺导管腺癌(pda),例如在对至少一种先前标准疗法已经发生胰腺癌进展的受试者中);食道腺癌、卵巢癌(例如浆液性上皮性卵巢癌,例如在至少一种先前标准治疗方案后已经发生卵巢癌进展的受试者中)、乳腺癌、结肠直肠癌、膀胱癌或其任何组合。在一个实施例中,癌症选自慢性淋巴细胞白血病(cll)、套细胞淋巴瘤(mcl)、多发性骨髓瘤、急性淋巴细胞白血病(all)、霍奇金淋巴瘤、b细胞急性淋巴细胞白血病(ball)、t细胞急性淋巴细胞白血病(tall)、小淋巴细胞白血病(sll)、b细胞幼淋巴细胞白血病、母细胞性浆细胞样树突状细胞肿瘤(blasticplasmacytoiddendriticcellneoplasm)、伯基特淋巴瘤、弥漫性大b细胞淋巴瘤(dlbcl)、与慢性炎症相关的dlbcl、慢性骨髓性白血病、骨髓增生性肿瘤、滤泡性淋巴瘤、小儿滤泡性淋巴瘤、毛细胞白血病、小细胞或大细胞滤泡性淋巴瘤、恶性淋巴组织增生性病症、malt淋巴瘤(黏膜相关淋巴组织的结外边缘区淋巴瘤)、边缘区淋巴瘤、骨髓增生异常、骨髓增生异常综合征、非霍奇金淋巴瘤、浆母细胞性淋巴瘤、浆细胞样树突状细胞肿瘤、华氏(waldenstrom)巨球蛋白血症、脾脏边缘区淋巴瘤、脾淋巴瘤/白血病、脾弥漫性红髓小b细胞淋巴瘤、毛细胞白血病变异、淋巴浆细胞性淋巴瘤、重链疾病、浆细胞性骨髓瘤、骨单发性浆细胞瘤、骨外浆细胞瘤、淋巴结边缘区淋巴瘤、小儿淋巴结边缘区淋巴瘤、原发性皮肤滤泡中心淋巴瘤、淋巴瘤样肉芽肿病、原发性纵隔(胸腺)大b细胞淋巴瘤、血管内大b细胞淋巴瘤、alk+大b细胞淋巴瘤、hhv8相关多中心卡斯尔曼(castleman)病中出现的大b细胞淋巴瘤、原发性渗出性淋巴瘤、b细胞淋巴瘤、急性骨髓性白血病(aml)、或无法分类的淋巴瘤。在一个实施例中,第一抗原结合结构域结合第一抗原(例如第一肿瘤抗原)并且第二抗原结合结构域结合第二抗原(例如第二肿瘤抗原),其中癌症表现出第一抗原(例如第一肿瘤抗原)和/或第二抗原(例如第二中瘤抗原)的异源表达,例如,其中癌症中少于90%、80%、70%、60%、或50%的细胞表达第一抗原(第一肿瘤抗原)并且癌症中少于90%、80%、70%、60%、或50%的细胞表达第二抗原(例如第二肿瘤抗原)。在一个方面,本发明提供了制备细胞的方法,所述方法包括将上述载体方面和实施例中所述的载体引入细胞。在一个实施例中,所述方法包括用上述载体方面和实施例中所述的载体转导细胞。在一个实施例中,所述方法进一步包括将第一抑制剂引入细胞,其中:(i)所述第一嵌合膜蛋白包含源自cd3γ的细胞外结构域的第一细胞外结构域,并且所述第一抑制剂减少细胞中内源cd3γ的表达;(ii)所述第一嵌合膜蛋白包含源自cd3δ的细胞外结构域的第一细胞外结构域,并且所述第一抑制剂减少细胞中内源cd3δ的表达;或(iii)所述第一嵌合膜蛋白包含源自cd3ε的细胞外结构域的第一细胞外结构域,并且所述第一抑制剂减少细胞中内源cd3ε的表达。在一个实施例中,第一抑制剂并不减少或基本上不减少细胞中第一嵌合膜蛋白的表达(例如,与不存在第一抑制剂的第一嵌合膜蛋白的表达相比,第一抑制剂以不多于2%、5%、10%、15%、或20%的水平减少第一嵌合膜蛋白的表达)。在一个实施例中,所述方法进一步包括将第二抑制剂引入细胞,其中:(i)所述第二嵌合膜蛋白包含源自cd3γ的细胞外结构域的第二细胞外结构域,并且所述第二抑制剂减少细胞中内源cd3γ的表达;(ii)所述第二嵌合膜蛋白包含源自cd3δ的细胞外结构域的第二细胞外结构域,并且所述第二抑制剂减少细胞中内源cd3δ的表达;或(iii)所述第二嵌合膜蛋白包含源自cd3ε的细胞外结构域的第二细胞外结构域,并且所述第二抑制剂减少细胞中内源cd3ε的表达。在一个实施例中,第二抑制剂并不减少或基本上不减少细胞中第二嵌合膜蛋白的表达(例如,与不存在第二抑制剂的第二嵌合膜蛋白的表达相比,第二抑制剂以不多于2%、5%、10%、15%、或20%的水平减少第二嵌合膜蛋白的表达)。在一个实施例中,第一或第二抑制剂是介导rna干扰的试剂,例如sirna或shrna、或编码sirna或shrna的核酸分子。在一个实施例中,第一或第二抑制剂是基因编辑系统(例如crispr/cas9系统、锌指核酸酶系统、talen系统、或大范围核酸酶系统)或编码基因编辑系统的一种或多种组分的核酸。在一个实施例中,细胞是免疫效应细胞,例如t细胞或nk细胞。载体在另一个方面,本发明涉及包含编码本文描述的嵌合多肽的核酸序列的载体。在一个实施例中,载体选自dna载体、rna载体、质粒、慢病毒载体、腺病毒载体或逆转录病毒载体。在一个实施例中,载体是慢病毒载体。在一个实施例中,载体包含编码嵌合蛋白(例如,如本文描述的)的核酸序列,和编码包含以下的抑制性分子的核酸序列:inhkir胞质结构域;跨膜结构域,例如kir跨膜结构域;和抑制剂胞质结构域,例如itim结构域,例如inhkiritim结构域。在一个实施例中,抑制性分子是天然存在的inhkir,或与天然存在的inhkir共有至少50%、60%、70%、80%、85%、90%、95%或99%同源性或相差不超过1、2、3、4、5、6、7、8、9、10、15或20个残基的序列。在一个实施例中,编码抑制性分子的核酸序列包含:slam家族胞质结构域;跨膜结构域,例如slam家族跨膜结构域;和抑制剂胞质结构域,例如slam家族结构域,例如slam家族itim结构域。在一个实施例中,抑制性分子是天然存在的slam家族成员,或与天然存在的slam家族成员共有至少50%、60%、70%、80%、85%、90%、95%或99%同源性或相差不超过1、2、3、4、5、6、7、8、9、10、15或20个残基的序列。在一个实施例中,载体进一步包含启动子。在一些实施例中,该启动子选自ef-1启动子、cmvie基因启动子、ef-1α启动子、泛素c启动子或磷酸甘油酸激酶(pgk)启动子。在一个实施例中,启动子是ef-1启动子。在一个实施例中,载体是体外转录的载体,例如转录本文描述的核酸分子的rna的载体。在一个实施例中,载体中的核酸序列进一步包含聚(a)尾,例如本文描述的聚a尾,例如包含约150个腺苷碱基。在一个实施例中,载体中的核酸序列进一步包含3'utr,例如本文描述的3'utr,例如包含源自人β-球蛋白的3'utr的至少一个重复。在一个实施例中,载体中的核酸序列进一步包含启动子,例如t2a启动子。多肽在另一个方面,本发明的特征在于一种或多种分离的多肽分子,这些分离的多肽分子包含抗原结合结构域、跨膜结构域、细胞内信号传导结构域中的一个或多个,其中所述抗原结合结构域结合选自以下中的一个或多个的肿瘤抗原:cd19、cd123、cd22、cd30、cd171、cs-1、cll-1(clecl1)、cd33、egfrviii、gd2、gd3、bcma、tnag、psma、ror1、flt3、tag72、cd38、cd44v6、cea、epcam、b7h3、kit、il-13ra2、间皮素、il-11ra、psca、prss21、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、cd20、叶酸受体α、erbb2(her2/neu)、muc1、egfr、ncam、前列腺酶、pap、elf2m、肝配蛋白b2、fap、igf-i受体、caix、lmp2、gp100、bcr-abl、酪氨酸酶、epha2、岩藻糖基gm1、sle、gm3、tgs5、hmwmaa、o-乙酰基-gd2、叶酸受体β、tem1/cd248、tem7r、cldn6、tshr、gprc5d、cxorf61、cd97、cd179a、alk、聚唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、or51e2、tarp、wt1、ny-eso-1、lage-1a、mage-a1、magea1、etv6-aml、精子蛋白17、xage1、tie2、mad-ct-1、mad-ct-2、fos相关抗原1、p53、p53突变体、前列腺特异性蛋白、存活素和端粒酶、pcta-1/半乳凝素8、melana/mart1、ras突变体、htert、肉瘤易位断点、ml-iap、erg(tmprss2ets融合基因)、na17、pax3、雄性激素受体、细胞周期蛋白b1、mycn、rhoc、trp-2、cyp1b1、boris、sart3、pax5、oy-tes1、lck、akap-4、ssx2、rage-1、人端粒酶逆转录酶、ru1、ru2、legumain、hpve6、e7、肠道羧基酯酶、muthsp70-2、cd79a、cd79b、cd72、lair1、fcar、lilra2、cd300lf、clec12a、bst2、emr2、ly75、gpc3、fcrl5、以及igll1。在一些实施例中,多肽分子的抗原结合结构域结合选自以下中的一个或多个的肿瘤抗原:tshr、cd171、cs-1、cll-1、gd3、tnag、flt3、cd38、cd44v6、b7h3、kit、il-13ra2、il-11ra、psca、prss21、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、muc1、egfr、ncam、caix、lmp2、epha2、岩藻糖基gm1、sle、gm3、tgs5、hmwmaa、o-乙酰基-gd2、叶酸受体β、tem1/cd248、tem7r、cldn6、gprc5d、cxorf61、cd97、cd179a、alk、聚唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、or51e2、tarp、wt1、etv6-aml、精子蛋白17、xage1、tie2、mad-ct-1、mad-ct-2、fos相关抗原1、p53突变体、htert、肉瘤易位断点、ml-iap、erg(tmprss2ets融合基因)、na17、pax3、雄性激素受体、细胞周期蛋白b1、mycn、rhoc、cyp1b1、boris、sart3、pax5、oy-tes1、lck、akap-4、ssx2、cd79a、cd79b、cd72、lair1、fcar、lilra2、cd300lf、clec12a、bst2、emr2、ly75、gpc3、fcrl5、和igll1。在一些实施例中,多肽分子的抗原结合结构域结合选自以下中的一个或多个的肿瘤抗原:tshr、cldn6、gprc5d、cxorf61、cd97、cd179a、alk、聚唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、和or51e2。在一些实施例中,多肽分子的抗原结合结构域包含抗体、抗体片段、scfv、fv、fab、(fab’)2、单结构域抗体(sdab)、vh或vl结构域、或骆驼科动物vhh结构域。在一些实施例中,多肽分子的抗原结合结构域包含选自以下的蛋白的跨膜结构域:t细胞受体的α、β或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154、kirds2、ox40、cd2、cd27、lfa-1(cd11a、cd18)、icos(cd278)、4-1bb(cd137)、gitr、cd40、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、il2rβ、il2rγ、il7rα、itga1、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、pag/cbp、nkp44、nkp30、nkp46、nkg2d、和/或nkg2c,或其功能变体。在其他实施例中,多肽分子的细胞内信号传导结构域包含初级信号传导结构域和/或共刺激信号传导结构域。在其他实施例中,多肽分子的细胞内信号传导结构域包含初级信号传导结构域。在其他优选实施例中,多肽分子的细胞内信号传导结构域包含共刺激信号传导结构域。在又其他实施例中,多肽分子的细胞内信号传导结构域包含初级信号传导结构域和共刺激信号传导结构域。在其他实施例中,car多肽的初级信号传导结构域包含选自由以下组成的组的蛋白的功能性信号传导结构域:cd3ζ、cd3γ、cd3δ、cd3ε、常见fcrγ(fcer1g)、fcrβ(fcεr1b)、cd79a、cd79b、fcγriia、dap10、和dap12。在一个实施例中,初级信号传导结构域包含cd3ζ的功能性信号传导结构域。在优选实施例中,car多肽分子的细胞内信号传导结构域包含编码共刺激信号传导结构域的序列。例如,细胞内信号传导结构域可以包含编码初级信号传导结构域的序列和编码共刺激信号传导结构域的序列。在一些实施例中,编码的共刺激信号传导结构域包含选自以下中的一种或多种的蛋白质的功能性信号传导结构域:cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、与cd83特异性地结合的配体、cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46、或nkg2d、或其功能变体。在一些实施例中,car多肽分子进一步包含前导序列。在某些实施例中,多肽分子的抗原结合结构域具有10-4m至10-8m的结合亲和力kd。在一个实施例中,抗原结合结构域是本文描述的抗原结合结构域,例如用于以上提供的靶标的本文描述的抗原结合结构域。在一个实施例中,car分子包含抗原结合结构域,所述抗原结合结构域对于靶抗原具有10-4m至10-8m,例如10-5m至10-7m,例如10-6m或10-7m的结合亲和力kd。在一个实施例中,该抗原结合结构域的结合亲和力比参考抗体(例如本文描述的抗体)的结合亲和力低至少5倍、10倍、20倍、30倍、50倍、100倍或1,000倍。在一个实施例中,编码的抗原结合结构域的结合亲和力比参考抗体(例如,该抗原结合结构域所来源的抗体)的结合亲和力低至少5倍。在另一个方面,本发明的特征在于分离的多肽分子,所述分离的多肽分子包含抗原结合结构域、跨膜结构域、和细胞内信号传导结构域,其中所述抗原结合结构域结合支持肿瘤的抗原(例如,如本文描述的支持肿瘤的抗原)。在一些实施例中,该支持肿瘤的抗原是存在于基质细胞或骨髓源性抑制细胞(mdsc)上的抗原。嵌合蛋白-和表达嵌合蛋白系统的细胞在另一个方面,本发明涉及细胞,例如免疫效应细胞(例如,细胞群体,例如免疫效应细胞群体),所述细胞包含如本文描述的核酸分子、一种或多种嵌合多肽分子、或载体。在一个实施例中,细胞是人t细胞。在一个实施例中,细胞是本文描述的细胞,例如人t细胞,例如本文描述的人t细胞;或人nk细胞,例如本文描述的人nk细胞。在一个实施例中,人t细胞是cd8+t细胞。在一个实施例中,细胞是t细胞,并且该t细胞是甘油二酯激酶(dgk)缺陷的。在一个实施例中,细胞是t细胞,并且该t细胞是ikaros缺陷的。在一个实施例中,细胞是t细胞,并且该t细胞是dgk和ikaros两者缺陷的。在另一个实施例中,本文描述的表达嵌合蛋白的免疫效应细胞可以进一步表达另一种药剂,例如增强细胞的活性的药剂。例如,在一个实施例中,药剂可以是对抑制性分子进行抑制的药剂。抑制性分子的实例包括例如,如本文描述的pd-1、pd-l1、ctla-4、tim-3、ceacam(例如,ceacam-1、ceacam-3和/或ceacam-5)、lag-3、vista、btla、tigit、lair1、cd160、2b4和tgfβ。在一个实施例中,对抑制性分子进行抑制的药剂包含第一多肽(例如抑制性分子),该第一多肽与向细胞提供阳性信号的第二多肽(例如本文描述的细胞内信号传导结构域)相关联。在一个实施例中,该药剂包含例如抑制性分子(如pd-1、pd-l1、ctla-4、tim-3、ceacam(例如,ceacam-1、ceacam-3和/或ceacam-5)、lag-3、vista、btla、tigit、lair1、cd160、2b4或tgfβ、或这些中的任一者的片段)的第一多肽,和第二多肽,该第二多肽是本文描述的细胞内信号传导结构域(例如,包含共刺激结构域(例如,41bb、cd27或cd28,例如如本文描述)和/或初级信号传导结构域(例如,本文描述的cd3ζ信号传导结构域)。在一个实施例中,该药剂包含pd-1的第一多肽或其片段,和本文描述的细胞内信号传导结构域(例如,本文描述的cd28、cd27、ox40或4-ibb信号传导结构域和/或本文描述的cd3ζ信号传导结构域)的第二多肽。在一个实施例中,该细胞进一步包含抑制性分子,该抑制性分子包含:inhkir胞质结构域;跨膜结构域,例如kir跨膜结构域;和抑制剂胞质结构域,例如itim结构域,例如inhkiritim结构域。在一个实施例中,抑制性分子是天然存在的inhkir,或与天然存在的inhkir共有至少50%、60%、70%、80%、85%、90%、95%或99%同源性或相差不超过1、2、3、4、5、6、7、8、9、10、15或20个残基的序列。在一个实施例中,该细胞进一步包含抑制性分子,该抑制性分子包含:slam家族胞质结构域;跨膜结构域,例如slam家族跨膜结构域;和抑制剂胞质结构域,例如slam家族结构域,例如slam家族itim结构域。在一个实施例中,抑制性分子是天然存在的slam家族成员,或与天然存在的slam家族成员共有至少50%、60%、70%、80%、85%、90%、95%或99%同源性或相差不超过1、2、3、4、5、6、7、8、9、10、15或20个残基的序列。在一个实施例中,该细胞中的第二car是抑制性car,其中该抑制性car包含抑制性分子的抗原结合结构域、跨膜结构域和细胞内结构域。抑制性分子可以选自以下中的一个或多个:pd1、pd-l1、ctla-4、tim-3、lag-3、vista、btla、tigit、lair1、cd160、2b4、tgfβ、ceacam-1、ceacam-3、和ceacam-5。在一个实施例中,第二car分子包含pd1的细胞外结构域或其片段。在实施例中,该细胞中的第二car分子进一步包含细胞内信号传导结构域,该细胞内信号传导结构域包含初级信号传导结构域和/或细胞内信号传导结构域。在其他实施例中,该细胞中的细胞内信号传导结构域包含含有cd3ζ的功能性结构域或其功能变体的初级信号传导结构域和含有4-1bb的功能性结构域的共刺激信号传导结构域。在某些实施例中,第一嵌合分子的抗原结合结构域包含scfv,并且第二嵌合分子的抗原结合结构域不包含scfv。例如,第一嵌合分子的抗原结合结构域包含scfv,并且第二嵌合分子的抗原结合结构域包含骆驼科vhh结构域。治疗方法/组合疗法在另一个方面,本发明提供了一种方法,该方法包括施用多肽(例如,如本文描述的多肽),或包含一种或多种编码多肽(例如,本文描述的多肽)的核酸的细胞。在一个实施例中,受试者患有本文描述的病症,例如受试者患有癌症,例如受试者患有表达本文描述的靶抗原的癌症。在一个实施例中,受试者是人。在另一个方面,本发明涉及一种治疗患有与如本文描述的癌症相关抗原的表达相关的疾病的受试者的方法,该方法包括向该受试者施用有效量的包含多肽(例如,如本文描述的多肽)的细胞。在又另一个方面,本发明的特征在于一种治疗患有与肿瘤抗原的表达相关的疾病的受试者的方法,该方法包括向该受试者施用有效量的包含如本文描述的嵌合分子的细胞,例如免疫效应细胞(例如免疫效应细胞群体)。在相关方面,本发明的特征在于一种治疗患有与肿瘤抗原的表达相关的疾病的受试者的方法。该方法包括向该受试者施用有效量的包含嵌合分子的细胞,例如免疫效应细胞(例如,免疫效应细胞群体)与增加免疫细胞的功效的药剂的组合,其中:在另一个方面,本发明的特征在于一种用于治疗患有与肿瘤抗原的表达相关的疾病(例如,如本文描述的障碍)的受试者的组合物,该组合物包含含有多肽(例如,如本文描述的多肽)的免疫效应细胞(例如,免疫效应细胞群体)。在任何前述方法或用途的某些实施例中,该与肿瘤抗原(例如,本文描述的肿瘤抗原)相关的疾病选自增生性疾病如癌症或恶性肿瘤,或癌前病状如骨髓增生异常、骨髓增生异常综合征或白血病前期,或是与本文描述的肿瘤抗原的表达相关的非癌症相关适应症。在一个实施例中,该疾病是本文描述的癌症,例如本文描述为与本文描述的靶标相关的癌症。在一个实施例中,该疾病是血液癌症。在一个实施例中,该血液癌症是白血病。在一个实施例中,该癌症选自下组,该组由以下组成:一种或多种急性白血病,包括但不限于b细胞急性淋巴细胞白血病(“ball”)、t细胞急性淋巴细胞白血病(“tall”)、急性淋巴细胞白血病(all);一种或多种慢性白血病,包括但不限于慢性髓细胞性白血病(cml)、慢性淋巴细胞性白血病(cll);另外的血液癌症或血液病状包括但不限于b细胞幼淋巴细胞性白血病、母细胞性浆细胞样树突细胞肿瘤、伯基特淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、毛细胞白血病、小细胞或大细胞滤泡性淋巴瘤、恶性淋巴组织增生性病状、malt淋巴瘤、套细胞淋巴瘤、边缘区淋巴瘤、多发性骨髓瘤、骨髓增生异常和骨髓增生异常综合征、非霍奇金淋巴瘤、霍奇金淋巴瘤、浆母细胞性淋巴瘤、浆细胞样树突细胞肿瘤、华氏(waldenstrom)巨球蛋白血症、和为由骨髓血细胞的无效产生(或发育异常)联合在一起的各种血液病状集合的“白血病前期”,并且与本文描述的肿瘤抗原的表达相关的疾病包括但不限于表达如本文描述的肿瘤抗原的非典型和/或非经典癌症、恶性肿瘤、癌前病状或增生性疾病;以及它们的任何组合。在另一个实施例中,与本文描述的肿瘤抗原相关的疾病是实体瘤。在上述方法或用途中任一项的某些实施例中,与疾病相关的肿瘤抗原选自以下中的一个或多个:cd19、cd123、cd22、cd30、cd171、cs-1、cll-1(clecl1)、cd33、egfrviii、gd2、gd3、bcma、tnag、psma、ror1、flt3、tag72、cd38、cd44v6、cea、epcam、b7h3、kit、il-13ra2、间皮素、il-11ra、psca、prss21、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、cd20、叶酸受体α、erbb2(her2/neu)、muc1、egfr、ncam、前列腺酶、pap、elf2m、肝配蛋白b2、fap、igf-i受体、caix、lmp2、gp100、bcr-abl、酪氨酸酶、epha2、岩藻糖基gm1、sle、gm3、tgs5、hmwmaa、o-乙酰基-gd2、叶酸受体β、tem1/cd248、tem7r、cldn6、tshr、gprc5d、cxorf61、cd97、cd179a、alk、聚唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、or51e2、tarp、wt1、ny-eso-1、lage-1a、mage-a1、magea1、etv6-aml、精子蛋白17、xage1、tie2、mad-ct-1、mad-ct-2、fos相关抗原1、p53、p53突变体、前列腺特异性蛋白、存活素和端粒酶、pcta-1/半乳凝素8、melana/mart1、ras突变体、htert、肉瘤易位断点、ml-iap、erg(tmprss2ets融合基因)、na17、pax3、雄性激素受体、细胞周期蛋白b1、mycn、rhoc、trp-2、cyp1b1、boris、sart3、pax5、oy-tes1、lck、akap-4、ssx2、rage-1、人端粒酶逆转录酶、ru1、ru2、legumain、hpve6、e7、肠道羧基酯酶、muthsp70-2、cd79a、cd79b、cd72、lair1、fcar、lilra2、cd300lf、clec12a、bst2、emr2、ly75、gpc3、fcrl5、以及igll1。在上述方法或用途中任一项的其他实施例中,与疾病相关的肿瘤抗原选自以下中的一个或多个:tshr、tshr、cd171、cs-1、cll-1、gd3、tnag、flt3、cd38、cd44v6、b7h3、kit、il-13ra2、il-11ra、psca、prss21、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、muc1、egfr、ncam、caix、lmp2、epha2、岩藻糖基gm1、sle、gm3、tgs5、hmwmaa、o-乙酰基-gd2、叶酸受体β、tem1/cd248、tem7r、cldn6、gprc5d、cxorf61、cd97、cd179a、alk、聚唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、or51e2、tarp、wt1、etv6-aml、精子蛋白17、xage1、tie2、mad-ct-1、mad-ct-2、fos相关抗原1、p53突变体、htert、肉瘤易位断点、ml-iap、erg(tmprss2ets融合基因)、na17、pax3、雄性激素受体、细胞周期蛋白b1、mycn、rhoc、cyp1b1、boris、sart3、pax5、oy-tes1、lck、akap-4、ssx2、cd79a、cd79b、cd72、lair1、fcar、lilra2、cd300lf、clec12a、bst2、emr2、ly75、gpc3、fcrl5、和igll1。在上述方法或用途中任一项的其他实施例中,与疾病相关的肿瘤抗原选自以下中的一个或多个:tshr、cldn6、gprc5d、cxorf61、cd97、cd179a、alk、聚唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、和or51e2。在某些实施例中,这些方法或用途与增加免疫效应细胞的功效的药剂(例如,如本文描述的药剂)组合进行。在任何前述方法或用途中,与肿瘤抗原的表达相关的疾病选自下组,该组由以下组成:增生性疾病、癌前病状、癌症以及与该肿瘤抗原的表达相关的非癌症相关适应症。癌症可以是血液癌症,例如选自以下中的一种或多种的癌症:慢性淋巴细胞性白血病(cll)、急性白血病、急性淋巴细胞白血病(all)、b细胞急性淋巴细胞白血病(b-all)、t细胞急性淋巴细胞白血病(t-all)、慢性髓细胞性白血病(cml)、b细胞幼淋巴细胞性白血病、母细胞性浆细胞样树突细胞肿瘤、伯基特淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、毛细胞白血病、小细胞或大细胞滤泡性淋巴瘤、恶性淋巴组织增生性病状、malt淋巴瘤、套细胞淋巴瘤、边缘区淋巴瘤、多发性骨髓瘤、骨髓增生异常和骨髓增生异常综合征、非霍奇金淋巴瘤、霍奇金淋巴瘤、浆母细胞性淋巴瘤、浆细胞样树突细胞肿瘤、华氏(waldenstrom)巨球蛋白血症或白血病前期。癌症还可以选自结肠癌、直肠癌、肾细胞癌、肝癌、非小细胞肺癌、小肠癌、食道癌、黑素瘤、骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼内恶性黑素瘤、子宫癌、卵巢癌、直肠癌、肛区癌、胃癌、睾丸癌、子宫癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、非霍奇金淋巴瘤、内分泌系统癌症、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、儿童实体瘤、膀胱癌、肾或输尿管癌、肾盂癌、中枢神经系统肿瘤(cns)、原发性cns淋巴瘤、肿瘤血管生成、脊轴肿瘤、脑干胶质瘤、垂体腺瘤、卡波济肉瘤、表皮样癌、鳞状细胞癌、t细胞淋巴瘤、环境诱导的癌症、所述癌症的组合、以及所述癌症的转移性病灶。在本文描述的方法或用途的某些实施例中,嵌合分子与增加免疫效应细胞的功效的药剂,例如蛋白磷酸酶抑制剂、激酶抑制剂、细胞因子、免疫抑制性分子的抑制剂;或降低treg细胞的水平或活性的药剂中的一个或多个组合施用。在本文描述的方法或用途的某些实施例中,蛋白磷酸酶抑制剂是shp-1抑制剂和/或shp-2抑制剂。在本文描述的方法或用途的其他实施例中,激酶抑制剂选自以下中的一种或多种:cdk4抑制剂、cdk4/6抑制剂(例如,帕博西尼)、btk抑制剂(例如,依鲁替尼或rn-486)、mtor抑制剂(例如,雷帕霉素或依维莫司(rad001))、mnk抑制剂或双重p13k/mtor抑制剂。在一个实施例中,btk抑制剂不会降低或抑制白细胞介素-2诱导型激酶(itk)的激酶活性。在本文描述的方法或用途的其他实施例中,抑制免疫抑制性分子的药剂包括抗体或抗体片段、抑制性核酸、聚集的规则间隔短回文重复序列(crispr)、转录活化因子样效应核酸酶(talen)或对抑制性分子的表达进行抑制的锌指核酸内切酶(zfn)。在本文描述的方法或用途的其他实施例中,降低treg细胞的水平或活性的药剂选自环磷酰胺、抗gitr抗体、cd25耗尽或它们的组合。在本文描述的方法或用途的某些实施例中,免疫抑制性分子选自下组,该组由以下组成:pd1、pd-l1、ctla-4、tim-3、lag-3、vista、btla、tigit、lair1、cd160、2b4、tgfβ、ceacam-1、ceacam-3、以及ceacam-5。在其他实施例中,对抑制性分子进行抑制的药剂包含含有抑制性分子的第一多肽或其片段以及向细胞提供阳性信号的第二多肽,并且其中该第一多肽和第二多肽在含有car的免疫细胞上表达,其中(i)该第一多肽包含pd1、pd-l1、ctla-4、tim-3、lag3、vista、btla、tigit、lair1、cd160、2b4、tgfβ、ceacam-1、ceacam-3、以及ceacam-5或其片段;和/或(ii)该第二多肽包含细胞内信号传导结构域,该细胞内信号传导结构域包含初级信号传导结构域和/或共刺激信号传导结构域。在一个实施例中,初级信号传导结构域包含cd3ζ的功能性结构域;和/或共刺激信号传导结构域包含选自41bb、cd27和cd28的蛋白质的功能性结构域。在其他实施例中,细胞因子选自il-7、il-15或il-21、或两者。在其他实施例中,免疫效应细胞和第二,例如本文披露的任何组合疗法(例如,增加免疫效应细胞的功效的药剂)基本上同时或顺序地施用。在一个实施例中,淋巴细胞输注(例如同种异体淋巴细胞输注)用于治疗癌症,其中淋巴细胞输注包含至少一种本发明的细胞。在一个实施例中,自体淋巴细胞输注用于治疗癌症,其中自体淋巴细胞输注包含至少一种本文描述的细胞。在一个实施例中,细胞是t细胞,并且该t细胞是甘油二酯激酶(dgk)缺陷的。在一个实施例中,细胞是t细胞,并且该t细胞是ikaros缺陷的。在一个实施例中,细胞是t细胞,并且该t细胞是dgk和ikaros两者缺陷的。在一个实施例中,该方法包括施用如本文描述的表达细胞的细胞与增强此类细胞的活性的药剂的组合,其中该药剂是细胞因子,例如il-7、il-15、il-21或其组合。可以与施用细胞组合,例如同时或在施用细胞之后不久递送细胞因子。可替代地,可以在施用细胞后延长的时间段后,例如,在评估受试者对细胞的应答之后递送细胞因子。在一个实施例中,将细胞因子与施用如权利要求61-80中任一项的细胞或细胞群体同时(例如,在同一天施用)或在施用该细胞或细胞群体之后不久(例如,在施用该细胞或细胞群体之后1天、2天、3天、4天、5天、6天或7天施用)施用至受试者。在其他实施例中,将细胞因子在施用如权利要求61-80中任一项的细胞或细胞群体之后或在评估受试者对细胞的应答之后延长的时间段(例如,例如,至少2周、3周、4周、6周、8周、10周或更长时间)后施用至受试者。在其他实施例中,将细胞与改善与细胞的施用相关的一种或多种副作用的药剂组合施用。与细胞相关的副作用可以选自细胞因子释放综合征(crs)或噬血细胞性淋巴组织细胞增多症(hlh)。在任何前述方法或用途的实施例中,表达分子的细胞与治疗与肿瘤抗原的表达相关的疾病的药剂(例如本文披露的第二或第三疗法中的任一种)组合施用。另外的示例性组合包括以下中的一种或多种。在另一个实施例中,表达例如,如本文描述的分子的细胞可以与另一种药剂(例如,本文描述的激酶抑制剂和/或检查点抑制剂)组合施用。在一个实施例中,细胞可以进一步表达另一种药剂,例如增强表达嵌合蛋白的细胞的活性的药剂。例如,在一个实施例中,增强细胞的活性的药剂可以是对抑制性分子进行抑制的药剂(例如,免疫抑制剂分子)。抑制性分子的实例包括pd1、pd-l1、ctla-4、tim-3、ceacam(例如,ceacam-1、ceacam-3和/或ceacam-5)、lag-3、vista、btla、tigit、lair1、cd160、2b4和tgfβ。在一个实施例中,对抑制性分子进行抑制的药剂是抑制性核酸,是dsrna、sirna或shrna。在实施例中,该抑制性核酸与编码嵌合分子的组分的核酸连接。例如,抑制性分子可以在细胞上表达。在另一个实施例中,对抑制性分子进行抑制的药剂例如是本文描述的分子,例如包含第一多肽(例如,抑制性分子)的药剂,该第一多肽与向细胞提供阳性信号的第二多肽(例如,本文描述的细胞内信号传导结构域)缔合。在一个实施例中,该药剂包含例如抑制性分子(如pd-1、pd-l1、ctla-4、tim-3、ceacam(例如,ceacam-1、ceacam-3和/或ceacam-5)、lag-3、vista、btla、tigit、lair1、cd160、2b4或tgfβ、或这些中的任一者的片段(例如,这些中的任一者的细胞外结构域的至少一部分))的第一多肽,和第二多肽,该第二多肽是本文描述的细胞内信号传导结构域(例如,包含共刺激结构域(例如,41bb、cd27或cd28,例如如本文描述)和/或初级信号传导结构域(例如,本文描述的cd3ζ信号传导结构域)。在一个实施例中,该药剂包含pd1或其片段(例如pd1的细胞外结构域的至少一部分)的第一多肽,和本文描述的细胞内信号传导结构域(例如本文描述的cd28信号传导结构域和/或本文描述的cd3ζ信号传导结构域)的第二多肽。在一个实施例中,将本发明的免疫效应细胞(例如,t细胞或nk细胞)施用至已接受先前干细胞移植(例如自体干细胞移植)的受试者。在一个实施例中,将本发明的免疫效应细胞(例如,t细胞或nk细胞)施用至已接受先前剂量的美法仑的受试者。在一个实施例中,将本文描述的细胞与增加细胞的功效的药剂(例如本文描述的药剂)组合施用。在一个实施例中,将本文描述的细胞与低免疫增强剂量的mtor抑制剂组合施用。尽管不希望受理论束缚,但据信用低免疫增强剂量(例如不足以完全抑制免疫系统但足以改善免疫功能的剂量)进行治疗伴随pd-1阳性t细胞的减少或pd-1阴性细胞的增加。pd-1阳性t细胞、但非pd-1阴性t细胞可以通过与表达pd-1配体(例如,pd-l1或pd-l2)的细胞接合而耗竭。在一个实施例中,在施用本文描述的细胞(例如,t细胞或nk细胞)之前,开始施用低免疫增强剂量的mtor抑制剂,例如变构抑制剂(例如,rad001),或催化性抑制剂。在一个实施例中,在足够的时间或足够剂量的mtor抑制剂后施用细胞,以使得pd1阴性免疫效应细胞(例如t细胞或nk细胞)的水平、或pd1阴性免疫效应细胞(例如t细胞)/pd1阳性免疫效应细胞(例如t细胞)的比率已经至少短暂地增加。在一个实施例中,将本文描述的细胞以本文描述的剂量和/或给药时间表施用。在另一个方面,本发明涉及编码本发明的一种或多种嵌合蛋白的分离的核酸分子、本发明的一种或多种嵌合蛋白的分离的多肽分子、包含编码本发明的一种或多种嵌合蛋白的核酸的载体、以及包含本发明的一种或多种嵌合蛋白的细胞,其用作药物。在任何前述方法或用途中,与支持肿瘤的抗原的表达相关的疾病选自下组,该组由以下组成:增生性疾病、癌前病状、癌症以及与该支持肿瘤的抗原的表达相关的非癌症相关适应症。在一个实施例中,与本文描述的支持肿瘤的抗原相关的疾病是实体瘤。在本文描述的方法或用途的一个实施例中,本文描述的多肽与另一种药剂组合施用。在一个实施例中,该药剂可以是激酶抑制剂,例如cdk4/6抑制剂、btk抑制剂、mtor抑制剂、mnk抑制剂或双重pi3k/mtor激酶抑制剂、以及它们的组合。在一个实施例中,激酶抑制剂是cdk4抑制剂,例如本文描述的cdk4抑制剂,例如cd4/6抑制剂,如6-乙酰基-8-环戊基-5-甲基-2-(5-哌嗪-1-基-吡啶-2-基氨基)-8h-吡啶并[2,3-d]嘧啶-7-酮盐酸盐(也称为帕博西尼(palbociclib)或pd0332991)。在一个实施例中,激酶抑制剂是btk抑制剂,例如本文描述的btk抑制剂,例如像依鲁替尼。在一个实施例中,激酶抑制剂是mtor抑制剂,例如本文描述的mtor抑制剂,例如像雷帕霉素、雷帕霉素类似物、osi-027。该mtor抑制剂可以是例如mtorc1抑制剂和/或mtorc2抑制剂,例如本文描述的mtorc1抑制剂和/或mtorc2抑制剂。在一个实施例中,激酶抑制剂是mnk抑制剂,例如本文描述的mnk抑制剂,例如像4-氨基-5-(4-氟苯胺基)-吡唑并[3,4-d]嘧啶。该mnk抑制剂可以是例如mnk1a、mnk1b、mnk2a和/或mnk2b抑制剂。该双重pi3k/mtor抑制剂可以是例如pf-04695102。在本文描述的方法或用途的一个实施例中,激酶抑制剂是选自以下的cdk4抑制剂:aloisinea;夫拉平度或hmr-1275,2-(2-氯苯基)-5,7-二羟基-8-[(3s,4r)-3-羟基-1-甲基-4-哌啶基]-4-色满酮;克唑替尼(pf-02341066;2-(2-氯苯基)-5,7-二羟基-8-[(2r,3s)-2-(羟甲基)-1-甲基-3-吡咯烷基]-4h-1-苯并吡喃-4-酮盐酸盐(p276-00);1-甲基-5-[[2-[5-(三氟甲基)-1h-咪唑-2-基]-4-吡啶基]氧基]-n-[4-(三氟甲基)苯基]-1h-苯并咪唑-2-胺(raf265);吲地横胺(indisulam)(e7070);洛斯可维汀(roscovitine)(cyc202);帕博西尼(pd0332991);地那西利(dinaciclib)(sch727965);n-[5-[[(5-叔丁基噁唑-2-基)甲基]硫代]噻唑-2-基]哌啶-4-甲酰胺(bms387032);4-[[9-氯-7-(2,6-二氟苯基)-5h-嘧啶并[5,4-d][2]苯并氮杂-2-基]氨基]-苯甲酸(mln8054);5-[3-(4,6-二氟-1h-苯并咪唑-2-基)-1h-吲唑-5-基]-n-乙基-4-甲基-3-吡啶甲胺(ag-024322);4-(2,6-二氯苯甲酰基氨基)-1h-吡唑-3-羧酸n-(哌啶-4-基)酰胺(at7519);4-[2-甲基-1-(1-甲基乙基)-1h-咪唑-5-基]-n-[4-(甲基磺酰基)苯基]-2-嘧啶胺(azd5438);和xl281(bms908662)。在本文描述的方法或用途的一个实施例中,激酶抑制剂是选自以下的mtor抑制剂:替西罗莫司;地磷莫司(1r,2r,4s)-4-[(2r)-2[(1r,9s,12s,15r,16e,18r,19r,21r,23s,24e,26e,28z,30s,32s,35r)-1,18-二羟基-19,30-二甲氧基-15,17,21,23,29,35-六甲基-2,3,10,14,20-五氧杂-11,36-二氧杂-4-氮杂三环[30.3.1.04,9]三十六碳-16,24,26,28-四烯-12-基]丙基]-2-甲氧基环己基二甲基次膦酸酯,也称为ap23573和mk8669;依维莫司(rad001);雷帕霉素(ay22989);塞马莫德(simapimod);(5-{2,4-双[(3s)-3-甲基吗啉-4-基]吡啶并[2,3-d]嘧啶-7-基}-2-甲氧基苯基)甲醇(azd8055);2-氨基-8-[反式-4-(2-羟基乙氧基)环己基]-6-(6-甲氧基-3-吡啶基)-4-甲基吡啶并[2,3-d]嘧啶-7(8h)-酮(pf04691502);和n2-[1,4-二氧代-4-[[4-(4-氧代-8-苯基-4h-1-苯并吡喃-2-基)吗啉-4-基]甲氧基]丁基]-l-精氨酰甘氨酰-l-α-天冬氨酰l-丝氨酸-(披露为seqidno:39的“rgds”)、内盐(sf1126);和xl765。在本文描述的方法或用途的一个实施例中,激酶抑制剂是选自以下的mnk抑制剂:cgp052088;4-氨基-3-(对氟苯基氨基)-吡唑并[3,4-d]嘧啶(cgp57380);尾孢酰胺(cercosporamide);etc-1780445-2;和4-氨基-5-(4-氟苯胺基)-吡唑并[3,4-d]嘧啶。在本文描述的方法或用途的一个实施例中,激酶抑制剂是双重磷脂酰肌醇3-激酶(pi3k)和mtor抑制剂,其选自2-氨基-8-[反式-4-(2-羟基乙氧基)环己基]-6-(6-甲氧基-3-吡啶基)-4-甲基-吡啶并[2,3-d]嘧啶-7(8h)-酮(pf-04691502);n-[4-[[4-(二甲基氨基)-1-哌啶基]羰基]苯基]-n'-[4-(4,6-二-4-吗啉基-1,3,5-三嗪-2-基)苯基]脲(pf-05212384,pki-587);2-甲基-2-{4-[3-甲基-2-氧代-8-(喹啉-3-基)-2,3-二氢-1h-咪唑并[4,5-c]喹啉-1-基]苯基}丙腈(bez-235);艾皮托里昔布(apitolisib)(gdc-0980,rg7422);2,4-二氟-n-{2-(甲氧基)-5-[4-(4-哒嗪基)-6-喹啉基]-3-吡啶基}苯磺酰胺(gsk2126458);8-(6-甲氧基吡啶-3-基)-3-甲基-1-(4-(哌嗪-1-基)-3-(三氟甲基)苯基)-1h-咪唑并[4,5-c]喹啉-2(3h)-酮马来酸(nvp-bgt226);3-[4-(4-吗啉基吡啶并[3',2':4,5]呋喃并[3,2-d]嘧啶-2-基]苯酚(pi-103);5-(9-异丙基-8-甲基-2-吗啉代-9h-嘌呤-6-基)嘧啶-2-胺(vs-5584,sb2343);和n-[2-[(3,5-二甲氧基苯基)氨基]喹喔啉-3-基]-4-[(4-甲基-3-甲氧基苯基)羰基]氨基苯磺酰胺(xl765)。在本文描述的方法或用途的一个实施例中,将本文描述的免疫效应细胞与蛋白酪氨酸磷酸酶抑制剂(例如本文描述的蛋白酪氨酸磷酸酶抑制剂)组合施用至受试者。在一个实施例中,蛋白酪氨酸磷酸酶抑制剂是shp-1抑制剂,例如本文描述的shp-1抑制剂,例如像葡萄糖酸锑钠。在一个实施例中,蛋白酪氨酸磷酸酶抑制剂是shp-2抑制剂。在本文描述的方法或用途的一个实施例中,将嵌合分子与另一种药剂组合施用,并且该药剂是细胞因子。该细胞因子可以是例如il-7、il-15、il-21或它们的组合。在另一个实施例中,将car分子与检查点抑制剂(例如本文描述的检查点抑制剂)组合施用。例如,在一个实施例中,检查点抑制剂抑制选自pd-1、pd-l1、ctla-4、tim-3、ceacam(例如,ceacam-1,ceacam-3和/或ceacam-5)、lag-3、vista、btla、tigit、lair1、cd160、2b4和tgfβ的抑制性分子。制备表达嵌合蛋白-和嵌合蛋白系统的细胞的方法在另一个方面,本发明涉及一种制备细胞(例如,免疫效应细胞或其群体)的方法,该方法包括将包含编码多肽或系统(例如,如本文描述的多肽或系统)的核酸的载体或编码多肽或系统(例如,如本文描述的多肽或系统)的核酸引入到(例如转导)细胞(例如,本文描述的t细胞或nk细胞)中。这些方法中的细胞是免疫效应细胞(例如,t细胞或nk细胞,或它们的组合)。在一些实施例中,这些方法中的细胞是甘油二酯激酶(dgk)和/或ikaros缺陷型的。在一些实施例中,引入核酸分子包括:将包含编码多肽或系统(例如,如本文描述的多肽或系统)的核酸分子的载体转导,或将编码多肽或系统(例如,如本文描述的多肽或系统)的核酸分子转染,其中该核酸分子是体外转录的rna。在其他实施例中,通过在刺激cd3/tcr复合物相关信号的药剂和/或刺激细胞表面上的共刺激分子的配体存在下培养细胞来扩增细胞群体。该药剂可以是与抗cd3抗体或其片段、和/或抗cd28抗体或其片段缀合的珠。在其他实施例中,使细胞群体在包含一种或多种白细胞介素的适当介质中扩增,该一种或多种白细胞介素导致在14天扩增期内细胞增加至少200倍、250倍、300倍或350倍,如通过流式细胞术所测量的。在其他实施例中,在il-15和/或il-7存在下扩增细胞群体。在某些实施例中,该方法进一步包括在适当的扩增期后冷冻保存细胞群体。在又其他实施例中,本文披露的制备方法进一步包括使免疫效应细胞群体与编码端粒酶亚基(例如htert)的核酸接触。编码端粒酶亚基的核酸可以是dna。本发明还提供了一种产生rna工程化的细胞,例如本文描述的细胞,例如瞬时表达外源rna的免疫效应细胞(例如,t细胞、nk细胞)的群体的方法。在另一个方面,本发明涉及一种在受试者中提供抗肿瘤免疫的方法,该方法包括将有效量的如本文描述的细胞施用于受试者。在一个实施例中,细胞是自体t细胞或nk细胞。在一个实施例中,细胞是同种异体t细胞或nk细胞。在一个实施例中,受试者是人。在一个方面,本发明包括用包含如本文描述的核酸分子的载体转染或转导的自体细胞的群体。在一个实施例中,该载体是逆转录病毒载体。在一个实施例中,该载体是如本文其他地方描述的自灭活慢病毒载体。在一个实施例中,将载体递送(例如,通过转染或电穿孔)至细胞,例如t细胞或nk细胞,其中该载体包含编码如本文描述的多肽的核酸分子,该核酸分子被转录为mrna分子,并且本发明的嵌合蛋白从该rna分子翻译并在细胞的表面上表达。在一个实施例中,本发明分子的核酸分子(例如,如本文描述)被表达为mrna分子。在一个实施例中,表达本发明的细胞,例如免疫效应细胞(例如,t细胞、nk细胞)可以通过将编码所希望的蛋白的rna分子(例如,没有载体序列)转染或电穿孔到细胞中来产生。在一个实施例中,本发明分子的嵌合蛋白一旦被掺入并在重组细胞的表面上表达就从rna分子翻译。在某些方面,前述嵌合蛋白(例如本文描述的系统的嵌合蛋白)由相同读框中的单个核酸分子编码并且作为单个多肽链。在这方面,蛋白可以例如被一个或多个肽切割位点分开。(例如,细胞内蛋白酶的自动切割位点或底物)。肽切割位点的实例包括以下,其中gsg残基是任选的:t2a:(gsg)egrgslltcgdveenpgp(seqidno:40)p2a:(gsg)atnfsllkqagdveenpgp(seqidno:41)e2a:(gsg)qctnyallklagdvesnpgp(seqidno:42)f2a:(gsg)vkqtlnfdllklagdvesnpgp(seqidno:43)在相关方面,本发明的特征在于单个蛋白,如以上描述,编码两个嵌合多肽。在其他方面,前述多肽,例如系统的多肽,由单个、或多个核酸分子编码,并且并不表达为单个多肽。此处,例如多肽可以由常见启动子控制,或由内部核糖体进入位点分开。可替代地,两个蛋白的表达例如可以由分开的启动子控制。在又另一个方面,本发明的特征在于包含前述编码不同嵌合蛋白(例如系统的嵌合蛋白)的核酸分子的一种或多种载体(例如以上描述的载体中的任一者)。附图说明图1是示出基于组成型活性的tcr的嵌合抗原受体(tcar)的示意图。通过与细胞内异源二聚化结构域融合,并且与融合至第二异源二聚化结构域的内源tcr复合物成员(例如cd3ε)一起共转染/共转导,将靶向结构域和共刺激结构域嵌入tcr复合物中。图2是示出具有细胞内异源二聚化结构域的抗原活化的tcar的jnl信号传导和il2表达的一对图。图3是一对图,示出随着转染而变化,在用所指出的构建体转染的细胞中所指出的细胞杀伤的百分比。图4是示出在所指出的构建体中,随着转染而变化的il-2表达浓度的图。图5是示出在增强的增殖情况下的基于组成型活性的tcr的嵌合抗原受体(tcar)的示意图。通过与细胞内异源二聚化结构域融合,并且与融合至第二共刺激结构域和第二异源二聚化结构域的内源tcr复合物成员(例如cd3ε)的细胞外结构域和跨膜结构域一起共转染/共转导,将靶向结构域和共刺激结构域嵌入tcr复合物中。不像第三代car,此取向提供了共刺激成员两者是膜近端的,并且应进一步增强增殖能力。图6是示出基于组成型活性的tcr的嵌合抗原受体(tcar)的示意图。通过与细胞内异源二聚化结构域融合,并且与融合至内源tcr复合物成员(例如cd3ε)(其与第二细胞内异源二聚化结构域融合)的靶向结构域一起共转染/共转导,将具有或不具有其天然细胞外结构域的共刺激受体嵌入tcr复合物中。图7是示出基于组成型活性的tcr的嵌合抗原受体(tcar)的示意图。通过与细胞内异源二聚化结构域融合,并且与融合至内源tcr复合物成员(例如cd3ε)(其与第二细胞内异源二聚化结构域融合)的靶向结构域一起共转染/共转导,将胞质共刺激结构域嵌入tcr复合物中。图8是示出基于组成型活性的tcr的嵌合抗原受体(tcar)的示意图。通过与结合tcr复合物的成员的细胞内结构域融合,将靶向结构域和共刺激结构域嵌入tcr复合物中。图9是示出基于组成型活性的tcr的嵌合抗原受体(tcar)的示意图。通过与结合tcr复合物的成员的细胞外结构域融合,将靶向结构域和共刺激结构域嵌入tcr复合物中。图10是示出组成型活性的嵌合抗原受体tcr融合(fustcar)的示意图。通过与内源截短的αtcr和βtcr直接融合,将源自抗体的靶向结构域的vl和vh嵌入tcr复合物中。图11是示出组成型活性的嵌合抗原受体tcr融合(fustcar)的示意图。通过与内源截短的αtcr和βtcr直接融合,随后是一个或多个共刺激结构域的细胞内融合,将源自抗体的靶向结构域的vl和vh嵌入tcr复合物中。图12是示出组成型活性的嵌合抗原受体tcr融合(fustcar)的示意图。通过与内源tcr复合物成员(例如cd3ε)直接融合,将靶向结构域嵌入tcr复合物中。图13是示出组成型活性的嵌合抗原受体tcr融合(fustcar)的示意图。通过与内源tcr复合物成员(例如cd3ε)(随后是一个或多个细胞内共刺激结构域(例如4-1bb),或其功能变体)直接融合,将靶向结构域嵌入tcr复合物中。图14是示出组成型活性的嵌合抗原受体tcr融合(fustcar)的示意图。通过与内源tcr复合物成员(例如cd3ε)的细胞外结构域和跨膜结构域(随后是一个或多个细胞内共刺激结构域(例如4-1bb),或其功能变体)直接融合,将靶向结构域嵌入tcr复合物中。图15是示出活化的fustcar的jnl信号传导和il2表达的图。图16是一系列图,示出随着转染而变化,通过用所指出的构建体转染的细胞,所指出的细胞的具体杀伤的百分比。图17是示出随着用所指出的构建体转染而变化的il-2的表达的图。图18是一对图,示出随着转染而变化,在用所指出的构建体转染的细胞中所指出的细胞杀伤的百分比。图19是示出在所指出的构建体中,随着转染而变化的il-2表达浓度的图。图20是示出在增强的增殖情况下的基于调节型tcr的嵌合抗原受体(rtcar)的示意图。通过与细胞内异源二聚化开关结构域融合,并且与融合至第二共刺激结构域和第二异源二聚化开关结构域的内源tcr复合物成员(例如cd3ε)的细胞外结构域和跨膜结构域一起共转染/共转导,将靶向结构域和共刺激结构域嵌入tcr复合物中。当添加开关分子例如rapalogue后,诱导信号传导。图21是示出基于调节型tcr的嵌合抗原受体(rtcar)的示意图。通过与细胞内异源二聚化开关结构域融合,并且与融合至内源tcr复合物成员(例如cd3ε)(其与第二细胞内异源二聚化开关结构域融合)的靶向结构域一起共转染/共转导,将具有或不具有其天然细胞外结构域的共刺激受体嵌入tcr复合物中。当添加开关分子例如rapalogue后,诱导增殖。图22是示出基于组成型活性的tcr的嵌合抗原受体(tcar)的示意图。通过与细胞内异源二聚化开关结构域融合,并且与结合tcr复合物的成员(其融合至共刺激受体的跨膜结构域和细胞内结构域和第二异源二聚化开关结构域)的细胞外结构域共转染/共转导,将靶向结构域和共刺激结构域嵌入tcr复合物中。当添加开关分子例如rapalogue后,诱导信号传导。图23是示出基于组成型活性的tcr的嵌合抗原受体(tcar)的示意图。通过与细胞内异源二聚化开关结构域融合,并且与具有或不具有融合至第二异源二聚化开关结构域和结合tcr复合物的成员的细胞内结构域的其天然细胞外结构域的共刺激受体共转染/共转导,将靶向结构域和共刺激结构域嵌入tcr复合物中。当添加开关分子例如rapalogue后,诱导信号传导。图24是示出基于组成型活性的tcr的嵌合抗原受体(tcar)的示意图。通过与细胞内异源二聚化开关结构域融合,并且与融合至第二异源二聚化开关结构域和结合tcr复合物的成员的细胞内结构域的胞质共刺激结构域共转染/共转导,将靶向结构域和共刺激结构域嵌入tcr复合物中。当添加开关分子例如rapalogue后,诱导信号传导。图25是示出基于调节型tcr的嵌合抗原受体(tcar)的示意图。通过与细胞内异源二聚化开关结构域融合,并且与融合至第二异源二聚化开关结构域的内源tcr复合物成员(例如cd3ε)一起共转染/共转导,将靶向结构域和共刺激结构域嵌入tcr复合物中。当添加开关分子例如rapalogue后,诱导信号传导。图26是示出基于调节型tcr的嵌合抗原受体(rtcar)的示意图。通过与细胞内异源二聚化开关结构域融合,并且与融合至第二异源二聚化开关结构域的内源tcr复合物成员(例如cd3ε)一起共转染/共转导,将靶向结构域和共刺激结构域嵌入tcr复合物中。当添加开关分子例如rapalogue后,诱导信号传导。将来自cd3ε融合的itam结构域突变为苯丙氨酸,从而证明由tcr复合物的其他成员诱导了信号传导。图27是示出用rad001诱导的抗原活化的fkbp/frprtcar的jnl信号传导和il2表达的一系列图。图28是示一系列图,出具有和不具有cd3eitam信号传导的敲除的情况下,rapalogue介导的抗原活化的fkbp/frprtcar的jnl信号传导和il2表达的比较。图29是一对图,示出随着转染而变化,在用所指出的构建体转染的细胞中所指出的细胞杀伤的百分比。图30是示出在所指出的构建体中,随着转染而变化的il-2表达浓度的图。图31是一对图,示出随着转染而变化,在用所指出的构建体转染的细胞中所指出的细胞杀伤的百分比。图32是示出在所指出的构建体中,随着转染而变化的il-2表达浓度的图。图33是示出由nfat报告基因系统产生的光强度的图。抗独特型抗体结合表达的scfv。图34是一对图,示出随着转染而变化,在用所指出的构建体转染的细胞中所指出的细胞杀伤的百分比。图35是示出在所指出的构建体中,随着转染而变化的il-2表达浓度的图。图36左图是示出随着转染而变化,在用所指出的构建体转染的细胞中所指出的细胞杀伤的百分比的图。图36右图是示出在所指出的表达条件下,表达所指出的构建体的细胞的数量的一系列图。图37的图示出随着转染而变化,在用所指出的构建体转染的细胞中所指出的细胞杀伤的百分比。图38是示出在所指出的构建体中,随着转染而变化的il-2表达浓度的图。图39的图示出随着转染而变化,在用所指出的构建体转染的细胞中所指出的细胞杀伤的百分比。图40是示出在所指出的构建体中,随着转染而变化的il-2表达浓度的图。图41示出用于本发明的不同方面的嵌合膜蛋白的不同实例。在本发明的系统方面,一起利用两种或更多种嵌合膜蛋白,例如在细胞中一起表达。图42是示出从本发明的系统组装的基于tcr的嵌合抗原受体(tcar)的示意图。通过将第一和第二抗原结合结构域(此处描绘为scfv抗原结合结构域)融合至包含cd3ε蛋白的细胞外部分的蛋白,并且融合至包含cd3γ蛋白的细胞外部分的蛋白,tcar对两种抗原具有特异性。将共刺激信号传导结构域进一步融合至嵌合膜分子中的一个或多个的细胞内部分。例如将两种嵌合膜蛋白共转染/共转导到t细胞中,导致形成包含两种异源嵌合蛋白的tcr,由此当抗原参与时,赋予对tcr/细胞的双抗原特异性连同cd3ζ信号传导和共刺激信号传导。图43是示出从本发明的系统组装的基于tcr的嵌合抗原受体(tcar)的示意图。通过将第一和第二抗原结合结构域(此处描绘为scfv抗原结合结构域)融合至包含cd3ε蛋白的细胞外部分的蛋白,并且融合至包含cd3δ蛋白的细胞外部分的蛋白,tcar对两种抗原具有特异性。将共刺激信号传导结构域进一步融合至嵌合膜分子中的一个或多个的细胞内部分。例如将两种嵌合膜蛋白共转染/共转导到t细胞中,导致形成包含两种异源嵌合蛋白的tcr,由此当抗原参与时,赋予对tcr/细胞的双抗原特异性连同cd3ζ信号传导和共刺激信号传导。图44是示出从本发明的系统组装的基于tcr的嵌合抗原受体(tcar)的示意图。通过将第一和第二抗原结合结构域(此处描绘为scfv抗原结合结构域)融合至包含cd3δ蛋白的细胞外部分的蛋白,并且融合至包含cd3γ蛋白的细胞外部分的蛋白,tcar对两种抗原具有特异性。将共刺激信号传导结构域进一步融合至嵌合膜分子中的一个或多个的细胞内部分。例如将两种嵌合膜蛋白共转染/共转导到t细胞中,导致形成包含两种异源嵌合蛋白的tcr,由此当抗原参与时,赋予对tcr/细胞的双抗原特异性连同cd3ζ信号传导和共刺激信号传导。图45是示出从本发明的系统组装的基于tcr的嵌合抗原受体(tcar)的示意图。通过将第一、第二和第三抗原结合结构域(此处描绘为scfv抗原结合结构域)融合至包含cd3δ蛋白的细胞外部分的蛋白、包含cd3ε蛋白的细胞外部分的蛋白、并且融合至包含cd3γ蛋白的细胞外部分的蛋白,tcar对三种抗原具有特异性。将共刺激信号传导结构域进一步融合至嵌合膜分子中的一个或多个的细胞内部分。例如将两种嵌合膜蛋白共转染/共转导到t细胞中,导致形成包含两种异源嵌合蛋白的tcr,由此当抗原参与时,赋予对tcr/细胞的双抗原特异性连同cd3ζ信号传导和共刺激信号传导。图46是示出从本发明的系统组装的基于tcr的嵌合抗原受体(tcar)的示意图。通过将第一和第二抗原结合结构域(此处描绘为scfv抗原结合结构域)融合至包含cd3γ蛋白的细胞外部分的蛋白(此处示出为串联scfv融合)、并且将第三抗原结合结构域融合至包含cd3δ蛋白的细胞外部分的蛋白,tcar对三种抗原具有特异性。将共刺激信号传导结构域进一步融合至嵌合膜分子中的一个或多个的细胞内部分。例如将两种嵌合膜蛋白共转染/共转导到t细胞中,导致形成包含两种异源嵌合蛋白的tcr,由此当抗原参与时,赋予对tcr/细胞的双抗原特异性连同cd3ζ信号传导和共刺激信号传导。图47a-47d是示出jnl细胞上的tcar表达的流式细胞术图的图。未转导的jnl(utd)、cd19-tcar、cd22-tcar、或cd19-tcar加cd22-tcar(cd19/22双tcar)转导的细胞用cd19-car抗独特型ab和cd22-fc染色,并且通过流式细胞术进行测定。左上四分之一中的数字表示cd22-tcar的表达水平,并且右下四分之一中的数字表示cd19-tcar的表达水平(几何平均值)。图48a-c是示出了来自测试tcar功能的jurkatnfat萤光素酶(jnl)报告基因测定的结果的条形图。将未转导的jnl(utd)、cd19-tcar、cd22-tcar、或cd19-tcar加cd22-tcar(cd19/22双tcar)转导的细胞与慢性髓细胞性白血病(cml)细胞系k562(k562-wt)或工程化以过表达cd19(k562-cd19)或cd20(k562-cd20)的k562细胞一起共培养。在所指出的肿瘤:jnl细胞比率下,对于每个jnl细胞系,示出了发光(rlu)。具体实施方式本发明的特征在于嵌合cd3蛋白用来调制t细胞受体(tcr)信号传导的用途。具体地,本发明部分地基于以下发现:在同源抗原存在的情况下,其细胞外结构域中的全部或大部分与抗原结合结构域融合的嵌合cd3蛋白(例如cd3δ、cd3γ、和cd3ε)可以活化tcr。本发明进一步基于以下观察:通过在嵌合分子的细胞内部分中包含共刺激结构域,可以加强以上嵌合蛋白。因此,本发明的工程化的信号传导复合物的优选元件包括抗原结合结构域、源自以上cd3蛋白之一的细胞外结构域、和细胞内共刺激结构域。有趣的是,本发明进一步基于以下发现:这些元件不需要存在于单个多肽中来实现基于抗原的tcr信号传导。实际上,抗原结合结构域和/或共刺激结构域中的任一者可以被工程化为第二嵌合分子,并且仍实现信号传导,其条件是如本文描述,第二嵌合分子和cd3分子是经由诱导型或组成型二聚化结构域偶联。与传统嵌合抗原受体对比,基于tcr的嵌合抗原受体(tcar)可以提供内在优势。传统嵌合抗原受体是包含以下的单个连续链分子:靶向结构域,随后是铰链、跨膜结构域、一个或多个共刺激结构域和信号传导结构域,例如cd3ζ。通过使靶向结构域成为tcr复合物的一部分,由tcar诱导的信号传导利用了tcr复合物内的辅助蛋白的整个途径,并且并不限于由来自例如car链上的cd3ζ的传统car提供的独有的信号传导。在t细胞活化和增殖的天然途径中,负责的细胞内途径成员是膜近端的;尽管对于按传统car形式的共刺激结构域和信号传导结构域两者,这是不可能的,但是tcar使得能够最佳取向以工程化为t细胞。定义除非另外定义,否则本文使用的所有技术和科学术语具有本发明所属领域的普通技术人员通常所理解的相同的含义。术语“一个/种(a/an)”是指一个/种或多于一个/种(即,至少一个/种)该冠词的语法宾语。通过举例,“一个元件”意指一个元件或多于一个元件。当指可测量的值如量、时距等时,术语“约”意在涵盖与规定值±20%或在一些情况下±10%、或在一些情况下±5%、或在一些情况下±1%、或在一些情况下±0.1%的变化,因为此类变化适于执行所披露的方法。术语“自体的”是指源自与后来将其重新引入个体中的同一个体的任何材料。术语“同种异体的”是指源自与引入材料的个体相同的物种的不同动物的任何材料。当一个或多个基因座处的基因不相同时,称两个或更多个个体彼此是同种异体的。在一些方面,来自相同物种的个体的同种异体材料可以在遗传上充分不同以抗原性地相互作用。术语“异种的”是指源自不同物种的动物的移植物。术语“癌症”是指特征在于异常细胞不受控制生长的疾病。癌细胞可以局部或通过血流和淋巴系统扩散到身体的其他部位。本文描述了各种癌症的实例,并且包括但不限于乳腺癌、前列腺癌、卵巢癌、宫颈癌、皮肤癌、胰腺癌、结肠直肠癌、肾癌、肝癌、脑癌、淋巴瘤、白血病、肺癌等。术语“肿瘤”和“癌症”在本文中可互换使用,例如,这两个术语包括实体和液体,例如弥散或循环肿瘤。如本文所用,术语“癌症”或“肿瘤”包括恶化前以及恶性癌症和肿瘤。短语“与如本文描述的肿瘤抗原的表达相关的疾病”包括但不限于与如本文描述的肿瘤抗原的表达相关的疾病或与表达如本文描述的肿瘤抗原的细胞相关的病状,包括例如增生性疾病(如癌症或恶性肿瘤)或癌前病状(如骨髓增生异常、骨髓增生异常综合征或白血病前期);或与表达如本文描述的肿瘤抗原的细胞相关的非癌症相关适应症。在一个方面,与如本文描述的肿瘤抗原的表达相关的癌症是血液癌症。在一个方面,与如本文描述的肿瘤抗原的表达相关的癌症是实体癌。与本文描述的肿瘤抗原的表达相关的其他疾病包括但不限于例如非典型和/或非经典癌症、恶性肿瘤、癌前病状或与如本文描述的肿瘤抗原的表达相关的增生性疾病。与如本文描述的肿瘤抗原的表达相关的非癌症相关适应症包括但不限于例如自身免疫性疾病(例如狼疮)、炎性病症(过敏症和哮喘)和移植。在一些实施例中,表达肿瘤抗原的细胞表达或在任何时间表达编码肿瘤抗原的mrna。在实施例中,表达肿瘤抗原的细胞产生肿瘤抗原蛋白(例如野生型或突变体),并且肿瘤抗原蛋白可以以正常水平或降低的水平存在。在实施例中,表达肿瘤抗原的细胞在一个时间点产生可检测水平的肿瘤抗原蛋白,并且随后基本上不产生可检测的肿瘤抗原蛋白。术语“保守序列修饰”是指不显著影响或改变含有氨基酸序列的抗体或抗体片段的结合特征的氨基酸修饰。此类保守修饰包括氨基酸置换、添加和缺失。可以通过本领域已知的标准技术(如定点诱变和pcr介导的诱变)将修饰引入本发明的抗体或抗体片段中。保守氨基酸取代是其中氨基酸残基被具有类似侧链的氨基酸残基置换的取代。具有类似侧链的氨基酸残基的家族已在本领域中进行了定义。这些家族包括具有碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸)、β分支侧链(例如苏氨酸、缬氨酸、异亮氨酸)以及芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)的氨基酸。因此,本发明的car内的一个或多个氨基酸残基可以被来自相同侧链家族的其他氨基酸残基替代,并且可以使用本文描述的功能测定法测试改变的car。术语“刺激”是指通过刺激分子(例如,tcr/cd3复合物)与其同源配体(或在car情况下的肿瘤抗原)的结合诱导的初级应答,从而介导信号转导事件,如但不限于,通过tcr/cd3复合物的信号转导或通过适当的nk受体或信号传导结构域的信号转导。刺激可以介导某些分子的改变的表达。术语“抗原呈递细胞”或“apc”是指免疫系统细胞如辅助细胞(例如,b细胞、树突细胞等),该免疫系统细胞在其表面上展示与主要组织相容性复合物(mhc)复合的外来抗原。t细胞可以使用它们的t细胞受体(tcr)识别这些复合物。apc处理抗原并将它们呈递给t细胞。当该术语在本文中使用时,“免疫效应细胞”是指参与免疫应答(例如促进免疫效应子应答)的细胞。免疫效应细胞的实例包括t细胞,例如α/βt细胞和γ/δt细胞、b细胞、天然杀伤(nk)细胞、天然杀伤t(nkt)细胞、肥大细胞和骨髓衍生的吞噬细胞。当该术语在本文中使用时,“免疫效应子功能或免疫效应子应答”是指例如免疫效应细胞的增强或促进靶细胞的免疫攻击的功能或应答。例如,免疫效应子功能或应答是指促进靶细胞的杀伤或抑制生长或增殖的t或nk细胞的特性。在t细胞的情况下,初级刺激和共刺激是免疫效应子功能或应答的实例。术语“编码”是指多核苷酸(如基因、cdna或mrna)中特定核苷酸序列用作在生物过程中用于合成具有确定核苷酸序列(例如,rrna、trna和mrna)或确定氨基酸序列的其他聚合物和大分子的模板的固有特性,以及由此产生的生物学特性。因此,如果与基因对应的mrna的转录和翻译在细胞或其他生物系统中产生蛋白质,则该基因、cdna或rna编码该蛋白质。编码链(其核苷酸序列与mrna序列相同并且通常在序列表中提供)和非编码链(用作基因或cdna转录的模板)都可以称为编码蛋白质或者该基因或cdna的其他产物。除非另外说明,否则“编码氨基酸序列的核苷酸序列”包括彼此呈简并形式且编码相同氨基酸序列的所有核苷酸序列。短语编码蛋白质或rna的核苷酸序列还可以包含内含子,其程度为编码该蛋白质的核苷酸序列可以在某些形式中含有一个或多个内含子。术语“有效量”或“治疗有效量”在本文中可互换使用,并且是指如本文描述的化合物、配制品、材料或组合物的有效于实现特定的生物学结果的量。术语“内源的”是指来自生物体、细胞、组织或系统或在其内部产生的任何材料。术语“外源的”是指从生物体、细胞、组织或系统引入或在其外部产生的任何材料。术语“表达”是指由启动子驱动的特定核苷酸序列的转录和/或翻译。术语“转移载体”是指包含分离的核酸并且可用于向细胞内部递送该分离的核酸的物质组合物。许多载体在本领域中是已知的,包括但不限于线性多核苷酸、与离子化合物或两亲化合物相关的多核苷酸、质粒、以及病毒。因此,术语“转移载体”包括自主复制的质粒或病毒。该术语还应当解释为进一步包括促进将核酸转移到细胞中的非质粒和非病毒化合物,例如像聚赖氨酸化合物、脂质体等。病毒转移载体的实例包括但不限于腺病毒载体、腺相关病毒载体、逆转录病毒载体、慢病毒载体等。术语“表达载体”是指包含重组多核苷酸的载体,该重组多核苷酸包含与有待表达的核苷酸序列可操作地连接的表达控制序列。表达载体包含足够的用于表达的顺式作用元件;用于表达的其他元件可以由宿主细胞提供或在体外表达系统中提供。表达载体包括本领域已知的所有表达载体,包括掺入重组多核苷酸的粘粒、质粒(例如,裸露的或包含在脂质体中)和病毒(例如,慢病毒、逆转录病毒、腺病毒和腺相关病毒)。术语“慢病毒”是指逆转录病毒科的一个属。慢病毒在逆转录病毒中是独特的,能够感染非分裂细胞;它们可以将显著量的遗传信息递送到宿主细胞的dna中,因此它们是基因递送载体的最有效方法中的一种。hiv、siv、和fiv都是慢病毒的实例。术语“慢病毒载体”是指源自慢病毒基因组的至少一部分的载体,尤其包括如下提供的自灭活慢病毒载体:milone等人,mol.ther.[分子疗法]17(8):1453–1464(2009)。可以在临床中使用的慢病毒载体的其他实例包括但不限于例如来自牛津生物医药公司(oxfordbiomedica)的基因递送技术、来自lentigen公司的lentimaxtm载体系统等。非临床类型的慢病毒载体也是可得的并且是本领域技术人员已知的。术语“同源的”或“同一性”是指两个聚合分子之间(例如,两个核酸分子(如两个dna分子或两个rna分子)之间、或两个多肽分子之间)的亚基序列同一性。当这两个分子中的亚基位置被相同的单体亚基占据时;例如,如果两个dna分子中的每一个中的位置被腺嘌呤占据,则它们在该位置是同源的或相同的。两个序列之间的同源性是匹配位置或同源位置的数量的直接函数;例如,如果两个序列中一半的位置(例如,长度为十个亚基的聚合物中的五个位置)是同源的,则这两个序列是50%同源的;如果90%的位置(例如,10个中的9个)是匹配的或同源的,则这两个序列是90%同源的。非人(例如鼠)抗体的“人源化”形式是嵌合免疫球蛋白、免疫球蛋白链或其片段(如fv、fab、fab'、f(ab')2或抗体的其他抗原结合子序列),其含有来自非人免疫球蛋白的最小序列。在大多数情况下,人源化抗体及其抗体片段是人免疫球蛋白(受体抗体或抗体片段),其中来自受体的互补决定区(cdr)的残基被来自非人物种(供体抗体)(如具有所希望的特异性、亲和力、和能力的小鼠、大鼠或兔)的cdr的残基置换。在一些情况下,人免疫球蛋白的fv框架区(fr)残基由相应非人残基置换。此外,人源化抗体/抗体片段可以包含既不在受体抗体中也不在导入的cdr或框架序列中发现的残基。这些修饰可以进一步改进和优化抗体或抗体片段性能。通常,人源化抗体或其抗体片段将包含基本上所有如下项:至少一个(典型地两个)可变结构域,其中所有或基本上所有cdr区对应于非人免疫球蛋白的那些cdr区,且fr区的所有或显著一部分是人免疫球蛋白序列的那些。人源化抗体或抗体片段还可以包含免疫球蛋白恒定区(fc)的至少一部分,典型地是人免疫球蛋白的恒定区的至少一部分。有关进一步的细节,参见jones等人,nature[自然],321:522-525,1986;reichmann等人,nature[自然],332:323-329,1988;presta,curr.op.struct.biol.[结构生物学现状],2:593-596,1992。“完全人”是指如下免疫球蛋白,如抗体或抗体片段,其中整个分子是人起源或由与抗体或免疫球蛋白的人形式相同的氨基酸序列组成。术语“分离的”意指从天然状态改变的或去除的。例如,天然存在于活体动物中的核酸或肽不是“分离的”,但是与其天然状态的共存材料部分或完全分开的相同核酸或肽是“分离的”。分离的核酸或蛋白质能以基本上纯化的形式存在,或者可以存在于非天然环境(例如像,宿主细胞)中。在本发明的上下文中,使用以下对常见核酸碱基的缩写。“a”是指腺苷,“c”是指胞嘧啶,“g”是指鸟苷,“t”是指胸苷,并且“u”是指尿苷。术语“可操作地连接”或“转录控制”是指调控序列和异源核酸序列之间的导致后者的表达的功能性连接。例如,当第一核酸序列被放置成与第二核酸序列有功能关系时,该第一核酸序列与该第二核酸序列可操作地连接。例如,如果启动子影响编码序列的转录或表达,则该启动子与该编码序列可操作地连接。可操作地连接的dna序列可以彼此邻接,并且例如在需要连接两个蛋白质编码区的情况下,它们处于同一阅读框中。术语“肠胃外”施用免疫原性组合物包括例如皮下(s.c.)、静脉内(i.v.)、肌肉内(i.m.)、或胸骨内注射、肿瘤内或输注技术。术语“核酸”或“多核苷酸”是指单链或双链形式的脱氧核糖核酸(dna)或核糖核酸(rna)及其聚合物。除非特别限定,否则该术语涵盖含有已知的天然核苷酸类似物的核酸,这些核酸具有与参考核酸类似的结合特性并且以与天然存在的核苷酸类似的方式进行代谢。除非另外指出,否则特定的核酸序列还隐含地涵盖其保守修饰的变体(例如,简并密码子取代)、等位基因、直向同源物、snp和互补序列以及明确指明的序列。具体地,简并密码子取代可以通过产生如下序列而获得,在这些序列中,一个或多个所选的(或全部)密码子的第三位被混合碱基和/或脱氧肌苷残基取代(batzer等人,nucleicacidres.[核酸研究]19:5081(1991);ohtsuka等人,j.biol.chem.[生物化学杂志]260:2605-2608(1985);和rossolini等人,mol.cell.probes[分子与细胞探针]8:91-98(1994))。术语“肽”、“多肽”和“蛋白质”可互换地使用,并且是指包含由肽键共价连接的氨基酸残基的化合物。蛋白质或肽必须含有至少两个氨基酸,并且对可构成蛋白质或肽序列的氨基酸的最大数量没有限制。多肽包括包含由肽键彼此相连的两个或更多个氨基酸的任何肽或蛋白质。如本文所用,该术语是指短链,例如其在本领域中通常也称为肽、寡肽和寡聚体;并且还是指较长的链,其在本领域中通常称为蛋白质,存在有很多类型的蛋白质。“多肽”包括例如生物活性片段、基本上同源的多肽、寡肽、同源二聚体、异源二聚体、多肽的变体、经修饰的多肽、衍生物、类似物、融合蛋白等。多肽包括天然肽、重组肽、或其组合。术语“启动子”是指启动多核苷酸序列的特异性转录所需的由细胞合成机器或引入的合成机器所识别的dna序列。术语“启动子/调控序列”是指表达与启动子/调控序列可操作地连接的基因产物所需的核酸序列。在一些情况下,该序列可以是核心启动子序列,并且在其他情况下,该序列还可以包含增强子序列和表达基因产物所需的其他调控元件。启动子/调控序列可以是例如以组织特异性方式表达基因产物的启动子/调控序列。术语“组成型”启动子是指当与编码或指定基因产物的多核苷酸可操作地连接时,在细胞的大多数或全部生理条件下致使基因产物在细胞中产生的核苷酸序列。术语“诱导型”启动子是指当与编码或指定基因产物的多核苷酸可操作地连接时,基本上仅在对应于启动子的诱导物存在于细胞中时才致使基因产物在细胞中产生的核苷酸序列。术语“组织特异性”启动子是指当与编码或由基因指定的多核苷酸可操作地连接时,基本上仅在细胞是对应于启动子的组织类型的细胞时才致使基因产物在细胞中产生的核苷酸序列。术语“癌症相关抗原”或“肿瘤抗原”可互换地指在癌细胞表面上完全或作为片段(例如,mhc/肽)表达的分子(典型地是蛋白质、碳水化合物或脂质),并且其可用于优先将药理学药剂靶向癌细胞。在一些实施例中,肿瘤抗原是由正常细胞和癌细胞两者表达的标记,例如谱系标记,例如b细胞上的cd19。在一些实施例中,肿瘤抗原是与正常细胞相比在癌细胞中过表达的细胞表面分子,例如,与正常细胞相比,1倍过表达、2倍过表达、3倍过表达或更多。在一些实施例中,肿瘤抗原是在癌细胞中不适当合成的细胞表面分子,例如,与正常细胞上表达的分子相比含有缺失、添加或突变的分子。在一些实施例中,肿瘤抗原将仅在癌细胞的细胞表面上完全或作为片段(例如,mhc/肽)表达,并且不在正常细胞的表面上合成或表达。在一些实施例中,本发明的car包括包含结合mhc呈递的肽的抗原结合结构域(例如抗体或抗体片段)的car。通常,源自内源性蛋白质的肽填充主要组织相容性复合物(mhc)i类分子的口袋,并且被cd8+t淋巴细胞上的t细胞受体(tcr)识别。mhci类复合物由所有有核细胞组成型表达。在癌症中,病毒特异性和/或肿瘤特异性肽/mhc复合物代表用于免疫疗法的独特类别的细胞表面靶标。已经描述了在人白细胞抗原(hla)-a1或hla-a2的上下文中靶向源自病毒或肿瘤抗原的肽的tcr样抗体(参见,例如,sastry等人,jvirol.[病毒学杂志]201185(5):1935-1942;sergeeva等人,blood[血液],2011117(16):4262-4272;verma等人,jimmunol[免疫学杂志]2010184(4):2156-2165;willemsen等人,genether[基因疗法]20018(21):1601-1608;dao等人,scitranslmed[科学转化医学]20135(176):176ra33;tassev等人,cancergenether[癌基因疗法]201219(2):84-100)。例如,可以从筛选文库(如人scfv噬菌体展示文库)鉴定tcr样抗体。术语“支持肿瘤的抗原”或“支持癌症的抗原”可互换地指在细胞表面上表达的分子(典型地是蛋白质、碳水化合物或脂质),该细胞本身不是癌性的、但例如通过促进其生长或存活、例如对免疫细胞的抗性而支持癌细胞。这种类型的示例性细胞包括基质细胞和骨髓源性的抑制细胞(mdsc)。支持肿瘤的抗原本身不需要在支持肿瘤细胞中发挥作用,只要该抗原存在于支持癌细胞的细胞上。术语“b细胞抗原(bcellantigen”或“b-cellantigen)”可互换使用,并且是指在可以用与其结合的药剂靶向的b细胞表面上优先id并且特异性表达的分子(典型地是蛋白、碳水化合物或脂质)。与哺乳动物的其他非b细胞组织相比,特别感兴趣的b细胞抗原优先在b细胞上表达。b细胞抗原可以在一个具体的b细胞群体上表达,例如b细胞前体或成熟b细胞,或在多于一个具体b细胞群体上表达,例如前体b细胞和成熟b细胞两者。示例性b细胞表面标记包括:cd5、cd10、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd27、cd30、cd34、cd37、cd38、cd40、cd53、cd69、cd72、cd73、cd74、cd75、cd77、cd79a、cd79b、cd80、cd81、cd82、cd83、cd84、cd85、cd86、cd123、cd135、cd138、cd179、cd269、flt3、ror1、bcma、fcrn5、fcrn2、cs-1、cxcr4、cxcr5、cxcr7、il-7/3r、il7/4/3r、和il4r。特别优选的b细胞抗原包括:cd19、cd20、cd22、fcrn5、fcrn2、bcma、cs-1和cd138。在实施例中,b细胞抗原是cd19。在实施例中,b细胞抗原是cd20。在实施例中,b细胞抗原是cd22。在实施例中,b细胞抗原是bcma。在实施例中,b细胞抗原是fcrn5。在实施例中,b细胞抗原是fcrn2。在实施例中,b细胞抗原是cs-1。在实施例中,b细胞抗原是cd138。术语“实体瘤抗原”或“实体瘤细胞抗原”是指在可以用与其结合的药剂靶向的实体瘤细胞表面上优先并且特异性表达的分子(典型地是蛋白、碳水化合物或脂质)。与哺乳动物的其他非瘤组织相比,特别感兴趣的实体瘤抗原优先在实体瘤细胞上表达。实体瘤抗原可以在一个具体实体瘤细胞群体上表达,例如在间皮瘤肿瘤细胞上表达,或在多于一个具体实体瘤细胞群体上表达,例如在间皮瘤肿瘤细胞和卵巢癌细胞两者上表达。示例性实体瘤抗原包括:egfrviii、间皮素、gd2、tnag、psma、tag72、cd44v6、cea、epcam、kit、il-13ra2、leguman、gd3、cd171、il-11ra、psca、mad-ct-1、mad-ct-2、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、叶酸受体α、erbb(例如erbb2)、her2/neu、muc1、egfr、ncam、肝配蛋白b2、caix、lmp2、sle、hmwmaa、o-乙酰基-gd2、叶酸受体β、tem1/cd248、tem7r、fap、legumain、hpve6或e7、ml-iap、cldn6、tshr、gprc5d、alk、多唾液酸、fos相关抗原、嗜中性粒细胞弹性蛋白酶、trp-2、cyp1b1、精子蛋白17、β人绒毛膜促性腺激素、afp、甲状腺球蛋白、plac1、globoh、rage1、mn-caix、人端粒酶逆转录酶、肠羧基酯酶、muthsp70-2、na-17、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、or51e2、tarp、gfrα4和mhc上呈递的这些抗原的任一个的肽。特别优选的实体瘤抗原包括:cldn6、间皮素和egfrviii。术语“髓系肿瘤抗原”或“髓系肿瘤细胞抗原”是指在可以用与其结合的药剂靶向的髓系肿瘤细胞表面上优先并且特异性表达的分子(典型地是蛋白、碳水化合物或脂质)。与哺乳动物的其他非瘤组织相比,特别感兴趣的髓系肿瘤抗原优先在髓系肿瘤细胞上表达。髓系肿瘤抗原可以在一个具体髓系肿瘤细胞群体上表达,例如在急性骨髓性白血病(aml)肿瘤细胞上表达,或在多于一个具体髓系肿瘤细胞群体上表达。示例性髓系肿瘤抗原包括:cd123、cd33和cll-1。如在scfv的情况下中使用的术语“柔性多肽接头”或“接头”是指由单独或组合使用的氨基酸(如甘氨酸和/或丝氨酸)残基组成的肽接头,以将可变重链和可变轻链区连接在一起。在一个实施例中,柔性多肽接头是gly/ser接头并且包含氨基酸序列(gly-gly-gly-ser)n,其中n是等于或大于1的正整数(seqidno:44)。例如,n=1,n=2,n=3,n=4,n=5,以及n=6,n=7,n=8,n=9,以及n=10。在一个实施例中,柔性多肽接头包括但不限于(gly4ser)4(seqidno:45)或(gly4ser)3(seqidno:46)。在另一个实施例中,接头包括(gly2ser)、(glyser)或(gly3ser)(seqidno:44)的多个重复。wo2012/138475中描述的接头也被包括在本发明的范围内,将该文献通过引用并入本文。如本文所用,5'帽(也称为rna帽、rna7-甲基鸟苷帽或rnam7g帽)是已经在转录开始后不久添加到真核信使rna的“前”端或5'端的经修饰的鸟嘌呤核苷酸。5'帽由与第一转录核苷酸连接的末端基团组成。它的存在对于被核糖体识别和被保护免于rna酶至关重要。帽添加与转录偶联,并且共转录地发生,使得每个都影响另一个。在转录开始后不久,合成的mrna的5'端被与rna聚合酶相关的帽合成复合物结合。这种酶复合物催化mrna加帽所需的化学反应。合成作为多步生物化学反应进行。可以修饰加帽部分以调制mrna的功能,如其稳定性或翻译效率。如本文所用,“体外转录的rna”是指已在体外合成的rna,优选mrna。通常,体外转录的rna由体外转录载体产生。体外转录载体包含用于产生体外转录的rna的模板。如本文所用,“瞬时”是指非整合转基因的持续数小时、数天或数周的表达,其中表达的时间段小于在整合到基因组中或包含在宿主细胞中的稳定质粒复制子内的情况下基因的表达的时间段。如本文所用,术语“治疗(treat、treatment和treating)”是指由于一种或多种疗法的施用而产生的增殖性障碍的进展、严重性和/或持续时间的减轻或改善,或者增殖性障碍的一种或多种症状(优选地,一种或多种可辨别的症状)的改善。在具体的实施例中,术语“治疗(treat、treatment和treating)”是指改善增殖性障碍的至少一种可测量的物理参数,如肿瘤的生长,这不一定是患者可辨别的。在其他实施例中,术语“治疗(treat、treatment和treating)”是指通过例如稳定可辨别的症状来物理地,或通过例如稳定物理参数来生理地,或通过两者,抑制增殖性障碍的进展。在其他实施例中,术语“治疗(treat、treatment和treating)”是指减少或稳定肿瘤大小或癌细胞计数。术语“信号转导途径”是指在多种信号转导分子之间的生物化学关系,这些信号转导分子在信号从细胞的部分传递至细胞的另一部分中发挥作用。短语“细胞表面受体”包括能够接收信号并且传递信号跨过细胞膜的分子以及分子复合物。术语“受试者”旨在包括可以在其中引发免疫应答的活生物体(例如,哺乳动物、人)。术语“基本上纯化的”细胞是指本质上不含其他细胞类型的细胞。基本上纯化的细胞还指已经与其天然存在状态下正常相关的其他细胞类型分离的细胞。在一些情况下,基本上纯化的细胞群体是指同质的细胞群体。在其他情况下,该术语仅指已经与其天然状态下天然相关的细胞分离的细胞。在一些方面,在体外培养细胞。在其他方面,不在体外培养细胞。如本文所用的术语“治疗剂”意指治疗。通过减少、抑制、缓解或根除疾病状态来获得治疗效果。如本文所用的术语“预防”意指对疾病或疾病状态的预防或保护性治疗。在本发明的上下文中,“肿瘤抗原”或“过度增殖性障碍抗原”或“与过度增殖性障碍相关的抗原”是指特异性过度增殖性障碍常见的抗原。在某些方面,本发明的过度增殖性障碍抗原衍生自癌症,包括但不限于原发性或转移性黑素瘤、胸腺瘤、淋巴瘤、肉瘤、肺癌、肝癌、非霍奇金淋巴瘤、霍奇金淋巴瘤、白血病、子宫癌、宫颈癌、膀胱癌、肾癌和腺癌(例如乳腺癌、前列腺癌、卵巢癌、胰腺癌等)。术语“转染的”或“转化的”或“转导的”是指将外源核酸转移或引入宿主细胞中的过程。“转染的”或“转化的”或“转导的”细胞是已用外源核酸转染、转化或转导的细胞。细胞包括原代主体细胞及其子代。术语“特异性地结合”是指识别样品中存在的结合配偶体(例如,肿瘤抗原)蛋白并与其结合的抗体或配体,但该抗体或配体基本上不识别或结合样品中的其他分子。当该术语在本文中使用时,“膜锚”或“膜系链结构域”是指足以将细胞外或细胞内结构域锚定到质膜的多肽或部分(例如肉豆蔻酰基)。“膜蛋白”意指包含跨膜结构域的蛋白,并且当在靶细胞上表达时,被锚定在细胞膜中,或传过细胞膜。术语“cd3ε”是指t细胞表面糖蛋白cd3ε链。swiss-prot登录号p07766提供了示例性的人cd3ε氨基酸序列。示例性人cd3ε氨基酸序列如seqidno:77所提供。在实施例中,cd3ε是swiss-prot登录号p07766中提供的序列的功能变体或片段,或seqidno:77的序列。在本文中,cd3ε还可以被称为cd3e。术语“cd3δ”是指t细胞表面糖蛋白cd3δ链。swiss-prot登录号p04234提供了示例性的人cd3δ氨基酸序列。示例性人cd3δ氨基酸序列如seqidno:82所提供。在实施例中,cd3δ是swiss-prot登录号p04234中提供的序列的功能变体或片段,或seqidno:82的序列。在本文中,cd3δ还可以被称为cd3d。术语“cd3γ”是指t细胞表面糖蛋白cd3γ链。swiss-prot登录号p09693提供了示例性的人cd3γ氨基酸序列。示例性人cd3γ氨基酸序列如seqidno:87所提供。在实施例中,cd3γ是swiss-prot登录号p09693中提供的序列的功能变体或片段,或seqidno:87的序列。在本文中,cd3γ还可以被称为cd3g。“cd3δ、γ、或ε结构域”意指源自cd3δ、cd3γ、或cd3ε,并且至少保留了其内源活性的结构域。如本文所用,“系统”是指一组嵌合膜蛋白,例如两种嵌合膜蛋白。在一些实施例中,嵌合膜蛋白中的每一个包含抗原结合结构域、源自tcr的组分的结构域(例如源自cd3γ、cd3δ、或ε的结构域)、和跨膜结构域。在一些实施例中,嵌合膜蛋白中的一个或多个进一步包含共刺激结构域。本发明的组合物和方法涵盖具有指定序列,或与其基本上相同或相似的序列,例如与指定序列具有至少85%、90%或95%同一性或更高同一性的序列的多肽和核酸。在氨基酸序列的语境中,术语“基本上相同”在本文中用于指第一氨基酸序列含有足够或最小数量的氨基酸残基,这些氨基酸残基i)与第二氨基酸序列中的比对氨基酸残基相同,或ii)是第二氨基酸序列中比对的氨基酸残基的保守置换,以使得第一氨基酸序列和第二氨基酸序列可以具有共同结构域和/或共同功能活性,例如含有与参考序列(例如,本文提供的序列)具有至少约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性的共同结构域的氨基酸序列。在核苷酸序列的语境中,术语“基本上相同”在本文中用于指第一核酸序列含有足够或最小数量的核苷酸,这些核苷酸与第二核酸序列中的比对核苷酸相同,以使得第一核苷酸序列和第二核苷酸序列编码具有共同功能活性的多肽,或编码共同结构多肽域或共同功能多肽活性,例如与参考序列(例如,本文提供的序列)具有至少约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性的核苷酸序列。术语“变体”是指具有与参考氨基酸序列基本上相同的氨基酸序列,或由基本上相同的核苷酸序列编码的多肽。在一些实施例中,变体是功能性变体。术语“功能性变体”是指具有与参考氨基酸序列基本上相同的氨基酸序列,或由基本上相同的核苷酸序列编码,并且能够具有参考氨基酸序列的一种或多种活性的多肽。术语“信号传导结构域”是指蛋白质的功能性部分,其通过在细胞内传递信息以通过产生第二信使或通过响应于此类信使而用作效应子,经由定义的信号传导途径调控细胞活性起作用。“细胞内共刺激结构域”意指共刺激分子的细胞内部分。共刺激分子可以在以下蛋白质家族中表示:tnf受体蛋白、免疫球蛋白样蛋白、细胞因子受体、整联蛋白、信号传导淋巴细胞活化分子(slam蛋白)和活化型nk细胞受体。此类分子的实例包括cd27、cd28、4-1bb(cd137)、ox40、gitr、cd30、cd40、icos、baffr、hvem、icam-1、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cds、cd7、cd287、light、nkg2c、nkg2d、slamf7、nkp80、nkp30、nkp44、nkp46、cd160、b7-h3、以及与cd83特异性地结合的配体等。细胞内信号传导结构域可以包含衍生它的分子的整个细胞内部分或整个天然细胞内信号传导结构域,或其功能片段或衍生物。“源自”(当该术语在本文中使用时)表示第一分子和第二分子之间的关系。它通常是指第一分子和第二分子之间的结构相似性,并不暗示或包括对源自第二分子的第一分子的过程或来源的限制。例如,在源自cd3ε分子的细胞外结构域的情况下,细胞外结构域保留足够的cd3ε结构,使得其具有所需的功能,即在适当条件下产生信号的能力。它没有暗示或包括对产生细胞外结构域的特定过程的限制,例如,它并不意指为了提供细胞外结构域,必须从cd3ε序列开始并删除不需要的序列,或强加突变,以到达细胞外结构域。“细胞外结构域”意指在细胞外表达的跨膜蛋白的结构域。“二聚化结构域”意指以组成型方式或诱导型方式结合同源二聚化结构域的结构域。此类同源二聚化结构域可以与初始二聚化结构域相同或相似(“同源二聚化结构域”),或对于初始二聚化结构域是异源的(“异源二聚化结构域”)。在其中结构域组成型二聚化的情况下,将典型地发生此类二聚化,其条件是这两种结构域都在同一细胞区室中表达。在其中结构域诱导型二聚化的情况下,仅将在“二聚化分子”存在的情况下,发生此类二聚化。当该术语在本文中使用时,“二聚化分子”是指促进第一二聚化结构域与第二二聚化结构域缔合的分子。在实施例中,二聚化分子不在受试者中天然发生,或者不以导致显著二聚化的浓度发生。在实施例中,二聚化分子是小分子,例如雷帕霉素(rapamycin)或rapalogue,例如rad001。如本文所用,术语“抗原结合结构域”是指能够结合第二多肽的多肽。此类抗原结合结构域包括抗体分子。此外,术语“抗原结合结构域”还包括不源自抗体分子的多肽(例如天然地结合同源多肽或分子(包括受体蛋白的细胞外结构域)的多肽)。如本文所用,术语“抗体分子”是指包含至少一种免疫球蛋白可变结构域序列的免疫球蛋白链或其片段。术语“抗体分子”涵盖抗体和抗体片段。在一个实施例中,抗体分子是多特异性抗体分子,例如其包含多个免疫球蛋白可变结构域序列,其中该多个中的第一免疫球蛋白可变结构域序列对第一表位具有结合特异性并且该多个中的第二免疫球蛋白可变结构域序列对第二表位具有结合特异性。在一个实施例中,多特异性抗体分子是双特异性抗体分子。双特异性抗体对不多于两种抗原具有特异性。双特异性抗体分子的特征在于具有对第一表位的结合特异性的第一免疫球蛋白可变结构域序列、和具有对第二表位的结合特异性的第二免疫球蛋白可变结构域序列。包含抗体或其抗体片段的本发明的嵌合蛋白的部分可以按多种形式存在,其中抗原结合结构域表达为连续多肽链的一部分,该连续多肽链包括例如单结构域抗体片段(sdab)、单链抗体(scfv)、人源化抗体或双特异性抗体(harlow等人,1999:usingantibodies:alaboratorymanual[使用抗体:实验室手册],coldspringharborlaboratorypress[冷泉港实验室出版社],纽约;harlow等人,1989:antibodies:alaboratorymanual[抗体:实验室手册],coldspringharbor[冷泉港],纽约;houston等人,1988,proc.natl.acad.sci.usa[美国国家科学院院刊]85:5879-5883;bird等人,1988,science[科学]242:423-426)。在一个方面,本发明的组合物的抗原结合结构域包含抗体片段。在另一个方面,蛋白包含含有scfv的抗体片段。抗体或其抗体片段可以按多种形式存在,其中抗原结合结构域表达为连续多肽链的一部分,该连续多肽链包括例如单结构域抗体片段(sdab)、单链抗体(scfv)、人源化抗体或双特异性抗体(harlow等人,1999:usingantibodies:alaboratorymanual[使用抗体:实验室手册],coldspringharborlaboratorypress[冷泉港实验室出版社],纽约;harlow等人,1989:antibodies:alaboratorymanual[抗体:实验室手册],coldspringharbor[冷泉港],纽约;houston等人,1988,proc.natl.acad.sci.usa[美国国家科学院院刊]85:5879-5883;bird等人,1988,science[科学]242:423-426)。在一个方面,本发明的抗原结合结构域包含抗体片段。在另一个方面,蛋白包含含有scfv的抗体片段。给定cdr的精确氨基酸序列边界可以使用许多熟知的方案中的任一种来确定,包括以下中所述的那些:kabat等人(1991),“sequencesofproteinsofimmunologicalinterest[免疫学兴趣的蛋白质序列],”第5版.publichealthservice[公共卫生服务],nationalinstitutesofhealth[国立卫生研究院],bethesda,md(“卡巴特(kabat)”编号方案);al-lazikani等人,(1997)jmb273,927-948(“乔西亚(chothia)”编号方案),或其组合。术语“scfv”是指融合蛋白,其包含至少一个包含轻链可变区的抗体片段和至少一个包含重链可变区的抗体片段,其中该轻链可变区和重链可变区例如通过合成接头(例如短柔性多肽接头)是连续连接的并且能够表达为单链多肽,并且其中scfv保留了它所来源的完整抗体的特异性。除非另有说明,否则如本文所用,scfv可以例如相对于多肽的n末端和c末端以任何顺序具有vl和vh可变区,该scfv可以包含vl-接头-vh或者可以包含vh-接头-vl。术语“4-1bb”是指具有作为genbank登录号aaa62478.2,或来自非人物种(例如小鼠、啮齿动物、猴、猿等)的等效残基提供的氨基酸序列的tnfr超家族的成员;并且“4-1bb共刺激结构域”定义为genbank登录号aaa62478.2的氨基酸残基214-255,或来自非人物种(例如小鼠、啮齿动物、猴、猿等)的等效残基。在一个方面,“4-1bb共刺激结构域”是如本文提供的序列,或来自非人物种例如小鼠、啮齿动物、猴子、猿等的等同残基。术语“生物等效的”是指产生与参考剂量或参考量的参考化合物(例如,rad001)产生的效果等同的效果所需的除参考化合物(例如,rad001)之外的药剂的量。在一个实施例中,该效果是mtor抑制水平,例如,如通过p70s6激酶抑制测量的,例如,如在体内或体外测定中评估的,例如,如通过本文描述的测定法(例如boulay测定法)测量的。在一个实施例中,效果是如通过细胞分选测量的pd-1阳性/pd-1阴性t细胞比例的改变。在一个实施例中,mtor抑制剂的生物等效量或剂量是实现与参考化合物的参考剂量或参考量相同水平的p70s6激酶抑制的量或剂量。在一个实施例中,mtor抑制剂的生物等效量或剂量是实现与参考化合物的参考剂量或参考量相同水平的pd-1阳性/pd-1阴性t细胞比例改变的量或剂量。当与mtor抑制剂(例如变构mtor抑制剂,例如rad001或雷帕霉素,或催化性mtor抑制剂)联合使用时,术语“低免疫增强剂量”是指mtor抑制剂部分但不是完全抑制mtor活性的剂量,例如,如通过p70s6激酶活性的抑制测量的。本文讨论了用于评价mtor活性的方法,例如通过抑制p70s6激酶。剂量不足以导致完全免疫抑制,但足以增强免疫应答。在一个实施例中,mtor抑制剂的低免疫增强剂量导致pd-1阳性t细胞数目的减少和/或pd-1阴性t细胞数目的增加,或pd-1阴性t细胞/pd-1阳性t细胞的比率的增加。在一个实施例中,低免疫增强剂量的mtor抑制剂导致初始t细胞的数目增加。在一个实施例中,低免疫增强剂量的mtor抑制剂导致以下中的一个或多个:以下标记中的一个或多个例如在记忆t细胞(例如,记忆t细胞前体)上的表达增加:cd62l高、cd127高、cd27+和bcl2;klrg1在例如记忆t细胞(例如,记忆t细胞前体)上的表达减少;以及记忆t细胞前体,例如具有以下特征中的任一个或组合的细胞的数目增加:增加的cd62l高、增加的cd127高、增加的cd27+、减少的klrg1、和增加的bcl2;其中,例如,与未治疗的受试者相比,例如至少瞬时地发生上述任何变化。如本文所用的“难治性”是指对治疗无应答的疾病,例如癌症。在实施例中,难治性癌症可以在治疗开始之前或治疗开始时对治疗具有抗性。在其他实施例中,难治性癌症可能在治疗期间变得有抗性。难治性癌症也称为抗性癌症。如本文所用的“复发”是指疾病(例如,癌症)或疾病的体征和症状(如改善期之后,例如在疗法(例如癌症疗法)的先前治疗后的癌症)的回返。范围:贯穿本披露内容,能以范围形式呈现本发明的各个方面。应该理解的是,范围形式的描述仅仅是为了方便以及简洁,不应该被理解为对本发明范围的不灵活的限制。因此,范围的描述应当被认为是具有确切披露的所有可能的子范围以及该范围内的单独数值。例如,范围如从1至6的描述应当被认为是具有确切披露的子范围,如从1至3、从1至4、从1至5、从2至4、从2至6、从3至6等,以及该范围内的单独数字,例如1、2、2.7、3、4、5、5.3、和6。作为另一个实例,范围如95%-99%同一性包括具有95%、96%、97%、98%或99%同一性,并且包括如96%-99%、96%-98%、96%-97%、97%-99%、97%-98%和98%-99%同一性的子范围。无论范围的宽度如何,这都适用。描述本文提供了用于使用经本发明的嵌合蛋白工程化的免疫效应细胞(例如t细胞、nk细胞)治疗疾病例如癌症的物质的组合物和使用方法。本发明的各种组分的一些实例的序列列于表1中,其中aa代表氨基酸,并且na代表编码相应肽的核酸。表1.car的各种组分的序列(aa-氨基酸,na-编码相应蛋白质的核酸)癌症相关抗原本发明提供了免疫效应细胞(例如,t细胞、nk细胞),这些免疫效应细胞被工程化为含有一种或多种嵌合蛋白,该一种或多种嵌合蛋白将免疫效应细胞引导至癌症。这通过蛋白上的抗原结合结构域实现,该抗原结合结构域对癌症相关抗原具有特异性。存在两类可以通过本发明的蛋白靶向的癌症相关抗原(肿瘤抗原):(1)在癌细胞表面上表达的癌症相关抗原;和(2)本身在细胞内的癌症相关抗原,然而,这种抗原(肽)的片段通过mhc(主要组织相容性复合物)呈递在癌细胞的表面上。因此,本发明提供了靶向以下癌症相关抗原(肿瘤抗原)的蛋白:cd19、cd123、cd22、cd30、cd171、cs-1、cll-1(clecl1)、cd33、egfrviii、gd2、gd3、bcma、tnag、psma、ror1、flt3、fap、tag72、cd38、cd44v6、cea、epcam、b7h3、kit、il-13ra2、间皮素、il-11ra、psca、vegfr2、lewisy、cd24、pdgfr-β、prss21、ssea-4、cd20、叶酸受体α、erbb2(her2/neu)、muc1、egfr、ncam、前列腺酶、pap、elf2m、肝配蛋白b2、igf-i受体、caix、lmp2、gp100、bcr-abl、酪氨酸酶、epha2、岩藻糖基gm1、sle、gm3、tgs5、hmwmaa、o-乙酰基-gd2、叶酸受体β、tem1/cd248、tem7r、cldn6、tshr、gprc5d、cxorf61、cd97、cd179a、alk、聚唾液酸、plac1、globoh、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、or51e2、tarp、wt1、ny-eso-1、lage-1a、legumain、hpve6、e7、mage-a1、magea1、etv6-aml、精子蛋白17、xage1、tie2、mad-ct-1、mad-ct-2、fos相关抗原1、p53、p53突变体、前列腺特异性蛋白、存活素和端粒酶、pcta-1/半乳凝素8、melana/mart1、ras突变体、htert、肉瘤易位断点、ml-iap、erg(tmprss2ets融合基因)、na17、pax3、雄性激素受体、细胞周期蛋白b1、mycn、rhoc、trp-2、cyp1b1、boris、sart3、pax5、oy-tes1、lck、akap-4、ssx2、rage-1、人端粒酶逆转录酶、ru1、ru2、肠道羧基酯酶、muthsp70-2、cd79a、cd79b、cd72、lair1、fcar、lilra2、cd300lf、clec12a、bst2、emr2、ly75、gpc3、fcrl5、以及igll1。在实施例中,本发明提供了靶向以下b细胞抗原的蛋白:cd5、cd10、cd19、cd20、cd21、cd22、cd23、cd24、cd25、cd27、cd30、cd34、cd37、cd38、cd40、cd53、cd69、cd72、cd73、cd74、cd75、cd77、cd79a、cd79b、cd80、cd81、cd82、cd83、cd84、cd85、cd86、cd123、cd135、cd138、cd179、cd269、flt3、ror1、bcma、fcrn5、fcrn2、cs-1、cxcr4、cxcr5、cxcr7、il-7/3r、il7/4/3r、和il4r。特别优选的b细胞抗原包括:cd19、cd20、cd22、fcrn5、fcrn2、bcma、cs-1和cd138。在实施例中,本发明提供了靶向以下实体瘤抗原的蛋白:egfrviii、间皮素、gd2、tnag、psma、tag72、cd44v6、cea、epcam、kit、il-13ra2、leguman、gd3、cd171、il-11ra、psca、mad-ct-1、mad-ct-2、vegfr2、lewisy、cd24、pdgfr-β、ssea-4、叶酸受体α、erbb(例如erbb2)、her2/neu、muc1、egfr、ncam、肝配蛋白b2、caix、lmp2、sle、hmwmaa、o-乙酰基-gd2、叶酸受体β、tem1/cd248、tem7r、fap、legumain、hpve6或e7、ml-iap、cldn6、tshr、gprc5d、alk、多唾液酸、fos相关抗原、嗜中性粒细胞弹性蛋白酶、trp-2、cyp1b1、精子蛋白17、β人绒毛膜促性腺激素、afp、甲状腺球蛋白、plac1、globoh、rage1、mn-caix、人端粒酶逆转录酶、肠羧基酯酶、muthsp70-2、na-17、ny-br-1、upk2、havcr1、adrb3、panx3、gpr20、ly6k、or51e2、tarp、gfrα4和mhc上呈递的这些抗原的任一个的肽。特别优选的实体瘤抗原包括:cldn6、间皮素和egfrviii。本文描述的嵌合蛋白可以包含结合至支持肿瘤的抗原(例如,如本文描述的支持肿瘤的抗原)的抗原结合结构域(例如,抗体或抗体片段,tcr或tcr片段)。在一些实施例中,该支持肿瘤的抗原是存在于基质细胞或骨髓源性抑制细胞(mdsc)上的抗原。基质细胞可以分泌生长因子以促进微环境中的细胞分裂。mdsc细胞可以抑制t细胞增殖和活化。在实施例中,基质细胞抗原选自以下中的一种或多种:骨髓基质细胞抗原2(bst2)、成纤维细胞活化蛋白(fap)和腱生蛋白。在一个实施例中,fap特异性抗体是西罗珠单抗,与西罗珠单抗竞争结合,或具有与西罗珠单抗相同的cdr。在实施例中,mdsc抗原选自以下中的一种或多种:cd33、cd11b、c14、cd15和cd66b。因此,在一些实施例中,该支持肿瘤的抗原选自以下中的一种或多种:骨髓基质细胞抗原2(bst2)、成纤维细胞活化蛋白(fap)或腱生蛋白、cd33、cd11b、c14、cd15、以及cd66b。如将从本披露所理解的那样,本发明的系统、细胞和其他方面包含多于一个抗原结合结构域,使得靶向多于一个抗原。可以通过利用包含靶向所述多于一个抗原的组合的抗原结合结构域的系统,靶向本文描述的抗原中的任一者的组合。本发明的嵌合蛋白本发明的特征在于一种或多种嵌合蛋白。通常,本发明的特征在于包含cd3δ、γ、或ε的细胞外结构域的全部或功能部分的第一嵌合膜蛋白。这些嵌合蛋白可以进一步包含以下中的一个或多个:抗原结合结构域、细胞内共刺激结构域、和/或二聚化结构域。在某些实施例中,例如其中第一嵌合分子并不包含抗原结合结构域的情况下,本发明的特征在于第二嵌合膜蛋白:此蛋白具有细胞外抗原结合结构域和二聚化结构域。任选地,第二蛋白可以进一步包含细胞内共刺激结构域(无论第一嵌合蛋白是否具有这样一个结构域)。可替代地,第二嵌合蛋白可以包含结合第一嵌合蛋白的结构域(例如细胞外结构域或细胞内结构域)的结构域和共刺激结构域、抗原结合结构域、或两者。抗原结合结构域在一个方面,本发明的某些嵌合蛋白包含靶标特异性结合元件,在其他方面称为抗原结合结构域。部分的选择取决于限定靶细胞表面的配体的类型和数目。例如,可以选择抗原结合结构域以识别在与特定疾病状态相关的靶细胞上充当细胞表面标记的配体。因此,可以作为本发明的蛋白中的抗原结合结构域的配体的细胞表面标记的实例包括与病毒、细菌和寄生虫感染、自身免疫疾病和癌细胞相关的那些。抗原结合结构域可以是与抗原结合的任何结构域,包括但不限于单克隆抗体、多克隆抗体、重组抗体、人抗体、人源化抗体、及其功能片段,包括但不限于单结构域抗体(如骆驼来源的纳米抗体的重链可变结构域(vh)、轻链可变结构域(vl)、和可变结构域(vhh)),以及本领域已知的用作抗原结合结构域的可替代支架(如重组纤连蛋白结构域等)、t细胞受体(tcr)或其片段(例如,单链tcr)等。在一个实施例中,针对cd22的抗原结合结构域是描述于例如以下中的抗体的抗原结合部分(例如cdr):haso等人,blood[血液],121(7):1165-1174(2013);wayne等人,clincancerres[临床癌症研究]16(6):1894-1903(2010);kato等人,leukres[白血病研究]37(1):83-88(2013);creativebiomart(creativebiomart.net):mom-18047-s(p)。在一个实施例中,针对cs-1的抗原结合结构域是埃罗妥珠单抗(elotuzumab)(bms)的抗原结合部分(例如cdr),参见例如,tai等人,2008,blood[血液]112(4):1329-37;tai等人,2007,blood.[血液]110(5):1656-63。在一个实施例中,针对cll-1的抗原结合结构域是可从r&d公司、ebiosciences公司、abcam公司获得的抗体的抗原结合部分(例如cdr),该抗体例如pe-cll1-hu目录号353604(biolegend公司);和pe-cll1(clec12a)目录号562566(bd)。在一个实施例中,针对cd33的抗原结合结构域是描述于例如以下中的抗体的抗原结合部分(例如cdr):bross等人,clincancerres[临床癌症研究]7(6):1490-1496(2001)(吉妥珠单抗奥佐米星,hp67.6);caron等人,cancerres[癌症研究]52(24):6761-6767(1992)(林妥珠单抗,hum195);lapusan等人,investnewdrugs[新药物研究]30(3):1121-1131(2012)(ave9633);aigner等人,leukemia[白血病]27(5):1107-1115(2013)(amg330,cd33bite);dutour等人,advhematol[血液学进展]2012:683065(2012);以及pizzitola等人,leukemia[白血病]doi:10.1038/lue.2014.62(2014)。在一个实施例中,针对gd2的抗原结合结构域是描述于例如以下中的抗体的抗原结合部分(例如cdr):mujoo等人,cancerres[癌症研究]47(4):1098-1104(1987);cheung等人,cancerres[癌症研究]45(6):2642-2649(1985),cheung等人,jclinoncol[临床肿瘤学杂志]5(9):1430-1440(1987),cheung等人,jclinoncol[临床肿瘤学杂志]16(9):3053-3060(1998),handgretinger等人,cancerimmunolimmunother[癌症免疫学和免疫疗法]35(3):199-204(1992)。在一些实施例中,针对gd2的抗原结合结构域是选自以下项的抗体的抗原结合部分:mab14.18、14g2a、ch14.18、hu14.18、3f8、hu3f8、3g6、8b6、60c3、10b8、me36.1、和8h9,参见例如wo2012033885、wo2013040371、wo2013192294、wo2013061273、wo2013123061、wo2013074916、和wo201385552。在一些实施例中,针对gd2的抗原结合结构域是美国公开号20100150910或pct公开号wo2011160119中描述的抗体的抗原结合部分。在一个实施例中,针对bcma的抗原结合结构域是描述于例如wo2012163805、wo200112812、和wo2003062401中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对tn抗原的抗原结合结构域是描述于例如以下中的抗体的抗原结合部分(例如cdr):us8,440,798;brooks等人,pnas[美国国家科学院院刊]107(22):10056-10061(2010);以及stone等人,oncoimmunology[肿瘤免疫学]1(6):863-873(2012)。在一个实施例中,针对psma的抗原结合结构域是描述于例如parker等人,proteinexprpurif[蛋白质表达和纯化]89(2):136-145(2013);us20110268656(j591scfv);frigerio等人,europeanjcancer[欧洲癌症杂志]49(9):2223-2232(2013)(scfvd2b);wo2006125481(mab3/a12、3/e7和3/f11)中的抗体以及单链抗体片段(scfva5和d7)的抗原结合部分(例如cdr)。在一个实施例中,针对ror1的抗原结合结构域是描述于例如以下中的抗体的抗原结合部分(例如cdr):hudecek等人,clincancerres[临床癌症研究]19(12):3153-3164(2013);wo2011159847;和us20130101607。在一个实施例中,针对flt3的抗原结合结构域是描述于例如wo2011076922、us5777084、ep0754230、us20090297529中的抗体以及几种商业目录抗体(r&d公司、ebiosciences公司、abcam公司)的抗原结合部分(例如cdr)。在一个实施例中,针对tag72的抗原结合结构域是描述于例如hombach等人,gastroenterology[肠胃病学]113(4):1163-1170(1997)中的抗体以及abcamab691的抗原结合部分(例如cdr)。在一个实施例中,针对fap的抗原结合结构域是描述于例如ostermann等人,clinicalcancerresearch[临床癌症研究]14:4584-4592(2008)(fap5);美国专利公开号2009/0304718;西罗珠单抗(参见例如,hofheinz等人,oncologyresearchandtreatment[肿瘤学研究和治疗]26(1),2003);以及tran等人,jexpmed[实验医学杂志]210(6):1125-1135(2013)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对cd38的抗原结合结构域是达雷木单抗(daratumumab)(参见例如,groen等人,blood[血液]116(21):1261-1262(2010));mor202(参见例如,us8,263,746);或描述于us8,362,211中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对cd44v6的抗原结合结构域是描述于例如casucci等人,blood[血液]122(20):3461-3472(2013)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对cea的抗原结合结构域是描述于例如chmielewski等人,gastoenterology[肠胃病学]143(4):1095-1107(2012)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对epcam的抗原结合结构域是选自以下的抗体的抗原结合部分(例如cdr):mt110、epcam-cd3双特异性ab(参见例如clinicaltrials.gov/ct2/show/nct00635596);依决洛单抗;3622w94;ing-1;和阿德木单抗(mt201)。在一个实施例中,针对prss21的抗原结合结构域是描述于美国专利号8,080,650中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对b7h3的抗原结合结构域是抗体mga271(宏观基因公司(macrogenics)公司)的抗原结合部分(例如cdr)。在一个实施例中,针对kit的抗原结合结构域是描述于例如us7915391、us20120288506中的抗体和几种商业目录抗体的抗原结合部分(例如cdr)。在一个实施例中,针对il-13ra2的抗原结合结构域是描述于例如wo2008/146911、wo2004087758中的抗体、几种商业目录抗体和wo2004087758中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对cd30的抗原结合结构域是描述于例如us7090843b1和ep0805871中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对gd3的抗原结合结构域是描述于例如以下中的抗体的抗原结合部分(例如cdr):us7253263;us8,207,308;us20120276046;ep1013761;wo2005035577;以及us6437098。在一个实施例中,针对cd171的抗原结合结构域是描述于例如hong等人,jimmunother[免疫疗法杂志]37(2):93-104(2014)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对il-11ra的抗原结合结构域是可从abcam公司(目录号ab55262)或罗福斯生物制剂公司(novusbiologicals)(目录号epr5446)获得的抗体的抗原结合部分(例如cdr)。在另一个实施例中,针对il-11ra的抗原结合结构域是肽,参见例如huang等人,cancerres[癌症研究]72(1):271-281(2012)。在一个实施例中,针对psca的抗原结合结构域是描述于例如以下中的抗体的抗原结合部分(例如cdr):morgenroth等人,prostate[前列腺]67(10):1121-1131(2007)(scfv7f5);nejatollahi等人.,jofoncology[肿瘤学杂志]2013(2013),文章id839831(scfvc5-ii);和美国专利公开号20090311181。在一个实施例中,针对vegfr2的抗原结合结构域是描述于例如chinnasamy等人,jclininvest[临床研究杂志]120(11):3953-3968(2010)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对lewisy的抗原结合结构域是描述于例如以下中的抗体的抗原结合部分(例如cdr):kelly等人,cancerbiotherradiopharm[癌症生物治疗和放射性药物]23(4):411-423(2008)(hu3s193ab(scfvs));dolezal等人,proteinengineering[蛋白质工程]16(1):47-56(2003)(nc10scfv)。在一个实施例中,针对cd24的抗原结合结构域是描述于例如maliaretal.,gastroenterology[肠胃病学]143(5):1375-1384(2012)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对pdgfr-β的抗原结合结构域是抗体abcamab32570的抗原结合部分(例如cdr)。在一个实施例中,针对ssea-4的抗原结合结构域是抗体mc813(cellsignaling公司)或其他市售抗体的抗原结合部分(例如cdr)。在一个实施例中,针对cd20的抗原结合结构域是抗体利妥昔单抗、奥法木单抗、奥瑞珠单抗、维妥珠单抗或ga101的抗原结合部分(例如cdr)。在一个实施例中,针对叶酸受体α的抗原结合结构域是抗体imgn853或描述于us20120009181、us4851332、lk26:us5952484中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对erbb2(her2/neu)的抗原结合结构域是抗体曲妥珠单抗或帕妥珠单抗的抗原结合部分(例如cdr)。在一个实施例中,针对muc1的抗原结合结构域是抗体sar566658的抗原结合部分(例如cdr)。在一个实施例中,针对egfr的抗原结合结构域是抗体西妥昔单抗、帕尼单抗、扎鲁木单抗、尼妥珠单抗或马妥珠单抗的抗原结合部分(例如cdr)。在一个实施例中,针对ncam的抗原结合结构域是抗体克隆2-2b:mab5324(emd密理博公司(emdmillipore))的抗原结合部分(例如cdr)。在一个实施例中,针对肝配蛋白b2的抗原结合结构域是描述于例如abengozar等人,blood[血液]119(19):4565-4576(2012)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对igf-i受体的抗原结合结构域是描述于例如us8344112b2、ep2322550a1、wo2006/138315或pct/us2006/022995中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对caix的抗原结合结构域是抗体克隆303123(r&d系统公司(r&dsystems)的抗原结合部分(例如cdr)。在一个实施例中,针对lmp2的抗原结合结构域是描述于例如us7,410,640或us20050129701中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对gp100的抗原结合结构域是抗体hmb45、nkiβb或描述于wo2013165940或us20130295007中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对酪氨酸酶的抗原结合结构域是描述于例如us5843674或us19950504048中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对epha2的抗原结合结构域是描述于例如yu等人,molther[分子疗法]22(1):102-111(2014)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对gd3的抗原结合结构域是描述于例如以下中的抗体的抗原结合部分(例如cdr):us7253263;us8,207,308;us20120276046;ep1013761a3;20120276046、wo2005035577;或us6437098。在一个实施例中,针对岩藻糖基gm1的抗原结合结构域是描述于例如us20100297138或wo2007/067992中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对sle的抗原结合结构域是抗体g193(对于lewisy)的抗原结合部分(例如cdr),参见scottam等人,cancerres[癌症研究]60:3254-61(2000),也如neeson等人,jimmunol[免疫学杂志]2013年5月190(会议摘要补充)177.10中所描述。在一个实施例中,针对gm3的抗原结合结构域是抗体ca2523449(mab14f7)的抗原结合部分(例如cdr)。在一个实施例中,针对hmwmaa的抗原结合结构域是描述于例如以下中的抗体的抗原结合部分(例如cdr):kmiecik等人,oncoimmunology[肿瘤免疫学]3(1):e27185(2014)(pmid:24575382)(mab9.2.27);us6528481;wo2010033866;或us20140004124。在一个实施例中,针对o-乙酰基-gd2的抗原结合结构域是抗体8b6的抗原结合部分(例如cdr)。在一个实施例中,针对tem1/cd248的抗原结合结构域是描述于例如以下中的抗体的抗原结合部分(例如cdr):marty等人,cancerlett[癌症快报]235(2):298-308(2006);zhao等人,jimmunolmethods[免疫法杂志]363(2):221-232(2011)。在一个实施例中,针对cldn6的抗原结合结构域是抗体imab027(咖尼米德制药公司(ganymedpharmaceuticals))的抗原结合部分(例如cdr),参见例如clinicaltrial.gov/show/nct02054351。在一个实施例中,针对tshr的抗原结合结构域是描述于例如us8,603,466、us8,501,415或us8,309,693中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对gprc5d的抗原结合结构域是抗体fab6300a(r&d系统公司);或ls-a4180(lifespanbiosciences公司)的抗原结合部分(例如cdr)。在一个实施例中,针对cd97的抗原结合结构域是描述于例如us6,846,911、degroot等人,jimmunol[免疫学杂志]183(6):4127-4134(2009)中的抗体或来自r&d:mab3734的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对alk的抗原结合结构域是描述于例如mino-kenudson等人,clincancerres[临床癌症研究]16(5):1561-1571(2010)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对聚唾液酸的抗原结合结构域是描述于例如nagae等人,jbiolchem[生物化学杂志]288(47):33784-33796(2013)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对plac1的抗原结合结构域是描述于例如ghods等人,biotechnolapplbiochem[生物化学生物技术应用]2013doi:10.1002/bab.1177中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对globoh的抗原结合结构域是以下的抗原结合部分(例如cdr):抗体vk9;或描述于例如kudryashovv等人,glycoconjj.[糖缀合物杂志]15(3):243-9(1998),lou等人,procnatlacadsciusa[美国国家科学院院刊]111(7):2482-2487(2014)中的抗体;mbr1:bremere-g等人jbiolchem[生物化学杂志]259:14773–14777(1984)。在一个实施例中,针对ny-br-1的抗原结合结构域是描述于例如jager等人,applimmunohistochemmolmorphol[应用免疫组织化学分子形态学]15(1):77-83(2007)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对wt-1的抗原结合结构域是描述于例如dao等人,scitranslmed[科学转化医学]5(176):176ra33(2013)或wo2012/135854中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对mage-a1的抗原结合结构域是描述于例如willemsen等人,jimmunol[免疫学杂志]174(12):7853-7858(2005)(tcr样scfv)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对精子蛋白17的抗原结合结构域是描述于例如song等人,targetoncol[靶标肿瘤学]2013年8月14日(pmid:23943313);song等人,medoncol[医学肿瘤学]29(4):2923-2931(2012)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对tie2的抗原结合结构域是抗体ab33(细胞信号传导技术公司(cellsignalingtechnology))的抗原结合部分(例如cdr)。在一个实施例中,针对mad-ct-2的抗原结合结构域是描述于例如pmid:2450952、us7635753中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对fos相关抗原1的抗原结合结构域是抗体12f9(罗福斯生物制剂公司(novusbiologicals))的抗原结合部分(例如cdr)。在一个实施例中,针对melana/mart1的抗原结合结构域是描述于ep2514766a2或us7,749,719中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对肉瘤易位断点的抗原结合结构域是描述于例如luo等人,embomol.med.[embo分子医学]4(6):453-461(2012)中的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对trp-2的抗原结合结构域是描述于例如wang等人,jexpmed.[实验医学杂志]184(6):2207-16(1996)中的抗体的抗原结合部分,例如cdr。在一个实施例中,针对cyp1b1的抗原结合结构域是描述于例如maecker等人,blood[血液]102(9):3287-3294(2003)中的抗体的抗原结合部分,例如cdr。在一个实施例中,针对rage-1的抗原结合结构域是抗体mab5328(emd密理博公司(emdmillipore))的抗原结合部分,例如cdr。在一个实施例中,针对人端粒酶逆转录酶的抗原结合结构域是抗体目录号ls-b95-100(lifespanbiosciences公司)的抗体的抗原结合部分(例如cdr)。在一个实施例中,针对肠羧基酯酶的抗原结合结构域是抗体4f12:目录号ls-b6190-50(lifespanbiosciences公司)的抗原结合部分(例如cdr)。在一个实施例中,针对muthsp70-2的抗原结合结构域是抗体lifespanbiosciences:单克隆:目录号ls-c133261-100(lifespanbiosciences公司)的抗原结合部分(例如cdr)。在一个实施例中,针对cd79a的抗原结合结构域是以下的抗原结合部分(例如cdr):抗体抗cd79a[hm47/a9](ab3121),可从abcam公司获得;抗体cd79a抗体#3351,可从细胞信号传导技术公司(cellsignallingtechnology)获得;或在兔中产生的抗体hpa017748-抗cd79a抗体,可从西格玛奥德里奇公司(sigmaaldrich)获得。在一个实施例中,针对cd79b的抗原结合结构域是以下的抗原结合部分(例如cdr):抗体维汀-珀拉妥珠单抗(polatuzumabvedotin);描述于dornan等人,“therapeuticpotentialofananti-cd79bantibody-drugconjugate,anti-cd79b-vc-mmae,forthetreatmentofnon-hodgkinlymphoma[抗cd79b抗体-药物缀合物、抗cd79b-vc-mmae用于治疗非霍奇金淋巴瘤的治疗潜力]”blood.[血液]2009年9月24日;114(13):2721-9.doi:10.1182/blood-2009-02-205500.电子版2009年7月24日中的抗cd79b;或描述于“4507pre-clinicalcharacterizationoftcell-dependentbispecificantibodyanti-cd79b/cd3asapotentialtherapyforbcellmalignancies[t细胞依赖性双特异性抗体抗cd79b/cd3作为b细胞恶性肿瘤的潜在疗法的4507临床前表征]”abstractsof56thashannualmeetingandexposition[第56届ash年会和博览会摘要],旧金山,加利福利亚州2014年12月6日-9日中的双特异性抗体抗cd79b/cd3。在一个实施例中,针对cd72的抗原结合结构域是以下的抗原结合部分(例如cdr):描述于myers,和uckun,“ananti-cd72immunotoxinagainsttherapy-refractoryb-lineageacutelymphoblasticleukemia.[针对治疗难治性b谱系急性成淋巴细胞性白血病的抗cd72免疫毒素]”leuklymphoma.[白血病和淋巴瘤]1995年6月;18(1-2):119-22中的抗体j3-109;或描述于polson等人,“antibody-drugconjugatesforthetreatmentofnon–hodgkin'slymphoma:targetandlinker-drugselection[用于治疗非霍奇金淋巴瘤的抗体-药物缀合物:靶标和接头-药物选择]”cancerres[癌症研究]2009年3月15日69;2358中的抗cd72(10d6.8.1,migg1)。在一个实施例中,针对lair1的抗原结合结构域是可从prospec公司获得的抗体ant-301lair1抗体或可从biolegend公司获得的抗人cd305(lair1)抗体的抗原结合部分(例如cdr)。在一个实施例中,针对fcar的抗原结合结构域是可从sinobiological公司获得的抗体cd89/fcar抗体(目录号10414-h08h)的抗原结合部分(例如cdr)。在一个实施例中,针对lilra2的抗原结合结构域是可从亚诺法(abnova)公司获得的抗体lilra2单克隆抗体(m17),克隆3c7;或可从lifespanbiosciences公司获得的小鼠抗lilra2抗体,单克隆(2d7)的抗原结合部分(例如cdr)。在一个实施例中,针对cd300lf的抗原结合结构域是可从biolegend公司获得的抗体小鼠抗cmrf35样分子1抗体,单克隆[up-d2];或可从r&d系统公司获得的大鼠抗cmrf35样分子1抗体,单克隆[234903]的抗原结合部分(例如cdr)。在一个实施例中,针对clec12a的抗原结合结构域是描述于noordhuis等人,“targetingofclec12ainacutemyeloidleukemiabyantibody-drug-conjugatesandbispecificcll-1xcd3biteantibody[通过抗体-药物-缀合物和双特异性cll-1xcd3bite抗体靶向急性骨髓性白血病中的clec12a]”53rdashannualmeetingandexposition[第53届ash年会和博览会],2011年12月10-13中的抗体双特异性t细胞衔接器(bite)scfv-抗体和adc,以及mcla-117(梅鲁斯公司(merus))的抗原结合部分(例如cdr)。在一个实施例中,针对bst2(也称为cd317)的抗原结合结构域是可从抗体在线(antibodies-online)获得的抗体小鼠抗cd317抗体,单克隆[3h4]或可从r&d系统公司获得的小鼠抗cd317抗体,单克隆[696739]的抗原结合部分(例如cdr)。在一个实施例中,针对emr2(也称为cd312)的抗原结合结构域是可从lifespanbiosciences公司获得的抗体小鼠抗cd312抗体,单克隆[ls-b8033]或可从r&d系统公司获得的小鼠抗cd312抗体,单克隆[494025]的抗原结合部分(例如cdr)。在一个实施例中,针对ly75的抗原结合结构域是可从emd密理博公司(emdmillipore)获得的抗体小鼠抗淋巴细胞抗原75抗体,单克隆[hd30]或可从生命科技公司(lifetechnologies)获得的小鼠抗淋巴细胞抗原75抗体,单克隆[a15797]的抗原结合部分(例如cdr)。在一个实施例中,针对gpc3的抗原结合结构域是以下的抗原结合部分(例如cdr):描述于nakanok,ishigurot,konishih,等人generationofahumanizedanti-glypican3antibodybycdrgraftingandstabilityoptimization[通过cdr移植和稳定性优化产生人源化抗磷脂酰肌醇蛋白聚糖3抗体].anticancerdrugs.[抗癌药物]2010年11月;21(10):907–916中的抗体hgc33;或mdx-1414、hn3或yp7,这三者全部都描述于feng等人,“glypican-3antibodies:anewtherapeutictargetforlivercancer[磷脂酰肌醇蛋白聚糖3抗体:肝癌的新治疗靶标].”febslett.[欧洲生化学会联合会快报]2014年1月21日;588(2):377-82中。在一个实施例中,针对fcrl5的抗原结合结构域是描述于elkins等人,“fcrl5asatargetofantibody-drugconjugatesforthetreatmentofmultiplemyeloma[fcrl5作为用于治疗多发性骨髓瘤的抗体-药物缀合物的靶标]”molcancerther.[分子癌症治疗]2012oct;11(10):2222-32中的抗fcrl5抗体的抗原结合部分(例如cdr)。在一个实施例中,针对igll1的抗原结合结构域是以下抗体的抗原结合部分(例如cdr):可从lifespanbiosciences公司获得的抗体小鼠抗免疫球蛋白λ样多肽1,单克隆[at1g4];可从biolegend公司获得的小鼠抗免疫球蛋白λ样多肽1抗体,单克隆[hsl11]。在一个实施例中,抗原结合结构域包含来自上文列出的抗体的一个、两个、三个(例如全部三个)重链cdr(hccdr1、hccdr2和hccdr3),和/或来自与上文列出的抗体的一个、两个、三个(例如全部三个)轻链cdr(lccdr1、lccdr2和lccdr3)。在一个实施例中,抗原结合结构域包含上文列出抗体的重链可变区和/或可变轻链区。在另一方面,抗原结合结构域包含人源化抗体或抗体片段。在一些方面,非人抗体是人源化的,其中抗体的特定序列或区域被修饰以增加与在人中天然产生的抗体或其片段的相似度。在一个方面,抗原结合结构域是人源化的。可以使用本领域已知的多种技术产生人源化抗体,这些技术包括但不限于cdr-移植(参见例如,欧洲专利号ep239,400;国际公开号wo91/09967;和美国专利号5,225,539、5,530,101和5,585,089,将该文献每一个通过引用以其整体并入本文)、饰面或表面重修(参见例如,欧洲专利号ep592,106和ep519,596;padlan,1991,molecularimmunology[分子免疫学],28(4/5):489-498;studnicka等人,1994,proteinengineering[蛋白质工程],7(6):805-814;以及roguska等人,1994,pnas,91:969-973,将该文献每一个通过引用以其整体并入本文)、链改组(参见例如,美国专利号5,565,332,将该文献通过引用以其整体并入本文)、和披露于例如以下中的技术:美国专利申请公开号us2005/0042664,美国专利申请公开号us2005/0048617,美国专利号6,407,213,美国专利号5,766,886,国际公开号wo9317105,tan等人,j.immunol.[免疫学杂志],169:1119-25(2002),caldas等人,proteineng.[蛋白质工程],13(5):353-60(2000),morea等人,methods[方法],20(3):267-79(2000),baca等人,j.biol.chem.[生物化学杂志],272(16):10678-84(1997),roguska等人,proteineng.[蛋白质工程],9(10):895-904(1996),couto等人,cancerres.[癌症研究],55(23增刊):5973s-5977s(1995),couto等人,cancerres.[癌症研究],55(8):1717-22(1995),sandhujs,gene[基因],150(2):409-10(1994),以及pedersen等人,j.mol.biol.[分子生物学杂志],235(3):959-73(1994),将这些文献中的每一个通过引用以其整体并入本文。通常,框架区中的框架残基将被来自cdr供体抗体的相应残基取代,以改变例如改善抗原结合。这些框架取代是通过本领域熟知的方法来鉴定,例如,通过对cdr和框架残基的相互作用建模以鉴定对抗原结合和序列比较而言重要的框架残基,以鉴定特定位置处的异常框架残基。(参见例如,queen等人,美国专利号5,585,089;以及riechmann等人,1988,nature[自然],332:323,将这些文献通过引用以其整体并入本文。)人源化抗体或抗体片段具有保留于其中的来自非人来源的一个或多个氨基酸残基。这些非人氨基酸残基通常称为“输入”残基,这些残基典型地取自“输入”可变结构域。如本文提供的,人源化抗体或抗体片段包含来自非人免疫球蛋白分子的一个或多个cdr和框架区,其中构成框架的氨基酸残基完全或大部分衍生自人种系。用于将抗体或抗体片段人源化的多种技术在本领域中是熟知的,并且基本上可以按照winter和同事的方法进行(jones等人,nature[自然],321:522-525(1986);riechmann等人,nature[自然],332:323-327(1988);verhoeyen等人,science[科学],239:1534-1536(1988)),该方法是通过用啮齿动物cdr或cdr序列取代人抗体的相应序列,即cdr-移植(ep239,400;pct公开号wo91/09967;和美国专利号4,816,567、6,331,415、5,225,539、5,530,101、5,585,089、6,548,640,将这些文献的内容通过引用以其整体并入本文)。在此类人源化抗体和抗体片段中,实质上少于完整的人可变结构域已被来自非人物种的相应序列取代。人源化抗体通常是人抗体,其中一些cdr残基和可能的一些框架(fr)残基被来自啮齿动物抗体中类似位点的残基取代。抗体和抗体片段的人源化也可以通过饰面或表面重修来实现(ep592,106;ep519,596;padlan,1991,molecularimmunology[分子免疫学],28(4/5):489-498;studnicka等人,proteinengineering[蛋白质工程],7(6):805-814(1994);和roguska等人,pnas,91:969-973(1994))或链改组(美国专利号5,565,332),将这些文献的内容通过引用以其整体并入本文。用于制备人源化抗体的人可变结构域(轻链和重链两者)的选择是降低抗原性。根据所谓的“最佳拟合”方法,针对已知的人可变结构域序列的整个文库筛选啮齿动物抗体的可变结构域的序列。然后接受与啮齿动物的序列最接近的人序列作为人源化抗体的人框架(fr)(sims等人,j.immunol.[免疫学杂志],151:2296(1993);chothia等人,j.mol.biol.[分子生物学杂志],196:901(1987),将这些文献的内容通过引用以其整体并入本文)。另一种方法采用衍生自具有特定亚组轻链或重链的全部人类抗体的共有序列的特定框架。相同的框架可用于几种不同的人源化抗体(参见例如nicholson等人mol.immun.[分子免疫学]34(16-17):1157-1165(1997);carter等人,proc.natl.acad.sci.usa[美国国家科学院院刊],89:4285(1992);presta等人,j.immunol.[免疫学杂志],151:2623(1993),将这些文献的内容通过引用以其整体并入本文)。在一些实施例中,重链可变区的框架区(例如全部四个框架区)源自vh4_4-59种系序列。在一个实施例中,框架区可以包括一个、两个、三个、四个或五个修饰,例如来自相应鼠序列处的氨基酸的取代。在一个实施例中,轻链可变区的框架区(例如全部四个框架区)源自vk3_1.25种系序列。在一个实施例中,框架区可以包括一个、两个、三个、四个或五个修饰,例如来自相应鼠序列处的氨基酸的取代。在一些方面,抗体片段的是人源化的,其保留对靶抗原的高亲和力和其他有利的生物学特性。根据本发明的一个方面,通过使用亲本和人源化序列的三维模型分析亲本序列和各种概念性人源化产物的方法制备人源化抗体和抗体片段。三维免疫球蛋白模型通常是可获得的并且是本领域技术人员所熟悉的。计算机程序可用于说明和显示所选候选免疫球蛋白序列的可能的三维构象结构。检查这些展示允许分析残基在候选免疫球蛋白序列的功能发挥中的可能作用,例如,分析影响候选免疫球蛋白结合靶抗原的能力的残基。以这种方式,可以从受体和输入序列中选择和组合fr残基,使得实现所希望的抗体或抗体片段特征,如对靶抗原的增加的亲和力。通常,cdr残基直接且最实质地参与影响抗原结合。人源化抗体或抗体片段可保留与原始抗体相似的抗原特异性,例如,在本发明中结合如本文描述的癌症相关抗原的能力。在一些实施例中,人源化抗体或抗体片段可具有改善的与如本文描述的人癌症相关抗原结合的亲和力和/或特异性。在一个方面,本发明的抗原结合结构域的特征在于抗体或抗体片段的特定功能特征或特性。例如,在一个方面,抗原结合结构域特异性结合如本文描述的肿瘤抗原。在一个方面,抗如本文描述的癌症相关抗原的结合结构域是片段,例如单链可变片段(scfv)。在一个方面,抗如本文描述的癌症相关抗原的结合结构域是fv、fab、(fab')2或双功能(例如双特异性)杂合抗体(例如,lanzavecchia等人,eur.j.immunol.[欧洲免疫学杂志]17,105(1987))。在一个方面,本发明的抗体及其片段以野生型或增强的亲和力结合如本文描述的癌症相关抗原蛋白。在一些情况下,可以根据本领域已知的方法制备scfv(参见例如,bird等人,(1988)science[科学]242:423-426和huston等人,(1988)proc.natl.acad.sci.usa[美国国家科学院院刊]85:5879-5883)。可以通过使用柔性多肽接头将vh和vl区连接在一起来产生scfv分子。scfv分子包含具有优化的长度和/或氨基酸组成的接头(例如,ser-gly接头)。接头长度可以极大地影响scfv的可变区折叠和相互作用的方式。事实上,如果采用短多肽接头(例如,在5-10个氨基酸之间),则可以防止链内折叠。还需要链间折叠以将两个可变区组合在一起以形成功能性表位结合位点。对于接头取向和大小的实例,参见例如,hollinger等人1993procnatlacad.sci.u.s.a.[美国国家科学院院刊]90:6444-6448、美国专利申请公开号2005/0100543、2005/0175606、2007/0014794、和pct公开号wo2006/020258以及wo2007/024715,这些专利通过援引并入本文。scfv可以在其vl与vh区之间包含具有至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、或更多个氨基酸残基的接头。接头序列可以包含任何天然存在的氨基酸。在一些实施例中,接头序列包含氨基酸甘氨酸和丝氨酸。在另一个实施例中,接头序列包含甘氨酸和丝氨酸重复序列组,如(gly4ser)n,其中n为等于或大于1的正整数(seqidno:52)。在一个实施例中,接头可以是(gly4ser)4(seqidno:45)或(gly4ser)3(seqidno:46)。接头长度的变化可以保留或增强活性,从而在活性研究中产生优异的功效。在另一个方面,抗原结合结构域是t细胞受体(“tcr”)或其片段,例如单链tcr(sctcr)。用于制备此类tcr的方法是本领域中已知的。参见例如willemsenra等人,genetherapy[基因疗法]7:1369–1377(2000);zhangt等人,cancergenether[癌症基因疗法]11:487–496(2004);aggen等人,genether.[基因疗法]19(4):365-74(2012)(将参考文献以其整体并入本文)。例如,sctcr可以工程化为含有来自通过接头(例如柔性肽)连接的t细胞克隆的vα和vβ基因。此途径对于本身在细胞内的癌症相关靶标非常有用,然而,这种抗原(肽)的片段通过mhc呈递在癌细胞的表面上。cd19抗原结合结构域在一些实施例中,本文披露的抗原结合结构域结合cd19(例如人cd19)(“cd19抗原结合结构域”)。在一个实施例中,cd19抗原结合结构域具有与描述于nicholson等人mol.immun.[分子免疫学]34(16-17):1157-1165(1997)中的fmc63scfv片段相同或相似的结合特异性。在一个实施例中,cd19抗原结合结构域包含在nicholson等人mol.immun.[分子免疫学]34(16-17):1157-1165(1997)(将其内容通过引用并入本文)中描述的scfv片段。在一个实施例中,cd19抗原结合结构域包含pct公开wo2012/079000(将其内容通过引用并入本文)中描述的抗原结合结构域(例如car19构建体的抗原结合结构域),或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列。在一个实施例中,cd19抗原结合结构域包含根据wo2014/153270(将其内容通过引用并入本文)的表3所述的抗原结合结构域(例如人源抗原结合结构域),或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列。对于临床环境,鼠cd19抗体的人源化可以是所希望的,其中小鼠特异性残基在接受cart19治疗(即,用car19构建体转导的t细胞治疗)的患者中可以诱导人-抗-小鼠抗原(hama)应答。人源化cd19car序列的产生、表征和功效描述于国际申请wo2014/153270中,将该文献通过引用以其整体并入本文,包括实例1-5(第115-159页)。wo2014/153270还描述了测定各种cd19抗原结合结构域构建体的结合和功效的方法。在一个实施例中,cd19抗原结合结构域包含seqidno:104的氨基酸序列(或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列)。diqmtqttsslsaslgdrvtiscrasqdiskylnwyqqkpdgtvklliyhtsrlhsgvpsrfsgsgsgtdysltisnleqediatyfcqqgntlpytfgggtkleitggggsggggsggggsevklqesgpglvapsqslsvtctvsgvslpdygvswirqpprkglewlgviwgsettyynsalksrltiikdnsksqvflkmnslqtddtaiyycakhyyyggsyamdywgqgtsvtvss(seqidno:104)bcma抗原结合结构域在一些实施例中,本文披露的抗原结合结构域结合bcma(例如人bcma)(“bcma抗原结合结构域”)。示例性bcma抗原结合结构域可以包括wo2016/014565(将其内容通过引用并入本文)的表1或16中披露的序列,或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列。在一个实施例中,bcma抗原结合结构域包含wo2016/014565中披露的bcma-1、bcma-2、bcma-3、bcma-4、bcma-5、bcma-6、bcma-7、bcma-8、bcma-9、bcma-10、bcma-11、bcma-12、bcma-13、bcma-14、bcma-15、149362、149363、149364、149365、149366、149367、149368、149369、bcma_ebb-c1978-a4、bcma_ebb-c1978-g1、bcma_ebb-c1979-c1、bcma_ebb-c1978-c7、bcma_ebb-c1978-d10、bcma_ebb-c1979-c12、bcma_ebb-c1980-g4、bcma_ebb-c1980-d2、bcma_ebb-c1978-a10、bcma_ebb-c1978-d4、bcma_ebb-c1980-a2、bcma_ebb-c1981-c3、bcma_ebb-c1978-g4、a7d12.2、c11d5.3、c12a3.2、或c13f12.1的一个或多个cdr、vh、vl、或scfv,或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列。另外的示例性bcma抗原结合结构域披露于wo2017/021450、wo2017/011804、wo2017/025038、wo2016/090327、wo2016/130598、wo2016/210293、wo2016/090320、wo2016/014789、wo2016/094304、wo2016/154055、wo2015/166073、wo2015/188119、wo2015/158671、us9,243,058、us8,920,776、us9,273,141、us7,083,785、us9,034,324、us2007/0049735、us2015/0284467、us2015/0051266、us2015/0344844、us2016/0131655、us2016/0297884、us2016/0297885、us2017/0051308、us2017/0051252、us2017/0051252、wo2016/020332、wo2016/087531、wo2016/079177、wo2015/172800、wo2017/008169、us9,340,621、us2013/0273055、us2016/0176973、us2015/0368351、us2017/0051068、us2016/0368988、和us2015/0232557中,将其内容通过引用并入本文。在一些实施例中,使用来自pct公开wo2012/0163805(将该公开的内容通过引用以其整体特此并入)的vh和vl序列产生另外的示例性bcma抗原结合结构域。cd20抗原结合结构域在一些实施例中,本文披露的抗原结合结构域结合cd20(例如人cd20)(“cd20抗原结合结构域”)。在一些实施例中,cd20抗原结合结构域包括根据wo2016/164731和pct/us2017/055627(将其内容通过引用并入本文)所述的抗原结合结构域。示例性cd20抗原结合结构域披露于例如pct/us2017/055627的表1-5中。在一些实施例中,cd20抗原结合结构域包含pct/us2017/055627或wo2016/164731中披露的cd20抗原结合结构域的cdr、可变区、或scfv序列,或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列。cd22抗原结合结构域在一些实施例中,本文披露的抗原结合结构域结合cd22(例如人cd22)(“cd22抗原结合结构域”)。在一些实施例中,cd22抗原结合结构域包括根据wo2016/164731和pct/us2017/055627(将其内容通过引用并入本文)所述的抗原结合结构域。示例性cd22抗原结合结构域披露于例如wo2016/164731的表6a、6b、7a、7b、7c、8a、8b、9a、9b、10a和10b中,以及pct/us2017/055627的表6-10中。在一些实施例中,cd22抗原结合结构域包含pct/us2017/055627或wo2016/164731中披露的cd22抗原结合结构域的cdr、可变区、或scfv序列,或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列。egfr抗原结合结构域在一些实施例中,本文披露的抗原结合结构域结合egfr(例如人egfr,例如egfrviii)(“egfrviii抗原结合结构域”)。在一些实施例中,egfrviii抗原结合结构域包括根据wo2014/130657(将其内容通过引用并入本文)所述的抗原结合结构域。示例性egfrviii抗原结合结构域披露于例如wo2014/130657的表2中。在一些实施例中,egfrviii抗原结合结构域包含wo2014/130657中披露的egfrviii抗原结合结构域的cdr、可变区、或scfv序列,或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列。间皮素抗原结合结构域在一些实施例中,本文披露的抗原结合结构域结合间皮素(例如人间皮素)(“间皮素抗原结合结构域”)。在一些实施例中,间皮素抗原结合结构域包括根据wo2015090230和wo2017112741(将其内容通过引用并入本文)所述的抗原结合结构域。示例性间皮素抗原结合结构域披露于例如wo2017112741的表2、3、4、和5中。在一些实施例中,间皮素抗原结合结构域包含wo2015090230和wo2017112741中披露的间皮素抗原结合结构域的cdr、可变区、或scfv序列,或与其具有至少约85%、90%、95%、99%或更大同一性的序列,和/或具有一个、两个、三个或更多个取代、插入或缺失,例如保守取代的序列。跨膜结构域关于跨膜结构域,在各种实施例中,嵌合蛋白可以设计为包含附接至嵌合蛋白的细胞外结构域的跨膜结构域。跨膜结构域可以包括与跨膜区相邻的一个或多个另外的氨基酸,例如与跨膜来源的蛋白质的细胞外区域相关的一个或多个氨基酸(例如该细胞外区域的1、2、3、4、5、6、7、8、9、10至15个氨基酸)和/或与跨膜蛋白来源的蛋白质的细胞内区域相关的一个或多个另外的氨基酸(例如该细胞内区域的1、2、3、4、5、6、7、8、9、10至15个氨基酸)。在一个方面,跨膜结构域是与嵌合分子的其他结构域之一相关的结构域,例如,在一个实施例中,跨膜结构域可以来自衍生出信号传导结构域、共刺激结构域、铰链结构域、或细胞外结构域的相同蛋白质。在另一个方面,跨膜结构域不源自嵌合蛋白的任何其他结构域源自的相同蛋白质。在一个方面,跨膜结构域可以是重组的,在这种情况下其将主要包含疏水性残基,如亮氨酸和缬氨酸。在一个方面,可以在重组跨膜结构域的每个末端处发现苯丙氨酸、色氨酸和缬氨酸的三联体。胞质结构域初级信号传导结构域以刺激方式或以抑制方式调控tcr复合物的初级活化。以刺激方式起作用的初级细胞内信号传导结构域可以含有被称为基于免疫受体酪氨酸的活化基序或itam的信号传导基序。含有在本发明中特别使用的初级细胞内信号传导结构域的itam的实例包括以下的那些:cd3ζ、常见fcrγ(fcer1g)、fcγriia、fcrβ(fcεr1b)、cd3γ、cd3δ、cd3ε、cd79a、cd79b、dap10、以及dap12。在一个实施例中,本发明的car包含细胞内信号传导结构域,例如cd3-ζ的初级信号传导结构域。在一个实施例中,初级信号传导结构域包含修饰的itam结构域,例如与天然itam结构域相比具有改变的(例如,增加或减少的)活性的突变itam结构域。在一个实施例中,初级信号传导结构域包含含有修饰的itam的初级细胞内信号传导结构域,例如含有优化的和/或截短的itam的初级细胞内信号传导结构域。在一个实施例中,初级信号传导结构域包含一个、两个、三个、四个或更多个itam基序。共刺激信号传导结构域是指car的包含共刺激分子的细胞内结构域的部分。共刺激分子是除了抗原受体或其配体之外的细胞表面分子,是淋巴细胞对抗原的有效应答所必需的。此类分子的实例包括cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3和特异性地结合cd83的配体等。例如,已证明cd27共刺激可增强体外人cart细胞的扩增、效应子功能、和存活,并增加体内人t细胞持久性和抗肿瘤活性(song等人blood.[血液]2012、119(3):696-706)。此类共刺激分子的其他实例包括cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、nkp44、nkp30、nkp46、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(tactile)、nkg2d、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、和cd19a。可调节的嵌合抗原受体在一些实施例中,希望car活性可控制的可调节car(rcar)以优化car疗法的安全性和功效。可以通过多种方式调节car活性。例如,使用例如与二聚化结构域融合的半胱天冬酶的诱导型细胞凋亡(参见,例如,di等人,negnl.j.med.[新英格兰医学杂志]2011年11月3日;365(18):1673-1683)可用作本发明的car疗法中的安全开关。在一个方面,rcar包含一组多肽,典型地在最简单的实施例中有两个,其中本文描述的标准car的组分(例如,抗原结合结构域和细胞内信号传导结构域)在分开的多肽或成员上分配。在一些实施例中,该组多肽包括二聚化开关,该二聚化开关在存在二聚化分子时可以将多肽彼此偶联,例如,可以将抗原结合结构域偶联至细胞内信号传导结构域。二聚化开关二聚化开关可以是非共价的或共价的。在非共价二聚化开关中,二聚化分子促进开关结构域之间的非共价相互作用。在共价二聚化开关中,二聚化分子促进开关结构域之间的共价相互作用。在一个实施例中,rcar包含基于fkbp/frap或基于fkbp/frb的二聚化开关。fkbp12(fkbp或fk506结合蛋白)是丰富的胞质蛋白,该胞质蛋白充当天然产物免疫抑制药物(雷帕霉素)的初始细胞内靶标。雷帕霉素结合至fkbp和大型pi3k同源物frap(raft,mtor)。frb是frap的93个氨基酸部分,该氨基酸部分足以结合fkbp-雷帕霉素复合物(chen,j.,zheng,x.f.,brown,e.j.和schreiber,s.l.(1995)identificationofan11-kdafkbp12-rapamycin-bindingdomainwithinthe289-kdafkbp12-rapamycin-associatedproteinandcharacterizationofacriticalserineresidue[鉴定289-kdafkbp12-雷帕霉素相关的蛋白内的11-kdafkbp12-雷帕霉素结合结构域并表征关键的丝氨酸残基].procnatlacadsciusa[美国国家科学院院刊]92:4947-51)。在实施例中,基于fkbp/frap(例如fkbp/frb)的开关可以使用二聚化分子,例如雷帕霉素或雷帕霉素类似物。fkbp的氨基酸序列如下:dvpdyaslggpsspkkkrkvsrgvqvetispgdgrtfpkrgqtcvvhytgmledgkkfdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellkletsy(seqidno:53)在实施例中,fkbp开关结构域可包含在雷帕霉素或类似物存在下具有与frb或其片段或类似物结合的能力的fkbp片段,例如下划线部分,其是:vqvetispgdgrtfpkrgqtcvvhytgmledgkkfdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellklets(seqidno:54)frb的氨基酸序列如下:ilwhemwhegleeasrlyfgernvkgmfevleplhammergpqtlketsfnqaygrdlmeaqewcrkymksgnvkdltqawdlyyhvfrrisk(seqidno:55)在实施例中,fkbp/frb二聚化开关包含经修饰的frb开关结构域,该经修饰的frb开关结构域在基于frb的开关结构域(例如,经修饰的frb开关结构域、基于fkbp的开关结构域)与二聚化分子(例如,雷帕霉素或rapalogue,例如rad001)之间表现出改变的(例如增强的)复合物形成。在一个实施例中,经修饰的frb开关结构域包含一个或多个(例如2、3、4、5、6、7、8、9、10个或更多个)突变,这些突变选自一个或多个氨基酸位置l2031、e2032、s2035、r2036、f2039、g2040、t2098、w2101、d2102、y2105和f2108的突变,其中野生型氨基酸突变为任何其他天然存在的氨基酸。在一个实施例中,突变体frb包含e2032处的突变,其中e2032突变为苯丙氨酸(e2032f)、甲硫氨酸(e2032m)、精氨酸(e2032r)、缬氨酸(e2032v)、酪氨酸(e2032y)、异亮氨酸(e2032i)、或亮氨酸(e2032l)。在一个实施例中,突变体frb包含t2098处的突变,其中t2098突变为苯丙氨酸(t2098f)或亮氨酸(t2098l)。在一个实施例中,突变体frb包含e2032和t2098处的突变,其中e2032突变为任何氨基酸,并且其中t2098突变为任何氨基酸。在一个实施例中,突变体frb包含e2032i和t2098l突变。在一个实施例中,突变体frb包含e2032l和t2098l突变。表10.示例性突变体frb对二聚化分子具有增加的亲和力。其他合适的二聚化开关包括基于gyrb-gyrb的二聚化开关、基于赤霉素的二聚化开关、标签/粘合剂二聚化开关、和卤素标签/快速标签二聚化开关。按照本文提供的指导,此类开关和相关的二聚化分子对于普通技术人员将是显而易见的。二聚化分子通过二聚化分子来促进开关结构域之间的缔合。在二聚化分子存在下,开关结构域之间的相互作用或结合允许在与第一开关结构域缔合(例如,融合)的多肽和与第二开关结构域缔合(例如,融合)的多肽之间进行信号转导。在非限制性水平的二聚化分子存在下,例如,如在本文描述的系统中,信号转导增加了1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、5、10、50、100倍。雷帕霉素和雷帕霉素类似物(有时称为rapalogue,例如rad001)可用作本文描述的基于fkbp/frb的二聚化开关中的二聚化分子。在一个实施例中,二聚化分子可以选自雷帕霉素(西罗莫司)、rad001(依维莫司)、佐他莫司、替西罗莫司,ap-23573(地磷莫司)、拜耳莫司(biolimus)和ap21967。适用于与基于fkbp/frb的二聚化开关一起使用的其他雷帕霉素类似物进一步描述在标题为“组合疗法”的部分或标题为“示例性mtor抑制剂”的小节中。包含多于一个嵌合膜蛋白的系统在一个方面,本发明提供了嵌合膜蛋白的系统,例如当其在细胞中表达时,导致对于多于一种抗原(例如肿瘤抗原,例如本文中描述)具有特异性的tcr的形成。此类系统是有利的,其中它们并不需要(尽管它们可以包含)本文描述的二聚化结构域,但是因为将抗原结合结构域连接至tcr的多于一个组分,所以当tcr组装时,对于抗原结合结构域的抗原,tcr具有改变的特异性。系统进一步包含一个或多个细胞内共刺激结构域。不受理论束缚,当抗原识别后,包含一个或多个细胞内共刺激结构域允许信号传导通过tcr的cd3ζ结构域,连同通过一个或多个共刺激结构域。因此,本发明提供了:一种系统,其包含:第一嵌合膜蛋白,所述第一嵌合膜蛋白包含细胞外结构域、跨膜结构域、和细胞内结构域,所述细胞外结构域包含第一抗原结合结构域和源自cd3γ、δ、或ε的细胞外结构域的第一细胞外结构域,所述细胞内结构域包含源自除了cd3γ、δ、或ε之外的蛋白的第一细胞内共刺激结构域;以及第二嵌合膜蛋白,所述第二嵌合膜蛋白包含细胞外结构域、跨膜结构域、和任选的细胞内结构域,所述细胞外结构域包含第二抗原结合结构域和源自cd3γ、δ、或ε的细胞外结构域的第二细胞外结构域,所述细胞内结构域包含源自除了cd3γ、δ、或ε之外的蛋白的第二细胞内共刺激结构域;其中所述第一抗原结合结构域和所述第二抗原结合结构域不相同,并且其中cd3γ、δ、或ε的第一细胞外结构域和cd3γ、δ、或ε的第二细胞外结构域不相同。一种或多种嵌合膜蛋白的示例性实施例示出在图41中。在实施例中,所述第一cd3γ、δ、或ε细胞外结构域包含整个cd3γ、δ、或ε细胞外结构域。在实施例中,所述第二cd3γ、δ、或ε细胞外结构域包含整个cd3γ、δ、或ε细胞外结构域。在实施例中,a)第一嵌合蛋白包含整个cd3ε细胞外结构域,并且第二嵌合蛋白包含整个cd3γ细胞外结构域;b)第一嵌合蛋白包含整个cd3ε细胞外结构域,并且第二嵌合蛋白包含整个cd3δ细胞外结构域;或c)第一嵌合蛋白包含整个cd3δ细胞外结构域,并且第二嵌合蛋白包含整个cd3γ细胞外结构域。在实施例中,第一嵌合蛋白包含整个cd3γ、δ、或ε蛋白,例如cd3γ、δ、或ε蛋白的细胞外结构域、跨膜结构域和细胞内结构域。在实施例中,第二嵌合蛋白包含整个cd3γ、δ、或ε蛋白,例如cd3γ、δ、或ε蛋白的细胞外结构域、跨膜结构域和细胞内结构域。在其他实施例中,第一嵌合蛋白不包含源自cd3γ、δ、或ε蛋白的任何细胞内结构域。在实施例中,第二嵌合蛋白不包含源自cd3γ、δ、或ε蛋白的任何细胞内结构域。在实施例中,第一嵌合蛋白和/或第二嵌合蛋白的跨膜结构域不包含cd3γ、δ、或ε的跨膜结构域。在实施例中,第一抗原结合结构域位于所述源自cd3γ、δ、或ε的第一细胞外结构域的n-末端。在实施例中,第二抗原结合结构域位于所述源自cd3γ、δ、或ε的第二细胞外结构域的n-末端。在实施例中,第一嵌合蛋白、第二嵌合蛋白、或第一和第二嵌合蛋白两者包含位于所述第一和/或第二抗原结合结构域的n-末端的第三抗原结合结构域。在实施例中,第一抗原结构域和所述源自cd3γ、δ、或ε的第一细胞外结构域通过例如第一接头连接,例如本文描述的接头,例如(ggggs)n接头,其中n是从0至10的整数(seqidno:68),例如其中n等于4;和/或第二抗原结构域和所述源自cd3γ、δ、或ε的第二细胞外结构域通过例如第二接头连接,例如本文描述的接头,例如(ggggs)n接头(seqidno:68)或(gggs)n接头(seqidno:69),其中n是从0至10的整数,例如其中n等于4。可替代地,可以使用刚性的接头(例如富含脯氨酸的接头),如本领域已知的。在实施例中,系统的两个嵌合膜蛋白中仅一个包含细胞内信号传导结构域,该细胞内信号传导结构域包含细胞内共刺激结构域,例如本文描述的细胞内共刺激结构域。在实施例中,所述嵌合膜蛋白仅由一个细胞内共刺激结构域组成。在其他实施例中,所述膜蛋白包含多于一个(例如两个)细胞内信号传导结构域。在其他实施例中,第一嵌合膜蛋白和第二嵌合膜蛋白两者都各自包含源自除了cd3γ、δ、或ε之外的蛋白的细胞内共刺激结构域。在实施例中,细胞内共刺激结构域是相同的(例如两者都是4-1bb共刺激结构域)。在其他实施例中,它们是不同的(例如一个是4-1bb共刺激结构域,并且另一个是cd28共刺激结构域)。共刺激结构域选自本文描述的共刺激结构域。在实施例中,共刺激结构域是与跨膜结构域紧邻布置的(例如紧邻c-末端)。在其他实施例中,共刺激结构域被布置在cd3δ、γ、或ε结构域的细胞内部分、例如cd3δ、γ、或ε的整个细胞内部分、或cd3δ、γ、或ε的截短的部分的c-末端。在实施例中,抗原结合结构域如本文描述。在实施例中,一个或多个抗原结合结构域是抗体或抗体样分子。在实施例中,抗原结合结构域中的一个或多个(例如系统中存在的抗原结合结构域中的每一个)是scfv。在实施例中,第一和第二抗原结构域两者结合肿瘤抗原。在实施例中,第一和第二抗原结合结构域两者结合b细胞抗原,例如,如本文描述。在优选实施例中,b细胞抗原是cd19和cd20、cd20和cd22、或cd19和cd22。在其他实施例中,一个抗原结合结构域结合b细胞抗原,例如,如本文描述,例如cd19、cd20或cd22,并且另一个抗原结合结构域结合实体瘤抗原,例如,如本文描述,例如间皮素或egfrviii。在实施例中,嵌合膜蛋白中的一个或多个包含多于一个,例如两个抗原结合结构域。通过举例,此类抗原结合结构域可以存在为串联scfv抗原结合结构域,任选地具有布置在它们中间的接头。此类串联scfv布置示出在图41中。使用本文预期的系统组装的tcr的具体实例示出在图42、图43、图44、图45、或图46中。在实施例中,会有益的是减少或消除本发明的嵌合膜蛋白中的一个或多个的天然同源物(例如天然cd3ε、δ或γ同源物)的表达。因此,本发明提供了包含本文描述的系统的细胞,其另外具有cd3ε、δ和/或γ蛋白的减少的或消除的表达,其中该系统包含蛋白的嵌合版本。因此,例如该系统包含第一嵌合膜蛋白和第二嵌合膜蛋白,该第一嵌合膜蛋白包含cd3δ的细胞外结构域的全部或一部分,该第二嵌合膜蛋白包含cd3γ的细胞外结构域的全部或一部分,在实施例中,包含所述系统的细胞具有内源cd3γ和/或cd3σ的减少的或消除的表达。不受理论束缚,据信嵌合膜蛋白的内源对应物的此类减少或消除的表达有利于用嵌合膜蛋白的tcr形成,并且减少或消除了仅用该系统的嵌合膜蛋白中的一个或不用嵌合膜蛋白就形成的细胞表面上的tcr。可用于减少或消除tcr的这样一个或多个内源组分的表达的分子和系统包括本文描述的sirna、shrna、和基因编辑(例如crispr、talen和zfn基因编辑)系统。表2.示例性序列编码car的核酸构建体本发明还提供了编码一种或多种本文描述的嵌合蛋白构建体的核酸分子。在一个方面,核酸分子以信使rna转录物提供。在一个方面,核酸分子以dna构建体提供。编码所希望分子的核酸序列可以使用本领域已知的重组方法获得,例如通过从表达该基因的细胞中筛选文库,通过从已知包含该基因的载体中获得基因,或通过使用标准技术直接从含有该基因的细胞和组织分离。替代性地,感兴趣的基因可以合成产生,而不是克隆。本发明还提供了其中插入本发明的dna的载体。衍生自逆转录病毒如慢病毒的载体是实现长期基因转移的合适工具,因为它们允许转基因的长期稳定整合及其在子细胞中的繁殖。慢病毒载体相对于衍生自肿瘤逆转录病毒如鼠白血病病毒的载体具有附加优点,因为它们可以转导非增殖性细胞,例如肝细胞。它们还具有低免疫原性的附加优点。逆转录病毒载体还可以是例如γ逆转录病毒载体。γ逆转录病毒载体可以包括例如启动子、包装信号(ψ)、引物结合位点(pbs)、一个或多个(例如两个)长末端重复序列(ltr)、和感兴趣的转基因(例如编码嵌合蛋白的基因)。γ逆转录病毒载体可能缺少病毒结构基因(如gag、pol、和env)。示例性γ逆转录病毒载体包括鼠白血病病毒(mlv)、形成脾脏病灶病毒(sffv)、和骨髓增生性肉瘤病毒(mpsv),以及由其衍生的载体。其他γ逆转录病毒载体描述于例如tobiasmaetzig等人,“gammaretroviralvectors:biology,technologyandapplication[γ逆转录病毒载体:生物学/技术和应用]”viruses.[病毒]2011年6月;3(6):677-713)。在另一个实施例中,包含编码本发明所希望car的核酸的载体是腺病毒载体(a5/35)。在另一个实施例中,编码嵌合蛋白的核酸的表达可以使用转座子如睡美人系统、crisper、cas9和锌指核酸酶完成。见下文june等人2009naturereviewsimmunology[自然免疫学综述]9.10:704-716,该文献通过援引并入本文。细胞来源在扩增和基因修饰或其他修饰之前,可以从受试者获得细胞来源,例如t细胞或自然杀伤(nk)细胞。术语“受试者”旨在包括可以在其中引发免疫应答的活生物体(例如,哺乳动物)。受试者的实例包括人、猴、黑猩猩、狗、猫、小鼠、大鼠及其转基因物种。t细胞可以从许多来源获得,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸膜积液、脾组织、和肿瘤。在本披露的某些方面,可以使用任何数量的本领域技术人员已知的技术(如ficolltm分离)从自受试者收集的血液单位获得免疫效应细胞,例如t细胞。在一个优选的方面,通过单采血液成分术获得来自个体的循环血液的细胞。单采血液成分术产物典型地含有淋巴细胞,包括t细胞、单核细胞、粒细胞、b细胞、其他有核白细胞、红细胞、和血小板。在一个方面,可以洗涤通过单采血液成分术收集的细胞以除去血浆部分并且任选地将细胞置于适当的缓冲液或培养基中用于后续加工步骤。在本发明的一个实施例中,使用磷酸盐缓冲盐水(pbs)洗涤这些细胞。在一个替代实施例中,洗涤溶液缺少钙并且可能缺少镁,或者可能缺少许多(如果不是全部)二价阳离子。在不存在钙的情况下的初始活化步骤可以导致放大的活化。如本领域普通技术人员将容易理解的,洗涤步骤可以通过本领域技术人员已知的方法完成,如通过根据制造商的说明使用半自动“流通”离心机(例如,cobe2991细胞处理器、baxtercytomate、或haemoneticscellsaver5)。在洗涤后,可以将细胞重悬于多种生物相容性缓冲液中,例如像无ca、无mg的pbs、plasmalytea、或者含有或不含缓冲液的其他盐溶液。替代性地,可以除去单采血液成分术样品中不希望的组分,并将细胞直接重悬于培养基中。应当认识到,本申请的方法可利用包含5%或更少(例如2%)的人ab血清的培养基条件,并使用已知的培养基条件和组合物,例如描述于以下的那些:smith等人,“exvivoexpansionofhumantcellsforadoptiveimmunotherapyusingthenovelxeno-freectsimmunecellserumreplacement[使用新型无xenocts免疫细胞血清替代物进行过继免疫治疗的人t细胞的离体扩增]”clinical&translationalimmunology[临床和移植免疫学](2015)4,e31;doi:10.1038/cti.2014.31。在一个方面,通过例如通过percolltm梯度离心或通过逆流离心淘洗来裂解红细胞和耗尽单核细胞,从外周血淋巴细胞分离t细胞。本文描述的方法可以包括,例如使用例如(例如本文描述的)阴性选择技术选择免疫效应细胞(例如t细胞)的特定亚群,该亚群是t调节细胞耗减的群体,cd25+耗减的细胞。优选地,t调节耗减的细胞群体含有少于30%、25%、20%、15%、10%、5%、4%、3%、2%、1%的cd25+细胞。在一个实施例中,使用抗cd25抗体或其片段或cd25结合配体il-2从该群除去t调节细胞(例如cd25+t细胞)。在一个实施例中,将抗cd25抗体或其片段或cd25结合配体与底物(例如珠)缀合,或以其他方式包被在底物(例如珠)上。在一个实施例中,将抗cd25抗体或其片段与如本文描述的底物缀合。在一个实施例中,使用来自miltenyitm的cd25耗减试剂从该群除去t调节细胞(例如cd25+t细胞)。在一个实施例中,细胞与cd25耗减试剂的比率是1e7个细胞至20ul、或1e7个细胞至15ul、或1e7个细胞至10ul、或1e7个细胞至5ul、或1e7个细胞至2.5ul、或1e7个细胞至1.25ul。在一个实施例中,例如对于t调节细胞(例如cd25+)耗减,使用大于5亿个细胞/ml。在另一个方面,使用600、700、800、或900百万个细胞/ml的细胞浓度。在一个实施例中,有待耗减的免疫效应细胞群体包括约6×109个cd25+t细胞。在其他方面,有待耗减的免疫效应细胞群体包括约1×109至1×1010个cd25+t细胞,以及其间的任何整数值。在一个实施例中,所得t调节耗尽的细胞群具有2x109个t调节细胞(例如cd25+细胞)或更少(例如1x109、5x108、1x108、5x107、1x107、或更少个cd25+细胞)。在一个实施例中,使用具有耗减管组(例如像管162-01)的clinimac系统从该群除去t调节细胞(例如cd25+细胞)。在一个实施例中,将clinimac系统在耗减设置(例如像depletion2.1)上运行。不希望受特定理论的束缚,在单采血液成分术之前或在制造表达嵌合蛋白的细胞产物期间降低受试者中免疫细胞的阴性调节剂水平(例如,减少不需要的免疫细胞(例如treg细胞)的数量)可以降低受试者复发的风险。例如,耗减treg细胞的方法是本领域已知的。减少treg细胞的方法包括但不限于环磷酰胺、抗gitr抗体(本文描述的抗gitr抗体)、cd25耗减、及其组合。在一些实施例中,制造方法包括在制造表达嵌合蛋白的细胞之前减少例如,耗减)treg细胞的数量。例如,制造方法包括使样品(例如单采血液成分术样品)与抗gitr抗体和/或抗cd25抗体(或其片段、或cd25结合配体)接触,例如以在制造表达嵌合蛋白的细胞(例如t细胞、nk细胞)产物之前耗减treg细胞。在一个实施例中,在收集细胞之前,用一种或多种减少treg细胞的疗法预先治疗受试者,从而降低受试者对细胞治疗复发的风险。在一个实施例中,减少treg细胞的方法包括但不限于向受试者施用环磷酰胺、抗gitr抗体、cd25耗减、或其组合中的一种或多种。施用环磷酰胺、抗gitr抗体、cd25耗减、或其组合中的一种或多种可以在输注细胞产物之前、期间或之后发生。在一个实施例中,有待除去的细胞群体既不是调控t细胞或肿瘤细胞,也不是以其他方式对细胞的扩增和/或功能产生负面影响的细胞(例如表达cd14、cd11b、cd33、cd15、或由潜在免疫抑制细胞表达的其他标记的细胞)。在一个实施例中,设想将此类细胞与调控t细胞和/或肿瘤细胞并行除去,或者在所述耗减之后,或以另一种顺序除去。本文描述的方法可以包括多于一个的选择步骤,例如多于一个的耗减步骤。可以例如用针对阴性选择的细胞特有的表面标记的抗体组合来完成通过阴性选择富集t细胞群体。一种方法是通过负磁性免疫吸附或流式细胞术进行细胞分选和/或选择,该负磁性免疫吸附或流式细胞术使用针对存在于阴性选择的细胞上的细胞表面标记的单克隆抗体的混合物。例如,为了通过阴性选择富集cd4+细胞,单克隆抗体混合物可以包括针对cd14、cd20、cd11b、cd16、hla-dr、和cd8的抗体。本文描述的方法可以进一步包括从表达肿瘤抗原(例如不包含cd25的肿瘤抗原,例如cd19、cd30、cd38、cd123、cd20、cd14或cd11b)的群体除去细胞,从而提供t调节耗减的(例如cd25+耗减的)和肿瘤抗原耗减的细胞群体,该细胞群体适于表达嵌合蛋白。在一个实施例中,将表达肿瘤抗原的细胞与t调节例如cd25+细胞同时除去。例如,抗cd25抗体或其片段、和抗肿瘤抗原抗体或其片段可以附接至可以用于除去细胞或抗cd25抗体或其片段、或抗肿瘤抗原抗体或其片段的同一底物(例如珠),可以附接至分开的珠(其混合物可以用于除去细胞)。在其他实施例中,t调节细胞(例如cd25+细胞)的除去和表达肿瘤抗原的细胞的除去是连续的,并且可以例如以任何顺序发生。还提供了包括以下的方法:从表达检查点抑制剂(例如本文描述的检查点抑制剂)的群体除去细胞(例如pd1+细胞、lag3+细胞、和tim3+细胞中的一种或多种),从而提供t调节耗减的(例如cd25+耗减的)细胞和检查点抑制剂耗减的细胞(例如pd1+、lag3+和/或tim3+耗减的细胞)群。示例性检查点抑制剂包括b7-h1、b7-1、cd160、p1h、2b4、pd1、tim3、ceacam(例如ceacam-1、ceacam-3和/或ceacam-5)、lag3、tigit、ctla-4、btla和lair1。在一个实施例中,将表达检查点抑制剂的细胞与t调节例如cd25+细胞同时除去。例如,抗cd25抗体或其片段、和抗检查点抑制剂抗体或其片段可以附接至可以用于除去细胞或抗cd25抗体或其片段、和抗检查点抑制剂抗体或其片段的同一珠,可以附接至分开的珠(其混合物可以用于除去细胞)。在其他实施例中,t调节细胞(例如cd25+细胞)的除去和表达检查点抑制剂的细胞的除去是连续的,并且可以例如以任何顺序发生。本文描述的方法可以包括阳性选择步骤。例如,可以通过将t细胞与抗-cd3/抗-cd28(例如,3x28)缀合的珠(如m-450cd3/cd28t)一起孵育足以对所希望的t细胞进行阳性选择的时间段来分离这些t细胞。在一个实施例中,该时间段是约30分钟。在另一个实施例中,该时间段的范围为从30分钟至36小时或更长以及其间的所有整数值。在另一个实施例中,该时间段是至少1、2、3、4、5或6小时。在又另一个实施例中,该时间段是10至24小时,例如24小时。与其他细胞类型相比,在存在较少t细胞的任何情况下,如从肿瘤组织或免疫受损个体分离肿瘤浸润淋巴细胞(til),可以使用更长的孵育时间来分离t细胞。此外,使用更长的孵育时间可以提高cd8+t细胞捕获的效率。因此,通过简单地缩短或延长使t细胞与cd3/cd28珠结合的时间和/或通过增加或减少珠与t细胞的比率(如本文进一步描述的),可以在培养起始时或在该过程期间的其他时间点优先地选择或针对t细胞亚群。另外,通过增加或减少抗cd3和/或抗cd28抗体在珠或其他表面上的比率,可以在培养起始时或在其他希望的时间点优先地选择或针对t细胞亚群。在一个实施例中,可以选择表达以下中的一者或多者的t细胞群体:ifn-γ、tnfα、il-17a、il-2、il-3、il-4、gm-csf、il-10、il-13、颗粒酶b、和穿孔素、或其他适当的分子(例如其他细胞因子)。筛选细胞表达的方法可以通过例如pct公开号wo2013/126712。为了通过阳性或阴性选择分离希望的细胞群体,可以改变细胞和表面(例如颗粒(如珠))的浓度。在某些方面,可能希望显著减小其中珠和细胞混合在一起的体积(例如,增加细胞的浓度),以确保细胞和珠的最大接触。例如,在一个方面,使用100亿个细胞/ml、90亿/ml、80亿/ml、70亿/ml、60亿/ml或50亿/ml的浓度。在一个方面,使用10亿个细胞/ml的浓度。在又一个方面,使用75、80、85、90、95、或100百万个细胞/ml的细胞浓度。在另外的方面,可以使用125或150百万个细胞/ml的浓度。使用高浓度可以导致细胞产量增加、细胞活化、和细胞扩增。此外,使用高细胞浓度允许更有效地捕获可能弱表达感兴趣的靶抗原的细胞(如cd28阴性t细胞),或来自存在许多肿瘤细胞的样品(例如白血病的血、肿瘤组织等)的细胞。此类细胞群体可能具有治疗价值,并且是希望获得的。例如,使用高浓度的细胞允许更有效地选择通常具有较弱cd28表达的cd8+t细胞。在相关方面,可能希望使用较低的细胞浓度。通过显著稀释t细胞和表面的混合物(例如颗粒(如珠)),使颗粒与细胞之间的相互作用最小化。这选择了表达大量有待结合颗粒的所希望抗原的细胞。例如,cd4+t细胞表达较高水平的cd28,并且在稀释浓度下比cd8+t细胞更有效地捕获。在一个方面,所使用的细胞的浓度是5x106/ml。在其他方面,所使用的浓度可以是从约1x105/ml至1x106/ml,以及其间的任何整数值。在其他方面,可以将这些细胞在旋转器上以不同的速度在2℃-10℃或室温下孵育不同的时间长度。用于刺激的t细胞也可以在洗涤步骤后冷冻。不希望受理论束缚,冷冻和随后的解冻步骤通过在细胞群中去除粒细胞及在一定程度上去除单核细胞提供更均匀的产物。在除去血浆和血小板的洗涤步骤之后,可以将细胞悬浮在冷冻溶液中。虽然许多冷冻溶液和参数是本领域已知的并且在这种情况下将是有用的,但一种方法涉及使用含有20%dmso和8%人血清白蛋白的pbs,或含有10%葡聚糖40和5%葡萄糖、20%人血清白蛋白和7.5%dmso的培养基,或含有31.25%plasmalyte-a、31.25%葡萄糖5%、0.45%nacl、10%葡聚糖40和5%葡萄糖、20%人血清白蛋白和7.5%dmso的培养基,或含有例如hespan和plasmalytea的其他适合的细胞冷冻培养基,然后将细胞以每分钟1°的速率冷冻至-80℃并储存在液氮储罐的气相中。可以使用其他控制冷冻的方法以及在-20℃或液氮中立即不受控制的冷冻。在某些方面,将冷冻保存的细胞如本文所描述进行解冻和洗涤,并允许在使用本发明的方法活化之前在室温静置1小时。在本发明的上下文中还考虑了在可能需要如本文描述的扩增细胞之前的时间段从受试者收集血液样品或单采血液成分术产物。因此,可以在任何必要的时间点收集待扩增细胞的来源,并且分离和冷冻所需的细胞(如t细胞)以便后续用于免疫效应细胞疗法中,以用于将受益于免疫效应细胞疗法的任意数目的疾病或病症,如本文描述的那些。在一个方面,血液样品或单采血液成分术取自基本健康的受试者。在某些方面,血液样品或单采血液成分术取自基本健康的受试者,该受试者处于发展疾病的风险中,但尚未患发展疾病,并且将感兴趣的细胞分离并冷冻供以后使用。在某些方面,t细胞可以扩增、冷冻,并在以后使用。在某些方面,在诊断如本文描述的特定疾病之后但在任何治疗之前不久从患者收集样品。在另一个方面,在任何数量的相关治疗方式之前,从受试者的血液样品或单采血液成分术分离细胞,这些相关治疗方式包括但不限于用以下进行治疗:药剂(如那他珠单抗(natalizumab)、依法珠单抗、抗病毒剂)、化疗、放射、免疫抑制剂(如环孢菌素、硫唑嘌呤、甲氨蝶呤、霉酚酸酯、和fk506)、抗体或其他免疫清除剂(如campath、抗cd3抗体、环磷酰胺、氟达拉滨(fludarabine)、环孢菌素、fk506、雷帕霉素、霉酚酸、类固醇、fr901228)、和照射。在本发明的另一个方面,在治疗后直接从患者获得t细胞使得受试者具有功能性t细胞。在这点上,已观察到在某些癌症治疗(特别是使用破坏免疫系统的药物的治疗)之后,在患者通常将从治疗恢复期间治疗后不久,所获得的t细胞的质量因其离体扩增的能力可能是最佳或改善的。同样地,在使用本文描述的方法进行离体操作之后,这些细胞可以处于优选的状态以增强植入和体内扩增。因此,在本发明的上下文中,预期在该恢复期期间收集血细胞,包括t细胞、树突细胞或造血谱系的其他细胞。此外,在某些方面,动员(例如,用gm-csf动员)和调整方案可以用于在受试者中产生病状,其中特定细胞类型的再增殖、再循环、再生、和/或扩增是有利的,尤其是在治疗后确定的时间窗口。例证性细胞类型包括免疫系统的t细胞、b细胞、树突细胞、和其他细胞。在一个实施例中,表达car分子(例如,本文描述的car分子)的免疫效应细胞获自已接受低免疫增强剂量的mtor抑制剂的受试者。在一个实施例中,在足够的时间后(或在足够剂量的低免疫增强剂量的mtor抑制剂后)收获被工程化以表达car的免疫效应细胞(例如t细胞)的群,使得受试者中或从受试者收获的pd1阴性免疫效应细胞(例如t细胞)的水平,或pd1阴性免疫效应细胞(例如t细胞)/pd1阳性免疫效应细胞(例如t细胞)的比率已经至少是短暂的增加了。在其他实施例中,免疫效应细胞的群体可以通过接触一定量的mtor抑制剂离体进行处理,该mtor抑制剂增加pd1阴性免疫效应子细胞(例如t细胞)的数量或增加pd1阴性免疫效应细胞(例如t细胞)/pd1阳性免疫效应细胞(例如t细胞)的比率。在一个实施例中,t细胞群体是二酰基甘油激酶(dgk)缺陷型。dgk缺陷型细胞包括不表达dgkrna或蛋白质,或具有降低或抑制的dgk活性的细胞。dgk缺陷型细胞可以通过遗传方法产生,例如施用rna干扰剂(例如sirna、shrna、mirna)以减少或预防dgk表达。替代性地,可以通过用本文描述的dgk抑制剂处理产生dgk缺陷型细胞。在一个实施例中,t细胞群体是ikaros缺陷型。ikaros缺陷型细胞包括不表达ikarosrna或蛋白质,或具有降低或抑制的ikaros活性的细胞,ikaros缺陷型细胞可以通过遗传方法产生,例如施用rna干扰剂(例如sirna、shrna、mirna)以减少或预防ikaros表达。替代性地,可以通过用ikaros抑制剂(例如,来那度胺(lenalidomide))处理产生ikaros缺陷型细胞。在实施例中,t细胞群体是dgk缺陷型且ikaros缺陷型的,例如不表达dgk和ikaros,或者具有降低或抑制的dgk和ikaros活性。可以通过本文描述的任何方法产生此类dgk和ikaros缺陷型细胞。在一个实施例中,从受试者获得nk细胞。在另一个实施例中,nk细胞是nk细胞系,例如nk-92细胞系(conkwest公司)。同种异体细胞在本文描述的实施例中,免疫效应细胞可以是同种异体免疫效应细胞,例如t细胞或nk细胞。例如,该细胞可以是同种异体t细胞,例如缺少功能性t细胞受体(tcr)和/或人白细胞抗原(hla)(例如hlai类和/或hlaii类)表达的同种异体t细胞。缺少功能性tcr的t细胞可以例如被工程化使得它在其表面上不表达任何功能性tcr,被工程化使得它不表达包含功能性tcr的一个或多个亚基或被工程化使得它在其表面上产生非常少的功能性tcr。替代性地,t细胞可以例如通过表达tcr的一个或多个亚基的突变或截短形式表达严重受损的tcr。术语“严重受损的tcr”意指该tcr将不在宿主中引发不利的免疫反应。本文描述的t细胞可以例如被工程化,使得它在其表面上不表达功能性hla。例如,可以工程化本文描述的t细胞,使得其细胞表面hla(例如hla1类和/或hlaii类)表达被下调。在一些实施例中,t细胞可以缺少功能性tcr和功能性hla(例如hlai类和/或hlaii类)。缺少功能性tcr和/或hla表达的修饰的t细胞可以通过任何适合的方式获得,包括敲除或敲低tcr或hla的一个或多个亚基。例如,t细胞可以包括使用sirna、shrna、成簇的规则间隔短回文重复序列(crispr)转录活化因子样效应核酸酶(talen)、或锌指核酸内切酶(zfn)敲低tcr和/或hla。在一些实施例中,同种异体细胞可以是例如通过本文描述的任何方法不表达或以低水平表达抑制性分子的细胞。例如,细胞可以是不表达或以低水平表达抑制性分子的细胞。抑制性分子的实例包括pd1、pd-l1、ctla4、tim3、ceacam(例如,ceacam-1、ceacam-3和/或ceacam-5)、lag3、vista、btla、tigit、lair1、cd160、2b4和tgfβ。抑制性分子的抑制(例如通过在dna、rna或蛋白质水平上的抑制)可以优化细胞的性能。在实施例中,可以使用例如如本文描述的抑制性核酸,例如抑制性核酸,例如dsrna,例如sirna或shrna、成簇的规则间隔短回文重复序列(crispr)、转录活化因子样效应核酸酶(talen)或锌指核酸内切酶(zfn)。抑制tcr或hla的sirna和shrna在一些实施例中,可以使用靶向编码t细胞中的tcr和/或hla的核酸的sirna或shrna来抑制tcr表达和/或hla表达。sirna和shrna在t细胞中的表达可以使用任何常规表达系统(例如像慢病毒表达系统)来实现。下调tcr的组分的表达的示例性shrna描述于例如美国公开号:2012/0321667中。下调hlai类和/或hlaii类基因表达的示例性sirna和shrna描述于例如美国公开号:us2007/0036773中。抑制tcr或hla的crispr如本文所用,“crispr”或“针对tcr和/或hla的crispr”或“抑制tcr和/或hla的crispr”是指一组规律间隔成簇短回文重复序列,或包含这组重复序列的系统。如本文所用,“cas”是指crispr相关蛋白。“crispr/cas”系统是指衍生自crispr和cas的系统,该系统可以用于使tcr和/或hla基因沉默或突变。在大约40%的测序的真细菌基因组和90%的测序的古细菌中发现了天然存在的crispr/cas系统。grissa等人(2007)bmcbioinformatics[bmc生物信息学]8:172。此系统是赋予对外来遗传元件(如质粒和噬菌体)的抗性并提供获得性免疫的形式的原核免疫系统。barrangou等人(2007)science[科学]315:1709-1712;marragini等人(2008)science[科学]322:1843-1845。因此,crispr/cas系统可用于编辑tcr和/或hla基因(添加或删除碱基对),或引入提前终止,该提前终止从而降低tcr和/或hla的表达。替代性地,可以像rna干扰一样使用crispr/cas系统,以可逆的方式关闭tcr和/或hla基因。例如,在哺乳动物细胞中,rna可以将cas蛋白引导至tcr和/或hla启动子,空间上阻断rna聚合酶。可以使用本领域中已知的技术产生抑制tcr和/或hla的人工crispr/cas系统,例如,描述于美国公开号20140068797和cong(2013)science[科学]339:819-823中的技术。还可以产生本领域已知的其他人工crispr/cas系统,其抑制tcr和/或hla,例如描述于以下:tsai(2014)naturebiotechnol.[自然生物技术],32:6569-576,美国专利号:8,871,445、8,865,406、8,795,965、8,771,945、和8,697,359。抑制tcr和/或hla的talen“talen”或“针对hla和/或tcr的talen”或“抑制hla和/或tcr的talen”是指转录活化因子样效应子核酸酶,一种可以用于编辑hla和/或tcr基因的人工核酸酶。抑制hla和/或tcr的锌指核酸酶“zfn”或“锌指核酸酶”或“针对hla和/或tcr的zfn”或“抑制hla和/或tcr的zfn”是指锌指核酸酶,一种可以用于编辑hla和/或tcr基因的人工核酸酶。像talen一样,zfn包含与dna结合结构域融合的foki核酸酶域(或它的衍生物)。就zfn而言,dna结合结构域包含一个或多个锌指。carroll等人(2011)geneticssocietyofamerica[美国遗传学学会]188:773-782;和kim等人(1996)proc.natl.acad.sci.usa[美国国家科学院院刊]93:1156-1160。端粒酶表达尽管不希望受任何特定理论的束缚,但在一些实施例中,由于t细胞中的端粒缩短,治疗性t细胞在患者中具有短期持久性;因此,用端粒酶基因转染可以延长t细胞的端粒并改善患者体内t细胞的持久性。参见carljune,“adoptivetcelltherapyforcancerintheclinic[临床上用于癌症的过继性t细胞疗法]”,journalofclinicalinvestigation[临床研究杂志],117:1466-1476(2007)。因此,在一个实施例中,免疫效应细胞(例如t细胞)异位表达端粒酶亚基,例如端粒酶的催化亚基,例如tert,例如htert。在一些方面,本披露内容提供了产生细胞的方法,该方法包括使细胞与编码端粒酶亚基(例如端粒酶的催化亚基,例如tert,例如htert)的核酸接触。可以使细胞在与编码嵌合蛋白的构建体接触之前、同时或之后与该核酸接触。免疫效应细胞(例如,t细胞)的活化和扩增免疫效应细胞(如t细胞)通常可以使用如描述于例如以下中的方法进行活化和扩增:美国专利6,352,694;6,534,055、6,905,680、6,692,964、5,858,358、6,887,466、6,905,681、7,144,575、7,067,318、7,172,869、7,232,566、7,175,843、5,883,223、6,905,874、6,797,514、6,867,041、和美国专利申请公开号20060121005中所述的方法来活化和扩增。通常,免疫效应细胞(例如t调节细胞耗减的细胞)群体可以通过与已附着有药剂和配体的表面接触而扩增,该药剂刺激cd3/tcr复合物相关信号并且该配体刺激t细胞表面上的共刺激分子。具体地,可以如本文所描述刺激t细胞群体,如通过与固定在表面上的抗cd3抗体或其抗原结合片段、或抗cd2抗体接触,或通过与结合有钙离子载体的蛋白激酶c活化因子(例如苔藓抑素)接触。对于t细胞表面上辅助分子的共刺激,使用结合辅助分子的配体。例如,可以在适于刺激t细胞增殖的条件下,使t细胞群体与抗cd3抗体和抗cd28抗体接触。为了刺激cd4+t细胞或cd8+t细胞的增殖,可以使用抗cd3抗体和抗cd28抗体。可以使用抗cd28抗体的实例包括9.3、b-t3、xr-cd28(法国贝桑松diaclone公司(diaclone,france)),还可以使用本领域公知的其他方法(berg等人,transplantproc.[移植学会会报]30(8):3975-3977,1998;haanen等人,j.exp.med.[实验医学杂志]190(9):13191328,1999;garland等人,j.immunolmeth.[免疫学杂志]227(1-2):53-63,1999)。在某些方面,t细胞的初级刺激信号和共刺激信号可以由不同的方案提供。例如,提供每个信号的药剂可以在溶液中或偶联到表面。当偶联到表面时,药剂可以偶联到同一表面(即,为“顺式”形成)或偶联到分离表面(即,为“反式”形成)。替代性地,可以将一种药剂偶联到表面并且使另一种药剂在溶液中。在一个方面,将提供共刺激信号的药剂与细胞表面结合,并且使提供初级活化信号的药剂在溶液中或偶联到表面。在某些方面,两种药剂都可以在溶液中。在一个方面,这些试剂可以为可溶形式,并且然后交联到表面,如表达fc受体的细胞或将与这些药剂结合的抗体或其他结合剂。在这方面,参见例如美国专利申请公开号20040101519和20060034810的人工抗原呈递细胞(aapc),其预期用于活化和扩增本发明中的t细胞。在一个方面,将两种药剂固定在珠上,或者在同一珠上,即“顺式”,或者在分离的珠上,即“反式”。通过举例,提供初级活化信号的药剂是抗cd3抗体或其抗原结合片段,并且提供共刺激信号的药剂是抗cd28抗体或其抗原结合片段;并且将两种药剂以等效分子量共固定到同一珠。在一个方面,使用与珠结合的每种抗体的1:1比率用于cd4+t细胞扩增和t细胞生长。在本发明的某些方面,使用与珠结合的抗cd3:cd28抗体的比率,使得与使用1:1的比率观察到的扩增相比,观察到t细胞扩增的增加。在一个特定方面,与使用1:1比率观察到的扩增相比,观察到从约1倍至约3倍的增加。在一个方面,与珠结合的cd3:cd28抗体的比率范围为从100:1至1:100以及其间的所有整数值。在一个方面,与抗cd3抗体相比,更多的抗cd28抗体与颗粒结合,即cd3:cd28的比率小于1。在某些方面,与珠结合的抗cd28抗体与抗cd3抗体的比率大于2:1。在一个特定方面,使用与珠结合的抗体的1:100cd3:cd28比率。在一个方面,使用与珠结合的抗体的1:75cd3:cd28比率。在另一个方面,使用与珠结合的抗体的1:50cd3:cd28比率。在一个方面,使用与珠结合的抗体的1:30cd3:cd28比率。在一个优选的方面,使用与珠结合的抗体的1:10cd3:cd28比率。在一个方面,使用与珠结合的抗体的1:3cd3:cd28比率。在又一个方面,使用与珠结合的抗体的3:1cd3:cd28比率。颗粒与细胞的比率为从1:500至500:1以及其间的任何整数值可以用于刺激t细胞或其他靶细胞。如本领域普通技术人员可以容易地理解的,颗粒与细胞的比率可以取决于相对于靶细胞的颗粒尺寸。例如,小尺寸的珠仅可以结合少量细胞,而较大的珠可以结合许多细胞。在某些方面范围从1:100至100:1以及其间的任何整数值的细胞与颗粒的比率和在另外的方面包括1:9至9:1的比率以及其间的任何整数值也可以用于刺激t细胞。如以上所指出,导致t细胞刺激的抗cd3和抗cd28偶联颗粒与t细胞的比率可以变化,然而某些优选值包括1:100、1:50、1:40、1:30、1:20、1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、和15:1,其中一个优选的比率是每个t细胞至少1:1个颗粒。在一个方面,使用1:1或更小的颗粒与细胞比率。在一个特定方面,优选的颗粒:细胞的比率为1:5。在另外的方面,颗粒与细胞的比率可以根据刺激日而变化。例如,在一个方面,颗粒与细胞的比率在第一天为从1:1至10:1,并且将另外颗粒在之后每天或每隔一天加入到细胞中持续最长10天,最终比率为从1:1至1:10(基于添加当天的细胞计数)。在一个特定方面,在刺激的第一天,颗粒与细胞的比率为1:1,并且在刺激的第三天和第五天调整为1:5。在一个方面,基于在第一天的最终比率为1:1并且在刺激的第三天和第五天为1:5,每天或每隔一天添加颗粒。在一个方面,在刺激的第一天,颗粒与细胞的比率为2:1,并且在刺激的第三天和第五天调整为1:10。在一个方面,基于在第一天的最终比率为1:1并且在刺激的第三天和第五天为1:10,每天或每隔一天添加颗粒。本领域技术人员将理解,各种其他比率可适用于本发明。具体地,比率将根据粒度和细胞大小和类型而变化。在一个方面,在第一天用于使用的最典型比率是1:1、2:1和3:1附近。在另外的方面,将细胞(如t细胞)与药剂包被的珠组合,随后将这些珠和这些细胞分离,并且然后培养细胞。在可替代方面,在培养之前,不将药剂包被的珠和细胞分开而是一起培养。在另一个方面,首先通过施加力(如磁力)浓缩珠和细胞,导致细胞表面标记的连接增加,从而诱导细胞刺激。通过举例,可以通过使抗cd3和抗cd28附着的顺磁珠(3x28珠)接触t细胞来连接细胞表面蛋白。在一个方面,将细胞(例如,104至109个t细胞)和珠(例如,比率为1:1的m-450cd3/cd28t顺磁珠)在缓冲液(例如pbs(不含二价阳离子(如钙和镁))中组合。同样,本领域的普通技术人员可易于理解可以使用任何细胞浓度。例如,靶标细胞在样品中可以非常稀少,仅占样品的0.01%,或者整个样品(即100%)可以包含所关注的靶标细胞。因此,任何细胞数量都在本发明的上下文内。在某些方面,可能希望显著减小其中颗粒和细胞混合在一起的体积(即增加细胞的浓度),以确保细胞和颗粒的最大接触。例如,在一个方面,使用约100亿个细胞/ml、90亿个细胞/ml、80亿个细胞/ml、70亿个细胞/ml、60亿个细胞/ml、50亿个细胞/ml、或20亿个细胞/ml的浓度。在一个方面,使用大于1亿个细胞/ml。在另一个方面,使用10、15、20、25、30、35、40、45、或50百万个细胞/ml的细胞浓度。在又一个方面,使用75、80、85、90、95、或100百万个细胞/ml的细胞浓度。在另外的方面,可以使用125或150百万个细胞/ml的浓度。使用高浓度可以导致细胞产量增加、细胞活化、和细胞扩增。此外,使用高细胞浓度允许更有效地捕获可能弱表达感兴趣的靶抗原的细胞,如cd28阴性t细胞。此类细胞群体可能具有治疗价值,并且在某些方面是希望获得的。例如,使用高浓度的细胞允许更有效地选择通常具有较弱cd28表达的cd8+t细胞。在一个实施例中,例如通过本文描述的方法扩增用本文描述的核酸转导的细胞。在一个实施例中,使细胞在培养物中扩增数小时(例如约2、3、4、5、6、7、8、9、10、15、18、21小时)至约14天(例如1、2、3、4、5、6、7、8、9、10、11、12、13或14天)的一段时间。还可能希望进行几个刺激循环,使得t细胞的培养时间可以是60天或更长。适于t细胞培养的条件包括适当的培养基(例如,minimalessentialmedia或rpmimedia1640或x-vivo15,(龙沙公司(lonza))),该培养基可以含有增殖和活力所必需的因子,包括血清(例如胎牛或人血清)、白介素-2(il-2)、胰岛素、ifn-γ、il-4、il-7、gm-csf、il-10、il-12、il-15、tgfβ、和tnf-α或本领域技术人员已知用于细胞生长的任何其他添加剂。用于细胞生长的其他添加剂包括但不限于表面活性剂、人血浆蛋白制品、和还原剂(如n-乙酰基-半胱氨酸和2-巯基乙醇)。培养基可以包括rpmi1640、aim-v、dmem、mem、α-mem、f-12、x-vivo15、和x-vivo20、优化剂,其中添加氨基酸、丙酮酸钠、和维生素,无血清或补充有适当量的血清(或血浆)或一组确定的激素、和/或足以使t细胞生长和扩增的一定量细胞因子。抗生素(例如青霉素和链霉素)仅包含在实验培养物中,而不包含在有待注入受试者的细胞培养物中。将靶细胞维持在支持生长所必需的条件下,例如,适当的温度(例如,37℃)和大气(例如空气加5%co2)。在一个实施例中,使细胞在包括一种或多种白介素的适当介质(例如本文描述的介质)中扩增,该白介素导致在14天的扩增期间细胞增加至少200倍(例如200倍、250倍、300倍、350倍),例如如通过本文描述的方法(如流式细胞术)测量。在一个实施例中,细胞在il-15和/或il-7(例如,il-15和il-7)的存在下扩增。在实施例中,本文描述的方法包括例如使用抗cd25抗体或其片段,或cd25结合配体il-2从细胞群体除去t调节细胞(例如cd25+t细胞)。本文描述了从细胞群体除去t调节细胞(例如cd25+t细胞)的方法。在实施例中,这些方法(例如制造方法)进一步包括使细胞群体(例如其中t调节细胞(如cd25+t细胞)已耗减的细胞群体;或先前已接触抗cd25抗体、其片段,或cd25-结合配体的细胞群体)与il-15和/或il-7接触。例如,使细胞群体(例如先前已接触抗cd25抗体、其片段,或cd25-结合配体)在il-15和/或il-7存在下扩增。在一些实施例中,在例如离体制造细胞过程中,使本文描述的细胞与包含白介素-15(il-15)多肽、白介素-15受体α(il-15ra)多肽,或il-15多肽和il-15ra多肽(例如,hetil-15)两者的组合的组合物接触。在实施例中,在例如离体制造细胞过程中,使本文描述的细胞与包含il-15多肽的组合物接触。在实施例中,在例如离体制造细胞过程中,使本文描述的细胞与包含il-15多肽和il-15ra多肽两者的组合的组合物接触。在一个实施例中,在离体扩增过程中,使本文描述的细胞与包含hetil-15的组合物接触。在一个实施例中,在离体扩增过程中,使本文描述的细胞与包含il-15多肽的组合物接触。在一个实施例中,在离体扩增过程中,使本文描述的细胞与包含il-15多肽和il-15ra多肽两者的组合物接触。在一个实施例中,该接触导致淋巴细胞亚群(例如cd8+t细胞)的存活和增殖。已暴露于不同刺激时间的t细胞可以表现出不同的特征。例如,典型的血液或外周血单核细胞产物具有辅助t细胞群体(th,cd4+),其大于细胞毒性或抑制性t细胞群体(tc,cd8+)。通过刺激cd3和cd28受体离体扩增t细胞产生t细胞群体,该t细胞群体在约8-9天之前主要由th细胞组成,而在约8-9天之后,该t细胞群体包含越来越多的tc细胞群体。因此,取决于治疗目的,向受试者输注主要包含th细胞的t细胞群体可能是有利的。类似地,如果已分离了tc细胞的抗原特异性子集,则将该子集扩增到更大程度可能是有益的。此外,在细胞扩增过程中,除cd4和cd8标记之外,其他表型标记显著地,但在很大程度上,可重复地变化。因此,这种可重复性使得能够针对特定目的定制活化的t细胞产物。治疗应用在另一个方面,提供了一种治疗受试者,例如减轻或改善受试者的过度增生性病状或病症(例如,癌症)、例如实体瘤、软组织肿瘤或转移性病灶的方法。如本文使用的术语“癌症”意欲包括所有类型的癌性生长或致癌性过程、转移性组织或恶性转化的细胞、组织或器官,而不考虑组织病理学类型或侵袭的阶段。实体瘤的实例包括各种器官系统的恶性肿瘤,例如肉瘤、腺癌和癌,如影响肝、肺、乳腺、淋巴、胃肠(例如结肠)、泌尿生殖道(例如,肾、尿路上皮细胞)、前列腺和咽的那些。腺癌包括诸如大多数结肠癌、直肠癌、肾细胞癌、肝癌、非小细胞肺癌、小肠癌和食管癌的恶性肿瘤。在一个实施例中,癌症是黑素瘤,例如晚期黑素瘤。还可以使用本发明的方法和组合物来治疗或预防上述癌症的转移性病灶。可以治疗的其他癌症的实例包括骨癌、胰腺癌、皮肤癌、头颈癌、皮肤或眼内恶性黑素瘤、子宫癌、卵巢癌、直肠癌、肛区癌、胃癌、睾丸癌、子宫癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、非霍奇金淋巴瘤、食道癌、小肠癌、内分泌系统癌症、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、慢性或急性白血病(包括急性骨髓性白血病、慢性骨髓性白血病、急性成淋巴细胞白血病、慢性成淋巴细胞性白血病)、儿童实体瘤、淋巴细胞性淋巴瘤、膀胱癌、肾或输尿管癌、肾盂癌、中枢神经系统肿瘤(cns)、原发性cns淋巴瘤、肿瘤血管生成、脊轴肿瘤、脑干胶质瘤、垂体腺瘤、卡波济氏肉瘤、表皮样癌、鳞状细胞癌、t细胞淋巴瘤、环境诱导的癌症(包括由石棉诱导的那些)、以及所述癌症的组合。可以使用本文描述的抗体分子来实现转移性癌症,例如表达pd-l1的转移性癌症的治疗(iwai等人(2005)int.immunol.[国际免疫学]17:133-144)。可以抑制其生长的示例性癌症包括典型地对免疫疗法有反应的癌症。用于治疗的癌症的非限制性实例包括黑素瘤(例如,转移性恶性黑素瘤)、肾癌(例如透明细胞癌)、前列腺癌(例如激素难治性前列腺腺癌)、乳腺癌、结肠癌和肺癌(例如非小细胞肺癌)。另外,可以使用本文描述的分子来治疗难治性或复发性恶性肿瘤。在一个方面,本发明涉及治疗受试者的癌症的方法。该方法包括向受试者施用本发明的细胞,以使得治疗受试者的癌症。在一个方面,与如本文描述的癌症相关抗原的表达相关的癌症是血液癌症。在一个方面,该血液癌症是白血病或淋巴瘤。在一个方面,与如本文描述的癌症相关抗原的表达相关的癌症包括癌症和恶性肿瘤,包括但不限于例如一种或多种急性白血病,包括但不限于例如b细胞急性淋巴细胞白血病(“ball”)、t细胞急性淋巴细胞白血病(“tall”)、急性淋巴细胞白血病(“all”);一种或多种慢性白血病,包括但不限于例如慢性髓细胞性白血病(cml)、慢性淋巴细胞白血病(cll)。与如本文描述的癌症相关抗原的表达相关的另外癌症或血液病状包括但不限于,例如b细胞幼淋巴细胞性白血病、母细胞性浆细胞样树突细胞肿瘤、伯基特淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、毛细胞白血病、小细胞或大细胞滤泡性淋巴瘤、恶性淋巴组织增生性病状、malt淋巴瘤、套细胞淋巴瘤、边缘区淋巴瘤、多发性骨髓瘤、骨髓增生异常和骨髓增生异常综合征、非霍奇金淋巴瘤、浆母细胞性淋巴瘤、浆细胞样树突细胞肿瘤、华氏(waldenstrom)巨球蛋白血症、和为由骨髓血细胞的无效产生(或发育异常)联合在一起的各种血液病状集合的“白血病前期”等。与如本文描述的癌症相关抗原表达相关的其他疾病包括但不限于例如非典型和/或非经典癌症、恶性肿瘤、癌前病状或与如本文描述的癌症相关抗原的表达相关的增生性疾病。造血干细胞和祖细胞的离体扩增程序描述于美国专利号5,199,942(通过援引并入本文)中,可以应用于本发明的细胞。其他合适的方法是本领域已知的,因此本发明不限于离体扩增细胞的任何具体方法。简言之,免疫效应细胞(例如t细胞\nk细胞)的离体培养和扩增包括:(1)从哺乳动物收集来自外周血收获物或骨髓外植体的cd34+造血干细胞和祖细胞;以及(2)离体扩增此类细胞。除了美国专利号5,199,942中描述的细胞生长因子,其他因子如flt3-l、il-1、il-3和c-kit配体也可以用于培养和扩增细胞。除了在离体免疫方面使用基于细胞的疫苗之外,本发明还提供了用于体内免疫以引发针对患者中的抗原的免疫应答的组合物和方法。血液癌症血液癌症病状是癌症的类型,如白血病、淋巴瘤以及影响血液、骨髓和淋巴系统的恶性淋巴组织增生性病状。白血病可以分类为急性白血病和慢性白血病。急性白血病可以进一步分类为急性髓细胞性白血病(aml)和急性淋巴细胞白血病(all)。慢性白血病包括慢性髓细胞性白血病(cml)和慢性淋巴细胞白血病(cll)。其他相关病状包括骨髓增生异常综合征(mds,以前称为“白血病前期”),其是由骨髓血细胞的无效产生(或发育异常)和转化为aml的风险联合的血液病状的多样化集合。淋巴瘤是一组从淋巴细胞发展的血细胞肿瘤。示例性淋巴瘤包括非霍奇金淋巴瘤和霍奇金淋巴瘤。本发明提供用于治疗癌症的组合物和方法。在一个方面,癌症是血液癌,包括但不限于作为白血病或淋巴瘤的血癌。在一个方面,本发明的细胞可用于治疗癌症和恶性肿瘤,如但不限于例如急性白血病,包括但不限于例如b细胞急性淋巴细胞白血病(ball)、t细胞急性淋巴细胞白血病(tall)、急性淋巴细胞白血病(all);一种或多种慢性白血病,包括但不限于例如慢性髓细胞性白血病(cml)、慢性淋巴细胞性白血病(cll);另外的血液癌症或血液病状包括但不限于,例如b细胞幼淋巴细胞性白血病、母细胞性浆细胞样树突细胞肿瘤、伯基特淋巴瘤、弥漫性大b细胞淋巴瘤、滤泡性淋巴瘤、毛细胞白血病、小细胞或大细胞滤泡性淋巴瘤、恶性淋巴组织增生性病状、malt淋巴瘤、套细胞淋巴瘤、边缘区淋巴瘤、多发性骨髓瘤、骨髓增生异常和骨髓增生异常综合征、非霍奇金淋巴瘤、浆母细胞性淋巴瘤、浆细胞样树突细胞肿瘤、华氏(waldenstrom)巨球蛋白血症、和为由骨髓血细胞的无效产生(或发育异常)联合在一起的各种血液病状集合的“白血病前期”等。与如本文描述的癌症相关抗原表达相关的其他疾病包括但不限于例如非典型和/或非经典癌症、恶性肿瘤、癌前病状或表达如本文描述的癌症相关抗原的增生性疾病。本发明还提供了用于预防、治疗和/或控制与表达如本文描述的癌症相关抗原的细胞相关的疾病(例如,表达如本文描述的癌症相关抗原的血液癌症或非典型癌症)的方法,这些方法包括向有需要的受试者施用本发明的t细胞或nk细胞,该t细胞或nk细胞结合至表达如本文描述的癌症相关抗原的细胞。在一个方面,受试者是人。与表达如本文描述的癌症相关抗原的细胞相关的病症的非限制性实例包括自身免疫性病症(如狼疮)、炎性病症(如过敏症和哮喘)和癌症(如表达如本文描述的癌症相关抗原的血液癌症或非典型癌症)。本发明还提供了用于预防、治疗和/或控制与表达如本文描述的癌症相关抗原的细胞相关的疾病的方法,这些方法包括向有需要的受试者施用本发明的t细胞或nk细胞,该t细胞或nk细胞结合至表达如本文描述的癌症相关抗原的细胞。在一个方面,受试者是人。本发明提供了用于预防与表达如本文描述的癌症相关抗原的细胞相关的癌症的复发的方法,这些方法包括向有需要的受试者施用本发明的t细胞或nk细胞,该t细胞或nk细胞结合至表达如本文描述的癌症相关抗原的细胞。在一个方面,这些方法包括向有需要的受试者施用有效量的本文描述t细胞或nk细胞与有效量的另一种疗法的组合,该t细胞或nk细胞结合至表达如本文描述的癌症相关抗原的细胞。药物组合物和治疗本发明的药物组合物可以包含表达嵌合蛋白的细胞(例如,如本文描述的多个表达嵌合蛋白的细胞),以及一种或多种药学上或生理学上可接受的载体、稀释剂或赋形剂。此类组合物可以包含缓冲液,如中性缓冲盐水、磷酸盐缓冲盐水等;碳水化合物,如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸如甘氨酸;抗氧化剂;螯合剂,如edta或谷胱甘肽;佐剂(例如氢氧化铝);以及防腐剂。在一个方面,本发明的组合物被配制用于静脉内施用。本发明的药物组合物能以适合于待治疗(或预防)的疾病的方式施用。施用的总量和频率将由如患者的状况以及患者的疾病的类型和严重程度等因素来确定,然而适当的剂量可以通过临床试验来确定。在一个实施例中,药物组合物基本上不含,例如不存在可检测水平的例如选自下组的污染物,该组由以下组成:内毒素、支原体、复制型慢病毒(rcl)、p24、vsv-g核酸、hivgag、残留的抗cd3/抗cd28包被的珠、小鼠抗体、合并的人血清、牛血清白蛋白、牛血清、培养基组分、载体包装细胞或质粒组分、细菌和真菌。在一个实施例中,细菌是选自下组的至少一种,该组由以下组成:粪产碱菌、白色念珠菌、大肠杆菌、流感嗜血杆菌、脑膜炎奈瑟氏菌、铜绿假单胞菌、金黄色葡萄球菌、肺炎链球菌、以及酿脓链球菌a组。当指示“免疫有效量”、“抗肿瘤有效量”、“肿瘤抑制有效量”或“治疗量”时,医生可以考虑到年龄、体重、肿瘤大小、感染或转移的程度以及患者(受试者)的状况的个体差异来确定待施用的本发明组合物的精确量。通常可以说,可以将包含本文描述的免疫效应细胞(例如,t细胞、nk细胞)的药物组合物以104至109个细胞/kg体重、在一些情况下105至106个细胞/kg体重(包括那些范围内的所有整数值)的剂量施用。还可以将t细胞组合物以这些剂量多次施用。可以通过使用在免疫疗法中通常已知的输注技术来施用细胞(参见例如rosenberg等人,neweng.j.ofmed.[新英格兰医学杂志]319:1676,1988)。在某些方面,可能希望向受试者施用活化的免疫效应细胞(例如,t细胞、nk细胞),并且然后随后重抽血液(或进行单采血液成分术),根据本发明从其活化免疫效应细胞(例如,t细胞、nk细胞),并用这些活化和扩增的免疫效应细胞(例如,t细胞、nk细胞)回输患者。该过程可以每隔几周进行多次。在某些方面,可以将来自从10cc至400cc抽血的免疫效应细胞(例如,t细胞、nk细胞)活化。在某些方面,将来自20cc、30cc、40cc、50cc、60cc、70cc、80cc、90cc、或100cc抽血的免疫效应细胞(例如,t细胞、nk细胞)活化。能以任何常规方式施用主题组合物,包括通过雾化吸入、注射、摄取、输血、植入或移植。可以向患者经动脉、皮下、真皮内、瘤内、结内、髓内、肌内、通过静脉内(i.v.)注射、或者腹膜内施用本文描述的组合物。在一个方面,通过真皮内或皮下注射向患者施用本发明的t细胞组合物。在一个方面,通过静脉内注射来施用本发明的t细胞组合物。可以将免疫效应细胞(例如,t细胞、nk细胞)的组合物直接注射到肿瘤、淋巴结或感染部位中。在特定的示例性方面,受试者可以经历白细胞单采法,其中离体收集、富集、或耗尽白细胞以选择和/或分离感兴趣的细胞(例如t细胞)。这些t细胞分离物可以通过本领域已知的方法扩增并处理,使得可以引入本发明的一个或多个构建体,从而产生本发明的t细胞。有需要的受试者可以随后经历使用高剂量化疗的标准治疗,随后进行外周血干细胞移植。在某些方面,在移植之后或与移植同时,受试者接受输注本发明的扩增的t细胞。在另外的方面,在手术之前或之后施用扩增的细胞。有待向患者施用的以上治疗的剂量将随着所治疗病症的确切性质和该治疗的受者而变化。可以根据本领域接受的做法来进行人类施用的剂量的缩放。例如,对于成年患者,campath的剂量通常将在1至约100mg的范围内,通常每天施用持续1至30天的时间。优选的日剂量是每天1至10mg,但在一些情况下,更大剂量的多达实例通过参考以下实验实例进一步详细描述本发明。提供这些实例仅用于说明的目的,除非另有说明,否则不应旨在是限制性的。因此,本发明决不应被解释为限于以下实例,而是应该被解释为涵盖由于本文提供的传授内容而变得明显的任何和所有变化。实例1:使用细胞内异源二聚化结构域的组成型活性的tcar瞬时表达和活化测定材料和方法组成型活性的tcar构建体的合成用dna2.0外部地合成质粒dna对。将命名的非可调节car构建体,cd19scfv-bbz,seqidno:1用作对照。对于tcar,可以将各种细胞内异源二聚化结构域连接至如图1中示出的tcar构建体的不同结构域。“tcar1”包含一对构建体。在第一构建体中,cd19scfv与以下一起克隆:cd8铰链和跨膜结构域,随后是共刺激结构域4-1bb,以及在c末端的异源二聚化结构域vps28(seqidno:2)。通过将异源二聚化结构域vps36融合至在cd3ε的c末端的接头,设计相应的第二构建体(seqidno:3)。“tcar2”包含一对构建体。在第一构建体中,cd19scfv与以下一起克隆:cd8铰链和跨膜结构域,随后是共刺激结构域4-1bb,以及在c末端的异源二聚化结构域mjun(seqidno:4)。通过将异源二聚化结构域mfos融合至在cd3ε的c末端的接头,设计相应的第二构建体(seqidno:5)。cd19scfv-bbz(seqidno:1)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyynsslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvsstttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprcd19scfv-bb-vps28(seqidno:2)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvsstttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycslkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelmfnakyvaeatgnfitvmdalklnynakdqlhpllaellisinrvtrddfenrsklidwivrinklsigdtltetqirellfdlelayksfyalldcd3e-vps36(seqidno:3)gsmqsgthwrvlglcllsvgvwgqdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsknrkakakpvtrgagaggrqrgqnkerpppvpnpdyepirkgqrdlysglnqrrigsgsggsgsgggsgsgssgasadvvstwvcpicmvsnetqgeftkdtlptpicincgvpadyeltkssincsnaidpnanprnqfgcd19scfv-bb-mjun(seqidno:4)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvsstttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycslkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelriarleeevktleaqnselastanmleeqvaqlkqkvcd3e-mfos(seqidno:5)gsmqsgthwrvlglcllsvgvwgqdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsknrkakakpvtrgagaggrqrgqnkerpppvpnpdyepirkgqrdlysglnqrrigsgsggsltdtlqaktdqlkdeksalqtkianllkekeklefil用于car功能的初始表征的jurkat报告基因细胞系的产生。作为初始t细胞转导和活化的替代方案,jurkat-nfat报告基因细胞系可以用于评估car构建体的功能活性。用nfat萤光素酶报告基因构建体转染jurkatt细胞系(e6-1),并且基于在pma和离子霉素刺激后nfat报告基因的强诱导,选择具有nfat-luc报告基因的稳定的、克隆细胞系jurket细胞(jnl)用于进一步表征。jurkat报告基因细胞系的转染和nfat的活化。在具有0.5μg/ml的嘌呤霉素的含有2mm谷氨酰胺和10%胎牛血清的rpmi-1640培养基中,将具有nfat-luc报告基因的jurkat细胞(jnl)生长至0.5-1.0x106/ml的密度。对于每次转染,在100g离心10分钟沉降2.0x106个细胞。每次转染,对于对照car的共转染,每次使用1μgdna,或对于对照car的单次转染,每次使用2μgdna。将amaxanucleofector溶液v和补充物i混合,并且将100μl添加至具有dna构建体的管中。然后将混合物添加至细胞,并且转移至电穿孔小槽中。使用maxanucleofectorii装置,在设置x-001下,进行电穿孔。在电穿孔后,立即添加0.4ml的含有2mm谷氨酰胺和10%fbs的rpmi-1640培养基,并且将混合物转移至6孔板的一个孔中的0.25ml生长培养基中,并且允许恢复至少3小时。在细胞恢复期间,用抗cd19个体基因型抗体或无关人igg1-fc阴性对照包被白色硬底部组织培养物处理的板2小时,随后在37℃、5%co2下,用fbs中的5%bsa封闭30分钟。然后吸出封闭缓冲液。一式三份平铺100μl的转染的jurkat构建体中的每一个。在过夜孵育后,将100μl的one-glo萤光素酶(普洛麦格公司(promega))试剂添加至每个孔。为了确定抗独特型抗体孔相对于阴性对照孔的活化倍数,然后将板孵育5min,从而允许萤光素酶信号的平衡,并且使用envision多标记读数仪中读板。转染的jurkat(jnl)细胞中的il-2表达除了在37℃,5%co2下孵育40-48小时,在jnlrga测定中如以上描述进行jnl细胞的转染和活化。通过在300xg离心10分钟,从细胞收集上清液。使用mesoscalediscovery人il-2试剂盒(mesoscale)测量il-2表达的水平。所有提供的试剂都根据制造商的说明书制备。将50μl的收集的上清液(纯)和制备的标准物添加至预包被的msd板,并且在振荡下在室温孵育两小时。用300μlpbs+tween20洗涤板3x,并且将25μl检测抗体溶液添加至每个孔。再次在振荡下在室温孵育板2小时,并且用先前条件洗涤,并且将150μl2x读数缓冲液t添加至每个孔。立即在msd仪器上,读取板的人il-2水平。瞬时表达结果经由tcar1和tcar2的jnl细胞的电穿孔的瞬时转染,证明了在报告基因测定中,抗原依赖性信号传导,如示出在图2中。在rga测定中,与阳性对照car、cd19scfv-bbz相比,基于tcar1、vps28/vps36的异源二聚体展示了相对于背景的相似倍数。评估了活化40小时后il2的表达。对于tcar1,观察到抗原依赖性il2表达;这是由于在jnlrga测定中低内在信号,未评估tcar2。经由接头长度优化异源二聚化结构域的取向,增强异源二聚化结构域彼此之间的亲和力,和/或增强cd3ε界面与tcr复合物的剩余部分的亲和力,将预期在信号传导和il2表达方面的进一步增强。慢病毒转导的初始人t细胞的产生与cd19scfv-bbz相比,使用经由慢病毒转导产生的初始人t细胞,体外评估tcar1。慢病毒产生使用lipofectamine2000(英杰公司(invitrogen))转染试剂,与prsv.rev,pmdl.g/p.rre和pvsvg包装质粒一起用慢病毒质粒共转染在补充有10%fbs和非必需氨基酸的dmem中生长的lenti-x293t细胞(克罗泰克公司(clontech))。在转染后48小时,收获含有慢病毒载体的上清液,并且使用lenti-x浓缩器浓缩,并且在1,500xg离心45分钟。将浓缩的载体储存在-80℃,直至进一步使用。使用对在补充有10%fbs的rpmi-1640中培养的sup-t1细胞(atcc)的有限稀释来确定慢病毒载体滴度。将载体3倍连续稀释,然后将50ul的稀释的载体添加至含有sup-t1细胞的平底微量滴定板中。72小时后,收获细胞,并且使用蛋白l,经由facs分析scfv表达。使用以下方程,从载体稀释计算按转导单位/ml(tu/ml)计的滴度,其中sup-t1细胞中的阳性表达百分比小于20%,但是大于5%:tu/ml=(%阳性/100)x2e4x稀释系数x20t细胞分离和病毒转导进入初始t细胞经由macs阴性选择(美天旎公司(miltenyi)泛t细胞分离试剂盒)从获得自细胞技术公司(cellulartechnologylimited)的人pbmc分离正常供体t细胞。在补充有10%fbs、100u/ml青霉素、100μg/ml链霉素、10mmhepes和1mm非必需氨基酸的rpmi中培养纯化的t细胞,并且按3:1的珠与细胞比率,用dynabeads人t细胞活化因子cd3/cd28珠(英杰公司(invitrogen))活化。在活化18-24小时后,将t细胞用慢病毒以5的感染复数(moi)进行转导。每2-3天扩增转导的t细胞,持续10天,维持约75万/ml的细胞密度。将细胞等分,并且低温冷冻。细胞毒性和il2测定针对转导的t细胞,分析其杀死表达靶标的细胞系的能力,连同分泌细胞因子il2的能力;用作增殖的替代物。将在具有10%fbs和k562(阴性对照)的rpmi中培养的、在具有10%fbs的imdm中培养的表达靶标的细胞系nalm6(cd19)都工程化为在嘌呤霉素选择下稳定表达萤火虫萤光素酶。简言之,经由facs,分析解冻的转导的t细胞的car表达百分比。通过用分离的、扩增的、冷冻/解冻的未转导的t细胞稀释,将所有构建体都归一化为10%car阳性表达。然后在各种效应物与靶标比率下,在200μl培养基中培养转导的、归一化的t细胞,使靶细胞保持恒定在2.5e4个细胞/孔。在不存在效应细胞的情况下,单独平铺靶细胞,从而确定最大发光。在18-20小时后,除去100μl培养上清液用于随后的il2分析,并且将100μl的oneglo(普洛麦格公司(promega))萤光素酶底物添加至剩余上清液和细胞。在10分钟孵育后,在envision读板仪上测量发光。使用以下方程计算特异性裂解百分比:特异性裂解(%)=(1-(样品发光/平均最大发光))*100按照制造商的说明,经由msdelisa,针对il2的量,分析收获的上清液。初始人t细胞结果图3和图4示出了相对于对照cd19scfv-bbz,“tcar1”的功能活性。如从重定向裂解测定和il2表达结果可以观察出,tcar1展示了减少的功能。不清楚的是,如果在转导条件下在t细胞中表达这两种构建体;可能需要进一步优化来确保在同一细胞中,含有这两种异源二聚化结构域的两种构建体的同时表达。另外,可能需要通过经由接头长度优化异源二聚化结构域的取向或增强异源二聚化结构域彼此之间的亲和力来进一步增强。然而,瞬时信号传导结果证明了这些类型的嵌合抗原受体的潜力。实例2:使用细胞内异源二聚化结构域,具有增强的增殖的组成型活性的tcar(图5-9)具有多个共刺激结构域的组成型活性的tcar的合成将用dna2.0外部地合成质粒dna对。将命名的非可调节car构建体,cd19scfv-bbz,seqidno:1将用作对照。“tcar1”包含一对构建体。在第一构建体中,cd19scfv与以下一起克隆:cd8铰链和跨膜结构域,随后是共刺激结构域4-1bb,以及在c末端的异源二聚化结构域vps28(seqidno:2)。通过将异源二聚化结构域vps36融合至在cd3ε的c末端的接头,如以上设计相应的第二构建体(seqidno:3)。“tcar3”(图5)包含一对构建体。在第一构建体中,cd19scfv将与以下一起克隆:cd8铰链和跨膜结构域,随后是共刺激结构域4-1bb,以及在c末端的异源二聚化结构域vps28(seqidno:2)。将通过将cd28的细胞内共刺激结构域(随后是vps36)融合至cd3ε细胞外结构域和跨膜结构域的c-末端,设计相应的第二构建体(seqidno:6)。cd3eecdtm-cd28-vps36(seqidno:6)gsmqsgthwrvlglcllsvgvwgqdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsrskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrsgsgsggsgsgggsgsgssgasadvvstwvcpicmvsnetqgeftkdtlptpicincgvpadyeltkssincsnaidpnanprnqfgjurkat报告基因细胞系的转染和nfat的活化。将用具有nfat-luc报告基因的jurkat细胞(jnl),如实例1中描述的报告细胞系,测量抗原结合结构域的靶抗原参与后的活化。以100μl/孔,将转染的细胞添加至靶标平板。每孔添加100μl萤光素酶oneglo试剂。将样品孵育5min,然后将如描述的测量发光。转染的jurkat(jnl)细胞中的il-2表达除了将在37℃,5%co2下孵育40-48小时,将在jnlrga测定中如以上描述进行jnl细胞的转染和活化。如实例1中描述,将进行分泌的il2的测量。实例3:经由cd3ε,将组成型活性的tcar融合进tcr复合物(fustcar)(图10-11)。瞬时表达和活化测定fustcar构建体的合成用dna2.0外部地合成质粒dna。将命名的非可调节car构建体cd19scfv-bbz(seqidno:1)用作对照。对于fustcar,可以将靶向结构域直接融合至具有或不具有细胞内共刺激结构域和信号传导结构域的tcr复合物的不同成员。在“fustcar1”(图12)中,将cd19scfv克隆为与完整cd3ε蛋白的n-末端的融合(seqidno:7)。将“fustcar2”(图13)克隆为与完整cd3ε蛋白的n-末端的融合,随完整cd3ε蛋白后是4-1bb的细胞内共刺激结构域的c-末端融合(seqidno:8)。“fustcar3”(图14)缺少内部内源itam结构域。将cd19scfv克隆到cd3细胞外结构域和跨膜结构域的n-末端上,随跨膜结构域后是细胞内共刺激结构域4-1bb(seqidno:9)。cd19scfv-cd3e(seqidno:7)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsknrkakakpvtrgagaggrqrgqnkerpppvpnpdyepirkgqrdlysglnqrricd19scfv-cd3e-41bb(seqidno:8)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsknrkakakpvtrgagaggrqrgqnkerpppvpnpdyepirkgqrdlysglnqrrigsgsggskrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-cd3eecdtm-41bb(seqidno:9)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywskrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggceljurkat报告基因细胞系的转染和nfat的活化。用具有nfat-luc报告基因的jurkat细胞(jnl),如实例1中描述的报告细胞系,测量抗原结合结构域的靶抗原参与后的活化。以100μl/孔,将转染的细胞添加至靶标平板。每孔添加100μl萤光素酶oneglo试剂。将样品孵育5min,然后如描述的测量发光。转染的jurkat(jnl)细胞中的il-2表达除了在37℃,5%co2下孵育40-48小时,在jnlrga测定中如以上描述进行jnl细胞的转染和活化。如实例1中描述,进行抗原依赖性il2的测量。瞬时表达结果经由瞬时转染到jnl细胞中,fustcar1、fustcar2和fustcar3的初始筛选展示了抗原依赖性信号传导,如图15中示出。重要的是,在fustcar3(其是截短的并且缺少cd3ε的itam信号传导结构域)情况下仍观察到信号传导。因此,含有itam信号传导结构域的构建体的转染并不是fustcar的活性的前提。通过使靶向结构域与tcr复合物相关联,信号传导是通过复合物的所有成员介导的,并且并不仅限于源自与靶向结构域融合的信号传导结构域的那些。慢病毒转导的初始人t细胞的产生也在初始人t细胞中测试了fustcar的活性。在产生慢病毒之前,还设计了另外的构建体以确认功能性itams对于传统car构建体的体外活性的依赖,并且确认无论是否存在功能itams情况下tcar的独立活性。用dna2.0外部地合成质粒dna。合成了第一代car设计构建体,cd19scfv-zeta,seqidno:10;将cd19scfv克隆为cd8a接头和跨膜结构域的n-末端的融合,随跨膜结构域后是细胞内信号传导结构域cd3ζ。类似地克隆第二构建体(seqidno:11),除了注释为磷酸化的cd3ζ内的所有细胞内酪氨酸残疾都被切换为苯丙氨酸,以取消细胞内磷酸酪氨酸信号传导。因为细胞内共刺激结构域与细胞内信号传导结构域的组合先前已经展示有益于典型的car构建体,克隆最终构建体,由此cd19scfv为cd8a接头和跨膜结构域的n-末端的融合,随跨膜结构域后是4-1bb;没有cd3ζ信号传导结构域包含在此构建体中(seqidno:12)。最后,将类似的fustcar合成为cd19scfv-zeta_7ytof。“fustcar4”缺少内部内源itam结构域。将cd19scfv,seqidno:13克隆为完整cd3ε蛋白的n-末端融合,除了注释为磷酸化的那些酪氨酸被突变为苯丙氨酸,使得与cd3εitam相关的内在信号传导途径无活性。cd19scfv-zeta(seqidno:10)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyynsslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvsstttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprcd19scfv-zeta_7ytof(seqidno:11)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyynsslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvsstttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycrvkfsrsadapafkqgqnqlfnelnlgrreefdvldkrrgrdpemggkprrknpqeglfnelqkdkmaeafseigmkgerrrgkghdglfqglstatkdtfdalhmqalpprcd19scfv-bb(seqidno:12)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyynsslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvsstttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-cd3e_2ytof(seqidno:13)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsknrkakakpvtrgagaggrqrgqnkerpppvpnpdfepirkgqrdlfsglnqrri慢病毒产生和病毒转导进入初始t细胞如在实例1中描述,产生慢病毒并且转导进入分离的初始人t细胞。扩增转导的t细胞和未转导的对照t细胞,并且冷冻用于随后的分析。细胞毒性和il2测定如实例1中描述,评估通过使初始人t细胞与靶肿瘤细胞交联诱导的细胞毒性和il2产生。初始人t细胞结果如在图16和17可以观察到的,传统car需要功能性内源itam信号传导结构域,从而诱导靶细胞的最大t细胞重定向裂解和il2产生。在两个元件中,构建体(其中cd3ζ被41bb替代,或被突变以灭活cd3ζ中的itams)是有缺陷的。相反,图18和图19展示了fustcar活性是特异性的并且独立于内源功能性itam。无论是否存在共刺激结构域或它们的顺序,观察到重定向裂解活性和il2分泌。此外,无论信号传导中涉及的关键酪氨酸的突变还是cd3ε的细胞内结构域的完全除去,都没有导致tcar的体外功能活性的可察觉损失。实例4:使用rapalogue开关可调节的tcar(图20-24)rapalogue开关介导的rtcar构建体的合成用dna2.0外部地合成质粒dna对。将命名的非可调节car构建体,cd19scfv-bbz,seqidno:1用作对照。对于rtcar,可以将各种异源二聚化结构域连接至rtcar构建体的不同结构域。“rtcar1”(图25)包含一对构建体。在第一个构建体中,cd19scfv与以下一起克隆:cd8铰链和跨膜结构域,随后是共刺激结构域4-1bb,以及在c末端的fkbp(seqidno:14)。通过将具有与rad001的增强亲和力的突变的frb结构域融合至在cd3ε的c末端的接头,设计相应的第二构建体(seqidno:15)。“rtcar2”(图26)包含一对构建体。在第一个构建体中,cd19scfv与以下一起克隆:cd8铰链和跨膜结构域,随后是共刺激结构域4-1bb,以及在c末端的fkbp(seqidno:14)。通过将具有与rad001的增强亲和力的突变的frb结构域融合至在cd3ε的c末端的接头,设计相应的第二构建体。另外,将cd3ε的itam结构域内的两个酪氨酸突变为苯丙氨酸,以从cd3ε除去内在的信号传导途径,并且展示信号传导是从整个tcr复合物介导的(seqidno:16)。cd19scfv-bb-fkbp(seqidno:14)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvsstttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycslkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelmgvqvetispgdgrtfpkrgqtcvvhytgmledgkkfdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellklecd3e-frb突变体(seqidno:15)gsmqsgthwrvlglcllsvgvwgqdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsknrkakakpvtrgagaggrqrgqnkerpppvpnpdyepirkgqrdlysglnqrrigsgsggsilwhemwheglieasrlyfgernvkgmfevleplhammergpqtlketsfnqaygrdlmeaqewcrkymksgnvkdllqawdlyyhvfrriskcd3e-ytof双-frb突变体(seqidno:16)gsmqsgthwrvlglcllsvgvwgqdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsknrkakakpvtrgagaggrqrgqnkerpppvpnpdfepirkgqrdlfsglnqrrigsgsggsilwhemwheglieasrlyfgernvkgmfevleplhammergpqtlketsfnqaygrdlmeaqewcrkymksgnvkdllqawdlyyhvfrriskrapalogue对nfat活化的剂量应答用具有nfat-luc报告基因的jurkat细胞(jnl),如实例1中描述的报告细胞系,测量在抗原结合结构域的靶抗原参与后,rcar构建体展示rapalogue依赖性信号活化的能力。以100μl/孔,将转染的细胞添加至靶标平板,并且与不同浓度的rad001一起孵育18hr。每孔添加100μl萤光素酶oneglo试剂。将样品孵育5min,然后如描述的测量发光。转染的jurkat(jnl)细胞中的il-2表达除了在37℃,5%co2下孵育40小时,在jnlrga测定中如以上描述进行jnl细胞的转染和活化。如实例1中描述,将进行分泌的il2的测量。结果经由瞬时转染进jnl细胞的rtcar1的初始筛选展示了rad001介导的和抗原依赖性的信号传导,以及il2表达,如图27中示出。在随后的实验中,将rtcar1与rtcar2(其中通过将相应的酪氨酸突变为苯丙氨酸,取消了瞬时转染的cd3ε的itam信号传导)相比。在两个报告基因基因测定中,连同在抗原诱导的il2表达中,针对rtcar1和rtcar2,观察到用rad001的剂量应答(图28),尽管针对rtcar2,信号和表达如预期减少。因此,含有itam信号传导结构域的构建体的转染并不是rtcar的活性的前提。通过使靶向结构域与tcr复合物相关联,信号传导是通过复合物的所有成员介导的,并且并不仅限于源自与靶向结构域融合的信号传导结构域的那些。实例6:经由截短的cd3ε细胞外结构域,将组成型活性的tcar融合进tcr复合物(fustcar)。已经报道了与抗cd3单克隆抗体okt3的fab片段复合的cd3ε和γ的晶体结构(kjer-nielsen等人,2004),以及与抗cd3单克隆abucht1的scfv复合的cd3ε和δ的晶体结构(arnett等人,2004)。这些结构展示了ε与其他辅助蛋白的相互作用是通过膜近端的β片层介导的。因此,靶向结构域与由含有β片层的序列组成的cd3ε细胞外结构域的截短形式的融合可能仅是fustcar活性的前提。瞬时表达fustcar构建体的合成用dna2.0外部地合成质粒dna。将命名的非可调节car构建体,cd19scfv-bbz,seqidno:1用作对照。在“fustcar5”中,将cd19scfv克隆为cd3ε细胞外结构域和跨膜结构域的n-末端截短形式的n-末端的融合,随跨膜结构域后是细胞内共刺激结构域4-1bb(seqidno:17)。与“fustcar5”类似地克隆“fustcar6”“fustcar7”和“fustcar8”,从而阐明在cd3ε(其似乎并不参与介导与其他tcr复合物成员的相互作用的分子内二硫键)中两个膜近端半胱氨酸的作用。对于“fustcar6”(seqidno:18),将第一半胱氨酸突变为丝氨酸。在“fustcar7”(seqidno:19)中,将第二半胱氨酸突变为丝氨酸。最后,对于“fustcar8”(seqidno:20),将两个半胱氨酸都突变为丝氨酸。此实例中所有四种构建体都缺少内在的细胞内itam信号传导结构域。cd19scfv-cd3e_minimalecdtm-41bb(seqidno:17)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggspedanfylylrarvcencmemdvmsvativivdicitggllllvyywskrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-cd3e_minimalecd-1stcystoser-tm-41bb(seqidno:18)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggspedanfylylrarvsencmemdvmsvativivdicitggllllvyywskrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-cd3e_minimalecdtm-2ndcystoser-tm-41bb(seqidno:19)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggspedanfylylrarvcensmemdvmsvativivdicitggllllvyywskrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-cd3e_minimalecdtm-2xcystoser-tm-41bb(seqidno:20)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggspedanfylylrarvsensmemdvmsvativivdicitggllllvyywskrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggceljurkat报告基因细胞系的转染和nfat的活化。用具有nfat-luc报告基因的jurkat细胞(jnl),如实例1中描述的报告细胞系,测量抗原结合结构域的靶抗原参与后的活化。以100μl/孔,将转染的细胞添加至靶标平板。每孔添加100μl萤光素酶oneglo试剂。将样品孵育5min,然后如描述的测量发光。瞬时表达结果在使用截短的细胞外结构域瞬时表达的fustcar中未观察到靶标依赖性信号传导。随后的fac分析展示,在细胞表明上,不存在构建体的可检测表达。慢病毒转导的初始人t细胞的产生为了确定对于报告基因细胞系,低表达是否独特,针对相对于cd19scfv-bbz的活性,还在初始人t细胞中测试了单个代表性截短的融合构建体fustcar6。慢病毒产生和病毒转导进入初始t细胞如在实例1中描述,产生慢病毒并且转导进入分离的初始人t细胞。扩增转导的t细胞和未转导的对照t细胞,并且冷冻用于随后的分析。细胞毒性和il2测定如实例1中描述,评估通过使初始人t细胞与靶肿瘤细胞交联诱导的细胞毒性和il2产生。初始人t细胞结果如可以在图29中观察到,相对于对照cd19scfv-bbzcar,fustcar6展示了可比较的细胞裂解活性。重要的是应注意,尽管不存在itam信号传导结构域,观察到重定向裂解活性。相反,如图30中示出,fustcar6导致减少的il2表达。为了稳定β片层或改善截短的cd3ε与tcr的剩余内源组分的相互作用,构建体的另外优化是必需的。尽管如此,结果证明,并不需要cd3ε的细胞外区域的整个细胞外结构域来维持细胞裂解活性。实例7:经由具有替代性共刺激结构域的cd3ε,将组成型活性的tcar融合进tcr复合物。具有除了4-1bb以外的替代性共刺激结构域的传统car已经展示是有功能的。慢病毒转导的初始人t细胞的产生fustcar构建体的合成将用dna2.0外部地合成质粒dna。将命名的非可调节car构建体cd19scfv-bbz(seqidno:1)用作对照,并且将“fuscar3”用作tcar对照(seqidno:9)。在下表列出的fustcar中,将cd19scfv克隆为与cd3ε细胞外结构域和跨膜结构域的n-末端的融合,随跨膜结构域后是如所指定的细胞内共刺激结构域。“fustcar9”至“fustcar13”缺少内在的细胞内itam信号传导结构域。“fustcar”共刺激结构域seqidnofustcar9cd2721fustcar10cd2822fustcar11ox4023fustcar12icos24fustcar13cd225cd19scfv-cd3eecdtm-cd27(seqidno:21)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsqrrkyrsnkgespvepaepchyscpreeegstipiqedyrkpepacspcd19scfv-cd3eecdtm-cd28(seqidno:22)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsrskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrscd19scfv-cd3eecdtm-ox40(seqidno:23)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsrrdqrlppdahkppgggsfrtpiqeeqadahstlakicd19scfv-cd3eecdtm-icos(seqidno:24)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywstkkkysssvhdpngeymfmravntakksrltdvtlcd19scfv-cd3eecdtm-cd2(seqidno:25)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywskrkkqrsrrndeeletrahrvateergrkphqipastpqnpatsqhpppppghrsqapshrppppghrvqhqpqkrppapsgtqvhqqkgpplprprvqpkpphgaaenslspssn慢病毒产生和病毒转导进入初始t细胞如在实例1中描述,产生慢病毒并且转导进入分离的初始人t细胞。扩增转导的t细胞和未转导的对照t细胞,并且冷冻用于随后的分析。细胞毒性和il2测定如实例1中描述,评估通过使初始人t细胞与靶肿瘤细胞交联诱导的细胞毒性和il2产生。初始人t细胞结果图31和图32展示,可以采用fustcar,其具有任何共刺激结构域,并且仍保留靶标依赖性细胞裂解活性,并且诱导il2表达,尽管缺少构建体内的itam结构域。实例8:经由cd3γ、cd3δ和cd3ζ,将组成型活性的tcar融合进tcr复合物(fustcar)。给定tcr复合物的复合多蛋白构架,针对tcar的活性并不限于与cd3ε的共价与非共价融合。与复合物中其他辅助蛋白(例如像cd3γ、cd3δ和cd3ζ)的非共价和共价融合还产生了活性tcar。另外,由于免疫突触可以由靶细胞和t细胞之间的距离介导,通过使用肿瘤靶向臂和与这些辅助蛋白的融合物之间的不同长度的接头来介导最佳长度可能变得必需。瞬时表达和活化测定fustcar构建体的合成将用dna2.0外部地合成质粒dna。将命名的非可调节car构建体,cd19scfv-bbz,seqidno:1将用作对照。在“fustcar14”中,将cd19scfv克隆为与cd3δ细胞外结构域和跨膜结构域的利用2xg4s接头(seqidno:62)的n-末端融合,随跨膜结构域后是细胞内共刺激结构域4-1bb(seqidno:26)。类似地,将克隆“fustcar15”(seqidno:27),除了在scfv和cd3ε细胞外结构域之间利用4xg4s接头(seqidno:45)。在“fustcar16”中,将cd19scfv克隆为cd3δ细胞外结构域和跨膜结构域的n-末端的融合,随跨膜结构域后是细胞内共刺激结构域4-1bb(seqidno:28)。类似地克隆“fustcar17”(seqidno:29)和“fuscar18”(seqidno:30),除了在scfv和cd3δ细胞外结构域之间分别利用2xg4s(seqidno:62)和4xg4s(seqidno:45)接头。在“fustcar19”中,将cd19scfv克隆为cd3γ细胞外结构域和跨膜结构域的n-末端的融合,随跨膜结构域后是细胞内共刺激结构域4-1bb(seqidno:31)。类似地克隆“fustcar20”(seqidno:32)和“fustcar21”(seqidno:33),除了在scfv和cd3γ细胞外结构域之间分别利用2xg4s(seqidno:62)和4xg4s(seqidno:45)接头。cd19scfv-cd3e_2g4s_ecdtm-41bb(seqidno:26/“2g4s”,披露为seqidno:62)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywskrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-cd3e_4g4s_ecdtm-41bb(seqidno:27/“4g4s”,披露为seqidno:45)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsggggsggggsggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywskrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-cd3d_ecdtm-41bb(seqidno:28)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsfkipieeledrvfvncntsitwvegtvgtllsditrldlgkrildprgiyrcngtdiykdkestvqvhyrmcqscveldpatvagiivtdviatlllalgvfcfakrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-cd3d_2g4s_ecdtm-41bb(seqidno:29/“2g4s”,披露为seqidno:62)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsggggsfkipieeledrvfvncntsitwvegtvgtllsditrldlgkrildprgiyrcngtdiykdkestvqvhyrmcqscveldpatvagiivtdviatlllalgvfcfakrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-cd3d_4g4s_ecdtm-41bb(seqidno:30/“4g4s”,披露为seqidno:45)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsggggsggggsggggsfkipieeledrvfvncntsitwvegtvgtllsditrldlgkrildprgiyrcngtdiykdkestvqvhyrmcqscveldpatvagiivtdviatlllalgvfcfakrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-cd3gecdtm-41bb(seqidno:31)gsatmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsqsikgnhlvkvydyqedgsvlltcdaeaknitwfkdgkmigfltedkkkwnlgsnakdprgmyqckgsqnkskplqvyyrmcqncielnaatisgflfaeivsifvlavgvyfiakrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-2g4s_cd3gecdtm-41bb(seqidno:32/“2g4s”,披露为seqidno:62)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsggggsqsikgnhlvkvydyqedgsvlltcdaeaknitwfkdgkmigfltedkkkwnlgsnakdprgmyqckgsqnkskplqvyyrmcqncielnaatisgflfaeivsifvlavgvyfiakrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelcd19scfv-4g4s_cd3gecdtm-41bb(seqidno:33/“4g4s”,披露为seqidno:45)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsggggsggggsggggsqsikgnhlvkvydyqedgsvlltcdaeaknitwfkdgkmigfltedkkkwnlgsnakdprgmyqckgsqnkskplqvyyrmcqncielnaatisgflfaeivsifvlavgvyfiakrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggceljurkat报告基因细胞系的转染和nfat的活化。用具有nfat-luc报告基因的jurkat细胞(jnl),如实例1中描述的报告细胞系,测量抗原结合结构域的靶抗原参与后的活化。以100μl/孔,将转染的细胞添加至靶标平板。每孔添加100μl萤光素酶oneglo试剂。将样品孵育5min,然后如描述的测量发光。瞬时转染结果图33展示了tcar是有功能的,并且导致经由nfat途径的信号传导,无论是cd3ε还是cd3γ用于构建体中的融合。另外,可以采用各种长度的接头,从而将结合结构域融合至tcar的剩余部分,以便获得希望的结果。基于facs,与cd3δ融合的构建体并不在报告基因细胞的细胞表面上瞬时表达,所以基于此方法,不能确定其适合性,并且替而在初始人t细胞中进行评估。慢病毒转导的初始人t细胞的产生也在初始人t细胞中测试了fustcar的活性。在产生慢病毒之前,还设计了另外的构建体,从而测试在不存在cd3ζ的细胞内结构域的情况下,是否可以使用cd3ζ的细胞外结构域和跨膜结构域。用dna2.0外部地合成质粒dna。在“fustcar22”中,将cd19scfv克隆为cd3ζ细胞外结构域和跨膜结构域的n-末端的融合,随跨膜结构域后是细胞内共刺激结构域4-1bb(seqidno:34)。cd19scfv-cd3zecdtm-41bb(seqidno:34)gsmalpvtalllplalllhaarpeivmtqspatlslspgeratlscrasqdiskylnwyqqkpgqaprlliyhtsrlhsgiparfsgsgsgtdytltisslqpedfavyfcqqgntlpytfgqgtkleikggggsggggsggggsqvqlqesgpglvkpsetlsltctvsgvslpdygvswirqppgkglewigviwgsettyyssslksrvtiskdnsknqvslklssvtaadtavyycakhyyyggsyamdywgqgtlvtvssggggsqsfglldpklcylldgilfiygviltalflkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel慢病毒产生和病毒转导进入初始t细胞如在实例1中描述,针对fustcar3、fustcar16、fustcar19和fustcar22产生慢病毒并且转导进入分离的初始人t细胞。扩增转导的t细胞和未转导的对照t细胞,并且冷冻用于随后的分析。细胞毒性和il2测定如实例1中描述,评估通过使初始人t细胞与靶肿瘤细胞交联诱导的细胞毒性和il2产生。初始人t细胞结果如可以在图34和图35中观察到,相对于对照cd19scfv-bbzcar,cd3ε、cd3γ和cd3δ上的fustcar展示了可察觉活性。重要的是应注意,尽管不存在itam信号传导结构域,观察到重定向裂解活性和il2分泌。相反,如图36中示出,cd3ζ上的fustcar导致减少的裂解活性。facs分析展示,此构建体的低细胞表面表达可能是由于tcr的构架和肿瘤靶向结构域的添加;为了改善表达并且将活性最大化,构建体设计的另外优化是必需的。实例9:经由具有替代性结合结构域的cd3ε,将组成型活性的tcar融合进tcr复合物。使用各种结合结构域和靶抗原,tcar应展示针对实体瘤连同血液肿瘤的广泛适用性。间皮素是在广泛的肿瘤类型上表达的感兴趣的一种抗原。fustcar构建体的合成将用dna2.0外部地合成质粒dna。将命名的非可调节car构建体,msln5scfv-bbz,seqidno:35将用作对照。在“fustcar23”中,将cd19scfv克隆为与cd3ε细胞外结构域和跨膜结构域的利用g4s接头(seqidno:52)的n-末端融合,随跨膜结构域后是细胞内共刺激结构域4-1bb(seqidno:36)。类似地克隆“fustcar25”,除了使用cd8a接头以融合至cd3ε细胞外结构域和跨膜结构域的n-末端,随跨膜结构域后是4-1bb(seqidno:37)。将“fustcar25”克隆为cd3ε细胞外结构域和跨膜结构域的利用g4s接头(seqidno:52)的n-末端融合,随跨膜结构域后是细胞内共刺激结构域cd27(seqidno:38)。“fustcar23”“fustcar24”和“fustcar25”缺少内在的细胞内itam信号传导结构域。msln5scfv-bbz(seqidno:35)gsmalpvtalllplalllhaarpqvqlvqsgaevekpgasvkvsckasgytftdyymhwvrqapgqglewmgwinpnsggtnyaqkfqgrvtmtrdtsistaymelsrlrsddtavyycasgwdfdywgqgtlvtvssggggsggggsggggsggggsdivmtqspsslsasvgdrvtitcrasqsiryylswyqqkpgkapklliytasilqngvpsrfsgsgsgtdftltisslqpedfatyyclqtyttpdfgpgtkveiktttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprmsln5scfv-cd3eecdtm-41bb(seqidno:36)gsmalpvtalllplalllhaarpqvqlvqsgaevekpgasvkvsckasgytftdyymhwvrqapgqglewmgwinpnsggtnyaqkfqgrvtmtrdtsistaymelsrlrsddtavyycasgwdfdywgqgtlvtvssggggsggggsggggsggggsdivmtqspsslsasvgdrvtitcrasqsiryylswyqqkpgkapklliytasilqngvpsrfsgsgsgtdftltisslqpedfatyyclqtyttpdfgpgtkveikggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywskrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelmsln5scfv-cd8铰链-cd3eecdtm-41bb(seqidno:37)gsmalpvtalllplalllhaarpqvqlvqsgaevekpgasvkvsckasgytftdyymhwvrqapgqglewmgwinpnsggtnyaqkfqgrvtmtrdtsistaymelsrlrsddtavyycasgwdfdywgqgtlvtvssggggsggggsggggsggggsdivmtqspsslsasvgdrvtitcrasqsiryylswyqqkpgkapklliytasilqngvpsrfsgsgsgtdftltisslqpedfatyyclqtyttpdfgpgtkveiktttpaprpptpaptiasqplslrpeasrpaaggavhtrgldtgggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywskrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelmsln5scfv-cd3eecdtm-cd27(seqidno:38)gsmalpvtalllplalllhaarpqvqlvqsgaevekpgasvkvsckasgytftdyymhwvrqapgqglewmgwinpnsggtnyaqkfqgrvtmtrdtsistaymelsrlrsddtavyycasgwdfdywgqgtlvtvssggggsggggsggggsggggsdivmtqspsslsasvgdrvtitcrasqsiryylswyqqkpgkapklliytasilqngvpsrfsgsgsgtdftltisslqpedfatyyclqtyttpdfgpgtkveikggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsqrrkyrsnkgespvepaepchyscpreeegstipiqedyrkpepacsp慢病毒产生和病毒转导进入初始t细胞如在实例1中描述,产生慢病毒并且转导进入分离的初始人t细胞。扩增转导的t细胞和未转导的对照t细胞,并且冷冻用于随后的分析。细胞毒性和il2测定如实例1中描述,评估通过使初始人t细胞与靶肿瘤细胞交联诱导的细胞毒性和il2产生。天然地过表达间皮素并且用萤火虫萤光素酶转染的ovcar8被取代为靶细胞系。初始人t细胞结果类似于利用靶向cd19的tcars的其他实例,靶向间皮素抗原的tcar是强细胞毒性分子。当参与时细胞毒性活性和il2表达(分别是图37和38)并不需要itam作为活性的前提,并且cd27和4-1bb细胞内共刺激结构域两者都展示了良好的功能活性。如图39和40中示出,肿瘤靶向结构域和tcr辅助蛋白之间的接头可以调制tcar的功能活性,并且可以被调节以获得希望的特征。实例10:靶向间皮素和cd19的tcar嵌合膜蛋白构建体的合成用dna2.0外部地合成质粒dna。将命名的非可调节car构建体,msln5scfv-bbz,seqidno:35,和/或命名的非可调节car构建体,cd19scfv-bbz,seqidno:1,用作对照。除了在先前实例中描述的嵌合膜蛋白,也将使用以下嵌合膜蛋白。msln5scfv-cd3decdtm-41bb(seqidno:63)gsmalpvtalllplalllhaarpqvqlvqsgaevekpgasvkvsckasgytftdyymhwvrqapgqglewmgwinpnsggtnyaqkfqgrvtmtrdtsistaymelsrlrsddtavyycasgwdfdywgqgtlvtvssggggsggggsggggsggggsdivmtqspsslsasvgdrvtitcrasqsiryylswyqqkpgkapklliytasilqngvpsrfsgsgsgtdftltisslqpedfatyyclqtyttpdfgpgtkveikggggsfkipieeledrvfvncntsitwvegtvgtllsditrldlgkrildprgiyrcngtdiykdkestvqvhyrmcqscveldpatvagiivtdviatlllalgvfcfakrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelmsln5scfv-cd3gecdtm-41bb(seqidno:64)gsmalpvtalllplalllhaarpqvqlvqsgaevekpgasvkvsckasgytftdyymhwvrqapgqglewmgwinpnsggtnyaqkfqgrvtmtrdtsistaymelsrlrsddtavyycasgwdfdywgqgtlvtvssggggsggggsggggsggggsdivmtqspsslsasvgdrvtitcrasqsiryylswyqqkpgkapklliytasilqngvpsrfsgsgsgtdftltisslqpedfatyyclqtyttpdfgpgtkveikggggsqsikgnhlvkvydyqedgsvlltcdaeaknitwfkdgkmigfltedkkkwnlgsnakdprgmyqckgsqnkskplqvyyrmcqncielnaatisgflfaeivsifvlavgvyfiakrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelmsln5scfv-cd3g(全长)(seqidno:65)gsmalpvtalllplalllhaarpqvqlvqsgaevekpgasvkvsckasgytftdyymhwvrqapgqglewmgwinpnsggtnyaqkfqgrvtmtrdtsistaymelsrlrsddtavyycasgwdfdywgqgtlvtvssggggsggggsggggsggggsdivmtqspsslsasvgdrvtitcrasqsiryylswyqqkpgkapklliytasilqngvpsrfsgsgsgtdftltisslqpedfatyyclqtyttpdfgpgtkveikggggsqsikgnhlvkvydyqedgsvlltcdaeaknitwfkdgkmigfltedkkkwnlgsnakdprgmyqckgsqnkskplqvyyrmcqncielnaatisgflfaeivsifvlavgvyfiagqdgvrqsrasdkqtllpndqlyqplkdreddqyshlqgnqlrrnmsln5scfv-cd3g(全长)-41bb(seqidno:66)gsmalpvtalllplalllhaarpqvqlvqsgaevekpgasvkvsckasgytftdyymhwvrqapgqglewmgwinpnsggtnyaqkfqgrvtmtrdtsistaymelsrlrsddtavyycasgwdfdywgqgtlvtvssggggsggggsggggsggggsdivmtqspsslsasvgdrvtitcrasqsiryylswyqqkpgkapklliytasilqngvpsrfsgsgsgtdftltisslqpedfatyyclqtyttpdfgpgtkveikggggsqsikgnhlvkvydyqedgsvlltcdaeaknitwfkdgkmigfltedkkkwnlgsnakdprgmyqckgsqnkskplqvyyrmcqncielnaatisgflfaeivsifvlavgvyfiagqdgvrqsrasdkqtllpndqlyqplkdreddqyshlqgnqlrrnkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelmsln5scfv-cd3e(全长)-41bb(seqidno:67)gsmalpvtalllplalllhaarpqvqlvqsgaevekpgasvkvsckasgytftdyymhwvrqapgqglewmgwinpnsggtnyaqkfqgrvtmtrdtsistaymelsrlrsddtavyycasgwdfdywgqgtlvtvssggggsggggsggggsggggsdivmtqspsslsasvgdrvtitcrasqsiryylswyqqkpgkapklliytasilqngvpsrfsgsgsgtdftltisslqpedfatyyclqtyttpdfgpgtkveikggggsdgneemggitqtpykvsisgttviltcpqypgseilwqhndkniggdeddknigsdedhlslkefseleqsgyyvcyprgskpedanfylylrarvcencmemdvmsvativivdicitggllllvyywsknrkakakpvtrgagaggrqrgqnkerpppvpnpdyepirkgqrdlysglnqrrikrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcel慢病毒产生和病毒转导进入初始t细胞如在实例1中描述,产生慢病毒并且转导进入分离的初始人t细胞。扩增转导的t细胞和未转导的对照t细胞,并且冷冻用于随后的分析。如以下描述,用编码靶向cd19的嵌合分子的慢病毒以及用靶向间皮素的嵌合分子转导细胞,并且与用编码仅靶向cd19的嵌合分子的慢病毒转导的细胞、或用编码仅靶向间皮素的嵌合分子的慢病毒转导的细胞、或未转导的细胞进行比较。产生用编码以下构建体的慢病毒转导的细胞,并且在以下描述的测定中进行测试:细胞毒性和il2测定如在实例1中描述,评估由如在此实例中工程化的人t细胞应答靶肿瘤细胞而诱导的细胞毒性和il2产生。将用萤火虫萤光素酶转导的nalm6(cd19+)、ovcar8(间皮素+)、或nalm6和ovcar8的组合用作靶细胞系,并且与k562(cd19-和间皮素-(阴性对照),用萤火虫萤光素酶转导)进行比较。实例11:表达两种不同tcar的t细胞示出了双特异性。将对cd22(cd22-65scfv-g4s-cd3eecdtm-41bb、“cd22tcar”、seqidno:73)具有特异性的tcar,连同对cd19(cd19scfv-g4s-cd3gecdtm-41bb、“cd19-tcar”、seqidno:72)具有特异性的tcar克隆到慢病毒car表达载体中。测试了表达具有两种特异性的tcar的t细胞是否也对表达靶蛋白中的一者或两者的靶细胞施加特异性应答。tcar慢病毒的产生使用编码tcar的慢病毒转移载体来产生包装到vsvg假型化慢病毒颗粒中的基因组材料。将编码tcar的慢病毒转移载体dna与三个包装组分vsvg、gag/pol和rev与lipofectamine2000试剂的组合混合以转染lenti-x293t细胞(克罗泰克公司),然后在12-18小时后更换培养基。培养基更换后30小时,收集培养基、过滤,并且使用lenti-x浓缩器(克罗泰克公司(clontech))浓缩,并且在-80℃下以等分试样储存。tcarjnl细胞的产生jurkatnfat萤光素酶(jnl)报告细胞系是基于急性t细胞白血病系jurkat。修饰该系以在活化t细胞核因子(nfat)响应元件的控制下表达萤光素酶。对于用tcar转导,以1.5的感染复数(moi)转导12孔板的400,000个jnl细胞/孔。在室温下解冻冷冻的含病毒上清液,并且添加至相应的孔。按各自moi=1.5,各自用cd19-tcar、cd22-tcar、或cd19-tcar加上cd22-tcar(“cd19/22双tcar”)转导一个孔。将板培养6天。评估单个t细胞上两种tcar的功能表达用流式细胞术,针对表达tcar的t细胞的靶结合能力,对它们进行测试。测试了表达未转导的(utd)、cd19-tcar、cd22-tcar和cd19/22双tcar的jnl细胞:在4℃,将细胞用cd22-fc染色30min。洗涤后,在4℃,将细胞用抗fc第二抗体染色30min。第二次洗涤后,在4℃,将细胞用cd19-car抗独特型抗体(ab)染色30min。在最后一次洗涤后,在facslsrfortessa上分析细胞。使用flowjo软件分析数据。utdjnl细胞并不结合任何染色试剂,并且低结合的cd22-fc被解释为背景结合(图47a)。表达cd19-tcar的细胞示出了正确折叠和tcar的表达(如通过cd19-car抗独特型ab染色检测),而cd22-fc并未被结合(图47b)。表达cd22-tcar的细胞结合cd22-fc,但是未用cd19-car抗独特型ab染色(图47c)。相反,用两种病毒,cd19/22双tcar转导的jnl细胞结合cd22并且示出cd19-car抗独特型的结合(图47d)。tcar重定向的jnl细胞的功效为了评估tcar的功能性能力,将未转导的jnl细胞和用一种或两种编码tcar的病毒转导的细胞与靶标癌细胞一起共培养,以通过定量萤光素酶表达来读出其活化。将jnlcart细胞与过表达cd19或cd22的慢性髓细胞性白血病(cml)细胞系k562一起共培养。将亲本k562细胞系用作阴性对照。将共培养以1:3、1:1和1:0.3的效应子与靶标(e:t)比例设置在384孔板中,并且孵育24h,之后通过briteliteplus报告基因测定系统(马萨诸塞州沃尔瑟姆的珀金埃尔默公司(perkinelmer,waltham,ma))定量通过活化的jnltcart细胞表达的萤光素酶。从每个孔发射的光量(发光)是相应的tcar活化jnl的直接读出。用表达cd19和cd22两者的k562细胞活化cd19/22双tcar细胞,展示了它们的双特异性(图48a和48b)。双tcart细胞活化的程度非常类似于用相应的抗原活化单tcar细胞,即cd19tcar细胞被k562-cd19活化,并且cd22tcar被k562-cd22活化。单tcar细胞并未被非同源抗原活化(图48a和48b)。而且亲本k562细胞系并不导致任何tcar的活化,证明了其特异性。(图48c)。结论用编码两种不同tcar的病毒转导的jnl细胞能够在细胞表面上同时表达两种正确折叠的tcar。cd19/22双tcar细胞结合cd22-fc,连同被cd19-car抗独特型抗体染色的能力证明了这一点(图47d)。除了在细胞表明上表达,tcar介导jnl的靶标依赖性活化(图48a和48b)。仅cd19/22双tcar细胞被k562-cd19和cd22两者活化,证明了这些细胞的双特异性(48a和48b)。实例12:在体外和体内,检查表达两种不同tcar的t细胞人t淋巴细胞取自受试者,并且离体提供,使用抗cd3/cd28珠刺激,并且用在ef1a启动子控制下的编码tcar的一种或两种慢病毒载体转导。在此实验中,使用具有不同特异性的两种tcar:一种tcar特异性针对cd19,并且另一种tcar特异性针对cd22。将用编码这些tcar中任一个的一个载体,或同时用两个载体,转导t细胞。此外,构建单个双顺反子慢病毒载体,其编码具有间插p2a位点的cd19tcar和cd22tcar两者,都在ef1a启动子的控制下,这样允许用单一病毒转导的双tcar的产生。使用本文披露的方法(例如,如wo2014/130657中描述),针对cd19+/cd22-细胞、cd19-/cd22+细胞、cd19+/cd22+细胞和包含cd19-/cd22+细胞和cd19+/cd22+细胞的细胞群体,测定tcart细胞增殖、细胞因子释放和细胞毒性。在具有建立的肿瘤的免疫受损的nod/scid/常见γ链-/-小鼠中,通过静脉内施用细胞,在体内进一步测定这些细胞(增殖、长期持久性和肿瘤毒性,例如通过wo2014/130657中描述的方法)。关于体外测定,测试了cd19+/cd22-细胞、cd19-/cd22+细胞、cd19+/cd22+细胞和包含cd19-/cd22+细胞和cd19+/cd22+细胞的细胞群体。监测了cart细胞持久性、增殖/表达和抗肿瘤功效。研究了双tcar是否能够排斥由仅表达相应的抗原中的一者或两者的癌细胞的混合群体组成的肿瘤。等同物本文引用的每一个专利、专利申请和出版物的披露内容据此通过援引以其全文并入本文。虽然已经参照具体方面披露了本发明,但是本领域其他技术人员可以在不偏离本发明的真实精神以及范围的情况下设想本发明的其他方面以及变化。所附权利要求旨在理解为包括所有这类方面以及等同变化。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1