调节纤维母细胞生长因子受体3活化的组合物及方法与流程
背景技术:
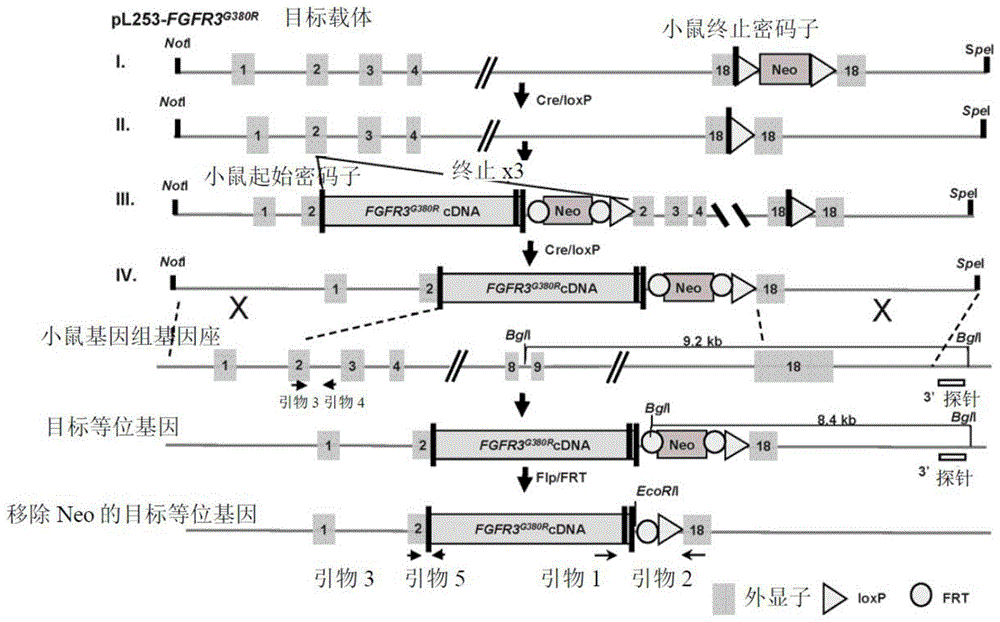
:纤维母细胞生长因子受体3(fibroblastgrowthfactorreceptor3,fgfr3)中导致该受体的持续性活化的点突变引起多种癌症及遗传为常染色体显性(autosomaldominant)性状的先天性骨骼发育不良。骨骼发育不良的特征在于不同程度的骨骼畸形,严重程度从最低到最高如下:软骨生成减退(hypochondroplasia,hch)、软骨发育不全(achondroplasia,ach)、带有发育迟缓及黑棘皮症的严重软骨发育不全(severeachondroplasiawithdevelopmentaldelayandacanthosisnigricans,saddan),以及致死性骨发育不全第1型(thanatophoricdysplasiatype1,tdi)及第2型(tdii)。软骨发育不全(ach)为人类最常见的遗传性短肢侏儒症。其特征为身材矮小、四肢不成比例、大头畸形、具有额骨突出、中脸部发育不全的脸部特征,以及夸张的胸腰椎后凸畸形。数种ach小鼠模型已被建立来研究fgfr3在骨骼发育及疾病中的角色。参见wang等人,proc.natl.acad.sci.usa96:4455-4460;chen等人,j.clin.invest.104:1517-1525;naski等人,development125:4977-4988;以及segev等人,hum.mol.genet.9:249-258。然而,尽管这些小鼠模型与人类ach共享一些表型,但并非所有的人类ach疾病表型都在这些小鼠模型中被充分描述或检查过。尽管目前有数种针对fgfr3活化的疾病的潜在治疗策略正在开发,但没有针对fgfr3活化的骨骼发育不良的药物被批准。参见jin等人,hum.mol.genet.21:5443-5455;lorget等人,am.j.hum.genet.9:1108-1114;garcia等人,sciencetranslationalmedicine:203ra124;xie等人,hum.mol.genet.21:3941-3955;yamashita等人,nature513:503-511;matsushita等人,endocrinology156:548-554;以及komla-ebri等人,j.clin.invest.126:1871-1874。显然地,需要开发用于鉴定针对过度活化的fgfr3突变体的药剂以及鉴定与过度活化的fgfr3突变体相关的病症的治疗剂的工具及方法。技术实现要素:为了满足上述需求,公开了一种抑制细胞中纤维母细胞生长因子受体3(fgfr3)过度活化的方法。该方法包括该细胞与含有有效量的去镁叶绿素酸a、焦去镁叶绿素酸a,或其活性衍生物的组合物接触。于另一方面,本文描述了一种治疗个体中与过度活化的fgfr3相关的病症的方法,透过鉴定有需要治疗的个体,以及对该个体施用含有有效量的去镁叶绿素酸a、焦去镁叶绿素酸a,或其活性衍生物的组合物。于另一方面,本文描述了一种基因敲入小鼠,包含一或二套异源基因组核酸,其中该一或二套异源核酸各自替换内源fgfr3基因的编码区且可操作地连接至内源fgfr3启动子,该一或两套异源核酸各自分别编码人类野生型fgfr3或人类fgfr3(g380r)突变体。此外,本文描述了一种哺乳动物细胞,其包含编码人类fgfr3蛋白的第一外源核酸以及编码包含绿色荧光蛋白(greenfluorescentprotein,gfp)与fgfr3效应子蛋白的融合蛋白的第二外源核酸。该细胞表达该人类fgfr3蛋白与该融合蛋白,且该效应子蛋白能够与活化的fgfr3结合。于另一方面,本文描述了一种鉴定fgfr3活性调节剂的方法,包括:提供如本文所述的哺乳动物细胞,使该细胞与测试试剂接触,对该细胞进行细胞质gfp讯号成像,以及获得单个细胞质gfp斑点的计数。获得低于或高于对照计数的计数表示该测试试剂为fgfr3活性调节剂。还公开了一种植物乙醇萃取物用于抑制过度活化的纤维母细胞生长因子受体3(fgfr3)的用途,该植物属于苋科(amaranthaceae)、山榄科(sapotaceae),或姜科(zingiberaceae)的成员。此外,提供了一种用于治疗fgfr3过度活化相关的病症的组合物。该组合物包含有效量的苋科、山榄科,或姜科植物的乙醇萃取物。在附图及以下的描述中阐述了一个或多个具体实施例的细节。从说明书及附图及权利要求中,具体实施例的其他特征、目的及优点将显而易见。附图说明以下本发明的描述参考了附图,其中:图1a为透过将人类fgfr3g380rcdna或野生型fgfr3导入小鼠fgfr3基因座而逐步生成ach小鼠及人类fgfr3野生型对照组的示意图。图中显示了在透过基因目标引入人类fgfr3g380rcdna之后产生目标载体(i-iv部分)以及小鼠fgfr3基因座的最终染色体结构;图1b为野生型(wt1、wt2)、ach杂合子(ach/+)与纯合子(ach/ach)小鼠的后肢中hfgfr3(左图)与mfgfr3(右图)的相对mrna表达程度图。数值为以gapdh标准化的相对mrna表达;图2a所示为杂交ach/+小鼠(上图)与预期门德尔比的偏差。下图显示野生型、ach/+,以及ach/ach小鼠的存活率与年龄的关系图。空心圆=野生型,实心圆=ach/+,实心三角形=ach/ach;图2b为野生型、ach/+,以及ach/ach小鼠的体重对年龄(左图)或体长对年龄(右图)的曲线图。以双尾学生氏t检验进行统计分析,*p值<0.05,**p值<0.01,***p值<0.001;图3a为在2周及4周龄的fgfr3ach(ach)小鼠以及野生型小鼠的股骨远程生长板的增殖区(proliferativezone,pz)及肥大区(hypertrophiczone,hz)的高度的测量值的柱状图。显示的数据为平均值±标准偏差。*p<0.05;***p<0.001;图3b为使用icelligencetm实时细胞分析系统分析野生型(wt)与fgfr3ach/ach(ach)小鼠的软骨细胞的细胞生长指数对时间的曲线图;图4所示为显示在胚胎肾细胞(293t)、软骨细胞以及骨肉瘤细胞(u2os)中fgfr1、fgfr2、fgfr3,以及fgfr4的相对mrna表达程度的柱状图;图5a所示为对照组(上部)与带有与活化的fgfr3相互作用的海肾(renillareniformis)绿色荧光蛋白(rrgfp)的融合构筑的示意图。所示为来自sh2b(seqidno:1)的src同源性2结构域(sh2)以及来自plcγ(seqidno:2)的sh2;图5b所示为导致该受体持续性活化的人类fgfr3中的某些单核苷酸突变的位点;图6a为基于细胞的易位测定数据的曲线图(见下文),表示为环点计数(左图)以及环点强度(右图),以指定浓度的pkc412处理的表达sh2(sh2b)-rrgfp/tdifgfr3的u2os细胞相对于对照组的百分比;图6b为以无血清培养基(serum-freemedium,sfm)处理或以sfm、酸性纤维母细胞生长因子(afgf)及肝素处理的稳定表达sh2(sh2b)-rrgfp、野生型fgfr3,或活化的fgfr3(ach、hyp、tdi,以及tdii)的u2os细胞相对于对照组的百分比的环点计数图;图6c为暂时表达sh2(sh2b)-rrgfp与活化的fgfr3(tdi),或不结合sh2结构域的tdi724f/760f突变体的细胞中每个细胞的环点计数图;图7a所示为稳定表达sh2(sh2b)-rrgfp和tdifgfr3并以101种植物萃取物中的每一种或以阳性对照组pkc412处理的细胞相对于对照组的百分比的环点计数。标示为命中的样品具有不超过阴性对照组的环点数的60%。三个实验的结果一起绘制;图7b为图7a所示数据的线性回归分析;图7c为稳定表达sh2(sh2b)-rrgfp以及tdifgfr3并以指定剂量的如图7a所示的阳性命中(命中1、命中2、命中3,以及命中4)处理的细胞相对于对照组的百分比的环点计数图;图7d为稳定表达sh2(sh2b)-rrgfp以及tdifgfr3的细胞,并以指定剂量的命中4与来自二种与命中4相关植物萃取物(4-1与4-2)处理的细胞,相对于对照组的百分比的环点计数图;图7e为显示以载剂(dmso)或指示量的命中4、4-1、4-2的植物萃取物,以及阳性对照组pkc412处理的kms-11细胞的相对生长的柱状图。***p<0.001;图8为自苋菜的乙醇萃取物中分离活性成分的纯化方案的流程图;图9为根据图8所示的流程图分离的指定剂量的苋菜萃取物分层(f1-f4)处理稳定表达sh2(sh2b)-rrgfp与tdifgfr3的细胞,相对于对照组的百分比的环点计数图;图10a为以指定剂量的苋菜萃取物分层f4的次分层1-4(is01-is04)处理稳定表达sh2(sh2b)-rrgfp与tdifgfr3的细胞,相对于对照组的百分比的环点计数图;图10b为以指定剂量的苋菜萃取物分层f4的次分层5-8(is05-is08)处理稳定表达sh2(sh2b)-rrgfp与tdifgfr3的细胞,相对于对照组的百分比的环点计数图;图10c为以指定剂量的苋菜萃取物分层f4的次分层9-12(is09-is12)处理稳定表达sh2(sh2b)-rrgfp与tdifgfr3的细胞,相对于对照组的百分比的环点计数图;图11a所示为去镁叶绿素酸衍生物hcl-n-pa与na-pa的结构;图11b为以指定剂量的hcl-n-pa、pa或na-pa处理稳定表达sh2(sh2b)-rrgfp与tdifgfr3的细胞,相对于对照组的百分比的环点计数图;图12所示为光敏剂(顶部)的结构,测试其抑制fgfr3活性的能力,以及以指定剂量的光敏剂或pyropa处理稳定表达sh2(sh2b)-rrgfp与tdifgfr3的细胞,相对于对照组的百分比的环点计数图(底部);图13a为在以dmso处理以作为指示或以来自苋菜的活性萃取物分层4(f4)处理的7天龄野生型(wt)或纯合ach(fgfr3ach/ach)小鼠中随时间增加的体重增加图,与对照组的百分比作为表示;图13b为随时间增加的小鼠身长增加图,与对照组的百分比作为表示。小鼠及样品如图例所示;图13c为随时间增加的股骨长度图。小鼠及样品如图13a的图例所示;图13d为在以dmso或以来自苋菜的活性亚分层is11处理的7日龄野生或fgfr3ach/ach小鼠中随时间增加的体重增加图,与对照组的百分比作为表示;图13e为随时间增加的小鼠身长增加图,与对照组的百分比作为表示。小鼠及样品如图例所示;图13f为随时间增加的股骨长度图。小鼠及样品如图13d的图例所示;以及图14为未处理的野生型、ach/ach或以去镁叶绿素酸a处理的小鼠的体重对时间的图。具体实施方式本文描述一种抑制fgfr3过度活化,或者治疗个体中fgfr3过度活化相关病症的方法。该方法包括鉴定有需要的个体,以及对该个体施用含有有效量的去镁叶绿素酸a或焦去镁叶绿素酸a(或其功能性衍生物)的组合物。fgfr3过度活化,可为fgfr3的过度表达或fgfr3过度活化的突变。该过度活化的突变可为,例如,fgfr3(y373c)、fgfr3(g380r)、fgfr3(n540k)、fgfr3(k650e)、fgfr3(r248c)、fgfr3(s371c)、fgfr3(y373c)、fgfr3(g375c)、fgfr3(g380r)、fgfr3(n540k)、fgfr3(k650m)、fgfr3(k650e)、fgfr3(x807g)、fgfr3(x807r),或fgfr3(x807c)。该病症可为骨骼发育不良或癌症,例如,软骨发育不全、软骨生成减退、带有发育迟缓及黑棘皮症的严重软骨发育不全(saddan)、致死性骨发育不全第1型、致死性骨发育不全第2型、多发性骨髓瘤、膀胱癌、子宫颈癌,或与fgfr3活化有关的任何类型的癌症。该组合物可包括纯化或合成的去镁叶绿素酸a或焦去镁叶绿素酸a。或者,该组合物可以含有去镁叶绿素酸a或焦去镁叶绿素酸a的活性衍生物,例如,hcl-n-去镁叶绿素酸a、na-去镁叶绿素酸a、hcl-n-焦去镁叶绿素酸a,以及na-焦去镁叶绿素酸a。该组合物也可为一绿色植物或绿藻的萃取物(例如,进行光合作用的任何植物或藻类)。于一具体实施例中,该植物为苋菜(amaranthusviridis)。本文还描述了一种基因敲入小鼠。该小鼠包含一或两套异源基因组核酸,其中该一或二套异源核酸各自替换内源fgfr3基因的编码区且可操作地连接至内源fgfr3启动子,该一或两套异源核酸各自分别编码人类野生型fgfr3或人类fgfr3(g380r)突变体。该小鼠可含有该二套异源基因组核酸,其中一套编码fgfr3(g380r)突变体,其中该转基因小鼠具有显性矮小身材、圆头、短嘴吻、驼背的外型,以及四肢长股短小、圆形颅骨,以及颈椎及上胸椎弯曲的骨骼异常。可以使用本领域已知的方法或以下描述的方法产生该小鼠。本文公开一种哺乳动物细胞,包含编码人类fgfr3蛋白的第一外源核酸以及编码包含绿色荧光蛋白(greenfluorescentprotein,gfp)与fgfr3效应子蛋白的融合蛋白的第二外源核酸,其中该细胞表达该人类fgfr3蛋白与该融合蛋白,且其中该效应子蛋白能够与活化的fgfr3结合。于一具体实施例中,该效应子蛋白为人类sh2-bβ的src同源2(srchomology2,sh2)结构区域。该gfp可以来自海肾(renillareniformis)。该人类fgfr3蛋白为野生型蛋白或过度活化的突变,例如,fgfr3(y373c)、fgfr3(g380r)、fgfr3(n540k)、fgfr3(k650e)、fgfr3(r248c)、fgfr3(s371c)、fgfr3(y373c)、fgfr3(g375c)、fgfr3(g380r)、fgfr3(n540k)、fgfr3(k650m)、fgfr3(k650e)、fgfr3(x807g)、fgfr3(x807r),或fgfr3(x807c)。含有一过度活化的fgfr3突变体以及一sh2-gfp融合蛋白的细胞显示出细胞质gfp斑点的点状图案。以fgfr3活性抑制剂处理这种细胞减少或消除了该细胞质gfp斑点。相反地,以进一步活化fgfr3的物质处理该细胞将导致细胞质gfp斑点的增加。该哺乳动物细胞可用于鉴定调节fgfr3活性的试剂。因此,本文描述了一种鉴定fgfr3活性调节剂的方法,其包括提供上述的哺乳动物细胞,使该细胞与测试试剂接触,对该细胞进行细胞质gfp讯号成像,以及获得单个细胞质gfp斑点的计数,亦即,环点计数。获得低于或高于对照计数的计数表示该测试试剂为fgfr3活性调节剂。若该计数低于该对照计数,则表示该测试试剂为fgfr3活性抑制剂。获得高于该对照计数的计数表示该测试试剂为fgfr3活性活化剂。该测试试剂可为植物、藻类萃取物,或其他天然复合物混合物萃取物、小分子化合物、胜肽、蛋白质、抗体、核酸分子、胜肽模拟物,或类胜肽。同样在本发明的范围内的是一种植物乙醇萃取物用于抑制过度活化的fgfr3的用途。该植物可为,但不限于,苋科(amaranthaceae)、山榄科(sapotaceae),或姜科(zingiberaceae)的成员。于一特定的具体实施例中,该乙醇萃取物来自苋菜。于一特定的具体实施例中,该萃取物包括去镁叶绿素酸a、焦去镁叶绿素酸a,或其活性衍生物。亦公开了一种用于治疗与fgfr3过度活化相关的病症的组合物。该组合物含有有效量的属于苋科、山榄科,或姜科植物的乙醇萃取物。于特定方面,该乙醇萃取物来自苋菜。该萃取物可包括去镁叶绿素酸a、焦去镁叶绿素酸a,或其活性衍生物。此外,公开了一种用于治疗fgfr3过度活化的相关的病症的组合物,其中该组合物含有来自苋菜植物的乙醇萃取物,透过以下步骤制备:干燥及切碎该植物,使该切碎的植物材料经95%乙醇回流萃取,浓缩该乙醇萃取物,将该萃取物在diaionhp-20管柱上分馏,以100%h2o(分层1)、50%v/v乙醇水溶液(分层2)、100%乙醇(分层3)、在乙酸乙酯中的50%(v/v)乙醇(分层4),以及100%乙酸乙酯(分层5)逐步分馏,并收集分层4。用于制备来自苋菜的乙醇萃取物的步骤还可包括使用在乙酸乙酯中的己烷以及在甲醇中的乙酸乙酯作为流动相使分层4进行正相硅胶管柱色层分析。以下的特定实施例应被解释为仅为说明性的,而非以任何方式限制本公开的其余部分。无需进一步详述,相信本领域技术人员可以基于本文的描述最大程度地利用本发明。本文引用的所有出版物均透过整体引用并入本文。实施例实施例1:敲入人类fgfr3软骨发育不全突变以作为人类骨骼发育不良的小鼠模型产生fgfr3ach以及fgfr3wt小鼠利用基因靶向方法在内源性小鼠fgfr3启动子、内含子1,以及5'和3'非转译区的完全控制下,透过以携带ach突变(fgfr3ach)的人类fgfr3cdna取代小鼠fgfr3以产生fgfr3ach小鼠。参见图1。还透过相同的方法将人类野生型fgfr3(fgfr3wt)cdna引入fgfr3中以产生对照组小鼠以用于比较。如以下方式开发了用于表达人类fgfr3g380r的目标载体。自一细菌人工染色体选殖系(geneservice公司,剑桥,英国)中回收携带源自于129s7小鼠品系的完整小鼠fgfr3基因座的dna片段,并将其选殖到pl253质体中。参见图1a,第一部分。透过重组在终止密码子后将一loxp-侧翼的新霉素抗性基因盒插入外显子18中,透过cre/loxp切除除去该新霉素抗性基因盒,留下loxp序列。参见图1a,第二部分。一dna片段包含(i)编码该fgfr3g380r蛋白的人类突变fgfr3cdna,(ii)三个转译终止密码子,(iii)侧接frt位点的新霉素抗性基因盒,以及(iv)loxp序列插入小鼠外显子2的起始密码子之后。参见图1a,第三部分。透过cre/loxp切除除去外显子2-18之间的小鼠fgfr3的区域。参见图1a,第四部分。所得的目标载体用于替换在129sv小鼠胚胎干细胞中fgfr3的野生型等位基因。参见图1a,第五部分。透过南方氏墨点分析鉴定含有目标等位基因的胚胎干细胞的选殖系,透过以bgli消化基因组dna并与由pcr产生的0.5kb3'寡核苷酸探针杂交。参见图1a,第五及第六部分。携带目标等位基因的胚胎干细胞显示存在一8.4kb的bgli片段,证实为正确的目标。透过flp/frt切除除去已鉴定的干细胞中的新霉素抗性基因盒,然后以针对人类fgfr3cdna的3'末端以及小鼠fgfr3的外显子18的引物透过pcr分析这些细胞,接着透过ecori消化该pcr产物。从不含新霉素抗性基因盒的干细胞分离的基因组dna扩增了一段528bp的pcr产物。该pcr产物以ecori消化后产生一328bp与一254bp的片段。图1a,第六部分及第七部分分别显示了透过基因目标引入人类fgfr3g380rcdna后,具有及不具有该新霉素抗性基因盒的鼠类fgfr3基因座的最终染色体结构。携带不含该新霉素抗性基因盒的目标载体的干细胞按照建立的程序注射到c57bl/6j胚泡中。所产生的嵌合小鼠与129sv雌性杂交以实现种系传递。杂合子用于维持该菌株并提供实验对。对自野生型以及fgfr3ach小鼠分离的基因组dna进行pcr扩增分析以确认其基因型。使用引物3(5’-cctccggagtaactcagtgc-3’;seqidno:27)以及4(5’-acaacttaccgagcgaaagc-3’;seqidno:28),在野生型动物中从该小鼠fgfr3基因座扩增一1067bp的pcr产物。参见图1a,第五部分。另一方面,使用引物3以及5(5’-gcacactgaagtggcacagt-3’;seqidno:29)从人类fgfr3g380r目标等位基因扩增一506bp的pcr产物。参见图1a,第七部分。微型计算器断层扫描(微-ct)将小鼠安乐死,并将解剖的组织在4%(w/v)多聚甲醛中固定整夜。将标本转移至70%(v/v)乙醇后,按照标准方法,使用台湾小鼠诊所的skyscan10763d系统透过三维显微-ct分析股骨远程干骺端的小梁骨。选择以下扫描参数:图像像素尺寸:9μm,x射线电压:50kv,x射线电流:140μa,滤光片:a10.5mm,曝光:3300ms,旋转步长:0.8°,帧平均:2,层析旋转:180°。使用nrecon软件(bruker)重建横截面。参数如下:平滑:0,环形伪像减少:6,光束硬化校正:20%,改变动态图像范围:0.015-0.07。组织学、组织化学,以及免疫组织化学将骨组织以4%(w/v)多聚甲醛固定,制备5μm切片并以马森三色染色法检查。针对免疫组织化学,将固定的骨组织于10%(w/v)edta中脱钙2周。透过在0.05%(w/v)胰蛋白酶中于37℃下作用15分钟以将切片脱蜡并回收。以3%(v/v)h2o2处理并以5%(v/v)正常山羊血清阻隔后,切片在4℃下与初级抗体作用整夜。使用磷酸化-fgfr3抗体(cellsignaling公司,danvers,麻州,美国)检测fgfr3活性,然后将切片与抗兔二级抗体(abcsystem,vectorlabs公司,burlingame,加州,美国)一起作用并以0.1%(w/v)3,3'-二胺基联苯胺将反应可视化。使用标准光学显微镜拍摄图像(zeiss公司,oberkochen,德国)。初代软骨细胞培养基本上如gosset等人,natureprotocols3:1253-1260中所述进行初步软骨细胞的分离与培养,并进行若干修改。简言之,从出生后第10天的小鼠中解剖无结缔组织的骺区域,然后以第ii型胶原酶(worthington公司,lakewood,纽泽西州,美国)整夜消化。将该软骨细胞透过70-mm尼龙网(bdbiosciences公司,sanjose,加州,美国)过滤,然后在含有10%(v/v)fcs的dmem中培养。为了避免细胞表型的转型,仅以初代细胞用于实验。细胞增殖测定使用icelligencetm实时细胞分析仪(aceabiosciences公司,sandiego,加州,美国,由rochediagnostics公司,basel,瑞士分销)评估软骨细胞的增殖。简言之,将10,000个活细胞/孔接种于含有完全培养基的8孔盘中并培养10天。使用icelligencetm系统连续记录细胞黏附及扩展的变化15天。生长培养基每2天更换一次。数据以指数阶段期间细胞指数值图表示。准备骨骼剥皮并且去除内脏的新生小鼠在95%(v/v)乙醇中固定整夜,随后与丙酮一起作用整夜。然后将样品以alcianblue8gx(0.05%,w/v)(sigma-aldrich公司,st.louis,密苏里州,美国)染色72小时,之后将它们在95%(v/v)乙醇中脱水24小时。将骨架在1%(w/v)koh中作用直至可见到骨头为止。然后将骨架以茜素红(0.005%,w/v)(sigma-aldrich公司)进一步染色24小时。标本在35%乙醇、50%甘油,以及15%水(所有百分比代表v/v)的溶液中清除以除去多余的污渍,然后保存于100%甘油中。小鼠在无特定病原体的条件下,将小鼠饲养在具有12小时光照/12小时黑暗周期的温度及湿度受控室中。所有动物实验均经台湾中央研究院动物管理与利用委员会批准(第14-12-795号议定书)。该研究符合美国国立卫生研究院出版的《实验动物照护暨使用指南》。定量反转录酶聚合酶连锁反应(quantitativereversetranscriptasepolymerasechainreaction,qrt-pcr)分离新生小鼠左后肢的总rna,将其转化为cdna,并进行qrt-pcr。表达数据标准化为gapdhmrna含量。以下列出基因特异性引物序列。小鼠fgfr3:正向序列,5'-tgcggtgccttcacaga-3'(seqidno:3);反向序列,5'-acttggacctctccgtg-3'(seqidno:4);人类fgfr3:正向序列,5'-gctgaggacacaggtgtg-3'(seqidno:5);反向序列,5'-cactccctccatctcctg-3'(seqidno:6);gapdh:正向序列5'-ccagaacatcatccctgcat-3'(seqidno:7);反向序列5'-gttcagctctgggatgacctt-3'(seqidno:8)。使用上述引物透过rt-pcr确定目标人类fgfr3g380r及内源小鼠fgfr3在杂合fgfr3g380r、纯合fgfr3g380r及野生型小鼠中的mrna表达含量,并将其标准化为gapdhmrna表达含量。图1b中显示的结果证实人类fgfr3g380r仅在杂合fgfr3ach/+小鼠及纯合fgfr3ach/ach小鼠中表达,而不在野生型同窝小鼠中表达。相反地,小鼠fgfr3表达仅在野生型凋落物中检测到,而在杂合fgfr3ach/+小鼠中只有少量表达。骨骼长度测量解剖小鼠的股骨并去除肉。股骨的长度是使用毫米级的卡尺测量。统计分析使用双尾学生氏t检验来检验组间差异。小于0.05的p值被认为是统计上显著的。使用卡方拟合优度测试(2自由度)来测试杂合子育种对产生的fgfr3ach小鼠的基因型的偏离门德尔期望。结果存活率与增长率与fgfr3ach/+及野生型小鼠相比,fgfr3ach/ach小鼠在出生时的存活率相对于预期显著更低,且在4周龄之前具有更高的死亡率。参见图2a。大多数fgfr3ach小鼠在1岁左右死亡。与野生型小鼠相比,fgfr3ach/+以及fgfr3ach/ach小鼠的平均体重及体长均降低。参见图2b。fgfr3ach/+小鼠表现出介于野生型及fgfr3ach/ach小鼠之间的中等体重及长度,表示活化的fgfr3g380r的剂量依赖性效应。参见图2b。新生fgfr3ach小鼠的骨骼异常人类ach患者的特征可于出生时在临床及放射学上容易地鉴定。在出生时,fgfr3ach/+或fgfr3ach/ach小鼠,统称为fgfr3ach,及其野生型同窝出生小鼠之间在外观上没有明显差异。新生fgfr3ach小鼠的骨结构分析显示,具有相对正常大小的躯干但近端肢体缩短。与野生型小鼠相比,fgfr3ach/+小鼠的股骨长度减少了15%,fgfr3ach/ach小鼠的股骨长度减少了42%。近距离观察颅骨结构显示,由于额骨与顶骨的位置偏移及压缩,在fgfr3ach小鼠中颅骨变圆且颅骨骨骼变形。在fgfr3ach小鼠中没有联脊限制物,亦即分开额骨与鼻骨的颅缝。在两个鼻骨之间的中在线的冠状颅缝在fgfr3ach小鼠中单侧融合或部分缺失。因此,新生的fgfr3ach小鼠表现出过早的骨缝关闭与异常的头骨形状。此外,与野生型小鼠相比,新生的fgfr3ach展现出颈椎与更窄的肋骨笼之间的更短的椎间距离。这些表型在许多方面与人类ach新生儿的骨骼畸形相似,且fgfr3ach/ach小鼠中的骨异常比fgfr3ach/+小鼠更明显。在出生后发育过程中fgfr3ach小鼠显示骨骼异常在fgfr3ach小鼠中,侏儒症表型逐渐变得明显。在10天至1个月龄的fgfr3ach小鼠中容易观察到显性矮小身材、圆头、短口鼻以及驼背(humpback)表型。所有fgfr3ach/ach小鼠在2周龄左右产生脊柱后凸表型,并且在1月龄之前约90%的fgfr3ach/+小鼠产生脊柱后凸表型。此外,在fgfr3ach小鼠中观察到下门牙的突出,这是由于影响门牙排列的颅骨改变的结果。相较之下,表达非突变的人类fgfr3的对照组fgfr3wt/+或fgfr3wt/wt小鼠表现出与野生型相同的外表型。此外,野生型、fgfr3wt/+及fgfr3wt/wt小鼠的生长速率相同。使用二维微型计算器断层扫描(micro-ct)来检查fgfr3ach小鼠中的骨骼异常。在fgfr3ach小鼠中骨骼显示侏儒症、圆形头骨,以及颈椎及上胸椎严重弯曲。与fgfr3ach/+小鼠相比,fgfrach/ach小鼠表现出更严重的表型。此外,基于1、4及12月龄小鼠表型的比较,这些表型在老年小鼠中变得更明显。密切观察fgfr3ach小鼠的头骨及脊椎骨,发现在fgfrach/ach以及较老的fgfrach/+小鼠中缩短的口鼻部、圆顶形的头骨,以及几乎完全折迭的上胸椎。与fgfr3ach/+小鼠相比,fgfr3ach/ach小鼠中这些表型的严重程度更加一致,如fgfr3ach/ach小鼠与fgfr3ach/+小鼠相比体长变化较小所证明的。参见图2b。显然,短口鼻、圆头以及后凸表型的严重程度的变化在体长中表现出来。ach患者出现肢根的(短肢)侏儒症。该表型在fgfr3ach/+小鼠中复制,与野生型小鼠中的相应测量相比,该小鼠显现出股骨长度缩短22%以及1个月龄时体长缩短7.1%。fgfr3ach/+小鼠的肢体相对于体长不成比例地缩短。此外,这些动物的股骨为短的、弯曲的,以及厚的,具有加宽的骨干以及张开的干骺,表型与ach患者中观察到的非常相似。改变fgfr3ach小鼠的软骨细胞的增殖及分化如上所述,fgfr3ach小鼠的股骨长度显著减少。对来自野生型及fgfr3ach小鼠的不同发育阶段的远侧股骨进行组织学分析,以更加仔细检查fgfr3ach小鼠的长骨中的缺陷。出生时野生型及fgfr3ach小鼠的骺结构相似。在1周龄的野生型小鼠中很容易形成二次骨化中心,而在fgfr3ach小鼠中其形成显著延迟,表示软骨细胞末端分化的延迟。在软骨内骨化中,软骨细胞依次通过静息、增殖、增生前,以及肥大阶段。fgfr3ach小鼠显示每个阶段的良好发展。然而,fgfr3ach小鼠中生长板显著较短,且在2、4,及8周龄时增殖区较短。参见图3a。这是由于增殖性软骨细胞数量减少所致,表示fgfr3ach小鼠软骨细胞增殖受到损害。参见图3b。尽管增生区较短,但fgfr3ach小鼠的生长板中软骨细胞柱的排列在2周龄之前保持正常。在4及8周龄时,在fgfr3ach小鼠中观察到软骨细胞柱之间的间隔增加。fgfr3ach小鼠在生长板的软骨细胞中也表现出更高的fgfr3磷酸化,且与野生型小鼠相比,初代软骨细胞具有更低的增殖率。这些结果表示fgfr3活化抑制了fgfr3ach小鼠的软骨细胞增殖。在fgfr3ach小鼠中改变骨形成在出生后发育的几个阶段,在fgfr3ach小鼠的股骨远程干骺端观察到纵向小梁骨的生长减少。此外,在2周龄的fgfr3ach小鼠的股骨远程成熟区及肥大区的软骨细胞中,骨钙素的表达与基质骨化的早期阶段相关。在8周龄的fgfr3ach小鼠中观察到肥大区减少。fgfr3ach小鼠的骨形成过程明显受到干扰。为了确定小梁骨的结构,我们进行了微ct分析。与野生型小鼠相比,新生及1岁fgfr3ach小鼠的远程股骨干骺端的三维图像显示骨量更低、骨小梁更薄、骨小梁更少、大腿间隙更大。骨形成的组织形态学分析显示,与出生时及1岁时的野生型小鼠相比,在fgfr3ach小鼠远程股骨干骺端中骨小梁体积(bv/tv)、骨小梁厚度(tb.th),以及骨小梁数量(tb.n)降低,同时骨小梁间距(tb.sp)及结构模型指数(smi)增加,如下表1所示。表1.新生小鼠股骨远程骨小梁的结构参数wt:野生型同窝动物;ach/ach:fgfrach/ach小鼠。bv/tv:骨小梁体积/组织体积;th.th:骨小梁厚度;th.sp:骨小梁间距;tb.n:骨小梁数量;smi:结构模型指数。每个值表示为平均值±标准偏差(所有组别n=3)。*p<0.05;**p<0.01;***p<0.001。此外,在1岁的fgfr3ach小鼠的股骨中观察到更少的成骨细胞与破骨细胞,这表示fgfr3ach小鼠中的骨转换速率可能改变。上述人类软骨发育不全及ach小鼠模型之间骨骼表型的比较总结如下表2所示。表2.人类软骨发育不全以及在软骨发育不全小鼠模型中观察到的骨骼特征的相似性tgmfgfr3ach,使用第二型胶原蛋白启动子与增强子序列表达小鼠fgfr3g374r的转基因小鼠(参见naski等人,development125:4977-4988)。kimfgfr3ach,目标小鼠fgfr3g374r的敲入基因(参见wang等人,proc.natl.acad.sci.usa96:4455-4460)。tghfgfr3ach,使用小鼠fgfr3启动子表达人类fgfr3g380r的转基因小鼠(参见segev,o.等人,hum.mol.genet.9:249-258)。kihfgfr3ach,目标上述人类fgfr3g380r的敲入基因。nd,未描述;ns,不显著。a在每个ach小鼠模型中首次观察到特定表型的时间点。实施例2:用于鉴定fgfr3调节剂的基于细胞的易位测定系统建立了基于细胞的蛋白质易位系统,用于鉴定用于治疗与fgfr3活化相关的疾病的潜在治疗性天然化合物。质体构筑与定点诱变透过聚合酶连锁反应(pcr)扩增海肾(renillareniformis)绿色荧光蛋白(rrgfp)的全长cdna,并使用noti与xbai位点将其次选殖到pcdna3.1/hygro表达载体(invitrogen公司)中。透过从含有内含子的基因组dna中扩增人类sh2bβ的sh2结构域以及人类plcγ的二个sh2结构域,并将它们次选殖到rrgfp表达载体的bamhi与noti位点中,产生与rrgfp的n端融合的src同源结构域2(sh2)蛋白质。参见图5a。将人类fgfr3的全长cdna(origene公司,rockville,马里兰州,美国)次选殖到pcdna3.1表达载体(invitrogen公司)的bamhi与xbai位点。使用quikchangesite-directedmutagenesis套组(stratagene公司,lajolla,加州,美国)透过寡核苷酸定向诱变将突变导入fgfr3。使用的诱变寡核苷酸如下:y373c(tdi),(正向)5'-cgaggcgggcagtgtgtgtgcaggcat-3'(seqidno:9)以及(反向)5'-atgcctgcacacacactgcccgcctcg-3’(seqidno:10);g380r(ach),(正向)5'-gcatcctcagctacagggtgggcttcttc-3'(seqidno:11)以及(反向)5'-gaagaagcccaccctgtagctgaggatgc-3'(seqidno:12);n540k(hyp),(正向)5'-ggaaacacaaaaacatcatcaaactgctgggcgcc-3'(seqidno:13)以及(反向)5'-ggcgcccagcagtttgatgatgtttttgtgtttcc-3'(seqidno:14);k650e(tdii),(正向)5'-cctcgactactacaaggagacaaccaacggccg-3'(seqidno:15)以及(反向)5'-cggccgttggttgtctccttgtagtagtcgagg-3'(seqidno:16)。所有质体都透过dna定序进行验证。细胞培养与转染将u2os人类骨肉瘤细胞株保持在补充有10%胎牛血清(fetalbovineserum,fbs)的mccoy's5a培养基(完全培养基)(invitrogen公司,carlsbad,加州,美国)中,在37℃及5%co2的潮湿培养箱中。对于瞬时测定,在进行测定前一天将编码rrgfp、sh2(sh2b)-rrgfp,或sh2(plcγ)-rrgfp融合蛋白的质体转染到u2os细胞中。透过以编码sh2(sh2b)-rrgfp融合蛋白的质体转染u2os细胞,并在400μg/ml潮霉素b(invitrogen公司)存在下选择2周以产生稳定表达sh2(sh2b)-rrgfp的u2os细胞。此后,透过荧光活化细胞分选(fluorescence-activatedcellsorting,facs)对单个阳性选殖株进行分选并继续选择以产生单个转染的细胞株。将稳定表达sh2(sh2b)-rrgfp的u2os细胞株用于随后用fgfr3的转染。将编码上述fgfr3形式,亦即野生型、tdi、ach、hyp以及tdii或空表达载体的质体转染到u2ossh2(sh2b)-rrgfp稳定细胞株中,并以800μg/mlg418(sigma-aldrich公司,st.louis,密苏里州,美国)选择2周。根据制造商的说明,以effectene(qiagen公司,hilden,德国)在u2os细胞中进行所有的转染。免疫沉淀以及免疫墨点法将表达fgfr3与sh2(sh2b)-rrgfp二者的稳定细胞株在补充有蛋白酶抑制剂混合物(roche公司,mannheim,德国)的裂解缓冲液(50mmtris-hclph8.0,150mmnacl,5mmedta,0.5%np-40)中进行裂解。针对免疫沉淀实验,以蛋白质a/gplus-琼脂(sc-2003;santacruzbiotechnology公司,santacruz,加州,美国)预先澄清细胞裂解物,然后与2μg抗fgfr3多株抗体(c-15;santacruzbiotechnology公司)在4℃下作用1小时。然后加入蛋白质a/b珠并在4℃作用整夜。将免疫沉淀的样品以裂解缓冲液洗涤4次,并使用抗fgfr3(c-15)、抗rrgfp(1-233;santacruzbiotechnology公司),以及抗磷酸酪胺酸(4g10;millipore公司,麻州,美国)抗体进行免疫墨点法分析。对于不需要免疫沉淀的实验,以抗fgfr3(c-15)、抗rrgfp(1-233)、抗pfgfr3(3471;cellsignaling公司,beverly,麻州,美国)、抗plcγ(2822;cellsignaling公司)、抗pplcγ(2821;cellsignaling公司)、抗erk1c-16(sc-123;santacruzbiotechnology公司)、抗erk1/2thr220/thr204(9101;cellsignaling公司)、抗pi3kp85(#4292,cellsignaling公司)、抗ppi3kp85αtyr508(sc-123,santacruz公司)、抗stat53h7(#9358,cellsignaling公司)、抗pstat5tyr694(#9359,cellsignaling公司),或抗β-肌动蛋白(mba1501;millipore公司)抗体进行免疫墨点法,随后使用增强化学发光(ecl;amershambiosciences公司,littlechalfont,buckinghamshire,英国)进行检测。显微镜与免疫荧光染色稳定表达sh2(sh2b)-rrgfp融合蛋白以及各种活化的fgfr3突变的u2os细胞在玻璃细胞培养玻片上生长。将培养基替换为无血清培养基以测定pkc412的激酶抑制,并在ultraview倒置共焦显微镜(perkinelmer公司,麻州,美国)上对活细胞进行成像。制备pkc412作为在dmso中的6%(w/w)原液。活细胞成像在37℃、5%co2培养箱中的潮湿条件下进行的。对于免疫荧光染色,在细胞培养玻片上生长的细胞以在磷酸盐缓冲盐水(pbs)中的3.6%多聚甲醛固定,并以上述兔抗fgfr3多株抗体染色。以偶联罗丹明的抗兔igg二级抗体(jacksonimmunoresearch公司,baltimore,麻里兰州,美国)检测一级抗体。以lsm510meta共焦显微镜(carlzeissmicroimaging公司,thornwood,纽约州,美国)收集图像。样品制备针对高含量筛选,包括化合物处理、固定与洗板在内的样品板制备的所有步骤都是全自动化的,并且使用bio-tekel405uv系统(bio-tekinstruments公司,winooski,佛蒙特州,美国)进行。将稳定表达tdifgfr3以及sh2-rrgfp的u2os细胞以4×103个细胞/孔的密度接种在黑色96-孔packardviewplate细胞培养盘中,在完全培养基中于37℃在co2培养箱中培养整夜,然后转移至100μl含有pkc412或植物萃取物的无血清培养基。最终的dmso浓度为1%。在co2培养箱中于37℃培养1小时后,以4.5%甲醛固定细胞,并以2μg/mlhoechst染色溶液(sigma-aldrich公司)标记细胞核。以对照组(dmso)或以10μmpkc412处理的细胞用于设定参数。在arrayscanhcs系统上进行成像及分析使用arrayscanvtihcs读取器(cellomics,pittsburgh,宾州,美国)自动获得细胞图像。使用适于检测两种荧光团的滤光片组,并使用20×0.4数值孔径显微镜物镜进行成像。使用compartmentalanalysisbioapplication(cellomics公司)对应用程序协议设置进行优化后的图像进行分析。对于这些分析,间隔分析使用hoechst标记的细胞核来识别单个细胞,并且透过软件中的参数设置来定义细胞的细胞核(圆形)以及细胞质区域(环形)。定义环形区域中的gfp斑点,并透过软件定量斑点数(环点数)及斑点强度(环点强度)。rna分离及定量实时rt-pcr分析使用trizol试剂(invitrogen公司)分离来自各种细胞株的总rna,并以qiagenrneasymini套组纯化,以脱氧核醣核酸酶(dnasei,30u/μg总rna;qiagen公司)处理,并使用superscriptiiifirst-strand合成系统(invitrogen公司)进行反转录。使用sybrgreenpcrmastermix以及abiprism7900ht序列侦测系统(appliedbiosystems公司)透过实时rt-pcr对fgfr1、2、3,以及4mrna的含量进行定量。用于rt-pcr的引物如下:fgfr1正向:5’-gagatggaggtgcttcactta-3’(seqidno:17)反向:5’-tacaggggcgaggtcatca-3’(seqidno:18)fgfr2正向:5’-atgcttgtactgccagtaggactgt-3’(seqidno:19)反向:5’-ctgacaaaatcttccgcaccat-3’(seqidno:20)fgfr3正向:5’-cctcgggagatgacgaagc-3’(seqidno:21)反向:5’-cgggccgtgtccagtaagg-3’(seqidno:22)fgfr4正向:5’-tgcagaatctcaccttgattaca-3’(seqidno:23)反向:5’-ggggtaactgtgcctattcg-3’(seqidno:24)hgapdh正向:5’-ttcgctctctgctcctcctgt-3’(seqidno:25)反向:5’-gcccaatacgaccaaatccg-3’(seqidno:26)统计分析使用双尾学生氏t检验来检验各处理之间的差异。小于0.05的p值被认为是统计学上显著的(*p值<0.05,**p值<0.01,***p值<0.001)。结果建立稳定的细胞株并评估效应子-gfp融合蛋白的次细胞分布如上所述透过定量rt-pcr确定fgfr1-4在293t细胞、软骨细胞,以及u2os人类骨肉瘤细胞中的表达含量。在所测试的三种细胞类型中,只有u2os细胞内源地表达fgfr1、2,以及4的mrna,但未表达fgfr3。参见图4。选择u2os细胞株用于开发针对活化的fgfr3功能的调节剂的基于细胞的筛选系统。已显示plcγ与sh2-bβ的sh2结构域与活化的fgfr3相互作用并转导特定的下游讯号。参见harada等人,bone41:273-281以及kong等人,j.biol.chem.277:15962-15970。按照上述方法在u2os细胞中瞬时表达rrgfp、rrgfp-plcγsh2结构域融合蛋白,以及rrgfp-sh2-bβsh2结构域融合蛋白。结果显示rrgfp讯号均匀分布在u2os细胞中。sh2(sh2-b)-rrgfp讯号分配到细胞质及核间隔。相比之下,sh2(plcγ)-rrgfp定位于质膜,可能是由于sh2(plcγ)-rrgfp与内源性fgfr1、2,以及4或与u2os细胞中的其他受体酪胺酸激酶的非特异性相互作用。将均质表达sh2(sh2-b)-rrgfp的稳定细胞株用于随后与野生型fgfr3及各种fgfr3活化突变体的共转染。参见图5a及5b。西方墨点法分析证实稳定细胞株中fgfr3蛋白(野生型与突变体)以及sh2(sh2-b)-rrgfp蛋白的表达。表达野生型fgfr3以及各种活化fgfr3的细胞表现出胞质溶胶sh2(sh2-b)-rrgfp荧光的点样,亦即点状图案。在用空表达载体转染的sh2(sh2-b)-rrgfp细胞株中则未观察到斑点。一部分内化的斑点讯号与溶酶体共定位,表示sh2(sh2b)-rrgfp与活化的fgfr3的复合物透过溶酶体途径发生内化与降解。细胞质荧光斑点代表活化的fgfr3与sh2(sh2-b)-rrgfp的内化复合物。透过免疫共沉淀检测fgfr3与sh2(sh2b)-rrgfp蛋白的直接相互作用。结果显示,在含有各种活化形式的fgfr3的细胞株中可检测到磷酸化的fgfr3,还显示sh2(sh2b)-rrgfp蛋白与fgfr3共免疫沉淀。透过免疫共定位进一步证实了sh2(sh2b)-rrgfp与fgfr3之间的相互作用,其显示大多数野生型fgfr3位于质膜上,而大多数活化的fgfr3内化并在胞质溶胶中形成点状讯号。透过共定位染色鉴定的活化的fgfr3与sh2(sh2b)-rrgfp的复合物对应于胞质溶胶中的点状sh2(sh2b)-rrgfp讯号。已知sh2结构域透过tyr-724与tyr-760与活化的fgfr3相互作用。参见harada等人,bone41:273-281。也测试了携带y724f与y760f突变的fgfr3的y373c(tdifgf3)活化形式在瞬时转染的细胞中与sh2(sh2b)-rrgfp的相互作用。在瞬时表达tdifgfr3的sh2(sh2b)-rrgfp稳定细胞的细胞溶质中观察到点状荧光讯号。相较之下,在瞬时表达y724f/760f-取代的tdifgfr3的sh2(sh2b)-rrgfp稳定细胞株中未观察到点状胞质荧光。如下节所述进行点状胞质荧光的定量,如图6c所示。表达tdifgfr3的细胞与表达y724f/760f-tdifgfr3的细胞之间的fgfr3表达含量相同。这些结果证实点状胞质荧光直接对应于活化的fgfr3与sh2(sh2b)-rrgfp的内化复合物,并且进一步证实fgfr3残基tyr-724与tyr-760对于在细胞中fgfr3与sh2(sh2b)-rrgfp的相互作用是重要的。使用高通量成像系统检测及定量pkc412抑制fgfr3活性基于上述rrgfp-表达细胞建立适合于高通量筛选及定量fgfr3抑制剂活性的细胞成像系统。首先,使用酪胺酸激酶抑制剂pkc412测试该系统精确定量fgfr3活性的能力。pkc412为一种小分子酪胺酸激酶抑制剂,已被证明可透过抑制fgfr3的酪胺酸自磷酸化来有效抑制fgfr3活化的多发性骨髓瘤细胞株中的细胞生长。参见chen等人,oncogene24:8259-8267。如上所述,tdifgfr3突变导致最严重的fgfr3活化相关骨骼发育不良。表达sh2(sh2b)-rrgfp与tdifgfr3的稳定细胞株,其显示内化斑点讯号最高含量,用于结合pkc412以优化定量高通量细胞成像应用的参数。以二甲基亚砜(dmso;对照组)或pkc412处理的细胞的图像使用arrayscanviihcs读取器获得,并以相关的compartmentalanalysisbioapplication进行分析。在sh2(sh2b)-rrgfp与tdifgfr3表达细胞中的点状gfp讯号在以pkc412处理后1小时内消失,但在以dmso处理后没有消失。透过高通量成像系统测量的两个主要可量化特征,即环点计数以及每个细胞的总环点强度,评估其反映潜在生物学的能力。从pkc412剂量–反应测定确定每个细胞的环点计数与总环点强度并绘制为dmso对照组反应的百分比。结果如图6a所示。由这两个测量特征计算的ic50值非常相似,表示可用来评估抑制剂的药理学性质。透过上述方法定量的环点计数用于比较稳定表达sh2(sh2b)-rrgfp与野生型fgfr3,或使用或不使用酸性纤维母细胞生长因子(afgf)及肝素处理的各种活化的fgfr3的细胞中的fgfr3活性。结果如图6b所示。在表达野生型fgfr3的细胞中,以afgf与肝素处理使环点计数显著增加。与使用或不使用afgf与肝素处理相比,在各种活化的fgfr3表达细胞中环点计数没有显著差异。同样的定量方法也用于比较上述瞬时表达td1fgfr3或y724f/760ftd1fgfr3的sh2(sh2b)/gfp稳定细胞。参见图6c。请注意,y724f/760ftd1fgfr3不与sh2结构域进行交互作用。与模拟转染的细胞相比,表达sh2(sh2b)/gfp与tdifgfr3突变体的细胞具有高出许多的环点计数。另一方面,表达sh2(sh2b)/gfp与y724f/760ftdifgfr3的细胞则显现出少许至无环点,证实环点的存在与tdifgfr3及sh2结构域之间的相互作用相关。实施例3:使用基于细胞的易位测定系统筛选fgfr3调节剂的植物萃取物使用上述基于细胞的易位测定系统来筛选从101种不同植物物种获得的乙醇萃取物,以鉴定能够调节fgfr3活性的药剂。植物萃取物制备从台湾收集的101个不同植物物种中,从下表4所示的57个分类科中创建植物萃取物文库。表4.测试fgfr3活性调节剂的植物家族*在这个科中确定有阳性命中将整株植物干燥,研磨并以95%乙醇萃取。将乙醇萃取物在旋转蒸发器中减压蒸发干燥,并溶于dmso中至浓度为37mg/ml。细胞增殖测定基于透过线粒体脱氢酶切割四唑鎓盐wst-1(roche公司)的细胞活性的比色测定来测定细胞增殖。细胞在无血清条件下生长24小时,然后以50,000个细胞/孔的密度在rpmi中接种于96孔盘中。将细胞与1nmafgf以及50μg/ml肝素以及各种剂量的植物萃取物在200μlrpmi中一起培养,终浓度为1%dmso。将培养盘在37℃,5%co2下培养72小时。根据制造商的说明书进行wst-1测定。在添加试剂后1小时,在波长450nm以及690nm测量形成的甲腙染剂的吸亮度,其与培养物中代谢活性细胞的数量相关。每个实验条件进行三重复。结果识别与验证植物萃取物fgfr3调节活性使用上述方法在表达sh2(sh2b)-rrgfp与tdifgfr3的细胞上筛选上述植物萃取物以鉴定含有抑制fgfr3活化的活性的萃取物。若以萃取物处理的细胞中测得的每个细胞的环点计数不超过dmso处理的细胞(即对照组)的60%,则筛选结果被认为是阳性(“命中”)。使用pkc412作为阳性对照组。筛选实验重复3次。基于上述标准,测试的101种植物乙醇萃取物中的4种在该初筛(“命中1”、“命中2”、“命中3”,以及“命中4”)中被鉴定为命中。另外,一些植物萃取物显示增强fgfr3活性。结果如图7a所示。为了进一步确认命中结果的重复性,进行筛选实验1及2的结果的线性回归分析。将每个细胞的环点计数与来自这二个实验的dmso对照组相比的百分比相对于每种植物萃取物与pkc412处理组相对绘图。结果如图7b所示。pkc412处理组与命中(在图7b的左下角圈出)明显不同于dmso对照组、无反应者,以及活化反应者群体(在图7b的右上角圈出)。透过确定在不同浓度的植物萃取物中与dmso对照组相比每个细胞的环点计数的百分比,对命中1、命中2,命中3,以及命中4进行剂量-反应分析。结果显示于图7c中。四种测试植物萃取物对fgfr3活化的抑制作用呈剂量依赖性,进一步证实了筛选结果。命中4从苋菜的乙醇萃取物中产生。乙醇萃取物也由二种密切相关的植物物种所制备。这二种植物萃取物,即命中4-1(刺苋(amaranthusspinosus))和命中4-2(三色苋(amaranthustricolor))显示出类似于命中4的对fgfr3活化的剂量依赖性抑制。参见图7d。在fgfr3活化的初代多发性骨髓瘤细胞中抑制细胞增殖与fgfr3讯号传导检测命中4、命中4-1,以及命中4-2对异位表达tdifgfr3的人类骨髓瘤细胞株kms-11的生长的影响。用afgf/肝素刺激kms-11细胞,并与dmso阴性对照组、pkc412阳性对照组,或10μg/ml以及100μg/ml剂量的每种测试植物萃取物一起培养。如上所述方式测量细胞生长。结果如图7e所示。观察到命中4、命中4-1,以及命中4-2在100μg/ml剂量下抑制细胞生长。来自无反应者的植物萃取物在相同剂量下不会抑制细胞生长。透过命中4、命中4-1,以及命中4-2抑制kms-11细胞生长与抑制fgfr3磷酸化以及抑制可能的fgfr3讯号传导中间体,包括plcγ、stat5、pi3k以及erk1/2,的磷酸化有关,如透过上述实施例2中所述的全细胞裂解物的免疫墨点法分析所确定的。实施例4:生物测定导向的植物萃取物分离与纯化的fgfr3活性抑制剂去镁叶绿素酸a与焦去镁叶绿素酸a以上实施例2中描述的基于细胞的易位测定法作为生物测定以鉴定抑制fgf3r活性的植物萃取物分层。以上讨论的命中4为苋菜(a.viridis)的一种萃取物。如下所述,获得来自该来源的分层并测定fgfr3抑制活性。植物材料的制备及萃取针对小规模制剂,收集新鲜的苋菜植物,以水洗涤,在65℃烘箱中干燥13小时,研磨成粉末。将该粉末在10份体积的95%乙醇中萃取并在室温下连续搅拌16小时。将乙醇萃取物过滤并在蒸发器中浓缩。由工业技术研究所制备了大量的苋菜萃取物。简言之,收集新鲜的苋菜植物(500kg),以水洗涤,在65℃的烘箱中干燥13小时,并切成小条。透过95%乙醇回流萃取将干燥的小条(47.3kg)萃取24小时,间歇搅拌,每隔2小时重复一次。透过蒸发器浓缩萃取物至在25.7l乙醇中的最终固体含量为6.43%。萃取物在使用前储存于4℃。苋菜(a.viridis)的乙醇萃取物的分层与分馏。将上述粗萃的乙醇萃取物如图8所示进行进一步分层。将该乙醇萃取物装载到diaionhp-20管柱(80×240mm)上,并以100%h2o(分层1;f1)、在h2o中的50%v/v乙醇(etoh/h2o分层2;f2)、100%乙醇(etoh分层3;f3)、在乙酸乙酯中的50%(v/v)乙醇(etoh/etoac分层4;f4)、100%乙酸乙酯(etoac分层5;f5)逐步分馏。将每个分层在蒸发器中浓缩并储存于-20℃备用。将f4分层进行管柱层析以将萃取物分离成107个分层。以硅胶作为固定相,而极性逐渐增加的溶剂体系,即乙酸乙酯中的己烷与甲醇中的乙酸乙酯用作流动相。收集洗脱的分层并透过蒸发器浓缩。该分层储存于-20℃。高效液相色谱分析透过高效液相色谱(high-performanceliquidchromatography,hplc)分析植物分层。将分层加入到50%hplc级甲醇(meoh)中至浓度为10mg/ml。使用配备spectrasystemp1000帮浦,thermouv6000lp的hplc系统(spectrasystemas公司)分离样品。反相色层分析在等度条件于在25℃下使用c-18反相管柱(250×4.6mm内径,粒度5μm,luna5μc-18(2);phenomenex,torrance,加州,美国)进行。运行条件如下:注射量5μl;流动相,甲醇:0.4%乙酸(80:20v/v);流速,1ml/min;在波长290nm下检测。样品在注入样品环之前透过超滤膜(孔径0.45μm;e-merck公司,darmstadt,德国)过滤。紫外光-可见光谱光谱研究透过分光亮度法(perkin-elmer公司)进行。所有用于光谱研究的溶剂都是分析级。所有的研究都使用了毫升石英比色皿。分析薄层色层分析与分层汇集将从硅胶色层分析获得的f4的107个分层中的每一个都点在涂覆有硅胶f254的铝薄层色层分析(thinlayerchromatography,tlc)板上。将点样的tlc板置于小型色层分析槽中,根据它们在溶剂体系中的相对迁移率分离各分层。用于分层1-72的溶剂体系为乙醇-己烷25:75(v/v),分层73-107为丙酮-甲醇9:1(v/v)。色层分析图案在紫外光下可见。根据它们的tlc图谱的相似性将107个分层合并为12个分层。高含量基于细胞的易位测定使用上述实施例2中描述的高含量基于细胞的易位测定来分析苋菜萃取物分层。细胞增殖测定如上面实施例3中所述分析各分层抑制人类骨髓瘤细胞株kms-11的fgfr3活性依赖性生长的能力。数据分析使用prism5.02(graphpad公司)分析剂量反应曲线与fgfr3抑制的ic50。透过配对t检验分析二组数据之间差异的统计学显著性,p值<0.05被认为是显著的。结果鉴定来自苋菜(a.viridis)的抑制fgfr3活化的生物活性分层如上所述,抑制fgfr3活化并被命名为命中4的生物活性萃取物为苋菜的乙醇萃取物。为了进一步表征来自苋菜乙醇萃取物的生物活性分层与化合物,透过生物测定导向的分离进行另外的分层分离。按照图8所示的分层方法,从苋菜的二个独立分离的乙醇萃取物中获得五个分层,即f1-f5。各分层的回收率示于下表5。一种萃取物(a-e01)为一小规模萃取物,而另一种(a-e02)为如上所述的大规模萃取物。表5:分配分层的回收率aetoh:乙醇;ea:乙酸乙酯透过上述基于细胞的易位测定系统分析各个苋菜分层对fgfr3活化的抑制活性。结果显示在图9中。在五个测试分层中,分层f3、f4,以及f5显示对fgfr3活化的抑制,相较于其他测试分层,其中分层f4具有对fgfr3活化最低50%抑制的浓度(ic50=3.63μg/ml)。如上所述,分离出二种独立的苋菜乙醇萃取物。第二种大规模萃取物来自一批从不同季节不同地点采集的苋菜植物中分离得到的。第一批为春季从台湾台北收集的,第二批为在夏季从台湾台南收集的。从二种不同的苋菜制剂(即a-e1-f4与a-e2-f4)获得的f4分层在hplc、uv、cad,以及ms分析中显示出相似的模式。然而,与从小规模制剂(a-e1-f4)获得的f4分层相比,来自大规模制剂(a-e2-f4)的f4分层具有较低的fgfr3抑制活性(e1-f4,ic50=7.918μg/ml;e2-f4,ic50=33.31μg/ml)。从大规模的苋菜制备物获得的f4分层透过硅胶相层析进一步分为107分层,并且透过tlc分析这些分层中的每一个。基于tlc图谱的相似性将107个分层合并为12个分层(f4-is1至f4-is12)。这12个部分的回收率显示在下面的表6中。表6:来自a-e2-f4的12个分层的回收率a-e2-f4回收率(%)f4-is011.58f4-is0221.84f4-is0318.71f4-is044.91f4-is054.87f4-is069.33f4-is074.53f4-is087.37f4-is091.10f4-is105.92f4-is113.25f4-is124.46总和87.87透过基于细胞的易位测定系统分析f4-is01至f4-is12的fgfr3抑制活性。结果如图10a至图10c所示。f4-is10与f4-is11分层显示出对fgfr3活化的最高抑制,ic50分别为6.605μg/ml和1.747μg/ml。参见图10c。活性分层抑制kms-11细胞的生长活性分层f4-is-10与f4-is-11对人类骨髓瘤细胞株kms-11生长的作用,kms-11的生长取决于y373cfgfr3的异位表达。f4-is-10与f4-is-11均抑制kms-11细胞的增殖,因此证实了基于细胞的易位测定的结果。活性化合物的分离与结构阐明为了进一步纯化活性分层,制备苋菜的大规模乙醇萃取物以及次分层使用以下溶剂:(i)在乙酸乙酯溶液中的25%己烷,(ii)在乙酸乙酯溶液中的50%己烷,(iii)在乙酸乙酯中的70%己烷,(iv)乙酸乙酯,以及(v)在丙酮中的50%甲醇。如下表7所示,从64.81g起始原料获得21个分层。表7.苋菜乙醇萃取物的乙醇萃取及溶剂分配hx,己烷;ea,乙酸乙酯;meoh,甲醇。使用基于细胞的测定系统测试每个分层抑制fgfr3活性的能力。结果显示分层x-ea-c11与12对fgfr3活化具有最高的抑制活性。透过反相色层分析对这二个分层进行进一步纯化,得到来自x-ea-c11的110个分层以及来自x-ea-c12的117个分层。在基于细胞的测定中测试这些分层中的每一个分层抑制fgfr3活化的能力。显示出大于60%抑制活性的分层进行进一步的剂量反应测定。分层1987-n-100为fgfr3活化最有效的抑制剂,并被选择用于进一步纯化。透过反相色层分析将分层1987-n-100细分为8个分层。在基于细胞的测定中测试所有8个分层以抑制fgfr3活化。其中,c2156-n3以及c2156-n5分层具有最高的fgfr3抑制活性。使用高分辨率ma、ms/ms、ir,以及nmr进一步分析这两个分层。核磁共振数据被用来确定c2156-n3与c2156-n5分层的主要化学成分分别为去镁叶绿素酸a(“pa”)以及焦去镁叶绿素酸a(“pyropa”)。去镁叶绿素酸a与焦去镁叶绿素酸a抑制fgfr3活化在基于细胞的易位测定系统中测定pa与pyropa抑制fgfr3活化的能力。结果显示pa与pyropa都抑制fgfr3活化。pa也在kms11细胞增殖测定中测试。它抑制这些细胞的fgfr3依赖性细胞增殖。pa的衍生物抑制fgfr3活化制备pa的衍生物的目的为提高效力及溶解度。在图11a中示出了二种这样的衍生物,即hcl-n-去镁叶绿素酸a(hcl-n-pa)以及na-去镁叶绿素酸a(na-pa)。与pa相比,两种衍生物都具有增强的溶解度,并且具有可相比的fgfr3抑制活性,如透过基于细胞的测定所评估的。参见图11b。pa已被作为氯基光敏剂并显示出抗肿瘤活性。测试了四种其他光敏剂(三种在结构上与pa相关,而另一种与其不同)的能力,以检测fgfr3抑制活性。结果显示于图12中。数据表示与pa结构相关的三种化合物,即叶绿酸a、替莫泊芬(temoporfin)以及焦去镁叶绿素酸-a甲酯,具有fgfr3抑制活性,而不相关的化合物5-胺基乙酰丙酸则否。值得注意的是,pyropa的fgfr3抑制活性强于任何所测试的光敏剂。实施例5:以植物萃取物及纯化合物对fgfr3活化的体内抑制以治疗软骨发育不全测试上述实施例4中植物萃取物分层f4与f4-is11以及纯化的pa对体内软骨发育不全的作用。治疗软骨发育不全小鼠在无特定病原体条件下,将小鼠安置在温度及湿度受控的房间中,并进行12小时光照/12小时黑暗循环。所有动物实验协议均由台湾中央研究院动物管理暨使用委员会批准。于上述实施例1中描述了软骨发育不良(fgfr3ach/ach)小鼠。fgfr3ach/ach小鼠自7天龄开始,每天以在200μlpbs中0.2mg/g/小鼠剂量的植物活性分层f4与f4-is11透过管饲处理4或7周。以载剂对照处理对照组野生型同窝小鼠(wt)以及fgfr3ach/ach小鼠。在另外的研究中,以类似的方式用0.09mg/g/小鼠剂量的纯化的pa或载剂对照处理小鼠。每周测量体重及体长。骨骼分析如上所述,透过二维成像(skyscan1076系统,bruker,brussels,比利时)分析骨架。活性分层改善了ach小鼠的临床表型及骨骼发育评估活性分层,即f4与f4-is11,在减弱fgfr3ach/ach小鼠的侏儒症表型中的临床功效。结果如图13a至图13f所示。正如预期的那样,fgfr3ach/ach小鼠与其野生型同窝小鼠(wt)相比具有较低的体重、体长,以及较短的股骨长度。参见图13a至图13f所示,将fgfr3hach/hach(dmso)与wt(dmso)比较。与载剂处理的fgfr3ach/ach小鼠相比,以f4及f4-is11处理的七日龄fgfr3ach/ach小鼠表现出增加的体重、体长,以及股骨长度。分别参见图13a至图13c与图13d至图13f。还透过二维微ct分析,与载剂处理的fgfr3ach/ach小鼠相比,以活性分层处理的fgfr3ach/ach小鼠的骨骼发育改善。f4-is11处理的fgfr3ach/ach小鼠呈现减弱的侏儒症表型,包括圆形颅骨的扁平化、短口鼻的伸长、突出的下门齿的矫正,以及脊柱后凸的改善。如上所述,透过实施例4中所述的方法将pa鉴定为苋菜萃取物中的活性化合物。7日龄的野生型与fgfr3ach小鼠以载剂(dmso)或0.09mg/g/小鼠剂量的pa处理7周。每周测量治疗小鼠的体重。结果显示于图14中。相较于以dmso处理的小鼠,以pa处理的野生型小鼠以及fgfr3ach小鼠显示出增加的体重。其他具体实施例本说明书中公开的所有特征可以任何组合结合。本说明书中公开的每个特征可由用于相同、等同或类似目的的替代特征替代。因此,除非另有明确说明,否则所公开的每个特征仅仅为一系列等同或类似特征的一个例子。从以上描述中,本领域技术人员可以容易地确定所描述的具体实施例的基本特征,并且在不脱离其精神及范围的情况下,可以对具体实施例进行各种改变及修改,以使其适应各种用途及条件。因此,其他具体实施例也在权利要求内。序列表<110>施明哲、中央研究院<120>调节纤维母细胞生长因子受体3活化的组合物及方法<130>218048-0279pct<150>us62/457,423<151>2017-02-10<160>29<170>patentinversion3.5<210>1<211>122<212>prt<213>人工序列<220><223>合成的多肽<400>1glygluprogluglyglygluglyaspglnproleuserglytyrpro151015trpphehisglymetleuserargleulysalaalaglnleuvalleu202530thrglyglythrglyserhisglyvalpheleuvalargglnserglu354045thrargargglyglutyrvalleuthrpheasnpheglnglylysala505560lyshisleuargleuserleuasnglugluglyglncysargvalgln65707580hisleutrppheglnserilepheaspmetleugluhispheargval859095hisproileproleugluserglyglyserseraspvalvalleuval100105110sertyrvalproserserglnargglngln115120<210>2<211>233<212>prt<213>人工序列<220><223>合成的多肽<400>2valserserserthrgluleuhisserasnglulystrpphehisgly151015lysleuglyalaglyargaspglyarghisilealagluargleuleu202530thrglutyrcysilegluthrglyalaproaspglyserpheleuval354045argglusergluthrphevalglyasptyrthrleuserphetrparg505560asnglylysvalglnhiscysargilehisserargglnaspalagly65707580thrprolysphepheleuthraspasnleuvalpheaspserleutyr859095aspleuilethrhistyrglnglnvalproleuargcysasngluphe100105110glumetargleusergluprovalproglnthrasnalahisgluser115120125lysglutrptyrhisalaserleuthrargalaglnalagluhismet130135140leumetargvalproargaspglyalapheleuvalarglysargasn145150155160gluproasnsertyralaileserpheargalagluglylysilelys165170175hiscysargvalglnglngluglyglnthrvalmetleuglyasnser180185190glupheaspserleuvalaspleuilesertyrtyrglulyshispro195200205leutyrarglysmetlysleuargtyrproileasngluglualaleu210215220glulysileglythralagluproasp225230<210>3<211>17<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>3tgcggtgccttcacaga17<210>4<211>17<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>4acttggacctctccgtg17<210>5<211>18<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>5gctgaggacacaggtgtg18<210>6<211>18<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>6cactccctccatctcctg18<210>7<211>20<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>7ccagaacatcatccctgcat20<210>8<211>21<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>8gttcagctctgggatgacctt21<210>9<211>27<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>9cgaggcgggcagtgtgtgtgcaggcat27<210>10<211>27<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>10atgcctgcacacacactgcccgcctcg27<210>11<211>29<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>11gcatcctcagctacagggtgggcttcttc29<210>12<211>29<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>12gaagaagcccaccctgtagctgaggatgc29<210>13<211>35<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>13ggaaacacaaaaacatcatcaaactgctgggcgcc35<210>14<211>35<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>14ggcgcccagcagtttgatgatgtttttgtgtttcc35<210>15<211>33<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>15cctcgactactacaaggagacaaccaacggccg33<210>16<211>33<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>16cggccgttggttgtctccttgtagtagtcgagg33<210>17<211>21<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>17gagatggaggtgcttcactta21<210>18<211>19<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>18tacaggggcgaggtcatca19<210>19<211>25<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>19atgcttgtactgccagtaggactgt25<210>20<211>22<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>20ctgacaaaatcttccgcaccat22<210>21<211>19<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>21cctcgggagatgacgaagc19<210>22<211>19<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>22cgggccgtgtccagtaagg19<210>23<211>23<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>23tgcagaatctcaccttgattaca23<210>24<211>20<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>24ggggtaactgtgcctattcg20<210>25<211>21<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>25ttcgctctctgctcctcctgt21<210>26<211>20<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>26gcccaatacgaccaaatccg20<210>27<211>20<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>27cctccggagtaactcagtgc20<210>28<211>20<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>28acaacttaccgagcgaaagc20<210>29<211>20<212>dna<213>人工序列<220><223>合成的寡核苷酸<400>29gcacactgaagtggcacagt20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1