氨基酸聚合物的制备方法与流程
本发明涉及用于制备氨基酸聚合物的方法,特别是涉及用于制备通过肽键与硫代酸氨基酸连接的氨基酸的聚合物的方法。
背景技术:
:氨基酸聚合物被用于多种目的,例如许多工业产品、这些产品的添加剂、以及这些产品中包含的化合物的合成中间体。例如,作为天冬氨酸均聚物的聚天冬氨酸用作洗涤剂、肥料、农用化学品、化妆品或这些产品的添加剂。此外,近年来,蜘蛛丝中含有的聚丙氨酸在其强度方面受到关注。以这种方式,已经发现氨基酸聚合物作为产生传统上不具备的新特性的功能性高分子材料的多种用途,并且预期在未来数年内对工业制备氨基酸聚合物的需求将提高。已经开发了多种方法(例如生物和化学方法)作为用于制备氨基酸聚合物的方法,尽管认为在多个点(例如制备效率和品质)都有改进的空间。例如,对于生物学方法,这包括例如对引入非天然型氨基酸的限制,或糖蛋白中糖链结构的不均一性。此外,对于化学方法,与生物方法相反,允许设计和结构控制的自由,但是需要合成期间的保护和去保护的步骤。出于这个原因,在这些步骤期间发生的副反应以及对生产率的限制(例如成本和时间)被指出为问题。还指出了这样的问题,即在去保护步骤中经常必需使用具有高毒性的毒素。因此,为了改善允许设计和结构控制自由的化学合成的生产率,期望将保护和去保护步骤改进为更简单且更迅速并且更安全的步骤。硫代酸是具有硫代酸基团(-cosh)的化合物的通用术语。迄今已知的用于与硫代酸形成酰胺键的方法是与具有叠氮基团的氨基酸偶联(非专利文献1),利用硫代酸s-s二聚体作为活性酯的方法(非专利文献2),以及通过硫代酸的亚硝化活化的方法(非专利文献3)。此外,已知用于使用硫代酸氨基酸形成肽键的方法是使用经保护硫代酸氨基酸s-s二聚体作为活性酯的方法(非专利文献4),以及利用硫代酸氨基酸作为hobt酯前体的方法(非专利文献5)。引用列表[非专利文献1]j.am.chem.soc.2003,125,7754-7755[非专利文献2]nature,vol389,4september1997[非专利文献3]org.lett.,vol.13,no.5,2011[非专利文献4]j.org.chem.2014,79,2377-2383[非专利文献5]j.am.chem.soc.9vol.132,no.47,2010技术实现要素:本发明要解决的问题本发明的目的是提供用于制备氨基酸聚合物的方法,该方法与用于制备氨基酸聚合物的常规方法相比更简单且高效。解决问题的手段通过使用一个氨基酸的α-氨基作为亲核基团以允许与另一氨基酸的羧基缩合来形成氨基酸之间的肽键。由于在缩合期间活化的羧基变得更可能与α-氨基以及侧链中存在的具有亲核性的多种官能团反应,因此为了制备结构上受控制的氨基酸的聚合物,必需保护氨基酸的侧链和α-氨基(除反应主体之外的那些)。本发明人为了解决本发明的问题而反复进行广泛的研究,结果出人意料地发现,当将硫代酸氨基酸用于制备氨基酸聚合物并使它们彼此进行氧化反应时,可在不保护α-氨基和侧链的情况下高效地制备通过肽键连接的氨基酸聚合物。本发明人还出人意料地发现,即使使用具备具有长侧链和亲核性的官能团并因此被认为在常规氨基酸缩合方法中必需进行保护的赖氨酸时,也可类似地制备氨基酸聚合物。这意味着本发明的制备方法可用于多种目的而不受氨基酸侧链类型的限制。本发明基于以上知识,并涵盖以下特征:[1]用于制备通过肽键连接的氨基酸的聚合物的方法,其特征在于其包括:(a)制备各自如下所示第一和第二氨基酸衍生物的步骤:h2n-ch(r)-cosh(1)(其中r表示任何氨基酸的侧链);以及(b)使所述第一氨基酸衍生物和第二氨基酸衍生物进行氧化反应以获得如下所示化合物的步骤:h2n-ch(r)-co-hn-ch(r)-co-sh(2)(其中每个r各自独立地表示任何氨基酸的侧链);其中所述第一氨基酸衍生物和第二氨基酸衍生物中的至少一个不具有保护基。[2]根据制备方法[1]所述的方法,其中所述第一氨基酸衍生物和第二氨基酸衍生物二者都不具有保护基。[3]根据[1]或[2]所述的制备方法,其包括:(c)使步骤(b)中获得的化合物(2)与如下所示第三氨基酸衍生物进行氧化反应:h2n-ch(r)-cosh(1)(其中r表示任何氨基酸的侧链),以获得如下所示化合物的步骤:h2n-ch(r)-co-(hn-ch(r)-co)2-sh(3)(其中每个r各自独立地表示任何氨基酸的侧链)。[4]根据[3]所述的制备方法,其特征在于,多次进行步骤(c)以获得如下所示化合物:h2n-ch(r)-co-(hn-ch(r)-co)n-sh(4)(其中每个r各自独立地表示任何氨基酸的侧链,并且n表示2或更大的整数)。[5]根据[3]或[4]所述的制备方法,其中所述一个或更多个第三氨基酸衍生物不具有保护基。[6]根据[1]至[5]中任一项所述的制备方法,其还包括:(d)使步骤(b)中获得的化合物(2)或者步骤(c)中获得的化合物(3)或化合物(4)与如下所示亲核性试剂反应:h-x(5)(其中x表示通过选自n、o、s和se的原子结合的取代基),以获得如下所示化合物的步骤:h2n-ch(r)-co-(hn-ch(r)-co)m-x(6)(其中每个r各自独立地表示任何氨基酸的侧链,m表示任何整数,并且x表示通过选自n、o、s和se的原子结合的取代基)。[7]根据[6]所述的制备方法,其中x是通过n原子或s原子结合的取代基。[8]根据[4]所述的制备方法,其是用于制备包含4至20个氨基酸的聚合物的方法。[9]根据[1]至[8]中任一项所述的制备方法,其中所述第一或第二氨基酸衍生物,或者所述多于一个第三氨基酸衍生物中的至少一个具有未经保护的4-氨基丁基作为侧链。[10]根据[1]至[8]中任一项所述的制备方法,其中所述第一和第二氨基酸衍生物的侧链与所述一个或更多个第三氨基酸衍生物的侧链是相同的。[11]根据[10]所述的制备方法,其中所述侧链均为甲基。[12]用于制备通过肽键连接的多于一个氨基酸的聚合物的方法,其特征在于其包括:(a)制备多于一个如下所示氨基酸衍生物的步骤:h2n-ch(r)-cosh(1)(其中r表示任何氨基酸的侧链);(b)对所述多于一个氨基酸衍生物进行氧化反应以获得多于一个如下所示化合物:h2n-ch(r)-co-(hn-ch(r)-co)x-sh(7)(其中每个r各自独立地表示任何氨基酸的侧链,x表示任何整数)和/或如下所示化合物的步骤:h2n-ch(r)-co-(hn-ch(r)-co)y-s-s-(co-ch(r)-nh)z-co-ch(r)-nh2(8)(其中每个r各自独立地表示任何氨基酸的侧链,并且y和z表示任何整数),其中所述多于一个氨基酸衍生物的一部分或全部不具有保护基。[13]根据[12]所述的方法,其中所述多于一个氨基酸衍生物全部不具有保护基。[14]根据[12]或[13]所述的方法,其中步骤(b)中获得的化合物包含化合物(7)。[15]根据[14]所述的制备方法,其还包括:(c1)使步骤(b)中获得的化合物(7)与如下所示亲核性试剂反应:h-x(5)(其中x表示通过选自n、o、s和se的原子结合的取代基),以获得如下所示化合物的步骤:h2n-ch(r)-co-(hn-ch(r)-co)x-x(9)(其中每个r各自独立地表示任何氨基酸的侧链,x表示任何整数,并且x表示通过选自n、o、s和se的原子结合的取代基)。[16]根据[15]所述的制备方法,其中x是通过n原子或s原子结合的取代基。[17]根据[12]或[13]所述的制备方法,其中步骤(b)中获得的化合物包含化合物(8)。[18]根据[17]所述的制备方法,还包括:(c2)使步骤(b)中获得的化合物(8)与如下所示亲核性试剂反应:h-x(5)(其中x表示通过选自n、o、s和se的原子结合的取代基),以获得如下所示化合物:h2n-ch(r)-co-(hn-ch(r)-co)y-x(10)(其中每个r各自独立地表示任何氨基酸的侧链,y表示任何整数,并且x表示通过选自n、o、s和se的原子结合的取代基)和如下所示化合物的步骤:h2n-ch(r)-co-(hn-ch(r)-co)z-x(11)(其中每个r各自独立地表示任何氨基酸的侧链,z表示任何整数,并且x表示通过选自n、o、s和se的原子结合的取代基)。[19]根据[18]所述的制备方法,其中x是通过n原子或s原子结合的取代基。[20]根据[12]至[19]中任一项所述的制备方法,其是用于制备包含4至20个氨基酸的聚合物的方法。[21]根据[12]至[20]中任一项所述的制备方法,其中所述多于一个氨基酸衍生物中的至少一个具有未经保护的4-氨基丁基作为侧链。[22]根据[12]至[21]中任一项所述的制备方法,其中所述多于一个氨基酸衍生物的侧链是相同的。[23]根据[22]所述的制备方法,其中所述侧链均为甲基。[24]根据[12]至[23]中任一项所述的制备方法,其用于产生多肽文库。本领域技术人员应认识到,上述本发明的一个或更多个特征的任意组合的发明都涵盖在本发明的范围内。发明的效果与利用保护基的常规方法相比,根据本发明的制备方法可极其高效地制备氨基酸聚合物。此外,由于在本发明的制备方法中不需要利用保护基,因此可容易地避免使用高度毒性毒素进行去保护的常规方法所涉及的问题。由于本发明的制备方法允许合成大量多于一个的氨基酸聚合物,因此其可适用于聚氨基酸的工业生产或多肽文库的产生。附图说明图1示出了在h-phe-sh的氧化反应之后即刻和之后2小时时的产物的lc-ms结果。图2示出了对应于图1中的ms(a)、ms(b)和ms(c)的级分的质谱结果。图3示出了h-phe-sh和h-ala-sh的寡聚反应之后1分钟时的uhplc结果。图4示出了对级分(a)至(i)进行测量的质谱结果。级分(a)至(i)分别对应于图3中的ms(a)至ms(i)。图5示出了对级分(j)进行测量的质谱结果。级分(j)对应于图3中的ms(j)。图6示出了phe-sh和lys-sh的寡聚反应的分析型lc-ms的tic色谱图。图7示出了从图6中的tic色谱图(2.2至14.0分钟)获得的积分ms谱。图8示出了在图6的tic色谱图中7分钟时从峰顶获得的2f2k寡肽的ms谱。c30h40n6o4s[m+2h]2+的hrms(esi),计算值:293.1645,实测值:293.1640。图9示出了2f2k寡肽的cid片段化模式。具体实施方式本文中的“氨基酸”以其最广泛的含义来使用,并且包含天然氨基酸,即丝氨酸(ser)、天冬酰胺(asn)、缬氨酸(val)、亮氨酸(leu)、异亮氨酸(ile)、丙氨酸(ala)、酪氨酸(tyr)、甘氨酸(gly)、赖氨酸(lys)、精氨酸(arg)、组氨酸(his)、天冬氨酸(asp)、谷氨酸(glu)、谷氨酰胺(gln)、苏氨酸(thr)、半胱氨酸(cys)、甲硫氨酸(met)、苯丙氨酸(phe)、色氨酸(trp)和脯氨酸(pro),以及非天然氨基酸(例如氨基酸变体)。因此,本文中的氨基酸包括例如l-氨基酸;d-氨基酸;经化学修饰的氨基酸;将不是用于体内构造蛋白质之材料的氨基酸,例如正亮氨酸、β-丙氨酸和鸟氨酸;氨基酸侧链取代基被另一个取代基取代的变体等。本文中的“氨基酸衍生物”是指使氨基酸的羧基转化为硫代酸基团(-cosh)的氨基酸(本文中也称为“硫代酸氨基酸”),通常是具有α-氨基和以下结构的那些:h2n-ch(r)-cosh(1)化合物(1)中的r表示任何氨基酸的侧链,并且因此,r可以是天然氨基酸的侧链或者可以是已被非天然侧链取代的那些。对于将硫代酸基团引入到羧基中的方法,已知有多种方法。例如,这样的方法包括:在存在锑催化剂(例如ph3sbo)的情况下,通过对应于目标硫代羧酸的羧酸与硫化磷之间的反应来制备的方法(chem.ber,123,2081-2082(1990));使用硫化氢作为硫化剂的方法(j.org.chem.,25,180-182(1960));将羧酸转化为酰卤并随后与硫化氢的金属盐(钠盐或钾盐)反应的方法(org.synth.,4,924(1963);synthesis.,998-1004(2005));这样的方法:使用n,n-二甲基硫代甲酰胺(n,n一ジメチルホル厶チ才アミド)或硫代乙酰胺作为酰卤的硫化剂(phosphorus,sulfur,andsilicon.,178,1661-1665(2003)),通过氯代碳酸酯与相应的羧酸之间的反应转化成混合酸酐,并随后与硫化氢反应(chem.pharm.bull.,34,999-1014(1986));等。在本发明中,用这些已知方法将氨基酸转化成硫代酸氨基酸并将其用于本发明。或者,可例如通过将氨基酸中的羧基转化为硫酯基团并对硫原子的保护基进行去保护来制备氨基酸衍生物。在一方面,本发明涉及用于制备通过肽键连接的氨基酸的聚合物的方法。不受特定理论的限制,在本发明的制备方法中,认为肽键的形成通过在氨基酸衍生物之间形成二硫(s-s)键,随后进行分子内转移反应来进行(参见以下)。[化学式1]因此,在本发明的制备方法中,为了进行反应,可采用在硫代酸氨基酸之间形成二硫键的任何方法和条件。这样的方法和条件是本领域技术人员已知的,并且本领域技术人员可通过参考例如chemicalapproachestothesynthesisofpeptidesandprotein第5章formationofdisulfidebridge第209-236页,1997,crcpress来适当地选择合适的方法和条件。本发明的制备方法,特别是以上反应可通过氧化反应来进行。因此,在一方面,本发明的制备方法的特征在于其包括:(a)制备各自如下所示第一和第二氨基酸衍生物的步骤:h2n-ch(r)-cosh(1)(其中r表示任何氨基酸的侧链);以及(b)使所述第一氨基酸衍生物和第二氨基酸衍生物进行氧化反应以获得如下所示化合物的步骤:h2n-ch(r)-co-hn-ch(r)-co-sh(2)(其中每个r各自独立地表示任何氨基酸的侧链)其中所述第一氨基酸衍生物和第二氨基酸衍生物中的至少一个不具有保护基。本文中的“第一氨基酸衍生物和第二氨基酸衍生物中的至少一个不具有保护基”意指第一氨基酸衍生物和第二氨基酸衍生物中的至少一个在其侧链或官能团上不具有任何保护基。本文中的保护基意指通常用于在氨基酸聚合物合成中保护侧链和氨基的保护基,并且可包括但不限于例如作为羟基的保护基,例如甲基、叔丁基、苄基、苯甲酰基、乙酰基(ac)、三甲基甲硅烷基(tms)、三乙基甲硅烷基(tes)、叔丁基二甲基甲硅烷基(tbs或tbdms),等。氨基的保护基可包括例如亲脂性保护基,基于碳酸酯或基于酰胺的保护基例如9-芴基甲氧基羰基(fmoc)、叔丁氧基羰基(boc)、苄基、a烯丙氧基羰基(alloc)、2,2,2-三氯乙氧基羰基(troc)、烯丙氧基羰基、乙酰基,等。在本发明的制备方法中,如上所述,尽管第一氨基酸衍生物或第二氨基酸衍生物中的至少一个不具有保护基,但不排除其他氨基酸衍生物具有保护基。因此,当使用具有保护基的第一氨基酸衍生物和不具有保护基的第二氨基酸衍生物时,以及当使用不具有保护基的第一氨基酸衍生物和具有保护基的第二氨基酸衍生物时的这两种情况都在本发明的范围内。优选地,将不具有保护基的氨基酸衍生物用作第一氨基酸衍生物和第二氨基酸衍生物二者。在本发明的制备方法中,氧化反应可通过但不限于通过使用氧化剂进行氧化等来进行。可用于本发明的氧化剂没有特别限制,只要其是可通过硫代酸基团(-cosh)中的硫烷基(sh)的氧化偶合形成二硫键的氧化剂即可。此类氧化剂的实例可包括但不限于氯化铁(iii)、碘等。在本发明的一个实施方案中,氧化反应通过使用氧化剂(例如氯化铁(iii))来进行。在本发明中,氧化反应可仅用水或者用水与有机溶剂的混合溶剂来进行。可使用的有机溶剂是但不限于脂肪族烃溶剂(例如己烷或环己烷)、芳香族烃溶剂(例如苯或甲苯)、含卤素的溶剂(例如二氯甲烷或氯仿)、非质子极性溶剂(例如乙酸乙酯或乙腈)和质子极性溶剂(例如乙醇或甲醇)。在本发明中,氧化反应中的反应温度没有特别限制,并且反应可在例如室温下进行。用于氧化反应的ph条件也没有特别限制,并且可以是例如ph1至4。在本发明的制备方法中,根据待作为制备目标的氨基酸聚合物,第一和第二氨基酸衍生物的侧链可以是相同或不同的侧链。本发明的制备方法可进一步包括(c)使步骤(b)中获得的以上化合物(2)与如下所示第三氨基酸衍生物进行氧化反应:h2n-ch(r)-cosh(1)(其中r表示任何氨基酸的侧链)以获得如下所示化合物的步骤:h2n-ch(r)-co-(hn-ch(r)-co)2-sh(3)(其中每个r各自独立地表示任何氨基酸的侧链)。通过步骤(c),一个另外的氨基酸分子通过肽键与化合物(2)连接。第三氨基酸衍生物可具有或可不具有保护基。在本发明的该优选实施方案中,第三氨基酸衍生物不具有保护基。此外,根据待作为制备目标的氨基酸聚合物的类型,第三氨基酸衍生物的侧链可具有与第一氨基酸衍生物和第二氨基酸衍生物中的一个或二者相同的侧链,或者可与二者都不同。在本发明的制备方法中,步骤(c)可根据需要重复多次以获得具有期望长度的如下所示化合物:h2n-ch(r)-co-(hn-ch(r)-co)n-sh(4)(其中每个r各自独立地表示任何氨基酸的侧链,并且n表示2或更大的整数)。以这种方式,可高效地制备具有受控序列的期望长度的氨基酸聚合物。因此,在本发明的制备方法中,可能使用多于一个第三氨基酸衍生物。所使用的多于一个第三氨基酸衍生物各自独立地可具有或可不具有保护基。在一个优选实施方案中,所使用的一个或更多个第三氨基酸衍生物全部不具有保护基。此外,根据待作为制备目标的氨基酸聚合物的类型,所使用的多于一个第三氨基酸衍生物的侧链各自独立地可具有与第一和第二氨基酸衍生物中的一个或二者相同的侧链,或者可与二者都不同。在一个实施方案中,本发明的制备方法还可包括对所获得的氨基酸聚合物进行衍生化的步骤。具体地,本发明的制备方法还可包括:(d)使步骤(b)中获得的化合物(2)或者步骤(c)中获得的化合物(3)或化合物(4)与如下所示亲核性试剂反应:h-x(5)(其中x表示通过选自n、o、s和se的原子结合的取代基)以获得如下所示化合物的步骤:h2n-ch(r)-co-(hn-ch(r)-co)m-x(6)(其中每个r各自独立地表示任何氨基酸的侧链,m表示任何整数,并且x表示通过选自n、o、s和se的原子结合的取代基)。以这种方式,可将以sh体形式获得的氨基酸聚合物转化成期望的形式。步骤(d)可以以与本领域技术人员公知的氨基酸或肽衍生化方法相似的方式进行。例如,可将基于酰胺的溶剂、脂肪族烃溶剂(例如己烷或环己烷)、芳香族烃溶剂(例如苯或甲苯)、含卤素的溶剂(例如二氯甲烷或氯仿)、非质子极性溶剂(例如乙酸乙酯或乙腈)和质子极性溶剂(例如乙醇或甲醇或水)用于化合物(2)或(3)与亲核性试剂(5)之间的反应。该反应特别是在酸性至中性缓冲溶液中进行。缓冲溶液的实例包括磷酸盐缓冲液、tris缓冲溶液、hepes缓冲溶液、柠檬酸缓冲溶液等。这些缓冲溶液可单独使用,或者以两种或更多种的混合物使用。步骤(d)的反应温度没有特别限制,并且可在0℃至30℃的范围内进行,优选地在0℃至20℃的范围内进行,并且进一步优选地在0℃至10℃的范围内进行。此外,反应时间没有特别限制,并且可在1分钟至5小时的范围内进行,优选地在1分钟至2小时的范围内进行,并且进一步优选地在1分钟至30分钟的范围内进行。此外,步骤(d)的ph条件没有特别限制,并且可在1至8的范围内进行,优选地在2至7的范围内进行,并且进一步优选地在4至7的范围内进行。化合物(5)的具体实例可包括水、烷基醇(例如甲醇)、芳基醇(例如苄醇)、经保护或未经保护的肼、烷基硫醇(例如乙硫醇)、芳基硫醇(例如苄硫醇)、硒化合物等。在一个实施方案中,化合物(5)中的x是通过n原子或s原子结合的取代基,并因此氨基酸聚合物分别作为酰肼体或以硫酯形式获得。在另一方面,本发明涉及用于制备通过肽键连接的多于一个氨基酸的聚合物的方法,其中所述方法包括(a)制备多于一个如下所示氨基酸衍生物的步骤:h2n-ch(r)-cosh(1)(其中r表示任何氨基酸的侧链);以及(b)对所述多于一个氨基酸衍生物进行氧化反应以获得多于一个如下所示化合物:h2n-ch(r)-co-(hn-ch(r)-co)x-sh(7)(其中每个r各自独立地表示任何氨基酸的侧链,x表示任何整数)和/或如下所示化合物的步骤:h2n-ch(r)-co-(hn-ch(r)-co)y-s-s-(co-ch(r)-nh)z-co-ch(r)-nh2(8)(其中每个r各自独立地表示任何氨基酸的侧链,并且y和z表示任何整数)。在这方面,本发明的制备方法的特征可在于,其使多于一个氨基酸衍生物同时进行氧化反应。此外,在该方面,本发明的制备方法的特征在于,所述多于一个氨基酸衍生物的至少一部分或全部不具有保护基。在本发明的制备方法中,“所述多于一个氨基酸衍生物的一部分不具有保护基”意指步骤(a)中制备的多于一个氨基酸衍生物包含不具有保护基的氨基酸衍生物,并且不具有保护基的氨基酸衍生物的比例不一定是问题,但优选的是,优选至少50%,更优选至少60%,更优选至少70%,更优选至少80%,更优选至少90%,更优选至少91%,更优选至少92%,更优选至少93%,更优选至少94%,更优选至少95%,更优选至少96%,更优选至少97%,更优选至少98%,并且更优选至少99%的所述多于一个氨基酸衍生物是不具有保护基的氨基酸衍生物。在本发明中,优选地,步骤(a)中制备的多于一个氨基酸衍生物全部不具有保护基。步骤(b)是对步骤(a)中制备的多于一个氨基酸衍生物同时进行氧化反应的步骤。不受特定理论的限制,认为当同时对多于一个氨基酸衍生物进行氧化反应时,氨基酸衍生物的单体或聚合物与氨基酸衍生物的单体产生二硫键的形成和分子内转移的先后过程,即形成肽键的第一反应和在氨基酸衍生物聚合物之间形成二硫键的第二反应。[化学式2]此外,不受特定理论的限制,认为当通过第二反应产生(氨基酸聚合物)-s-s-(氨基酸聚合物)(化合物(8))时,在该分子中不发生分子内转移,但当反应体系中存在氨基酸衍生物单体时,通过二硫键而存在的氨基酸聚合物中的一个与所述氨基酸衍生物单体发生交换反应以形成(氨基酸聚合物)-s-s-(氨基酸单体)(参见以下),并且由于该分子产生分子内转移反应而发生氨基酸的延伸。[化学式3]顺便提及,认为当不发生与氨基酸衍生物单体的此类交换反应时,氨基酸聚合物彼此形成二硫键,在此之后不再发生氨基酸的进一步延伸,并因此不能制备长链氨基酸聚合物。从本文中可制备长度最多为19个氨基酸的聚合物的实施例也可推测和确认,与氨基酸衍生物单体发生交换反应的可能性高。在另一方面,认为当产生(氨基酸聚合物)-s-s-(氨基酸聚合物)时不存在可用的氨基酸衍生物单体时,不会发生与氨基酸衍生物单体的交换反应,并因此不会发生进一步的延伸。尽管本发明的制备方法可任选地进一步包括将氨基酸衍生物单体添加至反应体系以进行进一步反应的步骤,但在任何情况下,本领域技术人员应认识到,在进行步骤(b)时,除化合物(7)之外还可能产生化合物(8)。此外,在本发明的制备方法中,根据待作为制备主体的氨基酸聚合物,所述“多于一个氨基酸衍生物”的侧链可全部相同或可不同。例如,通过具有所述“多于一个氨基酸衍生物”的所有相同侧链,本发明的制备方法可成为适合于获得更大量的特定聚氨基酸的目的的制备方法。这样的聚氨基酸可包括例如但不限于聚丙氨酸。聚丙氨酸可通过制备由具有甲基作为侧链的氨基酸衍生物组成的均一集合作为所述“多于一个氨基酸衍生物”,并随后对其进行氧化反应来制备。此外,通过制备和使用所述“多于一个氨基酸衍生物”使得它们包含20种天然氨基酸的侧链,本发明的制备方法可成为适合于获得多肽库之目标的制备方法。在一个实施方案中,本发明的制备方法还可包括:(c1)使步骤(b)中获得的化合物(7)与如下所示亲核性试剂反应:h-x(5)(其中x表示通过选自n、o、s和se的原子结合的取代基),以获得如下所示化合物的步骤:h2n-ch(r)-co-(hn-ch(r)-co)x-x(9)(其中每个r各自独立地表示任何氨基酸的侧链,x表示任何整数,并且x表示通过选自n、o、s和se的原子结合的取代基)。以这种方式,可将以sh体形式获得的氨基酸聚合物转化为期望的形式。步骤(c1)可以以与本领域技术人员公知的氨基酸或肽衍生化方法相似的方式进行。可将基于酰胺的溶剂、脂肪族烃溶剂(例如己烷或环己烷)、芳香族烃溶剂(例如苯或甲苯)、含卤素的溶剂(例如二氯甲烷或氯仿)、非质子极性溶剂(例如乙酸乙酯或乙腈)和质子极性溶剂(例如乙醇或甲醇或水)用于化合物(7)与亲核性试剂(5)之间的反应。该反应特别是在酸性至中性缓冲溶液中进行。缓冲溶液的实例包括磷酸盐缓冲液、tris缓冲溶液、hepes缓冲溶液、柠檬酸缓冲溶液等。这些缓冲溶液可单独使用,或者以两种或更多种的混合物使用。步骤(c1)的反应温度没有特别限制,并且可在0℃至30℃的范围内进行,优选地在0℃至20℃的范围内进行,并且进一步优选地在0℃至10℃的范围内进行。此外,反应时间没有特别限制,并且可在1分钟至5小时的范围内进行,优选地在1分钟至2小时的范围内进行,并且进一步优选地在1分钟至30分钟的范围内进行。此外,步骤(c1)的ph条件没有特别限制,并且可在1至8的范围内进行,优选地在2至7的范围内进行,并且进一步优选地在4至7的范围内进行。化合物(5)的具体实例可包括水、烷基醇(例如甲醇)、芳基醇(例如苄醇)、经保护或未经保护的肼、烷基硫醇(例如乙硫醇)、芳基硫醇(例如苄硫醇)和硒化合物。在一个实施方案中,化合物(5)中的x是通过n原子或s原子结合的取代基,并因此氨基酸聚合物分别以酰肼体或硫酯的形式获得。在另一个实施方案中,本发明的制备方法还可包括:(c2)使步骤(b)中获得的化合物(8)与如下所示亲核性试剂反应:h-x(5)(其中x表示通过选自n、o、s和se的原子结合的取代基),以获得如下所示化合物:h2n-ch(r)-co-(hn-ch(r)-co)y-x(10)(其中每个r各自独立地表示任何氨基酸的侧链,y表示任何整数,并且x表示通过选自n、o、s和se的原子结合的取代基)和如下所示化合物的步骤:h2n-ch(r)-co-(hn-ch(r)-co)z-x(11)(其中每个r各自独立地表示任何氨基酸的侧链,z表示任何整数,并且x表示通过选自n、o、s和se的原子结合的取代基)。步骤(c2)是通过使用作为亲核性试剂的化合物(4)裂解二硫键,从一个化合物(8)分子获得衍生形式的化合物(10)和(11)的步骤。通过亲核性试剂裂解二硫键是本领域技术人员已知的,例如通过水的水解、通过醇的酯化、通过氨基化合物的酰胺化、肼化、通过硫醇的硫酯化和通过硒化合物的硒酯化。可将基于酰胺的溶剂、脂肪族烃溶剂(例如己烷或环己烷)、芳香族烃溶剂(例如苯或甲苯)、含卤素的溶剂(例如二氯甲烷或氯仿)、非质子极性溶剂(例如乙酸乙酯或乙腈)和质子极性溶剂(例如乙醇或甲醇或水)用于化合物(8)与亲核性试剂(5)之间的反应。该反应特别是在酸性至中性缓冲溶液中进行。缓冲溶液的实例包括磷酸盐缓冲液、tris缓冲溶液、hepes缓冲溶液、柠檬酸缓冲溶液等。这些缓冲溶液可单独使用,或者以两种或更多种的混合物使用。步骤(c2)的反应温度没有特别限制,并且可在0℃至30℃的范围内进行,优选地在0℃至20℃的范围内进行,并且进一步优选地在0℃至10℃的范围内进行。此外,反应时间没有特别限制,并且可在1分钟至5小时的范围内进行,优选地在1分钟至2小时的范围内进行,并且进一步优选地在1分钟至30分钟的范围内进行。此外,步骤(c2)的ph条件没有特别限制,并且可在1至8的范围内进行,优选地在2至7的范围内进行,并且进一步优选地在4至7的范围内进行。化合物(5)的具体实例可包括水、烷基醇(例如甲醇)、芳基醇(例如苄醇)、经保护或未经保护的肼、烷基硫醇(例如乙硫醇)、芳基硫醇(例如苄硫醇)和硒化合物。根据本发明的制备方法,可高效地制备例如包含4至20、5至20、6至20、7至20、8至20、9至20、或10至20个氨基酸的聚合物或聚合物集合。此外,由于本发明的制备方法,即使在未经保护的情况下使用具有高度反应性侧链的氨基酸衍生物(例如赖氨酸,其具有4-氨基丁基作为侧链并且据说在常规氨基酸缩合反应中需要保护)时,也允许制备通过肽键连接的氨基酸聚合物,因此它具有不受氨基酸类型限制并具有极高通用性的优点。注意,本文中使用的术语用于描述一些特定实施方案,并不旨在限制本发明。此外,除非内容清楚地指出另外的理解,否则本文中使用的术语“包含/包括”旨在存在所述项目(例如组件、步骤、要素和数字),并且不排除存在其他项目(例如组件、步骤、要素和数字)。除非另外限定,否则本文中使用的所有术语(包括技术和科学术语)具有与本发明所属
技术领域:
的技术人员广泛认可的含义相同的含义。除非另外明确限定,否则本文中使用的术语应解释为具有与本文中和相关
技术领域:
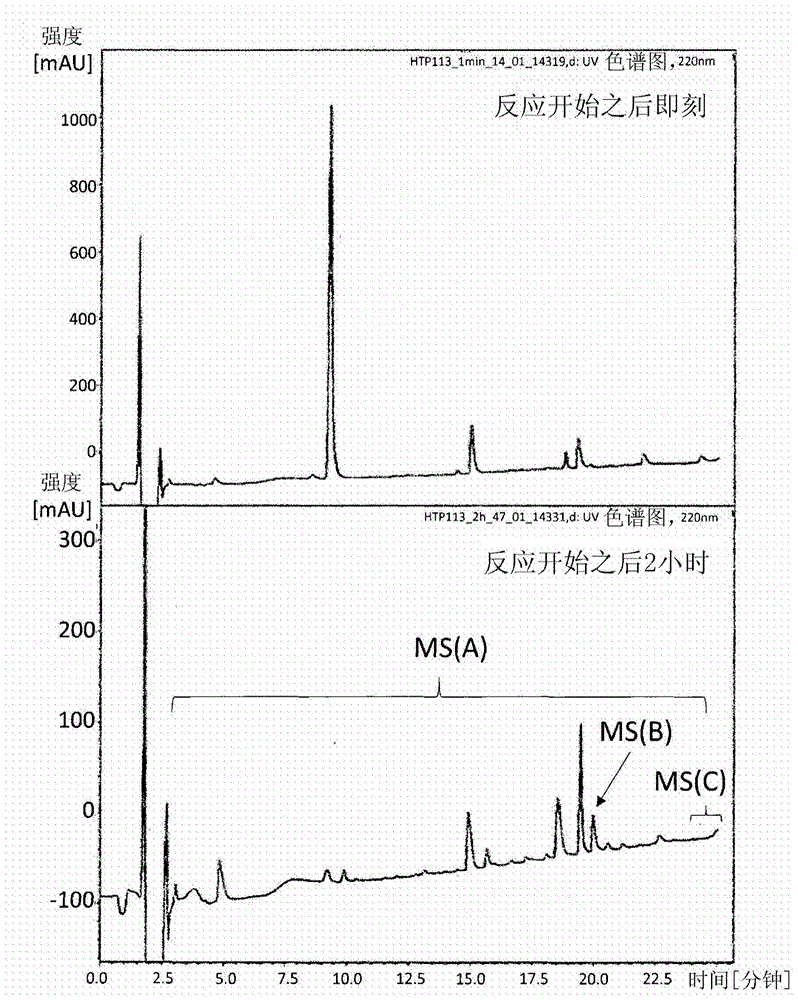
的含义一致的含义,并且不应被解释为具有理想化或过度正式的含义。术语例如第一和第二有时用于表达多种要素,并且应该认识到这些要素不受这些术语的限制。这些术语仅用于将一个要素与另一个要素区分的目的,且例如,在不脱离本发明的范围的情况下可将第一要素描述为第二要素,且类似地,可将第二要素描述为第一要素。现在通过实施例对本发明进行更具体地描述。然而,本发明可通过多种实施方案实现,且不应被解释为限于本文中描述的实施例。实施例原料在以下实施例中,使用以下物质:n,n-二异丙基乙胺(dipea)、三氟乙酸(tfa)、三异丙基硅烷(tips)、n,n-二甲基-4-氨基吡啶(dmap)、二氯甲烷(dcm)、甲酸(fa)、乙腈(mecn)、(苯并三唑-1-基氧基)三吡咯烷基六氟磷酸盐(pybop)和三苯基甲硫醇。1.硫代酸氨基酸的合成boc-phe-strt(1)在茄形烧瓶中置入boc-phe-oh(165.4mg,0.62mmol)、pybop(1622.1mg,3.12mmol)和trt-sh(861.6mg,3.12mmol),并将其在减压下干燥。干燥之后,添加dcm(3.1ml),并将其冷却至-20℃。在-20℃下,添加dipea(543.0μl),并将其在氩气氛下搅拌2小时。然后添加乙酸(543.0ul)用于中和,并随后将反应溶液浓缩。将浓缩的残余物在硅胶柱上纯化(洗脱溶剂:乙酸乙酯∶己烷=1∶10)以获得boc-phe-strt_1(268.4mg,0.51mmol,82.2%)。1hnmr(400mhz,cdcl3)δ4.82(d,1h),4.62(q,1h),2.99(q,1h),2.91(m,1h),1.43(s,9h)13cnmr(100mhz,cdcl3)δ197.7c33h33no3s[m+na]+的hrms(esi),计算值:546.2073,实测值:546.2076h-phe-sh(2)向boc-phe-strt_1(268.4mg,0.51mmol)添加5%tips/tfa(5.1ml),并将其在室温下搅拌。10分钟之后,将反应溶液浓缩,并向浓缩的残余物添加乙醚(40ml)以使目标物质沉淀。通过离心过程收集沉淀的目标物质。向所收集的沉淀物添加乙醚,并再次进行离心过程以洗涤沉淀物。将该洗涤重复两次。将沉淀物在常温常压下干燥,并随后溶于0.1%tfa/h2o:mecn=1∶1中并冻干以获得boc-phe-sh2(91.2mg,0.50mmol,98%)。1hnmr(400mhz,dmso)s7.73(s,2.5h),7.26(m,5h),3.68(q,1h),3.35(q,1h),2.92(q,1h)13cnmr(100mhz,dmso):δ208.4,137.4,129.9,128.8,127.0,63.9,38.6c9h10nos[m-h]-的hrms(esi),计算值:180.0489,实测值:180.0489boc-glv-strt(3)在茄形烧瓶中置入boc-gly-oh(208.2mg,1.19mmol)、wscihcl(273.4mg,1.43mmol)、trt-sh(361.3mg,1.31mmol)和dmap(14.5mg,0.12mmol),并将其在减压下干燥。干燥之后,添加thf(5.9ml),并将其在室温下在氩气氛下搅拌16小时。然后添加乙酸乙酯(20ml),将反应溶液稀释,将有机相用水、饱和氯化铵水溶液、饱和碳酸氢钠水溶液和饱和盐水各洗涤两次,并且最后将有机相经硫酸镁干燥。通过过滤去除硫酸镁,并随后将有机相浓缩。将残余物在硅胶柱上纯化(洗脱溶剂:乙酸乙酯∶己烷=1∶10)以获得boc-gly-strt3(304.6mg,0.70mmol,59.1%)。13cnmr(100mhz,cdcl3)δ194.8c26h27no3s[m+na]+的hrms(esi),计算值:456.1604,实测值:456.1601h-gly-sh(4)用类似于h-phe-sh2的合成的操作,从原料boc-gly-strt3(304.6mg,0.70mmol)获得h-gly-sh4(63.1mg,0.69mmol,定量(quant))。c2h4nos[m-h]-的hrms(esi),计算值:90.0019,实测值:90.0019boc-ala-strt(5)用类似于boc-phe-strt1的合成的操作,从原料boc-ala-oh(633.4mg,3.35mmol)获得boc-ala-strt5(1243.1mg,2.78mmol,83.0%)。13cnmr(100mhz,cdcl3)δ198.6c27h29no3s[m+na]+的hrms(esi),计算值:470.1760,实测值:470.1766h-ala-sh(6)用类似于h-phe-sh2的合成的操作,从原料boc-ala-strt5(1243.1mg,2.78mmol)获得h-ala-sh6(277.7mg,2.64mmol,95%)。1hnmr(400mhz,dmso)δ7.69(s,3h),3.49(q,1h),1.32(d,3h)13cnmr(100mhz,dmso)δ210.0,58.4,19.0c2h6nos[m-h]-的hrms(esi),计算值:104.0176,实测值:104.0176boc-ser(tbu)-strt(7)用类似于boc-phe-strt1的合成的操作,从原料boc-ser(tbu)-oh·dcha(717.6mg,1.62mmol)获得boc-ser(tbu)-strt7(685.2mg,1.48mmol,91.1%)。1hnmr(400mhz,cdcl3)δ5.44(d,1h),4.33(d,1h),3.76(dd,1h),3.43(dd,1h),1.45(s,9h)13cnmr(100mhz,cdcl3)δ197.9h-ser-sh(8)用类似于h-phe-sh2的合成的操作,从原料boc-ser(tbu)-strt7(685.2mg,1.48mmol)获得h-ser-sh8(173.3mg,1.43mmol,97%)。1hnmr(400mhz,dmso)δ7.69(s,3h),5.11(s,1h),3.96(q,1h),3.52(m,2h)13cnmr(100mhz,dmso)δ206.5,65.0,62.5c3h6no2s[m-h]-的hrms(esi),计算值:120.0125,实测值:120.01252.硫代酸氨基酸的同源寡聚化反应(ホモ才リゴマ一化反応)h-phe-sh的聚合向溶解于水(221μl)中的h-phe-sh2(0.40mg,2.2μmol)添加溶解于水(5μl)中的氯化铁(iii)fecl3(2.98mg,11.0μmol),并将其在室温下静置(ph=1.26)。在反应开始之后0小时和2小时时,用pipetman测量出2μl的每种溶液,用ph7下的磷酸盐缓冲液(20μl)终止反应,并通过lc-ms进行分析。图1示出了2小时之后的结果(波长220nm)(lc-ms分析方法:c185μm,4.6×100mm,0.1%fa:0.1%fa在90%mecn中=95∶5至45:55,20分钟,流量为0.2ml/分钟)。图2是图1中ms(a)、ms(b)和ms(c)各范围的质谱结果。ms(a)、ms(b)和ms(c)的m/z和组成各自如下所示:(a)m/z=460.4:h-fff-oh、(b)m/z=476.4:h-fff-sh、(c)m/z=1211.8:h-ffffffff-sh。3.硫代酸氨基酸的异寡聚化反应(气テ口才リゴマ一化反応)h-phe-sh与h-ala-sh的寡聚向溶解于水(520μl)中的h-phe-sh2(0.7mg,3.9μmol)与h-ala-sh6(1.0mg,9.5μmol)的混合物添加溶解于水(5μl)中的氯化铁(iii)fecl3(5.2mg,19.2μmol),并将其在室温下静置(ph=1.40)。在反应开始之后5分钟,用pipetman(ピペツトマン)量出2μl的溶液,用ph7的磷酸盐缓液(20μl)终止反应,并用uhplc进行分析。图3示出了1分钟之后的结果(波长218nm)(uhplc分析方法:c18,5μm,4.6×50mm,0.1%fa:0.09%fa在90%mecn中=95∶5至5∶95,5分钟,流量为0.2ml/分钟)。图4和图5示出了通过f=phe和a=ala的单字母表达式观察到的主要产物的组成。图4和图5中的(a)至(j)各自对应于对用图3中的ms(a)至ms(j)所示的级分进行测量的质谱结果。图5(j)是图4(i)的局部放大。ms(a)至ms(j)的m/z和组成各自如下所示:(a)m/z=322.20:h-f1a2-oh、(b)m/z=535.35:h-f1a5-sh、(c)m/z=327.19:h-f2-sh、m/z=677.25:h-f1a7-sh、(d)m/z=398.37:h-f2a1-sh、m/z=611.24:h-f2a4-sh、(e)m/z=687.38:h-f3a3-sh、(f)m/z=763.57:h-f4a2-sh、(g)m/z=839.54:h-f5a1-sh、(h)m/z=986.51:h-f6a1-sh、(i)m/z=1133.53:h-f7a1-sh、m/z=1280.57:h-f8a1-sh、(j)m/z=2067.82:h-f9a10-sh。在反应开始之后5分钟时通过质谱观察到的最大肽由19个氨基酸残基构成,并且其组成是包含9个苯丙氨酸残基和10个丙氨酸残基的硫代酸肽(图5j)。4.phe-sh与lys-sh的寡聚boc-lys(boc)-strt(13)用与以上boc-phe-strt1的合成基本相同的方法,从boc-lys(boc)-oh(1.05g,1.98mmol)获得作为无定形产物的boc-lys(boc)-strt13(1.10g,1.82mmol,92%)。[α]d20-26.78(c=0.95,chcl3).1hnmr(400mhz,cdcl3)δ:7.26(m),4.99(d,1h),4.49(1h),4.28(q,1h),3.05(q,2h),1.67(m,1h),1.45(s,9h),1.44(s,9h),1.40(m,1h),1.18(m,2h).13cnmr(100mhz,cdcl3)δ:198.2,156.1,155.3,143.6,129.9,127.7,127.1,80.1,79.2,70.3,60.3,40.0,32.2,29.6,28.5,28.3,22.2.c35h44n2nao5s[m+na]+的hrms(esi),计算值:627.2863,实测值:627.2861h-lys-sh(14)用与h-phe-sh2的合成基本相同的方法,从boc-lys(boc)-strt13(840mg,1.33mmol)获得作为白色粉末的h-lys-sh14(165mg,1.02mmol,73%)。[α]d204.73(c=0.74,h2o:mecn=1∶1).1hnmr(400mhz,d2o)δ:3.86(t,1h),2.87(t,2h),1.85(m,2h),1.57(m,2h),1.33(m,2h).13cnmr(100mhz,d2o)δ:214.4,62.4,39.0,31.4,26.3,21.1.c6h13n2os[m-h]-的hrms(esi),计算值:161.0754,实测值:180.0755phe-sh与lys-sh的寡聚将h-phe-sh2(0.1mg,0.55μmol)和h-lys-sh14(0.45mg,2.76μmol)溶解在脱气水(47.5μl)中。向该溶液添加包含5倍过量的fecl3·6h2o(2.76μmol)的fecl3·6h2o溶液(0.1mg/μl,7.5μl)。在每个反应时间点,用磷酸盐缓冲液(ph7)终止反应混合物的一部分的反应,进行lcms分析,并监测反应的进展(表1,图6至9)。在终止反应之后5分钟进行所有lc-ms分析。[表1]表.在phe-sh与lys-sh的寡聚反应中观察到的寡肽的hrmsfk肽离子电荷算得的m5观察到的m5误差(ppm)1f+1k[m+h]+310.1584310.1581-1.01f+2k[m+2h]2+219.6303219.6302-0.51f+3k[m+2h]2+283.6778283.6774-1.51f+4k[m+2h]2+347.7253347.7241-3.52f+1k[m+h]+457.2268457.2259-1.92f+2k[m+2h]2+293.1645293.1644-0.22f+3k[m+2h]2+357.2120357.21220.62f+4k[m+2h]2+421.2595421.25950.12f+5k[m+3h]3+323.8737323.8737-0.12f+6k[m+3h]3+366.5721366.5719-0.43f+1k[m+h]+604.2952604.29580.93f+2k[m+2h]2+366.6987366.6979-2.33f+3k[m+2h]2+430.7462430.746203f+4k[m+3h]3+330.1982330.19830.23f+5k[m+3h]3+372.8965372.896503f+6k[m+4h]4+415.5949415.59531.13f+7k[m+4h]2+343.9717343.97180.43f+8k[m+4h]4+375.9954375.9950-1.14f+1k[m+h]+374.1854374.1852-0.74f+2k[m+2h]2+440.2329440.23300.14f+3k[m+3h]3+336.5227336.5226-0.24f+4k[m+3h]3+373.2210373.2209-0.44f+5k[m+3h]3+421.9193421.91940.14f+6k[m+4h]4+348.7151348.7123-7.94f+7k[m+4h]4+380.7388380.73900.64f+8k[m+4h]4+412.7625412.7610-3.75f+1k[m+2h]2+449.7197449.71980.35f+2k[m+2h]2+513.7671513.7668-0.65f+3k[m+3h]3+385.5455385.54580.85f+4k[m+3h]3+428.2438428.24400.35f+4k[m+4h]4+353.4584353.4582-0.65f+5k[m+4h]4+385.4822385.48230.55f+5k[m+4h]4+471.5059471.50661.55f+7k[m+5h]5+359.8252359.8248-1.06f+1k[m+2h]2+523.2539523.25390当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1