抗寡糖抗体的制作方法
本申请要求2017年3月29日提交的新加坡申请号10201702572p的优先权,其内容为了所有目的通过引用整体并入本文。
发明领域
本发明属于抗体、具体是特异于lewisx型寡糖的抗体的领域。
背景技术:
血液恶性肿瘤包括来自造血和淋巴组织的广谱癌症。在这种分组中,各种形式的白血病、淋巴瘤和骨髓瘤已被分为60多种不同的疾病类型,每种疾病都具有特定的临床特征和疾病结果。在这些疾病中,已经开发了针对一些疾病例如慢性粒细胞白血病的具有高长期存活率的治愈性治疗,但这种有效的方案仍然不适用于许多其他疾病,例如,多发性骨髓瘤(mm)和急性髓性白血病(aml)。
因此,需要更有效的针对白血病、淋巴瘤和骨髓瘤的治疗方案。
技术实现要素:
根据一个方面,提供了抗原结合蛋白或其抗原结合片段,其包含(i)重链可变结构域,所述重链可变结构域包含具有氨基酸序列gytftsywih(seqidno:1)的vhcdr1;具有氨基酸序列einpsngrtnfnekfkn(seqidno:2)的vhcdr2和具有氨基酸序列vdydeay(seqidno:3)的vhcdr3;和(ii)轻链可变结构域,所述轻链可变结构域包含具有氨基酸序列rssksllhsngityly(seqidno:4)的vlcdr1、具有氨基酸序列qmsnlas(seqidno:5)的vlcdr2和具有氨基酸序列aqnlelwt(seqidno:6)的vlcdr3。
根据另一方面,提供了组合物,其包含生理学上可接受的载体和治疗有效量的如本文所述的抗原结合蛋白或其抗原结合片段。
根据另一方面,提供了如本文所述的抗原结合蛋白或其抗原结合片段或如本文所述的组合物在制备用于治疗或预防癌症的药物中的用途。
根据另一方面,提供了用于检测个体中的癌症的方法,该方法包括:使得自个体的样品与本文所述的抗原结合蛋白或其抗原结合片段在体外接触;检测所述样品中所述抗原结合蛋白或其抗原结合片段的结合;将所述结合与对照样品中的结合水平相关联以确定所述样品中的结合水平,其中所述样品中的所述结合水平相对于所述对照样品的增加指示癌症
根据另一方面,提供了用于鉴定易患癌症的个体的方法,该方法包括:使得自个体的样品与本文所述的抗原结合蛋白或其抗原结合片段在体外接触;检测所述样品中抗原结合蛋白或其抗原结合片段的结合;将所述结合与对照样品中的结合水平相关联以确定所述样品中的结合水平,其中所述样品中的所述结合水平相对于对照样品的增加指示所述个体易患癌症。
根据另一方面,提供了当用于本文所述方法时的试剂盒,其包含如本文所述的抗原结合蛋白或其抗原结合片段,以及使用说明书。
定义
本文所用的术语“抗原结合蛋白”是指抗体、抗体片段和其他蛋白质构建体,例如结构域等,其能够结合slamf7。
术语“抗体”在本文中以最广泛的含义使用,是指具有免疫球蛋白样结构域的分子,并包括单克隆抗体、重组抗体、多克隆抗体、嵌合抗体、人源化抗体、双特异性抗体和异源偶联抗体;单可变结构域、结构域抗体、抗原结合片段、免疫有效片段、单链fv、双抗体、tandabstm等(关于其他“抗体”形式的概述,参见holliger和hudson,naturebiotechnology,2005,vol23,no.9,第1126-1136页)。
短语“单可变结构域”是指独立于不同的可变区或结构域特异性结合抗原或表位的抗原结合蛋白可变结构域(例如,vh、vhh、vl)。
可以认为“结构域抗体”或“dab”与能够结合抗原的“单可变结构域”相同。单可变结构域可以是人抗体可变结构域,但也包括来自其他物种的单抗体可变结构域,例如啮齿动物(例如,如wo00/29004中所公开的)、护士鲨和骆驼科动物(camelid)vhhdab的单抗体可变结构域。骆驼科动物vhh是免疫球蛋白单可变结构域多肽,其衍生自包括骆驼(camel)、美洲驼(llama)、阿尔帕卡羊驼(alpaca)、单峰骆驼(dromedary)和原驼(guanaco)的物种,其产生天然缺乏轻链的重链抗体。这些vhh结构域可以根据本领域可获得的标准技术进行人源化,并且这些结构域被认为是“结构域抗体”。如本文所用,vh包括骆驼科动物vhh结构域。
如本文所用,术语“结构域”是指折叠的蛋白质结构,其具有独立于蛋白质其余部分的三级结构。通常,结构域负责蛋白质的离散功能特性,并且在许多情况下可以被添加、去除或转移至其他蛋白质而不丧失蛋白质和/或结构域的其余部分的功能。“单可变结构域”是折叠的多肽结构域,其包含抗体可变结构域的特征序列。因此,它包括完整的抗体可变结构域和修饰的可变结构域,例如,其中一个或多个环已被不是抗体可变结构域的特征序列所替换,或已被截短或包含n-或c-末端延伸的抗体可变结构域替换,以及被至少保留全长结构域的结合活性和特异性的可变结构域的折叠片段替换。结构域可独立于不同的可变区或结构域而结合抗原或表位。
可以通过在非抗体蛋白质支架例如结构域上排列一个或多个cdr来提供抗原结合片段。结构域可以是结构域抗体,或者可以是作为骨架蛋白的衍生物的结构域,所述骨架蛋白选自ctla-4、脂质运载蛋白、spa、亲和体、avimer、groe1、转铁蛋白、groes和纤连蛋白/adnectin,其已经蛋白质工程化以获得与天然配体以外的抗原的结合。
可以使用本领域技术人员已知的或如本文所述的一种或多种测定来确定或测量中和。例如,可以通过biacoretm、fmat、fortebio或类似的体外测定法在夹心elisa中评估与slamf7结合的抗原结合蛋白。
抗原结合片段或免疫有效片段可包含部分重链或轻链可变序列。所述片段长度至少为5、6、8或10个氨基酸。或者,所述片段的长度为至少15、至少20、至少50、至少75或至少100个氨基酸。
关于抗原结合蛋白本说明书中使用的术语“特异性结合”是指所述抗原结合蛋白结合lewisx型寡糖,与其他(例如,无关的)寡糖没有结合或没有明显结合。本文描述的抗体不与唾液酸化的lewisx结合。
术语“lewisx型寡糖”旨在涵盖lewisx寡糖的子集,包括不同形式的lewisx寡糖表位的生物活性构象。术语“生物活性构象”旨在包括相对于糖苷键周围的二面角φ和ψ而言糖环的相对取向及其侧链取向,以限定寡糖的特定构象。如本文所述的抗原结合蛋白的一个优点是它可以结合不同于市售(例如,抗ssea1抗体)抗lewisx抗体的lewisx寡糖表位的生物活性构象。
“cdr”定义为抗原结合蛋白的互补决定区氨基酸序列。这些是免疫球蛋白重链和轻链的高变区。在免疫球蛋白的可变部分中存在三个重链cdr和三个轻链cdr(或cdr区)。因此,如本文所用的“cdr”是指所有三个重链cdr,所有三个轻链cdr,所有重链cdr和轻链cdr,或至少两个cdr。
在整个说明书中,可变结构域序列和全长抗体序列中的氨基酸残基根据kabat编号惯例编号。类似地,实施例中使用的术语“cdr”、“cdrl1”、“cdrl2”、“cdrl3”、“cdrh1”、“cdrh2”、“cdrh3”遵循kabat编号惯例。有关进一步的信息,参见kabat等,sequencesofproteinsofimmunologicalinterest,4thed..u.s.departmentofhealthandhumanservices,nationalinstitutesofhealth(1987)。
对于本领域技术人员显而易见的是,对可变结构域序列和全长抗体序列中的氨基酸残基存在其他编号惯例。cdr序列也有其他编号惯例,例如chothia等人(1989)nature342:877-883所述的那些。抗体的结构和蛋白质折叠可以意味着其他残基被认为是cdr序列的一部分,并且被本领域技术人员理解。
本领域技术人员可获得的cdr序列的其他编号惯例包括“abm”(巴斯大学)和“接触”(伦敦大学学院)方法。可以确定使用kabat、chothia、abm和接触方法中的至少两种的最小重叠区域以提供“最小结合单位”。最小结合单元可以是cdr的子部分。
附图的简要说明
当结合非限制性实例和附图考虑时,参考详细描述将更好地理解本发明,其中:
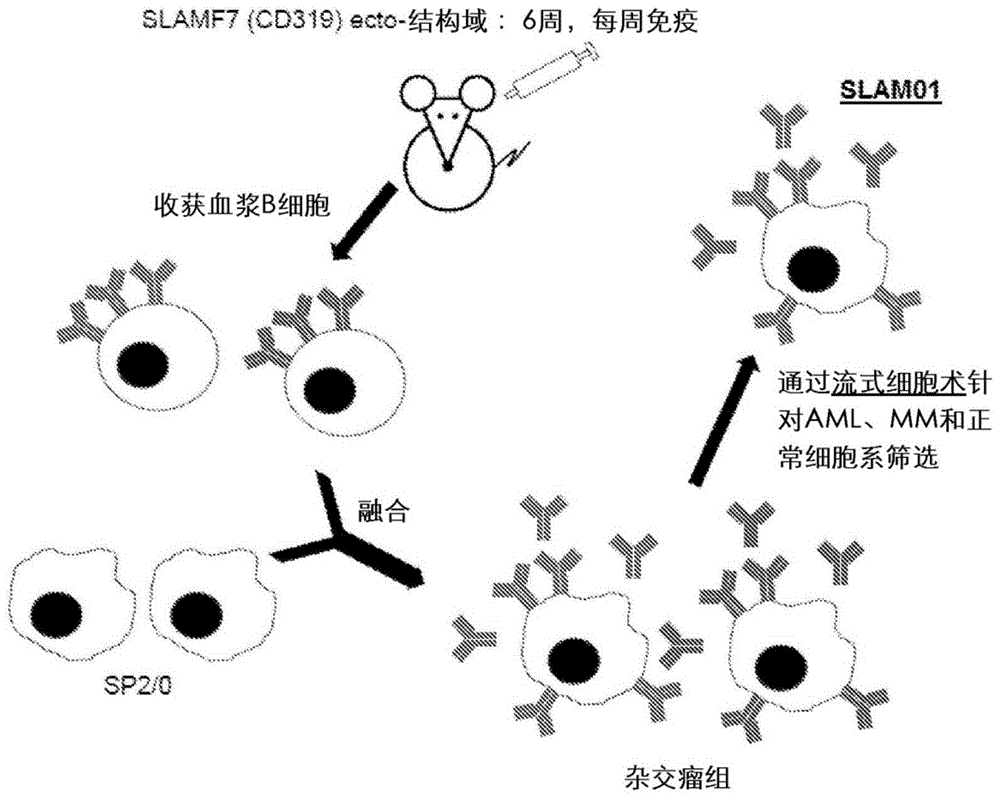
图1显示了小鼠免疫,杂交瘤融合和筛选的示意性工作流程。
图2显示slam01(1e10)和商业抗cd319在mm细胞系上的结合:kms28/bm和kms11。尽管在两种细胞系上都表达了cd319(slamf7),slam01仅与kms28/bm结合,但不与kms11结合。
图3显示了cd319的胞外域上slam01和抗cd319的免疫印迹。slam01仅在非还原条件(n)下识别出高分子量形式(>140kda)的cd319胞外域,但在还原条件(r)下不识别。slam01无法识别在40到50kda之间的预测大小(由抗cd319探测)的slamf7。
图4显示了kms28/bm裂解物上slam01和抗-cd319的免疫印迹。slam01识别出kms28/bm裂解物上高分子量形式和40kda形式的cd319,而不识别全长cd319成片条带在40至65kda之间的预期大小。
图5显示了抗cd319对slam01-免疫沉淀(ip)产物的免疫印迹。用slam01免疫沉淀kms28/bm裂解物,洗脱物用抗-cd319进行免疫印迹。在泳道1(ip洗脱物)和泳道5(kms28/bm裂解物)上观察到高分子量条带。
图6总结了slam01和抗cd319在各种血液细胞系上的结合谱。针对7个mm系、1个burkitt淋巴瘤系和14个aml系筛选slam01和抗cd319。slam01优先与aml系结合,但不与mm或b细胞系结合。
图7总结了slam01在实体瘤细胞系上的结合特征。slam01对非小细胞肺癌细胞系pc9、卵巢癌细胞系ovcar3和skov3呈阳性。
图8总结了slam01在正常细胞系上的结合谱。slam01不与所测试的各种正常细胞系结合。
图9总结了slam01在内部福尔马林固定的石蜡包埋(ffpe)细胞系阵列中的免疫组织化学结合谱。slam01对正常细胞系呈阴性。除了对aml系(f3)阳性(2+和3+)外,slam01对于一些非小细胞肺癌(nsclc)、卵巢癌、乳腺癌、胃癌和结肠直肠癌系也是阳性的。
图10显示了slam01在mono-mac-1(aml)和pc9(nsclc)上的免疫组织化学染色,两个核心(cores)都来自内部(house)ffpe细胞系阵列。slam01与mono-mac-1(3+)和pc9(3+)强结合。
图11显示了slam01的同种型。确定slam01是具有κ轻链的igm。
图12显示了链霉蛋白酶处理的aml3裂解物上slam01的免疫印迹。用链霉蛋白酶处理aml3裂解物以消化其中的蛋白质。在没有链霉蛋白酶的情况下建立对照裂解物。消化后,将裂解物点在膜上并使其干燥,然后用抗cd319mab、抗ssea1mab、抗-β-肌动蛋白mab或slam01进行免疫印迹。slam01在链霉蛋白酶处理的裂解物上的结合与对照相似,表明slam01的结合不受损失蛋白质和结构的影响。这表明slam01与聚糖表位结合。
图13显示了用pngase处理的oci-aml3裂解物上slam01的免疫印迹。用pngasef处理oci-aml3裂解物以除去n-连接的聚糖。在pngasef处理后,slam01与oci-aml3裂解物的结合丧失;由此推断出slam01结合需要抗原上的n-连接的聚糖。
图14显示了slam01在各种aml细胞系上的竞争性结合。将slam01与游离lewisx(lex)、路易斯y(ley)、路易斯a(lea)和路易斯b(leb)分别预孵育30分钟。然后测试每种slam01-聚糖混合物对五种aml细胞系(aml2、aml3、kg1、molm14和mono-mac-1)的结合。与所有5个品系的阳性对照(没有聚糖的slam01)相比,仅与lex预孵育的slam01显示出明显降低的结合百分比。结论是slam01识别具有末端lex结构的聚糖。
图15显示了slam01-phrodored缀合物在aml2和aml3上的结合谱。phrodored染料在酸性条件下例如在内体中发荧光。与对照相比,在室温与phrodored缀合的slam01孵育60分钟的aml2和aml3显示出增加的荧光。这表明slam01-phrodored染料被内化到内体中。
图16显示用slam01-mab-zap复合物处理3天后aml-2和aml-3的相对存活率。mab-zap是与皂草素缀合的二级抗小鼠抗体。当内化到细胞质中时,皂草素影响蛋白质翻译并导致细胞死亡。仅对用slam01-mab-zap复合物处理的细胞(右侧第1列)观察到细胞活力降低。由此得出结论,slam01可以向细胞中递送有毒有效载荷,从而导致作为adc的细胞死亡。
图17突出显示了aml细胞系上slam01结合百分比和相对细胞毒的正相关性。针对这些aml细胞系筛选slam01。通过流式细胞术收集关于平均结合百分比的数据,而通过mab-zap测定确定关于相对细胞毒性的数据。当用slam01-mab-zap复合物处理时,slam01结合为阳性的细胞系(平均结合百分比>20%)表现出高细胞毒百分比。
图18a显示用slam01-mab-zap复合物处理3天后aml-2和aml-3的相对存活率。如图所示,用各种条件处理两种aml细胞系。向slam01-mab-zap复合物中添加lex(右侧第1列),使细胞免于slam01-mab-zap复合物(右侧第2列)的细胞毒作用。
图18b显示了oci-aml3、mono-mac-1和pbmc上slam01的结合直方图。将slam01在oci-aml3、mono-mac-1和外周血单核细胞(pbmc)上孵育。slam01对oci-aml3和mono-mac-1呈阳性,而对pbmc呈阴性。
图19显示了aml3和mono-mac-1上cslam01和slam01的竞争性抑制流式细胞术。在cslam01和slam01之间建立竞争性抑制流式细胞术。对于竞争样品,在加入cslam01之前,将slam01与细胞在4℃预孵育30分钟。竞争样品上cslam01的结合直方图减少表明slam01阻断了cslam01与表位的结合。
图20显示了aml3、mono-mac-1、hme-1和mrc5上cslam01和slam01的结合直方图。比较了cslam01和slam01在细胞系上的结合谱。cslam01保留与slam01阳性细胞系的结合,而不与slam01阴性细胞系结合。
图21显示用各种cslam01/ig-毒素复合物处理3天后aml-3和mono-mac-1的相对存活率。在处理aml3和mono-mac-1之前,cslam01与mab-zap、ig-单甲基澳瑞他汀e(mmae)或ig-dm1复合。在没有cslam01的情况下设置了对照。与对照相比,对用cslam01/ig-毒素处理的细胞观察到细胞存活率降低,证明cslam01保留了adc潜能。
图22显示了aml3和mono-mac-1上cslam01和cslam01-mmae的结合直方图。cslam01-mmae的结合谱类似于cslam01的结合谱。
图23显示用cslam01-mmae处理3天后aml-3和mono-mac-1的剂量响应曲线。用增加剂量的cslam01-mmae处理aml3和mono-mac-1。cslam01-mmae在aml3和mono-mac-1上都证实了其adc效应。
图24显示了pc9和ovcar3细胞系上slam01和抗cd319的流式细胞术直方图。将pc9(非小细胞肺癌细胞系)和ovcar3(卵巢癌上皮细胞系)与slam01或抗cd319一起孵育,以测试细胞表面上各抗原的表达。
图25显示了slam01免疫沉淀的蛋白上slam01、抗cd319和抗lewis-x/ssea1的蛋白质印迹。用slam01免疫沉淀oci-aml3膜蛋白提取物(mpx)。通过sds-page分离免疫沉淀的蛋白质,并用slam01,抗cd319和抗lewis-x/ssea1进行免疫印迹。
图26显示了对slam01呈阳性的聚糖结构的2d表示形式。
图27显示了对slam01呈阴性的聚糖结构的2d表示形式。
图28显示了ffpe细胞系阵列上slam01和抗lewis-x/ssea1的免疫组织化学染色。
图29显示了slam01和抗lewis-x/ssea1在a549、colo205、h1299和hcc827的结合直方图。将slam01和抗lewis-x/ssea1在a549(肺癌细胞系)、colo205(结肠直肠癌细胞系)、h1299(肺癌细胞系)和hcc827(肺癌细胞系)上孵育以确定它们的细胞表面表达谱。
具体实施方式
在第一方面,本发明涉及抗原结合蛋白或其抗原结合片段,其包含(i)重链可变结构域,所述重链可变结构域包含具有氨基酸序列gytftsywih(seqidno:1)的vhcdr1;具有氨基酸序列einpsngrtnfnekfkn(seqidno:2)的vhcdr2和具有氨基酸序列vdydeay(seqidno:3)的vhcdr3;和(ii)轻链可变结构域,所述轻链可变结构域包含具有氨基酸序列rssksllhsngityly(seqidno:4)的vlcdr1、具有氨基酸序列qmsnlas(seqidno:5)的vlcdr2和具有氨基酸序列aqnlelwt(seqidno:6)的vlcdr3。
所述的抗原结合蛋白或其抗原结合片段可包含与(i)和(ii)的重链cdr区和轻链cdr区具有约80%、约85%、约90%、约95%、约96%、约97%、约98%或约99%的同一性的重链cdr区和轻链cdr区。
所述重链可变区可包含seqidno:7中所示的氨基酸序列qvklqqsgaelakpgasvklsckasgytftsywihwvkqrpgqglewigeinpsngrtnfnekfknkatltvdkssstaymqlnsltsedsavyycarvdydeaywgqgttvtvss。
在一些实施方案中,所述重链可变区包含与seqidno:7所示的氨基酸序列具有约80%、约85%、约90%、约95%、约96%、约97%、约98%或约99%的同一性的氨基酸序列。
在一些实施方案中,所述轻链可变区可包含seqidno:8中所示的氨基酸序列
divmtqaafsnpvtlgtsasiscrssksllhsngitylywylqkpgqspqlliyqmsnlasgvpdrfsssgsgtdftlrisrveaedvgvyycaqnlelwtfgggtkleik。
所述的轻链可变区可包含与seqidno:8所示的氨基酸序列具有约80%、约85%、约90%、约95%、约96%、约97%、约98%或约99%的同一性的氨基酸序列。
在一个实施方案中,所述抗原结合蛋白选自以下组成的组:单克隆抗体、重组抗体、多克隆抗体、嵌合抗体、人源化抗体、双特异性抗体和异源偶联抗体;单个可变结构域、结构域抗体、抗原结合片段、免疫有效性片段、单链fv、单链抗体、缺少铰链区的单价抗体、微抗体、双抗体和tandabstm。
在一些实施方案中,所述结合蛋白是单克隆抗体。在一个实施方案中,所述单克隆抗体是slam01。
本文描述的单克隆抗体可以是人源化的。或者,所述单克隆抗体是嵌合的。
在一个实施方案中,如本文所述的抗原结合蛋白或其抗原结合片段结合n-连接的聚糖。所述n-连接的聚糖可以位于slamf7的细胞外部分。所述n-连接的聚糖可以是lewisx型寡糖。在一些实施方案中,如本文所述的抗原结合蛋白或其抗原结合片段不结合唾液酸化的lewisx型寡糖。
在一个实施方案中,如本文所述的抗原结合蛋白或其抗原结合片段可包含放射性同位素或与其缀合的细胞毒素。
如本文所述的抗原结合蛋白或其抗原结合片段可以与选自以下组成的组的细胞毒素缀合:单甲基澳瑞他汀e(mmae-1)、美登素(dm-1)、皂草素、吉西他滨、伊立替康、依托泊苷、长春碱、培美曲塞、多西他赛、紫杉醇、铂剂(例如顺铂、奥沙利铂和卡铂)、长春瑞滨、卡培他滨、米托蒽醌、伊沙匹隆、艾日布林、5-氟尿嘧啶、三氟尿嘧啶和替吡嘧啶。
在一些实施方案中,所述抗原结合蛋白或其抗原结合片段可以在slamf7上结合所述n-连接的聚糖后内化到细胞中。
在一些实施方案中,所述抗原结合蛋白或抗原结合片段可选择性结合非小细胞肺癌细胞、卵巢癌细胞、乳腺癌细胞、急性髓细胞白血病细胞和结肠直肠癌细胞。
另一方面,本发明提供了组合物,其包含生理学上可接受的载体和治疗有效量的如本文所述的抗原结合蛋白或其抗原结合片段。
在一些实施方案中,如本文所述的组合物可包含一种或多种其他治疗性化合物。
在另一个方面,本发明提供了如本文所述的抗原结合蛋白或其抗原结合片段或如本文所述的组合物在制备用于治疗或预防癌症的药物中的用途。
所述癌症可选自非小细胞肺癌、卵巢癌、乳腺癌、急性髓性白血病和结肠直肠癌组成的组。
在一个实施方案中,所述药物可以与一种或多种其他活性药物成分一起施用。
在另一个实施方案中,所述药物可以与化学疗法一起施用。
所述一种或多种其他药剂或化疗可以与所述药物分开、同时或依次施用。
在另一个方面,本发明提供了用于检测个体中的癌症的方法,该方法包括:使得自个体的样品与本文所述的抗原结合蛋白或其抗原结合片段在体外接触;检测所述样品中所述抗原结合蛋白或其抗原结合片段的结合;将所述结合与对照样品中的结合水平相关联以确定所述样品中的结合水平,其中所述样品中的所述结合水平相对于所述对照样品的增加指示癌症。
在另一个方面,本公开提供了用于鉴定易患癌症的个体的方法,该方法包括:使得自个体的样品与本文所述的抗原结合蛋白或其抗原结合片段在体外接触;检测所述样品中抗原结合蛋白或其抗原结合片段的结合;将所述结合与对照样品中的结合水平相关联以确定所述样品中的结合水平,其中所述样品中的所述结合水平相对于对照样品的增加指示所述个体易患癌症。
在一些实施方案中,所述对照样品可以来自相同的个体。或者,所述对照样品可以来自不同的个体。
所述抗原结合蛋白或其抗原结合片段可包含可检测的标记。在一些实施方案中,所述可检测标记可以选自荧光标记、化学发光标记、酶标记和放射性核素标记组成的组。所述可检测标记可选自生物素、碱性磷酸酶、辣根过氧化物酶、fitc、pe和cy染料组成的组。
在一些实施方案中,可以在选自流式细胞术、组织切片、免疫荧光、免疫细胞化学或免疫组织化学的测定中检测所述可检测标记。
在一个实施方案中,所述癌症可选自非小细胞肺癌、卵巢癌、乳腺癌、急性髓性白血病和结肠直肠癌组成的组。
另一方面,本发明提供了用于本文所述方法的试剂盒,其包含如本文所述的抗原结合蛋白或其抗原结合片段以及使用说明书。
本文说明性描述的本发明可以在缺少本文未具体公开的任何一个或多个要素、限制的情况下适当地实施。因此,例如,术语“包括”、“包括”、“含有”等应当被广泛地理解而不受限制。另外,这里使用的术语和表达已被用作描述的术语而非限制性的术语,并且无意使用这些术语和表达来排除所示和所描述的特征的任何等同物或其部分,但应认识到在所要求保护的本发明的范围内可以进行各种修改。因此,应该理解,尽管已经通过优选实施例和可选特征具体公开了本发明,但是本领域技术人员可以采用本文公开的本发明的修改和变化形式,并且这些修改和变化是被认为是在本发明的范围内。
本文已广泛和一般地描述了本发明。落入一般公开内容中的每个较窄物种和亚属群组也构成本发明的一部分。这包括本发明中涉及附带条件或否定限制以从该属中去除任何主题的一般性描述,无论是否在本文中具体叙述了去除的内容。
其他实施方案在本发明的权利要求和非限制性实施例内。另外,在根据马库什群组描述本发明的特征或方面的情况下,本领域技术人员将认识到,本发明也由此以马库什群组的任何单个成员或成员子群的形式进行了描述。
实验部分
通过参考具体实施例将更详细地进一步描述本发明的非限制性实施例和比较例,其不应被解释为以任何方式限制本发明的范围。
实施例1.免疫和mab的产生
在本研究中,针对slamf7(cd319)产生一组单克隆抗体(mab),所述slamf7是与mm相关的细胞表面标志物。为了产生这些mab,用购自sinobiologicalinc.(目录号11691-h08h)的重组人slamf7(cd319)免疫4只雌性balb/c小鼠(图1)。编码重组人slam7(cd319)的dna序列由在c末端与多组氨酸标签融合的细胞外结构域(met1至met226)组成,其通过人宿主细胞表达。
小鼠免疫在2014年2月6日开始,然后是由5次每周一次的免疫和1次加强免疫组成的免疫方案。完成免疫方案后,于2014年3月13日收获血浆b细胞并与sp2/0小鼠骨髓瘤细胞系融合(图1)。使用stemcelltechnologiesclonacelltm-hy试剂盒进行杂交瘤融合,并产生一组杂交瘤,其产生存在于培养上清液中的mab。通过流式细胞术筛选mab与aml、mm、其他癌症和正常细胞系的结合,随后鉴定出新的抗slamf7抗体slam01。
实施例2.slam01mab的结合谱
对表达cd319(slamf7)的mm细胞系上的1e10mab(slam01)的流式细胞分析表明slam01与kms28/bm结合但不结合kms11(图2)。仅在非还原条件下通过免疫印迹观察到slam01与高分子量形式(>140kda)的cd319胞外域之间的结合(图3)。基于抗cd319ab探测的免疫印迹,slam01也不能识别在40至50kda之间的预测大小的slamf7。通过在非还原和还原条件下用kms28/bm裂解物对slam01进行免疫印迹来评估slam01对cd319全长形式的识别(图4)。免疫印迹显示slam01识别cd319的高分子量形式和40kda形式。然而,slam01不识别cd319的全长形式,其在抗cd319的免疫印迹上显示为成片条带(smear)(40至65kda)。为了进一步证实slam01对cd319的识别,用slam01免疫沉淀(ip)kms28/bm裂解物,并用抗cd319ab免疫印迹洗脱物(图5)。免疫印迹表明在ip洗脱物(泳道1)和kms28/bm裂解物(泳道5)二者中抗cd319ab与高分子量形式的cd319结合。因此,slam01识别cd319的高分子量形式。
在mab中,令人惊讶地发现slam01优先结合在aml细胞系而不是mm上表达的slamf7(图6)。此外,slam01通过流式细胞术显示对数种卵巢和nsclc细胞系的反应性(图7)。当通过流式细胞术测试时,slam01不具有与成纤维细胞、上皮细胞系、成人msc和pbmc的非特异性结合(图8)。为了进一步证实slam01在细胞系上的反应性,在内部(in-house)ffpe细胞系阵列上进行免疫组织化学,并通过immunomembrane对结果进行评分。人细胞系阵列显示slam01对许多aml细胞系和其他癌细胞系(如乳腺癌、卵巢癌、胃癌、结肠直肠癌和nsclc)的肿瘤抗原靶标具有高选择性,而在正常细胞系上未观察到染色(图9和10)。因此,流式细胞术和免疫组织化学均显示slam01优先结合aml和其他癌细胞系,而不是mm、b细胞系或正常细胞。
实施例3.slam01同种型和表位性质的测定
测定slam01同种型并确定为κ同种型的小鼠igm单克隆抗体(图11)。可变重链和轻链的翻译序列如下,其中互补决定区(cdr)加下划线:
可变重链(seqidno:7)
可变轻链(seqidno:8)
表位表征显示slam01识别聚糖表位,因为在用链霉蛋白酶(一种将蛋白质消化成氨基酸的酶)处理aml3后结合不受影响(图12)。此外,slam01需要存在n-连接的聚糖用于结合(图13)。用pngase处理(泳道1)消除slam01与抗原的结合,表明所述结合需要n-聚糖。此外,slam01与lex的预孵育导致slam01与所有aml细胞系的结合降低(图14)。因此,slam01是一种小鼠igm单克隆抗体,其识别人癌细胞上n-糖基化slamf7上的末端lex结构,具有编码可变重和轻抗体链的确定翻译蛋白序列。
为了进一步表征slam01与slamf7的结合,将pc9(非小细胞肺癌细胞系)和ovcar3(卵巢癌上皮细胞系)与slam01或抗cd319一起孵育以测试相应抗原在细胞表面的表达。图24中的直方图显示2个细胞系对slam01呈阳性,但对cd319呈阴性。这表明slam01与pc9和ovcar3结合的表位不在cd319上。
我们制备的slam01免疫沉淀的蛋白上的slam01、抗cd319和抗lewis-x/ssea1的western印迹(图25)。用slam01免疫沉淀oci-aml3膜蛋白提取物(mpx),并通过sds-page分离免疫沉淀的蛋白质,并用slam01、抗cd319和抗lewis-x/ssea1进行免疫印迹。印迹显示slam01已成功地从mpx免疫沉淀所述的蛋白质(左侧免疫印迹,泳道1)。然而,尽管oci-aml3表达cd319(中间免疫印迹,泳道7),所述免疫沉淀的蛋白质不被抗cd319(中间免疫印迹,泳道1)识别。这些slam01-免疫沉淀的蛋白质被lewis-x(右侧免疫印迹,泳道1)修饰。这些数据表明slam01不识别cd319,而是识别具有lewis-x的糖蛋白。
在图26中可以看到对slam01呈阳性的聚糖结构的2d表示。发现slam01对lewis-x以及在末尾非还原末端含有lewis-x结构的4个聚糖结构呈阳性。
在图27中可以看到对slam01呈阴性的聚糖结构的2d表示。slam01对于在聚糖结构的末尾非还原末端含有lewis-x结构的这些聚糖结构呈阴性。根据该数据,假设(尽管决不是限制性的)slam01的结合需要lewis-x呈递在特定的聚糖骨架上,或slam01识别由末端lewis-x结构和其他聚糖组成的表位。
在内部ffpe细胞系阵列上对slam01和抗lewis-x/ssea1染色(图28)。slam01染色5/48的细胞系核心,而抗lewis-x/ssea1染色16/48的核心。所有slam01阳性核心均为lewis-x阳性,支持slam01识别特定聚糖骨架上的lewis-x或由末端lewis-x结构与其他聚糖组成的slam01表位的假设。
将slam01和抗lewis-x/ssea1在a549(肺癌细胞系)、colo205(结肠直肠癌细胞系)、h1299(肺癌细胞系)和hcc827(肺癌细胞系)上孵育以确定它们的细胞表面表达谱(图29)。slam01在所有4种细胞系中具有与抗lewis-x/ssea1不同的表达谱,表明slam01识别特定聚糖骨架上的lewis-x或由末端lewis-x结构与其他聚糖组成的slam01表位。
实施例4.slam01的adc潜能
slam01可以潜在地用作adc。流式细胞术数据显示结合后slam01的一定程度的内化,如通过slam01与phrodored缀合时细胞内红色荧光的增加所观察到的(图15)。当间接通过二抗缀合于皂草素时,slam01在体外结合癌细胞系时显示出作为adc的细胞毒活性(图16)。slam01与核糖体毒素,皂草素(mab-zap)作为adc的间接缀合显示在各种slam01阳性细胞系上杀伤百分比范围为30%-90%(图17)。观察到杀伤百分比与结合百分比正相关。可溶性游离lex可以竞争性地抑制slam01与细胞的结合(图18a)。类似地,在lex存在下,slam01对靶细胞的杀伤效率降低。此外,对血液组织样品(n=3)的流式细胞术筛选和凝集测定证明在pbmc上没有结合,使其对于治疗应用是安全的(图18b)。功能上,slam01与皂草素缀合的二级mab复合后,能够内化进入并杀伤aml细胞系。
实施例5.嵌合slam01的验证
将slam01的恒定区转换为人igg1的恒定区以产生嵌合slam01(cslam01)。通过流式细胞术在竞争性抑制研究中证实了cslam01与slam-01阳性细胞系如aml3和mono-mac-1的结合(图19)。此外,cslam01还保留了slam-01靶结合谱,观察到与slam-01阳性细胞系的结合,但未观察到与slam01阴性细胞系如hme-1和mrc5的结合(图20)。功能上,用cslam01和ig-毒素复合物如dm1(一种高效的美登素)和单甲基澳瑞他汀e(mmae)(一种抗有丝分裂毒素)治疗降低了aml3和mono-mac-1的细胞活力(图21)。因此,cslam01在slam-01阳性细胞上保留了结合谱和adc潜力。
在cslam01的形成和验证之后,将mmae与cslam01直接缀合以形成cslam01-mmae。通过流式细胞术观察cslam01-mmae与aml3和mono-mac-1的结合(图22)。由于cslam01-mmae的结合谱与cslam01类似,因此接下来在活力测定中测试adc潜能。基于cslam01-mmae的剂量响应曲线,在aml3和mono-mac-1上均观察到adc效应,对后者的效力更强(图23)。总的来说,这些数据突出了将slam01开发成对aml的adc的潜力。
序列表
<110>新加坡科技研究局
<120>抗寡糖抗体
<130>9869sg4980
<150>10201702572p
<151>2017-03-29
<160>8
<170>patentinversion3.5
<210>1
<211>10
<212>prt
<213>小鼠
<400>1
glytyrthrphethrsertyrtrpilehis
1510
<210>2
<211>17
<212>prt
<213>小鼠
<400>2
gluileasnproserasnglyargthrasnpheasnglulysphelys
151015
asn
<210>3
<211>7
<212>prt
<213>小鼠
<400>3
valasptyraspglualatyr
15
<210>4
<211>16
<212>prt
<213>小鼠
<400>4
argserserlysserleuleuhisserasnglyilethrtyrleutyr
151015
<210>5
<211>7
<212>prt
<213>小鼠
<400>5
glnmetserasnleualaser
15
<210>6
<211>8
<212>prt
<213>小鼠
<400>6
alaglnasnleugluleutrpthr
15
<210>7
<211>116
<212>prt
<213>小鼠
<400>7
glnvallysleuglnglnserglyalagluleualalysproglyala
151015
servallysleusercyslysalaserglytyrthrphethrsertyr
202530
trpilehistrpvallysglnargproglyglnglyleuglutrpile
354045
glygluileasnproserasnglyargthrasnpheasnglulysphe
505560
lysasnlysalathrleuthrvalasplysserserserthralatyr
65707580
metglnleuasnserleuthrsergluaspseralavaltyrtyrcys
859095
alaargvalasptyraspglualatyrtrpglyglnglythrthrval
100105110
thrvalserser
115
<210>8
<211>111
<212>prt
<213>小鼠
<400>8
aspilevalmetthrglnalaalapheserasnprovalthrleugly
151015
thrseralaserilesercysargserserlysserleuleuhisser
202530
asnglyilethrtyrleutyrtrptyrleuglnlysproglyglnser
354045
proglnleuleuiletyrglnmetserasnleualaserglyvalpro
505560
aspargpheserserserglyserglythraspphethrleuargile
65707580
serargvalglualagluaspvalglyvaltyrtyrcysalaglnasn
859095
leugluleutrpthrpheglyglyglythrlysleugluilelys
100105110
- 还没有人留言评论。精彩留言会获得点赞!