腺相关病毒载体递送肌肉特异性微肌营养不良蛋白以治疗肌营养不良症的制作方法
本申请要求2017年3月17日提交的美国临时专利申请62/473,148的优先权,该临时专利申请通过引用整体并入本文。
通过引用并入电子递交的材料
作为本公开的单独部分,本申请包含计算机可读形式的序列表,其通过引用整体并入并且如下所示:文件名:51475_seqlisting.txt;大小:29,519字节,创建于2018年3月13日。
本发明提供基因治疗载体,例如腺相关病毒(aav)载体,其表达小型化的人微肌营养不良蛋白基因,以及使用这些载体在骨骼肌(包括膈肌和心肌)中表达微肌营养不良蛋白并保护肌纤维不受伤、增加肌肉力量和减少和/或防止患有肌营养不良的受试者的纤维化的方法。
背景技术:
肌肉量和力量对日常活动(如运动和呼吸)以及全身新陈代谢的重要性是明确的。肌肉功能缺陷会产生肌肉营养不良症(md),其特点是肌肉无力和消瘦,对生活质量有严重影响。最充分表征的md是由编码肌营养不良蛋白相关蛋白复合物(dapc)成员的基因突变引起的。这些md是由与dapc的肌膜-细胞骨架束缚丧失相关的膜脆性引起的。duchenne肌营养不良症(dmd)是最具破坏性的肌肉疾病之一,影响5000名新生男性中的1名。
dmd由dmd基因突变引起,导致mrna减少和肌营养不良蛋白的缺失,肌营养不良蛋白是与肌营养不良蛋白相关蛋白复合物(dapc)相关的427kd肌膜蛋白(hoffman等人,cell51(6):919-28,1987)。dapc由肌肉肌膜上的多种蛋白质组成,通过肌营养不良蛋白(一种肌动蛋白结合蛋白)和α-肌营养不良蛋白聚糖(一种层粘连蛋白结合蛋白)在细胞外基质(ecm)和细胞骨架之间形成结构连接。这些结构连接用于在收缩期间稳定肌细胞膜并防止收缩引起的损伤。随着肌营养不良蛋白的丧失,膜脆性导致肌膜撕裂和钙的流入,引发钙激活的蛋白酶和节段性纤维坏死(straub等人,curropin.neurol.10(2):168-75,1997)。这种不受控制的肌肉退化和再生循环最终会耗尽肌肉干细胞群(sacco等人,cell,2010.143(7):p.1059-71;wallace等人,annurevphysiol,2009.71:p.37-57),导致进行性肌肉无力、肌内膜炎症和纤维化瘢痕形成。
如果没有肌营养不良蛋白或微肌营养不良蛋白的膜稳定作用,dmd将表现出不受控制的组织损伤和修复循环,最终通过结缔组织增殖用纤维化瘢痕组织代替丢失的肌纤维。纤维化的特征在于ecm基质蛋白的过量沉积,包括胶原蛋白和弹性蛋白。ecm蛋白主要由细胞因子如tgfβ产生,其由对应激和炎症有反应的活化的成纤维细胞释放。尽管dmd的主要病理特征是肌纤维变性和坏死,但纤维化作为病理后果具有相同的影响。纤维化组织的过度产生限制了肌肉再生并且有助于dmd患者的进行性肌肉无力。在一项研究中,初始dmd肌肉活检组织中纤维化的存在与10年随访时的不良运动结果高度相关(desguerre等人,jneuropatholexpneurol,2009.68(7):p.762-7)。这些结果表明纤维化是dmd肌肉功能障碍的主要原因,并强调在明显纤维化之前需要早期干预。
腺相关病毒(aav)是复制缺陷型细小病毒,其单链dna基因组长约4.7kb,包括145个核苷酸的反向末端重复(itr)。存在多种血清型aav。aav血清型的基因组的核苷酸序列是已知的。例如,aav血清型2(aav2)基因组的核苷酸序列在如由ruffing等人《普通病毒学杂志(jgenvirol)》75:3385-3392(1994)校正的srivastava等人《病毒学杂志(jvirol)》45:555-564(1983)中提出。作为另一例子,aav-1的完整基因组在genbank登录号nc_002077中提供;aav-3的完整基因组在genbank登录号nc_1829中提供;aav-4的完整基因组在genbank登录号nc_001829中提供;aav-5基因组在genbank登录号af085716中提供;aav-6的完整基因组在genbank登录号nc_001862中提供;至少部分aav-7和aav-8基因组分别在genbank登录号ax753246和ax753249中提供(也参见涉及aav-8的美国专利7,282,199和7,790,449);aav-9基因组在gao等人,《病毒学期刊》,78:6381-6388(2004)中提供;aav-10基因组在《分子疗法(mol.ther.)》,13(1):67-76(2006)中提供;和aav-11基因组在《病毒学(virology)》,330(2):375-383(2004)中提供。aavrh.74血清型的克隆描述于rodino-klapac.等人,journaloftranslationalmedicine5,45(2007)。指导病毒dna复制(rep)、衣壳化/包装和宿主细胞染色体整合的顺式作用序列包含在itr中。三个aav启动子(其相对图谱位置命名为p5、p19和p40)驱动编码rep和cap基因的两个aav内部开放阅读框的表达。两个rep启动子(p5和p19)与单个aav内含子的差异剪接(例如在aav2核苷酸2107和2227处)结合导致从rep基因产生四种rep蛋白(rep78、rep68、rep52和rep40)。rep蛋白具有多种酶特性,所述酶特性最终负责复制病毒基因组。cap基因由p40启动子表現,並且其编码三种衣壳蛋白vp1、vp2及vp3。替代性剪接及非共有翻译起始位点负责产生三种相关的衣壳蛋白。单一共有聚腺苷酸化位点位于aav基因组的图谱位置95处。aav的生命周期及遗传学在muzyczka,《当前微生物学及免疫学的话题(currenttopicsinmicrobiologyandimmunology)》,158:97-129(1992)中评论。
aav独特的特征在于,其作为例如在基因治疗中将外源dna递送至细胞的载体具有吸引力。培养中细胞的aav感染是非细胞病变的,並且人类及其他动物的自然感染是沉默的及无症状的。而且,aav感染许多哺乳动物细胞,允许活体內靶向许多不同组织的可能性。而且,aav转导缓慢分裂和非分裂细胞,并且可以作为转录活性核附加体(染色体外元件)基本上持续这些细胞的寿命。aav原病毒基因组作为质粒中的克隆dna具有感染性,这使得重组基因组的构建成为可能。此外,由于指导aav复制、基因组衣壳化和整合的信号包含在aav基因组的itr中,因此部分或全部内部约4.3kb的基因组(编码复制和结构衣壳蛋白,rep-cap)可以用如含有启动子、感兴趣的dna和多腺苷酸化信号的基因盒等外源dna替代。rep蛋白和cap蛋白可以以反式提供。aav的另一个显著特征是其是极其稳定且强健的病毒。它易于承受用于灭活腺病毒的条件(56℃到65℃,持续数小时),使aav的冷保存不太重要。甚至可以将aav冻干。最后,aav感染的细胞不耐受重复感染。
多项研究证明了肌肉中长期(>1.5年)重组aav介导的蛋白质表达。参见clark等人,humgenether,8:659-669(1997);kessler等人,procnat.acadsc.usa,93:14082-14087(1996);和xiao等人,jvirol,70:8098-8108(1996)。还参见chao等人,molther,2:619-623(2000)和chao等人,molther,4:217-222(2001)。此外,由于肌肉高度血管化,重组aav转导导致肌肉注射后在体循环中出现转基因产物,如在herzog等人,procnatlacadsciusa,94:5804-5809(1997)和murphy等人,procnatlacadsciusa,94:13921-13926(1997)中所述。此外,lewis等人,jvirol,76:8769-8775(2002)证明骨骼肌纤维具有正确的抗体糖基化、折叠和分泌所必需的细胞因子,表明肌肉能够稳定表达分泌的蛋白质治疗剂。
患有dmd和其他肌营养不良症的患者的功能改善需要在疾病的早期阶段进行基因恢复。需要在患有dmd的患者中增加肌肉力量并防止肌肉损伤的治疗。
技术实现要素:
本发明涉及基因治疗载体,例如aav,其将微肌营养不良蛋白基因表达至骨骼肌,包括膈肌和心肌,以保护肌纤维免受损伤、增加肌肉力量并减少和/或预防纤维化。
本发明提供了使用基因治疗载体递送微肌营养不良蛋白以解决在dmd中观察到的基因缺陷来增加肌肉力量和/或增加肌肉量的疗法和方法。如实施例2中所示,用微肌营养不良蛋白基因疗法治疗导致体内更大的肌肉力量。此外,肌内和全身递送微肌营养不良蛋白基因疗法显示体内小鼠模型中肌营养不良蛋白递送至肌肉。
在一个实施方案中,本发明提供了raav载体,其包含肌肉特异性控制元件核苷酸序列和编码微肌营养不良蛋白的核苷酸序列。例如,核苷酸序列编码功能性微肌营养不良蛋白,其中核苷酸与seqidno:1具有例如至少65%、至少70%、至少75%、至少80%、81%、82%、83%、84%、85%、86%、87%、88%或89%,更通常至少90%、91%、92%、93%或94%,甚至更通常至少95%、96%、97%、98%、99%或100%的序列同一性,其中所述蛋白质保留微肌营养不良蛋白活性。微肌营养不良蛋白在肌肉收缩期间为肌肉膜提供稳定性,例如微肌营养不良蛋白在肌肉收缩期间充当减震器。
本发明还提供了raav载体,其中核苷酸序列编码功能性微肌营养不良蛋白,其包含在严格条件下与seqidno:1的核酸序列或其互补物杂交并编码功能性微肌营养不良蛋白的核苷酸序列。
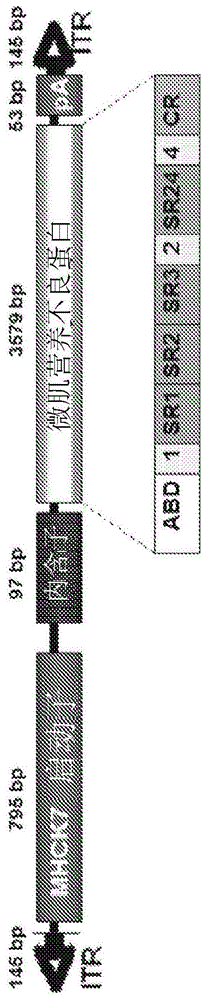
在一个实施方案中,raav载体是称为raavrh74.mhck7.微肌营养不良蛋白的非复制型重组腺相关病毒(aav)。该载体基因组含有基因表达所需的最小元件,包括aav2反向末端重复序列(itr)、微肌营养不良蛋白、sv40内含子(sd/sa)和合成多聚腺苷酸化(polya)信号,均在mhck7启动子/增强子的控制下。载体基因组和表达盒的示意图显示错误!未发现参考源。iv施用后,aavrh74血清型可用于在骨骼肌和心肌中实现有效的基因转移。
术语“严格”用于指本领域通常理解为严格的条件。杂交的严格性主要由温度、离子強度、以及如甲酰胺等变性剂的浓度決定。用于杂交和洗涤的严格条件的实例是0.015m氯化钠、65℃到68℃下0.0015m柠檬酸钠,或0.015m氯化钠、0.0015m柠檬酸钠和42℃下50%甲酰胺。参见sambrook等人《分子克隆:实验室手册(molecularcloning:alaboratorymanual)》,第2版,冷泉港实验室,(纽约冷泉港,1989)。还可以使用更严格的条件(例如更高的温度、更低的离子强度、更高的甲酰胺或其他变性剂),然而,杂交速率将受到影响。在涉及脱氧寡核苷酸杂交的情况下,另外的示例性严格杂交条件包括在37℃(对于14碱基寡聚物)、48℃(对于17碱基寡聚物)、55℃(对于20碱基寡聚物)和60℃(对于23碱基寡聚物)下在6×ssc0.05%焦磷酸钠中洗涤。
为了减少非特异性和/或背景杂交,可以在杂交和洗涤缓冲液中包含其他试剂。例子是0.1%牛血清白蛋白、0.1%聚乙烯吡咯烷酮、0.1%焦磷酸钠、0.1%十二烷基硫酸钠、nadodso4、(sds)、ficoll、denhardt溶液、超声处理鲑鱼精子dna(或其他非互补dna)和葡聚糖硫酸盐,尽管也可以使用其他合适的试剂。可以改变这些添加剂的浓度和类型,而基本上不影响杂交条件的严格性。杂交实验通常在ph6.8-7.4下进行,然而,在典型的离子强度条件下,杂交速率几乎与ph无关。参见anderson等人,nucleicacidhybridisation:apracticalapproach,ch.4,irlpresslimited(英国牛津)。本领域技术人员可以调节杂交条件以适应这些变量并允许不同序列相关性的dna形成杂交体。
术语“肌肉特异性控制元件”是指调节对肌肉组织中表达特异的编码序列的表达的核苷酸序列。这些控制元素包括增强子和启动子。本发明提供了包含肌肉特异性控制元件mckh7启动子、mck启动子和mck增强子的构建体。
术语“可操作地连接”是指调节元件核苷酸序列(例如启动子核苷酸序列)的定位,以通过所述调节元件赋予所述核苷酸序列的表达。
一方面,本发明提供raav载体,其中肌肉特异性控制元件是人骨骼肌动蛋白基因元件、心肌肌动蛋白基因元件、肌细胞特异性增强子结合因子(mef)、肌肉肌酸激酶(mck)、截短的mck(tmck)、肌球蛋白重链(mhc)、杂合α-肌球蛋白重链增强子/mck增强子启动子(mhck7)、c5-12、鼠肌酸激酶增强子元件、骨骼快肌纤维肌钙蛋白c基因元件、慢肌纤维心脏肌钙蛋白c基因元件、慢肌纤维肌钙蛋白i基因元件、缺氧诱导核因子、类固醇诱导元件或糖皮质激素反应元件(gre)。
例如,肌肉特异性控制元件是mhck7启动子核苷酸序列seqidno:2或肌肉特异性控制元件是mck核苷酸序列seqidno:4。另外,在本发明的任何raav载体中,肌肉特异性控制元件核苷酸序列,例如mhck7或mck核苷酸序列,与编码微肌营养不良蛋白的核苷酸序列可操作地连接。例如,mhck7启动子核苷酸序列(seqidno:2)与人微肌营养不良蛋白编码序列(seqidno:1)可操作地连接,如图1或图10中提供的构建体(seqidno:3)中所示。在另一个实例中,mck启动子(seqidno:4)与人微肌营养不良蛋白编码序列(seqidno:1)可操作地连接,如图7或图11中提供的构建体(seqidno:5)中所示。另一方面,本发明提供了raav载体,其包含seqidno:1和seqidno:2的核苷酸序列。本发明还提供了包含seqidno:1和seqidno:4的核苷酸序列的raav载体。
在另一方面,本发明提供了raav载体,其包含seqidno:3或seqidno:5的核苷酸序列。例如,raavrh74.mhck7.微肌营养不良蛋白载体包含seqidno:3的核苷酸序列并显示在图10中。该raav载体包含mhck7启动子、嵌合内含子序列、人微肌营养不良蛋白基因的编码序列、polya、氨苄青霉素抗性和具有pbr322起点或复制的pgex质粒骨架。
本发明提供了重组aav载体,其包含seqidno:1的人微肌营养不良蛋白核苷酸序列和seqidno:3的mhck7启动子核苷酸序列。该raav载体是aav血清型aavrh.74。
本发明还提供了重组aav载体,其包含seqidno:3的paav.mhck7.微肌营养不良蛋白构建体核苷酸序列。该raav载体是aav血清型aavrh.74。
本发明的raav载体可以是任何aav血清型,例如血清型aavrh.74、aav1、aav2、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12或aav13。
本发明还提供了包含任何本发明的raav载体的药物组合物(或有时在本文中简称为“组合物”)。
在另一个实施方案中,本发明提供产生raav载体颗粒的方法,包括培养已用本发明的任何raav载体转染的细胞,并从转染细胞的上清液中回收raav颗粒。本发明还提供了包含本发明的任何重组aav载体的病毒颗粒。
本发明提供治疗肌营养不良症的方法,包括给予治疗有效量的任何表达人微肌营养不良蛋白的本发明重组aav载体。
本发明提供治疗肌营养不良症的方法,包括给予治疗有效量的重组aav载体,该载体包含seqidno:1的人微肌营养不良蛋白核苷酸序列和seqidno:2的mhck7启动子核苷酸序列。
本发明还提供治疗肌营养不良症的方法,包括给予治疗有效量的重组aav载体,其包含seqidno:3的paav.mhck7.微肌营养不良蛋白构建体核苷酸序列。
“纤维化”是指细胞外基质(ecm)组分的过度的或未调节的沉积以及在损伤后组织中的异常修复过程,所述组织包括骨骼肌、心肌、肝脏、肺、肾和胰腺。被沉积的ecm组分包括纤连蛋白和胶原蛋白,例如胶原蛋白1、胶原蛋白2或胶原蛋白3。
本发明还提供减少或预防患有肌营养不良症的受试者的纤维化的方法,包括给予治疗有效量的本发明的任何重组aav载体。
在另一个实施方案中,本发明提供了预防有此需要的受试者的纤维化的方法,包括给予治疗有效量的本发明的重组aav载体。例如,可以将本发明的任何raav施用于患有肌营养不良的受试者以预防纤维化,例如在受试者中观察到纤维化之前施用的表达人微肌营养蛋白的本发明的raav。此外,表达人微肌营养不良蛋白基因的本发明的raav可被施用于有发展纤维化风险的受试者,例如患有或诊断患有肌营养不良症例如dmd的那些。本发明的raav可以施用于患有肌营养不良症的受试者,以防止这些受试者中的新纤维化。
本发明考虑在受试者中观察到纤维化之前给予本发明的任何aav载体。此外,本发明的raav可以施用于有发展纤维化风险的受试者,例如患有或诊断患有肌营养不良症例如dmd的那些。本发明的raav可以施用于已经患有纤维化的患有肌营养不良症的受试者,以便在这些受试者中预防新的纤维化。
本发明还提供增加患有肌营养不良症的受试者的肌肉力量和/或肌肉量的方法,包括给予治疗有效量的表达人微肌营养不良蛋白基因的本发明的raav载体。这些方法可以进一步包括施用表达微肌营养不良蛋白的raav的步骤。
本发明考虑将本发明的任何aav载体在受试者中观察到纤维化之前或在肌肉力量减少之前或肌肉量减少之前给予被诊断患有dmd的患者。
本发明还考虑将本发明的aav给予已经患有纤维化的患有肌营养不良的受试者,以便预防这些受试者中的新纤维化或减少这些患者的纤维化。本发明还提供给患有肌肉营养不良的患者施用本发明的任何raav,所述患者已经具有减小的肌肉力量或具有减少的肌肉量,以保护肌肉免受进一步的损伤。
在本发明的任何方法中,受试者可能患有肌营养不良症例如dmd或任何其他肌营养不良蛋白相关的肌营养不良症。
另一方面,表达微肌营养不良蛋白的raav载体包含微肌营养不良蛋白基因的编码序列,其可操作地连接于除mhck7或mck之外的肌肉特异性控制元件。例如,其中肌肉特异性控制元素是人骨骼肌动蛋白基因元件、心肌肌动蛋白基因元件、肌细胞特异性增强子结合因子mef、tmck(截短的mck)、肌球蛋白重链(mhc)、c5-12、鼠肌酸激酶增强子元件、骨骼快肌纤维肌钙蛋白c基因元件、慢肌纤维心脏肌钙蛋白c基因元件、慢肌纤维肌钙蛋白i基因元件、缺氧诱导核因子、类固醇诱导元件或糖皮质激素反应元件(gre)。
在本发明的任何方法中,raav载体或组合物可以通过肌内注射或静脉内注射给药。
此外,在本发明的任何方法中,raav载体或组合物可以全身给药。例如,raav载体或组合物可以通过注射、输注或植入进行肠胃外给药。
在另一个实施方案中,本发明提供了包含本发明的任何raav载体的组合物,用于减少有此需要的受试者的纤维化。
此外,本发明提供了一种组合物,其包含本发明的任何重组aav载体,用于预防患有肌营养不良症的患者的纤维化。
本发明提供了包含本发明的任何重组aav载体的组合物,用于治疗肌营养不良症。
本发明提供了包含重组aav载体的组合物,所述重组aav载体包含seqidno:1的人微肌营养不良蛋白核苷酸序列和seqidno:2的mhck7启动子序列,用于治疗肌营养不良症。
本发明提供了包含重组aav载体的组合物,所述重组aav载体包含paav.mhck7.微肌营养不良蛋白构建体,其包含seqidno:3的核苷酸序列,用于治疗肌营养不良症。
本发明还提供了包含本发明的任何raav载体的组合物,用于增加患有肌营养不良的受试者的肌肉力量和/或肌肉量。在另一个实施方案中,本发明提供了包含本发明的任何raav载体的组合物,用于治疗肌营养不良症。
本发明的组合物可以配制用于肌内注射或静脉内注射。本发明的组合物还配制用于全身给药,例如通过注射、输注或植入进行肠胃外给药。
此外,可以配制任何组合物用于给予患有肌营养不良症例如dmd或任何其他肌营养不良蛋白相关的肌营养不良症的受试者。
在另一个实施方案中,本发明提供了本发明的任何raav载体在制备用于减少有此需要的受试者的纤维化的药物中的用途。例如,有需要的受试者可能患有肌营养不良症,例如dmd或任何其他肌营养不良蛋白相关的肌营养不良症。
在另一个实施方案中,本发明提供了本发明的raav载体在制备药物中的用途,所述药物用于预防患有肌营养不良的受试者的纤维化。
此外,本发明提供了本发明的重组aav载体在制备药物中的用途,所述药物用于增加患有肌营养不良的受试者的肌肉力量和/或肌肉量。
本发明还提供了本发明的raav载体在制备用于治疗肌营养不良症的药物中的用途。
本发明提供了包含seqidno:1的人微肌营养不良蛋白核苷酸序列和seqidno:2的mhck7启动子核苷酸序列的重组aav载体在制备用于治疗肌营养不良症的药物中的用途。
本发明提供了包含seqidno:3的paav.mhck7.微肌营养不良蛋白构建体核苷酸序列的重组aav载体用于治疗肌营养不良的用途。
在本发明的任何用途中,药物可以配制成用于肌内注射或静脉内注射。此外,在本发明的任何用途中,药物可以配制用于全身给药,例如通过注射、输注或植入进行肠胃外给药。
可以制备任何药物用于给予患有肌营养不良症例如dmd或任何其他肌营养不良蛋白相关的肌营养不良症的受试者。
附图说明
图1显示了paav.mhck7.微肌营养不良蛋白构建体。在该构建体中,cdna表达盒的侧翼是aav2反向末端重复序列(itr)。该构建体的特征在于框内杆缺失(r4-r23),而铰链1、2和4(h1、h2和h4)和富含半胱氨酸的结构域仍然产生138kda蛋白质。微肌营养不良蛋白(3579bp)的表达由mhck7启动子(795bp)引导。内含子和5'utr衍生自质粒pcmvβ(clontech)。微肌营养不良蛋白盒在atg开始前立即具有共识kozak,以及用于mrna终止的小的53bp合成polya信号。人微肌营养不良蛋白盒包含如先前harper等人描述的(r4-r23/δ71-78)结构域(naturemedicine8,253-261(2002))。
图2显示了肌内递送aavrh74.mhck7构建体后肌营养不良蛋白的表达。mdx小鼠的胫骨前肌注射1×1011vg(每组n=5)。六周后收获肌肉并用肌营养不良蛋白和苏木精和伊红染色的n-末端抗体染色以进行肌营养不良蛋白表达。
图3a-3c提供肌内注射aavrh74.mhck7构建体后骨骼肌力量测量和微肌营养不良蛋白表达的量化。(a)用aavrh74.mhck7构建体向mdx小鼠的胫骨前肌注射1×1011vg(n=5)。六周后,收获胫骨前肌并进行体内力测量。给药的群组比未治疗的mdx对照具有显著更大的力产生。
图4a-4c显示全身施用aavrh.74.mhck7.微肌营养不良蛋白构建体后骨骼、膈肌和心肌纤维的广泛转导。(a)在治疗12周后,通过尾静脉用6×1012vg(2×1014vg/kg)的aavrh.74.mhck7.微肌营养不良蛋白在6周龄时全身处理mdx小鼠。(b)微肌营养不良蛋白的染色显示了在每个组织中表达微肌营养不良蛋白的肌纤维百分比的定量。(c)显示在低和高(计划临床)剂量下在隔膜中测量的比力量。低剂量时未见明显差异;然而,高剂量有显著改善。
图5显示了全身递送aavrh.74.mhck7.微肌营养不良蛋白构建体后肌营养不良蛋白的表达。mdx小鼠(n=5)在6周龄时通过尾静脉用6×1012vg的aavrh.74.mhck7.微肌营养不良蛋白进行全身处理。治疗12周后,收集所有肌肉并染色肌营养不良蛋白和恢复dapc组分(显示β-肌聚糖蛋白)。
图6a-6d显示了aavrh.74.mhck7的毒理学/安全性。在以下肌肉组织上进行苏木精和伊红(h&e)染色以分析毒性:胫骨前肌(ta)、腓肠肌(gas)、股四头肌(qd)、腰肌(pso)、肱三头肌(tri)和膈肌(dia)(图6a)。没有发现毒性。作为功效的指标,量化具有中心放置的细胞核(cn)的肌纤维的数量(图6b)。cn指示肌肉退化和再生的循环,因此cn的减少表明治疗效果。(图6c)表明纤维总数随处理而变化。(d)中提供肌酸激酶的量,显示高剂量下的改善。独立的t检验用于定位差异(p<.05);数据报告为平均值±sem。
图7显示了paav.mck.微肌营养不良蛋白质粒构建体。
图8提供了raavrh74.mck.微肌营养不良蛋白(人)效力测定的结果。mdx小鼠的胫骨前肌用3×109、3×1010或1×1011vg注入(每组n=3)。四周后收获肌肉并用n-末端dys3抗体染色肌营养不良蛋白表达。表达和剂量之间存在线性相关性,在3×109vg下表达非常少(无效应水平),在1×1011vg时表达为89%。
图9a-9c表明人微肌营养不良蛋白改善了力的产生和对偏心收缩引起的损伤的保护。(a)趾长伸肌(edl)和ta中的肌营养不良蛋白免疫染色显示经由股动脉注射raavrh.74-mck-微肌营养不良蛋白(人)后mdx肌纤维中的表达。模拟感染的肌肉以相同的方式染色,并且暴露是时间匹配的。(b)相对于模拟治疗的mdx肌肉,raavrh.74-mck-微肌营养不良蛋白显著增加归一化的比力量(对比mdx,p<0.05)。(c)将raavrh.74-mck-微肌营养不良蛋白(人)感染的mdx肌肉与模拟感染的对侧mdxedl肌肉和wt(wtc57bl/10)edl肌肉比较其在基因转移后12周时重复性偏心收缩期间的力下降。与模拟治疗的mdx肌肉相比,raavrh.74-mck-微肌营养不良蛋白(micro-dys)治疗显著地阻止了力的损失(对比mdx,p<0.001)。错误是sem。
图10提供了核酸序列(seqidno:3raavrh74.mhck7.微肌营养不良蛋白)。
图11提供了核酸序列(seqidno:5)raavrh74.mck.微肌营养不良蛋白。
图12a-12b提供了对非人灵长类动物中aavrh74.mhck7.微肌营养不良蛋白的全身递送的免疫应答。(a)对aav衣壳和微肌营养不良蛋白肽库的elispot应答。cona是阳性对照,dmso是阴性对照。aavrh74有三个库,有四个特异于微肌营养不良蛋白的肽库。(b)针对载体衣壳的循环中和抗体的elisa阳性滴度。每两周从灵长类动物中分离血清并分析抗体滴度。报告的滴度对应于应答比≥2下的最后稀释度。
图13a-b显示了aavrh74.mhck7.微肌营养不良蛋白在恒河猴的全身递送。左侧肌肉中的抗flag免疫荧光染色显示出强烈的微肌营养不良蛋白表达。
图14显示了raavrh74.mhck7.微肌营养不良蛋白对转基因表达的全身治疗的效果。使用心脏、膈肌、腰肌和胫骨前肌(ta)中的n-末端肌营养不良蛋白抗体对微肌营养不良蛋白进行免疫荧光染色,显示在注射后3个月在中(6e12vg;2e14vg/kg)和高剂量(1.2e13vg;6e14vg/kg)处理的动物中的强烈表达。显示20x图像。
图15显示了用raavrh74.mhck7.微肌营养不良蛋白全身治疗对转基因表达的影响。使用腓肠肌、四头肌、三头肌和臀肌中的n-末端肌营养不良蛋白抗体对微肌营养不良蛋白进行免疫荧光染色,显示在注射后3个月在中(6e12vg;2e14vg/kg)和最高剂量(1.2e13vg;6e14vg/kg)处理的动物中的强烈表达。显示20x图像。
图16显示了用raavrh74.mhck7.微肌营养不良蛋白全身治疗对肌肉病理学的影响。(a)来自c57bl/6wt,mdx和raavrh74.mhck7.微肌营养不良蛋白治疗小鼠的膈肌、胫骨前肌、腓肠肌和四头肌的h&e染色(中剂量-2e14vg/kg;高剂量-6e14vg/kg),(b)平均纤维尺寸的定量表明所有组织的纤维尺寸标准化。****p<0.001,单因素anova;数据报告为平均值±sem。显示20x图像。
图17显示了用raavrh74.mhck7.微肌营养不良蛋白进行全身治疗对肌肉病理学的影响。(a)来自c57bl/6wt,mdx和raavrh74.mhck7.微肌营养不良蛋白治疗小鼠的三头肌、臀肌和腰肌的h&e染色(中剂量-2e14vg/kg;高剂量-6e14vg/kg),(b)定量平均纤维尺寸以剂量依赖的方式显示出较大的纤维。****p<0.001,单因素anova;数据报告为平均值±sem。显示20x图像。
图18显示了用raavrh74.mhck7.微肌营养不良蛋白全身治疗对中心成核的影响。剂量增加表明所有骨骼肌和膈肌的中心成核减少。双因素anova用于定位差异(p<0.05)。数据报告为平均值±sem。
图19显示了用raavrh74.mhck7.微肌营养不良蛋白全身治疗对对胶原蛋白沉积的影响。剂量增加说明膈肌中胶原蛋白累积(%)的减少。*p<0.05,单因素anova;数据报告为平均值±sem。显示20x图像。
图20显示了膈肌中力不足的校正。在治疗3或6个月后,收获隔膜肌条以测量比力量(以横截面积归一化)。治疗恢复力量到wt水平。*p<0.05。单因素anova用于确定与mdx-lr小鼠的差异。
图21显示了ta中力不足的校正。(a)治疗3-6个月后,收获ta肌肉(左和右)以测量比力量(以ta重量归一化)。治疗恢复力量到wt水平。(b)经过严格的偏心收缩协议,治疗使ta肌肉免于疲劳。*p<0.05。单因素anova用于确定与mdx-lr小鼠的差异。
图22提供了在iv递送raavrh74.mhck7.微肌营养不良蛋白后来自三只mdx小鼠的各种组织中的平均vg拷贝的分布。
图23。通过独立的cro(charlesriverlaboratories)分析ssaavrh74.mhck7.微肌营养不良蛋白全身注射的小鼠的血清化学物质和年龄匹配的对照组的血清化学物质,其显示所分析的所有化学物质的正常值。唯一的异常值是在mdx载体处理的动物[mdx-lr(乳酸林格氏液)]中注意到的升高的ast和alt,其通过治疗标准化。已知ast和alt在dmd中升高。alt=丙氨酸氨基转移酶,alp/k=碱性磷酸酶,ast=天冬氨酸氨基转移酶,bun=血尿素氮,b/c=血液与肌酸酐比,creat=肌酸,glu=葡萄糖,tp=总蛋白,tbil=总胆红素,dbil=直接胆红素
图24提供了来自raavrh74.mhck7.微肌营养不良蛋白全身注射的mdx小鼠的肌肉和器官的生物分布蛋白质印迹。
图25提供了pnlrep2-caprh74aav辅助质粒图谱。
图26提供了ad辅助质粒phelp。
具体实施方式
本发明提供了基因治疗载体,例如过表达人微肌营养不良蛋白的raav载体,和减少和预防肌营养不良患者纤维化的方法。在dmd诊断的最早年龄取肌肉活检揭示突出的结缔组织增生。肌肉纤维化以多种方式是有害的。它通过结缔组织屏障减少肌内营养物质的正常转运,减少血液流动并剥夺肌肉的血管来源的营养成分,并且通过肢体挛缩在功能上促进早期丧失行走。随着时间的推移,治疗挑战因肌肉中明显纤维化而成倍增加。这可以在比较连续时间点的结缔组织增殖的肌肉活组织检查中观察到。这一过程继续加剧,导致行走丧失和加速失控,特别是在依赖轮椅的患者中。
如果没有早期治疗,包括减少纤维化的平行方法,就不可能完全实现外显子跳跃、终止密码子通读或基因替代疗法的益处。如果没有减少肌肉纤维化的方法,即使是小分子或蛋白质替代策略也可能会失败。先前在用aav.微肌营养不良蛋白治疗的现有纤维化的老年mdx小鼠中的工作证明我们不能实现完全功能恢复(liu,m.等人,molther11,245-256(2005))。还已知dmd心肌病的进展伴随着心室壁中的瘢痕形成和纤维化。
如本文所使用的,术语“aav”是腺相关病毒的标准缩写。腺相关病毒是一种仅在细胞中生成的单链dna细小病毒,其中某些功能由共感染辅助病毒提供。目前已经表征了十三种aav血清型。aav的基本信息和综述可以在例如carter,1989,《细小病毒手册(handbookofparvoviruses)》,第1卷,第169到228页和berns,1990,《病毒学(virology)》,第1743到1764页,raven出版社,(纽约)中找到。然而,完全可以预期这些相同的原理将可应用于额外aav血清型,这是由于众所周知的是,各种血清型在结构和功能上均紧密相关,甚至在基因水平下亦是如此。(参见例如,blacklowe,1988,《细小病毒和人类疾病(parvovirusesandhumandisease)》,第165到174页,j.r.pattison编辑;和rose,comprehensivevirology3:1-61(1974))。例如,所有aav血清型均明显地展现出非常类似的由同源rep基因介导的复制特性;并且全部具有三种相关的衣壳蛋白,如在aav2中表达的那些蛋白。相关性程度还进一步由异源双链体分析所表明,所述异源双链体分析显示血清型之间沿基因组长度具有广泛的交叉杂交;并且在末端处存在相似的自退火片段,所述自退火片段对应于“反向末端重复序列”(itr)。类似的感染性模式还表明每种血清型的复制功能处于类似的调节控制下。
如本文所使用的,“aav载体”指包含侧翼是aav末端重复序列(itr)的一种或多种感兴趣的多核苷酸(或转基因)的载体。当存在于已被对rep和cap基因产物进行编码和表达的载体转染的宿主细胞中时,这种aav载体可以被复制并包装成传染性病毒颗粒。
“aav病毒体”或“aav病毒颗粒”或“aav载体颗粒”是指由至少一种aav衣壳蛋白和衣壳化的多核苷酸aav载体构成的病毒颗粒。如果所述颗粒包括异源多核苷酸(即,除野生型aav基因组以外的多核苷酸,如待递送给哺乳动物细胞的转基因),则其通常被称为“aav载体颗粒”或简单地“aav载体”。因此,aav载体颗粒的产生必然包含产生aav载体,如此aav载体颗粒内含有载体。
aav
本发明的重组aav基因组包含本发明的核酸分子和侧接核酸分子的一个或多个aavitr。raav基因组中的aavdna可来自任何可衍生重组病毒的aav血清型,包括但不限于aav血清型aavrh.74、aav-1、aav-2、aav-3、aav-4、aav-5、aav-6、aav-7、aav-8、aav-9、aav-10、aav-11、aav-12和aav-13。在例如wo01/83692中公开了假型raav的产生。还考虑了其它类型的raav变体,例如具有衣壳突变的raav。参见,例如,marsic等人,《分子治疗》,22(11):1900-1909(2014)。如上文背景技术部分所述,各种aav血清型的基因组的核苷酸序列是本领域已知的。为了启动骨骼肌特异性表达,可使用aav1、aav6、aav8或aavrh.74。
本发明的dna质粒包含本发明的raav基因组。将dna质粒转移到允许用aav的辅助病毒(例如腺病毒、e1缺失的腺病毒或疱疹病毒)感染的细胞中,以将raav基因组装配成感染性病毒颗粒。产生raav颗粒的技术是本领域中的标准,其中待包装的aav基因组、rep和cap基因以及辅助病毒功能被提供给细胞。raav的产生需要以下组分存在于单个细胞内(在本文中表示为包装细胞):raav基因组、与raav基因组分开(即不在其中)的aavrep和cap基因,以及辅助病毒功能。aavrep和cap基因可来自任何可衍生重组病毒的aav血清型,并且可来自与raav基因组itr不同的aav血清型,包括但不限于aav血清型aav-1、aav-2、aav-3、aav-4、aav-5、aav-6、aav-7、aavrh.74、aav-8、aav-9、aav-10、aav-11、aav-12和aav-13。假型raav的产生在例如wo01/83692中公开,其通过引用整体并入本文。
产生包装细胞的方法是创建稳定表达aav颗粒产生的所有必需组分的细胞系。例如,包括缺乏aavrep和cap基因的raav基因组的质粒(或多个质粒)、与raav基因组分开的aavrep和cap基因、以及如新霉素抗性基因等可选择的标记整合到细胞的基因组中。已经通过如gc拖尾等程序将aav基因组引入细菌质粒中(samulski等人,1982,《美国国家科学院院刊(proc.natl.acad.sci.usa)》,79:2077-2081),添加含有限制性核酸内切酶切割位点的合成连接子(laughlin等人,1983,《基因(gene)》,23:65-73)或通过直接平末端连接(senapathy和carter,1984,《生物化学期刊(j.biol.chem.)》,259:4661-4666)。然后用如腺病毒等辅助病毒感染包装细胞系。此方法的优点是细胞为可选择的并且适合于大大规模生产raav。合适方法的其他实例采用腺病毒或杆状病毒而非质粒将raav基因组及/或rep及cap基因引入包装细胞。
raav产生的一般原理评论于例如carter,1992,《生物技术当前述评(currentopinionsinbiotechnology)》,1533-539;及muzyczka,1992,《微生物学及免疫学的当前课题(curr.topicsinmicrobial.andimmunol.)》,158:97-129)中评论。各种方法描述于ratschin等人,《分子与细胞生物学(mol.cell.biol.)》4:2072(1984);hermonat等人,《美国国家科学院院刊》,81:6466(1984);tratschin等人,《分子与细胞学》5:3251(1985);mclaughlin等人,《病毒学期刊》,62:1963(1988)以及lebkowski等人,《分子与细胞生物学》,7:349(1988)。samulski等人,《病毒学期刊》,63:3822-3828(1989);美国专利号5,173,414;wo95/13365和对应美国专利号5,658.776;wo95/13392;wo96/17947;pct/us98/18600;wo97/09441(pct/us96/14423);wo97/08298(pct/us96/13872);wo97/21825(pct/us96/20777);wo97/06243(pct/fr96/01064);wo99/11764;perrin等人《疫苗(vaccine)》13:1244-1250(1995);paul等人《人类基因疗法(humangenetherapy)》4:609-615(1993);clark等人《基因疗法(genetherapy)》3:1124-1132(1996);美国专利号5,786,211;美国专利号5,871,982;以及美国专利号6,258,595中。前述文献在此以全文引用的方式并入本文中,特别强调与raav产生有关的文献的那些部分。
因此,本发明提供产生感染性raav的包装细胞。在一个实施例中,包装细胞可为稳定转化的癌细胞,如hela细胞、293细胞和perc.6细胞(同源293系)。在另一个实施方案中,包装细胞是不为转化的癌细胞的细胞,如低传代293细胞(用腺病毒e1转化的人胚肾细胞)、mrc-5细胞(人胚成纤维细胞)、wi-38细胞(人胚成纤维细胞)、vero细胞(猴肾细胞)和frhl-2细胞(恒河猴胚肺细胞)。
本发明的重组aav(即,感染性衣壳化raav颗粒)包含raav基因组。在示例性实施方案中,两种raav的基因组缺乏aavrep和capdna,即,在基因组的itr之间不存在aavrep或capdna。可构建为包含本发明的核酸分子的raav的实例陈述于通过引用以其整体并入本文的国际专利申请号pct/us2012/047999(wo2013/016352)。
在一个示例性实施方案中,本发明的所述重组aav载体通过三重转染方法产生(xiao等人,jvirol72,2224-2232(1998),其使用aav载体质粒paav.mhck7.微肌营养不良蛋白、pnlrep2-caprh74和phelp,paav包含在aav2反向末端重复序列(itr)侧翼的微肌营养不良蛋白基因表达盒。正是这个序列被衣壳化到aavrh74病毒粒子中。该质粒含有微肌营养不良蛋白序列和肌肉特异性启动子的mhck7增强子和核心启动子元件,以驱动基因表达。表达盒还含有sv40内含子(sd/sa)以促进高水平基因表达,并且牛生长激素多腺苷酸化信号用于有效的转录终止。
pnlrep2-caprh74是aav辅助质粒,其编码来自血清型rh74的4种野生型aav2rep蛋白和3种野生型aavvp衣壳蛋白。所述pnlrep2-caprh74质粒的示意图图谱示于错误!未发现参考源25。
phelp腺病毒辅助质粒为11,635bp,从appliedviromics获得。质粒含有对aav复制很重要的腺病毒基因组区域,即e2a、e4orf6和varna(腺病毒e1功能由293个细胞提供)。存在于该质粒中的腺病毒序列仅占腺病毒基因组的约40%,并且不含有对复制至关重要的顺式元件,例如腺病毒末端重复序列。因此,预计不会从这种生产系统产生感染性腺病毒。.phelp质粒的示意图图谱示于图26。
raav可以通过本领域标准方法纯化,如通过柱色谱法或氯化铯梯度。从辅助病毒中纯化raav载体的方法是本领域已知的,并且包含在例如clark等人,《人类基因疗法》,10(6):1031-1039(1999);schenpp和clark,《分子医学方法(methodsmol.med.)》,69:427-443(2002);美国专利号6,566,118和wo98/09657。
在另一个实施方案中,本发明涉及包含本发明的raav的组合物。本发明的组合物包含raav和药学上可接受的载剂。组合物还可包含其它成分,如稀释剂和佐剂。可接受的载体、稀释剂和佐剂对接受者是无毒的,并且优选在所用的剂量和浓度下是惰性的,包括缓冲剂和表面活性剂,例如pluronics。
在本发明的方法中待给药的raav的滴度将根据例如特定raav、给药方式、医治目标、个体和靶向的一种或多种细胞类型而变化,并且可通过本领域标准的方法确定。raav的滴度范围可为每毫升约1×106、约1×107、约1×108、约1×109、约1×1010、约1×1011、约1×1012、约1×1013至约1×1014或更多dnase抗性颗粒(drp)。剂量也可以病毒基因组(vg)为单位表达。
本发明考虑体内或体外用raav转导靶细胞的方法。体内方法包含向有需要的动物(包括人类)给药有效剂量或有效多剂量的包含本发明的raav的组合物的步骤。如果在病症/疾病发展之前给药剂量,则给药是预防性的。如果在病症/疾病发展之后给药剂量,则给药是治疗性的。在本发明的实施方案中,有效剂量是减轻(消除或降低)与正在医治的病症/疾病状态相关的至少一种症状、减缓或预防进展至病症/疾病状态、减缓或预防病症/疾病状态的进展、减少疾病的程度、导致疾病的缓解(部分或全部),和/或延长存活的剂量。预期用本发明的方法预防或医治的疾病的实例是dmd。
本发明还考虑组合疗法。如本文使用的组合包括同时医治和顺序医治两者。特别考虑本发明方法与标准医药医治(例如皮质类固醇)的组合,以及与新疗法的组合。
给药有效剂量的组合物可通过本领域标准的途径,包括但不限于肌内、肠胃外、静脉内、口服、口腔、鼻、肺、颅内、骨内、眼内、直肠或阴道。考虑到感染和/或正在医治的疾病状态和要表达微肌营养不良蛋白的一个或多个靶细胞/组织,本领域技术人员可选择和/或匹配本发明的raav的aav组分(特别是aavitr和衣壳蛋白)的一个或多个给药途径和一种或多种血清型。
本发明提供有效剂量的raav和本发明组合物的局部给药和全身给药。举例来说,全身给药是给药到循环系统,使得整个身体受到影响。全身给药包括肠内给药,如通过胃肠道吸收和通过注射、输注或植入进行肠胃外给药。
特别地,本发明的raav的实际给药可通过使用将raav重组载体转运到动物的靶组织中的任何物理方法来实现。根据本发明的给药包括但不限于注射到肌肉和注射到血流。简单地将raav重新悬浮在磷酸盐缓冲盐水中已经证明足以提供可用于肌肉组织表达的载体,并且对可与raav共同给药的载体或其它组分没有已知的限制(尽管降解dna的组合物应使用raav以正常方式避免)。可修饰raav的衣壳蛋白,使得raav靶向感兴趣的特定靶组织,如肌肉。参见,例如,wo02/053703,其公开内容以引用的方式并入本文中。药物组合物可制备成可通过透皮转运递送至肌肉的注射制剂或局部制剂。许多用于肌内注射和透皮转运两者的制剂先前已经被开发,并且可用于本发明的实践中。raav可与任何药学上可接受的载剂一起使用,以便于给药和处理。
在本文公开的方法中待给药的raav的剂量将根据例如特定raav、给药方式、医治目标、个体和靶向的一种或多种细胞类型而变化,并且可通过本领域标准的方法确定。施用的每种raav的滴度范围可为从每毫升约1×106、约1×107、约1×108、约1×109、约1×1010、约1×1011、约1×1012、约1×1013、约1×1014或至约1×1015或更多dnase抗性颗粒(drp)。剂量也可以以病毒基因组(vg)为单位表示(即分别地1×107vg、1×108vg、1×109vg、1×1010vg、1×1011vg、1×1012vg、1×1013vg、1×1014vg、1×1015)。剂量也可以以每千克(kg)体重的病毒基因组(vg)为单位表示(即分别地1×1010vg/kg、1×1011vg/kg、1×1012vg/kg、1×1013vg/kg、1×1014vg/kg、1×1015vg/kg)。滴定aav的方法描述于clark等人,hum.genether.,10:1031-1039(1999)。
特别地,本发明的raav的实际给药可通过使用将raav重组载体转运到动物的靶组织中的任何物理方法来实现。根据本发明的给药包括但不限于注射到肌肉和注射到血流。简单地将raav重新悬浮在磷酸盐缓冲盐水中已经证明足以提供可用于肌肉组织表达的载体,并且对可与raav共同给药的载体或其它组分没有已知的限制(尽管降解dna的组合物应使用raav以正常方式避免)。可修饰raav的衣壳蛋白,使得raav靶向感兴趣的特定靶组织,如肌肉。参见,例如,wo02/053703,其公开内容以引用的方式并入本文中。药物组合物可制备成可通过透皮转运递送至肌肉的注射制剂或局部制剂。许多用于肌内注射和透皮转运两者的制剂先前已经被开发,并且可用于本发明的实践中。raav可与任何药学上可接受的载剂一起使用,以便于给药和处理。
为了肌内注射的目的,可采用佐剂如芝麻油或花生油或丙二醇水溶液,以及无菌水溶液。如果期望,则可缓冲这类水溶液,并且首先用盐水或葡萄糖使液体稀释剂等渗。作为游离酸的raav溶液(dna含有酸性磷酸酯基团)或药理学上可接受的盐可在适当地与表面活性剂如羟丙基纤维素混合的水中制备。还可在甘油、液体聚乙二醇及其混合物和油中制备raav的分散液。在通常的储存和使用条件下,这些制剂含有防腐剂以预防微生物的生长。在这方面,采用的无菌含水介质都可通过本领域技术人员熟知的标准技术容易地获得。
适于可注射使用的药物载体、稀释剂或赋形剂包括无菌水溶液或分散液和用于临时制备无菌可注射溶液或分散液的无菌粉末。在所有情况下,所述形式必须是无菌的并且流动性必须达到存在流畅注射能力的程度。它必须在制造和储存条件下稳定,并且必须防止微生物如细菌和真菌的污染作用。载体可为溶剂或分散介质,其含有例如水、乙醇、多元醇(例如甘油、丙二醇、液体聚乙二醇等)、其合适的混合物和植物油。举例来说,通过使用如卵磷脂的涂层、通过在分散液的情况下维持所需的粒度和通过使用表面活性剂,可维持适当的流动性。可通过各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等来预防微生物的作用。在许多情况下,将优选包括等渗剂,例如糖或氯化钠。通过使用延迟吸收的试剂,例如单硬脂酸铝和明胶,可实现可注射组合物的延长吸收。
根据需要,通过将raav以所需量掺入带有上面列举的各种其它成分的适当溶剂中来制备无菌可注射溶液,然后过滤灭菌。通常,通过将灭菌的活性成分掺入无菌载体中来制备分散液,所述无菌载体含有基础分散介质和来自上面列举的那些的所需其它成分。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥技术,其产生活性成分的粉末加上来自其先前无菌过滤溶液的任何附加期望成分。
用raav转导也可体外进行。在一个实施例中,从受试者中取出期望的靶肌肉细胞,用raav转导并且重新引入受试者。或者,可使用同基因或异基因肌肉细胞,其中这些细胞将不在受试者中产生不适当的免疫应答。
用于将转导细胞转导和重新引入受试者的合适方法是本领域已知的。在一个实施例中,可通过将raav与肌肉细胞组合(例如,在适当的培养基中)体外转导细胞,并且使用常规技术如southern印迹和/或pcr,或通过使用选择标记来筛选具有感兴趣的dna的那些细胞。然后可将转导的细胞配制成药物组合物,并且通过各种技术将组合物引入受试者,如通过肌内、静脉内、皮下和腹膜内注射,或通过使用例如导管来注射到平滑肌和心肌中。
用本发明的raav转导细胞导致微肌营养不良蛋白的持续表达。因此,本发明提供向动物,优选人类给药/递送表达微肌营养不良蛋白的raav的方法。这些方法包括用一种或多种本发明的raav转导组织(包括但不限于如肌肉的组织、如肝脏和脑的器官,以及如唾液腺的腺体)。转导可用包含组织特异性控制元件的基因盒进行。举例来说,本发明的一个实施方案提供转导由肌特异性控制元件指导的肌肉细胞和肌肉组织的方法,所述控制元件包括但不限于衍生自肌动蛋白和肌球蛋白基因家族,如衍生自myod基因家族的控制元件(参见weintraub等人,《科学(science)》,251:761-766(1991));肌细胞特异性增强子结合因子mef-2(cserjesi和olson,《分子细胞生物学》11:4854-4862(1991));衍生自人骨骼肌动蛋白基因(muscat等人,《分子细胞生物学》,7:4089-4099(1987))、心肌肌动蛋白基因的控制元件;肌肉肌酸激酶序列元件(参见johnson等人,《分子细胞生物学》,9:3393-3399(1989))和鼠肌酸激酶增强子(mck)元件;衍生自骨骼快速颤搐肌钙蛋白c基因、慢速颤搐心肌肌钙蛋白c基因和慢速颤搐肌钙蛋白i基因的控制元件:缺氧诱导的核因子(semenza等人,《美国国家科学院院刊(procnatlacadsciusa)》,88:5680-5684(1991));类固醇诱导的包括糖皮质激素应答元件(gre)的元件和启动子(参见mader和white,proc.natl.acad.sci.usa90:5603-5607(1993))以及其他控制元件。
肌肉组织是体内dna递送的有吸引力的靶标,因为它不是至关重要的器官并且易于接近。本发明考虑从转导的肌纤维中持续表达微肌营养不良蛋白。
“肌肉细胞”或“肌肉组织”意指衍生自任何种类的肌肉(例如,骨骼肌和平滑肌,例如来自消化道、膀胱、血管或心脏组织)的细胞或细胞群。这类肌肉细胞可为分化的或未分化的,如成肌细胞、肌细胞、肌管、心肌细胞和成心肌细胞。
术语“转导”是用来指经由本发明的复制缺陷型raav将微肌营养不良蛋白的编码区域体内或体外给药/递送到受体细胞,导致受体细胞表达微肌营养不良蛋白。
因此,本发明提供向有需要的患者给药有效剂量(或基本上同时给药的多个剂量或间隔给予的多个剂量)的编码微肌营养不良蛋白的raav的方法。
实施例
实施例1
产生paav.mhck7.微肌营养不良蛋白构建体
paav.mhck7.微肌营养不良蛋白质粒含有侧翼为aav2反向末端重复序列(itr)的人微肌营养不良蛋白cdna表达盒(参见图1)。微肌营养不良蛋白构建体的特征在于框内杆缺失(r4-r23),而铰链1、2和4和富含半胱氨酸的结构域仍然产生138kda蛋白质。微肌营养不良蛋白(3579bp)的表达由mhck7启动子(795bp)引导。通过除去mck启动子并插入mhck7启动子,从paav.mck.微肌营养不良蛋白质粒构建质粒。在核心启动子之后,存在53bp内源小鼠mck外显子1(未翻译的)用于有效的转录起始,接着是sv40晚期16s/19s剪接信号(97bp)和小的5'utr(61bp)。内含子和5'utr衍生自质粒pcmvβ(clontech)。微肌营养不良蛋白盒在atg开始前立即具有共识kozak,以及用于mrna终止的小的53bp合成polya信号。人微肌营养不良蛋白盒包含如先前harper等人描述的(r4-r23/δ71-78)结构域(naturemedicine8,253-261(2002))。将互补dna对人类使用进行了进行密码子优化并由genscript(piscataway,nj)(molther18,109-117(2010))合成。该载体中包含的唯一病毒序列是aav2的反向末端重复,其是病毒dna复制和包装所必需的。微肌营养不良蛋白盒具有用于mrna终止的小的53bp合成polya信号。
先前的研究证实使用mhck7启动子的心肌表达(salva等人,molther15,320-329(2007)和aavrh74实现骨骼、隔肌和心肌表达(sondergaard等人annalsofclinicalandtranslneurology2,256-270(2015))。图1中构建体的序列被衣壳化进入aavrh.74病毒体。从恒河猴猕猴淋巴结中克隆aavrh.74血清型的分子克隆,并在rodino-klapac等人journaloftranslationalmedicine5,45(2007)中描述。
表1显示了质粒paav.mhck7.微抗肌萎缩蛋白(seqidno:3)的分子特征
实施例2
使用raav.mhck7.微肌营养不良蛋白进行肌肉内表达研究
通过肌内注射,用人微肌营养不良蛋白构建体(raavrh74.mhck7.微肌营养不良蛋白;在实施例1描述)进行表达研究。将mdx小鼠(不表达肌营养不良蛋白的自发性dmdmdx突变小鼠)的胫骨前肌注射1×1011vg的盒(每组n=5)。六周后收获肌肉并用肌营养不良蛋白和苏木精和伊红(he)染色的n-末端抗体染色以进行肌营养不良蛋白(dys3)表达。图2显示了与未处理的肌肉相比,具有1×1011vg剂量的中心定位的核中的弥散基因表达和减少。此外,在用微肌营养不良蛋白构建体治疗后,观察中央成核的降低与平均纤维/框的增加。raavrh74.mhck7.微肌营养不良蛋白构建体的表达水平定量为约73%。
除了测量微肌营养不良蛋白定位和表达水平之外,在肌内注射盒后测量骨骼肌力。与未处理的对照相比,paav.mhck7.微肌营养不良蛋白构建体的肌肉内表达导致显著更大的绝对和特定的力产生(分别地图3a和3b)。
实施例3
将raavrh.74.mhck7.微肌营养不良蛋白全身递送至mdx小鼠
通过尾静脉将2x1012vg(8x1013vg/kg)或高剂量(计划临床剂量)6x1012vg(2x1014vg/kg)raavrh.74.mhck7.微肌营养不良蛋白在6周龄时注射至mdx小鼠组。治疗12周后,收集所有肌肉并染色肌营养不良蛋白和恢复dapc组分。全身注射(尾静脉)小鼠在所有肌肉中显示肌营养不良蛋白的高水平染色。图4a表示在6×1012vg(2×1014vg/kg)全身剂量后骨骼、膈肌和心肌纤维的广泛转导。图4b显示了在每个组织中表达微肌营养不良蛋白的肌纤维百分比的定量。最后测试隔肌的功能改进(图4c)。低剂量时未见明显差异;然而,高剂量有显著改善。重要的是,图5表明dapc的其他组分在微肌营养不良蛋白递送后完全恢复。显示的是β-肌聚糖蛋白(b-sg)。
aavrh.74.mhck7.微肌营养不良蛋白的毒理学/安全性通过按表2将载体通过静脉内(i.v.)注射给予mdx小鼠的尾静脉来评估。在所分析的任何肌肉组织中都没有毒性证据,包括:胫骨前肌(ta)、腓肠肌(gas)、股四头肌(qd)、腰肌(pso)、肱三头肌(tri)和膈肌(dia)(图6a和图6b)。随着高剂量6×1012vg(2×1014vg/kg),中心放置的细胞核数量减少。在历史上,未经治疗的年龄匹配的mdx小鼠的骨骼肌的中心成核平均为~80%。最后,来自小样本量(n=3)的初步数据表明高剂量处理小鼠(d)的血清中ck释放水平(u/l)降低。独立的t检验用于定位差异(p<.05);数据报告为平均值±sem。
表2.小鼠中raavrh.74.mhck7.微肌营养不良蛋白的毒理学/安全性研究概述。
实施例4
paav.mck.微肌营养不良蛋白构建体的产生
通过将驱动密码子优化的人微肌营养不良蛋白cdna序列的mck表达盒插入aav克隆载体psub201中构建paav.mck.微肌营养不良蛋白质粒(samulski等,j.virol.61(10):3096-3101)。肌肉特异性调节元件包含在构建体中以驱动肌肉特异性基因表达。该调节元件包含与351bpmck核心启动子(近端)融合的小鼠mck核心增强子(206bp)。在核心启动子后,构建体包含53bp内源小鼠mck外显子1(非翻译)用于有效转录起始,接着是sv40晚期16s/19s剪接信号(97bp)和小的5'utr(61bp)。内含子和5'utr衍生自质粒pcmvβ(clontech)。微肌营养不良蛋白盒在atg开始前立即具有共识kozak,以及用于mrna终止的小的53bp合成polya信号。人微肌营养不良蛋白盒包含如先前harper等人nat.med.8(3):253-61,2002描述的(r4-r23/δ71-78)结构域。
paav.mck.微肌营养不良蛋白质粒含有侧翼为aav2反向末端重复序列(itr)的人微肌营养不良蛋白cdna表达盒(参见图7)。将该序列衣壳化到aavrh.74病毒粒子中。从恒河猴猕猴淋巴结中克隆aavrh.74血清型的分子克隆,并在rodino-klapac等人journaloftran.med.45(2007)中描述。
实施例5
使用raav.mck.微肌营养不良蛋白的效力和剂量分析
通过肌内注射,用人微肌营养不良蛋白构建体(raav.mck.微肌营养不良蛋白;在实施例1描述)进行表达研究。将mdx小鼠(不表达肌营养不良蛋白的自发性dmdmdx突变小鼠)的胫骨前(ta)肌注射3×109、3×1010或1×1011vg(每组n=3)。四周后,收获肌肉并使用对n-末端dys3和苏木精和伊红(he)染色特异的抗体对肌营养不良蛋白表达进行染色。图8显示了表达和剂量之间的线性相关性,其中在3×109vg下表达非常少(无效应水平),在1×1011vg时表达为89%。
实施例6
血管递送raav.mck.微肌营养不良蛋白至mdx小鼠
使用孤立的肢体灌注模型(rodino-klapac等人,j.trans.med.5(45):1-11,2007),将mdx小鼠(n=10)经股动脉注射1×1011vg的raavrh.74.mck.微肌营养不良蛋白并进行结果分析。基因转移后3个月,收获下肢肌肉,并且功效研究表明力和抗偏心收缩诱导的损伤均显著改善(图9)。
在raavrh.74-mck-微肌营养不良蛋白处理后,在趾长伸肌(edl)肌肉和ta肌肉中的肌营养不良蛋白免疫染色显示在mdx肌纤维中的表达(图9a)。模拟感染的肌肉以相同的方式染色,并且暴露是时间匹配的。图9b证明相对于模拟治疗的mdx肌肉,raavrh.74-mck-微肌营养不良蛋白显著增加归一化的比力量(对比mdx,p<0.05)。此外,将感染raavrh.74-mck-微肌营养不良蛋白(人)的mdx肌肉与模拟感染的对侧mdxedl肌肉(蓝色)和野生型(wtc57bl/10)edl肌肉比较其在基因转移后12周在重复偏心收缩期间的力下降(图9c)。发现与模拟治疗的mdx肌肉相比,raavrh.74-mck-微肌营养不良蛋白(micro-dys)治疗显著地阻止了力的损失(对比mdx,p<0.001)。
实施例7
灵长类动物研究
为了将小鼠的临床前发现应用于临床范例,全身地给药至非人灵长类动物(nhp)以评估未来临床试验的安全性和有效性。在非人灵长类动物中研究通过头静脉静脉内递送的2×1014vg总剂量的aavrh74.mhck7.微肌营养不良蛋白.flag的效果。该剂量(基于动物重量)与给予小鼠的全身剂量成比例并且对应于给予小鼠的中剂量(6.0×1012vg的总剂量)。
进行基线化学和免疫学研究,包括酶联免疫吸附斑点测定(elispot)分析,以测量针对aavrh.74衣壳和微肌营养不良蛋白的t细胞以及抗aav抗体滴度。将三个肽库用于含有34-36个肽的aavrh.74衣壳蛋白(genemedsynthesis,sanantonio,tx),每个肽长18个氨基酸并且重叠11个残基。四个肽库包括微肌营养不良蛋白.flag蛋白(genemedsynthesis),每个长18个氨基酸,重叠11个残基。伴刀豆球蛋白a(cona)(sigma,1μg/ml)用作阳性对照,0.25%二甲基亚砜(dmso)用作阴性对照。对于整个研究,每两周重复这些研究。在处理后3个月,对动物实施安乐死以获得完整的组织尸检。免疫学测定未显示elispot对衣壳或转基因的任何意外应答(图12a),并且通过elisa没有对aavrh74衣壳的意外抗体应答(图12b)。
此外,完整的全血细胞计数和化学组显示肝酶的轻微升高,将其归一化至基线而无需干预或治疗,如下表3所示。
表3
在整个研究期间没有其他意想不到的化学值。最后,通过使用flag特异性抗体的免疫荧光染色和使用抗肌营养不良蛋白的小鼠单克隆抗体的蛋白质印迹检测,对所有骨骼肌的全面分析表明在肌肉纤维中广泛表达(图14a,b)。
数据一起表明aavrh74.mhck7.微营养不良蛋白.flag的全身递送确立了安全性和功效,并且在非人灵长类动物的所有骨骼肌中广泛表达。
实施例8
证明功效的临床前研究
进行了临床前研究以证明raavrh74.mhck7.微肌营养不良蛋白全身递送在治疗mdx小鼠的骨骼肌和心肌缺陷中的功效。如实施例1中所述,含有由肌肉和心脏特异性启动子mhck7驱动的密码子优化的人微肌营养不良蛋白转基因的aavrh74载体用于该研究。
通过mdx(肌营养不良蛋白无效)小鼠中的尾静脉全身注射raavrh74.mhck7.微肌营养不良蛋白用于剂量反应研究。该研究的结果表明,mdx小鼠中的全身注射以剂量依赖性方式有效地使肢体和膈肌中测量的组织学和功能结果正常化。此外,在经过委员会认证的兽医病理学家进行正式组织病理学检查后,未报告显著的载体相关毒性。
本研究的载体由全国儿童医院病毒载体中心(nationwidechildren’shospitalviralvectorcore)利用hek293细胞的三重转染方法在研究级条件下产生。产生后载体的表征包括通过qpcr用超螺旋标准物测定滴度、内毒素水平测定(eu/ml)和无菌评估。通过sds-page分析产生的载体以验证与预期raav的条带模式一致性。使用含有微肌营养不良蛋白构建体的质粒、驱动表达的肌肉特异性mhck7启动子、共有kozak序列(ccacc)、sv40嵌合内含子、合成的多聚腺苷酸化位点(53bp)产生该载体(错误!未发现参考源)。将微肌营养不良蛋白表达盒克隆到包装在aavrh74载体中的aav2itr之间,用于增强骨骼和心脏组织的转导。
通过将载体肌内注射到mdx小鼠中实现raavrh74.mhck7.微肌营养不良蛋白测试物品的效力测定。野生型小鼠用作阳性对照,并将无菌乳酸林格液注射到mdx小鼠中作为阴性对照。
表4:raavrh74.mhck7.微肌营养不良蛋白研究设计概述
表4中所示的动物在指定的年龄(4-5周龄)给药,尾静脉注射用于全身递送。为了通过肌内注射进行准确的给药,通过吸入异氟醚短暂地麻醉动物。通过直接注射到下肢的胫骨前肌来施用剂量。对于全身给药的准确给药,不需要麻醉。剂量由脉管系统通过尾静脉施用。注意将整个载体剂量准确地沉积到血管中。在进行给药后,将动物置于加热垫上直至恢复自发运动,然后返回笼中。在整个研究期间每周进行每只动物的观察。
在表4中列出的适当年龄下,小鼠过量服用氯胺酮/甲苯噻嗪混合物(200mg/kg/20mg/kg)。通过心脏穿刺收集血液,并将全血送至全血细胞计数(cbc)分析,并将血清储存在-80℃直至charlesriverslaboratory分析血清化学性质。然后收集组织并送去由独立的兽医组织病理学家和内部分析。
在1x1011vg总剂量下肌内递送raavrh74.mhck7.微肌营养不良蛋白至肌营养不良蛋白缺失小鼠导致注射的ta肌肉中约70%的肌营养不良蛋白表达。载体给药小鼠的免疫荧光成像证实了微肌营养不良蛋白基因的表达。
raavrh74.mhck7.微肌营养不良蛋白全身治疗后肌营养不良蛋白表达的恢复
raavrh74.mhck7.微肌营养不良蛋白测试物品的功效测定通过在mdx小鼠(基因型:c57bl/10scsn-dmdmdx/j)中使用低剂量、中剂量和高剂量(2.0x1012vg总剂量;6.0x1012vg总剂量;1.2x1013vg总剂量)的剂量递增进行全身注射来实现,以在注射后3个月和6个月的时间点全身递送时评估载体的转基因表达和功效。在4-5周龄时注射小鼠,并在注射后3个月和6个月进行完全尸检。基于每组的平均动物重量,这些剂量等于:8×1013vg/kg、2×1014vg/kg和6×14vg/kg。注射等体积的乳酸林格氏液作为阴性对照。将等体积的乳酸林格氏液注射到c57bl/6小鼠中作为阳性对照。通过在剂量为6.0×1012vg总剂量的wt小鼠(表示为wttx-中剂量组)中进行全身注射来确定安全性。进行骨骼肌胫骨前肌(ta)、腓肠肌(gas)、股四头肌(quad)、臀肌(glut)、腰肌、肱三头肌(tri)、膈肌(dia)和心脏的免疫荧光染色以确定肌营养不良蛋白的恢复和确保raavrh74.mhck7.微肌营养不良蛋白的病毒载体的功效。
提取骨骼肌(ta、quad、glut、tri)以及心脏和膈肌进行分析。还去除了器官以进行毒理学和生物分布研究。处理3-6个月后,微肌营养不良蛋白转基因表达仍然很高。这伴随着改善的肌肉组织病理学和改善的功能,对脱靶器官没有不利影响。
在raavrh74.mhck7.微肌营养不良蛋白全身治疗的mdx小鼠中逆转营养不良蛋白表型
进行骨骼肌、膈肌和心脏的苏木精和伊红(h&e)染色以确定全身注射raavrh74.mhck7.微肌营养不良蛋白2x1012vg总剂量(低剂量;n=1)、6x1012vg总剂量(中剂量;n=8)和1.2x1013vg总剂量(高剂量;n=8)后的肌营养不良蛋白病理学的逆转和改善,对于每个剂量在注射后12周安乐死。在注射后24周,评估用中剂量(6×1012vg总剂量)处理的第二组动物的肌营养不良蛋白病理学的逆转和改善(n=5)。
人微肌营养不良蛋白的免疫荧光染色用于在注射了微肌营养不良蛋白载体的所有肌营养不良蛋白缺失小鼠中确定六个骨骼肌(ta、gas、quad、glut、腰肌、tri)以及膈肌和心脏的左侧和右侧的微肌营养不良蛋白转基因表达。这样做是为了确定肌营养不良蛋白的恢复并确保raavrh74.mhck7.微肌营养不良蛋白的病毒载体在2×1012vg总剂量(低剂量;n=2)、6×1012vg总剂量(中剂量;n=8)和1.2×1013vg总剂量(高剂量;n=8)的功效,每个剂量在注射后12周安乐死。
为了评估表达和转导效率,使用来自所有三个剂量组和每个肌肉的左侧和右侧的图像进行定量。对每个肌肉拍摄四个20x图像,并确定每个图像的微肌营养不良蛋白阳性纤维的百分比,得到每个肌肉的平均转导百分比。图14和15呈现了中间剂量(6×1012vg;2×1014vg/kg)和高剂量(1.2×1013vg;6×1014vg/kg)治疗的小鼠的代表性图像。包括注射了乳酸林格氏液并且年龄匹配的肌营养不良蛋白缺失小鼠用于阴性对照,并且包括注射了乳酸林格氏液的野生型小鼠用于阳性对照。在所有分析的动物中,心脏显示≥75%。
来自未治疗动物的肌肉表现出广泛的肌病,包括脂肪浸润、中心成核、纤维化和坏死的局灶区域。错误!未发现参考源16和错误!未发现参考源17中的h&e染色显示了与正常wt小鼠相比,肌营养不良蛋白缺失小鼠的这种肌营养不良表型以及中剂量(6×1012vg;2×1014vg/kg)或高剂量(1.2×1013vg;6×1014vg/kg)治疗后肌肉病理学的改善。组织学参数的定量显示中心成核的减少(图18)和治疗的小鼠中所有肌肉中平均纤维直径以剂量依赖性方式的标准化(错误!未发现参考源16和17)。与未治疗(mdxlr)组群相比,天狼星红(siriusred)染色显示中剂量组和高剂量组中膈膜中胶原蛋白沉积的减少(图19)。
用raavrh74.mhck7.微肌营养不良蛋白进行全身治疗的功能评估
为了确定微肌营养不良蛋白基因转移是否为患病肌肉提供功能强度益处,评估了三种剂量水平下mdx小鼠、wt小鼠和载体给药小鼠的膈肌和胫骨前肌的功能特性。剂量递增包括低剂量(8×1013vg/kg)、中剂量(2×1014vg/kg)和高剂量(6×1014vg/kg)。在以总剂量6x1012vg(中剂量)全身注射raavrh74.mhck7.微肌营养不良蛋白的动物中,在注射后24周利用ta中的偏心收缩后,使用比力的体外体内评估和力输出的减小,进行raavrh74.mhck7.微肌营养不良蛋白的全身治疗的功能评估。另外,在相同的动物中评估隔膜中的比力输出。
如先前图中所概述的,组织病理学表现出更加正常化的环境,其中中和高剂量的中心成核、胶原沉积和纤维尺寸得到改善。raavrh74.mhck7.微肌营养不良蛋白的尾静脉递送导致隔肌中比力输出逐步改善(中剂量组中为176.9mn/mm2与高剂量组中为227.78mn/mm2)。此外,长期治疗的群组代表注射(中剂量2×1014vg/kg)后6个月的小鼠,长期隔膜力输出没有偏差(176.9mn/mm2vs194.9mn/mm2)(错误!未发现参考源20)。
此外,与wt小鼠相比,观察到mdx小鼠中胫骨前肌的功能缺陷。与wt小鼠相比,mdx小鼠的力输出减少50%(171.3mn/mm2vs.291.65mn/mm2)并且在偏心收缩后损失更大的力(mdx损失32%;wt损失5%)。中剂量水平的raavrh74.mhck7.微肌营养不良蛋白的全身递送导致胫骨前肌中65.5%的肌营养不良蛋白和比力输出的恢复,其改善至235.4mn/mm2,并且以力仅减小25%保护肌肉免受重复的偏心收缩损伤(图21)。wt中剂量组代表野生型治疗组,以证明在载体处理后没有毒性并且维持功能结果测量。
总结
在通过肌内注射初步证明生物效能后,通过血管递送同时转导骨骼肌、膈肌和心脏,实现了相似或增加的微肌营养不良蛋白的恢复。该效力证明,通过减少炎症、减少退化纤维和通过防止胫骨前肌和膈肌中的偏心收缩来改善功能恢复,以剂量依赖性方式逆转了营养不良特征。载体的功能益处包括在膈肌和ta的力生成中逐步改善至野生型水平。
实施例9
raavrh74.mhck7.微肌营养不良蛋白进行全身治疗的毒理学和生物分布
收集给予全身注射raavrh74.mhck7.微肌营养不良蛋白的mdx小鼠的器官和组织用于实时定量pcr以检测载体dna的特定序列。从所有收集的器官和组织中提取的蛋白质在蛋白质印迹上运行以检测脱靶器官中的微肌营养不良蛋白。
通过在4-5周龄静脉途径,测试物以三个剂量水平给予:低(2×1012vg;8×1013vg/kg)、中(6×1012vg;8×1014vg/kg)和高剂量(1.2×1013vg;6×1014vg/kg)。为了评估载体的安全性,对肌肉组织的冷冻切片和从先前描述的相同组小鼠收获的所有主要器官进行h&e染色。还包括来自c57bl6wt小鼠的器官和肌肉,其在中剂量下用载体进行了全身治疗。还包括乳酸林格氏液处理的mdx和wt小鼠,用于组织病理学分析。这些部分由第三方、经过委员会认证的兽医病理学家正式审查毒性,并且在任何小鼠的任何样本中均未检测到任何副作用;结果总结如下。
小组细节和研究设计如下4所示。
表5:raavrh74.mhck7.微肌营养不良蛋白安全性研究设计
载体转导组织的组织病理学研究
静脉注射raavrh74.mhck7.微肌营养不良蛋白并未引起所检查的任何骨骼肌的肌纤维的任何微观变化。此外,在组织学评估的任何组织中均未观察到与治疗相关的病变。在治疗和对照小鼠中均观察到任何变化,并被认为是偶然发现。总之,这些数据表明该测试物被测试对象良好耐受。此外,相对于来自年龄匹配的未治疗的mdx小鼠的参考样本,施用raavrh74.mhck7.微肌营养不良蛋白减少了治疗的mdx小鼠中的肌纤维萎缩,因此表明该测试物可以改善与mdx缺乏相关的肌病程度。
除了检查用载体全身治疗的患病mdx小鼠外,还将raavrh74.mhck7.微肌营养不良蛋白全身递送至5只c57bl/6wt小鼠,其剂量与上述mdx小鼠研究中建立的最低效剂量(med)相同,为6x1012vg总剂量(2x1014vg/kg)。这允许研究在健康wt小鼠中静脉内递送测试物以更明确地确定是否仅由于治疗而产生任何副作用。这里再次收集各种骨骼肌,包括膈肌、心脏和其他五个器官,每个组织的h&e切片由独立的兽医病理学家正式审查。
载体基因组生物分布
使用实时定量pcr测定(qpcr)检查测试物特异性dna序列的存在。对每剂量水平从三只给予载体的mdx动物收集的组织样品进行生物分布分析。阳性信号是检测到的任何等于或大于100个单链dna拷贝/μg基因组dna。在尸体剖检时收获组织,并使用对mhck7启动子序列特异的载体特异性引物探针组。图22和下面的表6描绘了在来自注射raavrh74.mhck7.微肌营养不良蛋白的小鼠的每个组织样品中检测到的载体基因组拷贝。
表6:来自每剂量水平的三只给予载体的mdx小鼠的器官和肌肉中的载体基因组拷贝数。值以vg/μg基因组dna显示。
在所有收集的组织中检测到不同水平的raavrh74.mhck7.微肌营养不良蛋白转录物。正如预期的,在骨骼肌和心脏中观察到最高水平。在性腺、肺、肾和脾中检测到最低水平。这些数据表明测试物被有效地递送到载体给药小鼠的所有研究组织中。
正如上面的qpcr结果所示,静脉内递送raavrh74.mhck7.微肌营养不良蛋白导致大多数组织中载体转录物的分布水平不同,最高水平发生在肝脏、心脏和股四头肌(中剂量)和肝脏、心脏和腓肠肌(高剂量)。因此,该部分研究的目的是确定这些组织中人微肌营养不良蛋白转基因的蛋白质表达,以确保肌肉特异性mhck7启动子的功能。蛋白质印迹用于检测组织样品中的微肌营养不良蛋白表达。
还使用qpcr和蛋白质印迹评估蛋白质表达和载体生物分布(图23),并且这些数据表明在离体器官中的正常载体水平和在高剂量处理的肝脏中微肌营养不良蛋白的最小检测。这些结果与肝脏中病理学家确定的无毒性相关。另外,通过独立的cro(charlesriverlaboratories)分析血清化学,其指示所分析的所有化学物质的正常值。肝酶ast中存在三个异常值,其中2个在mdx-lr组中证实,1个在中剂量组中证实(图23)。一部分动物接受肌酸激酶分析(ck),然而,在生理学评估之前和之后分析样品。血清分析证实在测试物递送后缺乏毒性。
在所有骨骼肌样品以及心脏样品中观察到不同量的微肌营养不良蛋白表达(图24)。然而,在肝脏中高剂量组群中检测到的蛋白质最少。这被认为是良性结果,并且可能是肝脏中的存在是由于肝脏平滑肌中的表达。重要的是,肝脏中,独立病理学家报告没有表现出不良的组织病理学效应。
总结
组织病理学检查得出结论,mdx-lr组表现出广泛的肌病,影响所评估的所有七种骨骼肌以及心脏的右心室壁。组织病理学评价的主要发现包括明显和广泛的肌纤维萎缩(正常肌纤维大小的30-75%)、轻度至中度单核细胞炎症、间质空间增加和细胞质矿物质沉积增加。隔膜在单核细胞浸润和肌纤维萎缩中表现出最显著的变化。心脏在心室心肌中表现出一些最小单核细胞积聚的小病灶。载体给药组群在所有骨骼组织和心脏中均显著减少了肌病。组织病理学发现的减少是剂量依赖性的,高剂量组具有显著较少的变性和炎症。使用raavrh74.mhck7.微肌营养不良蛋白的载体处理没有副作用,如在wt处理的群组和载体给药mdx群组中记录的。无论治疗如何,在mdx和wt小鼠的肝和肺中都有偶然的发现,其中小鼠表现出肝细胞细胞质的轻度空泡化。因此,测试物是安全的、有效的并且保护作用是剂量依赖性的。
参考文献
1.hoffman,e.p.,brown,r.h.,jr.&kunkel,l.m.dystrophin:theproteinproductoftheduchennemusculardystrophylocus.cell51,919-928(1987)。
2.straub,v.&campbell,k.p.musculardystrophiesandthedystrophin-glycoproteincomplex.curropinneurol10,168-175(1997)。
3.sacco,a.等人,shorttelomeresandstemcellexhaustionmodelduchennemusculardystrophyinmdx/mtrmice.cell143,1059-1071(2010)。
4.wallace,g.q.&mcnally,e.m.mechanismsofmuscledegeneration,regeneration,andrepairinthemusculardystrophies.annurevphysiol71,37-57(2009)。
5.zhou,l.&lu,h.targetingfibrosisinduchennemusculardystrophy.jneuropatholexpneurol69,771-776(2010)。
6.desguerre,i.等人,endomysialfibrosisinduchennemusculardystrophy:amarkerofpooroutcomeassociatedwithmacrophagealternativeactivation.jneuropatholexpneurol68,762-773(2009)。
7.diprimio,n.,mcphee,s.w.&samulski,r.j.adeno-associatedvirusforthetreatmentofmusclediseases:towardclinicaltrials.curropinmolther12,553-560(2010)。
8.mendell,j.r.等人,sustainedalpha-sarcoglycangeneexpressionaftergenetransferinlimb-girdlemusculardystrophy,type2d.annneurol68,629-638(2010)。
9.mendell,j.r.等人,limb-girdlemusculardystrophytype2dgenetherapyrestoresalpha-sarcoglycanandassociatedproteins.annneurol66,290-297(2009)。
10.mendell,j.r.等人,aphase1/2afollistatingenetherapytrialforbeckermusculardystrophy.moleculartherapy:thejournaloftheamericansocietyofgenetherapy23,192-201(2015)。
11.carnwath,j.w.&shotton,d.m.musculardystrophyinthemdxmouse:histopathologyofthesoleusandextensordigitorumlongusmuscles.jneurolsci80,39-54(1987)。
12.coulton,g.r.,morgan,j.e.,partridge,t.a.&sloper,j.c.themdxmouseskeletalmusclemyopathy:i.ahistological,morphometricandbiochemicalinvestigation.neuropatholapplneurobiol14,53-70(1988)。
13.cullen,m.j.&jaros,e.ultrastructureoftheskeletalmuscleinthexchromosome-linkeddystrophic(mdx)mouse.comparisonwithduchennemusculardystrophy.actaneuropathol77,69-81(1988)。
14.dupont-versteegden,e.e.&mccarter,r.j.differentialexpressionofmusculardystrophyindiaphragmversushindlimbmusclesofmdxmice.musclenerve15,1105-1110(1992)。
15.stedman,h.h.等人,themdxmousediaphragmreproducesthedegenerativechangesofduchennemusculardystrophy.nature352,536-539(1991),
16.deconinck,a.e.等人,utrophin-dystrophin-deficientmiceasamodelforduchennemusculardystrophy.cell90,717-727(1997),
17.grady,r.m.等人,skeletalandcardiacmyopathiesinmicelackingutrophinanddystrophin:amodelforduchennemusculardystrophy.cell90,729-738(1997)。
18.love,d.r.等人,anautosomaltranscriptinskeletalmusclewithhomologytodystrophin.nature339,55-58(1989),
19.tinsley,j.m.等人,primarystructureofdystrophin-relatedprotein.nature360,591-593(1992)。
20.tinsley,j.等人,expressionoffull-lengthutrophinpreventsmusculardystrophyinmdxmice.natmed4,1441-1444(1998)。
21.squire,s.等人,preventionofpathologyinmdxmicebyexpressionofutrophin:analysisusinganinducibletransgenicexpressionsystem.hummolgenet11,3333-3344(2002)。
22.rafael,j.a.,tinsley,j.m.,potter,a.c.,deconinck,a.e.&davies,k.e.skeletalmuscle-specificexpressionofautrophintransgenerescuesutrophin-dystrophindeficientmice.natgenet19,79-82(1998)。
23.zhou,l.等人,haploinsufficiencyofutrophingeneworsensskeletalmuscleinflammationandfibrosisinmdxmice.jneurolsci264,106-111(2008),
24.gutpell,k.m.,hrinivich,w.t.&hoffman,l.m.skeletalmusclefibrosisinthemdx/utrn+/-mousevalidatesitssuitabilityasamurinemodelofduchennemusculardystrophy.plosone10,e0117306(2015)。
25.rodino-klapac,l.r.,etal.micro-dystrophinandfollistatinco-deliveryrestoresmusclefunctioninageddmdmodel.humanmoleculargenetics22,4929-4937(2013)。
26.nevo,y.等人,therasantagonist,farnesylthiosalicylicacid(fts),decreasesfibrosisandimprovesmusclestrengthindy/dymousemodelofmusculardystrophy.plosone6,e18049(2011)。
27.rodino-klapac,l.r.等人,atranslationalapproachforlimbvasculardeliveryofthemicro-dystrophingenewithouthighvolumeorhighpressurefortreatmentofduchennemusculardystrophy.jtranslmed5,45(2007)。
28.mulieri,l.a.,hasenfuss,g.,ittleman,f.,blanchard,e.m.&alpert,n.r.protectionofhumanleftventricularmyocardiumfromcuttinginjurywith2,3-butanedionemonoxime.circres65,1441-1449(1989)。
29.rodino-klapac,l.r.等人,persistentexpressionofflag-taggedmicrodystrophininnonhumanprimatesfollowingintramuscularandvasculardelivery.moleculartherapy:thejournaloftheamericansocietyofgenetherapy18,109-117(2010)。
30.grose,w.e.等人,homologousrecombinationmediatesfunctionalrecoveryofdysferlindeficiencyfollowingaav5genetransfer.plosone7,e39233(2012)。
31.liu,m.等人,adeno-associatedvirus-mediatedmicrodystrophinexpressionprotectsyoungmdxmusclefromcontraction-inducedinjury.molther11,245-256(2005)。
32.harper,s.q.等人,modularflexibilityofdystrophin:implicationsforgenetherapyofduchennemusculardystrophy.naturemedicine8,253-261(2002)。
33.rodino-klapac,l.r.等人,persistentexpressionofflag-taggedmicrodystrophininnonhumanprimatesfollowingintramuscularandvasculardelivery.molther18,109-117(2010).
34.salva,m.z.等人,designoftissue-specificregulatorycassettesforhigh-levelraav-mediatedexpressioninskeletalandcardiacmuscle.molther15,320-329(2007)。
35.sondergaard,p.c.等人,aav.dysferlinoverlapvectorsrestorefunctionindysferlinopathyanimalmodels.annalsofclinicalandtranslationalneurology2,256-270(2015)。
36.de,b.p.等人,highlevelsofpersistentexpressionofalpha1-antitrypsinmediatedbythenonhumanprimateserotyperh.10adeno-associatedvirusdespitepreexistingimmunitytocommonhumanadeno-associatedviruses.molther13,67-76(2006).
37.rodino-klapac,l.r.等人,atranslationalapproachforlimbvasculardeliveryofthemicro-dystrophingenewithouthighvolumeorhighpressurefortreatmentofduchennemusculardystrophy.journaloftranslationalmedicine5,45(2007)。
38.bulfield等人,xchromosome-linkedmusculardystrophy(mdx)inthemouse.procnatlacadsciusa.1984;81(4):1189–1192。
39.sicinski等人,themolecularbasisofmusculardystrophyinthemdxmouse:apointmutation.science.198930;244(4912):1578-80。
- 还没有人留言评论。精彩留言会获得点赞!