制备蛋氨酸的方法与流程
本发明涉及制备蛋氨酸的方法,其包括在包含碱金属氢氧化物和/或碱金属碳酸盐和/或碱金属碳酸氢盐的水溶液中对5-(2-甲基巯基乙基)-乙内酰脲(蛋氨酸乙内酰脲)进行加碱水解,其中过程溶液中的碱金属阳离子为钾和钠,k/na摩尔比为99/1至20/80。
氨基酸蛋氨酸目前在世界范围内以工业方式大量生产,并且在商业上非常重要。蛋氨酸被用于许多领域,例如药物、保健和健身产品,但尤其是在用于各种牲畜的许多饲料中用作饲料添加剂。
在工业规模上,蛋氨酸是通过bucherer-bergs反应而化学生产的,这是strecker合成的一种变体。在此,初始物质3-甲基巯基丙醛(由2-丙烯醛基和甲硫醇制备)、氢氰酸(氰化氢)、氨和二氧化碳进行反应以得到5-(2-甲基巯基乙基)乙内酰脲(蛋氨酸乙内酰脲),然后将其通过用碳酸钾和碳酸氢钾的碱进行水解而制得蛋氨酸钾。蛋氨酸最终通过用二氧化碳处理而从其钾盐中释放出来(“碳酸化反应”),可以将其作为沉淀物而从含有碳酸钾和碳酸氢钾的母液中过滤出(us5,770,769)。然后,将沉淀的蛋氨酸从水溶液中进行重结晶、过滤出并干燥。由此获得的蛋氨酸的纯度大于99%,并且钾含量小于0.5%。
us4,272,631证实碱金属和碱土金属氢氧化物的混合物可用于使蛋氨酸乙内酰脲皂化。但是在这些方法中,首先必须在蛋氨酸的释放过程中分离碱土金属离子,所以仅得到80.5%的最大产率。us4,272,631并没有公开使用碱金属氢氧化物的混合物用于蛋氨酸乙内酰脲的皂化。
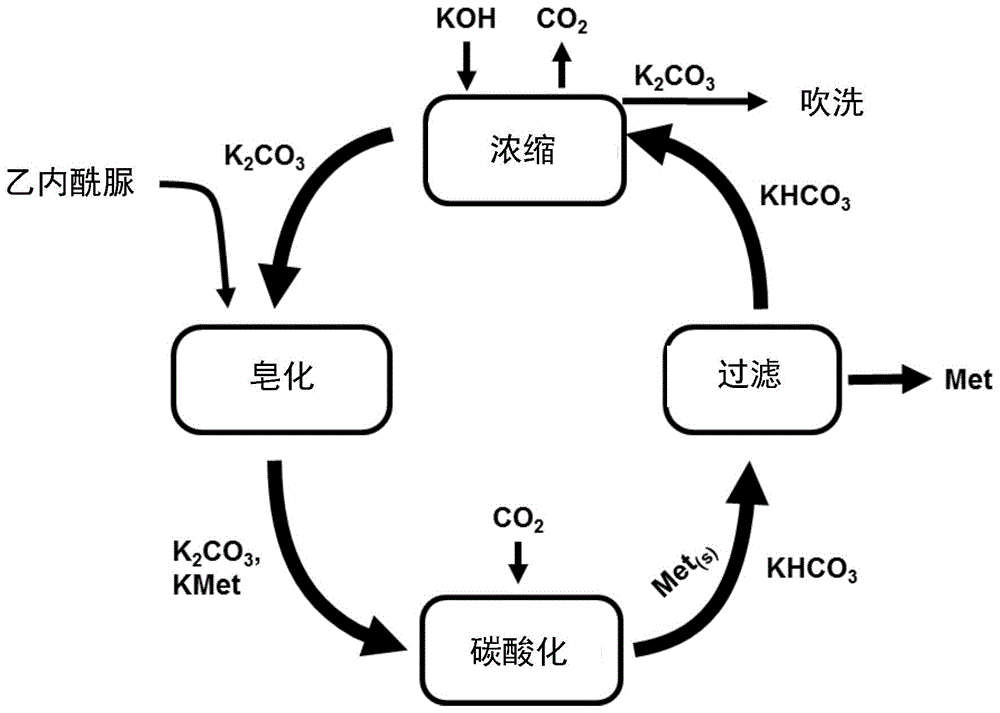
在工业蛋氨酸的生产中,通常将氨、碳酸钾和碳酸氢钾试剂以及二氧化碳进行再循环。然而,必须将该乙内酰脲水解循环的一部分水性过程溶液连续地用新鲜的氢氧化钾交换,实质上是从循环中除去(“吹洗”)呈甲酸钾形式的未活化的钾盐。甲酸钾由蛋氨酸乙内酰脲溶液中存在的氰化氢残留物和乙内酰脲水解的碱性钾盐形成(wo2013030068a2)。蛋氨酸合成的另一副产物是蛋氨酸二肽(ep1564208a1)。通常而言,必须避免乙内酰脲水解循环中副产物的过度富集,因为否则会在下游发生晶体形成的破坏。乙内酰脲水解循环的流程(scheme)如图1中所示。
再循环至乙内酰脲水解循环的典型过程溶液包含约10-16重量%的钾、5-10重量%的蛋氨酸、3-5重量%的甲硫氨酰基蛋氨酸、0.5-2.0重量%的甲酸盐和0.2-0.3重量%的乙酸盐。
通过用二氧化碳分别以呈蛋氨酸和碳酸钾形式而沉淀、过滤并送回至过程溶液中,可以将甲二磺酸盐(methionate)和钾从吹洗料流中部分回收。但是,仍然有相当昂贵的钾盐的显著损失。最终的吹洗溶液包含约2-6重量%的蛋氨酸、4-8重量%的甲硫氨酰基蛋氨酸6-14重量%的呈钾盐形式的钾、1-1.7重量%的甲酸盐和0.3-0.5重量%的乙酸盐。
为了回收利用剩余的碳酸钠,capelle和rey(wo2016/170252a1)提出了一种制备蛋氨酸的方法,该方法通过在水相中使蛋氨酸乙内酰脲进行加碱水解,从水解介质中除去氨和二氧化碳,中和所得蛋氨酸的钠盐,其中在除去氨和二氧化碳之后,将反应介质浓缩以使碳酸钠沉淀,将沉淀的碳酸钠过滤出,并在氢氧化钠和碳酸钠的存在下再循环而用于加碱水解。然而在该方法中,蛋氨酸钠盐的中和用亚硫酸实现,这仍然会导致大量作为副产物的硫酸钠,该副产物必须从所述过程中去除掉。
在碳酸化反应中,即在蛋氨酸的碱金属盐与二氧化碳形成蛋氨酸和碱金属碳酸氢盐的反应(图1)中,使蛋氨酸沉淀并从过程溶液中除去。但是,由于碳酸氢钠和蛋氨酸的溶解度差异很小(图2),在该反应中使用蛋氨酸的钠盐的情况下,大量的碳酸氢钠会与蛋氨酸共沉淀。因此,在碳酸化反应中使用蛋氨酸的钾盐,这意味着通常要将氢氧化钾添加到乙内酰脲水解循环过程中。
从us4,259,525和us5,770,769还知道,当在蛋氨酸乙内酰脲的水解中使用钠的盐或氢氧化物而代替钾的盐或氢氧化物时,由于碳酸钠的溶解性差,其会与产物一起沉淀,因此用二氧化碳沉淀的蛋氨酸倾向于含有高含量的钠。
本发明的目的是提供一种制备蛋氨酸的方法,其包括在包含氢氧化钾和/或碳酸钾和/或碳酸氢钾的过程水溶液中使5-(2-甲基巯基乙基)-乙内酰脲(蛋氨酸乙内酰脲)进行加碱水解,以形成蛋氨酸钾盐,借助二氧化碳使蛋氨酸沉淀,从过程溶液中分离沉淀的蛋氨酸,将过程溶液浓缩并将过程溶液再循环至蛋氨酸乙内酰脲的加碱水解中,其中过程溶液中的钾阳离子部分被钠阳离子代替,以避免吹洗溶液料流中较昂贵的钾盐的损失。
已经发现,在由乙内酰脲水解反应所产生的过程溶液中,大部分的钾可以由钠而代替,而不会在碳酸化反应中产生不希望的碳酸氢钠的共沉淀。
该目的通过以下制备蛋氨酸的方法实现,该方法包括在包含碱金属氢氧化物和/或碱金属碳酸盐和/或碱金属碳酸氢盐的水性过程溶液中对5-(2-甲基巯基乙基)-乙内酰脲(蛋氨酸乙内酰脲)进行加碱水解以形成蛋氨酸碱金属盐,借助二氧化碳使蛋氨酸沉淀,从所述过程溶液中分离出沉淀的蛋氨酸,将过程溶液浓缩,并将蛋氨酸乙内酰脲的加碱水解中的过程溶液再次循环送至(forwardto)过程溶液中,其中所述过程溶液中的碱金属阳离子为钾和钠,k/na摩尔比为99/1至20/80,导致钾浓度为13.9重量%至1.2重量%且钠的浓度为0.04重量%至6.6重量%。
在浓缩步骤中,将过程溶液再浓缩至其通常的乙内酰脲水解循环的初始浓度,即包含约5-16重量%的碱金属,5-8重量%的蛋氨酸,3-5重量%的甲硫氨酰基蛋氨酸,0.7-1.1重量%的甲酸盐和0.2-0.3重量%的乙酸盐。
在本发明的方法中,过程溶液中的k/na摩尔比优选为90/10至20/80,导致钾浓度为12.6重量%至1.2重量%,且钠的浓度为0.35重量%至6.6重量%。理想而言,过程溶液中的k/na摩尔比为70/30至50/50,从而导致钾浓度为9.8重量%至3重量%,且钠的浓度为1.06重量%至4.1重量%。
在本发明的方法中,然后将沉淀的蛋氨酸从水溶液中进行重结晶、过滤并干燥。由此获得的蛋氨酸的纯度大于99%,钾含量低于0.3%且钠含量低于0.1%,特别地结晶蛋氨酸中的钾含量为0.05-0.3%,且钠含量为0.01-0.1%。
在本发明的方法中,一部分过程溶液,即所谓的“吹洗溶液”,可以连续地从该过程中除去,并用新鲜的碱金属氢氧化物溶液交换。
从该过程中除去的吹洗溶液包含2-6重量%的蛋氨酸、4-8重量%的甲硫氨酰基蛋氨酸、1-1.7重量%的甲酸盐、0.3-0.5重量%的乙酸盐和6-14重量%的呈钾盐和钠盐形式的碱金属,钾和钠的k/na摩尔比为99/1至20/80,从而导致钾浓度为13.9重量%至1.2重量%,钠浓度为0.04重量%至6.6重量%。
本发明的方法还可以导致k/na摩尔比为90/10至20/80的吹洗溶液,从而导致钾浓度为12.6重量%至1.2重量%,且钠浓度为0.35重量%至6.6重量%。
本发明的方法还可以导致k/na摩尔比为70/30至50/50的吹洗溶液,从而导致钾浓度为9.8重量%至3重量%,且钠浓度为1.06重量%至4.1重量%。
由于钾、氮、硫和钠的含量,由此获得的吹洗溶液适合用作液体肥料(c.c.mitchel和a.e.hiltbold,journalofplantnutrition,17(12),2119-2134,1994)。此外,钠被认为是植物的功能性营养,即一种能最大程度地提高生物量产量和/或降低其对必要元素的需求(关键含量)的元素(subbarao等,criticalreviewsinplantsciences,22(5):391–416(2003))。
所述吹洗溶液可以包含2-6重量%的蛋氨酸、4-8重量%的甲硫氨酰基蛋氨酸、1-1.7重量%的甲酸盐、0.3-0.5重量%的乙酸盐和13.9重量%至1.2重量%的呈钾盐形式的钾,以及0.04重量%至6.6重量%的呈钠盐形式的钠。所述吹洗溶液的钾浓度还可以是12.6重量%至1.2重量%,且钠浓度是0.35重量%至6.6重量%。或者,所述吹洗溶液的钾浓度可以是9.8重量%至3重量%,且钠浓度是1.06重量%至4.1重量%。
归因于其组成,所述吹洗溶液可以用作肥料或肥料添加剂。
附图说明
图1显示了乙内酰脲水解循环的流程。
图2显示了khco3、nahco3和蛋氨酸在水中的溶解度曲线。测量值源自以下来源。
khco3的溶解度:
seidell,1940:seidel,a.;solubilitydataser.,1940。
gmelin:gmelinshandbuch,22,1938。
takahashi,1927:takahashi,g.;bull.imp.seric.stn.tokyo29,1927,165。
nahco3的溶解度:
trypuc&kielkowska,1998:trypuc,m.;kielkowska,u.;j.chem.eng.data43(2),1998,201-204。
fedotev,1904:fedotev,p.p.,z.phys.chem.49,1904,168。
蛋氨酸的溶解度:
fuchs等,2006:fuchs等,2006,ind.eng.chem.res.,45,6578-6584。
实验室试验:自己的实验室试验的结果(依据fuchs等,2006).
图3显示了过程溶液中不同摩尔比k/na的原料滤饼的组成(实施例1)
实验部分
在碳酸化的反应中,蛋氨酸的钾盐(k-met)与0.5当量的碳酸钾一起与co2反应。形成了khco3,并沉淀出蛋氨酸(h-met)(方程式1和2)。
k-met+co2+h2o->h-met(s)+khco3(方程式1)
k2co3+co2+h2o->2khco3(方程式2)
由于nahco3的溶解度显著低于khco3(图2),因此必须仔细调整k/na的摩尔比,以避免在碳酸化反应器中不希望地沉淀出nahco3晶体。
因此,在实验室中进行了一系列的试验,以考察使用不同k/na摩尔比时的合成过程溶液的碳酸化反应。总的碱浓度(k和na的总和)保持恒定,这意味着与k/na=100/0相比,摩尔比k/na=70/30时的钾浓度降低了30%,由钠进行了等摩尔取代。该研究的结果总结于图3中。
对于k/na摩尔比为100/0至0/100,滤饼中的蛋氨酸的含量可以认为是恒定的。对于摩尔比k/na100/0至20/80,滤饼中的na含量略有增加,至多3.92g,这可以通过过程溶液被附着至(attachto)并结合到滤饼中来解释。但是,对于摩尔比k/na10/90和0/100,则观察到在滤饼中明显更高的na含量9.34–19.67g),这表明nahco3也部分沉淀。
因此,可以运转碳酸化反应直至20/80的摩尔比k/na,也没有碳酸氢钠的共沉淀。
具体实施方式
实施例1
制备k/na摩尔比为90/10的过程溶液的试验步骤
将1000ml烧杯置于冰浴中,并将koh(40%于水中,354.2g,2.53mol)、naoh(40%于水中,11.2g,0.28mol)、d,l-蛋氨酸(159.7g,1.07mol)、dl-甲硫氨酰基-dl-蛋氨酸(29.9g,0.11mol)和甲酸(50%于水中,41.4g,0.45mol)溶解于200ml去离子水中,并搅拌45分钟。然后将溶液加热至20℃,转移至1000ml的容量瓶中,并用去离子水填充至1000ml的总体积。
然后将1100g的该溶液转移至2l的büchi实验室高压釜中,加入0.32g消泡剂eg2007。通过冷却夹套和低温恒温器将高压釜冷却至30℃。开始机械搅拌,并将高压釜用co2气体加压至表压2巴(barg)。调节co2气体进料流以维持表压2巴的压力,直到达到ph为8,将温度维持在30℃。从高压釜将压力释放,将悬浮液转移至真空过滤器玻璃料中,并在940毫巴的绝对压力下抽吸干燥15分钟。将滤液收集在100ml的玻璃瓶中,并用去离子水稀释以避免随后的固体沉淀,随后进行平衡。通过抹刀将滤饼转移至3000ml的烧杯中,并将玻璃料中的残留固体通过去离子水冲洗至烧杯中。加入额外的去离子水直到固体溶解。然后将该溶液转移至3l的玻璃瓶中并平衡。此外,将高压釜中的残留固体也用收集在玻璃瓶中的去离子水冲洗,作为所谓的“滞留物”,并进行平衡。
对于所述合成过程溶液、溶于去离子水中的滤饼、滤液和“滞留物”,通过ipc-oes对其钾含量和钠含量进行分析,通过hplc对met-和met-met进行分析,并通过离子色谱法对甲酸盐进行分析,且结果总结在表1中。
表1:k/na摩尔比为90/10的合成过程溶液的碳酸化反应
- 还没有人留言评论。精彩留言会获得点赞!