荧光化合物及应用该化合物的自噬检测试剂的制作方法
本发明涉及新的荧光化合物及应用该化合物的自噬检测试剂。
背景技术:
从酵母到人类的真核生物,普遍存在对于细胞内废弃的蛋白质、细胞器(organelle)等的细胞内成分进行再利用或代谢的降解过程,该过程被称为自噬(autophagy)。自噬被认为是在营养饥饿状态时非选择性地降解自身,以确保营养成分,用于在饥饿状态生存的生存机制,不过,根据之后的研究,阐明自噬通过去除变性蛋白质、防止在细胞内过量产生的蛋白质的积累、排除恶化的细胞器和病原性微生物等,还参与恒常性的维持、个体发育过程中的细胞程序性死亡、亨廷顿病(huntington’sdisease,hd)等疾病的抑制、细胞癌变的抑制等。
已知自噬具有多种具有不同机制的过程,例如,大自噬(macroautophagy)、小自噬(microautophagy)、分子伴侣介导的自噬(chaperone-mediatedautophagy,cma)等。根据初期的电子显微镜的研究,在大自噬中,由双层膜构成的隔离膜逐渐扩展,覆盖废弃物等的降解基质,形成自噬体(autophagosome),然后,已确认自噬体的内容物在自噬体和溶酶体(lysosome)融合的自噬溶酶体(autolysosome)阶段被消化酶降解。无论是哪种过程,共通点是降解基质最终移到溶酶体,并在那里进行降解。
近年来,关于自噬的分子机构的阐明也在不断推进,与自噬相关的基因等也被确认。作为自噬的检测方法,虽然存在一种溶解细胞并通过蛋白质免疫印迹法(westernblot)和免疫染色法从获得的mrna确认自噬相关因子的表达量的方法(例如,参照专利文献1),不过由于这个方法会破碎细胞,不能适用于活细胞成像(livecellimaging)。
作为监控活细胞内的自噬的方法,有如下方法:将在作为参与自噬体形成的遗传因子产物(atg蛋白质)的一种的lc3中结合了gfp的进行lc3-gfp编码的质粒载体(plasmidvector)导入细胞内,并通过gfp的发光监测lc3的表达(例如,参照非专利文献1)。由于在酸性条件下,荧光强度会降低,因此,gfp在自噬的初始阶段的检测中非常出众。但是,由于这个方法需要在细胞内进行lc3-gfp的表达,因此,并不是可适用于所有细胞。
作为活细胞成像的代表性的方法,有如下方法:在细胞内使被称为keima的ph响应性荧光蛋白质得以表达,并监控来自keima的荧光强度的方法(例如,参照非专利文献2)。keima的激发光谱(excitationspectrum)随着ph发生变化。在中性环境下短波长侧(440nm)呈优势,在酸性环境下长波长侧(550nm)呈优势。对来自这两个激发波长的图像数据所获得的比值(ratio)(550nm/440nm)图像进行观察,可知在中性环境下keima的比值变低,在酸性环境下keima的比值变高。通过利用这个现象,能够从荧光图像读取伴有自噬的降解基质的ph变化,检测出自噬的各个阶段(自噬体的形成、与溶酶体的融合等)。但是,由于这个方法需要在细胞内进行keima的表达,因此,并不是可适用于所有细胞。
另一方面,作为使用低分子荧光色素的自噬的检测案例,已知使用单丹磺酰尸胺(monodansylcadaverin,mdc)的方法(例如,参照非专利文献3)。但是,由于mdc的激发波长在紫外线区域,因此,存在细胞毒性及脱色等问题。近年来,enzo公司开发了cyto-id(商标名)作为克服mdc问题的新型色素(参照非专利文献4)。
现有技术文献
专利文献
专利文献1:日本特开2013-99305号公报(段落0016)
非专利文献
非专利文献1:kumaaetal.theroleofautophagyduringtheearlyneonatalstarvationperiod.naturevol.432,1032-1036(2004).
非专利文献2:t.kogure,etal.afluorescentvariantofaproteinfromthestonycoralmontiporafacilitatesdual-colorsingle-laserfluorescencecross-correlationspectroscopy;naturebiotechnology.vol.24,577-581(2006).
非专利文献3:"autophagyprecededapoptosisinoridonin-treatedhumanbreastcancermcf-7cells",qiaocuietal.biol.pharm.bull.,vol.30,no.5,p.859-864(2007).
非专利文献4:
http://www.enzolifesciences.com/enz-51031/cyto-id-autophagy-detection-kit/
技术实现要素:
(发明要解决的问题)
然而,由于非专利文献4中所记载的色素没有ph响应性,因此,不清楚检测到自噬的哪个阶段。
鉴于这样的情况而提出本发明,本发明的目的是提供一种无需基因重组等复杂的操作,就能够在所有细胞中检测出自噬的荧光化合物及应用该化合物的自噬检测试剂。
(解决问题的手段)
为了达到上述目的,本发明的第一方式,是通过提供下述通式(i)表示的荧光化合物或其盐来解决上述课题。
[化学式1]
其中,在上述通式(i)中,
r1表示烷基或ω-氨基烷基;
r2表示氢原子或烷基;
r3表示由式-(ch2)m-表示的原子团,其中,m是10以下的自然数;
r4表示由式-ch2-或-nr6-表示的原子团,其中,r6表示烷基;
r5表示由式-(ch2)n-表示的原子团,其中,n是10以下的自然数;
rn是由式-nh2、-nhr7、-nr7r8及-n+r7r8r9中的任一个表示的原子团,其中,r7、r8、r9分别独立地表示烷基;
当r2为烷基且r4为由式-nr6-表示的原子团时,r2和r6可相互结合形成环。
根据本发明的第一方式的荧光化合物,可以是由下述式4a~4f、6h及6i中的任一个表示的化合物或其盐,
[化学式2]
[化学式3]
根据本发明的第一方式的荧光化合物,优选为,由下述式4b或6h表示的化合物或其盐,
[化学式4]
[化学式5]
本发明的第二方式,是通过提供下述通式(ii)表示的荧光化合物或其盐来解决上述课题。
[化学式6]
其中,在上述通式(ii)中,
r11表示烷基或ω-氨基烷基;
r12表示氢原子或烷基;
r13表示由式-(ch2)m-表示的原子团,其中,m是10以下的自然数;
r14表示由式-ch2-或-nr16-表示的原子团,其中,r16表示烷基;
r15表示由式-(ch2)n-表示的原子团,其中,n是10以下的自然数;
rn是由式-nh2、-nhr17、-nr17r18及-n+r17r18r19中的任一个表示的原子团,其中,r17、r18、r19分别独立地表示烷基;
当r12为烷基且r14为由式-nr16-表示的原子团时,r12和r16可相互结合形成环。
根据本发明的第二方式的荧光化合物,优选为,由下述式11或13表示的化合物或其盐,
[化学式7]
[化学式8]
本发明的第三方式,是通过提供包括了从根据本发明的第一或第二方式的荧光化合物及其盐构成的群中选择的一种或多种的自噬检测试剂来解决上述课题。
在根据本发明第三方式的自噬检测试剂中,可以包括由上述式4a~4f中的任一个表示的荧光化合物及其盐构成的群中选择的一种或多种,和由上述式6h及6i中的任一个表示的荧光化合物及其盐构成的群中选择的一种或多种。
在根据本发明的第三方式的自噬检测试剂中,优选为,包括由上述式4b表示的荧光化合物或其盐及由上述式6h表示的荧光化合物或其盐。
在根据本发明的第三方式的自噬检测试剂中,可以包括由上述式11表示的荧光化合物或其盐及由上述式13表示的荧光化合物或其盐。
在根据本发明的第三方式的自噬检测试剂中,优选为,包括由下述通式(ia)表示的荧光化合物及其盐构成的群中选择的一种或多种,和由下述通式(iib)表示的荧光化合物及其盐构成的群中选择的一种或多种,或者,由下述通式(ib)表示的荧光化合物及其盐构成的群中选择的一种或多种,和由下述通式(iia)表示的荧光化合物及其盐构成的群中选择的一种或多种。
[化学式9]
[化学式10]
其中,在上述通式(ia)及(ib)中,
r1表示烷基或ω-氨基烷基;
r2表示氢原子或烷基;
r3表示由式-(ch2)m-表示的原子团,其中,m是10以下的自然数;
r5表示由式-(ch2)n-表示的原子团,其中,n是10以下的自然数;
rn是由式-nh2、-nhr7、-nr7r8及-n+r7r8r9中的任一个表示的原子团,其中,r7、r8、r9分别独立地表示烷基;
在上述通式(ia)中,r6表示烷基,且r2和r6可相互结合形成环;
在上述通式(iia)及(iib)中,
r11表示烷基或ω-氨基烷基;
r12表示氢原子或烷基;
r13表示由式-(ch2)m-表示的原子团,其中,m是10以下的自然数;
r15表示由式-(ch2)n-表示的原子团,其中,n是10以下的自然数;
rn是由式-nh2、-nhr17、-nr17r18及-n+r17r18r19中的任一个表示的原子团,其中,r17、r18、r19分别独立地表示烷基;
在上述通式(iia)中,r16表示烷基,且r12和r16可相互结合形成环。
在根据本发明的第三方式的自噬检测试剂中,优选为,包括由上述式6h表示的荧光化合物或其盐及上述式11表示的荧光化合物或其盐,或者,由上述式4b表示的荧光化合物或其盐及由上述式13表示的荧光化合物或其盐。
(发明的效果)
由上述通式表示的荧光化合物,使用在疏水场荧光发射的萘酰亚胺(naphthaleneimide)和苝酰亚胺(peryleneimide)作为荧光发色团。因此,由于被自噬体或自溶酶体取入而提高了荧光强度,因此,可以通过荧光发射来读取自噬。此外,通过适当选择官能团r1~r5,可以容易地进行使用疏水性的控制和光诱导电子转移(pet)赋予荧光强度或荧光波长的ph响应性等。进一步,通过组合在自噬的各个阶段对于自噬体和自溶酶体的内部环境(ph等)的变化具有不同敏感性的多种荧光化合物,可以观察自噬的各个阶段。特别地,除了对自噬体和自溶酶体的内部环境的变化的敏感性之外,当组合使用由具有不同发射波长的由通式(ia)表示的荧光化合物及其盐构成的群中选择的一种或多种,和由通式(iib)表示的荧光化合物及其盐构成的群中选择的一种或多种,或者由通式(ib)表示的荧光化合物及其盐构成的群中选择的一种或多种,和由通式(iia)表示的荧光化合物及其盐构成的群中选择的一种或多种时,可以阶段性地检测自噬的各个阶段。
附图说明
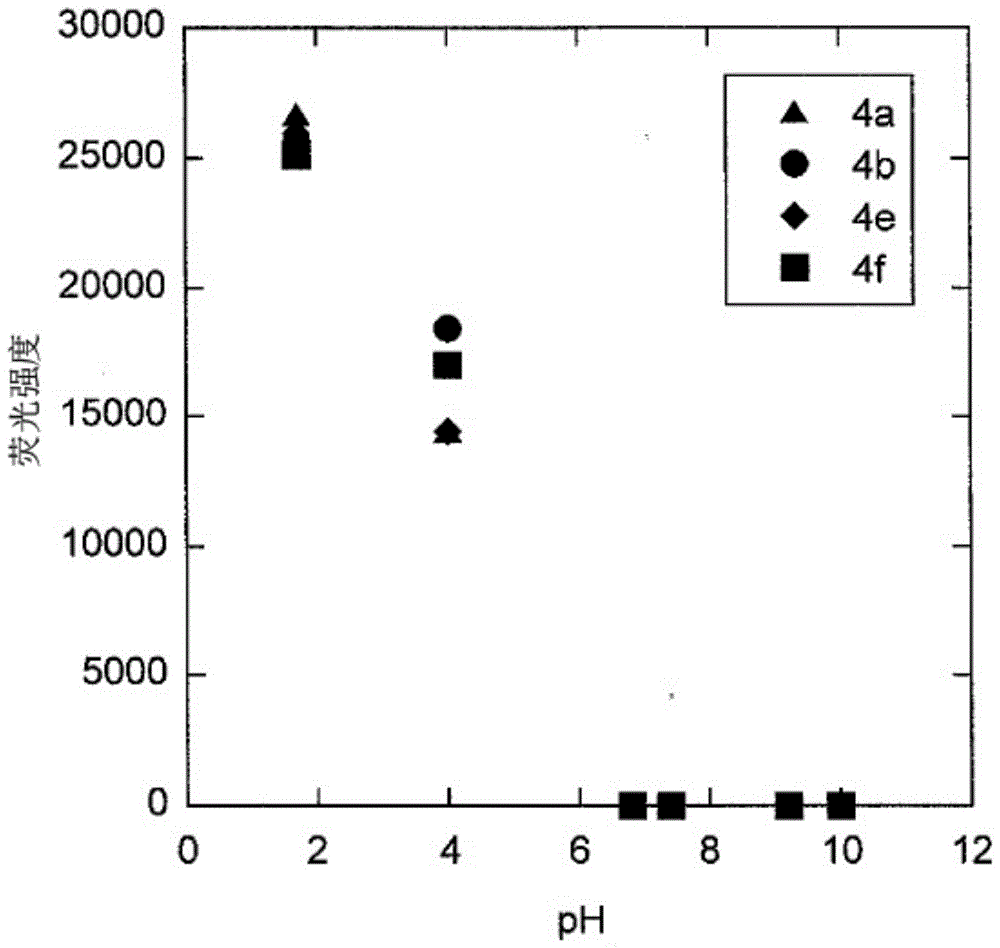
图1是示出荧光化合物4a、4b、4e及4f的荧光强度的ph依存性的图表。
图2是示出将化合物4b导入hela细胞,并培养6小时及20小时后的荧光显微镜照片。
图3是示出将化合物4b导入hela细胞,并在饥饿培养条件下培养6小时及20小时后的流式细胞仪(flowcytometry)的测定结果的图表。
图4是示出在氯喹的存在下,在通过雷帕霉素(rapamycin)或饥饿诱导进行自噬的hela细胞中,荧光强度的变化的荧光显微镜照片。
图5是示出在氯喹的存在下,在通过雷帕霉素(rapamycin)或饥饿诱导进行自噬的hela细胞中,lc3的表达量的定量结果的照片。
图6是示出荧光化合物4b及6h的荧光强度的ph依存性的图表。
图7是示出导入hela细胞的化合物4b及化合物6h的荧光强度的比较结果的荧光显微镜照片。
图8是示出导入hela细胞的化合物4b及化合物6h的荧光强度的比较结果的高倍荧光显微镜照片。
图9是示出荧光化合物11的荧光强度的ph依存性的图表。
图10是将化合物11导入hela细胞,并培养5小时后的荧光显微镜照片。
图11是将化合物6h及化合物11导入hela细胞,并培养3小时及6小时后的荧光显微镜照片。
图12是示出将化合物4b及化合物13导入hela细胞,并培养3小时及6小时后的荧光显微镜照片。
具体实施方式
根据本发明的第一实施方式的荧光化合物,由以下通式(i)表示。
[化学式11]
其中,在上述通式(i)中,r1表示烷基或ω-氨基烷基。烷基或ω-氨基烷基,可以具有支链或取代基,但优选为直链烷基或ω-氨基烷基,且碳原子数没有特别限制,但优选为1以上18以下,更加优选为1以上12以下,进一步优选为1以上10以下。
在上述通式(i)中,r2表示氢原子或烷基。烷基,可以具有支链或取代基,但优选为直链烷基,且碳原子数没有特别限制,但优选为1以上18以下,更加优选为1以上12以下,进一步优选为1以上10以下。
在上述通式(i)中,r3表示由式-(ch2)m-表示的原子团。m是10以下的自然数,优选为2以上6以下。
在上述通式(i)中,r4表示由式-ch2-或-nr6-表示的原子团。r6表示烷基。烷基,可以具有支链或取代基,但优选为直链烷基,且碳原子数没有特别限制,但优选为1以上18以下,更加优选为1以上12以下,进一步优选为1以上10以下。
在上述通式(i)中,r5表示由式-(ch2)n-表示的原子团。n是10以下的自然数,优选为2以上6以下。
在上述通式(i)中,rn是由式-nh2、-nhr7、-nr7r8及-n+r7r8r9中的任一个表示的原子团。r7、r8、r9分别独立地表示烷基。烷基,可以具有支链或取代基,但优选为直链烷基,且碳原子数没有特别限制,但优选为1以上18以下,更加优选为1以上12以下,进一步优选为1以上10以下。
当rn是由式-nh2、-nhr7或-nr7r8表示的原子团时,rn可以形成氮原子受到质子化的盐。作为盐的种类,只要不影响荧光强度就没有特别限定,但作为盐的具体例,可以列举盐酸盐、溴化氢盐、硝酸盐、硫酸盐、硫酸氢盐、碳酸盐、碳酸氢盐、磷酸盐、磷酸氢盐、磷酸二氢盐、醋酸盐、丙酸盐、乳酸盐、酒石酸盐、柠檬酸盐、甲磺酸盐、苯磺酸盐等。当rn是由式-n+r7r8r9表示的原子团时,rn可以形成与上述盐同样的盐。
此外,在上述通式(i)中,当r2为烷基且r4为由式-nr6-表示的原子团时,r2和r6可相互结合,并形成哌嗪环等的含氮环。
作为优选的由上述通式(i)表示的荧光化合物,可以列举由下述式4a~4f、6h及6i中的任一个表示的化合物和其盐。
[化学式12]
[化学式13]
这些化合物,作为荧光发色团具有在疏水场荧光发射的萘酰亚胺基,且被分子设计成通过被取入自噬体的内部而首次荧光发射。此外,由式4a~4f及6i表示的荧光化合物,由于来自氮原子上的非共用电子对的光诱导电子转移(pet)而发生荧光猝灭,但当氮原子在酸性条件下受到质子化时,荧光的发射强度增加。因此,这些荧光化合物,可适合使用于在自噬中与溶酶体融合之后的阶段的读取。另一方面,由式6h表示的在侧链中不具有氮原子的荧光化合物,由于荧光强度不受ph的影响,因此可适合使用于自噬前阶段的读取。进一步,通过适当地组合这两种化合物,可以通过荧光强度的变化读取自噬的全阶段。
由通式(i)表示的荧光化合物,可以使用任何公知的方法合成,例如,由式4a~4f、6h及6i表示的化合物(的盐酸盐),可以根据以下方案合成。
[化学式14]
[化学式15]
根据本发明的第一实施方式的荧光化合物,由下述通式(ii)表示。
[化学式16]
其中,在上述通式(ii)中,r11表示烷基或ω-氨基烷基。烷基或ω-氨基烷基,可以具有支链或取代基,但优选为直链烷基或ω-氨基烷基,且碳原子数没有特别限制,但优选为1以上18以下,更加优选为1以上12以下,进一步优选为1以上10以下。
在上述通式(ii)中,r12表示氢原子或烷基。烷基,可以具有支链或取代基,但优选为直链烷基,且碳原子数没有特别限制,但优选为1以上18以下,更加优选为1以上12以下,进一步优选为1以上10以下。
在上述通式(ii)中,r13表示由式-(ch2)m-表示的原子团。m是10以下的自然数,优选为2以上6以下。
在上述通式(ii)中,r14表示由式-ch2-或-nr16-表示的原子团。r16表示烷基。烷基,可以具有支链或取代基,但优选为直链烷基,且碳原子数没有特别限制,但优选为1以上18以下,更加优选为1以上12以下,进一步优选为1以上10以下。
在上述通式(ii)中,r15表示由式-(ch2)n-表示的原子团。n是10以下的自然数,优选为2以上6以下。
在上述通式(ii)中,rn是由式-nh2、-nhr17、-nr17r18及-n+r17r18r19中的任一个表示的原子团。r17、r18、r19分别独立地表示烷基。烷基,可以具有支链或取代基,但优选为直链烷基,且碳原子数没有特别限制,但优选为1以上18以下,更加优选为1以上12以下,进一步优选为1以上10以下。
当rn是由式-nh2、-nhr17或-nr17r18表示的原子团时,rn可以形成氮原子受到质子化的盐。作为盐的种类,只要不影响荧光强度就没有特别限定,但作为盐的具体例,可以列举盐酸盐、溴化氢盐、硝酸盐、硫酸盐、硫酸氢盐、碳酸盐、碳酸氢盐、磷酸盐、磷酸氢盐、磷酸二氢盐、醋酸盐、丙酸盐、乳酸盐、酒石酸盐、柠檬酸盐、甲磺酸盐、苯磺酸盐等。当rn是由式-n+r17r18r19表示的原子团时,rn可以形成与上述盐同样的盐。
在上述通式(ii)中,当r12为烷基且r14为由式-nr16-表示的原子团时,r12和r16可相互结合,形成哌嗪环等的含氮环。
作为由上述通式(ii)表示的荧光化合物的优选示例,可以列举由下述式11及13表示的化合物和其盐。
[化学式17]
[化学式18]
这些化合物,作为荧光发色团具有在疏水场荧光发射的苝酰亚胺基,且被分子设计成通过被取入到自噬体的内部而首次荧光发射。此外,由式11表示的荧光化合物,由于来自氮原子上的非共用电子对的光诱导电子转移(pet)而发生荧光猝灭,但当氮原子在酸性条件下受到质子化时,荧光的发射强度增加。因此,这些荧光化合物,可适合使用于在自噬中与溶酶体融合之后的阶段的读取。
由通式(ii)表示的荧光化合物,可以使用任何公知的方法合成,例如,由式11表示的化合物(的盐酸盐),可以根据以下方案合成。
[化学式19]
此外,由式13表示的化合物(的盐酸盐),可以根据以下方案合成。
[化学式20]
由上述通式(i)及(ii)表示的荧光化合物(以下,有时缩写为“同一化合物”),对细胞膜、自噬体及溶酶体(自溶酶体)具有渗透性。因此,将同一化合物导入细胞,无需使用特殊方法,而是通过仅使同一化合物与细胞接触就能够进行。以此方式,通过将已导入化合物的细胞培养规定时间,并使用荧光显微镜等的任何公知的方法测量来自细胞的荧光发射,从而能够检测细胞内的自噬。本发明的一个实施方式,涉及细胞内的自噬的检测方法,所述细胞内的自噬的检测方法包括:将由上述通式表示的荧光化合物给予细胞内的步骤;以及在培养规定时间后,测量来自细胞的荧光发射的步骤。
由下述通式(ia)及(iia)表示的荧光化合物,由于来自氮原子上的非共用电子对的光诱导电子转移(pet)而发生荧光猝灭,但当氮原子在酸性条件下受到质子化时,荧光的发射强度增加。因此,这些荧光化合物,可适合使用于在自噬中与溶酶体融合之后的阶段的读取。另一方面,由通式(ib)及(iib)表示的在侧链中不具有氮原子的荧光化合物,由于荧光强度不受ph的影响,因此可适合使用于自噬的前阶段的读取。因此,通过组合由下述通式(ia)表示的荧光化合物及其盐构成的群中选择的一种或多种,和由下述通式(iib)表示的荧光化合物及其盐构成的群中选择的一种或多种,或者由下述通式(ib)表示的荧光化合物及其盐构成的群中选择的一种或多种,和由下述通式(iia)表示的荧光化合物及其盐构成的群中选择的一种或多种,能够通过荧光波长及荧光强度的变化来读取自噬的全阶段。
[化学式21]
[化学式22]
并且,在上述通式(ia)及(ib)中,
r1表示烷基或ω-氨基烷基;
r2表示氢原子或烷基;
r3表示由式-(ch2)m-表示的原子团,其中,m是10以下的自然数;
r5表示由式-(ch2)n-表示的原子团,其中,n是10以下的自然数;
rn是由式-nh2、-nhr7、-nr7r8及-n+r7r8r9中的任一个表示的原子团,其中,r7、r8、r9分别独立地表示烷基;
在上述通式(ia)中,r2和r6可相互结合形成环;
在上述通式(iia)及(iib)中,
r11表示烷基或ω-氨基烷基;
r12表示氢原子或烷基;
r13表示由式-(ch2)m-表示的原子团,其中,m是10以下的自然数;
r15表示由式-(ch2)n-表示的原子团,其中,n是10以下的自然数;
rn是由式-nh2、-nhr17、-nr17r18及-n+r17r18r19中的任一个表示的原子团,其中,r17、r18、r19分别独立地表示烷基;
在上述通式(iia)中,r12和r16可相互结合形成环。
作为上述组合的优选示例,可以列举由上述式6h表示的荧光化合物或其盐及由上述式11表示的荧光化合物或其盐,或者,由上述式4b表示的荧光化合物或其盐及由上述式13表示的荧光化合物或其盐的组合。
当将同一化合物导入细胞时,可以在将同一化合物以规定浓度溶解或分散在适当的溶剂或缓冲溶液中的状态下进行。本发明的一个实施方式,涉及一种将同一化合物以规定浓度溶解或分散在溶剂或缓冲溶液中的自噬检测试剂。
接下来,对为了确认本发明的作用效果而进行的实施例进行说明。此外,在下面的实施例中,有时将“由式x表示的化合物”简称为“化合物x”。
实施例1:荧光化合物的合成(1)
6-溴-2-丙基-1h-苯并[de]异喹啉-1,3(2h)-二酮(1a)的合成
在200ml茄型烧瓶中,加入4-溴-1,8-萘酐(1g,3.6mmol)、丙胺(298mg,1.4当量,5.04mmol)、dmap(528mg,1.2当量,4.3mmol)、50ml的etoh,并在80℃下回流16小时。回到室温后,过滤析出的结晶,获得930mg的黄色结晶(收率:84%)。
1h-nmr(400mhz,cdcl3)δ:8.65(d,1h,j=7.2hz),8.55(d,1h,j=8.5hz),8.40(d,1h,j=7.8hz),8.03(d,1h,j=7.8hz),7.84(t,1h,j=7.8hz),4.13(t,2h,j=7.5hz),1.79-1.71(m,2h),1.01(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ163.5,133.1,131.9,131.1,131.0,130.5,130.1,128.9,128.0,123.1,122.2,42.0,21.3,11.5。
6-溴-2-戊基-1h-苯并[de]异喹啉-1,3(2h)-二酮(1b)的合成
与化合物1a同样,用4-溴-1,8-萘酐(1g,3.6mmol)、戊胺(436mg,1.4当量,5.04mmol)、dmap(528mg,1.2当量,4.3mmol)、50ml的etoh合成,获得1.2g黄色结晶(收率:80%)。
1h-nmr(400mhz,cdcl3)δ:8.65(d,1h,j=7.2hz),8.56(d,1h,j=8.5hz),8.40(d,1h,j=7.8hz),8.03(d,1h,j=7.8hz),7.84(t,1h,j=7.8hz),4.16(t,2h,j=7.5hz),1.75-1.69(m,2h),1.42-1.38(m,4h),0.91(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ163.5,133.1,131.9,131.1,131.0,130.5,130.1,128.9,128.0,123.1,122.3,40.6,29.2,27.7,22.4,14.0。
6-溴-2-庚基-1h-苯并[de]异喹啉-1,3(2h)-二酮(1c)的合成
与化合物1a同样,用4-溴-1,8-萘酐(2.0g,7.2mmol)、庚胺(1.1g,1.4当量,10.1mmol)、dmap(1.0g,1.2当量,8.6mmol)、100ml的etoh合成,获得1.5g黄色结晶(收率:55.6%)。
1h-nmr(400mhz,cdcl3)δ:8.65(d,1h,j=7.2hz),8.56(d,1h,j=8.5hz),8.41(d,1h,j=7.8hz),8.03(d,1h,j=7.8hz),7.84(t,1h,j=7.8hz),4.16(t,2h,j=7.5hz),1.76-1.68(m,2h),1.43-1.30(m,8h),0.89(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ163.5,133.1,131.9,131.1,131.0,130.5,130.1,128.9,128.0,123.1,122.2,40.6,31.7,29.0,28.0,27.0,22.6,14.0。
6-溴-2-癸基-1h-苯并[de]异喹啉-1,3(2h)-二酮(1d)的合成
与化合物1a同样,用4-溴-1,8-萘酐(2.0g,7.2mmol)、1-氨基癸烷(1.6g,1.4当量,10.1mmol)、dmap(1.0g,1.2当量,8.6mmol)、100ml的etoh合成,获得1.5g黄色结晶(收率:50%)。
1h-nmr(400mhz,cdcl3)δ:8.65(d,1h,j=7.2hz),8.56(d,1h,j=8.5hz),8.41(d,1h,j=7.8hz),8.04(d,1h,j=7.8hz),7.84(t,1h,j=7.8hz),4.16(t,2h,j=7.5hz),1.76-1.68(m,2h),1.45-1.25(m,17h),0.88(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ163.5,133.1,131.9,131.1,131.0,130.5,130.1,128.9,128.0,123.1,122.2,40.6,31.9,29.5,29.3,28.0,27.122.6,14.1。
叔丁基(2-(6-溴-1,3-二氧代-1h-苯并[de]异喹啉-2(3h)-基)乙基)氨基甲酸酯(1e)的合成
与化合物1a同样,用4-溴-1,8-萘酐(1.0g,3.6mmol)、n-(叔丁氧羰基)-1,2-二氨基乙烷(807mg,1.4当量,5.04mmol)、dmap(528mg,1.2当量,4.3mmol)、50ml的etoh进行与(1a)同样的合成,获得1.3g黄色结晶(收率:86%)。
1h-nmr(400mhz,cdcl3)δ:8.66(d,1h,j=7.2hz),8.57(d,1h,j=8.5hz),8.41(d,1h,j=7.8hz),8.04(d,1h,j=7.8hz),7.84(t,1h,j=7.8hz),4.93(s,1h),4.35(t,2h,j=7.5hz),3.54-3.53(m,2h),1.27(s,9h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ163.9,156.0,133.3,132.2,131.3,131.0,130.5,130.3,129.0,128.0,122.8,122.0,79.1,40.0,39.5,28.2。
叔丁基(4-(6-溴-1,3-二氧代-1h-苯并[异]异喹啉-2(3h)-基)丁基)氨基甲酸酯(1f)的合成
与化合物1a同样,用4-溴-1,8-萘酐(1.0g,3.6mmol)、n-(叔丁氧羰基)-1,4-二氨基丁烷(948mg,1.4当量,5.04mmol)、dmap(528mg,1.2当量,4.3mmol)、50ml的etoh进行与(1a)同样的合成,获得900mg黄色结晶(收率:56%)。
1h-nmr(400mhz,cdcl3)δ:8.65(d,1h,j=7.2hz),8.57(d,1h,j=8.5hz),8.41(d,1h,j=7.8hz),8.04(d,1h,j=7.8hz),7.85(t,1h,j=7.8hz),4.62(s,1h),4.18(t,2h,j=7.5hz),3.20-3.18(m,2h),1.79-1.75(m,2h),1.62-1.57(m,2h),1.42(s,9h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ163.5,155.9,133.2,132.0,131.2,131.0,130.5,130.2,128.9,128.0,123.0,122.1,79.0,40.2,40.0,28.4,27.5,25.4。
6-(哌嗪-1-基)-2-丙基-1h-苯并[de]异喹啉-1,3(2h)-二酮(2a)的合成
在200ml茄型烧瓶中,加入化合物1a(500mg,1.5mmol)、哌嗪(1.3g,10当量,15mmol)、50ml的2-甲氧基乙醇,并在120℃下回流16小时。确认反应的进行后,用蒸发器蒸馏除去反应溶液。使用硅胶柱以100%氯仿至氯仿/甲醇=7/3的梯度进行纯化。获得400mg黄色结晶(收率:82%)。
1h-nmr(400mhz,cdcl3)δ:8.58(d,1h,j=7.2hz),8.52(d,1h,j=8.5hz),8.42(d,1h,j=7.8hz),7.69(t,1h,j=7.8hz),7.21(d,1h,j=7.8hz),4.13(t,2h,j=7.5hz),3.22(d,8h,j=7.8hz),1.78-1.73(m,2h),1.01(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ164.5,164.0,156.3,132.5,131.0,130.2,129.9,126.2,125.6,123.3,116.7,114.9,54.4,46.2,41.7,21.4,11.5。
2-戊基-6-(哌嗪-1-基)-1h-苯并[de]异喹啉-1,3(2h)-二酮(2b)的合成
与化合物2a同样,用化合物1b(1g,2.8mmol)、哌嗪(2.6g,10当量,31mmol)、100ml的2-甲氧基乙醇进行合成,获得800mg黄色结晶(收率:79%)。
1h-nmr(400mhz,cdcl3)δ:8.56(d,1h,j=8.5hz),8.51(d,1h,j=7.8hz),8.41(d,1h,j=7.8hz),7.69(t,1h,j=7.8hz),7.21(d,1h,j=7.2hz),4.15(t,2h,j=7.5hz),3.24-3.21(m,2h),1.91(s,2h),1.72(m,2h),1.39(s,4h),0.91(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ164.4,163.9,156.3,132.5,131.0,130.2,129.8,126.1,125.5,123.2,116.7,114.8,54.4,46.2,40.2,29.2,27.8,22.4,14.0。
2-庚基-6-(哌嗪-1-基)-1h-苯并[de]异喹啉-1,3(2h)-二酮(2c)的合成
与化合物2a同样,用化合物1c(1g,2.6mmol)、哌嗪(2.3g,10当量,26mmol)、100ml的2-甲氧基乙醇进行合成,获得800mg黄色结晶(收率:79%)。
1h-nmr(400mhz,cdcl3)δ:8.57(d,1h,j=8.5hz),8.51(d,1h,j=7.8hz),8.41(d,1h,j=7.8hz),7.69(t,1h,j=7.8hz),7.21(d,1h,j=7.2hz),4.15(t,2h,j=7.5hz),3.25-3.20(m,8h),1.75-1.68(m,2h),1.43-1.28(m,8h),0.89(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ164.3,163.8,156.2,132.4,130.9,130.1,129.7,126.3,126.0,125.5,123.2,116.6,114.8,54.3,46.2,40.2,31.7,31.5,29.0,28.8,28.1,27.2,27.1,22.7,22.5,22.4,14.0。
2-癸基-6-(哌嗪-1-基)-1h-苯并[de]异喹啉-1,3(2h)-二酮(2d)的合成
与化合物2a同样,用化合物1d(1g,2.4mmol)、哌嗪(2.0g,10当量,24mmol)、100ml的2-甲氧基乙醇进行合成,获得800mg黄色结晶(收率:79%)。
1h-nmr(400mhz,cdcl3)δ:8.57(d,1h,j=8.5hz),8.51(d,1h,j=7.8hz),8.41(d,1h,j=7.8hz),7.69(t,1h,j=7.8hz),7.22(d,1h,j=7.2hz),4.15(t,2h,j=7.5hz),3.25-3.20(m,8h),1.75-1.67(m,2h),1.44-1.25(m,14h),0.88(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ164.3,163.9,156.2,132.4,130.9,130.1,129.8,126.1,125.8,125.5,123.2,116.7,114.8,54.3,46.2,40.3,31.8,31.6,29.5,29.3,29.2,28.1,27.1,22.6,22.4,14.1。
叔丁基(2-(1,3-二氧代-6-(哌嗪-1-基)-1h-苯并[de]异喹啉-2(3h)-基)乙基)氨基甲酸酯(2e)的合成
与化合物2a同样,用化合物1e(500mg,1.2mmol)、哌嗪(1.0g,10当量,12mmol)、50ml的2-甲氧基乙醇进行合成,获得420mg黄色结晶(收率:82%)。
1h-nmr(400mhz,cdcl3)δ:8.57(d,1h,j=8.5hz),8.51(d,1h,j=7.8hz),8.40(d,1h,j=7.8hz),7.68(t,1h,j=7.8hz),7.20(d,1h,j=7.2hz),5.08(s,1h),4.34(t,2h,j=7.5hz),3.52-3.51(m,2h),3.23-3.21(m,8h),1.30(s,9h);13c-nmr(101mhz,cdcl3):δ164.8,164.3,156.5,156.0,132.8,131.3,130.4,129.9,126.1,125.6,123.0,116.3,114.9,79.0,54.3,46.2,39.9,39.6,28.2。
叔丁基(2-(1,3-二氧代-6-(哌嗪-1-基)-1h-苯并[de]异喹啉-2(3h)-基)丁基)氨基甲酸酯(2f)的合成
与化合物2a同样,用化合物1f(500mg,1.1mmol)、哌嗪(962mg,10当量,11mmol)、50ml的2-甲氧基乙醇进行合成,获得330mg黄色结晶(收率:66%)。
1h-nmr(400mhz,cdcl3)δ:8.57(d,1h,j=8.5hz),8.50(d,1h,j=7.8hz),8.41(d,1h,j=7.8hz),7.69(t,1h,j=7.8hz),7.21(d,1h,j=7.2hz),4.67(s,1h),4.18(t,2h,j=7.5hz),3.25-3.18(m,10h),1.78-1.74(m,2h),1.62-1.58(m,2h),1.42(s,9h);13c-nmr(101mhz,cdcl3):δ164.5,164.0,156.4,155.9,132.6,131.1,130.3,129.9,126.1,125.6,123.2,116.6,114.9,79.0,54.4,46.2,40.2,39.7,28.4,27.5,25.4。
叔丁基(2-(4-(1,3-二氧代-2-丙基-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)乙基)氨基甲酸酯(3a)的合成
在100ml茄型烧瓶中,加入化合物2a(500mg,1.5mmol)、2-(boc-氨基)乙基溴(827mg,2.5当量,3.7mmol)、k2co3(510mg,2.5当量,3.7mmol)、50ml的乙腈,并在100℃下回流16小时。使反应溶液回到室温并过滤后,用蒸发器蒸馏去除反应溶液。使用硅胶柱以100%氯仿至氯仿/甲醇=9/1的梯度进行纯化。获得380mg黄色结晶(收率:54%)。
1h-nmr(400mhz,cdcl3)δ:8.58(d,1h,j=7.2hz),8.51(d,1h,j=8.5hz),8.39(d,1h,j=7.8hz),7.68(t,1h,j=7.8hz),7.21(d,1h,j=7.8hz),5.01(s,1h),4.13(t,2h,j=7.5hz),3.29(m,6h),2.79(s,4h),2.62(t,2h,j=7.3hz),1.78-1.73(m,2h),1.47(s,9h),1.00(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ164.4,163.9,155.9,155.8,132.4,131.0,130.1,129.8,126.1,125.6,123.2,116.7,114.8,79.2,61.9,57.2,52.9,42.3,41.7,37.1,28.4,23.2,21.4,11.5。
叔丁基(2-(4-(1,3-二氧代-2-戊基-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)乙基)氨基甲酸酯(3b)的合成
与化合物3a同样,用化合物2b(150mg,0.42mmol)、2-(boc-氨基)乙基溴(287mg,3.0当量,1.26mmol)、k2co3(177mg,3.0当量,1.26mmol)、15ml的乙腈进行合成,获得100mg黄色结晶(收率:48%)。
1h-nmr(400mhz,cdcl3)δ:8.58(d,1h,j=8.5hz),8.51(d,1h,j=7.8hz),8.39(d,1h,j=7.8hz),7.68(t,1h,j=7.8hz),7.21(d,1h,j=7.2hz),4.99(s,1h),4.15(t,2h,j=7.5hz),3.29(s,6h),2.78(s,4h),2.62(m,2h),1.72(m,2h),1.47(s,9h),1.39(s,2h),1.39(s,4h),0.91(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ164.4,164.0,155.9,155.8,132.5,131.0,130.1,129.8,126.1,125.6,123.3,116.8,114.9,79.3,57.2,53.0,45.7,40.3,37.1,29.7,29.2,28.4,27.8,22.4,14.0。
叔丁基(2-(4-(2-庚基-1,3-二氧代-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)乙基)氨基甲酸酯(3c)的合成
与化合物3a同样,用化合物2c(300mg,0.79mmol)、2-(boc-氨基)乙基溴(531mg,3.0当量,2.4mmol)、k2co3(327mg,3.0当量,2.4mmol)、30ml的乙腈进行合成,获得220mg黄色结晶(收率:53%)。
1h-nmr(400mhz,cdcl3)δ:8.56(d,1h,j=8.5hz),8.51(d,1h,j=7.8hz),8.39(d,1h,j=7.8hz),7.68(t,1h,j=7.8hz),7.21(d,1h,j=7.2hz),4.99(s,1h),4.15(t,2h,j=7.5hz),3.29(s,6h),2.78(s,4h),2.62(t,2h,j=7.8hz),1.75-1.68(m,2h),1.47(s,9h),1.43-1.28(m,8h),0.87(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ164.4,164.0,155.9,155.8,132.4,131.0,130.1,129.8,126.1,125.6,123.3,116.8,114.9,79.3,57.2,53.0,40.3,31.7,29.6,29.0,28.4,28.1,27.9,27.1,23.2,22.6,14.0。
叔丁基(2-(4-(2-癸基-1,3-二氧代-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)乙基)氨基甲酸酯(3d)的合成
与化合物3a同样,用化合物2d(300mg,0.71mmol)、2-(boc-氨基)乙基溴(478mg,3.0当量,2.1mmol)、k2co3(294mg,3.0当量,2.1mmol)、30ml的乙腈进行合成,获得200mg黄色结晶(收率:50%)。
1h-nmr(400mhz,cdcl3)δ:8.58(d,1h,j=8.5hz),8.51(d,1h,j=7.8hz),8.39(d,1h,j=7.8hz),7.68(t,1h,j=7.8hz),7.21(d,1h,j=7.2hz),4.99(s,1h),4.15(t,2h,j=7.5hz),3.29(s,6h),2.78(s,4h),2.62(t,2h,j=7.8hz),1.75-1.67(m,2h),1.47(s,9h),1.44-1.25(m,14h),0.88(t,3h,j=7.3hz);13c-nmr(101mhz,cdcl3):δ164.4,163.9,155.9,155.8,132.4,131.0130.1,129.8,126.1,125.6,123.3,116.8,114.8,79.2,61.2,57.2,53.0,40.3,37.1,31.8,29.5,29.4,29.3,28.7,28.4,28.1,27.9,27.1,22.6,14.1。
叔丁基(2-(6-(4-(2-((叔丁氧基羰基)氨基)乙基)哌嗪-1-基)-1,3-二氧代-1h-苯并[de]异喹啉-2(3h)-基)乙基)氨基甲酸酯(3e)的合成
与化合物3a同样,用化合物2e(300mg,0.71mmol)、2-(boc-氨基)乙基溴(475mg,3.0当量,2.1mmol)、k2co3(290mg,3.0当量,2.1mmol)、30ml的乙腈进行合成,获得220mg黄色结晶(收率:54%)。
1h-nmr(400mhz,cdcl3)δ:8.58(d,1h,j=8.5hz),8.52(d,1h,j=7.8hz),8.40(d,1h,j=7.8hz),7.68(t,1h,j=7.8hz),7.21(d,1h,j=7.2hz),5.01(s,2h),4.33(bs,2h),3.52-3.51(m,2h),3.29(s,6h),2.79(s,4h),2.62(bs,2h),1.47(s,9h),1.30(s,9h);13c-nmr(101mhz,cdcl3):δ164.8,164.3,156.0,155.9,132.8,131.3,130.4,130.0,126.1,125.6,123.0,116.5,114.9,79.3,79.0,57.2,53.0,52.9,39.9,39.6,37.1,28.4,28.2。
叔丁基(2-(6-(4-(2-((叔丁氧基羰基)氨基)乙基)哌嗪-1-基)-1,3-二氧代-1h-苯并[de]异喹啉-2(3h)-基)丁基)氨基甲酸酯(3f)的合成
与化合物3a同样,用化合物2f(150mg,0.33mmol)、2-(boc-氨基)乙基溴(300mg,4.0当量,1.32mmol)、k2co3(69mg,1.5当量,0.5mmol)、15ml的乙腈进行合成,获得160mg黄色结晶(收率:81%)。
1h-nmr(400mhz,cdcl3)δ:8.57(d,1h,j=8.5hz),8.51(d,1h,j=7.8hz),8.40(d,1h,j=7.8hz),7.68(t,1h,j=7.8hz),7.21(d,1h,j=7.2hz),4.98(s,1h),4.62(s,1h),4.18(t,2h,j=7.8hz),3.29(s,6h),3.19-3.18(m,2h),2.79(s,4h),2.62(t,2h,j=7.8hz),1.78-1.74(m,2h),1.62-1.58(m,2h),1.47(s,9h),1.42(s,9h);13c-nmr(101mhz,cdcl3):δ164.5,164.0,155.9,132.6,131.1,130.3,129.8,126.1,125.6,123.2,116.7,114.9,79.3,79.0,57.2,53.0,40.2,39.7,37.1,28.4,27.5,25.4。
2-(4-(1,3-二氧代-2-丙基-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)乙烷-1-胺盐酸盐(4a)的合成
在50ml的茄型烧瓶中,加入3a(150mg,0.32mmol)、5ml的thf溶解。向其中加入5ml的4nhcl/二恶烷(dioxane),并在室温下搅拌2小时。过滤收集析出的结晶,并用thf、chcl3过滤清洗,获得100mg黄色结晶(收率:77%)。
1h-nmr(400mhz,cd3od)δ:8.61-8.54(m,3h),7.86(t,1h,j=8.3hz),7.50(d,1h,j=7.3hz),4.12(t,2h,j=7.3hz),3.71-3.56(m,12h),1.80-1.71(m,2h),1.01(t,3h,j=7.3hz);13c-nmr(101mhz,cd3od):δ164.2,163.7,153.7,131.9,130.9,129.8,129.3,126.3,126.0,122.9,117.8,115.8,53.2,52.5,49.6,41.3,33.7,20.9,10.3。
2-(4-(1,3-二氧代-2-戊基-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)乙烷-1-胺盐酸盐(4b)的合成
与化合物4a同样,用化合物3b(130mg,0.26mmol)、5ml的thf、5ml的4nhcl/二恶烷合成,获得90mg的黄色结晶(收率:80%)。
1h-nmr(400mhz,cd3od)δ:8.62-8.54(m,3h),7.87(t,1h,j=8.3hz),7.50(d,1h,j=7.3hz),4.15(t,2h,j=7.3hz),3.68-3.50(m,12h),1.73(t,2h,j=8.3hz),1.42(s,4h),0.95(t,3h,j=7.3hz);13c-nmr(101mhz,cd3od):δ164.1,163.7,153.7,131.9,130.9,129.8,129.3,126.3,126.0,122.9,117.8,115.8,53.2,52.5,49.6,39.8,33.7,28.9,27.3,22.0,12.9。
2-(4-(2-庚基-1,3-二氧代-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)乙烷-1-胺盐酸盐(4c)的合成
与化合物4a同样,用化合物3c(130mg,0.24mmol)、5ml的thf、5ml的4nhcl/二恶烷合成,获得80mg的黄色结晶(收率:70%)。
1h-nmr(400mhz,cd3od)δ:8.50(d,1h,j=8.3hz),8.43(d,1h,j=8.3hz),7.80(t,1h,j=8.3hz),7.42(d,1h,j=7.3hz),4.08(t,2h,j=7.3hz),3.87-3.59(m,12h),1.68(t,2h,j=8.3hz),1.41-1.32(m,8h),0.91(t,3h,j=7.3hz);13c-nmr(101mhz,cd3od):δ164.1,163.7,153.7,131.8,130.8,129.8,129.3,126.3,126.0,122.8,117.8,115.7,53.2,52.5,49.6,39.8,33.7,31.5,28.7,27.6,26.7,22.2,13.0。
2-(4-(2-癸基-1,3-二氧代-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)乙烷-1-胺盐酸盐(4d)的合成
与化合物4a同样,用化合物3d(130mg,0.23mmol)、5ml的thf、5ml的4nhcl/二恶烷合成,获得80mg的黄色结晶(收率:69%)。
1h-nmr(400mhz,cd3od)δ:8.56-8.53(m,2h),8.49(d,1h,j=8.3hz),7.84(t,1h,j=8.3hz),7.46(d,1h,j=7.3hz),4.20(t,2h,j=7.3hz),3.90-3.58(m,12h),1.74-1.67(m,2h),1.41-1.30(m,14h),0.90(t,3h,j=7.3hz);13c-nmr(101mhz,cd3od):δ164.1,163.7,153.7,137.7,131.8,130.8,129.8,129.3,128.1,126.3,126.0,124.7,122.9,117.8,115.7,53.3,52.5,49.6,39.8,33.9,33.7,31.6,29.4,29.2,29.0,27.6,27.2,26.7,22.3,13.0。
2-(4-(2-(2-((叔丁氧基羰基)氨基)乙基)-1,3-二氧代-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)乙烷-1-胺盐酸盐(4e)的合成
与化合物4a同样,用化合物3e(120mg,0.21mmol)、5ml的thf、5ml的4nhcl/二恶烷合成,获得70mg的黄色结晶(收率:75%)。
1h-nmr(400mhz,cd3od)δ:8.67-8.59(m,3h),7.90(t,1h,j=8.3hz),7.52(d,1h,j=7.3hz),4.49(t,2h,j=7.3hz),3.71-3.57(m,12h)。
2-(4-(2-(2-((叔丁氧基羰基)氨基)乙基)-1,3-二氧代-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)丁烷-1-胺盐酸盐(4f)的合成
与化合物4a同样,用化合物3f(40mg,0.067mmol)、5ml的thf、5ml的4nhcl/二恶烷合成,获得20mg的黄色结晶(收率:64%)。
1h-nmr(400mhz,cd3od)δ:8.63-8.56(m,3h),7.88(t,1h,j=8.3hz),7.51(d,1h,j=7.3hz),4.22(t,2h,j=7.3hz),3.74-3.57(m,12h),3.03(t,2h,j=7.3hz),1.87-1.75(m,4h);13c-nmr(101mhz,dmso-d6):δ164.0,163.5,154.3,132.5,131.3,130.9,129.4,127.0,125.8,123.1,117.2,116.3,53.4,51.9,49.7,33.8,25.2,25.1。
叔丁基(5-((1,3-二氧代-2-戊基-2,3-二氢-1h-苯并[de]异喹啉-6-基)氨基)戊基)氨基甲酸酯(5h)的合成
在200ml的茄型烧瓶中,加入化合物1b(300mg,0.86mmol)、叔丁基(5-氨基戊基)氨基甲酸酯(210mg,1.2当量,1.0mmol)、40ml的2-甲氧基乙醇,在120℃下回流16小时。确认反应的进行后,用蒸发器蒸馏去除反应溶液。使用硅胶柱以100%氯仿至氯仿/甲醇=9/1的梯度进行纯化。获得310mg微黄色油(收率:77%)。
1h-nmr(400mhz,cdcl3)δ:8.58(d,1h,j=7.2hz),8.46(d,1h,j=8.5hz),8.17(d,1h,j=7.8hz),7.61(t,1h,j=7.8hz),6.70(d,1h,j=7.8hz),5.38(bs,1h),4.54(bs,1h),4.15(t,2h,j=7.5hz),3.43-3.39(m,),3.22-3.10(m),1.85(t),1.72(t),1.59-1.25(m),0.90(t,3h)。
叔丁基(2-((2-((1,3-二氧代-2-戊基-2,3-二氢-1h-苯并[de]异喹啉-6-基)氨基)乙基)(甲基)氨基)乙基)氨基甲酸酯(5i)的合成
与化合物5h同样,用化合物1b(200mg,0.57mmol)、叔丁基(2-((2-氨基乙基)(甲基)氨基)乙基)氨基甲酸酯(188mg,1.5当量,0.86mmol)、20ml的2-甲氧基乙醇进行合成,获得120mg的微黄色油(收率:43%)。
2-(4-(1,3-二氧代-2-丙基-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)乙烷-1-胺盐酸盐(6h)的合成
在50ml的茄型烧瓶中,加入化合物5h(100mg,0.86mmol)、10ml的thf并溶解。向其中加入10ml的4nhcl/二恶烷,并在室温下搅拌2小时。过滤收集析出的结晶后,以thf、chcl3过滤清洗,获得20mg的黄色结晶(收率:23%)。
1h-nmr(400mhz,cd3od)δ:8.57-8.52(m,2h),8.38(d,1h,j=7.3hz),7.67(t,1h,j=8.3hz),6.82(d,1h,j=7.3hz),4.12(t,2h,j=7.3hz),3.51(t,2h,j=7.3hz),2.97(t,2h),1.89-1.85(m,2h),1.79-1.69(m,2h),1.63-1.57(m,2h),1.54-1.46(m,2h),1.41(m,4h),0.95(t,3h,j=7.3hz)。
2-(4-(1,3-二氧代-2-丙基-2,3-二氢-1h-苯并[de]异喹啉-6-基)哌嗪-1-基)乙烷-1-胺盐酸盐(6i)的合成
在50ml的茄型烧瓶中,加入化合物5i(100mg,0.2mmol)、10ml的thf并溶解。向其中加入10ml的4nhcl/二恶烷,并在室温下搅拌2小时。过滤收集析出的结晶后,以thf、chcl3过滤清洗,获得20mg的黄色结晶(收率:23%)。
如图1所示,确认了化合物4a、4b、4e及4f均在ph6以下的酸性环境中,荧光强度增强。
实施例2:自噬的检测试验(1)
(1)将荧光化合物导入细胞以及自噬的诱导或抑制
将hela细胞接种在μ-slide8孔易必迪(ibidi)上,在37℃、co2培养箱中培养过夜。添加以血清培养基稀释的化合物4b(1μm)或化合物6h(0.1μm),培养30分钟。用血清培养基清洗两遍后,在不含氨基酸的培养基或含血清的培养基中,于37℃培养6小时或20小时,通过荧光显微镜进行观察。使用0.5μm雷帕霉素作为自噬诱导剂,使用10μm氯喹及0.1μm巴佛洛霉素a1作为自噬抑制剂。
使用流式细胞术评价
将hela细胞接种在24孔板(plate)上,在37℃、co2培养箱中培养过夜。添加以血清培养基稀释的1μm化合物4b,培养30分钟。用血清培养基清洗两遍后,添加氨基酸及不含血清的培养基,于37℃培养6小时或20小时。将细胞用pbs清洗一遍后,用0.25%胰蛋白酶-edta剥离,用于流式细胞术分析。
蛋白质免疫印迹法(westernblot)分析
将在任意条件下诱导的细胞以pbs清洗一遍,并用含有蛋白酶抑制剂的裂解缓冲液(lysisbuffer)回收细胞。以15%聚丙烯酰胺凝胶分离,并转印到pvdf膜上。阻断操作后,浸入稀释1000倍的anti-lc3抗体(mbl)中,并在4℃下培养16小时。用pbst清洗pvdf膜后,浸入稀释10000倍的hrp偶联抗体中,并在室温下摇动1小时。用pbst清洗三遍后,通过化学发光进行检测。
图2示出将化合物4b导入hela细胞,并培养6小时及20小时后的荧光显微镜图像。在图2中,“对照”表示对照组的结果。当通过添加雷帕霉素诱导自噬时(rapamycin&chloroquine,雷帕霉素&氯喹)、通过饥饿培养诱导自噬时(starved),均观测到荧光强度的增加。
图3示出将化合物4b导入hela细胞,并在饥饿培养条件下培养6小时及20小时后的流式细胞术的测量结果。确认了化合物4b不仅可用于荧光显微镜的检测,还可用于使用流式细胞术的自噬检测。
图4示出在氯喹的存在下,在进行通过雷帕霉素(rapamycin&chloroquine)或饥饿诱导(starved)的自噬的hela细胞中,荧光强度的变化。在图4中,“营养物”作为对照组,表示在通常的营养培养基中进行培养的hela细胞的测量结果。与图2的结果同样,确认了与自噬的诱导相伴的荧光强度的增加,不过,认为荧光强度的增加与图5所示使用蛋白质免疫印迹法的作为自噬标记的lc3的表达量的定量结果相关。
图6是示出化合物4b及6h的荧光强度的ph依存性的图表。确认了与化合物4b不同,化合物6h的荧光强度不显示ph依存性。可知,由于化合物6h在侧链中不存在具有非共用电子对的氮原子,因此,不会发生光诱导电子转移,因此,即使在ph6以上的环境下,荧光强度也不会降低。
图7示出导入到hela细胞的化合物4b及化合物6h的荧光强度的比较结果。与在几乎不发生自噬的对照组(control)、和在作为atp酶抑制剂并且抑制自噬体和溶酶体的融合的巴佛洛霉素(bafilomycin)的存在下,两种化合物的荧光强度都较低,而在自噬被诱导的饥饿条件下(starve),两种化合物都显示出高的荧光强度比较,在饥饿条件下加入巴佛洛霉素素时,相对于化合物4b的荧光强度降低,化合物6h的荧光强度未降低。这个结果表明,即使是在未与溶酶体融合的自噬体的内部中,化合物6h也显示出不依存于ph的荧光发射。
图8示出导入了化合物4b及化合物6h的hela细胞,在自噬诱导条件下的高倍荧光显微镜图像。从a-1及a-2所示的荧光显微镜图像的局部放大图可以清楚地确认,化合物6h发射出环状的荧光。这揭示化合物6h仅染色了自噬体膜。通过这些结果,可以期待化合物6h从自噬体的形成阶段显示响应。
通过使用荧光强度显示ph依存性的荧光化合物4b及荧光强度不显示ph依存性的荧光化合物6h,可以分阶段检测自噬体的形成(自噬的初期)、降解过程中的自溶酶体(自噬的后期)。通过与现有方法结合,可以期待自噬的机制及与细胞内细胞器的相关性的阐明。
实施例3:荧光化合物的合成(2)
2-戊基-1h-苯并[10,5]蒽[2,1,9-def]异喹啉-1,3(2h)-二酮(7)的合成
在200ml茄型烧瓶中,加入苝-3,4-二羧酸酐(1g,3.1mmol)、丙胺(322mg,1.2当量,3.7mmol)、dmap(452mg,1.2当量,3.7mmol)、100ml的dmf,并在90℃下回流16小时。回到室温后,过滤析出的结晶,获得1g的红色结晶(收率:82%)。
1h-nmr(400mhz,cdcl3)δ:8.40(d,2h),8.24(d,2h),8.18(d,2h),7.81(d,2h),7.55(d,2h),4.16(t,2h),1.78-1.75(m,2h),1.46-1.42(m,4h),0.94(t,3h)。
8-溴-2-己基-1h-苯并[10,5]蒽[2,1,9-def]异喹啉-1,3(2h)-二酮(8)的合成
在200ml茄型烧瓶中,加入化合物7(1g,2.5mmol)、100ml的1,2-二氯乙烷并溶解。加入溴,回流16小时,获得800mg的黑色结晶(收率:68%)。
1h-nmr(400mhz,cdcl3)δ:8.56(t,2h),8.44(d,1h),8.38(d,1h),8.33(d,1h),8.29(d,1h),8.18(d,1h),7.89(d,1h),7.70(t,1h),4.19(t,2h),1.76(t,2h),1.42(m,4h),0.93(t,3h)。
2-戊基-8-(哌嗪-1-基)-1h-苯并[10,5]蒽[2,1,9-def]异喹啉-1,3(2h)-二酮(9)的合成
在200ml茄型烧瓶中,使用化合物8(300mg,0.63mmol)、哌嗪(542mg,10当量,6.3mmol)、100ml的2-甲氧基乙醇进行合成,获得300mg黑色结晶(收率:95%)。
1h-nmr(400mhz,cdcl3)δ:8.52(t,2h),8.41(d,1h),8.34(t,2h),8.24(t,2h),7.62(t,1h),7.19(d,1h),4.19(t,2h),3.22(m,8h),1.70(m,2h),1.42(m,4h),0.92(t,3h)。
叔丁基(2-(4-(1,3-二氧代-2-戊基-2,3-二氢-1h-苯并[10,5]蒽[2,1,9-def]异喹啉-8-基)哌嗪-1-基)乙基)氨基甲酸酯(10)的合成
在100ml茄型烧瓶中,使用化合物9(300mg,0.63mmol)、2-(boc-氨基)乙基溴(212mg,1.5当量,0.94mmol)、k2co3(130mg,1.5当量,0.94mmol)、50ml的乙腈进行合成,获得100mg的黑色结晶(收率:25%)。
1h-nmr(400mhz,cdcl3)δ:8.54(t,2h),8.43(d,1h),8.37-8.34(dd,2h),8.28(d,1h),8.22(d,1h),7.62(t,1h),7.20(d,1h),5.03(s,1h),4.19(t,2h),3.34-3.25(m,6h),2.80(s,4h),2.63(t,2h),1.76(m,2h),1.60(s,8h),1.49(s,9h),1.42(m,5h),1.33-1.25(m,6h),0.91(t,3h);13c-nmr(101mhz,cdcl3):δ164.0,156.0,152.6,137.4,137.3,131.5,131.3,129.8,129.5,129.0,128.8,126.7,126.2,124.6,124.0,123.9,120.6,119.7,118.9,115.7,57.3,53.2,52.9,40.4,37.1,29.6,29.5,29.3,29.1,28.4,27.8,24.8,22.6,22.5,14.1,14.0。
8-(4-(2-氨基乙基)哌嗪-1-基)-2-戊基-1h-苯并[10,5]蒽[2,1,9-def]异喹啉-1,3(2h)-二酮(11)的合成
在50ml茄型烧瓶中,使用化合物10(100mg,0.16mmol)、5ml的thf、5ml的4nhcl/二恶烷进行合成,获得30mg的黑色结晶(收率:33%)。
1h-nmr(400mhz,cd3od)δ:8.34(d,1h),8.27(d,1h),8.23-8.13(m,4h),7.61(t,1h),7.30(d,1h),4.10(t,2h),3.74-3.49(m,12h),1.74(t,2h),1.46-1.45(m,4h),0.99(t,3h)。
如图9所示,确认了化合物11在ph6以下的酸性环境下,荧光强度增加。
叔丁基(5-((1,3-二氧代-2-戊基-2,3-二氢-1h-苯并[10,5]蒽[2,1,9-def]异喹啉-8-基)氨基)戊基)氨基甲酸酯(12)的合成
在200ml茄型烧瓶中,使用化合物8(300mg,0.63mmol)、叔丁基(2-((2-氨基乙基)(甲基)氨基)乙基)氨基甲酸酯(210mg,1.5当量,0.94mmol)、30ml的2-甲氧基乙醇进行合成,获得100mg深紫色油(收率:19%)。
1h-nmr(400mhz,cdcl3)δ:8.21-8.20(m,3h),7.92(d,1h),7.85(d,2h),7.62(d,1h),7.47(t,1h),6.63(d,1h),3.30-3.14(m,6h),1.67-1.50(m,6h),1.42(s,9h),1.29-1.28(m,4h),0.88(t,3h)。
5-((1,3-二氧代-2-戊基-2,3-二氢-1h-苯并[10,5]蒽[2,1,9-def]异喹啉-8-基)氨基)戊烷-1-胺盐酸盐(13)的合成
在50ml茄型烧瓶中,使用化合物12(100mg,0.16mmol)、5ml的thf、5ml的4nhcl/二恶烷进行合成,获得30mg的黑色结晶(收率:33%)。
1h-nmr(400mhz,cd3od)δ:8.23-8.22(m,3h),7.94(d,1h),7.86(d,2h),7.65(d,1h),7.46(t,1h),6.66(d,1h),3.35-3.17(m,6h),1.68-1.49(m,6h),1.33-1.29(m,4h),0.92(t,3h)。
确认了化合物13的荧光强度,与化合物6h同样,未显示出ph依存性。
实施例4:自噬的检测试验(2)
将hela细胞接种在μ-slide8孔易必迪(ibidi)上,在37℃、co2培养箱中培养过夜。添加以血清培养基稀释的化合物6h(0.1μm),培养30分钟。用血清培养基清洗两遍后,在不含氨基酸的培养基或含血清的培养基中,于37℃培养5小时,通过荧光显微镜进行观察。
图10示出将化合物6h导入hela细胞,并培养5小时后的荧光显微镜图像。在图10中,“对照”表示对照组的结果。当通过饥饿培养诱导自噬时(starve),检测到荧光强度增加。
实施例5:自噬的检测试验(3)
将hela细胞接种在μ-slide8孔易必迪(ibidi)上,在37℃、co2培养箱中培养过夜。添加以血清培养基稀释的化合物6h(1μm)及化合物11(0.1μm),培养30分钟。用血清培养基清洗两遍后,在不含氨基酸的培养基或含血清的培养基中,于37℃培养6小时,通过荧光显微镜进行观察。
图11示出将化合物6h及化合物11导入hela细胞,并培养3小时及6小时后的荧光显微镜图像。在图11中,“对照”表示对照组的结果。当通过饥饿培养诱导自噬时(starve),将化合物6h及化合物11导入同一细胞并进行饥饿培养的结果,确认了仅由化合物6h染色的颗粒斑点及由化合物6h和化合物11共染色的颗粒斑点。这些结果表明,通过使用具有不同荧光波长及ph响应性的两种类型的荧光化合物,分阶段区分了自噬体形成过程和自溶酶体形成期。
实施例6:自噬的检测试验(4)
将hela细胞接种在μ-slide8孔易必迪(ibidi)上,在37℃、co2培养箱中培养过夜。添加以血清培养基稀释的化合物4b(1μm)及化合物13(0.1μm),培养30分钟。用血清培养基清洗两遍后,在不含氨基酸的培养基或含血清的培养基中,于37℃培养3小时或6小时,通过荧光显微镜进行观察。
图12示出将化合物4b及化合物13导入hela细胞,并培养3小时及6小时后的荧光显微镜图像。在图12中,“对照”表示对照组的结果。当通过饥饿培养诱导自噬时(starve),将化合物4b及化合物13导入同一细胞并进行饥饿培养的结果,确认了仅由化合物4b染色的颗粒斑点和由化合物4b和化合物13共染色的颗粒斑点。这些结果表明,通过使用具有不同荧光波长及ph响应性的两种类型的荧光化合物,分阶段地区分了自噬体形成过程和自溶酶体形成期。
此外,在不脱离本发明的广义精神和范围的情况下,可以对本发明进行各种修改和变形。此外,上述实施方式用于解释本发明,而不限定本发明的范围。即,本发明的范围不是由实施方式示出,而是由权利要求书示出。此外,在权利要求书的范围内和与其同等的发明意义范围内所实施的各种变形被视为在本发明的范围内。
本申请,基于2017年5月19日申请的日本专利申请no.2017-100197,并且包括其说明书、权利要求书、附图及摘要。在所述日本专利申请中的公开,其全部内容作为参考被包括于本说明书中。
- 还没有人留言评论。精彩留言会获得点赞!