由间介中胚层细胞分化诱导肾祖细胞的方法和由多能干细胞分化诱导肾祖细胞的方法与流程
本发明涉及由间介中胚层细胞分化诱导肾祖细胞的方法。本发明还涉及由多能干细胞分化诱导肾祖细胞的方法。
背景技术:
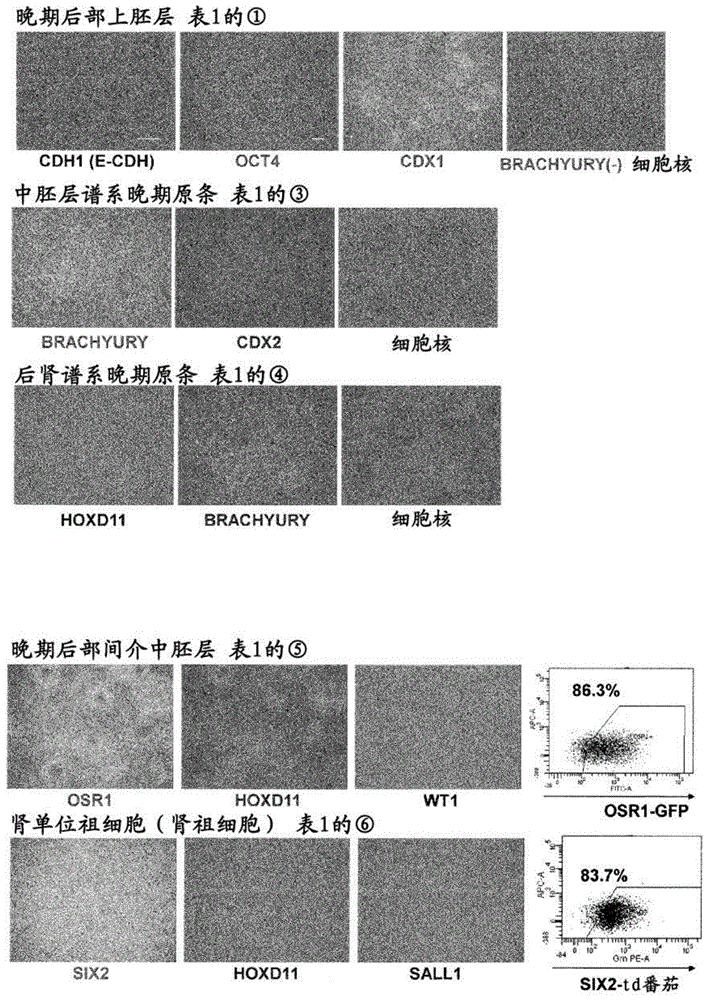
:目前,推测日本的慢性肾病(ckd)患者数约为1,300万人,被称为新的国民病。针对慢性肾病的根治性治疗方法少,根据其进展情况,必须进行透析治疗的终末期慢性肾功能衰竭患者为30万人以上,这不仅是医学上的一大问题,也是医疗经济上的一大问题。作为包括终末期慢性肾功能衰竭的慢性肾病的根治方法,可列举肾移植,但由于严重的供体器官不足而处于供应完全跟不上需求的状态。肾脏来源于作为早期胚胎组织的间介中胚层,在脊椎动物中,由间介中胚层形成前肾、中肾、后肾3个肾脏,在哺乳类中,后肾形成成体的肾脏。后肾是将分化出被称为间充质的成体肾的肾单位和间质的组织与将由被称为输尿管芽的成体肾集合管分化出下部的肾盂、尿管、膀胱的一部分的组织这两种组织的相互作用而产生的。进一步显示,后肾间质中存在具有分化出构成肾单位的肾小球和数种肾小管上皮细胞的多能性的肾单位祖细胞(非专利文献1、2)。如果确立了由人的人工多能干(ips)细胞、人的胚性干(es)细胞高效分化诱导肾单位祖细胞的方法,则可以期待将来通过三维肾脏的再建来解决肾移植供体不足的问题,作为肾小球、肾小管细胞的供应源用于细胞疗法。进一步,还可以期待发展使用肾小球、肾小管细胞、包含它们的肾组织的药物肾毒性评价体系、使用由疾病特异性ips细胞制作的肾细胞和肾组织的疾病模型的制作、治疗药物的开发等研究。已经报道了几种由人ips细胞、人es细胞分化诱导肾单位祖细胞的方法(非专利文献3~6),但存在因为使用胚样体(embryoidbody,eb)而分化诱导效率低(非专利文献3)、无法确定是否正确再现了发生的各阶段的问题(非专利文献4~6)。此外,本发明人等的团队公开了一种由间介中胚层细胞制造肾祖细胞的方法,包括将间介中胚层细胞用含有tgfβ信号刺激剂和bmp抑制剂的培养基培养的工序(专利文献1),但需要能够更高效地分化诱导肾祖细胞的方法。现有技术文献专利文献专利文献1:wo2014/200115非专利文献非专利文献1:osafunek.等,development2006;133:151-61。非专利文献2:kobayashia.等,cellstemcell2008;3:169-81。非专利文献3:taguchia.等,cellstemcell.2014;14:53-67。非专利文献4:takasatom.等,natcellbiol.2014;16:118-26。非专利文献5:takasatom.等,nature.2015;526:564-568。非专利文献6:morizaner.等,nat.biotechnol.2015;33:1193-1200。技术实现要素:发明所要解决的课题本发明的课题在于,提供一种高效地由间介中胚层细胞分化诱导肾祖细胞的方法。更具体地,提供一种包括将由多能干细胞诱导的间介中胚层细胞进一步向肾祖细胞分化诱导的工序的、由间介中胚层细胞分化诱导肾祖细胞的方法。用于解决课题的方法为了解决上述课题,本发明人等进行了深入研究,结果发现,通过用含有gsk-3β抑制剂和fgf9的培养基进行黏附培养,能够由间介中胚层细胞分化诱导肾祖细胞。本发明是基于这样的见解完成的。即,本发明具有以下特征:[1]一种肾祖细胞的制造方法,包括将间介中胚层细胞用含有gsk(糖原合酶激酶)-3β抑制剂和fgf(成纤维细胞生长因子)9的培养基黏附培养、由间介中胚层细胞诱导肾祖细胞的工序。[2]根据[1]所述的方法,前述肾祖细胞为six2阳性细胞。[3]根据[1]或[2]所述的方法,前述间介中胚层细胞为osr1阳性细胞。[4]根据[1]~[3]中任一项所述的方法,gsk-3β抑制剂为chir99021。[5]根据[1]~[4]中任一项所述的方法,前述培养基进一步含有rock抑制剂。[6]根据[1]~[5]中任一项所述的方法,前述黏附培养使用由细胞外基质包被的培养容器来进行。[7]根据[6]所述的方法,前述细胞外基质为层粘连蛋白511的e8片段。[8]根据[1]~[7]中任一项所述的方法,前述间介中胚层细胞为由多能干细胞诱导的间介中胚层细胞。[9]根据[8]所述的方法,前述间介中胚层细胞为通过包括以下的工序(i)~(v)的方法制造的间介中胚层细胞。(i)将多能干细胞用含有fgf2、bmp(骨形态发生蛋白)4、gsk-3β抑制剂和视黄酸或其衍生物的培养基培养的工序;(ii)将工序(i)中得到的细胞用含有fgf2、gsk-3β抑制剂和bmp7的培养基培养的工序;(iii)将工序(ii)中得到的细胞用含有fgf2、gsk-3β抑制剂、bmp7和tgfβ抑制剂的培养基培养的工序;(iv)将工序(iii)中得到的细胞用含有fgf2、gsk-3β抑制剂、bmp7、激活素和rock抑制剂的培养基培养的工序;以及(v)将工序(iv)中得到的细胞用含有视黄酸或其衍生物和fgf9的培养基培养的工序。[10]根据[9]所述的方法,工序(v)的培养基进一步含有bmp抑制剂。[11]根据[8]至[10]中任一项所述的方法,前述多能干细胞为人工多能干(ips)细胞。[12]根据[11]所述的方法,前述ips细胞为人ips细胞。[13]一种由多能干细胞制造肾祖细胞的方法,包括以下的工序(i)~(vi)。(i)将多能干细胞用含有fgf2、bmp4、gsk-3β抑制剂和视黄酸或其衍生物的培养基培养的工序;(ii)将工序(i)中得到的细胞用含有fgf2、gsk-3β抑制剂和bmp7的培养基培养的工序;(iii)将工序(ii)中得到的细胞用含有fgf2、gsk-3β抑制剂、bmp7和tgfβ抑制剂的培养基培养的工序;(iv)将工序(iii)中得到的细胞用含有fgf2、gsk-3β抑制剂、bmp7、激活素和rock(rho-kinase)抑制剂的培养基培养的工序;(v)将工序(iv)中得到的细胞用含有视黄酸或其衍生物和fgf9的培养基培养的工序;以及(vi)将工序(v)中得到的细胞用含有gsk-3β抑制剂和fgf9的培养基培养、由间介中胚层细胞诱导肾祖细胞的工序。[14]根据[13]所述的方法,工序(v)的培养基进一步含有bmp抑制剂。[15]根据[13]或[14]所述的方法,前述肾祖细胞为six2阳性细胞。[16]根据[13]~[15]中任一项所述的方法,前述工序(v)中得到的细胞为osr1阳性细胞。[17]根据[13]~[16]中任一项所述的方法,前述gsk-3β抑制剂为chir99021。[18]根据[13]~[17]中任一项所述的方法,前述工序(vi)的培养基进一步含有rock抑制剂。[19]根据[13]~[18]中任一项所述的方法,前述培养使用由细胞外基质包被的培养容器来进行。[20]根据[19]所述的方法,前述细胞外基质为层粘连蛋白511的e8片段。[21]根据[13]~[20]中任一项所述的方法,前述多能干细胞为人工多能干(ips)细胞。[22]根据[21]所述的方法,前述ips细胞为人ips细胞。[23]一种肾祖细胞,其是通过[1]~[22]中任一项所述的方法制造的。[24]一种肾脏类器官,其是使用通过[1]~[22]中任一项所述的方法制造的肾祖细胞得到的。[25]一种医药组合物,包含通过[1]~[22]中任一项所述的方法制造的肾祖细胞或使用其得到的肾脏类器官。[26]一种肾病治疗剂,包含通过[1]~[22]中任一项所述的方法制造的肾祖细胞或使用其得到的肾脏类器官。发明的效果根据本发明的方法,因为通过黏附培养进行培养,所以能够以80%以上的高效率由人ips细胞分化诱导肾祖细胞。进一步,因为是使派生出后肾间质肾单位祖细胞的后部上胚层、晚期体节中胚层细胞、后部间介中胚层细胞各发生分化阶段正确再现的方法,所以能够进行各阶段细胞的分析。后肾为形成成体肾的一种胎儿肾组织,是肾脏再生中必需的组成部分。此外,发生在后肾肾单位祖细胞、由其派生的肾小球、肾小管中的肾病多,因此本发明的方法在肾病模型制作中也是有用的。因此,本发明的方法在针对肾病的治疗方法、治疗药物的探索的观点上也是有用的。附图说明图1为显示表示由人ips细胞分化诱导的晚期后部上胚层、中胚层谱系晚期原条、后肾谱系晚期原条、晚期后部间介中胚层和肾单位祖细胞(肾祖细胞)的免疫细胞染色结果的图(照片)。对于晚期后部间介中胚层和肾单位祖细胞,还用facs显示了标志物阳性细胞的比例。图2为显示将人ips细胞来源肾祖细胞与小鼠胎幼崽肾共培养而得到的肾脏类器官染色结果的照片。图中,podocalyxin(pcx)表示肾小球的标志物,ltl表示近端小管的标志物,cdh1表示远端小管的标志物,cdh6表示近端小管的标志物,nephrin(nphn)表示肾小球的标志物,此外,比例尺表示50μm。图3为显示培养人ips细胞来源肾祖细胞而得到的肾脏类器官的明场图像和免疫染色图像的照片。图中,podocalyxin表示肾小球的标志物,ltl表示近端小管的标志物,cdh1和brn1表示远端小管和亨利氏环的标志物。dolicosbiflorusagglutinin(dba)为远端小管标志物。具体实施方式以下,详细地对本发明进行说明。<由间介中胚层细胞分化诱导肾祖细胞>本发明提供一种制造肾祖细胞的方法,包括将间介中胚层细胞用含有gsk-3β抑制剂和fgf9的培养基培养的工序(也称为肾祖细胞分化诱导工序)。本发明中,间介中胚层细胞的意思是,通过用含有gsk-3β抑制剂和fgf9的培养基培养来诱导肾祖细胞的任意细胞。作为获得间介中胚层细胞的方法,例如,公知的是由小鼠和人的多能干细胞分化诱导间介中胚层细胞的方法(biochembiophysrescommun.393:877-82(2010),natcommun.4:1367(2013)、wo2012/011610和专利文献1)。作为表征间介中胚层细胞的标志物,osr1是已知的,作为本发明的方法中使用的间介中胚层细胞的例子,可列举osr1阳性的间介中胚层细胞。例如对具有导入osr1启动子控制之下的报告基因(例如gfp)的多能干细胞(例如后述实施例记载的osr1-gfp报告-人ips细胞)进行培养,以该报告基因的表达为指标,通过本领域公知的方法(例如使用细胞分选仪的方法)可以分离osr1阳性的间介中胚层细胞。此外,也可以利用定量rt-pcr(natcommun4,1367,(2013))等分析基因表达的方法来确认间介中胚层细胞中osr1的表达。本发明中,osr1阳性的间介中胚层细胞包括表达osr1蛋白的细胞和表达由osr1启动子控制下的基因编码的蛋白的细胞。本发明中,osr1包括:人的情况下具有ncbi登录号nm_145260.2中记载的核苷酸序列、小鼠的情况下具有ncbi登录号nm_011859.3中记载的核苷酸序列的基因以及该基因编码的蛋白、以及具有它们的功能的天然存在的突变体。优选本发明的方法中使用的间介中胚层细胞为six2阴性且osr1、hox11、wt1阳性的细胞。本发明中,肾祖细胞是作为与肾单位祖细胞同等的细胞对待、在体外能够向肾脏的肾小球样结构、肾小管样结构等器官结构分化的细胞,向器官结构的分化能力例如可以通过osafunek等(2006),development133:151-61记载的方法来评价。作为用于维持作为肾祖细胞的状态的特征性因子,six2是已知的(cellstemcell3:169-181(2008)),作为通过本发明的方法诱导的肾祖细胞的例子,可列举six2阳性的肾祖细胞。例如对具有导入至six2启动子控制之下的报告基因(例如tdtomato(td番茄))的多能干细胞(例如后述实施例记载的osr1-gfp/six2-tdtomato报告-人ips细胞)进行培养,以该报告基因的表达为指标,通过本领域公知的方法(例如使用细胞分选仪的方法),可以分离six2阳性的肾祖细胞。此外,也可以通过定量rt-pcr(natcommun4,1367,(2013))等分析基因表达的方法来确认肾祖细胞中six2的表达。本发明中,six2阳性的肾祖细胞包括表达six2蛋白的细胞和表达处于six2启动子控制之下的基因编码的蛋白的细胞。本发明中,six2包括:人的情况下具有ncbi登录号nm_016932.4中记载的核苷酸序列、小鼠的情况下具有ncbi登录号nm_011380.2中记载的核苷酸序列的基因以及该基因编码的蛋白、以及具有它们的功能的天然存在的突变体。优选通过本发明的方法诱导的肾祖细胞为osr1阳性且hox11、wt1、six2和sall1阳性的细胞。本发明中,间介中胚层细胞或肾祖细胞可以作为包含其他细胞种类的细胞群提供,也可以为纯化的细胞团。优选为含有5%以上、6%以上、7%以上、8%以上、9%以上、10%、20%、28%或30%以上该细胞的细胞群。纯化可以以上述标志物为指标,通过facs等方法来进行。本发明中,黏附培养的意思是细胞在黏附于培养基材的状态被培养,例如,意思是利用经包被处理的培养皿进行培养。作为包被剂,优选为细胞外基质,例如可列举胶原蛋白、蛋白聚糖、纤连蛋白、玻尿酸、肌腱蛋白、肌动蛋白、弹性蛋白、纤维蛋白和层粘连蛋白等物质或它们的片段。这些细胞外基质可以组合使用,例如可以为bdmatrigel(商标)等来自细胞的制备物。细胞外基质优选为层粘连蛋白或其片段。本发明中层粘连蛋白为具有α链、β链、γ链各有一根的异源三聚体结构的蛋白,是存在亚基链的组成不同的亚型的细细胞外基质蛋白。层粘连蛋白是5种α链、4种β链和3种γ链的异源三聚体的组合,约有15种亚型。没有特别限定,例如可例示α链为α1、α2、α3、α4或α5、β链为β1、β2、β3或β4、并且γ链为γ1、γ2或γ3。层粘连蛋白更优选为由α5、β1和γ1构成的层粘连蛋白511(natbiotechnol28,611-615(2010))。层粘连蛋白可以是片段,只要是具有整合素连接活性的片段就没有特别限定,例如可以为作为用弹性蛋白酶消化而得到的片段的e8片段(层粘连蛋白511e8)(emboj.,3:1463-1468,1984,j.cellbiol.,105:589-598,1987,wo2011/043405)。层粘连蛋白511e8是有市售的,例如可以从nippi株式会社等购买。肾祖细胞分化诱导工序中使用的培养基可以在动物细胞的培养中使用的基础培养基中添加gsk-3β抑制剂和fgf9而制备。作为基础培养基,例如包括imdm培养基、medium199培养基、伊格尔极限必需培养基(eagle’sminimumessentialmedium,emem)、αmem培养基、杜尔贝科改良伊格尔培养基(dulbecco’smodifiedeagle’smedium,dmem)、ham’sf12(f12)培养基、rpmi1640培养基、fischer’s培养基和它们的混合培养基等。培养基中可以含有血清(例如胎牛血清(fbs)),或者也可以是无血清的。根据需要,可以含有例如白蛋白、转铁蛋白、knockoutserumreplacement(ksr)(es细胞培养时的血清替代物)(invitrogen)、n2添加剂(invitrogen)、b27添加剂(invitrogen)、脂肪酸、胰岛素、胶原蛋白前体、微量元素、2-巯基乙醇、3’-巯基甘油等1种以上血清替代物,也可以含有脂质、氨基酸、l-谷氨酰胺、glutamax(invitrogen)、非必需氨基酸(neaa)、维生素、生长因子、抗生素、抗氧化剂、丙酮酸、缓冲剂、无机盐类和它们的等同物等1种以上物质。也可以使用reproff2(reprocell)等预先针对干细胞培养进行了优化的培养基。此外,肾祖细胞分化诱导工序中使用的培养基中还可以含有后述y-27632等rock抑制剂。肾祖细胞分化诱导工序中使用的gsk-3β抑制剂只要能够抑制gsk-3β的功能、例如激酶活性就没有特别限定,例如可列举作为靛玉红衍生物的bio(别名,gsk-3β抑制剂ix,6-溴靛玉红-3’-肟)、作为马来酰亚胺衍生物的sb216763(3-(2,4-二氯苯基)-4-(1-甲基-1h-吲哚-3-基)-1h-吡咯-2,5-二酮)、作为苯基-α-溴甲基酮化合物的gsk-3β抑制剂vii(α,4-二溴苯乙酮)、作为细胞膜透过型磷酸化肽的l803-mts(别名,gsk-3β肽抑制剂,myr-n-gkeappappqspp-nh2)和具有高选择性的chir99021(nature(2008)453:519-523)。这些化合物例如可以从stemgent公司、calbiochem公司、biomol公司等获得,此外也可以自行制作。作为本工序中使用的优选的gsk-3β抑制剂,可列举chir99021。本领域技术人员可以根据所使用的gsk-3β抑制剂适当选择本工序中使用的gsk-3β抑制剂的浓度,例如为0.01μm至100μm,优选为0.1μm至10μm,进一步优选为0.5μm至3μm,特别优选为0.5μm至1.5μm。肾祖细胞分化诱导工序中使用的fgf9优选为人fgf9,作为人fgf9,例如可列举具有ncbi(美国国立生物技术信息中心)的登录号np_002001.1的氨基酸序列的蛋白。fgf9只要具有分化诱导活性即可,也包括其片段和功能突变体。fgf9可以使用市售产品,也可以使用从细胞纯化的蛋白、通过基因重组产生的蛋白。该工序中使用的fgf9的浓度例如为1ng/ml至500ng/ml、1ng/ml至100ng/ml、5ng/ml至50ng/ml或5ng/ml至25ng/ml。长时间培养对肾祖细胞的制造效率没有特殊影响,因此肾祖细胞分化诱导工序的培养天数没有上限,例如可列举2天以上、3天以上、4天以上、5天以上。肾祖细胞分化诱导工序中,培养温度不限定于下面的温度,约为30~40℃,优选约为37℃,优选在含有co2的空气气氛下进行培养,co2浓度优选约为2~5%。本发明一个实施方式中,间介中胚层细胞是由多能干细胞诱导的间介中胚层细胞。这种情况下,也可以暂时将诱导的间介中胚层细胞分离,通过本发明的培养工序将分离的间介中胚层细胞向肾祖细胞诱导。或者也可以由多能干细胞诱导间介中胚层细胞,不将间介中胚层细胞分离,而是直接用于本发明的培养工序,从而诱导肾祖细胞。将间介中胚层细胞分离的情况下,也可以使用具有表达被内源性osr1启动子控制的报告基因的多能干细胞。作为将报告基因导入多能干细胞的osr1启动子控制之下的方法,例如可列举使用bac载体等的同源重组,记载于wo2012/011610等中。此外,为了分离诱导的肾祖细胞,可以使用具有表达被six2启动子控制的报告基因的多能干细胞,可以使用与前述同样的方法来制作。作为所使用的报告基因,可列举编码β-半乳糖苷酶、β-葡糖苷酶、荧光素酶、绿色荧光蛋白(gfp)、tdtomato、细胞表面蛋白等公知的报告蛋白的基因。由这些多能干细胞诱导的间介中胚层细胞或肾祖细胞可以使用本领域公知的方法分离:以该报告蛋白的表达为指标,使用细胞分选仪的方法;使用针对该细胞的表面蛋白的抗体,使用磁珠,利用磁性对细胞进行筛选的方法(例如macs);使用固定有其抗体等的载体(例如细胞浓缩柱)的方法等。本发明中的多能干细胞是具有能够分化出生物体中存在的多种细胞的多能性、且同时具有増殖能力的干细胞,包括诱导出本发明中使用的间介中胚层细胞的任意细胞。多能干细胞没有特别限定,例如包括胚性干(es)细胞、通过核移植得到的克隆胚来源的胚性干(ntes)细胞、精原干细胞(“gs细胞”)、胚性生殖细胞(“eg细胞”)、人工多能干(ips)细胞、培养成纤维细胞、骨髄干细胞来源的多能性细胞(muse细胞)等。从在制造工序中不会破坏胚、卵子等且能够获得的观点出发,优选多能干细胞为ips细胞,更优选为人ips细胞。ips细胞的制造方法是本领域公知的,可以通过向任意体细胞导入初始化因子来制造。这里,初始化因子例如可列举oct3/4、sox2、sox1、sox3、sox15、sox17、klf4、klf2、c-myc、n-myc、l-myc、nanog、lin28、fbx15、eras、ecat15-2、tcl1、beta-catenin、lin28b、sall1、sall4、esrrb、nr5a2、tbx3或glis1等基因或基因产物,这些初始化因子可以单独使用,也可以组合使用。作为初始化因子的组合,可例示wo2007/069666、wo2008/118820、wo2009/007852、wo2009/032194、wo2009/058413、wo2009/057831、wo2009/075119、wo2009/079007、wo2009/091659、wo2009/101084、wo2009/101407、wo2009/102983、wo2009/114949、wo2009/117439、wo2009/126250、wo2009/126251、wo2009/126655、wo2009/157593、wo2010/009015、wo2010/033906、wo2010/033920、wo2010/042800、wo2010/050626、wo2010/056831、wo2010/068955、wo2010/098419、wo2010/102267、wo2010/111409、wo2010/111422、wo2010/115050、wo2010/124290、wo2010/147395、wo2010/147612、huangfud等(2008)nat.biotechnol.26:795-797、shiy等(2008)cellstemcell2:525-528、eminlis等(2008)stemcells.26:2467-2474、huangfud等(2008)nat.biotechnol.26:1269-1275、shiy等(2008)cellstemcell3,568-574、zhaoy等(2008)cellstemcell3:475-479、marsona(2008)cellstemcell3,132-135、fengb等(2009)nat.cellbiol.11:197-203、r.l.judson等(2009)nat.biotechnol.27:459-461、lyssiotisca等(2009)procnatlacadsciusa.106:8912-8917、kimjb等(2009)nature.461:649-643、ichidajk等(2009)cellstemcell.5:491-503、hengjc等(2010)cellstemcell.6:167-74、hanj等(2010)nature.463:1096-100、malip等(2010)stemcells.28:713-720、maekawam等(2011)nature.474:225-9.记载的组合。体细胞非限定地包括胎儿(幼崽)的体细胞、新生儿(幼崽)的体细胞和成熟的健康或疾病性的体细胞中的任一种,此外,也包括原代培养细胞、继代细胞和细胞株中的任一种。具体地,体细胞可例示例如(1)神经干细胞、造血干细胞、间充质干细胞、牙髓干细胞等组织干细胞(体性干细胞)、(2)组织祖细胞、(3)血液细胞(外周血细胞、脐带血细胞等)、淋巴细胞、上皮细胞、内皮细胞、肌肉细胞、成纤维细胞(皮肤细胞等)、毛细胞、肝细胞、胃粘膜细胞、肠细胞、脾细胞、胰细胞(胰外分泌细胞等)、脑细胞、肺细胞、肾细胞和脂肪细胞等已分化的细胞等。此外,将ips细胞用作移植用细胞的材料的情况下,从不发生排斥反应的观点出发,优选使用移植前个体的hla基因型相同或基本相同的体细胞。这里,“基本相同”是指,hla基因型一致到能够利用免疫抑制剂抑制对移植的细胞的免疫反应的程度,例如具有hla-a、hla-b和hla-dr3个基因座或加上hla-c这4个基因座一致的hla型的体细胞。<由多能干细胞分化诱导间介中胚层细胞>本发明中,由多能干细胞分化诱导间介中胚层细胞时,可以使用包括以下的工序的方法。(i)将多能干细胞用含有fgf2、bmp(骨形态发生蛋白)4、gsk-3β抑制剂和视黄酸或其衍生物的培养基培养的工序;(ii)将工序(i)中得到的细胞用含有fgf2、gsk-3β抑制剂和bmp7的培养基培养的工序;(iii)将工序(ii)中得到的细胞用含有fgf2、gsk-3β抑制剂、bmp7和tgfβ抑制剂的培养基培养的工序;(iv)将工序(iii)中得到的细胞用含有fgf2、gsk-3β抑制剂、bmp7、激活素和rock抑制剂的培养基培养的工序;以及(v)将工序(iv)中得到的细胞用含有视黄酸或其衍生物和fgf9的培养基培养的工序。以下进一步对各工序进行说明。(i)将多能干细胞用含有fgf2、bmp4、gsk-3β抑制剂和视黄酸或其衍生物的培养基培养的工序该工序中,由多能干细胞诱导晚期后部上胚层。晚期后部上胚层表征为cdx1、oct4、nanog、e-cdh(cdh1)中的至少1个以上标志物为阳性的细胞,优选表征为所有这些标志物为阳性的细胞。晚期后部上胚层进一步优选为eomes和brachyury阴性。工序(i)中,通过本领域公知的任意方法分离多能干细胞,优选通过黏附培养进行培养。作为分离多能干细胞的方法,例如可列举力学分离、使用具有蛋白酶活性和胶原酶活性的分离溶液(例如可列举accutase(tm)和accumax(tm)(innovativecelltechnologies,inc))或仅具有胶原酶活性的分离溶液的分离。优选为使用具有蛋白酶活性和胶原酶活性的分离溶液解离、通过力学手段分散成细的单个细胞的方法。作为工序(i)中使用的人多能干细胞,优选使用培养至相对于所使用的培养皿70%~80%汇合的集落。工序(i)中使用的培养基可以在动物细胞的培养中使用的基础培养基中添加fgf2、bmp4、gsk-3β抑制剂和视黄酸或其衍生物而制备。作为基础培养基,可以使用上述那样的基础培养基,可以含有血清,或者也可以是无血清的。根据需要,还可以含有血清替代物、脂质、氨基酸、维生素、生长因子、低分子化合物、抗生素、抗氧化剂、丙酮酸、缓冲剂、无机盐类等。工序(i)中使用的gsk-3β抑制剂可以使用前述肾祖细胞分化诱导工序中例示的gsk-3β抑制剂,作为优选的gsk-3β抑制剂,可列举chir99021。本领域技术人员可以根据所使用的gsk-3β抑制剂适当选择工序(i)中使用的gsk-3β抑制剂的浓度,例如为0.01μm至100μm,优选为0.1μm至10μm,进一步优选为0.5μm至3μm,特别优选为0.5μm至1.5μm。工序(i)中使用的fgf2(碱性fgf,bfgf)优选为人fgf2,作为人fgf2,例如可列举具有ncbi(美国国立生物技术信息中心)登录号abo43041.1的氨基酸序列的蛋白。fgf2只要具有分化诱导活性即可,包括其片段和功能突变体,fgf2可以使用市售产品,也可以使用从细胞纯化的蛋白、通过基因重组产生的蛋白。该工序中使用的fgf2的浓度为1ng/ml至1000ng/ml,优选为10ng/ml至500ng/ml,更优选为50ng/ml至250ng/ml。工序(i)中使用的bmp4优选为人bmp4,作为人bmp4,例如可列举具有ncbi(美国国立生物技术信息中心)登录号aah20546.1的氨基酸序列的蛋白。bmp4只要具有分化诱导活性即可,包括其片段和功能突变体,bmp4可以使用市售产品,也可以使用从细胞纯化的蛋白、通过基因重组产生的蛋白。该工序中使用的bmp4的浓度为0.1ng/ml至100ng/ml,优选为0.5ng/ml至50ng/ml,更优选为0.5ng/ml至5ng/ml。工序(i)中使用的视黄酸可以是视黄酸本身,也可以是保持了天然视黄酸具有的分化诱导功能的视黄酸衍生物。作为视黄酸衍生物,例如可列举3-脱氢视黄酸、4-[[(5,6,7,8-四氢-5,5,8,8-四甲基-2-萘基)羰基]氨基]-苯甲酸(am580)(tamurak等,celldiffer.dev.32:17-26(1990)),4-[(1e)-2-(5,6,7,8-四氢-5,5,8,8-四甲基-2-萘基)-1-丙烯-1-基]-苯甲酸(ttnpb)(stricklands等,cancerres.43:5268-5272(1983))和tanenagak.等,cancerres.40:914-919(1980)中记载的化合物、棕榈酸视黄醇、视黄醇、视黄醛、3-脱氢视黄醇、3-脱氢视黄醛等。工序(i)中使用的视黄酸或其衍生物的浓度例如为1nm至100nm,优选为5nm至50nm,更优选为5nm至25nm。工序(i)中,培养温度不限定于下面的温度,约为30~40℃,优选约为37℃,在含有co2的空气气氛下进行培养。co2浓度约为2~5%,优选约为5%。工序(i)的培养时间只要是足以分化诱导出晚期后部上胚层的时间即可,例如为1~2天的培养,优选为1天。(ii)将工序(i)中得到的细胞用含有fgf2、gsk-3β抑制剂和bmp7的培养基培养的工序该工序中,由晚期后部上胚层诱导中胚层谱系原条。中胚层谱系原条表征为cdx1和brachyury阳性的细胞。中胚层谱系原条进一步优选oct4、nanog和e-cdh为阴性。工序(ii)中,可以分离前述工序(i)中得到的细胞群,用另外准备的经包被处理的培养皿进行黏附培养,也可以将工序(i)中通过黏附培养得到的细胞直接通过培养基替换继续培养。工序(ii)中使用的培养基可以在动物细胞的培养中使用的基础培养基中添加fgf2、gsk-3β抑制剂和bmp7而制备。作为基础培养基,可以使用上述那样的基础培养基,可以含有血清,或者也可以是无血清的。根据需要,还可以含有血清替代物、脂质、氨基酸、维生素、生长因子、低分子化合物、抗生素、抗氧化剂、丙酮酸、缓冲剂、无机盐类等。工序(ii)中使用的fgf2与工序(i)中说明的物质是同样的,其优选浓度范围也是同样的。工序(ii)中使用的gsk-3β抑制剂可以使用前述工序(i)中例示的gsk-3β抑制剂,作为优选的gsk-3β抑制剂,可列举chir99021。本领域技术人员可以根据所使用的gsk-3β抑制剂适当选择工序(ii)中使用的gsk-3β抑制剂的浓度,例如为0.01μm至100μm,优选为0.1μm至10μm,进一步优选为1μm至7.5μm,特别优选为2至5μm。优选工序(ii)中使用的gsk-3β抑制剂的浓度比工序(i)中的浓度高。工序(ii)中使用的bmp7优选为人bmp7,作为人bmp7,例如可列举具有ncbi(美国国立生物技术信息中心)登录号nm_001719.2的氨基酸序列的蛋白。bmp7只要具有分化诱导活性即可,包括其片段和功能突变体,bmp7可以使用市售产品,也可以使用从细胞纯化的蛋白、通过基因重组产生的蛋白。该工序中使用的bmp7的浓度为0.1ng/ml至100ng/ml,优选为0.5ng/ml至50ng/ml,更优选为0.5ng/ml至5ng/ml。工序(ii)中,培养温度不限定于下面的温度,约为30~40℃,优选约为37℃,在含有co2的空气气氛下进行培养。co2浓度约为2~5%、优选约为5%。工序(ii)的培养时间只要是足以分化诱导中胚层谱系原条的时间即可,例如为10小时~2天或1~2天的培养,优选为0.5~1天。(iii)将工序(ii)中得到的细胞用含有fgf2、gsk-3β抑制剂、bmp7和tgfβ抑制剂的培养基培养的工序该工序中,由中胚层谱系原条诱导中胚层谱系晚期原条。中胚层谱系晚期原条表征为cdx2和brachyury阳性的细胞。工序(iii)中,可以分离前述工序(ii)中得到的细胞群、用另外准备的经包被处理的培养皿黏附培养,也可以将工序(ii)中通过黏附培养得到的细胞直接通过培养基替换继续培养。工序(iii)中使用的培养基可以在动物细胞的培养中使用的基础培养基中添加fgf2、gsk-3β抑制剂、bmp7和tgfβ抑制剂而制备。作为基础培养基,可以使用上述那样的基础培养基,可以含有血清,或者也可以是无血清的。根据需要,还可以含有血清替代物、脂质、氨基酸、维生素、生长因子、低分子化合物、抗生素、抗氧化剂、丙酮酸、缓冲剂、无机盐类等。工序(iii)中使用的fgf2、gsk-3β抑制剂、bmp7与工序(ii)是同样的,其优选浓度范围也是同样的,gsk-3β抑制剂的浓度范围为0.01μm至100μm,优选为0.1μm至10μm,进一步优选为1μm至7.5μm,特别优选为2至5μm。工序(iii)中使用的tgfβ抑制剂是抑制tgfβ与受体的结合而继续向smad传导信号的物质,可列举与作为受体的alk家族结合的物质或抑制alk家族导致的smad磷酸化的物质,例如,可例示lefty-1(作为ncbi登录号,可例示小鼠:nm_010094、人:nm_020997)、sb431542、sb202190(以上,r.k.lindemann等,mol.cancer,2003,2:20)、sb505124(glaxosmithkline)、npc30345、sd093、sd908、sd208(scios)、ly2109761、ly364947、ly580276(lillyresearchlaboratories)、a83-01(wo2009146408)和它们的衍生物等。tgfβ抑制剂可以优选为a83-01。培养液中tgfβ抑制剂的浓度只要是抑制alk的浓度就没有特别限定,为0.5μm至100μm,优选为1μm至50μm,进一步优选为5μm至25μm。工序(iii)中,培养温度不限定于下面的温度,约为30~40℃,优选约为37℃,在含有co2的空气气氛下进行培养。co2浓度约为2~5%、优选约为5%。工序(iii)的培养时间只要是足以分化诱导中胚层谱系晚期原条的时间即可,例如为1~3天的培养,优选为1.5~2天。(iv)将工序(iii)中得到的细胞用含有fgf2、gsk-3β抑制剂、bmp7、激活素和rock抑制剂的培养基培养的工序该工序中,由中胚层谱系晚期原条诱导后肾谱系晚期原条。后肾谱系晚期原条表征为hox11和brachyury阳性的细胞。工序(iv)中,可以分离前述工序(iii)中得到的细胞群,用另外准备的经包被处理的培养皿黏附培养,也可以将工序(iii)中通过黏附培养得到的细胞直接通过培养基替换继续培养。工序(iv)中使用的培养基可以在动物细胞的培养中使用的基础培养基中添加fgf2、gsk-3β抑制剂、bmp7、激活素和rock抑制剂而制备。作为基础培养基,可以使用上述那样的基础培养基,可以含有血清,或者也可以是无血清的。根据需要,还可以含有血清替代物、脂质、氨基酸、维生素、生长因子、低分子化合物、抗生素、抗氧化剂、丙酮酸、缓冲剂、无机盐类等。工序(iv)中使用的fgf2、gsk-3β抑制剂、bmp7与工序(ii)是同样的,其优选浓度范围也是同样的,gsk-3β抑制剂的浓度范围为0.01μm至100μm,优选为0.1μm至10μm,进一步优选为1μm至7.5μm,特别优选为2至5μm。工序(iv)中使用的激活素包括人和其他动物来源的激活素以及它们的功能突变体,例如可以使用r&dsystems公司等的市售产品。工序(iv)中使用的激活素的浓度为1ng/ml至100ng/ml,优选为5ng/ml至50ng/ml,更优选为5ng/ml至25ng/ml。工序(iv)中使用的rock抑制剂只要是能够抑制rho激酶(rock)的功能的物质就没有特别限定,例如可列举y-27632(例如参照ishizaki等,mol.pharmacol.57,976-983(2000);narumiya等,methodsenzymol.325,273-284(2000))、fasudil/ha1077(例如参照uenata等,nature389:990-994(1997))、h-1152(例如参照sasaki等,pharmacol.ther.93:225-232(2002))、wf-536(例如参照nakajima等,cancerchemotherpharmacol.52(4):319-324(2003))和它们的衍生物、以及针对rock的反义核酸、rna干扰诱导性核酸(例如sirna)、显性负性突变体、以及它们的表达载体。此外,作为rock抑制剂,也可以使用其他公知的低分子化合物(例如参照美国专利申请公开第2005/0209261号、美国专利申请公开第2005/0192304号、美国专利申请公开第2004/0014755号、美国专利申请公开第2004/0002508号、美国专利申请公开第2004/0002507号、美国专利申请公开第2003/0125344号、美国专利申请公开第2003/0087919号和国际公开第2003/062227号、国际公开第2003/059913号、国际公开第2003/062225号、国际公开第2002/076976号、国际公开第2004/039796号)。本发明中,可以使用1种或2种以上rock抑制剂。作为优选的rock抑制剂,可列举y-27632。本领域技术人员可以根据所使用的rock抑制剂适当选择工序(iv)中使用的rock抑制剂的浓度,例如为0.1μm至100μm,优选为1μm至75μm,进一步优选为5μm至50μm。工序(iv)中,培养温度不限定于下面的温度,约为30~40℃,优选约为37℃,在含有co2的空气气氛下进行培养。co2浓度约为2~5%、优选约为5%。工序(iv)的培养时间只要是足以分化诱导后肾谱系晚期原条的时间即可,例如为1~5天的培养,优选为3天。(v)将工序(iv)中得到的细胞用含有视黄酸或其衍生物和fgf9的培养基培养的工序该工序中,由后肾谱系晚期原条诱导晚期后部间介中胚层。间介中胚层表征为osr1、hox11和wt1阳性的细胞。工序(v)中,可以分离前述工序(iv)中得到的细胞群,用另外准备的经包被处理的培养皿黏附培养,也可以将工序(iv)中通过黏附培养得到的细胞直接通过培养基替换继续培养。工序(v)中使用的培养基可以在动物细胞的培养中使用的基础培养基中添加视黄酸或其衍生物和fgf9而制备。作为基础培养基,可以使用上述那样的基础培养基,可以含有血清,或者也可以是无血清的。根据需要,还可以含有血清替代物、脂质、氨基酸、维生素、生长因子、低分子化合物、抗生素、抗氧化剂、丙酮酸、缓冲剂、无机盐类等。工序(v)中使用的视黄酸或其衍生物和fgf9分别如工序(i)和肾祖细胞诱导工序中说明的那样,其优选浓度范围也是同样的。工序(v)中使用的培养基可以进一步含有bmp抑制剂。作为bmp抑制剂,可例示chordin、noggin、follistatin等蛋白性抑制剂、dorsomorphin(即6-[4-[2-(1-哌啶基)乙氧基]苯基]-3-(4-吡啶基)吡唑并[1,5-a]嘧啶)、其衍生物(p.b.yu等(2007),circulation,116:ii_60;p.b.yu等(2008),nat.chem.biol.,4:33-41;j.hao等(2008),plosone,3(8):e2904)和ldn193189(即4-[6-(4-(哌嗪-1-基)苯基]吡唑并[1,5-a]嘧啶-3-基)喹啉)。作为bmp抑制剂,更优选为noggin,其浓度例如可以设为1~100ng/ml。工序(v)中,培养温度不限定于下面的温度,约为30~40℃,优选约为37℃,在含有co2的空气气氛下进行培养。co2浓度约为2~5%、优选约为5%。工序(v)培养时间只要是足以分化诱导晚期后部间介中胚层的时间即可,例如为1~3天的培养,优选为2天。通过将工序(v)中得到的间介中胚层细胞如肾祖细胞诱导工序中说明的那样用含有gsk-3β抑制剂和fgf9的培养基培养,能够诱导肾祖细胞。本发明还提供使用通过上述方法得到的肾祖细胞得到的肾脏类器官。来自ips细胞的肾脏类器官例如在nature,526,564-568(2015)中有报道。本发明中,例如可以通过培养上述方法中得到的肾祖细胞制作细胞团、将其与3t3-wnt4细胞等饲养细胞、小鼠胎幼崽脊髄细胞或小鼠胎幼崽肾细胞共培养、或通过使用含有chir99021等gsk-3β抑制剂的基础培养基的半气相培养(参考文献nature,526,564-568(2015))获得。除了gsk-3β抑制剂以外,培养基还可以含有fgf9、fgf2。本发明还提供包含通过上述方法得到的肾祖细胞或使用其得到的肾脏类器官的医药组合物、包含该肾祖细胞或使用其得到的肾脏类器官的肾病治疗剂、包括给予该肾祖细胞或使用其得到的肾脏类器官的有效剂量的工序的治疗肾病的方法。作为对需要治疗的患者给予治疗剂的方法,例如可列举:将得到的肾祖细胞制成片状,粘贴于患者肾脏的方法;将得到的肾祖细胞悬浮于生理盐水等而得的细胞悬液、或者三维培养(例如devcell.sep11,2012;23(3):637-651)而得到的细胞团直接移植至患者肾脏的方法;在由基质胶等构成的骨架上进行三维培养,移植得到的肾祖细胞团的方法等。移植部位只要是在肾脏内就没有特别限定,优选为肾包膜下。作为肾病,可例示急性肾损伤、慢性肾功能衰竭、未导致慢性肾功能衰竭的慢性肾病。本发明中,关于肾病治疗剂所含肾祖细胞的细胞数,只要移植片能够在给予后植入就没有特别限定,可以根据患部大小、躯体大小适当增减而制备。实施例以下,基于实施例具体地对本发明进行说明,但本发明不受以下方式的限定。<1>由ips细胞分化诱导肾祖细胞按照以下的实验方案由ips细胞分化诱导肾祖细胞。其中,ips细胞使用201b7来源的osr1-gfp/six2-tdtomato报告-人ips细胞。1.通过accutase处理使未分化ips细胞单细胞化后,悬浮在添加有10μm的y27632的reproff2培养基(reprocell)中,在用matrigel(bdbiosciences)包被的孔(well)中以1.0×104/well~5.0×104/well的密度播种,在37℃温育24小时。2.24小时后(第1天),以添加有vitaminafreeb27supplement(thermofisherscientificinc.)的dmem/f12glutamax(thermofisherscientificinc.)为基础培养基,用添加有1μmchir99021、10nm视黄酸、1ng/mlbmp4、100ng/mlfgf2的培养基进行培养基替换。(晚期后部上胚层的制作……1)3.第2天,培养基替换为同一基础培养基中添加有3μmchir99021、1ng/mlbmp7、100ng/mlfgf2的培养基(中胚层谱系原条的制作……2)4.第3天、第4天,培养基替换为同一基础培养基中添加有3μmchir99021、1ng/mlbmp7、100ng/mlfgf2、10μma83-01的培养基(中胚层谱系晚期原条的制作……3)5.第5天、第6天、第7天,培养基替换为同一基础培养基中添加有3μmchir99021、1ng/mlbmp7、100ng/mlfgf2、10ng/mlactivin、30μmy27632的培养基(后肾谱系晚期原条的制作……4)6.第8天、第9天,培养基替换为同一基础培养基中添加有100ng/mlfgf9、100nm视黄酸的培养基(晚期后部间介中胚层的制作……5)7.第10天、第11天、第12天,培养基替换为同一基础培养基中添加有10ng/mlfgf9、1μmchir99021的培养基(肾祖细胞的制作……6)通过表1记载的标志物的表达来确认各阶段进行分化诱导的情况。阴性标志物确认未表达。图1显示的是各阶段细胞的标志物染色结果。对于晚期后部间介中胚层和肾祖细胞,获得了80%以上的标志物阳性细胞。而将上述5的工序中的培养基设为200ng/mlfgf9、100nm视黄酸、25ng/mlnoggin时也得到了同样的结果。[表1]各阶段的标志基因阳性标志物阴性标志物①cdx1,oct4,nanog,e-cdheomes,brachyury②brachyury,cdx1oct4,nanog,e-cdh③brachyury,cdx2④brachyury,hox11⑤osr1,hox11,wt1⑥osr1,hox11,wt1,six2,sall1根据以上结果,能够由ips细胞分化诱导肾祖细胞。分化诱导效率为80%以上,能够显著地以高效率获得肾祖细胞。<2>通过与小鼠胎幼崽肾细胞的共培养,制作来自肾祖细胞的肾脏类器官将<1>中得到的肾祖细胞制成1.0×105大小的细胞团,用添加有1μmchir99021和10ng/mlfgf9的基础培养基培养1天。通过半气相培养与e11.5的小鼠胎幼崽脊髓共培养。其结果如图2所示,能够确认到肾小球、肾小管,成功制作了肾脏类器官。<3>利用肾祖细胞单独培养制作肾脏类器官将<1>中得到的肾祖细胞制成1.0×105大小的细胞团,用添加有1μmchir99021和200ng/mlfgf9的基础培养基培养1~2天。将该细胞团用添加有5μmchir99021和200ng/mlfgf2的基础培养基进行2天半气相培养,进一步用单独的基础培养基进行8天半气相培养。其结果如图3所示,能够确认到肾小球、肾小管,成功制作了肾脏类器官。此外,能够观察到brn1(+)cdh1(+)dba(-)亨利氏环。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1