使用转化的T细胞培养自然杀伤细胞的方法与流程
本发明涉及使用转化的t细胞培养自然杀伤细胞的方法。
背景技术:
已有人开发了利用患者免疫功能的免疫疗法,其可以作为治疗癌症患者和预防癌症复发的医疗方法。特别地,已经有人研究了利用可以大量生产和冷冻的自然杀伤细胞进行的免疫疗法。自然杀伤细胞是约占外周血淋巴细胞的15%的淋巴细胞,在先天性免疫应答中起重要作用。
具体而言,自然杀伤细胞激活树突状细胞并诱导细胞毒性t淋巴细胞(ctl)对肿瘤产生特异性反应,从而消除肿瘤细胞。自然杀伤细胞直接杀伤恶性肿瘤,例如肉瘤、骨髓瘤、恶性上皮肿瘤、淋巴瘤和白血病。然而,存在于正常受试者体内的大多数自然杀伤细胞以非活性状态存在,需要活化的自然杀伤细胞来消除肿瘤。此外,对于癌症患者体内存在的自然杀伤细胞,由于癌细胞的免疫逃逸机制,自然杀伤细胞具有功能缺陷。
因此,为了使用自然杀伤细胞作为治疗剂,自然杀伤细胞的活化非常重要。此外,体内存在的自然杀伤细胞的数量是有限的,因此必须开发一种对正常受试者或患者血液中的自然杀伤细胞进行大规模扩增和冷冻的技术。
使用体外扩增培养法作为大量扩增自然杀伤细胞的方法。为了自然杀伤细胞的体外扩增培养,将外周血单核细胞(pbmc)、cd3-细胞、cd3-cd56+细胞、cd56+细胞等用作种子细胞,并将激活cd3(condiotti等,experimentalhematol.29(1):104-113,2001)的细胞因子,如il-2、il-12、il-15、和il-21、lps(goodier等,j.immunol.165(1):139-147,2000)、okt-3抗体用作自然杀伤细胞的扩增因子。仅使用上述扩增因子,就有可能使自然杀伤细胞扩增约3至10倍。然而,以上述扩增速率,难以将自然杀伤细胞商业化为治疗剂。
近来,已有人研究了用各种类型的饲养细胞进行自然杀伤细胞扩增的方法。用作饲养细胞的代表细胞系包括pbmc、ebv-lcl和k562细胞系。k562细胞系是hla缺失的血液癌衍生细胞系,是自然杀伤细胞容易攻击的代表性靶细胞系。使用基于k562的饲养细胞进行nk细胞培养的方法如下:一种使用表达4-1bbl和膜结合il-15的k562细胞系培养nk细胞的方法(fujisaki等,cancerres.69(9):4010-4017,2009),一种使用表达mica、4-1bbl和il-15的k562细胞系培养nk细胞的方法(gong等,组织抗原,76(6):467-475,2010),以及一种使用表达4-1bbl和膜结合il-21的k562细胞系培养nk细胞的方法(cecelejd等,plosone,7(1):e30264,2012)。
技术实现要素:
技术问题
因此,为了激活和扩增自然杀伤细胞,本发明人开发了一种用于体外有效扩增自然杀伤细胞的方法,包括表达共刺激分子和生长因子,其可以增强cd4+t细胞中自然杀伤细胞的扩增。
具体地,为了提高使用cd4(+)t细胞作为饲养细胞的自然杀伤细胞培养方法的效率,本发明人建立了转化的或基因修饰的cd4(+)t细胞。本发明人已经确定,在将基因修饰的cd4(+)t细胞与外周血单核细胞共培养的情况下,这种共培养可增加自然杀伤细胞的扩增和异常细胞杀伤活性,因而完成了本发明。因此,提供了一种使用基因修饰的cd4(+)t细胞以有效且稳定的方式扩增自然杀伤细胞的培养方法。
解决问题的技术方案
在本发明的一个方面,提供了一种基因修饰的或转化的cd4+t细胞,其表达至少一种选自下组的基因:4-1bbl基因,mbil-21基因,ox40l基因和mtnf-α基因。
此外,在本发明的另一方面,提供了一种用于自然杀伤细胞的培养方法,其包括共培养基因修饰的cd4+t细胞和种子细胞的步骤。
此外,在本发明的另一方面,提供了一种用于培养自然杀伤细胞的组合物,其包含经基因修饰的cd4+t细胞作为活性成分。
此外,在本发明的另一方面,提供了一种通过所述培养方法产生的自然杀伤细胞。
发明的有益效果
使用本发明的基因修饰的t细胞的自然杀伤细胞培养方法可使自然杀伤细胞能够有效扩增并由少量种子细胞产生。此外,该培养方法还提高了自然杀伤细胞的异常细胞杀伤活性。因此,使用本发明的基因修饰的t细胞的自然杀伤细胞培养方法可被有效地商业化为细胞治疗剂。此外,通过本发明的培养方法产生的自然杀伤细胞可以被有效地用作细胞治疗剂。
附图的简要说明
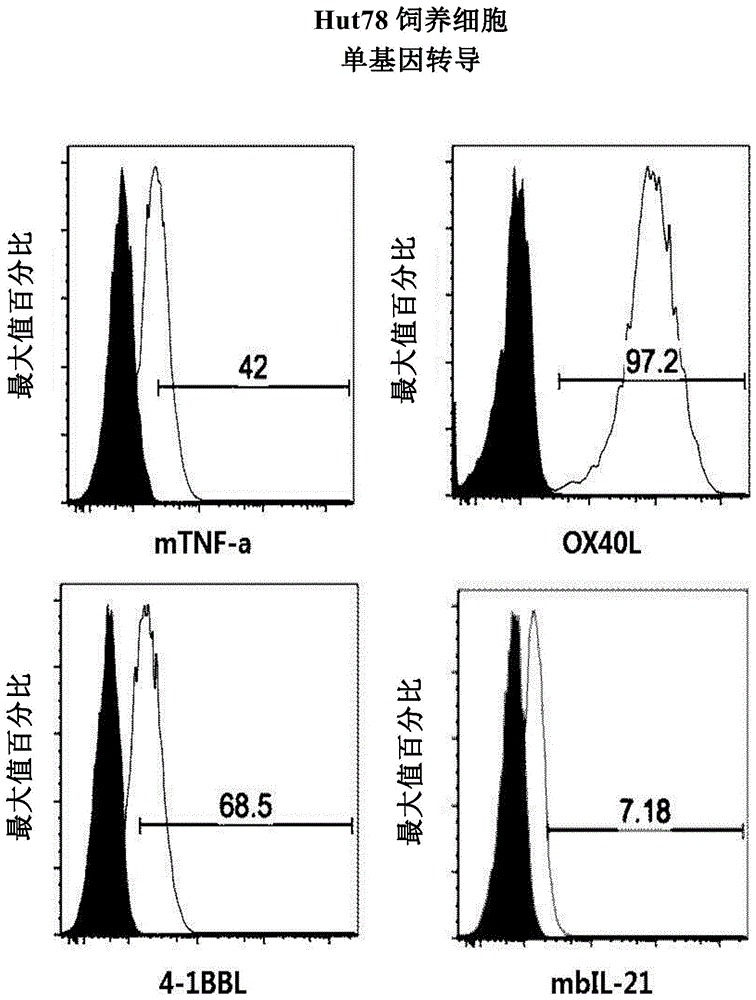
图1a显示了基于facs的转导至hut78细胞系中的单基因的表达。
图1b显示了基于facs的转导至hut78细胞系中的双重基因的表达。
图1c显示了基于facs的hut78细胞系中的基因表达。
图1d显示了基于facs的转导至hut78细胞系中的单基因的表达。
图1e显示了基于facs的转导至hut78细胞系中的双重基因mtnf-α/ox40l和mtnf-α/4-1bbl的表达。
图1f显示了基于facs的转导至hut78细胞系中的双重基因mbil-21/ox40l和mbil-21/4-1bbl的表达。
图1g显示了基于facs的转导至hut78细胞系中的三重基因的表达。
图1h显示了基于facs的转导至hut78细胞系中的四重基因的表达。
图2a显示了基于facs的转导至h9细胞系中的单基因的表达。
图2b显示了基于facs的转导至h9细胞系中的双重基因的表达。
图3a显示了基于facs的转导至jurkatt细胞系中的单基因的表达。
图3b显示了基于facs的转导至jurkatt细胞系中的双重基因的表达。
图4a显示了基于各转导基因的自然杀伤细胞的倍数增加,所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞与外周血单核细胞共培养而产生的。
图4b显示了基于各转导基因的自然杀伤细胞的倍数增加,所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞与外周血单核细胞共培养而产生的。
图4c显示了基于各转导基因的自然杀伤细胞的倍数增加,所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkatt细胞与外周血单核细胞共培养而产生的。
图4d显示了基于各转导基因的自然杀伤细胞的倍数增加,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图5a显示了将经历了三重基因转导的hut78t细胞系和外周血单核细胞共培养而产生的自然杀伤细胞(d7r)的倍数增加。
图5b显示了将经历了三重基因转导的hut78t细胞系和外周血单核细胞共培养而产生的自然杀伤细胞(d7r)的倍数增加,以对数值计算。
图5c显示了将经历了三重基因转导的hut78t细胞系和外周血单核细胞共培养而产生的自然杀伤细胞(d11r)的倍数增加。
图5d显示了将经历了三重基因转导的hut78t细胞系和外周血单核细胞共培养而产生的自然杀伤细胞(d11r)的倍数增加,以对数值计算。
图6a显示了基于各转导基因的自然杀伤细胞的活力,所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图6b显示了基于各转导基因的自然杀伤细胞的活力,所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞系与外周血单核细胞共培养而产生的。
图6c显示了基于各转导基因的自然杀伤细胞的活力,所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkatt细胞系与外周血单核细胞共培养而产生的。
图6d显示了基于各转导基因的自然杀伤细胞的活力,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图7a显示了基于各转导基因的自然杀伤细胞的纯度(cd3-cd56+),所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图7b显示了基于各转导基因的自然杀伤细胞的活化(cd16+cd56+),所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图7c显示了基于各转导基因的自然杀伤细胞的纯度(cd3-cd56+),所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞系与外周血单核细胞共培养而产生的。
图7d显示了基于各转导基因的自然杀伤细胞的活化(cd16+cd56+),所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞系与外周血单核细胞共培养而产生的。
图7e显示了基于各转导基因的自然杀伤细胞的纯度(cd3-cd56+),所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkatt细胞系与外周血单核细胞共培养而产生的。
图7f显示了基于各转导基因的自然杀伤细胞的活化(cd16+cd56+),所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkat细胞系与外周血单核细胞共培养而产生的。
图7g显示了基于各转导基因的自然杀伤细胞的纯度(cd3-cd56+),所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图7h显示了基于各转导基因的自然杀伤细胞的活化(cd16+cd56+),所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图8a显示了基于各转导基因的自然杀伤细胞中表型标志物cd16的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图8b显示了基于各转导基因的自然杀伤细胞中表型标志物nkg2d的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图8c显示了基于各转导基因的自然杀伤细胞中表型标志物nkp30的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图8d显示了基于各转导基因的自然杀伤细胞中表型标志物nkp44的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图8e显示了基于各转导基因的自然杀伤细胞中表型标志物nkp46的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图8f显示了基于各转导基因的自然杀伤细胞中表型标志物dnam-1的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图8g显示了基于各转导基因的自然杀伤细胞中表型标志物cxcr3的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图9a显示了基于各转导基因的自然杀伤细胞中表型标志物cd16的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞系与外周血单核细胞共培养而产生的。
图9b显示了基于各转导基因的自然杀伤细胞中表型标志物nkg2d的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞系与外周血单核细胞共培养而产生的。
图9c显示了基于各转导基因的自然杀伤细胞中表型标志物nkp30的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞系与外周血单核细胞共培养而产生的。
图9d显示了基于各转导基因的自然杀伤细胞中表型标志物nkp44的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞系与外周血单核细胞共培养而产生的。
图9e显示了基于各转导基因的自然杀伤细胞中表型标志物nkp46的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞系与外周血单核细胞共培养而产生的。
图9f显示了基于各转导基因的自然杀伤细胞中表型标志物dnam-1的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞系与外周血单核细胞共培养而产生的。
图9g显示了基于各转导基因的自然杀伤细胞中表型标志物cxcr3的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞系与外周血单核细胞共培养而产生的。
图10a显示了基于各转导基因的自然杀伤细胞中表型标志物cd16的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkatt细胞系与外周血单核细胞共培养而产生的。
图10b显示了基于各转导基因的自然杀伤细胞中表型标志物nkg2d的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkatt细胞系与外周血单核细胞共培养而产生的。
图10c显示了基于各转导基因的自然杀伤细胞中表型标志物nkp30的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkatt细胞系与外周血单核细胞共培养而产生的。
图10d显示了基于各转导基因的自然杀伤细胞中表型标志物nkp44的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkatt细胞系与外周血单核细胞共培养而产生的。
图10e显示了基于各转导基因的自然杀伤细胞中表型标志物nkp46的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkatt细胞系与外周血单核细胞共培养而产生的。
图10f显示了基于各转导基因的自然杀伤细胞中表型标志物dnam-1的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkatt细胞系与外周血单核细胞共培养而产生的。
图10g显示了基于各转导基因的自然杀伤细胞中表型标志物cxcr3的表达水平,所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkatt细胞系与外周血单核细胞共培养而产生的。
图11a显示了基于各转导基因的自然杀伤细胞中表型标志物cd16的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图11b显示了基于各转导基因的自然杀伤细胞中表型标志物nkg2a的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图11c显示了基于各转导基因的自然杀伤细胞中表型标志物nkg2c的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图11d显示了基于各转导基因的自然杀伤细胞中表型标志物nkg2d的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图11e显示了基于各转导基因的自然杀伤细胞中表型标志物nkp30的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图11f显示了基于各转导基因的自然杀伤细胞中表型标志物nkp44的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图11g显示了基于各转导基因的自然杀伤细胞中表型标志物nkp46的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图11h显示了基于各转导基因的自然杀伤细胞中表型标志物dnam-1的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图11i显示了基于各转导基因的自然杀伤细胞中表型标志物cxcr3的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图11j显示了基于各转导基因的自然杀伤细胞中表型标志物cd62l的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图11k显示了基于各转导基因的自然杀伤细胞中表型标志物cd57的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图11l显示了基于各转导基因的自然杀伤细胞中表型标志物cd69的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图12a显示了自然杀伤细胞中表型标志物cd16、nkg2a、nkg2c和nkg2d的表达水平,所述自然杀伤细胞是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图12b显示了自然杀伤细胞中表型标志物nkp30、nkp44、nkp46和dnam-1的表达水平,所述自然杀伤细胞是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图12c显示了自然杀伤细胞中表型标志物cd62l、cd69、cxcr3和cd57的表达水平,所述自然杀伤细胞是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图13a显示了基于各转导基因的自然杀伤细胞的肿瘤细胞杀伤活性,所述自然杀伤细胞是将经历了单基因或双重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图13b显示了基于各转导基因的自然杀伤细胞的肿瘤细胞杀伤活性,所述自然杀伤细胞是将经历了单基因或双重基因转导的h9t细胞系与外周血单核细胞共培养而产生的。
图13c显示了基于各转导基因的自然杀伤细胞的肿瘤细胞杀伤活性,所述自然杀伤细胞是将经历了单基因或双重基因转导的jurkatt细胞系与外周血单核细胞共培养而产生的。
图14a显示了基于各转导基因的自然杀伤细胞的肿瘤细胞杀伤活性(e:t=10:1),所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图14b显示了基于各转导基因的自然杀伤细胞的肿瘤细胞杀伤活性(e:t=3:1),所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图14c显示了基于各转导基因的自然杀伤细胞的肿瘤细胞杀伤活性(e:t=1:1),所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图14d显示了基于各转导基因的自然杀伤细胞的肿瘤细胞杀伤活性(e:t=0.3:1),所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图15a显示了基于各细胞比例的自然杀伤细胞(nos1)的肿瘤细胞杀伤活性,所述自然杀伤细胞(nos1)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图15b显示了基于各细胞比例的自然杀伤细胞(d7rs5)的肿瘤细胞杀伤活性,所述自然杀伤细胞(d7rs5)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图15c显示了基于各细胞比例的自然杀伤细胞(d11rs4)的肿瘤细胞杀伤活性,所述自然杀伤细胞(d11rs4)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图16a显示了基于各转导基因的自然杀伤细胞中增殖标志物ki-67的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图16b显示了第16天时基于各转导基因的自然杀伤细胞中增殖标志物ki-67的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图16c显示了基于各转导基因的自然杀伤细胞中增殖标志物ki-67的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的,以平均荧光指数(mfi)比值表示。
图16d显示了基于各转导基因的自然杀伤细胞的增殖标志物ki-67的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的,以平均荧光指数比值表示。
图17a显示了自然杀伤细胞(d7r)中扩增标志物ki-67的表达水平,所述自然杀伤细胞(d7r)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养时以7天间隔进行重复刺激而产生的。
图17b显示了自然杀伤细胞(d11r)中扩增标志物ki-67的表达水平,所述自然杀伤细胞(d11r)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养时以11天间隔进行重复刺激而产生的。
图17c显示了自然杀伤细胞(d7r)中扩增标志物ki-67的表达水平,所述自然杀伤细胞(d7r)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养时以7天间隔进行重复刺激而产生的,以平均荧光指数比值表示。
图17d显示了自然杀伤细胞(d11r)中扩增标志物ki-67的表达水平,所述自然杀伤细胞(d11r)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养时以11天间隔进行重复刺激而产生的,以平均荧光指数比值表示。
图18a显示了基于各转导基因的自然杀伤细胞中共刺激分子cd25的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图18b显示了第11天时基于各转导基因的自然杀伤细胞中共刺激分子cd25的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图18c显示了基于各转导基因的自然杀伤细胞中共刺激分子tnfrii的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图18d显示了第16天时基于各转导基因的自然杀伤细胞中共刺激分子tnfrii的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图18e显示了基于各转导基因的自然杀伤细胞中共刺激分子41bb的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图18f显示了第7天时基于各转导基因的自然杀伤细胞中共刺激分子41bb的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图19a显示了自然杀伤细胞(d7r)中共刺激分子cd25的表达水平,所述自然杀伤细胞(d7r)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养时以7天间隔进行重复刺激而产生的。
图19b显示了自然杀伤细胞(d7r)中共刺激分子tnfrii的表达水平,所述自然杀伤细胞(d7r)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养时以7天间隔进行重复刺激而产生的。
图19c显示了自然杀伤细胞(d7r)中共刺激分子41bb的表达水平,所述自然杀伤细胞(d7r)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养时以7天间隔进行重复刺激而产生的。
图19d显示了自然杀伤细胞(d11r)中共刺激分子cd25的表达水平,所述自然杀伤细胞(d11r)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养时以11天间隔进行重复刺激而产生的。
图19e显示了自然杀伤细胞(d11r)中共刺激分子tnfrii的表达水平,所述自然杀伤细胞(d11r)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养时以11天间隔进行重复刺激而产生的。
图19f显示了自然杀伤细胞(d11r)中共刺激分子41bb的表达水平,所述自然杀伤细胞(d11r)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养时以11天间隔进行重复刺激而产生的。
图20a显示了基于各转导基因的自然杀伤细胞中cd107a的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图20b显示了基于各转导基因的自然杀伤细胞中ifn-γ的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图20c显示了基于各转导基因的自然杀伤细胞中tnf-α的表达水平,所述自然杀伤细胞是将经历了单基因或四重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图21a显示了自然杀伤细胞(nos1)中cd107a、ifn-γ和tnf-α的表达水平,所述自然杀伤细胞(nos1)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图21b显示了自然杀伤细胞(d7rs5)中cd107a、ifn-γ和tnf-α的表达水平,所述自然杀伤细胞(d7rs5)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
图21c显示了自然杀伤细胞(d11rs4)中cd107a、ifn-γ和tnf-α的表达水平,所述自然杀伤细胞(d11rs4)是将经历了三重基因转导的hut78t细胞系与外周血单核细胞共培养而产生的。
本发明的最佳实施方式
以下,详细说明本发明。
在本发明的一个方面,提供了一种转化的cd4+t细胞,其表达至少一种选自下组的基因:4-1bbl基因、mbil-21基因、ox40l基因和mtnf-α基因。
具体地,当转导一个基因时,该基因可以是4-1bbl、mbil-21、ox40l或mtnf-α。此外,当转导两个基因时,该基因组合可以是mbil-21/4-1bbl、4-1bbl/ox40l、mtnf-α/4-1bbl、mbil-21/ox40l、mbil-21/mtnf-α或mtnf-α/ox40l。在本发明的一个实施方案中,将基因mbil-21/4-1bbl、mtnf-α/ox40l、mtnf-α/4-1bbl和mbil-21/ox40l的组合转导到t细胞中。
此外,当转导三个基因时,该基因组合可以是4-1bbl/mbil-21/ox40l、mbil-21/ox40l/mtnf-α、mtnf-α/mbil-21/4-1bbl或4-1bbl/ox40l/mtnf-α。在本发明的一个实施方案中,将基因的组合mtnf-α/mbil-21/4-1bbl转导到t细胞中。
此外,当转导四个基因时,该基因组合可以是mtnf-α/mbil-21/ox40l/4-1bbl。在本发明的一个实施方案中,将基因的组合mtnf-α/mbil-21/ox40l/4-1bbl转导到t细胞中。
如本文所用,术语“4-1bbl”是指tnf超家族(tnfsf)之一,称为cd137l,并且是指形成三聚体并结合作为受体的4-1bb的配体。4-1bbl基因可能来自人。
具体地,4-1bbl基因可以是ncbi参考序列:nm_003811,但不限于此。4-1bbl基因可以具有编码seqidno:1所示氨基酸序列的核苷酸序列。编码seqidno:1所示氨基酸序列的核苷酸序列可以是由seqidno:2所示的核苷酸序列。
如本文所用,术语“mbil-21”可以是旨在结合至细胞膜的il-21。在此,mbil-21可以是il-21与跨膜蛋白的结合而形成的融合蛋白。跨膜蛋白可以是cd8α。具体地,跨膜蛋白可以是cd8α的跨膜结构域。
具体地,il-21基因可以是ncbi参考序列:nm_021803.3,但不限于此。此外,cd8α基因可以是ncbi参考序列:nm_001768,但不限于此。mbil-21以与细胞膜结合的il-21的形式表达。此外,mbil-21基因可以具有编码seqidno:3所示氨基酸序列的核苷酸序列。编码seqidno:3所示氨基酸序列的核苷酸序列可以是由seqidno:4所示的核苷酸序列。
如本文所用,术语“ox40l”也称为act-4受体、tnf4-人、gp34或cd134l,是指与ox40结合的配体。具体而言,ox40l基因可以是ncbi参考序列:nm_003326,但不限于此。ox40l基因可以具有编码seqidno:5所示氨基酸序列的核苷酸序列。编码seqidno:5所示氨基酸序列的核苷酸序列可以是由seqidno:6所示的核苷酸序列。
如本文所用,术语“mtnf-α”是指在肿瘤坏死因子-α的dna上引入点突变从而使丙氨酸-缬氨酸(肿瘤坏死因子-α的氨基酸序列中被肿瘤坏死因子-α转化酶(tace)识别的位点)变为脯氨酸-缬氨酸而获得的基因。丙氨酸到脯氨酸的突变是随机选择的。
具体地,mtnf-α基因可以具有编码seqidno:8所示氨基酸序列的核苷酸序列。编码seqidno:8所示氨基酸序列的核苷酸序列可以是由seqidno:9所示的核苷酸序列。
可以通过重组慢病毒转导4-1bbl基因、mbil-21基因、ox40l基因或mtnf-α基因。然而,转导不限于此。
对于将基因转染到细胞中的方法,可以使用生物化学方法、物理方法、或病毒介导的转染方法。此外,对于生物化学方法,可以使用fugene6(罗氏,美国)、脂质体(脂质体tm2000,英杰,美国)或exgen500(mbifermentas国际公司,加拿大)。此外,利用脂质体的脂质介导方法是可以使用的。
如本文所用,术语“载体”是一种表达载体,其能够在转导了该载体的细胞中表达目的基因,并且是指一种基因构建体,其包含可操作地连接的必需调控元件从而使转导插入载体的基因表达。
此外,对于含有该基因的表达载体,可以使用能够在cd4+t细胞系中表达该基因的任何表达载体。本发明的具体实施方案中,使用pcdh-cmv-mcs-ef1-puro(sbi,cd510b-1)或pcdh-cmv-mcs-ef1-neo(sbi,cd514b-1)慢病毒载体。
慢病毒是指一种属于逆转录病毒家族并以较长的潜伏期为特征的病毒。慢病毒可以将遗传信息传递到宿主细胞的dna中。对于使用能够在非分裂细胞中复制的基因传递载体,使用慢病毒是最有效方法之一。
所述cd4+t细胞可以是体外分离的cd4+t细胞、体外扩增培养的cd4+t细胞或cd4+t细胞系(t淋巴瘤细胞系)。此外,所述cd4+t细胞可以是辅助t细胞,并且可以是将cd4+t细胞与癌细胞融合而获得的杂交瘤细胞。具体地,所述cd4+t细胞可以是选自下组的任一种:hut78、h9、jurkat、loucy、molt-3、molt-13、peer、rpmi8402和tall-01细胞。优选为hut78、h9或jurkatt细胞。
在本发明的另一方面,提供了一种用于自然杀伤细胞的培养方法,其包括共培养转化的cd4+t细胞和种子细胞的步骤。
如本文所用,术语“饲养细胞”也被称为用于培养的辅助细胞,是指不扩增但具有代谢活性的细胞,从而使得该细胞产生各种代谢物且有助于靶细胞的扩增。饲养细胞可以是转化的cd4+t细胞,其表达至少一种选自下组的基因:4-1bbl基因、mbil-21基因、ox40l基因和mtnf-α基因。
用作饲养细胞的t细胞可以是分裂/扩增被抑制的灭活细胞或尚未灭活的细胞。优选地,可以使t细胞失活以确保安全性。对于灭活方法,可以使用本领域已知的常规方法。例如,可以使用伽马射线照射方法。在使用尚未灭活的t细胞时,它们大多数是肿瘤细胞,因此在培养过程中可能被活化的自然杀伤细胞杀伤。
如本文所用,术语“种子细胞”是指能够通过适当培养而扩增为自然杀伤细胞的细胞。具体地,种子细胞可以是选自下组的任一种:外周血、外周血白细胞、外周血单核细胞(pbmc)、富集的自然杀伤细胞和分离的自然杀伤细胞。种子细胞可以优选是但不限于:已经从中消除了cd3(+)细胞的cd3(-)细胞。
在自然杀伤细胞的培养方法中,可以通过以0.1或更高的比例混合饲养细胞和种子细胞来进行培养。具体地,饲养细胞和种子细胞的比例可以是0.1∶1至50∶1。更具体地,该比例可以是0.5∶1至40∶1。
更加具体地,该比例可以是1:1至30:1。最具体地,该比例可以是2∶1至20∶1。在一个实施方案中,饲养细胞和种子细胞的比例可以是5∶1,但是不特别限于此。“比例”是指基于细胞数目的比例。
在自然杀伤细胞的培养方法中,种子细胞可以与饲养细胞混合一次,并且可以进行5天至60天的培养,或者可以与饲养细胞混合两次或更多次,并且可以进行60天或更长时间的培养。优选地,种子细胞可以与饲养细胞混合一次,并且进行14天至21天的培养。然而,所述培养方法不限于此。
在自然杀伤细胞的培养方法中,将自然杀伤细胞和t淋巴瘤细胞系在常规动物细胞培养基(如aim-v培养基、rpmi1640、cellgroscgm、x-vivo20、imdm和dmem)中共培养。在共培养时,可以通过添加对t细胞具有低亲和力并刺激t细胞的抗体以及白介素来进行培养。然而,所述培养方法不限于此。
如本文所用,术语“对t细胞具有低亲和力并刺激t细胞的抗体”是指对cd3抗原有特异性反应的蛋白,其中cd3是一类分子,每个分子与t细胞受体(tcr)结合形成抗原识别复合物。与tcr相比,cd3分子具有更长的胞内区域,并在将抗原识别信号传递到细胞中发挥作用。
可用于本发明的对t细胞具有低亲和力并刺激t细胞的抗体可以优选为抗cd3抗体。具体地,抗cd3抗体可以是okt-3、ucht1或hit3a。
如本文所用,术语“白介素(il)”是指属于细胞因子的一类物质,并且是指由免疫活性细胞如淋巴细胞、单核细胞和巨噬细胞产生的蛋白质类生物活性物质。白介素可以是il-2、il-15、il-12、il-18或il-21。
在本发明的一个实施方案中,通过添加okt-3抗体和il-2进行培养。okt-3抗体的添加浓度可以为0.1ng/ml至100ng/ml。优选地,okt-3抗体的浓度可以是10ng/μl。il-2的浓度可以是10u/ml至2,000u/ml。优选地,il-2的浓度可以是500u/ml。此外,可以添加血清或血浆以及支持淋巴细胞生长的其他生长因子进行培养。对要添加到培养基中的血清或血浆的类型没有特别限制,可以使用各种可商购的动物来源的血清或血浆。优选地,可以使用人源的血清或血浆,特别是自身来源的血清或血浆。
如本文所用,术语“培养”是指在适当人工调节的环境条件下生长细胞的方法。基因修饰的cd4+t细胞的培养方法可以使用本领域众所周知的方法进行。具体地,培养可以以分批或补料分批工艺进行,或者可以以重复补料分批工艺连续进行。
此外,可以使用适合于培养基的前体细胞。上述原料可以通过适当的方法在培养过程中以分批、补料分批或连续的方式添加到培养物中。然而,本发明不特别限于此。可以以适当的方式使用碱性化合物(如氢氧化钠、氢氧化钾和氨)或酸性化合物(如磷酸或硫酸)来调节培养物的ph。
使用t细胞作为饲养细胞的培养方法,可以从种子细胞如pbmc中选择性地培养自然杀伤细胞,并且由于与根据供体使用pbmc饲养细胞情况相比,自然杀伤细胞的扩增没有差异,因此可以进行稳定的培养。因此,可以有效且稳定地获得大量自然杀伤细胞治疗剂。
此外,在本发明的另一方面,提供了一种用于培养自然杀伤细胞的组合物,其包含经基因修饰的cd4+t细胞作为活性成分。
此外,在本发明的另一方面,提供了一种通过所述自然杀伤细胞培养方法产生的自然杀伤细胞。
根据所述自然杀伤细胞培养方法培养的自然杀伤细胞可以冷冻,并且即使在再次融化的情况下也不显示细胞功能受损。此外,由于活化受体如nkp46的高表达,自然杀伤细胞表现出增强的针对肿瘤细胞系的杀伤活性和增强的细胞因子分泌。因此,优异的抗癌作用是可以预期的。因此,可以使用大量可临床应用的活化的自然杀伤细胞来制备对肿瘤治疗有效的细胞治疗剂。
此外,在用于预防或治疗传染病的组合物中,其包含自然杀伤细胞培养方法产生的自然杀伤细胞作为有效成分,包含的所述自然杀伤细胞的量可以为10%-95%,以相对于组合物总重量的重量计。此外,除所述活性成分外,本发明的用于预防或治疗传染病的组合物还可以包含一种或多种表现出相同或相似功能的活性成分。
除上述活性成分之外,所述的用于预防或治疗感染性疾病的组合物可以进一步包含一种或多种药学上可接受的载体,从而配制成用于给药的药物组合物。
可以根据各种因素来调节用于预防或治疗感染性疾病的药物组合物的剂量,所述因素包括疾病的类型、疾病的严重程度、组合物中所含的活性成分和其他成分的类型和含量、制剂的类型、患者的年龄、重量、总体健康状况、性别和饮食、给药时间、给药途径、组合物的分泌率、治疗的持续时间以及同时使用的药物。然而,为了获得期望的效果,本发明的自然杀伤细胞的剂量可以为0.01×107细胞/kg-1.0×109细胞/kg,或者可以是0.5×107细胞/kg-1.0×108细胞/kg。在此,所述剂量可以每天给药一次或可以一天分几次给药。
此外,可以通过本领域已知的各种方法将所述的用于预防或治疗感染性疾病的药物组合物施用于个体。考虑到给药方法、体液体积、粘度等,本领域技术人员可以适当选择给药途径。
发明模式
在下文中,将通过实施例更详细地描述本发明。然而,以下实施例仅用于说明本发明,本发明不限于以下实施例。
实施例1重组慢病毒的构建
实施例1.1重组慢病毒载体的构建
使用pcdh-cmv-mcs-ef1-puro(sbi,cd510b-1)或pcdh-cmv-mcs-ef1-neo(sbi,cd514b-1)作为慢病毒载体。使用4-1bbl(tnf超家族成员9,tnfsf9)、mbil-21(膜结合il-21)、ox40l(tnf超家族成员4(tnfsf4)转录变体1)和mtnf-α(膜结合tnfα)基因作为转导的基因。
具体地,对于4-1bbl基因(seqidno:2),使用4-1bbl基因表达载体(origene,rc211160)。对于mbil-21基因(seqidno:4),使用插入了密码子优化的mbil-21基因序列的pcdna3.1载体(金斯瑞,us)。对于ox40l基因(seqidno:6),请求bioneer公司进行合成。
对于mtnf-α基因(seqidno:9),从外周血单核细胞(pbmc)中提取rna,然后通过逆转录酶(rt)-pcr从中获得cds。为了实现tnf-α的分泌,tnf-α会被肿瘤坏死因子-α转化酶(tace)裂解。然而,在tnf-α的dna上引入点突变,使得tnf-α的氨基酸序列中被tace识别的位点丙氨酸-缬氨酸(av)变成脯氨酸-缬氨酸(pv),从而使得tnf-α保留在细胞膜上。在seqidno:7所示的人mtnf-α基因中,用胞嘧啶替换鸟嘌呤(第226位碱基)并用鸟嘌呤替换腺嘌呤(第228位碱基)来进行点突变。
用于pcr扩增转基因编码序列(cds)的适合各转导基因的引物(表1)。
[表1]
表1显示了实验中使用的引物。
用限制性内切酶ecori和bamhi处理转基因和慢病毒载体。随后,使用in-fusionhd克隆试剂盒(clontech,639649)进行连接。用连接后的慢病毒载体转化dh5α感受态细胞并进行培养。使用质粒小量制备试剂盒(macherey-nagel/740422.50)从转化的dh5α感受态细胞中获得质粒dna。对于所有的质粒dna,都请求外部公司对其进行了测序,并证实其dna序列是准确的。
实施例1.2富集慢病毒的构建
为了重组慢病毒生产,在转染的前两天,将293t细胞系以1.5×106至2×106细胞接种到75t烧瓶(nunc,156499)中,并在5%co2和37℃的条件下,在培养箱中孵育。当293t细胞的细胞融合度达到约80%至90%时,将培养基替换为6mlopti-mem(gibco,31985-088),并在5%co2条件下,37℃孵育30分钟。制备dna混合溶液和脂质体(脂质体2000,生命科技,11668500)混合溶液(表2)。
[表2]
表2显示了dna混合溶液和脂质体(脂质体2000,生命科技,11668500)混合溶液。
使用涡旋仪充分混合各混合溶液的成分,并使其在室温下静置3分钟。然后,将两种混合溶液混合并使其在室温下静置20分钟或更长时间。用2mldna和脂质体的混合溶液处理已经进行了培养基替换的293t细胞。4小时后,用补充有10%(v/v)fbs的dmem(gibco,11995073)培养基替换原培养基,并在5%co2的条件下,37℃孵育48小时。
收集8ml293t细胞培养物(进行48小时温育后获得),并用0.45μm过滤器(密理博,slhp033rs)进行过滤。使用带有再生纤维素-100膜(ultracel-100membrane)的amiconultra-15离心过滤装置(默克密理博,ufc910096),将过滤后的培养物富集至250μl或更少。将富集的病毒以适当的量等分,并保存在-80℃的温度下。
实施例2具有转导基因的t细胞的构建
实施例2.1慢病毒感染
将培养的t细胞系中的0.5×106个细胞、1mlopti-mem,50μl解冻的慢病毒、10μg/ml的聚凝胺(polybrene,santacruz,c2013)进行混合。将混合物置于6孔板(nunc,140675)中,并在1800g和32℃的温度下进行90分钟的旋转接种(spinoculation)。然后,在5%co2和37℃的条件下,在培养箱中孵育2小时。随后,用相同培养基替换原培养基,并孵育48小时。
在含有20%(v/v)fbs的imdm(atcc,30-2005)培养基中培养hut78细胞系(atcc,tib-161tm)。在传代培养中,细胞浓度维持在1.5×105细胞/ml至2.0×105细胞/ml。在含有10%(v/v)fbs的rpmi1640(atcc,30-2001)培养基中培养h9细胞系(atcc,htb-176tm)和jurkatt细胞系(atcc,tib-152tm)。在传代培养中,细胞浓度分别维持在1.0×105细胞/ml至1.5×105细胞/ml和0.5×105细胞/ml至1.0×105细胞/ml。所有细胞系的传代培养以2天至3天的间隔进行。使用75t烧瓶作为培养容器,培养基体积保持在15ml至20ml。
使用抗生素筛选被重组慢病毒感染的细胞系(表3)。
[表3]
表3显示了用于具有转导基因的细胞系的抗生素。
实施例2.2转导基因表达的鉴定
收集实施例2.1中传代培养的t细胞系,并以1200rpm离心5分钟。然后,通过抽吸除去培养物。将2%(v/v)fbs加入pbs制成facs缓冲液。用1mlfacs缓冲液稀释并检测细胞数。用facs缓冲液进行稀释,使其浓度为5×106细胞/ml。将100μl稀释后的细胞溶液添加到各个5mlfacs管(falcon,352052)中。用抗人tnf-α(膜)-pe(r&d系统,fab210p)、抗人ox40l-pe(bd,558184)、抗人4-1bbl-pe(bd,559446)、抗人il-21-pe(ebioscience,12-7219-42)、7-aad(beckmancoulter公司,im3630c)、pe小鼠igg1k同种型对照(bdpharmingen,555749)和percp-cy5.5小鼠igg1k同种型对照(bd,550795)抗体进行染色,然后使用facs设备分析各基因的表达率(图1a至3b)。
实施例3cd3(-)pbmc和具有转导基因的t细胞的共培养
实施例3.1cd3(-)pbmc种子细胞的制备
将磷酸盐缓冲盐水(pbs,lonza,17-516q)以1:1的比例添加到收集自健康供体的pbmc中,并以1,500rpm和4℃的温度离心10分钟。将2%(v/v)fbs和2mmedta添加到pbs中,制成macs运行缓冲液。将pbmc沉淀(pellet)悬浮于10ml的macs运行缓冲液中,并使用adam细胞计数系统检测细胞数。
为了获得去除cd3(+)细胞的种子细胞,将5×107pbmc转移到新的50ml试管中,然后在1200rpm和4℃的温度下离心10分钟。将400μl的macs运行缓冲液和100μl的cd3磁珠(miltenyibiotech,130050101)添加到5×107pbmc细胞沉淀(cellpellets)中,并在4℃的温度下反应20分钟。向其中加入10ml至20ml的macs运行缓冲液并进行洗涤。然后,在1200rpm和4℃的温度下离心10分钟,并将所得物重悬于2ml的macs运行缓冲液中。
使用配备有cs柱(miltenyibiotech,130-041-305)的variomacs(miltenyi生物科技)分离细胞。洗涤柱子直至最终体积达到20ml,以回收细胞。使用adam细胞计数系统检测细胞数。将1×107个细胞置于新的50ml试管中,并在1200rpm和4℃的温度下离心10分钟。将细胞沉淀(cellpellets)悬浮于冷冻培养基中,并以每小瓶1×107个细胞在液氮中冷冻。
解冻一个冷冻的cd3(-)pbmc小瓶,并将其转移到50ml试管中。将cd3(-)pbmc悬浮在含有0.6%(v/v)acd(柠檬酸盐-葡萄糖溶液,西格玛奥德里奇,c3821)、0.2%(v/v)胎牛血清牛(fbs)和2mmedta的pbs中,并在1200rpm和4℃的温度下离心10分钟。将cd3(-)pbmc沉淀悬浮在1%(v/v)cellgro培养基(cellgenix,20802-0500)中,并使用adam细胞计数系统检测细胞数。将cd3(-)pbmc种子细胞以1×106细胞/ml的浓度悬浮在1%(v/v)cellgro培养基中。
实施例3.2cd3(-)pbmc种子细胞和具有转导基因的t饲养细胞的共培养
从培养瓶中回收具有转导基因的t细胞,并在1200rpm和4℃的温度下离心10分钟。此后,将细胞悬浮在1%(v/v)cellgro培养基中,并使用adam细胞计数系统检测细胞数。通过将其以5×106细胞/ml的浓度悬浮于1%(v/v)cellgro培养基中,制备具有转导基因的t饲养细胞,然后在γ射线辐照器中以20,000cgy照射并灭活。
在培养自然杀伤细胞时,将500iuil-2(proleukininj.,诺华韩国)和10ng/mlokt-3(ebioscience,16-0037-85)添加到培养塑料板上。在培养的第0天,分别将cd3(-)pbmc种子细胞和具有转导基因的t饲养细胞以0.5ml到1ml的体积、以1:5或1:2.5的比例进行添加,并以0.25ml至0.5ml的体积向其中添加含有1%(v/v)人血浆的cellgro培养基。在添加培养基的同时,将所得物在培养箱中在37℃的温度条件下静置培养4-7天。
在培养的第4-5天,检测细胞数,使得细胞的浓度为约0.5×106至1×106细胞/ml。此后,将细胞用含有500iuil-2和1%(v/v)自体血浆的cellgro培养基稀释,并置于适当的培养容器中。再次对细胞进行静置培养。
之后,以2天-3天的间隔检测细胞数,使得细胞的浓度为0.5×105至1×106细胞/ml。之后,对细胞进行悬浮培养直至第21天,培养的同时用含有500iuil-2和1%(v/v)自体血浆的cellgro培养基进行稀释。在悬浮培养的第21天,获得自然杀伤细胞。
比较培养的自然杀伤细胞的扩增速率的结果,基于总有核细胞(tnc)的扩增速率而言,可以确定,与没有转导基因的细胞系相比,包含导入了一种或多种基因(mtnf-α、ox40l、4-1bbl或mbil-21)的细胞系的培养物使得自然杀伤细胞的扩增增强(h9中为76倍,hut78中为382倍,jurkat中为26倍)。特别地,无论转导的t细胞为何种类型,与单次转导4-1bbl基因或mbil-21基因相比,当细胞系转导mbil-21/4-1bbl基因时,自然杀伤细胞的扩增速率非常高,在hut78-mbil-21/4-1bbl中为4,169倍,h9-mbil-21/4-1bbl中为3,758倍,jurkat-mbil-21/4-1bbl中为258倍(表4,图4a至4c)。亦即,确定在转导mbil-21基因和4-1bbl基因时观察到协同作用。
[表4]
表4显示了用进行了单或双基因转导的t细胞系培养的自然杀伤细胞的扩增速率。
为了鉴定转导两个或多个基因的组合时获得的协同作用,将用经历三重基因(mtnf-α/mbil-21/4-1bbl)或四重基因(mtnf-α/mbil-21/ox40l/4-1bbl)转导的hut78t细胞系进行培养的自然杀伤细胞的扩增作用,与之前进行过实验的基因组合进行比较。在经历了双重基因转导的细胞系中,诱导最高的自然杀伤细胞扩增的细胞系是转导了mbil-21/4-1bbl基因的细胞系(998倍)。然而,当用经历了三重基因转导的细胞系(1,607倍)或经历了四重基因转导的细胞系(1,640倍)进行培养时,发现与转导了mbil-21/4-1bbl基因的细胞系(998倍)相比,观察到的协同作用更高(表5和图4d)。
[表5]
表5显示了用进行了多基因转导的t细胞系培养的自然杀伤细胞的扩增速率。
进行实验以鉴定自然杀伤细胞的培养是否可以由于基因转导在t细胞系的重复再刺激下不断维持。
从培养瓶中回收经历了三重基因转导的hut78细胞,并在1200rpm和4℃的温度下离心10分钟。此后,将细胞悬浮在1%(v/v)cellgro培养基中,并使用adam细胞计数系统检测细胞数。通过将其以2.5×106细胞/ml的浓度悬浮于1%(v/v)cellgro培养基中,制备经历了三重基因转导的hut78饲养细胞,然后在γ射线辐照器中以20,000cgy照射并灭活。
在培养自然杀伤细胞时,将500iuil-2(proleukininj.,诺华韩国)和10ng/mlokt-3(ebioscience,16-0037-85)添加到培养塑料板上。
在培养的第0天,分别将cd3(-)pbmc种子细胞和经历了三重基因转导的hut78饲养细胞以0.5ml到1ml的体积和1:2.5的比例进行添加,并以0.5ml至1ml的体积向其中添加含有1%(v/v)人血浆的cellgro培养基。将细胞在培养箱中在37℃的温度条件下静置培养4-7天。在培养的第2天或第3天,除去一半的培养基,并向其中加入与除去体积相同的含有1%(v/v)人血浆的cellgro培养基。在培养的第4或5天,检测细胞数,使得细胞的浓度为约0.5×106细胞/ml至1×106细胞/ml。
在培养的第7天或第11天,检测细胞数并将细胞以1×106细胞/ml的浓度悬浮在1%(v/v)cellgro培养基中。为了进行再刺激,分别将经历了三重基因转导的hut78饲养细胞以0.5ml至1ml的体积、以1:2.5的比例加入其中,并将含有500iuil-2的cellgro培养基(proleukininj.,诺华韩国)、10ng/ml的okt-3(ebioscience,16-0037-85)和1%(v/v)的人血浆以0.5ml至1ml的体积加入其中。将细胞在培养箱中在37℃的温度条件下静置培养3-4天。之后,以2天或3天的间隔检测细胞数,使得细胞的浓度为0.5×105细胞/ml至1×106细胞/ml。
以7天或11天的间隔重复进行再刺激过程,从而以7天间隔给予了总共4次再刺激(d7rs5),以11天间隔给予了总共3次再刺激(d11rs4)。
比较培养的自然杀伤细胞的扩增速率的结果,基于总有核细胞(tnc)的扩增而言,可以确定,与没有给予再刺激的情况下获得的扩增相比,进行一种或多种再刺激的培养使得自然杀伤细胞的扩增增强(图5a至5d)。当在培养的第0天用hut78-mtnf-α/4-1bbl/mbil-21细胞系刺激一次时,培养持续进行至第25天,并获得了2124倍的扩增。当用hut78-mtnf-α/4-1bbl/mbil-21细胞系以7天的间隔刺激5次时,培养持续进行至第35天,并获得了436,032倍的扩增。当用hut78-mtnf-α/4-1bbl/mbil-21细胞系以11天的间隔刺激4次时,培养持续进行至第42天,并实现了2,628,153倍的扩增。因此,可以确定用hut78-mtnf-α/4-1bbl/mbil-21t细胞系以7天或11天的间隔进行重复刺激使得自然杀伤细胞的扩增持续增加。
实验例1基于转导基因鉴定自然杀伤细胞的细胞活力
为了比较和评估体外的细胞活力,使用了adam细胞计数系统,该系统是使用能够与细胞内核结合的pi染色溶液的细胞计数器之一。通过从测得的细胞总数中减去死细胞数从而计算出活细胞的数目后,使用下述的表达式i计算细胞活力。
[表达式i]
细胞活力(%)=(活细胞数/总细胞数)×100
培养21天后检测自然杀伤细胞的活力,结果在所有条件下均观察到约80%或更高的高细胞活力(图6a至6d)。
实验例2基于转导基因分析自然杀伤细胞的细胞表型
对培养21天的自然杀伤细胞或通过重复再刺激培养的自然杀伤细胞进行收集,并以1200rpm离心5分钟。通过抽吸除去培养基。用1mlfacs缓冲液稀释并检测细胞数。用facs缓冲液进行稀释,使其浓度为5×106细胞/ml。将100μl稀释的细胞溶液添加到各个5mlfacs管(falcon,352052)中,并使用以下抗体进行表型分析。
管1:抗人cd3-fitc(bdpharmingen,555332)、抗人cd16-pe(bdpharmingen,555407)、抗人cd56-pe-cy5(bdpharmingen,555517)或抗人cd56-pecy7(bdpharmingen,557747)、抗人类cd56-bv421(bdpharmingen,562751)
管2:抗人cd14-fitc(bdpharmingen,555397)、抗人cd19-pe(bdpharmingen,555413)、抗人cd3-pe-cy5(bdpharmingen,555341)或抗人cd3-pecy7(ebioscience,25-0038-42)、抗人cd3-bv421(bdpharmingen,562438)
管3:抗人cd3-fitc、抗人nkg2d-pe(r&d系统,fab139p)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管4:抗人cd3-fitc、抗人nkp30-pe(bdpharmingen,558407)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管5:抗人cd3-fitc、抗人nkp44-pe(bdpharmingen,558563)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管6:抗人cd3-fitc、抗人nkp46-pe(bdpharmingen,557991)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管7:抗人cd3-fitc、抗人dnam-1-pe(bdpharmingen,559789)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管8:抗人cd3-fitc、抗人cxcr3-pe(bdpharmingen,557185)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管9:抗人cd3-fitc、pe小鼠igg1k同种型对照(bdpharmingen,555749)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管10:fitc小鼠igg1k同种型对照(bdpharmingen,555748)、pe小鼠igg1k同种型对照、pe-cy5小鼠igg1k同种型对照(bdpharmingen,555750)或pe-cy7小鼠igg1k同种型对照(bdpharmingen,557872)、bv421小鼠igg1k同种型对照(bdpharmingen,562438)
管11:抗人cd3-fitc、抗人nkg2a-pe(r&d系统,fab1059p)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管12:抗人cd3-fitc、抗人nkg2c-pe(r&d系统,fab138p)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管13:抗人cd3-fitc、抗人cd62l-pe(ebioscience,12-0629-42)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管14:抗人cd3-fitc、抗人cd69-pe(r&d系统,fab23591p)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管15:抗人cd3-fitc、抗人cd57-pe(bdpharmingen,560844)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
在管1中,选择三种荧光之一进行抗人cd56染色,并且为管2的cd3、管3-9和11-15的cd56以及管10的同种型对照选择相同的荧光。
将上述管中的细胞在冷藏温度下染色30分钟。之后,将2ml的facs缓冲液加入到染色的细胞中,并以1,500rpm离心5分钟。除去上清液,并再次加入2mlfacs缓冲液。以1,500rpm离心5分钟。再次除去上清液,并将其悬浮在200μl固定缓冲液(bd,554655)中。然后,使用facslsriifortessa(bd)进行细胞的鉴定及其纯度和表型的检测。
对培养21天的自然杀伤细胞进行鉴定和纯度分析。结果确定在所有条件下,nk细胞(cd3-cd56+)的含量都为95%或以上,并且使用经历了双重基因转导的t饲养细胞,用于评估自然杀伤细胞活化的标志物cd56+cd16+的表达维持在高水平(图7a至7h)。
此外,分析了自然杀伤细胞中代表性受体的表达。可以确定,所有自然杀伤细胞均以高水平表达cd16,并且与没有基因被转导的条件或经历了单基因转导的饲养细胞的条件相比,在经历了双重基因转导的饲养细胞的条件下培养的自然杀伤细胞以高水平表达活化标志物nkg2d、nkp30、nkp44、nkp46和dnam-1,而在供体之间没有差异。特别地,可以确定在经历了双重基因转导的饲养细胞的条件下,cxcr3的量大大增加。因此,可以确定经历了双重基因转导的饲养细胞是有用的饲养细胞,其能够增强nk细胞的活化和肿瘤靶向(图8a至11l)。
对利用基因转导导致的t细胞系的重复再刺激而培养的自然杀伤细胞的受体和活化标志物进行鉴定,结果确定在不进行再刺激的条件下和在进行重复再刺激的条件下,即使再刺激间隔或培养时间增加,活化标志物(cd16、nkg2d、nkp30、nkp44、nkp46、dnam-1)的表达均无明显差异(图12a至12c)。
实验例3基于t细胞转导基因鉴定自然杀伤细胞的异常细胞杀伤活性
将1×106个细胞的k562癌细胞系置于15ml试管中并进行离心。将细胞沉淀物悬浮在补充有1ml10%(v/v)fbs的rpmi1640培养基中。此后,向其中添加30μl的1mm钙黄绿素-am(分子探针,c34852)。然后,使用银箔遮光,并在37℃的温度条件下,在恒温箱中染色1小时。
加入10ml-15ml补充有10%(v/v)fbs的rpmi1640培养基,对钙黄绿素-am染色的肿瘤细胞系进行洗涤,并进行离心。然后,将沉淀(pellet)悬浮于10ml补充有10%(v/v)fbs的rpmi1640培养基中,使得细胞浓度为1×105细胞/ml。将1×106个自然杀伤细胞置于15ml试管中,并进行离心。将沉淀以相对于k562癌细胞系的期望比例(1:1)悬浮在补充有10%(v/v)fbs的rpmi1640培养基中。将制备的k562癌细胞系和自然杀伤细胞系各使用100μl进行混合,然后分配到96孔u形平板中(nunc,163320)。每个孔的制备重复三次,并获得其平均值。
向自发释放孔中添加100μl染色的k562癌细胞系和100μl补充有10%(v/v)fbs的rpmi1640培养基。向最大释放孔中添加100μl染色的k562癌细胞系和100μl补充有2%(v/v)triton-x100的三重蒸馏水。
为了校正补充有10%(v/v)fbs的rpmi1640培养基和补充2%(v/v)的triton-x100的rpmi1640培养基中存在的自发荧光,加入200μl补充有10%(v/v)fbs的rpmi1640培养基以形成培养基值;将100μl补充有2%(v/v)triton-x100的rpmi1640培养基添加到100μl补充有10%(v/v)fbs的rpmi1640培养基中以形成两种溶液的混合溶液值。通过将培养基值减去混合溶液值而得到的差值(a)加到最大释放值上,来校正自发荧光。
遮光,在37℃的温度条件下,恒温箱中反应4小时,然后将板以2,000rpm离心3分钟。将各上清液以100μl分配到96孔黑色平板中(nunc,237108)。使用荧光板读数器(珀金埃尔默,victorx3)测量荧光值(od480/535nm),并使用下述表达式ii计算自然杀伤细胞的肿瘤细胞杀伤活性。
[表达式ii]
杀伤百分比=(样品孔平均荧光值-spon孔平均荧光值)/{(最大孔平均荧光值+a)-spon孔平均荧光值}×100
用各个饲养细胞培养的自然杀伤细胞与k562癌细胞系反应,以检测其直接杀伤细胞的活性。与其他条件相比,在经历了双重基因转导的饲养细胞的条件下,对k562癌细胞系的平均杀伤活性增加(图13a至14d)。
将利用基因转导导致的t细胞系的再刺激而培养的自然杀伤细胞与k562癌细胞系反应,以检测其直接杀伤细胞的活性。可以确定,在不进行再刺激的条件下和进行反复再刺激的条件下,即使是在培养时间延长且扩增倍数增加时,其对k562的杀伤活性也得到了很好的维持(图15a至15c)。
实验例4基于t细胞转导基因分析自然杀伤细胞中的扩增标志物(ki-67)
对培养21天的自然杀伤细胞或通过重复再刺激培养的自然杀伤细胞进行收集,并以1200rpm离心5分钟。通过抽吸除去培养基。用1mlfacs缓冲液稀释并检测细胞数。用facs缓冲液进行稀释,使其浓度为5×106细胞/ml。将100μl稀释的细胞溶液添加到各个5mlfacs管(falcon,352052)中,并使用以下抗体进行扩增标志物分析。
管1:抗人cd3-fitc(bdpharmingen,555332)、抗人cd56-pe-cy7(bdpharmingen,557747)、7-aad(beckmancoulter公司,a07704)
管2:抗人cd3-fitc(bdpharmingen,555332)、抗人cd56-pe-cy7(bdpharmingen,557747)、7-aad(beckmancoulter公司,a07704)
管3:fitc小鼠igg1k同种型对照(bdpharmingen,555748)、pe-cy7小鼠igg1k同种型对照(bdpharmingen,557872)
将上述管中的细胞在冷藏温度下染色30分钟。之后,将2ml的facs缓冲液加入到染色的细胞中,并以1,500rpm离心5分钟。除去上清液,并再次加入2mlfacs缓冲液。以1,500rpm离心5分钟。再次除去上清液,并将其悬浮在200μl固定/透化缓冲液(ebioscience,00-5521-00)中。然后,在冷藏温度下反应30分钟以上。加入2ml的1×perm/洗涤缓冲液,并以1,500rpm离心5分钟。除去上清液,并再次加入2mlfacs缓冲液。以1,500rpm离心5分钟。将抗人ki-67-v450(bdpharmingen,561281)添加到管1中,并将v450小鼠igg1k同种型对照(bdpharmingen,561504)添加到管2和3中。在室温下染色30分钟。
随后,将2ml的1×perm/洗涤缓冲液加入到染色的细胞中,并以1,500rpm离心5分钟。除去上清液,并再次加入2ml1×perm/洗涤缓冲液。以1,500rpm离心5分钟。再次除去上清液,并将其悬浮在200μl固定缓冲液(bd,554655)中。然后,使用facslsriifortessa(bd)检测细胞中的扩增标志物。
可以确定,除hut78-mtnf-α/ox40l外,与没有基因转导的hut78细胞系相比,用转导了一种或多种基因的hut78细胞系培养的自然杀伤细胞中,ki-67的表达维持在较高水平(图16a至16d)。
对通过hut78-mtnf-α/4-1bbl/mbil-21饲养细胞的再刺激培养的自然杀伤细胞中的扩增标志物进行了分析。结果确定,ki-67的表达随着饲养细胞以7天或11天的间隔进行刺激而增加,且呈下降趋势。此外,可以确定,ki-67的表达可以通过重复再刺激维持(图17a至17d)。
实验例5基于t细胞转导基因分析自然杀伤细胞中的共刺激分子
对培养21天的自然杀伤细胞或通过重复再刺激培养的自然杀伤细胞进行收集,并以1200rpm离心5分钟。通过抽吸除去培养基。用1mlfacs缓冲液稀释并检测细胞数。用facs缓冲液进行稀释,使其浓度为5×106细胞/ml。将100μl稀释的细胞溶液添加到各个5mlfacs管(falcon,352052)中,并使用以下抗体进行表型分析。
管1:抗人cd3-fitc(bdpharmingen,555332)、抗人cd25-pe(bdpharmingen,555432)、抗人cd56-pe-cy5(bdpharmingen,555517)或抗人cd56-pecy7(bdpharmingen,557747)、抗人类cd56-bv421(bdpharmingen,562751)
管2:抗人cd3-fitc、抗人tnfrii-pe(r&d系统,fab226p)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管3:抗人cd3-fitc、抗人4-1bb-pe(bdpharmingen,559446)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管4:抗人cd3-fitc、pe小鼠igg1k同种型对照(bdpharmingen,555749)、抗人cd56-pe-cy5或抗人cd56-pe-cy7、抗人cd56-bv421
管5:fitc小鼠igg1k同种型对照(bdpharmingen,555748)、pe小鼠igg1k同种型对照、pe-cy5小鼠igg1k同种型对照(bdpharmingen,555750)或pe-cy7小鼠igg1k同种型对照(bdpharmingen,557872)、bv421小鼠igg1k同种型对照(bdpharmingen,562438)
在试管1中,通过选择三种荧光之一进行抗人cd56染色,因此为试管2至4的cd56和试管5的同型对照选择了相同的荧光。
将上述管中的细胞在冷藏温度下染色30分钟。之后,将2ml的facs缓冲液加入到染色的细胞中,并以1,500rpm离心5分钟。除去上清液,并再次加入2mlfacs缓冲液。以1,500rpm离心5分钟。再次除去上清液,并将其悬浮在200μl固定缓冲液(bd,554655)中。然后,使用facslsriifortessa(bd)进行细胞鉴定和共刺激分子的检测。
对用具有各个基因组合的hut78细胞系培养21天的自然杀伤细胞中的共刺激分子进行分析。结果确定,与非转基因hut78细胞系相比,用转导了一种或多种基因的hut78细胞系培养的自然杀伤细胞中,共刺激分子的表达维持在较高水平。特别地,可以确定,转导了单基因或包含mbil-21基因的多基因组合的细胞系表现出比其他细胞系更高的共刺激分子表达(图18a至18f)。
对培养第0天用hut78-mtnf-α/4-1bbl/mbil-21细胞系刺激一次后培养的自然杀伤细胞,以及用hut78-mtnf-α/4-1bbl/mbil-21细胞系以7天或11天的间隔重复再刺激而培养的自然杀伤细胞中的共刺激分子进行分析。结果,除非在第一次刺激后进行额外的再刺激,否则共刺激分子的表达增加并在随后保持下降状态。另一方面,共刺激分子在重复刺激的培养期间持续表达,这表明在被饲养细胞反复刺激后,共刺激分子的表达在刺激的时间点增加,然后在一定时间后下降(图19a至19f)。
实验例6基于t细胞转导基因鉴定自然杀伤细胞的细胞因子分泌
将2.5×106个细胞的k562癌细胞系的置于15ml试管中并离心。将细胞沉淀悬浮在补充有10%(v/v)fbs的1mlrpmi1640培养基中。
将2.5×106个细胞的自然杀伤细胞置于15ml试管中并离心。将细胞沉淀物悬浮在补充有1ml10%(v/v)fbs的rpmi1640培养基中。为了在细胞内鉴定要从细胞中分泌出去的细胞因子,向其中添加了蛋白转运抑制剂golgiplug(bd,555029)和golgistop(bd,554724)。
将制备的细胞分配到96孔u底平板(nunc,163320)中,其中将自然杀伤细胞和培养基以各100μl的量添加到孔1中,然后将k562癌细胞系和自然杀伤细胞系各100μl混合并将其添加到孔2和3。
孔1、2:抗人cd107a-apc(bdpharmingen,560664)
孔3:apc小鼠igg1k同种型对照(bdpharmingen,555751)
遮光,在37℃的温度条件下,恒温箱中反应4小时,然后将板以2,000rpm离心3分钟。除去上清液,用如下抗体分析细胞因子的分泌能力。
孔1、2、3:抗人cd3-percp-cy5.5(ebioscience,45-0036-42)、抗人cd56-apc-cy7(ebioscience,47-0567-42)、7-aad(贝克曼库尔特公司,a07704)
将该板在冷藏温度下染色30分钟。之后,将100μl的facs缓冲液添加至染色的细胞中,并以2,000rpm进行离心3分钟。去除上清液,并再次向其中加入200μlfacs缓冲液。以2,000rpm离心3分钟。再次除去上清液,并将其悬浮于200μl固定/透化缓冲液(bdpharmingen,554714)中。然后,在冷藏温度下反应30分钟以上。
向其中加入200μl的1×perm/洗涤缓冲液,并以1,500rpm离心5分钟。除去上清液,并再次加入2mlfacs缓冲液。以2,000rpm离心3分钟。将抗人ifn-γ-fitc(bdpharmingen,554700)、抗人tnfα-pe-cy7(ebioscience,25-7349-82)添加至孔1和2中,并将fitc小鼠igg1k同种型对照(bdpharmingen,555748)、pe-cy7小鼠igg1k同种型对照(bdpharmingen,557872)添加至孔3中。在冷藏温度下染色30分钟。
之后,将100μl的1×perm/洗涤缓冲液加入到染色的细胞中,并以2,000rpm离心3分钟。除去上清液,并再次向其中加入100μl的1×perm/洗涤缓冲液。以2,000rpm离心3分钟。再次除去上清液,并将其悬浮在200μl固定缓冲液(bd,554655)中。然后,使用facslsriifortessa(bd)检测细胞的细胞因子分泌能力。
对用具有各个基因组合的hut78细胞系培养21天的自然杀伤细胞针对k562癌细胞系的细胞因子分泌能力进行了测定。结果确定,与没有基因转导的细胞系相比,用转导了一种或多种基因的细胞系培养时,尽管在扩展倍数上有很大差异,但观察到相似水平的细胞因子分泌能力(图20a至20c)。
通过与k562癌细胞系反应,对培养第0天用hut78-mtnf-α/4-1bbl/mbil-21细胞系刺激一次后培养的自然杀伤细胞,以及用hut78-mtnf-α/4-1bbl/mbil-21细胞系以7天或11天的间隔重复再刺激而培养的自然杀伤细胞中的细胞因子分泌进行检测。可以确定,与进行一次刺激而培养的自然杀伤细胞相比,尽管培养时间长且扩增倍数高,通过重复再刺激培养的自然杀伤细胞仍维持针对k562的细胞因子分泌能力,而没有明显差异(图21a至21c)。
序列表
<110>gc细胞治疗
<120>使用转化的t细胞培养自然杀伤细胞的方法
<130>p2019-1805
<150>kr10-2017-0065180
<151>2017-05-26
<160>17
<170>siposequencelisting1.0
<210>1
<211>254
<212>prt
<213>人工序列(artificialsequence)
<400>1
metglutyralaseraspalaserleuaspproglualaprotrppro
151015
proalaproargalaargalacysargvalleuprotrpalaleuval
202530
alaglyleuleuleuleuleuleuleualaalaalacysalavalphe
354045
leualacysprotrpalavalserglyalaargalaserproglyser
505560
alaalaserproargleuarggluglyprogluleuserproaspasp
65707580
proalaglyleuleuaspleuargglnglymetphealaglnleuval
859095
alaglnasnvalleuleuileaspglyproleusertrptyrserasp
100105110
proglyleualaglyvalserleuthrglyglyleusertyrlysglu
115120125
aspthrlysgluleuvalvalalalysalaglyvaltyrtyrvalphe
130135140
pheglnleugluleuargargvalvalalaglygluglyserglyser
145150155160
valserleualaleuhisleuglnproleuargseralaalaglyala
165170175
alaalaleualaleuthrvalaspleuproproalasersergluala
180185190
argasnseralapheglypheglnglyargleuleuhisleuserala
195200205
glyglnargleuglyvalhisleuhisthrglualaargalaarghis
210215220
alatrpglnleuthrglnglyalathrvalleuglyleupheargval
225230235240
thrprogluileproalaglyleuproserproargserglu
245250
<210>2
<211>765
<212>dna
<213>人工序列(artificialsequence)
<400>2
atggaatacgcctctgacgcttcactggaccccgaagccccgtggcctcccgcgccccgc60
gctcgcgcctgccgcgtactgccttgggccctggtcgcggggctgctgctgctgctgctg120
ctcgctgccgcctgcgccgtcttcctcgcctgcccctgggccgtgtccggggctcgcgcc180
tcgcccggctccgcggccagcccgagactccgcgagggtcccgagctttcgcccgacgat240
cccgccggcctcttggacctgcggcagggcatgtttgcgcagctggtggcccaaaatgtt300
ctgctgatcgatgggcccctgagctggtacagtgacccaggcctggcaggcgtgtccctg360
acggggggcctgagctacaaagaggacacgaaggagctggtggtggccaaggctggagtc420
tactatgtcttctttcaactagagctgcggcgcgtggtggccggcgagggctcaggctcc480
gtttcacttgcgctgcacctgcagccactgcgctctgctgctggggccgccgccctggct540
ttgaccgtggacctgccacccgcctcctccgaggctcggaactcggccttcggtttccag600
ggccgcttgctgcacctgagtgccggccagcgcctgggcgtccatcttcacactgaggcc660
agggcacgccatgcctggcagcttacccagggcgccacagtcttgggactcttccgggtg720
acccccgaaatcccagccggactcccttcaccgaggtcggaataa765
<210>3
<211>223
<212>prt
<213>人工序列(artificialsequence)
<400>3
metalaleuprovalthralaleuleuleuproleualaleuleuleu
151015
hisalaalaargproglnasparghismetileargmetargglnleu
202530
ileaspilevalaspglnleulysasntyrvalasnaspleuvalpro
354045
glupheleuproalaprogluaspvalgluthrasncysglutrpser
505560
alaphesercyspheglnlysalaglnleulysseralaasnthrgly
65707580
asnasngluargileileasnvalserilelyslysleulysarglys
859095
proproserthrasnalaglyargargglnlyshisargleuthrcys
100105110
prosercysaspsertyrglulyslysproprolysglupheleuglu
115120125
argphelysserleuleuglnlysmetilehisglnhisleuserser
130135140
argthrhisglysergluaspseralalysprothrthrthrproala
145150155160
proargproprothrproalaprothrilealaserglnproleuser
165170175
leuargproglualacysargproalaalaglyglyalavalhisthr
180185190
argglyleuaspphealacysaspiletyriletrpalaproleuala
195200205
glythrcysglyvalleuleuleuserleuvalilethrleutyr
210215220
<210>4
<211>672
<212>dna
<213>人工序列(artificialsequence)
<400>4
atggctctgcccgtcaccgctctgctgctgcctctggccctgctgctgcacgccgcaaga60
ccacaggaccgccacatgattcggatgaggcagctgatcgacattgtggatcagctgaag120
aactacgtgaatgacctggtccccgagttcctgcccgctcctgaggatgtcgaaacaaac180
tgcgaatggtctgcattcagttgttttcagaaggctcagctgaaatctgcaaacactgga240
aacaatgagcgaatcattaatgtgagcatcaagaaactgaagcggaaacccccttccact300
aatgcaggccggagacagaagcaccgactgacctgcccctcatgtgacagctatgaaaag360
aaaccacccaaagagttcctggagcggttcaagagcctgctccagaaaatgatccaccag420
cacctgagcagccggacccacggcagcgaggattctgccaagcctaccacaactccagct480
ccccgccctccaacccctgcaccaacaattgccagtcagcccctgtcactgaggcctgaa540
gcatgccgcccagccgctggcggagcagtccacacacgaggcctggactttgcttgtgat600
atctacatttgggcacctctggctggaacttgcggcgtcctgctgctgtccctggtcatc660
accctgtattga672
<210>5
<211>183
<212>prt
<213>人工序列(artificialsequence)
<400>5
metgluargvalglnproleuglugluasnvalglyasnalaalaarg
151015
proargphegluargasnlysleuleuleuvalalaservalilegln
202530
glyleuglyleuleuleucysphethrtyrilecysleuhispheser
354045
alaleuglnvalserhisargtyrproargileglnserilelysval
505560
glnphethrglutyrlyslysglulysglypheileleuthrsergln
65707580
lysgluaspgluilemetlysvalglnasnasnservalileileasn
859095
cysaspglyphetyrleuileserleulysglytyrpheserglnglu
100105110
valasnileserleuhistyrglnlysaspglugluproleuphegln
115120125
leulyslysvalargservalasnserleumetvalalaserleuthr
130135140
tyrlysasplysvaltyrleuasnvalthrthraspasnthrserleu
145150155160
aspaspphehisvalasnglyglygluleuileleuilehisglnasn
165170175
proglygluphecysvalleu
180
<210>6
<211>552
<212>dna
<213>人工序列(artificialsequence)
<400>6
atggaacgggtgcaacctctggaggagaatgtgggcaatgcagcccggccaagatttgag60
aggaacaagctactgctggtggcctctgtgatacagggactggggctcctcctgtgcttc120
acctacatctgcctgcacttcagcgctcttcaggtgtcacaccggtatccccgcatacaa180
agtatcaaggtccagtttaccgagtataagaaagagaagggtttcatcctcactagtcag240
aaggaggatgaaatcatgaaggtgcagaacaactcagttattattaactgtgacggcttt300
tatctgatcagcctgaagggctacttctcccaggaagtaaacatcagcctgcattaccag360
aaggatgaggagcccctgtttcagctgaagaaggtccggtccgtgaactcccttatggtc420
gcctctctgacgtacaaggacaaggtgtacctcaatgtgaccacagacaatacatccctg480
gatgacttccatgtgaatggcggagaactgattctgattcaccagaaccctggggagttc540
tgtgtcttgtga552
<210>7
<211>705
<212>dna
<213>智人(homosapiens)
<400>7
atgagcactgaaagcatgatccgggacgtggagctggccgaggaggcgctccccaagaag60
acaggggggccccagggctccaggcggtgcttgttcctcagcctcttctccttcctgatc120
gtggcaggcgccaccacgctcttctgcctgctgcactttggagtgatcggcccccagagg180
gaagagttccccagggacctctctctaatcagccctctggcccaggcagtcagatcatct240
tctcgaaccccgagtgacaagcctgtagcccatgttgtagcaaaccctcaagctgagggg300
cagctccagtggctgaaccgccgggccaatgccctcctggccaatggcgtggagctgaga360
gataaccagctggtggtgccatcagagggcctgtacctcatctactcccaggtcctcttc420
aagggccaaggctgcccctccacccatgtgctcctcacccacaccatcagccgcatcgcc480
gtctcctaccagaccaaggtcaacctcctctctgccatcaagagcccctgccagagggag540
accccagagggggctgaggccaagccctggtatgagcccatctatctgggaggggtcttc600
cagctggagaagggtgaccgactcagcgctgagatcaatcggcccgactatctcgacttt660
gccgagtctgggcaggtctactttgggatcattgccctgtgagga705
<210>8
<211>233
<212>prt
<213>人工序列(artificialsequence)
<400>8
metserthrglusermetileargaspvalgluleualaglugluala
151015
leuprolyslysthrglyglyproglnglyserargargcysleuphe
202530
leuserleupheserpheleuilevalalaglyalathrthrleuphe
354045
cysleuleuhispheglyvalileglyproglnargglugluphepro
505560
argaspleuserleuileserproleualaglnprovalargserser
65707580
serargthrproserasplysprovalalahisvalvalalaasnpro
859095
glnalagluglyglnleuglntrpleuasnargargalaasnalaleu
100105110
leualaasnglyvalgluleuargaspasnglnleuvalvalproser
115120125
gluglyleutyrleuiletyrserglnvalleuphelysglyglngly
130135140
cysproserthrhisvalleuleuthrhisthrileserargileala
145150155160
valsertyrglnthrlysvalasnleuleuseralailelysserpro
165170175
cysglnarggluthrprogluglyalaglualalysprotrptyrglu
180185190
proiletyrleuglyglyvalpheglnleuglulysglyaspargleu
195200205
seralagluileasnargproasptyrleuaspphealaglusergly
210215220
glnvaltyrpheglyileilealaleu
225230
<210>9
<211>702
<212>dna
<213>人工序列(artificialsequence)
<400>9
atgagcactgaaagcatgatccgggacgtggagctggccgaggaggcgctccccaagaag60
acaggggggccccagggctccaggcggtgcttgttcctcagcctcttctccttcctgatc120
gtggcaggcgccaccacgctcttctgcctgctgcactttggagtgatcggcccccagagg180
gaagagttccccagggacctctctctaatcagccctctggcccagccggtcagatcatct240
tctcgaaccccgagtgacaagcctgtagcccatgttgtagcaaaccctcaagctgagggg300
cagctccagtggctgaaccgccgggccaatgccctcctggccaatggcgtggagctgaga360
gataaccagctggtggtgccatcagagggcctgtacctcatctactcccaggtcctcttc420
aagggccaaggctgcccctccacccatgtgctcctcacccacaccatcagccgcatcgcc480
gtctcctaccagaccaaggtcaacctcctctctgccatcaagagcccctgccagagggag540
accccagagggggctgaggccaagccctggtatgagcccatctatctgggaggggtcttc600
cagctggagaagggtgaccgactcagcgctgagatcaatcggcccgactatctcgacttt660
gccgagtctgggcaggtctactttgggatcattgccctgtga702
<210>10
<211>46
<212>dna
<213>人工序列(artificialsequence)
<400>10
tctagagctagcgaattcgccaccatggaatacgcctctgacgctt46
<210>11
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>11
ttcgcggccgcggatccttattccgacctcggtgaagg38
<210>12
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>12
tagagctagcgaattcgccaccgccaccatggctctgccc40
<210>13
<211>35
<212>dna
<213>人工序列(artificialsequence)
<400>13
tcgcggccgcggatcctcaatacagggtgatgacc35
<210>14
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>14
tagagctagcgaattcgccaccatggaacgggtgcaac38
<210>15
<211>37
<212>dna
<213>人工序列(artificialsequence)
<400>15
tcgcggccgcggatcctcacaagacacagaactcccc37
<210>16
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>16
tagagctagcgaattcgccaccgccaccatggctctgccc40
<210>17
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>17
tcgcggccgcggatcctcacagggcaatgatccc34
- 还没有人留言评论。精彩留言会获得点赞!