环状烯丙基硝基化合物的制备的制作方法
相关申请的交叉引用
本申请要求2017年4月7日提交的美国申请号62/483,014的优先权,其内容通过引用整体结合于此。
发明领域
本发明涉及环状烯丙基硝基化合物的合成,特别是使用硝基-醛醇反应的环状烯丙基硝基化合物的合成。
发明背景
烯丙基硝基化合物1是一类合成的通用结构,其能够输送范围广泛的具有重要结构基序(motif)的产物(方案1)。这些包括α,β-不饱和酮2、烯丙基胺3、烯丙基腈4、不饱和β-硝基醇5、不饱和β-氨基醇6、不饱和α-硝基酮7、2-硝基-1,3-二烯8以及进一步官能化的产物9。
方案1
硝基-醛醇反应或henry反应是用于构建共轭硝基烷烃10的广泛使用的工具(henry,compt.rend.1895,120,1265;wang,henryreaction.于comprehensiveorganicnamereactionsandreagents,johnwiley&sons,inc.:2010)。在1982年,barton等人详细描述了亚胺催化用于不规则的硝基-醛醇反应的用途,该反应产生了可用于合成皮质类固醇的烯丙基硝基化合物11(barton等人,j.chem.soc.,chem.commun.1982,551-552)。tamura等人随后对此进行了更详细的探讨(j.org.chem.1986,51,4368-4375)。其中显示出n,n-二甲基乙二胺12可以用作催化剂,用于由酮和伯硝基烷烃形成烯丙基硝基化合物(方案2)。
方案2
由barton和tamura开发的方法最近用于合成对称的环烯烃烯丙基硝基化合物(umemiya等人,chem.eur.j.2014,20,15753-59)。对于所有这些开发的硝基-醛醇反应,苯被用作共沸移除水的溶剂,所述水在反应期间形成。然而,现在苯的使用受到严格管制。另外,从1982/1986年的这些最初发现以来,关于不对称环状烯丙基硝基化合物的选择性制备一直没有引起关注。需要开发一种绿色且有效的方法来制备环状烯丙基硝基化合物。
发明概述
本申请公开了一种由相应的环酮和硝基烷烃制备环状烯丙基硝基化合物的方法,特别是选择性地合成5,5-二甲基-1-(1-硝基乙基)环己-1-烯,然后将该方法与随后的nef反应偶联,从而高选择性地将脱氢药草酮输送为所需的α-脱氢药草酮(α-dehydroherbac)13a,其是香料和香精工业中的重要中间体,可用于制备α-galbascone14a(方案3)。
在一个方面,本发明提供了一种制备环状烯丙基硝基化合物的方法,该方法包括在溶剂中在硝基-醛醇催化剂存在下环酮和硝基烷烃之间的硝基-醛醇反应。
方案3:脱氢药草酮13a,用于α-galbascone的工业合成
环状烯丙基硝基化合物是式(i)的化合物,
其中两个
环酮是式(ii)的化合物,
硝基-醛醇催化剂可以是式(iii)的胺催化剂:
硝基烷烃典型地是硝基乙烷或硝基甲烷。溶剂是乙酸c2-c3烷基酯(例如,乙酸乙酯和乙酸异丙酯)。
在另一个方面,本发明提供了一种制备α-脱氢药草酮(即,1-(5,5-二甲基环己-1-烯-1-基)乙酮)的方法,所述方法包括(a)根据上述硝基-醛醇反应获得5,5-二甲基-1-(1-硝基乙基)环己-1-烯,和(b)5,5-二甲基-1-(1-硝基乙基)环己-1-烯的nef反应以获得α-脱氢药草酮。
在又一个方面,本发明提供一种制备α-galbascone的方法,所述方法包括(c)通过上述硝基-醛醇反应和nef反应获得α-脱氢药草酮,和(d)将α-脱氢药草酮转化为α-galbascone。
鉴于详细描述和权利要求,可以更好地理解本发明的其他方面和优点。
发明详述
本发明基于令人惊讶的发现,即一种绿色且可持续的方法,其用于通过硝基-醛醇反应有效地制备环状烯丙基硝基化合物。
在一个方面,本发明提供了一种制备环状烯丙基硝基化合物的方法,该方法包括在溶剂中在硝基-醛醇催化剂存在下环酮和硝基烷烃之间的硝基-醛醇反应。
合适的硝基-醛醇催化剂包括离子碱诸如碱金属氧化物或氢氧化物(例如,mgo、cao、sro、bao、la2o3、zro2、zno、lioh、naoh、koh、ca(oh)2、mg(oh)2、ba(oh)2、sr(oh)2、γ-氧化铝、mgo-氧化铝和koh/氧化铝)、醇盐、碳酸盐(mgco3、baco3、caco3和srco3)、氟阴离子源(例如,kf/氧化铝、四正丁基氟化铵)、聚合物负载的胺以及胺催化剂诸如1,1,3,3-四甲基胍(tmg)、n,n-二异丙基乙胺(dipea)、1,8-二氮杂双环[5.4.0]十一碳-7-烯(dbu)、1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)和奎宁及衍生物。参见akutu等人,appliedcatalysisa:general2003,247(1),65-74;和palacios等人,archivefororganicchemistry2005(9),405-14。
在一些实施方案中,硝基-醛醇催化剂是胺催化剂。实例包括:
在一些实施方案中,硝基烷烃的量相对于环酮为至少1当量(例如,1至20当量,下限为1.5、2、2.5、3或5当量并且上限为15、12、10或8当量)。在其他实施方案中,硝基-醛醇(例如胺催化剂)的量相对于环酮也为高达1当量(例如,0.01至1当量,下限为0.02、0.05、0.1或0.2当量并且上限为1、0.8、0.6或0.5当量)。
在一些实施方案中,硝基-醛醇反应在回流下进行并且例如经由共沸蒸馏或分子筛吸水性来移除水。在优选实施方案中,将迪安-斯塔克(dean-stark)装置用于共沸蒸馏。
在一些实施方案中,例如在减压下(0.1至100毫巴,下限为0.2、0.5或1毫巴并且上限为80、50、30或20毫巴),通过蒸馏分离硝基-醛醇反应产物。
在优选实施方案中,在通过蒸馏分离硝基-醛醇产物之前进行酸洗。
在一些实施方案中,逐份添加硝基-醛醇催化剂(例如,胺催化剂),并且反应时间为36小时以下(例如,1-36小时,下限为1、2、4、6、8或10小时并且上限为36、30、28或24小时)。
在一些实施方案中,环酮是选自由以下组成的组中的任一种:
在优选实施方案中,环状烯丙基硝基化合物为5,5-二甲基-1-(1-硝基乙基)环己-1-烯,环酮为3,3-二甲基环己酮,并且硝基烷烃为硝基乙烷。
在另一个方面,本发明提供了一种制备α-脱氢药草酮的方法,所述方法包括(a)根据上述硝基-醛醇反应获得5,5-二甲基-1-(1-硝基乙基)环己-1-烯,和(b)5,5-二甲基-1-(1-硝基乙基)环己-1-烯的nef反应以获得α-脱氢药草酮。
在一些实施方案中,nef反应包括使用naoh形成氮酸盐,随后用硫酸、盐酸或两者处理。
在又一个方面,本发明提供一种制备α-galbascone的方法,所述方法包括(c)通过上述硝基-醛醇反应和nef反应获得α-脱氢药草酮,和(d)将α-脱氢药草酮转化为α-galbascone。
在一些实施方案中,本发明还提供了本文公开的优选实施方案中任一项的组合。
如本文中使用的,术语“烷基”意指直链或支链饱和脂族烃基,其含有1至10个碳原子、优选1至8个碳原子、有时更优选1至6个碳原子(“低级烷基”)并且有时更优选1至4个碳原子(“c1-c4烷基”),其通过单键与分子部分的其余部分连接。烷基的代表性实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基等。
如本文中使用的,术语“烯基”意指直链或支链不饱和脂族烃基,其含有2至10个碳原子、优选2至6个碳原子(“低级烯基”)并且有时更优选2至4个碳原子(“c2-c4烯基”),其通过单键与分子部分的其余部分连接。烯基的代表性实例包括但不限于乙烯基、丙烯基、烯丙基、丁烯基等。
如本文中使用的,术语“硝基烷烃”意指式r-no2的化合物,其中r表示如上定义的烷基。硝基烷烃的代表性实例包括但不限于硝基甲烷、硝基乙烷、硝基丙烷、硝基丁烷等。
除非上下文另有明确指明,否则单数形式“一个(a)”、“一种(an)”和“所述(the)”包括复数指代,并且反之亦然。
本文公开的值和尺寸不被理解为严格限于所记载的精确数值。而是,除非另外详细说明,每个这样的值都旨在意指所记载的值和在该值附近的功能等同范围两者。例如,作为“50%”公开的值旨在意指“约50%”。
以范围形式表示的值应该以灵活的方式解释为不仅包括作为范围界限明确记载的数值,而且还包括涵盖在该范围内的所有单个数值或子范围,就像每个数值和子范围都被明确记载一样。例如,在(cr5r6)n(其中n是0至20的整数)的情况下,“0至20”的数值范围应当解释为不仅包括明确记载的0至20的数值,而且还包括在所述范围内的单个数值(例如,1、2、3、5、10和15)和子范围(例如,0-3、1-3、1-5、5-10、10-15)。
在本文中,本申请公开了一种制备式(i)的环状烯丙基硝基化合物的改进方法:
在式(i)中,两个
环状烯丙基硝基化合物的制备方法包括环酮和硝基烷烃之间的硝基-醛醇反应,其中硝基烷烃如上所定义,并且环酮是式(ii)的化合物:
硝基-醛醇反应在硝基-醛醇催化剂存在下在溶剂中进行,以获得含有产物环状烯丙基硝基化合物的硝基-醛醇反应混合物。本发明的方法出乎意料地给出了朝向所需的环状烯丙基硝基化合物的α-异构体产物的高选择性和高收率。
不受任何理论束缚,所需的区域选择性可以通过考虑二胺加合物17的去质子化涉及的位阻效应而进行解释(方案4)。由于更小的空间相互作用,环上的成双的二甲基基团和n-二甲基官能度的存在导致优先α-碳处的去质子化,优先得到α-产物16a。
方案4
环酮的浓度与反应速率有关并且因此与反应时间有关。在浓度增加时,由于高沸点溶剂硝基乙烷(沸点114℃)与低沸点溶剂乙酸乙酯(“etoac”,沸点77℃)的比率增加,内部反应器温度也增加。优选地,反应温度保持为低于一定温度(例如,100℃以下、90℃以下和80℃以下)以避免胺催化剂的显著蒸发,其将被截留在迪安-斯塔克分离器(dean-starktrap)的水层中。进行净反应(即,不含溶剂)是任选的并且可以提供净反应,条件是成功地从反应混合物中移除水。示例性胺催化剂包括下表中示出的那些。
以环酮的摩尔计,硝基-醛醇催化剂(例如,胺催化剂)的典型量从5%到100%(在下文中为mol%),下限为5mol%、7mol%、10mol%或15mol%并且上限为100mol%、90mol%、80mol%、70mol%或60mol%。优选地,硝基-醛醇催化剂的量为15-60mol%。硝基烷烃的量相对于环酮优选地为2当量以上,例如2至100当量,下限为2、2.5或5当量并且上限为100、80、50、20或10当量。
在一些实施方案中,硝基-醛醇反应时间保持为1至48小时,下限为1、2、4、7、10或16小时并且上限为48、36、30或24小时(例如,2至36小时、10至30小时和16至24小时)。
环状烯丙基硝基化合物,即硝基-醛醇反应产物,可以通过常规分离方法诸如萃取、蒸馏和色谱法从硝基-醛醇反应混合物中纯化或分离。在一些实施方案中,环状烯丙基硝基化合物通过蒸馏分离。优选地,在蒸馏之前用酸水溶液洗涤硝基-醛醇反应混合物以移除副产物和/或胺催化剂。示例性酸水溶液为1mol/lhcl水溶液。在一些实施方案中,在酸洗步骤之前,将硝基烷烃或胺催化剂通过蒸馏从硝基-醛醇反应混合物中去除。硝基烷烃通常比水密度更高,并且在酸洗步骤期间,其存在导致不良相分离。在一些实施方案中,将硝基烷烃和/或胺催化剂回收和重复利用。
可以分份添加胺催化剂。在一些实施方案中,在硝基-醛醇反应之前将第一部分的胺催化剂(例如,相对于环酮1至15mol%)添加到含有环酮、硝基烷烃和溶剂的第一反应混合物中;在第一反应混合物达到预定反应温度(例如,50至110℃)后1至5小时,将第二部分的胺催化剂(例如,相对于环酮1至15%mol%)添加到第一反应混合物中以获得第二反应混合物;和任选地,在添加第二部分的胺催化剂后1至5小时,将第三部分的胺催化剂(例如,相对于环酮1至15mol%)添加到第二反应混合物中,获得第三反应混合物。
本发明的另一个方面涉及制备α-脱氢药草酮的方法。该方法包括以下步骤:(a)根据上述方法获得5,5-二甲基-1-(1-硝基乙基)环己-1-烯,和(b)5,5-二甲基-1-(1-硝基乙基)环己-1-烯的nef反应以获得α-脱氢药草酮。
自从在1894年发现nef反应(nef,liebigsann.chem.1894,280,263-291),已报道经典碱-酸处理的各种替代条件(ballini等人,adv.synth.catal.2015,357,2371-2402)。感兴趣的实例包括使用过一硫酸氢钾(oxone)(ceccherelli等人,synth.commun.1998,28,3057-3064),有机碱诸如dabco(umemiya等人,chem.eur.j.2014,20,15753-15759)和dbu(ballini等人,m.tetrahedronlett.2002,43,5233-5235)以及生物催化方法(francis等人,biol.chem.2005,280,5195-5204;durchschein等人,org.biomol.chem.2011,9,3364-3369)。
5,5-二甲基-1-(1-硝基乙基)环己-1-烯的nef反应优选地包括(b1)通过将5,5-二甲基-1-(1-硝基乙基)环己-1-烯与naoh接触而形成氮酸酯(nitronate)盐,(b2)将氮酸盐与酸诸如硫酸(h2so4)、盐酸(hcl)或两者接触。在一些实施方案中,相对于5,5-二甲基-1-(1-硝基乙基)环己-1-烯,以0.5至5当量(例如,0.75至2.5当量、1至1.5当量和1.1至1.4当量)的水平使用naoh。在其他实施方案中,在-5至15℃以1至10当量(例如,1至5当量和1.5至4当量)的水平添加酸。
总之,公开了通过硝基-醛醇反应制备环状烯丙基硝基化合物的改进方法,其中将常规溶剂苯替换为更绿色的溶剂,并且本文公开的反应条件出乎意料地得到了所需的选择性和高收率。
特别地,已开发用于合成α-脱氢药草酮的灵巧方法,其得到朝向所需双键异构体的高选择性。本发明的方法提供了经济有效且绿色的制备α-脱氢药草酮的方法。通过本发明的方法制备的环状烯丙基硝基化合物提供了一类合成上通用的结构单元,并且还可以转化为有用的α,β-不饱和酮。
通过以下非限制性实例更详细地描述本发明。在没有进一步阐释的情况下,据信基于本文中的描述,本领域技术人员可以利用本发明至其最充分程度。
实施例
一般方法
除非另有说明,否则所有溶剂均购自fisherscientific并且在不进一步纯化的情况下使用。底物及其前体和试剂购自alfaaesar或sigmaaldrich,并且按原样使用。
在brukeravance-400或varianvnmrs-700仪器上记录1h-nmr谱,并且相对于残留溶剂chcl3(δ7.26ppm)进行报告。在相同的仪器上记录13c-nmr谱并且相对于chcl3(δ77.16ppm)进行报告。如下报告1h-nmr数据:化学位移(δ/ppm)(峰裂数(multiplicity),耦合常数(hz),积分)。如下报告峰裂数:s=单峰,d=双峰,t=三重峰,q=四重峰,p=五重峰,m=多重峰,br.s=宽单峰,app.=明显。以化学位移(δc/ppm)报告13c-nmr的数据。dept-135、cosy、hsqc、hmbc和noesy实验用于结构鉴定。
使用perkinelmerspectrumtwouatrtwoft-ir光谱仪(净,atr采样)获得红外光谱,特征信号的强度报告为弱(w,<最高信号的20%),中等(m,最高信号的21-70%)或强(s,>最高信号的71%)。使用所示技术进行低分辨和高分辨质谱。气相色谱质谱(gc-ms)在配备由ei模式的rxi-5silms柱的shimadzuqp2010-ultra上进行。使用waterslctpremierxe进行大气固体分析探针质谱(asap-ms)。为了进行精确的质量测量,与计算式的偏差以ppm报告。
起始材料3,3-二甲基环己酮15
按照文献(us20120283476)经由双甲酮的选择性氢化进行制备。1hnmr(400mhz,cdcl3)δ2.31–2.25(m,2h),2.16(t,j=0.8hz,2h),1.94–1.85(m,2h),1.62–1.57(m,2h),0.99(s,6h);13cnmr(101mhz,cdcl3)δ212.3,55.0,40.9,38.0,36.1,28.6,22.5ppm;ft-irvmax503(w),1076(w),1225(m),1291(w),1368(w),1455(w),1708(s),2954(m,br);gc-msrt2.60min,m/z126[m]+,111[m-me]+。
用于胺催化的不规则硝基-醛醇反应的代表性程序
将3,3-二甲基环己酮(15,40g,0.305mol)、n,n-二乙基乙二胺(18,4.3ml,10mol%)、etoac(30ml)和硝基乙烷(214ml,10当量)在配备有迪安-斯塔克分离器(预填充有etoac)和回流冷凝器的圆底烧瓶中进行搅拌,并且加热至100℃。在总计22小时后,将反应冷却至室温(即,25℃),并且在减压下移除硝基乙烷和etoac。添加etoac(100ml),通过用1mhcl(2x100ml)洗涤来移除胺残余物。将剩余溶液在真空中蒸馏以得到产物环状烯丙基硝基化合物16a和16b,收率为78%,16a(α产物)和16b(β产物)之间的比率为5.4:1。
实施例1-13
除了下表1和2所示的试剂、其量、反应时间、收率和后处理步骤(移除溶剂和硝基乙烷,用hcl洗涤以外,遵循上述代表性程序。
5,5-二甲基-1-(1-硝基乙基)环己-1-烯16a
通过硝基乙烷与3,3-二甲基环己酮的反应获得,其为浅黄色液体,通过真空蒸馏(沸点105-110℃/10毫巴)分离。1hnmr(400mhz,cdcl3)δ5.90(m,1h,1),5.00(q,j=7.6hz,1h,8),2.14(m,2h,6),1.88–1.71(qq,j=18.9,2.0hz,2h,2),1.62(d,j=6.8hz,3h,9),1.39–1.33(m,2h,3),0.93(s,3h,5),0.91(s,3h,5)ppm;13cnmr(101mhz,cdcl3)δ132.0(7),128.4(1),88.3(8),37.8(2),34.4(3),28.8(4),28.3(5),27.4(5),23.2(6),16.9(9)ppm;ft-irvmax663(w),860(w),1364(w),1384(m),1449(w),1545(s),2918(w);gc-msrt3.71min,m/z137[m-no2]+;hrmsm/z实测值[m+h]+184.1344,c10h18no2要求184.1338(δ=3.3ppm)。
3,3-二甲基-1-(1-硝基乙基)环己-1-烯16b
通过硝基乙烷与3,3-二甲基环己酮的反应获得,其为浅黄色液体,通过真空蒸馏(沸点105-110℃/10毫巴)分离。1hnmr(600mhz,cdcl3)δ5.59(s,1h,6),4.92(q,j=7.0hz,1h,8),2.02–1.87(m,2h,1),1.67–1.62(m,2h,2),1.62(d,j=6.8hz,3h,9),1.45–1.35(m,2h,3),0.98(s,3h,5),0.97(s,3h,5)ppm;13cnmr(151mhz,cdcl3)δ139.5(6),130.8(7),88.3(8),36.5(3),32.0(4),29.6(5),29.2(5),24.3(1),19.4(2),17.0(9)ppm;ft-irvmax663(w),860(w),1364(w),1384(m),1449(w),1545(s),2918(w);gc-msrt3.61min,m/z137[m-no2]+;hrmsm/z实测值[m+h]+184.1344,c10h18no2要求184.1338(δ=3.3ppm)。
在实施例1中,使用3,3-二甲基环己酮(15)、n,n-二甲基乙二胺(12)、乙酸异丙酯(iproac)和硝基乙烷(etno2)遵循代表性程序。将反应混合物回流18小时。
在实施例2中,除了使用乙酸乙酯(etoac)代替iproac和进行反应22小时代替18小时以外,遵循与实施例1相同的程序。
除了使用苯代替iproac和进行反应24小时以外,按照与实施例1相同的程序进行比较反应,即比较1。
下表1中示出了化合物16a(α-产物)和16b(β-产物)的收率。乙酸异丙酯作为溶剂工作良好,得到64%转化,α-选择性为4.8:1。使用浓度1m的乙酸乙酯重现了该结果。
除了使用不同的硝基-醛醇催化剂(胺碱)以外,实施例3-5中的每一个按照与实施例2相同的程序进行。参见下表2。
表1:乙酸异丙酯和乙酸乙酯中的硝基-醛醇反应
除非另有指明,以0.2m按5mmol规模进行反应。
a使用正十五烷作为内标通过gc-ms估算收率。
b观察到的通过蒸发的溶剂损失。c以1m进行反应。
表2:使用不同催化剂的硝基-醛醇反应
以1m按50mmol规模进行反应。
a使用正十五烷作为内标通过gc-ms估算收率。
如上表2所示,二乙基乙二胺(18)、1-(2-氨基乙基)吡咯烷(19)和1-(2-氨基乙基)哌啶(20)各自有效地催化硝基-醛醇反应,分别得到80%、81%和70%的收率,并且分别得到5.3、8.2和4.8的选择性(即,16a:16b的比率)。
在实施例6-10中,相对于环酮15,以5mol%至100mol%使用硝基-醛醇催化剂二乙基乙二胺18。参见下表3。在实施例11-13中,相对于环酮15,分别以2.5、5和10当量的水平使用硝基乙烷。参见下表4。对于在实施例6-13中使用的水平的硝基-醛醇催化剂和硝基乙烷二者,获得了可接受的收率和选择性。
表3:碱化学计量的变化
以1m按50mmol规模进行反应。
a使用正十五烷作为内标通过gc-ms估算收率。
表4:硝基乙烷化学计量的变化
以1.0m按50mmol规模进行反应。
a使用正十五烷作为内标通过gc-ms估算收率。
实施例14-16
在实施例14-16中使用多种后处理条件纯化产物16a和16b。
在实施例14中,按照上述代表性程序,以0.5摩尔规模进行反应。将所得反应混合物用1m水溶液洗涤并且用etoac萃取到油相中,然后将其蒸馏以得到产物,收率为73%并且16a和16b之间的比率为5.7:1。
在实施例15中,进行实施例14中描述的相同反应。在真空下蒸馏所得反应混合物以得到产物,收率为76%并且16a和16b之间的收率为5.2:1。然而,纯化产物不与实施例14中的产物一样纯。在最终纯化产物中存在杂质和副产物。
在实施例16中,分三份添加硝基乙烷。更具体地,将3,3-二甲基环己酮(15,40g,0.305mol)、n,n-二乙基乙二胺(18,4.3ml,10mol%)、etoac(30ml)和硝基乙烷(214ml,10当量)在配备有迪安-斯塔克分离器(预填充有etoac)和回流冷凝器的圆底烧瓶中进行搅拌,并且加热至100℃。3小时后添加第二部分的n,n-二乙基乙二胺(4.3ml,10mol%),并且在另外3小时后添加第三部分(4.3ml,10mol%)。在总计22小时后,将反应冷却至室温(即,25℃),并且在减压下移除硝基乙烷和etoac。添加etoac(100ml),通过用1mhcl(2x100ml)洗涤来移除n,n-二乙基乙二胺残余物。将剩余溶液在真空中浓缩以得到产物,收率为78%并且16a和16b之间的收率为5.4:1。
实施例17.1-(1-硝基乙基)环庚-1-烯34
通过硝基乙烷与环庚酮的反应获得,其为黄色液体(50.0mmol规模,5.17g,61%),通过sio2柱层析分离(己烷:etoac,95:5),rf(8:2,己烷:etoac)0.7。1hnmr(400mhz,cdcl3)δ6.05(t,j=6.5hz,1h),4.99(q,j=6.9hz,1h),2.25–2.18(m,4h),1.81–1.74(m,2h),1.62(d,j=6.8hz,3h),1.59–1.44(m,4h)ppm;13cnmr(101mhz,cdcl3)δ139.4,134.8,89.5,32.3,28.4,28.3,26.6,26.2,17.3ppm;ft-irvmax861(m),1354(m),1384(m),1447(m),1544(s),2850(w),2921(m);gc-msrt3.63min,m/z123[m-no2]+。
实施例18.1-(1-硝基乙基)环辛-1-烯35
通过硝基乙烷与环辛酮的反应获得,其为浅黄色液体(50.0mmol规模,3.60g,39%),通过sio2柱层析分离(己烷:etoac,95:5),rf(9:1,己烷:etoac)0.5。1hnmr(400mhz,cdcl3)δ5.90(t,j=8.2hz,1h),5.05(q,j=6.8hz,1h),2.33–2.26(m,2h),2.24–2.16(m,2h),1.65(d,j=6.8hz,3h),1.60–1.42(m,8h)ppm;13cnmr(101mhz,cdcl3)δ135.6,132.7,88.5,29.4,29.0,26.3,26.3,26.2,26.1,17.6ppm;ft-irvmax758(w),860(w),1359(w),1383(w),1449(w),1469(w),1545(s),2852(w),2926(m);gc-msrt4.05min,m/z137[m-no2]+。
实施例19.3,5,5-三甲基-1-(1-硝基乙基)环己-1-烯/3,3,5-三甲基-1-(1-硝基乙基)环己-1-烯36a+36b
通过硝基乙烷与环辛酮的反应获得,其为浅黄色液体(50mmol规模,2.51g,25%),通过sio2柱层析分离(己烷:etoac,95:5),rf(9:1,己烷:etoac)0.4。获得内型双键异构体连同两个相应外型异构体的混合物。未解析混合物的nmr谱;ft-irvmax1362(m),1384(m),1456(m),1520(s),1548(s),2907(m),2952(m);gc-msrt3.74+3.69min,m/z151[m-no2]+;hrmsm/z实测值[m+h]+198.1483,c11h20no2要求198.1494(δ=5.6ppm)。
实施例20.5,5-二甲基-1-(硝基甲基)环己-1-烯37a
通过硝基甲烷与3,3-二甲基环己酮的反应获得,其为浅黄色液体(55mmol规模,8.8g,94%),通过sio2柱层析分离(己烷:etoac,98:2),其为双键异构体的混合物(3:1,37a:37b),rf(9:1,己烷:etoac)0.7。1hnmr(700mhz,cdcl3)δ5.91–5.88(m,1h,3),4.79(s,2h,1),2.16–2.12(m,2h,4),1.84(s,2h,8),1.34(t,j=6.4hz,2h,5),0.92(s,6h,7)ppm;13cnmr(176mhz,cdcl3)δ132.0(3),127.4(2),82.7(1),40.3(8),34.2(5),29.0(6),27.9(7),23.3(4)ppm;ft-irvmax665(w),1367(m),1428(w),1550(s),2920(w,br);gc-msrt3.42min,m/z123[m-no2]+;hrmsm/z实测值[m+h]+170.1186,c9h16no2要求170.1181(δ=2.9ppm)。
3,3-二甲基-1-(硝基甲基)环己-1-烯37b
通过硝基甲烷与3,3-二甲基环己酮的反应获得,其为浅黄色液体(55.0mmol规模,8.80g,94%),通过sio2柱层析分离(己烷:etoac,98:2),其为双键异构体的混合物(3:1,37a:37b),rf(9:1,己烷:etoac)0.7。1hnmr(700mhz,cdcl3)δ5.64–5.61(m,1h,8),4.77(s,2h,1),2.01(t,j=6.3hz,2h,3),1.70–1.65(m,2h,4),1.43–1.40(m,2h,5),1.00(s,6h,7)ppm;13cnmr(176mhz,cdcl3)δ143.0(8),126.2(2),82.8(1),36.2(5),32.3(6),29.3(7),26.6(3),19.3(4)ppm;ft-irvmax665(w),1367(m),1428(w),1550(s),2920(w,br);gc-msrt3.37min,m/z123[m-no2]+;hrmsm/z实测值[m+h]+170.1186,c9h16no2要求170.1181(δ=2.9ppm)。
实施例21.1-(硝基甲基)环庚-1-烯38
通过硝基甲烷与环庚酮的反应获得,其为黄色液体(50mmol规模,5.83g,75%),通过sio2柱层析分离(己烷:etoac,95:5),rf(8:2,己烷:etoac)0.6。1hnmr(400mhz,cdcl3)δ6.07(t,j=6.4hz,1h),4.84(d,j=0.8hz,2h),2.34–2.16(m,4h),1.84–1.73(m,2h),1.65–1.50(m,4h)ppm;13cnmr(101mhz,cdcl3)δ138.4,134.4,84.4,31.9,31.3,28.6,26.3,26.2ppm;ft-irvmax643(m),848(w),1306(w),1370(m),1447(w),1547(s),2851(w),2923(m);gc-msrt3.50min,m/z109[m-no2]+。
实施例22.6-甲基-1-(硝基甲基)-3-(丙-1-烯-2-基)环己-1-烯39a
通过硝基甲烷与二氢香芹酮(dihydrocarvone)的反应获得,其为浅黄色液体(50mmol规模,8.65g,89%),通过sio2柱层析纯化(己烷:etoac,95:5),其为非对映异构体39a连同双键异构体39b的混合物(39a:39b=3.3:1),rf(8:2,己烷:etoac)0.6。1hnmr(700mhz,cdcl3)δ5.80(s,1h,11),5.04–4.98(m,1h,1),4.80(m,1h,9),4.79–4.74(m,1h,1),4.69(m,1h,9),2.85–2.77(m,1h,7),2.33–2.27(m,1h,3),1.89–1.67(m,2x1h,5+6),1.74–1.71(m,3h,10),1.59–1.42(m,1+0.5h,6+0.5(5)),1.32(m,0.5h,5),1.06(dd,j=7.1,3.7hz,3h,4)ppm;13cnmr(176mhz,cdcl3)δ(147.6+147.5,8),(136.8+136.3,11),(133.6+133.4,2),(111.5+111.2,9),(80.6+80.4,1),(43.7+43.3,7),(30.5+30.0,3),(29.5+28.8,5),(25.0+23.5,6),(21.1+21.0,10),(19.0+18.9,4)ppm。ft-irvmax892(m),1372(m),1428(w),1549(s),1644(w),2936(w);gc-msrt3.94+3.96min,m/z149[m-no2]+;hrmsm/z实测值[m+h]+196.1326,c11h18no2要求196.1338(δ=6.1ppm)。
1-甲基-2-(硝基甲基)-4-(丙-1-烯-2-基)环己-1-烯39b
通过硝基甲烷与二氢香芹酮的反应获得,其为浅黄色液体(50mmol规模,8.65g,89%),通过sio2柱层析纯化(己烷:etoac,95:5),其为非对映异构体39a连同双键异构体39b的混合物(39a:39b=3.3:1),rf(8:2,己烷:etoac)0.6。1hnmr(700mhz,cdcl3)δ4.98–4.89(dd,j=41.8,6.0hz,2h,1),4.73(m,1h,9),4.70-4.69(m,1h,9),2.22–2.02(m,5h,5,7,11),1.81(m,1h,6),1.78(s,3h,4),1.73(s,3h,10),1.46–1.42(m,1h,6)ppm;13cnmr(176mhz,cdcl3)δ148.8,138.5,120.4,109.1,78.0,41.1,34.0,32.5,27.3,20.7,19.2ppm;ft-irvmax892(m),1372(m),1428(w),1549(s),1644(w),2936(w);gc-msrt4.09min,m/z149[m-no2]+;hrmsm/z实测值[m+h]+196.1326,c11h18no2要求196.1338(δ=6.1ppm)。
硝基烯烃的nef反应的一般程序
将环状烯丙基硝基化合物16(15g,82mmol)溶于乙醇(140ml)中并且添加naoh(4.1g,1.25当量)。将所得混合物在25℃搅拌30分钟,在这之后氮酸盐已析出。将悬浮液冷却至0℃并且添加h2so4(8.75ml,2当量)在h2o(41ml)中的溶液。在0℃搅拌1小时后,将反应温热至25℃并且搅拌2小时。然后在减压下移除乙醇,并且用naoh水溶液中和残余物。将酮产物用二氯甲烷(3x60ml)萃取,并且将合并的有机层在减压下浓缩。根据实施例23-26中的所述方法获得纯产物。
实施例23.1-(5,5-二甲基环己-1-烯-1-基)乙酮13a
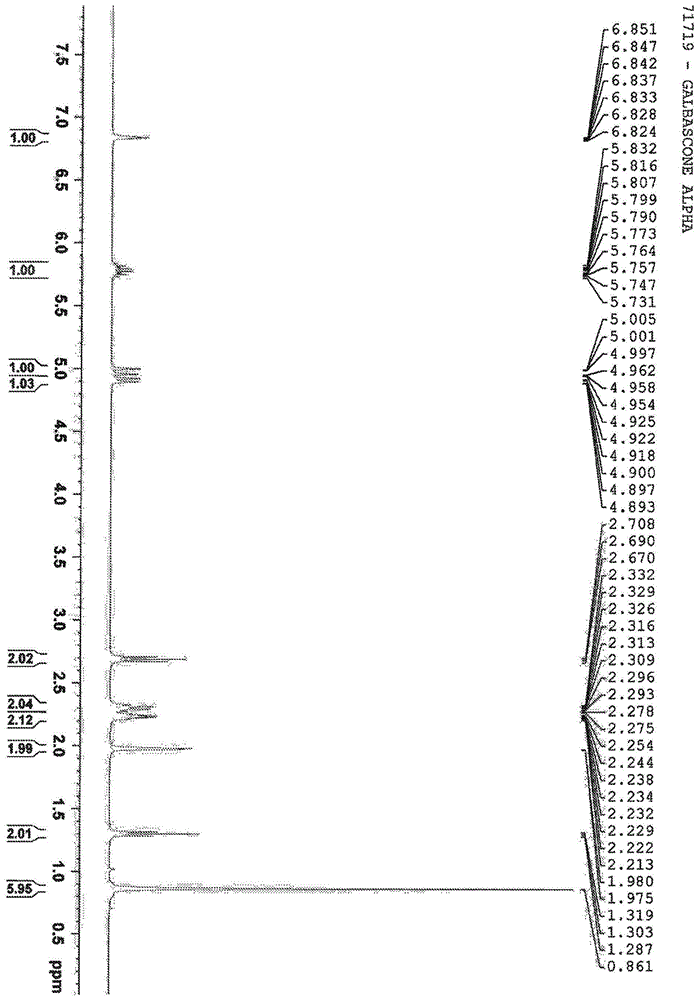
由16获得(82mmol规模,8.11g,65%,13a:13b=5.4:1),通过真空蒸馏分离(沸点85-95℃/9毫巴)。1hnmr(700mhz,cdcl3)δ6.87(m,1h,1),2.28(m(模糊),2h,7),2.28(s,3h,9),2.01(q,j=2.2hz,2h,3),1.34(t,j=6.4hz,2h,6),0.90(s,6h,5)ppm;13cnmr(176mhz,cdcl3)δ199.5(8),139.7(1),138.7(2),36.4(3),34.2(6),28.5(4),28.0(5),25.3(9),24.1(7)ppm;gc-msrt3.32min,m/z152[m]+,109[m-ac]+;hrmsm/z实测值[m+h]+153.1281,c10h17o要求153.1279(δ=1.3ppm)。
1-(3,3-二甲基环己-1-烯-1-基)乙酮13b
由16获得(82.0mmol规模,8.11g,65%,13a:13b=5.4:1),通过真空蒸馏分离(沸点85-95℃/9毫巴)。1hnmr(700mhz,cdcl3)δ6.53(t,j=1.7hz,1h,3),2.27(s,3h,9),2.15(td,j=6.3,1.7hz,2h,1),1.61(m,2h,7),1.43(m,2h,6),1.06(s,6h,5)ppm;13cnmr(176mhz,cdcl3)δ199.9(8),149.7(3),137.3(2),36.3(6),32.7(4),29.1(5),25.2(9),23.1(1),19.1(7)ppm;gc-msrt3.24min,m/z152[m]+,109[m-ac]+;hrmsm/z实测值[m+h]+153.1281,c10h17o要求153.1279(δ=1.3ppm)。
实施例24.1-(环庚-1-烯-1-基)乙酮40
由34获得,其为无色液体(10.0mmol规模,584mg,42%),通过sio2柱层析分离(己烷:etoac,95:5),rf(8:2,己烷:etoac)0.4。1hnmr(400mhz,cdcl3)δ7.07(t,j=6.7hz,1h),2.50–2.45(m,2h),2.37–2.30(m,2h),2.28(s,3h),1.80–1.73(m,2h),1.58–1.51(m,2h),1.47–1.40(m,2h)ppm;13cnmr(101mhz,cdcl3)δ199.1,146.5,145.5,32.2,29.1,26.1,25.8,25.3,25.2ppm;ft-irvmax857(m),985(m),1198(m),1252(m),1280(m),1350(m),1449(m),1662(s),2850(m),2919(m);gc-msrt3.18min,m/z138[m]+,95[m-ac]+。
实施例25.1-(环辛-1-烯-1-基)乙酮41
由35获得,其为无色液体(5.8mmol规模,417mg,47%),通过sio2柱层析分离(己烷:etoac,95:5),rf(8:2,己烷:etoac)0.4。1hnmr(400mhz,cdcl3)δ6.89(t,j=8.3hz,1h),2.49–2.44(m,2h),2.39–2.33(m,2h),2.33(s,3h),1.69–1.62(m,2h),1.59–1.41(m,6h)ppm;13cnmr(101mhz,cdcl3)δ199.1,143.5,143.1,29.2,29.1,27.5,26.5,26.1,25.4,23.4ppm;ft-irvmax755(m),1199(m),1284(m),1350(w),1383(w),1653(m),1662(s),2852(m),2922(m);gc-msrt3.58min,m/z152[m]+。
实施例25.1-(3,5,5-三甲基环己-1-烯-1-基)乙酮42a
由36获得,其为无色液体(9.29mmol规模,695mg,54%,42a:42b=1.9:1),通过sio2柱层析分离(己烷:etoac,95:5),rf(8:2,己烷:etoac)0.6。1hnmr(600mhz,cdcl3)δ6.66(m,1h,4),2.44–2.38(m,1h,5),2.29(s,3h,1),2.19–2.13(m,1h,10),1.84–1.78(m,1h,10),1.50–1.45(m,1h,7),1.09(d,j=7.2hz,3h,6),1.00(s,3h,9),0.97–0.92(m,1h,7),0.80(s,3h,9)ppm;13cnmr(151mhz,cdcl3)δ199.8(2),144.9(4),137.8(3),43.9(7),36.5(10),31.7(9),29.5(8),29.5(5),25.4(1),25.1(9),20.7(6)ppm;ft-irvmax(混合物)755(m),1248(m),1364(w),1456(w),1635(m),1665(s),2870(w),2954(m);gc-msrt3.34min,m/z166[m]+;hrmsm/z实测值[m+h]+167.1425,c11h19o要求167.1436(δ=6.6ppm)。
1-(3,3,5-三甲基环己-1-烯-1-基)乙酮42b
由36获得,其为无色液体(9.29mmol规模,695mg,54%,42a:42b=1.9:1),通过sio2柱层析分离(己烷:etoac,95:5),rf(8:2,己烷:etoac)0.6。1hnmr(600mhz,cdcl3)δ6.52(m,1h,10),2.50–2.44(m,1h,4),2.27(s,3h,1),1.71–1.63(m,1h,5),1.56–1.51(m,1h,4),1.51–1.48(m,1h,7),1.07(s,3h,9),1.05(s,3h,9),1.02(m,1h,7),0.99(d,j=6.6hz,3h,6)ppm;13cnmr(151mhz,cdcl3)δ199.8(2),149.5(10),137.0(3),45.3(7),34.1(8),31.8(4),30.4(9),28.4(9),25.6(5),25.3(1),22.0(6)ppm;ft-irvmax(混合物)755(m),1248(m),1364(w),1456(w),1635(m),1665(s),2870(w),2954(m);gc-msrt3.13min,m/z166[m]+;hrmsm/z实测值[m+h]+167.1425,c11h19o要求167.1436(δ=6.6ppm)。
实施例26
按照以下程序将环状烯丙基酮13a和13b转化为galbascone。
步骤1:二甲基乙缩醛中间体的合成
向配备有搅拌器、温度计、加热器和回流冷凝器的5l反应容器中添加545g甲醇、1,330g原甲酸三甲基酯和6g30%hcl水溶液。将所得反应混合物冷却至0℃,然后在保持温度低于5℃的同时在8小时时间段内添加1,900g的α和β-脱氢药草酮(分别为13a和13b)的混合物。添加结束后,将反应搅拌另外1小时,并且用12g甲醇钠(甲醇中的30%溶液)猝灭,然后在减压下(100mmhg)将其加热至80℃,以通过蒸馏移除甲醇和形成的甲酸甲酯。所得浓缩粗制物(2,435g)含有二甲基乙缩醛中间体混合物,其在不进行进一步纯化的情况下用于后续步骤。
步骤2:由二甲基乙缩醛中间体合成galbascone
在配备有搅拌器、温度计、加热器和回流冷凝器的5l反应容器中添加2,435g的来自步骤1的二甲基乙缩醛中间体、30g冰醋酸、17g乙酸钠和1.485g烯丙醇。将反应混合物在搅拌下缓慢加热至185℃,同时蒸馏甲醇和烯丙醇的混合物,并且在此温度下保持3小时,直到二甲基乙缩醛中间体完全转化。随后,将反应冷却至室温,并且转移至蒸馏器用以纯化。由此获得的粗制物的分馏得到1,710g(71%总收率)的α-和β-galbascone的混合物。
本文引用的所有参考文献通过引用整体结合于此。某些优选实施方案的前述实施例和描述应当认为是举例说明而不是限制本发明。如本领域技术人员将容易理解的,在不脱离本发明的情况下,可以利用上述特征的多种变化和组合,这些均被本发明所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!