在深玫色篮状菌中生产嗜氮酮的方法与流程
本发明提供了一类新型的天然嗜氮酮(azaphilone)色素,称为深玫素(atrorosin),及其生产方法。用于生产深玫素的方法包括使用属于篮状菌(talaromyces)属的真菌物种,优选深玫色篮状菌(talaromycesatroroseus)物种,通过发酵生产。新型深玫素色素以及包括该新型深玫素色素的试剂盒,作为着色剂用于食品和/或非食品以及用于化妆品的用途。
背景技术:
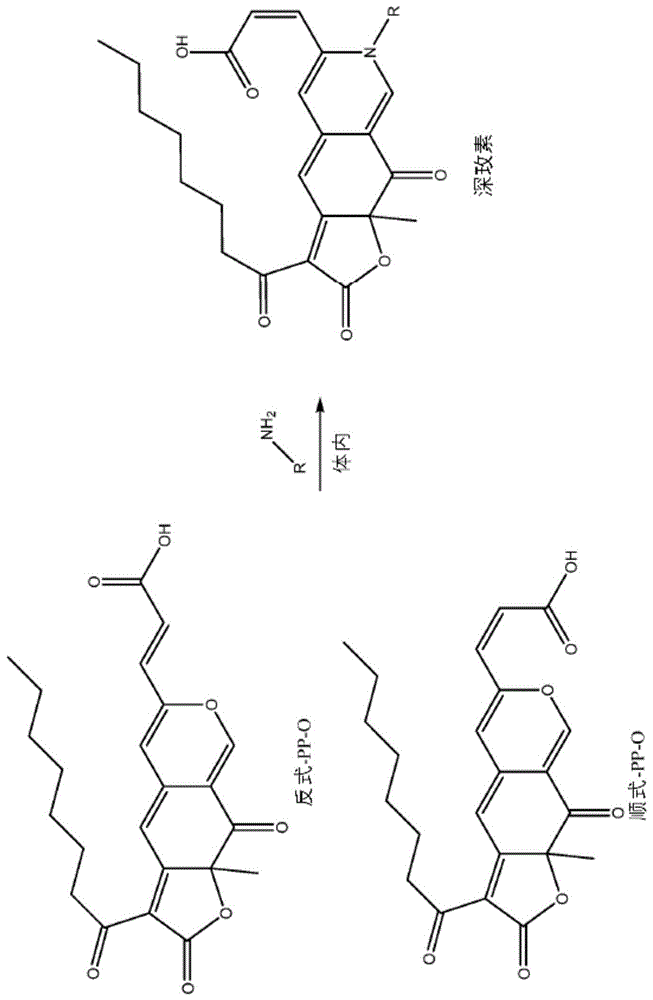
:由于消费者对合成着色剂1,2的潜在有害影响的认识不断提高,天然食品着色剂越来越受到追捧。鉴于人们日益认识到饮食与健康之间的联系,食品添加剂工业在提供天然色素替代品方面面临新挑战。迄今为止,大多数工业上使用的天然着色剂都是直接提取自天然来源,例如,花青素(甜菜根betavulgaris提取物)、番茄红素(番茄solanumlycopersicum提取物)或胭脂红酸(提取自雌性昆虫胭脂虫(dactylopiuscoccus)3)。它们的生产高度依赖于原料的供应,而原料的数量和质量均会受季节变化影响4。这些限制可以通过探索天然色素的新来源(诸如微生物)来克服5。已知真菌可天然地生物合成和分泌各种次级代谢产物,包括颜色范围广泛的色素6。红曲霉(monascus)是一种生产色素的真菌属,其长期以来一直用于亚洲国家传统食品的制造7。源自红曲霉的色素被称为“红曲霉色素”,其是包括黄色、橙色和红色组成的嗜氮酮混合物。使用红曲霉物种来生产红曲霉色素会产生具有一系列色调的不同红曲霉色素的混合物8,其组成难以控制并且批次与批次之间可能不同。另外,已知红曲霉物种会产生霉菌毒素,诸如桔霉素9,其导致多种毒性作用,包括肾毒性、肝毒性和细胞毒性作用,并且这排除了它们在西方国家用于工业目的的用途。从工业角度来看,非常优选通过发酵分别生产这些成分色素,其中所产生的单一种类的色素不含霉菌毒素,使得可以容易地提取和回收色素,而无需多个且可能复杂的纯化步骤。天然色素的重要用途之一是作为食品添加剂;其中非常需要水溶性色素。技术实现要素:根据第一实施方式,本发明提供了通过发酵来生产深玫素色素(优选单一种类的深玫素色素)的方法,其包括以下步骤:a)提供篮状菌属物种的孢子或菌丝体,b)在液体生长培养基中培养(a)的孢子或菌丝体,c)回收在所述培养步骤b)中产生的深玫素色素,以及d)任选地分离所述深玫素色素,其中,步骤(b)中生长培养基的ph保持在4至6之间;其中,步骤(b)中所述液体生长培养基中的唯一氮源是选自由氨基酸、肽、氨基糖和伯胺组成的组的单一化合物;并且其中,深玫素色素具有式i的结构:其中,n-r选自由氨基酸、肽、氨基糖和伯胺组成的组,并且碳2和3之间的双键的构型是顺式。根据第一实施方式的方法还可以包括以下附加步骤:a')在初始液体生长培养基中培养(a)的孢子或菌丝体,其中唯一氮源是无机氮源,且no3﹣的浓度不超过20mm,持续培养直至no3﹣的浓度消耗至小于5mm;以及其中,所述步骤(a')之后是步骤(b)。根据第二实施方式,本发明提供了具有式i的结构的深玫素色素:其中,n-r选自氨基酸、肽、氨基糖和伯胺,并且碳2和3之间的双键的构型是顺式,其中,所述氨基酸选自由以下组成的组中的一种:l-丙氨酸、l-精氨酸、l-天冬酰胺、l-天冬氨酸、l-半胱氨酸、l-谷氨酸、l-甘氨酸、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-蛋氨酸、l-苯丙氨酸、l-丝氨酸、l-苏氨酸、l-酪氨酸、l-缬氨酸和l-鸟氨酸。根据第三实施方式,本发明提供了通过本发明的方法生产的具有如上定义的式i的结构的深玫素色素。根据第四实施方式,本发明提供了具有如上定义的式i的结构的深玫素色素作为着色剂用于食物、非食物产品和化妆品中的任一种的用途。根据第五实施方式,本发明提供了包括深玫素色素的产品,该深玫素色素具有如上定义的式i的结构,其中,该产品选自食物、非食物产品和化妆品。根据第六实施方式,本发明提供了用于对产品进行着色的试剂盒,其中,该试剂盒包括具有如上定义的式i的结构的至少一种深玫素色素,其中,该色素被提供在容器中,并且其中,该产品选自食物、非食物产品和化妆品。本发明的描述附图说明图1.深玫素色素的化学结构,其中r选自氨基酸、肽、氨基糖和伯胺,并且碳2和3之间的双键的构型是顺式。在体内,它通过含异色烯的嗜氮酮前体(顺式-pp-o和反式-pp-o)与含氮分子的衍生化而合成。图2.纯化的深玫素色素的吸收光谱及其对应的标准曲线的图形表示:纯pp-o的吸收光谱和在450nm处具有方程:y=54.869x的对应的标准曲线。纯深玫素(示例性深玫素-s)的吸收光谱和在500nm处具有方程:y=95.244x的对应的标准曲线。图3.通过深玫色篮状菌的一步发酵96hr后产生的生物质积累(条形图)和色素以g/l计(■)的图形表示,当在限定的发酵培养基中在摇瓶中培养时(参见实施例1.2),当补充有指定的单一氨基酸(0.1m)或kno3(0.1m)作为唯一氮源时。96hr后取样。数据集基于一式三份进行的摇瓶发酵。图4.该图示出了从源自深玫色篮状菌的一步发酵(如实施例1.2中定义)的发酵液中提取的化合物的uv色谱图(在520±20nm处测量),其中,生长培养基(100ml)供应有以硝酸钾(kno3)、天冬氨酸、谷氨酸、组氨酸或丝氨酸形式的单一氮源作为唯一氮源,浓度为0.1m。用naoh和hcl水溶液将培养基的ph调节至5。在无挡板摇瓶中于30℃和150rpm在旋转振荡温育器中进行培养。96hr后取样。摇瓶实验一式三份进行。图5.在提供有丝氨酸或硝酸钾(kno3)和丝氨酸作为唯一氮源的深玫色篮状菌的一步或两步发酵期间,随时间检测的生物质积累(dw)和色素(pp-o和深玫素-s)、co2和蔗糖的水平的图形表示。a)用10g/lkno3一步发酵的时间进程;b)以10g/l丝氨酸一步发酵的时间进程;c)两步发酵的时间进程;d)用10g/lkno3一步发酵的发酵培养基上清液的颜色分布;e)用10g/l丝氨酸一步发酵的发酵培养基上清液的颜色分布;f)两步发酵的发酵培养基上清液的颜色分布;g)在用10g/lkno3一步培养中发酵培养基上清液的uv色谱图(520±10nm),显示出色素的混合物;h)在用10g/l丝氨酸一步培养中发酵培养基上清液的uv色谱图(520±10nm),显示出深玫素-s;以及i)来自两步培养中发酵培养基上清液的uv色谱图(520±10nm),显示出首先形成顺式-和反式-pp-o两者,并然后在加入丝氨酸之后,基本上为纯的顺式-深玫素-s。图6.该图示出了认证标准的桔霉素的离子色谱图(m/z=251.0290)相比于源自当供应有丝氨酸作为唯一氨基氮源时的深玫色篮状菌的一步相比两步发酵的发酵液样品的色谱图,相比于硝酸钾(kno3)作为唯一氮源时的色谱图。图7.该图示出了顺式-深玫素-s的化学结构。图8.该图示出了a)深玫素-s和红曲红胺-s(monascorubramine-s)以及b)深玫素-e和红曲红胺-e的logd值。图9.使用硝酸盐测试条进行的比色硝酸盐测量。左上:取自2-步培养的样品。左下:在稀释40x以适合5-100mg范围后,用于每个样品的硝酸盐测试条。取样时间点记录在硝酸盐测试条上。图10.在不同ph下氮源为kno3的生物反应器中培养的深玫色篮状菌。a)生长速率(μmax(h-1))随ph的变化;b)生物质(ysx■)和总色素(ysp□)产量随ph的变化。缩写和术语:pp-o:是具有化学式c23h24o7的色素,并且可以是顺式或反式形式。深玫素(atrorosin):是具有化学式c23h24o6nr的色素,其中,nr是包含伯胺的化合物,诸如氨基酸,并且碳2和3之间的双键的构型是顺式。基本上不含可用无机氮的生长培养基:是一种生长培养基,其由于缺乏可用的氮,会限制指数增长并导致微生物(真菌)生长进入延滞期或细胞死亡期。当生长培养基含有少于0.5g/l的氮源时(例如,<0.5g/lkno3或nano3,诸如<5mmno3﹣),氮源将被耗尽并且没有可用的氮剩余。具体实施方式本发明提供了使用属于篮状菌属的真菌物种,优选深玫色篮状菌物种,通过发酵来生产单一种类的嗜氮酮色素的方法。篮状菌物种最初被选择为潜在地适合用作生产生物,因为与红曲霉物种一样,发现它们在固体培养基上培养时会分泌亮红色。根据第一实施方式,本发明提供了使用一步发酵程序来生产单一种类的嗜氮酮色素的方法,该方法包括:a)提供篮状菌属物种的孢子或菌丝体,b)在液体生长培养基中培养所述孢子或菌丝体,c)回收在步骤b)中的培养期间产生的嗜氮酮色素,以及任选地分离一种或多种所述嗜氮酮色素,其中,步骤(b)中所述液体生长培养基中的唯一氮源是选自由氨基酸、肽、氨基糖和任何其他伯胺组成的组的单一化合物;并且其中深玫素色素具有式i的结构:其中,n-r选自由氨基酸、肽、氨基糖和伯胺组成的组,并且碳2和3之间的双键的构型是顺式。合适的唯一氮源包括氨基糖,诸如氨基葡萄糖或氨基半乳糖;并且包括伯胺,诸如邻氨基苯甲酸、苯胺或对苯二胺。优选地,唯一氮源是选自由以下组成的组中的一种的单一氨基酸:l-丙氨酸、l-精氨酸、l-天冬酰胺、l-天冬氨酸、l-半胱氨酸、l-谷氨酰胺、l-谷氨酸、l-甘氨酸、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-蛋氨酸、l-苯丙氨酸、l-丝氨酸、l-苏氨酸、l-酪氨酸、l-缬氨酸和l-鸟氨酸。包括氮源的液体生长培养基是包括盐、痕量金属和碳源的合成培养基。合适的碳源包括葡萄糖、蔗糖、麦芽糖、可溶性淀粉、甜菜或甘蔗糖蜜、麦芽以及其至少两种的任何组合。生长培养基优选包括或由以下盐和痕量金属组成:kh2po4(例如1g/l)、nacl(例如1g/l)、mgso4.7h2o(例如2g/l)、kcl(例如0.5g/l)、cacl2.h2o(例如0.1g/l)和痕量金属溶液(例如2ml/l)。痕量金属溶液可以包括或由以下组成:cuso4.5h2o(例如0.4g/l)、na2b4o7.10h2o(例如0.04g/l)、feso4.7h2o(例如0.8g/l)、mnso4.h2o(例如0.8g/l)、na2moo4.2h2o(例如0.8g/l)、znso4.7h2o(例如8g/l)。在生长培养基中提供唯一氮源的化合物的浓度可以为0.05m至1m,例如至少0.05、0.075、0.10、0.125、0.15、0.175、0.2、0.3、0.4、0.5、0.6、0.7和0.8m。在步骤(b)期间提供并维持的生长培养基的ph优选为4至6之间;更优选为4.5至5.5之间;其中,ph可以通过添加naoh或hcl的水溶液进行调节。步骤(b)中的培养可以通过将篮状菌属物种的孢子或菌丝体悬浮在液体生长培养基中来进行;或者更优选地,通过将篮状菌属物种的孢子或菌丝体浸没在液体生长培养基中来进行。步骤(a)中的孢子可以包括篮状菌属物种的孢子的水性悬浮液。优选地,篮状菌属物种是深玫色篮状菌物种(例如,菌株深玫色篮状菌ibt11181)。根据第二实施方式,本发明提供了使用修改的一步发酵程序——称为两步发酵程序——来生产单一种类的嗜氮酮色素的方法。根据该修改,在步骤(a)之后执行附加步骤(a')。在步骤(a')中,将步骤(a)中提供的孢子或菌丝体在初始液体生长培养基中培养,其中,唯一氮源是无机氮源,并且no3﹣的浓度不超过20mm。无机氮源可以选自由kno3和nano3组成的组。包括无机氮作为唯一氮源的初始液体生长培养基是包括盐、痕量金属和碳源的合成培养基。该合成培养基关于盐和痕量金属的组成为:kh2po4(例如1g/l)、nacl(例如1g/l)、mgso4.7h2o(例如2g/l)、kcl(例如0.5g/l)、cacl2.h2o(例如0.1g/l)和痕量金属溶液(例如2ml/l)。痕量金属溶液可以包括或由以下组成:cuso4.5h2o(例如0.4g/l)、na2b4o7.10h2o(例如0.04g/l)、feso4.7h2o(例如0.8g/l)、mnso4.h2o(例如0.8g/l)、na2moo4.2h2o(例如0.8g/l)、znso4.7h2o(例如8g/l)。合适的碳源包括葡萄糖、蔗糖、麦芽糖、可溶性淀粉、甜菜或甘蔗糖蜜、麦芽以及其至少两种的任何组合。根据两步发酵方法,培养步骤(a')中产生的篮状菌培养物,然后在液体生长培养基中继续进行另外的培养步骤(b)。步骤(b)中的液体生长培养基是关于盐和痕量金属具有与初始液体生长培养基相同组成的合成培养基。然而,步骤(b)中的液体生长培养基包括选自氨基酸、肽、氨基糖和伯胺中的一种的化合物,作为有机氮的唯一来源。合适的有机氮源选自由氨基酸、肽、氨基糖和任何其他伯胺组成的组;并且对应于用于一步发酵程序中的液体生长培养基的合适的源。虽然在步骤(a')中无机氮源是初始液体生长培养基的成分;但在步骤(b)中的液体生长培养基中不包括附加的无机氮源,而是将无机氮替换为给定的有机氮源。根据第二实施方式,两步发酵可以通过在步骤(a')中在初始液体生长培养基中培养孢子或菌丝体,并且然后在步骤(b)中将唯一有机氮源添加到由步骤(a')产生的培养物中来进行。初始液体生长培养基的无机氮含量在步骤(a')中的真菌孢子或菌丝体的培养期间被耗尽,使得在步骤(a')结束时,生长培养基基本上没有可用的无机氮。可以调整初始液体生长培养基中的无机氮含量,以确保到步骤(a')结束时被完全耗尽;例如,通过提供不超过2g/l、1.75g/l、1.5g/l、1.25g/l、1g/l的kno3或nano3,诸如提供不超过20mm、17.5mm、15mm、12.5mm、10mm的no3﹣。一旦初始液体生长培养基中存在的无机氮水平被消耗至量小于0.5g/l、0.4g/l、0.3g/l、0.2g/l、0.1g/l或0.05g/l的kno3或nano3,诸如消耗至量小于5mm、4mm、3mm、2mm、1mm、0.5mm的no3﹣,则它不能再支持篮状菌培养物的生长。替代地,在另外的培养步骤(b)开始时,将步骤(a')中的初始液体生长培养基替换为包括上述确定的作为唯一氮源的有机氮化合物的液体生长培养基。在步骤(a')中提供并在步骤(b)期间保持的生长培养基的ph优选为4至6之间;优选为4.5至5.5之间;其中,ph可以通过添加naoh或hcl的水溶液进行调节。一步和两步发酵期间的培养条件支持篮状菌培养物中的有氧代谢。有氧代谢依赖于足够的通气,这可以通过摇动液体培养物或通过提供空气源(例如氧气)来实现。一步和两步发酵程序可以在生物反应器中进行。可以将用于一步和两步发酵程序两者中的液体生长培养基(上述)提供至生物反应器以促进真菌培养物的分批、补料分批或连续培养。选择两步发酵程序中培养步骤(a')和(b)的持续时间以优化篮状菌培养物的生长(如通过生物质测量的)和由篮状菌培养物产生的嗜氮酮色素的产率。培养步骤(a')优选为至少28h;例如30h到40h之间。培养步骤(a')的持续时间可以为约32、34、36、38、40、42、44、46、48、50、52和54h。在步骤(a')之后的培养步骤(b)的持续时间优选为至少50h;例如50h至80h之间。培养步骤(b)的持续时间可以为约50、52、54、56、58、60、62、64、66、68、70、75、80h。根据第一或第二实施方式,通过培养篮状菌培养物而产生的嗜氮酮色素是细胞外的,并且因此可以从液体培养基中回收。令人惊讶的是,与一步发酵程序相比,当使用两步发酵程序时,在培养显著更少的小时后发生嗜氮酮色素合成的开始(参见实施例3.2;图5)。另外,如通过嗜氮酮色素产率来判断,两步发酵程序的碳经济性更优异(参见实施例3.4-3.5;表3和表4)。据报道,深玫色篮状菌菌株能够产生红曲霉色素的混合物,包括黄色嗜氮酮(pp-y)和橙色嗜氮酮(pp-o)的顺式和反式异构体,以及紫色嗜氮酮(pp-v)。令人惊讶的是,通过根据本发明的第一和第二实施方式的方法生产的嗜氮酮色素是单一种类的深玫素色素,而不是色素的混合物(参见实施例2)。当在两步发酵程序的步骤(a')中提供kno3或nano3(以较少的量,例如2g/l(0.02mno3﹣))作为唯一氮源时,这会选择性地促进步骤(a')期间顺式和反式两种形式的橙色嗜氮酮色素(pp-o)的少量合成。在随后的步骤(b)中,有机氮源中存在的氨基被并入pp-o嗜氮酮核心异构体结构(顺式和反式-pp-o)中,以形成基本上纯形式的特定的顺式-深玫素衍生物(图1)。因此,可以提取和回收通过该方法生产的单一种类的深玫素色素,而无需多个且可能复杂的纯化步骤。此外,使用该方法的发酵产物不含任何霉菌毒素(参见实施例4),并且因此对于人类使用是安全的。根据第三实施方式,本发明提供了具有式i的新型深玫素色素:其中,n-r选自氨基酸、肽、氨基糖(例如氨基葡萄糖或氨基半乳糖)和伯胺(例如邻氨基苯甲酸、苯胺或对苯二胺),并且碳2和3之间的双键的构型是顺式。在优选的实施方式中,深玫素色素具有式i,其中,n-r是选自由以下组成的组中的一种的氨基酸:l-丙氨酸、l-精氨酸、l-天冬酰胺、l-天冬氨酸、l-半胱氨酸、l-谷氨酸、l-甘氨酸、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-蛋氨酸、l-苯丙氨酸、l-丝氨酸、l-苏氨酸、l-酪氨酸、l-缬氨酸和l-鸟氨酸。具有如上定义的式i的新型深玫素是从通过根据本发明的第一或第二实施方式的发酵程序产生的真菌培养物中回收的嗜氮酮色素。使用该发酵程序的新型深玫素的产量是当真菌菌株在相同条件下培养但供给具有无机氮作为唯一氮源的合成培养基时所产生的不同深玫素的总和的至少4倍(参见实施例3.4)。与已知的红曲霉色素相比,具有式i的新型深玫素的重要性质是其增加的水溶性。这归因于深玫素中主链结构中的羧酸和由所并入的含氨基部分赋予的极性(参见实施例6.1)。实施例2.1和2.2中详细描述了用于提取和检测具有式i的深玫素的方法。如在实施例5.1和5.2中所描述的,具有式i的深玫素的化学结构可以借助与二极管阵列检测和高分辨率质谱和核磁共振波谱联用的超高效液相色谱法来确定。具有式i的深玫素可以用作食物产品、非食物产品和化妆品中的着色剂。食物产品可以选自以下食品:烘焙食品、烘焙混合物、饮料和饮料基料、早餐谷物、奶酪、调味品和风味剂、糖果和糖霜、油和脂、冷冻乳制甜食和混合物、明胶、布丁和馅料、肉汁和酱汁、奶制品、植物蛋白产品、加工的水果和果汁以及休闲食品。非食物产品可以选自以下非食品:纺织品、棉花、羊毛、丝绸、皮革、纸、涂料、聚合物、塑料、油墨、片剂。化妆品产品可以是游离的、倾倒的或压实的粉末,流体无水油脂产品,用于身体和/或面部的油,用于身体和/或面部的洗剂或护发产品的形式。本发明提供了用于对产品进行着色的试剂盒,其中,该试剂盒包括至少一种根据本发明的具有式i的深玫素色素;其中,该色素被提供在容器中(任选地与分散剂例如胶体或增稠剂组合),其中,该产品选自食物、非食物产品和化妆品。实施例实施例1.通过发酵生产深玫素——一种新型的嗜氮酮色素1.1菌株维持和孢子产生:真菌菌株,深玫色篮状菌ibt11181(ibtdtu菌株收集)被用于生产深玫素。深玫色篮状菌的孢子在czapekdoxagar(cya)琼脂(由70185sigma-aldrich提供)的平板上繁殖,并在30℃下温育7天。用0.9%氯化钠(nacl)溶液收获孢子。将悬浮液通过米拉布(mira-cloth)过滤以将孢子与菌丝体分离。将孢子溶液在4℃下以10.000rpm离心10min。除去上清液,并将孢子球重新悬浮在0.9%的nacl溶液中。通过使用burker-turk计数室来测定孢子浓度。接种所有培养物以产生106个孢子/ml的初始孢子浓度。1.2一步发酵程序,用于生产深玫素小规模生产:使用包括以下成分的发酵培养基,通过一步发酵来生产深玫素:蔗糖(7.5g/l)、葡萄糖(0.375g/l)、kh2po4(1g/l)、nacl(1g/l)、mgso4.7h2o(2g/l)、kcl(0.5g/l)、cacl2.h2o(0.1g/l)和痕量金属溶液(2ml/l)。痕量金属溶液由cuso4.5h2o(0.4g/l)、na2b4o7.10h2o(0.04g/l)、feso4.7h2o(0.8g/l)、mnso4.h2o(0.8g/l)、na2moo4.2h2o(0.8g/l)、znso4.7h2o(8g/l)组成。通过提供以下物质来提供各种氮源:0.1m的l-氨基酸,选自l-丙氨酸、l-精氨酸、l-天冬酰胺、l-天冬氨酸、l-半胱氨酸、l-谷氨酰胺、l-谷氨酸、l-甘氨酸、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-蛋氨酸、l-苯丙氨酸、l-脯氨酸、l-丝氨酸、l-苏氨酸、l-色氨酸、l-酪氨酸、l-缬氨酸和l-鸟氨酸。用naoh和hcl的水溶液将介质的ph调节至ph5。在30℃下无挡板摇瓶中和150rpm的旋转振荡温育箱中以100ml体积进行发酵。96hr后取样。摇瓶实验一式三份进行。作为对照/基准,测试了kno3(0.1m)代替氨基酸作为氮源。大规模生产:还在1l生物反应器中使用相同的培养基通过一步发酵生产深玫素,其中修改为该培养基包括20g/l的蔗糖和丝氨酸作为唯一氮源,且在4.5的ph下。发酵在30℃、800rpm和1vvm下进行。生物反应器实验一式两份进行。1.3通过发酵得到的深玫色篮状菌生物质的分析使用预称重的过滤器,将发酵过程中积累的深玫色篮状菌生物质测量为干重(dw)。将过滤器在微波中预干燥20min,在干燥器中放置至少10min并称重。对于dw测量,将过滤器放置在真空过滤泵中,并加入约10ml的发酵培养物。随后,将具有生物质的过滤器在微波中干燥20min,并在干燥器中放置至少10min,然后重新称重。将生物质的重量确定为样品施加前后过滤器重量的差值,并假设培养液密度为1g/l。1.4通过发酵产生的深玫素的定量分析使用synergy2光谱和96孔微量滴定板测定色素的吸光度值。将150μl过滤的发酵液样品在200-700nm的范围内扫描并确定最大吸光度值,发酵液来源于在包括每种氨基酸作为氮源的培养基上的发酵。490nm处的吸光度表明存在红色色素。使用橙色和红色色素的标准曲线来计算培养基中的浓度(参见图2)。1.5通过在限定的发酵培养基上发酵深玫色篮状菌产生的深玫素色素和生物质在小规模摇瓶中在如实施例1.2中限定的限定培养基中,针对20种天然氨基酸和非蛋白原氨基酸鸟氨酸中的每一种,评估一步发酵期间氨基氮源对由深玫色篮状菌生产色素和生物质积累的重要作用。作为对照,在使用kno3作为唯一氮源的限定培养基中进行发酵。通过测量整个发酵液在500nm处的吸光度来确定每次发酵中产生的色素的浓度,使用图2中所示的标准曲线从中计算出色素的浓度。如图3中看到的,虽然每种天然氨基酸在作为唯一氮源提供时都支持生长,但一些氨基酸比其他氨基酸更有利于生物质积累。使用脯氨酸(6.05+0.3g/l)的生物质积累最高,其次是丙氨酸(5.48+0.01g/l)和鸟氨酸(4.83+0.07g/l)。精氨酸(4.45+0.02g/l)、天冬酰胺(4.4+0.03g/l)、天冬氨酸(4.26+0.5g/l)和谷氨酸(4.49+0.24g/l)也引起高生物质值。提供kno3作为氮源的对照的产率为2.77±0.06g/l。组氨酸、异亮氨酸、亮氨酸、赖氨酸、蛋氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸和酪氨酸支持低于2g/l的低生物质值。就色素产生而言,得到最高产率的氨基氮源是谷氨酸,产率为0.39g/l。其他高产率的氨基氮源是天冬氨酸(0.25g/l)、组氨酸(0.19g/l)和亮氨酸(0.11g/l),其次是丝氨酸(0.08g/l)和异亮氨酸(0.07g/l)(参见图3)。当提供脯氨酸作为唯一氨基氮源时,未观察到可检测的色素产生。据信是由于脯氨酸中的仲胺阻止了其并入色素的核心结构。其他17种天然氨基酸是通过其伯胺并入的。在不存在色素形成的情况下,可以看到深玫色篮状菌将脯氨酸用作生长的碳源,从而观察到高生物质积累。在包括谷氨酰胺和天冬酰胺的培养基中色素产生相对较低归因于未能在摇瓶中保持稳定的ph。72hr后,在包括谷氨酰胺的培养基中发酵液的ph降至ph3.8,而包括谷氨酸的培养基具有最终6.1的ph(参见表1)。表1:摇瓶中发酵72h后发酵液的ph氨基酸源发酵液phgln3.7glu6.1用于一步方法的生物反应器实验表明,发酵液的ph极大地影响了色素和生物质的产生。图10a示出了与较高ph(诸如ph5-7)相比,当在较低ph(诸如ph3-4.5)下培养时,深玫色篮状菌ibt11181的生长速率显著更高。然而,如表2和图10b中所示,当发酵液的ph保持在ph3时,这完全阻碍了色素产生。同样在高ph(诸如ph≥6)下,基本上没有观察到色素产生。如从缺乏ph控制的摇瓶培养物中已经看到的,生物反应器实验证实了ph控制对于维持有利于色素产生的条件的重要性。表2:ph对生物反应器中色素产率的影响*如实施例1.2中限定的生长培养基;其中,唯一氮源如所指示的。实施例2.通过在限定的发酵培养基上发酵深玫色篮状菌获得高纯度单一的深玫素色素将从发酵培养物中收集的样品首先通过孔径为0.45μm的无菌statoriusstedim过滤器过滤,以便从滤液中分离出生物质,然后通过hplc、吸光度和lc-ms对它们进行分析。使用两种方法来纯化通过在限定的发酵培养基上发酵深玫色篮状菌产生的深玫素。2.1通过发酵产生的深玫素的提取和纯化方法i:将源自深玫色篮状菌(ibt11181)的培养物的发酵液过滤、离心,并用1:1乙酸乙酯(etoac)在ph3(用甲酸(fa)调节)下萃取上清液两次。将有机萃取物真空浓缩。在c18柱材料上使用水/甲醇梯度洗脱,在isoleraone自动闪蒸系统(biotage)上通过对etoac萃取物进行快速层析,将目标化合物富集为粗级分。最终分离是在半制备型hplc上使用含有50ppm三氟乙酸(tfa)的水/乙腈梯度进行的,该半制备型hplc是带有996光电二极管阵列检测器的waters600controller,配备有lunaiic18柱(250mm×10mm,5μm,phenomenex)。方法ii:将源自深玫色篮状菌(ibt11181)的培养物的发酵液过滤、离心,并用1/3体积的etoac在ph3(用fa调节)下萃取滤液3次。将合并的etoac相蒸发至100ml,并在ph8(用氢氧化铵调节)下用milli-q水(1:1)萃取两次。用fa将水相重新调节至ph3,并用etoac萃取两次,然后蒸发,以得到高度富集的>95%的色素级分(几种深玫素和n-氨基酸红曲红胺的混合物,比例>10:1)。将色素在配备有gilson172二极管阵列检测器的gilson332半制备hplc系统上,使用lunaiic18柱(250mm×10mm,5μm,phenomenex),用水/乙腈梯度进行分离。2.2通过发酵产生的深玫素的定量分析使用synergy2光谱和96孔微量滴定板确定各个色素溶液的吸光度值。对每种氨基酸色素溶液的150μl发酵液样品在200-700nm范围内进行扫描并确定最大吸光度值。490nm处的吸光度表明存在红色色素。可以使用橙色和红色色素的标准曲线来计算培养基中的浓度(参见图2)。2.3在限定培养基上发酵的深玫色篮状菌的发酵液中检测的单一深玫素色素通过提供单一氨基酸作为唯一氮源,极大地提高了由深玫色篮状菌发酵产生的给定嗜氮酮的富集(图4)。当用0.1m硝酸钾作为氮源培养深玫色篮状菌时,检测到过多的不同嗜氮酮色素,而当仅提供单一氨基酸作为唯一氮源时,仅观察到一个主要的uv-可检测峰,该主要的uv-可检测峰对应于在其结构中并入该特定氨基酸的深玫素(图4)。实施例3.通过在限定的发酵培养基上发酵深玫色篮状菌来大规模生产高纯度单一深玫素色素3.1用于生产深玫素的两步发酵程序两步培养:在1l生物反应器中进行两步发酵。发酵培养基含有蔗糖(20g/l)、葡萄糖(1g/l)、kh2po4(10g/l)、nacl(1g/l)、mgso4.7h2o(2g/l)、kcl(0.5g/l)、cacl2.h2o(0.1g/l)和痕量金属溶液(2ml/l)。在第一步骤中,培养基包括2g/l(0.02m)的kno3作为唯一氮源。培养53h后,添加丝氨酸至1g/l(0.01m)的最终浓度以诱导氨基酸衍生物的形成。发酵条件保持在30℃、800rpm、1vvm和ph4.5。3.2使用两步发酵程序代替一步发酵更快地生产深玫素比较了使用一步和两步发酵程序的由深玫色篮状菌的生物质产量和色素产生两者。在一步发酵中,0.1m丝氨酸用作唯一氮源,且0.1mkno3用作对照。在两步发酵中,顺式-和反式-pp-o最初由0.02mkno3诱导产生,然后在kno3从生长培养基中耗尽之后,通过添加l-丝氨酸(最终浓度为0.01m)将其转化为顺式-深玫素-s。在一步发酵期间,在75h后对于对照(kno3作为唯一氮源)发酵变成了碳限制的,并且在发酵结束时产生了0.35g/l的混合色素和5g/l的生物质(参见图5a)。在培养过程中,随着碳被消耗,产生的色素将颜色从橙色(pp-o)变为红色(深玫素和红曲霉色素的混合物)(图5a&d)。在以l-丝氨酸作为唯一氮源的一步发酵期间,在180h后发酵变成了碳限制的,并且在发酵结束时产生了0.9g/l的顺式-深玫素-s和6.5g/l的生物质(参见图5b)。对于其他天然氨基酸也获得了相似的结果(参见图4)。在发酵的整个时间进程中,顺式-深玫素-s的生产随真菌生长而增加,并且未观察到pp-o异构体(图5b&e)。在两步发酵程序中,最初提供少量的kno3(20mm)作为氮源,从而导致橙色色素pp-o的生物合成(图5c&f)。发酵53h后,首先添加浓度为0.01m的氨基酸(在该情况下为丝氨酸),随后将其并入顺式和反式pp-o嗜氮酮核心结构中,从而导致合成红色色素——顺式-深玫素-s(图1)。虽然两步培养也产生了0.9g/l的深玫素s,但相比于6.5g/l,产生了7.4g/l生物质的更高的生物质,这在碳限制开始仅100h后即获得。3.3鉴定由深玫色篮状菌的发酵产生的深玫素色素图5g&h中分别示出了在包括kno3或丝氨酸作为唯一氮源的限定的发酵培养基上通过深玫色篮状菌的一步发酵所产生的深玫素色素的uv色谱图谱(520±20nm),而在添加氨基酸之前和之后的两步发酵的色素图谱在图5i中示出。包括0.1mkno3作为唯一氮源的发酵产生了色素的混合物(图5g),而包括0.1ml-丝氨酸作为唯一氮源的发酵产生了具有最小杂质的顺式-深玫素-s(图5h)。对于两步发酵,在第一阶段(低kno3量)期间产生了pp-o的两种异构体:在第二阶段(添加丝氨酸后),pp-o的两种异构体都转化为顺式-深玫素-s。色谱图h和i两者中在8分钟处检测到的主要uv峰对应于深玫素-s(如通过质谱确认的),且色谱图i中在10至11分钟之间检测到的两个峰对应于pp-o的顺式和反式异构体。3.4两步发酵期间的硝酸盐消耗54小时后,由于co2和生物质排放中的平台期,估计kno3被耗尽(图5c)。这被如图9所示的使用定量(quanto-fix)硝酸盐条进行的半定量估计所证实。与发酵初期相比,硝酸盐水平已经在42小时后开始下降;这对应于当前体pp-o的两种异构体形式开始被生产时(图5c)。更为明显的是,在转换到丝氨酸作为氮源后,上清液中的色素变成了鲜红色,并且正如硝酸盐定量条所证明的,硝酸盐被耗尽了。根据两步发酵方法为了通过深玫色篮状菌生产单一的深玫素色素,必须在添加氨基酸之前使培养基中的硝酸盐水平被耗尽(至低于5mm)。在包括高硝酸盐浓度(诸如>0.02m)的发酵培养基中培养深玫色篮状菌,在硝酸盐耗尽之前会产生色素的混合物(如在图5a和图5g中看到的),并且因此,当向培养基添加氨基酸时,不可能获得单一的纯深玫素产品。在包括低硝酸盐水平(诸如<0.02m)的发酵培养基中培养深玫色篮状菌,并“过早”地即在硝酸盐耗尽之前和pp-o积累开始之前向培养基添加氨基酸,不会获得单一的深玫素产品,而是获得色素的混合物。当在pp-o生产开始之前添加时,氨基酸会被用于细胞功能,并且不会过量存在(与硝酸盐相比),从而产生深玫素的混合物。3.5使用两步发酵提高了深玫素生产的碳经济性(计算参考表3)在提供有丝氨酸的一步发酵程序中,深玫色篮状菌使用20g/l的蔗糖和10g/l的丝氨酸来产生0.9g/l的深玫素-s。在两步发酵程序中,深玫色篮状菌使用20g/l的蔗糖和2g/l的丝氨酸来生产0.9g/l的深玫素-s。蔗糖的分子量为324.3g/mol。当仅考虑该过程的碳利用率时,将使用单位c-摩尔。蔗糖具有化学式c12h22o11,因此:324.3g/mol对应于28.53g/c-摩尔20g蔗糖等于(n=m/c-摩尔=20g/28.53g/c摩尔)=0.7c-摩尔。可以对深玫素-s和丝氨酸进行相同的计算深玫素-s:c26h29no9以及499.18g/mol。丝氨酸:c3h7no3以及105.09g/mol。表3:深玫素-s生产的碳经济性一步培养法将4.8%的碳转化到深玫素-s中,而在对应的两步培养中,转化到深玫素-s中的碳提高至6.4%(参见表4)。当提供kno3作为氮源时,转化到色素混合物中的碳仅为1%(表4)。因此,用于生产嗜氮酮色素的一步和两步发酵方法的碳经济性获得了相比基于无机氮的传统发酵方法的至少4倍高的产率。3.6使用一步和两步发酵程序通过深玫色篮状菌生产的纯顺式-深玫素-s的提高的产率使用基于包括无机氮的生长培养基的传统发酵方法(参见表4),深玫色篮状菌将碳转化到色素的混合物中具有的碳经济性仅为1%或更少。相反,用于生产单一嗜氮酮色素的一步和两步发酵方法的碳经济性具有至少4倍高的产率。表4:发酵条件对色素分布和产率的影响*各发酵均在30℃、ph4.5下进行实施例4.通过一步或两步发酵方法生产的深玫色篮状菌的产物不含霉菌毒素分析源自深玫色篮状菌的一步或两步发酵的发酵液(供给有kno3、丝氨酸或kno3和丝氨酸),表明在三种培养条件中的任何一种中均未产生霉菌毒素桔霉素(m/z=251.0920)(无洛伐他汀(mevinolin);未示出)(图6)。实施例5.通过发酵深玫色篮状菌产生的新型深玫素色素的结构如实施例2.1中所描述的,对源自一步或两步发酵的深玫色篮状菌的发酵液中的深玫素色素进行提取和分离;并且随后使用以下方法进行分析:5.1超高效液相色谱-高分辨率质谱(uhplc-hrms)在配备有二极管阵列检测器的agilentinfinity1290uhplc系统(agilenttechnologies,santaclara,ca,usa)上进行uhplc-hrms。在agilentporoshell120苯基己基柱(2.1×250mm,2.7μm)上获得分离,线性梯度由水(a)和乙腈(b)组成,两者均用20mm甲酸缓冲,从10%b开始并在15min内增加至100%,在此保持2min,在0.1min内恢复至10%并保持3min(0.35ml/min,60℃)。使用1μl的注射体积。ms检测是在配备有agilentdualjetstream电喷雾离子源的agilent6545qtofms上以正检测模式进行的,干燥气的温度为250℃,气流量为8l/min,鞘气温度为300℃,并且流量为12l/min。毛细管电压设置为4000v,且喷嘴电压设置为500v。对于ms模式下的m/z85-1700和ms/ms模式下的m/z30-1700,质谱在10、20和40ev处被记录为质心数据,其中采集速率为10光谱/s。使用1:100分流器以15μl/min的流量使用额外的lc泵将70:30甲醇:水中的锁定质量溶液注入第二喷雾器中。该溶液含有1μm三丁胺(sigma-aldrich)和10μmhexakis(2,2,3,3-四氟丙氧基)磷腈(apolloscientificltd.,cheshire,uk)作为锁定质量。使用两种化合物的[m+h]+离子(分别为m/z186.2216和922.0098)。5.2核磁共振(nmr)波谱在brukerascend400mhz(bruker,billerica,ma,usa)或位于丹麦技术大学(technicaluniversityofdenmark)化学系的brukeravance800mhz上记录1d和2dnmr波谱(1h,dqf-cosy,edhsqc,hmbc和noesy)。使用标准脉冲序列获得nmr波谱。所用溶剂为dmso-d6(其也用作δh=2.50ppm和δc=39.5ppm处的信号的参照)或cd3od(δh=3.31ppm和δc=49.0ppm处的参照)。使用topspin3.5(bruker)、mestrenovav.6.2.1-7569(mestrelabresearch,santiagodecompostela,spain)和acdnmrworkbook(advancedchemicaldevelopment,inc.,toronto,ontario,canada)进行数据处理和分析。j-耦合以赫兹(hz)表示,并且化学位移以ppm(δ)表示。5.3顺式-深玫素-s的结构解析纯化的深玫素-s为暗红色,几乎黑色,无定形固体。hr-esi-ms给出的质荷比为[m+h]+=500.1915da,对应的分子式为c26h30no9(dbe=13)。表5:深玫素-s的质子和碳位移以及耦合常数。顺式-深玫素–s具有的uv吸收光谱类似于已知的红曲红胺的吸收光谱,在520nm处具有uvmax。使用1d和2dnmr(表5中列出的位移)来确定其结构。1h-nmr和hsqc揭示了在6.43至8.57ppm(2、3、5、7和12)范围内的五个烯质子,以及在1.67(9-ch3)和0.89ppm(22)处的两个甲基基团。另外,总共可以鉴定出七个ch2基团,其中六个在脂肪酸链中连接在一起(16-21),并且一个(3')在5.12ppm(2')处与ch连接。13c-nmr和hmbc揭示了11个季碳:五个羰基(1、10、13、15和1’),五个烯碳(4、6、8、11和14)和一个季烷(9)。hmbc在嗜氮酮支架内提供了长距离的h-c耦合,将3'与羰基1'连接。3'还显示出与4耦合。16和17与15相关,并且5和12与6、10和10相关,而7和9-ch3显示出与8和9耦合。另外,观察到从2和3耦合到1和4。最终,在2和3之间的耦合常数支持双键的顺式构型。根据获得的光谱,确定深玫素-s具有图7所示的结构。5.4深玫素-氨基酸衍生物的结构解析阐明了剩余的18种深玫素-氨基酸衍生物的结构,以确认对于顺式深玫素-s,相应的氨基酸已并入核心嗜氮酮结构中(数据未示出)。nmr数据仅示出了连接至分子的异喹啉部分的氨基酸部分中与顺式深玫素-s的差异。所有18种深玫素-氨基酸衍生物均具有亮红色。实施例6.深玫素色素的物理性质6.1与相应的红曲红胺(与所有深玫素一样在位置1中没有羧酸)相比深玫素色素的亲水性logp和logd值是对分析物在两相水/辛醇系统中的溶解度的量度。值越低,分析物的亲水性越高,logp/d值为0对应于50:50的分布。logp仅指非离子化物质;而logd是指离子化和非离子化物质两者,并且因此随ph变化。表5深玫素和红曲红胺色素的logp值图8中示出了深玫素-s和深玫素-e的logp和logd值,表明它们更易溶。6.2深玫素色素的比色值使用cielab颜色系统(15)确定了深玫素色素的颜色特性。l*、a*和b*的值通过cr-300色度计使用cielab颜色系统(minoltacameraco.,ltd.,osaka,japan)来测量。然后将这些值用于计算色度(c*)和色相角(hab)值。l*表示从0(黑色)到100(白色)的亮度。a*中的正和负分别代表红色和绿色,而b*中的正和负分别代表黄色和蓝色。色度值表示颜色的饱和度或纯度。在同一l*值处靠近中心的值表示暗淡或灰色,而在圆周附近的值代表鲜艳或明亮的颜色。色相角值表示红色为0、黄色为90、绿色为180和蓝色为270。在将它们的稀释浓度调整为4后,获得纯色素的l*、a*和b*值。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1