改变微生物群体和修饰微生物群的制作方法
发明领域
本发明涉及指导的核酸酶、crispr/cas系统、crrna、单一grna、载体、方法和药物组合物,例如用于靶向孢子形成细菌或用于靶向艰难梭菌、沙门氏菌、大肠杆菌或链球菌。
发明背景
抑制细菌群体生长和改变混合物中的不同细菌物种的相对比例发现应用于广泛的工业和背景中,例如用于处理水道、饮用水或在其他环境背景中。还发现应用于在人和非人动物(例如牲畜)中改变细菌,用于减少致病性感染或重新平衡肠道或口腔微生物群。最近,有兴趣分析人肠道细菌在具有不同体重或肥胖情况的人中的相对比例,或者研究疾病背景诸如克罗恩病中可能的细菌影响。
虽然细菌针对噬菌体的先天性免疫机制很多,一种广泛记录的细菌适应性免疫系统为crispr/cas系统。工程改造的crispr/cas系统已用于精确修饰从细菌至动物和植物细胞范围内各种类型的原核和真核细胞中的核酸(例如参见jiangw等人(2013))。原核生物(诸如细菌和古细菌)编码适应性免疫系统,称为crispr/cas(成簇的规律间隔的短回文重复序列/crispr相关的),以提供针对移动的入侵者、诸如病毒(例如细菌噬菌体)和质粒的抗性。参考seed等人(2013),其解释细菌噬菌体(或噬菌体)是地球上最丰富的生物实体,并估计数目超过其细菌猎物的10倍。噬菌体捕食的不断威胁已导致广泛范围的细菌免疫机制的进化,这进而导致不同的噬菌体免疫逃避策略的进化,导致动态的共进化军备竞赛。
宿主免疫是基于入侵者dna序列在记忆位点(crispr阵列)中的结合、从该位点形成指导rna及位于邻近前间隔区序列邻近基序(pam)的同源入侵者dna(前间隔区)的降解。参见例如wo2010/075424。宿主crispr阵列包含各种元件:一个或多个重复区-间隔区-重复区单元的紧邻5’的前导区(包括启动子),其中重复区相同且间隔区不同。通过从入侵的病毒或质粒核酸采集间隔区序列,宿主防御系统能够将新的间隔区并入crispr阵列(每个间隔区侧接重复区),以充当记忆来应对病毒或质粒的未来入侵。已经观察到,新近采集的间隔区往往在前导区之后被直接插入宿主阵列中。
参考heler等人(2014),其解释crispr位点及其相关基因(cas)赋予细菌和古细菌对噬菌体和其他入侵的遗传元件以适应性免疫。任何免疫系统的基本要求是建立既往感染记忆以便更有效地应对复发性感染的能力。crispr-cas免疫系统的适应性特征依赖于其记忆入侵分子的dna序列并将其以“间隔区”的形式整合在crispr阵列的重复序列之间的能力。间隔区的转录产生小的反义rna,其被rna指导的cas核酸酶用于裂解入侵的核酸,以保护细胞免受感染。采集新的间隔区使得crispr-cas免疫系统快速适应新的威胁,并因此称为“适应”(即载体序列间隔区采集)。
seed等人(2013)报道了事件的一个显著转折,其中噬菌体编码的crispr/cas系统被用于抵抗细菌宿主的噬菌体抑制的染色体岛。噬菌体的成功裂解性感染据报道依赖于crispr间隔区和靶标染色体岛之间的序列同一性。在没有这种靶向的情况下,噬菌体编码的crispr/cas系统可以采集新间隔区以快速进化,并确保染色体岛的有效靶向以恢复噬菌体复制。bondy-denomy等人(2012)描述了早期观察到的介导crispr/cas系统的抑制的基因实例。在感染铜绿假单胞菌的细菌噬菌体的基因组中发现了5种不同的“抗-crispr”基因。噬菌体的抗-crispr基因的突变使其无法感染具有功能性crispr/cas系统的细菌,并且对crispr/cas靶向的噬菌体的基因组增加同一基因允许其逃避crispr/cas系统。
不成熟的rna从crispr阵列转录,并随后成熟以形成crrna。一些crispr/cas系统还包含编码反式活化rna(tracrrna)的序列,其能够在不成熟的crrna中与重复区杂交以形成pre-crrna,由此进一步加工产生成熟的,或crrna。crna的结构根据crispr/cas系统包含的类型(i、ii或iii型)而不同。
crispr相关(cas)基因通常与crispr阵列相关。广泛的比较基因组学已经鉴定了许多不同的cas基因;40种细菌和古细菌基因组的初步分析表明,可能存在45个cas基因家族,只有两种基因(cas1和cas2)普遍存在。cas1和cas2据信对将新间隔区采集到阵列中是必不可少的,因此在对来自噬菌体或质粒的入侵者核酸出现抗性的机制方面是重要的。nuñez等人(2015)据报道表明cas1-cas2复合物为催化间隔区dna采集的最小机制,并且其显然解释crispr重复区在提供用于cas1-cas2介导的适应性免疫的序列和结构特异性中的重要性。
crispr/cas系统还包括表达核酸酶(例如cas9)的序列,所述核酸酶用于切割入侵者核苷酸序列的入侵者核酸相邻的同源识别基序(pams)。核酸酶的pam识别对每种类型的cas核酸酶为特异性的。入侵者序列中的pams可能位于前间隔区序列的紧邻3’,其中核酸酶通常切割pam上游(5’)的3-4个核苷酸。pam序列的保守性在crispr-cas系统之间不同,并且似乎在进化上与cas1和前导序列有关。fineran等人(2014)观察到,入侵者可通过在前间隔区或其邻近pam的区域(“种子区域”)中进行点突变,在大肠杆菌k12中逃避i-e型crispr-cas免疫,但是通过在涉及采集的正反馈过程中整合新的间隔区(“引发”),宿主快速恢复免疫功能。迄今为止,在许多i型和ii型系统中,pam被充分表征,并且在前间隔区的突变效应已被记录(参见fineran等人(2014)中的参考文献5、14、23、46、47)。fineran等人(2014)得出结论,他们的结果表明pam和种子序列的关键作用,与先前的工作一致。
semenova等人(2011)研究了种子序列的作用,并且得出结论,在大肠杆菌亚型crispr/cas系统的情况下,crrna匹配的要求对紧随pam的种子区域是严格的。他们观察到,通过减少crrna指导的cascade复合物对前间隔区dna的结合亲合力,种子区域中的突变废除crispr/cas介导的免疫。
对3种主要类型的适应性免疫各自的crispr免疫阶段如下:
(1)采集通过经cas1和cas2识别入侵的dna并裂解前间隔区开始;
(2)前间隔区序列连接至邻近前导序列的直接重复区;和
(3)单链延伸修复crispr并复制直接重复区。
在3种主要类型crispr系统各自中不同地发生crrna加工和干扰阶段。初级crispr转录物由cas裂解以产生crrna。在i型系统中,cas6e/cas6f在直接重复区中由发夹环形成的ssrna和dsrna的接合点处裂解。ii型系统使用反式活化(tracr)rna以形成dsrna,其由cas9和核糖核酸酶iii裂解。iii型系统使用cas6同源物,其在直接重复区中裂解不需要发夹环。在ii型和iii型系统中,在5’或3’末端进行二次修剪,以产生成熟的crrna。成熟的crrna与cas蛋白缔合形成干扰复合物。在i型和ii型系统中,crrna和pam之间的碱基配对引起入侵dna的降解。iii型系统不需要pam用于成功降解,并且在iii-a型系统中,碱基配对发生在crrna和mrna而不是由iii-b型系统靶向的dna之间。
发明陈述
本发明的第一种配置中
发明人相信他们已首次证实了在微生物群(人、动物或环境微生物群)中自然共存的混合聚生体(consortium)中的一种特定菌株的群体生长的抑制,其具有以下特征中的一种或多种:
通过以下的群体生长抑制
•靶向野生型细胞;
•利用野生型内源性cas核酸酶活性;
•靶向必需和抗生素抗性基因;
•其中靶标为野生型序列。
发明人已在具有以下特征的混合细菌群体中证明了这一点:
•靶向人类微生物群(诸如肠道微生物群)物种的混合群体中的细菌生长抑制;
•其中群体包含3种不同的物种;
•包括选择性杀伤这些物种中的一种和保留其他物种的细胞;
•在与系统发生密切相关的其他物种(其免于这种抑制)存在的情况下靶向细胞生长抑制;
•在包括靶标厚壁菌门物种和非厚壁菌门物种的混合群体中靶向细胞生长抑制;
•靶向特定的厚壁菌门菌株的细胞生长抑制,同时保留混合群体中不同的厚壁菌门物种;
•靶向特定的革兰氏阳性菌菌株的细胞生长抑制,同时保留混合群体中不同的革兰氏阳性菌物种;
•靶向致病性(在人类中)细菌物种,同时保留共生的人类肠道细菌物种;
•靶向致病性细菌物种,同时保留益生的人类肠道细菌物种;
•靶向表面上的混合细菌群体的细胞生长抑制;
•单独或与聚生体的多种其他细菌物种混合时,获得特定细菌物种至少10倍的生长抑制;和
•获得特定细菌物种的两种不同菌株的至少10倍的生长抑制。
在野生型细胞利用内源性cas活性的能力对于在生物体(例如人和动物)原位治疗宿主细胞感染和处理环境是非常有用的。采用本发明也可解决野生型(即非工程化或预操控的)细菌种群诸如人、动物或植物微生物群的处理。在混合种群影响选择性生长抑制作用的能力对于解决细菌种群诸如人、动物或植物微生物群,或者对于解决环境微生物群是有用的。该特征也可用于产生药物(例如用于给予人或动物受试者用于本文公开的任何治疗或预防的细菌细胞移植物;或用于产生包含本发明的细菌种群产物的除草剂或杀虫剂组合物),其中选择性杀伤可用于选择性地改变混合种群的不同细菌比例,以产生为药物、除草剂或杀虫剂的改变的细菌种群;或者由此产生药物、除草剂或杀虫剂。例如,药物可鼻内移植给人或动物接受者,以影响这种治疗或预防。
在以下样例中,解决了固体表面细菌种群(革兰氏阳性厚壁菌门种群)的生长抑制作用。获得了>10倍的种群生长抑制作用。靶向针对抗生素抗性基因。本发明将用于抑制抗生素抗性细菌的生长,其中靶标序列是抗生素抗性基因的序列。在一个实例中,同时给予工程化核苷酸序列与抗生素可能是有效的。这可在人或动物受试者提供宿主细胞感染的更完整治疗或预防和/或使得减少用于给予人或动物的治疗有效的抗生素剂量。考虑到人们越来越担心过量给予抗生素和在人和动物群体出现耐药性,这是有用的。本发明还发现以下活体外和体外应用:用于处理工业或医用流体、表面、装置或容器(例如食物、消费品、化妆品、个人健康护理产品、石油或石油生产);或者用于处理水道、水、饮料、食品或化妆品,其中宿主细胞由流体、表面、装置、容器、水道、水、饮料、食品或化妆品包含。本发明还在控制腐蚀、生物膜和生物污损方面发现具有用途。第一种配置因此提供以下概念:-
宿主修饰(hm)crispr/cas系统用于改变细菌的混合群体中的第一和第二细菌的亚群的相对比例的用途,所述第二细菌包含宿主细胞,
对于每种宿主细胞,所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)宿主细胞靶标序列和包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列,所述hm-crrna包含与宿主细胞靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的宿主crispr/cas系统;且
其中所述靶标序列被cas修饰,由此杀死宿主细胞或减少宿主细胞生长。
用于方面1的用途的宿主修饰(hm)crispr/cas系统,其用于修饰细菌宿主细胞的靶标核苷酸序列,所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)宿主细胞靶标序列和包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列,所述hm-crrna包含能够与宿主靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或用于表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种可以转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的宿主crispr/cas系统。
这通过本文工作实施例例举,其中我们在混合和非混合细胞群体中显示选择性的宿主细胞生长抑制作用达至少10倍。混合物模拟在人微生物群中发现的物种和菌株的组合。
细菌宿主细胞群体抑制群体生长的野生型内源性cas核酸酶活性的用途,其中每种宿主细胞具有含有野生型cas核酸酶活性的内源性crispr/cas系统,所述用途包括转化群体的宿主细胞,其中每种转化的宿主细胞用工程改造的核苷酸序列转化,用于提供宿主细胞内的宿主修饰(hm)crna或指导rna(grna),hm-crna或grna包含能够与宿主细胞靶标前间隔区序列杂交的序列,以将内源性cas指导至靶标,其中crna或grna与具有所述野生型核酸酶活性的宿主细胞的内源性cas核酸酶同源,并且在转化宿主细胞后群体的生长受到抑制。
宿主修饰(hm)crispr/cas系统用于杀死或减少细菌宿主细胞的生长的用途(任选地所述用途是根据以上紧接的前述段落的用途),对于每种宿主细胞,所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列,所述hm-crrna包含与宿主细胞靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的靶标序列;
其中所述cas核酸酶对所述宿主细胞是内源的;且其中所述靶标序列被cas修饰,由此杀死宿主细胞或减少宿主细胞生长。
因此,所述hm-crrna能够与宿主细胞靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰所述靶标序列。
在一个替代方案中,hm-crrna和tracrrna由单一指导rna(grna)包含。
通过利用内源性cas核酸酶,本发明的实施方案使用内源性cas核酸酶活性(即不需要先前的宿主细胞基因修饰来活化或增强核酸酶活性)。因此,在一个实例中,cas核酸酶被宿主细胞的野生型基因编码。在一个实例中,核酸酶是活性的,以实现细胞杀死或生长抑制,而不使宿主细胞中的内源性cas核酸酶(或cas核酸酶基因)阻遏物失活。因此,本发明可以解决野生型细菌群体,而不需要先前的操纵以带来有效的cas介导的细胞杀死或生长下降。因此,当群体在其野生环境(诸如水道或由人或动物微生物组包含)中时,群体可暴露于crna。
在一个实例中,第一细菌为拟杆菌门(例如拟杆菌属)细胞。在一个实例中,第二细菌为厚壁菌门细胞。该方法例如用于改变肠道微生物群群体的比例(例如体外或体内),其例如用于治疗或预防体重增加或肥胖症(例如其中第一细菌为厚壁菌门细胞)。
第一种配置也提供了:改变包含所述亚群的细菌混合群体中的第一和第二种细菌亚群的相对比例的方法,其中第一细菌为噬菌体感染的宿主细胞(例如拟杆菌门细胞)且第二细菌不被所述噬菌体感染(或者不是拟杆菌门细胞),所述方法包括使混合群体与多种载体以一个或多个步骤组合,用于将载体核酸引入宿主细胞中,并允许混合群体中的细菌生长,其中所述第一和第二细菌的相对比例被改变;
其中每种载体包含工程改造的噬菌体修饰(pm)crispr阵列,用于引入噬菌体感染的宿主细胞,以修饰细胞中所述噬菌体的靶标核苷酸序列,
(a)其中所述pm-crispr阵列包含一个或多个用于表达pm-crrna的序列和用于在噬菌体感染的宿主细胞中的序列转录的启动子;和
(b)其中所述pm-crrna能够与噬菌体靶标序列杂交,以指导感染的宿主细胞内的cas(例如cas核酸酶)以修饰靶标序列。
在第二种配置中,本发明提供了:-
用于修饰宿主细胞的靶标核苷酸序列的宿主修饰(hm)crispr/cas系统(例如用于第一种配置的用途),所述系统包含根据(i)至(iv)的组分:
(i)至少一种编码cas核酸酶的核酸序列;
(ii)包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列,所述hm-crrna包含能够与宿主靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或用于表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种可以转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的靶标序列;
其中任选地组分(i)对所述宿主细胞是内源的。
第二种配置还提供了:工程改造的噬菌体-修饰(pm)crispr阵列,其用于第一种配置中的用于修饰所述噬菌体的基因组的方法中,
(a)其中所述pm-crispr阵列包含一个或多个用于表达pm-crrna的序列和用于在噬菌体感染的宿主细胞的序列转录的启动子;和
(b)其中所述pm-crrna能够与噬菌体基因组靶标序列杂交,以在感染的宿主细胞内指导cas(例如cas核酸酶)以修饰靶标序列。
在一个实例中,所述噬菌体为拟杆菌门(例如拟杆菌属)噬菌体,例如crass噬菌体。
在一个实例中,所述阵列包含crispr重复区,其与宿主细胞crispr/cas系统一起有功能。这有益于增加阵列对细菌混合物中所期望细胞的选择性。这也简化了阵列和含有本发明的阵列的载体的产生,因为其可能不必包括编码对宿主细胞内阵列功能需要的一种或多种cas蛋白(和/或tracrrna)的庞大核苷酸序列。在一个替代方案中,所述阵列提供有同源cas9编码序列和任选地同源tracrrna编码序列。
在第三种配置中,本发明提供了:-
用于修饰包含内源性crispr/cas系统的细菌宿主细胞的工程改造的核酸载体,所述载体
(a)包含用于根据本发明的crispr/cas系统或用途中的表达多种不同crrna(例如,单一指导rna,即,grna)的核酸序列;和
(b)缺乏编码cas核酸酶的核酸序列,
其中第一所述crrna能够与所述宿主细胞内的第一核酸序列杂交;且第二所述crrna能够与所述宿主细胞内的第二核酸序列杂交,其中所述第二序列不同于所述第一序列;且
(c)第一序列由抗生素抗性基因(或其rna)包含且第二序列由抗生素抗性基因(或其rna)包含;任选地其中所述基因是不同的;
(d)第一序列由抗生素抗性基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含;
(e)第一序列由必需基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含;或
(f)第一序列由毒力基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含。
第三种配置还提供了:用于本发明的方法中的核酸载体(例如质粒、噬菌体或噬菌粒),所述载体包含本发明的crispr阵列。
在第四种配置中,本发明提供了:-
核酸载体(例如质粒、病毒、噬菌体或噬菌粒),其包含用于在宿主细胞中修饰宿主细菌细胞(例如致病性细菌细胞,诸如以上描述)的基因组或病毒(例如噬菌体)的基因组的靶标序列的工程改造的crispr阵列,
(a)其中所述crispr阵列包含一个或多个用于表达crrna(例如作为grna提供)的序列和用于在宿主细胞中序列转录的启动子;
(b)其中所述crrna能够与靶标序列杂交,以在宿主细胞内指导cas(例如cas核酸酶)以修饰靶标序列;
(c)其中所述阵列由转座子包含,所述转座子能够在不同物种的第一和第二细菌细胞之间水平转移。
在第五种配置中,本发明提供了:-
工程改造的核酸载体,其包含可动遗传元件(mge)或由其组成,其中所述mge包含转移起点(orit)和用于修饰宿主细胞(例如致病性细菌细胞)的基因组或宿主细胞中的病毒(例如前噬菌体)的基因组的靶标序列的crispr阵列,
(a)其中所述crispr阵列包含一个或多个用于表达crrna的序列和用于在宿主细胞中序列转录的启动子;
(b)其中所述crrna能够与靶标序列杂交,以在宿主细胞内指导cas(例如cas核酸酶)以修饰靶标序列;
(c)其中所述载体能够在以下之间转移:(i)第一宿主细胞的第一和第二核酸位置之间,其中每个位置为染色体或质粒上的位置,并且所述靶标序列由宿主细胞包含,或(ii)第一和第二宿主细胞之间,其中靶标序列由第一和/或第二宿主细胞包含。
在第六种配置中,本发明提供了:-
控制工业或家用系统中基底的微生物影响的腐蚀(mic)或生物污损的方法,其中基底的表面与介导基底的mic或生物污损的第一微生物物种的第一宿主细胞群体接触,所述方法包括
(i)使群体与多种能够转化或转导细胞的载体接触,每种载体包含crispr阵列,由此crispr阵列被引入宿主细胞中,其中
(a)每种crispr阵列包含一个或多个用于表达crrna的核苷酸序列和用于在宿主细胞中序列转录的启动子;和
(b)每种crrna能够与宿主细胞的靶标序列杂交,以在宿主细胞内指导cas(例如cas核酸酶)以修饰靶标序列(例如以切割靶标序列);所述靶标序列为介导宿主细胞活力的基因序列;和
(ii)允许所述crna在宿主细胞中在cas存在的情况下表达,由此修饰宿主细胞内的靶标序列,导致宿主细胞活力减小并控制所述基底的mic或生物污损。
在另一个实施方案中,提供了:-
控制由原油、天然气或石化产品回收、加工、储存或运输设备包含的基底微生物影响的腐蚀(mic)或生物污损的方法,其中基底的表面与第一宿主细胞的群体接触,其中第一宿主细胞为介导基底的mic或生物污损的第一物种的硫或硫酸盐还原细菌(srb)、胞外聚合物产生细菌(epsb)、产酸细菌(apb)、硫或硫化物氧化细菌(sob)、铁氧化细菌(iob)、锰氧化细菌(mob)、产氨细菌(ampb)或产乙酸细菌(acpb),其中所述表面和细胞群体与选自海水、淡水、压裂液或井中液体的液体接触,所述方法包括:
(i)通过混合液体与多种能够转化或转导第一宿主细胞的载体,使细胞群体与载体接触,每种载体包含crispr阵列,由此crispr阵列被引入宿主细胞中,其中
(a)每种crispr阵列包含一个或多个用于表达crrna的序列和用于在宿主细胞中序列转录的启动子;
(b)每种crrna能够与宿主细胞的靶标序列杂交,以在宿主细胞内指导cas(例如cas核酸酶)以修饰靶标序列(例如切割靶标序列);所述靶标序列为用于介导宿主细胞活力的基因序列;
(c)其中每种(a)的序列包含用于在第一宿主细胞中表达和产生相应crrna的序列r1-s1-r1’,其中r1为第一crispr重复区,r1’为第二crispr重复区,且r1或r1’为任选的;且s1为第一crispr间隔区,其包含与所述第一宿主细胞的靶标序列具有80%或更多同一性的核苷酸序列或由其组成;和
(ii)允许所述crna在宿主细胞中在cas存在的情况下进行表达,由此在宿主细胞内修饰靶标序列,导致宿主细胞活力减小并控制所述基底的mic或生物污损。
其他实施方案提供了:-
用于所述方法中的载体,其中第一细胞为硫酸盐还原细菌(srb)细胞,例如脱硫弧菌属或脱硫肠状菌属细胞,所述载体包含一种或多种用于靶向srb的crispr阵列,其中每种阵列如在(a)-(c)中所定义。
在另一个实施方案中,提供了:控制工业或家用系统中的流体的微生物污损的方法,其中所述流体包含介导所述生物污损的第一微生物物种的第一宿主细胞的群体,所述方法包括
(i)使所述群体与多种能够转化或转导细胞的载体接触,每种载体包含crispr阵列,由此crispr阵列被引入宿主细胞中,其中
(a)每种crispr阵列包含一个或多个用于表达crrna的核苷酸序列和用于在宿主细胞中序列转录的启动子;和
(b)每种crrna能够与宿主细胞的靶标序列杂交,以在宿主细胞内指导cas(例如cas核酸酶)以修饰靶标序列(例如切割靶标序列);所述靶标序列为用于介导宿主细胞活力的基因序列;和
(ii)允许所述crna在宿主细胞中在cas存在的情况下进行表达,由此在宿主细胞内修饰靶标序列,导致宿主细胞活力减小并控制所述生物污损。
例如,提供了:控制船舶或船只的压载水的细菌生物污损的方法,其中所述水包含介导所述生物污损的第一微生物物种的第一宿主细胞的群体,所述方法包括
(i)使所述群体与多种能够转化或转导细胞的载体接触,每种载体包含crispr阵列,由此crispr阵列被引入宿主细胞中,其中
(a)每种crispr阵列包含一个或多个用于表达crrna的序列和用于在宿主细胞中序列转录的启动子;和
(b)每种crrna能够与宿主细胞的靶标序列杂交,以指导宿主细胞内的cas(例如cas核酸酶)以修饰靶标序列(例如切割靶标序列);所述靶标序列为介导宿主细胞活力的基因序列;和
(ii)允许所述crna在宿主细胞中在cas存在的情况下进行表达,由此在宿主细胞内修饰靶标序列,导致宿主细胞活力减小并控制所述生物污损。
其他实施方案提供了:包含crispr阵列的压载海水(例如海水或集装箱中的海水样品),其中压载水通过所述方法得到或可得到。包含压载海水的船舶、船只、海运集装箱或钻井平台。用于所述方法中的载体,其中第一细胞为霍乱(例如弧菌属,例如o1或o139)、大肠杆菌或肠球菌物种细胞,所述载体包含一种或多种用于靶向细胞的crispr阵列,其中每种阵列如在所述方法的(a)和(b)中所定义。
本发明还提供了适合用于该第六种配置中或用于其他应用诸如用于医疗用途或者用于食品或饮料处理的载体和crispr阵列。为此,提供了:用于引入细菌宿主细胞的包含crispr阵列的载体,其中所述细菌能够经水传播,其中
(a)所述crispr阵列包含用于表达crrna的序列和用于在所述宿主细胞中的序列转录的启动子;
(b)所述crrna能够与宿主细胞靶标序列杂交,以在宿主细胞内指导cas(例如cas核酸酶)以修饰靶标序列(例如切割靶标序列);所述靶标序列为用于介导宿主细胞活力的核苷酸序列;
(c)其中(a)的序列包含用于表达和产生crrna的序列r1-s1-r1’,其中r1为第一crispr重复区,r1’为第二crispr重复区,且r1或r1’为任选的;且s1为第一crispr间隔区,其包含与宿主细胞靶标序列具有80%或更多同一性的核苷酸序列或由其组成。
还提供了:包含多种此类载体的水或食品处理组合物。用于在人中治疗或预防细菌感染(例如霍乱弧菌感染)的药物,所述药物包含多种这样的载体。本发明还提供了细菌群体、组合物、食品和饮料。例如,食品或饮料为乳制品。
在第七种配置中,本发明提供了:-
在第一个方面:-
修饰编码第一cas的可表达基因的方法,所述方法包括:
(a)在从所述基因表达的第一cas存在的情况下使指导rna(grna1)与cas基因组合;和
(b)允许grna1与所述cas基因的序列(例如启动子或其第一cas编码dna序列)杂交,并将第一cas指导至所述基因,由此cas修饰cas基因。
例如用于所述方法中的第一核酸载体或载体的组合,其中
(a)第一载体或所述组合的载体包含编码指导rna(grna1,例如单链grna)的可表达核苷酸序列,所述指导rna与预定的前间隔区序列(ps1)互补,用于指导第一cas在第一位点(cs1)修饰ps1,其中ps1为与第一cas同源的邻接pam(p1);或者可表达序列编码与tracrrna一起形成grna1的crrna;和
(b)ps1和p1为可表达的第一cas编码基因的序列,并且ps1能够在cs1被第一cas修饰。
本发明的这些方面对于例如在细胞或体外调节cas活性是有用的。本发明涉及靶向cas编码基因以限制cas活性,这对于cas的暂时调节是有利的。本发明也可用于其中增加cas活性严格性为期望的环境下,例如在修饰细胞基因组时减少脱靶cas切割的机会。例如在修饰人、动物或植物细胞应用时,例如对于细胞或包含细胞的组织或生物体的基因疗法或基因靶向的脱靶效应应最大限度地减小或者避免。例如,当采用cas修饰在人细胞(例如ips细胞)中进行期望的改变时(其被施用于患者用于基因疗法或者用于在人中治疗或预防疾病或病症),需要非常高的严格性。本公开提供了这些应用作为本发明的方法和产物的部分。
本发明也解决了载体,特别是病毒载体中插入能力有限的问题。
因此,本发明的第八种配置提供了:-
包含编码crispr/cas系统的组分的多于1.4kb外源性dna序列的核酸载体,其中所述序列包含用于在宿主细胞(本文的任一种细胞,例如人、动物或者细菌或古细菌宿主细胞)表达一种或多种hm-或pm-crrna或grna的工程改造的阵列或工程改造的序列(任选地如本文所述),其中所述阵列或工程改造的序列不包含编码cas核酸酶、与crna(s)或grna(s)同源的核苷酸序列;任选地其中至少2、3或4种crna或grna由外源性dna编码。
包含多于1.4kb或多于4.2kb外源性dna序列的核酸载体,其中外源性dna编码crispr/cas系统的一种或多种组分,并且包含用于在宿主细胞表达一种或多种hm-crrna或grna的工程改造的阵列或序列(例如本文描述的任何这种工程改造的阵列或序列),其中外源性序列没有编码cas核酸酶、与crna(s)或grna(s)同源的核苷酸序列;任选地其中至少2种不同的crna或grna由外源性dna编码。
本发明的第九种配置提供了:-
修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
(a)将微生物群细菌的混合群体与编码cas核酸酶和宿主修饰(hm)crrna的多种载体组合,和
(b)在宿主细胞中表达载体-编码的cas和hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与载体-编码的cas一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas核酸酶指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例。
本发明的第十种配置提供了:-
修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
(a)将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
(b)在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,
其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中所述方法将宿主细胞群体生长降低至少5倍、10倍、100倍、1000倍、10000倍、100000倍或1000000倍。
本发明的第十一种配置提供了:-
修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
(a)将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
(b)在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中所述方法抑制表面上的宿主细胞群体生长。
本发明的第十二种配置提供了:-
修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
(a)将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
(b)在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中所述第一物种具有编码16s核糖体rna的dna序列,其与宿主细胞物种的编码16s核糖体rna的dna序列具有至少80%同一性,其中所述混合细菌中的第一细菌的生长不被所述hm-系统抑制。
本发明的第十三种配置提供了:-
修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
(a)将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
(b)在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中步骤(a)的混合群体包含第三细菌物种。
本发明的第十四种配置提供了:-
修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
(a)将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
(b)在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中步骤(a)的混合群体包含与宿主细胞相同物种的细菌细胞的另外的亚群,其中所述另外的亚群的细菌细胞不包含所述靶标序列。
本发明的第十五种配置提供了:-
修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
(a)将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
(b)在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中每个宿主细胞包含多个所述靶标序列。
本发明的第十六种配置提供了:-
修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
(a)将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
(b)在宿主细胞中表达hm-crrna,
其中在宿主细胞中诱导cas表达,由此在宿主细胞中组合所述表达的cas和hm-crrna;
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例。
本发明的第十七种配置提供了:-
修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
(a)将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
(b)在宿主细胞中诱导hm-crrna的产生,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中在所述宿主细胞中可诱导从工程改造的核酸序列表达rna用于产生hm-crna,且所述工程改造的序列和cas形成hm-crispr/cas系统,所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例。
本发明的第十八种配置提供了:-
修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
(a)将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
(b)在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例。
本发明的第十九种配置提供了:-
能够转化细菌宿主细胞的载体,其中所述载体能够容纳以下的插入:(i)在所述宿主细胞中可表达的化脓性链球菌cas9核苷酸序列和(ii)任选地,至少一种本发明的编码hm-crrna的工程改造的核酸序列,所述载体用于本发明的方法中,其中当所述载体包含(i)(和任选地(ii))时,所述载体能够转化宿主细胞并表达cas(和任选地至少一种hm-crrna(例如,grna)。
本发明的第二十种配置提供了:-
多种细菌宿主细胞,其各自包含本发明的载体,其中载体-编码的cas(和任选地所述hmcrrna)在所述宿主细胞中表达或可表达,其中所述细菌细胞由微生物群细菌的混合群体包含,所述混合群体包含第一亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体(所述多种细菌宿主细胞),其中所述第二物种是与所述第一微生物群物种不同的物种。
本发明的第二十一种配置提供了:-
指导的核酸酶,其经程序化以识别宿主细菌或古细菌细胞的靶标核苷酸序列,由此所述程序化的核酸酶能够修饰所述核苷酸序列,任选地,其中所述核苷酸序列由靶基因包含,所述靶基因由宿主细胞中的σ因子介导的基因表达级联包含。
在一个方面,所述核酸酶是cas核酸酶,且
(a)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与seqidno:273的氨基酸序列具有至少70%同一性,或者由与seqidno:738或738或274的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:273的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与选自seqidno:138-209的重复序列和包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam一起操作;或
(b)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与seqidno:261或263的氨基酸序列具有至少70%同一性,或者由与seqidno:262或264的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:261或263的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与选自seqidno:210-213的重复序列和包含awg、例如aag、agg、gag或atg或由其组成的pam一起操作;或
(c)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与seqidno:265的氨基酸序列具有至少70%同一性,或者由与seqidno:266的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:265的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与选自seqidno:215-218的重复序列和包含nnagaaw、nggng或aw(例如aa、at或ag)或由其组成的pam一起操作;或
(d)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与seqidno:267或269的氨基酸序列具有至少70%同一性,或者由与seqidno:268或270的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:267或269的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与重复序列seqidno:214一起操作。
本发明的第二十二种配置提供了:-
治疗人或非人动物受试者中的梭菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含梭菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述梭菌物种,
各宿主细胞包含
(a)包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,
所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是选自seqidno:138-209(或与其具有至少70%同一性的序列)的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中所述系统任选地包含tracrrna序列或表达tracrrna序列的dna序列;
其中表达的hm-crrna与cascadecas和包含seqidno:273的氨基酸序列或由seqidno:738或274的核苷酸序列编码的cas3或其直向同源物或同源物组合,
其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的梭菌感染。
用于杀死宿主细胞或减少宿主细胞的生长的宿主修饰(hm)-cr1spr/cas系统,其中所述宿主细胞是梭菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(i)一个或多个重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam的紧邻3’;
(b)cascadecas;和
(c)cas3或用于在宿主细胞中表达cas3的编码cas3的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
用于所述系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam的紧邻3’。
本发明的第二十三种配置提供了:-
治疗人或非人动物受试者中的大肠杆菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含多种大肠杆菌宿主细胞的细胞的第二亚群,其中所述第一物种不是大肠杆菌,
各宿主细胞包含
(a)包含awg(例如,aag、agg、gag或atg)或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,
所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是选自seqidno:210-213的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中所述系统任选地包含tracrrna序列或表达tracrrna序列的dna序列;
其中表达的hm-crrna与cascadecas和包含seqidno:261或263的氨基酸序列或由seqidno:262或264的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的大肠杆菌感染。
用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是大肠杆菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(i)一个或多个重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含awg或由其组成的pam的紧邻3’;
(b)cascadecas;和
(c)cas3或用于在宿主细胞中表达cas3的编码cas3的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
用于所述系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3包含选自seqidno:261、263和287-289的氨基酸序列,或由包含seqidno:262或264的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:210-213和514-731的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含awg或由其组成的pam的紧邻3’。
本发明的第二十四种配置提供了:-
治疗人或非人动物受试者中的链球菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含链球菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述链球菌物种,
各宿主细胞包含
(a)包含nnagaaw、nggng或aw(例如,aa、at或ag)或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,
所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是选自seqidno:215-218的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中所述系统任选地包含tracrrna序列或表达tracrrna序列的dna序列;
其中表达的hm-crrna与cascadecas和包含seqidno:265的氨基酸序列或由seqidno:266的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的链球菌感染。
用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是链球菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,任选地其中所述重复序列是选自seqidno:215-218的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含nnagaaw、nggng或aw或由其组成的pam的紧邻3’;
(b)cascadecas;和
(c)任选地包含seqidno:265的氨基酸序列的cas3,或用于在宿主细胞中表达cas3(任选地包含seqidno:266)的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
用于所述系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3任选地包含seqidno:265的氨基酸序列,或由任选地包含seqidno:266的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,任选地其中所述重复序列是选自seqidno:215-218的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含nnagaaw、nggng或aw或由其组成的pam的紧邻3’。
本发明的第二十五种配置提供了:-
治疗人或非人动物受试者中的沙门氏菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含沙门氏菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述沙门氏菌物种,
各宿主细胞包含
(a)pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,
所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是seqidno:214;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中所述系统任选地包含tracrrna序列或表达tracrrna序列的dna序列;
其中表达的hm-crrna与cascadecas和包含seqidno:267或269的氨基酸序列或由seqidno:268或270的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的沙门氏菌感染。
用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是沙门氏菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,任选地其中所述重复序列是seqidno:214;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列;
(b)cascadecas;和
(c)任选地包含seqidno:267或269的氨基酸序列的cas3,或用于在宿主细胞中表达cas3的核苷酸序列(任选地包含seqidno:268或270),或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
用于所述系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3任选地包含seqidno:267或269的氨基酸序列,或由任选地包含seqidno:268或270的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,任选地其中所述重复序列是seqidno:214;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列。
本发明还提供了用于这样的方法中,例如用于治疗或预防人或动物受试者中的宿主细胞感染的系统、工程改造的核苷酸序列和多种细菌载体细胞。
本文在任何配置中,例如crna(s)由一种或多种单一指导rna(grna)提供,并且在这种情况下“crispr阵列”可以是指一种或多种编码所述grna(s)的可表达核苷酸序列。因此,所述序列能够在用于在细胞内表达grna(s)的宿主细胞内表达。
本发明主要就细菌而言进行描述,但是其也可进行必要的变更适用于古细菌。
在一个实例中,关于一种本文配置的任何特征,与本发明的不同配置组合,在本文的一个或多个方面中可能包含这种组合。
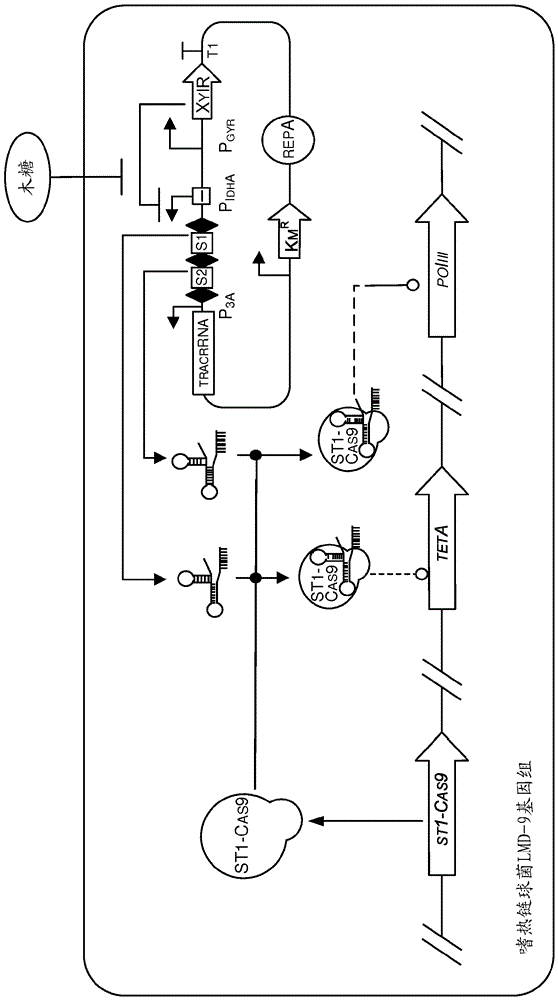
附图简述
图1显示木糖诱导系统。
图2显示st1-crispr阵列。
图3显示在该项工作中使用的菌株在th-琼脂上的斑点检测。所有菌株在37℃下在th-琼脂上生长20小时。对大肠杆菌、乳酸乳球菌和变形链球菌一式两份,和对嗜热链球菌的两种菌株一式三份,对过夜培养物进行连续稀释,以计数单个菌落。
图4a-4c显示嗜热链球菌、变形链球菌、乳酸乳球菌和大肠杆菌在不同培养条件下的选择性生长。四环素不能用于使嗜热链球菌lmd-9选择性生长。然而,3gl-1的pea被证明使嗜热链球菌lmd-9选择性生长,同时限制大肠杆菌的生长。
图4a显示共生肠道细菌。图4b显示靶标物种的亲缘关系,且图4c显示靶标物种。
图5a-5c举例说明两个木糖诱导盒的构造(图5b和5c基于图5a中举例说明的野生型巨大芽孢杆菌操纵子。(xie等人.2013)。图5b:基于野生型巨大芽胞杆菌操纵子(左侧)构建两种木糖诱导盒(中间,右侧)。(xie等人,2013)。
图6证实含质粒pbav1kt5-xylr-mcherry-pldha的嗜热链球菌lmd-9的木糖诱导盒的表征。随着木糖的量增加可观察到明显的荧光反应。
图7说明以pbav1kt5-xylr-mcherry-pldha+xyla设计crispr阵列。阵列含有2个在诱导型木糖启动子下靶向嗜热链球菌基因和在强组成型启动子p3a下靶向tracrrna的间隔序列。
图8a-8b显示嗜热链球菌lmd-9用质粒pbav1kt5-xylr-mcherry-pldha+xyla)(图8a)和用pbav1kt5-xylr-crispr-pxyla(图8b)的转化效率。
图9显示木糖诱导型crispr装置的示意图。在木糖诱导时,靶向嗜热链球菌lmd-9基因组的poliii和teta两者的crispr阵列被表达。与组成型表达的tracrrna一起,与cas9形成复合物。该复合物在嗜热链球菌lmd-9基因组的teta和poliii基因中引入双链断裂,导致细胞活力受限。
图10a-10d显示具有质粒pbav1kt5-xylr-crispr-pxyla(图10a和10c)或pbav1kt5-xylr-crispr-pldha+xyla(图10b和10d)的嗜热链球菌dsm20617(t)的生长抑制。未诱导的(图10a和10b)和诱导的(图10c和10d)。孵育63h后拍摄照片。左下角为菌落计数(上面一行:>1000,>1000,底下一行:336,113)。
图11显示嗜热链球菌、乳酸乳球菌和大肠杆菌的16s序列的最大似然系统发生树。
图12a-12f显示含有pbav1kt5-xylr-crispr-pxyla或pbav1kt5-xylr-crispr-pldha+xyla质粒的大肠杆菌、乳酸乳球菌和嗜热链球菌的共同培养物中的选择性嗜热链球菌生长抑制。在含有pbav1kt5-xylr-crispr-pxyla或pbav1kt5-xylr-crispr-pldha+xyla质粒的大肠杆菌之间没有观察到生长差异(图12b和12e)。然而,嗜热链球菌(在用2.5gl-1pea补充的th琼脂上选择性生长,图12c和12f)显示正如我们预期的那样,在pbav1kt5-xylr-crispr-pxyla(强)或pbav1kt5-xylr-crispr-pldha+xyla(弱)质粒之间转化效率降低。我们因此证明了细胞混合群体中靶嗜热链球菌亚群的选择性生长抑制。左下角为菌落计数(上面一行:>1000,>1000,68,底下一行:>1000,>1000,32)。
图13显示控制spcas9和靶向核糖体rna亚基16s的自靶向sgrna的表达的调节剂。
图14显示外源crispr-cas系统对大肠杆菌菌株的特异性靶向。sgrna靶向k-12衍生的大肠杆菌菌株(如大肠杆菌top10)的基因组,而另一种测试菌株未受影响。
图15显示用在该研究中使用的单个细菌物种的系列稀释物和未诱导crispr-cas9系统的th琼脂中的混合培养物的斑点测定。
图16显示稀释物103在不同选择性培养基上的斑点测定。具有2.5gl-1pea的th是单独的枯草芽孢杆菌的选择性培养基。用麦芽糖补充的macconkey是一种选择性和差异的细菌培养基,其经设计以选择性分离革兰氏阴性和肠道杆菌,并将它们基于麦芽糖发酵进行区分。因此,top10δmalk突变体在板上产生白色菌落,而nissle产生粉红色菌落;a是大肠杆菌δmalk,b是大肠杆菌nissile,c是枯草芽孢杆菌,d是乳酸乳球菌,e是混合培养物;macconkey-/b和e的图像显示为粉红色;macconkey+/b和e的图像显示为粉红色。
图17显示在该研究中使用的细菌在不同培养基和选择性板上的选择性生长。
图18显示转接合体艰难梭菌的完全杀死。显示使用grna编码crispr阵列完全精确地杀死艰难梭菌,所述grna编码crispr阵列通过结合质粒作为载体从益生菌载体细菌物种递送。含有载体的载体细菌(大肠杆菌供体菌株与艰难梭菌交配,其在递送设计的阵列后被杀死。这利用艰难梭菌的内源性cas3机制。实现了对梭状芽胞杆菌细胞的100%杀死,并且显示于该图中。
详述
抑制微生物群体生长和改变微生物比例
本发明涉及用于抑制细菌群体生长或改变细菌混合群体中的第一和第二种细菌亚群的相对比例,例如改变人类或动物微生物组,诸如改变人类微生物群中拟杆菌门(例如拟杆菌属)、厚壁菌门和/或革兰氏阳性或阴性细菌的比例的方法、用途、系统、阵列、crna、grna和载体。参见例如本文描述的第一-第三种配置。本发明例如涉及修饰宿主细菌细胞、例如拟杆菌门细胞或厚壁菌门细胞的一种或多种靶标核苷酸序列。
已有多项研究指出,两种主要肠道门类(拟杆菌门和厚壁菌门)的相应水平与人类和无菌小鼠两者的肥胖相关。研究的作者推断碳水化合物代谢是重要因素。他们观察到肥胖个体的微生物群为厚壁菌门的细菌富集更多,和拟杆菌门富集较少,并且他们推测这种细菌混合体在自给定的饮食获取能量方面比精瘦个体的微生物群(其比例相反)更有效。在一些研究中,他们发现当肥胖个体减肥,并且进一步当肥胖小鼠的微生物群转移到无菌小鼠时,拟杆菌门的相对丰度增加,这些小鼠比接受精瘦小鼠微生物群的对照组获得更多脂肪。参见例如,turnbaugh,p.j.,r.e.ley,m.a.mahowald,v.magrini,e.r.mardis,andj.i.gordon.2006,"anobesity-associatedgutmicrobiomewithincreasedcapacityforenergyharvest",nature444:1027–1131。
概念
本发明提供了涉及宿主细胞靶标的以下概念:-
1.宿主修饰(hm)crispr/cas系统用于杀死细菌宿主细胞或减少细菌宿主细胞的生长的用途,对于每种宿主细胞,所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列,所述hm-crrna包含与宿主细胞靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的靶标序列;
其中所述cas核酸酶对所述宿主细胞是内源的;且其中所述靶标序列被cas修饰,由此杀死宿主细胞或减少宿主细胞生长。
概念1可替代地提供了:
宿主修饰(hm)crispr/cas系统用于改变细菌的混合群体中的第一和第二细菌的亚群的相对比例的用途,所述第二细菌包含宿主细胞,对于每种宿主细胞,所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列,所述hm-crrna包含与宿主细胞靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的靶标序列;其中任选地所述cas核酸酶对所述宿主细胞是内源的;且其中所述靶标序列被cas修饰,由此杀死宿主细胞或减少宿主细胞生长。
概念1还提供了:用于改变细菌的混合群体中的第一和第二细菌的亚群的相对比例的方法,所述第二细菌包含宿主细胞,且所述方法包括组合混合群体与宿主修饰(hm)crispr/cas系统,由此杀死第二细菌宿主细胞或减少所述细胞的生长,由此改变所述比例,其中对于每种宿主细胞,所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列,所述hm-crrna包含与宿主细胞靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的靶标序列;
其中任选地所述cas核酸酶对所述宿主细胞是内源的;且
其中所述靶标序列被cas修饰,由此杀死宿主细胞或减少宿主细胞生长。
概念1还提供了:-
宿主修饰(hm)crispr/cas系统用于改变细菌的混合群体中的第一和第二细菌的亚群的相对比例的用途,所述第二细菌包含多种宿主细胞,每种包含靶标前间隔区序列,对于每种宿主细胞,所述系统包含以上定义的组分(ii)和(iii),所述系统进一步包含至少一种编码cas核酸酶的核酸序列;其中所述组分(ii)和所述cas编码序列由至少一种转化宿主细胞的核酸载体包含,由此由(i)编码的hm-crrna将cas指导至靶标以修饰宿主细胞中的靶标序列;
其中所述cas核酸酶对所述宿主细胞是内源的;且其中所述靶标序列被cas修饰,由此杀死宿主细胞或减少宿主细胞生长。
在一个实施方案中,第一细菌的生长不受抑制;或者所述宿主细胞的生长抑制为第一细胞生长抑制的至少2x、3x、4x、5x、6x、7x、8x、9x、10x、50x、100x或1000x。生长抑制可作为抑制倍数或作为抑制百分比计算(如本文所述)。在另一个实例中,抑制在培养样品中通过分光光度计测量,其中在预定的crrna/grna处理时段开始和结束时测定吸光度(例如在od600)(当通过倍数或百分比测定抑制时参见这样时段的描述)。在一个实例中,宿主细胞样品的吸光度增加(比较预定时段开始时的吸光度与所述时段结束时的吸光度)少于对照样品(其没有暴露于所述crna或grna),例如前者的增加比后者低至少10、100、1000、10000或100000倍(例如作为od600测定)。在一个实例中,在每个样品的中期指数生长阶段(例如预定时段开始后6-7小时)进行生长抑制测定(即预定时段结束)。
在一个实例中,所述宿主细胞由微生物群群体包含,所述微生物群群体由生物体或环境(例如,水路微生物群、水微生物群、人或动物肠道微生物群、人或动物口腔微生物群、人或动物阴道微生物群、人或动物皮肤或毛发微生物群或人或动物腋窝微生物群)包含,所述群体包含与所述生物体或环境共栖或共生的第一细菌和包含所述宿主细胞的第二细菌,其中所述宿主细胞对所述生物体或环境有害(例如,致病)。在一个实施方案中,所述群体是离体的。
第一细菌亚群与第二细菌亚群的比例增加。
概念1还提供了用于抑制宿主细胞生长的用途,如下面进一步描述。
2.用于修饰宿主细胞的靶标核苷酸序列的宿主修饰(hm)crispr/cas系统(例如,用于概念1的用途),所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列,所述hm-crrna包含能够与宿主靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或用于表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种可以转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的靶标序列;
其中任选地组分(i)对所述宿主细胞是内源的。
在一个替代方案中,hm-crrna和tracrrna由单一指导rna(grna)包含。
通过利用内源性cas核酸酶,本发明的实施方案使用内源性cas核酸酶活性(即不需要之前的宿主细胞基因修饰来活化或增强核酸酶活性)。因此,在一个实例中,cas核酸酶由宿主细胞的野生型基因编码。在一个实例中,核酸酶是活性的,以至于不需抑制宿主细胞内的内源性cas核酸酶(或cas核酸酶基因)阻遏物即实现细胞杀伤或生长下降。因此,本发明不需之前的操控即可解决野生型细菌群体带来有效的cas介导的细胞杀伤或生长下降。因此,当群体在其野生环境(诸如水路或由人类或动物微生物组(microbiome)包含)中时,群体可暴露于crna。
在一个实例中,第二细菌为拟杆菌门(例如拟杆菌属)细胞。在一个实例中,第二细菌为厚壁菌门细胞。所述用途、系统或方法例如用于改变肠道微生物群群体(例如体外或体内)中的比例,其例如用于治疗或预防体重增加或肥胖症(例如其中第二细菌为厚壁菌门细胞)。
在一个实例中,所述用途、方法、系统、载体、工程改造的核苷酸序列、crna或grna用于治疗性或预防性再平衡人或非人动物的微生物群(包含混合群体),例如用于治疗或预防肥胖症、糖尿病、炎症性肠病(ibd)、胃肠道病况或口腔病况。
在一个实例中,本文提及的微生物群为人或动物微生物组(例如肠道、阴道、头皮、腋窝、皮肤血流、喉咙或口腔微生物组)的微生物群。
在一个实例中,本文提及的微生物群为腋窝微生物群,并且所述用途、方法、系统、载体、工程改造的核苷酸序列、crna或grna用于预防或减少人的体味。
在一个实例中,所述宿主细胞群体或混合群体由用于人食用的饮料或水(例如水道或饮用水)含有。
在一个实例中,所述用途、方法、系统、载体、工程改造的核苷酸序列、crna或grna用于减少致病性感染或者用于再平衡肠道或口腔微生物群,例如用于治疗或预防人或动物中的肥胖症或疾病。例如,所述用途、方法、系统、载体、工程改造的核苷酸序列、crna或grna用于敲低肠道微生物群中的艰难梭菌细菌。
在一个实例中,第一细菌为拟杆菌属细菌且第二细菌为厚壁菌门或致病性细菌、例如肠道细菌。在一个实例中,宿主细胞或第二细菌为厚壁菌门细胞,例如选自链球菌属(例如嗜热链球菌和/或化脓性链球菌)、芽孢杆菌属、乳杆菌属、李斯特氏菌属、梭菌属、太阳杆菌属和葡萄球菌属细胞。在一个实例中,所述混合群体含有拟杆菌属和耐甲硝哒唑(mtz)的艰难梭菌菌株630亚群,其中所述宿主细胞包含所述艰难梭菌细胞。
在一个实例中,所述宿主细胞群体、混合群体或系统由用于施用于人或非人动物的组合物(例如饮料、漱口水或食品)包含,用于栖居和再平衡其肠道或口腔微生物群。
在一个实例中,所述用途或方法、或系统、载体、工程改造的核苷酸序列、crna或grna的产物用于通过黏膜、肠道、口腔、鼻内、直肠内、阴道内、眼或颊施用来施用于人或非人动物。
在本文的任何配置的实例中,所述混合群体(在与阵列、grna、crrna或工程改造的序列组合之前)为人或动物受试者的微生物群,例如肠道或本文公开的任何其他微生物群或本文公开的任何微生物组的微生物群的样品。在一个实例中,在这种情况下,本发明的用途的产物为可用于如本文公开的人或动物受试者的治疗或疗法的修饰的微生物群群体。
3.概念2的系统,其中所述一种或多种载体缺乏cas(例如,cas9)核酸酶编码序列。
4.任一前述概念的用途、方法或系统,其中每种宿主细胞是人微生物群中发现的菌株或物种的,任选地其中所述宿主细胞与不同菌株或物种的细胞混合,其中不同细胞是肠杆菌科或人(例如,在人肠道中)益生菌的、共栖的或共生的细菌。在一个实例中,所述宿主细胞是厚壁菌门、例如链球菌属细胞。
5.任一前述概念的用途、方法或系统,其用于改变混合细菌群体(例如在人,诸如在人微生物群)中的拟杆菌门(例如拟杆菌属)细菌的比例。
6.概念5的用途、方法或系统,其用于增加拟杆菌相比于厚壁菌门的相对比例。
7.任一前述概念的用途、方法或系统,其中所述cas核酸酶由所述细胞的内源ii型crispr/cas系统提供。
8.任一前述概念的用途、方法或系统,其中组分(iii)对所述宿主细胞是内源的。
9.任一前述概念的用途、方法或系统,其中所述靶标序列由宿主细胞的抗生素抗性基因、毒力基因或必需基因包含。
10.任一前述概念的用途、方法或系统,所述阵列由抗生素组合物包含,其中所述阵列与抗生素剂组合。
11.任一前述概念的用途、方法或系统,其中可替代地hm-crrna和tracrrna由单一指导rna(grna)包含,例如由载体提供。
12.任一前述概念的用途、方法或系统,所述宿主细胞包含具有编码目标hm-序列的游离端(hm-dna)的脱氧核糖核酸链和/或其中所述系统包含编码hm-dna的序列,其中所述hm-dna包含分别与用于将hm-dna插入宿主基因组(例如插入染色体或附加体位点)的靶标序列中或其侧翼的一个或多个序列同源的一个或多个序列。
13.用于修饰包含内源性crispr/cas系统的细菌宿主细胞的工程改造的核酸载体,所述载体
(a)包含用于根据任一前述概念的crispr/cas系统、方法或用途中的表达多种不同crrna(例如grna)的核酸序列;和
(b)任选地缺乏编码cas核酸酶的核酸序列,
其中第一所述crrna能够与所述宿主细胞内的第一核酸序列杂交;且第二所述crrna能够与所述宿主细胞内的第二核酸序列杂交,其中所述第二序列不同于所述第一序列;且
(c)第一序列由抗生素抗性基因(或其rna)包含且第二序列由抗生素抗性基因(或其rna)包含;任选地其中所述基因是不同的;
(d)第一序列由抗生素抗性基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含;
(e)第一序列由必需基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含;或
(f)第一序列由毒力基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含。
14.包含一种或多种cas的宿主细胞内的概念13的载体,所述cas可与由载体编码的crna(例如,单一指导rna)一起操作。
15.任一前述概念的用途、方法、系统或载体,其中所述hm-crispr阵列包含多个拷贝的相同间隔区。
16.任一前述概念的用途、方法、系统或载体,其中所述载体包含多个hm-crispr阵列。
17.任一前述概念的用途、方法、系统或载体,其中每种载体是质粒、粘粒、病毒、病毒粒子、噬菌体、噬菌粒或原噬菌体。
18.任一前述概念的用途、方法、系统或载体,其中所述系统或载体包含两个、三个或更多个拷贝的编码crrna(例如,grna)的核酸序列,其中所述拷贝包含用于靶向宿主细胞序列(例如,毒力、抗性或必需基因)的相同间隔区序列。
19.概念18的用途、方法、系统或载体,其中所述拷贝在两个或更多个载体crispr阵列之间分割(split)。
20.包含任一前述概念中记载的系统或载体的细菌宿主细胞。
21.概念2至20中任一项的系统、载体或细胞,其与抗生素药剂(例如,β-内酰胺抗生素)组合。
22.任一前述概念的用途、方法、系统、载体或细胞,其中所述或每种宿主细胞是葡萄球菌属、链球菌属、假单胞菌属、沙门氏菌属、李斯特氏菌属、大肠杆菌、脱硫弧菌属或梭菌属宿主细胞。在一个实例中,所述或每种宿主细胞是厚壁菌门细胞,例如葡萄球菌属、链球菌属、李斯特氏菌属或梭菌属细胞。
在一个实例中,每种crispr阵列包含用于在宿主细胞中表达和产生相应crrna(例如由单一指导rna包含)的序列r1-s1-r1',(i)其中r1为第一crispr重复区,r1'为第二crispr重复区,且r1或r1'为任选的;和(ii)s1为第一crispr间隔区,其包含与所述靶标序列具有95%或更多同一性的核苷酸序列或由其组成。
在一个实例中,r1和r1'分别与第二宿主细胞物种的crispr阵列的第一和第二重复序列具有至少95%同一性。在一个实例中,r1和r1'分别与所述物种,例如所述物种的所述宿主细胞的crispr阵列的第一(最5'端)和第二(紧邻第一重复区的3'的重复区)重复序列具有至少95%(例如96、97、98、99或100%)同一性。在一个实例中,r1和r1'具有ii型cas9核酸酶(例如嗜热链球菌、化脓性链球菌或金黄色葡萄球菌cas9)修饰所述宿主细胞内的靶标的功能。
本发明的替代概念1用途提供了以下用途,如经工作实验实施例证实的那样:
细菌宿主细胞群体抑制群体生长的野生型内源性cas核酸酶活性的用途,其中每种宿主细胞具有含有野生型cas核酸酶活性的内源性crispr/cas系统,所述用途包括转化群体的宿主细胞,其中每种转化的宿主细胞用工程改造的核苷酸序列转化,用于提供宿主细胞内的宿主修饰(hm)crna或指导rna(grna),hm-crna或grna包含能够与宿主细胞靶标前间隔区序列杂交的序列,以将内源性cas指导至靶标,其中crna或grna与具有所述野生型核酸酶活性的宿主细胞的内源性cas核酸酶同源,并且在转化宿主细胞后群体的生长受到抑制。
在以下工作实施例中,解决了固体表面细菌群体(革兰氏阳性厚壁菌门)的抑制。实现了>10倍的宿主细胞群体生长抑制。靶向针对抗生素抗性基因和必需基因。本发明将可用于抑制抗生素抗性细菌的生长,其中靶标序列是抗生素抗性基因的序列。在一个实例中,共同施用工程改造的核苷酸序列与抗生素可能是有效的。这可在人或动物受试者中提供宿主细胞感染的更完全的治疗或预防和/或使得能够减少用于施用于人或动物的治疗有效的抗生素剂量。鉴于关于抗生素的过量施用和在人和动物群体中出现耐药性的日益增加的担忧,这是有用的。
在其中本发明用于在人或动物受试者治疗或预防由如本文公开的微生物群介导或引起的疾病或病况的实施方案中,证明本发明抑制表面宿主细胞生长的能力是重要和期望的。这种微生物群一般地与受试者的组织(例如肠道、口腔、肺、腋窝、眼、阴道、肛门、耳、鼻或喉组织)接触,并因此我们相信证实了抑制表面微生物群细菌物种(以链球菌属为例)生长的活性支持了这种用途。
在一个实例中,使用野生型宿主细胞内源性cas9或cfp1活性。工程改造的核苷酸序列不能与外源性cas核酸酶编码序列组合。
在一个实例中,所述宿主细胞为野生型(例如非工程改造的)细菌细胞。在另一个实例中,所述宿主细胞为工程改造的(诸如染色体引入外源性核苷酸序列或修饰内源性核苷酸序列,例如在宿主细胞的染色体或质粒上),且其中宿主细胞包含具有野生型cas核酸酶活性的内源性crispr/cas系统,其可与crrna或grna一起操作。在一个实例中,在所述转化后所述宿主细胞的细菌菌落形成受到抑制。在一个实例中,在所述转化后宿主细胞的增殖受到抑制。在一个实例中,在所述转化后宿主细胞被杀伤。
所谓“与……同源”意欲内源性cas可由crrna或grna序列操作而被指导至宿主细胞内的靶标。技术人员(skilledaddressee)应理解,这种cas指导通常为细菌细胞中crispr/cas活性的特征,例如具有内源性活性野生型crispr/cas系统的细菌细胞中野生型crispr/cas活性。
所谓“野生型”cas活性意欲(就像对技术人员显而易见的那样)内源性cas不是工程改造cas,或者细胞尚未工程改造以对内源性cas活性去阻遏。这与其中cas核酸酶活性被天然阻遏的某些细菌形成对比(即没有野生型cas核酸酶活性或者对本发明没有任何用处,其相反适用于原位处理野生型宿主细胞,例如当可利用内源性cas活性影响细胞群体生长抑制时)。
在一个实例中,宿主细胞群体生长的抑制与未暴露于所述工程改造的核苷酸序列的所述宿主细胞的生长相比为至少2、3、4、5、6、7、8、9或10倍。例如,生长抑制通过以下表明,即与第二宿主细胞样品(单独或以混合细菌群体存在)的细菌菌落数相比,第一宿主细胞样品(单独或以混合细菌群体存在)的菌落数低至少2、3、4、5、6、7、8、9或10倍,其中第一细胞已用所述工程改造的核苷酸序列转化,但是第二样品没有暴露于所述工程改造的核苷酸序列。在一个实施方案中,在第一样品已暴露于工程改造的序列后12、24、36或48小时测定菌落计数。在一个实施方案中,菌落在固体琼脂上体外(例如petri培养皿中)生长。因此,应该理解,生长抑制可通过包含靶标序列的细胞或群体生长的减少(与未处理即对照组样品生长相比<100%生长)来表明,或者可完全消除这种生长。在一个实例中,宿主细胞群体的生长减少至少10、20、30、40、50、60、70、80、90或95%,即经预定的时间段(例如与宿主细胞内crna或grna组合后24小时后48小时),即宿主细胞群体的生长比没有暴露于所述crna或grna,但除此之外已在相同条件下保持所述预定的持续时间段的对照组宿主细胞群体的生长低至少这样的百分比。在一个实例中,通过比较所述时间段结束时(例如在对照组样品的中期指数生长阶段时)每一个群体样品中的菌落数,测定生长的百分比减少。例如,在时间零时使受试群体暴露于crrna或grna后,取受试和对照组群体的样品,并将每一个样品铺板在琼脂板上,且在相同条件下孵育所述预定的时间。在这段时间结束时,计数每个样品的菌落数和百分数差(即受试组菌落数除以对照组菌落数,并然后乘以100,然后自100减去该结果,得到生长百分比减少)。通过对照组菌落数除以受试组菌落数计算倍数差异。
因此可通过群体中宿主细胞数增殖的减少指示群体生长的抑制。这可能是由于细胞被核酸酶和/或由于宿主细胞增殖(分裂和/或细胞生长)通过靶标前间隔区序列上核酸酶的作用下调而杀伤。在如本文公开的治疗或预防的一个实施方案中,人或动物受试者的宿主细胞负担减少,要治疗(例如减少或消除)或预防(即受试者出现疾病或病况的风险)的疾病或病况由此被减少或消除。
本发明可用于靶向在环境(例如在水或水道、冷却或加热设备中)中自然发现、由饮料和食品(或用于制造、加工或储存这些的设备)包含的野生型细菌群体,或者由人类或动物微生物群包含的野生型细菌群体。因此,本发明在宿主细胞预修饰使其接受杀伤或生长抑制作用不可能或不合需要时(例如当期望原位治疗肠道或受试者其他部位的微生物群时)发现具有用途。在另一种应用中,本发明发现用于活体外产生用于施用于人或动物受试者治疗或预防由宿主细胞引起或介导的疾病或病况的药物的用途,其中药物包含修饰的混合细菌群体(例如获得自一个或多个人类供体的粪便或肠道微生物群),其为本发明用途或方法的产物,其中所述群体包含不同于宿主细胞物种或菌株的物种或菌株的细菌亚群。前者亚群细胞不包含靶标,且因此不被用途或方法修饰。因此,例如,所述方法可用于减少混合群体中特定厚壁菌门亚群的比例和保留(spare)拟杆菌门,例如用于产生治疗或预防本文公开的代谢性或者gi病况或疾病的药物。这样,本发明可提供修饰的细菌移植物(例如修饰的粪便移植物)药物,用于这种用途或用于在人或动物的所述治疗或预防。例如,所述方法可用于体外修饰一种或多种微生物群,以产生用于施用于人或动物用于医疗用途(例如治疗或预防代谢性病况(诸如肥胖症或糖尿病)或胃肠道病况(例如本文提及的任何这种病况)或癌症(例如胃肠道癌症))或用于化妆品或个人卫生用途(例如用于人类局部使用,例如用于通过局部用于人的腋窝或人的其他相关部位减少腋窝或其他身体气味)的修饰的细菌集合。在另一个实例中,所述阵列、crrna、grna或工程改造的核苷酸序列被施用于人或动物,并且宿主细胞由人或动物含有,例如由人或动物的微生物群(诸如肠道微生物群或本文公开的任何其他类型的微生物群)包含。以该方式,由宿主细胞介导或引起的疾病或病况可得到治疗或预防。在一个实例中,所述转化在体外实施,并且任选地,所述阵列、crrna、grna或工程改造的核苷酸序列由电穿孔入宿主细胞中的核酸包含。在一个实例中,核酸为rna(例如grna的拷贝)。在另一个实例中,核酸为编码crrna或grna用于其在宿主细胞内表达的dna。
因此,在一个实例中,本发明提供了工程改造的核苷酸序列,用于在由人或动物受试者的微生物群包含的野生型细菌宿主细胞群体中提供宿主细胞修饰(hm)crna或指导rna(grna),用于治疗或预防由受试者的微生物群宿主细胞介导或引起的疾病或病况,所述crna或grna包含能够与宿主细胞靶标前间隔区序列杂交用于将cas指导至靶标的序列,其中crna或grna与具有野生型核酸酶活性的内源性宿主细胞cas核酸酶同源,其中以下群体的宿主细胞生长的转化受到抑制,并且所述疾病或病况得到治疗或预防。
在一个实例中,工程改造的核苷酸序列包含如本文所定义的hm-crispr阵列。在一个实例中,工程改造的核苷酸序列编码单一指导rna。在一个实例中,工程改造的核苷酸序列为指导rna(例如单一指导rna)或crrna。在一个实例中,工程改造的序列由能够感染宿主细胞的细菌噬菌体包含,其中转化包括宿主细胞被细菌噬菌体转导。细菌噬菌体可为如本文描述的细菌噬菌体。在一个实例中,工程改造的核苷酸序列由能够转化宿主细胞的质粒(例如接合质粒)包含。质粒可为如本文描述的质粒。在一个实例中,工程改造的核苷酸序列由能够转移至宿主细胞和/或在宿主细胞之间转移的转座子包含。转座子可为如本文描述的转座子。
本发明的任何用途或方法可包括用核酸载体转化宿主细胞,用于在细胞中产生crna或grna。例如,包含工程改造的核苷酸序列的载体或核酸口服、静脉内、局部、眼、鼻内、通过吸入、通过直肠施用、耳内、通过阴道施用或通过本文公开的任何其他施用途径或以其他方式施用于包含混合细菌群体的人或动物(例如作为人或动物微生物群的部分),其中所述施用用载体或核酸转化宿主细胞。
在一个实例中,宿主细胞群体为离体的。在一个实例中,混合群体由人或动物受试者包含,并且受试者中的宿主细胞感染得到治疗或预防。
在一个实例中,第一和第二细菌由其中细菌共生的微生物菌群包含。在一个实例中,联合体为人或动物微生物群;在一个实例中联合体由人或动物包含(例如其中所述用途、系统、工程改造的序列、载体或细胞用于治疗人或动物中的联合体的宿主细胞引起的感染,例如,其中所述宿主细胞介导或引起人或动物中的抗生素抗性或有害的疾病或病况)。以下工作实施例中使用的物种(大肠杆菌、乳酸乳球菌和嗜热链球菌)是在人类和动物肠道微生物群共生共存的菌株。实施例也解决混合革兰氏阳性和革兰氏阴性细菌群体中的靶向。另外,实施例解决厚壁菌门(嗜热链球菌)群体和肠杆菌科(大肠杆菌)群体,其两者发现于人类微生物群。肠杆菌科的其他实例为沙门氏菌属、鼠疫耶尔森氏菌、克雷伯氏菌属、志贺氏菌属、变形杆菌属、肠杆菌科、沙雷氏菌属和枸橼酸杆菌属。
在一个实例中,所述方法、用途、工程改造的核苷酸序列、阵列、crrna、grna、载体或系统用于治疗人肠道微生物群群体中的宿主细胞感染,任选地所述群体也包含作为人共栖肠道细菌和/或肠杆菌科的第一细菌,例如,其中所述宿主细胞和共栖细胞(第一和第二细菌)在人肠道微生物群中共生。
在一个实例中,所述用途或系统用于改变包含拟杆菌门细菌和其他细菌的混合细菌群体中的拟杆菌门细菌的比例。例如,用于增加群体中拟杆菌门相比于一种、两种或所有厚壁菌门(例如相比于链球菌属)的相对比例。在这种情况下,所述宿主细胞可为包含靶标的厚壁菌门细胞。在一个实例中,所述群体为由人或动物受试者包含的微生物群的细菌群体,并且所述方法、用途、工程改造的核苷酸序列、阵列、载体或系统用于(i)在受试者中治疗由所述宿主细胞包含的(例如由混合群体包含的)感染;(ii)在受试者中治疗或预防由所述宿主细胞介导的病况或疾病;(iii)减少由所述宿主细胞引起或介导的人的体味;或者(iv)人的个人卫生处理。在一个实例中,本发明的工程改造的核苷酸序列、阵列、crrna、grna或载体用于这样的本发明的系统或用途。
在一个实例中,病况或疾病为代谢性或胃肠道疾病或病况,例如肥胖症、ibd、ibs、克罗恩氏病或溃疡性结肠炎。在一个实例中,病况或疾病为癌症,例如实体瘤或胃肠道(gi)癌症(例如胃癌)、肝癌或前列腺癌。在一个实例中,病况为对抗生素(例如本文公开的任何抗生素)抗性或反应减少。
在一个实例中,所述细胞包含内源性rna酶iii,其在细胞中产生所述hm-crrna中,可由组分(ii)操纵。在一个替代方案中,一种或多种载体包含编码这种rna酶iii,用于在宿主细胞内表达rna酶iii的核苷酸序列。
在一个实例中,必需基因(包含靶标)编码细胞的dna聚合酶。这在以下举例说明。
在所述用途、系统、载体或细胞的一个实例中,阵列、crna或grna包含能够与宿主细胞靶标前间隔区序列的序列杂交,其邻近ngg、nag、nga、ngc、nggng、nngrrt或nnagaaw前间隔区序列邻近基序(pam),例如,aaagaaa或taagaaapam(这些序列被写成5'-3')。在一个实施方案中,pam紧邻前间隔区序列的3'末端。在一个实例中,cas为金黄色葡萄球菌、嗜热链球菌或化脓性链球菌cas。在一个实例中,cas为cpf1和/或pam为ttn或cta。
在一个实例中,工程改造的核苷酸序列、crna、grna或阵列与抗生素组合,例如,其中靶标由抗生素抗性基因包含,其中抗生素为所述药物。在一个实施方案中,宿主细胞对抗生素敏感。例如,对使用消除宿主细胞(例如在包含所述群体的人或制造容器/设备中)存在的感染的抗生素敏感性可能不足,但抗生素可抑制或减少宿主细胞亚群的大小或生长,同时使用根据本发明的cas修饰(例如靶标切割)实现进一步杀死或抑制生长。
本发明提供了用途、系统、阵列、crna、grna、工程改造的核苷酸序列、载体或细胞,用于在人或动物受试者中所述宿主细胞感染的抗生素(第一抗生素)治疗的方法,其中抗生素抗性基因(对第一抗生素抗性的)为通过宿主细胞内的系统或载体cas靶向,其中所述方法包括向受试者施用所述系统、阵列、crna、grna、工程改造的核苷酸序列、载体或细胞和抗生素。基因被下调,即宿主细胞中的基因编码的蛋白产物的表达减少或消除,由此抗生素抗性被下调。感染在受试者体内被减少或预防。在一个实例中,所述抗生素与所述系统、阵列、crna、grna、工程改造的核苷酸序列、载体或细胞同时施用;在另一个实例中,所述施用是依次的(例如抗生素在系统、阵列、crna、grna、工程改造的核苷酸序列、载体或细胞之前)。本发明的该特征可用于增强受试者中的抗生素治疗,例如,当单独的抗生素对治疗这样的宿主细胞感染不是完全有效时。抗生素可为本文公开的任何抗生素,例如四环素。
在一个实例中,每种工程改造的核苷酸序列或载体包含所述crispr阵列或编码所述crrna或grna的序列,并且进一步包含抗生素抗性基因(例如卡那霉素抗性),其中hm-crrna或grna不靶向抗生素抗性基因。在一个实例中,靶标序列由宿主细胞的抗生素抗性基因包含,其中抗生素不同于第一抗生素(例如卡那霉素)。这样,所述系统、工程改造的序列或载体能够靶向没有靶向其自身的宿主。通过使宿主细胞暴露于第一抗生素,可通过正选择压力促进其中的工程改造的序列或载体保留,因为含有第一抗生素抗性基因的细胞在第一抗生素存在的情况下具有存活优势(当宿主细胞未被工程改造的序列或载体转化时,它们对第一抗生素没有抗性)。因此,一个实例提供:本发明的用途,其包括使宿主细胞或混合群体暴露于所述抗生素(例如卡那霉素)和所述工程改造的序列或载体,用于促进crrna或grna编码序列保持在宿主细胞内;或者本发明的系统、工程改造的序列、阵列或载体与所述抗生素组合。
在一个实例中,编码crna或grna的序列或组分(ii)在宿主细胞物种可操作的组成型启动子(例如强启动子)或诱导型启动子下。在一个实例中,组分(iii)在宿主细胞物种可操作的组成型启动子或诱导型启动子下。
在一个实例中,所述或每种宿主细胞为革兰氏阳性细胞。在另一个实例中,所述或每种宿主细胞为革兰氏阳性菌细胞。
在一个实例中,所述方法、用途、系统、工程改造的序列或载体用于治疗人类肠道微生物群群体的宿主细胞感染,任选地所述群体包含人类共栖肠道细菌(即与人类共栖的肠道细菌)。
在所述方法、用途、系统、阵列、crna、grna、工程改造的序列或载体的一个实例中,所述宿主细胞由人或动物受试者包含的混合细菌群体包含,并且所述方法、用途、系统、阵列、crna、grna、工程改造的序列或载体用于(i)在受试者治疗混合群体包含的所述宿主细胞的感染;(ii)在受试者中治疗或预防所述宿主细胞介导的病况或疾病;(iii)减少所述宿主细胞引起或介导的人的体味;或(iv)人的个人卫生处理。
在所述方法、用途、系统、阵列、crna、grna、工程改造的序列或载体的一个实例中,用于体外处理工业或医用流体、固体表面、装置或容器(例如用于食品、消费品、化妆品、个人健康护理产品、石油或石油生产);或者用于处理水道、水、饮料、食品或化妆品,其中宿主细胞由流体、表面、装置、容器、水道、水、饮料、食品或化妆品包含或在其上。
本发明还提供了:可通过本文的任一概念的用途或方法获得的离体细菌混合群体。
在一个实例中,所述用途或方法的混合群体或产物在用于医疗或营养用途的容器中。例如,容器为灭菌容器,例如,吸入器或连接于注射器或iv针头。
在一个实例中,所述用途或方法的产物群体用于施用于人或动物以栖居其微生物组。
本发明提供了:用于人或非人动物食用的食品或饮料,其包含所述用途或方法的群体产物。
本文中,在任何配置、概念或方面的一个实例中,拟杆菌属为选自以下的物种:粪便拟杆菌、多毛拟杆菌、解纤维素拟杆菌、coprocola、嗜粪拟杆菌、coprosuis、狄氏拟杆菌、多雷拟杆菌、埃氏拟杆菌、faecis、finegoldii、fluxus、脆弱拟杆菌、肠道拟杆菌、产黑素拟杆菌、nordii、oleiciplenus、口腔拟杆菌、卵形拟杆菌、嗜果胶拟杆菌、蓝斑拟杆菌、粪便拟杆菌、多形拟杆菌、单形拟杆菌、普通拟杆菌和木糖降解拟杆菌。例如,拟杆菌属为多形拟杆菌,例如,其中所述宿主细胞或混合群体是离体或体外的肠道微生物群群体。在一个实例中,所述宿主细胞、第一或第二细胞亚群包含多种不同的拟杆菌属物种、或多物种杆菌属物种(例如包含多形拟杆菌和脆弱拟杆菌)、或类杆菌属和普雷沃菌属物种。在此,在一个实例中,普雷沃菌属为选自bergensis、二路普雷沃尔菌、颊普雷沃菌、口颊普雷沃菌、粪便普雷沃菌、产黑色普雷沃菌、口部普雷沃菌、栖瘤胃普雷沃菌、谭氏普雷沃菌、timonensis和真口腔普雷沃菌的物种。在一个替代方案中,所述宿主细胞、第一或第二细菌是厚壁菌门细胞。在一个实例中,所述宿主细胞、第一或第二亚群包含一种或多种选自以下的厚壁菌门或由其组成:厌氧棍状菌属、厌氧醋菌属、醋香肠菌属、醋弧菌属、厌氧球菌属、厌氧细杆菌属、厌氧弯曲杆菌属、anaerostipes、anaerovorax、丁酸弧菌属、梭菌属、粪球菌属、脱卤素杆菌属、小杆菌属、多利菌属(dorea)、肠球菌属、产乙醇杆菌属、栖粪杆菌属、梭形杆菌属、gracilibacter、guggenheimella、hespellia、毛形杆菌属、毛螺菌属、乳杆菌属、明串珠菌属、巨单胞菌属、moryella、光冈菌属、oribacterium、产醋杆菌属、帕匹杆菌属、丙酸螺菌属、假丁酸弧菌属、假支杆菌属、罗氏菌属、瘤胃球菌属、八叠球菌属、清野氏菌属、shuttleworthia、孢杆菌属(sporobacter)、生孢杆菌属、链球菌属、罕见小球菌属、互营球菌属、耐热芽孢杆菌属、图利杆菌属和魏斯氏菌属。在一个实例中,所述宿主细胞或第一或第二亚群由梭菌属细胞组成(和任选地其他亚群由拟杆菌属(例如多形拟杆菌)细胞组成)。在一个实例中,所述宿主细胞或第一或第二亚群由肠球菌属细胞组成(和任选地其他亚群由拟杆菌属(例如多形拟杆菌)细胞组成)。在一个实例中,所述宿主细胞或第一或第二亚群由瘤胃球菌属细胞组成(和任选地其他亚群由拟杆菌属(例如多形拟杆菌)细胞组成)。在一个实例中,所述宿主细胞或第一或第二亚群由链球菌属细胞组成(和任选地其他亚群由拟杆菌属(例如多形拟杆菌)细胞组成)。在一个实例中,所述宿主细胞或第一或第二亚群由栖粪杆菌属细胞组成(和任选地其他亚群由拟杆菌属(例如多形拟杆菌)细胞组成)。例如,栖粪杆菌属是普雷沃氏粪杆菌(例如a2-165、l2-6、m21/2或sl3/3)。
在一个实例中,所述宿主细胞或所述第一或第二亚群包含一种或多种选自以下的厚壁菌门或由其组成:厌氧棍状菌属、厌氧醋菌属、醋香肠菌属、醋弧菌属、厌氧球菌属、厌氧细杆菌属、厌氧弯曲杆菌属、anaerostipes、anaerovorax、丁酸弧菌属、梭菌属、粪球菌属、脱卤素杆菌属、小杆菌属、多利菌属(dorea)、肠球菌属、产乙醇杆菌属、栖粪杆菌属、梭形杆菌属、gracilibacter、guggenheimella、hespellia、毛形杆菌属、毛螺菌属、乳杆菌属、明串珠菌属、巨单胞菌属、moryella、光冈菌属、oribacterium、产醋杆菌属、帕匹杆菌属、丙酸螺菌属、假丁酸弧菌属、假支杆菌属、罗氏菌属、瘤胃球菌属、八叠球菌属、清野氏菌属、shuttleworthia、孢杆菌属(sporobacter)、生孢杆菌属、链球菌属、罕见小球菌属、互营球菌属、耐热芽孢杆菌属、图利杆菌属和魏斯氏菌属。在一个实例中,所述宿主细胞或所述第一或第二亚群由梭菌属(例如,艰难梭菌)细胞组成(且任选地其他亚群由拟杆菌属(例如,多形拟杆菌)细胞组成)。在一个实例中,所述宿主细胞或第一或第二亚群由肠球菌属细胞组成(和任选地其他亚群由拟杆菌属(例如多形拟杆菌)细胞组成)。在一个实例中,所述宿主细胞或第一或第二亚群由瘤胃球菌属细胞组成(和任选地其他亚群由拟杆菌属(例如多形拟杆菌)细胞组成)。在一个实例中,所述宿主细胞或第一或第二亚群由链球菌属细胞组成(和任选地其他亚群由拟杆菌属(例如多形拟杆菌)和/或肠杆菌科(例如大肠杆菌)细胞组成)。在一个实例中,所述宿主细胞或第一或第二亚群由栖粪杆菌属细胞组成(和任选地其他亚群由拟杆菌属(例如多形拟杆菌)细胞组成)。在一个实例中,宿主细胞或第一或第二亚群由链球菌属细胞(任选地嗜热链球菌和/或化脓性链球菌细胞)组成且其他亚群由拟杆菌属(例如多形拟杆菌)和/或肠杆菌科(例如大肠杆菌)细胞组成。
在一个实施方案中,本发明的用途或方法的群体产物用于通过粘膜、肠道、口服、鼻内、直肠内、阴道内、眼或颊施用来施用于人或非人动物。
任选地,所述宿主细胞或第一或第二亚群细菌为脆弱拟杆菌细菌且群体由水含有。
包含本发明的阵列、系统、工程改造的序列、载体或grna的合适饮料为例如益生菌饮料,例如适合的养乐多(商标)、actimel(商标)、kevita(商标)、activia(商标)、jarrow(商标)或类似的用于人食用的饮料。
噬菌体序列靶标
在本发明的方面,靶标序列为感染宿主细菌细胞的噬菌体序列。如通过本发明实现的期望的噬菌体基因组修饰,不仅涉及噬菌体杀死或敲低,而且相反可为宿主细胞内期望的噬菌体基因或调节元件活化(例如当噬菌体表达与宿主细胞活力或增殖增加有关的期望的蛋白或其他产物时)。或者,修饰可为诱导型噬菌体基因表达调节,例如利用靶向噬菌体靶标位点的本发明的诱导型cas。在一个实施方案中,本发明提供了通过在宿主细胞内用cas核酸酶切割来修饰噬菌体靶标位点。由于各种原因这可为有用的,例如:-
a.使靶标位点突变以活化或使其失活(例如用于基因敲低或使反宿主基因失活;或者用于在噬菌体靶标被整合到宿主染色体时杀死宿主细胞);
b.缺失靶标序列或包含靶标序列的更大序列(例如当本发明与靶向噬菌体基因组中的间隔位点的第一和第二pm-crrna一起使用时,其中每个位点的切割导致在切割之间的噬菌体核酸缺失);
c.将期望的pm-dna序列插入宿主细胞基因组中(例如通过在宿主核酸中提供一种或多种pm-crna指导的切割,用于期望的pm-dna的同源重组插入)。
本发明提供了以下方面:-
用于改变包含亚群的细菌的混合群体中的第一和第二细菌的所述亚群的相对比例的方法,其中第一细菌为宿主细胞(例如拟杆菌门宿主细胞)(其中第一细菌任选地被噬菌体感染且第二细菌未被所述噬菌体(或未被拟杆菌门)感染),所述方法包括使混合的群体与多种载体在一个或多个步骤中组合,用于将载体核酸(例如其含pm的转座子)引入宿主细胞中,并允许混合群体中的细菌生长,其中所述第一和第二细菌的相对比例被改变;
其中每种载体包含工程改造的噬菌体修饰(pm)crispr阵列,用于引入宿主细胞内修饰细胞内的靶标核苷酸序列(例如所述噬菌体的),
(a)其中pm-crispr阵列包含一个或多个分别用于表达pm-crrna的序列和用于宿主细胞内序列转录的启动子;和
(b)其中pm-crrna能够与靶标序列杂交,以指导宿主细胞内的cas(例如cas核酸酶)以修饰靶标序列。
通过靶向噬菌体序列以使噬菌体活力、传播或感染性需要的基因失活,在一方面,本发明提供了具有可促进其被噬菌体感染的宿主细胞摄取和保留的积极的选择性优势的阵列。当宿主细胞被杀死或生长减少时,群体中的第一与第二细菌的相对比例减少。本发明提供这样的产物群体,例如用作用于在人或动物受试者中治疗或预防疾病或病况(减小风险)的药物,其中药物被施用于受试者。所述疾病或病况可为本文公开的任何疾病或病况。在一个实例中,单一指导rna(grna)在宿主细胞内表达,以提供crrna,并且每种载体包含编码这样的grna的可表达的工程改造的核苷酸序列。
在使用pm-阵列的一个实例中,靶标序列为多形拟杆菌序列。任选地,靶标序列不由脆弱拟杆菌包含。例如当修饰切割或者使得靶标序列非功能性,由此在没有靶向脆弱拟杆菌的情况下增加多形拟杆菌宿主细胞的比例,例如其中混合群体为本文描述的肠道微生物群群体时,这是有用的。脆弱拟杆菌在一些背景下与脓肿有关,并且因此该实例减少这种情况的风险,同时使本发明的比例改变(多形拟杆菌细胞比例增加),这例如对于再平衡肠道微生物群,例如用于治疗或预防肥胖或糖尿病或炎症性肠病(ibd)是有用的。
启动子(或hm-或pm-阵列)在宿主细胞内是可操作的。在一个实例中,启动子为病毒或噬菌体启动子,例如t7启动子。在另一个实例中,启动子为细菌启动子(例如宿主细胞物种的启动子)。
2.方面1的方法,其中第一细菌为拟杆菌属(例如多形拟杆菌或脆弱拟杆菌)、另枝菌属、产碱杆菌属、副拟杆菌属、坦纳菌属、xylanibacter和/或普雷沃菌属细菌。
3.方面1或2的方法,其中第二细菌为厚壁菌门细菌(例如当第一细菌为拟杆菌门或拟杆菌属时)。
4.任一前述方面的方法,其中第一细菌亚群与第二细菌亚群的比例增加,即在实施所述方法之后大于之前。
5.方面4的方法,其中混合群体由用于施用于人或非人动物用于栖居和再平衡其肠道或口腔微生物群的组合物(例如饮料、漱口水或食品)包含,例如,其中所述混合群体是在人或非人动物体外或体内。
6.方面1、2或3的方法,其中第一细菌亚群与第二细菌亚群的比例降低,即在实施所述方法之后小于之前。
7.方面6的方法,其中所述混合群体由用于人类食用的饮料或水(例如水道或饮用水)包含。
8.任一前述方面的方法,其中每种载体为质粒、噬菌体(例如包装的噬菌体)或噬菌粒。
9.方面8的方法,其中每种载体为噬菌体(例如包装的噬菌体),并且通过噬菌体载体核酸转导至宿主细胞,即通过用噬菌体载体感染宿主细胞,将载体核酸引入宿主细胞内。在一个实例中,噬菌体包含一种或多种如本文描述的转座子。
10.方面8的方法,其中每种载体为质粒,并且载体核酸通过从包含载体的细菌转化或水平质粒转移引入宿主细胞。在一个实例中,所述质粒包含一种或多种如本文描述的转座子。在一个实例中,包含载体的细菌为非-拟杆菌门或非-拟杆菌属物种。
另外或可替代地,包含载体的细菌为非-厚壁菌门物种。在一个实例中,含有所述载体的细菌为一种或多种选自以下物种的细菌:乳杆菌属物种(例如嗜酸乳杆菌(例如,la-5、la-14或ncfm)、短乳杆菌、保加利亚乳杆菌、植物乳杆菌、鼠李糖乳杆菌、发酵乳杆菌、高加索乳杆菌、瑞士乳杆菌、乳酸链杆菌、罗伊氏乳杆菌或干酪乳杆菌,例如干酪乳杆菌代田株)、双歧杆菌属物种(例如两歧双歧杆菌、短双歧杆菌、长双歧杆菌或婴儿双岐杆菌)、嗜热链球菌和屎肠球菌。例如,所述细菌为嗜酸乳杆菌或乳酸乳杆菌细菌。
11.用于任一前述方面修饰所述拟杆菌门噬菌体的基因组的方法中的工程改造的拟杆菌门噬菌体修饰(pm)crispr阵列,
(a)其中所述pm-crispr阵列包含一个或多个用于表达pm-crrna的序列和用于在拟杆菌门噬菌体感染的宿主细胞中序列转录的启动子;和
(b)其中所述pm-crrna能够与拟杆菌门噬菌体基因组靶标序列杂交,以在感染的宿主细胞内指导cas(例如cas核酸酶)以修饰靶标序列。
12.用于方面1-10中任一者的方法中的核酸载体(例如质粒、噬菌体或噬菌粒),所述载体包含方面11的pm-crispr阵列。
在本发明的一般实施方案中,或者对于方面12提供了:-
包含工程改造的hm-crispr阵列的核酸载体(例如质粒、病毒、噬菌体或噬菌粒),其用于修饰宿主细菌细胞(例如致病性细菌细胞,诸如以上描述)的基因组或宿主细胞中的病毒(例如噬菌体)的基因组的靶标序列,
(a)其中所述crispr阵列包含一个或多个用于表达crrna的序列和用于在宿主细胞内序列转录的启动子;和
(b)其中所述crrna能够与靶标序列杂交,以指导宿主细胞内的cas(例如cas核酸酶)以修饰靶标序列。
启动子在宿主细胞内是可操作的。在一个实例中,启动子为病毒或噬菌体启动子,例如t7启动子。在另一个实例中,启动子为细菌启动子(例如宿主细胞物种的启动子)。
在一个实例中,所述阵列由本文描述的转座子包含。在一个实例中,所述阵列由本文描述的载体细菌包含。在一个实例中,提供了多种用于靶向噬菌体或宿主细胞的一种或多种靶标核苷酸序列的阵列,其中多种阵列由细菌细胞,例如本文描述的载体、第一受体或第二受体细胞包含。在一个实例中,所述载体细胞由本文描述的饮料(例如用于人食用的益生菌饮料)或食品包含。在一个实例中,所述阵列或载体细菌用于施用于人或非人动物用于治疗或预防人或动物的感染,例如其中宿主细胞为致病性的。在一个实例中,所述阵列或载体细菌用于施用于人或非人动物的肠道,用于治疗或预防人或动物的肥胖症、糖尿病或ibd。
13.方面11或12的阵列或载体,其中所述阵列或载体由细菌细胞,例如用于人或非人动物食用的益生菌细胞包含。
14.任一前述方面的方法、阵列或载体,其中所述载体由第三细菌群体(例如本文描述的载体细菌)包含,其用于与混合群体的所述组合或者用于与混合群体组合,由此载体核酸通过转化(例如通过从第三细菌水平转移质粒载体或转座子至第一细菌宿主细胞)或转导(例如通过第一细菌宿主细胞的噬菌体载体感染)被引入宿主细胞。
15.任一前述方面的方法、阵列或载体,其中所述或每种阵列或载体由人或非人动物肠道共栖或共生细菌细胞(例如本文描述的载体细菌细胞)包含。因此,细胞属于与人或非人动物共栖或共生的肠道细菌物种。
16.方面12-15中任一项的方法或载体,其中所述或每种载体为包含在厚壁菌门宿主细胞或在拟杆菌门噬菌体感染的宿主细胞(例如拟杆菌属细胞)中为可操作的,且任选地在如在方面15中定义的共栖或共生细菌细胞中为可操作的复制起点的质粒、噬菌体或噬菌粒。在一个实例中,复制起点为orit或本文描述的任何其他复制起点。
17.方面12-16中任一项的方法或载体,其中所述或每种载体为包含能够在以下两者之间水平转移的序列(例如本文描述的转座子)的质粒或噬菌粒:(1)不是拟杆菌属细胞的人或非人动物共栖或共生细菌细胞与(2)其为拟杆菌属细胞的所述噬菌体感染的细胞之间;或者(3)不是厚壁菌门细胞的人或非人动物共栖或共生细菌细胞与(4)包含靶标序列的厚壁菌门细胞之间。
18.方面12-17中任一项的方法或载体,其中所述或每种载体为能够在以下两者之间水平转移的质粒或噬菌粒序列(例如本文描述的转座子):(1)作为拟杆菌属细胞的所述噬菌体感染的细胞和(2)适合于益生施用于人或非人动物肠道的细菌细胞之间;或者(3)包含靶标序列的厚壁菌门细胞和(4)适合于益生施用于人或非人动物肠道的细菌细胞之间。
19.方面15-18中任一项的方法或载体,其中共栖、共生或益生菌物种选自以下:乳杆菌属物种(例如嗜酸乳杆菌(例如,la-5、la-14或ncfm)、短乳杆菌、保加利亚乳杆菌、植物乳杆菌、鼠李糖乳杆菌、发酵乳杆菌、高加索乳杆菌、瑞士乳杆菌、乳酸链杆菌、罗伊氏乳杆菌或干酪乳杆菌,例如干酪乳杆菌代田株)、双歧杆菌属物种(例如两歧双歧杆菌、短双歧杆菌、长双歧杆菌或婴儿双岐杆菌)、嗜热链球菌和屎肠球菌。
任一前述方面的方法、阵列或载体,其中所述启动子对于在如在方面15-19中任一项中所定义的所述噬菌体感染的拟杆菌门宿主细胞内和在共栖、共生或益生细菌细胞中;或在如在方面15-19中任一项中所定义的包含靶标序列的厚壁菌门细胞内和在共栖、共生或益生细菌细胞中所述序列的转录是可操作的。例如,所述启动子为病毒或细菌启动子,例如t7启动子。在一个实例中,所述启动子为宿主细胞启动子,例如宿主crispr/cas阵列的启动子。
20.任一前述方面的方法、阵列或载体,或者本文的任何用途,其中修饰为(i)切割靶标序列,(ii)下调包含靶标序列的基因的转录,(iii)上调包含靶标序列的基因的转录,或(iv)添加、缺失或取代靶标处的核酸序列。
21.任一前述方面的方法、阵列或载体,其中拟杆菌门噬菌体为选自crass噬菌体、gb-124噬菌体、ga-17噬菌体、hb-13噬菌体、h16-10噬菌体、b40-8噬菌体和脆弱拟杆菌噬菌体atcc51477-b1的拟杆菌属噬菌体。参考natcommun.2014jul24;5:4498.doi:10.1038/ncomms5498,"ahighlyabundantbacteriophagediscoveredintheunknownsequencesofhumanfaecalmetagenomes",dutilhbe等人。crass噬菌体~97kbp基因组在公开可用的宏基因组中的丰度是所有其他已知噬菌体一起的六倍;其在病毒样颗粒(vlp)衍生的宏基因组和全社群宏基因组中分别占全部读数的最多达90%和22%;并且其总计在公共数据库中占所有的人粪便宏基因组测序读数的1.68%。使用新的共同存在概况分析方法,dutilh等人预测用于这种噬菌体的拟杆菌属宿主,与拟杆菌属相关蛋白同源物和噬菌体基因组中编码的独特碳水化合物结合结构域一致。
22.任一前述方面的方法、阵列或载体,或本文的任何用途,其中靶标序列由宿主细胞感染性、噬菌体溶原性或溶解性周期或噬菌体活力所需的噬菌体基因、例如必需基因或衣壳蛋白基因包含。
23.任一前述方面的方法、阵列或载体,其中靶标序列由bacon(拟杆菌门相关的碳水化合物结合)结构域-编码序列(例如其中宿主为拟杆菌属宿主)或细胞内溶素编码序列包含。参考febslett.2010jun3;584(11):2421-6,doi:10.1016/j.febslet.2010.04.045.epub2010apr21,"miningmetagenomicdatafornoveldomains:bacon,anewcarbohydrate-bindingmodule",mellol等人。在噬菌体结构蛋白中存在bacon结构域可通过提出的细菌噬菌体粘附于粘液模型来解释。根据这种模型,噬菌体通过衣壳展示的碳水化合物结合结构域(诸如免疫球蛋白样折叠或bacon结构域)粘附于构成肠粘液层的粘液糖蛋白,便于与噬菌体感染的细菌更频繁的相互作用。
25.任一前述方面的方法、阵列或载体,或者本文的任何用途,其中所述crispr阵列包含序列r1-s1-r1’,用于宿主细胞内crrna的表达和产生,
(i)其中r1为第一crispr重复区,r1’为第二crispr重复区,且r1或r1’为任选的;和
(ii)s1为包含与所述靶标序列具有95%或更多同一性的核苷酸序列或由其组成的第一crispr间隔区。例如,当本发明的阵列在宿主细胞中时,靶标序列包含前间隔区或由紧邻与cas同源的前间隔区邻近基序(pam)的前间隔区序列包含,其中cas也与从阵列表达的crrna同源。在一个实施方案中,cas对细胞为内源性的。在另一个实例中,cas对宿主细胞为外源性的,例如由本发明的载体提供。
26.方面25的方法、阵列或载体,其中r1和r1’与和宿主细胞相同物种的细胞crispr阵列的重复序列具有至少95%(例如96、97、98、99或100%)同一性。
27.方面25的方法、阵列或载体,其中r1和r1’各自与选自多形拟杆菌和脆弱拟杆菌(例如脆弱拟杆菌nctc9343)的拟杆菌属物种的crispr阵列(例如ii-c型阵列)的重复序列具有至少95%(例如96、97、98、99或100%)同一性,其中宿主细胞包含与重复序列有功能的crispr/cas系统,并且为例如所述物种的拟杆菌属细胞。
28.方面27的方法、阵列或载体,其中r1和r1’分别与所述物种、例如所述物种的所述宿主细胞的crispr阵列的第一(最5’)和第二(第一重复区的紧邻3’的重复区)重复序列具有至少95%(例如96、97、98、99或100%)同一性。在一个实例中,所述阵列为ii-c型阵列。在一个实例中,所述阵列或载体进一步包含r2-s2-r2’,其中间隔区s2与间隔区s1(例如用于靶向宿主细胞或噬菌体基因组中的不同靶标位点)相同或不同,其中r2和r2’在宿主细胞内为功能性的,并且任选地与r1相同。例如,r1、r1’、r2和r2’各自为脆弱拟杆菌crispr重复区。
29.方面25的方法、阵列、用途或载体,其中(iii)r1和r1’各自与拟杆菌属物种细胞的crispr阵列(例如ii-c型阵列)的重复序列相同,其中所述物种选自:粪便拟杆菌、多毛拟杆菌、解纤维素拟杆菌、coprocola拟杆菌、嗜粪拟杆菌、coprosuis拟杆菌、狄氏拟杆菌、多雷拟杆菌、埃氏拟杆菌、faecis拟杆菌、finegoldii拟杆菌、fluxus拟杆菌、脆弱拟杆菌(例如脆弱拟杆菌nctc9343)、肠道拟杆菌、产黑素拟杆菌、nordii拟杆菌、oleiciplenus拟杆菌、口腔拟杆菌、卵形拟杆菌、嗜果胶拟杆菌、蓝斑拟杆菌、粪便拟杆菌、多形拟杆菌、单形拟杆菌、普通拟杆菌和木糖降解拟杆菌,且(iv)其中所述宿主细胞包含与重复序列有功能的crispr/cas系统,并且是选自所述组的物种的拟杆菌属细胞(例如与选择的(iii)的物种相同的物种)。
30.方面25的方法、阵列、用途或载体,其中r1和r1’与用于修饰靶标序列的所述宿主拟杆菌门或厚壁菌门细胞的crispr系统有功能。在一个实例中,r1、r1’、r2和r2’为相同细菌物种、例如拟杆菌属、诸如多形拟杆菌或脆弱拟杆菌或链球菌属、诸如嗜热链球菌或化脓性链球菌的ii型(例如ii-c型)crispr/cas系统重复区。
31.方面25的方法、阵列、用途或载体,其中r1和r1’与拟杆菌门(例如拟杆菌属或普雷沃菌属)或厚壁菌门(例如链球菌属)细胞的crispr阵列(例如ii-c型阵列)的重复序列具有至少95%(例如96、97、98、99或100%)同一性。
32.方面25的方法、阵列、用途或载体,其中r1和r1’各自与选自表2的seqidno:1-5的序列具有至少95%(例如96、97、98、99或100%)同一性,并且任选地第一细菌细胞为例如表2的物种或菌株(例如针对选择的序列列出的物种或菌株)的拟杆菌属细胞。
33.方面25的方法、阵列、用途或载体,其中r1和r1’各自与选自表2的seqidno:6-11序列具有至少95%(例如96、97、98、99或100%)同一性,并且任选地第一细菌细胞为例如表2的物种或菌株(例如针对选择的序列列出的物种或菌株)的普雷沃菌属细胞。
34.任一前述方面的方法、阵列或载体,其中所述或每种阵列与所述宿主细胞中与crrna有功能的一种或多种cas核酸酶组合,以修饰靶标序列。例如靶标序列包含紧邻前间隔区序列邻近基序(pam)的前间隔区序列,任选地其中pam与由拟杆菌门宿主细胞包含的cas核酸酶同源。在一个实例中,cas为ii-c型核酸酶。
35.任一前述方面的方法、阵列或载体,其中所述或每种阵列与编码所述宿主细胞中与crrna有功能的一种或多种cas核酸酶的核酸序列组合,以修饰靶标序列。
36.方面25的方法、阵列、用途或载体,其中r1和r1’与ii型cas9核酸酶(例如化脓性链球菌、嗜热链球菌或金黄色葡萄球菌cas9)有功能,以修饰所述宿主细胞内的靶标,任选地其中所述方法、阵列或载体进一步根据方面34或35,其中所述cas为所述cas9。
37.可通过方面1-10或14-36中任一项的方法获得的离体细菌混合群体或本文的用途。例如,混合群体在用于医疗或营养用途的容器中。例如,容器为灭菌容器。
38.用于施用于人或非人动物用于治疗、预防、化妆品、人或非人动物体重减少(例如化妆品减少)或营养用途的组合物,所述组合物包含方面37的混合群体。在一个实例中,所述组合物用于口服、全身、吸入、直肠内、眼、颊或阴道内施用。在一个实例中,所述组合物用于施用于人或非人动物的肠道或口腔。
39.用于人或非人动物食用的食品或饮料,其包含方面37的混合群体或方面38的组合物。
40.方面39的食品或饮料,其为营养补充剂或益生菌饮料或食品。
41.用于在人或非人动物中或在饮用水治疗(处理)或预防拟杆菌门感染的抗生素组合物,其中所述组合物包含方面11-36中任一项的阵列或载体,任选地其中修饰为根据方面21(iii)或(iv)。
42.用于增加人或非人动物中的肠道拟杆菌门的比例(例如治疗或预防肥胖症、糖尿病)(例如i型糖尿病)或胃肠道炎性病况)的益生菌组合物,其中所述组合物包含方面11-36中任一项的阵列或载体,任选地其中所述修饰根据方面21(iii)或(iv)。
43.方面38、41或42的组合物,其用于增加人或动物中的肠道拟杆菌属与厚壁菌门的相对比例,例如用于治疗或预防肥胖症、糖尿病(例如i型糖尿病)或胃肠道病况(例如克罗恩病、ibd、ibs或溃疡性结肠炎)。
在一个替代方案中,本发明的任何配置中的“阵列”可被编码hm-crrna或grna用于宿主细胞内表达的工程改造的核苷酸序列替换。因此,涉及阵列的本文方面的任一项的特征可在替代方案中进行必要的变更应用于这样的工程改造的序列。
可动遗传元件和crispr系统
44.包含工程改造的crispr阵列的核酸载体(例如质粒、病毒、噬菌体或噬菌粒),其用于在宿主细胞中修饰宿主细菌细胞(例如厚壁菌门或致病性细菌细胞,诸如以上描述)的基因组或病毒(例如噬菌体)的基因组的靶标序列,
(a)其中crispr阵列包含一个或多个用于表达crrna(例如由grna包含)的序列和用于宿主细胞内序列转录的启动子;
(b)其中crrna能够与靶标序列杂交,以在宿主细胞内指导cas(例如cas核酸酶)以修饰靶标序列;
(c)其中所述阵列由其能够在不同物种的第一和第二细菌细胞之间水平转移的转座子包含。
任选地,cas核酸酶为宿主细胞的野生型内源性cas核酸酶。
45.方面44的载体,其中所述阵列用于施用于人或非人动物;且第一细胞物种对人或动物为非致病性的,且第二细胞物种对人或动物为致病性的,其中所述阵列由第一细胞包含。
46.方面45的载体,其中第一细胞物种为与人或动物共栖或共生的物种,例如肠道微生物群物种。
47.方面45或46的载体,其中第一细胞物种选自乳杆菌属物种(例如嗜酸乳杆菌(例如,la-5、la-14或ncfm)、短乳杆菌、保加利亚乳杆菌、植物乳杆菌、鼠李糖乳杆菌、发酵乳杆菌、高加索乳杆菌、瑞士乳杆菌、乳酸链杆菌、罗伊氏乳杆菌或干酪乳杆菌,例如干酪乳杆菌代田株)、双歧杆菌属物种(例如两歧双歧杆菌、短双歧杆菌、长双歧杆菌或婴儿双岐杆菌)、嗜热链球菌和屎肠球菌。
48.方面44-47中任一项的载体,其中所述载体由用于人或动物食用的饮料(例如益生菌饮料)或食品包含。
49.方面44-48中任一项的载体,其中所述载体包含至少一个用于靶向靶标序列的重复区-间隔区-重复区单元,其中重复区与宿主细胞的crispr/cas系统的重复区具有至少95%(例如96、97、98、99或100%)同一性,由此载体的重复区在宿主细胞为可操作的,以指导宿主系统的cas以修饰靶标核苷酸序列。
50.方面49的载体,其中所述载体缺乏cas(例如cas核酸酶)编码序列。
根据本发明的宿主crispr/cas系统的核苷酸序列的靶向可用于除去宿主细胞对载体(例如入侵的病毒)的抗性或减少抗性的出现或增加。例如,本发明由此提供靶向和敲低内源性crispr/cas系统的活性、使得新的载体(例如噬菌体)间隔区获取被抑制的有利条件。
运动的一个特征是存在转移所需的顺式作用区(orit)。该区域为质粒中造成位点和链特异性切口以开始转移事件的dna加工的起始位点。本发明提供了如下采用可动遗传元件(mge)的进一步实施方案:
1.工程改造的核酸载体,其包含可动遗传元件(mge)或由其组成,其中所述mge包含转移起点(orit)和用于修饰宿主细胞(例如致病性细菌细胞)的基因组或宿主细胞中的病毒(例如前噬菌体)的基因组的靶标序列的crispr阵列,
(a)其中所述crispr阵列包含一个或多个用于表达crrna的序列和用于在宿主细胞中序列转录的启动子;
(b)其中所述crrna能够与靶标序列杂交,以在宿主细胞内指导cas(例如cas核酸酶)以修饰靶标序列;
(c)其中所述载体能够在以下之间转移:(i)第一宿主细胞的第一和第二核酸位置之间,其中每个位置为染色体或质粒上的位置,且靶标序列由宿主细胞包含,或(ii)第一和第二宿主细胞之间,其中靶标序列由第一和/或第二宿主细胞包含。
mge的实例为ice、转座子、质粒和细菌噬菌体。转移起点(orit)为含有它的dna在接合期间自细菌宿主到受体转移必需的短序列(例如最多达500bp)。orit为顺式作用-其被发现于正在转移的相同dna上,并且其连同dna一起转移。典型的转移起点包含3个功能定义区:切口区、转移区和终止区。
任选地,所述启动子对所述序列在第一和第二(和任选地第三)细胞中的转录是可操作的。
任选地,所述靶标序列由第二细胞包含。任选地,所述靶标序列不由第二细胞包含。
在一个实例中,所述第一和第二细胞属于不同的细菌物种(例如在人微生物组群体发现的,例如肠道、腋窝、阴道或口腔的物种)。在一个实例中,第一和第二细胞为离体的。在另一个实例中,第一和第二细胞由人肠道、阴道、腋窝或口腔微生物组体内或离体包含。
2.实施方案1的载体,其中所述mge为或包含整合和接合元件(ice)。或者,mge为可动mge(即能够由不由mge携带的基因编码的因子,以被移动)。关于mge的术语“可动的”和“接合的”对技术人员是显而易见的。
参考iceberg数据库(http://db-mml.sjtu.edu.cn/iceberg/),其提供用于本发明的合适ice和合适orit来源的实例。在一个实例中,ice为ice家族的成员,包括选自1-28组(group)的ice,或者orit为以下这样家族成员的orit:1=sxt/r391;2=tn916;3=tn4371;4=ctndot/erl;5=iceclc;6=icebs1;7=icehin1056;8=papi-1;9=icemlsym(r7a);10=icet1;11=spi-7;12=ice6013;13=icekp1;14=tngbs1;15=tn5253;16=icea2603;17=iceye1;18=10270-rd.2;19=tn1207.3;20=tn1806;21=icea5632;22=icef-i/ii;23=iceapg2;24=icem;25=10270-rd.1;26=tn5801;27=ppi-1;28=icef-iii。家族描述见于iceberg数据库。例如,tn916家族由roberts等(2009)(trendsmicrobiol.2009年6月;17(6):251-8.doi:10.1016/j.tim.2009.03.002.2009年5月20日电子出版;"amodularmasteronthemove:thetn916familyofmobilegeneticelements",robertsa,mullanyp)定义。属于tn916家族的元件通过以下标准定义:它们必须具有在roberts等显示的一般组织,并且它们必须具有核心区域(接合和调节模块),其在dna水平上序列和结构与初始tn916相似。例外是一些接合转座子(如tn1549,其先前已分类在该家族)和与在相应参考文献中描述的具有高度蛋白相似性的那些。
3.实施方案2的载体,其中ice为转座子,例如接合转座子。在一个实例中,mge为其在功能性辅助元件存在的情况下可动的可动转座子,任选地其中转座子与所述辅助元件组合。
4.任一前述实施方案的载体,其中所述载体为质粒,任选地其中mge为由质粒包含的转座子。例如转座子为接合转座子。在一个实例中,转座子为可动的转座子(例如使用一种或多种由质粒、例如由质粒的转座子序列外部的基因编码的因子可动的)。任选地,转座子为i型转座子。任选地,转座子为ii型转座子。
5.任一前述实施方案的载体,其中orit在第一和第二宿主细胞为功能性的。这对于促进细菌群体中跨细菌的扩散和传播是有用的,例如当第一和第二细胞属于不同物种时。
6.实施方案5的载体,当被第一细胞包含时,其中第一细胞包含编码对使mge转移至第二细胞是可操作的蛋白的核苷酸序列,其中序列不由mge包含。这可用于对这样的序列避免在mge中采用间隔区。例如,这使得能够构建更紧密的mge用于在细胞之间转移,或者使得能够包含更大或更多的crispr阵列,例如包括多种间隔区以靶向宿主细胞内的相应序列,或者靶向第一和第二宿主细胞内的不同序列。
7.实施方案6的载体,其中序列不由载体包含。这可用于对这样的序列避免在载体或mge中使用间隔区。例如,这使得能够构建更紧密的载体或mge用于在细胞之间转移,或者使得能够包括更大或更多的crispr阵列,例如以包括多种间隔区以靶向宿主细胞内的相应序列,或者靶向第一和第二宿主细胞内的不同序列,和/或包括一种或多种编码cas蛋白(例如cas9)的序列。
8.实施方案6或7的载体,其中序列由第一细胞的接合转座子包含。这是有用的,因为其使得能够利用mge外面的因子以实现接合转位,用于本发明的mge在第一和第二宿主细胞(例如人微生物组的不同细菌物种的)之间水平转移。
9.实施方案8的载体,其中转座子对使mge转移至第二细胞是反式可操作的。这是有用的,因为其使得能够利用mge外面的因子实现接合转位,用于本发明的mge在第一和第二宿主细胞(例如人微生物组的不同细菌物种的)之间水平转移。例如,本发明的mge的orit与由宿主细胞的接合转座子包含的orit相同。这可用于使得本发明的mge能够用由宿主细胞编码的因子操纵,用于实现mge在第一和第二宿主细胞(例如不同物种、例如人微生物组物种的细菌细胞)之间水平转移。这使得mge能够更紧密或释放空间用于如上所讨论的crispr阵列和/或cas基因。
术语“反式可操作的”意味着mge(ice)对于使用从载体核苷酸序列外部的宿主核苷酸序列表达的蛋白(例如通过宿主细胞的接合转座子表达的蛋白)水平转移,以使mge(或整个载体,诸如含有mge的质粒)转移至第二细胞中是可操作的。
10.任一前述实施方案的载体,当由第一细胞包含时,其中mge的orit与由第一细胞的ice包含的orit相同,其中ice对使mge转移至第二细胞中是反式可操作的。
11.任一前述实施方案的载体,其中所述载体orit为拟杆菌门(例如拟杆菌目或拟杆菌属)或普雷沃菌属转座子的orit。当第一和/或第二宿主细胞分别为拟杆菌门(例如拟杆菌目或拟杆菌属)或普雷沃菌属细胞时,这是有用的。例如,第一细胞为这样的物种的细胞且第二细胞为厚壁菌门细胞,靶标序列由第二细胞而不是第一细胞包含,由此crispr阵列在第二细胞内指导cas以切割靶标序列。在一个实例中,靶标序列由第二细胞的必需基因或抗生素抗性基因包含(并且对于后者,任选地载体与所述抗生素组合,或者与所述抗生素组合施用于人或非人动物)。任选地,转座子为ctndot或ctnerl转座子,并且载体与四环素组合,或者与四环素组合施用于人或非人动物。
12.任一前述实施方案的载体,其中所述载体orit为ctndot、ctnerlsxt/r391、tn916或tn4371家族转座子orit。
13.任一前述实施方案的载体,其中mge包含第一和第二末端重复序列及重复序列之间的crispr阵列。
14.任一前述实施方案的载体,其中mge在以下位置留下转座子拷贝:(1)当其已转移至第二位置时,在第一核酸位置;或(2)当其已转移至第二细胞时,在第一细胞中。这对于促进mge在包含宿主细胞的细菌群体中的传播和维持是有用的。在一个替代方案中,mge在以下位置不留下转座子拷贝:(1)当其已转移至第二位置时,在第一核酸位置;或(2)当其已转移至第二细胞时,在第一细胞中。
15.当被第一和/或第二细胞包含(例如载体的第一和第二拷贝由第一和第二细胞包含)时任一前述实施方案的载体。
16.实施方案15的载体,其中第一和第二细胞为不同物种的细胞。例如,第一细胞为乳杆菌属细胞(例如本文描述的)和/或第二细胞为拟杆菌门(例如拟杆菌属细胞,例如本文描述的这种细胞)或厚壁菌门细胞(例如本文描述的这种细胞)。在一个实例中,第一细胞为拟杆菌门(例如拟杆菌属细胞,例如本文描述的这种细胞)且第二细胞为厚壁菌门细胞(例如本文描述的这种细胞),例如用于施用于人的肠道微生物组,用于治疗或预防胃肠道病况或糖尿病,或者用于治疗或预防肥胖症。
17.实施方案15或16的载体,其中第一和第二细胞为细菌或古细菌细胞。
18.实施方案16或17的载体,其中第一细胞在人中为非致病性的(例如共栖或共生的细菌细胞)且任选地第二细胞在人中为致病性的。在一个替代方案中,第二细胞在人中为非致病性细胞。术语“在人中非致病性的”包括细胞,诸如某些细菌物种(例如拟杆菌属物种,诸如脆弱拟杆菌),其可驻留于人的微生物组(例如肠道、阴道、腋窝或口腔微生物组)而没有致病性或显著致病性,但是在人的其他环境中为致病性的。技术人员易于理解,第一细胞类型可保留在人体中或其上,且第二细胞类型应在人体中或其上减少。例如,crispr阵列修饰第二细胞的基因组,以杀死或减少人中或其上的细胞活力或生长。例如,靶标位点由第二细胞包含并且位点被所述cas核酸酶切割,由此使包含靶标位点的基因失活或下调。例如,基因为第二细胞的必需基因或抗生素抗性基因。在一个实例中,基因为毒力基因。
19.任一前述实施方案的载体,或本文的任何用途,其中第二细胞(每种宿主细胞)为选自以下的细胞:(i)金黄色葡萄球菌细胞,例如对选自甲氧西林、耐万古霉素的和替考拉宁的抗生素抗性的;(ii)铜绿假单胞菌细胞,例如对选自头孢菌素类(例如头孢他啶)、碳青霉烯类(例如亚胺培南或美罗培南)、氟喹诺酮类、氨基糖苷类(例如庆大霉素或妥布霉素)和粘菌素的抗生素抗性的;(iii)克雷伯氏菌属(例如肺炎克雷伯氏菌)细胞,例如对碳青霉烯类抗性的;(iv)链球菌属(例如肺炎链球菌或化脓性链球菌)细胞,例如对选自红霉素、克林霉素、β-内酰胺类、大环内酯类、阿莫西林、阿奇霉素和青霉素的抗生素抗性的;(v)沙门氏菌属(例如血清型伤寒沙门氏菌)细胞,例如对选自头孢曲松、阿奇霉素和环丙沙星的抗生素抗性的;(vi)志贺氏菌属细胞,例如对选自环丙沙星和阿奇霉素的抗生素抗性的;(vii)结核分枝杆菌细胞,例如对选自耐异烟肼(inh)、利福平(rmp)、氟喹诺酮类、阿米卡星、卡那霉素和卷曲霉素的抗生素抗性的;(viii)肠球菌属细胞,例如对万古霉素抗性的;(ix)肠杆菌科细胞,例如对选自头孢菌素类和碳青霉烯类的抗生素抗性的;(x)大肠杆菌细胞,例如对选自甲氧苄啶、呋喃妥因、头孢氨苄和阿莫西林的抗生素抗性的;(xi)梭菌属(例如艰难梭菌)细胞,例如对选自氟喹诺酮类抗生素和碳青霉烯类的抗生素抗性的;(xii)淋病奈瑟氏菌细胞,例如对选自头孢克肟(例如口服用头孢菌素类)、头孢曲松(注射用头孢菌素类)、阿奇霉素和四环素的抗生素抗性的;(xiii)鲍曼不动杆菌细胞,例如对选自β-内酰胺类、美罗培南和碳青霉烯类的抗生素抗性的;或(xiv)弯曲杆菌属细胞,例如对选自环丙沙星和阿奇霉素的抗生素抗性的。这样的物种对人类可为致病性的。
20.实施方案19的载体或用途,其中靶标位点由第二细胞的抗生素抗性基因包含,其中抗生素为在实施方案19中记载的相应抗生素。
21.实施方案15-20中任一项的载体,其中第一细胞为拟杆菌门(例如拟杆菌目或拟杆菌属)细胞、乳杆菌属(例如嗜酸菌(例如la-5、la-14或ncfm)、短乳杆菌、保加利亚乳杆菌、植物乳杆菌、鼠李糖乳杆菌、发酵乳杆菌、高加索乳杆菌、瑞士乳杆菌、乳酸乳杆菌、罗伊氏乳杆菌或干酪乳杆菌例如干酪乳杆菌代田株)、双歧杆菌属(例如两歧双歧杆菌、短双歧杆菌、长双歧杆菌或婴儿双歧杆菌)、嗜热链球菌、屎肠球菌、另枝菌属、产碱杆菌属、副拟杆菌属、坦纳菌属或xylanibacter细胞。
22.任一前述实施方案的载体,其中第一和/或第二核酸位置(i)由拟杆菌门(例如拟杆菌目或拟杆菌属)细胞包含;或者第一和/或第二宿主细胞(ii)为拟杆菌门(例如拟杆菌目或拟杆菌属)或普雷沃菌属细胞。
23.实施方案22的载体,其中第一细胞为拟杆菌门(例如拟杆菌目或拟杆菌属)细胞且第二细胞为厚壁菌门(例如梭菌属或葡萄球菌属)细胞,例如其中所述载体用于施用于人的肠道微生物组,用于治疗或预防胃肠道病况或糖尿病,或者用于治疗或预防肥胖症。
24.实施方案16或17的载体(或本文的任何用途),其中第一细胞(每种第一细胞)为环境中(例如水或土壤环境中)环境可接受的,且任选地第二细胞(每种宿主细胞)为环境中不可接受的。水环境对技术人员为易于显而易见的,并可例如为海洋或水道(例如湖泊、运河、河流或水库)环境。在一个实例中,水环境为意欲用于人食用的饮用水或者污水。在一个实例中,土壤环境为农业土地的土壤或挖掘现场(例如矿物或金属挖掘现场)的土壤。
对于“可接受的”和“不可接受的”,技术人员应易于理解,第一细胞类型可在环境中保留且第二细胞类型应在环境中减少。例如,crispr阵列修饰第二细胞的基因组,以杀死或减少环境中的细胞活力或生长。例如,靶标位点由第二细胞包含,并且位点被所述cas核酸酶切割,由此使包含靶标位点的基因失活或下调。例如,所述基因为第二细胞的必需基因或抗生素抗性基因。在一个实例中,所述基因为毒力基因。
在一个实例中,环境为人的微生物组,例如口腔微生物组或肠道微生物组或血流。在一个实例中,环境不为人体内或其上的环境。在一个实例中,环境不为非人动物体内或其上的环境。在一个实施方案中,环境为空气环境。在一个实施方案中,环境为农业环境。在一个实施方案中,环境为石油或石油回收环境,例如石油或油田或井。在一个实例中,环境为用于人或非人动物食用的食品或饮料中或其上的环境。
在一个实例中,本文的载体、系统、载体、阵列、crrna、grna、方法或任何用途用于工业,或者所述环境为工业环境,其中工业为选自以下领域的行业:医疗和健康护理、制药、人类食品、动物饲料、植物肥料、饮料、乳品、肉品加工、农业、畜牧业、养禽业、鱼类和贝类养殖、兽医、石油、天然气、石油化工、水处理、污水处理、包装、电子和计算机、个人健康护理和化妆用具、化妆品、牙科、非医疗牙科、眼科、非医疗眼科、矿物开采与加工、金属开采与加工、采石、航空、汽车、铁路、航运、空间、环境、土壤处理、纸浆和造纸、服装制造、染料、印刷、粘合剂、空气处理、溶剂、生物防御、维生素补充剂、冷藏、纤维沤麻和生产、生物技术、化学、工业清洁产品、家庭清洁产品、肥皂和洗涤剂、消费品、林业、渔业、休闲、回收、塑料、兽皮、皮革和仿麂皮、废物管理、殡葬事业、燃料、建筑、能源、钢铁和烟草行业领域。
25.与核酸(例如dna)组合用于在修饰的靶标位点包含的任一前述实施方案的载体。
在一个实例中,所述修饰为靶标位点的切割,并且核酸(例如dna)通过在宿主细胞中同源重组而并入。这对于使用本发明的载体实现精确靶向修饰宿主细胞基因组是有用的。
26.实施方案25的载体,其中用于并入的核酸为或包含调节元件或外显子序列,例如人类序列。
27.任一前述实施方案的载体,其与用于mge的移动的转座酶组合。
28.任一前述实施方案的载体,其中所述载体或mge包含在第一宿主细胞中可操作的毒素-抗毒素模块;任选地其中所述毒素-抗毒素模块包含在除了第一细胞以外的细胞中不可操作或操作减少的抗毒素基因。
29.任一前述实施方案的载体,其中所述载体或mge包含在第二宿主细胞中可操作的毒素-抗毒素模块;任选地其中毒素-抗毒素模块包含在除了第二细胞以外的细胞中不可操作或操作减少的抗毒素基因。
30.任一前述实施方案的载体,其中所述载体或mge包含在第一和第二宿主细胞中可操作的毒素-抗毒素模块;任选地其中毒素-抗毒素模块包含在除了第一和第二细胞以外的细胞中不可操作或操作减少的抗毒素基因。使用毒素-抗毒素模块可用于赋予选择性的有点,并且因此赋予mge保留和传播。例如,模块为i型模块,例如hok-sok模块。例如,模块为ii型模块,例如hica-hicb模块。例如,模块为tad-ata型毒素-抗毒素模块。例如,模块为质粒成瘾模块。在一个实例中,第一和/或第二细胞为拟杆菌属细胞且模块为拟杆菌属物种的模块,例如txe/yoeb家族成瘾模块(参见例如http://www.uniprot.org/uniprot/f0r9d1)、rele/stbe家族成瘾模块(参见例如http://www.uniprot.org/uniprot/f0r9a0)、higa家族成瘾模块(参见例如http://www.uniprot.org/uniprot/d7j8v2或http://www.uniprot.org/uniprot/d2esd0)、rele/stbe家族成瘾模块(参见例如http://www.uniprot.org/uniprot/f0r5f4)。使用载体或mge中的毒素-抗毒素可用于允许破坏除了期望的细胞以外的带有载体的细胞(例如第一和第二和/或第三细菌细胞)。在该实例中,mge或载体包含细菌毒素-抗毒素模块的毒素基因和同源抗毒素基因,其中所述毒素和抗毒素基因的表达分别例如从不同启动子调节。例如,毒素基因可包含在第一、第二(和第三)细胞中组成型活化的启动子,使得总是产生毒素。抗毒素基因可包含可被第一和/或第二细胞中、但是不是不同菌株或物种的非靶细胞中的一种或多种因子(例如表达的蛋白)诱导的启动子。众所周知,抗毒素固有地比细菌毒素-抗毒素系统的毒素更不稳定,并且因此所述载体或mge转移至不是靶细胞(例如不是第一和/或第二细胞)的细胞,将导致毒素在没有抗毒素表达或抗毒素活性较低的情况下进行表达,因此导致非靶细胞的细胞死亡。这因此对靶细胞(第一、第二和第三细胞)摄取并保留本发明的载体,使得其可在其中具有期望的crispr阵列活性以及在群体(诸如肠道微生物群)跨靶细胞传播造成选择压力。这也限制载体或mge向非靶细胞传播,使得阵列的作用在群体中受到控制-在这方面,对不摄取载体的非靶细胞存在压力,并且如果它们这样做,受体细胞将不能在群体中存活,由此限制具有mge和阵列的非靶细胞的复制。
31.任一前述实施方案的载体,其中第一和第二细胞属于相同的门(例如两种细菌细胞),并且载体为在以下中可复制或可操作的:(d)在第一细胞和/或第二细胞但不在相同门的另一细胞;(e)在第一细胞和/或第二细胞但不在相同目的另一细胞;(f)在第一细胞和/或第二细胞但不在相同纲的另一细胞;(g)在第一细胞和/或第二细胞但不在相同目的另一细胞;(h)在第一细胞和/或第二细胞但不在相同科的另一细胞;(i)在第一细胞和/或第二细胞但不在相同属的另一细胞;(j)在第一细胞和/或第二细胞但不在相同物种的另一细胞;(k)在第一细胞和/或第二细胞但不在相同菌株的另一细胞。
这提供本发明的载体在微生物组中的选择性(例如用于选择性杀死混合细菌群体中的第二宿主细胞类型)。这可例如通过将mge或阵列(例如其启动子)工程改造,使得其需要表达用于复制或操作的特定蛋白(例如表达产生crrna)来实现。例如,启动子可选自在第一和/或第二细胞但不在其他细胞中操作的启动子,或者其中mge被工程改造,使得其复制起点中的一个或多个依赖于在第一和/或第二细胞但不在其他细胞中产生的蛋白或其他因子。
32.任一前述实施方案的载体在细胞的混合群体中的第一和第二拷贝,其中第一载体由第一细胞包含,第二载体由第二细胞包含,细胞是不同物种(例如不同的细菌物种)的细胞,并且载体mge中的一种或两者能够转移至第三细胞(例如细菌细胞),其中第三细胞物种与第一或第二细胞的物种相同,或者为不同于第一和第二细胞物种的物种。这是有用的,因为第一细胞可充当载体(例如当其为非致病性时,其可被施用于人或动物,使得其栖居人或动物,诸如其微生物组)。通过水平转移,载体可向第三细胞转移并传播本发明的crispr阵列(直接或经由第二细胞,后者充当阵列的储库)。所述阵列然后可在第三细胞内介导靶标序列的cas修饰(例如切割),例如使第三细胞的必需或抗生素抗性基因失活或下调。
通常在本文,当靶标序列被细胞的抗生素抗性基因包含时,本发明的载体、工程改造的序列或阵列可与抗生素一起(同时或依次)施用于人或动物。这对于杀死或减少包含靶标序列的细胞增殖是有用的。在这方面,所述载体、工程改造的序列或阵列由包含抗生素的组合物包含,其中靶标序列为编码对所述抗生素的抗性的基因序列。
任选地,混合群体包含第三细胞。
在一个实例中,提供了多种第一细胞,其各自包含本发明的载体。在一个实例中,提供了多种第二细胞,其各自包含本发明的载体。在一个实例中,提供了与多种第二细胞组合的多种第一细胞,每种细胞包含本发明的载体。在一个实例中,提供了与多种第二细胞和多种第三细胞组合的多种第一细胞,至少2种(或全部)所述多种的细胞包含本发明的载体。
33.实施方案32的载体,其中所述载体或mge包含在第一、第二和第三宿主细胞中可操作的毒素-抗毒素模块;任选地其中毒素-抗毒素模块包含在除了第一、第二和第三细胞以外的细胞中不可操作或操作减少(即更少)的抗毒素基因。
34.任一前述实施方案的载体,其中mge为接合转座子,orit在第一和第二宿主细胞中为功能性的,mge包含第一和第二末端重复序列和重复序列之间的crispr阵列,并且其中第一和第二细胞为细菌细胞,第二细胞属于人类微生物群细胞物种(例如致病性物种),其中靶标位点由第二细胞但非第一细胞包含,并且其中所述修饰使第二细胞中的包含所述靶标的基因或调节序列失活或下调。
通常,第一细胞可由此充当本发明的阵列的载体和储库,其可通过mge的水平转移进行转移。
在一个实例中,mge为接合的拟杆菌们转座子,orit是在第一和第二宿主细胞中有功能的拟杆菌门orit,mge包含第一和第二末端重复序列和重复序列之间的crispr阵列,并且其中第一和第二细胞为细菌细胞,第一细胞为拟杆菌门细胞且第二细胞为厚壁菌门细胞(例如梭菌属或葡萄球菌属细胞),其中靶标位点由第二细胞而非第一细胞包含,并且其中所述修饰使第二细胞中包含所述靶标的基因或调节序列失活或下调。
35.当由第一或第二细胞包含时实施方案34的载体。
36.任一前述实施方案的载体,其中第一和第二细胞由混合细菌细胞群体、例如人或非人动物(例如狗、猫或马)肠道、阴道、腋窝或口腔微生物群物种的群体包含。如上所解释,所述群体用于施用于人或动物以栖居其微生物组。
37.包含多种如在实施方案22中定义的细胞的离体组合物,其中每种细胞包含实施方案1-36中任一项的载体。或者,所述组合物在体内,例如在非人动物体内。
38.用于人或非人动物食用的饮料或食品,其包含实施方案1-36中任一项的载体或实施方案37的组合物。饮料可为例如益生菌饮料,例如用于人或动物每天、每两天或每周一次食用,例如在人或动物治疗或预防肥胖症或胃肠道病况。
39.包含多种拟杆菌属细胞的组合物,其中每种细胞包含根据实施方案1-36中任一项的载体。
通常,所述细胞可充当本发明的阵列的载体或储库,用于施用于人或动物的微生物组(例如肠道微生物组),例如在人或动物治疗或预防肥胖症或胃肠道病况。
40.包含第一细胞的亚群和第二细胞的亚群的细菌细胞的混合群体,其中第一细胞包含根据实施方案1-36中任一项的载体,其中所述载体能够在第一和第二细胞亚群之间水平转移。当其可被施用(例如鼻内)于人或动物、使得细菌栖居人或动物的一种或多种微生物组(例如肠道微生物组)时,这样的群体是有用的。第一(任选地还有第二)细胞可充当本发明crispr阵列的载体,尤其是当那些细胞对人或动物为非致病性的(例如在肠道微生物组中非致病性的)。微生物组可为本文公开的任何其他微生物组或微生物群群体。
41.实施方案40的群体,其中第一和第二细菌物种中的一种或两者能够栖居人或非人动物的肠道微生物群,并且任选地第一细菌与人或动物共栖或共生。通常,第一细菌可被安全施用于人或动物,并可充当本发明的阵列的载体,用于之后转移至微生物群的其他细胞。
42.实施方案40的群体,其中混合群体由饮料或水(例如水道或用于人食用的饮用水)或土壤包含。在水或土壤中提供群体可用于在环境或(对水)加热、冷却或工业系统或在饮用水存储容器进行这种处理。
在任一实施方案的实例中,第二细胞为包含靶标序列的霍乱细胞,其中当靶标序列被修饰时杀死细胞或减少细胞增殖。在一个实例中,第二细胞由用于人食用的水(例如用于人消费处理之前或之后的这种水)包含。在一个实例中,载体由用于施用于人的药物组合物包含,以在人中治疗或预防霍乱。
43.体外包含实施方案1-36中任一项的多种载体的组合物。例如,所述组合物在工业装置或容器(例如用于食品、消费品、化妆品、个人健康护理产品、石油或石油生产)中与多物种细菌群体混合。
44.用于施用于人或非人动物的任一前述实施方案的载体、组合物、食品、饮料或群体,其用于治疗性或预防性栖居和再平衡其微生物组,或者用于美容改变人或动物(例如用于美容减肥)。
45.修饰宿主细胞内的靶标核苷酸序列的方法,所述方法包括
(1)使宿主细胞与载体细胞合组合,
(a)其中所述载体细胞包含含有用于修饰靶标的crispr阵列的crispr核酸载体,
(b)其中crispr阵列包含一个或多个用于表达crrna的序列和用于宿主细胞内的序列转录的启动子;
(c)其中crrna能够与靶标序列杂交,以指导宿主细胞内的cas(例如cas核酸酶)以修饰靶标序列;和
(2)一起培养细胞,其中所述载体从载体细胞转移至宿主细胞,由此crrna与靶标序列杂交,以指导宿主细胞内的cas并修饰靶标。
在一个实例中,所述方法离体实施。在一个实例中,所述方法为美容方法并且不是治疗性或预防性的医疗方法。
46.实施方案45的方法,其中所述载体为根据实施方案1-36中任一项。
47.实施方案45或46的方法,其中宿主细胞为人或非人动物微生物组细菌物种的细胞,任选地其中宿主细胞为致病性细菌物种的细胞。在一个实例中,本文的任何微生物组选自肠道、阴道、腋窝、头皮、皮肤或口腔微生物组。
48.实施方案45-47中任一项的方法,其中所述载体细胞属于作为共栖或或共生的人或非人动物微生物组细菌物种的物种。在一个实例中,载体细胞对人为非致病性的,例如当被鼻内、局部或口服施用时。
在本文的任何配置、概念、方面、实施方案或实例中,本发明的载体、组合物、阵列或群体被鼻内、局部或口服施用于人或非人动物,或者用于这样的施用。旨在治疗人或动物微生物组的技术人员将根据目标微生物组而确定最佳施用途径。例如,当微生物组为肠道微生物组时,施用可为鼻内或口服施用。当微生物组为头皮或腋窝微生物组时,施用可为局部施用。当微生物组在口腔或喉咙中时,施用可为口服施用。
49.实施方案45-48中任一项的方法,其中宿主细胞属于人或非人动物的肠道微生物组细菌物种。
50.改变包含所述亚群的细菌混合群体中的第一和第二细菌宿主细胞物种的亚群的相对比例的方法,所述方法包括
a:提供所述第一细菌宿主细胞;
b:提供第二细菌宿主细胞,其中第二细胞为与第一细胞不同物种或菌株的细胞;
c:向第一细菌宿主细胞中引入工程改造crispr阵列,其中每种crispr阵列包含一个或多个用于表达crrna的序列和用于所述第二宿主细胞内序列转录的启动子,其中crrna能够与由所述第二细胞包含的靶标序列杂交,以指导宿主细胞内的cas(例如cas核酸酶)以修饰靶标序列;
d:将第一和第二细菌细胞合一起组合,以产生混合的细菌群体;和
e:允许混合群体中的细菌生长,使得发生crispr阵列从第一细菌细胞水平转移至第二细菌细胞,其中第二细胞中的靶标序列为cas修饰的,由此改变所述第一与第二细菌的相对比例。
51.实施方案50的方法,其中每种crispr阵列根据实施方案1-26中任一项。
52.实施方案50或51的方法,所述方法进一步包括获得步骤e的混合群体的第一样品,并任选地比较细胞的第一样品中的第二细胞的比例和第二样品中的第二细胞的比例,其中第二样品为用于在步骤b中提供第二细胞的细菌细胞的混合群体的样品,并且比较显示第二细胞的比例在步骤e之后增加或降低。
53.实施方案52的方法,其中第二样品为人或动物微生物组(例如肠道、阴道、头皮、腋窝、皮肤或口腔细胞)的样品。
54.实施方案50-53中任一项的方法,其中人或动物微生物组(例如肠道、阴道、头皮、腋窝、皮肤或口腔细胞)的样品用于提供步骤b的第二细胞。
55.实施方案50-54中任一项的方法,其中重组、培养的第一细胞群体被用于步骤a。
56.实施方案50-55中任一项的方法,其中质粒、ice或转座子水平转移被用于步骤e中,其中每种质粒、ice或转座子包含所述crispr阵列。
57.实施方案50-56中任一项的方法,其用于治疗性或预防性再平衡人或非人动物微生物群,例如用于治疗或预防肥胖症、糖尿病、ibd、胃肠道病况或口腔病况。糖尿病可为i型或ii型。在一个实例中,预防为医疗性的。在一个实例中,本文的预防为非医疗性的,例如用于美容或卫生目的。例如,微生物群为腋窝微生物群并且所述方法用于预防或减少人的体味。例如,在这种情况下,所述方法下调介导人体气味的产生和/或持久性的宿主细菌细胞的生长或活力。
58.实施方案50-57中任一项的方法,所述方法包括提供不同于所述载体和宿主细胞的物种或菌株的第三细菌宿主细胞,其中第三细胞由步骤e的混合群体包含,或与步骤e之后的所述群体组合,其中发生crispr阵列水平转移至第三宿主细胞。
59.实施方案58的方法,其中第三细胞不包含所述靶标序列。
这样,第三细胞可充当阵列的载体并且能够将阵列水平转移至包含靶标序列的宿主细胞。
60.实施方案58的方法,其中第三细胞不包含用于cas修饰的靶标序列。
61.实施方案50-60中任一项的方法,其中所述载体(任选地还有第三)细胞属于在实施方案21中记载的物种,例如拟杆菌门细胞。
62.实施方案50-60中任一项的方法,其中宿主细胞属于在实施方案19中记载的物种或厚壁菌门细胞。
63.任一前述实施方案的载体、组合物、食品、饮料、群体或方法,其中每种载体为或由质粒、噬菌体(例如包装的噬菌体)或噬菌粒包含。
64.任一前述实施方案的载体、组合物、食品、饮料、群体或方法,其中修饰为(i)切割靶标序列,(ii)下调包含靶标序列的基因转录,(iii)上调包含靶标序列的基因转录,或(iv)添加、缺失或取代靶标上的核酸序列。
65.任一前述实施方案的载体、组合物、食品、饮料、群体或方法,其中每种靶标序列为由宿主细胞的调节元件或基因包含的序列,其中所述基因为必需基因、crispr基因或抗生素抗性基因,任选地其中调节元件为这样基因的元件。在一个替代方案中,所述基因为毒力基因。
66.任一前述实施方案的载体、组合物、食品、饮料、群体或方法,其中每种靶标序列为由噬菌体基因组包含的序列,其中噬菌体由宿主细胞包含。在一个实例中,靶标序列由宿主细胞感染性、噬菌体溶原性或溶解性周期、或噬菌体活力所需的噬菌体基因,例如必需基因或衣壳蛋白基因包含。
在一个实例中,拟杆菌门噬菌体为选自crass噬菌体、gb-124噬菌体、ga-17噬菌体、hb-13噬菌体、h16-10噬菌体、b40-8噬菌体和脆弱拟杆菌噬菌体atcc51477-b1的拟杆菌属噬菌体。这可用于例如为人或动物的肠道微生物组中的拟杆菌门提供存活优势。这样,可以改变拟杆菌门与厚壁菌门的比例,以增加前者相比于后者的比例(例如用于治疗或预防肥胖症)。在一个实例中,靶标序列由bacon(拟杆菌门相关的碳水化合物结合)结构域-编码序列(例如其中所述宿主为拟杆菌属宿主)或细胞内溶素编码序列包含。
67.任一前述实施方案的载体、组合物、食品、饮料、群体或方法,其中每种crispr阵列包含用于在宿主细胞表达和产生相应crrna的序列r1-s1-r1’,
(i)其中r1为第一crispr重复区,r1’为第二crispr重复区,且r1或r1’为任选的;且
(ii)s1为第一crispr间隔区,其包含与所述靶标序列具有95%或更多同一性的核苷酸序列或由其组成。
68.实施方案67的载体、组合物、食品、饮料、群体或方法,其中r1和r1’与第二宿主细胞物种的crispr阵列的第一和第二重复序列分别具有至少95%同一性。
69.实施方案67或68的载体、组合物、食品、饮料、群体或方法,其中r1和r1’与所述宿主细胞的crispr/cas系统有功能,用于修饰靶标序列。
70.任一前述实施方案的载体、组合物、食品、饮料、群体或方法,其中所述或每种阵列与一种或多种cas核酸酶组合,其与宿主细胞内的相应crrna对于修饰靶标序列具有功能。靶标序列包含紧邻前间隔区序列邻近基序(pam)的前间隔区序列。
71.任一前述实施方案的载体、组合物、食品、饮料、群体或方法,其中所述或每种阵列与编码一种或多种cas核酸酶的核酸序列组合,其与宿主细胞中的相应crrna对于修饰靶标序列具有功能。
72.实施方案67-71中任一项的载体、组合物、食品、饮料、群体或方法,其中r1和r1’与ii型cas9核酸酶(例如化脓性链球菌或金黄色葡萄球菌cas9)对于修饰所述宿主细胞内的靶标具有功能,任选地其中所述载体、组合物、食品、饮料、群体或方法进一步根据实施方案70或71,其中cas为所述cas9。
73.可通过实施方案50-72中任一项的方法获得的细菌的离体混合群体。
74.用于施用于人或非人动物的组合物,其用于治疗、预防、美容、人或非人动物体重减轻(例如化妆品减少)或营养用途,所述组合物包含实施方案73的混合群体。
75.用于人或非人动物食用的食品或饮料,其包含实施方案73的混合群体或实施方案74的组合物。
76.实施方案75的食品或饮料,其为营养补充剂或者益生菌饮料或食品。
77.用于在人或非人动物或在饮用水或土壤治疗(处理)或预防细菌感染的抗生素组合物,其中所述组合物包含实施方案1-36和63-72中任一项的载体。
78.用于在人或非人动物中增加肠道拟杆菌门的比例(例如治疗或预防肥胖症、糖尿病或胃肠道炎性病症)的益生菌组合物,其中所述组合物包含实施方案1-36和63-72中任一项的载体。
79.实施方案74、77或78的组合物,其用于在人或动物中增加肠道拟杆菌属与硬壁菌类的相对比例,例如用于治疗或预防肥胖症、糖尿病或胃肠道病况。
80.任一前述实施方案的载体、组合物、食品、饮料、群体或方法,其中所述载体不包含对可与阵列一起操作的cas核酸酶编码序列。这对于节省载体中的空间是有用的(例如以允许包含更大阵列或更多阵列用于宿主细胞靶向---这可用于靶向多个基因组位置,以减少对本发明阵列出现抗性的可能性)。
81.任一前述实施方案的载体、组合物、食品、饮料、群体或方法,其中mge不包含可与阵列一起操作的cas核酸酶编码序列。这对于节省mge空间是有用的(例如以允许包含更大阵列或更多阵列用于宿主细胞靶向---这可用于靶向多个基因组位置,以减少对本发明阵列出现抗性的可能性)。例如,这可避免包含大的编码cas9核酸内切酶的序列。
82.实施方案80或81的载体、组合物、食品、饮料、群体或方法,其中所述阵列可与存在于与第一和/或第二细胞相同的物种或菌株的细胞中的cas核酸内切酶一起操作。在一个实例中,所述阵列可与存在于与宿主细胞或第三细胞相同的物种或菌株的细胞中的cas核酸内切酶一起操作。这对于节省载体或mge中的空间是有用的(例如以允许包含更大阵列或更多阵列用于宿主细胞靶向---这可用于靶向多个基因组位置,以减少对本发明阵列出现抗性的可能性)。
83.任一前述实施方案的载体、组合物、食品、饮料或群体,其中第一和第二细胞为不同物种的细菌细胞,其中第二细胞属于人类微生物群物种,且第一细胞属于在所述人类微生物群中非致病性的物种,其中靶标序列不由第一细胞的基因组包含,mge包含在第一和第二细胞可操作的orit,其中mge能够从第一细胞水平转移至第二细胞。
在一个替代方案中,提供了:
任一前述实施方案的方法,其中所述载体和宿主细胞为不同物种的细菌细胞,其中宿主细胞属于人类微生物群物种,且载体细胞属于在所述人类微生物群中非致病性的物种,其中靶标序列不由载体细胞的基因组包含,mge包含在载体和宿主细胞可操作的orit,其中mge能够自载体细胞水平转移至宿主细胞。
84.方面83的载体、组合物、食品、群体或方法,其中所述载体由细菌噬菌体包含,细菌噬菌体能够感染第一细胞(载体),以将mge引入第一(载体)细胞内。
85.实施方案83或84的载体、组合物、食品、饮料、群体或方法,其中靶标序列由第二(宿主)细胞的基因组包含(例如由基因组的必需或抗生素抗性基因包含)。
86.实施方案85的载体、组合物、食品、饮料、群体或方法,其中第二(宿主)细胞物种在所述人类微生物群中为致病性的,其中靶标序列通过切割靶标序列或下调包含所述靶标序列的基因进行修饰。在一个实例中,第二(宿主)细胞为根据实施方案19的特征(i)-(xiv)中的任一项的细胞。在一个实例中,第二(宿主)细胞为厚壁菌门细胞,例如其中所述载体用于在人类治疗或预防肥胖症。
87.实施方案83、84或85的载体、组合物、食品、饮料、群体或方法,其中第二(宿主)细胞物种在所述人类微生物群中为非致病性的。
88.实施方案83-87中任一项的载体、组合物、食品、饮料、群体或方法,其中第二(宿主)细胞为拟杆菌门或普雷沃菌属细胞;任选地其中mge能够自第二(宿主)细胞物种水平转移至所述人类微生物群的厚壁菌门物种。例如,当靶标序列由厚壁菌门而非第一(载体)或第二(宿主)细胞包含时,后者可用于在人中治疗或预防肥胖症。
89.实施方案83-88中任一项的载体、组合物、食品、饮料、群体或方法,其中mge能够从第二(宿主)细胞物种水平转移至所述人类微生物群的第三细菌细胞物种,其中第三细胞物种在所述人类微生物群中为致病性的并且包含所述靶标序列。在一个实例中,第一(载体)和第二(宿主)细胞不包含靶标序列。
90.实施方案89的载体、组合物、食品、饮料、群体或方法,其中第三细胞为根据方面19的特征(i)-(xiv)中的任一项的细胞。
91.任一前述实施方案的载体、组合物、食品、饮料、群体或方法,其中mge没有对阵列的重复序列可操作的编码cas核酸内切酶的序列,且其中所述载体在mge外面包含这样的序列(例如编码cas9)。
一般特征中的任一种也可应用于本发明配置。本文中的任何其他配置、方面、段落、实例、实施方案或概念的特征中的任一种也可与采用mge的本发明配置组合。
因此,本发明提供了以下特征(作为段落编号);这些段落应用于所记载方面的任一项,或者实施方案1-91中的任一项,或者应用于本文的任何其他配置:-
1.方面44-55中任一项的载体,其中靶标序列为宿主crispr/cas系统的核苷酸序列,由此crrna将cas指导至靶标以修饰宿主细胞内的宿主crispr/cas系统。
2.段落1的载体,其中宿主crispr/cas系统为i、ii或iii型系统,且靶标序列为在至少1、2或3种另外的宿主菌株或物种中的所述系统类型中保存的核苷酸序列,其中所述另外的菌株或物种不同于所述宿主。
3.任一前述段落的载体,其中靶标序列与链球菌属物种(例如嗜热链球菌或化脓性链球菌)crispr/cas系统序列相同。
4.任一前述段落的载体,其中宿主crispr/cas系统的靶标序列包含
i.与第一重复区的最5’核苷酸连续的crispr阵列前导或前导启动子序列(和任选地包含重复区的所述最5’核苷酸,例如包含在第一重复区的5’末端的前3个核苷酸);
ii.紧邻第一重复区5’的最多达20(例如3、5、7、9、10、12、15、20、30或32)个核苷酸连续核苷酸的序列;
iii.第一重复区的最5’核苷酸的最多达20(例如3、5、7、9、10、12、15、20、30或32)个连续核苷酸的序列;或
iv.紧邻第一间隔区3’的最多达20(例如3、5、7、9、10、12、15、20、30或32)个连续核苷酸的序列(并且任选地其中所述序列包含第一间隔区的最3’核苷酸,例如包含在第一重复区3’末端的最后3个核苷酸)。
5.段落1、2或3的载体,其中所述阵列由核酸载体(例如病毒、病毒粒子、噬菌体、噬菌粒或前噬菌体)包含且
i.所述crrna包含结构r-s-r或由其组成,其中r=crispr重复区且s=crispr间隔区,其中s包含(在5’至3’方向)v-hr或hr-v或者,其中v=与载体的dna序列相同的序列且hr=所述宿主细胞crispr阵列的crispr阵列的重复区的dna序列;
ii.其中hr的序列与宿主crispr阵列的序列紧接;和
iii.其中crrna能够与宿主crispr阵列的间隔区杂交,以将cas指导至宿主靶标,用于修饰细胞中的宿主crispr阵列。
例如,v为噬菌体载体衣壳蛋白编码序列的序列。在这方面,heler等人在一项细菌抗药性的研究中发现,3种crispr无关的细菌噬菌体抗性的突变体展现噬菌体吸附的明显缺陷(约50%),表明它们最有可能携带包膜抗性突变。
6.段落5的载体,其中第一crrna不或基本上不与载体中存在的核酸杂交。例如,第一crrna不与载体中的v杂交,或者杂交比其与宿主阵列的间隔区的杂交不太强烈。杂交测试对技术人员为常规的。例如,其可通过分离或合成载体dna,并将其与crrna孵育而进行体外测定。标准技术,例如使用pcr可用于检测是否已发生杂交(例如在于宿主细胞中发现的ph和温度条件下测试)。
7.段落5或6的载体,其中v=载体dna的1或最多达40(例如最多达15)个连续核苷酸。靶标序列中发现的前间隔区序列中pam的紧邻5’的种子序列对crrna配对和crispr/cas系统的切割功能是重要的。这种种子序列包括pam的紧邻5’的约15或12个连续核苷酸。
8.任一前述方面或段落的方法、阵列或载体,其中所述阵列由载体包含,并且包含(在5’至3’方向)第一重复序列、第一间隔区序列和第二重复序列,其中间隔区序列包含能够与宿主细胞中靶标序列杂交(例如相同或具有大于90%同一性)的序列,所述阵列进一步包含用于宿主细胞中重复区和间隔区的转录的启动子,并且任选地所述载体包含cas核酸酶编码序列和/或tracrrna编码序列,用于在宿主细胞中编码功能性cas和/或tracrrna序列,其中tracrrna序列包含与第一或第二重复区互补的序列。
9.任一前述方面或段落的方法、阵列或载体,其中crispr阵列由载体包含,并且包含(在5’至3’方向)第一重复序列、第一间隔区序列和第二重复序列,其中间隔区序列包含能够与宿主细胞中靶标序列杂交(例如相同或具有大于90%同一性)的序列,所述阵列进一步包含用于宿主细胞中重复区和间隔区的转录的启动子,并且其中所述载体不包含cas核酸酶编码序列和/或tracrrna编码序列用于在宿主细胞中编码tracrrna序列,其中tracrrna序列包含与第一或第二重复区互补的序列,其中hm-crispr阵列在宿主细胞中为功能性的,以将cas(例如内源性宿主cas核酸酶)指导至宿主靶标位点,任选地采用宿主tracrrna。
10.段落8或9的方法、阵列或载体,其中重复区与宿主阵列的重复区相同,其中本发明的crispr阵列不包含被宿主crispr/cas系统的cas(例如cas核酸酶,例如cas9)识别的pam。剔除(omit)cas序列的能力在本发明的阵列中释放出空间。
“必需基因”为其存在或表达是宿主细胞生长或者促进或维持细胞活力需要的宿主细胞中的基因。抗性基因为其存在或表达是对抗宿主药物例如抗生素(例如β-内酰胺类抗生素)呈现完全或部分抗性需要的宿主中的基因。毒力基因为其存在或表达是宿主细胞能够感染的生物体的感染性需要的宿主中的基因,例如其中宿主为病原体(例如植物、动物、人、牲畜、伴侣宠物、植物、鸟、鱼或昆虫)。
11.任一前述方面或段落的方法、阵列或载体,其中crispr阵列与非宿主细胞cas(例如i型系统cas,其中宿主系统为ii或iii型;ii型系统cas,其中宿主系统为i或iii型;或iii型系统cas,其中宿主系统为i或ii型)组合,任选地其中宿主细胞不包含或表达与非宿主cas的类型相同类型的cas。这是有用的,因为crispr阵列不靶向序列本身(诸如在载体中)或宿主中载体编码的cas。
12.任一前述方面或段落的方法、阵列或载体,其中crispr阵列与tracrrna序列或编码tracrrna序列(例如在与阵列相同的核酸上)的序列组合,任选地其中tracrrna序列和hm-crrna由单一指导rna(grna)包含。
13.任一前述方面或段落的方法、阵列或载体,其中crispr阵列与cas或编码cas的序列组合,任选地其中所述阵列被整合在宿主细胞基因组中,并且cas对宿主细胞为内源性的或者由外源序列编码。在一个实例中,cas编码序列为外源序列,其已例如从质粒或病毒诸如噬菌体引入宿主中。
14.任一前述方面或段落的方法、阵列或载体,其中crispr阵列由质粒、病毒、病毒粒子、噬菌体、噬菌粒或前噬菌体的核苷酸序列包含。噬菌粒为包装的噬菌体。前噬菌体为整合至细胞内宿主染色体或附加体的噬菌体。
15.任一前述方面或段落的方法、阵列或载体,其中crispr阵列被整合在宿主细胞基因组中,例如整合在染色体或附加体核酸中。
在一个实例中,所述阵列与缀合至作用于靶标序列或包含靶标序列的基因的转录或翻译活化剂的失活cas(例如dcas9)组合。这例如可用于开启宿主细胞中的基因表达(例如期望的基因,例如先前已被工程改造至宿主细胞中的外源基因序列,例如编码其中宿主为微生物的抗生素,或者编码期望的外源蛋白用于在宿主培养物中产生,例如用于食品、饮料、医药或如本文公开的本发明的任何其他应用)。
16.包含任一前述方面或段落的crispr阵列的病毒(例如病毒粒子、噬菌体、噬菌粒或前噬菌体),其例如用于感染细胞(例如微生物)或者用于医药或牙科学。
17.根据段落16的病毒粒子的群体,其第一和第二病毒粒子包含不同的阵列前导区或启动子和/或用于靶向宿主细胞中或不同宿主菌株中的不同靶标序列。
18.crispr阵列的集合,每种阵列根据任一前述方面或段落,其中第一阵列包含用于crrna转录的第一启动子;第二阵列包含用于crrna转录的不同于第一启动子的第二启动子;且其中每种启动子与宿主启动子相同或为其同源物;任选地其中第一或两者启动子与宿主cas(例如cas1、2、9或csn2)启动子或宿主crispr阵列启动子相同。例如,第一启动子为内源性cas核酸酶启动子或内源性cas1或cas2启动子;或者高度或组成型表达的内源基因或宿主细胞的必需、毒力或抗性基因的启动子。通过使用内源性启动子,在宿主进化期间对保持宿主启动子存在压力,并且因此这降低宿主crispr/cas防御系统靶向一种或多种阵列启动子的可能性。
19.本发明的crispr阵列的集合,其中第一阵列包含一个或多个间隔区(例如2、3、4、5、6、7、8、9、10、20、30、40、50或更多个间隔区);且第二阵列包含多于1个间隔区(例如2、3、4、5、6、7、8、9、10、20、30、40、50或更多个间隔区),其中第二阵列的所述间隔区与第一阵列的一个或多个间隔区相同。当证明hm-阵列中的许多这样的间隔区(或者此外跨多种阵列分布间隔区)增加一些hm-阵列间隔区将保留在宿主细胞中的机会(即使宿主细胞确实缺失所述间隔区中的一些),这可用于通过hm-阵列间隔区的同源重组逃避宿主抗性。针对缺失的防御也通过使用在不同阵列中侧接间隔区的相同拷贝的不同重复区得到增强。因此本发明提供以下:-
20.段落18或19的集合,其中第一阵列的间隔区(或所述间隔区)侧接相同的第一重复区;第二阵列的间隔区(或所述间隔区)侧接相同的第二重复区;且其中第一重复区不同于第二重复区。
21.段落20的集合,其中第一重复区与宿主细胞crispr/cas系统的重复区相同。
22.段落20的集合,其中第一重复区不同于宿主crispr/cas系统的重复区。
23.段落18-22中任一项的集合,其中第一和第二阵列包含在相同的宿主细胞或相同的载体(例如质粒、病毒、病毒粒子、噬菌体、噬菌粒或前噬菌体)中。
24.段落18-22中任一项的集合,其中第一阵列包含在第一载体中且第二阵列包含在不包含第一阵列的第二载体中(例如其中所述载体为质粒或病毒粒子(例如相同病毒类型的)或包装的噬菌体(例如相同噬菌体类型的))。
在一个实施方案中,用于本发明的方法中的载体为由段落18-24中任一项的阵列包含的载体。
25.包含根据任一前述段落的阵列、病毒、病毒粒子、噬菌体、噬菌粒、前噬菌体、群体或集合的宿主细胞。
一般特征中的任一种(参见以下)也可适用于本配置。
本发明的一个实例提供用于减少对阵列的宿主适应性和抗性风险的以下特征:-
用于修饰宿主细胞的靶标核苷酸序列的本发明的crispr阵列或载体,
a.其中宿主细胞包含用于靶标序列的转录的第一内源性启动子(第一宿主启动子);
b.其中crispr阵列包含编码crrna的序列和用于crrna转录的第一启动子,所述crrna任选地由单一指导rna(grna)包含,并且能够与宿主靶标序列杂交,以将cas指导至宿主细胞内的靶标以修饰靶标序列;
c.其中第一启动子的序列为不同于第一宿主启动子序列的第二内源性宿主启动子的序列。
在一个实例中,启动子用于每种载体(例如噬菌体)crispr单元,其为宿主中必需基因的启动子-那样宿主将很好表达crrna(并且如果启动子来自必须总是或经常开启的宿主基因则为组成型表达)。宿主不易于适应远离该启动子,因此不易获得抗性。任选地,可对不同的载体crispr单元使用不同的必需启动子以降低宿主适应性(抗性)的机会。可使用宿主中被阵列(或不同阵列)靶向的毒力或必需或抗性基因的启动子。为了获得对噬菌体的抗性,宿主需要突变内源性基因启动子和基因靶向位点(其可例如处于对细胞生长、活力或抗宿主药物(例如抗生素)抗性必需的编码序列中),并因此处于这样也使基因失活的风险中。
根据本发明提供了编码crrna的核酸序列的多个拷贝,其中所述拷贝包含相同的间隔区序列,因为根据本发明靶向宿主细胞序列对于减少宿主从载体去除有用的靶向间隔区(例如通过宿主细胞同源重组)的机会是有利的。可以在本发明的相同或多个hm-阵列上灵活地提供多个靶向间隔区,以提供逃避抗性的替代方式。
因此,本发明提供了以下概念:-
1.用于修饰宿主细胞的靶标核苷酸序列的宿主修饰(hm)crispr/cas系统(例如,i、ii或iii型),所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶(例如,cas9)的核酸序列;
(ii)包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列(例如,如上所述的阵列),所述hm-crrna包含能够与宿主靶标序列杂交以将cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或用于表达tracrrna序列的dna序列;
(iv)其中所述系统组分包含两个、三个或更多个拷贝(例如,2、3、4、5、6、7、8、9,10、20、30、40、50或更多个)的编码crrna的核酸序列,其中所述拷贝包含用于靶向宿主细胞序列(例如,宿主毒力、抗性或必需基因或介导载体适应的宿主crispr/cas系统组分的序列)的相同间隔区序列。
例如,所述系统包含编码包含相同间隔区的crrna的核酸序列的4或更多个或5或更多个所述拷贝。这有利于增加在宿主中表达期望的crna。另外,这提供更大的避免宿主抗性的机会,因为需要靶向多于1个序列(尤其是如果可能存在诸如5、10、15、20、30、40、50或100或者更多个拷贝)。所述拷贝在不同阵列上的分布(例如所述载体包含在相同dna链上间隔的这些拷贝)可用于减少在间隔区之间或在侧接重复区之间重组的机会,这然后可导致切除期望的crna编码序列。宿主切除所有拷贝的机会通过提供分布在许多载体阵列的拷贝而减少,这也通过包括许多期望的间隔区的拷贝(例如第一载体阵列中的许多拷贝和第二载体阵列中的许多拷贝-可包括至少2、3、4、5、6、10或者更多这样的阵列,每个阵列包含2、3、4、5、6、7、8、9、10、20、30、40、50或100或者更多个期望的间隔区的拷贝)来减少。
2.概念1的系统,其中所述系统的组分包含编码包含相同间隔区的crrna的核酸序列的4、5、10、15或20多个所述拷贝。
3.概念1或2的系统,其中所述拷贝在两个或更多个核酸载体crispr阵列之间分割(split)。
4.概念3的系统,其中所述系统包含第一和第二hm-阵列,其中第一和第二载体crispr阵列包含在相同的宿主细胞或相同的载体(例如质粒、病毒、病毒粒子、噬菌体、噬菌粒或前噬菌体)中。
5.概念3或4的系统,其中所述第一阵列包含在第一载体中且所述第二阵列包含在不包含第一阵列的第二载体(例如其中所述载体为质粒或病毒粒子(例如相同病毒类型的)或噬菌粒(例如相同噬菌体类型的))中。
6.任一前述概念的系统,其中重复区与宿主crispr阵列中的重复区相同。
7.概念1-5中任一项的系统,其中重复区与宿主crispr阵列中的重复区不相同。
8.包含任一前述概念的系统、载体、病毒、病毒粒子、噬菌体、噬菌粒或前噬菌体的宿主细胞。
9.包含概念1-8中任一项的系统、载体、病毒、病毒粒子、噬菌体、噬菌粒或前噬菌体的抗微生物组合物(例如抗生素,例如药物、消毒剂或漱口水)。
一般特征中的任一种(参见以下)也可适用于本发明的概念。
分割(split)crispr/cas9系统
该配置有利于释放出靶标载体、例如携带外源序列的能力受限的病毒或噬菌体的空间。通过释放出空间,能够包括更多的靶向间隔区或阵列,这对逃避宿主抗性是有用的。例如利用内源性cas核酸内切酶而不是在载体中编码它-尤其是对于庞大的cas序列、诸如sp或sacas9是有利的。另外,如同对于来自非宿主来源的一些外源性cas可见的那样,不存在相容性差的可能性。减少病毒、例如噬菌体基因组大小的能力,也可有益于促进宿主细胞摄取(病毒在宿主细胞中的感染和/或维持)。在一些实例中,优点是通过载体(例如噬菌体)入侵宿主可上调宿主crispr/cas活性,包括增加宿主cas核酸酶的表达-在宿主对抗入侵的核酸的尝试中。然而,当这些包含一个或多个由宿主cas识别的重复区时,这也可用于提供与该配置发明的阵列、载体、系统及其他方面一起使用的内源性cas。在其中本发明涉及一个或多个靶向宿主crispr阵列的间隔区(也根据本发明的第一配置)的情况下,则这促进宿主crispr阵列本身的失活,类似于一种“自杀”的宿主细胞,其然后使用其自身的cas核酸酶使其自身的crispr系统失活。
因此,本发明提供了以下特征,编号为实例:-
1.用于修饰宿主细胞的靶标核苷酸序列的宿主修饰(hm)crispr/cas9系统(例如,i、ii或iii型),所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶(例如,cas9)的核酸序列;
(ii)包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列(例如,上述的本发明的阵列),所述hm-crrna包含能够与宿主靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或用于表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种可以转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的靶标序列。
本文的“分割(split)”意味着载体包含系统的一种或多种(但不是全部)组分且宿主细胞包含一种或多种(但不是全部)组分,并且载体包含一种或多种不由宿主细胞包含的组分。在一个实施方案中,载体和宿主细胞不共同享有任何组分,例如宿主细胞包含组分(i)且载体包含组分(ii),并且载体包含组分(iii)和/或宿主细胞包含组分(iii)。当载体在宿主细胞内(例如作为整合或附加体载体,例如前噬菌体)时,意图载体为已由转化宿主细胞的载体提供的核酸(并且由这样的核酸提供的系统组分不是被解释为宿主细胞组分的情况中)。这可通过将转化的宿主的核酸(例如染色体和附加体核酸)测序并将其与来自相同类型(例如来自相同宿主亲本菌落或克隆,例如当宿主为微生物,例如细菌或古细菌时)非转化宿主的序列进行比较而容易地确定。
任选地,所述系统为crispr/cas9系统。任选地,(a)的核酸酶为i型cas核酸酶。任选地,(a)的核酸酶为ii型cas核酸酶(例如cas9)。任选地,(a)的核酸酶为iii型cas核酸酶。
2.实例1的系统,其中所述组分中的至少一种对所述宿主细胞是内源的。
3.实例1或2的系统,其中组分(i)对所述宿主细胞是内源的。
4.实例1至3中任一项的系统,其中组分(iii)对所述宿主细胞是内源的。
5.用于修饰宿主细胞的靶标核苷酸序列的宿主修饰(hm)crispr/cas系统(例如,i、ii或iii型),所述系统包含根据(a)至(e)的组分:-
a.至少一种编码cas核酸酶(例如,cas9)的核酸序列;
b.包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列,所述hm-crrna包含能够与宿主靶标序列杂交以将所述cas指导至宿主细胞中的靶标的序列;
c.一种任选的tracrrna序列或用于表达tracrrna序列的dna序列;
d.其中所述系统的组分在至少第一和第二核酸载体之间分割(split),其中第一载体包含组分(a),但第二载体缺乏组分(a);且
e.其中所述载体可以同时或依次共同转化宿主细胞,由此hm-crrna将cas指导至靶标以修饰宿主细胞内的靶标序列。
以上提供的“分割(split)”的定义进行必要的变更以适用于包含第一和第二载体的本发明的实例。
在一个实施方案中,tracrrna序列不是由载体提供,但是为内源性宿主细胞crispr/cas系统的tracrrna序列,其中tracrrna能够与细胞内的hm-crrna杂交,用于随后加工成为成熟的crrna,用于将cas指导至宿主细胞内的靶标。
6.实例5的系统,其中第一载体包含组分(a)且第二载体包含组分(b)和(c)。
7.实例5或6的系统,其中第一和/或第二载体各自包含1、2、3或更多个另外的工程改造的hm-crispr阵列。
8.实例5-7中任一项的系统,其中第一和第二载体之一为噬菌粒且其他载体为辅助噬菌体。
9.任一前述实例(例如实例3或6)的系统,其中crrna序列和tracrrna序列由单一指导rna(grna)包含,例如由载体提供。
10.任一前述实例的系统,其中每种载体插入外源性核酸的能力有限。
11.任一前述实例的系统,其中一种或多种载体为病毒(例如病毒粒子、包装的噬菌体、噬菌粒或前噬菌体)。
12.任一前述实例的系统,所述宿主细胞包含具有编码目标hm-序列的游离端(hm-dna)的脱氧核糖核酸链和/或其中所述系统包含编码hm-dna(例如,整合至载体中或宿主细胞基因组或其附加体中)的序列,其中所述hm-dna包含分别与所述靶标序列中或其侧翼的一个或多个序列同源的一个或多个序列。
所述链包含游离末端,即所述末端未整合至宿主或载体dna中,使得所述链具有一个或两个游离末端,即dna未分别结合至紧邻5’和/或3’的邻近核苷酸。
13.实例12的系统,其中靶标位点在宿主细胞内被cas(例如当所述cas核酸酶为cas9时通过cas)切割,并且hm-dna包含分别侧接用于将hm-dna插入宿主基因组(例如插入到染色体或附加体位点)的切割处的5’和3’同源的第一和第二序列。
14.实例13的系统,其中所述插入通过同源定向重组(hdr)。
15.实例13的系统,其中所述插入通过非同源末端连接(nhej)。
16.实例12-15中任一项的系统,其中hm-序列为或编码调节元件(例如启动子,例如替代内源性启动子的诱导型启动子)、转录抑制序列、转录增强序列、标记或者编码外源蛋白或区域的序列。
17.实例12-16中任一项的系统,其中所述系统包含第一和第二hm-dna,其中第一hm-dna的序列与第二dna的序列互补,由此dna能够通过同源重组在宿主细胞内组合以形成组合的hm-dna,用于插入宿主细胞基因组(例如插入染色体或附加体位点)。
18.任一前述实例的系统,其中一种或多种载体能够感染宿主细胞,以将包含系统组分的载体核酸引入细胞中。
19.任一前述实例的系统,其中所述cas核酸酶为切口酶。
20.任一前述实例的系统,其中所述细胞为细菌或古细菌,且所述cas核酸酶由细菌或古细菌的内源性ii型crispr/cas系统提供。
21.任一前述实例的系统,其中一种或多种载体在所述宿主细胞内,任选地整合至宿主dna中。
22.任一前述实例的系统,其中一种或多种载体缺乏cas核酸酶(例如cas9)编码序列。
23.用于感染微生物宿主细胞的工程改造核酸病毒载体(例如以上描述的病毒、病毒粒子或包装的噬菌体),其包含内源性crispr/cas系统,所述载体
(a)包含用于根据任一前述实例的crispr/cas系统中的表达多种不同crrna的核酸序列;和
(b)缺乏编码cas核酸酶(例如,cas9)的核酸序列,
其中第一所述crrna能够与所述宿主细胞内的第一核酸序列杂交;且第二所述crrna能够与所述宿主细胞内的第二核酸序列杂交,其中所述第二序列不同于所述第一序列;且
(c)第一序列由抗微生物(例如抗生素)抗性基因(或其rna)包含且第二序列由抗微生物抗性基因(或其rna)包含;任选地其中所述基因是不同的;
(d)第一序列由抗微生物抗性基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含;
(e)第一序列由必需基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含;或
(f)第一序列由毒力基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含。
24.用于转化宿主细胞的工程改造的(在宿主细胞中从载体直接工程改造或分离,其中所述载体源自转化宿主的工程改造的载体)核酸载体,其包含内源性crispr/cas系统,所述载体任选地为如上所述的载体并且
(a’)包含用于表达多种不同crrna,用于任一前述实例的crispr/cas系统的核酸序列;和
(b')缺乏编码cas核酸酶(例如,cas9)的核酸序列,
其中第一所述crrna能够与所述宿主细胞内的第一核酸序列杂交;且第二所述crrna能够与所述宿主细胞内的第二核酸序列杂交,其中所述第二序列不同于所述第一序列;且
第一和/或第二序列为宿主crispr/cas系统的靶标序列,其序列为或包含
(c’)在所述宿主crispr阵列中的重复dna或rna序列(例如其中重复区为最5’重复区(第一重复区));
(d’)tracrrna序列或tracrrna编码dna序列;
(e’)crispr阵列前导序列;
(f’)cas基因启动子(例如cas1、cas2或csn2启动子);
(g’)crispr阵列前导启动子序列;或
(h’)cas编码dna或rna序列(例如其中cas为cas9、cas1、cas2或csn2),例如其中第一所述crrna能够靶向宿主cas1基因序列(或其rna序列)且第二所述crrna能够靶向宿主cas2基因序列(或其rna序列)。
25.实例24的载体,其中第一和/或第二靶标序列为或包含
i.与第一重复区的最5’核苷酸连续的crispr阵列前导或前导启动子序列(和任选地包含重复区的所述最5’核苷酸),例如包含第一重复区的5’末端的前3个核苷酸;
ii.第一重复区的紧邻5’的最多达20(例如3、5、7、9、10、12、15、20、30或32)个连续核苷酸的序列;
iii.第一重复区的最5’核苷酸的最多达20(例如3、5、7、9、10、12、15、20、30或32)个连续核苷酸的序列;或
iv.第一间隔区的紧邻3’的最多达20(例如3、5、7、9、10、12、15、20、30或32)个连续核苷酸的序列(并且任选地其中序列包含第一间隔区的最3’核苷酸),例如包含在第一重复区3’末端的最后3个核苷酸。
26.实例24或25的载体,其中所述或每种靶标序列由选自seqidno:1-44的序列或其互补物包含。
27.实例24-26中任一项的载体,其中第一crrna包含结构r-s-r或由其组成,其中r=crispr重复区且s=crispr间隔区,其中s包含(在5’至3’方向)v-hr或hr-v或者,其中v=与载体的dna序列相同的序列且hr=所述宿主细胞crispr/cas系统的crispr阵列重复区的dna序列,其中第一crrna能够与宿主crispr阵列的间隔区杂交,以将cas指导至crrna的靶标用于修饰细胞中的宿主crispr阵列。
28.实例27的载体,其中第一crrna基本上不与载体中存在的核酸杂交。例如,其中第一crrna不与载体中的v杂交,或者杂交比其与宿主阵列的间隔区的杂交不太强烈。以上关于测定这个的讨论也适用于该实例。
29.实例27或28的载体,其中v=载体dna的1或最多达40(例如最多达15)个连续核苷酸。例如,v=载体dna的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40个连续核苷酸。
30.实例29的载体,其中
i.能够识别同源pam的宿主crispr/cas系统;
j.其中所述载体dna包含前间隔区序列的紧邻3’的这样的pam;
k.其中v=1或最多达40(例如最多达15)个前间隔区核苷酸;和
l.其中hr=与宿主crispr阵列的重复区的连续序列相同的序列。
31.实例30的载体,其中宿主阵列的重复区的所述连续序列为宿主重复区的至少50%的序列(例如包含宿主重复区的最5’或最3’核苷酸)。
32.实例30或31的载体,其中v=1-40(例如最多达15)个最3’前间隔区连续核苷酸;且任选地重复区的所述连续序列包括宿主重复区的最5’核苷酸。
33.实例30或31的载体,其中v=1-40(例如最多达15)个最5’前间隔区连续核苷酸;且任选地重复区的所述连续序列包括宿主重复区的最3’核苷酸。
34.实例27-33中任一项的载体,其中r=被宿主crispr/cas系统识别的重复区。或者,r=不被宿主crispr/cas系统识别的重复区。在这种情况下,优选地载体包含与r同源、即能够在宿主细胞内与r发挥功能的cas核酸酶的核苷酸序列(和任选地tracrrna)。
35.根据实例24-34中任一项的载体,其中第一序列根据(c’)-(h’)中任一项且第二序列选自宿主必需基因、毒力基因或抗性基因。
36.用于感染微生物宿主细胞的用于实例1-22中任一项的系统的工程改造的核酸病毒载体(例如病毒粒子或包装的噬菌体),其包含内源性crispr/cas系统,
a.所述载体包含用于在宿主细胞表达第一crrna的第一核酸序列;和
b.其中第一序列包含(在5’至3’方向)r1a-s1-r1b,其中r1a=第一crispr重复区,其中r1a为任选的;r1b=第二crispr重复区且s1=与宿主序列(例如在实例23或24中记载的宿主序列)互补的crispr间隔区,其中r1a和r1b被宿主cas核酸酶(例如ii型核酸酶,例如cas9)识别;
c.其中所述载体缺乏(i)编码识别(b)的重复区的cas核酸酶(例如cas9)的核酸序列和/或(ii)编码与第一序列编码的crrna序列互补的tracrrna序列的核酸序列。
例如,所述载体为由噬菌体包含的核酸载体。
37.实例36的载体,其中
d.所述载体包含用于在宿主中表达第二crrna的第二核酸序列,其中第二crrna不同于第一crrna;
e.其中第二序列包含(在5’至3’方向)r2a-s2-r2b,其中r2a=第一crispr重复区,其中r2a为任选的;r2b=第二crispr重复区且s2=与宿主序列(例如在实例23或24中记载的宿主序列)互补的crispr间隔区,其中r2a和r2b被宿主cas核酸酶(例如i或ii型核酸酶,例如cas6)识别。
因此,例如,第一和第二核酸序列被相同的包装的噬菌粒包含,例如在相同或不同的crispr阵列中。
38.实例37的载体,其中所述载体缺乏(iii)编码识别(e)的重复区的cas(例如cas6)的核酸序列和/或(iv)编码与第二序列编码的crrna序列互补的tracrrna序列的核酸序列。
39.包含内源性crispr/cas系统的用于共同感染微生物宿主细胞的用于实例1-22中任一项的系统中的工程改造的核酸病毒载体(例如如上所述的载体、病毒粒子或包装的噬菌体)的集合,所述集合包含第一载体和第二载体,
f.其中第一载体根据实例36;
g.其中第二载体包含用于在宿主表达第二crrna的第二核酸序列,其中第二crrna不同于第一crrna;
h.其中第二序列包含(在5’至3’方向)r2a-s2-r2b,其中r2a=第一crispr重复区,其中r2a为任选的;r2b=第二crispr重复区且s2=与宿主序列互补的crispr间隔区,其中r2a和r2b被宿主cas核酸酶(例如i或ii型核酸酶,例如cas6)识别。
例如,第一载体被第一包装的噬菌粒包含且第二载体被第二包装的噬菌粒包含。
40.实例39的集合,其中第二载体包含(v)编码识别(b)的重复区的cas(例如cas9)的核酸序列和/或(vi)编码与第一序列编码的crrna序列互补的tracrrna序列的核酸序列。
例如,在这种情况下,cas功能由内源性宿主系统提供。这节省了载体空间(例如用于包含更多的宿主靶向hm-阵列间隔区)并简化载体和阵列配置。
41.实例39或40的集合,其中第二载体缺乏(vii)编码识别(h)的重复区的cas(例如cas6)的核酸序列和/或(viii)编码与第二序列编码的crrna序列互补的tracrrna序列的核酸序列。
例如,在这种情况下,cas功能由内源性宿主系统提供。
42.实例39的集合,其中第一和第二载体每种缺乏(ix)编码识别(b)的重复区的cas(例如cas9)的核酸序列和(x)编码识别(h)的重复区的cas(例如cas6)的核酸序列;任选地其中集合由包含识别(b)和(h)的重复区的一种或多种cas的宿主细胞包含。
43.实例42的集合,所述集合进一步包含含有根据(ix)和/或(x)的核酸序列的第三载体(例如病毒粒子或噬菌体)。
44.实例39-43中任一项的集合,其中每种载体由相应包装的病毒粒子或噬菌粒或者相应的病毒粒子或噬菌体核酸包含。
45.实例36-44中任一项的载体或集合,其中r1a和r1b包含相同的重复序列。
46.实例37-45中任一项的载体或集合,其中r2a和r2b包含相同的重复序列。
47.实例37-46中任一项的载体或集合,其中(b)的重复区被cas核酸酶识别,所述cas核酸酶不同于识别(e)的重复区的cas核酸酶。
48.实例37-47中任一项的载体或集合,其中所述宿主包含不同类型的crispr/cas系统(例如i型和ii型系统;i型和iii型系统;ii型和iii系统;或i、ii和iii型系统)。
49.实例36-48中任一项的载体或集合,其中(b)的重复区被ii型cas核酸酶(例如cas9)识别。
50.实例37-49中任一项的载体或集合,其中(e)的重复区被i或iii型cas核酸酶(例如cas6)识别。
51.实例23-50中任一项的载体或集合,其中所述载体为病毒、病毒粒子、噬菌体、噬菌粒或前噬菌体。
52.包含可与由载体编码的crna一起操作的一种或多种cas的宿主细胞内的实例23-51中任一项的载体或集合。
53.包含cas9的宿主细胞内的实例23-52中任一项的载体或集合。
54.与hm-dna组合(例如整合在载体中、质粒上或宿主细胞基因组或其附加体中)的实例23-53中任一项的载体或集合,其中hm-dna如在实例12-17中任一项中所记载。
55.任一前述实例的系统、载体或集合,其包含用于表达多种不同crrna的核酸序列,其中所述crrna能够靶向宿主细胞中的至少3、4、5、6、7、8、9、10、15、20、30、40、50或100个dna序列。
56.任一前述实例的系统、载体或集合,其包含第一crrna或编码第一crna的核酸序列(所述第一crna能够靶向不是所述cas核酸酶(例如cas9)、但介导宿主载体适应性的cas核酸酶的dna序列(或其rna的序列));任选地包含第二crrna或编码第二crna的核酸序列(所述第二crna能够靶向宿主中的抗性、毒力或必需宿主基因(或其rna))。
57.任一前述实例的系统、载体或集合,其包含编码crrna的核酸序列的2、3或更多个拷贝,其中所述拷贝包含用于靶向宿主细胞序列(例如毒力、抗性或必需基因序列或者介导载体适应性但不是所述cas核酸酶的宿主crispr/cas系统组分的序列)的相同间隔区序列。
58.实例57的系统、载体或集合,其中所述拷贝在两个或更多个载体crispr阵列之间分割(split)。
59.任一前述实例的系统、载体或集合,其中所述载体重复区与宿主crispr阵列中的重复区或宿主crispr阵列相同(例如每种载体重复区与宿主重复区具有至少95%序列同一性)。
60.实例1-58中任一项的系统、载体或集合,其中所述载体重复区不与宿主crispr阵列中的重复区或宿主crispr阵列相同。
61.任一前述实例的系统、载体或集合,其包含第一和第二载体crispr阵列,所述阵列包含在相同的宿主细胞内或由相同的载体(例如质粒或病毒或病毒粒子或噬菌体或前噬菌体或噬菌粒)包含。
62.实例61的系统、载体或集合,其中第一阵列包含在第一载体中且第二阵列包含在不含有第一阵列的第二载体中(例如其中所述载体为质粒或病毒粒子(例如相同病毒类型的)或噬菌粒(例如相同噬菌体类型的)。
63.包含根据任一前述实例的系统、载体、集合、病毒、病毒粒子、噬菌体、噬菌粒或前噬菌体的宿主细胞。
64.包含根据实例1-62中任一项的系统、载体、病毒、病毒粒子、噬菌体、噬菌粒或前噬菌体的抗微生物组合物(例如抗生素,例如药物、消毒剂或漱口水)。
一起调节微生物
本发明提供了产生微生物(例如噬菌体和/或细菌群体)的方法,所述方法涉及将宿主和病毒一起调节以促进共同进化,并因此促进宿主至病毒(例如噬菌体)的调节,反之亦然。使用crrna表达或活性的可阻遏控制,本发明有意以可控的方式调节共同进化,其中期望的间隔区活性可被开启或关闭,使得能够在宿主内的间隔区指导的cas作用施加的应激存在或不存在的情况下,例如在抗生素抗性基因靶向存在或不存在的情况下发生调节。这样,细菌群体可被调整,用于其中可遇到期望基因的噬菌体失活的各种情况(例如乳制品或食品生产培养基),或者用于调节用于杀死或调节细菌,例如敲低抗生素抗性的噬菌体。在一个实施方案中,这种配置进一步使得能够将抗生素抗性细菌宿主与病毒、例如噬菌体(含有一种或多种靶向宿主抗生素抗性基因的本发明的crispr阵列)一起培养,因为在与宿主培养期间,所述方法有意阻遏阵列的抗生素抗性基因失活活性。因此,抗性细菌宿主群体可用于在培养物中使噬菌体长大(例如在工业培养容器或设备中),其允许噬菌体和宿主共同进化并相互调节而不产生抑制生长且因此抑制宿主细胞的培养能力的抗生素抗性失活效果(否则将最大限度地减少噬菌体扩增),并同时仍使得期望的噬菌体的所有其他组分适合培养的宿主群体。例如以实验室规模,使用抗生素抗性宿主细胞群体,但用对宿主细胞的抗生素抗性基因的阵列靶向去阻遏的测试噬菌体,可实施生成的噬菌体群体样品的测试。在原核细胞和噬菌体环境下基因表达的自然发生和合成阻遏为技术人员众所周知的,例如tet系统或光诱导系统。
因此,本发明提供了以下特征、编号为段落:
1.微生物生产方法,所述方法包括
(a)提供包含用于宿主细胞内的核苷酸序列靶向的宿主crispr/cas系统的宿主细胞;
(b)提供能够感染宿主细胞的病毒,其中
(i)所述病毒包含一种或多种用于修饰宿主细胞的靶标核苷酸序列的工程改造的宿主修饰(hm)crispr阵列(例如如上所述的阵列);
(ii)第一所述hm-阵列编码第一hm-crrna,其包含能够与第一宿主靶标序列杂交,以将cas指导至宿主细胞内的靶标以修饰靶标序列的间隔区序列(hm-间隔区),任选地其中第一靶标序列的修饰减少宿主细胞生长或活力;和
(iii)第一hm-阵列对第一hm-crrna的转录为可逆阻遏的和/或第一hm-crrna活性为可阻遏的;
(c)用病毒感染宿主细胞,以将一种或多种hm-crispr阵列引入细胞内;
(d)在细胞内阻遏第一hm-crrna的转录和/或第一hm-crrna活性;
(e)培养感染的宿主细胞以产生包含病毒群体(pv1)的宿主细胞群体(ph1);和
(f)获得病毒群体(pv1)和/或培养的宿主细胞群体。
在一个实例中,第一hm-crrna包含能够与第一宿主靶标序列杂交,以将cas指导至宿主细胞内的靶标以修饰靶标序列的hm-间隔区,其中靶标序列为宿主crispr/cas系统的核苷酸序列,由此第一hm-crrna将cas指导至靶标以修饰宿主细胞内的宿主crispr/cas系统,其中靶标序列的修饰减少或消除宿主crispr/cas系统的功能。
在一个替代方案中,所述修饰增强或抑制宿主中的基因表达。在一个实施方案中,所述基因为必需基因、毒力基因或抗性基因(例如抗生素抗性基因)。在一个实施方案中,所述修饰增强对宿主为内源性或外源性的基因产物的表达。在一个实例中,所述宿主为包含外源性核苷酸序列(例如用于产生期望的蛋白)的工程改造的宿主,并且所述修饰增强或抑制期望的蛋白在宿主细胞中的表达。在一个实例中,期望的蛋白为抗生素且所述宿主细胞为微生物,例如细菌或古细菌细胞。因此,所述方法使得能够培养宿主细胞以产生病毒群体,其中抗生素不被表达,否则阻碍宿主细胞群体的增殖。之后,分离的病毒群体中的一种或多种病毒可用于减少宿主细胞生长或活力的抗微生物组合物中,因为第一hm-crrna阻遏可在分离之后去除,由此提供活性抗生素病毒组合物。本发明因此也提供了这样的方法和包含能够在宿主细胞中表达抗生素的病毒的这样的抗生素组合物。例如通过提供缀合至转录活化因子的cas(例如cas9),可实现活化表达的修饰,其中cas为第一hm-crrna的同源cas,并且活化因子活化期望的外源性或内源性基因的转录。例如通过提供失活cas(例如dcas9),可实现抑制表达的修饰,其中cas为第一hm-crrna的同源cas,并且抑制期望的外源性或内源性基因的转录。
crrna转录或活性的阻遏可为部分或完全的(即crrna没有活性或没有在宿主自阵列转录)。活性是指crrna与同源宿主序列杂交用于将cas指导至第一宿主靶标位点用于修饰的能力。
在一个实例中,病毒在被引入细胞内时不受如此阻遏,所述方法包括在病毒已经感染细胞后,例如通过使用化学、物理、机械、磁性、光或引起阻遏的其他试剂来实施步骤(d)。在一个实施方案中,第一hm-阵列包含可阻遏启动子(hm-启动子)用于第一hmcrrna的转录,并且在将第一hm-阵列引入细胞内后阻遏启动子(例如通过将阻遏剂(例如化学品或蛋白)结合至启动子)。
在另一个实例中,病毒在实施步骤(c)之前,例如通过使用化学、物理、机械、磁性、光或引起阻遏的其他试剂受到如此阻遏。在一个实施方案中,第一hm-阵列包含可阻遏启动子(hm-启动子)用于第一hmcrrna的转录,并且在将第一hm-阵列引入细胞内之前阻遏启动子(例如通过将阻遏剂(例如化学品或蛋白)结合至启动子),其中随后被阻遏的第一hm-阵列被引入细胞内。
在一个实施方案中,步骤(f)包括分离pv1。在一个实施方案中,步骤包括从ph1的宿主细胞分离pv1或其病毒。
2.段落1的方法,所述方法进一步包括在步骤(e)或(f)之后使病毒群体的第一hm-crrna的转录和/或第一hm-crrna活性去阻遏,并且任选地之后进一步培养宿主细胞。
3.任一前述段落的方法,所述方法包括
a.获得任选地与(a)、(f)的宿主细胞或段落2的进一步培养的细胞相同的宿主细胞的群体(ph2);
b.用来自群体pv1的病毒感染a的宿主细胞;
c.阻遏细胞中第一hm-crrna的转录和/或第一hm-crrna活性;
d.培养感染的宿主细胞,以产生包含病毒群体(pv2)的宿主细胞群体(ph3);和
e.获得病毒群体(pv2)(或其病毒)和/或培养的宿主细胞群体。
4.段落3的方法,所述方法进一步包括在步骤(d)或(e)之后使病毒群体中的第一hm-crrna的转录和/或第一hm-crrna活性去阻遏,并且任选地之后进一步培养宿主细胞。
5.任一前述段落的方法,所述方法包括测试病毒群体pv1或pv2在另外的宿主细胞或宿主细胞群体(ph4)上的分离样品,任选地其中另外的细胞或群体ph4与(a)的细胞相同,所述测试包括用所述样品的病毒感染另外的细胞或群体ph4,等待一段时间以允许发生任何宿主细胞生长,并确定是否已经修饰(例如减少,诸如减少宿主细胞生长或活力*)或发生另外细胞或群体ph4的预定活性(例如细胞生长或活力),其中一种或多种细胞内的病毒在所述时间段期间使第一hm-crrna的转录和/或第一hm-crrna活性去阻遏。
*对于将样品的病毒加入铺板在琼脂上的细胞或ph4时的空斑形成,这可使用标准测定法进行测试。
6.任一前述段落5的方法,其中所有的宿主细胞为微生物细胞(例如细菌或古细菌细胞)且第一靶标序列的修饰减少宿主细胞生长或活力,并且所述测定确定已发生抗微生物活性**。
这可使用标准空斑测定法测定。
7.段落5或6的方法,其中时间段为至少1、5、10、30、60或120分钟。
8.段落5-7中任一项的方法,其中(a)的细胞和任选地ph1、ph2和/或ph3细胞不包含第一靶标序列,其中另外的细胞或群体ph4细胞包含第一靶标序列。
9.段落1-8中任一项的方法,其中(a)的细胞和任选地ph1、ph2和/或ph3细胞不包含赋予第一抗生素抗性的基因,其中第一靶标序列为这样的基因的靶标序列;任选地其中另外的细胞或群体ph4细胞包含这样的基因。
10.段落1-7中任一项的方法,其中(a)的细胞和任选地ph1、ph2和/或ph3细胞包含赋予第一抗生素抗性的基因,其中第一靶标序列为这样的基因的靶标序列。
11.任一前述段落的方法,其中所有宿主细胞为微生物细胞(例如细菌或古细菌细胞)且第一靶标序列的修饰减少宿主细胞生长或活力,或者减少宿主细胞对抗生素的抗性。
12.任一前述段落的方法,其中所有宿主细胞为人、动物(例如非人动物)或植物的感染性疾病病原体。
13.任一前述段落的方法,其中所有宿主细胞都是相同物种的,例如,选自以下的物种:埃希氏杆菌属(例如大肠杆菌o157:h7或o104:h4)、志贺氏菌属(例如痢疾杆菌)、沙门氏菌属(例如伤寒沙门氏菌或肠道沙门氏菌,例如血清型鼠伤寒沙门氏菌,例如dt104)、欧文氏菌属、耶尔森菌属(例如鼠疫耶尔森氏菌)、芽胞杆菌属、弧菌属、军团菌属(例如嗜肺军团菌)、假单胞菌属(例如铜绿假单胞菌)、奈瑟氏菌属(例如淋病奈瑟氏菌或脑膜炎奈瑟氏菌)、博德特氏菌属(例如百日咳博德特氏菌)、螺杆菌属(例如幽门螺杆菌)、李斯特氏菌属(例如单核细胞增生李斯特氏菌)、农杆菌属、葡萄球菌属(例如金黄色葡萄球菌,例如mrsa(甲氧西林抗性金黄色葡萄球菌))、链球菌属(例如化脓性链球菌或嗜热链球菌)、肠球菌属、梭菌属(例如艰难梭状芽胞杆菌或肉毒梭状芽胞杆菌)、棒状杆菌属(例如无枝菌酸棒杆菌)、分枝杆菌属(例如结核分枝杆菌)、密螺旋体属、疏螺旋体属(例如博氏疏螺旋体)、弗朗西斯氏菌属、布鲁氏菌属、弯曲杆菌属(例如空肠弯曲杆菌)、克雷伯氏菌属(例如肺炎克雷伯氏菌)、弗兰克氏菌属、巴尔通氏体属、立克次体属、希瓦氏菌属、沙雷氏菌属、肠杆菌属、变形杆菌属、普罗威登斯菌属、环丝菌属、双歧杆菌属、短杆菌属、丙酸菌属、乳球菌属、乳杆菌属、小球菌属、明串珠菌属、弧菌属(例如霍乱弧菌,例如o139或创伤弧菌)、嗜血杆菌属(例如流感嗜血杆菌)、布鲁氏菌属例如(流产布鲁氏菌)、弗朗西斯氏菌属、黄单胞菌属、埃立克体属(例如查菲埃立克体)、衣原体属(例如衣原体肺炎)、副衣原体属、肠球菌属(例如粪肠球菌或屎肠球菌,例如利奈唑胺耐药的)、酒球菌属和不动杆菌属(例如鲍曼不动杆菌,例如多重耐药的)。
14.权利要求13的方法,其中所述宿主细胞全部是金黄色葡萄球菌细胞,例如对选自甲氧西林、耐万古霉素和替考拉宁的抗生素抗性的。
15.权利要求13的方法,其中所述宿主细胞全部是铜绿假单胞菌细胞,例如对选自头孢菌素类(例如头孢他啶)、碳青霉烯类(例如亚胺培南或美罗培南)、氟喹诺酮类、氨基糖苷类(例如庆大霉素或妥布霉素)和粘菌素的抗生素抗性的。
16.权利要求13的方法,其中所述宿主细胞全部是克雷伯氏菌属(例如肺炎克雷伯氏菌)细胞,例如对碳青霉烯类抗性的。
17.权利要求13的方法,其中所述宿主细胞全部是链球菌属(例如肺炎链球菌或化脓性链球菌)细胞,例如对选自红霉素、克林霉素、β-内酰胺类、大环内酯类、阿莫西林、阿奇霉素和青霉素的抗生素抗性的。
18.权利要求13的方法,其中所述宿主细胞全部是沙门氏菌属(例如血清型伤寒沙门氏菌细胞),例如对选自头孢曲松、阿奇霉素和环丙沙星的抗生素抗性的。
19.权利要求13的方法,其中所述宿主细胞全部是志贺氏菌属细胞,例如对选自环丙沙星和阿奇霉素的抗生素抗性的。
20.权利要求13的方法,其中所述宿主细胞全部是结核分枝杆菌细胞,例如对选自耐异烟肼(inh)、利福平(rmp)、氟喹诺酮类、阿米卡星、卡那霉素和卷曲霉素的抗生素抗性的。
21.权利要求13的方法,其中所述宿主细胞全部是肠球菌属细胞,例如对万古霉素抗性的。
22.权利要求13的方法,其中所述宿主细胞全部是肠杆菌科细胞,例如对选自头孢菌素类和碳青霉烯类的抗生素抗性的。
23.权利要求13的方法,其中所述宿主细胞全部是大肠杆菌细胞,例如对选自甲氧苄啶、呋喃妥因、头孢氨苄和阿莫西林的抗生素抗性的;
24.权利要求13的方法,其中所述宿主细胞全部是梭菌属(例如艰难梭状芽胞杆菌)细胞,例如对选自氟喹诺酮类抗生素和碳青霉烯类的抗生素抗性的。
25.权利要求13的方法,其中所述宿主细胞全部是淋病奈瑟氏菌细胞,例如对选自头孢克肟(例如口服用头孢菌素)、头孢曲松(注射用头孢菌素)、阿奇霉素和四环素的抗生素抗性的。
26.权利要求13的方法,其中所述宿主细胞全部是鲍曼不动杆菌细胞,例如对选自β-内酰胺类、美罗培南和碳青霉烯类的抗生素抗性的。
27.权利要求13的方法,其中所述宿主细胞全部是弯曲杆菌属细胞,例如对选自环丙沙星和阿奇霉素的抗生素抗性的。
28.任一前述段落的方法,其中所述宿主细胞产生β(β)-内酰胺酶。
29.任一前述段落的方法,其中所述宿主细胞对在段落14-27中任一项中记载的抗生素为抗性的。
30.段落29的方法,其中第一靶标序列为编码对所述抗生素赋予宿主细胞抗性的产物的基因序列。
31.任一前述段落的方法,其中第一靶标序列为抗生素抗性基因的序列(即用于赋予宿主细胞对抗生素的抗性,例如甲氧西林抗药性)和/或群体ph1、群体ph2、群体ph3和群体ph4中的一种、多种或全部对抗生素或所述抗生素(例如在段落13-27中任一项中记载的抗生素)为抗性的。
32.任一前述段落的方法,其中病毒群体pv1或pv2的去阻遏病毒具有抗微生物活性(例如抗菌活性,诸如当病毒为噬菌体时);任选地其中宿主细胞或多种细胞包含如在段落30中记载的第一靶标序列,其中第一靶标的修饰提供所述抗微生物活性。
33.从属于段落5的任一前述段落的方法,其中ph4的细胞对抗生素(例如在段落13-27中任一项中记载的抗生素)为抗性的,并且(a)的细胞和ph2对所述抗生素为非抗性的。这有助于制造用于药物用途的病毒,因为培养和扩增可相对安全地进行而没有必须应对抗生素抗性宿主细胞的风险(以及这些控制(containment)不足和例如从药物制造设备逸出的风险)。然而,针对ph4的测试可在控制(containment)实验室或设置用于抗生素抗性宿主菌株的其他设施实施。当针对ph4测试时,第一hm-crrna被去阻遏,使得可通过本发明的hm-阵列修饰宿主细胞内的抗性基因。
34.任一前述段落的方法,其中宿主crispr/cas系统为i、ii或iii型系统,并且靶标序列为在与(a)的宿主细胞相同属的至少一、二或三种另外的宿主菌株或物种中的所述系统类型中保存的核苷酸序列。
35.任一前述段落的方法,其中所述病毒为噬菌体或噬菌粒。
36.段落35的方法,其中(b)的病毒为覆盖噬菌体科、囊状噬菌体科、丝状噬菌体科、光滑噬菌体科、微小噬菌体科、肌尾噬菌体科、短尾噬菌体科、长尾噬菌体科或复层噬菌体科病毒。
37.段落35或36的方法,其中(b)的病毒为天然存在的噬菌体,例如从属于与(a)的细胞相同菌株的细胞诱导的噬菌体。
38.段落35、36或37的方法,其中(b)的噬菌体为使用噬菌体抗性细菌通过选择压力获得的突变噬菌体。
39.任一前述段落的方法,其中在(b)中
(iv)所述一种或多种hm-阵列包含编码第二hm-crrna的hm-阵列,所述第二hm-crrna包含能够与第二宿主靶标序列杂交,以将cas指导至宿主细胞中的第二靶标以修饰靶标序列的hm-间隔区,其中第二靶标序列为宿主crispr/cas系统的核苷酸序列,由此第二hm-crrna将cas指导至第二靶标,以修饰宿主细胞中的宿主crispr/cas系统,其中第二靶标序列的修饰减少或消除宿主crispr/cas系统的功能;和
(v)其中(iv)的hm-阵列在(a)的细胞中对于能够与第二宿主靶标序列杂交的第二hm-crrna的转录是有活性的。
在一个实施方案中,(ii)和(iv)的hm-阵列为相同的hm-阵列。在另一个实施方案中,它们为不同的hm-阵列(例如不同crispr/cas类型的阵列,例如i和ii型、或ii和iii型、或i和iii型、或不同的ii型阵列)。
40.段落39的方法,其中ph1-4中的任何一种或全部的细胞包含所述第二靶标序列。
41.段落39或40的方法,其中第二靶标序列与在段落11-24中任一项中记载的细胞的属或物种(例如嗜热链球菌、化脓性链球菌或金黄色葡萄球菌)的crispr/cas系统序列相同。
42.段落39-41中任一项的方法,其中第二靶标序列由选自seqidno:1-44的序列或其互补物包含。
43.段落39-42中任一项的方法,其中第二靶标序列包含
a.重复dna或rna序列(例如其中重复区为所述宿主crispr阵列中的最5’重复区(第一重复区));
b.tracrrna序列或tracrrna编码dna序列;crispr阵列前导序列;
c.cas基因启动子(例如cas1、cas2或csn2启动子);
d.crispr阵列前导启动子序列;或
e.cas编码dna或rna序列(例如其中cas为cas9、cas1、cas2或csn2)。
44.段落39-43中任一项的方法,其中第二靶标序列包含
f.与第一重复区的最5’核苷酸连续的crispr阵列前导或前导启动子序列(和任选地包含重复区的所述最5’核苷酸);
g.第一重复区的紧邻5’的最多达20个连续核苷酸的序列;
h.第一重复区的最5’核苷酸的最多达20个连续核苷酸的序列;或
i.第一间隔重复区的紧邻3’的最多达20个连续核苷酸的序列(和任选地其中序列包含第一间隔区的最3’核苷酸)。
45.段落39-44中任一项的方法,其中
j.第二hm-crrna包含结构r-s-r或由其组成,其中r=crispr重复区且s=crispr间隔区,其中s包含(在5’至3’方向)v-hr或hr-v或者,其中v=与(b)的病毒的dna序列具有至少95、96、97、98或99%同一性的序列且hr=所述宿主细胞crispr/cas系统的crispr重复区的dna序列;
k.其中hr的序列与宿主crispr/cas系统中v的序列紧接;且
l.其中第二hm-crrna能够与宿主crispr/cas系统的间隔区杂交,以将cas指导至间隔区,用于修饰(例如裂解或失活)细胞中的宿主crispr/cas系统。
46.段落45的方法,其中v=病毒dna的1或最多达40(例如最多达15)个连续核苷酸。
47.段落39-46中任一项的方法,其中第二hm-crrna基本上不与(b)的病毒核酸杂交。
48.段落45-47中任一项的方法,其中
a.宿主crispr/cas系统能够识别同源pam;
b.其中(b)的病毒的核酸包含前间隔区序列的紧邻3’的这样的pam;
c.其中v=前间隔区的1或最多达40(例如最多达15)个核苷酸;和
d.其中hr=与宿主crispr/cas系统的重复区连续序列相同的序列。
49.段落48的方法,其中宿主系统重复区的所述连续序列为宿主重复区的至少50%的序列(例如包括宿主重复区的最5’或最3’核苷酸)。
50.段落45或46的方法,其中v=1-40(例如最多达15)个最3’前间隔区连续核苷酸;和任选地重复区的所述连续序列包括宿主重复区的最5’核苷酸。
51.段落48或49的方法,其中v=1-40(例如最多达15)个最5’前间隔区连续序列;和任选地重复区的所述连续序列包括宿主重复区的最3’核苷酸。
52.段落45-51中任一项的方法,其中r=被宿主crispr/cas系统识别的重复区。
53.任一前述段落的方法,其中所述或每种hm-crispr包含(在5’至3’方向)第一重复序列、第一间隔区序列和第二重复序列,其中间隔区序列包含能够与宿主细胞中的相应靶标序列的序列杂交,所述阵列进一步包含用于宿主细胞中重复区和间隔区的转录的启动子,且任选地(b)的病毒核酸包含cas核酸酶编码序列和/或用于编码宿主细胞内的功能性cas和/或tracrrna序列的tracrrna-编码序列,其中tracrrna序列包含与第一或第二重复区互补的序列。
54.任一前述段落的方法,其中所述或每种hm-crispr阵列包含(在5’至3’方向)第一重复序列、第一间隔区序列和第二重复序列,其中间隔区序列包含能够与宿主细胞中的相应靶标序列的序列杂交,所述阵列进一步包含用于宿主细胞中重复区和间隔区的转录的启动子,并且其中所述载体不包含cas核酸酶编码序列和/或用于编码宿主细胞内tracrrna序列的tracrrna编码序列,其中tracrrna序列包含与第一或第二重复区互补的序列,其中hm-crispr阵列在宿主细胞内有功能以将cas(例如内源性宿主cas核酸酶)指导至相应的宿主靶标位点(任选地使用宿主tracrrna)。
55.段落53或54的方法,其中重复区与宿主crispr/cas系统中的重复区相同,其中所述或每种hm-crispr阵列不包含被宿主crispr/cas系统的cas(例如cas核酸酶,例如cas9)识别的pam。
56.任一前述段落的方法,其中所述或每种hm-crispr阵列包含hm-间隔区的多于1个拷贝(例如至少2、3或4个拷贝)。
57.任一前述段落的方法,其编码第二或第三hm-crrna(另外的hm-crrna),其中另外的hm-crrna包含能够与宿主靶标序列杂交、以将cas指导至宿主细胞内的靶标的核苷酸序列;任选地其中靶标序列为宿主细胞的、或者宿主细胞的crispr/cas系统的必需组分的必需、毒力或抗性基因的核苷酸序列。
58.任一前述段落的方法,其中所述或每种hm-crispr阵列包含与宿主细胞内源性crispr重复序列相同的用于产生宿主细胞内相应hm-crrna的crispr重复序列。
59.任一前述段落的方法,其中(b)的病毒包含编码在(a)的宿主细胞内为功能性的cas(非宿主cas)的核苷酸序列(例如其中非宿主cas为i型系统cas(其中宿主系统为ii或iii型)、ii型系统cas(其中宿主系统为i或iii型)或者iii型系统cas(其中宿主系统为i或ii型)),任选地其中宿主细胞不包含或表达与非宿主cas类型相同类型的cas。
60.任一前述段落的方法,其中(b)的病毒包含编码tracrrna序列的核苷酸序列,任选地其中tracrrna序列和第一hm-crrna由单一指导rna(grna)包含。
61.任一前述段落的方法,其中所述或每种hm-crrna由相应的单一指导rna(grna)包含。
62.任一前述段落的方法,其中第一hm-阵列可操作以引起第一靶标序列中的cas裂解、第一靶标序列(或包含第一靶标序列的基因)的活化、第一靶标序列(或包含第一靶标序列的基因)的敲低或第一靶标序列的突变。
63.可通过任一前述段落的方法获得的病毒、宿主细胞或病毒群体,任选地其中所述群体与pv1或pv2相同或者病毒可获得自这样的群体。
64.可通过任一前述段落的方法获得的宿主细胞(例如细菌细胞)群体,任选地其中所述群体与ph1、ph2、ph3或ph4或者任一前述段落中记载的培养的细胞群体相同。
65.段落64的宿主细胞群体,其中所述群体不包含(b)的病毒核酸,或者不包含所述第一hm-阵列或所述第二hm-阵列(例如如如通过pcr所测定)。
66.段落63-65中任一项的病毒、宿主细胞或群体,其用于医学或牙科和眼科用途(例如用于在生物体中治疗或预防感染或在生物体中限制感染的传播)。
67.包含根据段落63-66中任一项的病毒、宿主细胞或群体的组合物,其用于食品、饮料、乳制品或化妆品用途(例如用于美容产品,例如化妆品)或者用于卫生用途(例如用于卫生用品,例如肥皂)。
68.根据段落63-67中任一项的组合物、病毒、宿主细胞或群体在医药或牙科治疗或预防性使用中的用途。
69.根据段落63-68中任一项的组合物、病毒、宿主细胞或群体在美容用途(例如用于美容产品,例如化妆品)或者用于卫生用途(例如用于卫生用品,例如肥皂)中的用途。
70.段落63-69中任一项的用途、病毒、宿主细胞或群体,其用于修饰微生物宿主细胞(例如用于杀死或减少细胞生长或微生物细胞的培养)。
71.段落1-63和66-70中任一项的方法、病毒或病毒群体,其中所述病毒或所述群体中的病毒表达穿孔素和/或细胞内溶素用于宿主细胞裂解,任选地其中细胞内溶素为噬菌体phi11、噬菌体twort、噬菌体p68、噬菌体phiwmy或噬菌体k细胞内溶素(例如mv-l细胞内溶素或p-27/hp细胞内溶素)。
72.段落1-63和66-70中任一项的方法、病毒或病毒群体,其中所述病毒或所述群体中的病毒不表达用于宿主细胞裂解的穿孔素和/或细胞内溶素。
73.段落1-63和66-70中任一项的方法、病毒或病毒群体,其中所述病毒(例如(b)的病毒)或每种所述群体中的病毒与在(a)宿主细胞中有功能的抗微生物剂、例如抗生素、例如β-内酰胺类抗生素(例如在段落13-27中任一项中记载的抗生素)组合。
腐蚀、生物膜和生物污损的控制
本发明尤其涉及控制工业或家用系统中的基底或流体的微生物影响的腐蚀(mic)或生物污损的方法。本发明还涉及用于所述方法中的处理液和载体。
腐蚀为一系列化学、物理和(微)生物过程的结果,导致材料诸如金属(例如钢或铁)、塑料和石头的劣化。这是一个世界性的问题,具有巨大的社会和经济后果。目前基于化学生产的产品的腐蚀控制策略处于日益严格的环境法规的压力之下。此外,它们相当低效,并且可能受到微生物(例如细菌)对所用试剂抗性的阻碍。因此,迫切需要环境友好和可持续的腐蚀控制策略。腐蚀受进行不同的电化学反应和分泌可能具有次生效应的蛋白和代谢物的不同微生物的复杂过程的影响。
微生物腐蚀过程的严重性从许多工业和家用金属和合金诸如不锈钢、镍基和铝基合金及材料诸如混凝土、沥青和聚合物易于被微生物降解的事实是显而易见的。保护涂层、抑制剂、油和乳剂也会受到微生物降解的影响。
微生物影响的腐蚀(mic)为一个昂贵的问题,其影响烃类生产和加工设备、水分配系统、船舶、轨道车及其他类型的金属和非金属的工业和家用系统。特别是已知mic对烃类燃料基础设施(包括生产、运输和存储系统)造成相当大的损害,通常会带来灾难性的环境污染结果。在石油工业中约40%的管道腐蚀归因于微生物腐蚀,并导致每年在石油生产、运输和仓储方面出现巨大的经济损失。由于管壁上的结垢过程,管道生物膜可造成设备中的流体流速降低。此外,由于腐蚀而产生管道泄漏,随之而来的是对环境和生产率产生影响。
mic发生于诸如土壤、淡水和海水等环境中,并且据估计造成全部腐蚀损坏中的多于30%。mic由于微生物诸如细菌的固定、代谢物的释放和通常形成诱导或加速腐蚀过程的生物膜而发生。在参与腐蚀过程的细菌群中包括:硫或硫酸盐还原细菌(srb)、胞外聚合物产生细菌(epsb)、产酸细菌(apb)、硫或硫化物氧化细菌(sob)、铁或锰氧化细菌(iob)、产氨细菌(ampb)或产乙酸细菌(acpb)。小亚单位核糖体rna基因焦磷酸测序调查表明,醋酸产生细菌(醋杆菌属物种和葡糖醋杆菌属物种)在接触燃料级乙醇和水的环境中普遍存在。
环境条件下的微生物生长直接或间接地影响电化学反应。微生物-基底相互作用导致初始粘附和生物膜形成。微生物诸如细菌附着于基底、释放代谢物和形成生物膜影响基底表面的电化学条件,诱导或加速腐蚀过程,从而介导mic过程。在金属基底上形成细菌生物膜包括以下步骤:i-通过在金属上吸附有机和无机分子形成膜,这修饰金属表面的载荷分布,并且也用作细菌的营养来源,促进液体中存在的自由漂浮微生物的粘附;ii-好氧菌形成微菌落的粘附和增殖;iii-通过一些固着菌产生胞外聚合物(eps);iv-通过好氧自由漂浮微生物细胞进行定植,其通过呼吸消耗氧气,在生物膜中建立如严格厌氧菌要求的局部厌氧环境;和v-增加生物膜厚度,这可有利于外层的脱落。由细菌产生的粘附于生物膜的eps捕获用于其生长的必需离子;除了在养分可用性低的情况下用作营养来源,它们还用作附着的手段,并通过有利于建立差异化的曝气区保护细菌免受生物杀灭剂干扰腐蚀机制。由于生物膜在具有曝气区(生物膜周围)和非曝气区(生物膜下面)的金属基底上分布不均匀而发生差异曝气的腐蚀过程。金属表面的生物膜形成降低含氧量,达到几乎完全厌氧水平。假单胞菌属为主要的eps产生属。
由腐蚀性细菌介导的mic生物腐蚀过程的实例如下:(a)来自淡水、海水、工业/家用系统或储槽的好氧腐蚀性细菌伸出其表面具有条件层的工业或家用系统的设备和管道。(b)eps-产生细菌附着于设备/管道壁并产生eps,为其他微生物创建有利的附着环境。(c)发生其他腐蚀性细菌群(groups)粘附于管道壁上,释放其代谢物,通过细胞分裂、消耗可用的氧气发展成微菌落。铁氧化细菌的作用导致三价铁沉淀大量积累,造成设备/管道堵塞;硫氧化细菌释放的硫酸促进环境酸化。(d)低氧浓度和由产酸细菌释放的有机酸有利于产生硫化氢(h2s)的硫酸盐还原细菌的附着与发展,从而加速腐蚀过程和降低局部ph。(e)结果是设备/管道腐蚀,部分被铁沉淀堵塞,伴有微泄漏和细菌生物被膜。h2s对操作被影响系统的人员构成严重的健康风险。此外,产生厚的生物膜和污泥导致生物污损和妨碍系统的功能。
类似地,细菌群体可在液体诸如水商店或储库中(例如饮用水或冷却系统的水中)传播,从而介导液体的生物污损。这也可称为液体的恶化变质。一个实例为水道或饮用水储库恶化变质。
本发明通过提供以下方面1以及下列等等解决这样的mic和生物污损问题:-
1.控制工业或家用系统中的基底的微生物影响的腐蚀(mic)或生物污损的方法,其中基底的表面与介导基底的mic或生物污损的第一微生物物种的第一宿主细胞群体接触,所述方法包括
(i)使群体与多种能够转化或转导细胞的载体接触,每种载体包含crispr阵列,由此crispr阵列被引入宿主细胞中,其中
(a)每种crispr阵列包含一个或多个用于表达crrna的核苷酸序列和用于在宿主细胞中序列转录的启动子;和
(b)每种crrna能够与宿主细胞的靶标序列杂交,以在宿主细胞内指导cas(例如cas核酸酶,例如cas9或cpf1)以修饰靶标序列(例如切割靶标序列);所述靶标序列为用于介导宿主细胞活力的基因序列;和
(ii)允许所述crna在宿主细胞中在cas存在的情况下进行表达,由此修饰宿主细胞内的靶标序列,导致宿主细胞活力减小并控制所述基底的mic或生物污损。
在一个实例中,所述系统包含设备(例如用于工业过程)且表面为所述设备的表面。在一个实例中,每种阵列为工程改造的阵列,例如本文公开的任何工程改造的阵列。在一个实施方案中,载体为如本文描述的工程改造crispr核酸载体。在一个实例中,生物污损包括微生物生物膜和/或污泥的形成、增殖或维持。在一个实例中,第一宿主细胞为固着的。在方面1或4的一个实例中(以下),“控制”包括防止、减少或消除所述mic或生物污损,或者减少所述mic或生物污损在系统中的扩散。细菌如何介导mic或生物污损的非限制性实例在以上描述。细胞生长或增殖或维持为例如细胞活力的特征。因此,在一个实例中,所述方法减少宿主细胞增殖和/或维持。在一个实例中,所述方法杀死宿主细胞。
2.方面1的方法,其中所述宿主细胞被与所述基底接触的微生物生物膜包含。
3.任一前述方面的方法,其中所述表面和宿主细胞与流体诸如水性液体(例如海水、淡水、储存水或饮用水)接触。
淡水为地球表面在冰原、冰盖、冰川、冰山、沼泽、池塘、湖泊、河流和溪流中以及地下作为含水层和伏流中的地下水天然存在的水。淡水通常特征为具有低浓度的溶解盐和其他完全溶解的固体。该术语具体地不包括海水和苦咸水,尽管其确实包括富含矿物质的水诸如铁质泉。在一个实例中,所述淡水为这些淡水类型中的任一种。饮用水为用于人或动物(例如牲畜)食用的水。在一个实例中,流体选自工业冷却水(其中系统为冷却系统)、污水(其中系统为污水处理或储存系统)、饮用水(其中系统为饮用水处理、储存、运输或输送系统)、造纸水(其中系统为纸张制造或加工系统)、游泳池水(其中系统为泳池或泳池水处理或储存系统)、灭火器用水(其中系统为灭火系统)、或者任何管道、槽、坑、池或通道中的工业过程用水。
4.控制工业或家用系统中的流体的微生物污损(例如用于控制储库或容器中流体的细菌恶化变质)的方法,其中所述流体包含介导所述生物污损的第一微生物物种的第一宿主细胞群体,所述方法包括
(i)使所述群体与多种能够转化或转导细胞的载体接触,每种载体包含crispr阵列,由此crispr阵列被引入宿主细胞中,其中
(a)每种crispr阵列包含一个或多个用于表达crrna的序列和用于在宿主细胞内序列转录的启动子;和
(b)每种crrna能够与宿主细胞的靶标序列杂交,以指导宿主细胞内的cas(例如cas核酸酶)以修饰靶标序列(例如切割靶标序列);所述靶标序列为介导宿主细胞活力的基因序列;且
其中所述方法包括允许所述crna在宿主细胞中在cas存在的情况下进行表达,由此修饰宿主细胞内的靶标序列,导致宿主细胞活力减小并控制所述生物污损。
在一个实例中,流体为液体。在一个实例中,流体为气态流体。
系统:用于任何一个方面的实例系统选自:
石化产品回收、加工、储存或运输系统;烃类回收、加工、储存或运输系统;原油回收、加工、储存或运输系统;天然气回收、加工、储存或运输系统(例如油井、石油钻井平台、石油钻探设备、油品泵送系统、石油管道、天然气钻井平台、天然气开采设备、天然气泵送设备、天然气管道、油轮、气槽船、储油装备或储气装备);水处理或储存设备、蓄水池(例如饮用水蓄水池);空气或水调节(例如冷却或加热)设备,例如冷却液管、冷凝器或热交换器;医疗或手术设备、环境(例如土壤、水道或空气)处理设备、纸张制造或回收设备、发电厂例如火力或核能发电厂、燃料(例如烃类燃料,例如石油、柴油或lpg)储存设备;采矿或冶金、矿物或燃料回收系统例如矿山或采矿设备;工程系统、船舶设备、货物或货物储存设备(例如货物集装箱);食品或饮料制造、加工或包装设备;清洗设备(例如洗衣设备,例如洗衣机或洗碗机)、餐饮(例如家庭或商业餐饮)设备、耕作设备、建筑(例如建筑、公用事业基础设施或道路施工)设备、航空设备、航空航天设备、运输设备(例如机动车辆(例如汽车、卡车或货车))、轨道车、航空器(例如飞机)或者海洋或水路交通车辆(例如船只或船舶,潜艇或气垫船))、包装设备例如消费品包装设备、或者食品或饮料包装设备、电子产品(例如计算机或移动电话或其电子元件)、或者电子产品制造或包装设备、牙科设备、工业或家用管道(例如海底管道)或储存容器(例如水槽或燃料箱(例如油箱,例如车辆油箱))、地下设备、建筑物(例如住宅或办公室或商业楼宇或工厂或发电站)、道路、桥梁、农业设备、工厂系统、原油或天然气勘探设备、办公室系统和家居系统。
在一个实例中,所述系统用于选自以下的工业或商业中:农业、石油或石化工业、食品或饮料行业、服装行业、包装行业、电子行业、计算机行业、环境行业、化学工业、航空航天工业、汽车行业、生物技术行业、医疗行业、健康行业、牙科产业、能源产业、消费品产业、医药工业、采矿业、清洗业、林业、渔业、休闲业、回收业、化妆品业、塑胶工业、纸浆或造纸工业、纺织业、服装行业、皮革或仿麂皮或兽皮行业、烟草行业或钢铁行业。在一个实例中,待处理的表面或流体为用于所述所选择的行业中的设备的表面或流体。在一个实例中,系统用于原油工业中。在一个实例中,系统用于天然气工业中。在一个实例中,系统用于石油工业中。在一个实例中,所述系统为海运集装箱、平台或钻井平台(例如用于海上或海上的石油或天然气平台或钻井平台)、船舶或船只。在一个实施方案中,这样的系统锚定在海上,例如非暂时性锚定在海上,例如已经在海上锚定1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或更多个月(例如连续几个月)。在一个实施方案中,这样的系统处于国家或州的水域中,例如非暂时性地在这样水域的海水中,例如已经处于所述国家的水域中1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或更多个月(例如连续几个月)。
在一个实例中,待处理的基底表面包括不锈钢,碳钢、铜、镍、黄铜、铝、混凝土、塑料或木材。在一个实例中,基底为金属焊接或连接。在一个实例中,表面为金属(例如钢或铁)或非金属(例如塑料、混凝土、沥青、木材、橡胶或石料)表面。在一个实例中,金属为合金(例如不锈钢、黄铜或者镍、锌、铜、镍或铝合金)。在一个实例中,表面为人造聚合物表面。在一个实例中,表面为基底涂层。在一个实例中,基底与土壤、淡水或海水接触。
在一个实例中,所述流体为饮用水、水道、苦咸水;或者液体燃料例如汽油或柴油(例如用于小汽车或机动车辆)、lpg、煤油、醇(例如乙醇、甲醇或丁醇)、液体氢或液态氨),在一个实例中,所述燃料为储存的液体燃料。在一个实例中,所述流体为油或非水性流体。在一个实例中,所述流体为由水道或水体例如海水、淡水、饮用水、河流、溪流、池塘、湖泊、蓄水池、储存水(例如储水槽或冷却设备)、地下水、井水、岩层中的水、土壤水或雨水包含的流体。在一个实例中,所述流体为海水。在一个实例中,所述基底与该段落中提及的液体接触。在一个实例中,所述流体或液体选自油、水溶液、水力压裂液、燃料、二氧化碳、天然气、油/水混合物、燃料/水混合物、含盐的水、海洋或海水、苦咸水、淡水来源、湖泊、河流、溪流、沼泽、池塘、沼泽地、来自冰雪融化的径流、泉水、地下水、地下蓄水层、降水、在环境温度下(例如在室温下)为液体并为疏水性的但是可溶于有机溶剂的任何物质、己烷类、苯、甲苯、氯仿、乙醚、植物油类、石化油类、原油、精炼石化产品、挥发性精油、化石燃料、汽油、烃类混合物、喷气式飞机燃料、火箭燃料、生物燃料。在一个实例中,流体为油/水混合物。
如本文所用的术语“微生物影响的腐蚀”或“mic”,除非另外指明,是指其中系统的任何元件(基底)由于微生物群体例如细菌或古细菌群体中至少一个成员的作用而结构上受到危害的过程。如本文所用的术语“生物污损”,除非另外指明,是指其中微生物(诸如细菌和/或古细菌)在与流体(例如水或水性液体、或烃类、或石油化学品)接触的基底表面上积累的过程。也包括流体(例如水或水性液体、或烃类、或石油化学品)中微生物(诸如细菌和/或古细菌)不期望的积累与增殖,即流体的“恶化变质”。在一个实例中,细菌由船舶或船只压载水包含,并且细菌为环境上不期望的。如本文所用的术语“基底”是指上面可附着细胞并可形成和生长生物膜或者上面可发生生物污损(例如形成粘液或淤泥)的任何类型表面。基底可为“工业”基底诸如石化、燃料、原油或天然气管道系统的设备表面,或者“非工业”(例如家庭,例如家居或办公室)基底诸如厨房台面或淋浴器基底或花园基底。
在任一个方面的替代方案中,代替宿主细菌细胞的群体,所述群体为第一物种的古细菌细胞的群体。
5.方面4的方法,其中所述液体为水性液体(例如海水、淡水、储存水或饮用水)。
6.方面3-5中任一项的方法,其中所述方法包括混合流体与载体,由此使宿主细胞与载体接触。例如,所述载体可与液体(任选地也具有抗生素或生物杀灭剂)预混合,并然后将混合物加入与表面接触的流体(方面1)或方面4的流体中。
7.方面1-6中任一项的方法,其中每种靶标序列为宿主细胞毒力、抗性或必需基因序列,例如其外显子或调节序列。所述抗性可为抗生素抗性。在一个实例中,宿主细胞与所述抗生素和所述载体接触,以减少宿主细胞活力。
8.方面1-7中任一项的方法,其中靶标序列的修饰导致宿主细胞杀死和/或减少宿主细胞生长或增殖。所述增殖为例如与表面接触的细胞扩增或细胞分布。
9.方面1-8中任一项的方法,其中所述载体包含相同的crispr阵列。
10.方面1-9中任一项的方法,其中所述宿主细胞为细菌或古细菌细胞。在一个替代方案中,相反第一细胞为藻类细胞。
11.方面1-10中任一项的方法,其中第一宿主细胞为硫酸盐还原细菌(srb)细胞(例如脱硫弧菌属或脱硫肠状菌属细胞)。在一个实例中,所述细胞选自致黑脱硫肠状菌、地下脱硫状菌、运动热脱硫杆菌、thermodesulforhabdusnorvegicus、闪烁古生球菌、desulfomicrobiumapsheronum、desulfovibriogabonensis、长脱硫弧菌、desulfovibriovietnamensis、鲸脱硫杆菌、desulphomaculumhalophilum、desulfobactervibrioformis和嗜热脱硫肠状菌细胞。在一个实例中,所述群体包含这些细胞物种的中两种或更多种的混合物。
12.方面11的方法,其中所述表面或流体由原油、天然气或石化产品回收、加工、储存或运输设备包含。原油为世界上最重要的能源资源之一。其用作许多行业(包括炼油-石化行业)的原材料,其中原油通过各种工艺流程精炼成消费品诸如汽油、油类、石蜡油、润滑剂、沥青、家用燃油、凡士林和聚合物。石油衍生产品也常用于许多其他化学过程。在一个替代方案中,所述流体为所述消费品或者表面与这样的消费品接触。
13.方面11或12的方法,其中所述表面与海水、压裂液或井中液体接触;或者其中所述流体为海水、压裂液或井中液体。
14.方面1-13中任一项的方法,其中所述方法的步骤(i)包括提供第二物种的微生物细胞的群体(第二宿主细胞),第二细胞包含所述载体,其中所述载体能够从第二宿主细胞中转移至第一宿主细胞;并使第二宿主细胞与第一宿主细胞组合,由此将载体引入第一宿主细胞中。在一个实例中,第二细胞在环境(例如在水或土壤环境)中为环境、工业或家庭可接受的,并且第一宿主细胞为环境中不可接受的。
15.方面14的方法,其中第一宿主细胞在与所述载体接触之前由微生物细胞的混合物包含(例如由微生物生物膜包含),其中所述混合物包含所述第二物种的细胞。
16.方面14或15的方法,其中所述第二物种为芽胞杆菌属或硝酸盐还原细菌或硝酸盐还原-硫化物氧化细菌(nrb)的物种。
17.方面16的方法,其中nrb选自弯曲杆菌属物种、硝化菌属物种、亚硝化单胞菌属物种、硫微螺菌属物种、硫磺单胞菌属物种、陶厄氏菌属物种、副球菌属物种、假单胞菌属物种、红细菌属物种和脱硫弧菌属物种;或者包含所述物种中的至少两种。
18.方面17的方法,其中nrb选自普通消化杆菌、欧洲亚硝化单胞菌、施氏假单胞菌、铜绿假单胞菌、脱氮副球菌、sulfurospirillumdeleyianum和类球红细菌。
19.方面1-18中任一项的方法,其中所述方法包括使所述第一物种的宿主细胞同时或依次与生物杀灭剂、同时或依次与所述载体接触。在一个实例中,提供所述载体和生物杀灭剂,其在与宿主细胞接触的组合物中预混合。
20.方面19的方法,其中所述生物杀灭剂选自四羟甲基硫酸鏻(thps)、戊二醛、一氧化氯、二氧化氯、次氯酸钙、次氯酸钾、次氯酸钠、二溴氰基乙酰胺(dbnpa)、二硫氰基甲烷(mbt)、2-(氰硫基甲基硫代)苯并噻唑(tcmtb)、布罗波尔、2-溴-2-硝基-1,3-丙二醇(bnpd)、三丁基十四烷基氯化鏻(ttpc)、牛磺酰胺及其衍生物、酚类、季铵盐类、含氯物质、喹醛啶盐类、内酯类、有机染料、缩氨基硫脲类、醌类、氨基甲酸酯类、脲、水杨酰胺、对称二苯脲、胍(guanide)、脒类、咪唑啉类、乙酸、苯甲酸、山梨酸、丙酸、硼酸、无水醋酸、亚硫酸、香草酸、对-羟基苯甲酸酯类、异丙醇、丙二醇、苄醇、氯丁醇、苯乙醇、甲醛、碘及其溶液、聚维酮碘、六亚甲基四胺、羟甲基甲硫脲、1-(3-氯烯丙基)-3,5,7-三偶氮(triazo)-1-氮鎓金刚烷氯化物、滔罗定、滔罗胺、n-(5-硝基-2-呋喃甲叉)-1-氨基-乙内酰脲、5-硝基-2-糠醛缩氨基脲、3,4,4’-三氯二苯脲、3,4’,5-三溴水杨酰苯胺、3-三氟甲基-4,4’-二氯对称二苯脲、8-羟基喹啉、l-环丙基-6-氟-l,4-二氢-4-氧代-7-(1-哌嗪基)-3-喹啉羧酸、1,4-二氢-1-乙基-6-氟-4-氧代-7-(1-哌嗪基)-3-喹啉羧酸、过氧化氢、过乙酸、氧氯苯磺酸钠、对氯间二甲苯酚、2,4,4’-三氯-2’-羟基联苯酚、麝香草酚、双氯苯双胍己烷、苯扎氯铵、西吡氯铵、磺胺嘧啶银、硝酸银、溴、臭氧、异噻唑啉酮、聚氧乙烯(二甲基亚氨基)亚乙基(二甲基亚氨基)亚乙基二氯化物、2-(叔丁基氨基)-4-氯-6-乙基氨基-5’-三嗪(特丁津)及其组合。在一个实例中,所述生物杀灭剂为四羟甲基硫酸鏻(thps)。在一个实例中,所述生物杀灭剂为季铵化合物。
21.方面1-20中任一项的方法,其中所述系统用于选自以下的行业操作中:采矿、航运;原油、天然气或石化产品的回收或加工;水力压裂、空气或水加热或冷却;饮用水生产、储存或输送;烃类的运输以及废水处理。
22.方面21的方法,其中所述表面为在所述选择的行业中使用的设备表面,或者其中流体为由所述选择的行业中使用的设备包含的流体。
23.方面1-22中任一项的方法,其中所述表面为厨房、洗浴或园艺设备的表面,或者其中流体由厨房、洗浴或园艺设备包含。例如,所述设备用于家庭环境。
24.从属于方面3的方面1-23中任一项的方法,其中流体为容器(例如水槽或瓶)中含有的适于饮用的流体并且表面为与流体接触的容器表面。
25.方面1-24中任一项的方法,其中每种载体包含可动遗传元件(mge),其中mge包含转移起点(orit)和所述crispr阵列;其中mge能够在所述第一物种的宿主细胞和所述行业或家用系统中的另外的微生物宿主细胞之间转移。例如,另外的细胞在环境(例如在水或土壤环境)中为环境、行业或家庭可接受的,并且第一宿主细胞为环境中不可接受的。
26.方面25的方法,其中orit在第一和另外的宿主细胞中为功能性的。
27.方面25或26的方法,其中所述第一和另外的宿主细胞由与所述表面接触的流体生物膜包含;或者其中所述细胞由所述流体包含。
28.方面25、26或27的方法,其中所述另外的细胞为如在方面16-18中任一项中记载的物种的细胞。在一个实例中,mge能够从另外的细胞转移至第一宿主细胞和/或反之亦然。
29.方面25-27中任一项的方法,其中另外的细胞为所述第一物种的细胞。
例如,在一个实施方案中,mge能够在所述系统中的群体的第一细胞中转移。当mge在转移过程中将自身的拷贝留给其他细胞时,然后这提供了用于传播和扩散mge,并因此crispr阵列通过系统中的细胞群传播和扩散的手段,由此扩散阵列的靶标序列修饰效果。这可例如在与表面接触的生物膜中或流体中有效产生阵列的传播,并且当对常规生物杀灭剂的生物膜渗透为次佳时是有用的。
30.方面25-29中任一项的方法,其中每种mge为或包含整合性接合元件(ice);或者其中每种载体为能够感染所述第一物种的宿主细胞的噬菌体,并且每种mge为能够在细胞之间进行所述转移的噬菌体核酸。
31.方面30的方法,其中每种ice为转座子,例如接合转座子。
32.方面1-31中任一项的方法,其中每种载体为任选地包含方面25-31中任一项的mge的质粒。
33.方面25-32中任一项的方法,其中第一和/或另外的细胞包含编码对使mge转移至其他细胞为可操作的蛋白的核苷酸序列,其中所述序列不由mge包含。
34.方面33的方法,其中所述序列不由载体包含。
35.方面33的方法,其中所述序列由第一细胞和/或另外细胞的接合转座子包含。
36.方面35的方法,其中所述转座子对在第一和另外细胞之间转移mge是反式可操作的。
37.方面25-36中任一项的方法,其中mge的orit与由第一细胞和/或另外细胞的ice包含的orit相同,其中ice对在第一和另外细胞之间转移mge是反式可操作的。
38.方面25-37中任一项的方法,其中所述载体orit为srb或srb转座子的orit。
39.方面25-38中任一项的方法,其中每种mge包含第一和第二末端重复序列和重复序列之间的所述crispr阵列。
40.方面25-39中任一项的方法,其中mge在以下位置留下crispr阵列拷贝:(1)当其已转移至所述另外的宿主细胞时,在第一宿主细胞的基因组中;或(2)当其已转移至第一宿主细胞时,在所述另外的宿主细胞中。例如,所述拷贝由从中发生转移的细胞基因组中留下的转座子或前噬菌体包含。
41.方面25-40中任一项的方法,其中第一和另外的细胞为不同物种的细菌细胞(例如分别为srb和nrb、或者srb和芽孢杆菌属细胞)。
42.从属于方面30的方面25-41中任一项的方法,其与用于迁移mge的转座酶组合。
43.方面1-42中任一项的方法,其中所述载体或mge包含在所述第一物种的宿主细胞可操作的毒素-抗毒素模块;任选地其中毒素-抗毒素模块包含在另一物种的细胞中不可操作或操作减少的抗毒素基因。这些实施方案可用于建立选择压力,该压力有利于载体/mge(并因此为crispr阵列)保留在包含靶标序列的第一宿主细胞内。
44.方面1-43中任一项的方法,其中所述载体或mge包含在所述第二或另外的细胞可操作的毒素-抗毒素模块;任选地其中毒素-抗毒素模块包含在除了第二或另外细胞以外的细胞中不可操作或操作减少的抗毒素基因。这可用于将crispr阵列的群体维持在第二或另外的细胞中(例如当这样的细胞存在于也包含第一细胞的生物膜中时),但其中毒素-抗毒素模块在第一宿主细胞中提供另外的杀死(超过靶标序列修饰的作用)。在一个实例中,所述载体或mge包含在第一宿主细胞和在所述第二或另外的细胞可操作的毒素-抗毒素模块。
45.方面43或44中任一项的方法,其中毒素-抗毒素模块在除了第一和第二或另外细胞以外的细胞中不可操作或操作减少。因此,在第一和第二(或另外)细胞两者中可存在选择压力以维持crispr阵列。有用地,这然后提供了用于在混合群体(例如接触表面的生物膜或由流体包含的群体)的细胞之间水平转移mge阵列的储库。
46.方面25-45中任一项的方法,其中第一和第二细胞(或者第一和另外的细胞)属于相同的门(例如两种细菌细胞),并且载体为在以下可复制或可操作的:(a)在第一细胞和/或第二(或另外)细胞但不在相同门的另一细胞中;(b)在第一细胞和/或第二(或另外)细胞但不在相同目的另一细胞中;(c)在第一细胞和/或第二(或另外)细胞但不在相同纲的另一细胞中;(d)在第一细胞和/或第二(或另外)细胞但不在相同目的另一细胞中;(e)在第一细胞和/或第二(或另外)细胞但不在相同科的另一细胞中;(f)在第一细胞和/或第二(或另外)细胞但不在相同属的另一细胞中;或(g)在第一细胞和/或第二(或另外)细胞但不在相同物种的另一细胞中。
47.方面25或从属于25的方面26-46中任一项的方法,其中每种mge为接合转座子,orit在第一和另外(或第二)宿主细胞中为功能型的,mge包含第一和第二末端重复序列和重复序列之间的所述crispr阵列,并且其中第一和另外(或第二)细胞为细菌细胞,其中靶标位点由第一细胞而非另外(或第二)细胞包含,并且其中所述修饰使第一细胞中包含所述靶标的基因或调节序列失活或下调,导致第一宿主细胞活力减小并控制所述mic或生物污损。
48.方面1-47中任一项的方法,其中每种crispr阵列包含用于在第一宿主细胞中表达和产生相应crrna的序列r1-s1-r1’,
(i)其中r1为第一crispr重复区,r1’为第二crispr重复区,且r1或r1’为任选的;和
(ii)s1为第一crispr间隔区,其包含与所述第一宿主细胞的靶标序列具有95%或更多同一性的核苷酸序列或由其组成。
49.方面48的方法,其中r1和r1’分别与第一宿主细胞物种的crispr阵列的第一和第二重复序列具有至少95、96、97、98或99%同一性。在一个实施方案中,存在r1和r1’两者。
50.方面48或49的方法,其中r1和r1’与所述第一物种的所述宿主细胞的crispr/cas系统有功能用于修饰靶标序列。
51.方面48-50中任一项的方法,其中第一宿主细胞为硫酸盐还原细菌(srb),并且r1和r1’分别与第一宿主细胞物种的crispr阵列的重复序列(例如第一重复区)具有至少95、96、97、98或99%同一性。
52.方面51的方法,其中r1和r1’分别与选自seqidno:50-74、125-128和49的重复序列具有至少95、96、97、98或99%同一性。参见表1。在一个实施方案中,存在r1和r1’两者。
53.方面51的方法,其中r1和r1’分别与选自seqidno:51和125-126、54和127、69和128的重复序列具有至少95、96、97、98或99%同一性。seqidno:51和125-126、54和127、69和128存在于多于1个种srb物种中。这对于用本发明的crispr阵列靶向多于1种srb类型特别有用,例如当所述srb类型共存于待处理的行业或家用系统中,例如共存于与待处理的基底接触或流体中的群体或生物膜中时。在一个实施方案中,存在r1和r1’两者。
54.方面48-53中任一项的方法,其中r1和r1’的序列相同。
55.方面1-54中任一项的方法,其中被引入第一宿主细胞中的每种阵列与一种或多种cas核酸酶(例如cas9和/或cfp1)组合引入,所述cas核酸酶在宿主细胞内与相应crrna对于修饰其靶标序列具有功能。
在一个实例中,本文的任一配置中的cas被针对核酸酶活性失活,并且任选地包含靶标序列活化剂或阻遏物。本文的cas9为例如化脓性链球菌或金黄色葡萄球菌cas9。
56.方面1-55中任一项的方法,其中被引入第一宿主细胞中的每种阵列与编码一种或多种cas核酸酶(例如cas9和/或cfp1)的核酸序列组合引入,所述cas核酸酶在宿主细胞内与相应crrna对于修饰靶标序列具有功能。
57.方面48-56中任一项的方法,其中r1和r1’与ii型cas9核酸酶对于修饰所述第一宿主细胞内的靶标序列具有功能,任选地其中所述方法进一步根据方面55或56,其中cas为所述cas9。
58.方面1-57中任一项的方法,其中所述载体或mge中的全部或一些不包含可与相应阵列一起操作的cas核酸酶编码序列。
59.方面58的方法,其中每种所述相应阵列可与第一物种的细胞中发现的cas核酸内切酶一起操作。
60.方面25或从属于方面25的方面26-59中任一项的方法,其中每种mge没有编码可与所述阵列的重复序列一起操作的编码cas核酸内切酶的序列,且其中相应的载体在mge外部包含这样的序列(例如编码cfp1的cas9)。
61.控制由原油、天然气或石化产品回收、加工、储存或运输设备(例如原油油轮、石油钻井平台或石油钻探设备)包含的基底的微生物影响的腐蚀(mic)或生物污损的方法,其中基底的表面与第一宿主细胞的群体接触,其中第一宿主细胞为介导基底的mic或生物污损的第一物种的硫或硫酸盐还原细菌(srb)、胞外聚合物产生细菌(epsb)、产酸细菌(apb)、硫或硫化物氧化细菌(sob)、铁氧化细菌(iob)、锰氧化细菌(mob)、产氨细菌(ampb)或产乙酸细菌(acpb),其中表面和细胞群体与选自海水、淡水、压裂液或井(例如石油或天然气井)中液体的液体接触,所述方法包括
(i)通过混合液体与多种能够转化或转导第一宿主细胞的载体,使细胞群体与载体接触,每种载体包含crispr阵列,由此crispr阵列被引入宿主细胞中,其中
(a)每种crispr阵列包含一个或多个用于表达crrna的序列和用于在宿主细胞中序列转录的启动子;
(b)每种crrna能够与宿主细胞的靶标序列杂交,以指导宿主细胞内的cas(例如cas核酸酶,例如cas9或cfp1)以修饰靶标序列(例如切割靶标序列);所述靶标序列为用于介导宿主细胞活力的基因序列;
(c)其中每种(a)的序列包含用于在第一宿主细胞中表达和产生相应crrna的序列r1-s1-r1’,其中r1为第一crispr重复区,r1’为第二crispr重复区,且r1或r1’为任选的;且s1为第一crispr间隔区,其包含与所述第一宿主细胞的靶标序列具有70、75、80、85、90或95%或更多同一性的核苷酸序列或由其组成;和
(ii)允许所述crna在宿主细胞中在cas存在的情况下进行表达,由此在宿主细胞内修饰靶标序列,导致宿主细胞活力减小并控制所述基底的mic或生物污损。在一个实施方案中,存在r1和r1’两者。
62.方面61的方法,其中所述方法根据方面1或从属于方面1的任一前述方面。
63.方面61或62的方法,其中每种载体为能够感染第一宿主细胞的噬菌体,或者为包含其包含所述crispr阵列的mge(例如转座子)的载体,其中mge能够转移至第一宿主细胞内。
64.方面61、62或63的方法,其中第一细胞为硫酸盐还原细菌(srb)细胞,例如脱硫弧菌属或脱硫肠状菌属细胞。
65.方面64的方法,其中r1和r1’分别与第一宿主细胞物种的crispr阵列的重复序列(例如第一重复区)具有至少95、96、97、98或99%同一性,并且所述载体阵列可与存在于第一物种细胞内的cas核酸内切酶一起操作。在一个实例中,r1和r1’为相同的序列。
66.方面65的方法,其中r1和r1’分别与选自seqidno:50-74、125-128和49的重复序列具有至少95、96、97、98或99%同一性。在一个实例中,r1和r1’为相同的序列。
67.方面66的方法,其中r1和r1’分别与选自seqidno:51和125-126、54和127、69和128的重复序列具有至少95、96、97、98或99%同一性。参见表1。这对于用本发明的crispr阵列靶向多于1种srb类型特别有用,例如当所述srb类型共存于待处理的行业或家用系统中,例如共存于与待处理的基底接触或流体中的群体或生物膜中时。在一个实例中,r1和r1’为相同的序列。
68.方面1-67中任一项的方法,其中所述多种载体包括另外的载体,其中每种另外的载体包含一种或多种用于靶向由所述群体包含的另外宿主细胞的crispr阵列,其中另外的宿主细胞物种不同于第一宿主细胞物种,其中在步骤(i)中,所述群体的所述另外细胞与多种能够转化或转导另外细胞的所述另外载体接触,每种载体包含crispr阵列,由此crispr阵列被引入另外的宿主细胞内,其中
(a)每种crispr阵列包含一个或多个用于表达crrna的序列和用于宿主细胞内序列转录的启动子;和
(b)每种crrna能够与所述另外宿主细胞的靶标序列杂交,以指导宿主细胞内的cas(例如cas核酸酶)以修饰靶标序列(例如切割靶标序列);所述靶标序列为用于介导宿主细胞活力的基因序列;和
步骤(ii)包括允许所述crna在所述另外的宿主细胞中在cas存在的情况下进行表达,由此修饰另外宿主细胞内的靶标序列。
69.方面68的方法,其中另外的宿主细胞介导所述基底或流体的mic或生物污损,其中步骤(ii)导致另外宿主细胞的活力减小并控制所述基底或流体的mic或生物污损。
70.控制船舶或船只的压载水的细菌生物污损的方法,其中所述水包含介导所述生物污损的第一微生物物种的第一宿主细胞的群体,所述方法包括
(i)使群体与多种能够转化或转导细胞的载体接触,每种载体包含crispr阵列,由此crispr阵列被引入宿主细胞中,其中
(a)每种crispr阵列包含一个或多个用于表达crrna的序列和用于在宿主细胞中序列转录的启动子;和
(b)每种crrna能够与宿主细胞的靶标序列杂交,以指导宿主细胞内的cas(例如cas核酸酶)以修饰靶标序列(例如切割靶标序列);所述靶标序列为用于介导宿主细胞活力的基因序列;和
(ii)允许所述crna在宿主细胞中在cas存在的情况下进行表达,由此在宿主细胞内修饰靶标序列,导致宿主细胞活力减小并控制所述生物污损。
71.方面70的方法,其中第一宿主细胞为霍乱弧菌、大肠杆菌或肠球菌物种细胞。
72.方面70或71的方法,其中步骤(i)包括例如在船舶或船只的船体中混合压载水与载体。
73.方面70-72中任一项的方法,其中船舶或船只为海上运输工具且水为海水。
74.方面70-72中任一项的方法,其中不是船舶或船只,压载水由集装箱或海上钻井平台,例如石油平台或石油钻井平台包含。在一个实例中,船舶、船只、集装箱、平台或钻井平台锚定在海上(即暂时不在其位置上)。
75.从船舶或船只排放压载水的方法,其中排放的压载水包含通过方面70-74中任一项的方法处理的水。
76.方面75的方法,其中水被排入水体例如海、海洋或水道(例如河流、运河、湖泊或水库)或者排入集装箱中。
77.包含crispr阵列的压载海水,其中压载水通过方面70-76中任一项的方法得到或可得到。
78.包含方面77的压载海水的船舶、船只、集装箱或钻井平台。
79.用于方面61-69中任一项的方法的载体,其中第一细胞为硫酸盐还原细菌(srb)细胞,例如脱硫弧菌属或脱硫肠状菌属细胞,每种载体包含一种或多种用于靶向srb的crispr阵列,其中每种阵列如在方面61的(a)-(c)中所定义。
80.方面79的载体,其中r1和r1’根据方面65-67中任一项。
81.用于方面70-76中任一项的方法中的载体,其中第一细胞为霍乱(例如弧菌属,例如o1或o139)、大肠杆菌或肠球菌物种细胞,所述载体包含一种或多种用于靶向细胞的crispr阵列,其中每种阵列如在方面70的(a)和(b)中所定义。
82.方面79-81中任一项的载体,其中所述载体为能够感染所述细胞的细菌噬菌体。
83.方面79-81中任一项的载体,其中所述载体为能够转移至所述细胞中的转座子或mge。
84.任选地与能够减少所述细胞的活力的生物杀灭剂或抗生素组合的多种载体,其中每种载体根据方面82或83。
介导mic或生物污损的细菌:在一个实例中,第一宿主细胞选自硫或硫酸盐还原细菌(srb)、胞外聚合物产生细菌(epsb,例如假单胞菌属)、产酸细菌(apb)、硫或硫化物氧化细菌(sob)、铁或锰氧化细菌(iob)、产氨细菌(ampb)和产乙酸细菌(acpb)。例如,第一宿主细胞为acpb(例如醋酸杆菌物种和/或葡糖酸醋杆菌物种)并且表面与烃类燃料(例如燃料级乙醇)和/或水接触。
以下为用于本发明的相关细菌的实例(在一个实例中,第一宿主细胞为以下物种中任一种的细胞)。嗜酸硫杆菌属细菌产生硫酸。嗜酸性氧化硫硫杆菌(一种嗜酸硫杆菌属细菌的亚属)经常损坏污水管。氧化亚铁铁杆菌直接将铁氧化为铁氧化物和氢氧化物。其他细菌产生各种酸(有机的和矿物的两者)或者氨。在氧的存在下,需氧菌像氧化硫硫杆菌、排硫硫杆菌和蚀阴沟硫杆菌(所有三种广泛存在于环境中),为引起生源硫化物腐蚀的常见腐蚀因素。没有氧气存在下,厌氧菌尤其是脱硫弧菌属和脱硫肠状菌属为常见的。需盐脱硫弧菌需要至少2.5%浓度的氯化钠,但普通脱硫弧菌和脱硫脱硫弧菌能在淡水和咸水两者中生长。非洲脱硫弧菌为另一种常见的引起腐蚀的微生物。脱硫肠状菌属包括还原硫酸盐的芽孢形成菌。东方脱硫肠状菌和致黑脱硫肠状菌参与腐蚀过程。硫酸盐还原剂需要还原环境,需要至少-100mv的电极电位才能使其茁壮成长。然而,即使是产生少量的硫化氢也能实现这种转变,因此一旦开始生长,就会加速。
在一个实例中,第一宿主细胞为粘质沙雷氏菌、披毛菌属物种、假单胞菌属物种、芽孢杆菌属物种(例如枯草芽孢杆菌、蜡样芽胞杆菌、短小芽胞杆菌或巨大芽孢杆菌)、硫杆菌属物种、硫化叶菌属物种、奥克西托克雷白杆菌、铜绿假单胞菌、施氏假单胞菌、微球菌属、肠球菌属、葡萄球菌属(例如金黄色葡萄球菌)、粪肠球菌或藤黄微球菌细胞。在一个实例中,第一宿主细胞包含两种或更多种所述物种的混合物。这些物种已从位于印度西北和西南地区的柴油和轻油运输管道中分离,证实了在这些菌群存在的情况下与管线钢管局部腐蚀的关联性。不同的欧洲飞机制造商联合项目证实,在飞机构造中常用的铝合金的强烈腐蚀损伤来自属微球菌属、肠球菌属、葡萄球菌属和芽孢杆菌属的分离物的参与。这些细菌可能创建微酸性环境(产酸细菌),这有利于其他细菌的发展,或者产生eps,有利于生物膜的形成(eps产生细菌)。因此,在本发明的一个实施方案中,待处理的系统表面(例如钢制品表面)与柴油或轻油接触,或者待处理的流体为柴油或轻油(并且任选地第一宿主细胞属于该段落中定义的一种或多种物种)。在本发明的一个实施方案中,待处理的系统表面(例如含铝表面,例如航空器表面)与1种、2种、3种或所有以下属接触:微球菌属、肠球菌属、葡萄球菌属和芽孢杆菌属(第一宿主细胞)。在该段落中任何实施方案中的一个实例中,所述表面为系统的钢或铝部件的表面。
产酸细菌:需氧细菌能够产生短链有机酸诸如乙酸、甲酸、乳酸、丙酸和丁酸作为其来自有机材料发酵代谢的代谢产物。由于需氧代谢,它们也是最初的定殖菌。这些微生物存在于各种环境,包括天然气站(gasstands)和油类中。有机酸充当srb的基底,除了降低周围介质的ph以外,还加速腐蚀过程。此外,产生的大量有机酸作用于金属的去极化,开始局部腐蚀过程。
硫氧化细菌:硫氧化细菌为需氧的和兼性厌氧微生物,其从无机硫化合物诸如硫化物、亚硫酸盐、硫代硫酸盐和在一些情况下为硫的氧化作用获得生长必需的能量。氧化代谢导致产生硫酸,其促使环境酸化。该组包括许多属,嗜酸硫杆菌属被研究最多。该组也包括选自属硫化叶菌属、硫微螺菌属、贝格阿托氏菌属、嗜酸硫杆菌属和硫发菌属以及物种泛养硫球菌和脱氮副球菌的细菌物种。在一个实例中,第一宿主细胞为这些物种中任何一种的细胞。
铁氧化细菌:铁氧化细菌为需氧微生物,属于大型和多样化群,其从铁氧化得到其代谢所必需的能量。因此,形成氢氧化铁(其通常形成基底表面的不溶性沉淀物),促进具有不同氧水平的区域。它们广泛存在于河流、湖泊和石油生产的水中。他们大多具有运动鞘(locomotorsheath),并且其存在可通过作为腐蚀产物沉淀的大量积累的三价铁进行检测。这种积累或无机污垢导致工业设备出现问题,诸如石油管道堵塞。最常见的是:氧化亚铁硫杆菌和属泉发菌属、披毛菌属、纤毛菌属和spherotillus。在一个实例中,第一宿主细胞为这些物种中任一种的细胞。
硫或硫酸盐还原细菌(srb):srb形成形态和系统发育异质的组,其包括细菌和受限的厌氧古细菌,尽管一些物种具有明显的氧耐受性。它们主要是革兰氏阴性细菌、嗜温的和一些通常形成孢子的嗜热菌。这些微生物能够氧化各种低分子量的有机化合物,包括一-或二元脂肪羧酸类、醇类、烃类和芳香族化合物,其使用硫酸根离子或其他含硫化合物(硫代硫酸盐、亚硫酸盐等)作为电子受体。乙酸盐、乳酸盐、丙酮酸盐和乙醇为其中srb最常用的底物。srb生长刺激是由于生物膜中存在厌氧条件,通过腐蚀产物与微生物组合沉积,和在采油期间注入的水性介质诸如海水,其富含硫酸盐来解释。可产生大量的生源硫化氢;管道和其他石油、天然气或石化产品回收、加工、储存或运输设备中形成的大部分h2s来源于srb的代谢活动。另一个对石油工业的经济影响是h2s对石油和天然气的酸化。
考虑到与srb的代谢活性相关的许多经济损失,已努力使用环境有害的和有毒的代谢抑制剂诸如钼酸盐、硝酸盐和亚硝酸盐及应用生物杀灭剂,这有助于控制srb的代谢活动和随后抑制生源h2s产生。
几种机制导致包括通过使用代谢抑制剂的生源h2s形成过程:i-srb和作为通过普通电子供体的亚硝酸盐或硝酸盐还原剂的异养细菌之间的竞争,导致竞争性srb排斥;ii-氧化还原电位由于硝酸盐还原的中间体(一氧化二氮和一氧化氮)的存在而增加,因为h2s的生物产生仅发生在低氧化还原电位(低于-100mv);iii-一些srb的能量代谢的变化,还原硝酸盐而不是硫酸盐;iv-硫化物氧化细菌和硝酸盐或亚硝酸盐还原细菌,其使用硝酸盐或亚硝酸盐再氧化h2s,导致h2s去除;v-通过亚硝酸盐抑制异化的亚硫酸盐还原酶,以通过srb中的硫酸盐还原抑制最后的酶促步骤。
在本发明的某些实施方案中,与待处理的基底接触或由待处理的流体包含的宿主细胞群体也在本发明的载体存在的情况下与一种或多种硝酸盐和/或一种或多种亚硝酸盐接触。例如,在同时或依次使用载体的步骤(i)中,将硝酸盐/亚硝酸盐和载体与石油、天然气、石化产品、水或者工业或家庭系统包含的其他流体相组合(例如注入其中)。类似地,另外或可替代地,钼酸盐也可作为srb的控制机制用于这些系统中。因此,在一个实施方案中,在本发明的载体存在的情况下,与待处理的基底接触或由待处理的流体包含的宿主细胞群体也与一种或多种钼酸盐接触。例如,在同时或依次使用载体的步骤(i)中,将钼酸盐(s)和载体与石油、天然气、石化产品或者工业或家庭系统包含的其他流体相组合(例如注入其中)。
在其他实施方案中,在本发明的载体存在的情况下,所述群体与硝酸盐还原细菌和/或硝酸盐还原-硫化物氧化细菌(nrsob)(本文统称“nrb”)接触。例如,与载体同时或依次,nrb与石油、天然气、石化产品、水或者工业或家庭系统包含的其他流体组合(例如注入其中)。在一个实例中,nrb包含本发明的载体,其中所述载体能够从nrb细胞转移至第一宿主细胞(srb细胞);并在组合nrb和srb细胞之后,载体被引入srb细胞内。在一个实例中,在与所述载体接触之前,srb细胞由微生物细胞的混合物包含(例如由微生物生物膜包含),其中混合物包含nrb物种的细胞。因此,在这种情况下,本发明涉及使srb细胞与nrb细胞(含有载体)接触,其中nrb细胞物种已与待靶向的生物膜中的srb共存,其因此增加含有载体的nrb摄入生物膜中的细胞群体的相容性和机会。这对增加载体被摄入生物膜的机会,由此增加修饰srb细胞的效力的机会和本发明的crispr阵列在生物膜内传播的机会(尤其是当所述阵列由可动遗传元件诸如转座子包含或由噬菌体包含时,如本文所述)是有用的。
srb和nrb通常竞争存在于细菌生长需要的某些油田和工业水系统中的相同非高聚物碳源(诸如乙酸盐)。通过与srb相比增加nrb的生长速率,nrb可在可用非高聚物碳源的消耗中战胜srb,剥夺srb的生长能力,并产生不期望的硫化物和减少腐蚀速率。进一步地,通过抑制srb的生长速率,nrb可占主导地位,再一次在对系统例如油田或工业水系统的可用非高聚物碳的竞争中战胜srb。因此,通过增加群体中nrb与srb的比例,使所述群体中的srb细胞与nrb接触可助于减少srb细胞的活力。
在一个实施方案中,本发明包括使包含第一宿主细胞(例如srb)的群体与有机和/或无机硝酸盐和亚硝酸盐接触。这些用于刺激所存在的nrb生长,因此有助于nrb战胜srb。有机和无机硝酸盐或无机亚硝酸盐可用于注入某些油田和工业水系统中。可用于本公开的用途的无机硝酸盐和无机亚硝酸盐包括例如硝酸钾、亚硝酸钾、硝酸钠、亚硝酸钠、硝酸铵及其混合物。这些有机和无机硝酸盐和无机亚硝酸盐为通常可得到的,但可使用非限制性的和任何合适的硝酸盐或亚硝酸盐。
所使用的有机或无机硝酸盐或亚硝酸盐的量取决于多种因素,包括存在于系统中的群体中的硫酸盐和/或有机酸的量以及抵抗srb所需的预期的nrb量。在某些实施方案中,为了处理与流体接触的基底mic,或者为了处理本发明液体的生物污损,当使用批处理应用方法应用时,所使用的有机或无机硝酸盐或亚硝酸盐的浓度按液体的重量计小于2000ppm,或者按重量计500-1600ppm或者按重量计在约900-1100ppm之间。当通过连续操作应用时,有机或无机硝酸盐或亚硝酸盐的浓度可按液体的重量计小于500ppm,或者介于10-500ppm之间,或者介于10-100ppm之间。
在一个实施方案中,所述群体与本发明的载体接触,且同时或依次与nrb(例如其包含载体)和硝酸盐和/或亚硝酸盐接触。
合适的nrb包括能够进行厌氧硝酸盐还原的任何类型的细菌,诸如异养硝酸盐还原细菌和硝酸盐还原-硫化物氧化细菌。在一个实例中,nrb包含一、二、三或多种(例如一种或多种)选自以下的nrb:弯曲杆菌属物种、硝化菌属物种、硫杆菌属物种、亚硝化单胞菌属物种、硫微螺菌属物种、硫磺单胞菌属物种、陶厄氏菌属物种、副球菌属物种、假单胞菌属物种和红细菌属物种。例如,nrb选自以下中的一种或多种:普通消化杆菌、欧洲亚硝化单胞菌、施氏假单胞菌、铜绿假单胞菌、脱氮副球菌、sulfurospirillumdeleyianum和类球红细菌。
在某些实施方案中,nrb为在原油、天然气、石化产品或水回收、加工、运输或储存系统(例如在其设备中)中发现或者在地层诸如水或油井中发现的nrb菌株。nrb可被优化以在系统条件下代谢。nrb例如选自nrb菌株的文库或者可从待处理的系统或类似系统培养。
所述系统中与srb细胞接触的nrb的量可取决于多种因素,包括预期的srb的量,以及任何可能存在的生物杀灭剂。当注入地层时,也可考虑地层的渗透性和孔隙度。在本公开的某些实施方案中,注入液体的nrb的量为1-108菌数计数/ml的液体之间,或者在10-104菌数计数/ml的液体之间。
除了刺激nrb战胜srb以外,可期望的是在本公开的某些实施方案中与硝酸盐一起引入另外的srb抑制剂。在一个实例中,srb与一种或多种选自9,10-蒽醌、钼酸盐(诸如钼酸钠和/或钼酸锂)及其混合物的srb抑制剂接触。在本公开的某些实施方案中,钼酸盐以按液体的重量计5-100ppm的范围加入液体中。
在一个实例中,在例如通过将混合物注入与待处理的表面接触的液体或将混合物注入待处理的流体中使第一细胞与混合物接触之前,将本发明的载体和一种或多种生物杀灭剂(即第一宿主细胞的生物杀灭剂,诸如srb生物杀灭剂)混合。
对于含有载体的nrb细胞,另外或可替代地,本发明考虑使用含有本发明的载体的芽孢杆菌属细胞的物种。
在一个实施方案中,所述载体为能够感染srb的细菌噬菌体并且噬菌体与第一宿主细胞(例如srb)接触,由此由噬菌体包含的crispr阵列被引入第一宿主细胞内用于其本发明的修饰。在一个实施方案中,当第一细胞为srb时,srb也与本发明的噬菌体载体接触,并且同时或依次与nrb接触。对于与nrb接触,替代或另外,srb与硝酸盐和/或亚硝酸盐接触。
参与mic的实例机制如下;在一个实施方案中,使用所述方法的“控制”包括选自以下的还原机制:
•微生物(例如细菌)促进生物矿化,这是由于铁氢氧化物沉积在金属表面上,修饰界面金属/溶液处的电化学过程,诱导腐蚀;
•产生有利于生物膜的形成的eps;
•微生物(例如细菌)促进石油产物的降解,这是由于作用于金属的腐蚀的酶芳基烃羟化酶(ahh)的释放;
•硫酸的产生,其增加腐蚀过程;和
•硫的氧化。
在一个实施方案中,所述方法包括选自以下的还原机制:
•细菌促进生物矿化,这是由于铁氢氧化物沉积在表面上,其中表面为金属表面;
•产生eps;
•细菌促进系统中石油产物降解,原因是酶芳基烃羟化酶(ahh)释放,其中表面为金属表面;
•硫酸的产生;和
•硫的氧化。
应用于mic或生物污损控制的实例
存在本发明设想的减少与细菌相关的腐蚀和/或生物污损的具体实例应用。以下描述的应用不意欲限制本发明的概念,并且仅举例说明本发明可如何用于控制细菌诱导的腐蚀或减少环境污染。
酸性矿山排水:在酸性矿山排水中,细菌的生长可以增加环境的酸度。对酸的产生存在一个反应方案,且因此为潜在的环境损害。酸性矿山排水的问题在全世界被公认为严重的环境问题。酸性矿山排水的来源是硫化铁矿及其他含硫化物矿物的风化和氧化。矿山排水是在黄铁矿(硫化铁)暴露于空气和水并反应形成硫酸和溶解铁而形成的。这些铁的一些或全部可在含矿山排水的溪流底部沉淀形成红色、橙色或黄色沉淀物。酸性径流进一步将重金属诸如铜、铅、汞溶解到地面或地表水中。某些细菌的作用可提高酸性矿山排水行进的速率和程度。
在一个实例中,所述系统因此为矿山或由矿山包含。流体为矿山排水流体,并且方法减少矿山排水造成的硫酸。在一个实例中,表面与矿山排水流体接触。
在一个实例中,第一个宿主细胞为嗜酸性氧化亚铁硫杆菌、嗜酸性氧化硫硫杆菌、嗜酸性脱氮硫杆菌、氧化亚铁钩端螺旋菌或嗜热硫氧化硫化杆菌细胞或者这些中两种或更多种的混合物。
水力压裂:水力压裂为一种破碎岩层的方法,以便于提取气体及其他烃类。本质上,一旦确定含气地层,矿井就可在垂直和水平两个方向钻入地表以接近气体。矿井然后使用高压水、砂和大量的化学物质用于使页岩破裂,以使一旦水力压裂完成后保持断裂和裂缝不被上覆岩层的巨大压力所封闭。数百万加仑的水用于压裂井。介于30%-70%之间的压裂液作为“返排”返回到表面。返排含有溶解在压裂水中的任何物质,包括盐。溶解什么取决于位置。返排保留在井场的衬塑坑中,直至其在处置前被卡车运输和处理。在某一时间点,高流量和相对低盐度的水转换成较低流量,但是盐度高得多的“采出水”,以区别于“返排”水。
在任一情况下,都存在微生物诱导腐蚀(mic)的问题。其中特别感兴趣的是srb。因此,在一个实例中,该系统为水力压裂系统和流体为水力压裂液(如返排水或采出水)或者待处理的表面与这样的液体接触。该方法例如降低srb的活力(例如杀死srb和/或减少srb在液体中的增殖),且第一宿主细胞为srb。
例如,第一宿主细胞为嗜酸硫杆菌属细菌、嗜酸性氧化硫硫杆菌、氧化亚铁铁杆菌、氧化硫硫杆菌、排硫硫杆菌、蚀阴沟硫杆菌、脱硫弧菌属(例如需盐脱硫弧菌、普通脱硫弧菌、脱硫脱硫弧菌或非洲脱硫弧菌)或脱硫肠状菌属(例如东方脱硫肠状菌或致黑脱硫肠状菌)细胞,或者这些物种中的两种或更多种的混合。
冷却设备(例如冷却塔):在冷却设备诸如冷却塔中存在细菌会在若干方面对冷却功能产生不利影响。例如,srb支持在冷却塔、热交换器等的壁面产生酸性条件,这导致冷却系统的腐蚀和潜在停机同时进行维修。另外,例如热交换器壁面上的生物膜降低交换器壁的传热系数,导致冷却系统的运行效率降低。
另外,含铁部件的腐蚀可能尤其有害。可经由srb发生铁氧化为铁(ii)和硫酸盐还原为硫化物离子,产生铁硫化物的沉淀和原位产生腐蚀性氢离子。硫酸盐还原细菌对铁的腐蚀很快,并且不像普通的生锈,它不是自限性的。由脱硫弧菌属产生的腐蚀结由与含软的、黑色硫化亚铁中心的黑色磁性铁氧化物‘混合’的红色三氧化二铁的外壳组成。
因此,在一个实例中,所述系统为冷却系统,且所述流体为由所述系统包含的流体(如水或水性液体),或者待处理的表面为与这样的流体接触的冷却设备的表面。在一个实例中,第一宿主细胞为srb(例如本文公开的任何srb)。在一个实例中,所述表面为含铁表面。
在一个实例中,第一宿主细胞为军团菌属细胞。这样的物种对人健康有害,并在水冷却、加热、加工或储存设备中传播。因此,在一个实例中,所述系统为这样的设备。
管道腐蚀:烃类和石化管道通常包括足够的水分来允许细菌生长,导致例如srb引起的mic。mic通常由需氧细菌的生物膜造成,所述生物膜保护厌氧并与管道内表面直接接触的srb。这产生酸性条件及其他金属腐蚀条件,这将导致局部腐蚀和管道最终失效。
在一个实例中,所述系统包含设备表面(例如管道或钻井设备),其包含与第一宿主细胞(例如srb)接触的表面。例如,所述系统为原油、烃类、石化产品(例如柴油或石油)、天然气或水的回收、加工、储存或运输系统。例如,所述管道为石化管道。例如,所述管道由石油或天然气钻井平台包含。例如,管道表面与海水接触。例如,管道表面与石化流体、原油或天然气接触。
废水处理:废水处理涉及在污水处理厂下游添加活性污泥以去除有机污染物。因此,在废水处理设施中处理废水后存在许多可被细菌“消化”的有机污染物。因此,将活性污泥添加到槽/容器中处理过的水中,以处理自废水处理设施流出的废水。
然而,有时槽/容器中的细菌(无论是源自活性污泥、废水本身还是周围环境)将占据主导地位且生长非常快速。这样的快速生长可导致丝状细菌的生长。丝状物可在槽或容器中形成最多达细菌群体的20-30%并且它们漂浮。这种丝状生长导致所谓的膨胀污泥。本发明可用于膨胀污泥的控制,这是废水处理的重要方面。
因此,在一个实例中,系统为水处理系统和表面为系统容器的表面,其中表面与水和第一宿主细胞接触;或者待处理的流体包含所述水和细胞。在一个实例中,所述方法控制废水系统污泥中的细菌生长。
航运和运输:船舶和船可在其与海水或水道(例如河流、湖泊、池塘或淡水)接触的外表面(例如船体)经历mic。船体内表面也可受到mic的影响,因为它们通常与可能含有介导mic的微生物诸如细菌的水分或液体接触,例如与压载水接触。例如,海水通常载于船舶的船体(诸如油轮)中,以提供海上稳定性;这样的海水含有可以介导srb的细菌。其他运输运载工具,诸如机动运载工具(小汽车、卡车、货车或卡车)、火车、航天器和航空器也可能易受到影响。
因此,在一个实例中,所述系统为运输运载工具(例如用于运送货物和/或人或牲畜,例如小汽车、卡车、货车或卡车、火车、航天器或航空器)。例如,交通工具为船舶或船只,例如石油、天然气或石化产品的海上船舶(例如油轮)。在一个实例中,待处理的表面与海水接触。在一个实例中,所述表面为船舶或船只船体的外表面。在一个实例中,所述表面为船舶或船只船体的内表面。
压载水中的细菌持续存在或生长(生物污损):本发明的一个具体应用是处理海上运载工具(例如船舶或船只)压载水,以减少不期望的细菌,诸如霍乱弧菌、大肠杆菌和/或肠球菌物种。
海运量超过世界货物的90%,并造成全球运送约2-30亿吨的压载水,这些压载水通常由船舶运载,以维持其稳定。类似体积的压载水也可能是在国家和区域内每年国内运送的(globallastpartnerships,www.globallast.imo.org)。压载水已被公认为外来海洋生物的主要来源,其威胁自然进化的生物多样性,其后果日益被认识到(anil等人,2002)。无意中引入引起疾病的致病性细菌(在运输过程中自起源或形成的地方输入),可直接影响社会和人类健康。船舶压载舱拥有不同的非本地脊椎动物、无脊椎动物、植物、微小藻类、细菌等(williams等人.1988;carlton和geller,1993;smith等人,1996;ruiz等人,2000;drake等人,2002,2005,2007;mimura等人,2005)。微生物(诸如细菌),由于其天然丰度高、形成休眠期的能力和承受广泛范围环境条件的能力,比其他生物体更大量地被引入陌生环境中。虽然带载到压载舱的所有生物体可能无法存活,但是细菌和微藻类都能够通过形成囊肿、孢子或其他生理休眠期长期存活于不利条件下(roszak等人,1983;hallegraeff和bolch,1992;anil等人,2002;carney等人,2011)。一旦释放,这些微生物很适合于入侵,因为其体积小,这有利于其被动散布和比后生动物的存活需求更加简单(deming,1997)。在新加坡港船舶检验的压载水样品中弧菌属物种细胞的浓度在1.1-3.9×104ml-1范围内(joachimsthal等人,2004)。无意引入引起疾病的致病性细菌可以具有直接的社会影响,包括对人类健康的影响。在一项早期研究中发现,引入切萨皮克湾的病原体大多源自与浮游生物有关的细菌,而不是水柱本身(ruiz等人,2000)。因此,压载水微生物诸如细菌和古细菌属于压载水处理/管理项目的主要关注问题。
国际海事组织(imo)已经制定了一项旨在防止这些有害影响的公约,在2004年采用《控制和管理船舶压载水和沉淀物的国际公约》(《压舱水管理公约》)。在美国,美国海岸警卫队关于压载水管理的最终规则在2012年6月开始生效,适用于美国水域的压载水排放。
海上压载水交换不被认为是压载水管理的理想方法,并且正在大力发展处理方法。这些方法必须根据imo的压载水管理公约的标准d-2。标准d2规定,已处理和排放的压载水必须具有:
•每立方米中最低尺寸大于或等于50微米的活生物体少于10个。
•每毫升中最小尺寸小于50微米和最小尺寸大于或等于10微米的活生物体少于10个。
另外,标准d2规定指示微生物的排放量不应超过如下的规定浓度:
•产生有毒物质的霍乱弧菌(o1和o139)每100毫升小于一个菌落形成单位(cfu)或者每1克(湿重)的浮游动物样品低于1cfu;
•每100毫升中大肠杆菌小于250cfu;
•每100毫升中肠球菌属小于100cfu。
这些是作为人类健康标准的指示微生物,但它们不限于这些类型。事实上,已经表明,实际上,在一些情况下,采用的压载水处理可以使情况变得更糟。通过去除吃掉细菌的小生物体,一些处理系统已将压载舱变成细菌培养箱,使得在一些试验中处理的排放物始终比没有处理的排放物含有高数千倍浓度的细菌。增加的细菌可能包括人病原体。
因此,在本发明的一个实例中(例如根据方面70或从属于方面70的方面),所述系统为船舶或船只或海上运载工具(例如船舶或船只,例如港口、码头或海上的油轮)。在一个实例中,包含第一宿主细胞的流体为船舶或船只或海上运载工具的压载水(例如船舶或船只压载水,例如油轮压舱水)。在一个实例中,所述系统为海上集装箱或平台或钻井平台(例如石油和天然气钻井平台),例如在海上。在一个实例中,所述流体为这样的集装箱、平台或钻井平台的压载水。
在一个实施方案中,有害细菌(本发明的第一宿主细胞,例如根据方面70或从属于方面70的方面)属于选自以下的物种:霍乱弧菌、留萌弧菌、海洋弧菌、大肠杆菌、肠球菌属物种、类黄假单胞菌、施氏假单胞菌、缓慢弧菌、海假交替单胞菌、河豚毒素假交替单胞菌、假交替单胞菌属物种、恶臭假单胞菌、食油假单胞菌、灿烂弧菌、嗜环弧菌、希拉氏肠球菌、屎肠球菌、轮虫弧菌、水蛹假交替单胞菌、普城沙雷菌、黄褐假单胞菌、托拉斯假单胞菌、施氏假单胞菌、施氏假单胞菌、塔氏弧菌、美丽盐单胞菌、热液海源菌、嗜环弧菌、塔氏弧菌、普城沙雷菌、假交替单胞菌属物种、假别单胞菌、产黄假单胞菌、施氏假单胞菌、食鹿角菜假交替单胞菌、粘着杆菌物种、蕈状芽孢杆菌、需钠弧菌、白翎芽孢杆菌、希拉氏肠球菌、戊糖乳杆菌、食鹿角菜交替假单胞菌和铜绿假单胞菌。
在一个实例中,第一宿主细胞为需氧异养细菌。在一个实例中,第一宿主细胞为霍乱弧菌细胞(例如菌株o1或/或o139)。在一个实例中,第一宿主细胞为大肠杆菌细胞。在一个实例中,第一宿主细胞为肠球菌属物种细胞。
"characterizationofbacteriainballastwaterusingmaldi-tofmassspectrometry",kaveheetal,plosone.2012;7(6):e38515;2012年6月7日在线公开。doi:10.1371/journal.pone.0038515(通过引用并入本文)公开了一种用于监测压载水中的细菌的合适、快速和高效经济的方法。
本发明的一个具体实例如下:
控制船舶或船只的压载水中的细菌生物污损的方法,其中水包含介导所述生物污损的第一微生物物种的第一宿主细胞群体(诸如霍乱、大肠杆菌或肠球菌物种),所述方法包括
(i)使所述群体与多种能够转化或转导细胞的载体接触,每种载体包含crispr阵列,由此crispr阵列被引入宿主细胞中,其中
(a)每种crispr阵列包含一个或多个用于表达crrna的序列和用于在宿主细胞内序列转录的启动子;和
(b)每种crrna能够与宿主细胞的靶标序列杂交,以指导宿主细胞内的cas(例如cas核酸酶)以修饰靶标序列(例如切割靶标序列);所述靶标序列为用于介导宿主细胞活力的基因序列;和
(ii)允许所述crna在宿主细胞内在cas存在的情况下进行表达,由此修饰宿主细胞内的靶标序列,导致宿主细胞活力减小和控制所述生物污损。
在一个实例中,步骤(i)包括使压载水与载体混合,例如在船舶或船只的船体中。
在一个实例中,船舶或船只为海上运载工具且水为海水。不是船舶或船只,在一个替代方案中,压载水由集装箱或海上钻探平台例如石油平台或石油钻井平台包含。
本发明也包括从船舶或船只排放压载水的方法,其中排放的压载水包括通过以上具体实例的方法处理的水。在一个实例中,水被排放至水体、例如海、海洋或水道(例如河流、运河、湖泊或水库)中。
本发明也包括包含crispr阵列的船舶或船只压载水,其中压载水通过以上具体实例得到或可得到。本发明也包括包含crispr阵列的海运集装箱压载水,其中压载水通过以上具体实例得到或可得到。本发明也包括在海上平台或钻井平台(例如石油或天然气钻井平台)的压载水,水包含crispr阵列,其中压载水通过以上具体实例得到或可得到。所述阵列如在具体实例的(a)和(b)中所记载。
参考文献:
1.anilac,venkatk,sawantss,dileepkumarm,dhargalkarvk,ramaiahn,harkantrasn和ansariza(2002)marinebioinvasion:concernforecologyandshipping.currentscience83(3):214-218;
2.azamf和malfattif(2007)microbialstructuringofmarineecosystems.naturereviewsmicrobiology5:782-791;
3.belkins和colwellrr(2005)oceanandhealth:pathogensinthemarineenvironment.newyork,ny:springer;
4.carltonjt和gellerjb(1993)ecologicalroulette:theglobaltransferofnon-indigenousmarineorganisms.science261:78-82;
5.carmankr和dobbsfc(1997)epibioticmicroorganismsincopepodsandothermarinecrustaceans.microscopyresearchandtechnique37:116-135;
6.carneykj,delanyje,sawantss,mesbahie(2011)theeffectsofprolongeddarknessontemperateandtropicalmarinephytoplankton,andtheirimplicationsforballastwaterriskmanagement.marinepollutionbulletin62(6):1233–1244;
7.colwellrr(1996)globalclimateandinfectiousdisease:thecholeraparadigm.science738or274:2025-2031;
8.conwaydvp,whiterg,hugues-dit-cilesj,galliennecp,robinsdb(2003)guidetothecoastalandsurfacezooplanktonofthesouthwesternindianocean.in:marinebiologicalassociationoftheunitedkingdomoccasionalpublication.ukdefradarwininitiativeproject162/09/004zooplanktonofthemascareneplateau,vol15,pp1–354;
9.daleyrj和hobbieje(1975)directcountsofaquaticbacteriabyamodifiedepifluorescencetechnique.limnologyandoceanography20:875–882;
10.demingjw(1997)unusualorextremehigh-pressuremarineenvironments.in:asmmanualofenvironmentalmicrobiology,hurstcj,knudsengr,mcinerneymj,stetzenbachld,waltermv(editors),washington,dc:asmpress,pp366–376;
11.drakela,ruizgm,galilbs,mulladytl,friedmanndo和dobbsfc(2002)microbialecologyofballastwaterduringatransoceanicvoyageandtheeffectsofopen-oceanexchange.marineecologyprogressseries233:13-20;
12.drakela,meyerae,forsbergrl,baierre,doblinma,heinemanns,johnsonwp,kochm,rubleepa和dobbsfc(2005)potentialinvasionofmicroorganismsandpathogensvia‘interiorhullfouling’:biofilmsinsideballastwatertanks.biologicalinvasions7:969-982;
13.drakela,doblinma和dobbsfc(2007)potentialmicrobialbioinvasionsviaship’sballastwater,sedimentandbiofilm.marinepollutionbulletin55:333-341;
14.dawsonmp,humphreyba和marshallkc(1981)adhesion:atacticinthesurvivalstrategyofamarinevibrioduringstarvation.currentmicrobiology6:195-199;
15.foladorip,brunil,andreottolag和zigliog(2007)effectsofsonicationonbacteriaviabilityinwastewatertreatmentplantsevaluatedbyflowcytometry-fecalindictors,wastewaterandactivatedsludge.waterresearch41:235-243;
16.hallegraeffgm和bolchcj(1992)transportofdiatomsanddinoflagellaterestingsporesinshipsballastwater:implicationsforplanktonbiogeographyandaquaculture.journalofplanktonresearch14(8):1067-1084;
17.harrisjm(1993)thepresence,natureandroleofgutmicroflorainaquaticinvertebrates:asynthesis.microbialecology25:195-231;
18.heidelbergjf,heidelbergkb和colwellrr(2002)bacteriaofthegamma-subclassproteobacteriaassociatedwithzooplanktoninchesapeakebay.appliedandenvironmentalmicrobiology68:5498-5507;
19.hoodma,nessge,rodrickge,blakenj(1984)theecologyofvibriocholeraeintwofloridaestuaries.in:vibriosintheenvironment,colwellr(editor),newyork,ny:wiley,pp399–409;
20.huqa,westpa,smalleb和colwellrr(1984)influenceofwatertemperature,salinityandphonsurvivalandgrowthoftoxigenicvibriocholeraeserovaro1associatedwithlivecopepodsinlaboratorymicrocosms.appliedandenvironmentalmicrobiology48:420-424;
21.internationalmaritimeorganization(imo)(2004)internationalconventionforthecontrolandmanagementofships’ballastwaterandsediments.london:internationalmaritimeorganization;
22.joachimsthalel,ivanovv,tayst-l和tayj-h(2004)bacteriologicalexaminationofballastwaterinsingaporeharbourbyflowcytometrywithfish.marinepollutionbulletin49:334–343;
23.jyotikk和panditab(2001)waterdisinfectionbyacousticandhydrodynamiccavitation.biochemicalengineeringjournal7:201–212;
24.kasturiranganlr(1963)akeyfortheidentificationofthemorecommonplanktoniccopepodaofindiancoastalwaters.in:indiannationalcommitteeonoceanicresearch,panikkarnk(editor),newdelhi:councilofscientificandindustrialresearch,p87;
25.khandeparkerl&anilac;ecohealth.2013sep;10(3):268-76.doi:10.1007/s10393-013-0857-z.epub2013jul12,"associationofbacteriawithmarineinvertebrates:implicationsforballastwatermanagement";
26.kriegnr(1984)bergey’smanualofsystematicbacteriology,vol1.williams&wilkins,baltimore;
27.leebg和fisherns(1992)decompositionandreleaseofelementsfromzooplanktondebris.marineecologyprogressseries88:117-128;
28.lloyd’sregister(2010)ballastwatertreatmenttechnologyguide;
29.mcfall-ngaimj和rubyeg(1991)symbiontrecognitionandsubsequentmorphogenesisasearlyeventsinananimal–bacterialmutualism.science254:1491–1494;
30.mimurah,katakurar和ishidah(2005)changesofmicrobialpopulationsinaship’sballastwaterandsedimentsonavoyagefromjapantoqatar.marinepollutionbulletin50:751-757;
31.munropm和colwellrr(1996)fateofvibriocholeraeo1inseawatermicrocosms.waterresearch30(1):47-50;
32.pfefferc和oliverdj(2003)acomparisonofthiosulphate-citrate-bilesalts-sucrose(tcbs)agarandthiosulphate-chloride-iodide(tci)agarfortheisolationofvibriospeciesfromestuarineenvironments.lettersinappliedmicrobiology36:150–151;
33.peterh和sommarugar(2008)anevaluationofmethodstostudythegutbacterialcommunitycompositionoffreshwaterzooplankton.journalofplanktonresearch30:997-1006;
34.polzmf,disteldl,zardab,amannr,felbeckh,ottja和cavanaughcm(1994)phylogeneticanalysisofahighlyspecificassociationbetweenectosymbiotic,sulfuroxidizingbacteriaandamarinenematode.appliedandenvironmentalmicrobiology.60:4461–4467;
35.pruzzoc,vezzullil和colwellrr(2008)globalimpactofvibriocholeraeinteractionswithchitin.environmentalmicrobiology10(6):1400-1410;
36.rehnstam-holma-s,godhea,härnströmk,raghunathp,saravananv,collinb,karunasagari和karunasagari(2010)associationbetweenphytoplanktonandvibriospp.alongthesouthwestcoastofindia:amesocosmexperiment.aquaticmicrobialecology58:127-139;
37.richardc(1993)chromobacteriumviolaceum,opportunisticpathogenicbacteriaintropicalandsubtropicalregions.bulletindelasociétédepathologieexotique86:169-173;
38.roszakdb,grimesdj和colwellrr(1983)viablebutnonrecoverablestageofsalmonellaenteritidisaquaticsystems.canadianjournalofmicrobiology30:334-338;
39.ruizgm,rawlingstk,dobbsfc,drakela,mulladyt,huqa和colwellrr(2000)globalspreadofmicroorganismsbyships—ballastwaterdischargedfromvesselsharboursacocktailofpotentialpathogens.nature408:49–50;
40.sawantss,anilac,krishnamurthyv,gaonkarc,kolwalkarj,khandeparkerl,desaidv,mahulkarav,ranadevv和panditab(2008)effectofhydrodynamiccavitationonzooplankton:atoolfordisinfection.biochemicalengineeringjournal42:320–328;
41.sethn,chakravartyp,khandeparkerl,anilac和panditab(2010)quantificationoftheenergyrequiredforthedestructionofbalanusamphitritelarvabyultrasonictreatment.journalofthemarinebiologicalassociationoftheunitedkingdom90(7):1475–1482;
42.smithld,wonhammj,mccannld,reiddm,carltonjt,ruizgm(1996)biologicalinvasionsbynonindigenousspeciesinunitedstateswaters:quantifyingtheroleofballastwaterandsediments.partsiandii.reportnumbercg-d-02-97,groton,ct:uscoastguardresearchanddevelopmentcenter;
43.tangkw(2005)copepodsasmicrobialhotspotsintheocean:effectsofhostfeedingactivitiesonattachedbacteria.aquaticmicrobialecology38:31-40;
44.tangkw,freundcs和schweitzercl(2006)occurrenceofcopepodcarcassesinthelowerchesapeakebayandtheirdecompositionbyambientmicrobes.estuarine,coastalandshelfscience68:499-508;
45.tangkw,dziallasc,hutalle-schmelzerk和grossarthp(2009)effectsoffoodonbacterialcommunitycompositionassociatedwiththecopepodacartiatonsadana.biologicalletters5:549-553;
46.thompsoncc,thompsonfl,vandemeulebroeckek,hosteb,dawyndtp和swingsj(2004)useofrecaasanalternativephylogeneticmarkerinthefamilyvibrionaceae.internationaljournalofsystematicandevolutionarymicrobiology54:919–929;
47.toddcd,laverackms,boxshallga(1966)coastalmarinezooplankton:apracticalmanualforstudents,london,uk:thenaturalhistorymuseums,p106;
48.viñasmd,diovisalvinr和cepedagd(2010)individualbiovolumeofsomedominantcopepodspeciesincoastalwatersoffbuenosairesprovince,argentinesea.brazilianjournalofoceanography58(2):177-181;
49.williamsrj,griffithsfb,vanderwalej和kellyj(1988)cargovesselballastwaterasavectorforthetransportofnonindigenousmarinespecies.estuarine,coastalandshelfscience26:409-420。
本发明也提供了如下的载体和crispr阵列。
85.用于引入细菌宿主细胞的包含crispr阵列的载体,其中细菌能够经水传播,其中
(a)所述crispr阵列包含用于表达crrna的序列和用于所述宿主细胞内序列转录的启动子;
(b)所述crrna能够与宿主细胞靶标序列杂交,以指导宿主细胞内的cas(例如cas核酸酶)以修饰靶标序列(例如切割靶标序列);所述靶标序列为用于介导宿主细胞活力的核苷酸序列(例如基因或调节序列);
(c)其中(a)的序列包含用于表达和产生crrna的序列r1-s1-r1’,其中r1为第一crispr重复区,r1’为第二crispr重复区,并且r1和r1’为任选的;且s1为第一crispr间隔区,其包含与宿主细胞靶标序列具有80%或更多同一性(例如85、90、91、92、93、94、95、96、97、98、99或100%同一性)的核苷酸序列或由其组成。
“经水传播”意指所述细菌的细胞能在水或者在不同生物体之间、生物体内、不同环境之间、或生物体和环境之间的水性液体中传播。实例为霍乱弧菌、肠球菌属物种和大肠杆菌。霍乱弧菌为带有极性鞭毛的革兰氏阴性逗号形细菌。其属于γ-变形菌门类别。存在两种主要生物型的霍乱弧菌(古典的和埃尔托型),及许多的血清型。霍乱弧菌为霍乱的病原体,是小肠的严重细菌感染,并且是发展中国家中的主要死亡原因。霍乱弧菌的毒力基因是检测和研究霍乱弧菌感染的有趣目标。这些基因中的大多数位于两个致病岛,命名为tcp(毒素协同调节菌毛)和ctx(霍乱毒素),组成为前噬菌体1、2。tcp含有参与宿主经由菌毛的粘附的基因簇,而ctx基因参与霍乱毒素3的合成。
在一个实施方案中,所述载体为分离的载体(即载体不在所述宿主细胞内)。在一个实例中,所述载体为工程改造或合成载体(即非天然存在的载体)。
在一个实例中,所述阵列为icp1阵列,即icp1霍乱弧菌噬菌体的阵列,例如其中噬菌体为icp1_2003_a、icp1_2004_a、icp1_2005_a、icp1_2006_e或icp1_20011_a。在一个实例中,所述阵列为cr1或cr2icp1噬菌体阵列,例如这样的阵列的工程改造或非天然存在的衍生物。
在一个实例中,所述crispr阵列和cas为1-e型或1-f型,例如亚型系统17。
在一个实例中,所述crispr阵列包含多种序列,每种用于表达相应的crrna并与用于所述宿主细胞内序列转录的启动子相关。
在一个实例中,所述载体或每种载体包含多种(例如2、3、4、5、6、7、8、9、10或更多种)所述crispr阵列。
在一个实例中,所述载体包含编码所述cas的核苷酸序列。
在另一个实例中,所述载体没有这样的序列。例如,在这种情况下,所述阵列可与由宿主细胞产生的一种或多种cas一起操作。
86.方面85的载体,其中所述细胞为霍乱弧菌、肠球菌属或大肠杆菌细胞。
87.方面85或86的载体,其中所述载体没有能够表达所述cas的核苷酸序列。
因此,在一个实例中,所述载体不编码cas核酸酶。在一个替代方案中,所述载体编码所述cas。
88.方面85、86或87的载体,其中靶标序列为17-45个连续核苷酸,例如18,19,20或21个连续核苷酸的前间隔区序列。
在一个实例中,每种间隔区(s1)为17-45个连续核苷酸,例如18、19、20、21、30、31、32或33个连续核苷酸的核苷酸序列。霍乱弧菌ple的前间隔区序列为例如32个连续核苷酸,并且靶向它的载体可例如具有32个连续核苷酸的间隔区序列,其与32个核苷酸的ple序列具有100%或至少80、90或95%的同一性。在所述载体包含多个间隔区的情况下,间隔区可为不同间隔区的混合物,或者可为相同的间隔区。例如,所述阵列包含多种间隔区,其中间隔区的亚组为相同的。例如,相同的间隔区与编码宿主细胞致病因子的基因的前间隔区序列可为同源的。使用多间隔区可为有利的,一旦载体处于细胞内,如果宿主切割一个或多个间隔区-未切割的间隔区仍能够形成crrna并回归至靶标序列。在所述载体或阵列中使用不同间隔区的混合物有利于使宿主对入侵载体的适应性风险最小化,由此使抗性最小化。
89.方面85-88中任一项的载体,其中所述靶标序列为毒力、抗性或必需基因序列。在一个实例中,所述靶标序列为pici样元件(ple),例如霍乱弧菌ple,例如ple1的序列。
90.方面85-89中任一项的载体,其中所述靶标序列为致病岛序列,任选地其中宿主细胞为霍乱弧菌细胞且靶标序列为tcp、ctx或vpi序列。在一个实例(例如其中宿主为弧菌属)中,致病岛为tcp(毒素协同调节菌毛)或ctx(霍乱毒素)。弧菌属致病岛(vpi)含有主要参与产生毒素协同调节菌毛(tcp)的基因。其为结构上类似于噬菌体基因组、侧接两个重复区(att样位点)的大的遗传元件(约40kb)。vpi含有两种与其他几种基因一起的基因簇(tcp簇和acf簇)。acf簇由4种基因组成:acfabcd。tcp簇由15种基因组成:tcpabcdefhijpqrst和调节基因toxt。
91.方面85-90中任一项的载体,其中宿主细胞为霍乱弧菌且靶标序列为ctxφ基因序列。霍乱毒素的基因由插入霍乱弧菌基因组中的模板细菌噬菌体ctxphi(ctxφ)携带。ctxφ可以将霍乱毒素基因从一种霍乱弧菌菌株传播至另一种,一种水平基因转移的形式。毒素协同调节菌毛的基因由vpi致病岛(vpi)编码。
92.方面85-90中任一项的载体,其中宿主细胞为霍乱弧菌且靶标序列为ctxb、tcpa、ctxa、tcpb、wbet、hlya、hapr、rstr、msha或tcpp序列。
93.方面85-92中任一项的载体,其中靶标序列为17-45个连续核苷酸(例如18、19、20或21个连续核苷酸)的靶标序列,并与革兰氏阳性细菌、例如金黄色葡萄球菌致病岛(sapi)的噬菌体诱导性染色体岛(pici)的序列具有至少80%同一性(例如85、90、91、92、93、94、95、96、97、98、99或100%同一性)。以下提供了icp1噬菌体(akaicp1相关噬菌体)间隔区序列的实例。这些间隔区序列与霍乱弧菌的靶标序列(前间隔区序列)同源。
94.方面85-93中任一项的载体,其中宿主细胞为霍乱弧菌且crrna能够与霍乱弧菌细胞中前间隔区序列邻近基序(pam)的5、4或3个核苷酸内的靶标序列杂交,其中pam为ga。
95.方面85-94中任一项的载体,其中宿主细胞为霍乱弧菌且所述细胞为埃尔托型、o1或o139霍乱弧菌细胞。在一个实例中,霍乱弧菌为血清型o1埃尔托型n16961、埃尔托生物型18或埃尔托型菌株mj-1236。在一个实例中,宿主细胞为大肠杆菌o157:h7细胞。
96.方面85-95中任一项的载体,其中所述载体为能够感染所述宿主细胞的细菌噬菌体。在一个实例中,宿主细胞为大肠杆菌,和噬菌体为λ或t4噬菌体。在一个实例中,宿主细胞为肠球菌属细胞且噬菌体为肠球菌属噬菌体ime-ef1、phief24c、φef1或efdg1(参见applenvironmicrobiol.2015apr;81(8):2696-705.doi:10.1128/aem.00096-15.epub2015feb6,“targetingenterococcusfaecalisbiofilmswithphagetherapy”,khalifal等人)。
97.方面96的载体,其中宿主细胞为霍乱弧菌且载体为能够感染霍乱弧菌细胞的细菌噬菌体。
98.方面97的载体,其中细菌噬菌体选自ctxφ、icpi噬菌体和肌尾病毒,例如其中噬菌体为icp1_2003_a、icp1_2004_a、icp1_2005_a、icp1_2006_e或icp1_20011_a,任选地工程改造和非天然存在的噬菌体。
99.方面85-98中任一项的载体,其中所述载体为或包含ice,例如转座子。ice可包含本文描述的ice的任何特征。
100.方面99的载体,其中转座子为能够从第一所述宿主细胞转移至第二所述宿主细胞的接合转座子。
101.方面99或100的载体,其中转座子在第一细胞中留下crispr阵列的拷贝。
102.方面85-101中任一项的载体,其中所述或每种阵列由相应的可动遗传元件(mge)包含,其中mge包含在宿主细胞中可操作的转移起点(orit)。mge可以是根据本文描述的任何mge。
103.方面85-102中任一项的载体,其中所述载体为工程改造的载体。
104.水或食品处理组合物,其包含多种方面85-103中任一项的载体。
在一个实例中,水为压载水、海水、苦咸水、淡水、饮用水、水道水(例如河口水)或工业用水。在一个实例中,水为人类胃肠道(gi)流体中的水。
在一个实例中,宿主细胞由贝类、鱼类、稻米或谷物包含。在一个实例中,组合物用于处理食物且宿主细胞为大肠杆菌o157:h7细胞。在一个实例中,靶标序列为在大肠杆菌(例如o157:h7)宿主细胞中编码志贺毒素的序列。在迄今为止描述的经水传播的物种的一个替代方案中,宿主细胞为沙门氏菌属或李斯特氏菌属细胞。
105.用于治疗或预防人中的霍乱弧菌感染的药物,药物包含多种方面85-103中任一项的载体。在一个替代方案中,本发明提供了用于治疗或预防人中的大肠杆菌感染的药物,所述药物包含多种本发明的载体。在一个替代方案中,本发明提供了用于治疗或预防人中的肠球菌属感染的药物,所述药物包含多种本发明的载体。
106.方面104或105的组合物或药物,其进一步包含抗宿主细胞抗生素或抗宿主细胞生物杀灭剂。
以下实施例5为与霍乱相关的实例。
任何一般特征(参见下文)也可应用于本配置(第六种配置)。以下任何配置可与本配置组合,例如以提供包含在本文的一个或多个方面中的特征的组合。
调节cas活性
本发明的这些方面可用于调节cas活性(例如在细胞或体外)。本发明涉及靶向cas编码基因以限制cas活性,这有利于cas的时序调节。本发明也可用于其中期望增加cas活性的严格性的环境下,例如在修饰细胞的基因组时减少脱靶cas切割的机会。例如在修饰人、动物或植物细胞应用时,例如对于细胞或组织或者包含细胞的生物体的基因疗法或基因靶向的脱靶效应应最小化或者避免。例如,当使用cas修饰以在待施用于患者用于基因疗法或者用于治疗或预防人中的疾病或病况的人细胞(例如ips细胞)中进行期望的改变时,需要非常高的严格性。本公开提供了这些应用作为本发明的方法和产物的部分。
本发明因此提供了下面条款:-
1.修饰编码第一cas的可表达基因的方法,所述方法包括:
(a)在从所述基因表达的第一cas存在的情况下使指导rna(grna1)与cas基因组合;和
(b)允许grna1与所述cas基因的序列(例如启动子或其第一cas编码dna序列),并将第一cas指导至基因,由此cas修饰cas基因。
在一个实例中,所述方法为体外无细胞方法(例如重组方法)。在另一个实例中,所述方法在细胞内实施,例如,其中所述基因通过编码其自身的cas切割(即内源性cas用于切割基因)。
2.条款1的方法,其中cas为核酸酶且cas基因被切割。
3.条款1或2的方法,其中cas基因被突变、下调或失活。
4.条款1-3中任一项的方法,其中第一cas为cas9。
5.条款1-4中任一项的方法,其中grna1为单一指导rna。
6.条款1-5中任一项的方法,其中所述方法在宿主细胞内实施。
7.条款6的方法,其中所述细胞为原核细胞,例如细菌或古细菌细胞(例如大肠杆菌细胞)。
8.条款6的方法,其中所述方法为重组方法。
9.条款6、7或8的方法,其中细胞属于人或非人动物病原体物种或菌株(例如金黄色葡萄球菌)。
10.条款6-9中任一项的方法,其中所述细胞为人类微生物组物种,例如人肠道微生物物种的细胞。
11.条款6-10中任一项的方法,其中cas基因由宿主crispr/cas系统包含。
任选地,外源性第一cas编码序列不用于所述方法中,例如当宿主细胞包含与grna1同源的野生型内源性cas核酸酶时。
12.条款6的方法,其中所述细胞为真核细胞(例如人、非人动物、酵母或植物细胞)。
13.条款12的方法,其中所述方法在非人胚胎;非人受精卵;非人生殖细胞;或人或动物内实施(例如其中所述方法为美容方法);任选地其中所述方法不是用于通过手术或疗法或诊断治疗人或动物体的方法。
14.条款6-3中任一项的方法,其中cas基因由在步骤(a)中引入细胞的核酸包含。
15.条款6-4中任一项的方法,其用于减少宿主细胞对通过核酸载体转化或在宿主细胞内维持核酸载体的抗性发展。
16.条款1-15中任一项的方法,或其核酸或细胞产物,其用于人或动物药物治疗、预防或诊断(例如用于人或动物、当所述方法在人或动物细胞中实施时的人或动物细胞的基因疗法;或者用于当所述方法在细菌细胞内实施时在人或动物中治疗或预防细菌感染)。
17.条款1-6中任一项的方法,其中所述方法在体外实施。
18.条款1-16中任一项的方法,其中所述方法在体内实施,任选地不在人胚胎内和任选地其中所述方法不是用于通过手术或疗法或诊断治疗人或动物体的方法。
19.条款1-18中任一项的方法,其中grna1通过从在步骤(a)中与cas基因组合的第一核酸转录产生。
20.条款19的方法,其中所述方法在细胞内实施且在步骤(a)中将编码grna1的第一核酸引入细胞内;或者在步骤(a)中将编码crrna的第一核酸引入细胞内,其中crrna与tracrrna在细胞内形成grna1。
21.条款19或20的方法,其中cas基因与包含待被第一cas修饰的靶标位点(cs-t)的靶标核酸组合,且其中
i.cas基因包含邻近与第一cas同源的pam(p1)的第一前间隔区(ps1),其中ps1在第一位点(cs1)由第一cas修饰(例如切割);
ii.grna1包含与用于指导第一cas的ps1互补的序列,其中ps1在步骤(b)中在cs1被修饰;
iii.靶标核酸包含邻近pam(p-t)的前间隔区序列(ps-t),其中p-t与第一cas同源;
iv.在步骤(b)之前或期间,所述方法包括使指导rna(grna-t)与靶标核酸和从所述基因表达的第一cas组合,其中grna-t与ps-t杂交并指导第一cas以修饰cs-t;和;
v.所述方法任选地包括对修饰的靶标核酸进行分离或测序。
22.任一条款21的方法,其中grna-t通过从步骤iv中与cas组合的核酸(例如所述第一核酸)转录来产生。
23.条款22的方法,其中所述方法在细胞内实施并且所述核酸编码crrna,其中crrna在细胞内与tracrrna形成grna-t。
24.条款21-23中任一项的方法,其中grna1的产生在grna-t产生之后开始,由此ps-t在ps1被修饰(例如切割)之前在靶标核酸的拷贝中被修饰(例如切割),以使第一cas表达下调或失活。
25.条款1-24中任一项的方法,其进一步包括组合切割靶标核酸与另外的核酸,由此在核酸之间发生同源重组且
(i)靶标核酸的核苷酸序列被缺失;
(ii)另外核酸的核苷酸序列被缺失;
(iii)靶标核酸的核苷酸序列被插入另外的核酸中;和/或
(iv)另外核酸的核苷酸序列被插入靶标核酸中。
26.条款25的方法,其中(i)发生,由此使核苷酸序列或靶标核酸的调节元件失活。
27.条款25的方法,其中(i)发生,由此使核苷酸序列或靶标核酸的调节元件活化。
28.条款25、26或27的方法,其中(ii)发生,由此使核苷酸序列或另外核酸的调节元件失活。
29.条款25、26或27的方法,其中(ii)发生,由此使核苷酸序列或另外核酸的调节元件活化。
30.条款25-29中任一项的方法,其中(iii)发生,任选地将插入序列放置在与另外核酸的调节元件的功能关系中和/或创建新的标记序列。
31.条款25-30中任一项的方法,其中(iv)发生,任选地将插入序列放置在与靶标核酸的调节元件的功能关系中和/或创建新的标记序列。
32.条款30或31的方法,其进一步包括检测新的标记序列或其表达产物以确定同源重组已经发生。
33.条款21-32中任一项的方法,其进一步包括对靶标核酸产物、另外的核酸产物和/或第一载体产物进行分离或测序。
34.条款1-33中任一项的方法,其中第一载体如在条款35-55中任一项中所定义。
35.第一(例如分离的)核酸载体或载体的组合,其例如用于条款1的方法,其中
(a)第一载体或所述组合的载体包含编码指导rna(grna1,例如单一grna)的可表达核苷酸序列,所述指导rna与预定的前间隔区序列(ps1)互补,用于指导第一cas在第一位点(cs1)修饰ps1,其中ps1邻近于与第一cas同源的pam(p1);或者可表达序列编码与tracrrna形成grna1的crrna;和
(b)ps1和p1为可表达的第一cas编码基因的序列,并且ps1能够在cs1被第一cas修饰。
在任何配置中的本文每种载体可以是携带特定序列的线形或环状(例如闭合环状,任选地为超螺旋的)的dna。
36.条款35的载体或组合,其中第一cas为核酸酶,其中cs1能够被核酸酶切割。
37.条款35或36的载体或组合,其中第一cas为cas9。
38.条款35-37中任一项的载体或组合,其中grna1为单一指导rna。
39.条款35-38中任一项的载体或组合,其中核苷酸序列在用于产生grna1的原核细胞(例如细菌或古细菌)内可表达。
40.重组试剂盒,其包含条款39的载体或组合(例如其中所述细胞为重组许可的大肠杆菌细胞)。
41.条款35-38中任一项的载体或组合,其中所述核苷酸序列在用于产生grna1的真核细胞(例如人、动物、植物或酵母细胞)内可表达。
42.条款35-41中任一项的载体或组合,其中第一载体或所述组合的载体(例如第二载体)包含编码指导rna(grna-t,例如单链grna)的可表达核苷酸序列,所述指导rna与靶标核酸的预定前间隔区序列(ps-t)互补,用于指导第一cas以修饰(例如切割)ps-t;或者可表达序列编码与tracrrna形成grna-t的crrna;靶标核酸包含邻近pam(p-t)的ps-t,其中p-t与用于修饰ps-t的第一cas同源。
43.条款42的载体或组合,其进一步与所述靶标核酸组合。
44.条款43的载体或组合,其中所述靶标核酸为细胞的染色体或游离核酸。
45.条款44的载体或组合,其中所述细胞是人或非人动物病原体物种或菌株(例如金黄色葡萄球菌)的细胞。
46.条款44或45的载体或组合,其中所述细胞为人类微生物群物种、例如人类肠道微生物物种的细胞。
47.条款44-46中任一项的载体或组合,其中ps-t由细胞(例如原核细胞)的必需基因、毒力基因或抗生素抗性基因序列包含。
48.条款47的载体或组合,其中当第一cas修饰(例如切割)ps-t时,所述基因被下调或失活。
49.条款47的载体或组合,其中当第一cas修饰ps-t时,所述基因被上调或活化。
50.条款35-49中任一项的载体或组合,其与编码第一cas(例如由第一载体包含)的所述基因组合。
51.当在细胞内时的条款35-50中任一项的载体或组合,其中所述细胞包含含有编码第一cas的所述基因的crispr/cas系统。
52.条款35-51中任一项的载体或组合,其用于在人或非人动物中治疗、预防或诊断疾病或病况,例如用于人或动物、当所述方法在人或动物细胞内实施时人或动物细胞中的基因疗法;或者当所述方法在细菌细胞内实施时用于在人或动物中治疗或预防细菌感染。
53.食品、食品成分或前体成分、饮料、水(例如意欲用于人食用)、工业或环境物质(例如石油、石油产品、土壤或水道或水库,或者用于回收或加工石油、石油产品、土壤、水、食品、食品成分或前体、或饮料或饮料前体成分的设备),其包含条款35-52中任一项的第一载体或组合。
54.抗生素(例如抗细菌或抗古细菌)组合物,其包含条款35-52中任一项的第一载体或组合。
55.用于在人或动物中治疗或预防疾病或病况(例如细菌感染或肥胖症)的药物,所述药物包含条款35-52中任一项的第一载体或组合。
在一个实例中,所述载体、组合、药物或抗生素由医疗设备或医疗容器(例如注射器、吸入器或静脉输液袋)包含。
任何一般特征(参见下文)也可应用于本配置。以下任何配置可与本配置组合,例如以提供用于包含在本文的一个或多个方面中的特征的组合。
普遍适用的特征
以下特征应用于本发明的任何配置(例如在其方面、实施方案、概念、段落或实例中的任何一项):
在一个实例中,靶标序列为染色体序列、内源性宿主细胞序列、野生型宿主细胞序列、非病毒性染色体宿主细胞序列、非外源序列和/或非噬菌体序列(即这些中的一种多种或全部),例如序列为野生型宿主染色体细胞序列,如由宿主细胞染色体包含的抗生素抗性基因或必需基因序列。在一个实例中,序列为宿主细胞质粒序列,例如,抗生素抗性基因序列。
在一个实例中,至少两种靶标序列被cas修饰,例如抗生素抗性基因和必需基因。这样多靶向可用于减少逃逸突变宿主细胞的进化。
在一个实例中,cas为野生型内源性宿主细胞cas核酸酶和/或每种宿主细胞是野生型宿主细胞。因此,在一个实施方案中,本发明使用不需要首先使内源性cas去阻遏以提供相关cas活性的宿主细胞。在一个实例中,每种宿主细胞具有组成型cas核酸酶活性,例如组成型野生型cas核酸酶活性。在一个实例中,宿主细胞为细菌细胞;在其他实例中宿主细胞为古细菌细胞。采用内源性cas是有利的,因为这能使编码hm-或pm-crna或grna的载体内空间得以释放。例如,当ii型crispr/cas系统用于本发明的宿主细胞修饰时,ii型cas9核苷酸序列为大型的并且在那种情况下采用宿主细胞的内源性cas反而是有利的。在4.2千碱基(kb)测量下时最常使用的cas9来自化脓性链球菌。当其为有效的核酸酶时,分子长度可超越载体能容纳多少遗传物质的极限,这种极限对在活体动物组织及本文描述的其他环境下使用crispr造成障碍(参见f.a.ran等人,“invivogenomeeditingusingstaphylococcusaureuscas9,”nature,doi:10.1038/nature14299,2015)。因此,在一个实施方案中,本发明的载体为aav载体,或者具有不超过aav载体的外源性dna插入能力,并且cas为宿主细胞的内源性cas,其中细胞为细菌或古细菌细胞。
嗜热链球菌cas9(uniprotkb-g3ecr1(cas9_strtr))核苷酸序列具有1.4kb大小。
因此,在一个实施方案中,本发明提供了
包含多于1.4kb或多于4.2kb的编码crispr/cas系统的组分的外源性dna序列的核酸载体,其中所述序列包含用于在宿主细胞(本文的任何细胞,例如人、动物或细菌或古细菌宿主细胞)中表达一种或多种hm-或pm-crrna或grna的工程改造的阵列或工程改造的序列(任选地如本文所述),其中所述阵列或工程改造的序列不包含编码与crrna(s)或grna(s)同源的cas核酸酶的核苷酸序列;任选地其中至少2、3或4种crna或grna由外源dna编码。在一个实施方案中,所述宿主细胞为表达与crrna或grna同源的cas核酸酶的细菌或古细菌细胞。在另一个实例中,诸如对于用于人或动物(例如啮齿动物、大鼠或小鼠)细胞,所述cas核酸酶由不同的核酸载体编码。在一个实例中,其中细胞为人或动物细胞,所述载体为aav或慢病毒载体。在一个实例中,本发明包含含有这样的载体的宿主细胞,其中所述宿主细胞表达所述cas。在一个实例中,所述宿主细胞为离体的人或动物细胞。
本发明也提供了
包含多于1.4kb或多于4.2kb的外源性dna序列的核酸载体,其中外源性dna编码crispr/cas系统的一种或多种组分且包含工程改造的阵列或序列(例如本文描述的任何这样的阵列或序列),用于在宿主细胞中表达一种或多种hm-crrna或grna,其中外源序列没有编码与crrna(s)或grna(s)同源的cas核酸酶的核苷酸序列;任选地其中至少2种不同的crna或grna由外源dna编码。在一个实例中,本发明包含含有这样的载体的宿主细胞,其中所述宿主细胞表达所述cas。在一个实例中,crna或grna能够在宿主细胞内与相应的靶标前间隔区序列杂交,其中每个前间隔区序列由抗生素抗性或必需宿主基因包含。这通过本文的工作实施例例举,其中我们显示宿主细胞在混合或非混合细胞群体中的选择性生长抑制达至少10倍。混合物模拟在人微生物群中发现的物种和菌株的组合。
“编码crispr/cas系统的组分的外源性dna序列”意指插入载体骨架中的dna,或者先前已经发生所述插入(例如使用重组dna技术,诸如重组)的载体的后代中的这样dna。在一个实例中,外源性dna为载体插入容量的95、90、80、85、70或60%。
在一个实例中,载体为病毒载体。病毒载体对外源性dna插入具有特别有限的容量,因此需要考虑病毒包装容量。需要为编码重要病毒功能,如用于表达衣壳蛋白和聚合酶的序列留出空间。在一个实例中,载体为噬菌体载体或aav或慢病毒载体。在宿主为细菌细胞的情况下,噬菌体载体是有用的。
本发明提供了组合产品试剂盒(例如在如本文所述用于治疗或预防人或动物受试者中的疾病或病况),其中试剂盒包含阵列、载体、系统、细胞、工程改造的crna或grna编码序列或者crna或grna,其与抗生素(第一抗生素)组合,其中crna或grna能够与由细菌宿主细胞抗生素抗性基因包含的前间隔区序列杂交,其中抗生素为所述第一抗生素。抗生素可为本文公开的任何抗生素。在一个实施方案中,抗生素在制剂中与阵列、载体、系统、细胞、工程改造的crna或grna编码序列或者crna或grna组合。在一个实例中,所述试剂盒在与含有阵列、载体、系统、细胞、工程改造的crna或grna编码序列或者crna或grna的容器分开的容器中包含抗生素。
在一个实施方案中,除非另外指明,所述或每种细胞为细菌细胞、古细菌细胞、藻类细胞、真菌细胞、原生动物细胞、无脊椎动物细胞、脊椎动物细胞、鱼类细胞、鸟类细胞、哺乳动物细胞、伴侣动物细胞、狗细胞、猫细胞、马细胞、小鼠细胞、大鼠细胞、兔细胞、真核细胞、原核细胞、人类细胞、动物细胞、啮齿动物细胞、昆虫细胞或植物细胞。另外,在这种情况下,优选地所述细胞属于相同的门、目、科或属。
通过使用术语“工程改造”,对技术人员应显而易见的是,本发明的阵列、序列、载体、mge或任何其他配置、概念、方面、实施方案、段落或实施例等为非天然存在的。例如,mge、载体或阵列包含与mge、载体或阵列的其他序列或组分一起非天然发现的一种或多种序列或组分。例如,阵列对所述或每种宿主细胞为重组的、人工的、合成的或外源性的(即非内源性或非野生型)。
在一个实例中,本发明的阵列或载体被分离,例如从宿主细胞分离。在一个实例中,所述阵列或载体不与在细胞内与所述阵列的重复序列一起天然发现的cas核酸内切酶编码序列组合。
在一个实例中,当不在宿主细胞内时,所述载体、mge或阵列不与cas核酸内切酶编码序列组合。在一个实例中,所述载体或mge不包含cas核酸内切酶编码序列。
在一个实例中,靶标修饰或切割通过dsdnacas核酸酶(例如cas9,例如spcas9或sacas9)实施,由此通过非同源末端连接(nhej)进行切割的修复。这通常在修复位点引入突变(插入缺失),其可用于失活靶标位点(例如噬菌体基因或调节元件,诸如其必需基因或调节元件)。在另一个实例中,切割通过其在单链中切割(但不进行双链dna切割)的ssdnacas核酸酶(例如cas9核酸酶)实施。这可用于有利于切割的hdr修复,其减少插入缺失的机会。当期望靶标位点(或包含其的基因或调节元件)时,例如在靶标位点插入hm-或pm-dna用于期望的位点修饰的情况下,这可能是有用的。例如,在这种情况下,修饰的基因产生融合蛋白,所述融合蛋白包含与宿主dna编码序列融合的hm-dna编码的氨基酸,或与噬菌体dna编码序列融合的pm-dna编码的氨基酸序列。本发明也提供了通过这样的方法得到或可得到的编码融合蛋白的序列。在另一个实例中,hm-或pm-dna包含调节元件(例如用于调节基因表达的启动子、增强子、阻遏蛋白或诱导型开关),使得所述融合产物包含与宿主或噬菌体基因或调节元件dna融合的所述dna,由此产生融合基因。本发明也提供了通过这样的方法得到或可得到的融合基因。在一个实施方案中,本发明提供了包含这样的融合基因的载体(例如病毒、病毒粒、噬菌体、噬菌粒、前噬菌体或质粒),任选地其中所述载体包含在细菌细胞内(例如原核、真核、细菌、古细菌或酵母细胞)。在一个实例中,细胞为体外的。
在一个实例中,hm或pm-dna为细胞内的载体dna。例如,载体中的hm-或pm-dna可以侧接位点特异性重组位点(例如frt或lox位点),其通过由宿主细胞或由载体序列编码的位点特异性重组酶的作用切割。在另一个实例中,载体包含转录为hm-或pm-dna的rna拷贝的dna和用于从rna产生hm-或pm-dna的逆转录酶(例如通过载体核酸序列编码)。这可用于产生许多拷贝的期望的hm-或pm-dna,以增加在一个或多个靶标位点有效或有效率引入的机会。在另一个实施方案中,hm-或pm-dna为或由已转导或转化宿主细胞的第二载体(例如第二噬菌体或质粒)的核酸编码。例如,这可以是辅助噬菌体(其也可编码一种或多种包装第一噬菌体载体所需的衣壳蛋白)。在另一个实例中,dna被提供在载体dna中并且侧接臂,其中当载体包含在宿主细胞中时,5’臂包含由cas核酸酶识别的pam,并且3’臂紧邻下游(3’)侧接这样的pam,由此在宿主细胞内cas用其侧接臂裂解释放hm-或pm-dna,所述侧接臂可被设计成侧接宿主靶标序列中的切口的宿主序列同源,由此hm-dna被整合至宿主基因组中,或者pm-dna被整合至噬菌体基因组中。在一方面,本发明提供了包含这样的hm-或pm-dna和臂的核酸或包含这样的核酸的载体(例如噬菌体或包装的噬菌体),任选地其中所述载体由宿主细胞包含。任选地,hm-dna与如本文定义的hm-阵列组合。任选地,pm-dna与如本文定义的pm-阵列组合。
本发明的一个具体应用为改变离体或体内混合细菌群体中的拟杆菌门(例如拟杆菌属)细菌的比例。如以上所讨论,这可用于环境处理,诸如处理被不期望的拟杆菌门感染的水道或饮用水,或者有利于人或动物中有用的共栖或共生拟杆菌门,例如用于产生为这样的目的施用于人或动物的细菌培养物。在后者的一个实例中,本发明可用于增加拟杆菌门相比于厚壁菌门的相对比例,其与体重降低有关且因此在治疗或预防用于医疗或美容目的的肥胖症方面发现用途。
研究表明,拟杆菌属在预防艰难梭菌感染方面具有作用。限制潜在病原体的进入和增殖的免疫反应的发展深切取决于脆弱拟杆菌。而且,潘氏细胞蛋白可响应于通过多形拟杆菌刺激产生抗菌肽,并且这些分子可预防定殖于肠道的病原体。另外,多形拟杆菌可诱导潘氏细胞产生杀菌凝集素regiii,其通过结合于革兰氏阳性菌的肽聚糖发挥其抗微生物作用。因此,本发明以其任何配置用于增加肠道细胞的混合群体中拟杆菌属(例如多形拟杆菌和/或脆弱拟杆菌)比例的用途,对限制人或非人动物的群体或肠道致病细菌的定殖是有用的。
hooper等人证明多形拟杆菌可以修饰由岩藻糖阻遏基因和信号系统介导的复杂相互作用中的肠道岩藻糖基化。使用转录分析证明,多形拟杆菌可以调节多种宿主基因的表达,包括参与营养吸收、粘膜屏障防御和血管生成因子产生的那些基因。
在一个实施方案中,所述混合群体由第一和第二细菌组成(即没有另外的细菌群体)。
在一个实例中,所述或每种阵列为载体中的重组阵列和/或载体中的分离阵列。在一个实例中,所述阵列包含在宿主细胞(例如微生物、细菌或古细菌细胞)内。
在一个实例中,所述cas为宿主细胞的内源性cas核酸酶(例如cas9)。通过利用宿主的cas,这使得能够有效利用阵列中的宿主类型重复区和也利用内源性crrna的可能性-释放出否则其在载体诸如病毒或噬菌体中有限的容量(注意cas基因序列诸如ii型cas9为大型的)。
在一个实例中,宿主crispr/cas系统为i型系统。在一个实例中,宿主crispr/cas系统为ii型系统。在一个实例中,宿主crispr/cas系统为iii型系统。
由本发明的hm-crrna或grna指导的cas为宿主内源性cas或与靶标序列中的pam相容的载体编码的cas。
任选地,宿主(或第一和/或第二细菌)为革兰氏阴性菌(例如螺旋状菌属或弧菌属)。任选地,宿主(或第一和/或第二细菌)为革兰氏阳性菌。任选地,宿主(或第一和/或第二细菌)为支原体属、衣原体属、螺旋体属或结核分枝杆菌属。任选地,宿主(或第一和/或第二细菌)为链球菌属(例如化脓性链球菌或嗜热链球菌)宿主。任选地,宿主(或第一和/或第二细菌)为链球菌属(例如金黄色葡萄球菌,例如mrsa)宿主。任选地,宿主(或第一和/或第二细菌)为大肠杆菌(例如o157:h7)宿主,例如其中cas由载体编码或内源性宿主cas核酸酶活性被去阻遏。任选地,宿主(或第一和/或第二细菌)为假单胞菌属(例如铜绿假单胞菌)宿主。任选地,宿主(或第一和/或第二细菌)为弧菌属(例如霍乱弧菌(例如o139)或创伤弧菌)宿主。任选地,宿主(或第一和/或第二细菌)为奈瑟氏菌属(例如淋病奈瑟氏菌或脑膜炎奈瑟氏菌)宿主。任选地,宿主(或第一和/或第二细菌)为博德特氏菌属(例如百日咳博德特氏菌)宿主。任选地,宿主(或第一和/或第二细菌)为嗜血杆菌属(例如流感嗜血杆菌)宿主。任选地,宿主(或第一和/或第二细菌)为志贺氏菌属(例如痢疾杆菌)宿主。任选地,宿主(或第一和/或第二细菌)为布鲁氏菌属(例如流产布鲁氏菌)宿主。任选地,宿主(或第一和/或第二细菌)为弗朗西斯氏菌属宿主。任选地,宿主(或第一和/或第二细菌)为黄单孢菌属宿主。任选地,宿主(或第一和/或第二细菌)为农杆菌属宿主。任选地,宿主(或第一和/或第二细菌)为欧文氏菌属宿主。任选地,宿主(或第一和/或第二细菌)为军团菌属(例如嗜肺军团菌)宿主。任选地,宿主(或第一和/或第二细菌)为李斯特氏菌属(例如单核细胞增生李斯特氏菌)宿主。任选地,宿主(或第一和/或第二细菌)为弯曲杆菌属(例如空肠弯曲杆菌)宿主。任选地,宿主(或第一和/或第二细菌)为耶尔森氏菌属(例如鼠疫耶尔森氏菌)宿主。任选地,宿主(或第一和/或第二细菌)为疏螺旋体属(例如博氏疏螺旋体)宿主。任选地,宿主(或第一和/或第二细菌)为螺杆菌属(例如幽门螺杆菌)宿主。任选地,宿主(或第一和/或第二细菌)为梭菌属(例如艰难梭菌或肉毒梭菌)宿主。任选地,宿主(或第一和/或第二细菌)为埃立克体属(例如查菲埃立克体)宿主。任选地,宿主(或第一和/或第二细菌)为沙门氏菌属(例如伤寒沙门氏菌或肠道沙门氏菌,例如血清型鼠伤寒沙门氏菌,例如dt104)宿主。任选地,宿主(或第一和/或第二细菌)为衣原体属(例如衣原体肺炎)宿主。任选地,宿主(或第一和/或第二细菌)为副衣原体属宿主。任选地,宿主(或第一和/或第二细菌)为棒状杆菌属(例如无枝菌酸棒杆菌)宿主。任选地,宿主(或第一和/或第二细菌)为克雷伯氏菌属(例如肺炎克雷伯氏菌)宿主。任选地,宿主(或第一和/或第二细菌)为肠球菌属(例如粪肠球菌或屎肠球菌,例如利奈唑胺耐药的)宿主。任选地,宿主(或第一和/或第二细菌)为不动杆菌属(例如鲍曼不动杆菌,例如多重耐药的)宿主。
在一个实例中,所述细胞为原核细胞。在一个实例中,所述细胞为细菌细胞。在一个实例中,所述细胞为古细菌细胞。在一个实例中,所述细胞为微生物细胞。在一个实例中,所述细胞为原生动物细胞。在一个实例中,所述细胞为鱼类细胞。在一个实例中,所述细胞为鸟类细胞。在一个实例中,所述细胞为爬行动物细胞。在一个实例中,所述细胞为蛛形纲动物细胞。在一个实例中,所述细胞为酵母细胞(例如酵母属细胞)。在一个实例中,所述宿主细胞为植物细胞。在一个实例中,所述宿主细胞为动物细胞(例如不是人类细胞,例如不是啮齿动物细胞)。在一个实例中,所述宿主细胞为人类细胞(例如不是胚胎或人中的细胞),例如为体外宿主细胞。在一个实例中,所述细胞为牲畜或伴侣宠物动物细胞(例如牛、猪、山羊、绵羊、马、狗、猫或兔细胞)。在一个实例中,所述宿主细胞为昆虫细胞(在其生命周期的任何阶段的昆虫,例如卵、幼虫或蛹)。在一个实例中,所述宿主细胞为原生动物细胞。在一个实例中,所述细胞为头足类动物细胞。
任选地,所述阵列、系统、工程改造的核苷酸序列或载体核酸进一步包括(例如一种、两种或更多种)核定位信号(nls),例如当宿主细胞为真核细胞例如植物或动物时用于靶向细胞核。在一个实例中,nls侧接本发明的cas编码核酸序列和/或本发明的阵列的每一末端,特别是用于在真核宿主细胞中靶向。
tracrrna序列可从本发明的阵列或载体省略(omitted),例如对于不使用tracrrna的类型的cas系统。
在一个实例中,指导至靶标的cas为核酸外切酶。任选地,本文提及的切口酶为双链切口酶。
切口酶的一个实例为cas9切口酶,即具有两个核酸酶功能区即ruvc和/或hnh结构域之一失活的cas9。
任选地,宿主系统为i型系统(和任选地,所述阵列、hm-crrna或grna属于不同的crispr系统,例如ii或iii型)。任选地,所述阵列或工程改造的序列与含有编码与所述阵列、hm-crrna或grna相同的系统的cas的核苷酸序列的病毒或质粒组合,例如其中cas用宿主系统不操作或有效操作。任选地,所述宿主系统为ii型系统(和任选地,所述阵列、hm-crrna或grna属于不同的crispr系统,例如i或iii型)。任选地,所述阵列或工程改造的序列与含有编码与所述阵列、hm-crrna或grna相同的系统的cas的核苷酸序列的病毒或质粒组合,例如其中cas对于宿主系统不操作或有效操作。任选地,所述宿主系统为iii型系统(和任选地,所述阵列、hm-crrna或grna属于不同的crispr系统,例如,i或ii型)。任选地,所述工程改造的序列的阵列与含有编码与所述阵列相同的系统的cas的核苷酸序列的病毒或质粒组合,例如其中cas对于宿主系统不操作或有效操作。
本文提及的使用载体dna也可在一个替代实施方案中进行必要的变更应用于上下文允许的载体rna。例如,其中载体为rna载体。因此,当上下文允许时,当指代本文的载体dna时,本发明的所有特征在替代方案中被公开,并被认为是“rna”而不是“dna”。在一个实例中,所述或每种载体也编码逆转录酶。
在一个实例中,所述或每种阵列或工程改造的核苷酸序列由纳米粒载体或在脂质体中提供。
在一个实例中,cas为用于切割的cas核酸酶、用于干扰的死cas(dcas)或与用于活化靶标的转录活化因子缀合的dcas。
在一个实例中,所述宿主crispr/cas系统包含宿主crispr阵列和用于宿主中的核苷酸序列靶向的同源宿主cas。在一个实例中,所述宿主靶标序列包含至少5、6、7、8、9、10、20、30或40个连续核苷酸。在一个实例中,所述靶标序列被cas、例如cas9切割。在一个实施方案中,所述序列不在间隔区中。
在一个实例中,所述或每种阵列或工程改造的序列包含对于宿主内crrna或grna转录为功能性的外源性启动子。
在一个实例中,所述或每种阵列重复区与宿主阵列的重复区相同,其中crispr阵列不包含被宿主crispr/cas系统的cas(例如cas核酸酶,例如cas9)识别的pam。这进行必要的变更应用于hm-crrna和grna的重复序列。该实施方案是有利的,因为其只是使得crispr阵列能够使用内源性宿主cas靶向宿主靶标序列。则这是有效的,因为阵列是专为宿主机制(machinery)使用,且因此有助于宿主细胞中发挥功能。另外地或可替代地(例如,在将所述阵列与外源(非宿主内源)cas编码序列组合提供的情况下),该实施方案使得crispr阵列能够使用内源编码的tracrrna,因为crispr阵列重复区会与内源性tracrrna杂交用于产生pre-crrna和加工成与宿主靶标序列杂交的成熟crrna。然后,后者复合物可以指导内源性cas核酸酶(例如,cas9)或指导由crispr阵列包含的序列产生的cas。因此,该实施方案提供简单构建含有crispr阵列、但不包含tracrrna-和/或cas核酸酶编码序列的载体(例如包装的病毒或噬菌体)的灵活性。这对于载体构造而言更为直截了当,并且也在载体(例如病毒或噬菌体)中释放出有价值的空间,这是对于载体,特别是病毒载体(例如噬菌体)的容量限制的有用记忆。另外的空间可以是有用的,例如使得能够在阵列中包含更多的空间,例如以靶向用于修饰的宿主基因组,诸如使宿主基因失活或为宿主内表达带入期望的非宿主序列。另外或可替代地,所述空间可用于在载体中包含多个crispr阵列。例如,这些可以是这样的排列,其中第一阵列是第一crispr/cas类型(例如ii型或ii-a型)的,且第二阵列可以是第二种类型(例如i或iii型或者ii-b型)的。另外或可替代地,所述阵列可以使用宿主内的不同cas核酸酶(例如一个阵列可以与宿主cas核酸酶一起操作,且第二阵列可与外源性cas核酸酶(即载体编码的核酸酶))。这些方面提供了用于靶向宿主的机制,一旦已引入载体,则当宿主需要靶向更大范围的元件时其有益于减少宿主对载体的抗性。例如,如果宿主能够获得基于第一crispr阵列序列的新间隔区,则第二crispr阵列仍能够在宿主内发挥功能,以靶向宿主细胞内相应靶标序列。因此,该实施方案对减少宿主对载体的适应是有用的。
另一个益处是可以(例如,采用这种排列)在crispr阵列中(或分布在载体中的多个此类阵列中)包括多个拷贝的相同间隔区(例如,用于在宿主细胞中靶向靶标位点的间隔区)。这是有益的,因为已经提出宿主(例如细菌和古细菌)的适应可涉及从其阵列丢失间隔区,其中所述间隔区靶向有益宿主dna(plosgenet.2013;9(9):e1003844.doi:10.1371/journal.pgen.1003844.epub2013sep26,"dealingwiththeevolutionarydownsideofcrisprimmunity:bacteriaandbeneficialplasmids",jiangw等人)。认为间隔区-重复区单元的去除通过重复序列的重组而发生。因此,根据本发明方面,提供了1、2、3、4、5、6或更多个本发明的crispr阵列或工程改造的序列,其包含多个(例如2、3、4、5、10、15、20、25、30、35、40、45、50、55、60、70、80、90、100或更多个)拷贝的与宿主靶标序列杂交的间隔区。这减少宿主细胞内通过重组丢失所有这些间隔区的机会。在该方面的进一步应用中,crispr阵列包含含有一个或多个(例如2、3、4、5、10、15、20、25、30、35、40、45、50、55、60、70、80、90或更多个)拷贝的间隔区的第一阵列和含有一个或多个(例如2、3、4、5、10、15、20、25、30、35、40、45、50、55、60、70、80、90或更多个)拷贝的相同间隔区的第二阵列,其中第一阵列中的间隔区拷贝各自侧接第一重复区,且第二阵列中的相同间隔区拷贝各自侧接第二重复区,其中第一重复区不同于第二重复区。
这具有以下益处:可以选择第一和第二重复序列中的至少一个不被宿主cas核酸酶(或相同的宿主cas核酸酶)识别,以减少涉及多于一个阵列的宿主适应的机会。在一个实例中,第一阵列与不由宿主细胞编码且为用于第一重复区的同源cas的cas核酸酶序列组合。任选地,第二阵列也与不由宿主细胞编码且为第二重复区的同源cas的cas核酸酶序列(例如,与第一阵列的序列相同或不同)组合。
一个实施方案提供了包含在第一载体中的第一阵列和包含在不包含第一阵列的第二载体中的第二阵列(例如其中所述载体为质粒或病毒粒子(例如相同病毒类型的)或包装的噬菌体(例如相同噬菌体类型的))。这是有用的,因为载体可被同时或依次引入相同的宿主细胞中。因此,当宿主获得对第一阵列的抗性时,引入第二阵列以提供抗性宿主(例如细菌或古细菌)先前没有与其共同进化、由此提供针对宿主细胞的第二修饰(例如敲低)波的第二阵列。这也提供了灵活性,因为第三种这样的载体(包含不同于第一和第二阵列和间隔区的间隔区或阵列)可以与第二载体同时或依次引入宿主细胞,以提供对第一阵列中的间隔区具有抗性的宿主进化期间先前不存在的宿主细胞修饰的另外途径。代替阵列,可以使用本发明的工程改造的核苷酸序列。
因此,在一个实施方案中,本发明提供了用于修饰宿主细胞的组合物,其中所述组合物提供如本文描述的任何阵列或工程改造的序列。因此,在一个实施方案中,本发明提供了用于修饰宿主细胞的组合物,其中所述组合物提供第一载体(例如病毒粒子或包装的噬菌体)中的如本文描述的第一阵列和第二载体(例如分别为病毒粒子或包装的噬菌体)中的如本文描述的第二第一这样的阵列,其中第二阵列包含靶向一个或多个宿主靶标序列并且不被第一阵列包含的一个或多个间隔区。代替阵列,可以使用本发明的工程改造的核苷酸序列。
在一个实施方案中,阵列或工程改造的序列包含在噬病毒体载体中并且宿主或者为可感染细胞的病毒。例如,宿主为可能已感染阿米巴细胞的大型病毒。例如,宿主为sputnik病毒、阔口罐病毒、拟菌病毒、妈妈病毒、巨型病毒或潘多拉病毒,例如,其中宿主病毒处于水中。在该实施方案的一个实例中,本发明用于水或污水处理(例如净化,例如水道、河流、湖泊、池塘或海洋治理)。
在一个实施方案中,所述或每种载体或工程改造的序列为φnm1噬菌体或由其包含,例如其中宿主细胞为金黄色葡萄球菌(例如mrsa)细胞。
一般特征也提供了以下条款:-
1.抗微生物组合物(例如抗生素,例如药物、消毒剂或漱口水),其包含根据本发明的任一方面的阵列、工程改造的序列、病毒、病毒粒子、噬菌体、噬菌粒、前噬菌体、群体或集合。
2.条款1的组合物,其用于医疗或牙科或眼科用途(例如用于在生物体中治疗或预防感染或者限制在生物体中的扩散)。
在一个实例中,所述生物体为植物或动物,例如脊椎动物(例如本文公开的任何哺乳动物或人)或作物或食用植物。
3.包含根据本发明的阵列、工程改造的序列、系统、集合、病毒、病毒粒子、噬菌体、噬菌粒、前噬菌体、组成、群体、集合的组合物、用途或方法,其用于化妆品用途(例如用于美容产品,例如化妆品)或用于卫生用途(例如用于卫生产品,例如肥皂)。
4.包含条款1-35中任何一项的阵列、工程改造的序列、集合、病毒、病毒粒子、噬菌体、噬菌粒、前噬菌体、群体或集合的组合物在医药中或用于牙科治疗或预防用途的用途。
5.包含根据本发明的阵列、工程改造的序列、集合、系统、病毒、病毒粒子、噬菌体、噬菌粒、前噬菌体、组成、群体、集合的组合物、用途或方法在化妆品用途(例如用于美容产品,例如化妆品)或用于卫生用途(例如用于卫生产品,例如肥皂)的用途。
6.根据本发明的阵列、工程改造的序列、系统、集合、病毒、病毒粒子、噬菌体、噬菌粒、前噬菌体、组合物、群体或集合在能够修饰宿主细胞的靶标核苷酸序列的宿主修饰(hm)crispr/cas9系统(例如i、ii或iii型)中的用途,其中所述阵列、工程改造的序列、系统、病毒、病毒粒子、噬菌体、噬菌粒、前噬菌体、群体或集合根据本发明。
7.条款4、5或6的用途,其中所述阵列、工程改造的序列、系统、集合、病毒、病毒粒子、噬菌体、噬菌粒、前噬菌体、群体或集合不在宿主细胞内。
8.条款5或6的用途,其中所述阵列、工程改造的序列、集合、系统、病毒、病毒粒子、噬菌体、噬菌粒、前噬菌体、群体或集合在宿主细胞(例如微生物,细菌或古细菌细胞)内。
9.条款4-6中任一项用于修饰微生物细胞(例如用于杀死或减少细胞生长或微生物细胞培养)的用途。
10.修饰宿主细胞(例如微生物细菌或古细菌)内的靶标核苷酸序列的方法,所述方法包括用根据本发明的阵列、工程改造的序列、系统、集合、病毒、病毒粒子、噬菌体、噬菌粒、群体或集合转化宿主细胞,由此靶标核苷酸序列被cas修饰,其中宿主靶标序列为细胞的宿主crispr/cas系统的核苷酸序列。
11.减少宿主细胞对通过核酸载体转化或在宿主细胞内维持核酸载体的抗性发展的方法,其中宿主细胞包含靶标核苷酸序列,所述方法包括用根据本发明的阵列、工程改造的序列、集合、系统、病毒、病毒粒子、噬菌体、噬菌粒、群体或集合转化宿主细胞,由此靶标核苷酸序列被cas修饰(例如切割、突变或敲低)。
12.条款11的方法,其中所述载体为能够感染宿主细胞的病毒且转化步骤包括用载体感染宿主细胞。
13.条款11或12的方法,其中宿主细胞为细菌或古细菌细胞且载体为噬菌体或噬菌粒。
14.条款11-13中任一项的方法,其中宿主靶标序列对crispr/cas介导的载体序列间隔区的获取为必需的。
15.任一前述条款的阵列、工程改造的序列、系统、载体、细胞、集合、组合物、用途或方法,其中至少组分(ii)包含在能够表达细胞内溶素用于宿主细胞裂解的病毒(例如噬菌体)中,任选地其中细胞内溶素为噬菌体phi11、噬菌体twort、噬菌体p68、噬菌体phiwmy或噬菌体k细胞内溶素(例如mv-细胞内溶素或p-27/hp细胞内溶素)。
16.条款15的阵列、工程改造的序列、系统、载体、集合、细胞、组合物、用途或方法,其与用于宿主细胞裂解的细胞内溶素组合,例如与mv-细胞内溶素或p-27/hp细胞内溶素或其功能同源物组合。
17.任一前述条款的阵列、工程改造的序列、系统、载体、集合、细胞、组合物、用途或方法,其与抗微生物药,例如抗生素,例如β-内酰胺类抗生素组合。
18.任一前述条款的阵列、工程改造的序列、系统、载体、集合、细胞、组合物、用途或方法,其中宿主细胞为葡萄球菌属、链球菌属、假单胞菌属、沙门氏菌属、李斯特氏菌属、大肠杆菌属、脱硫弧菌属或梭菌属宿主细胞。
19.任一前述条款的阵列、工程改造的序列、系统、载体、集合、细胞、组合物、用途或方法,其中宿主细胞为葡萄球菌属(例如金黄色葡萄球菌)宿主细胞且至少组分(ii)包含在i、ii或iii类葡萄球菌属噬菌体(例如包装的噬菌体)、任选地有尾噬菌体目或肌尾噬菌体科噬菌体中。
20.任一前述条款的阵列、工程改造的序列、系统、载体、细胞、集合、组合物、用途或方法,其中宿主细胞为β-内酰胺类抗生素抗性金黄色葡萄球菌、甲氧西林抗性金黄色葡萄球菌(mrsa)、万古霉素抗性金黄色葡萄球菌或替考拉宁抗性金黄色葡萄球菌,且任选地靶标序列分别为宿主β-内酰胺类抗生素抗性基因、甲氧西林抗性基因、万古霉素抗性基因或替考拉宁抗性基因的序列。
用于产生和测试本发明的噬菌体载体的合适方法为例如在wo2014/124226中公开的一般方法。
可动遗传元件、转座子和载体(用于本发明的任何配置)
质粒在拟杆菌属物种中非常常见,并且在20-50%的菌株中被发现。许多质粒具有orit和反式作用运动基因,其允许它们通过接合转移。因此,在一个实例中,所述载体为包含orit和/或运动基因的质粒,例如其中第一或第二细菌为拟杆菌属。在一个实例中,工程改造的序列由这样的载体包含。
在一个实例中,宿主细胞、或者第一或第二细菌天然包含转座子。转座子(可动和接合的)不独立复制;相反,它们从染色体dna切除和整合至染色体dna中,并且与染色体dna一同被拷贝。接合转座子具有切除和整合的机制,其类似于质粒和细菌噬菌体两者的一些特征。接合转座子在拟杆菌属中实际上普遍存在:超过80%的拟杆菌属菌株含有至少一种接合转座子。拟杆菌属的接合转座子属于至少两个家族;ctndot被最好描述。通常,其中它们被发现的菌株的名称被添加至命名中(例如在多形拟杆菌的dot菌株中发现的ctndot)。除了能够被插入染色体中以外,拟杆菌属接合转座子能够插入共驻留质粒中,并且通过使其本身整合至质粒中和便于质粒-接合转座子杂合体转移入另一细胞中而使它们顺式运动(即它们可作用于物理上相邻的实体)。通过供应便于质粒转移所需的因子,同时在物理上保持与质粒分开,它们也可“反式”运动共驻留质粒。
接合转座子不排除彼此做质粒,所以菌株可以聚集多于一种接合转座子。此外,一些证据证明在菌株中存在接合转座子的多于一种拷贝导致刺激转位(反式活化)。在理论上,这表明当环境中累积更多的接合转座子时,转座子基因向其他细菌的转移也增加,并且基因存在明显向上的螺旋式分布。许多拟杆菌属转座子携带tetq基因并且因此赋予四环素抗性。进一步地,自主转移和其他活动明显由低水平的四环素刺激,通过tetq-rtea-rteb操纵子调节。四环素增加rtea和-b的转录,其编码双组分调节系统的传感器和活化组分。进而,rteb活化rtec的表达,其对自主转移是必要的。
在一个实例中,载体(例如包含工程改造的序列的载体)包含转座子,其中转座子包含本发明的工程改造的序列、hm-或pm-阵列,其中转座子在宿主细胞或者在第一或第二细菌宿主细胞物种内为可操作的。在一个实施方案中,转座子为拟杆菌属转座子(例如ctndot转座子,例如多形拟杆菌或脆弱拟杆菌ctndot转座子)和宿主细胞、或者第一或第二细菌为或包含拟杆菌属(例如属于与所述ctndot转座子相同的物种)。在一个实例中,转座子为接合转座子。在一个实例中,转座子为可动转座子。在一个实例中,转座子可在拟杆菌属细胞之间转移。在一个实例中,转座子包含intdot序列。在一个实例中,转座子包含orit。在一个实例中,转座子编码一种或多种交配孔蛋白用于转座子在宿主细胞之间的接合转移。
在一个实例中,本发明提供了包含拟杆菌属tetq基因的转座子。在一个实例中,转座子进一步包含拟杆菌属tetq-rtea-rteb操纵子。在一个实例中,第一或第二细菌为拟杆菌属。在一个实例中,转座子为编码一种或多种用于转座子在宿主细胞之间接合转移的交配孔蛋白的拟杆菌属ctndot转座子,并且包含一种或多种本发明的阵列或工程改造的序列,orit、intdot序列和tetq-rtea-rteb操纵子,和任选地用于或与四环素组合施用或被施用本文提及的所述人或非人动物。大多数拟杆菌属ctns的转移通过四环素刺激。转座子对宿主细胞内的整合酶为可操作的或者对转座子的相同或不同载体上携带的外源性整合酶为可操作的。在一个实施方案中,载体为包含转座子和编码同源整合酶的核苷酸序列的噬菌体(例如包装的噬菌体)。噬菌体能够感染用于转座子复制和切除的宿主细菌细胞,例如用于在混合细菌群体(例如肠道微生物群群体)中接合转移至邻近的宿主细胞。
在一个实施方案中,转座子由携带一种或多种宿主细胞之间转座子转移必需的基因序列的载体包含,其中所述基因序列在载体核酸上转座子的外部。例如,载体为能够感染宿主细胞(例如拟杆菌属宿主细胞)的包装的噬菌体,其中噬菌体核酸包含所述转座子,其包含本发明的阵列和转座子的上游或下游的对转座子的接合转移可操作的一种或多种基因(例如编码用于转座子接合转移的释放酶、偶联蛋白和/或交配桥蛋白一种或多种基因;和/或mob和tra操纵子中的一种或两者),其中一种、多种或所有这些基因不由转座子包含。在一个实例中,这些基因为用于从第一宿主细胞内的染色体dna切除转座子的基因。因此,转座子能够在该细胞内部运动并携带其对于随后接合转移进入第二宿主细胞必需的基因。通过以这种方式在转座子外部的载体上提供一些转座子基因,这在转座子中释放出空间用于包括本发明的工程改造的序列或阵列dna,使得这可被运动的转座子容纳和携带。本发明提供了包含一种或多种这样的转座子的这样的载体,其用于本发明的方法、用途或系统或者通常用于引入细菌细胞中(在这种情况下不是靶向噬菌体序列,包含在转座子中的阵列能够靶向细菌靶标序列以修饰序列,例如将其使用携带转座子的细胞内的cas切割)。
ctndot切除和整合的分子机制更密切类似于细菌噬菌体的分子机制而不是转位。ctndot整合酶和切割蛋白自身与细菌噬菌体的那些相当类似。因此,在一个实施方案中,一种或多种本发明的转座子的整合酶和/或切割蛋白的功能分别由噬菌体整合酶和/或切割蛋白提供,并且转座子不包含其功能由噬菌体蛋白提供的编码这样的整合酶或切割蛋白的相应基因。
在一个实例中,转座子包含rtec和操纵子xis2c-xis2d-orf3-exc。任选地,所述载体另外包含转座子外部的mob和tra操纵子(例如在载体核酸中转座子的上游或下游)。因此,这在转座子中释放出空间用于提供本发明的crispr阵列序列或工程改造的序列。
许多接合转座子能够运动其他元件。例如,许多共驻留质粒由接合转座子以反式迁移。这发生在含有orit的质粒利用ctn提供的交配孔蛋白用于转移至受体细胞时。拟杆菌属ctns也显示当呈顺式时运动元件,对ctns不典型的特征。例如,如果ctndot从染色体切除并整合在质粒上,其可以提供交配孔(orit)和动员(释放酶/偶联)蛋白,允许其通过“以顺式”起作用来转移整个质粒。这种使用反式和顺式运动机制两者的能力是不常见的,并且提示拟杆菌属ctns具有更大容量来运动其他元件。
在一个实例中,本发明的载体为包含一种或多种本发明的工程改造的序列或阵列和与宿主细胞物种的编码交配孔蛋白的ctndot转座子同源的orit的质粒,由此所述质粒在包含所述ctndot转座子的宿主细胞内可动。因此,所述质粒能够在宿主细胞之间水平转移,由此使本发明的阵列在这样的宿主细胞(例如拟杆菌属细胞)的群体中传播。在一个实例中,本发明提供了包含载体细菌的群体的组合物,其中所述载体细菌与这样的本发明的质粒载体相容,由此所述载体能够在混合载体与受体细菌时水平转移至包含同源ctndot转座子的受体宿主细菌细胞(例如拟杆菌属或厚壁菌门,例如链球菌属细胞)。在一个实例中,载体细菌由用于人或非人动物食用的饮料(例如益生菌饮料,诸如本文描述饮料)或食品包含,由此载体细菌可以与人或动物(例如在口腔或肠道)包含的受体细菌混合。ctndot样家族内的其他转座子包括ctnerl和ctn341,尽管这些元件与ctndot不同,并且因此替代ctndot转座子,本发明的一般方面的转座子可为ctnerl或ctn341转座子,当转座子由细菌或古细菌宿主细胞包含时,所述转座子携带一种或多种期望的crispr阵列或工程改造的序列用于靶向一种或多种细菌或噬菌体核苷酸靶标位点。
为了发生接合转座子的转移,发生3个主要步骤。第一步是从染色体切除以形成共价闭合环状中间物。第二,然后将单链拷贝通过交配孔转移至受体细胞,之后拷贝变成双链。第三,完整的双链ctn整合至受体的染色体中。接合转座子为复制的,因为ctn的拷贝保留在供体细胞内。因为该元件位于染色体内,它也垂直转移至后代细胞。这是重要的,因为当期望的crispr阵列或工程改造的序列(和任选地cas序列)存在于ctns上时,它们不仅易于在群体内转移,而且它们也很稳定地在世代间维持。这如例如用保留的抗生素抗性决定簇所见。进一步地,确信拟杆菌属可充当抗生素抗性决定簇的储库,其向拟杆菌属以外的其他生物体传播这些基因,甚至可能将这些元件转移至瞬时通过肠道的生物体。类似地,使用施用于人或非人动物的本发明的载体,可产生本发明的阵列或工程改造的序列的储库,例如用于治疗或预防肥胖症、糖尿病或ibd或者本文公开的任何其他疾病或病况。
在一个实例中,可通过使用一种或多种由转座子(例如ctndot)包含的阵列或序列开发期望的crispr阵列或工程改造的序列的储库,所述转座子能够被拟杆菌属细胞(例如人或非人动物的肠道或口腔中)包含,其中所述阵列/序列不靶向宿主拟杆菌属细胞的序列,但确实靶向由不同物种(例如厚壁菌门细胞或致病性细菌细胞,例如链球菌属、艰难梭菌、幽门螺杆菌、沙门氏菌属、李斯特氏菌属、耶尔森菌属、志贺氏菌属或弯曲杆菌属细胞)的肠道生物群细胞(例如细菌细胞)包含的核苷酸序列。因此,以这种方式,能够发生将本发明的阵列或序列转移至邻近的受体致病性或不期望的细菌,并且一旦在受体细胞内,本发明的阵列可操作,以将cas指导至宿主细胞内的相应靶标位点以修饰(例如切割)位点。在这种情况下,所述阵列/序列可包含在目标受体细胞中发现的重复序列,使得阵列/序列可与受体细胞内的内源性crispr/cas系统一起操作。这不需要在本发明的载体、工程改造的序列或转座子中包括cas和/或tracrrna编码序列,由此释放出空间和简化构造。增加空间可用于使得能够在受体细胞中包括更多的间隔区以靶向更多的靶标位点。在一个替代方案中,转座子阵列或序列包含ii型cas9编码序列和同源重复序列。例如,cas9(本文提及的任何cas9)为化脓性链球菌、嗜热链球菌或金黄色葡萄球菌cas9,并可任选地为切口酶或dcas9(“失活cas9”)。当拟杆菌属为专性厌氧菌(或强烈偏好厌氧环境)并且通常在肠道环境外为致病性时,使用拟杆菌属细胞作为本发明的载体或转座子的载体可能是不期望的,例如当施用于人或动物的肠道或口腔时。为了解决这个问题,本发明提供了携带本发明的载体、工程改造的序列或转座子的细菌载体的群体,其中所述载体细菌与这样的载体、序列或转座子相容,所述载体、序列或转座子由此能够在混合载体与受体细菌时水平转移至肠道微生物群中的受体宿主细菌细胞(例如拟杆菌属)。在一个实例中,所述载体细菌由用于人或非人动物食用的饮料(例如益生菌饮料,诸如本文描述的饮料)或食品包含,由此所述载体细菌可与人或动物包含的(例如在口腔或肠道)受体细菌混合。在一个实施方案中,所述载体、序列或转座子包含本发明的crispr阵列,其中所述阵列靶向由受体细胞包含的核苷酸序列以修饰靶序列,例如通过切割序列以使包含靶标序列的基因失活。在一个替代方案中,所述载体、序列或转座子能够水平转移(例如接合转座子转移)至细菌的第二受体群体,其对第一受体细菌属于不同的物种,其中核苷酸序列靶标位点由第二受体细菌包含但不由第一受体细菌包含,由此靶标位点由第二受体细菌(宿主细胞)中的cas修饰。
在一个实例中,第一受体细菌为拟杆菌属细菌且第二受体细菌为厚壁菌门或致病性细菌,例如肠道细菌。在一个实例中,载体细菌包含含有一种或多种接合转座子(例如ctndot转座子)的本发明的载体(例如噬菌体或质粒),其能够被载体细菌、第一细菌和第二细菌携带,例如其中转座子包含orit,且载体细菌、第一细菌和第二细菌与orit相容。
在一个替代方案中,所述载体细菌能够例如在人或非人动物体内,例如在肠道、口腔或全身(例如在血液中)将本发明的载体、工程改造的序列或转座子直接转移至厚壁菌门或致病性细菌。在一个实例中,致病性细菌为艰难梭菌、幽门螺杆菌、致病性大肠杆菌、沙门氏菌属、李斯特氏菌属、耶尔森菌属、志贺氏菌属、金黄色葡萄球菌、链球菌属或弯曲杆菌属细菌。
在一个实例中,载体细菌为选自以下的一个或多个物种的细菌:乳杆菌属物种(例如嗜酸乳杆菌(例如,la-5、la-14或ncfm)、短乳杆菌、保加利亚乳杆菌、植物乳杆菌、鼠李糖乳杆菌、发酵乳杆菌、高加索乳杆菌、瑞士乳杆菌、乳酸链杆菌、罗伊氏乳杆菌或干酪乳杆菌,例如干酪乳杆菌代田株)、双歧杆菌属物种(例如两歧双歧杆菌、短双歧杆菌、长双歧杆菌或婴儿双岐杆菌)、嗜热链球菌和屎肠球菌。例如,所述细菌为嗜酸乳杆菌细菌。
可动转座子(如可动质粒)不能自主转移,但可以在tcr辅助元件存在的情况下在细胞之间转移。最常讨论的这类拟杆菌属转座子包括tn4399、tn4555和非复制拟杆菌属单元。例如,可动转座子tn4555在可传播头孢西丁抗性的研究期间在普通拟杆菌的临床分离物中首次检测到。因此,在一个实施方案中,本发明的转座子为可动转座子(例如拟杆菌属可动转座子),例如包含一种或多种本发明的阵列或序列的tn4399或tn4555。转座子与tcr辅助元件组合。
在一个实例中,本发明的转座子为肠球菌属tn916或革兰氏阳性tn1546转座子。转座子(例如作为ctndot、tn4399或tn4555转座子)可以例如根据其末端重复区和/或转座酶或解离酶编码序列进行表征。在一个替代实例中,所述载体或转座子包含选自pmb1、pbr322、cole1、r6k(与pir基因组合)、p15a、psc101、f1和puc的复制起点。在一个实例中,转座子与转座子运动或转移所需的因子(例如抗生素,例如四环素)组合。在一个实例中,转座子包含抗生素抗性基因(例如四环素抗性基因)且转座子与所述抗生素组合(例如与所述抗生素同时或依次施用于人)。在一个实例中,转座子为与同源转座酶组合的piggybac、水手或睡美人转座子。在一个实例中,转座子为i类转座子。在一个实例中,转座子为ii类转座子。在一个实例中,转座子为tn家族转座子。
靶向细菌宿主中的抗生素抗性
抗生素抗性是一个世界性问题。新形式的抗生素抗性可以跨越国际边界轻松地在各大洲之间传播。许多形式的抗性以惊人的速度传播。世界卫生领导人已将抗生素抗性微生物描述为“噩梦细菌”,其对世界上每一个国家的人“造成灾难性的威胁”。每年在美国至少有200万人对一种或多种被设计治疗那些感染的抗生素产生抗性的细菌产生严重感染。每年至少有23000人直接死于这些抗生素抗性感染。更多的死于抗生素抗性感染并发症的其他病症。另外,每年有将近250000人需要住院治疗艰难梭菌(艰难梭菌)感染。在大多数这些感染中,抗生素的使用是导致这种疾病的一个主要影响因素。在美国每年至少14000人死于艰难梭菌感染。许多这些感染是可以预防的。抗生素抗性感染给已经不堪重负的美国和其他医疗保健体系带来了可观的和可以避免的费用。在大多数情况下,抗生素抗性感染需要长期和/或昂贵的治疗,延长住院时间,需要额外的去看医生和医疗保健用途,并且与用抗生素易于治疗的感染相比较导致更大的残疾和死亡。抗生素抗性对美国经济的总经济成本很难计算。估计数不尽相同,但在过度的直接医疗费用范围高达200亿美元,社会生产力损失的追加成本高达每年350亿美元(2008美元)。抗生素的使用是导致全世界抗生素抗性的最重要因素。抗生素是用于人类医学的最常用处方药物。然而,为人们提供的所有处方用抗生素中,多达50%是不需要的,或者没有规定的最佳效果。抗生素也常用于食用动物,以预防、控制和治疗疾病,以及促进食用动物的生长。使用抗生素促进生长是没有必要的,并且这种做法应逐步取消。最近美国食品与药品管理局(fda)的指导方针描述了实现这一目标的途径。很难直接比较用于食用动物的药物量和人类使用的数量,但有证据表明,在食品生产中使用了更多的抗生素。
抗生素抗性增长的另一个主要因素是细菌的耐药细菌株在人与人之间或自环境中的非人来源(包括食物)传播。有四个核心行动将有助于打击这些致命的感染:1.预防感染和防止耐药性的传播;2.跟踪耐药菌;3.提高今天的抗生素使用;和4.促进开发新型抗生素和开发耐药菌的新诊断测试。细菌将不可避免地找到抵御我们开发的抗生素的方法,这就是为什么现在需要采取积极行动来保持不要出现新的耐药性和防止已经存在的耐药性蔓延。
本发明提供了用于靶向抗生素抗性宿主和减少宿主对本发明组合物出现进一步抗性的可能性的改善手段。
使用本发明的宿主细胞和在这样的细胞靶向抗生素抗性的另外实例如下:-
1.任选地,宿主细胞为金黄色葡萄球菌细胞,例如对选自甲氧西林、万古霉素、利奈唑胺、达托霉素、喹奴普丁、达福普汀和替考拉宁的抗生素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
2.任选地,宿主细胞为铜绿假单胞菌细胞,例如对选自头孢菌素(例如头孢他啶)、碳青霉烯类(例如亚胺培南或美罗培南)、氟喹诺酮类、氨基糖苷类(例如庆大霉素或妥布霉素)和粘菌素的抗生素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
3.任选地,宿主细胞为克雷伯氏菌属(例如肺炎克雷伯氏菌)细胞,例如对碳青霉烯类抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
4.任选地,宿主细胞为链球菌属(例如嗜热链球菌、肺炎链球菌或化脓性链球菌)细胞,例如对选自红霉素、克林霉素、β-内酰胺类抗生素、大环内酯类、阿莫西林、阿奇霉素和青霉素的抗生素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
5.任选地,宿主细胞为沙门氏菌属(例如血清型伤寒沙门氏菌)细胞,例如对选自头孢曲松、阿奇霉素和环丙沙星的抗生素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
6.任选地,宿主细胞为志贺氏菌属细胞,例如对选自环丙沙星和阿奇霉素的抗生素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
7.任选地,宿主细胞为结核分枝杆菌细胞,例如对选自耐异烟肼(inh)、利福平(rmp)、氟喹诺酮类、阿米卡星、卡那霉素和卷曲霉素和阿奇霉素的抗生素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
8.任选地,宿主细胞为肠球菌属细胞,例如对万古霉素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
9.任选地,宿主细胞为肠杆菌科细胞,例如对选自头孢菌素类和碳青霉烯类的抗生素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
10.任选地,宿主细胞为大肠杆菌细胞,例如对选自甲氧苄啶、呋喃妥因、头孢氨苄和阿莫西林的抗生素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
11.任选地,宿主细胞为梭菌属(例如艰难梭菌)细胞,例如对选自氟喹诺酮类抗生素和碳青霉烯类的抗生素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
12.任选地,宿主细胞为淋病奈瑟氏菌细胞,例如对选自头孢克肟(例如一种口服头孢菌素)、头孢曲松(一种注射用头孢菌素)、阿奇霉素和四环素的抗生素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
13.任选地,宿主细胞为鲍曼不动杆菌细胞,例如对选自β-内酰胺类、美罗培南和碳青霉烯类的抗生素抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
14.任选地,宿主细胞为弯曲杆菌属细胞,例如对选自环丙沙星和阿奇霉素的抗生素产生抗性,并且宿主靶标位点(或者一个或多个靶标位点)由对所述抗生素赋予宿主抗性的基因包含。
15.任选地,宿主细胞产生β(β)-内酰胺酶。
16.任选地,宿主细胞为对实例1-14中任一项中记载的抗生素抗性的细菌宿主细胞。
在一个实施方案中,宿主细胞为usa300金黄色葡萄球菌菌株细胞。
在一个实例中,所述或每种宿主靶标序列由宿主细胞的质粒,例如金黄色葡萄球菌质粒(例如usa300菌株的质粒)包含,例如,靶标由金黄色葡萄球菌细胞的pusa01、pusa02或pusa03质粒包含。在一个实例中,第一和/或第二靶标由宿主meca、meca2或sek基因序列(例如金黄色葡萄球菌菌株细胞的)包含。在一个实例中,第一和/或第二靶标由宿主致病岛核苷酸(例如dna)序列包含。在实例中,本发明的间隔区包含在wo2014/124226的第26页上表1中公开的间隔区或由其组成,所述间隔区序列通过引用并入本文。在一个实例中,工程改造的序列、hm-crrna或grna包含这样的间隔区。
本发明的组合物、用途、方法系统、载体、集合、阵列、工程改造的序列、病毒、噬菌体、噬菌粒、前噬菌体或病毒粒子,其在小鼠皮肤定殖测定(例如在wo2014/124226,kugelberge,等人.establishmentofasuperficialskininfectionmodelinmicebyusingstaphylococcusaureusandstreptococcuspyogenes.antimicrobagentschemother.2005;49:3435–3441或pastagiam,等人anovelchimericlysinshowssuperioritytomupirocinforskindecolonizationofmethicillin-resistantand-sensitivestaphylococcusaureusstrains.antimicrobagentschemother.2011;55:738–744中所公开)中有效减少或杀死或抑制抗生素抗性细菌宿主生长,其中第一和/或第二靶标由对所述抗生素赋予抗性的宿主基因包含,例如其中宿主为金黄色葡萄球菌(例如usa300菌株)宿主。
提及化脓性链球菌序列可在genbank登录号nc_002737下得到,其在位置854757-858863具有cas9基因。化脓性链球菌cas9氨基酸序列可在编号np_269215下得到。这些序列对于本发明中的用途通过引用并入本文。如20150079680中公开的另外的序列,无论是明确地还是通过引用并入本文,也对于本发明中的用途通过引用并入本文。也参考wo2013/176772中的序列和方法的公开内容,其通过引用并入本文。实例tracrrna序列为在wo2014/124226的第15页公开的那些序列,其对于本发明中的用途通过引用并入本文。
在一个实例中,所述或每种重复区包含长度为20-50(例如24-47,例如30、29、28、27、26、25或24)个连续核苷酸或由其组成。
在一个实例中,所述或每种间隔区包含长度为18-50(例如24-47,或者24-40,例如30、29、28、27、26、25、24、23、22、21、20、19、18),例如19或20个连续核苷酸或由其组成。
在一个实例中,第一重复区(在本发明的hm-阵列中的最5’)紧邻与包含第一宿主靶标的序列互补的间隔区序列的5’。鉴于新获得的间隔区(例如入侵噬菌体序列的)通常在细菌中的该位置并入的观察,这是有用的,并且因此本发明的第一间隔区的定位以这种方式可用于促进其用途。
在一个实例中,所述病毒(例如噬菌体)核酸包含复制起点(ori)和包装位点。在一个实例中,病毒的核酸也包含一种、多种或所有编码必需衣壳蛋白的基因,例如rina、ters和terl基因。在一个实例中,一种、多种或所有这些由用于与本发明的病毒共同感染的伴侣辅助病毒(例如辅助噬菌体)替换包含,这在后者中释放出空间,用于包括更多hm-阵列核酸和/或更多在宿主内可操作的cas编码核酸。在一个实例中,所述病毒核酸包含野生型噬菌体基因组的片段,其中所述片段由至少包含rina、ters和terl基因的基因组的连续核苷酸或编码噬菌体蛋白的同义基因组成。
在一个实例中,宿主细胞属于人类微生物群中发现的菌株或物种。
在一个实例中,所述或每种靶标位点由介导宿主致病性粘附、定殖、入侵、免疫反应抑制、致病、必需蛋白或功能表达或毒素产生的基因包含。在一个实例中,所述基因为编码细胞毒素、α-溶血素、β-溶血素、γ-溶血素、杀白细胞素、致死毒素pv杀白细胞素(panton-valentinelekocidin)(pvl)、外毒素、tsst-1、肠毒素、sea、seb、secn、sed、see、seg、she、sei、表皮剥脱毒素、eta或etb的基因,任选地其中宿主为金黄色葡萄球菌,例如mrsa。
在一个实例中,所述或每种crispr阵列为本文公开的配置、实施方案、实例、概念、方面、段落或条款中任一项的阵列。在一个实例中,所述或每种工程改造的核苷酸序列为本文公开的配置、实施方案、实例、概念、方面、段落或条款中任一项的工程改造的核苷酸序列。
在一个实例中,所述或每种载体为本文公开的配置、实施方案、实施例、概念、方面、段落或条款中任一项的载体。
在本文公开的配置、实施方案、实例、方面、段落或条款中任何一项的一个实例中,载体或mge为或包含casposon。mge在下文进一步描述。在一个实例中,casposon为家族1、2或3casposon。在一个实例中,本发明的mge包含casposon末端反向重复区且任选地包含casposoncas1编码序列。在一个实例中,本发明的mge为或包含缺少cas1的casposon并且对宿主细胞的cas1运动是可操作的。对于casposons的详情,参见bmcbiol.2014may19;12:36.doi:10.1186/1741-7007-12-36,"casposons:anewsuperfamilyofself-synthesizingdnatransposonsattheoriginofprokaryoticcrispr-casimmunity",krupovicm等人。
本发明的另外的实例应用
在一个实例中,所述组合物(例如,hm-组合物或工程改造的序列与抗生素组合)为以下中的任何一种:在一个实例中,所述组合物为医学、眼科、牙科或药用组合物(例如由抗宿主疫苗包含)。在一个实例中,所述组合物为抗微生物组合物,例如抗生素或抗病毒物质,例如药物、消毒剂或漱口水。在一个实例中,所述组合物为化妆品组合物(例如面部或身体化妆组合物)。在一个实例中,所述组合物为除草剂。在一个实例中,所述组合物为杀虫剂(例如当宿主为芽孢杆菌属(例如苏云金芽孢杆菌)宿主时)。在一个实例中,所述组合物为饮料(例如啤酒、葡萄酒或酒精饮料)添加剂。在一个实例中,所述组合物为食品添加剂(例如其中宿主为大肠杆菌、沙门氏菌属、李斯特氏菌属或梭菌属(例如肉毒梭菌)宿主)。在一个实例中,所述组合物为水添加剂。在一个实例中,所述组合物为用于水生动物环境(例如鱼缸中)的添加剂。在一个实例中,所述组合物为石油或石化工业组合物或者包含在这种组合物中(例如当宿主为硫酸盐还原菌,例如脱硫弧菌属宿主时)。在一个实例中,所述组合物为石油或石油化工添加剂。在一个实例中,所述组合物为化学添加剂。在一个实例中,所述组合物为消毒剂(例如供人类或动物使用的消毒设备,例如用于手术或医疗用途,或者用于婴儿喂养)。在一个实例中,所述组合物为用于人类或动物使用的个人卫生组合物。在一个实例中,所述组合物为用于环境用途,例如用于土壤处理或环境净化(例如自污水,或自石油、石化产品或化学品,例如当宿主为硫酸盐还原菌,例如脱硫弧菌属宿主时)的组合物。在一个实例中,所述组合物为植物生长促进剂。在一个实例中,所述组合物为用于石油、石化产品、金属或矿物提取的组合物。在一个实例中,所述组合物为织物处理或添加剂。在一个实例中,所述组合物为兽皮、皮革或仿麂皮处理或添加剂。在一个实例中,所述组合物为染料添加剂。在一个实例中,所述组合物为饮料(例如啤酒或葡萄酒)酿造或发酵添加剂(例如当宿主为乳酸杆菌属宿主)。在一个实例中,所述组合物为纸张添加剂。在一个实例中,所述组合物为油墨添加剂。在一个实例中,所述组合物为胶添加剂。在一个实例中,所述组合物为抗人类、动物或植物寄生虫的组合物。在一个实例中,所述组合物为空气添加剂(例如用于空气调节设备中的空气或由空气调节设备产生的空气,例如其中宿主为军团菌属宿主)。在一个实例中,所述组合物为防冻添加剂(例如其中宿主为军团菌属宿主)。在一个实例中,所述组合物为洗眼液或眼科组合物(例如隐形眼镜液)。在一个实例中,组合物由乳制品包含(例如组合物在或为牛奶或奶制品;例如其中宿主为乳酸杆菌属、链球菌属、乳球菌属或李斯特氏菌属宿主)。在一个实例中,所述组合物为或由家用或工业清洁产品包含(例如其中宿主为大肠杆菌、沙门氏菌属、李斯特氏菌属或梭菌属(例如肉毒梭菌)宿主)。在一个实例中,所述组合物由燃料包含。在一个实例中,所述组合物由溶剂(例如水除外)包含。在一个实例中,所述组合物为烘焙添加剂(例如食品烘焙添加剂)。在一个实例中,所述组合物为实验室试剂(例如用于生物技术或者重组dna或rna技术)。在一个实例中,组合物由纤维沤麻剂包含。在一个实例中,组合物用于维生素合成工艺。在一个实例中,所述组合物为抗作物或植物的破坏成分(例如当宿主为腐生菌)。在一个实例中,所述组合物为防腐化合物,例如用于防止或减少金属腐蚀(例如当宿主为硫酸盐还原菌,例如脱硫弧菌属宿主,例如用于减少或防止石油提取、处理或保存设备;金属提取、处理或保存设备;或者矿物提取、处理或保存设备的腐蚀时)。在一个实例中,所述组合物为农业或耕作组合物或者包含在这种组合物中。在一个实例中,所述组合物为青贮饲料添加剂。本发明提供了本文描述用于在该段落中描述的任何一种组合物中,或者用于在该段落中描述的任何一项用途中的hm-crispr阵列、hm-crispr/cas系统、hm-crrna、hm-间隔区、hm-dna、hm-cas、hm-组合物或grna,例如其中宿主细胞为微生物细胞、细菌或古细菌细胞。本发明提供了用于在该段落中描述的任何一项应用的方法,其中所述方法包括组合本发明的hm-crispr阵列、hm-crispr/cas系统、hm-crrna、hm-间隔区、hm-dna、hm-cas、grna或hm-组合物与宿主细胞(例如微生物、细菌或古细菌细胞)。在一个实施方案中,宿主细胞不存在于人类(或人类胚胎)或动物体内或上。
本发明的任一方面用于工业或家庭用途,或者用于这样用途的方法中。例如,其用于农业、石油或石化工业、食品或饮料行业、服装行业、包装行业、电子行业、计算机行业、环境行业、化学工业、航空航天工业、汽车行业、生物技术行业、医疗行业、健康行业、牙科产业、能源产业、消费品产业、医药工业、采矿业、清洗业、林业、渔业、休闲业、回收业、化妆品业、塑胶工业、纸浆或造纸工业、纺织业、服装行业、皮革或仿麂皮或兽皮行业、烟草行业或钢铁行业,或用在其中。
在本文中,其中有提及脱硫弧菌属宿主,所述宿主可以被脱硫叶菌属、脱硫杆菌属、脱硫杆菌属、脱硫球菌属、脱硫念珠菌属、脱硫丝菌属、desulfobotulus或脱硫八叠球菌属宿主或本文公开的任何其他硫还原细菌替代。在用于油、水、污水或环境应用的一个实施方案中,宿主为desulfovibriocapillatus宿主。
广泛的微生物分析和16srrna序列测定已表明,属脱硫弧菌属只是约8个不同组的可从环境分离的硫酸盐还原细菌之一。这些组中的7组为革兰氏阴性的,而1组代表革兰氏阳性细菌(脱硫肠状菌属)。属脱硫弧菌属具有相当小的基因组。对普通脱硫弧菌和巨大脱硫弧菌(其可能是根据本发明的宿主)的基因组的初步估计值分别为1.7mbp和1.6mbp。这有助于鉴定用于本发明中的期望的靶标序列(例如在必需或抗性基因中的序列)。脱硫脱硫弧菌(其可能为根据本发明的宿主)g200的内源质粒的表征已允许构建穿梭载体(wall1993,所述载体可用作本发明的载体),并且来自普通脱硫弧菌hildenborough(其可能为根据本发明的宿主)的两种细菌噬菌体的分离和表征(seyedirashti,1992)可提供有效遗传操纵脱硫弧菌属物种的其他途径。在一个实例中,所述载体为mu或mu样细菌噬菌体。
一种实例宿主为普通脱硫弧菌亚种vulgarispostgate和campbell(atcc®29579™)菌株名称:ncib8303[dsm644,hildenborough]。
用丝裂霉素c或uv处理细菌先前已用于从细菌诱导噬菌体(driggers&schmidt),并且这是一种用于获得合适的宿主-匹配的噬菌体用于产生用于本发明的任一实例或方面的载体的合适方法。
本发明应用于乳品工业(例如奶酪或黄油或奶制品制造)或发酵(例如葡萄酒或醋或酱油)或啤酒酿造或面包制作工业中。例如,对于乳品工业应用,本发明的方法为一种用于生产乳制品的方法,所述方法包括使乳酸产生细菌(例如乳杆菌属宿主细胞)的培养基发酵一段时间,以从培养物产生乳酸,并且之后通过从与细菌混合的一种或多种本发明的阵列、系统、载体、群体或集合引起crrna表达来抑制细菌生长,由此减少或抑制细菌产生乳酸。这可用于减少食物/饮料破坏或者不期望的食物/饮料味道和/或气味。在一个实例中,在细菌中包括诱导型hm-阵列,其中所述方法包括在第一时间段之后加入诱导剂。
参考文献
wall,j.d.,b.j.rapp-giles,和m.rousset.1993."characterizationofasmallplasmidfromdesulfovibriodesulfuricansanditsuseforshuttlevectorconstruction".j.bacteriol.175:4121–4128;
seyedirashtis等人;jgenmicrobiol.1992jul;138(7):1393-7,"molecularcharacterizationoftwobacteriophagesisolatedfromdesulfovibriovulgarisncimb8303(hildenborough)";
driggers&schmidt,j.gen.virol.(i97o),6,421-427,"inductionofdefectiveandtemperatebacteriophagesincaulobacter"。
概念:改变细菌的混合群体中(例如在微生物群中)第一和第二细菌亚群的相对比例
1.宿主修饰(hm)crispr/cas系统用于改变细菌的混合群体中的第一和第二细菌的亚群的相对比例的用途,所述第二细菌包含宿主细胞,
对于每种宿主细胞,所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)宿主细胞靶标序列和包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列,所述hm-crrna包含与宿主细胞靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的宿主crispr/cas系统;且
其中所述靶标序列被cas修饰,由此杀死宿主细胞或减少宿主细胞生长。
2.用于概念1的用途的宿主修饰(hm)crispr/cas系统,其用于修饰细菌宿主细胞的靶标核苷酸序列,所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)宿主细胞靶标序列和包含间隔区序列(hm-间隔区)和编码hm-crrna的重复区的工程改造的宿主修饰(hm)crispr阵列,所述hm-crrna包含能够与宿主靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或用于表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种可以转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的宿主crispr/cas系统。
3.概念2的系统,其中所述一种或多种载体缺乏cas(例如,cas9)核酸酶编码序列。
4.任一前述概念的用途或系统,其中每种宿主细胞是人微生物群中发现的菌株或物种的。
5.概念1或4的用途,其用于(a)改变混合细菌群体中的拟杆菌细菌的比例;(b)减少混合细菌群体中的厚壁菌门亚群(宿主细胞)的比例;(c)减少混合群体中的第一厚壁菌门物种(宿主细胞)的比例,其中所述混合群体包含其生长不被所述crna抑制的第二厚壁菌门物种;(d)减少混合细菌群体中的第一革兰氏阳性细菌物种(宿主细胞)的比例,其中所述混合群体包含其生长不被所述crna抑制的第二革兰氏阳性细菌物种;(e)减少混合细菌群体中的细菌物种(宿主细胞)的比例,其中所述混合群体包含其生长不被所述crna抑制的不同的细菌物种,其中所述第一物种具有编码16s核糖体rna的dna序列,其与其他物种的编码16s核糖体rna的dna序列具有至少80、82、83、84、85、90或95%同一性;(f)减少混合细菌群体中的第一细菌人肠道微生物群物种(宿主细胞,例如厚壁菌门)的比例,其中所述混合群体包含不同的细菌物种,其中所述不同的物种是其生长不被所述crna抑制的人肠道益生菌物种;或(g)减少混合细菌群体中的细菌人肠道微生物群物种((宿主细胞,例如厚壁菌门)的比例,其中所述混合群体包含不同的细菌物种,其中所述不同的物种是其生长不被所述crna抑制的人肠道共生物种。
6.概念2或3的系统,其用于(a)改变混合细菌群体中的拟杆菌细菌的比例;(b)减少混合细菌群体中的厚壁菌门亚群(宿主细胞)的比例;(c)减少混合群体中的第一厚壁菌门物种(宿主细胞)的比例,其中所述混合群体包含其生长不被所述crna抑制的第二厚壁菌门物种;(d)减少混合细菌群体中的第一革兰氏阳性细菌物种(宿主细胞)的比例,其中所述混合群体包含其生长不被所述crna抑制的第二革兰氏阳性细菌物种;(e)减少混合细菌群体中的细菌物种(宿主细胞)的比例,其中所述混合群体包含其生长不被所述crna抑制的不同的细菌物种,其中所述第一物种具有编码16s核糖体rna的dna序列,其与其他物种的编码16s核糖体rna的dna序列具有至少80、82、83、84、85、90或95%同一性;(f)减少混合细菌群体中的第一细菌人肠道微生物群物种(宿主细胞,例如厚壁菌门)的比例,其中所述混合群体包含不同的细菌物种,其中所述不同的物种是其生长不被所述crna抑制的人肠道益生菌物种;或(g)减少混合细菌群体中的细菌人肠道微生物群物种(宿主细胞,例如厚壁菌门)的比例,其中所述混合群体包含不同的细菌物种,其中所述不同的物种是其生长不被所述crna抑制的人肠道共生物种;其中(a)-(g)用于在人或动物受试者中治疗或预防(i)由其比例降低的所述细菌物种引起的微生物群感染;或(ii)由其比例降低的所述细菌物种介导的疾病或病况。
7.概念5或6的用途或系统,其用于增加拟杆菌相比于厚壁菌门的相对比例。
8.任一前述概念的用途或系统,其中所述cas核酸酶由所述细胞的内源ii型crispr/cas系统提供。
9.任一前述概念的用途或系统,其中组分(i)对所述宿主细胞是内源的。
10.任一前述概念的用途或系统,其中所述靶标序列由宿主细胞的抗生素抗性基因、毒力基因或必需基因包含。
11.任一前述概念的用途或系统,其中所述靶标序列是宿主染色体序列。
12.任一前述概念的用途或系统,其中可替代地hm-crrna和tracrrna由单一指导rna(grna)包含,例如由载体提供。
13.任一前述概念的用途或系统,所述宿主细胞包含具有编码目标hm-序列的游离端(hm-dna)的脱氧核糖核酸链和/或其中所述系统包含编码hm-dna的序列,其中所述hm-dna包含分别与用于将hm-dna插入宿主基因组(例如插入染色体或附加体位点)的靶标序列中或其侧翼的一个或多个序列同源的一个或多个序列。
14.用于概念1的用途的工程改造的核酸载体,其用于修饰包含内源性crispr/cas系统的细菌宿主细胞,所述载体
(a)包含用于根据任一前述概念的crispr/cas系统或用途中的表达多种不同crrna(例如,由grna包含)的核酸序列;和
(b)任选地缺乏编码cas核酸酶的核酸序列,
其中第一所述crrna能够与所述宿主细胞内的第一核酸序列杂交;且第二所述crrna能够与所述宿主细胞内的第二核酸序列杂交,其中所述第二序列不同于所述第一序列;且
(c)第一序列由抗生素抗性基因(或其rna)包含且第二序列由抗生素抗性基因(或其rna)包含;任选地其中所述基因是不同的;
(d)第一序列由抗生素抗性基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含;
(e)第一序列由必需基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含;或
(f)第一序列由毒力基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含。
15.包含一种或多种cas的宿主细胞内的概念14的载体,所述cas可与由载体编码的crna(例如,单一指导rna)一起操作。
16.任一前述概念的用途、系统或载体,其中所述hm-crispr阵列包含多个拷贝的相同间隔区。
17.任一前述概念的用途、系统或载体,其中所述载体包含多个hm-crispr阵列。
18.任一前述概念的用途、系统或载体,其中每种载体是病毒或噬菌体。
19.任一前述概念的用途、系统或载体,其中所述系统或载体包含两个、三个或更多个拷贝的编码crrna(例如,grna)的核酸序列,其中所述拷贝包含用于靶向宿主细胞序列(例如,毒力、抗性或必需基因)的相同间隔区序列。
20.概念19的用途、系统或载体,其中所述拷贝在两个或更多个载体crispr阵列之间分割(split)。
21.包含任一前述概念中记载的系统或载体的细菌宿主细胞。
22.任一前述概念的用途、系统、载体或细胞,其中所述阵列与抗生素剂组合;或所述用途包括将所述宿主细胞暴露于第一抗生素,其中所述靶标序列由对所述第一抗生素的抗性的抗生素抗性基因包含。
23.任一前述概念的用途、系统、载体或细胞,其中所述宿主细胞是葡萄球菌属、链球菌属、假单胞菌属、沙门氏菌属、李斯特氏菌属、大肠杆菌、脱硫弧菌属或梭菌属宿主细胞。
24.概念1-13或16-23中任一项的用途、系统或细胞,其中每种载体根据概念14或15。
25.任一前述概念的用途、系统、载体或细胞,其中与未用所述hm-阵列或编码所述grna的核苷酸序列转化的所述宿主细胞的群体的生长相比,宿主细胞群体生长减少至少5倍。
26.任一前述概念的用途、系统、载体或细胞,其中表面上的宿主细胞群体生长受到抑制。在一个实例中,所述群体与人组织表面(例如肠道组织表面,例如体内或离体)接触。
27.任一前述概念的用途、系统、载体或细胞,其中其第一细菌与人(例如在人肠道中)为益生、共栖或共生的。
28.任一前述概念的用途、系统、载体或细胞,其中所述第一和第二细菌均为厚壁菌门,并且为不同物种或菌株的细菌;或者其中所述第一细菌为肠杆菌科且所述第二细菌为厚壁菌门。
29.任一前述概念的用途、系统、载体或细胞,其中所述宿主细胞为古细菌细胞而不是细菌细胞,或者每种群体为古细菌群体而不是细菌群体。
30.概念1、4、5、7-13、16-20和22-29中任一项的用途,其用于处理工业或离体医疗流体、表面、设备或容器;或用于处理水道、水、饮料、食品或化妆品,其中所述宿主细胞由流体、表面、设备、容器、水道、水、饮料、食品或化妆品包含或在流体、表面、设备、容器、水道、水、饮料、食品或化妆品上。
31.任一前述概念的用途、系统、载体或细胞,其中所述hm-crna或grna包含能够与宿主细胞靶标前间隔区序列(其邻近于nnagaaw或nggng前间隔区序列邻近基序(pam))杂交的序列。
32.根据任一前述概念的用途、系统或细胞或用于任一前述概念的用途、系统或细胞中的核酸载体,所述载体包含多于1.4kb的外源性dna序列,其中外源性dna编码crispr/cas系统的一种或多种组分,并且包含用于在宿主细胞中表达hm-crrna或grna的工程改造的阵列,其中外源性序列没有与crna(s)或grna(s)同源的编码cas核酸酶的核苷酸序列;其中至少2种不同的crna或grna由外源性dna(例如由至少2种hm-crispr阵列)编码。
33.概念32的载体,其中所述载体为能够转化宿主细胞的病毒载体。
34.概念32或33的载体,其中crna或grna能够在宿主细胞内与相应的靶标前间隔区序列杂交,其中每种前间隔区序列由抗生素抗性或必需宿主基因包含。
35.概念32-34中任一项的载体,其中宿主细胞为人微生物群物种的细胞。
实施方案:利用野生型内源性cas用于群体生长抑制和表面上的细菌的处理
1.细菌宿主细胞群体的野生型内源性cas核酸酶活性抑制群体生长的用途,其中所述群体包含多种宿主细胞并且每种宿主细胞包含具有野生型cas核酸酶活性的内源性crispr/cas系统,所述用途包括转化所述群体的宿主细胞,其中每种转化的宿主细胞用工程改造的核苷酸序列转化,用于提供宿主细胞内的宿主修饰(hm)crna或指导rna(grna),所述hm-crna或grna包含能够与宿主细胞靶标前间隔区序列杂交,用于将内源性cas指导至靶标的序列,其中所述crna或grna与具有所述野生型核酸酶活性的宿主细胞的内源性cas核酸酶同源,并且之后所述群体的宿主细胞生长的所述转化被抑制。
宿主细胞可属于相同的物种或菌株。
2.实施方案1的用途,其中与未用所述工程改造的核苷酸序列转化的所述宿主细胞的群体生长相比,宿主细胞群体生长的抑制为生长减少至少5倍。
3.实施方案1的用途,其中表面上的群体生长被抑制。
4.实施方案2的用途,其中表面上的群体生长被抑制。
5.实施方案1的用途,所述抑制包括使用hm-crispr/cas系统用于杀死或减少所述宿主细胞的生长,对于每种宿主细胞,所述系统包含根据(i)-(iv)的组分:
(i)至少一种编码所述cas核酸酶的核酸序列;
(ii)包含间隔区序列(hm-间隔区)和编码所述hm-crrna的重复区的工程改造宿主修饰(hm)crispr阵列;
(iii)任选的tracrrna序列或表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将所述cas指导至靶标以修饰靶标序列;
其中所述靶标序列在宿主细胞内被cas修饰,由此杀死宿主细胞或减少宿主细胞生长。
6.任一前述实施方案用于改变细菌混合群体中的第一和第二细菌亚群的相对比例的用途,所述第二细菌包含所述宿主细胞。
7.实施方案6的用途,其中所述宿主细胞属于人类微生物群中发现的菌株或物种。
8.实施方案6或7的用途,其中所述宿主细胞与不同菌株或物种的细胞混合,其中不同细胞为肠杆菌科或者与人类益生、共栖或共生的细菌(例如在人肠道中)。
9.任一前述实施方案用于改变包含拟杆菌门细菌和其他细菌的混合细菌群体中拟杆菌门细菌的比例的用途,任选地用于增加群体中拟杆菌门相比于一种、多种或所有厚壁菌门物种(例如相比于链球菌属)的相对比例。
10.任一前述实施方案用于改变混合群体中的第一细菌相比于第二细菌的相对比例的用途,其中第一和第二细菌两者为厚壁菌门,并且为不同物种或菌株的细菌,所述第二细菌包含宿主细胞。在一个实例中,所述用途增加第一相对于第二细菌的比例。
11.实施方案1的用途,其中工程改造的核苷酸序列不与外源性cas核酸酶编码序列组合。
12.实施方案5的用途,其中一种或多种载体缺乏cas核酸酶编码序列。
13.实施方案1的用途,其中每种宿主细胞属于在人微生物群中发现的菌株或物种。
14.实施方案6的用途,其中每种宿主细胞属于在人微生物群中发现的菌株或物种。
15.实施方案13的用途,其中每种宿主细胞与不同菌株或物种的细胞混合,其中不同细胞为肠杆菌科或者与人类益生、共栖或共生的细菌(例如在人肠道中)。
16.实施方案1的用途,其中所述用途改变拟杆菌门细菌在包含拟杆菌门细菌和其他细菌的混合细菌群体中的比例,任选地其中所述用途改变拟杆菌门相比于一种、两种或所有厚壁菌门(例如链球菌属)物种在所述群体中的相对比例。
17.实施方案1的用途,其中第一和第二细菌两者为厚壁菌门且所述用途改变第一相比于第二细菌在混合群体中的相对比例。在一个实例中,所述用途增加第一相比于第二细菌的比例。
18.实施方案1的用途,其中所述cas核酸酶由宿主细胞内源性ii型crispr/cas系统提供和/或hm-crna或grna包含能够与邻近于5’-nnagaaw-3’前间隔区序列邻近基序(pam)的宿主细胞靶标前间隔区序列杂交的序列。
19.实施方案5的用途,其中所述cas核酸酶由宿主细胞内源性ii型crispr/cas系统提供。
20.实施方案5的用途,其中组分(iii)对宿主细胞为内源性的。
21.实施方案5的用途,其中每种转化的宿主细胞包含在细胞内产生所述hm-crrna中可与组分(ii)一起操作的内源性核糖核酸酶iii。
22.实施方案1的用途,其中靶标序列由宿主细胞的抗生素抗性基因、毒力基因或必需基因包含。
23.实施方案1的用途,其中所述工程改造的核苷酸序列与抗生素组合。
24.实施方案5的用途,其中hm-crrna和tracrrna由单一指导rna(grna)包含。
25.实施方案1的用途,其中转化的宿主细胞各自包含具有编码目标hm-序列的游离端(hm-dna)的脱氧核糖核酸链,其中所述hm-dna包含分别与用于将hm-dna插入宿主基因组的靶标序列中或其侧翼的一个或多个序列同源的一个或多个序列,其中hm-dna序列被插入宿主细胞基因组中。
26.实施方案1的用途,其包括在宿主细胞内表达多种不同的crrna(或grna)用于与宿主细胞前间隔区靶标序列杂交,其中第一所述crrna(或grna)能够与第一前间隔区核酸序列杂交;且第二所述crrna(或grna)能够与第二前间隔区核酸序列杂交,其中所述第二序列不同于所述第一序列;和
(a)第一序列由抗生素抗性基因(或其rna)包含且第二序列由抗生素抗性基因(或其rna)包含;任选地其中所述基因为不同的;
(b)第一序列由抗生素抗性基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含;
(c)第一序列由必需基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含;或者
(d)第一序列由毒力基因(或其rna)包含且第二序列由必需或毒力基因(或其rna)包含。
27.实施方案6的用途,其中所述宿主细胞由人或动物受试者包含的混合细菌群体包含,且所述用途(i)在受试者中治疗由混合群体包含的所述宿主细胞的感染;(ii)在受试者中治疗或减少由所述宿主细胞介导的病况或疾病的风险;(iii)减少由所述宿主细胞引起或介导的人的体味;或者(iv)为人类的个人卫生处理。
28.实施方案1的用途,其中所述用途在人或动物受试者中治疗或减少所述宿主细胞感染的风险,其中宿主细胞各自包含含有所述靶标前间隔区序列的抗生素抗性基因(对第一抗生素的抗性),其中所述用途包括向受试者施用工程改造的核苷酸序列和第一抗生素,其中在受试者中减少或预防感染。
29.实施方案1的用途,其中每种工程改造的核苷酸序列进一步包含抗生素抗性基因,其中hm-crrna或grna不靶向抗生素抗性基因且所述用途包括使群体暴露于所述抗生素和多种所述工程改造的序列,由此促进在宿主细胞内维持hm-crrna或grna编码序列。
30.实施方案1的用途,其中所述宿主细胞为革兰氏阳性细胞或链球菌属、葡萄球菌属、假单胞菌属、沙门氏菌属、李斯特氏菌属、大肠杆菌属、脱硫弧菌属、霍乱弧菌或梭菌属细胞。
31.实施方案1用于处理工业或医用流体、表面、装置或容器,或者用于处理水道、水、饮料、食品或化妆品的用途,其中所述宿主细胞由流体、表面、装置、容器、水道、水、饮料、食品或化妆品包含或在其上,且其中所述宿主细胞群体的生长被抑制,由此实施所述处理。
在一个替代方案中,任一实施方案从属于任一前述实施方案。
方面:在载体和混合群体中的宿主细胞之间的水平转移
1.用于产生包含载体细菌的混合细菌群体的方法,其中所述群体分别包含第一和第二细菌的第一和第二亚群,其中所述亚群为彼此不同并且第二细菌包含多种宿主细胞的第一和第二物种的细菌,其中所述载体细菌为第一细菌细胞,各自包含工程改造的核苷酸序列,用于提供宿主细胞内的宿主细胞修饰(hm)crna或指导rna(grna),所述hm-crna或grna包含能够与宿主细胞靶标前间隔区序列杂交,用于将第一cas核酸酶指导至靶标以修饰靶标的序列,其中所述载体细菌不包含靶标序列,所述方法包括:
a.提供多种核酸,各自包含所述工程改造的核苷酸序列;
b.使所述多种核酸与分别包含第一和第二细菌物种的第一和第二亚群的第一混合群体组合,所述第二亚群包含宿主细胞;
c.在宿主细胞存在的情况下使核酸转化所述第一亚群的细胞,由此产生包含所述载体细胞和所述宿主细胞的第二混合群体,其中由载体细胞包含的所述工程改造的核苷酸序列能够水平移动至宿主细胞,以转化宿主细胞用于在转化的宿主细胞内产生所述hm-crna或grna。
2.方面1的方法,其进一步包括获得第二混合群体。
3.方面1的方法,其进一步包括从第二混合群体分离多种载体细胞。
4.方面1的方法,其进一步包括在转化的宿主细胞内产生所述hm-crna或grna,其中所述hm-crna或grna序列与所述转化的宿主细胞内的靶标前间隔区序列杂交,并将第一cas核酸酶指导至靶标,由此用第一cas核酸酶修饰靶标。
5.方面4的方法,其进一步包括获得包含所述靶标修饰的宿主细胞(例如其中宿主细胞由包含所述第一细菌物种的混合群体包含)。
6.方面1的方法,其中所述crna或grna与宿主细胞的内源性cas核酸酶同源,其中所述核酸酶为所述第一cas核酸酶。
7.方面1的方法,其中所述crna或grna与载体细胞的内源性cas核酸酶同源,其中核酸酶为所述第一cas核酸酶。
8.方面7的方法,其中所述核酸酶具有野生型核酸酶活性。
9.方面1、6、7或8的方法,其中第一cas核酸酶为cas9。
10.方面9的方法,其中cas9为链球菌属cas9。
11.方面1的方法,其中每种工程改造的核苷酸序列由相应的核酸载体包含,其中所述载体能够在载体和宿主细胞之间水平转移。
12.方面1或11的方法,其中每种工程改造的序列由相应的可动遗传元件例如转座子或质粒包含。
13.方面1的方法,其中在宿主细胞的所述转化后,宿主细胞亚群的生长被抑制。
14.方面13的方法,其中与未用所述工程改造的核苷酸序列转化的所述宿主细胞的群体的生长相比,宿主细胞群体生长的抑制为至少5倍。
15.方面13或14的方法,其中表面上的宿主细胞群体生长被抑制。
在一个替代方案中,任一方面从属于任一前述方面。
在一个实例中,所述方法为在人、动物或植物受试者中治疗或预防疾病或病况的方法,例如如本文所述,其中所述方法实现所述治疗或预防。本发明提供了通过用于这样的治疗或预防方法的方法得到或可得到的混合细菌群体。
在一个实例中,所述方法在环境、设备、装置、容器、水道、水、流体、食品、饮料、微生物群、微生物组或化妆品的混合细菌群体中实施,例如如本文所述,其中与第一细胞相比,所述方法减少宿主细胞的比例。
在一个实例中,所述方法的产物用于施用于人或非人动物的肠道,用于治疗或预防人或动物的肥胖症、糖尿病或ibd。
在一个实例中,第一和第二物种为人或非人动物肠道共栖或共生细菌的物种。
当所述方法的产物可被施用(例如鼻内)于人或动物、使得细菌栖居人或动物的一种或多种微生物组(例如肠道微生物组)时,所述方法的产物是有用的。第一细胞充当载体,尤其是当那些细胞对人或动物为非致病性的(例如在肠道微生物组中是非致病性的)。微生物组可为本文公开的任何其他微生物组或微生物群群体。
在一个实例中,第一第二细菌物种能够栖居人或非人动物的肠道微生物群,并且第一细菌与人或动物共栖或共生。有用的是,第一细菌能够安全施用于人或动物,并且可以充当载体,用于之后将工程改造的序列转移至微生物群的宿主细胞。
在一个实例中,工程改造的序列由本文公开的任何阵列或载体包含。在一个实例中,所述方法使用本文公开的任何crispr/cas系统。
在一个实例中,第一细胞为拟杆菌门(例如拟杆菌目或拟杆菌属)细胞、乳杆菌属(例如嗜酸菌(例如la-5、la-14或ncfm)、短乳杆菌、保加利亚乳杆菌、植物乳杆菌、鼠李糖乳杆菌、发酵乳杆菌、高加索乳杆菌、瑞士乳杆菌、乳酸链球菌、罗伊氏乳杆菌或干酪乳杆菌、例如干酪乳杆菌代田株)、双歧杆菌属物种(例如两歧双歧杆菌、短双歧杆菌、长双歧杆菌或婴儿双岐杆菌)、嗜热链球菌、屎肠球菌、另枝菌属、产碱杆菌属、副拟杆菌属、坦纳菌属、大肠杆菌属或xylanibacter细胞。
在一个实例中,宿主细胞属于人微生物群物种且载体细胞是在所述人微生物群中为非致病性的物种的细胞,其中靶标序列不由载体细胞的基因组包含,工程改造的序列由包含在载体和宿主细胞中可操作的orit的mge包含,其中mge能够从载体细胞水平转移至宿主细胞。在一个实例中,工程改造的序列、mge或载体由细菌噬菌体包含,所述细菌噬菌体能够感染第一细胞(载体),以指导mge进入第一(载体)细胞。之后mge能够水平转移至宿主细胞。
在一个实例中,第一细胞为拟杆菌门或普雷沃菌属细胞;任选地其中mge能够从所述人微生物群的第一细胞物种水平转移至厚壁菌门物种(宿主细胞)。当靶标序列被厚壁菌门但不是第一(载体)细胞包含时,厚壁菌门物种例如用于在人中治疗或预防肥胖症。
以下编号的段落描述了本发明的一些方面。本发明至少提供了:
1.修饰微生物群细菌的混合群体的方法,所述混合群体分别包含第一和第二微生物群物种的第一和第二细菌亚群,其中所述物种是不同的,所述第二细菌亚群包括宿主细胞群体,所述方法包括将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的工程改造的核酸序列的多个拷贝组合,和在宿主细胞中表达hm-crrna,其中每个工程改造的核酸序列可在相应宿主细胞中与cas核酸酶一起操作以形成hm-crispr/cas系统,且所述工程改造的序列包含间隔区和编码hm-crrna的重复序列;所述hm-crrna包含能够与宿主细胞靶标序列杂交以将cas核酸酶指导至宿主细胞中的靶标序列的序列;和任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例。
2.段落1的方法,其包括使用宿主细胞的内源性cas核酸酶用于修饰靶标核苷酸序列。
3.段落1或2的方法,其包括与未接受所述cas修饰的宿主细胞的对照群体的生长相比,将宿主细胞群体生长减少至少5倍。
4.段落1、2或3的方法,其包括抑制表面上的宿主细胞群体生长。
5.段落1、2、3或4的方法,其中所述第一物种具有编码16s核糖体rna的dna序列,其与宿主细胞物种的编码16s核糖体rna的dna序列具有至少80%同一性,其中所述混合细菌中的第一细菌的生长不被所述hm-系统抑制。
6.段落1-5中任一项的方法,其中所述第一物种是人肠道共生物种和/或人肠道益生菌物种。
7.段落1-6中任一项的方法,其中所述第一物种是拟杆菌门(bacteroidetes)(例如,拟杆菌属(bacteroides)),且任选地,所述宿主细胞是革兰氏阳性细菌细胞。
8.段落1-7中任一项的方法,其中所述宿主细胞是厚壁菌门细胞。
9.段落1-8中任一项的方法,其中所述宿主细胞是厚壁菌门细胞。
10.段落1-9中任一项的方法,其中所述宿主细胞是厚壁菌门细胞。
11.段落1-10中任一项的方法,其中对于每种宿主细胞,所述系统包含根据(i)至(iv)的组分:(i)至少一种编码cas核酸酶的核酸序列;(ii)包含间隔区序列和编码hm-crrna的重复区的工程改造的hmcrispr阵列,所述hm-crrna包含与宿主细胞靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;(iii)任选的tracrrna序列或表达tracrrna序列的dna序列;(iv)其中所述系统组分在宿主细胞和至少一种转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的宿主靶标序列;且其中所述靶标序列被cas修饰,由此杀死宿主细胞或减少宿主细胞生长;所述方法包括将(iv)的载体引入宿主细胞和在宿主细胞中表达所述hm-crrna,使hm-crna与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞生长,由此改变细菌的混合群体中的所述亚群的相对比例。
12.段落11的方法,其中组分(i)对每个宿主细胞是内源的。
13.段落12的方法,其中每种载体是病毒或噬菌体。
14.段落11的方法,其中每个靶标序列与nnagaaw或nggng原型间隔区相邻基序(pam)相邻。
15.段落1-14中任一项的方法,其中,可替代地,hm-crrna和tracrrna由单一指导rna(grna)包含,所述方法包括将所述grna引入宿主细胞或在宿主细胞中表达grna。
16.段落1-15中任一项的方法,其中所述第一和第二物种各自都是相应的厚壁菌门物种,且所述第一细菌的生长不被hm-系统抑制。
17.段落1-16中任一项的方法,其中所述第一和第二物种各自都是相应的革兰氏阳性物种,且所述第一细菌的生长不被hm-系统抑制。
18.段落1-17中任一项的方法,其用于治疗人或动物受试者的宿主细胞感染,所述方法包括将所述宿主细胞暴露于第一抗生素,其中靶标序列各自由对所述第一抗生素的抗性的抗生素抗性基因包含,其中在受试者中治疗所述宿主细胞感染。
19.段落1-18中任一项的方法,其用于治疗或降低人或动物受试者中的疾病或病况的风险,其中所述疾病或病况由所述第二细菌物种介导,其中所述第一细菌是人(例如,在人肠道中)益生菌的、共栖的或共生的,且其中所述第一细菌细胞不包含所述靶标序列,其中实施通过所述cas的靶标序列修饰,且宿主细胞的生长在所述受试者中被抑制,但第一细胞的生长不被抑制,其中所述疾病或病况得到治疗或所述受试者中的疾病或病况的风险降低。
20.段落1-19中任一项的方法,其用于处理工业或医疗流体、表面、设备或容器;或用于处理水道、水、饮料、食品或化妆品,其中所述宿主细胞由流体、表面、设备、容器、水道、水、饮料、食品或化妆品包含或在流体、表面、设备、容器、水道、水、饮料、食品或化妆品上,其中宿主细胞生长被抑制,由此实施所述治疗。
21.段落1-20中任一项的方法,其中每种宿主细胞是葡萄球菌、链球菌、假单胞菌、沙门氏菌、李斯特菌、大肠杆菌、脱硫弧菌、弧菌或梭状芽孢杆菌细胞。
22.段落1-21中任一项的方法,其中每个靶标序列由宿主细胞的抗生素抗性基因、毒力基因或必需基因包含。
23.段落7的方法,其用于增加混合群体中的拟杆菌的比例,其中实施所述增加。
24.段落23的方法,其中多形拟杆菌和/或脆弱拟杆菌的比例增加。
25.段落7的方法,其中所述混合群体包含的拟杆菌门相比于厚壁菌门或革兰氏阳性宿主细胞的相对比例增加。
26.段落25的方法,其中多形拟杆菌和/或脆弱拟杆菌的比例增加。
27.段落1-24中任一项的方法,其用于有利于人或动物中的共栖或共生的拟杆菌。
28.段落27的方法,其包括产生包含方面1的产物的细菌培养物,和将所述培养物施用于人或动物,由此有利于所述人或动物中的共栖或共生的拟杆菌。
29.方面1的方法,其用于在人或动物中通过肠道拟杆菌(例如多形拟杆菌)刺激潘氏细胞,其中所述混合群体包含肠道细菌,所述肠道细菌包含拟杆菌属第一细菌,且方面1的产物在所述人或动物中产生或施用于所述人或动物,由此刺激潘氏细胞。
30.方面1的方法,其用于在人或动物中发展对肠道拟杆菌(例如,脆弱拟杆菌)的免疫应答,其中所述混合群体包含肠道细菌,所述肠道细菌包含拟杆菌属第一细菌,且方面1的产物在所述人或动物中产生或施用于所述人或动物,由此发展所述免疫应答。
本发明的进一步例举的条款
本发明还涉及以下条款1向前,其在下面向前的工作实施例6中例举,其首次使用内源或外源(载体-编码的cas)在不同物种和菌株的混合微生物群体中确立成功的宿主细胞靶向:-
1.修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
a.将微生物群细菌的混合群体与编码cas核酸酶和宿主修饰(hm)crrna的多种载体组合,和
b.在宿主细胞中表达载体-编码的cas和hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与载体-编码的cas一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas核酸酶指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例。
2.修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
a.将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
b.在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中所述方法将宿主细胞群体生长降低至少5倍、10倍、100倍、1000倍、10000倍、100000倍或1000000倍。
3.修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
a.将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
b.在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中所述方法抑制表面上的宿主细胞群体生长。
4.修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
a.将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
b.在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中所述第一物种具有编码16s核糖体rna的dna序列,其与宿主细胞物种的编码16s核糖体rna的dna序列具有至少80%同一性,其中所述混合细菌中的第一细菌的生长不被所述hm-系统抑制。
5.修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
a.将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
b.在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中步骤(a)的混合群体包含第三细菌物种。
6.修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
a.将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
b.在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中步骤(a)的混合群体包含与宿主细胞相同物种的细菌细胞的另外的亚群,其中所述另外的亚群的细菌细胞不包含所述靶标序列。
在所述hm-crispr/cas系统存在的情况下,所述另外的亚群的细胞没有被杀死,或者在所述系统存在的情况下,宿主细胞群体生长减少。
7.修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
a.将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
b.在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例;
其中每个宿主细胞包含多个所述靶标序列。
8.修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
a.将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
b.在宿主细胞中表达hm-crrna,
其中在宿主细胞中诱导cas表达,由此在宿主细胞中组合所述表达的cas和hm-crrna;
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例。
9.修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
a.将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
b.在宿主细胞中诱导hm-crrna的产生,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中在所述宿主细胞中可诱导从工程改造的核酸序列表达rna用于产生hm-crna,且所述工程改造的序列和cas形成hm-crispr/cas系统,所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例。
10.修饰微生物群细菌的混合群体的方法,所述混合群体包含第一细菌亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体,其中所述第二物种是与所述第一微生物群物种不同的物种,所述方法包括
a.将微生物群细菌的混合群体与编码宿主修饰(hm)crrna的多种载体组合,和
b.在宿主细胞中表达hm-crrna,
其中每个hm-crrna均由载体工程改造的核酸序列编码且可在宿主细胞中与cas核酸酶一起操作,其中所述工程改造的核酸序列和cas形成hm-crispr/cas系统,且所述工程改造的核酸序列包含
(i)包含间隔区和编码所述hm-crrna的重复序列的核酸序列;
(ii)编码所述hm-crrna的序列的核酸序列,其中所述hm-crrna序列能够与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;和
任选地,所述hm-系统包含tracrrna序列或表达tracrrna序列的dna序列;
由此hm-crrna指导宿主细胞中的宿主靶标序列的cas修饰,由此杀死宿主细胞或减少宿主细胞群体生长,由此减少所述宿主细胞群体的比例和改变混合细菌群体中的所述细菌亚群的相对比例。
11.条款2至10中任一项的方法,其中所述cas由所述载体编码。
12.条款2至10中任一项的方法,其中所述cas由所述宿主细胞基因组编码。
13.任一前述条款的方法,其中所述方法将宿主细胞群体生长降低至少5倍。
14.任一前述条款的方法,其中所述方法抑制表面上的宿主细胞群体生长。
15.任一前述条款的方法,其中所述第一物种具有编码16s核糖体rna的dna序列,其与宿主细胞物种的编码16s核糖体rna的dna序列具有至少80%同一性,其中所述混合细菌中的第一细菌的生长不被所述hm-系统抑制。
16.条款15的方法,其中所述第一物种是革兰氏阴性物种,且任选地,所述第二物种是革兰氏阴性物种。
17.条款1至15中任一项的方法,其中所述第一物种是革兰氏阳性物种,且所述第二物种是革兰氏阴性物种。
18.任一前述条款的方法,其中步骤(a)的混合群体包含第三物种,其中所述第三物种是革兰氏阴性物种。
19.任一前述条款的方法,其中步骤(a)的混合群体包含第三细菌物种。
20.条款19的方法,其中所述第三物种是革兰氏阳性物种。
21.条款20的方法,其中所述第一和第二物种是革兰氏阴性物种。
22.任一前述条款的方法,其中步骤(a)的混合群体包含与宿主细胞相同物种的细菌细胞的另外的亚群,其中所述另外的亚群的细菌细胞不包含所述靶标序列。
23.任一前述条款的方法,其中所述载体表达包含hm-crrna序列的单一指导rna(hm-grna)。
24.条款1至22中任一项的方法,其中所述方法包括在宿主细胞中的hm-crna的产生中使用内源宿主细胞核糖核酸酶iii和/或内源宿主细胞tracrrna。
25.任一前述条款的方法,其中每个宿主细胞包含多个所述靶标序列(例如,核糖体rna-编码序列,例如,16srrna-编码序列)。
26.条款25的方法,其中每个宿主细胞包含至少2、3、4、5、6或7个拷贝的所述靶标序列。
27.任一前述条款的方法,其中所述靶标序列在所述第二物种的细菌中是保守的。
例如,所述靶标序列在所述第二物种的细菌的菌株中是保守的,并且任选地在所述第二物种的第二细菌菌株中不是保守的。
28.任一前述条款的方法,其中所述靶标序列由必需基因包含和/或是在宿主细胞中的蛋白表达所需的。
29.任一前述条款的方法,其中所述宿主细胞是所述第二种的第一菌株的且所述遗传靶标序列存在于所述菌株中,但所述靶标序列不存在于不同菌株的第二物种的细菌中。
30.条款29的方法,其中步骤(a)的混合群体包含所述不同菌株的细菌的亚群。
例如,所述靶标序列在所述第二物种的细菌的菌株中是保守的,并且任选地在所述第二物种的第二细菌菌株中不是保守的。
31.条款30的方法,其中所述第一物种是革兰氏阴性物种,且步骤(a)的混合群体包含第三物种的细菌的亚群,其中所述第三物种是革兰氏阳性物种。
32.条款30的方法,其中所述第一物种是革兰氏阳性物种,且步骤(a)的混合群体包含第三物种的细菌的亚群,其中所述第三物种是革兰氏阴性物种。
33.条款30、31或32的方法,其中所述第二物种是革兰氏阴性物种。
34.任一前述条款的方法,其中所述第二物种是肠杆菌科物种。
35.任一前述条款的方法,其中所述第二物种是大肠杆菌。
36.任一前述条款的方法,其中所述第二物种是人或动物肠道微生物群物种。
37.任一前述条款的方法,其中每种物种是环境物种,或人或动物(例如,肠道)微生物群物种,和/或其中所述宿主细胞是人微生物群物种的细胞。
38.任一前述条款的方法,其中cas表达在宿主细胞中是可诱导的。
39.任一前述条款的方法,其中在宿主细胞中诱导cas表达。
40.任一前述条款的方法,其中hm-crna表达在宿主细胞中是可诱导的。
41.任一前述条款的方法,其中在宿主细胞中诱导hm-crrna表达。
42.能够转化细菌宿主细胞的载体,其中所述载体能够容纳以下的插入:(i)在所述宿主细胞中可表达的化脓性链球菌cas9核苷酸序列和(ii)任选地,至少一个如任一前述条款中所定义的编码hm-crrna的工程改造的核酸序列,所述载体用于任一前述条款的方法中,其中当所述载体包含(i)(和任选地(ii))时,所述载体能够转化宿主细胞并表达cas(和任选地至少一种hm-crrna(例如,grna)。
43.条款42的载体,其中表达的cas是cas9。
在一个替代方案中,表达的cas是cas3,例如,大肠杆菌cas3。所述表达的cas可与宿主细胞中表达的hm-crrna一起操作,以将cas靶向至所述宿主细胞中的一个或多个靶标序列。
44.任一前述条款的方法或载体,其中所述方法用于治疗或预防人或动物中的疾病或病况;或其中所述方法治疗或预防人或动物中的疾病或病况。
45.多种细菌宿主细胞,其各自包含条款42至44中任一项的载体,其中载体-编码的cas(和任选地所述hmcrrna)在所述宿主细胞中表达或可表达,其中所述细菌细胞由微生物群细菌的混合群体包含,所述混合群体包含第一亚群和第二细菌亚群,其中所述第一亚群包含第一微生物群物种,且所述第二亚群包含第二微生物群物种的宿主细胞群体(所述多种细菌宿主细胞目),其中所述第二物种是与所述第一微生物群物种不同的物种。
46.条款45的多种细胞,其用于治疗或预防人或动物中的疾病或病况。
47.任一前述条款的方法、载体或多种细胞,其中所述第一微生物群物种是人肠道共生物种和/或人肠道益生菌物种。
48.任一前述条款的方法、载体或多种细胞,其中所述第一微生物群物种是拟杆菌门(bacteroidetes)(例如,拟杆菌属(bacteroides)),且任选地,所述宿主细胞是革兰氏阳性细菌细胞。
49.任一前述条款的方法、载体或多种细胞,其中所述宿主细胞群体由厚壁菌门细胞组成。
50.任一前述条款的方法、载体或多种细胞,其中对于每种宿主细胞,所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)包含间隔区序列和编码hm-crrna的重复区的工程改造的hmcrispr阵列,所述hm-crrna包含与宿主细胞靶标序列杂交以将所述cas指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或表达tracrrna序列的dna序列;
(iv)其中所述系统组分在宿主细胞和至少一种转化宿主细胞的核酸载体之间分割(split),由此hm-crrna将cas指导至靶标以修饰宿主细胞中的宿主靶标序列;且
其中所述靶标序列被cas修饰,由此杀死宿主细胞或减少宿主细胞生长;
所述方法包括将(iv)的载体引入宿主细胞和在所述宿主细胞中表达所述hm-crrna,使hm-crna与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞生长,由此改变细菌的混合群体中的所述亚群的相对比例。
51.任一前述条款的方法、载体或多种细胞,其中每种载体是病毒或噬菌体。
52.任一前述条款的方法、载体或多种细胞,其中每个靶标序列与nnagaaw或nggng原型间隔区相邻基序(pam)相邻。
53.任一前述条款的方法、载体或多种细胞,其中所述第一和第二物种各自都是相应的厚壁菌门物种,且所述第一细菌的生长不被hm-系统抑制。
54.任一前述条款的方法、载体或多种细胞,其中所述第一和第二物种各自都是相应的革兰氏阳性物种,且所述第一细菌的生长不被hm-系统抑制。
55.任一前述条款的方法、载体或多种细胞,其用于治疗人或动物受试者的宿主细胞感染,所述方法包括将所述宿主细胞暴露于第一抗生素,其中靶标序列各自由对所述第一抗生素的抗性的抗生素抗性基因包含,其中在受试者中治疗所述宿主细胞感染。
56.任一前述条款的方法、载体或多种细胞,其用于治疗或降低人或动物受试者中的疾病或病况的风险,其中所述疾病或病况由所述第二细菌物种介导,其中所述第一细菌物种是人(例如,在人肠道中)益生菌的、共栖的或共生的,且其中所述第一细菌物种细胞不包含所述靶标序列,其中实施通过所述cas的靶标序列修饰,且宿主细胞的生长在所述受试者中被抑制,但第一细菌物种细胞的生长不被抑制,其中所述疾病或病况得到治疗或所述受试者中的疾病或病况的风险降低。
57.任一前述条款的方法、载体或多种细胞,其用于处理工业或医疗流体、表面、设备或容器;或用于处理水道、水、饮料、食品或化妆品,其中所述宿主细胞由流体、表面、设备、容器、水道、水、饮料、食品或化妆品包含或在流体、表面、设备、容器、水道、水、饮料、食品或化妆品上,其中宿主细胞生长被抑制,由此实施所述治疗。
58.任一前述条款的方法、载体或多种细胞,其中每种宿主细胞是葡萄球菌、链球菌、假单胞菌、沙门氏菌、李斯特菌、大肠杆菌、脱硫弧菌、弧菌或梭状芽孢杆菌细胞。
59.任一前述条款的方法、载体或多种细胞,其中每个靶标序列由宿主细胞的抗生素抗性基因、毒力基因或必需基因包含。
60.任一前述条款的方法、载体或多种细胞,其用于增加混合群体中的拟杆菌的比例,其中实施所述增加。
61.任一前述条款的方法、载体或多种细胞,其中多形拟杆菌和/或脆弱拟杆菌的比例增加。
62.任一前述条款的方法、载体或多种细胞,其中所述混合群体包含的拟杆菌门相比于厚壁菌门或革兰氏阳性宿主细胞的相对比例增加。
63.任一前述条款的方法、载体或多种细胞,其用于有利于人或动物中的共栖或共生的拟杆菌。
64.任一前述条款的方法,其包括产生包含条款1的产物的细菌培养物,和将所述培养物施用于人或动物,由此有利于所述人或动物中的共栖或共生的拟杆菌。
例如,所述方法包括产生包含方面1的产物的细菌培养物,和将所述培养物施用于人或动物,由此有利于所述人或动物中的共栖或共生的拟杆菌。
65.任一前述条款的方法、载体或多种细胞,其用于在人或动物中通过肠道拟杆菌(例如多形拟杆菌)刺激潘氏细胞,其中所述第一细菌物种是拟杆菌属物种,其中所述方法包括在所述人或动物中产生包含所述改变比例的混合群体,和将包含所述改变比例的所述混合群体施用于所述人或动物,由此刺激潘氏细胞。
66.任一前述条款的方法、载体或多种细胞,其用于在人或动物中发展对肠道拟杆菌(例如,脆弱拟杆菌)的免疫应答,其中所述第一细菌物种是拟杆菌属物种,其中所述方法包括产生在所述人或动物中产生的包含所述改变比例的混合群体,和将包含所述改变比例的所述混合群体施用于所述人或动物,由此发展所述免疫应答。
在一个实施方案中,多种载体包含载体,所述载体各自包含用于在宿主细胞中表达cas的编码所述cas的核苷酸序列的载体;和用于在细胞中表达一种或多种crrna(例如,由单一指导rna包含)的核苷酸序列。
在一个实施方案中,所述载体编码多种cas蛋白(例如,cas9和cas1(和/或cas2);或i型casa、b、c、d、e和cas3)。在一个实施方案中,所述cas是cas9、dcas9或cas3(例如,i型cas3或大肠杆菌cas3或鼠伤寒沙门氏菌cas3)。
在一个实施方案中,每种载体包含编码cas核酸酶的核苷酸序列和编码宿主修饰(hm)crrna的工程改造的核酸序列。
在一个实施方案中,所述载体包含低拷贝数载体,例如,质粒或噬菌粒。在另一个实施方案中,所述载体包含高拷贝数载体,例如,质粒或噬菌粒。
在一个实施方案中,每个hm-crrna均由载体工程改造的核酸序列编码且可在相应的宿主细胞中与载体-编码的cas一起操作,多个hm-crrna可在相同的相应的宿主细胞中与载体-编码的cas一起操作。
在一个实施方案中,所述第二物种是革兰氏阳性物种。在一个实施方案中,所述第二物种是革兰氏阴性物种。在一个实施方案中,所述第一或第三物种是乳酸乳杆菌。在一个实施方案中,所述第一或第三物种是枯草芽孢杆菌。在一个实施方案中,所述第一物种是乳酸乳杆菌且所述第三物种是枯草芽孢杆菌。在一个实施方案中,所述第一物种是乳酸乳杆菌且所述第三物种是枯草芽孢杆菌。在一个实例中,所述第二物种是大肠杆菌。在一个实例中,所述第三物种能够在含有pea的培养基(例如,每升pea含有2.5g的th培养基)中或上生长。在一个实例中,所述混合群体包含不同于所述第一、第二和第三物种的第四细菌物种的第四细菌亚群。
在一个实施方案中,所述载体能够在体外、例如在表面上、诸如在琼脂凝胶上将宿主细胞群体体外生长减少至少5、10、100、1000、10000、100000或1000000倍。例如,所述方法包括与未接受所述cas修饰的宿主细胞的对照群体的生长相比,将宿主细胞群体生长减少至少所述倍。在一个实施方案中,所述载体能够在第三物种(以及任选地还有第四物种)的情况下将宿主细胞群体体外生长减少至少5、10、100、1000、10000、100000或1000000倍,其中所述第一、第二、第三和第四物种彼此不同。
在一个实例中,所述宿主细胞群体在表面上,由此宿主细胞群体生长在所述表面上被抑制。
在一个实施方案中,每种载体包含多个hm-crispr阵列。在一个实施方案中,所述系统或每种载体包含两个、三个或更多个拷贝的编码hm-crrna(例如,grna)的核酸序列,其中所述拷贝包含用于靶向宿主细胞序列(例如,毒力、抗性或必需基因)的相同间隔区序列。
在一个实例中,所述方法是体外的。在一个实例中,所述方法是体内的(例如,在人或动物中,例如在其肠道微生物组中;或在植物中或植物上)。
在一个实例中,所述方法用于(a)改变混合细菌群体中的拟杆菌细菌的比例;(b)减少混合细菌群体中的厚壁菌门亚群(宿主细胞)的比例;(c)减少混合群体中的第一厚壁菌门物种(宿主细胞)的比例,其中所述混合群体包含其生长不被所述crna抑制的第二厚壁菌门物种;(d)减少混合细菌群体中的第一革兰氏阳性细菌物种(宿主细胞)的比例,其中所述混合群体包含其生长不被所述crna抑制的第二革兰氏阳性细菌物种;(e)减少混合细菌群体中的细菌物种(宿主细胞)的比例,其中所述混合群体包含其生长不被所述crna抑制的不同的细菌物种,其中所述第一物种具有编码16s核糖体rna的dna序列,其与其他物种的编码16s核糖体rna的dna序列具有至少80%同一性;(f)减少混合细菌群体中的第一细菌人肠道微生物群物种(宿主细胞,例如厚壁菌门)的比例,其中所述混合群体包含不同的细菌物种,其中所述不同的物种是其生长不被所述crna抑制的人肠道益生菌物种;或(g)减少混合细菌群体中的细菌人肠道微生物群物种((宿主细胞,例如厚壁菌门)的比例,其中所述混合群体包含不同的细菌物种,其中所述不同的物种是其生长不被所述crna抑制的人肠道共生物种,其中实施所述改变或减少(例如,离体、体内或在人或动物微生物群(例如,肠道微生物群)中)。
所述疾病或病况由人或动物中(例如,在微生物群或微生物组、诸如肠道或皮肤微生物群或微生物组中)的所述第二物种的细胞的存在介导或与其相关。在一个实例中,所述第二物种对于(作为所述方法的受试者的所述动物的相同物种的)人或动物是致病的,其中所述方法治疗或预防所述第二物种的细胞的感染。
本文中的任何方面、段落、实施方案、实例、概念或配置可以进行组合或加上必要的变更适用于本文中的任何条款1向前。所述方法、系统、载体或多种细胞可以在本文公开的任何方法或用途中使用或用于本文公开的任何方法或用途中。
us20160333348及其继续和部分继续申请(除了本申请以外)的公开内容通过引用并入本文,并且其中的任何方面、段落、实施方案、实例、概念或配置可以进行组合或加上必要的变更适用于本文中的任何条款1向前。
靶向形成孢子的物种艰难梭菌、枯草芽孢杆菌、大肠杆菌、肠道沙门氏菌等的程序化的核酸酶。
本发明的另外的配置提供了:-
指导的核酸酶,其经程序化以识别宿主细菌或古细菌细胞的靶核苷酸序列,由此所述程序化的核酸酶能够修饰所述核苷酸序列,任选地,其中所述核苷酸序列由靶基因包含,所述靶基因由宿主细胞中的σ因子介导的基因表达级联包含。
本发明的另外的配置的第一方面提供了:-
所述核酸酶是cas核酸酶,其可作为宿主细胞中的宿主修饰(hm)-crlspr/cas系统的一部分操作,
其中所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)(a)工程改造的核酸序列,其包含间隔区序列和一个或多个编码hm-crrna的重复序列,
其中所述间隔区包含与宿主细胞靶标序列杂交以将所述cas核酸酶指导至宿主细胞中的靶标以修饰靶标序列的序列;或(b)编码指导rna(例如,单一指导rna)的工程改造的核苷酸序列,其包含与所述宿主细胞靶标序列杂交以将所述cas核酸酶指导至宿主细胞中的靶标以修饰靶序列的序列;
(iii)任选的tracrrna序列或表达tracrrna序列的dna序列;
(iv)其中组分(ii)由核酸载体包含,所述核酸载体能够转化宿主细胞,由此hm-crrna或指导rna将cas指导至靶标以修饰宿主细胞中的宿主靶标序列;且
其中所述靶标序列被cas核酸酶修饰,由此杀死宿主细胞或减少宿主细胞生长。
本发明的另外的配置的第二方面提供了:-
所述核酸酶是cas核酸酶,且
(a)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与seqidno:273或275-286的氨基酸序列具有至少70%同一性,或者由与seqidno:738或274的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:273的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与选自seqidno:138-209或290-513的重复序列和包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam一起操作;或
(b)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与选自seqidno:261或263或287-289的氨基酸序列具有至少70%同一性,或者由与seqidno:262或264的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:261或263的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与选自seqidno:210-213和514-731的重复序列和包含awg(例如aag、agg、gag或atg)或由其组成的pam一起操作;或
(c)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与seqidno:265的氨基酸序列具有至少70%同一性,或者由与seqidno:266的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:265的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与选自seqidno:215-218的重复序列和包含nnagaaw、nggng或aw(例如aa、at或ag)或由其组成的pam一起操作;或
(d)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与seqidno:267或269的氨基酸序列具有至少70%同一性,或者由与seqidno:268或270的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:267或269的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与重复序列seqidno:214一起操作。
在宿主细胞是艰难梭菌细胞;大肠杆菌细胞;嗜热链球菌细胞;或肠道沙门氏菌细胞的情况下,这些方面尤其有用。例如,所述系统可以包含所述细胞的内源性cas3和cascade,其与编码rna(例如,crna或单一grna)的载体(例如,细菌噬菌体或噬菌体)组合用于使核酸酶程序化。在一个实例中,这样的载体可以在由载体、如本文公开的乳杆菌(例如罗伊氏乳杆菌)载体包含,例如用于向人或动物受试者施用用于治疗或预防受试者中的艰难梭菌、大肠杆菌或沙门氏菌感染。
本发明部分基于以下观察:某些因子和调节因子在厚壁菌门(诸如艰难梭菌和枯草芽孢杆菌)中的孢子形成期间调节基因表达,并且这些因此成为核酸酶介导的宿主基因组的修饰、尤其用于杀死宿主或用于减少宿主细胞群体的生长的的合适靶标。
艰难梭菌(一种革兰氏阳性、厌氧、孢子形成细菌)是一种新出现的病原体,并且是医院腹泻的最常见原因。艰难梭菌产生抗性孢子,其促进该细菌在包括医院在内的环境中的持久性。其传播是由孢子对肠道的污染介导。四种σ因子σf、σe、σg和σk的级联控制隔室特异性基因表达。艰难梭菌的spoiiid在表达的母细胞系中也发挥关键作用,抑制σe调节子的许多成员的转录并活化sigk表达。前孢子产物spoiir是加工pro-σe所需的。spo0a和σh均存在,并且是有效的艰难梭菌芽孢形成所需的。这些类型的因子、控制和相互作用在厚壁菌门中的孢子形成过程中是重要的。
两种大毒素,肠毒素tcda和细胞毒素tcdb是发展艰难梭菌感染(cdi)的症状所需的主要毒力因子。
在枯草芽孢杆菌中孢子形成开始时,孢子形成细胞经历不对称分裂,其将孢子囊细胞分成更大的母细胞和较小的前孢子(未来的孢子)。接下来,前孢子被母细胞完全吞噬,并且随后休眠孢子通过裂解从母细胞释放。孢子形成的发展程序主要受四种σ因子(σf、σe、σg和σk)的依次活化支配。它们的活动仅限于前孢子囊(对于σf和σg)和母细胞(对于σe和σk)。基因表达的隔室化与形态发生有关,其中σf和σe在不对称分裂后变得有活性,且σg和σk在完成母细胞吞噬前孢子后变得有活性。
在枯草芽孢杆菌中,基因表达的协调变化是在分裂前孢子囊中以及随后具有母细胞和前孢子之间的通讯存在的两个隔室中的形态学分化的基础。应答调节剂spo0a和涉及五种激酶的磷酸中继,中间磷酸化蛋白和磷酸酶,控制孢子形成起始。转录spo0a和sigf的替代σ因子σh也控制早期孢子形成步骤。当spo0a-p水平达到临界阈值时,spo0a-p活化孢子形成基因,包括spoiie以及分别编码σf和σe的spoiiaa-spoiiab-sigf和spoiiga-sige操纵子。其合成后,σf通过反-σ因子spoiiab保持无活性,直到磷酸酶spoiie使反-反-σ因子spoiiaa去磷酸化,导致完成不对称细胞分裂后从spoiiab释放活性σf。然后,σf在前孢子中转录约50种基因,包括spoiir,其编码在母细胞中将pro-σe加工成活性σe所需的分泌蛋白。σe进而调节母细胞特异性基因的表达并以spoiiid调节剂的组合活性活化sigk表达。在前孢子中,σf还控制sigg转录。然而,σg变得与母细胞完成前孢子吞噬同时有活性。在吞噬完成后,需要σe-控制的spoiiia蛋白连同前孢子特异性spoiiq蛋白来维持在前孢子中进行大分子合成的潜能。rna聚合酶σg全酶在前孢子中转录95种基因,包括蛋白如参与σk(孢子形成的最后一个因子σ)的加工和活化的spoivb或ctpb。
四种孢子形成特异性σ因子在梭菌中是保守的,并且存在于艰难梭菌中。参与孢子形态发生的关键基因也是如此。梭菌的sigf和sigg突变体以及丙酮丁醇梭菌的sige突变体均未形成抗性孢子,而产气荚膜梭菌的sige和sigk突变体的孢子形成的能力是严重缺陷的。有趣的是,丙酮丁醇梭菌的sige和sigf突变体无法形成不对称的分裂隔膜,而sigk突变体在孢子形成方面比产气荚膜梭菌中的sige突变体更早被阻断。艰难梭菌sigf和sige突变体在不对称阶段被阻止,而sigg突变体在完成吞噬后被阻断,但在枯草芽孢杆菌中不同,显示在前孢子周围的电子致密的衣壳材料的沉积。这些突变体不能形成孢子。艰难梭菌的sigk突变体形成比同基因野生型菌株少四个数量级的的耐热孢子。尽管在发育中的孢子周围没有显示衣壳沉积的迹象,但该突变体显示至少一些皮质材料的积累。
枯草芽孢杆菌中孢子形成的标志是存在连接基因表达的前孢子和母细胞特异性细胞系的细胞-细胞信号传导通路。由于这些途径在孢子形成的关键形态阶段起作用,因此结果是两种基因表达系的协调部署,与形态发生的过程密切相关。实际上,σf是在母细胞中将pro-σe活化为σe所需的,且σe进而是在前孢子中活化σg所需的。最后,σg是在母细胞中将pro-σk活化为σk所需的。在枯草芽孢杆菌中,σf驱动产生信号传导蛋白spoiir,其被分泌穿过前孢子内膜至膜间空间中,其中其在母细胞中刺激spoiiga依赖的pro-σe加工。已经观察到spoiir基因的失活导致艰难梭菌完全不能形成孢子。
在枯草芽孢杆菌中,大部分σg活性发生在吞噬完成之后。另外,被吞噬的前孢子中的sigg靶标基因的表达至少部分通过spoiiia蛋白的合成而取决于母细胞中的σe活化。在枯草芽孢杆菌中,sigg通过控制pro-σk加工的过程来调节σk调节子在母细胞中的表达。sigg突变体在吞噬完成后立即被阻断,并且没有显示在前孢子周围的表面层组装的任何迹象。
在艰难梭菌中,已经鉴定几种对孢子形成必不可少的基因:编码孢子形成的主要调节子的spo0a,和编码σh(过渡阶段的关键σ因子)的sigh,其两者先前已显示是艰难梭菌中的孢子形成必需的。还鉴定受spo0a和σh直接控制并因此参与孢子形成的起始的基因,包括前孢子和母细胞特异性早期rna聚合酶σ因子(分别为σf和σe)连同控制其活性的蛋白(spoiiaa、spoiiab、spoiie和spoiiga)。σf和σe调节子中的许多基因也看起来是孢子形成所需的,包括参与孢子形成的ii期(spoiiq、spoiid、spoiip和spoiir)、iii期(spoiiiaa、spoiiiab、spoiiiad、spoiiiae、spoiiiaf、spoiiiag、spoiiiah和spoiiid)和iv期(spoiva、spoivb′和sipl)的基因。在这些基因中,spoiir先前已被表征,并且spoiid、spoiip、spoiiq和属于spoiiia基因座的基因特别值得注意,因为它们编码参与前孢子吞噬的枯草芽孢杆菌蛋白的同源物。spoiiid是母细胞调节网络的重要组分,活化sigk表达并在孢子形态发生期间发挥几种辅助作用,而spoiva和sipl编码参与将外壳蛋白靶向至前孢子的表面的关键孢子形态发生蛋白。即使对控制艰难梭菌中的信号传导级联调节孢子形成中的后续步骤的分子机制知之甚少,但已经鉴定许多被认为参与这些过程的基因。这些基因包括sigg(其编码后期前孢子特异性σ因子σg),以及属于σg调节子的基因,spoivb、spovac、spovad和spovae。在该组中也已经鉴定了参与孢子形成的其他著名基因,包括编码两种小酸可溶性蛋白sspa和sspb的基因。
已经表明trps、metk和cd0274在艰难梭菌630δerm中是必不可少的。因此,在一个实例中,靶标序列由trps、metk或cd0274包含。
孢子形成是古老的细菌细胞分化程序,其在梭菌目和芽孢杆菌目中是非常保守的,特别是关于关键调节组分spo0a和四种孢子形成特异性σ因子σe、σf、σg和σk。尽管艰难梭菌中存在spo0a和σh并且是孢子形成所需的,但艰难梭菌中spo0a的磷酸化涉及简单的两组分系统,其不同于调节枯草芽孢杆菌中的spo0a活性的复杂磷酸中继。孢子是主要的传染因子,并且研究已显示,不能产生spo0a(孢子形成的主要调节子)的艰难梭菌的突变菌株不能在环境中有效地持续和传播疾病。因此,在一个实例中,靶标序列由spo0a包含。因此,在一个实例中,靶标序列由spo0a、trps、metk和cd027;编码芽孢形成特异性σ因子(例如,σh、σe、σf、σg和σk)的基因序列、sigf、spoiie、spoiiaa、spoiiab、sigk、spoiiid、sige、sigf或sigg包含。
在一个实例中,靶标序列由σf、σe、σg和σk调节子、例如艰难梭菌的调节子包含的基因包含。在一个实例中,靶标序列由spoiiaa-spoiiab-sigf或spoiiga-sige操纵子包含的基因包含,例如,其中所述细胞是艰难梭菌细胞。spoiiaa-spoiiab-sigf操纵子负责σf的合成和活化/失活,由rna聚合酶σh全酶转录,并受spo0a正性控制。poiiga-sige-sigg基因座包含sigg控制的基因,例如,对于孢子形成关键的那些,例如spova、sspa、sspb和pdaa。
spovt在孢子形成中的作用:在枯草芽孢杆菌中,两种转录调节子参与前孢子调节网络,rfsa和spovt。spovt控制σg调节子的约一半成员的合成。rfsa在艰难梭菌和几种梭菌的基因组中不存在,而存在spovt的直向同源物(与枯草芽孢杆菌的spovt具有55%同一性)。
spoiiid调节子:在枯草芽孢杆菌中,spoiiid正性或负性调节几乎一半的σe靶标基因。在枯草芽孢杆菌和艰难梭菌中,spoiiid在基因表达的母细胞系中起着关键作用,关闭σe调节子的许多成员的转录,并开启sigk和σk调节子的表达。在一个实例中,靶标序列由spoiiid调节子(例如,枯草芽孢杆菌或艰难梭菌细胞的)包含。
在以下陈述中进一步阐述本发明的本配置。
陈述
1.指导的核酸酶,其经程序化以识别宿主细菌或古细菌细胞的靶标核苷酸序列,由此所述程序化的核酸酶能够修饰所述核苷酸序列,任选地,其中所述核苷酸序列由靶基因包含,所述靶基因由宿主细胞中的σ因子介导的基因表达级联包含。
在一个实例中,所述核酸酶通过rna(例如,crrna)人工程序化。
σ因子是细菌rna聚合酶(rnap)的多结构域亚基,其在转录起始中发挥关键作用,包括启动子的识别和打开以及rna合成的初始步骤。
2.陈述1的核酸酶,其中所述核苷酸序列由基因包含,所述基因的转录在宿主细胞物种或菌株中由σ因子直接或间接地控制。
3.任一前述陈述的核酸酶,其中所述核苷酸序列由基因包含,所述基因编码在宿主细胞物种或菌株中直接或间接地控制σ因子的转录的产物。
4.任一前述陈述的核酸酶,其中所述核苷酸序列由编码所述级联的σ因子的基因包含。
5.任一前述陈述的核酸酶,其中所述靶基因的转录在宿主细胞物种的细胞中通过如下控制:
(a)σe;
(b)σf;
(c)σg;
(d)σh;
(e)σk;
(f)spo0a;
(g)spoiiid;
(h)spovt;或
(i)spoiir。
6.任一前述陈述的核酸酶,其中所述σ因子是σe;σf;σg;σh;或σk。
7.任一前述陈述的核酸酶,其中所述σ因子是艰难梭菌或枯草芽孢杆菌σe;σf;σg;σh;或σk,其同源物或直向同源物。
在一个实施方案中,所述同源物、直向同源物或等效物具有与选择的基因相同的功能或编码具有与由选择的基因编码的产物相同的功能的产物。
8.任一前述陈述的核酸酶,其中所述σ因子包含与选自seqidno:223、225、227、239和243的氨基酸序列具有至少80、85、90、95、96、97、98或99%同一性(或100%同一性)的氨基酸序列。
任选地,所述细胞是艰难梭菌细胞。
9.任一前述陈述的核酸酶,其中所述核苷酸序列由编码以下的基因包含:
(a)σe;
(b)σf;
(c)σg;
(d)σh;
(e)σk;
(f)spo0a;
(g)spoiiid;
(h)spovt;或
(i)spoiir。
10.任一前述陈述的核酸酶,其中所述靶标核苷酸序列由选自表12至17和23中所述的基因的基因或其同源物、直向同源物或功能等效物包含。
任选地,所述宿主细胞是非艰难梭菌的物种的。
在一个实施方案中,所述同源物、直向同源物或等效物具有与选择的基因相同的功能或编码具有与由选择的基因编码的产物相同的功能的产物。
同源物:通过从共同祖先dna或蛋白序列遗传而与第二基因、核苷酸或蛋白序列相关的基因、核苷酸或蛋白序列。术语同源物可适用于通过基因复制的事件分开的基因之间的关系或通过基因复制的事件分开的基因之间的关系。
直向同源物:直向同源物是通过物种形成从共同祖先基因、核苷酸或蛋白序列进化而来的不同物种的基因、核苷酸或蛋白序列。通常,直向同源物在进化的过程中保留相同的功能。
11.任一前述陈述的核酸酶,其中所述靶标核苷酸序列由核苷酸序列包含,所述核苷酸序列与选自seqidno:220、222、224、226、228、229、232、234、236、238、240、242、244、246、248、250、252、254、256、258、259和260的序列具有至少80、85、90、95、96、97、98或99%同一性(或100%同一性)。
12.任一前述陈述的核酸酶,其中所述靶标序列编码氨基酸序列,所述氨基酸序列与选自seqidno:219、221、223、225、227、230、231、233、235、237、239、241、243、245、247、249、251、253、255和257的序列具有至少80、85、90、95、96、97、98或99%同一性(或100%同一性)。
13.任一前述陈述的核酸酶,其中所述靶标序列由spo0a、spoiiid、sigk、sigf、sigh、spo0a-p磷酸酶、spoiie、spoiiaa、spoiiab、spoiiga、sige、spoiir、sigg、spoiiia、spoiid、spoiiq、spoivb或ctpb基因包含。
14.任一前述陈述的核酸酶,其中所述宿主细胞是艰难梭菌细胞,且所述靶标序列由艰难梭菌utxa、毒素a或艰难梭菌毒素b基因包含。
15.任一前述陈述的核酸酶,其中所述宿主细胞是艰难梭菌细胞,且所述靶标序列由核苷酸序列包含,所述核苷酸序列由艰难梭菌cdu2、cdu1、tcdd、tcdb、tcde、tcda、tcdc、cdd1、cdd2、cdd3或cdd4基因包含。
16.任一前述陈述的核酸酶,其中所述靶标序列由i、ii、iii、iv或v期孢子形成基因包含,或编码孢子衣壳蛋白。
17.任一前述陈述的核酸酶,其中所述核酸酶与另外的核酸酶组合,其中所述另外的核酸酶经程序化以识别所述宿主细菌的另外的靶标核苷酸序列,由此所述另外的程序化的核酸酶能够修饰所述另外的核苷酸序列,其中任选地所述另外的核苷酸序列由靶基因包含,所述靶基因由宿主细胞中的σ因子介导的基因表达级联包含。
在一个实例中,所述核酸酶是数拷贝的相同类型的核酸酶,例如cas3或9。在一个实例中,所述核酸酶对所述宿主细胞是内源的(例如,内源的i型艰难梭菌cas核酸酶)。
18.陈述17的核酸酶,其中所述另外的靶标序列由陈述9至16中任一项中所述的基因或序列包含。
19.任一前述陈述的核酸酶,其中所述或每种核酸酶是宿主细胞的内源cas。
任选地,所述cas核酸酶、载体或系统由所述宿主细胞包含。
20.任一前述陈述的核酸酶,其中所述或每种核酸酶是由能够感染或转化宿主细胞的核酸载体(例如,噬菌体、噬菌粒或结合质粒)包含的cas。
21.任一前述陈述的核酸酶,其中所述或每种核酸酶是选自由核苷酸序列编码的cas的cas,所述核苷酸序列与选自seqidno:220、222、224、226、228、229、232、234、236、238、240、242、244、246、248、250、252、254、256、258、259和260的核苷酸序列具有至少70、75、80、85、90、95、96、97、98或99%同一性(或100%同一性)。
22.任一前述陈述的核酸酶,其中所述或每种核酸酶是选自包含氨基酸序列的cas的cas,所述氨基酸序列与选自seqidno:219、221、223、225、227、230、231、233、235、237、239、241、243、245、247、249、251、253、255和257的氨基酸序列具有至少70、75、80、85、90、95、96、97、98或99%同一性(或100%同一性)。
23.任一前述陈述的核酸酶,其中所述或每种核酸酶可与重复序列一起操作的cas,所述重复序列与选自seqidno:138-218(例如,选自seqidno:138-209)的重复序列具有至少70、75、80、85、90、95、96、97、98或99%同一性(或100%同一性),且任选地其中所述宿主细胞是艰难梭菌细胞。
24.任一前述陈述的核酸酶,其中所述宿主细胞是孢子形成细菌物种的细胞。
25.任一前述陈述的核酸酶,其中所述级联控制宿主细胞物种中的孢子形成。
26.任一前述陈述(例如,陈述24或25)的核酸酶,其中所述宿主细胞是厚壁菌门、梭菌属、梭菌目、消化链球菌科、clostridioides或芽孢杆菌属物种,例如表18中所述的艰难梭菌菌株。
在一个实施方案中,所述菌株选自630、atcc43255、cd3、r20291、cd69、cd002、cf5和m120。在一个实例中,所述菌株是艰难梭菌630。
27.任一前述陈述的核酸酶,其中所述修饰切割所述宿主细胞包含的染色体或附加体序列。
所述染色体或附加体序列包含靶标序列。
28.任一前述陈述的核酸酶,其中所述修饰杀死所述宿主细胞或降低所述细胞的生长或增殖。
29.任一前述陈述的核酸酶,其中所述核酸酶是体外的。
30.任一前述陈述的核酸酶,其中所述核酸酶是cas核酸酶(例如,cas3或9,或cpf1),其任选地用工程改造的crrna或指导rna(例如,单一grna)程序化。
31.任一前述陈述的核酸酶,其中所述核酸酶与编码所述核酸酶的核酸载体(例如,噬菌体或噬菌粒)和任选地用于程序化所述核酸酶的一种或多种rna组合。
32.陈述31的核酸酶,其中所述核酸酶是i型cas3,且所述载体编码一种或多种cascadecas(例如,casa、b、c、d和e和/或cas1或cas2),或所述载体与编码所述cascadecas的第二载体组合,其中所述cas3可与所述cascadecas一起操作以修饰所述靶标序列。
33.任一前述陈述的核酸酶,其中所述核酸酶是i型cas3,且在所述宿主细胞中与一种或多种cascadecas(例如,casa、b、c、d和e和/或cas1或cas2)组合,其中cascadecas中的一种或多种由所述宿主细胞的内源核苷酸序列编码,其中所述cas3可与所述cascadecas一起操作以修饰所述靶标序列。
34.任一前述陈述的核酸酶,其中所述核酸酶是i型cas(例如,i-b、-c或-e型cas,例如,cas3)。
任选地,所述核酸酶是cascadecas。
35.任一前述陈述的核酸酶,其中所述cas核酸酶(和任选地cascadecas)是大肠杆菌、艰难梭菌、肠道沙门氏菌或嗜热链球菌cas3。
36.任一前述陈述的核酸酶,其中所述核酸酶是cas核酸酶,其可作为宿主细胞中的宿主修饰(hm)-crlspr/cas系统的一部分操作,其中所述系统包含根据(i)至(iv)的组分:-
(i)至少一种编码cas核酸酶的核酸序列;
(ii)(a)工程改造的核酸序列,其包含间隔区序列和一个或多个编码hm-crrna的重复序列,其中所述间隔区包含与宿主细胞靶标序列杂交以将所述cas核酸酶指导至宿主细胞中的靶标以修饰靶标序列的序列;或(b)编码指导rna(例如,单一指导rna)的工程改造的核苷酸序列,其包含与所述宿主细胞靶标序列杂交以将所述cas核酸酶指导至宿主细胞中的靶标以修饰靶标序列的序列;
(iii)任选的tracrrna序列或表达tracrrna序列的dna序列;
(iv)其中组分(ii)由核酸载体包含,所述核酸载体能够转化宿主细胞,由此hm-crrna或指导rna将cas指导至靶标以修饰宿主细胞中的宿主靶标序列;且
其中所述靶标序列被cas核酸酶修饰,由此杀死宿主细胞或减少宿主细胞生长。
或者,所述cas核酸酶是dcasdcas,以阻遏宿主细胞中的靶标序列的转录或阻遏从宿主细胞中的靶标序列的转录。
任选地,所述方法包括将(iv)的载体引入宿主细胞和在宿主细胞中表达所述hm-crrna,允许hm-crna与宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞生长,由此改变细菌的混合群体中的所述亚群的相对比例。
37.陈述36的核酸酶,其与(iv)的所述载体组合。
38.陈述37的核酸酶,其中组分(i)由(iv)的载体或由不同的载体包含。
39.任一前述陈述的核酸酶,其中所述核酸酶由宿主细胞的内源核苷酸序列编码。
在本实施例中,所述宿主细胞包含内源核酸酶活性。
40.如陈述36至39中任一项中所定义的宿主修饰系统。
41.任一前述陈述的核酸酶或系统,其中核酸酶是cas核酸酶,且所述宿主包含编码所述cas核酸酶或其同源物或直向同源物的内源核苷酸序列,其中所述cas核酸酶在宿主细胞中可操作。
42.任一前述陈述的核酸酶或系统,其中所述核酸酶是cas核酸酶,且
(a)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与seqidno:273的氨基酸序列具有至少70%同一性,或者由与seqidno:738或274的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:273的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与选自seqidno:138-209的重复序列和包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam一起操作;或
(b)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与seqidno:261或263的氨基酸序列具有至少70%同一性,或者由与seqidno:262或264的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:261或263的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与选自seqidno:210-213的重复序列和包含awg、例如aag、agg、gag或atg或由其组成的pam一起操作;或
(c)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与seqidno:265的氨基酸序列具有至少70%同一性,或者由与seqidno:266的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:265的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与选自seqidno:215-218的重复序列和包含nnagaaw、nggng或aw、例如aa、at或ag或由其组成的pam一起操作;或
(d)所述cas核酸酶包含这样的氨基酸序列,所述氨基酸序列与seqidno:267或269的氨基酸序列具有至少70%同一性,或者由与seqidno:268或270的核苷酸序列具有至少70%同一性的核苷酸序列编码,或者是包含seqidno:267或269的氨基酸序列的cas的直向同源物或同源物,其中所述cas核酸酶可与重复序列seqidno:214一起操作。
43.任一前述陈述的核酸酶或系统,其中所述核酸酶是cas核酸酶且所述cas可与以下一起操作
(a)包含seqidno:的重复区和包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam;
(b)包含seqidno:的重复区和包含awg(例如,aag、agg、gag或atg)或由其组成的pam;或
(c)包含seqidno:的重复区和包含nnagaaw、nggng或aw(例如,aa、at或ag)或由其组成的pam。
本文的核苷酸序列以5’至3’方向书写。
任选地,所述系统包含被阻遏的cas且
(a)所述cas包含选自seqidno:58、60、66和68的氨基酸序列,或与选择的序列具有至少80%同一性的氨基酸序列,或者是其直向同源物或同源物,所述其直向同源物或同源物可与包含选自seqidno:49-52的序列的重复区和包含awg(例如,aag、agg、gag或atg)或由其组成的pam一起操作,其中任选地所述宿主细胞是大肠杆菌细胞;或
(b)所述cas包含选自seqidno:56、64、70和72的氨基酸序列,或与选择的序列具有至少80%同一性的氨基酸序列,或者是其直向同源物或同源物,所述其直向同源物或同源物可与包含seqidno:53的重复区一起操作,其中任选地所述宿主细胞是肠道沙门氏菌;或
(c)所述cas包含选自seqidno:62的氨基酸序列,或与选择的序列具有至少80%同一性的氨基酸序列,或者是其直向同源物或同源物,所述其直向同源物或同源物可与包含nnagaaw、nggng或aw(例如,aa、at或ag)或由其组成的pam一起操作,其中任选地所述宿主细胞是嗜热链球菌细胞。
任选地,所述系统包含被阻遏的cas且所述cas可与以下一起操作:
(a)包含选自seqidno:49-52的序列的重复区和包含awg(例如,aag、agg、gag或atg)或由其组成的pam,其中任选地所述宿主细胞是大肠杆菌细胞;
(b)包含seqidno:53的重复区,其中所述宿主细胞是肠道沙门氏菌;或
(c)包含nnagaaw、nggng或aw(例如,aa、at或ag)或由其组成的pam,其中任选地所述宿主细胞是嗜热链球菌细胞。
任选地,所述系统包含被阻遏的cas且所述cas可与以下一起操作:
(a)包含awg(例如,aag、agg、gag或atg)或由其组成的pam,且任选地所述cas核酸酶包含选自seqidno:58、60、66和68的氨基酸序列或与选择的序列具有至少80%同一性的氨基酸序列,其中任选地所述宿主细胞是大肠杆菌细胞;或
(b)包含nnagaaw、nggng或aw(例如,aa、at或ag)或由其组成的pam,且任选地所述cas核酸酶包含选自seqidno:62的氨基酸序列或与选择的序列具有至少80%同一性的氨基酸序列,其中任选地所述宿主细胞是嗜热链球菌细胞。
任选地,所述原间隔区包含在宿主细胞的基因组中的所述pam的紧邻3’的至少5、6、7、8、9或10个连续核苷酸的序列。
任选地,所述原间隔区包含在宿主细胞的基因组中的所述pam的紧邻5’的至少5、6、7、8、9或10个连续核苷酸的序列。
44.任一前述陈述的核酸酶或系统,其中所述核酸酶是cas核酸酶且所述cas可与以下一起操作
(a)包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam,且任选地所述cas核酸酶是i-b型cas和/或包含seqidno:273的氨基酸序列,或者是其直向同源物或同源物;
(b)包含awg(例如,aag、agg、gag或atg)或由其组成的pam,且任选地所述cas核酸酶包含seqidno:261或263的氨基酸序列,或者是其直向同源物或同源物;
(c)包含nnagaaw、nggng或aw(例如,aa、at或ag)或由其组成的pam,且任选地所述cas核酸酶是i-b型cas和/或包含seqidno:266的氨基酸序列,或者是其直向同源物或同源物。
45.根据以下的核酸酶或系统
(a)陈述42(a)、43(a)或44(a),其中所述宿主细胞是艰难梭菌细胞,任选地,所述细胞包含选自seqidno:138-209的重复序列和在所述或每种重复序列5’的包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam;
(b)陈述42(b)、43(b)或44(b),其中所述宿主细胞是大肠杆菌细胞;
(c)陈述42(c)、43(c)或44(c),其中所述宿主细胞是嗜热链球菌细胞;或
(d)陈述42(d),其中所述宿主细胞是肠道沙门氏菌细胞。
任选地,所述cas是i-b型cas或所述系统是i-b型系统。
46.根据陈述42至45中任一项的核酸酶或系统,其中所述靶标核苷酸序列包含所述pam的紧邻3’的至少5、10、15、20、25、30、35、40、45、50、55、60、65或70个连续核苷酸的序列,其中所述pam由所述宿主细胞的染色体或附加体包含,或由选自seqidno:220、222、224、226、228、229、232、234、236、238、240、242、244、246、248、250、252、254、256、258、259和260的序列包含。
参考本文公开的任何核苷酸序列,本发明还提供了所述靶标核苷酸序列包含在本文公开的pam的紧邻3’或5’的连续的5、10、15、20、30、40或50个核苷酸或由其组成,其中所述pam由参考序列包含。所有此类靶标序列都包括在本说明书中,如同在本文中分开书写或者由本文公开的参考序列的全部或部分侧接核苷酸序列包含一样。
47.根据任一前述陈述的核酸酶或系统,其中所述核酸酶是cas核酸酶,且
(a)
(a)所述宿主细胞任选地是艰难梭菌细胞;
(b)所述cas如陈述42(a)、43(a)或44(a)中所述;
(c)其中所述cas可与如陈述42(a)或43(a)中所述的重复区一起操作;
(d)且所述靶标核苷酸序列包含如陈述42(a)、43(a)或44(a)中所述的pam的紧邻3’的至少5、10、15、20、25、30、35、40、45、50、55、60、65或70个连续核苷酸的序列;或
(b)
(e)所述宿主细胞任选地是大肠杆菌细胞;
(f)所述cas如陈述42(b)、43(b)或44(b)中所述;
(g)其中所述cas可与如陈述42(b)或43(b)中所述的重复区一起操作;
(h)且所述靶标核苷酸序列包含如陈述42(b)、43(b)或44(b)中所述的pam的紧邻3’的至少5、10、15、20、25、30、35、40、45、50、55、60、65或70个连续核苷酸的序列;或
(c)
(i)所述宿主细胞任选地是嗜热链球菌细胞;
(j)所述cas如陈述42(c)、43(c)或44(c)中所述;
(k)其中所述cas可与如陈述42(c)或43(c)中所述的重复区一起操作;
(l)且所述靶标核苷酸序列包含如陈述42(c)、43(c)或44(c)中所述的pam的紧邻3’的至少5、10、15、20、25、30、35、40、45、50、55、60、65或70个连续核苷酸的序列。
48.根据任一前述陈述1至29和31的核酸酶或系统,其中所述核酸酶是talen、大范围核酸酶或锌指核酸酶。
49.载体、核酸或hm-cr1spr阵列,其包含用于根据陈述40至47中任一项的系统中的工程改造的核苷酸序列,其中所述工程改造的核苷酸序列如陈述36(ii)中所定义;和/或编码根据任一前述陈述的核酸酶。
50.陈述49的载体,其中所述载体是噬菌体、噬菌粒或质粒(例如,结合质粒)。
51.用于治疗或预防人或动物受试者中的疾病或病况的药物,所述药物包含任一前述陈述的核酸酶、系统、载体、核酸或阵列,其用于施用于所述受试者以治疗或预防所述疾病或病况。
52.陈述51的药物,其用于治疗受试者的艰难梭菌感染,其中所述宿主细胞是艰难梭菌宿主细胞,例如选自表18中的菌株的菌株的艰难梭菌宿主细胞。
53.核酸分子,其编码或包含核酸序列(例如,rna、crrna或单一grna序列),其能够在宿主细菌或古细菌细胞中与陈述1至39和41至48中任一项的核酸酶组合以指导核酸酶识别和修饰所述细胞的靶标序列。
54.陈述34的核酸,其中所述核酸酶是cas,且所述核酸编码或是rna、crrna或单一grna,任选地包含,其中所述rna、crrna或单一grna包含一个或两个重复序列,所述重复序列各自与选自seqidno:138-218(例如,选自seqidno:138-209)的重复序列具有至少70、75、80、85、90、95、96、97、98或99%同一性(或100%同一性),且任选地其中所述宿主细胞是艰难梭菌细胞。
55.核酸载体(例如,噬菌体、病毒、噬菌粒、质粒或结合质粒),其包含陈述53或54中所述的核酸或核酸序列。
56.陈述53至55中任一项的核酸或载体,其用于治疗或预防人或动物受试者中的疾病或病况。
57.用于修饰由混合细菌或古细菌群体包含的多种宿主细胞的方法,其中所述群体包含(i)第一物种或菌株的细菌或古细菌细胞的第一亚群,和(ii)包含所述多种宿主细胞的细胞的第二亚群,其中所述第一细胞不包含靶标序列,且所述核酸酶能够修饰所述混合群体的宿主细胞,但不能修饰第一细胞,所述方法包括组合所述混合群体与陈述1至39和41至56中任一项的核酸酶、载体、核酸、阵列或药物,由此形成陈述40至48中任一项的系统,由此所述核酸酶修饰由宿主细胞包含的靶标序列,由此修饰或杀死宿主细胞。
在一个实例中,本发明用于治疗或预防包含所述混合群体的人或非人动物中的疾病或病况,其中所述疾病或病况由所述宿主细胞物种或菌株的细菌介导或引起。
58.陈述57的方法,其中所述宿主细胞包含如陈述42至45中任一项中所定义的pam,其中所述靶标核苷酸序列包含所述pam的紧邻3’的至少5、10、15、20、25、30、35、40、45、50、55、60、65或70个连续核苷酸的序列,其中所述pam由宿主细胞的染色体或附加体包含,其中所述靶标序列由选自seqidno220、222、224、226、228、229、232、234、236、238、240、242、244、246、248、250、252、254、256、258、259和260的序列包含。
59.陈述57或58的方法,其用于处理工业或离体医疗流体、表面、设备或容器;或用于处理水道、水、饮料、食品或化妆品,其中所述宿主细胞由流体、表面、设备、容器、水道、水、饮料、食品或化妆品包含或在流体、表面、设备、容器、水道、水、饮料、食品或化妆品上。
任选地,细胞选自选自表25的物种的物种的细胞。
段落:本发明还提供了以下段落中的概念。
1.治疗人或非人动物受试者中的梭菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含梭菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述梭菌物种,
各宿主细胞包含
(a)包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是选自seqidno:138-209的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中所述系统任选地包含tracrrna序列或表达tracrrna序列的dna序列;
其中表达的hm-crrna与cascadecas和包含seqidno:273的氨基酸序列或由seqidno:738或274的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的梭菌感染。
任选地,在本发明的方法、阵列、序列或其他配置中的替代方案中,所述cas3包含与选自seqidno:275-286的序列相同的氨基酸序列,或包含与所述选择的序列具有至少70、75、80、85、90、95、96、97、98或99%同一性的氨基酸序列。在一个实例中,所述同一性是至少80%。在一个实例中,所述同一性是至少85%。在一个实例中,所述同一性是至少90%。在一个实例中,所述同一性是至少95%。在一个替代方案中,所述cas3氨基酸序列包含来自所述选择的序列的一个或多个氨基酸改变,例如,所述改变由1、2、3、4、5、6、7、8、9、10、11、12或13个改变组成。任选地,所述改变是氨基酸取代和/或缺失。
任选地,在本发明的方法、阵列、序列或其他配置中的替代方案中,所述重复区包含与所述选择的序列相同的核苷酸序列,或包含与所述选择的序列具有至少70、75、80、85、90、95、96、97、98或99%同一性的核苷酸序列。在一个实例中,所述同一性是至少80%。在一个实例中,所述同一性是至少85%。在一个实例中,所述同一性是至少90%。在一个实例中,所述同一性是至少95%。在一个替代方案中,所述重复序列包含来自所述选择的序列的一个或多个核苷酸改变,例如,所述改变由1、2、3、4、5、6、7、8、9、10、11、12或13个改变组成。任选地,所述改变是核苷酸取代和/或缺失。
任选地,所述宿主细胞是梭菌宿主细胞。
2.段落1的方法,其中所述靶标核苷酸序列由选自seqidno:220、222、224、226、228、229、232、234、236、238、240、242、244、246、248、250、252、254、256、258、259和260的序列包含。
3.段落1或2的方法,其中所述靶标核苷酸序列由基因包含,所述基因由宿主细胞中的σ因子介导的基因表达级联包含。
4.任一前述段落的方法,其中所述靶标核苷酸序列由基因包含,所述基因的转录在宿主细胞物种中由σ因子直接或间接地控制。
5.任一前述段落的方法,其中所述靶标序列的转录在宿主细胞物种的细胞中通过如下控制:
(a)σe;
(b)σf;
(c)σg;
(d)σh;
(e)σk;
(f)spo0a;
(g)spoiiid;
(h)spovt;或
(i)spoiir。
6.任一前述段落的方法,其中所述靶标核苷酸序列由基因包含,所述基因编码在宿主细胞物种中直接或间接地控制σ因子的转录的产物。
7.段落3至6中任一项的方法,其中所述σ因子是σe;σf;σg;σh;或σk。
8.段落3至7中任一项的方法,其中所述σ因子包含与选自seqidno:223、225、227、239和243的氨基酸序列具有至少80%同一性的氨基酸序列。
9.任一前述段落的方法,其中所述靶标核苷酸序列由选自表12至17和23中所述的基因的基因或其同源物、直向同源物或功能等效物包含。
10.任一前述段落的方法,其中所述靶标序列由i、ii、iii、iv或v期孢子形成基因包含,或编码孢子衣壳蛋白。
11.任一前述段落的方法,其中所述pam和靶标序列是宿主细胞的染色体序列。
12.段落1至10中任一项的方法,其中所述pam和靶标序列是宿主细胞的附加体序列。
13.任一前述段落的方法,其中所述cas3和/或cascadecas是宿主细胞的内源cas。
14.任一前述段落的方法,其中步骤(e)包括向所述受试者施用编码所述cas3和/或cascadecas的核酸。
15.任一前述段落的方法,其中步骤(e)包括向所述受试者施用包含所述工程改造的序列的多种核酸载体,其中所述载体是病毒、噬菌体、噬菌粒或质粒(例如,结合质粒)。
16.任一前述段落的方法,其中步骤(e)包括向所述受试者施用包含所述工程改造的序列的多种载体细菌细胞,任选地其中所述载体细菌细胞是乳杆菌细胞。
17.段落16的方法,其中所述载体细胞是罗伊氏乳杆菌细胞。
18.治疗人或非人动物受试者中的大肠杆菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含多种大肠杆菌宿主细胞的细胞的第二亚群,其中所述第一物种不是大肠杆菌,
各宿主细胞包含
(a)包含awg(例如,aag、agg、gag或atg)或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,
所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是选自seqidno:210-213的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中所述系统任选地包含tracrrna序列或表达tracrrna序列的dna序列;
其中表达的hm-crrna与cascadecas和包含seqidno:261或263的氨基酸序列或由seqidno:262或264的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的大肠杆菌感染。
任选地,在本发明的方法、阵列、序列或其他配置中的替代方案中,所述cas3包含与选自seqidno:287-289的序列相同的氨基酸序列,或包含与所述选择的序列具有至少70、75、80、85、90、95、96、97、98或99%同一性的氨基酸序列。在一个实例中,所述同一性是至少80%。在一个实例中,所述同一性是至少85%。在一个实例中,所述同一性是至少90%。在一个实例中,所述同一性是至少95%。在一个替代方案中,所述cas3序列包含来自所述选择的序列的一个或多个氨基酸改变,例如,所述改变由1、2、3、4、5、6、7、8、9、10、11、12或13个改变组成。任选地,所述改变是氨基酸取代和/或缺失。
任选地,在本发明的方法、阵列、序列或其他配置中的替代方案中,所述重复区包含与所述选择的序列相同的核苷酸序列,或包含与所述选择的序列具有至少70、75、80、85、90、95、96、97、98或99%同一性的核苷酸序列。在一个实例中,所述同一性是至少80%。在一个实例中,所述同一性是至少85%。在一个实例中,所述同一性是至少90%。在一个实例中,所述同一性是至少95%。在一个替代方案中,所述重复序列包含来自所述选择的序列的一个或多个核苷酸改变,例如,所述改变由1、2、3、4、5、6、7、8、9、10、11、12或13个改变组成。任选地,所述改变是核苷酸取代和/或缺失。
在这些选项中的任一种的替代方案中,所述宿主细胞反而是沙门氏菌、肠道沙门氏菌或肠道沙门氏菌鼠伤寒血清变型细胞。大肠杆菌和沙门氏菌有些相关,且因此,在该替代方案中,在沙门氏菌宿主中使用大肠杆菌重复区。
19.段落18的方法,其中所述cas3和/或cascadecas是宿主细胞的内源cas。
20.段落18或19的方法,其中步骤(e)包括向所述受试者施用编码所述cas3和/或cascadecas的核酸。
21.段落18、19或20的方法,其中所述靶标核苷酸序列由基因包含,所述基因由宿主细胞中的σ因子介导的基因表达级联包含。
22.段落18至21中任一项的方法,其中所述靶标核苷酸序列由基因包含,所述基因的转录在宿主细胞物种中由σ因子直接或间接地控制。
23.段落18至23中任一项的方法,其中所述靶标核苷酸序列由基因包含,所述基因编码在宿主细胞物种中直接或间接地控制σ因子的转录的产物。
24.段落18至23中任一项的方法,其中所述σ因子是σe;σf;σg;σh;或σk。
25.段落18至24中任一项的方法,其中所述靶标核苷酸序列由选自表12至17和23中所述的基因的基因或其同源物、直向同源物或功能等效物包含。
26.段落18至25中任一项的方法,其中所述pam和靶标序列是宿主细胞的染色体序列。
27.段落18至25中任一项的方法,其中所述pam和靶标序列是宿主细胞的附加体序列。
28.段落18至27中任一项的方法,其中步骤(e)包括向所述受试者施用包含所述工程改造的序列的多种核酸载体,其中所述载体是病毒、噬菌体、噬菌粒或质粒(例如,结合质粒)。
29.段落18至28中任一项的方法,其中步骤(e)包括向所述受试者施用包含所述工程改造的序列的多种载体细菌细胞,任选地其中所述载体细菌细胞是乳杆菌细胞。
30.段落29的方法,其中所述载体细胞是罗伊氏乳杆菌细胞。
31.治疗人或非人动物受试者中的链球菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含链球菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述链球菌物种,
各宿主细胞包含
(a)包含nnagaaw、nggng或aw(例如,aa、at或ag)或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,
所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是选自seqidno:215-218的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中所述系统任选地包含tracrrna序列或表达tracrrna序列的dna序列;
其中表达的hm-crrna与cascadecas和包含seqidno:265的氨基酸序列或由seqidno:266的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的链球菌感染。
32.段落31的方法,其中所述cas3和/或cascadecas是宿主细胞的内源cas。
33.段落31或32的方法,其中步骤(e)包括向所述受试者施用编码所述cas3和/或cascadecas的核酸。
34.段落31、32或33的方法,其中所述靶标核苷酸序列由基因包含,所述基因由宿主细胞中的σ因子介导的基因表达级联包含。
35.段落31至34中任一项的方法,其中所述靶标核苷酸序列由基因包含,所述基因的转录在宿主细胞物种中由σ因子直接或间接地控制。
36.段落31至35中任一项的方法,其中所述靶标核苷酸序列由基因包含,所述基因编码在宿主细胞物种中直接或间接地控制σ因子的转录的产物。
37.段落35或36的方法,其中所述σ因子是σe;σf;σg;σh;或σk。
38.段落31至37中任一项的方法,其中所述靶标核苷酸序列由选自表12至17和23中所述的基因的基因或其同源物、直向同源物或功能等效物包含。
39.段落31至38中任一项的方法,其中所述pam和靶标序列是宿主细胞的染色体序列。
40.段落31至38中任一项的方法,其中所述pam和靶标序列是宿主细胞的附加体序列。
41.段落31至40中任一项的方法,其中步骤(e)包括向所述受试者施用包含所述工程改造的序列的多种核酸载体,其中所述载体是病毒、噬菌体、噬菌粒或质粒(例如,结合质粒)。
42.段落31至41中任一项的方法,其中步骤(e)包括向所述受试者施用包含所述工程改造的序列的多种载体细菌细胞,任选地其中所述载体细菌细胞是乳杆菌细胞。
43.段落42的方法,其中所述载体细胞是罗伊氏乳杆菌细胞。
44.治疗人或非人动物受试者中的沙门氏菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含沙门氏菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述沙门氏菌物种,
各宿主细胞包含
(a)pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,
所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是seqidno:214;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中所述系统任选地包含tracrrna序列或表达tracrrna序列的dna序列;
其中表达的hm-crrna与cascadecas和包含seqidno:267或269的氨基酸序列或由seqidno:268或270的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的沙门氏菌感染。
45.段落44的方法,其中所述cas3和/或cascadecas是宿主细胞的内源cas。
46.段落44或45的方法,其中步骤(e)包括向所述受试者施用编码所述cas3和/或cascadecas的核酸。
47.段落44、45或46的方法,其中所述靶标核苷酸序列由基因包含,所述基因由宿主细胞中的σ因子介导的基因表达级联包含。
48.段落44至47中任一项的方法,其中所述靶标核苷酸序列由基因包含,所述基因的转录在宿主细胞物种中由σ因子直接或间接地控制。
49.段落44至48中任一项的方法,其中所述靶标核苷酸序列由基因包含,所述基因编码在宿主细胞物种中直接或间接地控制σ因子的转录的产物。
50.段落48或49的方法,其中所述σ因子是σe;σf;σg;σh;或σk。
51.段落44至50中任一项的方法,其中所述靶标核苷酸序列由选自表12至17和23中所述的基因的基因或其同源物、直向同源物或功能等效物包含。
52.段落44至51中任一项的方法,其中所述pam和靶标序列是宿主细胞的染色体序列。
53.段落44至51中任一项的方法,其中所述pam和靶标序列是宿主细胞的附加体序列。
54.段落44至53中任一项的方法,其中步骤(e)包括向所述受试者施用包含所述工程改造的序列的多种核酸载体,其中所述载体是病毒、噬菌体、噬菌粒或质粒(例如,结合质粒)。
55.段落44至54中任一项的方法,其中步骤(e)包括向所述受试者施用包含所述工程改造的序列的多种载体细菌细胞,任选地其中所述载体细菌细胞是乳杆菌细胞。
56.段落55的方法,其中所述载体细胞是罗伊氏乳杆菌细胞。
57.用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是梭菌细胞(例如,如段落1至17中任一项中所定义),所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:138-209的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam的紧邻3’;
(b)任选的tracrrna序列或表达tracrrna序列的dna序列;
(c)cascadecas;和
(d)包含seqidno:273的氨基酸序列的cas3,或用于在宿主细胞中表达cas3的包含seqidno:738或274的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
58.用于段落57的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3包含seqidno:273的氨基酸序列,或由包含seqidno:738或274的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:138-209的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam的紧邻3’。
任选地,本文的工程改造的核苷酸序列是dna序列。任选地,本文的工程改造的核苷酸序列是rna序列。
59.用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是大肠杆菌细胞(例如,如段落18至30中任一项中所定义),所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:210-213的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含awg(例如,aag、agg、gag或atg)或由其组成的pam的紧邻3’;
(b)任选的tracrrna序列或表达tracrrna序列的dna序列;
(c)cascadecas;和
(d)包含seqidno:261或263的氨基酸序列的cas3,或用于在宿主细胞中表达cas3的包含seqidno:262或264的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
60.用于段落59的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3包含seqidno:261或263的氨基酸序列,或由包含seqidno:262或264的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:210-213的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含awg(例如,aag、agg、gag或atg)或由其组成的pam的紧邻3’。
61.用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是链球菌细胞(例如,如段落31至43中任一项中所定义),所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:215-218的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含nnagaaw、nggng或aw(例如,aa、at或ag)或由其组成的pam的紧邻3’;
(b)任选的tracrrna序列或表达tracrrna序列的dna序列;
(c)cascadecas;和
(d)包含seqidno:265的氨基酸序列的cas3,或用于在宿主细胞中表达cas3的包含seqidno:266的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
62.用于段落61的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3包含seqidno:265的氨基酸序列,或由包含seqidno:266的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:215-218的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含nnagaaw、nggng或aw(例如,aa、at或ag)或由其组成的pam的紧邻3’。
63.用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是沙门氏菌细胞(例如,如段落44至56中任一项中所定义),所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(iii)一个或多个重复序列,其中所述重复序列是seqidno:214;和
(iv)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列;
(b)任选的tracrrna序列或表达tracrrna序列的dna序列;
(c)cascadecas;和
(d)包含seqidno:267或269的氨基酸序列的cas3,或用于在宿主细胞中表达cas3的包含seqidno:268或270的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
64.用于段落63的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3包含seqidno:267或269的氨基酸序列,或由包含seqidno:268或270的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是seqidno:214;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列。
65.段落57至64中任一项的系统或工程改造的序列,其中各crrna由单一指导rna(单一grna)包含,其中单一grna包含tracrrna序列。
66.段落57至65中任一项的系统或工程改造的序列,其中所述工程改造的序列由核酸载体(例如病毒、噬菌体、噬菌粒、质粒或接合质粒)包含。
67.段落57至66中任一项的系统或工程改造的序列,其中数拷贝的所述工程改造的序列由多种载体细菌包含,任选地其中所述载体细菌细胞是乳杆菌细胞。
68.段落67的系统或工程改造的序列,其中所述载体细胞是罗伊氏乳杆菌细胞。
69.如段落67或68中所定义的多种载体细菌细胞,其用于施用于人或动物受试者用于治疗或预防所述受试者中的所述宿主细胞的感染,其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长,由此降低所述受试者中的所述宿主细胞的比例和治疗所述受试者中的宿主细胞感染。
70.段落57至68中任一项的系统或工程改造的序列,其用于治疗或预防人或动物受试者中的所述宿主细胞的感染,其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长,由此降低所述受试者中的所述宿主细胞的比例和治疗所述受试者中的宿主细胞感染。
71.药物组合物,其包含段落57至70中任一项的工程改造的序列或多种细菌细胞以及药学上可接受的稀释剂或赋形剂。
条款:在一个实例中,本发明提供了以下条款:-
1.用于杀死宿主细胞或减少宿主细胞的生长的宿主修饰(hm)-cr1spr/cas系统,其中所述宿主细胞是梭菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(iii)一个或多个重复序列;和
(iv)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam的紧邻3’;
(b)cascadecas;和
(c)cas3或用于在宿主细胞中表达cas3的编码cas3的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
在条款1的一个实例中,提供了:-
用于杀死宿主细胞或减少宿主细胞的生长的宿主修饰(hm)-cr1spr/cas系统,
其中所述宿主细胞是梭菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:138-209和290-513的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam的紧邻3’;
(b)cascadecas;和
(c)包含选自seqidno:273和275-286的氨基酸序列的cas3,或用于在宿主细胞中表达cas3的包含seqidno:738或274的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
在一个实例中,所述宿主细胞是菌株o27、002、017、018、027、078、244或1420细胞。
任选地,所述重复序列是seqidno:213,且所述cas3包含seqidno:261的氨基酸序列,例如,其中所述宿主细胞是艰难梭菌的高毒力菌株,诸如菌株o27、002、017、018、027、078、244或1420。
2.用于条款1的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam的紧邻3’。
在一个实例中,条款2提供了:-
用于条款1的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3包含选自seqidno:273和275-286的氨基酸序列,或由包含seqidno:738或274的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:138-209和290-513的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam的紧邻3’。
3.任一前述条款的系统或工程改造的序列,其中所述cas3包含选自seqidno:273和275-286的氨基酸序列或与所述选择的序列具有至少70%同一性的序列。
4.任一前述条款的系统或工程改造的序列,其中(i)的重复序列是选自seqidno:138-209和290-513的重复序列;或与所述选择的序列具有至少70%同一性的序列。
5.条款4的系统或工程改造的序列,其中所述重复序列是选自以下的重复序列:
(a)seqidno:138-146或496-513,任选地其中所述宿主细胞是艰难梭菌r20291菌株细胞和/或所述cas3是所述菌株的cas3和/或所述cas3是所述菌株的cas3;或
(b)seqidno:147-158、290-306或370-384,任选地其中所述宿主细胞是艰难梭菌630菌株细胞和/或所述cas3是所述菌株的cas3;或
(c)seqidno:159-166,任选地其中所述宿主细胞是艰难梭菌atcc45233菌株细胞和/或所述cas3是所述菌株的cas3;或
(d)seqidno:167-175,任选地其中所述宿主细胞是艰难梭菌bi-9菌株细胞和/或所述cas3是所述菌株的cas3;或
(e)seqidno:176-181或470-476,任选地其中所述宿主细胞是艰难梭菌m120菌株细胞和/或所述cas3是所述菌株的cas3;或
(f)seqidno:182-187,任选地其中所述宿主细胞是艰难梭菌cf5菌株细胞和/或所述cas3是所述菌株的cas3;或
(g)seqidno:188-194,任选地其中所述宿主细胞是艰难梭菌cd002菌株细胞和/或所述cas3是所述菌株的cas3;或
(h)seqidno:195-201,任选地其中所述宿主细胞是艰难梭菌cd3菌株细胞和/或所述cas3是所述菌株的cas3;或
(i)seqidno:202-209,任选地其中所述宿主细胞是艰难梭菌cd69菌株细胞和/或所述cas3是所述菌株的cas3;或
(j)seqidno:351-369,任选地其中所述宿主细胞是艰难梭菌2007855菌株细胞和/或所述cas3是所述菌株的cas3;或
(k)seqidno:385-419,任选地其中所述宿主细胞是艰难梭菌bi1菌株细胞和/或所述cas3是所述菌株的cas3;或
(l)seqidno:420-434,任选地其中所述宿主细胞是艰难梭菌bi9菌株细胞和/或所述cas3是所述菌株的cas3;或
(m)seqidno:435-452,任选地其中所述宿主细胞是艰难梭菌cd196菌株细胞和/或所述cas3是所述菌株的cas3;或
(n)seqidno:420-434,任选地其中所述宿主细胞是艰难梭菌bi9菌株细胞和/或所述cas3是所述菌株的cas3;或
(o)seqidno:453-468,任选地其中所述宿主细胞是艰难梭菌cf5菌株细胞和/或所述cas3是所述菌株的cas3;或
(p)seqidno:477-495,任选地其中所述宿主细胞是艰难梭菌m68菌株细胞和/或所述cas3是所述菌株的cas3。
6.任一前述条款的系统或工程改造的序列,其中所述靶标核苷酸序列由选自seqidno:220、222、224、226、228、229、232、234、236、238、240、242、244、246、248、250、252、254、256、258、259和260的序列包含。
7.条款1至5中任一项的系统或工程改造的序列,其中所述靶标核苷酸序列由基因包含,所述基因由宿主细胞中的σ因子介导的基因表达级联包含。
8.任一前述条款的系统或工程改造的序列,其中所述靶标序列的转录在宿主细胞物种的细胞中通过如下控制:
(a)σe;
(b)σf;
(c)σg;
(d)σh;
(e)σk;
(f)spo0a;
(g)spoiiid;
(h)spovt;或
(i)spoiir。
9.任一前述条款的系统或工程改造的序列,其中所述靶标核苷酸序列由基因包含,所述基因编码在宿主细胞物种中直接或间接地控制σ因子的转录的产物。
10.任一前述条款的系统或工程改造的序列,其中所述靶标核苷酸序列由选自表12至17和23中所述的基因的基因或其同源物、直向同源物或功能等效物包含。
11.任一前述条款的系统或工程改造的序列,其中所述靶标序列由i、ii、iii、iv或v期孢子形成基因包含,或编码孢子衣壳蛋白。
12.用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是大肠杆菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(iii)一个或多个重复序列;和
(iv)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含awg或由其组成的pam的紧邻3’;
(b)cascadecas;和
(c)cas3或用于在宿主细胞中表达cas3的编码cas3的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
任选地,所述重复序列是seqidno:213,且所述cas3包含seqidno:261的氨基酸序列,例如,其中所述宿主细胞是大肠杆菌o157:h7细胞。在一个实例中,条款12提供了:-
用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是大肠杆菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:210-213和514-731的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含awg或由其组成的pam的紧邻3’;
(b)cascadecas;和
(c)包含选自seqidno:261、263和287-289的氨基酸序列的cas3,或用于在宿主细胞中表达cas3的包含seqidno:262或264的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
13.用于条款12的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3包含选自seqidno:261、263和287-289的氨基酸序列,或由包含seqidno:262或264的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,任选地其中所述重复序列是选自seqidno:210-213和514-731的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含awg或由其组成的pam的紧邻3’。
在一个实例中,条款13提供了:-
用于条款12的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3包含选自seqidno:261、263和287-289的氨基酸序列,或由包含seqidno:262或264的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:210-213和514-731的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含awg或由其组成的pam的紧邻3’。
14.条款12的系统或条款13的工程改造的序列,其中所述cas3包含选自seqidno:261、263和287-289的氨基酸序列或与所述选择的序列具有至少70%同一性的序列。
15.条款12至14中任一项的系统或工程改造的序列,其中所述重复序列是选自seqidno:210-213和514-731的重复序列,或与所述选择的序列具有至少70%同一性的序列。
16.条款15的系统或工程改造的序列,其中所述重复序列是选自以下的重复序列:
(a)seqidno:210-212或691-695,任选地其中所述宿主细胞是大肠杆菌k12菌株细胞和/或所述cas3是所述菌株的cas3;或
(b)seqidno:213、677或678,任选地其中所述宿主细胞是大肠杆菌o157:h7菌株细胞和/或所述cas3是所述菌株的cas3;或
(c)seqidno:514-518,任选地其中所述宿主细胞是大肠杆菌042菌株细胞和/或所述cas3是所述菌株的cas3;或
(d)seqidno:519-521,任选地其中所述宿主细胞是大肠杆菌1303菌株细胞和/或所述cas3是所述菌株的cas3;或
(e)seqidno:522-527,任选地其中所述宿主细胞是大肠杆菌536菌株细胞和/或所述cas3是所述菌株的cas3;或
(f)seqidno:528或529,任选地其中所述宿主细胞是大肠杆菌55989菌株细胞和/或所述cas3是所述菌株的cas3;或
(g)seqidno:530-532,任选地其中所述宿主细胞是大肠杆菌acn001菌株细胞和/或所述cas3是所述菌株的cas3;或
(h)seqidno:533-545,任选地其中所述宿主细胞是大肠杆菌apec菌株细胞和/或所述cas3是所述菌株的cas3;或
(i)seqidno:533-537,任选地其中所述宿主细胞是大肠杆菌apecimt5155菌株细胞和/或所述cas3是所述菌株的cas3;或
(j)seqidno:538-542,任选地其中所述宿主细胞是大肠杆菌apeco1菌株细胞和/或所述cas3是所述菌株的cas3;或
(k)seqidno:543-545,任选地其中所述宿主细胞是大肠杆菌apeco78菌株细胞和/或所述cas3是所述菌株的cas3;或
(l)seqidno:546-560,任选地其中所述宿主细胞是大肠杆菌b菌株细胞和/或所述cas3是所述菌株的cas3;或
(m)seqidno:556-560,任选地其中所述宿主细胞是大肠杆菌brel606菌株细胞和/或所述cas3是所述菌株的cas3;或
(n)seqidno:561-574,任选地其中所述宿主细胞是大肠杆菌bl21菌株细胞和/或所述cas3是所述菌株的cas3;或
(o)seqidno:575-578,任选地其中所述宿主细胞是大肠杆菌bw25113菌株细胞和/或所述cas3是所述菌株的cas3;或
(p)seqidno:579-582,任选地其中所述宿主细胞是大肠杆菌bw2592菌株细胞和/或所述cas3是所述菌株的cas3;或
(q)seqidno:583-588,任选地其中所述宿主细胞是大肠杆菌c(例如,attc8739)菌株细胞和/或所述cas3是所述菌株的cas3;或
(r)seqidno:589-597,任选地其中所述宿主细胞是大肠杆菌dh1菌株细胞和/或所述cas3是所述菌株的cas3;或
(s)seqidno:598-600,任选地其中所述宿主细胞是大肠杆菌e24377a菌株细胞和/或所述cas3是所述菌株的cas3;或
(t)seqidno:601-603,任选地其中所述宿主细胞是大肠杆菌ecc-1470菌株细胞和/或所述cas3是所述菌株的cas3;或
(u)seqidno:604-608,任选地其中所述宿主细胞是大肠杆菌ed1a菌株细胞和/或所述cas3是所述菌株的cas3;或
(v)seqidno:609-612,任选地其中所述宿主细胞是大肠杆菌er2796菌株细胞和/或所述cas3是所述菌株的cas3;或
(w)seqidno:613-618,任选地其中所述宿主细胞是大肠杆菌etec(例如,h10407)菌株细胞和/或所述cas3是所述菌株的cas3;或
(x)seqidno:644-667,任选地其中所述宿主细胞是大肠杆菌lf82菌株细胞和/或所述cas3是所述菌株的cas3;或
(y)seqidno:668-670,任选地其中所述宿主细胞是大肠杆菌ly180菌株细胞和/或所述cas3是所述菌株的cas3;或
(z)seqidno:671-673,任选地其中所述宿主细胞是大肠杆菌o104:h4菌株细胞和/或所述cas3是所述菌株的cas3;或
(aa)seqidno:674-676,任选地其中所述宿主细胞是大肠杆菌o111:h(例如,1128)菌株细胞和/或所述cas3是所述菌株的cas3;或
(bb)seqidno:679-684,任选地其中所述宿主细胞是大肠杆菌p12b菌株细胞和/或所述cas3是所述菌株的cas3;或
(cc)seqidno:685,任选地其中所述宿主细胞是大肠杆菌pcn033菌株细胞和/或所述cas3是所述菌株的cas3;或
(dd)seqidno:686-689,任选地其中所述宿主细胞是大肠杆菌pcn061菌株细胞和/或所述cas3是所述菌株的cas3;或
(ee)seqidno:690,任选地其中所述宿主细胞是大肠杆菌sececsms-3-5菌株细胞和/或所述cas3是所述菌株的cas3;或
(ff)seqidno:691-695,任选地其中所述宿主细胞是大肠杆菌k12mc4100菌株细胞和/或所述cas3是所述菌株的cas3;或
(gg)seqidno:696-699,任选地其中所述宿主细胞是大肠杆菌um146菌株细胞和/或所述cas3是所述菌株的cas3;或
(hh)seqidno:700-707,任选地其中所述宿主细胞是大肠杆菌umn026菌株细胞和/或所述cas3是所述菌株的cas3;或
(ii)seqidno:708-711,任选地其中所述宿主细胞是大肠杆菌umnf18菌株细胞和/或所述cas3是所述菌株的cas3;或
(jj)seqidno:712-715,任选地其中所述宿主细胞是大肠杆菌umnk88菌株细胞和/或所述cas3是所述菌株的cas3;或
(kk)seqidno:716-720,任选地其中所述宿主细胞是大肠杆菌ut189菌株细胞和/或所述cas3是所述菌株的cas3;或
(ll)seqidno:721-723,任选地其中所述宿主细胞是大肠杆菌vr50菌株细胞和/或所述cas3是所述菌株的cas3;或
(mm)seqidno:724-729,任选地其中所述宿主细胞是大肠杆菌w菌株细胞和/或所述cas3是所述菌株的cas3;或
(nn)seqidno:730或731,任选地其中所述宿主细胞是大肠杆菌xuzhou21菌株细胞和/或所述cas3是所述菌株的cas3。
17.条款12至16中任一项的系统或工程改造的序列,其中所述pam包含aag、agg、gag或atg或由其组成。
18.用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是链球菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,任选地其中所述重复序列是选自seqidno:215-218的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含nnagaaw、nggng或aw或由其组成的pam的紧邻3’;
(b)cascadecas;和
(c)任选地包含seqidno:265的氨基酸序列的cas3,或用于在宿主细胞中表达cas3(任选地包含seqidno:266)的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
在条款18的一个实例中,提供了:-
用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是链球菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(iii)一个或多个重复序列,其中所述重复序列是选自seqidno:215-218的重复序列;和
(iv)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含nnagaaw、nggng或aw或由其组成的pam的紧邻3’;
(b)cascadecas;和
(c)包含seqidno:265的氨基酸序列的cas3,或用于在宿主细胞中表达cas3的包含seqidno:266的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
19.用于条款18的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3任选地包含seqidno:265的氨基酸序列,或由任选地包含seqidno:266的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,任选地其中所述重复序列是选自seqidno:215-218的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含nnagaaw、nggng或aw或由其组成的pam的紧邻3’。
在一个实例中,条款19提供了:-
用于条款18的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3包含seqidno:265的氨基酸序列,或由包含seqidno:266的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是选自seqidno:215-218的重复序列;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列,其中所述靶标序列在包含nnagaaw、nggng或aw或由其组成的pam的紧邻3’。
20.条款18的系统或条款19的工程改造的序列,其中所述pam包含aa、at或ag或由其组成。
21.用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是沙门氏菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(iii)一个或多个重复序列,任选地其中所述重复序列是seqidno:214;和
(iv)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列;
(b)cascadecas;和
(c)任选地包含seqidno:267或269的氨基酸序列的cas3,或用于在宿主细胞中表达cas3的核苷酸序列(任选地包含seqidno:268或270),或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
在一个实例中,条款21提供了:-
用于杀死宿主细胞或减少宿主细胞的生长的hm-crlspr/cas系统,其中所述宿主细胞是沙门氏菌细胞,所述系统包含
(a)用于在宿主细胞中表达hm-crrna的编码所述hm-crrna的工程改造的核酸序列,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是seqidno:214;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列;
(b)cascadecas;和
(c)包含seqidno:267或269的氨基酸序列的cas3,或用于在宿主细胞中表达cas3的包含seqidno:268或270的核苷酸序列,或其直向同源物或同源物;
其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长。
22.用于条款21的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3任选地包含seqidno:267或269的氨基酸序列,或由任选地包含seqidno:268或270的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,任选地其中所述重复序列是seqidno:214;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列。
在一个实例中,条款22提供了:-
用于条款21的系统中的工程改造的核苷酸序列,其中所述工程改造的序列编码hm-crrna,用于在宿主细胞中表达所述hm-crrna,其中各crrna可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述cas3包含seqidno:267或269的氨基酸序列,或由包含seqidno:268或270的核苷酸序列编码,且其中所述工程改造的核酸序列包含
(i)一个或多个重复序列,其中所述重复序列是seqidno:214;和
(ii)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与宿主细胞靶标核苷酸序列杂交以将cas指导至宿主细胞中的靶标序列。
23.任一前述条款的系统或工程改造的序列,其中所述cas3和/或cascadecas是宿主细胞的内源cas。
24.任一前述条款的系统或工程改造的序列,其中所述工程改造的序列由核酸载体(任选地病毒、噬菌体、噬菌粒、质粒或接合质粒)包含。
25.任一前述条款的系统或工程改造的序列,其中数拷贝的所述工程改造的序列由多种载体细菌包含,任选地其中所述载体细菌细胞是乳杆菌细胞。
26.任一前述条款的系统或工程改造的序列,其用于治疗或预防人或动物受试者中的所述宿主细胞的感染,其中表达的hm-crrna能够在宿主细胞中与cascadecas和cas3或所述直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此可以杀死宿主细胞或可以减少宿主细胞群体生长,由此降低所述受试者中的所述宿主细胞的比例和治疗所述受试者中的宿主细胞感染。
27.药物组合物,其包含任一前述条款的任一前述条款的系统或工程改造的序列以及药学上可接受的稀释剂或赋形剂。
28.治疗人或非人动物受试者中的梭菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含梭菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述梭菌物种,
各宿主细胞包含
(a)包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,任选地其中所述重复序列是选自seqidno:138-209和290-513的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中表达的hm-crrna与cascadecas和任选地包含选自seqidno:273和275-286的氨基酸序列或由seqidno:738或274的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的梭菌感染。
在一个实例中,条款28提供了:-
治疗人或非人动物受试者中的梭菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含梭菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述梭菌物种,
各宿主细胞包含
(a)包含ccw、cca、cct、ccc、ccg或tca或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,
所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是选自seqidno:138-209和290-513的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中表达的hm-crrna与cascadecas和包含选自seqidno:273和275-286的氨基酸序列或由seqidno:738或274的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的梭菌感染。
29.治疗人或非人动物受试者中的大肠杆菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含多种大肠杆菌宿主细胞的细胞的第二亚群,其中所述第一物种不是大肠杆菌,
各宿主细胞包含
(a)包含awg(例如,aag、agg、gag或atg)或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,任选地其中所述重复序列是选自seqidno:210-213和514-731的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中表达的hm-crrna与cascadecas和任选地包含选自seqidno:261、263和287-289的氨基酸序列或由seqidno:262或264的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的大肠杆菌感染。
在一个实例中,条款29提供了:-
治疗人或非人动物受试者中的大肠杆菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含多种大肠杆菌宿主细胞的细胞的第二亚群,
其中所述第一物种不是大肠杆菌,
各宿主细胞包含
(a)包含awg(例如,aag、agg、gag或atg)或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,
所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是选自seqidno:210-213和514-731的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中表达的hm-crrna与cascadecas和包含选自seqidno:261、263和287-289的氨基酸序列或由seqidno:262或264的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的大肠杆菌感染。
30.治疗人或非人动物受试者中的链球菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含链球菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述链球菌物种,
各宿主细胞包含
(a)包含nnagaaw、nggng或aw(例如,aa、at或ag)或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,任选地其中所述重复序列是选自seqidno:215-218的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中表达的hm-crrna与cascadecas和任选地包含seqidno:265的氨基酸序列或由seqidno:266的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的链球菌感染。
在一个实例中,条款30提供了:-
治疗人或非人动物受试者中的链球菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含链球菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述链球菌物种,
各宿主细胞包含
(a)包含nnagaaw、nggng或aw(例如,aa、at或ag)或由其组成的pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,
所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是选自seqidno:215-218的重复序列;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中表达的hm-crrna与cascadecas和包含seqidno:265的氨基酸序列或由seqidno:266的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的链球菌感染。
31.治疗人或非人动物受试者中的沙门氏菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含沙门氏菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述沙门氏菌物种,
各宿主细胞包含
(a)pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,任选地其中所述重复序列是seqidno:214;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中表达的hm-crrna与cascadecas和任选地包含seqidno:267或269的氨基酸序列或由seqidno:268或270的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的沙门氏菌感染。
在一个实例中,条款31提供了:-
治疗人或非人动物受试者中的沙门氏菌感染的方法,所述受试者包含混合细菌群体,其中所述群体包含(i)第一物种的细菌细胞的第一亚群,和(ii)包含沙门氏菌物种的多种宿主细胞的细胞的第二亚群,其中所述第一物种不同于所述沙门氏菌物种,
各宿主细胞包含
(a)pam;
(b)所述pam的紧邻3’的靶标核苷酸序列;
(c)编码可在宿主细胞中与cas3核酸酶一起操作的cascade(用于抗病毒防御的crispr-相关复合物)cas的可表达核苷酸序列;
(d)编码所述cas3的可表达的核苷酸序列;
其中所述第一细胞不包含所述pam的紧邻3’的所述靶标序列,
所述方法包括
(e)向所述受试者施用药物组合物,所述药物组合物包含多个拷贝的编码宿主修饰(hm)crna的工程改造的核酸序列;和
(f)在宿主细胞中表达hm-crrna;
其中每个hm-crrna均由相应的工程改造的核酸序列编码且可与在相应的宿主细胞中表达的cas3和cascadecas一起操作,其中所述相应的工程改造的核酸序列和cas形成hm-crlspr/cas系统,且所述工程改造的核酸序列包含核酸序列,所述核酸序列包含
(g)一个或多个重复序列,其中所述重复序列是seqidno:214;和
(h)编码所述hm-crrna的序列的间隔区序列,其中所述hm-crrna序列能够与所述宿主细胞靶标序列杂交以将cas指导至宿主细胞中的靶标序列;
其中表达的hm-crrna与cascadecas和包含seqidno:267或269的氨基酸序列或由seqidno:268或270的核苷酸序列编码的cas3或其直向同源物或同源物组合,其中所述cas3可与宿主细胞中的所述hm-crrna一起操作以修饰靶标序列,由此杀死宿主细胞或减少宿主细胞群体生长,由此降低所述宿主细胞群体的比例和治疗受试者中的沙门氏菌感染。
32.用于条款1、3至14至18、20、21和23至26中任一项的系统中的指导核酸酶,其中所述核酸酶是cas,且被程序化以识别宿主细菌或古细菌细胞的靶标核苷酸序列,由此所述程序化的核酸酶能够修饰所述核苷酸序列,其中所述核苷酸序列由靶标基因包含,所述靶标基因由宿主细胞中的σ因子介导的基因表达级联包含。
33.条款32的核酸酶,其中所述核苷酸序列由编码所述级联的σ因子的基因包含。
34.条款32的核酸酶,其中所述靶标基因的转录在宿主细胞物种的细胞中通过如下控制:
(a)σe;
(b)σf;
(c)σg;
(d)σh;
(e)σk;
(f)spo0a;
(g)spoiiid;
(h)spovt;或
(i)spoiir。
35.条款32的核酸酶,其中所述核苷酸序列由编码以下的基因包含:
(a)σe;
(b)σf;
(c)σg;
(d)σh;
(e)σk;
(f)spo0a;
(g)spoiiid;
(h)spovt;或
(i)spoiir。
36.条款32的核酸酶,其中所述靶标核苷酸序列由选自表12至17和23中所述的基因的基因或其同源物、直向同源物或功能等效物包含。
37.条款32的核酸酶,其中所述靶标核苷酸序列由核苷酸序列包含,所述核苷酸序列与选自seqidno:220、222、224、226、228、229、232、234、236、238、240、242、244、246、248、250、252、254、256、258、259和260的序列具有至少80%同一性。
38.条款32的核酸酶,其中所述靶标序列编码氨基酸序列,所述氨基酸序列与选自seqidno:219、221、223、225、227、230、231、233、235、237、239、241、243、245、247、249、251、253、255和257的序列具有至少80%同一性。
39.条款32的核酸酶,其中所述靶标序列由spo0a、spoiiid、sigk、sigf、sigh、spo0a-p磷酸酶、spoiie、spoiiaa、spoiiab、spoiiga、sige、spoiir、sigg、spoiiia、spoiid、spoiiq、spoivb或ctpb基因包含。
40.条款32的核酸酶,其中所述宿主细胞是艰难梭菌细胞,且所述靶标序列由艰难梭菌utxa、毒素a或艰难梭菌毒素b基因包含。
41.条款32的核酸酶,其中所述宿主细胞是艰难梭菌细胞,且所述靶标序列由核苷酸序列包含,所述核苷酸序列由艰难梭菌cdu2、cdu1、tcdd、tcdb、tcde、tcda、tcdc、cdd1、cdd2、cdd3或cdd4基因包含。
42.条款32的核酸酶,其中所述靶标序列由i、ii、iii、iv或v期孢子形成基因包含,或编码孢子衣壳蛋白。
43.核酸载体(任选地,噬菌体、噬菌粒或结合质粒),其能够感染或转化宿主细胞,其中所述载体编码条款32至42中任一项的核酸酶。
44.条款32至42中任一项的核酸酶或条款43的载体,其中所述核酸酶或载体与一种或多种用于程序化核酸酶的crrna或指导rna(grna)组合,或与编码这种crrna或grna的核酸组合。
45.条款32至42中任一项的核酸酶或条款43的载体,其中所述核酸酶是cas3,且所述cas或载体与编码一种或多种cascadecas(任选地,casa、b、c、d和e;或cas1或cas2)的核酸组合,其中所述cas3可与所述cascadecas一起操作以修饰宿主细胞的靶标序列。
46.条款26至39中任一项的核酸酶或载体,其中所述cas核酸酶是大肠杆菌、艰难梭菌、肠道沙门氏菌或嗜热链球菌cas3。
47.条款46的核酸酶或载体,其中所述cas3包含选自seqidno:273和275-286、261、263、287-289、265、267和269的氨基酸序列或与所述选择的序列具有至少70%同一性的序列。
48.编码或包含crrna或单一grna的核酸分子,其能够在宿主细菌细胞中与条款32至36、42和44至47中任一项的核酸酶组合以指导核酸酶识别和修饰所述细胞的靶标序列。
49.条款48的核酸,其中所述crrna或单一grna包含这样的序列,所述序列由与选自seqidno:138-209和290-513的重复序列具有至少70、80、85、90、95、96、97、98或99%同一性(或100%同一性)的序列包含,且任选地其中所述宿主细胞是艰难梭菌细胞。
50.核酸载体(任选地,噬菌体、噬菌粒或结合质粒),其能够感染或转化宿主细胞,其中所述载体包含条款48或49的核酸。
51.用于治疗或预防人或动物受试者中的疾病或病况的药物,所述药物包含条款1至27和32至50中任一项的系统、序列、载体、核酸酶或核酸,其用于施用于所述受试者以治疗或预防由所述宿主细胞介导的疾病或病况。
52.条款51的药物,其用于治疗受试者的艰难梭菌感染,其中所述宿主细胞是艰难梭菌宿主细胞,任选地选自表18和19中的菌株以及对于表24中的seqidno:275-286所列的菌株的艰难梭菌菌株。
本文的任何配置可以例如使用如这些条款中任一项中所记载的cas3和/或如这些条款中任一项中所记载的重复序列,并且本文的配置可以加上必要的变更被读为采用这样的cas3和/或重复区。
在一个实例中,所述cas是选自表18和19中的菌株以及表24中对于seqidno:275-286所列的菌株的艰难梭菌菌株,且任选地所述宿主细胞是所述菌株的细胞。
本发明人已经确定艰难梭菌002、027和其他的高毒力核糖型的cas3序列是相关的,因为它们都包含在seqidno:275-286中的一个或多个的80%同一性内的氨基酸序列。因此,这种类型的cas3的使用可用于治疗或预防人或动物受试者中的艰难梭菌(例如,艰难梭菌002和/或027)感染。在一个实例中,所述菌株是用于人感染的高毒力菌株。在一个实例中,所述菌株是o27、002、017、018、027、078、244或1420。
本发明提供了这种用途和本文中用于此类目的的任何配置。
在一个替代方案中,所述重复序列与记载的重复序列具有至少70、75、80、85、90、95、96、97、98或99%同一性。
在一个替代方案中,所述cas3序列与记载的cas3序列具有至少70、75、80、85、90、95、96、97、98或99%同一性。例如,所述cas3与所述记载的cas3的不同仅在于保守的氨基酸取代。
在一个实例中(例如,在涉及混合细菌群体的本发明方法中),宿主细胞(或第一细胞或第二细胞)属或种选自表25中列出的属或种。在本发明的实例中,cas(例如,cas核酸酶,如i型、ii型或iii型cas,例如cas3或9)是由选自表25中列出的属或种的属或种的细菌包含的cas,任选地,所述宿主细胞(或第一细胞或第二细胞)具有相同的属或种。在此的一个实例中,所述cas对所述宿主细胞(或第一或第二细胞)是内源的,其对于本文的实施方案是有用的,其中内源性cas用于修饰靶标序列。在这种情况下,hm-阵列可以包含一个或多个重复核苷酸(例如,dna或rna)序列,其与所述细胞、属或种的重复序列具有至少90、95、96、97、98或99%同一性(或具有100%同一性),由此cas可与hm-阵列编码的crna操作,用于修饰细胞中的一个或多个靶标序列。在一个实例中,cas是i型cas3并且与i型cascade一起使用,其中cas3和cascade中的一个或两者对于宿主或第一细胞是内源的,或者是载体携带的(即,对于宿主或第一细胞外源的)。
在一个实例中,本发明的方法选择性杀死微生物群或混合群体中的宿主细胞,而不靶向其他细胞,例如,其中其他细胞是(a)宿主细胞物种的菌株的相关菌株的细胞或(b)与宿主细胞物种不同并且与宿主细胞物种系统发生相关的物种的细胞,其中所述其他物种或菌株具有编码16s核糖体rna的dna序列,其与宿主细胞物种或菌株的编码16s核糖体rna的dna序列具有至少80%同一性。在一个实施方案中,所述宿主细胞是选自表25的第一物种的细胞,且其他细胞是选自表25的不同物种的细胞。在一个实例中,所述物种是同一属的物种或不同属的物种。
在一个实例中,所述cas是cas9核酸酶(切口酶、dna、rna和/或pam识别和结合)、cas3、cas3'或cas3"。
在一个实例中,本文的cas或cascadecas或蛋白选自i型cascade多肽。如本文所用,“i型cascade多肽”是指形成多肽复合物的多肽,所述多肽复合物参与pre-crrna的加工以及随后与i型crispr-cas系统中的靶标dna的结合。这些多肽包括,但不限于,i型亚型i-a、i-b、i-c、i-d、i-e和i-f的cascade多肽。
i-a型cascade多肽的非限制性实例包括cas7(csa2)、cas8al(csxl3)、cas8a2(csx9)、cas5、csa5、cas6a、cas3'和/或cas3"。i-b型cascade多肽的非限制性实例包括cas6b、cas8b(cshl)、cas7(csh2)和/或cas5。i-c型cascade多肽的非限制性实例包括cas5d、cas8c(csd1)和/或cas7(csd2)。i-d型cascade多肽的非限制性实例包括cas10d(csc3)、csc2、csc1和/或cas6d。i-e型cascade多肽的非限制性实例包括cse1(casa)、cse2(casb)、cas7(casc)、cas5(casd)和/或cas6e(case)。i-f型cascade多肽的非限制性实例包括cys1、cys2、cas7(cys3)和/或cas6f(csy4)。i-u型cascade多肽的非限制性实例包括cas8c、cas7、cas5、cas6和/或cas4。在一些实施方案中,i型多肽与cas3、cas3'核酸酶或cas3"核酸酶具有至少70%同一性(例如,至少或约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)。在一些实施方案中,i型cascade多肽与cas7(csa2)、cas8al(csxl3)、cas8a2(csx9)、cas5、csa5、cas6a、cas6b、cas8b(cshl)、cas7(csh2)、cas5、cas5d、cas8c(csdl)、cas7(csd2)、caslod(csc3)、csc2、cscl、cas6d、csel(casa)、cse2(casb)、cas7(casc)、cas5(casd)、cas6c(case)、cysl、cys2、cas7(cys3)、cas6f(csy4)、cas6或cas4具有至少70%同一性(例如,至少或约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)。
i型crispr-cas系统是本领域中众所周知的,并且包括例如:archaeoglobusfulgidus包含示例性i-a型crispr-cas系统,克氏梭菌dsm555包含示例性i-b型crispr-cas系统,嗜盐芽孢杆菌c-125包含示例性i-c型crispr-cas系统蓝丝菌属物种pcc802包含示例性i-d型crispr-cas系统,大肠杆菌-12包含示例性i-e型crispr-cas系统,硫还原地杆菌包含示例性i-u型crispr-cas系统且假结核耶尔森氏菌ypiii包含示例性i-f型crispr-cas系统。
在一些实施方案中,可与本发明使用的ii型核酸酶与cas9(例如spcas9或stcas9)的氨基酸序列具有至少70%同一性(例如,至少或约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)。ii型crispr-cas系统是本领域中众所周知的,并且包括例如嗜肺军团菌str.paris、嗜热链球菌cnrz1066和乳酸奈瑟氏菌020-06。
在一些实施方案中,可与本发明使用的iii型核酸酶与cas6、caslo(或csml)、csm2、csm3、csm4、csm5、andcsm6、cmrl、caslo(或cmr2)、cmr3、cmr4、cmr5、andcmr6、cas7、caslo、cas7(csm3)、cas5(csm4)、cas7(csm5)、csm6、cas7(cmrl)、cas5(cmr3)、cas7(cmr4)、cas7(cmr6)、cas7(cmr6)、cmr5、cas5(cmr3)、cas5(cslo)、csm2、cas7(csm3)和所有1473的氨基酸序列具有至少70%同一性(例如,至少或约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)。
iii型crispr-cas系统是本领域中众所周知的,并且包括例如表皮葡萄球菌rp62a,其包含示例性iii-a型crispr-cas系统;激烈热球菌dsm3638,其包含示例性iii-b型crispr-cas系统;热自养甲烷热杆菌str.delta11,其包含示例性iii-c型crispr-cas系统;和roseiflexis物种rs-1,其包含示例性iii-d型crispr-cas系统。
在一些实施方案中,可与本发明使用的iv型核酸酶与csf4(ding),csfl,cas7(csf2)和/或cas5(csf3)的氨基酸序列具有至少70%同一性(例如,至少或约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)。iv型crispr-cas系统是本领域中众所周知的,例如,氧化亚铁嗜酸硫杆菌atcc23270包含示例性iv型crispr-cas系统。
在一些实施方案中,可与本发明使用的v型核酸酶与cpfl、casl、cas2或cas4的氨基酸序列具有至少70%同一性(例如,至少或约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%)。v型crispr-cas系统是本领域中众所周知的,并且包括,例如,新凶手弗朗西丝氏菌fxl包含示例性v型crispr-cas系统。
用于大肠杆菌中的i-ecrispr-cas系统的pam包括aag、gag、gag和atg,并且这样的pam可以用于本发明中,例如当细胞是大肠杆菌细胞时。用于嗜热链球菌crispr1(nnagaaw)或crispr3(nggng)的pam可用于本发明中,例如其中所述细胞是嗜热链球菌细胞。
根据嗜热链球菌dgcc7710的基因组序列,crispr4/cas系统的cas3基因编码926个氨基酸的蛋白,其具有∼106kda的预测分子量。序列数据已提交至genbank数据库,登录号为hq453272。在一个实施方案中,本发明的核酸酶是这样的cas3。
在一个实例中,以下艰难梭菌组分中的一种或多种可用于本发明中:
梭菌重复区
任选地,在本发明的方法、阵列、序列或其他配置中的替代方案中,所述重复序列(例如,所述阵列或工程改造的核酸包含的重复区)是选自seqidno:138-209和290-513的重复序列。
任选地,在本发明的方法、阵列、序列或其他配置中的替代方案中,所述重复序列是选自以下的重复序列:-
(a)seqidno:138-146和496-513,任选地其中所述宿主细胞是艰难梭菌r20291菌株细胞和/或所述cas3是所述菌株的cas3;或
(b)seqidno:147-158、290-306和370-384,任选地其中所述宿主细胞是艰难梭菌630菌株细胞和/或所述cas3是所述菌株的cas3;或
(c)seqidno:159-166,任选地其中所述宿主细胞是艰难梭菌atcc45233菌株细胞和/或所述cas3是所述菌株的cas3;或
(d)seqidno:167-175,任选地其中所述宿主细胞是艰难梭菌bi-9菌株细胞和/或所述cas3是所述菌株的cas3;或
(e)seqidno:176-181和470-476,任选地其中所述宿主细胞是艰难梭菌m120菌株细胞和/或所述cas3是所述菌株的cas3;或
(f)seqidno:182-187,任选地其中所述宿主细胞是艰难梭菌cf5菌株细胞和/或所述cas3是所述菌株的cas3;或
(g)seqidno:188-194,任选地其中所述宿主细胞是艰难梭菌cd002菌株细胞和/或所述cas3是所述菌株的cas3;或
(h)seqidno:195-201,任选地其中所述宿主细胞是艰难梭菌cd3菌株细胞和/或所述cas3是所述菌株的cas3;或
(i)seqidno:202-209,任选地其中所述宿主细胞是艰难梭菌cd69菌株细胞和/或所述cas3是所述菌株的cas3;或
(j)seqidno:351-369,任选地其中所述宿主细胞是艰难梭菌2007855菌株细胞和/或所述cas3是所述菌株的cas3;或
(k)seqidno:385-419,任选地其中所述宿主细胞是艰难梭菌bi1菌株细胞和/或所述cas3是所述菌株的cas3;或
(l)seqidno:420-434,任选地其中所述宿主细胞是艰难梭菌bi9菌株细胞和/或所述cas3是所述菌株的cas3;或
(m)seqidno:435-452,任选地其中所述宿主细胞是艰难梭菌cd196菌株细胞和/或所述cas3是所述菌株的cas3;或
(n)seqidno:420-434,任选地其中所述宿主细胞是艰难梭菌bi9菌株细胞和/或所述cas3是所述菌株的cas3;或
(o)seqidno:453-468,任选地其中所述宿主细胞是艰难梭菌cf5菌株细胞和/或所述cas3是所述菌株的cas3;或
(p)seqidno:477-495,任选地其中所述宿主细胞是艰难梭菌m68菌株细胞和/或所述cas3是所述菌株的cas3。
任选地,所述cas3包含与选自seqidno:275-286的序列相同的氨基酸序列,或包含与所述选择的序列具有至少70、75、80、85、90、95、96、97、98或99%同一性的氨基酸序列。在一个实例中,所述同一性是至少80%。在一个实例中,所述同一性是至少85%。在一个实例中,所述同一性是至少90%。在一个实例中,所述同一性是至少95%。在一个替代方案中,所述cas3氨基酸序列包含来自所述选择的序列的一个或多个氨基酸改变,例如,所述改变由1、2、3、4、5、6、7、8、9、10、11、12或13个改变组成。任选地,所述改变是氨基酸取代和/或缺失。
任选地,所述重复区包含与所述选择的序列相同的核苷酸序列,或包含与所述选择的序列具有至少70、75、80、85、90、95、96、97、98或99%同一性的核苷酸序列。在一个实例中,所述同一性是至少80%。在一个实例中,所述同一性是至少85%。在一个实例中,所述同一性是至少90%。在一个实例中,所述同一性是至少95%。在一个替代方案中,所述重复序列包含来自所述选择的序列的一个或多个核苷酸改变,例如,所述改变由1、2、3、4、5、6、7、8、9、10、11、12或13个改变组成。任选地,所述改变是核苷酸取代和/或缺失。
任选地,所述宿主细胞是梭菌宿主细胞。
大肠杆菌重复区
任选地,在本发明的方法、阵列、序列或其他配置中的替代方案中,所述重复序列是选自210-213和514-731的重复序列。
任选地,在本发明的方法、阵列、序列或其他配置中的替代方案中,所述重复序列是选自以下的重复序列:-
(a)seqidno:210-212和691-695,任选地其中所述宿主细胞是大肠杆菌k12菌株细胞和/或所述cas3是所述菌株的cas3;或
(b)seqidno:213、677和678,任选地其中所述宿主细胞是大肠杆菌o157:h7菌株细胞和/或所述cas3是所述菌株的cas3;或
(c)seqidno:514-518,任选地其中所述宿主细胞是大肠杆菌042菌株细胞和/或所述cas3是所述菌株的cas3;或
(d)seqidno:519-521,任选地其中所述宿主细胞是大肠杆菌1303菌株细胞和/或所述cas3是所述菌株的cas3;或
(e)seqidno:522-527,任选地其中所述宿主细胞是大肠杆菌536菌株细胞和/或所述cas3是所述菌株的cas3;或
(f)seqidno:528或529,任选地其中所述宿主细胞是大肠杆菌55989菌株细胞和/或所述cas3是所述菌株的cas3;或
(g)seqidno:530-532,任选地其中所述宿主细胞是大肠杆菌acn001菌株细胞和/或所述cas3是所述菌株的cas3;或
(h)seqidno:533-545,任选地其中所述宿主细胞是大肠杆菌apec菌株细胞和/或所述cas3是所述菌株的cas3;或
(i)seqidno:533-537,任选地其中所述宿主细胞是大肠杆菌apecimt5155菌株细胞和/或所述cas3是所述菌株的cas3;或
(j)seqidno:538-542,任选地其中所述宿主细胞是大肠杆菌apeco1菌株细胞和/或所述cas3是所述菌株的cas3;或
(k)seqidno:543-545,任选地其中所述宿主细胞是大肠杆菌apeco78菌株细胞和/或所述cas3是所述菌株的cas3;或
(l)seqidno:546-560,任选地其中所述宿主细胞是大肠杆菌b菌株细胞和/或所述cas3是所述菌株的cas3;或
(m)seqidno:556-560,任选地其中所述宿主细胞是大肠杆菌brel606菌株细胞和/或所述cas3是所述菌株的cas3;或
(n)seqidno:561-574,任选地其中所述宿主细胞是大肠杆菌bl21菌株细胞和/或所述cas3是所述菌株的cas3;或
(o)seqidno:575-578,任选地其中所述宿主细胞是大肠杆菌bw25113菌株细胞和/或所述cas3是所述菌株的cas3;或
(p)seqidno:579-582,任选地其中所述宿主细胞是大肠杆菌bw2592菌株细胞和/或所述cas3是所述菌株的cas3;或
(q)seqidno:583-588,任选地其中所述宿主细胞是大肠杆菌c(例如,attc8739)菌株细胞和/或所述cas3是所述菌株的cas3;或
(r)seqidno:589-597,任选地其中所述宿主细胞是大肠杆菌dh1菌株细胞和/或所述cas3是所述菌株的cas3;或
(s)seqidno:598-600,任选地其中所述宿主细胞是大肠杆菌e24377a菌株细胞和/或所述cas3是所述菌株的cas3;或
(t)seqidno:601-603,任选地其中所述宿主细胞是大肠杆菌ecc-1470菌株细胞和/或所述cas3是所述菌株的cas3;或
(u)seqidno:604-608,任选地其中所述宿主细胞是大肠杆菌ed1a菌株细胞和/或所述cas3是所述菌株的cas3;或
(v)seqidno:609-612,任选地其中所述宿主细胞是大肠杆菌er2796菌株细胞和/或所述cas3是所述菌株的cas3;或
(w)seqidno:613-618,任选地其中所述宿主细胞是大肠杆菌etec(例如,h10407)菌株细胞和/或所述cas3是所述菌株的cas3;或
(x)seqidno:644-667,任选地其中所述宿主细胞是大肠杆菌lf82菌株细胞和/或所述cas3是所述菌株的cas3;或
(y)seqidno:668-670,任选地其中所述宿主细胞是大肠杆菌ly180菌株细胞和/或所述cas3是所述菌株的cas3;或
(z)seqidno:671-673,任选地其中所述宿主细胞是大肠杆菌o104:h4菌株细胞和/或所述cas3是所述菌株的cas3;或
(aa)seqidno:674-676,任选地其中所述宿主细胞是大肠杆菌o111:h(例如,1128)菌株细胞和/或所述cas3是所述菌株的cas3;或
(bb)seqidno:679-684,任选地其中所述宿主细胞是大肠杆菌p12b菌株细胞和/或所述cas3是所述菌株的cas3;或
(cc)seqidno:685,任选地其中所述宿主细胞是大肠杆菌pcn033菌株细胞和/或所述cas3是所述菌株的cas3;或
(dd)seqidno:686-689,任选地其中所述宿主细胞是大肠杆菌pcn061菌株细胞和/或所述cas3是所述菌株的cas3;或
(ee)seqidno:690,任选地其中所述宿主细胞是大肠杆菌sececsms-3-5菌株细胞和/或所述cas3是所述菌株的cas3;或
(ff)seqidno:691-695,任选地其中所述宿主细胞是大肠杆菌k12mc4100菌株细胞和/或所述cas3是所述菌株的cas3;或
(gg)seqidno:696-699,任选地其中所述宿主细胞是大肠杆菌um146菌株细胞和/或所述cas3是所述菌株的cas3;或
(hh)seqidno:700-707,任选地其中所述宿主细胞是大肠杆菌umn026菌株细胞和/或所述cas3是所述菌株的cas3;或
(ii)seqidno:708-711,任选地其中所述宿主细胞是大肠杆菌umnf18菌株细胞和/或所述cas3是所述菌株的cas3;或
(jj)seqidno:712-715,任选地其中所述宿主细胞是大肠杆菌umnk88菌株细胞和/或所述cas3是所述菌株的cas3;或
(kk)seqidno:716-720,任选地其中所述宿主细胞是大肠杆菌ut189菌株细胞和/或所述cas3是所述菌株的cas3;或
(ll)seqidno:721-723,任选地其中所述宿主细胞是大肠杆菌vr50菌株细胞和/或所述cas3是所述菌株的cas3;或
(mm)seqidno:724-729,任选地其中所述宿主细胞是大肠杆菌w菌株细胞和/或所述cas3是所述菌株的cas3;或
(nn)seqidno:730或731,任选地其中所述宿主细胞是大肠杆菌xuzhou21菌株细胞和/或所述cas3是所述菌株的cas3。
任选地,所述cas3包含与选自seqidno:287-289的序列相同的氨基酸序列,或包含与所述选择的序列具有至少70、75、80、85、90、95、96、97、98或99%同一性的氨基酸序列。在一个实例中,所述同一性是至少80%。在一个实例中,所述同一性是至少85%。在一个实例中,所述同一性是至少90%。在一个实例中,所述同一性是至少95%。在一个替代方案中,所述cas3序列包含来自所述选择的序列的一个或多个氨基酸改变,例如,所述改变由1、2、3、4、5、6、7、8、9、10、11、12或13个改变组成。任选地,所述改变是氨基酸取代和/或缺失。
任选地,所述重复区包含与所述选择的序列相同的核苷酸序列,或包含与所述选择的序列具有至少70、75、80、85、90、95、96、97、98或99%同一性的核苷酸序列。在一个实例中,所述同一性是至少80%。在一个实例中,所述同一性是至少85%。在一个实例中,所述同一性是至少90%。在一个实例中,所述同一性是至少95%。在一个替代方案中,所述重复序列包含来自所述选择的序列的一个或多个核苷酸改变,例如,所述改变由1、2、3、4、5、6、7、8、9、10、11、12或13个改变组成。任选地,所述改变是核苷酸取代和/或缺失。
在这些选项中的任一种的替代方案中,所述宿主细胞反而是沙门氏菌、肠道沙门氏菌或肠道沙门氏菌鼠伤寒血清变型细胞。大肠杆菌和沙门氏菌有些相关,且因此,在该替代方案中,在沙门氏菌宿主中使用大肠杆菌重复区。
任选地,宿主菌株是肠出血性大肠杆菌(ehec)、大肠杆菌血清型o157:h7或产生志贺毒素的大肠杆菌(stec)。在一个实例中,所述宿主细胞选自以下大肠杆菌菌株:-
●产生志贺毒素的大肠杆菌(stec)(stec也可称为产生vero细胞毒素的大肠杆菌(vtec);
●肠出血性大肠杆菌(ehec)(这种致病型是新闻中最经常听到的与食物传播的暴发相关的致病型);
●产肠毒素大肠杆菌(etec);
●肠致病性大肠杆菌(epec);
●肠聚集性大肠杆菌(eaec);
●肠侵入性大肠杆菌(eiec);和
●弥散性附着的大肠杆菌(daec)。
在一个实例中,所述cas3是选自这些大肠杆菌菌株的菌株的cas3。
在一个实例中,所述重复区是选自这些大肠杆菌菌株的菌株的重复区,任选地包含来自所述重复区的一个或多个核苷酸改变,例如,所述改变由1、2、3、4、5、6、7、8、9、10、11、12或13个改变组成。任选地,所述改变是核苷酸取代和/或缺失。
肠出血性大肠杆菌(ehec)血清型o157:h7是人病原体,其引起全世界的血性腹泻和溶血性尿毒症综合征(hus)的爆发。常规抗微生物剂触发ehec中的sos应答,其促进有效的志贺毒素的释放,所述志贺毒素造成与ehec感染相关的大部分发病率和死亡率。牛是ehec的天然储库,并且近似75%的ehec爆发与食用受污染的牛来源的产品有关。ehec在人中引起疾病,但在成年反刍动物中无症状。大肠杆菌血清型o157:h7(ehec)感染的特征包括腹部绞痛和血性腹泻,以及危及生命的并发症溶血性尿毒症综合征(hus)。目前,需要ehec感染的治疗法(goldwater和bettelheim,2012)。常规抗生素的使用加剧志贺毒素介导的细胞毒性。在由疾病控制与预防中心进行的一项流行病学研究中,针对ehec肠炎用抗生素治疗的患者具有发展hus的更高风险(slutsker等人,1998)。额外研究支持在ehec感染中禁忌使用抗生素;针对与ehec相关的出血性结肠炎接受抗生素疗法的儿童具有增加的发展hus的机会(wong等人,2000;zimmerhackl,2000;safdar等人,2002;tarr等人,2005).常规抗生素通过增强stx基因的复制和表达来促进志贺毒素的产生,所述stx基因在染色体整合的lambdoid原噬菌体基因组中编码。
本发明的方法依赖于核酸酶切割。stx诱导还促进噬菌体介导的ehec细胞膜的裂解,允许志贺毒素的释放和散布至环境中(karch等人,1999;matsushiro等人,1999;wagner等人,2002)。因此,有利地,本发明提供了用于在人和动物受试者中治疗ehec的替代手段。这在以下用关于由核酸酶作用(与常规抗生素作用相反)产生的抗ehec作用的速度和持续时间的令人惊讶的结果进行例举。
在一个实例中,所述受试者(例如,人)患有溶血性尿毒综合征(hus)或处于溶血性尿毒综合征(hus)的风险中,例如,所述受试者患有大肠杆菌感染,诸如ehec大肠杆菌感染。
在替代实例中,所述宿主是本文公开的梭菌的任何物种或菌株,例如如表18或25中所公开。
在替代实例中,所述宿主是本文公开的沙门氏菌的任何物种或菌株。
在替代实例中,所述宿主是本文公开的链球菌的任何物种或菌株。
另外实施例
实施例1:环境处理或去污
石油、金属和矿业行业
在一个实施方案中,宿主细胞在矿山或矿区;金属矿山或矿区;油田或石油或石化产品中(例如当宿主为厌氧的硫酸盐还原细菌、例如脱硫弧菌属细菌时,用于这些中的任一种)。在一个实施例中,所述组合物包含氧化剂(例如次氯酸钠)、季铵化合物或异噻唑啉酮或者与次氯酸钠、季铵化合物和异噻唑啉酮同时或依次施用。用于本发明中用于修饰脱硫弧菌属细菌宿主的合适载体的一个实例为细菌噬菌体。以下参考文献描述用于分离感染脱硫弧菌属的噬菌体的合适方法。作为本发明中的载体,可以使用任何参考文献描述的细菌噬菌体。或者,载体由纳米颗粒提供。
heidelberg等人描述了几乎相同的μ样细菌噬菌体dvuo189-221、dvu2847-79、dvu2688-733的两个拷贝,并且细菌噬菌体的剩余部分存在于普通脱硫弧菌hildenborough的基因组中。这样的噬菌体可为设计用于本发明中的噬菌体载体的基础。
参考文献:
(i)seyedirashtis等人,jgenmicrobiol.1991jul;137(7):1545-9,"inductionandpartialpurificationofbacteriophagesfromdesulfovibriovulgaris(hildenborough)anddesulfovibriodesulfuricansatcc13541;
(ii)seyedirashtis等人,jgenmicrobiol.1992jul;138(7):1393-7,"molecularcharacterizationoftwobacteriophagesisolatedfromdesulfovibriovulgarisncimb8303(hildenborough)";
(iii)*walkercbetal;environmicrobiol.2006nov;8(11):1950-9,"recoveryoftemperatedesulfovibriovulgarisbacteriophageusinganovelhoststrain";
(iv)miranda等人,corrosionscience48(2006)2417–2431,"biocorrosionofcarbonsteelalloysbyanhydrogenotrophicsulfate-reducingbacteriumdesulfovibriocapillatusisolatedfromamexicanoilfieldseparator";
(v)eydal等人,theismejournal(2009)3,1139–1147;doi:10.1038/ismej.2009.66;publishedonline11june2009,"bacteriophagelytictodesulfovibrioaespoeensisisolatedfromdeepgroundwater";
(vi)walkercb等人;environmicrobiol.2009sep;11(9):2244-52.doi:10.1111/j.1462-2920.2009.01946.x,"contributionofmobilegeneticelementstodesulfovibriovulgarisgenomeplasticity"。
*[在该文章中描述的序列已保藏于genbank的登录号dq826728-dq826732下,其通过引用并入本文]
实施例2:水或污水处理或环境(例如土壤)金属去污
本发明的一个替代应用提供如本文所述用于水或污水处理的hm-crispr阵列、hm-crispr/cas系统、hm-crrna、hm-间隔区、hm-dna、hm-cas或hm-组合物,例如其中所述宿主为硫酸盐还原细菌,例如脱硫弧菌属细菌。
在一个实施例中,宿主中的靶标核苷酸序列为重金属抗性基因的序列。任选地,宿主也为脱硫弧菌属细菌,例如普通脱硫弧菌。
实施例3:医学用途
本发明的一个替代应用提供如本文所述用于在人或动物中治疗、预防或减少细菌感染(例如减少其扩散或扩张)的hm-crispr阵列、hm-crispr/cas系统、hm-crrna、hm-间隔区、hm-dna、hm-cas或hm-组合物。
在第一实施例中,所述感染由人中的mrsa宿主细胞包含。所述宿主细胞时金黄色葡萄球菌宿主细胞,且本发明的hm-阵列包含在i、ii或iii类葡萄球菌属包装噬菌体(有尾噬菌体目或肌尾噬菌体科噬菌体)的群体中。噬菌体群体与或不与甲氧西林或万古霉素一起施用于mrsa感染的患者。在一项试验中,噬菌体hm-阵列靶向(i)在内源性金黄色葡萄球菌crispr阵列的前导启动子3’的20个核苷酸的区域和(ii)宿主细胞中的甲氧西林抗性基因。当施用万古霉素时,向患者施用比平时更低的剂量。预计宿主细胞感染将被敲低,并且不建立对噬菌体药物的抗性或以比通常更低的速度或严重程度建立对噬菌体药物的抗性。在其他试验中,设计是相同的,除了在那些试验中的噬菌体也靶向必需的金黄色葡萄球菌基因ftsz(liang等人,intjinfectdis.2015jan;30:1-6.doi:10.1016/j.ijid.2014.09.015.epub2014nov5,"inhibitingthegrowthofmethicillin-resistantstaphylococcusaureusinvitrowithantisensepeptidenucleicacidconjugatestargetingtheftszgene")。另外的试验重复以上试验,但另外或替代甲氧西林施用噬菌体k细胞内溶素。
参考文献
1.jiangw等人,nucleicacidsres.2013nov;41(20):e188.doi:10.1093/nar/gkt780.epub2013sep2,"demonstrationofcrispr/cas9/sgrna-mediatedtargetedgenemodificationinarabidopsis,tobacco,sorghumandrice";
2.seedkd等人,nature.2013feb28;494(7438):489-91.doi:10.1038/nature11927,"abacteriophageencodesitsowncrispr/casadaptiveresponsetoevadehostinnateimmunity";
3.semenovae等人,procnatlacadsciusa.2011jun21;108(25):10098-103.doi:10.1073/pnas.1104144108.epub2011jun6,"interferencebyclusteredregularlyinterspacedshortpalindromicrepeat(crispr)rnaisgovernedbyaseedsequence";
4.helerr等人,molmicrobiol.2014jul;93(1):1-9.doi:10.1111/mmi.12640.epub2014jun4,"adaptingtonewthreats:thegenerationofmemorybycrispr-casimmunesystems";
5.gomaaa等人,mbio.2014jan28;5(1):e00928-13.doi:10.1128/mbio.00928-13,"programmableremovalofbacterialstrainsbyuseofgenome-targetingcrispr-cassystems";
6.fineranpc等人,procnatlacadsciusa.2014apr22;111(16):e1629-38.doi:10.1073/pnas.1400071111.epub2014apr7,"degeneratetargetsitesmediaterapidprimedcrispradaptation";
7.wiedenheft等人,nature.2011sep21;477(7365):486-9.doi:10.1038/nature10402,"structuresoftherna-guidedsurveillancecomplexfromabacterialimmunesystem;
8.bondy-denomy等人,nature493,429–432(17january2013)doi:10.1038/nature11723,"bacteriophagegenesthatinactivatethecrispr/casbacterialimmunesystem";
9.nuñezjk等人,nature.2015mar12;519(7542):193-8.doi:10.1038/nature14237.epub2015feb18,"integrase-mediatedspaceracquisitionduringcrispr-casadaptiveimmunity"。
实施例4:改变混合肠道微生物群群体中细菌的比例
根据本实施例进行细菌的比例的改变,其通过参考敲低混合肠道微生物群样品中艰难梭菌细菌进行描述。样品将含有拟杆菌和甲硝哒唑(mtz)抗性艰难梭菌菌株630亚群。将混合的群体与已根据本发明工程改造以含有crispr阵列的载体细菌群体(嗜酸乳杆菌la-14和/或la-5)离体组合。
每种crispr阵列包含在与载体细菌和艰难梭菌细胞相容的质粒上。阵列由多形拟杆菌ctndot转座子包含,其也包含orit、intdot序列、tetq-rtea-rteb操纵子、rtec和操纵子xis2c-xis2d-orf3-exc。在一项实验中,不包括mob和tra操纵子(相反,依赖于由与载体细菌组合的混合物中转入转座子的拟杆菌属细胞所提供的那些)。在另一项实验中,mob和tra操纵子包含在转座子中。
蛋白在细胞质膜上转位在所有细菌中是一个必需过程。在其核心包含atp酶、seca和膜通道secyeg的sec系统负责大多数这种蛋白转运。第二种平行sec系统已在许多革兰氏阳性菌物种中得到描述。这种辅助sec系统特征在于存在活化atp酶seca2的第二拷贝;其中其已被研究,seca2负责sec底物子集的转位。与许多致病性革兰氏阳性菌物种一样,艰难梭菌具有seca的两个拷贝。s-层蛋白(slps)和额外细胞壁蛋白(cwpv)的输出取决于seca2。在表达显性负性seca1或seca2等位基因的细胞中观察到slpsslpa的细胞质前体和其他细胞壁蛋白的聚集,伴有细胞壁内成熟的slps水平降低。此外,显性负性等位基因或敲低seca1或seca2的反义rna的表达显著地影响生长,表明两种sec系统在艰难梭菌中是必需的。
艰难梭菌菌株630(流行性x型)具有一个4,290,252bp(g+c含量=29.06%)的单一环状染色体和一个7,881bp(g+c含量=27.9%)的环状质粒。全基因组已经测序并发现11%的基因组由可动遗传元件如接合转座子组成。这些元件为艰难梭菌提供负责其抗微生物抗性、毒性、宿主相互作用和表面结构产生的基因。例如,艰难梭菌的cdea基因产生多药外排泵,其显示与已知的多药和毒性化合物排出(mate)家族中的外排转运蛋白是同源的。所述蛋白促进药物从细胞中的能量依赖性和钠偶联流出。另外,已显示艰难梭菌的cme基因在其他细菌中提供多药抗性。
阵列包含用于靶向艰难梭菌细胞的必需基因(seca2)中的序列的r1-s1-r1'crispr单元。在另一项实验中,在mtz和任选地一种或多种其他抗艰难梭菌抗生素存在的情况下,靶向cdea基因。每种间隔区(s)包含seca或cdea基因的20聚体核苷酸序列,其中所述序列包含与重复序列同源的艰难梭菌菌株630crispr/cas系统的pam。每种重复区与艰难梭菌菌株630重复区相同且具有以下序列
5'-atttacataccacttagttaatataaaac-3'(seqidno:118)
在一个替代组的实验中,以下序列用于所述重复区:
5'-gttttatattaactaagtggtatgtaaat-3'(seqidno:119)
重复区与对混合群体中艰难梭菌细胞为内源性的cas一起发挥功能。细菌的混合群体被回收为来自患有艰难梭菌感染的人类患者的粪便样品的离体样品。混合群体与载体细菌体外混合,在厌氧条件下于37℃孵育以模拟四环素存在的情况下的肠道状况。预期含有crispr阵列的转座子将转移至混合物中的拟杆菌和艰难梭菌细胞。此外,预期后者细胞中的靶位点通过cas核酸酶作用切割,因此减少艰难梭菌在混合群体中的比例(并且增加拟杆菌相比于艰难梭菌的比例)。
在后续实验中,产生包含载体细菌的饮料,并且连续数天被人类患者饮用一次或两次。在治疗期间还向患者施用四环素。预期粪便分析将揭示粪便样品中艰难梭菌的比例将降低(并且拟杆菌相比于艰难梭菌的比例将增加)。
实施例5:霍乱治疗或预防
参考世界卫生组织(who)霍乱情况说明书n°107(2015年7月更新)。霍乱是由细菌霍乱弧菌污染的食物或水的摄入引起的急性腹泻感染。研究人员已估计由于霍乱每年约有140-430万个病例,并且全世界每年28000-142000人死于霍乱。2小时-5天的短暂潜伏期为引发潜在爆发性疫情的一个因素。霍乱为一种极其毒性疾病。其影响儿童和成人两者,并可在数小时内杀死。感染霍乱弧菌的人中约有80%没有出现任何症状,尽管感染后细菌在其粪便中存在1-10天,并且流回到环境中可能感染其他人。在出现症状的人中,80%的人有轻度或中度症状,同时约20%的人出现伴随严重脱水的急性水样腹泻。若不及时治疗可能导致死亡。
两种血清型霍乱弧菌(o1和o139)引起爆发。霍乱弧菌o1引起的疾病暴发居多,而1992年于孟加拉国首先鉴定的o139局限于东南亚。非o1和非o139霍乱弧菌可引起轻度腹泻,但不会产生流行病。最近,在亚洲和非洲的某些地方发现了新的变体菌株。观察表明这些菌株引起更严重的霍乱,其中病死率更高。霍乱弧菌的主要储库为人和水性来源,诸如苦咸水和河口,通常与藻花有关。
参考nature.2013feb28;494(7438):489-91.doi:10.1038/nature11927,“abacteriophageencodesitsowncrispr/casadaptiveresponsetoevadehostinnateimmunity”,seedkd等人(通过引用并入本文),其描述霍乱弧菌血清群o1为严重腹泻疾病霍乱的主要病原体,并且裂解霍乱弧菌噬菌体已特别是在围绕孟加拉湾的流行地区涉及影响疾病负担。作者描述了分离icp1(用于国际腹泻病研究中心,孟加拉国霍乱噬菌体1)相关的霍乱弧菌o1特异性致命性肌尾病毒,其在采集自2001-201114的霍乱患者水稻-水粪便样品和在其出版物中描述的研究中普遍存在。
作者解释icp1crispr/cas系统由两个crispr位点(命名为cr1和cr2)和六个cas基因(其组织和蛋白产物与1-f型(鼠疫耶尔森氏菌)亚型系统17的cas蛋白同源性最高)组成。霍乱弧菌分为两种生物型,经典生物型和埃尔托生物型,其中前者与早期的流行病大流行有关,并且已被埃尔托生物型18替代。经典菌株霍乱弧菌o395具有属于1-e型(大肠杆菌)亚型17的crispr/cas系统,并且迄今为止,尚未见任何埃尔托菌株具有crispr/cas系统的描述。因此,crispr/cas系统在icp1噬菌体中的起源是未知的。
cr1和cr2共有直接重复区的rna序列(其中在crrna中形成预测的茎的部分回文序列用下划线表示)如下:-
guuagcagccgcauaggcugcuuaaaua[seqidno:75]
在本发明的一个实施例中,所述或每种阵列的重复区包含与seqidno:75具有至少80、90、95、96、97、98或99%同一性(或与seqidno:75相同)的序列或由其组成。
icp1crispr中的大多数间隔区显示与在包括1964年于印度分离的经典菌株o395、1994年于孟加拉国分离的埃尔托菌株mj-1236和2001-2011年之间于icddr,b收集的几种埃尔托菌株的霍乱弧菌菌株的子集中发现的18kb岛的序列的100%同一性。18kb岛类似于革兰氏阳性细菌的噬菌体诱导型染色体岛(picis),包括原型金黄色葡萄球菌致病岛(sapis)。sapis在某些噬菌体感染后被诱导切除、环合和复制。它们使用不同的机制来干扰噬菌体的繁殖周期以使其自身肆意扩散,这可保护周围的细菌群体免于进一步的噬菌体捕食。icp1crispr/cas系统靶向的霍乱弧菌18kb岛的组织与在picis的sapis子集中观察到的长度、碱基组成和组织相类似,其中整合酶在一端同源且gc含量比宿主物种的gc含量更低(37%与47.5%相比)。因此,18kb元件被称作霍乱弧菌pici样元件(ple)。
[核苷酸序列=seqidno:76(32bp前间隔区序列(seqidno:77)以灰色遮蔽,本公开包括在第一个灰色遮蔽的t开始和最后灰色遮蔽的c结束的序列;并且氨基酸序列=seqidno:78]
seed等人确定cr1和cr2阵列通过gapam序列的识别操作。seed等人也发现所研究的icp1相关噬菌体crispr阵列中的大多数间隔区显示与霍乱弧菌ples的同一性。间隔区显示于以下表3中;例如,在本发明的阵列中的s1选自这些序列中的任一个。在一个实施方案中,s1选自被下划线序列中的任一个。
在一个实施例中,本发明的阵列(或每种阵列)为包含一个、多个或所有带下划线的间隔区序列的工程改造的阵列。阵列间隔区可包含如下非天然存在的排列:
例如,所述阵列包含8a和/或9a型的间隔区和1a-7a类型中的0、1、2、3、4、5或6(但不是7)种。例如,所述阵列包含4b类型的间隔区和1b-3b类型中的0、1或2、3(但不是3或更多)种。例如,所述阵列包含8a型的间隔区和9a、4b、1c、3d、1e和3e中的一种、多种或所有。例如,所述阵列包含9a型的间隔区和8a、4b、1c、3d、1e和3e中的一种、多种或所有。例如,所述阵列包含4b型的间隔区和8a、9a、1c、3d、1e和3e中的一种、多种或所有。例如,所述阵列包含1c型的间隔区和8a、9a、4b、3d、1e和3e中的一种、多种或所有。例如,所述阵列包含3d型的间隔区和8a、9a、4b、1c、1e和3e中的一种、多种或所有。例如,所述阵列包含1e型的间隔区和8a、9a、4b、1c、3d和3e中的一种、多种或所有。例如,所述阵列包含3e型的间隔区和8a、9a、4b、1c、3d和1e中的一种、多种或所有。
在另一个非天然存在的排列中,所述载体包含本发明的第一和第二阵列,其中所述阵列包含至少两种选自1a-1g的间隔区(例如至少两种选自8a、9a、4b、1c、3d、1e和3e的间隔区),其中间隔区不是相同icp1噬菌体基因组的间隔区,例如不是所有的icp1_2011_a、或icp1_2006_e、或icp1_2005_a或icp1_2004_a的间隔区(通过参考上表中的间隔区)。因此,在一个实施方案中:-
第一阵列包含icp1_2011_a间隔区序列(例如8a和/或9a),且第二阵列包含icp1_2006_e、icp1_2005_a或icp1_2004_a的间隔区序列(例如一种或多种选自4b、1c、3d、1e和3e的间隔区)。
在一个实施例中,所述载体包含选自8a、9a、4b、1c、3d、1e和3e的1、2、3、4、5、6或所有7种间隔区类型。在一个实施例中,所述载体包含一种或多种所述选择类型的多拷贝。在一个实施例中,所述载体中的所述、一些或每种阵列包含第一间隔区(最接近阵列的启动子),其中第一间隔区选自8a、9a、4b、1c、3d、1e和3e。以这种方式定位是有利的,因为天然阵列最常见采用第一间隔区。
参考nucleicacidsres.2013oct;41(19):9033-48.doi:10.1093/nar/gkt654.epub2013jul30,"high-resolutiondefinitionofthevibriocholeraeessentialgenesetwithhiddenmarkovmodel-basedanalysesoftransposon-insertionsequencingdata",chaomc等人(通过引用并入),其公开了高密度转座子诱变与高通量dna测序(转座子插入测序)的偶联使得能够同时和全基因组评价单个位点对细菌生长和存活的贡献。hmm结果表明128种基因为在lb中的霍乱弧菌的最佳生长需要的。本发明的靶标序列可为这些基因中任何一种的序列(其基因名称和序列通过引用明确并入本文,用于提供本发明载体的靶标序列和用于可包含在本文的方面中)。
例如,在分别具有5.6和4.7的平均读数的vc0309和vc0753中的插入突变体被严重减弱生长。同样地,在体外竞争性实验中,vc0237和vc1773突变体比野生型细胞更不合适。列表也包括许多来自假定毒素/抗毒素成瘾基因座的抗毒素基因,包括vca0360、vca0477、vca0486和vca0488。当与活性毒素相关时,这样的基因被认为是必需的。
作者发现表4中的必需霍乱弧菌基因。作者鉴定了多于200种似乎是必不可少的基因间隔区。
因此,在本发明的一个实施例中,当宿主细胞为霍乱弧菌细胞时,靶标序列为vc0631、vc2024、vc2626、vc2763-vc2767或vc2768-vc2770序列。在本发明的一个实施例中,当宿主细胞为霍乱弧菌细胞时,靶标序列为vc0309和vc0753、vc0237和vc1773、vca0360、vca0477、vca0486或vca0488序列。
参考infectimmun.2015sep;83(9):3381-95.doi:10.1128/iai.00411-15.epub2015jun8,"agenome-widescreenrevealsthatthevibriocholeraephosphoenolpyruvatephosphotransferasesystemmodulatesvirulencegeneexpression",wangq等人(通过引用并入)。作者使用基于转座子插入位点(tis)测序的策略鉴定tcpa表达所需的新因子,所述tcpa编码tcp的主要亚基,生物体的主要肠道定殖因子。除了鉴定大部分已知调节tcpa表达的基因以外,筛选得到ptsi和ptsh,其编码酶i(ei)和霍乱弧菌磷酸烯醇丙酮酸磷酸转移酶系统(pts)的hpr组分。除了tcpa的表达减少,缺乏ei、hpr或相关的eiia(glc)蛋白的菌株产生较少的霍乱毒素(ct)并且定殖小鼠婴儿肠道的能力减弱。pts通过调节tcpph和aphab(其本身控制toxt(毒力基因表达的中枢活化剂)的表达)的表达调节毒力基因表达。
因此,在本发明的一个实施例中,当宿主细胞为霍乱弧菌细胞时,靶标序列为tcpa序列或tcpa调节因子序列(即本身或经由其表达产物调节tcpa的核苷酸序列)。例如,序列为ptsi或ptsh序列。在一个实施例中,靶标序列为磷酸烯醇丙酮酸磷酸转移酶系统(pts)的序列、或tcpph、aphab或toxt序列。在一个实施例中,靶标序列为编码eiia(glc)蛋白的基因序列。
用于本发明的合适靶标序列也显示在表5中-以下任何一种的序列(毒力基因带下划线)。
在一个实施方案中,所述细胞为弧菌属(例如霍乱)细胞并且靶标序列为这些基因的序列(若有的话)。
毒力基因显示在表6中。
在一个实施方案中,所述细胞为弧菌属(例如霍乱)细胞并且靶标序列为这些基因的序列(若有的话)。
来自tcp和ctx致病岛的基因
在一个实施方案中,所述细胞为弧菌属(例如霍乱)细胞并且靶标序列为ace、cep、ctxa、ctxb、orfu、zot、rsta、rstb、rstr、acfa、acfb、acfc、tage、alda、int、taga、tagd、tcpa、tcpb、tcpc、tcpd、tcpe、tcpf、tcph、tcpi、tcpj、tcpp、tcpq、tcpr、tcps、tcpt或toxt序列。
实施例6:通过利用野生型内源性cas的特异性微生物群细菌群体生长的抑制
1.材料和方法
1.1.菌株
以下菌株用于本实施例及实施例7和8的过程中:大肠杆菌mg1655、大肠杆菌top10、嗜热链球菌lmd-9(atccbaa-491,弗吉尼亚州马纳萨斯)、嗜热链球菌dsm20617(t)(dsmz,德国布伦瑞克)、乳酸乳球菌mg1363和变形链球菌clarke1924dsm20523(dsmz,德国布伦瑞克)。
在培养基选择和基因构建体的测试期间,采用不同的链球菌菌株。嗜热链球菌lmd-9(atccbaa-491)和大肠杆菌top10由于其相容性的生长需求而被考虑。除非另外指明,在有氧条件和37℃下,在todd-hewitt液体培养基(th)(t1438sigma-aldrich)中培养所有菌株。菌株于-80℃下储存在25%甘油中。
1.2差异生长培养基
所有菌株在37℃下于th培养基上生长20小时。嗜热链球菌的选择性培养基为用3gl-1的2-苯乙醇(pea)补充的th培养基。将pea添加至培养基并在121℃下于15psi下高压灭菌15分钟。通过将1.5%(wt/vol)琼脂添加至相应的培养基制备琼脂板。当有选择或质粒维护必要时,30μgml-1卡那霉素被用于嗜热链球菌菌株和大肠杆菌两者,且500μgml-1用于变形链球菌。
在一些情况下,取决于菌株和质粒,看到用pea补充的培养基上生长可能需要更长的孵育,最高达48小时。为了控制所使用生物体的活力,必须平行实施对照组th琼脂。
1.3.克隆
大肠杆菌(oneshot®thermofischertop10化学感受态细胞)被用于所有的亚克隆程序。使用phusion聚合酶实施pcr。根据制造商方案,所有pcr产物用nucleospin凝胶和machereynagel的pcrclean-up进行纯化。纯化的片段用1xfd缓冲液中的限制性酶dpni消化,其中在34µl总体积中含1µl酶。根据制造商方案,用nucleospin凝胶和machereynagel的pcrclean-up再次纯化所消化的反应。根据制造商(newenglandbiolab)的方案,gibson组装在10µl反应中进行。
根据制造商说明书,采用qiagen试剂盒制备质粒dna。对革兰氏阳性菌株的修饰包括在用0.5%甘氨酸和促进细胞裂解的溶菌酶补充的培养基中使细菌生长。
1.4.转化
1.4.1电感受态大肠杆菌细胞和转化
市售电感受态细胞被用于克隆和实验(oneshot®thermofischertop10化学感受态大肠杆菌)。采用标准设置进行电穿孔法:1800v、25μf和200ω,使用electrocellmanipulator(btxharvardapparatusecm630)。脉冲后,加入1mllb-soc培养基并于37℃下将细胞孵育1小时。在含有50μgml-1卡那霉素的lb-琼脂中将转化的细胞接种在板上。
1.4.2电感受态嗜热链球菌细胞的制备
电穿孔方案自somkuti和steinberg,1988改进。将嗜热链球菌在用40mmdl-苏氨酸(t8375sigma-aldrich)补充的th液体培养基中的过夜培养液以5ml相同培养基稀释100倍,并生长至od600介于0.3-0.5之间(接种后大约2.5小时)。通过于4℃下以10000xg离心10分钟收集细胞,并用5ml的冰冷洗涤缓冲液(0.5m蔗糖+10%甘油)洗涤3次。在洗涤细胞后,在电穿孔缓冲液(0.5m蔗糖、10%甘油和1mmmgcl2)中将它们悬浮至od600为15-30。将电穿孔缓冲液中的细胞保持在4℃下直到使用(1小时内)或在微量离心管(eppendorf管)中等分50μl,在液氮中冷冻它们并储存在-80℃用于后来使用。
1.4.3电穿孔嗜热链球菌细胞
将1μl纯化的质粒dna加入50μl的细胞悬浮液中,并在预先冷却的2mm-缝隙(gap)电穿孔比色皿实施电穿孔。电穿孔设置为2500v、25μf和200ω,使用electrocellmanipulator(btxharvardapparatusecm630)。电脉冲后立即将1ml的th液体培养基加入细胞并将悬浮液在冰上保持10分钟,随后将细胞于37℃下孵育3小时。允许用于表达抗性基因的时间之后,将细胞接种在含有30μgml-1卡那霉素的th-琼脂板上。取决于构建体,于37℃下孵育12-48小时之间可见菌落。
1.5.xyls质粒的构建
在该研究中使用的所有质粒均基于pbav1k-t5,其为衍生自乳酪链球菌(bryksin&matsumura,2010)的隐蔽性质粒pwv01的宿主范围广泛的表达载体,使用用于含有突出端的(引物)来扩增骨架,以采用gibson方法与其他片段组装。
通过在xylr阻遏物前面克隆启动子gyra构建木糖诱导系统(图1)。利用反向引物和正向引物从枯草芽孢杆菌菌株sck6(zhang等人,2011)扩增xylr阻遏物,其中所述反向引物包括用于gibson组装的突出端,所述正向引物是用于引入gyra启动子(xie等人,2013)和用于组装至pbav1kt5骨架中的相应突出端的ultramer。所得片段侧接用ultramer从pcl002扩增的mcherry(未发表的工作),所述ultramer包括pldha+pxyla杂合启动子(xie等人,2013)。根据制造商说明书,三种所得pcr产物在gibsonmastermix®(newenglandbiolab)中组装。产物最后转化到大肠杆菌top10电感受态细胞内。参见图1。
1.6.crispr阵列质粒的设计和构建
嗜热链球菌具有4种不同的crispr系统(sapranauskas等人,2011),ii型crispr1(st1-crispr)系统被选择该项工作。靶标序列的设计基于可得到的lmd-9(genbank:cp000419.1)的基因组序列。st1-crispr阵列被设计为仅含有在木糖诱导型启动子下的crispr阵列重复区和间隔区(xie等人,2013),之后在链球菌属物种的强组成型启动子下的相应的tracrrna(sorg等人,2014)(图2,seqidnos:)。
tracrrna在crrna的成熟中起作用,并且其由嗜热链球菌内源性rna酶iii加工,与crrna形成复合物。该复合物作为核酸内切酶st1-cas9(horvath&barrangou,2010)的指导起作用。在从木糖诱导型启动子转录合成阵列之后,内源性cas9和核糖核酸酶将它加工成功能性grna。grna/cas复合物将在靶位置引起双链断裂。
阵列的设计采用2种gc含量高和tracrrna部分减少(即不完整的tracrrna序列)的特异性靶标序列,已提出,其对crrna的适当成熟不是必要的(horvath&barrangou,2010)。
2种靶标为必需基因(dna聚合酶iii亚基α)和抗生素抗性基因(teta样基因)(seqidnos:)。
引物被用于扩增pbav1kt5-xylr-pldha骨架。根据制造商说明书(newenglandbiolabs),crispr阵列gblock和具有突出端的骨架在gibsonmastermix®上组装。产物最后转化到大肠杆菌top10电感受态细胞内。
1.7.嗜热链球菌lmd-9中木糖诱导系统的表征
将过夜的稳定生长期培养基1:100稀释至含有相应抗生素的th液体培养基中。用不同浓度的d-(+)-木糖(0、0.001、0.01、0.1、0.5和1%wt/vol)诱导对数中期细胞,并基于细胞悬浮液或悬浮缓冲液(pbs缓冲液),直接在培养基中测量细胞培养物以评价培养基的自发荧光程度。在具有平底的96孔板上,将20μl的细胞培养液样品在pbs缓冲液中稀释1/10。在板阅读器上读取细胞悬浮液或培养液的荧光。使用558nm的激发波长和612nm的发射波长测量mcherry荧光。在od600nm处测定重悬浮细胞的吸光度。每个实验至少进行三次独立的生物重复。
1.8.嗜热链球菌中crispr阵列的活化
将嗜热链球菌lmd-9和大肠杆菌top10(两者均具有含有靶向嗜热链球菌的dna聚合酶iii和teta的crispr阵列的质粒),在补充有用于维持质粒的30μgml-1卡那霉素的3ml培养基上生长过夜。第二天,在500μl在补充30μgml-1卡那霉素的新鲜th培养基中的1/100过夜培养物接种96孔深孔板。对数中期细胞培养物用1%木糖诱导。在嗜热链球菌和大肠杆菌上单独测量杀伤作用。对测试的每种菌株和条件,在不含木糖的情况下保持阴性对照。细胞生长直至~od0.5并且接下来在th培养基中10倍连续稀释,并且使用96孔复制板(mettlertoledoliquidator™96),将5μl体积的液滴点在th琼脂板和用gl-1pea补充的th琼脂板上。将板于37℃孵育24小时,并从一式三份测量计算菌落形成单位(cfu)。
2.结果
2.1生长条件和选择性培养基
我们首先着手建立细菌菌株和支持我们计划用于共同培养实验的所有菌株生长的培养方案。我们使用嗜热链球菌菌株lmd-9,其能够于37℃下在th液体培养基中支持与大肠杆菌类似的生长(图3)。
为了测定不同物种的细胞数目,区分来自混合培养基的不同细菌是重要的。使用macconkey琼脂可使大肠杆菌选择性生长,然而,对嗜热链球菌的选择性生长没有特异性培养基。pea琼脂为用于从革兰氏阴性菌(大肠杆菌)分离革兰氏阳性菌(嗜热链球菌)的选择性培养基。另外,我们发现不同浓度的pea部分抑制其他革兰氏阳性菌的生长,这允许用于本工作的其他革兰氏阳性菌之间的选择(图4)。3gl-1的pea证明使嗜热链球菌lmd-9选择性生长同时限制大肠杆菌的生长。
2.2诱导系统的设计和验证
通过产生异源木糖诱导盒(xyl-s),先前基于巨大芽孢杆菌木糖操纵子(图5)开发了用于链球菌属物种的诱导系统。xylr和xyla启动子分别用变形链球菌组成型表达的gyra和ldh启动子替代。这种用于链球菌属物种的表达盒显示在不同物种之间的敏感性和表达水平中的差异,然而,该系统未在嗜热链球菌中测试(xie等人,2013)。因此,我们首先着手验证嗜热链球菌中的木糖诱导盒。
诱导盒的一个替代版本通过仅用变形链球菌gyra启动子替换xylr启动子,但使内源性巨大芽孢杆菌的xyla启动子保持完整来构建。在木糖诱导系统的设计期间,我们考虑诱导型启动子的两个版本,在巨大芽孢杆菌中发现的天然pxyla启动子和与pxyla启动子的阻遏蛋白结合位点融合的高度保守的启动子pldha的杂合启动子(图5)。仅有少数链球菌属物种已被报道代谢木糖,并且因此识别xyla启动子的调节机构在其他链球菌物种中的存在是不大可能的。因此,我们构建两种木糖诱导系统,但仅测试具有pldha+xyla系统的mcherry的可诱导性。
为了测定木糖的mcherry诱导表达,用不同浓度的木糖诱导含有质粒(pbav1kt5-xylr-mcherry-pldha+xyla)的细胞的对数中期培养物。诱导后6小时,我们测量培养物中的mcherry荧光,其中我们在携带质粒的细胞种观察到显著更高的总体表达水平(图6)。值得注意的是甚至在其中未加入木糖的培养物中,系统显示显著的基础表达水平。这意味着系统是“渗漏”的并且在杀伤-阵列的背景下,这可以导致细胞死亡,甚至在系统用木糖诱导之前。然而,在该研究的后续过程中,我们使用两种质粒版本(pbav1kt5-xylr-mcherry-pldha+xyla和pbav1kt5-xylr-mcherry-pxyla)。
2.3crispr/cas9阵列的设计
为了确定crispr阵列中的基因组靶向间隔区是否可以引起嗜热链球菌lmd-9中的死亡,我们将我们设计的crispr阵列插入两种先前构建的木糖诱导系统(pbav1kt5-xylr-mcherry-pldha+xyla和pbav1kt5-xylr-mcherry-pxyla)。在这些质粒中,我们用含有crispr阵列的gblock替换mcherry(图7)。预期具有pldha+xyla启动子的变体比pxyla更强和具有更高的基本活性(xie等人,2013)。
2.4使用内源性cas9的细菌群体生长抑制
当我们在大肠杆菌中构建质粒后,我们将质粒转化至嗜热链球菌中。这将使我们确定我们是否可以引起特定细菌物种的细胞死亡。有趣的是,暴露于含有强pldh+xyla杂合启动子的质粒的嗜热链球菌中的细菌宿主群体大小(通过使细菌在琼脂板上生长并计数菌落数所表明),当与暴露于含有弱的正常pxyla启动子的质粒的嗜热链球菌相比时少了10倍(图8;52个菌落具有强阵列表达相比于556个菌落具有弱阵列表达,10.7倍差异),所述两个菌株已使用电感受态嗜热链球菌细胞的相同批次平行转化。这提示我们,携带靶向嗜热链球菌基因的crispr阵列的质粒能够使用内源性cas核酸酶和rna酶iii杀伤细胞,由此将群体生长抑制10倍。
我们预期用包含pxyla启动子的质粒转化的宿主细胞内的弱阵列表达导致一定程度的细胞杀伤,即使远小于具有强启动子质粒。我们预期,如果强阵列表达的活性与不暴露于任何阵列编码质粒的嗜热链球菌(如直接从肠道微生物群分离的细菌)进行比较,应确定大于所观察到的10倍抑制的群体生长抑制。因此,我们相信用于利用内源性cas核酸酶的宿主细胞中的阵列(或单一指导rna)表达可用于在环境、医疗和本文提及的其他设置中提供靶宿主细胞的有效生长抑制。共同施用抗生素也可用于增强生长抑制,特别是当靶向一种或多种抗生素抗性基因时。
3.讨论和展望
在该项研究中,我们着手设计crispr-阵列以使用内源性cas9系统特异性杀伤嗜热链球菌。为了得到对杀伤信号的控制,我们试图应用可以在嗜热链球菌中应用的诱导系统。来自巨大芽孢杆菌的木糖诱导xylr系统先前应用于变形链球菌中(xie,2013),但未应用于嗜热链球菌中。在该项研究中,我们证明使用设计的xylr-mcherry-pldha回路的xylr诱导系统在嗜热链球菌中的功能性。我们发现0.1%wt/vol足以充分诱导嗜热链球菌中的xylr系统(图6)。
为了在共同培养嗜热链球菌和大肠杆菌时观察丰度,我们建立了用3gl-1的pea补充培养基,允许嗜热链球菌的选择性生长,同时限制大肠杆菌的生长(图4)。
将靶向嗜热链球菌lmd-9基因组中的dna聚合酶iiiα亚基和teta样基因的st1-crispr阵列置于木糖诱导型启动子下(xie等人,2013)。靶向这些区域应导致双链断裂,并因此限制嗜热链球菌活力(图9)。因为工程改造阵列被设计使用内源性crispr/cas机构来加工编码的crispr阵列来靶向嗜热链球菌基因组,预期阵列对不相关的菌株如大肠杆菌的生长没有影响,即使在其基因组上可发现类似的靶标。在混合细菌群体(模拟人类微生物群的方面)成功测试了这一点,如在实施例3中讨论的那。
在其中本发明用于在人或动物受试者治疗或预防由本文公开的微生物群介导或引起的疾病或病况的实施方案中,证明本发明抑制宿主细胞在表面上生长的能力是重要和期望的。此类微生物群通常与受试者的组织(例如肠道、oralcavity,lung,armpit,ocular,vaginal,anal,ear,noseorthroat组织)接触,并且因此我们相信证明抑制微生物群细菌物种(以链球菌属为例)在表面上生长的活性支持这种效用。
实施例7:在不同菌株中特异性微生物群细菌群体生长抑制
实施例6证明嗜热链球菌lmd-9的特异性生长抑制。在此我们证明生长抑制也可在第二菌株中获得:嗜热链球菌dsm20617。因此,实施例6中描述的方法应用于后一菌株(除了嗜热链球菌dsm20617的选择性培养基为用2.5gl-1的2-苯乙醇(pea)补充的th培养基以外)。
将用crispr阵列质粒转化的嗜热链球菌dsm20617在37℃于液体培养基上孵育3小时时间段用于恢复,这允许表达卡那霉素抗性。在恢复期后,在1%木糖存在的情况下将细胞铺板在不同的选择培养基中,以便诱导细胞死亡,并且以没有木糖作为对照(图10)。很明显,(1)通过木糖诱导,可以抑制嗜热链球菌的生长(‘强’启动子质粒相比于对照组约为10倍),(2)‘强’系统(pbav1kt5-xylr-crispr-pldha)比‘弱’系统(pbav1kt5-xylr-crispr-pxyla)导致生长减少得更多。
实施例8:在不同微生物群物种的混合聚生体中的选择性细菌群体生长抑制
我们接下来证明3种物种的混合群体中特定细菌物种的选择性生长抑制。我们选择在人类和动物的肠道微生物群中发现的物种(嗜热链球菌dsm20617(t)、乳酸乳杆菌和大肠杆菌)。我们包括两种革兰氏阳性菌物种(嗜热链球菌和乳酸乳杆菌)以观察这是否会影响前者物种的选择性杀伤能力;此外为了增加困难(和更接近模拟微生物群的情况),乳酸乳杆菌被选择,因为这是嗜热链球菌的系统发生相关物种(如通过两种物种之间的高16s核糖体rna序列同一性所指出的)。嗜热链球菌和乳酸乳杆菌两者都是厚壁菌门。此外,为了刺激微生物群,人类共生肠道物种(大肠杆菌)被包括在内。
1.材料和方法
如在实施例6中阐述的方法是使用的菌株(除了选择性培养基为用2.5gl-12-苯乙醇(pea)补充的th培养基以外)。
1.1电感受态乳酸乳杆菌细胞的制备
将乳酸乳杆菌在用0.5m蔗糖和1%m甘氨酸补充的th培养基中的过夜培养物在5ml的相同培养基中稀释100倍,并在30℃下生长至od600介于0.2-0.7之间(接种后约2个小时)。于4℃下以7000xg5分钟收集细胞,并用5ml的冰冷洗涤缓冲液(0.5m蔗糖+10%甘油)洗涤3次。在洗涤细胞后,在电穿孔缓冲液(0.5m蔗糖、10%甘油和1mmmgcl2)中将它们悬浮至od600为15-30。将电穿孔缓冲液中的细胞保持在4℃下直到使用(1小时内)或在微量离心管(eppendorf管)中等分50μl,在液氮中冷冻它们并储存在-80℃用于后来使用。
所有物种的电穿孔条件如在实施例6中所述。
1.2crispr阵列的活化:聚生体实验
嗜热链球菌dsm20617、乳酸乳杆菌mg1363和大肠杆菌top10用含有靶向嗜热链球菌的dna聚合酶iii和teta的crispr阵列的质粒进行基因转化。转化后使所有细胞单独生长并在37℃下共同培养3小时,使得恢复以发展质粒中编码的抗生素抗性。我们决定使用转化效率作为crispr编码的生长抑制的读出值。因此,在允许细胞恢复后,将培养物铺板在th培养基、用pea补充的th和所有都用卡那霉素补充的macconkey琼脂中,并通过1%木糖诱导。
2.结果
2.0乳酸乳杆菌、大肠杆菌和嗜热链球菌之间的系统发生距离
在嗜热链球菌和乳酸乳杆菌的16srrna编码dna序列中计算的序列相似性被测定为83.3%。使用以下16s序列:大肠杆菌:ab030918.1,嗜热链球菌:ay188354.1,乳酸乳杆菌:ab030918。序列用needle(http://www.ebi.ac.uk/tools/psa/emboss_needle/nucleotide.html)使用以下参数比对:-gapopen10.0-gapextend0.5-endopen10.0-endextend0.5-aformat3pair-snucleotide1-snucleotide2。图11显示来自嗜热链球菌、乳酸乳杆菌和大肠杆菌的16s序列的最大似然系统发生树。
2.1生长条件和选择性培养基
嗜热链球菌和乳酸乳杆菌通常组合用于许多发酵食品和酸奶中。我们选择这些菌株,因为它们通常已知为与宿主形成密切关系的肠道微生物,并且嗜热链球菌和乳酸乳杆菌的16s核糖体rna区的先前表征已经显示这些生物体为系统发生密切相关的(ludwig等人,1995)。平行地,我们也评估了用于我们的混合群体共同培养实验的大肠杆菌的生长,因为这种生物体在肠道微生物群落中也是常见的。我们首先着手建立细菌菌株和培育方案,其支持我们计划用于共同培养实验的所有菌株的生长。我们发现所有菌株都能够支持在37℃下于th液体培养基中生长(图3)。
为测定不同物种的细胞数目,从混合培养基区分不同的细菌是重要的。用macconkey琼脂可使大肠杆菌选择性生长,然而,对嗜热链球菌的选择性生长没有特异性培养基。pea琼脂为用于从革兰氏阴性菌(大肠杆菌)分离革兰氏阳性菌(嗜热链球菌)的选择性培养基。另外,不同浓度的pea部分抑制不同革兰氏阳性菌物种和菌株的生长,这允许用于本工作的其他革兰氏阳性菌之间的选择。使用2.5gl-1的pea证明使嗜热链球菌选择性生长,同时限制乳酸乳杆菌和大肠杆菌的生长。
所有菌株都用使用具有卡那霉素筛选标记的pbav1kt5载体骨架的质粒转化;我们发现使用30μgml-1卡那霉素补充的培养基足以使细胞生长,同时保持质粒。
2.3在混合群体中的转化和选择性生长抑制
我们用含有crispr阵列的质粒转化嗜热链球菌、乳酸乳杆菌和大肠杆菌,并在以相等部分组合的所有细菌物种的聚生体中培养它们,这使得我们确定我们是否可以特异性地引起在嗜热链球菌细胞死亡。我们用pbav1kt5-xylr-crispr-pxyla或pbav1kt5-xylr-crispr-pldha+xyla质粒转化所有物种。
图12显示在携带pbav1kt5-xylr-crispr-pxyla或pbav1kt5-xylr-crispr-pldha+xyla质粒的大肠杆菌、乳酸乳杆菌和嗜热链球菌的共同培养物中的选择性嗜热链球菌生长抑制。在携带pbav1kt5-xylr-crispr-pxyla或pbav1kt5-xylr-crispr-pldha+xyla质粒的大肠杆菌之间未观察到生长差异(中间一列)。然而,嗜热链球菌(在用2.5gl-1pea补充的th琼脂上选择性生长,最后一列)显示如我们预期的,在pbav1kt5-xylr-crispr-pxyla(强)或pbav1kt5-xylr-crispr-pldha+xyla(弱)质粒之间转化效率降低。我们因此证明靶嗜热链球菌亚群在细胞混合群体中的选择性生长抑制。
参考文献
●barrangou,r.,fremaux,c.,deveau,h.,richards,m.,patrickboyaval,moineau,s.,…horvath,p.(2007).crisprprovidesacquiredresistanceagainstvirusesinprokaryotes.science,315(march),1709–1712.
●bryksin,a.v,&matsumura,i.(2010).rationaldesignofaplasmidoriginthatreplicatesefficientlyinbothgram-positiveandgram-negativebacteria.plosone,5(10),e13244.
●chancty,leejw,cameronde,bashorcj,collinsjj:“deadman”and“passcode”microbialkillswitchesforbacterialcontainment.natchembiol2015,12(december):1–7.
●horvath,p.,romero,d.a.,coûté-monvoisin,a.-c.,richards,m.,deveau,h.,moineau,s.,barrangou,r.(2008).diversity,activity,andevolutionofcrisprlociinstreptococcusthermophilus.journalofbacteriology,190(4),1401–12.
●ludwig,e.s.,klipper,r.,magruml.,wosec.,&stackebrandt,e.(1985).thephylogeneticpositionofstreptococcusandenterococcus.journulofgencwlmicrohiologj.,131,543–551.
●mercenier,a.(1990).moleculargeneticsofstreptococcusthermophilus.femsmicrobiologyletters,87(1-2),61–77.\
●samaržija,d.,antunac,n.,&havranek,j.(2001).taxonomy,physiologyandgrowthoflactococcuslactis:areview.mljekarstvo,51(1),35–48.retrievedfrom
●sapranauskas,r.,gasiunas,g.,fremaux,c.,barrangou,r.,horvath,p.,&siksnys,v.(2011).thestreptococcusthermophiluscrispr/cassystemprovidesimmunityinescherichiacoli.nucleicacidsresearch,39(21),9275–9282.
●somkuti,g.a.,&steinberg,d.h.(1988).genetictransformationofstreptococcusthermophilusbyelectroporation.biochimie,70(4),579–585
●sorg,r.a.,kuipers,o.p.,&veening,j.-w.(2014).geneexpressionplatformforsyntheticbiologyinthehumanpathogenstreptococcuspneumoniae.acssyntheticbiology,4(3),228–239.
●suvorov,a.(1988).transformationofgroupastreptococcibyelectroporation.femsmicrobiologyletters,56(1),95–99.
●xie,z.,qi,f.,&merritt,j.(2013).developmentofatunablewide-rangegeneinductionsystemusefulforthestudyofstreptococcaltoxin-antitoxinsystems.appliedandenvironmentalmicrobiology,79(20),6375–84.
●zhang,x.z.,&zhang,y.h.p.(2011).simple,fastandhigh-efficiencytransformationsystemfordirectedevolutionofcellulaseinbacillussubtilis.microbialbiotechnology,4(1),98–105。
实施例9:用于在混合细菌聚生体中选择性物种和菌株生长抑制的载体编码的系统
在实施例8中,我们令人惊讶地确定了在宿主细菌中利用内源性cas核酸酶活性用于在不同物种的混合聚生体中选择性群体生长抑制的可能性。我们接下来探索代之以使用载体编码的cas活性用于在不同物种的混合聚生体中选择性群体生长抑制的可能性。我们证实了在三种不同物种的混合群体中对特定细菌物种的选择性生长抑制,并且进一步包括靶细菌的替代菌株。我们可以令人惊讶地显示仅对预定靶物种的靶菌株的选择性生长抑制。此外,替代菌株没有被载体编码的crispr/cas系统靶向,这对于在模拟人或动物肠道微生物群要素的混合细菌聚生体中建立此类载体携带系统的精细特异性是期望的。
我们选择在人和动物的肠道微生物群中发现的物种(枯草芽孢杆菌、乳酸乳杆菌和大肠杆菌)。我们包括人类共生肠道物种大肠杆菌的两种菌株。我们认为有兴趣看看我们是否可以区分密切相关的菌株,所述菌株仍然具有序列差异,我们可以使用所述序列差异来靶向杀死一种菌株,而不杀死另一种菌株。这是令人感兴趣的,因为微生物群中的大肠杆菌的一些菌株是期望的,而其他菌株可能是不期望的(例如,对人或动物致病),且因此可以是cas修饰以敲低该菌株的靶标。
1.材料和方法
1.1.质粒和菌株
参见表7和8。除非另外指明,在有氧条件和37℃下,在todd-hewitt液体培养基(th)(t1438sigma-aldrich)中培养所有菌株。菌株于-80℃下储存在25%甘油中。
自靶向sgrna-cas9复合物分别由茶碱核糖开关和arac/pbad表达系统严格调节。需要严格调节cas9以便在大肠杆菌中稳定携带。该质粒含有来自化脓性链球菌的外源性cas9与靶向大肠杆菌的k-12菌株的单一指导rna(sgrna)。因此,当系统被活化时,k-12衍生的菌株top10易受双链自切割的影响并且随后死亡。大肠杆菌菌株如nissle不具有相同的靶标序列,因此它们不受sgrna-cas9活性的影响。参见下面的表9-11,其显示实施例9中使用的序列。我们选择在靶细胞中保守并且以多个拷贝(7个拷贝)存在的靶标序列(核糖体rna编码序列),这增加了使用单一grna设计在多个地方切割宿主细胞基因组以促进杀伤的机会。
图13显示控制spcas9和靶向核糖体rna亚基16s的自靶向sgrna的表达的调节剂。
1.2差异生长培养基
所有菌株在37℃下于th培养基上生长20小时。枯草芽孢杆菌的选择性培养基为用3gl-1的2-苯乙醇(pea)补充的th培养基。将pea添加至培养基并在121℃下于15psi下高压灭菌15分钟。通过将1.5%(wt/vol)琼脂添加至相应的培养基来制备琼脂板。
1.3.克隆
大肠杆菌(oneshot®thermofischertop10化学感受态细胞)被用于所有的亚克隆程序。使用phusion™聚合酶实施pcr。根据制造商方案,所有的pcr产物用nucleospin™凝胶和macherey-nagel™的pcrclean-up进行纯化。纯化的片段用1xfd缓冲液中的限制性酶dpni消化,其中在34µl总体积中含1µl酶。根据制造商方案,用nucleospin凝胶和machereynagel的pcrclean-up再次纯化消化的反应物。根据制造商(newenglandbiolab)的方案,gibson组装在10µl反应中进行。
根据制造商说明书,采用qiagen试剂盒制备质粒dna。对革兰氏阳性菌株的修饰包括在使细菌用0.5%甘氨酸和促进细胞裂解的溶菌酶补充的培养基中生长。
1.4.转化
1.4.1电感受态大肠杆菌细胞和转化
市售电感受态细胞被用于克隆和实验(oneshot®thermofischertop10电感受态大肠杆菌)。采用标准设置进行电穿孔:1800v、25μf和200ω,使用electrocellmanipulator(btxharvardapparatusecm630)。脉冲后,加入1mllb-soc培养基并于37℃下将细胞孵育1小时。将转化的细胞铺板在含有相应抗生素的lb-琼脂中。
1.5.在大肠杆菌和聚生体实验中活化sgrna-cas9
使大肠杆菌top10和nissle(两者均具有含有靶向k-12衍生菌株的核糖体rna编码序列的sgrna的质粒),以及其他细菌在3mlth液体培养基中生长过夜。第二天,将细胞稀释至~od0.5并且接下来在th培养基中10倍连续稀释,并且使用96孔复制板(mettlertoledoliquidator™96),将4μl体积的液滴点在th琼脂、具有诱导剂(1%阿拉伯糖和2mm茶碱)的th琼脂、用2.5gl-1pea补充的th琼脂和用1%麦芽糖补充的macconkey琼脂上。将板于37℃下孵育24小时,并自一式三份测量计算菌落形成单位(cfu)。
2.结果
2.1使用外源性crispr-cas9系统特异性靶向大肠杆菌菌株
我们首先测试该系统是否可以通过在大肠杆菌top10和nissle两者中引入杀伤系统来区分两种大肠杆菌菌株。
2.1在混合培养物中使用外源性crispr-cas9系统靶向大肠杆菌
对于两种大肠杆菌菌株、枯草芽孢杆菌、乳酸乳球菌,一式两份进行过夜培养物的连续稀释,并且对于混合培养物,一式三份进行过夜培养物的连续稀释。所有菌株在含有和不含诱导物的选择性板中在37℃生长20小时。该系统的诱导活化sgrna-cas9靶向k-12衍生菌株,同时保持其他细菌完整。
为测定不同物种的细胞数目并测定物种的特定去除,区分来自混合培养基的不同细菌是重要的。macconkey琼脂使大肠杆菌选择性生长,pea琼脂为用于从革兰氏阴性菌(大肠杆菌)分离革兰氏阳性菌(枯草芽孢杆菌)的选择性培养基。另外,我们发现不同浓度的pea部分抑制其他革兰氏阳性菌的生长。2.5gl-1的pea证明使枯草芽孢杆菌选择性生长,同时限制大肠杆菌和乳酸乳杆菌的生长。
图14显示通过诱导性、外源、载体携带的crispr-cas系统特异性靶向大肠杆菌菌株。sgrna靶向k-12衍生大肠杆菌菌株(大肠杆菌top10)的基因组,而测试的另一种大肠杆菌菌株未受影响。
图15显示用在该研究中使用的单个细菌物种的系列稀释物和未诱导crispr-cas9系统的th琼脂中的混合培养物的斑点测定。
图16显示稀释物103在不同选择性培养基上的斑点测定。具有2.5gl-1pea的th是单独的枯草芽孢杆菌的选择性培养基。用麦芽糖补充的macconkey是一种选择性和差异的细菌培养基,其经设计以选择性分离革兰氏阴性和肠道杆菌,并将它们基于麦芽糖发酵进行区分。因此,top10δmalk突变体在板上产生白色菌落,而nissle产生粉红色菌落;a是大肠杆菌δmalk,b是大肠杆菌nissile,c是枯草芽孢杆菌,d是乳酸乳球菌,e是混合培养物;macconkey-/b和e的图像显示为粉红色;macconkey+/b和e的图像显示为粉红色。图17显示在该研究中使用的细菌在不同培养基和选择性板上的选择性生长。可以看到,我们清楚地选择性杀死混合群体中的靶大肠杆菌菌株(图17中x-轴上的“大肠杆菌”),而另一个相关菌株(“大肠杆菌-nissle”)没有被类似地杀死。该实验中,混合群体中靶菌株的杀死是1000倍。
参考文献
[1]zhang,x.z.,&zhang,y.h.p.(2011).simple,fastandhigh-efficiencytransformationsystemfordirectedevolutionofcellulaseinbacillussubtilis.microbialbiotechnology,4(1),98–105.http://doi.org/10.1111/j.1751-7915.2010.00230.x
[2]wegmann,u.,o’connell-motherway,m.,zomer,a.,buist,g.,shearman,c.,canchaya,c.,…kok,j.(2007).completegenomesequenceoftheprototypelacticacidbacteriumlactococcuslactissubsp.cremorismg1363.journalofbacteriology,189(8),3256–70.http://doi.org/10.1128/jb.01768-06。
实施例10.通过结合质粒载体和cas3体外crispr杀死艰难梭菌
该实施例提供了使用宿主内源的cas3和重复序列快速且精确地杀死艰难梭菌的例举。
该实验涉及使用grna编码crispr阵列完全精确地杀死艰难梭菌,所述grna编码crispr阵列通过结合质粒作为载体(我们称为crispr指导载体(cgv™))从益生菌载体细菌物种递送。载体细菌(含有crispr指导载体(cgv™)的大肠杆菌供体菌株)与艰难梭菌交配,其在递送含有设计阵列的cgv™后被杀死。该cgv™利用艰难梭菌630δerm的内源性cas3机制。实现艰难梭菌细胞的100%杀死。
引言
艰难梭菌(c.difficile)是形成孢子的人机会病原体,其可以无症状地定殖健康个体的肠。感染艰难梭菌相关疾病(诸如医院腹泻)的两个主要风险因素是年龄和抗生素治疗,并且可以具有致命后果。艰难梭菌630δerm,我们研究的主题,是良好表征的菌株,并且其广泛用于突变体样本的产生。
研究目标
目标1:通过结合递送cgv。
设计并组装crispr指导载体(cgv),其含有专门靶向并杀死艰难梭菌的阵列。组装缺乏所述阵列的相同cgv以用作结合效率的对照。将两种cgv转化至载体菌株大肠杆菌ca434中,其被用作供体菌株以将质粒接合至我们的目标菌株艰难梭菌630δerm中。
目标2:利用艰难梭菌内源cas3机制。
在递送的crispr阵列在受体靶标菌株艰难梭菌中转录后,指导内源cas3以切割其自身的dna;导致细菌死亡。
目标3:艰难梭菌630δerm的根除。
使用设计的cgv实现对转接合艰难梭菌细胞的有效杀死。
材料和方法
细菌菌株和生长条件
大肠杆菌菌株ca434购自chainbiotech。将其在富含营养的培养基(2xyt)上培养,并在37℃和250rpm下生长过夜。当需要维持cgv时,向培养基中补充12,5μg/ml甲砜霉素。
使艰难梭菌630δerm在补充有5g/l酵母提取物、0.03%l-半胱氨酸、250ug/mld-环丝氨酸和8ug/ml头孢西丁(bhis+cc)的bhi琼脂上生长。使艰难梭菌在coy乙烯基厌氧箱中在92%n2、6%co2和2%h2的气氛中在37℃下生长过夜。
供体ca434和艰难梭菌的交配在纯bhi琼脂上生长以允许供体菌株的生长。将甲砜霉素添加至bhis+cc板至12.5μg/ml的最终浓度,用于在交配后选择转接合体。将所有板干燥1.5小时,并在使用前至少3小时将其与该培养基的液体培养物形式一起转移至厌氧室中。
cgv转移程序
通过电穿孔我们的cgv(对照载体pmtl84151-fj797649和crispr载体pmtl84151-cdcrispr1)的任一种获得大肠杆菌ca434的载体细胞。为了做到这一点,将大肠杆菌ca434的过夜培养物在没有选择的新鲜2xyt培养基中1:100稀释,且生长至od600~0.5。然后,通过标准程序使它们为电感受态(sharan等人,2009)。用质粒pmtl84151-fj797649或pmtl84151-cdcrispr1转化电感受态细胞,并在2xyt中在37℃下在摇动(250rpm)下回收1h。最后,将它们铺板在补充有12.5μg/ml甲砜霉素的lb琼脂上以选择转化体。使转化体在补充有12.5μg/ml甲砜霉素的液体2xyt中在37℃和250rpm下生长,用于与艰难梭菌交配。将1ml供体细胞以4000xg离心2分钟,除去上清液,并用400μlpbs小心洗涤。在第二离心循环后,将沉淀物转移至厌氧室中,用于与艰难梭菌在bhi非选择性板中交配。
遵循修改的方案制备艰难梭菌用于交配(despurdy等人,2002).艰难梭菌630δerm在选择性bhis+cc板中孵育过夜,将来自其的刮擦物过夜接种在1ml非选择性bhi中,并孵育过夜用于交配。使用200ul的该培养物来重悬浮沉淀的供体细胞,并将混合的培养物以20μl斑点铺板在非选择性bhi板的顶部。将交配物孵育24小时以允许接合。孵育后,将整个板用无菌接种环彻底刮擦,重悬浮于bhi中,并将系列稀释液铺板在bhi+cc板上以防止供体大肠杆菌的生长,并铺板在补充有甲砜霉素的bhi+cc用于额外选择转接合体。48小时后计数单一菌落。
结果
选择携带对照cgv的艰难梭菌转接合体的bhi+cc+甲砜霉素板的复制物显示一致数量的菌落,每个交配实验导致~600-750个cfu。对于艰难梭菌与携带具有crispr阵列的cgv的大肠杆菌ca434的交配,所述板是空的,未观察到菌落。这转化为接受crispr阵列的转接合体艰难梭菌630δerm细胞的100%杀死(参见图18:转接合体艰难梭菌630δerm的杀死)。
讨论和结论
该实验的结果显示,我们可以成功地将含有期望的crispr阵列的cgv接合至来自大肠杆菌载体细菌的艰难梭菌630δerm中。我们还可以成功地利用艰难梭菌内源cas3机制用于非常有效的crispr杀死。
参考文献
●purdyd,o'keeffeta,elmorem,herbertm,mcleoda,bokori-brownm,ostrowskia,mintonnp.(2002)conjugativetransferofclostridialshuttlevectorsfromescherichiacolitoclostridiumdifficilethroughcircumventionoftherestrictionbarrier.molec.microbiology46(2),439-452
●sharan,s.k.,thomason,l.c.,kuznetsov,s.g.,和court,d.l.(2009)recombineering:ahomologousrecombination-basedmethodofgeneticengineering.nat.protoc.4,206−223。
表3:
带下划线的=与霍乱弧菌ple内的序列具有100%同一性的crispr间隔区
表4:
表5:
表6:
表7.实施例9中使用的菌株
表8.实施例9中使用的质粒
还参见下面的表9-11,其显示实施例9中使用的序列。
表9:pcasens3中使用的基因部分的序列(参见实施例9)
表10:pdual2中的基因部分的序列(参见实施例9)
表11:靶标序列(参见实施例9)
表12-19:艰难梭菌
表12.转录组中由σf控制的基因的列表
表13:转录组中由σe控制的基因的列表
表14:转录组中由σg控制的基因的列表
表15:转录组中由σk控制的基因的列表
表16:转录组中由spoiiid控制的基因的列表
表17:通过spoiiid、spovt或spoiir控制孢子形成基因的表达
表19:艰难梭菌重复序列
表20:大肠杆菌重复序列
表21:肠道沙门氏菌肠道亚种鼠伤寒血清变型重复序列
表22:嗜热链球菌重复序列
表26.基因组靶标和选择性crispr-杀死艰难梭菌的cas的序列(参见实施例10)
(a)pmtl84151-靶向艰难梭菌的cdcrispr1中的设计间隔区的概览
(b)cas3序列(seqidno:738)
表27:序列:
在一个实例中,本发明的一个或多个间隔区靶向本序列表中的相应的序列。seqidno:1-44是ii型crispr/cas系统序列,例如链球菌序列。
- 还没有人留言评论。精彩留言会获得点赞!