产生多特异性抗体混合物及其使用方法与流程
相关申请
本申请要求2017年7月21日提交的美国临时申请第62/535354号的权益,其内容通过参考以其全部结合至本文中。
发明领域
本发明涉及多特异性抗体混合物的产生,所述混合物包括从两种或更多种单特异性抗体和一种或多种双特异性抗体的混合物分离的抗体子集,其中子集中的所有抗体具有相同的共同重链。本发明还涉及通过使用至少一个亲和色谱步骤分离、纯化或者以其它方式产生这种抗体子集的方法。本发明还涉及在多种治疗适应症中使用这种抗体子集的方法。
发明背景
在过去的二十年期间,单克隆抗体(mab)已成为一种重要的治疗方法,给各种适应症的患者带来明显益处。mab的成功部分地归因于其对靶抗原的高特异性和低内在毒性。当与其他类别的药物相比较,这些特性极大地限制脱靶副作用。绝大多数批准的治疗性mab为igg同种型的未修饰抗体。
然而,由标准mab实现的靶向单一蛋白可能并不总是足以实现显著的治疗效果(fischerexpertopin.drugdiscov.20083(8):833-839)。
提高功效的一种显而易见的选择为组合使用两种mab。例如,对于靶向免疫检查点分子的抗体(比如抗ctla4和抗pd-1抗体)在临床上采取这种策略(larkinetal.,nengljmed2015;373:23-34;harrisetal.,cancerbiolmed.201613(2):171-93)。然而,mab组合的开发涉及显著的成本和开发障碍。特别是,必须采用两个单独的制造过程,从而导致成本大幅增加(rasmussenetal.,archivesofbiochemistryandbiophysics2012526:39-145)。如果考虑靶向三种或更多种蛋白或抗原,这些问题变得甚至更加重要。
迄今为止,已经使用几种用于靶向多种蛋白或抗原的方法。已经采取组合使用两种mab,但通常因显著的成本和开发障碍而受到阻碍。双特异性抗体(biab)代表一种快速发展的备选方案,以实现多特异性靶向,并且迄今为止已经描述了60多种形式(spiessetal.,molimmunol.201567:95-106;brinkmannandkontermannmabs20179:182-212),而另一种实现靶向两种或者甚至更多种蛋白的方法为产生抗体混合物或重组多克隆混合物。然而,这些多特异性形式中仅有少数已被批准用于治疗用途。
因此,需要产生能够靶向多种蛋白、表位和/或抗原的多特异性抗体混合物。
发明概述
本公开提供抗体混合物,所述混合物包含从两种或更多种单特异性抗体和一种或多种双特异性抗体的混合物分离的抗体子集,其中子集中的所有抗体具有相同的共同重链。当多种轻链与共同的重链在单个细胞中共表达时,产生这些混合物。在一些实施方案中,纯化的子集仅包含至少含有κ轻链的抗体。在一些实施方案中,纯化的子集仅包含至少含有λ轻链的抗体。在一些实施方案中,纯化的子集仅包含含有κ轻链和λ轻链的抗体。
本公开还提供通过使用至少一个亲和色谱步骤分离、纯化或者以其它方式产生从两种或更多种单特异性抗体和一种或多种双特异性抗体的混合物分离的抗体子集的方法,其中子集中的所有抗体具有相同的共同重链。在一些实施方案中,纯化步骤使用κ恒定或可变结构域特异性亲和色谱介质进行。在一些实施方案中,纯化步骤使用λ恒定或可变结构域特异性亲和色谱介质进行。在一些实施方案中,纯化步骤使用两步亲和色谱法进行。在一些实施方案中,第一纯化步骤使用κ恒定或可变结构域特异性亲和色谱介质进行,和第二纯化步骤使用λ恒定特异性亲和色谱介质进行。在一些实施方案中,第一纯化步骤使用λ恒定特异性亲和色谱介质进行,和第二纯化步骤使用κ恒定或可变结构域特异性亲和色谱介质进行。
本文提供的多特异性抗体混合物和方法可用于多种治疗、诊断和/或预防适应症中的任何一种。例如,通过给予期望这种治疗或预防的受试者抗体混合物,多特异性抗体混合物可用于治疗、预防癌症或其他赘生性病症和/或延迟其进展或减轻其症状。在一些实施方案中,本文所述的多特异性抗体混合物可用于治疗血液系统恶性肿瘤和/或实体肿瘤。例如,本文所述的多特异性抗体混合物可用于治疗cd47+肿瘤、间皮素+肿瘤及其组合。作为非限制性实例,本文描述的多特异性抗体混合物可用于治疗非霍奇金淋巴瘤(nhl)、急性淋巴细胞性白血病(all)、急性髓细胞性白血病(aml)、慢性淋巴细胞性白血病(cll)、慢性髓细胞性白血病(cml)、多发性骨髓瘤(mm)、乳腺癌、卵巢癌、头颈癌、膀胱癌、黑色素瘤、间皮瘤、结直肠癌、胆管癌、胰腺癌(包括胰腺腺癌)、肺癌(包括肺腺癌)、平滑肌瘤、平滑肌肉瘤、肾癌、神经胶质瘤、成胶质细胞瘤、子宫内膜癌、食道癌、胆汁性胃癌和前列腺癌。实体肿瘤包括例如乳腺肿瘤、卵巢肿瘤、肺肿瘤、胰腺肿瘤、前列腺肿瘤、黑色素瘤肿瘤、结直肠肿瘤、肺肿瘤、头颈肿瘤、膀胱肿瘤、食道肿瘤、肝肿瘤和肾肿瘤。
在一些实施方案中,多特异性抗体混合物可通过给予其中期望这种治疗或预防的受试者抗体混合物来治疗、预防自身免疫性疾病和/或炎性障碍和/或延迟其进展或减轻其症状。自身免疫性疾病包括例如获得性免疫缺陷综合征(aids,其为一种具有自身免疫性成分的病毒性疾病)、斑秃、强直性脊柱炎、抗磷脂综合征、自身免疫性艾迪生氏病、自身免疫性溶血性贫血、自身免疫性肝炎、自身免疫性内耳病(aied)、自身免疫性淋巴细胞增生综合征(alps)、自身免疫性血小板减少性紫癜(atp)、贝切特病、心肌病、口炎性腹泻-疱疹样皮炎、慢性疲劳免疫功能障碍综合征(cfids)、慢性炎性脱髓鞘性多发性神经病(cipd)、瘢痕性类天疱疮、冷凝集素病、crest综合征、克罗恩病、德戈斯病、幼年型皮肌炎、盘状红斑狼疮、原发性混合型冷球蛋白血症、纤维肌痛-纤维肌炎、格雷夫斯病、格林-巴利综合征、桥本甲状腺炎、特发性肺纤维化、特发性血小板减少性紫癜(itp)、iga肾病、胰岛素依赖型糖尿病、幼年型慢性关节炎(斯蒂尔病)、幼年型类风湿性关节炎、梅尼埃病、混合性结缔组织病、多发性硬化症、重症肌无力、恶性贫血、结节性多动脉炎、多发性软骨炎、多腺体综合征、风湿性多肌痛、多发性肌炎和皮肌炎、原发性无丙种球蛋白血症、原发性胆汁性肝硬化、牛皮癣、牛皮癣性关节炎、雷诺现象、赖特综合征、风湿热、类风湿性关节炎、结节病、硬皮病(进行性系统性硬化症(pss),也称为系统性硬化症(ss))、舍格伦综合征、僵人综合征、系统性红斑狼疮、大动脉炎、颞动脉炎/巨细胞动脉炎、溃疡性结肠炎、葡萄膜炎、白癜风和韦格纳肉芽肿病。
炎性障碍包括例如慢性和急性炎性障碍。炎性障碍的实例包括阿尔茨海默病、哮喘、慢性阻塞性肺病、特应性变态反应、变态反应、动脉粥样硬化、支气管哮喘、湿疹、肾小球肾炎、移植物抗宿主病、溶血性贫血、骨关节炎、脓毒症、中风、组织和器官移植、血管炎、糖尿病性视网膜病变和呼吸机所致的肺损伤。
在一些实施方案中,多特异性抗体混合物可用于重新靶向t细胞。
本发明的药用组合物可包括本发明的多特异性抗体混合物和载体。这些药用组合物可包含在试剂盒(比如治疗试剂盒和/或诊断试剂盒)中。
附图简述
图1a、1b和1c为一系列产生重组抗体混合物的各种方法的示意图。图1a描绘混合独立地表达和纯化的单克隆抗体(mab)以产生mab混合物的方法。图1b描绘混合细胞系(也称为多克隆细胞库)以在单个发酵反应器中产生仅mab的混合物的方法。图1c描绘了在单个细胞系中共表达多种抗体链以产生mab和双特异性抗体(biab)的混合物的方法。
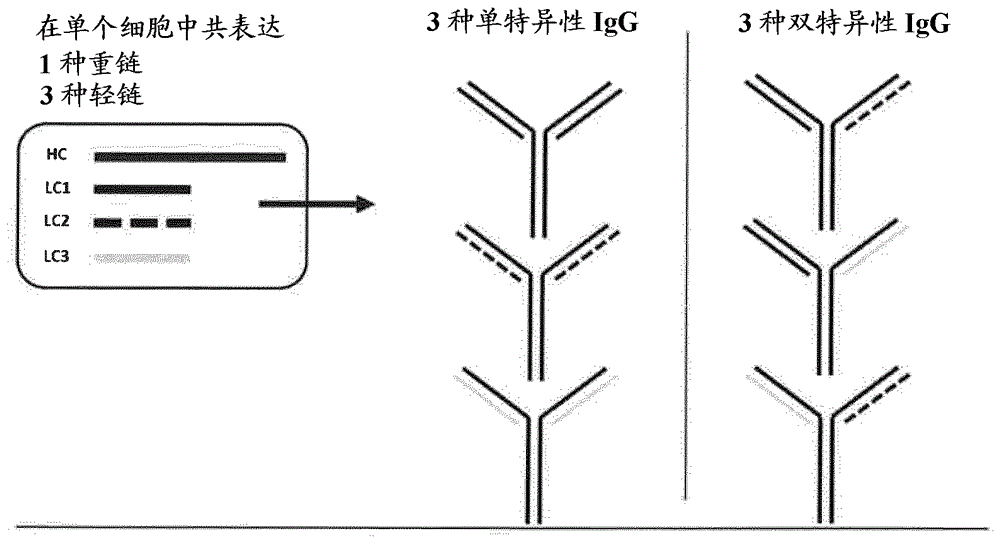
图2a、2b和2c为一系列共表达多种轻链与单一共同重链的方法以及产生的所得抗体混合物的示意图。图2a描绘2种抗体轻链与单一重链的共表达如何导致分泌3种不同抗体:2种mab在每个fab中各自结合相同的轻链,和单一biab在每个fab中结合不同的轻链。图2b描绘3种抗体轻链与单一重链的共表达如何导致分泌6种不同抗体:3种mab在每个fab中各自结合相同的轻链,和3种biab在每个fab中结合不同的轻链。图2c描绘4种抗体轻链与单一重链的共表达如何导致分泌10种不同抗体:4种mab在每个fab中各自结合相同的轻链,和6种biab在每个fab中结合不同的轻链。
图3为在单个细胞中共表达2种λ轻链、1种κ轻链和单一共同重链的方法的示意图,该方法导致分泌2种iggλλmab、1种iggκκmab、2种iggκλbiab和1种iggλλbiab的混合物(混合物1)。如所示,可使用不同的亲和色谱步骤从混合物1中分离出不同的子混合物。
图4为在单个细胞中共表达2种λ轻链、2种κ轻链和单一共同重链的方法的示意图,该方法导致分泌2种iggλλmab、2种iggκκmab、4种iggκλbiab、1种iggλλbiab和1种iggκκbiab(混合物1)。如所示,可使用不同的亲和色谱步骤从混合物1中分离出不同的子混合物。
图5为在单个细胞中共表达3种λ轻链、1种κ轻链和单一共同重链的方法的示意图,该方法导致分泌3种iggλλmab、1种iggκκmab、3种iggκλbiab、3种iggλλbiab和1种iggκκbiab的混合物(混合物1)。如所示,可使用不同的亲和色谱步骤从混合物1中分离出不同的子混合物。
图6为本公开方法的总体示意图。
图7a为靶向cd47和肿瘤相关抗原(taa)的两个表位的2种双特异性抗体的示意图。
图7b为通过两步亲和色谱,先后使用κ特异性亲和介质和λ特异性亲和介质,或反之亦然,纯化含有2种biab(cd47xtaa表位1和cd47xtaa表位2)的子集的方法示意图。
图8a为靶向cd47和第一肿瘤相关抗原(taa1)的第一双特异性抗体和靶向cd47和第二肿瘤相关抗原(taa2)的第二双特异性抗体的示意图。
图8b为通过两步亲和色谱,先后使用κ特异性亲和介质和λ特异性亲和介质,或反之亦然,纯化含有2种biab(cd47xtaa1和cd47xtaa2)的子集的方法示意图。
图9a为靶向多种肿瘤相关抗原(taa1、taa2等)和/或taa上的多个表位的双特异性抗体的示意图。
图9b为通过两步亲和色谱,先后使用κ特异性亲和介质和λ特异性亲和介质,或反之亦然,纯化含有4种不同biab(cd47xtaa1、cd47xtaa2、pd-l1xtaa1、pd-l1xtaa2)的子集的方法示意图。
图10a为用于使t细胞重新靶向多种肿瘤相关抗原(taa1、taa2等)和/或taa上的多个表位的双特异性抗体的示意图。
图10b为通过两步亲和色谱,先后使用κ特异性亲和介质和λ特异性亲和介质,或反之亦然,纯化含有2种不同biab(cd3xtaa1、cd3xtaa2)的子集的方法示意图。
图11a为靶向第一taa的mab与靶向第一和第二taa的biab(应避免二价靶向)组合的混合物示意图。
图11b为通过两步亲和色谱,先后使用κ特异性亲和介质和λ特异性亲和介质,或反之亦然,纯化含有biab(taa1xtaa2)和抗taa1mab的子集的方法示意图。
图12a、12b和12c描绘一系列图表,其描绘在胰腺腺癌hpac细胞系中,在存在递增浓度的各种双特异性抗体和/或单克隆抗体以及双特异性抗体的组合的情况下观察到的抗体依赖性细胞吞噬(adcp)水平,显示为吞噬指数。
图13a、13b和13c描绘一系列图表,其描绘在卵巢腺癌caov细胞系中,在存在递增浓度的各种双特异性抗体和/或单克隆抗体以及双特异性抗体的组合的情况下观察到的adcp水平,显示为吞噬指数。
图14a、14b和14c描绘一系列图表,其描绘在胃癌nci-n87细胞系中,在存在递增浓度的各种双特异性抗体和/或单克隆抗体以及双特异性抗体的组合的情况下观察到的adcp水平,显示为吞噬指数。
图15为一个图表,其描绘在胃癌nci-n87细胞系中,在存在递增浓度的各种双特异性抗体以及使用不同比率的双特异性抗体的组合的情况下观察到的adcp水平,显示为吞噬指数。
图16a为等电聚焦凝胶的图片,其上为经1种重链和3种不同轻链共表达获得,并通过蛋白a色谱从上清液中纯化的igg混合物的样品(泳道1)。将由两种双特异性抗体组成的k2o25o30子混合物上样于泳道2。
图16b为在k2o25o30子混合物的疏水相互作用色谱之后获得的色谱图。插入表中显示洗脱时间和峰特征。
图17为一个图表,其描绘在胃癌nci-n87细胞系中,在存在递增浓度的k2o25o30子混合物和k2o25与k2o30的等摩尔组合的情况下观察到的adcp水平,显示为吞噬指数。
图18a描绘在msln转染的肝癌hepg2小鼠模型中,2种cd47xmslnκλ体(k2o38和k2o41)及其组合(k2o38+k2o41)的抗肿瘤活性。图18b显示曲线下面积和统计分析。图18c为显示在不同治疗组中观察到的肿瘤生长抑制的图表。
详述
本文提供的多特异性抗体混合物和方法克服了对其他抗体形式和/或抗体混合物所见的局限性。目前,大多数批准的单克隆抗体形式为igg1同种型的未修饰抗体。然而,靶向单一抗原并不总是足以实现期望的治疗效果(fischerexpertopin.drugdiscov.20083(8):833-839)。组合使用两种mab可提高效率。例如,对于靶向免疫检查点分子的抗体(比如抗ctla4和抗pd-1抗体)在临床上采取这种策略(larkinetal.,nengljmed2015;373:23-34;harrisetal.,cancerbiolmed.201613(2):171-93)。然而,mab组合的开发涉及显著的成本和开发障碍。特别是,必须采用两个单独的制造过程,从而导致成本大幅增加(rasmussenetal.,archivesofbiochemistryandbiophysics2012526:39-145)。如果考虑靶向三种或更多种蛋白或抗原,这些问题变得甚至更加重要。
已经开发出双特异性抗体(biab)作为实现多特异性靶向的备选方法,并且迄今为止已经描述了60多种形式(spiessetal.,molimmunol.201567:95-106;brinkmannandkontermannmabs20179:182-212)。由于将两个结合位点结合至同一分子中,biab可实现mab或mab组合不支持的独特作用模式(fischerandlégerpathobiology.200774(1):3-14)。这种独特作用模式的实例为使t细胞或nk细胞重新靶向肿瘤细胞、biab经增加跨血脑屏障的转运递送至中枢神经系统、凝血因子viii模拟活性、选择性靶向多种细胞类型上表达的受体。
实现靶向两种或者甚至更多种蛋白的又一种方法为产生抗体混合物或重组多克隆混合物。与上述两种mab的组合(其中每种mab分别产生)形成对比,混合物中的抗体作为混合物一起产生。已经描述了产生混合物的各种方法(参见例如rajuandstrohlexpertopin.biol.ther.201313(10):1347-1352;wangetal.,2013currentopinioninchemicalengineering20132:1-11)。产生重组多克隆混合物的一般挑战为实现批次之间的一致性,使得混合物的每种组分保持恒定,从而使混合物的总体组成和生物活性保持一致。
在一种方法中,将各自表达单一单克隆抗体的不同的稳定细胞系混合在一起以产生多克隆细胞库,用于单个生物反应器中进行生产。在这种情况下,不同抗体被不同细胞系分泌至培养基中,并且所有抗体一起纯化以获得最终重组抗体混合物(rasmussenetal.,archivesofbiochemistryandbiophysics2012526:39-145)。在这种情况下,发酵期间单个细胞系的可再现生长和生产力特性必须极其良好地控制以确保重组多克隆混合物批次之间的一致性。一种细胞系的更快生长或生产力提高直接影响混合物的组成。实现这种控制水平并非易事,并且代表这种方法的重大障碍。然而,已经使用多克隆细胞系开发了多达25种独立抗体的非常复杂混合物,并在临床试验中进行了评估(hjelmströmetal.,blood2008112:1987)。
另一种策略为在单个细胞内共表达多种抗体重链和/或轻链。在这种情况下,不同重链和轻链可以配对,并因此可产生混合物。所得混合物的复杂性取决于共表达的不同链的数量。在这种方法中,确保不同的可能配对重新构成功能性抗原结合位点对于避免产生非功能性分子至关重要。可通过使用共同重链或共同轻链或者通过工程改造蛋白界面以优先形成期望的配对来解决该配对问题(参见例如fischeretal.,nat.comms20156:6113doi:10.1038/ncomms7113)。与先前依赖于混合独立细胞系的方法形成对比,该方法导致产生mab和biab两者。一个显著的优势是,一旦鉴定出以稳定方式表达不同抗体链的细胞系,就可简化发酵和生产,因为其类似于标准mab工艺。然而,如果允许所有配对,则混合物成分(mab和biab)的复杂性可能会非常显著,并且因此优选依赖于共同重链或轻链的抗体。
产生重组抗体混合物的不同方法、其益处和局限性列于表1中,并且在图1a-1c中说明。
表1.重组抗体混合物
已使用上述一些方法开发了几种混合物,并且已经达到临床阶段,表明该治疗方法是可行的。混合物可实现单一抗体无法实现的独特作用模式。
例如,已用抗体混合物积极研究了靶向her/erbb家族的受体。该受体酪氨酸激酶家族包括生长因子受体egfr/erbb1、her-2/erbb2、her-3/erbb3和her-4/erbb4。几种靶向egfr和her2的单克隆抗体被批准用于临床使用。研究报道,在体外和体内实验中,靶向多个表位并因此能够同时结合这些靶标的抗体混合物导致增强对癌细胞生长的抑制作用。这导致了针对her/erbb家族成员的几种抗体混合物的开发。一个实例为sym004,这是两种抗egfrmab的混合物,与批准的抗egfrmab西妥昔单抗相比较,其在临床前模型中显示出明显优异的活性(koefoedetal.,mabs20113:6,584-595)。mm-151为另一种混合物,由3种人类mab组成,其靶向egfr上不同的非重叠表位(arenaetal.,sciencetranslationalmedicine20168(324),324ra14)。与单一mab治疗相比较,这种混合物提供更有效地阻断受体和限制耐药性的出现。一种由6种靶向egfr、her2和her3的mab组成的更复杂混合物sym013(两种mab针对每种靶标上的非重叠表位)也已进入临床开发阶段。用混合物观察到的针对该受体家族的总体优异活性可通过几个因素来解释,比如该部分冗余信号传导通路的更完全关闭、经抗体介导的受体交联增加内在化和降解、增加fc介导的细胞杀伤。
其中抗体混合物已显示出引人注目的优势的另一个治疗领域为感染性疾病的治疗(oleksiewiczetal.,archivesofbiochemistryandbiophysics2012526:124-131;pohletal.,infectionandimmunity201381(6):1880-1888)。例如,可溶性毒素(比如肉毒杆菌毒素a)的多表位靶向不仅增加毒素的中和作用,而且增加其从循环中的清除。总体而言,与其他治疗领域形成对比,mab方法尚未证明对感染的治疗非常有效。这可能反映出有效防御复杂生物体(比如病原体)需要类似于天然免疫系统的多克隆抗体反应。
rozrolimupab为复杂抗体混合物可如何产生作用的引人注目的实例。这种针对恒河猴d抗原的25种mab的混合物为使用多克隆细胞库方法产生的,如图1b所示,并且已开发用于治疗免疫性血小板减少性紫癜(itp)。这种复杂混合物的益处为,其提供在种群中存在的众多恒河猴d变体的有效覆盖(robaketal.,blood.2012120(18):3670-76)。
这些实例突出表明,与单一mab治疗相比较,混合物可提供的机制优势。这些机制包括(但不限于):增加受体的内在化和降解、可溶性靶标的快速和优异清除、增加fc依赖性效应子功能、在单个靶标或多个靶标和途径上靶向多个表位的协同效应、更好地覆盖靶标变体和防止逃逸突变。
本发明提供产生以下的所定义抗体混合物的方法:i)仅有双特异性抗体(biab),或者ii)单克隆抗体(mab)和biab。该方法依赖于混合物中抗体的所有fv区共有的单一抗体重链和κ或λ家族的几种轻链的共表达。这种共表达和随机结合至igg分子中导致从单个细胞分泌均含有相同重链的单特异性mab或biab的混合物。然后可使用例如结合igg的fc区的亲和试剂(比如蛋白a)纯化完整混合物,如先前us20140179547所述。本发明比先前的方法有所改进,因为其使得能够选择性地纯化分泌的混合物的不同子集。特别是,其使得能够简单且成本有效地产生biab的混合物。这开辟了将biab的混合物用于单一mab或mab混合物无法实现的作用模式的可能性。本发明组合了使用单个生产细胞系的益处和控制最终纯化的混合物的组成以最大化期望的生物活性的可能性。
取决于与共同重链共表达的轻链数量,可产生不同类型的抗体混合物。该过程可概括如下:
当
n=与共同重链一起表达的不同轻链的数量
则
不同mab的数量=n
不同biab的数量=(n2-n)/2
不同抗体的总数=n+(n2-n)/2
表2列出2-10种不同轻链的共表达的这些数量,并且以下进一步详述3个实例:
1-如果两种抗体轻链与单一重链共表达,则会分泌3种不同抗体:2种mab(各自在每个fab中结合相同的轻链)和单一biab(在每个fab中结合不同的轻链)(参见图2a)。然而,这3种形式的丰度取决于2种轻链的相对表达和组装。如果表达和组装是等量的,则理论分布为每种mab是25%和biab是50%。
2-如果3种抗体轻链与单一重链共表达,则会分泌6种不同抗体:3种mab(各自在每个fab中结合相同的轻链)和3种biab(在每个fab中结合不同的轻链)(参见图2b)。如果表达和组装是等量的,则理论分布为每种mab是11.1%和每种biab是22.2%。
3-如果4种抗体轻链与单一重链共表达,则会分泌10种不同抗体:4种mab(各自在每个fab中结合相同的轻链)和6种biab(在每个fab中结合不同的轻链)(参见图2c)。如果表达和组装是等量的,则理论分布为每种mab是6.25%和每种biab是12.5%。
表2.抗体混合物概述
取决于共表达的不同轻链属于κ型还是λ型,含有κ或λ轻链的mab和biab的分布将会变化,因此使可通过该方法产生的混合物类型进一步多样化。例如,如果2种λ轻链和1种κ轻链与共同重链共表达,则将产生2种iggλλmab、1种iggκκmab、2种iggκλbiab和1种iggλλbiab,如图3所示。如果4种轻链共表达,则如果使用2种κ和2种λ轻链(图4),或者如果使用3种λ和1种κ轻链(图5),分子分布将会变化。
在给定的多特异性混合物中产生的抗体形式的所得数量可概括如下:
当
n=κ轻链的数量
m=λ轻链的数量
则
iggκκmab的数量=n
iggλλmab的数量=m
iggκλbiab的数量=nxm
iggκκbiab的数量=(n2-n)/2
iggλλbiab的数量=(m2-m)/2
如果不同轻链的表达和组装相同,则每种形式的所得理论分布可概括如下:
当
n=κ轻链的数量
m=λ轻链的数量
则
iggκκmab的比例=n/(nxm)
iggλλmab的比例=m/(nxm)
iggκλbiab的比例=(nxm)x2/(nxm)
iggκκbiab的比例=(n2-n)/(nxm)
iggλλbiab的比例=(m2-m)/(nxm)
如上所述,本发明提供从可通过共表达不同数量的κ和/或λ轻链产生的广泛种类的不同混合物中纯化以下的所明确定义子集的方法:i)仅有biab或者ii)mab和biab。本发明依赖于使用与fc部分特异性结合的树脂和与κ恒定区或λ恒定区特异性结合的树脂的多步亲和色谱。以这种方式,可易于分离出构成这些复杂混合物的抗体形式的子集,并根据所使用的树脂类型和期望的作用模式来定制其组成。
例如,使2种λ轻链和1种κ轻链与共同重链共表达产生由2种iggλλmab、1种iggκκmab、2种iggκλbiab和1种iggλλbiab组成的混合物(图3)。所有这些抗体形式均含有fc部分,并且可使用例如蛋白a色谱容易和有效地纯化。使用与κ或λ链特异性结合的亲和色谱介质,可易于从该混合物(混合物1,图3所示)中分离出不同的所定义抗体子集,从而使得能够分别捕获含有至少1个κ或λ链的所有抗体形式(参见图3,分别为子混合物2和3)。子混合物2将含有1种iggκκmab和2种iggκλbiab。子混合物3将含有2种iggλλmab、2种iggκλbiab和1种iggλλbiab。可经两个连续的亲和色谱步骤,使用与κ和λ链特异性结合的介质,分离出含有2种iggκλbiab(不含mab)的子混合物(图3,子混合物4)。
如果4种不同轻链共表达,则所得混合物会更复杂,并且取决于共表达的κ和λ轻链的比例。在图4和5中描述两个实例,其中分别共表达2种λ轻链和2种κ轻链或3种λ轻链和1种κ轻链。
将2种λ轻链和2种κ轻链与共同重链共表达产生一种混合物(混合物1,图4),其由2种iggλλmab、2种iggκκmab、4种iggκλbiab、1种iggλλbiab和1种iggκκbiab组成。所有这些抗体形式均含有fc部分,并且可使用例如蛋白a色谱有效地纯化。如上所述,使用与κ或λ链特异性结合的亲和色谱介质,可易于从该初始混合物1中分离出不同的所定义抗体子集,从而使得能够分别捕获含有至少1种κ或λ链的所有抗体形式(图4,分别为子混合物2和3)。子混合物2将含有2种iggκκmab、4种iggκλbiab和1种iggκκbiab。子混合物3将含有2种iggλλmab、4种iggκλbiab和1种iggλλbiab。最后,可经两个连续的亲和色谱步骤,使用与κ和λ链特异性结合的介质,分离出含有4种iggκλbiab(没有mab或者仅含有λ或仅含有κ链的biab)的混合物(图4,子混合物4)。
在其中3种λ轻链和1种κ轻链与共同重链共表达的情况下,产生一种混合物(混合物1,图5),其由3种iggλλmab、1种iggκκmab、3种iggκλbiab、3种iggλλbiab和1种iggκκbiab组成。所有这些抗体形式均含有fc部分,并且可使用例如蛋白a色谱有效地纯化。如上所述,使用与κ或λ轻链恒定结构域特异性结合的亲和色谱介质(比如captureselectfabkappa和captureselectfablambda亲和基质(gehealthcare)),可易于从该初始混合物1(图5)中分离出不同的所定义抗体子集,从而使得能够分别捕获含有至少1种κ或λ链的所有抗体形式(图5,分别为子混合物2和3)。子混合物2将含有1种iggκκmab和3种iggκλbiab。子混合物3将含有3种iggλλmab、3种iggκλbiab和3种iggλλbiab。最后,可经两个连续的亲和色谱步骤,使用与κ和λ链特异性结合的介质,分离出含有3种iggκλbiab(没有mab或者仅含有λ或仅含有κ链的biab)的子混合物(图5,子混合物4)。
上述两种情况突出表明,尽管在每种情况下4种轻链共表达,但所表达的链(即2种κ轻链和2种λ轻链或3种λ轻链和1种κ轻链)的性质导致产生和纯化非常不同的混合物子集,这些子集可通过应用本发明的方法容易和有效地分离。这些情况仅代表所选择的实例,并且不将本发明的应用限制于其他情况。
显然,基于其κ和λ轻链的各自含量,本发明通常可用于从复杂混合物中分离出mab和/或biab的子集。在任何情况下,均可使用与κ或λ抗体轻链的恒定或可变结构域特异性结合的亲和色谱介质纯化3种类型的混合物子集:
1.含有至少1种κ轻链的所有抗体分子,包括mab和biab两者
2.含有至少1种λ轻链的所有抗体分子,包括mab和biab两者
3.含有1种κ轻链和1种λ轻链的所有biab分子。
如专利us20140179547所述,本发明还可进一步用于纯化含有杂合轻链的抗体混合物的抗体子集。这些杂合链由以下任一组成:
1.与恒定λ结构域融合的可变κ结构域,或
2.与恒定κ结构域融合的可变λ结构域。
与全长λ或κ轻链相似,这些杂合分子可通过使用与以下任何一种结合的色谱介质,根据其可变和恒定结构域的组成进行选择性地分离:
·κ恒定结构域(比如captureselect™lc-kappa(hu)亲和基质(lifetechnologies,zug,switzerland))
·一些κ可变结构域(比如proteinl)
·λ恒定结构域(比如captureselect™lc-lambda(hu)亲和基质(lifetechnologies,zug,switzerland))。
本发明的一般应用如图6所示。
本公开的多特异性抗体混合物可用于多种适应症。依赖于mab、mab混合物或biab无法实现的作用模式,抗体混合物的子集可对治疗方法的开发具有多种应用。
特别是,本发明使得能够使用单个细胞系直接产生完全人类biab混合物,这代表了显著优势。实际上,如上所述,两种单独mab的组合导致成本显著增加。如果必须将两种单独的biab组合在一起,则这种局限性显然甚至更为显著,因为产生biab比标准mab更为复杂且成本更高。biab的潜在引人关注的混合物以及可如何使用本发明产生这些混合物的实例将在以下更详细地描述。
多表位靶向肿瘤相关抗原(taa)结合cd47阻断:cd47为一种普遍表达的受体,其可作为先天免疫系统的检查点,经与sirpα的相互作用抑制吞噬作用(参见例如oldenborg,p.a.,cd47:acellsurfaceglycoproteinwhichregulatesmultiplefunctionsofhematopoieticcellsinhealthanddisease,isrnhematol.2013;2013:614619;soto-pantojadr,etal.,therapeuticopportunitiesfortargetingtheubiquitouscellsurfacereceptorcd47(2012),expertopinthertargets.2013jan;17(1):89-103;sicke,etal.,cd47update:amultifacedactorinthetumormicroenvironmentofpotentialtherapeuticinterest,brjpharmacol.2012dec;167(7):1415-30)。用biab方法阻断cd47可避免针对cd47的mab所观察到的毒性。cd47xtaabiab仅使得能够对taa表达细胞上的cd47进行有限的抑制,从而避免毒性和药代动力学特性不良。靶向单一受体上两个表位的两种biab的混合物(各自结合抗-taa臂和抗cd47臂)将导致优异的抗cd47阻断作用、增加fc覆盖和最终更好的肿瘤细胞杀伤(图7a)。实际上,在这种情况下,对于每个taa分子,可阻断两个cd47受体并且两个fc存在于靶细胞表面,从而增强经fcγ受体相互作用的效应细胞募集。
共同重链与以下一起的共表达:
·驱动针对taa上第一表位的特异性的第一λ轻链
·驱动针对taa上第二表位的特异性的第二λ轻链
·驱动针对cd47的特异性的κ轻链
可通过两步亲和色谱,先后使用κ特异性亲和介质和λ特异性亲和介质,或反之亦然,从所得混合物中纯化含有2种biab(cd47xtaa表位1和cd47xtaa表位2)的子集(图7b)。
多taa靶向结合cd47阻断:以上实例可用于靶癌细胞表达的两种taa。靶向两种taa的两种biab的混合物(各自结合抗-taa臂和抗cd47臂)还将导致优异的抗cd47阻断作用、增加fc覆盖、进一步结合同taa阻断相关的作用和最终更好的肿瘤细胞杀伤(图8a)。
共同重链与以下一起的共表达:
·驱动针对第一taa的特异性的第一λ轻链
·驱动针对第二taa的特异性的第二λ轻链
·驱动针对cd47的特异性的κ轻链
可通过两步亲和色谱,先后使用κ特异性亲和介质和λ特异性亲和介质,或反之亦然,从所得混合物中纯化含有2种biab(cd47xtaa1和cd47xtaa2)的子集(图8b)。
多taa或表位靶向结合几种检查点分子的阻断:以上实例中使用的方法可扩展至由靶癌细胞表达的两种taa(或同一taa上的两个表位)结合阻断两种检查点受体(例如cd47和pd-l1)的臂。这种混合物将导致cd47阻断、pd-l1阻断、增加fc覆盖和最终更好的肿瘤细胞杀伤及免疫系统的潜在持久反应,同时避免与免疫检查点的一般单特异性阻断相关的毒性(图9a)。
共同重链与以下一起的共表达:
·驱动针对第一taa的特异性的第一λ轻链
·驱动针对第二taa的特异性的第二λ轻链
·驱动针对cd47的特异性的κ轻链
·驱动针对pd-l1的特异性的κ轻链
可通过两步亲和色谱,先后使用κ特异性亲和介质和λ特异性亲和介质,或反之亦然,从所得混合物中纯化含有4种不同biab(cd47xtaa1、cd47xtaa2、pd-l1xtaa1、pd-l1xtaa2)的子集(图9b)。
t细胞的多taa重新靶向:t细胞重新靶向为一种在肿瘤学上经过临床验证和广泛采用的方法(chamesandbatymabs.20091(6):539-47)。biab的混合物将使得t细胞能够重新靶向两种不同的taa(或同一taa上的表位),从而潜在地改善治疗效果(图10a)。
共同重链与以下一起的共表达:
·驱动针对第一taa的特异性的第一λ轻链
·驱动针对第二taa的特异性的第二λ轻链
·驱动针对cd3的特异性的κ轻链
可通过两步亲和色谱,先后使用κ特异性亲和介质和λ特异性亲和介质,或反之亦然,从所得混合物中纯化含有2种不同biab(cd3xtaa1、cd3xtaa2)的子集(图10b)。
以上实例为说明性的,并且不限制可通过应用本发明采用的可能应用。此外,显而易见的是,在任何实例中提供的任何κ链均可被λ链代替,并且反之亦然。
本发明的另一重要类型的应用为排除一种或几种形式的mab的mab和biab混合物的产生。该特征是重要的,因为对于一些靶标,mab的单特异性二价结合是有害的,并可导致毒性和其他不需要的作用。例如,已知抗cmet抗体会导致不需要的激动活性,其导致单价抗体的开发。使用本发明直接产生含有抗cmet抗体的混合物,但避免抗c-metmab。如上所述,用mab靶向cd47导致对人类的明显毒性。可从靶向其他受体的mab和靶向cd47连同另一受体的biab的混合物中去除抗cd47mab。类似地,还需要从含有cd3结合成分的抗体混合物中消除单克隆抗cd3。
组合单价和二价靶向两种肿瘤相关抗原:例如,靶向第一taa的mab组合靶向第一和第二taa的biab的混合物,应避免二价靶向。该策略可用于taa,比如cmet和egfr(图11a)。
共同重链与以下一起的共表达:
·驱动针对第一taa1的特异性的λ轻链
·驱动针对第二taa2的特异性的κ轻链
可通过亲和色谱,使用λ特异性亲和介质,从所得混合物中纯化含有biab(taa1xtaa2)和抗taa1mab的子集(图11b)。
同样,可合理化抗体混合物子集的其他应用,并且以上实例不限制本发明的范围。
相同的原理适用于任何抗体同种型以及非人类物种的抗体,只要可使用亲和性或其他色谱试剂来分离抗体的不同子混合物。
此外,本发明的相同原理可适用于f(ab’)2形式,其中单一vhch1与两种或更多种vκcκ或vλcλ共表达,从而导致分泌单特异性和双特异性f(ab’)2分子的混合物。然后,可根据本发明的方法,使用与κ或λ轻链的一部分结合的亲和色谱介质将其分离为明确定义的子混合物。类似地,当实施本发明的方法时,也可使用杂合vκcλ和vλcκ。
实施例
实施例1:用于双特异性抗体产生的候选抗体的选择
选择4种靶向hmsln上不同表位的抗体和抗hcd19抗体(均含有λ轻链)以及含有κ轻链的抗hcd47抗体,以用于产生抗体混合物。这些抗体均含有相同的重链,其描述于pct公开号wo2014/087248和共同未决专利申请美国专利申请号62/511669(2017年5月26日提交并且标题为“anti-cd47xanti-mesothelinantibodiesandmethodsofusethereof”),适合于基于κλ体形式的双特异性抗体的产生,如专利申请公开号us20140179547所述。所选抗体列于表3中,并且序列如下所示。
表3
表3中的抗hmsln、抗hcd19和抗hcd47抗体各自包含由seqidno:1所示核酸序列编码的共同重链(seqidno:2):
>共同-hc-nt(seqidno:1)
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgagactctcctgtgcagcctctggattcacctttagcagctatgccatgagctgggtccgccaggctccagggaaggggctggagtgggtctcagctattagtggtagtggtggtagcacatactacgcagactccgtgaagggccggttcaccatctccagagacaattccaagaacacgctgtatctgcaaatgaacagcctgagagccgaggacacggccgtatattactgtgcgaaaagttatggtgcttttgactactggggccagggaaccctggtcacagtctcgagcgcctccaccaagggcccatcggtcttccccctggcaccctcctccaagagcacctctgggggcacagcggccctgggctgcctggtcaaggactacttccccgaaccggtgacagtctcgtggaactcaggagccctgaccagcggcgtgcacaccttcccggctgtcctacagtcctcaggactctactccctcagcagcgtggtgactgtgccctccagcagcttgggcacccagacctacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagagagttgagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaagggcagccccgagaaccacaggtgtataccctgcccccatctcgggaggagatgaccaagaaccaggtcagcctgacttgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaacgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctatagcaagctcaccgtggacaagtccaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggttaa
>共同-hc-aa(seqidno:2)
evqllesggglvqpggslrlscaasgftfssyamswvrqapgkglewvsaisgsggstyyadsvkgrftisrdnskntlylqmnslraedtavyycaksygafdywgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg
表3中的抗hmsln、抗hcd19和抗hcd47抗体各自包含由seqidno:3所示核酸序列编码的共同可变重链结构域(seqidno:4):
>共同-vh-nt(seqidno:3)
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgagactctcctgtgcagcctctggattcacctttagcagctatgccatgagctgggtccgccaggctccagggaaggggctggagtgggtctcagctattagtggtagtggtggtagcacatactacgcagactccgtgaagggccggttcaccatctccagagacaattccaagaacacgctgtatctgcaaatgaacagcctgagagccgaggacacggccgtatattactgtgcgaaaagttatggtgcttttgactactggggccagggaaccctggtcacagtctcgagc
>共同-vh-aa(seqidno:4)
evqllesggglvqpggslrlscaasgftfssyamswvrqapgkglewvsaisgsggstyyadsvkgrftisrdnskntlylqmnslraedtavyycaksygafdywgqgtlvtvss
o25抗体包含由seqidno:1所示核酸序列编码的共同重链(seqidno:2)和包含由seqidno:5所示核酸序列编码的λ轻链(seqidno:6)。λ轻链的可变区在以下氨基酸序列中以粗体显示。
>o25-lc-nt(seqidno:5)
cagcctgtgctgactcagccggcttccctctctgcatctcctggagcatcagccagtctcacctgcaccttgcacagtggcatctctgttaaggattacaggatatactggtaccagcagaagccagggcgtcctccccagtatctcctgaggtacaagtctaattcagatatgcagcagggatctggagtccccagccgcttctctgggtccaaagatgcttcggccaatgcagggattttactcatctctgggctccagtctgaggatgaggctgactattactgtatgatttggcaccatggccatgggactagtcttgtgttcggcggagggaccaagctgaccgtcctaggtcagcccaaggctgccccctcggtcactctgttcccgccctcctctgaggagcttcaagccaacaaggccacactggtgtgtctcataagtgacttctacccgggagccgtgacagtggcttggaaagcagatagcagccccgtcaaggcgggagtggagaccaccacaccctccaaacaaagcaacaacaagtacgcggccagcagctatctgagcctgacgcctgagcagtggaagtcccacagaagctacagctgccaggtcacgcatgaagggagcaccgtggagaagacagtggcccctacagaatgttcataa
>o25-lc-aa(seqidno:6)
qpvltqpaslsaspgasasltctlhsgisvkdyriywyqqkpgrppqyllryksnsdmqqgsgvpsrfsgskdasanagillisglqsedeadyycmiwhhghgtslvfgggtkltvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptecs
o25抗体包含由seqidno:3所示核酸序列编码的共同可变重链结构域(seqidno:4)和包含由seqidno:7所示核酸序列编码的λ可变轻链结构域(seqidno:8)。
>o25-vh-nt(seqidno:7)
cagcctgtgctgactcagccggcttccctctctgcatctcctggagcatcagccagtctcacctgcaccttgcacagtggcatctctgttaaggattacaggatatactggtaccagcagaagccagggcgtcctccccagtatctcctgaggtacaagtctaattcagatatgcagcagggatctggagtccccagccgcttctctgggtccaaagatgcttcggccaatgcagggattttactcatctctgggctccagtctgaggatgaggctgactattactgtatgatttggcaccatggccatgggactagtcttgtgttcggcggagggaccaagctgaccgtccta
>o25-vh-aa(seqidno:8)
qpvltqpaslsaspgasasltctlhsgisvkdyriywyqqkpgrppqyllryksnsdmqqgsgvpsrfsgskdasanagillisglqsedeadyycmiwhhghgtslvfgggtkltvl
o30抗体包含由seqidno:1所示核酸序列编码的共同重链(seqidno:2)和包含由seqidno:9所示核酸序列编码的λ轻链(seqidno:10)。λ轻链的可变区在以下氨基酸序列中以粗体显示。
>o30-lc-nt(seqidno:9)
cagtctgtgctgactcagccaccctcagcgtctgggacccccgggcagagggtcaccatctcttgttctggaagcagctccaacatcgcgcatgggcctgtaaactggtaccagcagctcccaggaacggcccccaaactcctcatctatgctactaatcatcggccctcaggggtccctgaccgattttctggctccaagtctggcaccacagcctccctgaccatcagtgggctccagtctgaggatgaggctgattattactgtgctgcatatgatcttacgggctggtttgcgtatgctgtgttcggcggagggaccaagctgaccgtcctaggtcagcccaaggctgccccctcggtcactctgttcccgccctcctctgaggagcttcaagccaacaaggccacactggtgtgtctcataagtgacttctacccgggagccgtgacagtggcttggaaagcagatagcagccccgtcaaggcgggagtggagaccaccacaccctccaaacaaagcaacaacaagtacgcggccagcagctatctgagcctgacgcctgagcagtggaagtcccacagaagctacagctgccaggtcacgcatgaagggagcaccgtggagaagacagtggcccctacagaatgttcataa
>o30-lc-aa(seqidno:10)
qsvltqppsasgtpgqrvtiscsgsssniahgpvnwyqqlpgtapklliyatnhrpsgvpdrfsgsksgttasltisglqsedeadyycaaydltgwfayavfgggtkltvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptecs
o30抗体包含由seqidno:3所示核酸序列编码的共同可变重链结构域(seqidno:4)和包含由seqidno:11所示核酸序列编码的λ可变轻链结构域(seqidno:12)。
>o30-vl-nt(seqidno:11)
cagtctgtgctgactcagccaccctcagcgtctgggacccccgggcagagggtcaccatctcttgttctggaagcagctccaacatcgcgcatgggcctgtaaactggtaccagcagctcccaggaacggcccccaaactcctcatctatgctactaatcatcggccctcaggggtccctgaccgattttctggctccaagtctggcaccacagcctccctgaccatcagtgggctccagtctgaggatgaggctgattattactgtgctgcatatgatcttacgggctggtttgcgtatgctgtgttcggcggagggaccaagctgaccgtccta
>o30-vl-aa(seqidno:12)
qsvltqppsasgtpgqrvtiscsgsssniahgpvnwyqqlpgtapklliyatnhrpsgvpdrfsgsksgttasltisglqsedeadyycaaydltgwfayavfgggtkltvl
o35抗体包含由seqidno:1所示核酸序列编码的共同重链(seqidno:2)和包含由seqidno:13所示核酸序列编码的λ轻链(seqidno:14)。λ轻链的可变区在以下氨基酸序列中以粗体显示。
>o35-lc-nt(seqidno:13)
cagcctgtgctgactcagccggtttccctctctgcatctcctggagcatcagtcagtctcacctgcaccttgcgcagtgacatcagggttagagattacaggatattctggtaccagcagaagccagggagtcctccccagtatctcctgaggtacaaaaccgactcagataagcagcagggctctggagtccccagccgcttctctgggtccaaagatgcttcggccaatgcagggattttactcatctctgggctccagtctgaggatgaggctgactattactgtatgatttggcaccgcaccacgggcactagtcttgtgttcggcggagggaccaagctgaccgtcctaggtcagcccaaggctgccccctcggtcactctgttcccgccctcctctgaggagcttcaagccaacaaggccacactggtgtgtctcataagtgacttctacccgggagccgtgacagtggcttggaaagcagatagcagccccgtcaaggcgggagtggagaccaccacaccctccaaacaaagcaacaacaagtacgcggccagcagctatctgagcctgacgcctgagcagtggaagtcccacagaagctacagctgccaggtcacgcatgaagggagcaccgtggagaagacagtggcccctacagaatgttcataa
>o35-lc-aa(seqidno:14)
qpvltqpvslsaspgasvsltctlrsdirvrdyrifwyqqkpgsppqyllryktdsdkqqgsgvpsrfsgskdasanagillisglqsedeadyycmiwhrttgtslvfgggtkltvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptecs
o35抗体包含由seqidno:3所示核酸序列编码的共同可变重链结构域(seqidno:4)和包含由seqidno:15所示核酸序列编码的λ可变轻链结构域(seqidno:16)。
>o35-vl-nt(seqidno:15)
cagcctgtgctgactcagccggtttccctctctgcatctcctggagcatcagtcagtctcacctgcaccttgcgcagtgacatcagggttagagattacaggatattctggtaccagcagaagccagggagtcctccccagtatctcctgaggtacaaaaccgactcagataagcagcagggctctggagtccccagccgcttctctgggtccaaagatgcttcggccaatgcagggattttactcatctctgggctccagtctgaggatgaggctgactattactgtatgatttggcaccgcaccacgggcactagtcttgtgttcggcggagggaccaagctgaccgtccta
>o35-vl-aa(seqidno:16)
qpvltqpvslsaspgasvsltctlrsdirvrdyrifwyqqkpgsppqyllryktdsdkqqgsgvpsrfsgskdasanagillisglqsedeadyycmiwhrttgtslvfgggtkltvl
o38抗体包含由seqidno:1所示核酸序列编码的共同重链(seqidno:2)和包含由seqidno:30所示核酸序列编码的λ轻链(seqidno:29)。
>o38-lc-nt(seqidno:29)
cagcctgtgctgactcagccggcttccctctctgcatctcctggggcatcagccagtctcacctgcaccttgcgcagtggcatcaacgttagagattacaggatattctggtaccagcagaagccagggagtcctccccagtatctcctgaggtacaaaagcgcatcagataagcagcagggctctggagtccccagccgcttctctgggtccaaagatgcttcggccaatgcagggattttactcatctctgggctccagtctgaggatgaggctgactattactgtatgatttggcaccacgattcggaggggcatgcttttgtgttcggcggagggaccaagctgaccgtcctaggtcagcccaaggctgccccctcggtcactctgttcccgccctcctctgaggagcttcaagccaacaaggccacactggtgtgtctcataagtgacttctacccgggagccgtgacagtggcttggaaagcagatagcagccccgtcaaggcgggagtggagaccaccacaccctccaaacaaagcaacaacaagtacgcggccagcagctatctgagcctgacgcctgagcagtggaagtcccacagaagctacagctgccaggtcacgcatgaagggagcaccgtggagaagacagtggcccctacagaatgttcataa
>o38-lc-aa(seqidno:30)
qpvltqpaslsaspgasasltctlrsginvrdyrifwyqqkpgsppqyllryksasdkqqgsgvpsrfsgskdasanagillisglqsedeadyycmiwhhdseghafvfgggtkltvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptecs
o38抗体包含由seqidno:3所示核酸序列编码的共同可变重链结构域(seqidno:4)和包含由seqidno:32所示核酸序列编码的λ可变轻链结构域(seqidno:31)。
>o38-vl-nt(seqidno:31)
cagcctgtgctgactcagccggcttccctctctgcatctcctggggcatcagccagtctc
acctgcaccttgcgcagtggcatcaacgttagagattacaggatattctggtaccagcag
aagccagggagtcctccccagtatctcctgaggtacaaaagcgcatcagataagcagcag
ggctctggagtccccagccgcttctctgggtccaaagatgcttcggccaatgcagggatt
ttactcatctctgggctccagtctgaggatgaggctgactattactgtatgatttggcac
cacgattcggaggggcatgcttttgtgttcggcggagggaccaagctgaccgtccta
>o38-vl-aa(seqidno:32)
qpvltqpaslsaspgasasltctlrsginvrdyrifwyqqkpgsppqyllryksasdkqqgsgvpsrfsgskdasanagillisglqsedeadyycmiwhhdseghafvfgggtkltvl
o41抗体包含由seqidno:1所示核酸序列编码的共同重链(seqidno:2)和包含由seqidno:17所示核酸序列编码的λ轻链(seqidno:18)。λ轻链的可变区在以下氨基酸序列中以粗体显示。
>o41-lc-nt(seqidno:17)
tcctatgtgctgactcagccaccctcagtgtcagtggccccaggaaagacggccaggattacctgtgggggaaacaaaattggacaccgcgccgtgcactggtaccagcagaagccaggccaggcccctgtgctggtcatctattatacctatgagcggccctcagggattcctgagcgattctctggctccaactctgggaacacggccaccctgaccatcagcagggtcgaagccggggatgaggccgactattactgtcaggtgtgggattggtacagcgaggggggggttgtgttcggcggagggaccaagctgaccgtcctaggtcagcccaaggctgccccctcggtcactctgttcccgccctcctctgaggagcttcaagccaacaaggccacactggtgtgtctcataagtgacttctacccgggagccgtgacagtggcttggaaagcagatagcagccccgtcaaggcgggagtggagaccaccacaccctccaaacaaagcaacaacaagtacgcggccagcagctatctgagcctgacgcctgagcagtggaagtcccacagaagctacagctgccaggtcacgcatgaagggagcaccgtggagaagacagtggcccctacagaatgttcataa
>o41-lc-aa(seqidno:18)
syvltqppsvsvapgktaritcggnkighravhwyqqkpgqapvlviyytyerpsgiperfsgsnsgntatltisrveagdeadyycqvwdwyseggvvfgggtkltvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptecs
o41抗体包含由seqidno:3所示核酸序列编码的共同可变重链结构域(seqidno:4)和包含由seqidno:19所示核酸序列编码的λ可变轻链结构域(seqidno:20)。
>o41-vl-nt(seqidno:19)
tcctatgtgctgactcagccaccctcagtgtcagtggccccaggaaagacggccaggattacctgtgggggaaacaaaattggacaccgcgccgtgcactggtaccagcagaagccaggccaggcccctgtgctggtcatctattatacctatgagcggccctcagggattcctgagcgattctctggctccaactctgggaacacggccaccctgaccatcagcagggtcgaagccggggatgaggccgactattactgtcaggtgtgggattggtacagcgaggggggggttgtgttcggcggagggaccaagctgaccgtccta
>o41-vl-aa(seqidno:20)
syvltqppsvsvapgktaritcggnkighravhwyqqkpgqapvlviyytyerpsgiperfsgsnsgntatltisrveagdeadyycqvwdwyseggvvfgggtkltvl
l7-2抗体包含由seqidno:1所示核酸序列编码的共同重链(seqidno:2)和包含由seqidno:21所示核酸序列编码的λ轻链(seqidno:22)。
>l7-2-vl-nt(seqidno:21)
aattttatgctgactcagccccactctgtgtcggagtctccggggaagacggtaaccatctcctgcacccgcagcagtggctctatcgaagataagtatgtgcagtggtaccagcagcgcccgggcagttcccccaccattgtgatctattatgataacgaaagaccctctggggtccctgatcggttctctggctccatcgacagctcctccaactctgcctccctcaccatctctggactgaagactgaggacgaggctgactactactgtcagacctacgaccagagcctgtatggttgggtgttcggcggagggaccaagctgaccgtcctaggtcagcccaaggctgccccctcggtcactctgttcccgccctcctctgaggagcttcaagccaacaaggccacactggtgtgtctcataagtgacttctacccgggagccgtgacagtggcttggaaagcagatagcagccccgtcaaggcgggagtggagaccaccacaccctccaaacaaagcaacaacaagtacgcggccagcagctatctgagcctgacgcctgagcagtggaagtcccacagaagctacagctgccaggtcacgcatgaagggagcaccgtggagaagacagtggcccctacagaatgttcataa
>l7-2-lc-aa(seqidno:22)
nfmltqphsvsespgktvtisctrssgsiedkyvqwyqqrpgssptiviyydnerpsgvpdrfsgsidsssnsasltisglktedeadyycqtydqslygwvfgggtkltvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshrsyscqvthegstvektvaptecs
c2抗体包含由seqidno:113所示核酸序列编码的共同可变重链结构域(seqidno:114)和包含由seqidno:23所示核酸序列编码的λ可变轻链结构域(seqidno:24)。
>l7-2-vl-nt(seqidno:23)
aattttatgctgactcagccccactctgtgtcggagtctccggggaagacggtaaccatctcctgcacccgcagcagtggctctatcgaagataagtatgtgcagtggtaccagcagcgcccgggcagttcccccaccattgtgatctattatgataacgaaagaccctctggggtccctgatcggttctctggctccatcgacagctcctccaactctgcctccctcaccatctctggactgaagactgaggacgaggctgactactactgtcagacctacgaccagagcctgtatggttgggtgttcggcggagggaccaagctgaccgtccta
>l7-2-vl-aa(seqidno:24)
nfmltqphsvsespgktvtisctrssgsiedkyvqwyqqrpgssptiviyydnerpsgvpdrfsgsidsssnsasltisglktedeadyycqtydqslygwvfgggtkltvl
k2抗体包含由seqidno:1所示核酸序列编码的共同重链(seqidno:2)和包含由seqidno:25所示的核酸序列编码的λ轻链(seqidno:26)。
>k2-lc-nt(seqidno:25)
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagagcattagcagctatttaaattggtatcagcagaaaccagggaaagcccctaagctcctgatctatgctgcatccagtttgcaaagtggggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcagcagatgcacccgcgcgccccgaagaccttcggccaagggaccaaggtggaaatcaaacgtacggtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgttaa
>k2-lc-aa(seqidno:26)
diqmtqspsslsasvgdrvtitcrasqsissylnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqmhprapktfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
k2抗体包含由seqidno:3所示核酸序列编码的共同可变重链结构域(seqidno:4)和包含由seqidno:27所示核酸序列编码的λ可变轻链结构域(seqidno:28)。
>k2-vl-nt(seqidno:27)
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagagcattagcagctatttaaattggtatcagcagaaaccagggaaagcccctaagctcctgatctatgctgcatccagtttgcaaagtggggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcagcagatgcacccgcgcgccccgaagaccttcggccaagggaccaaggtggaaatcaaa
>k2-vl-aa(seqidno:28)
diqmtqspsslsasvgdrvtitcrasqsissylnwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqmhprapktfgqgtkveik
实施例2:带有λ和κ轻链的双特异性抗体的表达和纯化
在同一细胞中同时表达1种重链和2种轻链可导致3种不同抗体的组装。可以不同方式实现同时表达,比如转染表达要共表达的1种链的多种载体,或通过使用驱动多基因表达的载体。如us2012/0184716和wo2012/023053所述,先前产生了载体pnoviκhλ,以使得能够共表达1种重链、1种κ轻链和1种λ轻链,其各自特此通过参考以其全部结合。这3个基因的表达由人类巨细胞病毒启动子(hcmv)驱动,并且载体还含有谷氨酰胺合成酶基因(gs),其使得可选择和建立稳定的细胞系。将抗hmslniggλ、抗hcd19iggλ或抗hcd47iggκ的vl基因克隆在载体pnoviκhλ中,以用于在哺乳动物细胞中瞬时表达。在t175烧瓶中,将peak细胞在含有胎牛血清的45ml培养基中以每瓶8x106个细胞的浓度扩增和分裂。根据制造商的说明,使用lipofectamine2000转染试剂将30µg质粒dna转染到细胞中。使用bio-layerinterferometry(bli)技术,在生产期间的几个时间点测量转染细胞的含血清上清液中的抗体浓度。使用octetred96仪器和蛋白a生物传感器进行定量(pall,basel,switzerland)。用200µl上清液测定igg浓度;生物传感器经过预处理,并使用10mm甘氨酸(ph1.7)进行再生,并制备以条件peak细胞培养基稀释的igg校准品以用于产生标准曲线。使用剂量反应5pl加权y标准曲线方程和初始斜率结合速率方程确定浓度。根据抗体浓度,在转染之后7-10天收获上清液,并通过以1300g离心10分钟进行澄清。纯化过程由3个亲和步骤组成。首先,将captureselect™igg-ch1亲和基质(thermofisherscientific,waltham,ma)用pbs洗涤,并然后加入澄清的上清液中。在+4℃下温育过夜之后,将上清液以1000g离心10分钟,储存流通液并用pbs洗涤树脂两次。然后,将树脂转移到旋转柱上,并使用含有50mm甘氨酸的溶液(ph3.0)进行洗脱。产生几个洗脱级分,合并并使用50kdaamicon®ultracentrifugal过滤装置(merckkgaa,darmstadt,germany),针对25mm组氨酸/125mmnaclph6.0缓冲液脱盐。使用nanodrop分光光度计(nanodroptechnologies,wilmington,de)对含有来自上清液的总人类igg的最终产物进行量化,并在室温和20rpm下与适当体积的captureselect™lc-kappa(hu)亲和基质(thermofisherscientific,waltham,ma)一起温育30分钟。如前所述进行温育、树脂回收、洗脱和脱盐步骤。最后的亲和纯化步骤使用captureselect™lc-lambda(hu)亲和基质(thermofisherscientific,waltham,ma),应用与前两次纯化相同的方法进行。使用nanodrop量化最终产物。在变性和还原条件下,通过电泳分析纯化的双特异性抗体。如制造商(agilenttechnologies,santaclara,ca,usa)所述,将agilent2100bioanalyzer与protein80试剂盒一起使用。将4µl纯化的样品与补充有二硫苏糖醇(dtt;sigmaaldrich,st.louis,mo)的样品缓冲液混合。将样品在95℃下加热5分钟,并然后上样到芯片上。将来自第一纯化步骤的等分试样(含有双特异性抗体和两种单特异性mab)和最终产物的等分试样上样到isoelectricfocusing(ief)凝胶上,以评估最终纯化的双特异性抗体的纯度(不存在mab污染)。总水平通过sec-hplc测定。最后,使用octetred96评价双特异性抗体在两种靶标上的结合。简而言之,将生物素化的靶标(hmsln、hcd19、hcd47和无关靶标)上样到链霉亲和素生物传感器上。然后将该生物传感器浸入到含有双特异性抗体的溶液中,并实时监测结合。使用limulusamebocytelysate测试(lal;charlesriverlaboratories,wilmington,ma)测试所有样品的内毒素污染。将以下双特异性抗体表达为纯化的:
表4
实施例3:在吞噬作用测定中靶向hmsln和hcd47的单独双特异性抗体以及双特异性抗体组合的活性
靶向于肿瘤细胞表面表达的蛋白或抗原并能够在同一肿瘤细胞上共同结合cd47的双特异性抗体可通过阻止cd47与sirpα相互作用介导的抑制信号来介导巨噬细胞吞噬活性的提高。该原理已描述于pct公开号wo2014/087248和共同未决专利申请美国专利申请号62/511669(2017年5月26日提交并且标题为“anti-cd47xanti-mesothelinantibodiesandmethodsofusethereof”)。在此,我们测试了多表位靶向肿瘤相关抗原(taa)的假设,在这种情况下,hmsln组合cd47阻断,如图7所示。为了评估每分子msln具有更高fc密度和更高cd47阻断作用的益处,我们比较了由单独hcd47/hmsln双特异性抗体或由双特异性抗体的成对组合介导的吞噬活性。将hcd47/hcd19双特异性抗体k2l7-2用作单价抗hcd47对照,因为测定中不存在hcd19。测试了3种表达不同水平的hcd47和hmsln的肿瘤细胞系:nci-n87、hpac和caov-3。nci-n87细胞的cd47和间皮素的细胞表面表达水平分别为43000和27000。hpac细胞的cd47和间皮素的细胞表面表达水平分别为105000和13000。caov-3细胞的cd47和间皮素的细胞表面表达水平分别为220000和38000。
用从外周血单核细胞分化的人类巨噬细胞和作为靶细胞的nci-n87、hpac或caov3进行测定。在存在递增浓度的双特异性或单价抗体的情况下,将巨噬细胞与钙黄绿素am标记的靶细胞(效应器:靶标比率1:1)在37℃下共同温育2.5小时。温育期结束时,将上清液更换为完全培养基。用cx5成像平台对板成像,并根据条件采集1500个巨噬细胞并进行分析。吞噬作用由双阳性事件证明,吞噬指数由软件计算。
这些剂量反应实验表明,对所有3种细胞类型,由k2o30+k2o41组合介导的吞噬活性优于k2o30或k2o41的活性(图12a,13a和14a)。类似地,对所有3种细胞类型,由k2o35+k2o41组合介导的吞噬活性优于k2o35或k2o41的活性(图12b,13b和14b)。另外,对nci-n87和hpac细胞,由k2o38+k2o41组合介导的吞噬活性优于k2o38或k2o41的活性(图12c和14c)。对nci-n87细胞,k2o30+k2o25组合优于k2o30或k2o25的活性(图15)。在所有情况下,阴性对照igg(称为ni-0801,描述于pct公开号wo2008/106200中)或单价抗hcd47对照仅诱导最小或没有吞噬活性。在所有这些实例中,以等量(即以50:50比率)添加两种双特异性抗体。为了评估该等摩尔比率的细微变化是否会影响活性,将k2o30和k2o25以40:60和60:40的比率混合并进行测试。所有比率均给出相似的结果,表明两种双特异性抗体之间比率的细微差异不会显著影响组合的吞噬活性的提高(图15a)。
实施例4:从单一载体表达4种抗体链
修饰载体pnoviκhλ,以使得能表达另外的轻链。新载体pnovih3l含有4个启动子,驱动1种重链和3种轻链的表达。将k2抗cd47κ轻链和两种抗hmslnλ轻链o30和o25克隆到该单一载体中。通过测序验证所有编码序列和克隆接合处。如实施例2所述,将该载体用于瞬时转染,以验证其功能性,即可产生双特异性抗体。然后将载体线性化以在中国仓鼠卵巢(cho)细胞中进行电穿孔。
实施例5:含有双特异性和单特异性抗体的抗体混合物的表达
在本文呈现的研究中,稳定的cho系使用化学定义的无动物成分(cdacf)制造工艺进行转染和生长。通过电穿孔转染并用msx选择之后,通过facs进行筛选。选择最高生产池用于以分批补料条件进行生产。通过octet技术评价不同池的总igg生产力。如实施例2所述进行亲和纯化。使用agilentbioanalyzer,通过等电聚焦凝胶(ief)分析蛋白a色谱步骤之后含有所有igg形式的物质的多肽含量,并通过sec-hplc测定其总水平。最后,使用octetred96评价双特异性抗体在两种靶标上的结合。简而言之,将生物素化的靶标(hmsln、hcd47和无关靶标)上样到链霉亲和素生物传感器上。然后将该生物传感器浸入到含有双特异性抗体的溶液中,并实时监测结合。使用limulusamebocytelysate测试(lal;charlesriverlaboratories,wilmington,ma)测试所有样品的内毒素污染。
实施例6:含有两种双特异性抗体的子混合物的纯化
在实施例5中表达和纯化的所有igg形式(双特异性和单特异性igg)的混合物,使用与κ或λ轻链恒定结构域特异性相互作用的介质(比如captureselectfabkappa和captureselectfablambda亲和基质(gehealthcare))进一步进行两步色谱。这两个步骤使得能够回收所有含有κ轻链和λ轻链两者的igg形式,如图6和7b所示。然后将总igg应用于含有用10倍体积pbs平衡的captureselectfabkappa亲和基质(gehealthcare)的柱上。然后用5-10倍柱体积的pbs洗涤该柱。通过应用5倍柱体积的0.1m甘氨酸(ph3.0)从柱上洗脱所有带有κ轻链的免疫球蛋白分子,并收集级分。合并含有抗体的级分,之后在用pbs平衡的amicon缓冲液交换柱(merck)上进行缓冲液交换。然后将抗体应用于含有用10倍体积pbs平衡的captureselectfablambda亲和基质的第二柱上。然后用5-10倍柱体积的pbs洗涤该柱。所有仅带有κ轻链的免疫球蛋白分子均与柱结合,并在流通液中发现。通过应用5倍柱体积的0.1m甘氨酸(ph3.0)从柱上洗脱带有λ轻链的抗体,并收集级分。合并含有双特异性抗体的级分,之后在用pbs平衡的amicon缓冲液交换柱(merck)上进行缓冲液交换。通过sds-page分析每个纯化步骤的流通液和洗脱级分,并且表明在captureselectfabkappa亲和基质的流通液中发现带有λ轻链的抗体,并且相反,在captureselectfablambda亲和基质的流通液中发现带有κ轻链的抗体。
在蛋白a步骤之后获得的所有igg形式的混合物和如上所述纯化的含有两种双特异性抗体形式的k2o25o30子混合物通过ief进行分析(图16a)。如预期的那样,对在蛋白a之后获得的混合物可见对应于不同单-和双特异性抗体形式的6个条带。在3个亲和纯化步骤之后,可见对应于含有κ和λ轻链的双特异性形式的两个条带。通过疏水相互作用色谱(hic)对纯化的k2o25o30子混合物进行进一步分析,以确定两种双特异性抗体形式的相对含量。两个不同峰的积分表明,k2o25o30含有69%的k2o25和31%的k2o30(图16b)。
实施例7:含有两种靶向hmsln和hcd47的双特异性抗体的子混合物以及相同的两种双特异性抗体的组合在吞噬作用测定中的活性
然后,如实施例3所述,在使用nci-n87细胞的体外吞噬作用测定中,将实施例6中分离的k2o25o30子混合物的活性与k2o25和k2o30的等摩尔组合进行比较。k2o25o30与k2o25和k2o30的等摩尔组合的活性相同(图17),表明与实施例3所述的单独双特异性抗体的活性相比较,该子混合物概括了组合活性的提高。
实施例8:双特异性抗体组合的体内抗肿瘤活性
以msln转染的肝癌hepg2模型评估2种cd47xmslnκλ体(k2o38和k2o41)和一种cd47xmslnκλ体组合(k2o38+k2o41)的抗肿瘤活性。将3.106个hepg2-msln细胞皮下植入nod/scid小鼠中。每周测量肿瘤体积2-3次(使用以下公式:(长x宽2)/2)。当肿瘤达到150-200mm3之间时开始治疗。将小鼠随机分为8组(每组6-7只小鼠)。该实验比较了cd47xmslnκλ体组合的作用与单独cd47xmslnκλ-体和mslnmab阿玛西单抗的作用。i.v.注射抗体每周一次,直至实验结束(d28)。所有抗体均以每次注射60mg/kg给予。肿瘤体积测量用于计算每只单个小鼠的曲线下面积(auc)。为了进行统计分析,使用graphpadprism先后进行了单因素方差分析和多重比较检验(tukey多重比较)。p<0.05认为具有统计学意义。还基于肿瘤体积,使用以下公式确定与同种型对照组相比较的肿瘤生长抑制(tgi)百分比:%tgi={1-[(tt-t0)/(vt-v0)]}x100;其中tt=在时间t时治疗的中位肿瘤体积;t0=在时间0时治疗的中位肿瘤体积;vt=在时间t时对照的中位肿瘤体积和v0=在时间0时对照的中位肿瘤体积。
如图18所示,与higg1对照相比较,用2种cd47xmslnκλ体治疗显著减少肿瘤生长,其中k2o41的tgi为21%,和k2o38的tgi为46%。与单一方法相比较,组合显示出对肿瘤生长的优异效果,其中k2o41+k2o38的tgi为80%。最后,与目前正在进行临床研究的识别msln的中和性mab阿玛西单抗相比较,单一cd47xmslnκλ体及其组合两者均呈现出优异的抗肿瘤作用。
其他实施方案
尽管本发明已结合其详述进行了描述,但是前述描述旨在说明而不是限制本发明的范围,本发明的范围由随附权利要求的范围限定。其他方面、优势和修改处于随附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 与CD56分子特异性结合的多肽及其应用的制造方法与工艺
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 避免信号干扰的肌原纤维蛋白丝氨酸磷酸化水平的测定方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 活化人CD40的抗体和针对人PD‑L1的抗体的组合疗法的制造方法与工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺