关于抗体的复制保护的制作方法
发明领域
本发明涉及包含抗体和标签的抗体缀合物及其用途,其中存在于抗体中的一种或多种元素显示出与所述一种或多种元素的自然存在的同位素比率不同的同位素比率,其中自然界中的稀有同位素的量增加至抗体中的相应元素原子的至少4%。
背景
蛋白质特别是抗体的一级氨基酸序列(包括共价连接的修饰)可以使用质谱法容易地测定(applicationsofliquidchromatographycoupledtomassspectrometry-basedmetabolomicsinclinicalchemistryandtoxicology:areview,2011,第44卷,第1期,第119-135页,特刊)。一般,执行下述步骤:a)分离靶;b)用产生多种肽的多种不同的酶来酶促消化靶;c)层析分离所产生的肽;d)使用质谱法测量完整肽以及其序列特异性片段的质量;e)测量的数据的基于软件的解释用于鉴定肽的序列;e)由不同蛋白酶产生的重叠肽的组合用于确定整个蛋白质的完整氨基酸序列。对于这个过程,仅需要约50µg的蛋白质,以及商购可得的hplc和质谱法仪器(例如来自absciex的tripletof系统或来自thermofisher的基于orbitrap的混合ms仪器)和合适的软件(例如来自bioinformaticssolutions,inc的peaks®studiosoftware)。迄今,尚无可用于保护蛋白质例如抗体免于通过质谱法测序的机制。
然而,本领域存在保护蛋白质免于被测序的迫切需要,所述蛋白质特别是可能具有商业利益的那些蛋白质,这是因为它们可以是药物、诊断和/或生物技术产品的部分。
这个问题通过本发明人提供蛋白质特别是抗体以及产生且使用其的方法得到解决,所述蛋白质特别是抗体,包含一种或多种元素的稳定同位素的改变的比率。蛋白质中的一种或多种元素的稳定同位素的改变的比率的掺入改变所述蛋白质的质量。如果使用质谱法进行分析,则每种产生的肽的质量以及完整蛋白质的质量两者均与自然存在的那些不同。因此,使用可用的标准工具的序列确定不再是可能的。因此标记的蛋白质的进一步优点是蛋白质内的同位素的均匀分布,其导致质谱法谱中降低的信号。
发明概述
在第一个方面,本发明涉及包含抗体和标签的抗体缀合物,其中存在于抗体中的一种或多种元素显示出与所述一种或多种元素的自然存在的同位素比率不同的同位素比率,其中自然界中的稀有同位素的量增加至抗体中的相应元素原子的至少4%。在第二个方面,本发明涉及如本发明的第一个方面所详细说明的抗体缀合物用于预防抗体(特别是经由massspec)的测序的用途。
在第三个方面,本发明涉及稳定同位素标记用于保护如本发明的第一个方面所详细说明的抗体缀合物的序列免于(特别是经由massspec)被测定的用途。
在第四个方面,本发明涉及试剂盒,其包括如本发明第一个方面所详细说明的至少一种抗体缀合物。
附图列表
图1:lc-ms/ms后的序列覆盖度;a:在正常培养基中表达的抗-tnt-抗体;b:在c13标记的培养基中表达的抗-tnt-抗体
图2:同位素效应的模拟
图3:肽ntqpimdtdgsyfvysk的测量谱;a:模拟;b:在正常(第一谱)或c13标记的培养基(第二谱)中表达的抗-tnt-抗体
图4:biacore测定–示意图
图5:a+b:biacore测定中的抗-tnt-抗体的结合亲和力
详述
定义
在下文详细描述本发明之前,应理解,本发明并不限于本文描述的特定方法、规程和试剂,这是因为这些可以变化。还应理解,本文使用的术语仅是为了描述特定实施方案起见的,且并不是用来限制仅由所附权利要求限制的本发明的范围的。除非另有定义,否则本文使用的所有技术和科学术语都具有与本领域普通技术人员通常理解的相同的含义。
在本说明书的文本自始至终引用了几个文件。无论是上文还是下文,本文引用的每个文件(包括所有专利、专利申请、科学出版物、制造商的说明书、说明书等),都特此整体引入作为参考。本文的任何内容均不应解释为承认本发明无权凭借在先发明而早于这种公开内容。本文引用的一些文件表征为被“引入作为参考”。在这种引入的参考文献的定义或教导与本说明书中叙述的定义或教导之间冲突的情况下,以本说明书的文本为准。
在下文中,将描述本发明的要素。这些要素与特定实施方案一起列出,然而,应该理解,它们可以以任何方式和任何数目组合,以产生额外的实施方案。各种描述的实例和优选实施方案不应该被解释为将本发明限制于仅明确描述的实施方案。这种描述应该被理解为支持并包含将明确描述的实施方案与任何数目的所公开和/或优选的要素组合的实施方案。此外,除非上下文另外指出,否则本申请中所有描述的要素的任何排列和组合都应该被视为由本申请的描述公开。
单词“包含(comprise)”以及变化形式如“包含(comprises)”和“包含(comprising)”,将被理解为暗示包括所陈述的整数或步骤或者整数或步骤组,但不排除任何其它整数或步骤或者整数或步骤组。
如在本说明书和所附权利要求中使用的,单数形式“一个(a)”、“一种(an)”和“该/所述(the)”包括复数对像,除非内容另外明确指出。
百分比、浓度、量和其它数字数据可以在本文中以“范围”格式表示或呈现。应理解,这种范围格式仅为了方便和简洁而使用,并且因此应该灵活地解释为不仅包括明确叙述为范围界限的数值,而且包括在该范围内包含的所有个别的数值或子范围,如同每个数值和子范围被明确叙述一样。作为举例说明,“4至20%”的数字范围应该被解释为不仅包括明确叙述的4%至20%的值,而且包括在指出的范围内的个别值和子范围。因此,在这个数字范围内包括的是个别值,例如4、5、6、7、8、9、10、...、18、19、20%,以及子范围,例如4-10%、5-15%、10-20%等。这个相同原理适用于仅叙述一个数值的范围,如例如最小值或最大值。此外,无论所描述的范围的宽度或特征如何,这种解释都应该适用。
当与数值结合使用时,术语“约”指的是包含在范围内的数值,所述范围具有比所指出的数值小5%的下限,并且具有比所指出的数值大5%的上限。
术语“氨基酸”一般指任何单体单位,其包含取代或未取代的氨基,取代或未取代的羧基,以及一个或多个侧链或基团,或这些基团中的任一种的类似物。示例性的侧链包括,例如,硫醇、硒基、磺酰基、烷基、芳基、酰基、酮基、叠氮基、羟基、肼、氰基、卤、酰肼、链烯基、炔基、醚、硼酸根、硼酸酯(boronate)、磷酸基、膦酰基、膦、杂环、烯酮、亚胺、醛、酯、硫羰酸、羟胺或这些基团的任何组合。其它代表性氨基酸包括,但不限于,包含可光活化的交联剂的氨基酸、金属结合氨基酸、自旋标记的氨基酸、荧光氨基酸、含金属氨基酸、具有新官能团的氨基酸、与其它分子共价或非共价相互作用的氨基酸、光敏笼状(photocaged)和/或可光异构化的氨基酸、放射性氨基酸、包含生物素或生物素类似物的氨基酸、糖基化氨基酸、其它碳水化合物修饰的氨基酸、包含聚乙二醇或聚醚的氨基酸、重原子取代的氨基酸、可化学切割和/或可光切割的氨基酸、含有碳连接的糖的氨基酸、氧还活性氨基酸、包含氨基硫羰酸的氨基酸和包含一种或多种毒性部分的氨基酸。如本文使用的,术语“氨基酸”包括下述二十种自然或遗传编码的α-氨基酸:丙氨酸(ala或a)、精氨酸(arg或r)、天冬酰胺(asn或n)、天冬氨酸(asp或d)、半胱氨酸(cys或c)、谷氨酰胺(gln或q)、谷氨酸(glu或e)、甘氨酸(gly或g)、组氨酸(his或h)、异亮氨酸(ile或i)、亮氨酸(leu或l)、赖氨酸(lys或k)、甲硫氨酸(met或m)、苯丙氨酸(phe或f)、脯氨酸(pro或p)、丝氨酸(ser或s)、苏氨酸(thr或t)、色氨酸(trp或w)、酪氨酸(tyr或y)和缬氨酸(val或v)。术语“非必需”氨基酸指可以由人合成,并且因此对于人膳食不是必需的那些氨基酸。存在11种非必需氨基酸:丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、脯氨酸、丝氨酸和酪氨酸。“必需氨基酸”是不能由人体合成,并且因此需要由食物蛋白提供的那些氨基酸。必需氨基酸包括组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、苏氨酸、色氨酸、缬氨酸。这二十种自然氨基酸的结构显示于,例如,stryer等人,biochemistry,第5版,freemanandcompany(2002)中。额外的氨基酸,例如硒代半胱氨酸和吡咯赖氨酸,也可以被遗传编码(stadtman(1996)“selenocysteine,”annurevbiochem.65:83-100,以及ibba等人(2002)“geneticcode:introducingpyrrolysine,”currbiol.12(13):r464-r466)。术语“氨基酸”还包括非自然氨基酸、修饰的氨基酸(例如,具有修饰的侧链和/或主链)和氨基酸类似物。氨基酸可以合并成肽、多肽或蛋白质。
在本发明的上下文中,术语“肽”指通过肽键连接的氨基酸的短聚合物。它具有与蛋白质相同的化学(肽)键,但长度通常较短。最短的肽是二肽,由通过单个肽键连接的两个氨基酸组成。还可以存在三肽、四肽、五肽等。一般,肽具有最多到4、6、8、10、12、15、18或20个氨基酸的长度。除非它是环状肽,否则肽具有氨基末端和羧基末端。
在本发明的上下文中,术语“多肽”指通过肽键结合在一起的氨基酸的单条直链,并且一般包含至少约21个氨基酸,即至少21、22、23、24、25等个氨基酸。多肽可以是由多于一条链组成的蛋白质的一条链,或者如果蛋白质由一条链组成,则它可以是蛋白质本身。
在本发明的不同方面的上下文中,术语“蛋白质”指包含恢复二级结构和三级结构的一种或多种多肽的分子,并且另外指由形成四级结构的几种多肽,即几种亚基构成的蛋白质。蛋白质有时具有附着的非肽基团,所述基团可以称为辅基或辅因子。
如本文使用的,术语“变体”应理解为与它由其衍生的分子相比,在其长度或序列方面差别是一种或多种变化的分子。变体由其衍生的分子也称为亲本分子。术语“变体”包括亲本分子的“片段”或“衍生物”。一般,“片段”在长度或大小中小于亲本分子,而“衍生物”与亲本分子相比,显示出在其序列中的一种或多种差异。还包含的是修饰的分子,例如但不限于翻译后修饰的蛋白质(例如糖基化、生物素化、磷酸化、泛素化、棕榈酰化或蛋白酶解切割的蛋白质)和修饰的核酸,例如甲基化的dna。术语“变体”也包含不同分子的混合物,例如但不限于rna-dna杂交体。一般,变体是优选通过基因技术手段人工构建的,而亲本蛋白或多核苷酸是野生型蛋白或多核苷酸或者其共有序列。然而,自然存在的变体也应理解为由如本文使用的术语“变体”包含。进一步地,可用于本发明中的变体还可以衍生自亲本分子的同源物、直向同源物或侧向同源物或者人工构建的变体,只要所述变体显示出亲本分子的至少一种生物活性,即是功能活性的。
特别地,术语“肽变体”、“多肽变体”、“蛋白质变体”应理解为与它由其衍生的肽、多肽或蛋白质相比,在氨基酸序列方面差别是一种或多种变化的肽、多肽或蛋白质。相应的变体由其衍生的肽、多肽或蛋白质也称为亲本肽、多肽或蛋白质。进一步地,可用于本发明中的变体还可以衍生自亲本肽、多肽或蛋白质的同源物、直向同源物或侧向同源物或者人工构建的变体,只要所述变体显示出亲本肽、多肽或蛋白质的至少一种生物活性。氨基酸序列中的变化可以是氨基酸交换、插入、缺失、n-末端截短或c-末端截短、或这些变化的任何组合,其可以在一个或几个位点处发生。多肽或蛋白质变体可以显示出氨基酸序列中的总数最多到200(最多到1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190或200)种变化(即交换、插入、缺失、n-端截短和/或c-末端截短)。氨基酸交换可以是保守的和/或非保守的。另一方面或此外,如本文使用的“变体”的特征可以在于与它由其衍生的亲本肽、多肽或蛋白质的一定程度的序列同一性。更精确地,在本发明的上下文中的肽、多肽或蛋白质变体显示出与其亲本肽、多肽或蛋白质至少80%的序列同一性。多肽或蛋白质变体的序列同一性是在20、30、40、50、60、70、80、90、100个或更多个氨基酸的连续序列段上。
关于参考序列的“百分比(%)氨基酸序列同一性”定义为在比对序列并引入缺口(如果有必要的话)以达到最大的百分比序列同一性后,并且为了比对起见不考虑任何保守取代作为序列同一性的部分,候选序列中与参考亲本序列中的氨基酸残基等同的氨基酸残基的百分比。用于确定百分比氨基酸序列同一性的目的的比对可以以在本领域技术内的各种方式来实现,例如使用可公开获得的计算机软件,例如blast、blast-2、clustalw、megalign(dnastar)软件或fasta程序包。fasta程序包由w.r.pearson和d.j.lipman(1988),“improvedtoolsforbiologicalsequenceanalysis”,pnas85:2444-2448;w.r.pearson(1996)“effectiveproteinsequencecomparison”meth.enzymol.266:227-258;以及pearson等人(1997)genomics46:24-36写作,并且可从http://www.ebi.ac.uk/tools/sss/fasta/公开获得。本领域技术人员可以确定用于比对序列的适当参数,包括在待比较序列的全长上实现最大比对所需的任何算法。
术语“氨基酸突变”或“氨基酸改变”表示亲本氨基酸序列的氨基酸序列中的修饰。示例性修饰包括氨基酸取代、插入和/或缺失。
术语“在位置处的氨基酸突变”或“在位置处的氨基酸改变”表示指定残基的取代或缺失,或与指定残基相邻的至少一个氨基酸残基的插入。术语“与指定残基相邻的插入”表示在其一个至两个残基内的插入。插入可以在指定残基的n-末端或c-末端。
术语“氨基酸取代”表示预定的亲本氨基酸序列中的至少一个氨基酸残基被不同的“置换”氨基酸残基的置换。一个或多个置换残基可以是“自然存在的氨基酸残基”(即,由遗传密码编码的),并且选自:丙氨酸(ala);精氨酸(arg);天冬酰胺(asn);天冬氨酸(asp);半胱氨酸(cys);谷氨酰胺(gln);谷氨酸(glu);甘氨酸(gly);组氨酸(his);异亮氨酸(ile):亮氨酸(leu);赖氨酸(lys);甲硫氨酸(met);苯丙氨酸(phe);脯氨酸(pro);丝氨酸(ser);苏氨酸(thr);色氨酸(trp);酪氨酸(tyr);和缬氨酸(val)。氨基酸交换可以是保守的、半保守的和/或非保守的。半保守的和尤其保守的氨基酸取代是优选的,其中氨基酸被化学相关的氨基酸取代。典型的取代在脂族氨基酸中,在具有脂族羟基侧链的氨基酸中,在具有酸性残基的氨基酸中,在酰胺衍生物中,在具有碱性残基的氨基酸中或具有芳族残基的氨基酸中。典型的半保守和保守取代为:
如果新的半胱氨酸仍然作为游离硫醇,则从a、f、h、i、l、m、p、v、w或y变为c是半保守的。此外,技术人员将理解,在空间上要求的(stericallydemanding)位置处的甘氨酸不应该被取代,并且p不应该被引入具有α-螺旋或β片层结构的蛋白质部分内。
用一种或多种非自然存在的氨基酸残基的取代也由本文的氨基酸取代的定义包含。“非自然存在的氨基酸残基”表示除上文列出的那些自然存在的氨基酸残基外的残基,其能够与多肽链中的一个或多个相邻氨基酸残基共价结合。非自然存在的氨基酸残基的实例包括正亮氨酸、鸟氨酸、正缬氨酸、高丝氨酸、α-氨基异丁酸(aib)和其它氨基酸残基类似物,例如在ellman等人,meth.enzym.202(1991)301-336中描述的那些。为了产生这种非自然存在的氨基酸残基,可以使用noren等人(science244(1989)182)和/或ellman等人(上文)的程序。简言之,这些程序涉及用非自然存在的氨基酸残基化学激活抑制型trna,继之以rna的体外转录和翻译。
术语“氨基酸缺失”表示在氨基酸序列中的预定位置处的至少一个氨基酸残基的去除。
在本申请中,每当提及氨基酸改变时,它是有意的氨基酸改变而不是随机的氨基酸修饰。
术语“抗原”指引起免疫系统产生针对其的抗体的任何物质。抗原可以源于体内(“自身抗原”)或外部环境(“非自身的”)。抗原呈递细胞以组织相容性分子上的肽形式呈递抗原。适应性免疫系统的t细胞识别抗原。取决于抗原和组织相容性分子的类型,激活不同类型的t细胞。
“表位”,也称为“抗原决定簇”,是大分子的区段,特别是蛋白质或非蛋白质抗原的区段,其被免疫系统,特别是抗体、b细胞或t细胞识别。表位一般是抗原的部分,并且能够被抗体或其抗原结合片段结合。在这个上下文中,术语“结合”优选地涉及特异性结合。在本发明的上下文中,术语“表位”指被抗体识别的蛋白质区段。表位通常由分子的化学活性表面定组例如氨基酸或糖侧链组成,并且通常具有特定的三维结构特征以及特定电荷特征。构象表位和非构象表位的区别在于,在有变性溶剂的情况下,与前者的结合而不是与后者的结合丧失。对于与特定表位结合的抗体(即,与相同表位结合的那些)的筛选可以使用本领域常规的方法来完成,所述方法如例如但不限于丙氨酸分区、肽印迹(参见meth.mol.biol.248(2004)443-463)、肽切割分析、表位切除、表位提取、抗原的化学修饰(参见prot.sci.9(2000)487-496)和交叉阻断(参见"antibodies,"harlow和lane(coldspringharborpress,coldspringharb.,ny)。基于抗原结构的抗体概况分析(profiling)(asap),也称为修饰辅助的概况分析(map),允许基于来自多种的抗体各自与化学或酶促修饰的抗原表面的结合概况,箱并(bin)与某一抗原特异性结合的许多种单克隆抗体(参见例如,us2004/0101920)。每个箱中的抗体与相同的表位结合,所述表位可以是与由另一个箱代表的表位显然不同或部分重叠的独特表位。竞争性结合也可以用于容易地确定抗体是结合与参考抗体相同的抗原表位,还是与参考抗体竞争结合相同的抗原。在实施方案中,如果如在竞争性结合测定中所测量的,1-、5-、10-、20-或100-倍过量的一种抗体将另一种抗体的结合抑制至少50%、至少75%、至少90%或甚至99%或更多,则两种抗体被视为结合相同或重叠的表位(参见,例如,junghans等人,cancerres.50(1990)1495-1502)。
在一些实施方案中,如果抗原中减少或消除一种抗体的结合的基本上所有氨基酸突变也减少或消除另一种抗体的结合,则两种抗体被视为结合相同的表位。如果仅减少或消除一种抗体结合的氨基酸突变的亚群减少或消除另一种抗体的结合,则两种抗体被视为具有“重叠表位”。
如本文使用的术语“抗体”指分泌的免疫球蛋白(ig),其缺乏跨膜区域,且因此可以被释放到血流和体腔内。“天然抗体”指具有不同结构的自然存在的免疫球蛋白分子。例如,天然igg抗体是约150,000道尔顿的异四聚体糖蛋白,由二硫键合的两条等同的轻链和两条等同的重链组成。
人抗体基于它们具有的重链分组成不同的同种型。存在由希腊字母表示的五种类型的人ig重链:α、γ、δ、ε和μ。存在的重链类型定义了抗体类别,其各自执行不同作用,并且指导针对不同类型的抗原的适当免疫应答。因此,抗体的“类别”指由其重链所具有的恒定结构域或恒定区的类型。抗体的五种主要类别是:iga、igd、ige、igg和igm,并且这些中的几个可以进一步分为亚类(同种型),例如,igg1、igg2、igg3、igg4、iga1和iga2。
不同的重链在大小和组成方面不同;并且可以包含大约450个氨基酸(janeway等人(2001)immunobiology,garlandscience)。iga在黏膜区域例如消化道、呼吸道和尿生殖道,以及唾液、眼泪和母乳中发现,并且预防由病原体定居(underdown&schiff(1986)annu.rev.immunol.4:389-417)。igd主要起在尚未暴露于抗原的b细胞上的抗原受体的作用,并且与激活嗜碱性粒细胞和肥大细胞以产生抗微生物因子有关(geisberger等人(2006)immunology118:429-437;chen等人(2009)nat.immunol.10:889-898)。ige与经由其与变应原的结合的变态反应有关,从而触发来自肥大细胞和嗜碱性粒细胞的组胺释放。ige还与针对寄生蠕虫的保护有关(pier等人(2004)immunology,infection,andimmunity,asmpress)。igg提供了针对侵入病原体的大多数基于抗体的免疫,并且是能够穿过胎盘以给予胎儿被动免疫的唯一抗体同种型(pier等人(2004)immunology,infection,andimmunity,asmpress)。在人中,存在四种不同的igg亚类(igg1、2、3和4),按其在血清中的丰度次序命名,而igg1是最丰富的(~66%),继之以igg2(~23%)、igg3(~7%)和igg(~4%)。不同igg类别的生物学概况由各自的铰链区的结构决定。igm以单体形式和具有非常高的亲合力的分泌的五聚体形式在b细胞的表面上表达。在产生足够的igg之前,igm与b细胞介导的(体液)免疫的早期阶段中消除病原体有关(geisberger等人(2006)immunology118:429-437)。抗体不仅作为单体发现,而且已知形成两个ig单位的二聚体(例如iga)、四个ig单位的四聚体(例如硬骨鱼的igm)或五个ig单位的五聚体(例如哺乳动物igm)。抗体一般由包含两条等同的重链和等同的两条轻链的四条多肽链制备,所述两条等同的重链和等同的两条轻链经由二硫键连接,并且类似“y”形大分子。每条链包含许多免疫球蛋白结构域,其中一些是恒定结构域,并且其它的是可变结构域。免疫球蛋白结构域由7到9条以两个β片层排列的反平行链的2-层夹心组成。
一般,抗体的“重链”包含四个ig结构域,其中三个为“恒定结构域”(ch结构域:ch1、ch2、ch3),并且其中一个为“可变结构域”(vh结构域)。“轻链”一般包含一个恒定的ig结构域(cl)和一个可变的ig结构域(vl)。作为例子,人igg重链由从n-末端到c-末端按次序ch1-ch2-ch3连接的四个ig结构域组成,而人igg轻链由从n-末端到c-末端按次序vl-cl连接的两个免疫球蛋白结构域组成,为κ或λ类型中的任一种(vκ-cκ或vλ-cλ)。作为例子,人igg的恒定链包含447个氨基酸。
相应地,术语抗体的“可变区”或“可变结构域”指抗体的重链或轻链的氨基末端结构域。重链的可变结构域可以被称为“vh”。轻链的可变结构域可以被称为“vl”。这些结构域通常是抗体的最可变部分,并且含有抗原结合部位。术语“可变的”指以下事实:可变结构域的某些部分在抗体中的序列方面广泛不同,并且用于每种特定抗体对于其特定抗原的结合和特异性。然而,可变性在抗体的整个可变结构域中并非均匀分布。它集中在轻链和重链可变结构域两者中的称为“高变区”(hvrs)的三个区段中。可变结构域中更高度保守的部分称为“构架区”(fr)。天然重链和轻链的可变结构域各自包含由三个hvrs连接的四个fr区,所述四个fr区主要采用β片层构型,所述三个hvrs形成连接并且在某些情况下形成β片层结构的部分的环。每条链中的hvrs通过fr区极接近地结合,并且与来自另一条链的hvrs一起有助于抗体的抗原结合部位的形成(参见kabat等人,sequencesofproteinsofimmunologicalinterest,第五版,nationalinstituteofhealth,bethesda,md(1991))。相应地,如本文使用的术语“高变区”或“hvr”指抗体可变结构域的各个区域,其在序列中是高变的(也称为“互补性决定区”或“cdrs”),和/或形成结构上确定的环(“高变环”),和/或含有抗原接触残基(“抗原接触(antigencontacts)”)。通常,抗体包含六个hvrs:vh中的三个(h1、h2、h3)和vl中的三个(l1、l2、l3)。本文中的示例性hvrs包括:
(a)在氨基酸残基26-32(l1)、50-52(l2)、91-96(l3)、26-32(h1)、53-55(h2)和96-101(h3)处存在的高变环(chothia和lesk,j.mol.biol.196:901-917(1987));
(b)在氨基酸残基24-34(l1)、50-56(l2)、89-97(l3)、31-35b(h1)、50-65(h2)和95-102(h3)处存在的cdrs(kabat等人,上文);
(c)在氨基酸残基27c-36(l1)、46-55(l2)、89-96(l3)、30-35b(h1)、47-58(h2)和93-101(h3)处存在的抗原接触(maccallum等人j.mol.biol.262:732-745(1996));和
(d)(a)、(b)和/或(c)的组合,包括hvr氨基酸残基46-56(l2)、47-56(l2)、48-56(l2)、49-56(l2)、26-35(h1)、26-35b(h1)、49-65(h2)、93-102(h3)和94-102(h3)。
“构架区”或“fr”指除高变区(hvr)残基外的可变结构域残基。可变结构域的fr一般由四个fr结构域组成:fr1、fr2、fr3和fr4。相应地,hvr和fr序列通常按下述顺序在vh(或vl)中出现:fr1-h1(l1)-fr2-h2(l2)-fr3-h3(l3)-fr4。
术语“位置”表示氨基酸残基在肽链的氨基酸序列中的定位。位置可以序贯地进行编号,或根据确立的格式进行编号,例如用于抗体编号的“kabat的eu索引”(kabat,e.a.,wu,t.t.,perry,h.m.,gottesman,k.s.和foeller,c.,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nationalinstitutesofhealth,bethesda,md(1991),nihpublication91-3242,明确地引入本文作为参考)。“如kabat中的eu索引”指人iggleu抗体的残基编号。相应地,在igg的情况下,ch结构域如下:“ch1”指根据如kabat中的eu索引的氨基酸位置118-220;“ch2”指根据如kabat中的eu索引的氨基酸位置237-340;并且“ch3”指根据如kabat中的eu索引的氨基酸位置341-447。除非另外指出,否则hvr(例如cdr)残基和可变结构域中的其它残基(例如fr残基)在本文中根据kabat等人,上文进行编号。
恒定结构域不直接涉及抗体与抗原的结合,但显示出各种效应子功能。“效应子功能”指可归于抗体的恒定结构域的那些生物活性,其随着抗体同种型而变。抗体效应子功能的实例包括:c1q结合和依赖补体的细胞毒性(cdc);fc受体结合;依赖抗体的细胞毒性(adcc);吞噬作用;细胞表面受体(例如b细胞受体)的下调;以及b细胞活化。
术语“铰链区”表示抗体重链多肽的部分,其在野生型抗体重链中连接ch1结构域和ch2结构域,例如对于人igg1,根据eu编号系统(http://www.imgt.org/imgtscientificchart/numbering/hu_ighgnber.html)的约位置216至约位置238或kabat编号的约位置226至约位置243。根据kabat的位置226对应于人igg1重链恒定区的位置99。其它igg亚类的铰链区可以通过与人igg1亚类序列的铰链区半胱氨酸残基比对来确定。铰链区通常是二聚体的,由具有等同氨基酸序列的两个多肽组成。铰链区通常包含约25个氨基酸残基,并且是柔性的,从而允许抗原结合区独立地移动。铰链区可以细分成三个结构域:上部、中间和下部铰链结构域(参见例如roux等人,j.immunol.161(1998)4083)。术语fc-区的“上部铰链区”,例如对于人igg1,表示中间铰链区n-末端的氨基酸残基序列段,即根据eu编号的fc-区的残基216至225。术语“中间铰链区”,例如对于人igg1,即根据eu编号的fc-区的残基226至230,表示包含交联半胱氨酸残基的氨基酸残基序列段,富含脯氨酸和半胱氨酸,并且它位于上部和下部铰链区之间。术语fc-区的“下部铰链区”,例如对于人igg1,表示紧接在中间铰链区c-末端的氨基酸残基序列段,即根据eu编号的fc-区的残基231至238。
术语“抗体”包括单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们显示出所期望的抗原结合活性。该术语包括全长抗体以及其片段两者。术语“全长抗体”、“完整抗体”和“整个抗体”在本文中可互换使用,以指以其基本上完整形式的抗体,而不是指如下定义的抗体片段。因此,该术语表示具有与天然抗体基本上等同的结构和氨基酸序列的抗体。
术语“嵌合”抗体指这样的抗体,其中重链和/或轻链的一部分衍生自特定来源或物种,而重链和/或轻链的剩余部分衍生自不同来源或物种。
“人抗体”是这样的抗体,其具有的氨基酸序列对应于由人或人细胞产生、或者衍生自非人来源的抗体的那种,所述非人来源利用人抗体谱或其它人抗体编码序列。人抗体的这个定义特别排除了包含非人抗原结合残基的人源化抗体。
“人源化”抗体指包含来自非人hvrs的氨基酸残基和来自人frs的氨基酸残基的嵌合抗体。在某些实施方案中,人源化抗体将包含至少一个且一般是两个可变结构域的基本上全部,其中所有或基本上所有的hvrs(例如cdrs)对应于非人抗体的那些,并且所有或基本上所有的frs对应于人抗体的那些。人源化抗体可以任选地包含衍生自人抗体的抗体恒定区的至少一部分。抗体例如非人抗体的“人源化形式”指已经历人源化的抗体。
“分离的”抗体是已与其自然环境的组分分开的抗体。在一些实施方案中,将抗体纯化至大于95%或99%的纯度,如通过例如电泳(例如,sds-page、等电聚焦(ief)、毛细管电泳)或层析(例如,离子交换或反相hplc)方法测定的。关于用于评价抗体纯度的方法的综述,参见,例如,flatman等人,j.chromatogr.b848:79-87(2007)。
如本文使用的术语“单克隆抗体”指从基本上均质的抗体群体获得的抗体,即,构成群体的个别抗体是等同的和/或结合相同的表位,除了例如含有自然存在的突变或在单克隆抗体制剂的生产过程中出现的可能的变体抗体之外,这种变体通常以较少量存在。与一般包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂形成对照的是,单克隆抗体制剂的每种单克隆抗体针对抗原上的单个决定簇。因此,修饰语“单克隆”表示抗体的特征为从基本上均质的抗体群体获得,并且不应解释为要求通过任何特定方法的抗体生产。例如,待根据本发明使用的单克隆抗体可以通过多种技术制备,所述技术包括但不限于杂交瘤方法、重组dna方法、噬菌体展示方法、以及利用含有人免疫球蛋白基因座的全部或部分的转基因动物的方法,本文描述了用于制备单克隆抗体的这种方法和其它示例性方法。
“裸抗体”指未与标签缀合的抗体。
“亲和力”指分子(例如,抗体)的单个结合位点与其结合配偶体(例如,抗原)之间的非共价相互作用的总和的强度。除非另外指出,否则如本文使用的,“结合亲和力”指内在结合亲和力,其反映结合对的成员(例如,抗体和抗原)之间的1:1相互作用。分子x对于其配偶体y的亲和力通常可以由解离常数(kd)表示。“亲和力成熟的”抗体指与不具有这种改变的亲本抗体相比,在一个或多个高变区(hvrs)中具有一种或多种改变的抗体,这种改变导致抗体对于抗原的亲和力中的改善。亲和力可以通过本领域已知的常规方法,包括本文所述的那些方法进行测量。下文描述了用于测量结合亲和力的具体举例说明性和示例性实施方案:
作为例子,可以使用biacore®表面等离振子共振测定来测量kd。biacore®-2000或biacore®-3000(biacore,inc.,piscataway,nj)测定于37℃用固定的抗原cm5芯片以~10应答单位(ru)执行。根据供应商的说明书,可以用n-乙基-n'-(3-二甲氨基丙基)-碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs),来激活羧甲基化的葡聚糖生物传感器芯片(cm5,biacore,inc.)。可以在以5μl/分钟的流速注射前,将抗原用10mm乙酸钠,ph4.8稀释至5μg/ml(~0.2μm),以达到大约10应答单位(ru)的偶联蛋白。在抗原注射后,1m乙醇胺注射封闭未反应的基团。对于动力学测量,将fab的两倍连续稀释物(0.78nm至500nm)于37℃以大约25μl/分钟的流速注射到pbs中,所述pbs具有0.05%聚山梨醇酯20(tween-20tm)表面活性剂(pbst)和任选地5%dmso。通过同时拟合缔合和解离传感图,使用简单的一对一langmuir结合模型(biacore®evaluationsoftware版本3.2)计算缔合速率(kon)和解离速率(koff)。平衡解离常数(kd)计算为比率koff/kon。参见,例如,chen等人,j.mol.biol.293:865-881(1999)。如果结合速率通过上文的表面等离振子共振测定超过106m-1s-1,则可以通过使用荧光猝灭技术确定结合速率,所述荧光猝灭技术测量在有递增浓度的抗原的情况下,在pbs,ph7.2中的20nm抗抗原抗体(fab形式)于37℃的荧光发射强度(激发=295nm;发射=340nm,16nm带通)中的增加或减少,如在分光计中测量的,所述分光计例如配备有停流的分光光度计(spectrophometer)(avivinstruments)或具有搅拌的杯的8000-系列slm-amincotm分光光度计(thermospectronic)。
在备择方法中,通过放射性标记的抗原结合测定(ria)来测量kd。在一个实施方案中,用感兴趣的抗体的fab形式及其抗原来执行ria。例如,通过在有未标记的抗原的滴定系列的情况下,用最小浓度的(125i)标记的抗原平衡fab,然后用抗-fab抗体包被的板捕获结合的抗原,来测量fabs对于抗原的溶液结合亲和力(参见,例如,chen等人,j.mol.biol.293:865-881(1999))。为了确定用于测定的条件,microtiter®多孔板(thermoscientific)用在50mm碳酸钠(ph9.6)中的5μg/ml捕获抗-fab抗体(cappellabs)包被过夜,并接着于室温(大约23℃)用pbs中的2%(w/v)牛血清清蛋白封闭2至5小时。在非吸附板(nunc#269620)中,将100pm或26pm[125i]-抗原与感兴趣的fab的连续稀释物混合(例如,与presta等人,cancerres.57:4593-4599(1997)中抗-vegf抗体,fab-12的评估一致)。然后使感兴趣的fab温育过夜;然而,温育可以继续更长的时间段(例如,约65小时),以确保达到平衡。其后,将混合物转移至捕获板,用于于室温温育(例如,一小时)。然后去除溶液,并且用pbs中的0.1%聚山梨醇酯20(tween-20®)将板洗涤八次。当板已干燥后,添加150μl/孔的闪烁体((microscint-20tm;packard),并且将板在topcounttmγ计数器(packard)上计数十分钟。选择给出小于或等于最大结合的20%的每种fab的浓度,用于在竞争性结合测定中使用。
抗体的木瓜蛋白酶消化产生各自具有单个抗原结合部位的两个等同的抗原结合片段,称为“fab片段”(也称为“fab部分”或“fab区”),以及残留的“fc片段”(也称为“fc部分”或“fc区”),其名称反映了其容易结晶的能力。人iggfc区的晶体结构已在20世纪80年代确定。在igg、iga和igd同种型中,fc区由衍生自抗体的两条重链的ch2和ch3结构域的两个等同的蛋白片段组成;在igm和ige同种型中,fc区含有在每条多肽链中的三个重链恒定结构域(ch2-4)。另外,较小的免疫球蛋白分子自然存在或已进行人工构建。
术语“fab'片段”指另外包含ig分子的铰链区的fab片段,而“f(ab')2片段”被理解为包含经由二硫键化学连结或连接的两个fab'片段。
尽管“单结构域抗体(sdab)”(desmyter等人(1996)nat.structurebiol.3:803-811)和“纳米抗体(nanobodies)”仅包含单个vh结构域,但“单链fv(scfv)”片段包含经由短接头肽与轻链可变结构域连接的重链可变结构域(huston等人(1988)proc.natl.acad.sci.usa85,5879-5883)。可以通过连接两个scfvs(scfva-scfvb)来改造二价单链可变片段(di-scfvs)。这可以通过产生具有两个vh和两个vl区的单条肽链来完成,从而产生“串联scfvs”(vha-vla-vhb-vlb)。另一种可能性是产生具有接头的scfvs,所述接头对于两个可变区折叠在一起太短,从而迫使scfvs二聚化。通常具有5个残基的长度的接头用于产生这些二聚体。这种类型称为“双抗体”。vh和vl结构域之间的还要更短的接头(一个或两个氨基酸)导致形成单特异性三聚体,所谓的“三链抗体”或“tribadies”。通过表达分别具有排列vha-vlb和vhb-vla或vla-vhb和vlb-vha的链,来形成双特异性双抗体。单链双抗体(scdb)包含vha-vlb和vhb-vla片段,其通过12-20个氨基酸,优选14个氨基酸的接头肽(p)进行连接(vha-vlb-p-vhb-vla)。“双特异性t-细胞接合物(engagers)(bite)”是由不同抗体的两个scfvs组成的融合蛋白,其中scfvs之一经由cd3受体与t细胞结合,并且另一个经由肿瘤特异性分子与肿瘤细胞结合(kufer等人(2004)trendsbiotechnol.22:238-244)。双重亲和力重定向分子(dualaffinityretargetingmolecule)(“dart”分子)是通过c-末端二硫键另外稳定化的双抗体。
相应地,术语“抗体片段”指完整抗体的一部分,优选包含其抗原结合区。抗体片段包括但不限于fab、fab'、f(ab')2、fv片段;双抗体;三链抗体、sdab、纳米抗体、scfv、di-scfvs、串联scfvs、scdb、bites和darts。
如本文使用的术语“缀合物”指包含彼此非常接近,并且实现共同或相互有关的功能的许多个别组分、成分或部分的整体。缀合物的各个部分可以具有相同或不同的特性,即它们可以由相同、相似或不同的化学实体组成,所述化学实体例如但不限于核苷酸、氨基酸、核酸、肽、多肽、蛋白质、碳水化合物或脂质。作为例子,缀合物可以包含许多相关的肽、多肽或蛋白质,或者蛋白质与一种或多种核酸的混合物,或者一种或多种蛋白质与一种或多种脂质和/或碳水化合物的混合物。应理解,还包括相同、相似或不同的化学实体的任何其它组合。缀合物的各个部分可以是互连的或不是互连的。一般,缀合物的各个成分经由共价键或非共价键连接。术语“抗体缀合物”指包含抗体和包括但不限于标记和/或标签的一种或多种额外部分的缀合物。
在本公开内容的上下文中,“标签”指附着至蛋白质的部分。标签可以附着于蛋白质以允许蛋白质被检测,或者可以附着于所述蛋白质以提供具有特定功能的蛋白质。合适的可检测标签包括但不限于荧光染料(例如gft及其变体、fitc、tritc、荧光素和罗丹明等等)、电子密试剂(例如金)、酶(例如elisa中常用的)、化学发光分子、电化学发光分子、生物素、地高辛配基或半抗原以及可检测或可以制备为可检测的其它实体。作为例子,抗体可以被生物素化或钌化(ruthenylated)。提供具有特定功能的蛋白质的标签包括但不限于结合对的配偶体、官能团、治疗剂(药物)和/或细胞毒剂(例如毒素,例如阿霉素或百日咳毒素)。
用于将标签附着于抗体的方法是本领域技术人员众所周知的,并且例如在以下中大量描述:haugland(2003)molecularprobeshandbookoffluorescentprobesandresearchchemicals,molecularprobes,inc.;brinkley(1992)bioconjugatechem.3:2;garman,(1997)non-radioactivelabeling:apracticalapproach,academicpress,london;means(1990)bioconjugatechem.1:2;glazer等人chemicalmodificationofproteins.laboratorytechniquesinbiochemistryandmolecularbiology(t.s.work和e.work,编辑)americanelsevierpublishingco.,newyork;lundblad,r.l.和noyes,c.m.(1984)chemicalreagentsforproteinmodification,第i和ii卷,crcpress,newyork;pfleiderer,g.(1985)"chemicalmodificationofproteins",modernmethodsinproteinchemistry,h.tschesche,编辑,walterdegruyter,berlinandnewyork;以及wong(1991)chemistryofproteinconjugationandcross-linking,crcpress,bocaraton,fla.);deleon-rodriguez等人,chem.eur.j.10(2004)1149-1155;lewis等人,bioconjugatechem.12(2001)320-324;li等人,bioconjugatechem.13(2002)110-115;mier等人bioconjugatechem.16(2005)240-237。标记
在本公开内容的上下文中,“标记”指具有以在没有附着额外标签的情况下本身可检测的方式改变的结构的分子。这种标记的实例包括但不限于放射性同位素或稳定同位素标记。
同位素是在中子数方面不同的特定化学元素的变体。给定元素的所有同位素在每个原子中具有相同数目的质子。原子核内的质子数称为原子序数,并且等于中性(非电离)原子中的电子数。每个原子序数鉴定特定元素,而不是同位素;给定元素的原子可以在其中子数方面具有宽的范围。核中的核子(质子和中子两者)数是原子的质量数,并且给定元素的每种同位素具有不同的质量数。例如,碳-12(12c)、碳-13(13c)和碳-14(14c)是分别具有质量数12、13和14的元素碳的三种同位素。碳的原子序数为6,其意味着每个碳原子具有6个质子,从而使得这些同位素的中子数分别为6、7和8。一些同位素是放射性的,并且因此被称为“放射性同位素”或“不稳定同位素”,而其它同位素从未被观察到放射性衰变,并且被称为“稳定同位素”。例如,14c是碳的放射性同位素,而12c和13c是稳定同位素。自然界中存在的98.9%的碳是12c(也称为“常见同位素”),而仅1.1%是13c(也称为“稀有同位素”)。进一步的例子是氮(n),其由两种稳定同位素组成:氮-14,其构成绝大多数的自然存在的氮(14n:99.6%,常见同位素),和氮-15(15n:0.4%,稀有同位素)。甚至存在氧(o)的三种稳定同位素:16o、17o和18o,分别具有99.76%(常见同位素)、0.04%(稀有同位素)和0.20%(稀有同位素)的自然分布。氢(h)也具有三种自然存在的同位素,有时表示为1h(也称为氕)、2h(也称为氘)和3h(也称为氚),其中前两种是稳定的,且第三种具有12.32年的半衰期。自然存在的h的99.98%百分比是1h(常见同位素),而自然存在的h的仅0.02%是2h(稀有同位素)。
相应地,术语“常见同位素”指构成绝大多数自然存在的同位素的原子的同位素。作为例子,碳的常见稳定同位素为12c。氮的常见稳定同位素为14n。氧的常见稳定同位素为16o,并且氢的常见稳定同位素为1h。
相应地,术语“稀有同位素”指构成少数自然存在的同位素的原子的同位素。作为例子,碳的稀有稳定同位素为13c。氮的稀有稳定同位素为15n。氧的稀有稳定同位素为17o或18o,并且氢的稀有稳定同位素为2h。
术语“比率”指两个数值之间的关系。在本公开内容的上下文中,术语“比率”特别指蛋白质中的给定元素的同位素的百分比之间的关系。术语“改变的比率”涉及某些元素的同位素分布,所述同位素分布不同于自然同位素分布。作为例子,在蛋白质中存在多于1.1%的13c原子的情况下,例如如果蛋白质中存在的碳的5%、10%或20%为13c,则存在碳同位素的改变的比率。在这种情况下,同位素分布从98.9%12c:1.1%13c改变为95%12c:5%13c、90%12c:10%13c或80%12c:20%13c。进一步的例子将是氮的同位素比率,其在自然界中以99.6%14n:0.4%15n的比率存在。氮的改变的同位素比率因此可以包括99.0%14n:1.0%15n或90%14n:10%15n或80%14n:20%15n的比率。
术语“同位素的增加的量”指给定元素的特定同位素的量的改变,其高于所述元素的自然存在的同位素分布中的。作为例子,在元素碳的同位素13c自然存在于元素碳的所有出现的1.1%中的情况下,如果13c存在于元素碳的所有出现的例如1.2%、2%、5%或10%中,则它的量是增加的。
术语“同位素的降低的量”指给定元素的特定同位素的量的改变,其低于所述元素的自然存在的同位素分布中的。作为例子,在元素碳的同位素14c自然存在于元素碳的所有出现的98.9%中的情况下,如果12c存在于元素碳的所有出现的例如98.8%、98%、95%或90%中,则它的量是降低的。
在本公开内容的上下文中,术语“测序”指测定肽、多肽或蛋白质的一级结构。测序导致称为序列的符号线性描述,其简洁地概括测序的分子的许多原子水平结构。用于执行蛋白质测序的方法包括:edman降解、肽质量指纹分析、质谱法和蛋白酶消化。一般,一旦已知肽、多肽或蛋白质的序列,它就可以容易地复制。
在本公开内容的上下文中,术语“复制保护”指进行设计以预防肽、多肽或蛋白质的复制,特别是预防其序列的鉴定的努力。术语“免于被测序的保护”指进行设计以预防肽、多肽或蛋白质的测序的努力。作为例子,可以使用质谱法或edman降解来鉴定蛋白质的序列。因此,术语复制保护指进行设计以预防经由这些方法中的任一种,特别是经由质谱法的蛋白质序列鉴定的努力。
“质谱法”(“massspec”或“ms”)是将化学物类电离,并且基于其质荷比来分选离子的分析技术。在样品制备步骤之后,使用例如气相层析或液相层析,将一种或多种感兴趣的分析物与基质分开。对于质谱法测量,执行下述三个步骤:
1.小样品通过电子的丧失通常电离为阳离子。电离源包括但不限于电喷射离子化(esi)和大气压化学电离(apci)。
2.离子根据其质量和电荷进行分选且分开。高场不对称波形离子迁移率光谱法(faims)可以用作离子过滤器。
3.然后测量分开的离子,并且结果展示在图表上。
由于质谱仪分开并检测质量略有不同的离子,所以它容易地区分给定元素的不同同位素。因此,质谱法是用于分析物的准确质量测定和表征的重要方法,所述分析物包括但不限于肽、多肽或蛋白质。它的应用包括蛋白质及其翻译后修饰的鉴定,蛋白质复合体、其亚基和功能相互作用的阐明,以及蛋白质组学中蛋白质的总测量。肽或蛋白质通过质谱法的从头测序一般可以在没有氨基酸序列的先前了解的情况下执行。
“个体”或“主体”是哺乳动物。哺乳动物包括,但不限于,驯养动物(例如,牛、羊、猫、狗和马)、灵长类动物(例如,人和非人灵长类动物,例如猴)、兔和啮齿类动物(例如,小鼠和大鼠)。在某些实施方案中,个体或主体是人。
术语“疾病”、“病症”或“适应症”在本文中可互换使用,指异常状况,尤其是异常的医学状况,例如病或损伤,其中组织、器官或个体不再能够有效地实现其功能。一般,但不必定,疾病与指示这种疾病存在的特定症状或病征相关。因此,这种症状或病征的存在可以指示患有疾病的组织、器官或个体。这些症状或病征的改变可以指示这种疾病的进展。疾病的进展一般特征在于这种症状或病征的增加或降低,其可以指示疾病的“恶化”或“改善”。疾病的“恶化”特征在于组织、器官或生物有效地实现其功能的降低的能力,而疾病的“改善”一般特征在于组织、器官或生物有效地实现其功能的能力的增加。处于“发展疾病的风险”中的组织、器官或个体处于健康状态,但显示疾病出现的潜力。一般,发展疾病的风险与这种疾病的早期或较弱的病征或症状相关。在这种情况下,仍然可以通过治疗来预防疾病的发病。疾病的实例包括但不限于心脏病、创伤性病、炎性疾病、传染病、皮肤状况、内分泌疾病、肠疾病、神经障碍、关节疾病、遗传病、自身免疫性疾病和各种类型的癌症。
在本发明的上下文中,术语“生物标记”指生物系统内的物质,其用作所述系统的生物状态的指示物。在本领域中,术语“生物标记”有时也应用于检测所述内源性物质的手段(例如抗体、核酸探针等,成像系统)。在本发明的上下文中,术语“生物标记”应该仅应用于物质,而不是检测手段。因此,生物标记可以是活生物中存在的任何种类的分子,例如核酸(dna、mrna、mirna、rrna等)、蛋白质(细胞表面受体、胞质蛋白质等)、代谢物或激素(血糖、胰岛素、雌激素等)、代表另一种分子的某种修饰的分子(例如蛋白质上的糖部分或磷酰基残基、基因组dna上的甲基残基)或已被生物内在化的物质或这种物质的代谢物。
“试剂盒”是包括至少一种试剂的任何制品(例如包装或容器),所述试剂例如,用于治疗病症的药物、或者用于特异性检测本发明的生物标记基因或蛋白质的探针。该制品优选作为用于执行本发明的方法的单位来宣传、分配或出售。一般,试剂盒可以进一步包括被区室化的载体工具,以在紧密限制中容纳一种或多种容器工具,例如小瓶、管等等。特别地,每种容器工具包括待在第一个方面的方法中使用的分开的要素之一。试剂盒可以进一步包括一种或多种其它容器,其包含进一步的材料,包括但不限于缓冲液、稀释剂、过滤器、针、注射器和具有使用说明书的包装插页。标签可以存在于容器上以指示该组合物用于特定应用,并且还可以指示用于体内或体外使用的指导。计算机程序代码可以
在数据存储介质或设备例如光学存储介质(例如,光盘)上,或者直接在计算机或数据处理设备上提供。此外,试剂盒可以包含用于校准目的的关于如本文其它地方所述的生物标记的标准量。
“包装插页”用于指通常包括在治疗用产品或药物的商业包装中的说明书,其含有关于适应症、用法、剂量、施用、禁忌症、待与包装产品组合的其它治疗用产品和/或关于这种治疗用产品或药物使用的警告等的信息。
实施方案
在第一个方面,本发明涉及包含抗体和标签的抗体缀合物,其中存在于抗体中的一种或多种元素显示出与所述一种或多种元素的自然存在的同位素比率不同的同位素比率,其中自然界中的稀有同位素的量增加。因此,本发明涉及抗体缀合物,其包含具有抗体中存在的一种或多种元素的改变的同位素比率的抗体和标签。特别地,所述抗体具有一种或多种元素的同位素比率,其中自然界中的稀有同位素的量增加。
在第一个方面的实施方案中,一种或多种元素选自碳(c)、氢(h)、氮(n)和氧(o)。在特定实施方案中,元素是碳(c)或氮(n)。在特定实施方案中,元素是碳(c)。
在第一个方面的实施方案中,抗体包含增加量的元素碳(c)的稳定同位素13c。因此,抗体包含的同位素13c的量高于自然存在的13c的量,即高于碳的总出现的1.1%。
在第一个方面的实施方案中,抗体包含增加量的元素氢(h)的稳定同位素2h。因此,抗体包含的同位素2h的量高于自然存在的2h的量,即高于氢的总出现的0.02%。
在第一个方面的实施方案中,抗体包含增加量的元素氮(n)的稳定同位素15n。因此,抗体包含的同位素15n的量高于自然存在的15n的量,即高于氮的总出现的0.4%。
在第一个方面的实施方案中,抗体包含增加量的元素氧(o)的稳定同位素17o和/或18o。因此,抗体包含的同位素17o和/或18o的量高于自然存在的17o和/或18o的量,即分别高于氧的总出现的0.04%或0.2%。
在第一个方面的实施方案中,自然界中的稀有同位素的量增加至抗体中的相应元素原子的至少4%。
在特定实施方案中,自然界中的稀有同位素的量增加至抗体中的相应原子的总出现的6-90%。
在特定实施方案中,自然界中的稀有同位素的量增加至抗体中的相应原子的总出现的6-12%,特别是8-10%。
在特定实施方案中,自然界中的稀有同位素的量增加至抗体中的相应原子的总出现的30-70%,特别是40-60%。
在第一个方面的实施方案中,其中所述抗体包含增加量的稳定同位素13c,所述13c的量增加至抗体中的碳的总出现的4-20%。在特定实施方案中,13c的量增加至抗体中的碳的总出现的5-15%。在特定实施方案中,13c的量增加至抗体中的碳的总出现的6-13%。相应地,在特定实施方案中,13c的量从1.1%增加到至少4%。因此,同位素比率从98.9%的12c和1.1%的13c改变为最多96%的12c和至少4%的13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为95%12c:5%13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为94%12c:6%13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为87%12c:13%13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为85%12c:15%13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为80%12c:20%13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为33%12c:67%13c。在特定实施方案中,抗体显示出抗体中的碳的总出现的同位素13c的4-20%,特别是5-15%,特别是6%的含量。
在第一个方面的实施方案中,其中所述抗体包含增加量的稳定同位素15n,所述15n的量增加至抗体中的氮的总出现的4-96%。在特定实施方案中,15n的量增加至抗体中的氮的总出现的5-95%。在特定实施方案中,15n的量增加至抗体中的氮的总出现的6-94%。相应地,在特定实施方案中,15n的量从0.4%增加到至少4%。因此,同位素比率从99.6%的14n和0.4%的15n改变为最多96%的14n和至少4%的15n。在特定实施方案中,该比率从99.6%14n:0.4%15n改变为95%14n:5%15n。在特定实施方案中,该比率从99.6%14n:0.4%15n改变为90%14n:10%15n。在特定实施方案中,该比率从99.6%14n:0.4%15n改变为80%14n:20%15n。在特定实施方案中,该比率从99.6%14n:0.4%15n改变为60%14n:40%15n。在特定实施方案中,抗体显示出抗体中的氮的总出现的同位素15n的5-95%,特别是10-90%,特别是20-60%,特别是30-50%的含量。
在第一个方面的实施方案中,增加量的稀有稳定同位素在抗体的序列中随机分布。
在第一个方面的实施方案中,增加量的稀有稳定同位素掺入抗体的非必需氨基酸中。
在第一个方面的实施方案中,抗体是单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)、嵌合抗体(特别是人源化抗体)或抗体片段。在第一个方面的实施方案中,抗体是单特异性或多特异性抗体。在其中抗体是抗体片段的实施方案中,抗体片段选自fab、fab'、f(ab')2、fv片段;双抗体;三链抗体、sdab、纳米抗体、scfv、di-scfvs、串联scfvs、scdb、bites、darts;以及由这些抗体片段中的任一种形成的多特异性抗体。
在第一个方面的实施方案中,抗体是分离的抗体。
在第一个方面的实施方案中,该抗体是药物抗体或诊断抗体。特别地,所述抗体是对于一种或多种生物标记特异性的诊断抗体,所述生物标记对于某种疾病是特异性的。特别地,所述抗体是对于一种或多种生物标记特异性的诊断抗体,所述生物标记对于选自以下的疾病是特异性的:心脏病、创伤性病、炎性疾病、传染病、皮肤状况、内分泌疾病、肠疾病、神经障碍、关节疾病、遗传病、自身免疫性疾病和各种类型的癌症。
在实施方案中,抗体是对于指示心脏病的生物标记特异性的诊断抗体。特别地,诊断抗体针对肌钙蛋白c或肌钙蛋白t(缩写:tnt或tropt)。
在某些实施方案中,抗体具有≤1μm、≤100nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm或≤0.001nm(例如10-8m或更小,例如10-8m至10-13m,例如10-9m至10-13m)的解离常数(kd)。使用biacore®表面等离振子共振测定或使用放射性标记的抗原结合测定(ria)来测量kd。
在第一个方面的实施方案中,缀合物中包含的标签是结合对的配偶体、官能团、治疗剂(药物)、细胞毒剂(例如毒素,例如阿霉素或百日咳毒素)、荧光团(例如荧光染料如荧光素或罗丹明)、化学发光标签或电化学发光标签、放射性标签、用于成像或放射治疗目的的金属螯合物、酶或荧光蛋白如gfp。
在一个实施方案中,标签是结合对的配偶体。如本文使用的结合对由两个配偶体组成,所述两个配偶体以高亲和力,即以一纳摩尔(nanomolar)的亲和力或更好的亲和力彼此结合。关于结合对的实施方案是例如由受体和配体,半抗原和抗半抗原抗体组成的结合对,以及基于自然存在的高亲和力结合对的结合对。
受体-配体结合对的一个实例是由类固醇激素受体和相应的类固醇激素组成的对。
适合于本发明的一种类型的结合对是半抗原和抗半抗原抗体结合对。半抗原是分子量为100至2000道尔顿,优选150至1000道尔顿的有机分子。通过将这种小分子与载体分子偶联,可以使其变得具有免疫原性,并且可以根据标准程序产生抗半抗原抗体。半抗原可以选自固醇、胆汁酸、性激素、肾上腺皮质激素、强心苷、强心苷-糖苷、蟾蜍二烯羟酸内酯、类固醇-皂苷配基(sapogenines)和类固醇生物碱、强心苷和强心苷-糖苷。这些物质类别的代表是地高辛配基、毛地黄毒苷配基、芰他毒配基、毒毛旋花子苷配基、地高辛、洋地黄毒苷、ditoxin、毒毛旋花子苷。另一种合适的半抗原是例如荧光素。
基于自然存在的高亲和力结合对的结合对的实例是生物素或生物素类似物,例如氨基生物素、亚氨基生物素或脱硫生物素和抗生物素蛋白或链霉抗生物素蛋白以及fimg和dsf结合对。生物素-(链霉)抗生物素蛋白结合对是本领域众所周知的。fimg-dsf结合对的基本原理例如在wo2012/028697中描述。
在一个实施方案中,结合对选自半抗原和抗半抗原抗体,生物素或生物素类似物例如氨基生物素、亚氨基生物素或脱硫生物素和抗生物素蛋白或链霉抗生物素蛋白,fimg和dsf,以及受体和配体。
在一个实施方案中,结合对选自半抗原和抗半抗原抗体,以及生物素或生物素类似物例如氨基生物素、亚氨基生物素或脱硫生物素/抗生物素蛋白或链霉抗生物素蛋白,fimg和dsf。
在一个实施方案中,结合对是生物素(或生物素类似物,例如氨基生物素、亚氨基生物素或脱硫生物素)和抗生物素蛋白或链霉抗生物素蛋白。
在一个实施方案中,结合对由生物素和链霉抗生物素蛋白组成。
在一个实施方案中,标签是选自以下的官能团:醛、羧酸、羧酸酯、环氧化物、n-羟基琥珀酰亚胺酯、氨基、卤素、肼、羟基、巯基、马来酰亚胺基、炔基、叠氮化物、异氰酸酯、异硫氰酸酯和亚磷酰胺、反式环辛烯、四嗪。
在一个实施方案中,标签是选自以下的官能团:羧酸、n-羟基琥珀酰亚胺酯、氨基、卤素、巯基、马来酰亚胺基、炔基、叠氮化物、异氰酸酯、异硫氰酸酯和亚磷酰胺。
在一个实施方案中,标签是治疗剂(药物),并且可以例如是抗体或其抗原结合片段。针对细胞表面分子及其配体的许多治疗用抗体是已知的,例如rituxan/mabthera/利妥昔单抗(rituximab)、2h7/奥美珠单抗(ocrelizumab)、zevalin/替伊莫单抗(ibrizumomab)、arzerra/奥法木单抗(ofatumumab)(cd20)、hll2/依帕珠单抗(epratuzumab)、inotuzomab(cd22)、zenapax/达克珠单抗(daclizumab)、simulect/巴利昔单抗(basiliximab)(cd25)、赫赛汀(herceptin)/曲妥珠单抗(trastuzumab)、帕妥珠单抗(pertuzumab)(her2/erbb2)、mylotarg/吉妥单抗(gemtuzumab)(cd33)、raptiva/依法利珠单抗(efalizumab)(cd11a)、erbitux/西妥昔单抗(cetuximab)(egfr、表皮生长因子受体)、imc-1121b(vegf受体2)、tysabri/那他珠单抗(natalizumab)(α4β1和α4β7整联蛋白的α4-亚基)、reopro/阿昔单抗(abciximab)(gpiib-gpiia和αvβ3-整联蛋白)、orthocloneokt3/莫罗单抗(muromonab)-cd3(cd3)、benlysta/贝利木单抗(belimumab)(baff)、tolerx/oteliximab(cd3)、soliris/依库珠单抗(eculizumab)(c5补体蛋白)、actemra/托珠单抗(tocilizumab)(il-6r)、panorex/依决洛单抗(edrecolomab)(epcam、上皮细胞黏着分子)、cea-cam5/拉贝珠单抗(labetuzumab)(cd66/cea、癌胚抗原)、ct-11(pd-1、程序性死亡-1t细胞抑制受体、cd-d279)、h224g11(c-met受体)、sar3419(cd19)、imc-a12/西妥木单抗(cixutumumab)(igf-1r、胰岛素样生长因子1受体)、medi-575(pdgf-r、血小板衍生生长因子受体)、cp-675、206/曲美木单抗(tremelimumab)(细胞毒性t淋巴细胞抗原4)、ro5323441(胎盘生长因子或pgf)、hgs1012/马帕木单抗(mapatumumab)(trail-r1)、sgn-70(cd70)、vedotin(sgn-35)/本妥昔单抗(brentuximab)(cd30)和arh460-16-2(cd44)。
在进一步的实施方案中,标签是选自以下的细胞毒剂:(i)化学治疗剂,其可以起微管抑制剂、有丝分裂抑制剂、拓扑异构酶抑制剂或dna嵌入剂的作用;(ii)蛋白质毒素,其可能酶促起作用;以及(iii)治疗用放射性同位素。
化学治疗剂包括,但不限于,美登木素生物碱、澳瑞他汀(auristatin)、多拉司他汀(dolastatin)、单端孢菌毒素、cc1065、加利车霉素和其它烯二炔类(enediyne)抗生素、紫杉烷(taxane)、蒽环及其立体异构体、等构物、类似物或衍生物。
蛋白质毒素包括但不限于,白喉-a链、白喉毒素的非结合活性片段、外毒素a链(来自铜绿假单胞菌(pseudomonasaeruginosa))、蓖麻毒蛋白a链(vitetta等人(1987)science,238:1098)、相思豆毒蛋白a链、蒴莲根毒蛋白iia链、α-帚曲霉素、油桐(aleuritesfordii)蛋白、香石竹毒蛋白、美国商陆(phytolacaamericana)蛋白(papi、papii和pap-5)、苦瓜(momordicacharantia)抑制剂、麻风树毒蛋白、巴豆毒蛋白、肥皂草(sapaonariaofficinalis)抑制剂、多花白树毒蛋白、米托洁林(mitogellin)、局限曲菌素、酚霉素、伊诺霉素和单端孢菌毒素(tricothecenes)(wo93/21232)。
治疗用放射性同位素包括32p、33p、90y、125i、131i、131in、153sm、186re、188re、211at、212b、212pb和lu的放射性同位素。放射性同位素可以以已知方式掺入(fraker等人(1978)biochem.biophys.res.commun.80:49-57;"monoclonalantibodiesinimmunoscintigraphy"chatal,crcpress1989)。碳-14-标记的1-异硫氰基苄基-3-甲基二亚乙基三胺五乙酸(mx-dtpa)是用于将放射性核素缀合至复合体的示例性螯合剂(wo94/11026)。
在一个实施方案中,标签可以起作用以:(i)提供可检测的信号;(ii)与第二标记相互作用,以修饰由第一标记或第二标记提供的可检测信号,例如以给出fret(荧光共振能量转移);(iii)通过电荷、疏水性、形状或其它物理参数影响迁移率,例如电泳迁移率或细胞透性,或(iv)提供捕获部分,例如以调节离子络合。
提供可检测信号的众多标签是可获得的,并且通常可以分成下述种类:
(a)荧光标签或荧光团,
(b)化学发光染料(briggs等人"synthesisoffunctionalizedfluorescentdyesandtheircouplingtoaminesandaminoacids,"j.chem.soc.,perkin-trans.1(1997)1051-1058),和
(c)电化学发光标签。
荧光标签或荧光团包括稀土元素螯合物(铕螯合物)、荧光素类型标签(包括fitc、5-羧基荧光素、6-羧基荧光素);罗丹明类型标签,包括tamra;丹磺酰;丽丝胺;花青;藻红蛋白;德克萨斯红;及其类似物。可以使用例如currentprotocolsinimmunology,上文中公开的技术,使荧光标签缀合。荧光染料和荧光标签试剂包括例如从invitrogen/molecularprobes(eugene,oregon,usa)和piercebiotechnology,inc.(rockford,ill.)商购可得的那些。
致化学发光的标签的不同类别包括鲁米诺、吖啶
作为电化学发光标签的具有较重要的关系的标签分别是基于钌和铱的电化学发光络合物。电化学发光(ecl)作为高度灵敏和选择性的方法在分析应用中证明是非常有用的。它组合了化学发光分析(不存在背景光信号)的分析优势和通过施加电极电位进行反应控制的容易程度。通常,将在液相或液-固界面由tpa(三丙胺)再生的钌络合物,尤其是[ru(bpy)3]2+(其在~620nm释放光子)用作ecl-标记。最近,也已经描述了基于铱的ecl-标记(wo2012107419(a1))。
适合作为用于成像和治疗目的的标记的金属螯合物是本领域众所周知的(us2010/0111856;us5,342,606;us5,428,155;us5,316,757;us5,480,990;us5,462,725;us5,428,139;us5,385,893;us5,739,294;us5,750,660;us5,834,456;hnatowich等人,j.immunol.methods65(1983)147-157;meares等人,anal.biochem.142(1984)68-78;mirzadeh等人,bioconjugatechem.1(1990)59-65;meares等人,j.cancer(1990),suppl.10:21-26;izard等人,bioconjugatechem.3(1992)346-350;nikula等人,nucl.med.biol.22(1995)387-90;camera等人,nucl.med.biol.20(1993)955-62;kukis等人,j.nucl.med.39(1998)2105-2110;verel等人,j.nucl.med.44(2003)1663-1670;camera等人,j.nucl.med.21(1994)640-646;ruegg等人,cancerres.50(1990)4221-4226;verel等人,j.nucl.med.44(2003)1663-1670;lee等人,cancerres.61(2001)4474-4482;mitchell等人,j.nucl.med.44(2003)1105-1112;kobayashi等人bioconjugatechem.10(1999)103-111;miederer等人,j.nucl.med.45(2004)129-137;denardo等人,clinicalcancerresearch4(1998)2483-90;blend等人,cancerbiotherapy&radiopharmaceuticals18(2003)355-363;nikula等人j.nucl.med.40(1999)166-76;kobayashi等人,j.nucl.med.39(1998)829-36;mardirossian等人,nucl.med.biol.20(1993)65-74;roselli等人,cancerbiotherapy&radiopharmaceuticals,14(1999)209-20)。
酶也可以用作标签。各种酶-底物标记系统是可获得的。酶通常催化生色底物的化学改变,其可以使用各种技术进行测量。例如,酶可以催化底物中的颜色变化,其可以通过分光光度法进行测量。另一方面,酶可以改变底物的荧光或化学发光。化学发光底物通过化学反应变得电子激发,且然后可以发出可以进行测量(例如使用化学发光计(chemiluminometer))的光或将能量贡献给荧光受体。酶促标记的实例包括萤光素酶(例如,萤火虫萤光素酶和细菌萤光素酶;us4,737,456)、萤光素、2,3-二氢二氮杂萘二酮(dihydrophthalazinediones)、苹果酸脱氢酶、脲酶、过氧化物酶如辣根过氧化物酶(hrp)、碱性磷酸酶(ap)、(3-半乳糖苷酶、葡糖淀粉酶、溶菌酶、糖氧化酶(例如葡糖氧化酶、半乳糖氧化酶和葡糖-6-磷酸脱氢酶)、杂环氧化酶(例如尿酸氧化酶和黄嘌呤氧化酶)、乳过氧化物酶、微过氧化物酶等等。
酶-底物组合的实例(还参见us4,275,149;us4,318,980)包括,例如:
(i)以过氧化氢酶为底物的辣根过氧化物酶(hrp),其中所述过氧化氢酶氧化染料前体(例如,邻苯二胺(opd)或3,3',5,5'-四甲基联苯胺盐酸盐(tmb));
(ii)以对硝基苯磷酸为生色底物的碱性磷酸酶(ap);和
(iii)(3-d-半乳糖苷酶((3-d-gal),具有生色底物(例如,对硝基苯基-(3-d-半乳糖苷酶)或荧光底物4-甲基伞形酮基-(3-d-半乳糖苷酶(4-methylumbelliferyl-(3-d-galactosidase)。
在第二个方面,本发明涉及如上文关于本发明的第一个方面详细描述的缀合物用于预防所包含的抗体的测序的用途。
在特定实施方案中,缀合物用于预防所包含的抗体经由质谱法的测序。
在第三个方面,本发明涉及稳定同位素标记用于保护抗体的序列免于被测定,特别是免于被测序的用途。在特定实施方案中,稳定同位素标记用于预防经由质谱法的抗体测序。在第三个方面的特定实施方案中,通过改变,特别是通过增加抗体,特别是抗体缀合物中包含的抗体中的特定元素的稳定同位素的量,来产生稳定同位素标记。
在第三个方面的实施方案中,其稳定同位素是改变的,特别是增加的一种或多种元素选自碳(c)、氢(h)、氮(n)和氧(o)。在特定实施方案中,元素是碳(c)或氮(n)。在特定实施方案中,元素是碳(c)。
在第三个方面的实施方案中,增加量的元素碳(c)的稳定同位素13c用于保护抗体的序列免于被测定。因此,高于自然存在的13c的量,即高于碳的总出现的1.1%的稳定同位素13c的量,用于保护抗体的序列免于被测定。在第三个方面的实施方案中,增加量的元素氢(h)的稳定同位素2h用于保护抗体的序列免于被测定。因此,高于自然存在的2h的量,即高于氢的总出现的0.02%的稳定同位素2h的量,用于保护抗体的序列免于被测定。
在第三个方面的实施方案中,增加量的元素氮(n)的稳定同位素15n用于保护抗体的序列免于被测定。因此,高于自然存在的15n的量,即高于氮的总出现的0.4%的稳定同位素15n的量,用于保护抗体的序列免于被测定。
在第三个方面的实施方案中,增加量的元素氧(o)的稳定同位素17o和/或18o用于保护抗体的序列免于被测定。因此,高于自然存在的17o和/或18o的量,即分别高于氧的总出现的0.04%或0.2%的稳定同位素17o和/或18o的量,用于保护抗体的序列免于被测定。
在第三个方面的实施方案中,自然界中的稀有同位素的量增加至抗体中的相应元素原子的至少4%。
在特定实施方案中,自然界中的稀有同位素的量增加至抗体中的相应元素的总出现的6-90%。
在特定实施方案中,自然界中的稀有同位素的量增加至抗体中的相应元素的总出现的6-12%,特别是8-10%。
在特定实施方案中,自然界中的稀有同位素的量增加至抗体中的相应元素的总出现的30-70%,特别是40-60%。
在第三个方面的实施方案中,其中使用增加量的稳定同位素13c,所述13c的量增加至抗体中的碳的总出现的4-20%。在特定实施方案中,13c的量增加至抗体中的碳的总出现的5-15%。在特定实施方案中,13c的量增加至抗体中的碳的总出现的6-13%。相应地,在特定实施方案中,13c的量从1.1%增加到至少4%。因此,同位素比率从98.9%的12c和1.1%的13c改变为最多96%的12c和至少4%的13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为95%12c:5%13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为94%12c:6%13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为87%12c:13%13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为85%12c:15%13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为80%12c:20%13c。在特定实施方案中,该比率从98.9%12c:1.1%13c改变为33%12c:67%13c。在特定实施方案中,抗体显示出抗体中的碳的总出现的同位素13c的4-20%,特别是5-15%,特别是6%的含量。
在第三个方面的实施方案中,其中使用增加量的稳定同位素15n,所述15n的量增加至抗体中的氮的总出现的4-96%。在特定实施方案中,15n的量增加至抗体中的氮的总出现的5-95%。在特定实施方案中,15n的量增加至抗体中的氮的总出现的6-94%。相应地,在特定实施方案中,15n的量从0.4%增加到至少4%。因此,同位素比率从99.6%的14n和0.4%的15n改变为最多96%的14n和至少4%的15n。在特定实施方案中,该比率从99.6%14n:0.4%15n改变为95%14n:5%15n。在特定实施方案中,该比率从99.6%14n:0.4%15n改变为90%14n:10%15n。在特定实施方案中,该比率从99.6%14n:0.4%15n改变为80%14n:20%15n。在特定实施方案中,该比率从99.6%14n:0.4%15n改变为60%14n:40%15n。在特定实施方案中,抗体显示出抗体中的氮的总出现的同位素15n的5-95%,特别是10-90%,特别是20-60%,特别是30-50%的含量。
在第三个方面的实施方案中,增加量的稀有稳定同位素在抗体的序列中随机分布。
在第三个方面的实施方案中,增加量的稀有稳定同位素掺入抗体的非必需氨基酸中。
在第三个方面的实施方案中,抗体是单克隆抗体、多克隆抗体、多特异性抗体(例如,双特异性抗体)、嵌合抗体(特别是人源化抗体)或抗体片段。在第三个方面的实施方案中,抗体是单特异性或多特异性抗体。在其中抗体是抗体片段的实施方案中,抗体片段选自fab、fab'、f(ab')2、fv片段;双抗体;三链抗体、sdab、纳米抗体、scfv、di-scfvs、串联scfvs、scdb、bites、darts;以及由这些抗体片段中的任一种形成的多特异性抗体。
在第三个方面的实施方案中,抗体是分离的抗体。
在第三个方面的实施方案中,该抗体是药物抗体或诊断抗体。特别地,所述抗体是对于一种或多种生物标记特异性的诊断抗体,所述生物标记对于某种疾病是特异性的。特别地,所述抗体是对于一种或多种生物标记特异性的诊断抗体,所述生物标记对于选自以下的疾病是特异性的:心脏病、创伤性病、炎性疾病、传染病、皮肤状况、内分泌疾病、肠疾病、神经障碍、关节疾病、遗传病、自身免疫性疾病和各种类型的癌症。
在实施方案中,抗体是对于指示心脏病的生物标记特异性的诊断抗体。特别地,诊断抗体针对肌钙蛋白c或t。
在某些实施方案中,抗体具有≤1μm、≤100nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm或≤0.001nm(例如10-8m或更小,例如10-8m至10-13m,例如10-9m至10-13m)的解离常数(kd)。使用biacore®表面等离振子共振测定或使用放射性标记的抗原结合测定(ria)来测量kd。
在第三个方面的实施方案中,复合体中包含的标签是结合对的配偶体、官能团、治疗剂(药物)、细胞毒剂(例如毒素,例如阿霉素或百日咳毒素)、荧光团(例如荧光染料如荧光素或罗丹明)、化学发光标签或电化学发光标签、放射性标签、用于成像或放射治疗目的的金属螯合物、酶或荧光蛋白如gfp。
在一个实施方案中,标签是结合对的配偶体。如本文使用的结合对由两个配偶体组成,所述两个配偶体以高亲和力,即以一纳摩尔(nanomolar)的亲和力或更好的亲和力彼此结合。关于结合对的实施方案是例如由受体和配体,半抗原和抗半抗原抗体组成的结合对,以及基于自然存在的高亲和力结合对的结合对。
受体-配体结合对的一个实例是由类固醇激素受体和相应的类固醇激素组成的对。
适合于本发明的一种类型的结合对是半抗原和抗半抗原抗体结合对。半抗原是分子量为100至2000道尔顿,优选150至1000道尔顿的有机分子。通过将这种小分子与载体分子偶联,可以使其变得具有免疫原性,并且可以根据标准程序产生抗半抗原抗体。半抗原可以选自固醇、胆汁酸、性激素、肾上腺皮质激素、强心苷、强心苷-糖苷、蟾蜍二烯羟酸内酯、类固醇-皂苷配基和类固醇生物碱、强心苷和强心苷-糖苷。这些物质类别的代表是地高辛配基、毛地黄毒苷配基、芰他毒配基、毒毛旋花子苷配基、地高辛、洋地黄毒苷、ditoxin、毒毛旋花子苷。另一种合适的半抗原是例如荧光素。
基于自然存在的高亲和力结合对的结合对的实例是生物素或生物素类似物,例如氨基生物素、亚氨基生物素或脱硫生物素和抗生物素蛋白或链霉抗生物素蛋白以及fimg和dsf结合对。生物素-(链霉)抗生物素蛋白结合对是本领域众所周知的。fimg-dsf结合对的基本原理例如在wo2012/028697中描述。
在一个实施方案中,结合对选自半抗原和抗半抗原抗体,生物素或生物素类似物例如氨基生物素、亚氨基生物素或脱硫生物素和抗生物素蛋白或链霉抗生物素蛋白,fimg和dsf,以及受体和配体。
在一个实施方案中,结合对选自半抗原和抗半抗原抗体,以及生物素或生物素类似物例如氨基生物素、亚氨基生物素或脱硫生物素/抗生物素蛋白或链霉抗生物素蛋白,fimg和dsf。
在一个实施方案中,结合对是生物素(或生物素类似物,例如氨基生物素、亚氨基生物素或脱硫生物素)和抗生物素蛋白或链霉抗生物素蛋白。
在一个实施方案中,结合对由生物素和链霉抗生物素蛋白组成。
在一个实施方案中,标签是选自以下的官能团:醛、羧酸、羧酸酯、环氧化物、n-羟基琥珀酰亚胺酯、氨基、卤素、肼、羟基、巯基、马来酰亚胺基、炔基、叠氮化物、异氰酸酯、异硫氰酸酯和亚磷酰胺、反式环辛烯、四嗪。
在一个实施方案中,标签是选自以下的官能团:羧酸、n-羟基琥珀酰亚胺酯、氨基、卤素、巯基、马来酰亚胺基、炔基、叠氮化物、异氰酸酯、异硫氰酸酯和亚磷酰胺。
在一个实施方案中,标签是治疗剂(药物),并且可以例如是抗体或其抗原结合片段。针对细胞表面分子及其配体的许多治疗用抗体是已知的,例如rituxan/mabthera/利妥昔单抗(rituximab)、2h7/奥美珠单抗(ocrelizumab)、zevalin/替伊莫单抗(ibrizumomab)、arzerra/奥法木单抗(ofatumumab)(cd20)、hll2/依帕珠单抗(epratuzumab)、inotuzomab(cd22)、zenapax/达克珠单抗(daclizumab)、simulect/巴利昔单抗(basiliximab)(cd25)、赫赛汀(herceptin)/曲妥珠单抗(trastuzumab)、帕妥珠单抗(pertuzumab)(her2/erbb2)、mylotarg/吉妥单抗(gemtuzumab)(cd33)、raptiva/依法利珠单抗(efalizumab)(cd11a)、erbitux/西妥昔单抗(cetuximab)(egfr、表皮生长因子受体)、imc-1121b(vegf受体2)、tysabri/那他珠单抗(natalizumab)(α4β1和α4β7整联蛋白的α4-亚基)、reopro/阿昔单抗(abciximab)(gpiib-gpiia和αvβ3-整联蛋白)、orthocloneokt3/莫罗单抗(muromonab)-cd3(cd3)、benlysta/贝利木单抗(belimumab)(baff)、tolerx/oteliximab(cd3)、soliris/依库珠单抗(eculizumab)(c5补体蛋白)、actemra/托珠单抗(tocilizumab)(il-6r)、panorex/依决洛单抗(edrecolomab)(epcam、上皮细胞黏着分子)、cea-cam5/拉贝珠单抗(labetuzumab)(cd66/cea、癌胚抗原)、ct-11(pd-1、程序性死亡-1t细胞抑制受体、cd-d279)、h224g11(c-met受体)、sar3419(cd19)、imc-a12/西妥木单抗(cixutumumab)(igf-1r、胰岛素样生长因子1受体)、medi-575(pdgf-r、血小板衍生生长因子受体)、cp-675、206/曲美木单抗(tremelimumab)(细胞毒性t淋巴细胞抗原4)、ro5323441(胎盘生长因子或pgf)、hgs1012/马帕木单抗(mapatumumab)(trail-r1)、sgn-70(cd70)、vedotin(sgn-35)/本妥昔单抗(brentuximab)(cd30)和arh460-16-2(cd44)。
在进一步的实施方案中,标签是选自以下的细胞毒剂:(i)化学治疗剂,其可以起微管抑制剂、有丝分裂抑制剂、拓扑异构酶抑制剂或dna嵌入剂的作用;(ii)蛋白质毒素,其可能酶促起作用;以及(iii)治疗用放射性同位素。
化学治疗剂包括,但不限于,美登木素生物碱、澳瑞他汀(auristatin)、多拉司他汀(dolastatin)、单端孢菌毒素、cc1065、加利车霉素和其它烯二炔类(enediyne)抗生素、紫杉烷(taxane)、蒽环及其立体异构体、等构物、类似物或衍生物。
蛋白质毒素包括但不限于,白喉-a链、白喉毒素的非结合活性片段、外毒素a链(来自铜绿假单胞菌(pseudomonasaeruginosa))、蓖麻毒蛋白a链(vitetta等人(1987)science,238:1098)、相思豆毒蛋白a链、蒴莲根毒蛋白iia链、α-帚曲霉素、油桐(aleuritesfordii)蛋白、香石竹毒蛋白、美国商陆(phytolacaamericana)蛋白(papi、papii和pap-5)、苦瓜(momordicacharantia)抑制剂、麻风树毒蛋白、巴豆毒蛋白、肥皂草(sapaonariaofficinalis)抑制剂、多花白树毒蛋白、米托洁林(mitogellin)、局限曲菌素、酚霉素、伊诺霉素和单端孢菌毒素(tricothecenes)(wo93/21232)。
治疗用放射性同位素包括32p、33p、90y、125i、131i、131in、153sm、186re、188re、211at、212b、212pb和lu的放射性同位素。放射性同位素可以以已知方式掺入(fraker等人(1978)biochem.biophys.res.commun.80:49-57;"monoclonalantibodiesinimmunoscintigraphy"chatal,crcpress1989)。碳-14-标记的1-异硫氰基苄基-3-甲基二亚乙基三胺五乙酸(mx-dtpa)是用于将放射性核素缀合至复合体的示例性螯合剂(wo94/11026)。
在一个实施方案中,标签可以起作用以:(i)提供可检测的信号;(ii)与第二标记相互作用,以修饰由第一标记或第二标记提供的可检测信号,例如以给出fret(荧光共振能量转移);(iii)通过电荷、疏水性、形状或其它物理参数影响迁移率,例如电泳迁移率或细胞透性,或(iv)提供捕获部分,例如以调节离子络合。
提供可检测信号的众多标签是可获得的,并且通常可以分成下述种类:
(a)荧光标签或荧光团,
(b)化学发光染料(briggs等人"synthesisoffunctionalizedfluorescentdyesandtheircouplingtoaminesandaminoacids,"j.chem.soc.,perkin-trans.1(1997)1051-1058),和
(c)电化学发光标签。
荧光标签或荧光团包括稀土元素螯合物(铕螯合物)、荧光素类型标签(包括fitc、5-羧基荧光素、6-羧基荧光素);罗丹明类型标签,包括tamra;丹磺酰;丽丝胺;花青;藻红蛋白;德克萨斯红;及其类似物。可以使用例如currentprotocolsinimmunology,上文中公开的技术,使荧光标签缀合。荧光染料和荧光标签试剂包括例如从invitrogen/molecularprobes(eugene,oregon,usa)和piercebiotechnology,inc.(rockford,ill.)商购可得的那些。
致化学发光的标签的不同类别包括鲁米诺、吖啶
作为电化学发光标签的具有较重要的关系的标签分别是基于钌和铱的电化学发光络合物。电化学发光(ecl)作为高度灵敏和选择性的方法在分析应用中证明是非常有用的。它组合了化学发光分析(不存在背景光信号)的分析优势和通过施加电极电位进行反应控制的容易程度。通常,将在液相或液-固界面由tpa(三丙胺)再生的钌络合物,尤其是[ru(bpy)3]2+(其在~620nm释放光子)用作ecl-标记。最近,也已经描述了基于铱的ecl-标记(wo2012107419(a1))。
适合作为用于成像和治疗目的的标记的金属螯合物是本领域众所周知的(us2010/0111856;us5,342,606;us5,428,155;us5,316,757;us5,480,990;us5,462,725;us5,428,139;us5,385,893;us5,739,294;us5,750,660;us5,834,456;hnatowich等人,j.immunol.methods65(1983)147-157;meares等人,anal.biochem.142(1984)68-78;mirzadeh等人,bioconjugatechem.1(1990)59-65;meares等人,j.cancer(1990),suppl.10:21-26;izard等人,bioconjugatechem.3(1992)346-350;nikula等人,nucl.med.biol.22(1995)387-90;camera等人,nucl.med.biol.20(1993)955-62;kukis等人,j.nucl.med.39(1998)2105-2110;verel等人,j.nucl.med.44(2003)1663-1670;camera等人,j.nucl.med.21(1994)640-646;ruegg等人,cancerres.50(1990)4221-4226;verel等人,j.nucl.med.44(2003)1663-1670;lee等人,cancerres.61(2001)4474-4482;mitchell等人,j.nucl.med.44(2003)1105-1112;kobayashi等人bioconjugatechem.10(1999)103-111;miederer等人,j.nucl.med.45(2004)129-137;denardo等人,clinicalcancerresearch4(1998)2483-90;blend等人,cancerbiotherapy&radiopharmaceuticals18(2003)355-363;nikula等人j.nucl.med.40(1999)166-76;kobayashi等人,j.nucl.med.39(1998)829-36;mardirossian等人,nucl.med.biol.20(1993)65-74;roselli等人,cancerbiotherapy&radiopharmaceuticals,14(1999)209-20)。
酶也可以用作标签。各种酶-底物标记系统是可获得的。酶通常催化生色底物的化学改变,其可以使用各种技术进行测量。例如,酶可以催化底物中的颜色变化,其可以通过分光光度法进行测量。另一方面,酶可以改变底物的荧光或化学发光。化学发光底物通过化学反应变得电子激发,且然后可以发出可以进行测量(例如使用化学发光计(chemiluminometer))的光或将能量贡献给荧光受体。酶促标记的实例包括萤光素酶(例如,萤火虫萤光素酶和细菌萤光素酶;us4,737,456)、萤光素、2,3-二氢二氮杂萘二酮(dihydrophthalazinediones)、苹果酸脱氢酶、脲酶、过氧化物酶如辣根过氧化物酶(hrp)、碱性磷酸酶(ap)、(3-半乳糖苷酶、葡糖淀粉酶、溶菌酶、糖氧化酶(例如葡糖氧化酶、半乳糖氧化酶和葡糖-6-磷酸脱氢酶)、杂环氧化酶(例如尿酸氧化酶和黄嘌呤氧化酶)、乳过氧化物酶、微过氧化物酶等等。酶-底物组合的实例(还参见us4,275,149;us4,318,980)包括,例如:
(i)以过氧化氢酶为底物的辣根过氧化物酶(hrp),其中所述过氧化氢酶氧化染料前体(例如,邻苯二胺(opd)或3,3',5,5'-四甲基联苯胺盐酸盐(tmb));
(ii)以对硝基苯磷酸为生色底物的碱性磷酸酶(ap);和
(iii)(3-d-半乳糖苷酶((3-d-gal),具有生色底物(例如,对硝基苯基-(3-d-半乳糖苷酶)或荧光底物4-甲基伞形酮基-(3-d-半乳糖苷酶(4-methylumbelliferyl-(3-d-galactosidase)。
在第四个方面,本发明涉及用于确定生物标记的存在和/或量的试剂盒,其包括如上文关于本发明的第一个方面所详细说明的至少一种缀合物。在特定实施方案中,试剂盒包括如上文关于本发明的第一个方面所详细说明的两种缀合物。
在特定实施方案中,所述试剂盒包括如本发明的第一个方面所详细说明的第一缀合物和第二缀合物。在实施方案中,第一缀合物和第二缀合物能够结合相同的抗原。特别地,所述第一缀合物和所述第二缀合物的结合彼此并不相干扰。在实施方案中,所述缀合物之一结合至或能够结合至固相,并且所述抗体或其抗原结合片段中的另一种是可检测地标记的。相应地,在第四个方面,本发明涉及用于测量生物标记的水平的试剂盒,该试剂盒包括:第一缀合物和第二缀合物,其中所述第一缀合物和所述第二缀合物能够结合所述抗原,并且其中所述第一缀合物和所述第二缀合物的结合彼此并不相干扰,其中所述缀合物之一结合至或能够结合至固相,并且其中所述缀合物中的另一种是可检测地加上标签的。
在实施方案中,试剂盒进一步包括被区室化的载体工具,以在紧密限制中容纳选自小瓶和管的一种或多种容器工具。在特定实施方案中,容器工具进一步包括待使用的几种分开的要素之一,特别是选自缓冲液、稀释剂、过滤器、针、注射器和具有使用说明书的包装插页的那些。标签可以存在于容器上以指示该组合物用于特定应用,并且还可以指示用于体内或体外使用的指导。
在特定实施方案中,试剂盒包括至少一个容器、在所述至少一个容器上的标签以及包含在所述至少一个容器内的组合物,其中所述组合物包含与生物标记结合的至少一种缀合物。特别地,在所述容器上的标签指示该组合物可以用于评价样品中生物标记的存在。特别地,试剂盒包括关于使用缀合物用于评价特定样品类型中的生物标记存在的说明书。试剂盒可以进一步包括用于制备样品,并且将缀合物施加于样品的一套说明书和材料。
在特定实施方案中,试剂盒包括一个容器,其包含如上文在第一个方面的上下文中所详细说明的第一缀合物和第二缀合物。
在特定实施方案中,试剂盒包括两个容器,其中第一容器包含第一缀合物,并且其中第二容器包含第二缀合物,如上文在第一个方面的上下文中所详细说明的。
在进一步的实施方案中,试剂盒还包括选自以下的组分:一种或多种缓冲液(例如,封闭缓冲液、洗涤缓冲液、底物缓冲液等)、其它试剂例如通过酶促标记化学改变的底物(例如色原)、表位提取溶液、对照样品(阳性对照和/或阴性对照)、一种或多种对照载玻片等。试剂盒还可以包括用于解释使用试剂盒获得的结果的说明书。
实施例
实施例1:抗体标记和massspec分析
在有正常或c13-葡萄糖富集rpmi培养基(gibco目录号31870-025)、+2g/l葡萄糖(正常或13c)和5%胎牛血清的情况下,通过利用小鼠杂交瘤克隆(与骨髓瘤细胞(p3x63-ag8.653)融合的小鼠脾的单细胞),来表达抗体“mak11-7,抗肌钙蛋白t”。相应的杂交瘤细胞于37℃和6%co2温育7天。
在收获细胞后,将含有所期望的抗体的培养物上清液分离并转移用于串联ms/ms分析。详细地,fcs-基质(胎牛血清)中的抗体用dtt于50℃还原30分钟,游离的sh基团在暗处于室温进行脲基甲基化(carbamidomethylated),并且于37℃使用胰蛋白酶消化18小时。肽经由具有45分钟的总运行时间的乙腈梯度洗脱ip-rp-hplc层析分开,并且使用来自thermofisher的fticr在数据依赖性串联ms/ms模式下进行分析(图1)。使用mascot(数据库搜索算法)评价实验数据,所述mascot将实验数据与理论计算的数据进行比较。使用标准参数(酶:胰蛋白酶;漏失切割的最大数目(maximumnumberofmissedcleavages)=2;前体质量容限:10ppm;片段容限:0.8m/z;静态修饰:脲基甲基化;可变修饰:氧化),针对内部产生的数据库搜索数据,所述数据库包括靶序列和已知“污染物”。获得的结果表示为基于概率的肽序列的一览表。如图1a中所示的,可以清楚地鉴定各38%的轻链和重链。相反,仅可以清楚地鉴定c13-标记的抗体的2%重链和0%轻链(参见图1b)。
重链的胰蛋白酶消化产生例如肽片段ntqpimdtdgsyfvysk。关于双重正性[m+2h]2+肽的12c与13c的不同比率的同位素分布的理论计算,结果产生如图2中所示的谱(使用版本3.0中的isopro执行计算)。
与测量数据的比较揭示了如图3a中所示的肽的表达培养基依赖性同位素分布。在重培养基中,它对应于大约6%13c的掺入(参见图3b)。因此,已经掺入的6%或13c(与正常存在的1.1%相比)预防了该肽的鉴定。这提示需要高得多的实验数据质量的从头测序将是不成功的。在这种情况下,已经掺入的少于6%13c将保护抗体。
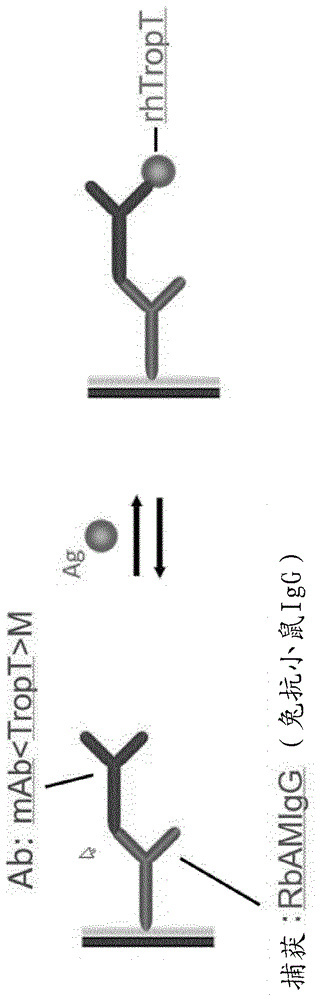
实施例2:生物分子相互作用分析
为了分析c13-标记的抗肌钙蛋白t抗体与其抗原的功能性,即结合活性,于37℃使用biacore®表面等离振子共振测定来测量kd。结果在图5中给出,其显示了c13标记的抗体显示出与正常的未标记抗体相同的kd值,即显示出相同的结合亲和力。
在gehealthcaret200仪器上于37℃执行详细的动力学调查。将biacorecm5系列s传感器安装到仪器内,并且根据制造商的说明书进行流体动力学寻址(addressed)和预先调节。系统缓冲液是pbs-dt(pbsph7.4、0.05%dmso,0.05%tween20(w/v))。样品缓冲液是补加有1mg/mlcmd(羧甲基葡聚糖,fluka)的系统缓冲液。在一个实施方案中,在cm5生物传感器上确立了小鼠抗体捕获系统。根据制造商的说明书,使用nhs/edc化学,以13kru固定多克隆兔抗鼠iggfc捕获抗体(rbamigg,pab<m-igg>rb-igg(is)(br-1008-38,2016-12,gehc)。
抗-tropt抗体于各10nm在样品缓冲液中稀释,并且以10µl/分钟的流速在生物传感器上捕获0.5分钟,继之以用2.5-倍浓缩的pbs-dt系统缓冲液以80µl/分钟的0.5分钟洗涤步骤。监控以应答单位(ru)表示的鼠抗体捕获水平(cl)。
对于2分钟的缔合阶段和15分钟的解离阶段,以80µl/分钟注射一系列的tropt(37kda,roche)分析物浓度。tropt浓度为0nm、1.1nm、3.3nm、10nmx2、30nm和90nm。通过10mm甘氨酸(glycin)ph1.5的15秒注射,继之以10mm甘氨酸ph1.7以20µl/分钟的2分钟注射,来再生生物传感器捕获系统。
产生传感图覆盖图,以显示tropt结合信号。监控来自分析物缔合阶段的信号平台(signalplateau)的结合晚期报告点(bindinglatereportpoints)。使用biacore评价软件测定动力学参数。测定动力学参数ka[1/ms]、kd[1/s]、t1/2diss[分钟]、kd[m]和抗体:tropt结合化学计量(摩尔比)。
- 还没有人留言评论。精彩留言会获得点赞!