β连环蛋白核酸抑制剂分子的制作方法
相关申请的交叉引用
本申请要求2017年10月18日提交的名为“betacateninnucleicacidinhibitormolecule”的美国临时专利申请号62/573,999和2018年1月5日提交的名为“reducingbeta-cateninandidoexpressiontopotentiateimmunotherapy”的美国临时专利申请号62/614,206的优先权,该两案的全部内容是以引用的方式整体并入本文。
序列表
本申请含有已经以ascii格式电子提交并且特此以引用的方式整体并入的序列表。所述ascii拷贝创建于2018年10月11日,命名为0243_0008-pct_sl.txt,且大小为19,219字节。
背景
致癌基因β-连环蛋白是细胞中wnt信号传导的关键介质。β-连环蛋白在多个细胞位置发挥若干种细胞功能,所述细胞位置包括细胞质膜(在此处β-连环蛋白有助于细胞间粘附复合物的稳定)、细胞质(在此处β-连环蛋白水平受到调控)以及细胞核(在此处β-连环蛋白参与转录调控和染色质相互作用)。
β-连环蛋白(由人体内的ctnnb1基因编码)中的突变与结肠直肠癌、硬纤维瘤、子宫内膜癌、胃癌、肝细胞癌、肝母细胞瘤、肾癌(维尔姆斯瘤(wilms'tumor))、成髓细胞瘤、黑色素瘤、卵巢(子宫内膜样)癌、胰腺癌、毛母质瘤、前列腺癌、甲状腺(间变性)癌和子宫(子宫内膜)癌尤其相关(polakisp.genesdev.14:1837-51;samowitz等,cancerres.59:1442-4;iwao等,cancerres.58:1021-6;mirabelli-primdahl等,cancerres.59:3346-51;shitoh等,jclinpath.52:695-6;tejpar等,oncogene18:6615-20;kitaeva等,cancerres.57:4478-81;sparks等,cancerres.58:1130-4;miyaki等,cancerres.59:4506-9;park等,cancerres.59:4257-60;huang等,amjpathol.155:1795-801;nhieu等,amjpathol.155:703-10;legoix等,oncogene18:4044-6;jeng等,cancerlett.152:45-51;koch等,cancerres.59:269-73;wei等,oncogene19:498-504;koesters等,cancerres.59:3880-2;maiti等,cancerres.60:6288-92;zurawel等,cancerres.58:896-9;gamallo等,amjpathol.155:527-36;palacios及gamallocancerres.58:1344-7;wright等,intjcancer82:625-9;gerdes等,digestion60:544-8;chan等,natgenet.21:410-3;voeller等,cancerres.58:2520-3;garcia-rostan等,cancerres.59:1811-5;fukuchi等,cancerres.58:3526-8)。
β-连环蛋白/wnt途径在超过80%的结肠直肠癌中被持续激活。β-连环蛋白/wnt途径还在超过50%的肝细胞癌(hcc)患者中被持续激活。激活的wnt信号传导和核β-连环蛋白与疾病复发和不良预后相关(takigawa等,2008,currdrugtargetsnovember;9(11):1013-24)。
β-连环蛋白基因中的突变包括:截短,其导致β-连环蛋白n末端的一部分缺失;或点突变,其影响细胞质破坏复合物中诸如gsk3α/β或ckiα等介导β-连环蛋白磷酸化并靶向其通过蛋白体降解的组分所靶向的丝氨酸和苏氨酸残基。这些突变β-连环蛋白耐磷酸化,并且因此逃避蛋白酶体降解。因此,β-连环蛋白在受影响的细胞内积聚。稳定化且核局部化的β-连环蛋白是几乎所有结肠癌病例的标志。(clevers,h.,2006,cell127:469-480)。morin等证明了β-连环蛋白的改变了磷酸化位点的突变致使细胞对apc介导的β-连环蛋白下调不敏感,而且这种被破坏的机制对结肠直肠肿瘤发生很重要。(morin等,1997,science275:1787-1790)。
尽管在理解β-连环蛋白如何在细胞中发挥作为wnt信号传导的关键介质的功能以及β-连环蛋白的突变和/或表达改变如何在肿瘤发生中起作用方面取得了诸多进展,但仍然需要可用于治疗与ctnnb1表达相关的疾病(诸如癌症)的组合物。
技术实现要素:
本申请提供了一种有效的优化的双链β-连环蛋白核酸抑制剂分子,其具有独特的修饰核苷酸模式,包括在所述分子中的大多数核苷酸的糖部分的2'-碳上的2'-氟代(“2'-f)和2'-o-甲基(“2'-ome”或“2'-och3”)修饰的独特模式。不希望受任何理论束缚,似乎该独特的核苷酸修饰模式改善了所述β-连环蛋白核酸抑制剂分子的诸多性质,诸如降低免疫原性、改善β-连环蛋白mrna表达减少、改善ago2结合或改善肿瘤生长抑制中的一种或多种。
在一个实施方案中,所述优化的β-连环蛋白核酸抑制剂分子包括包含seqidno:11的核酸或由其组成的有义(或随从)链和包含seqidno:12的核酸或由其组成的反义(或向导)链,以及在所述有义链与所述反义链之间的26个核苷酸的互补区。所述反义链包括在其3'末端的2个单链核苷酸和在其5'末端的10个单链核苷酸。在某些实施方案中,所述有义链由seqidno:11的核酸组成,并且所述反义链由seqidno:12的核酸组成。
在一个实施方案中,所述优化的β-连环蛋白核酸抑制剂分子是包括有义链和反义链的双链核酸抑制剂分子;
其中所述有义链包含seqidno:13的核酸序列或由其组成,并且所述反义链包含seqidno:14的核酸序列或由其组成,并且所述有义链和反义链一起形成26个碱基对的双链体区,并且所述反义链包括在其3'末端的2个单链核苷酸和在其5'末端的10个单链核苷酸;
其中seqidno:13的核苷酸1、3、7、9-11、13、15、19和20中每一个的糖部分经2'-f修饰,seqidno:13的核苷酸2、4-6、8、12、14、16-18和24中每一个的糖部分经2'-och3修饰,seqidno:13的核苷酸25和26是脱氧核糖核苷酸,并且seqidno:13的核苷酸21-23是核糖核苷酸;以及
其中seqidno:14的核苷酸2、6、19、21、23、25、30、31、33和35中每一个的糖部分经2'-f修饰,seqidno:14的核苷酸1、3-5、7-9、11-15、20、22、24、26、32、34和36-38中每一个的糖部分经2'-och3修饰,seqidno:14的核苷酸10是脱氧核糖核苷酸,并且seqidno:14的核苷酸16-18和27-29是核糖核苷酸。
一个方面针对一种治疗受试者的癌症的方法,所述方法包括向所述受试者施用治疗有效量的如本文所描述的优化的β-连环蛋白核酸抑制剂分子。在某些实施方案中,所述方法还包括施用治疗有效量的免疫治疗剂。在某些实施方案中,所述受试者是人类。
另一个方面针对一种药物组合物,其包含如本文所描述的优化的β-连环蛋白核酸抑制剂分子。在某些实施方案中,所述包含优化的β-连环蛋白核酸抑制剂分子的药物组合物用于治疗癌症。在某些实施方案中,所述药物组合物与诸如抗ctla-4单克隆抗体、抗pd-1单克隆抗体、抗pd-l1单克隆抗体或抗ctla-4单克隆抗体与抗pd-1单克隆抗体的组合等免疫治疗剂组合施用。
在所述方法或所述药物组合物的某些实施方案中,所述癌症是非wnt激活的癌症。在其他实施方案中,所述癌症是wnt激活的癌症。在所述方法或所述药物组合物的某些实施方案中,所述非wnt激活的癌症是黑色素瘤、成神经细胞瘤或肾癌。
在所述方法或组合物的某些实施方案中,如本文所描述的优化的β-连环蛋白核酸抑制剂分子与脂质纳米颗粒一起配制。在某些实施方案中,所述脂质纳米颗粒包含核心脂质和被膜脂质,其中所述核心脂质包含第一阳离子脂质和第一聚乙二醇化脂质,并且其中所述被膜脂质包含第二阳离子脂质、中性脂质、固醇和第二聚乙二醇化脂质。在某些实施方案中,所述第一阳离子脂质是dl-048,所述第一聚乙二醇化脂质是dsg-mpeg,所述第二阳离子脂质是dl-103,所述中性脂质是dspc,所述固醇是胆固醇,并且所述第二聚乙二醇化脂质是dspe-mpeg。
附图说明
并入本说明书中并构成本说明书的一部分的附图说明了某些实施方案,并且连同书面描述一起用来解释本文所公开的组合物和方法的某些原理。
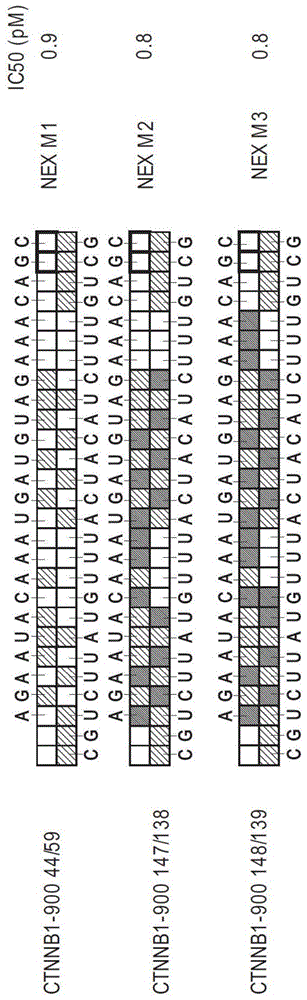
图1a示意性地示出了靶向β-连环蛋白基因且具有不同的核苷酸修饰模式的三个示例性非延伸双链核酸抑制剂分子的结构:非延伸m1(nexm1);非延伸m2(nexm2);以及非延伸m3(nexm3)。在此示意图中,无阴影的核苷酸表示核糖核苷酸,有条纹的核苷酸含有2'-ome修饰,有阴影的碱基含有2'-f修饰,并且用黑色方框示廓的核苷酸表示脱氧核糖核苷酸。nexm1的随从链和向导链分别对应于seqidno:1和seqidno:2。nexm2的随从链和向导链分别对应于seqidno:3和seqidno:4。nexm3的随从链和向导链分别对应于seqidno:5和seqidno:6。还示出了三个分子的ic50值(pm)。
图1b示出了人外周血单核细胞(pbmc)中不同的非延伸双链核酸抑制剂分子的干扰素应答(如通过ifit1诱导所测量)。nexm1诱导if1t1显著升高,而nexm2显示中度升高。另一方面,nexm3仅显示ifit1的极低程度的升高。
图2a示意性地示出了靶向β-连环蛋白基因且具有不同的核苷酸修饰模式的三个示例性延伸双链核酸抑制剂分子的结构:延伸m1(exm1);延伸m2(exm2);以及延伸m3(exm3)。在此示意图中,无阴影的核苷酸表示核糖核酸碱基,有条纹的核苷酸表示2'-ome修饰的碱基,有阴影的碱基表示2'-f修饰的碱基,并且用黑色方框示廓的核苷酸表示脱氧核糖核酸碱基。exm1的随从链和向导链分别对应于seqidno:7和seqidno:8。exm2的随从链和向导链分别对应于seqidno:9和seqidno:10。exm3的随从链和向导链分别对应于seqidno:11和seqidno:12。还示出了三个分子的ic50值(pm)。
图2b示出了人外周血单核细胞(pbmc)中不同的延伸双链核酸抑制剂分子的干扰素应答(如通过ifit1诱导所测量)。exm1诱导if1t1显著升高,而exm2显示中度升高。另一方面,nexm3显示ifit1基本上没升高。
图3a示出了通过测量nexm1、nexm3和exm3在与来自四个不同供体的人pbmc混合时对干扰素水平的影响来评定相对免疫原性的测定的结果。nexm3和exm3对所有四个供体显示很小或没有干扰素应答,而nexm1对供体1、2和4显示适度干扰素应答并且对供体3显示相当大的干扰素应答(过敏)。
图3b示出了在不同时间点(处理后24和120小时)从用nexm1、nexm3和exm3处理的小鼠获得的ls411n肿瘤中的β-连环蛋白mrna敲低的量(“效能”)。在24小时,exm3显示当与exm2和nexm3相比时略强的效能和与nexm1相比类似的效能。在处理后120小时,exm3显示与nexm1相比有所提高的效能。
图4a至图4d示出了比较nexm1和exm3构建体的各种测定结果的图或图像。
图4a示出了在携带ls411n肿瘤并且用nexm1和exm3处理的小鼠中,给药后第3天,exm3在肿瘤组织中的水平高得多。
图4b示出了在携带ls411n肿瘤并且用nexm1和exm3处理的小鼠中,在给药后第3天,exm3表现出肿瘤组织中阿格核酸酶(argonaute)(ago)2结合/rna诱导的沉默复合物(risc)负载效率增加。
图4c示出了在携带sw403肿瘤并且用nexm1和exm3处理的小鼠中,nexm1相对于媒介物处理的动物抑制肿瘤生长达约55%,而exm3抑制肿瘤生长达超过80%。x轴列出了(sw403肿瘤的)植入后天数,其中箭头指出施用nexm1、exm3或对照物的天数(剂量为3mg/kg)。
图4d通过免疫组织化学示出了在图4c中描绘的研究结束时获得的sw403肿瘤中的β-连环蛋白水平显著降低。
图5示出了可用于配制β-连环蛋白核酸抑制剂分子的脂质纳米颗粒(lnp)的一个非限制性实施方案。所述lnp包括以下核心脂质:dl-048(阳离子脂质)和dsg-mpeg(聚乙二醇化脂质),以及以下被膜脂质:dl-103(阳离子脂质)、dspc、胆固醇和dspe-mpeg(聚乙二醇化脂质)。
图6示出了wnt信号传导途径的简化图。左侧描绘了其中wnt配体未结合至其表面受体、β-连环蛋白螯合在破坏复合物中并且被靶向以进行泛素化和降解,而且靶基因受到阻遏的细胞。右侧描绘了wnt配体结合其表面受体后的细胞,其中破坏复合物分解,稳定化的β-连环蛋白被释放并输送至细胞核,而且靶基因被激活。
图7a示出了植入有wnt激活的4t1肿瘤并且用安慰剂或exm3处理的balb/c小鼠的处理方案,如实施例5中所描述。
图7b通过免疫组织化学示出了在4t1肿瘤中,exm3处理降低了β-连环蛋白水平并且增加了cd8t细胞浸润,但没有显著降低的ido1水平。
图7c示出了两个周期的exm3处理与安慰剂相比抑制了植入balb/c小鼠体内的4t1肿瘤的肿瘤生长。
图8a示出了植入有4t1肿瘤并且用pbs或exm3处理的balb/c小鼠的处理方案,如实施例5中所描述。
图8b通过流式细胞术分析示出了4t1肿瘤的exm3处理增加了cd8+t细胞,增加了多个检查点分子(pd-1、lag-3+和tim-3+),并且增加了调控t细胞(treg),但没有显著改变肿瘤微环境中骨髓源性抑制细胞(mdsc)的数目。
图9a示出了植入有4t1肿瘤并且用媒介物或称为依帕卡司他(epacadostat)的ido抑制剂(idoi)处理的balb/c小鼠的处理方案,如实施例6中所描述。
图9b通过免疫组织化学示出了在4t1肿瘤中,idoi处理降低了β-连环蛋白水平,增加了cd8t细胞浸润并且降低了ido1水平。
图9c示出了两个周期的idoi处理与安慰剂相比抑制了植入balb/c小鼠体内的4t1肿瘤的肿瘤生长。
图10a至图10c示出了idoi(依帕卡司他)、抗pd-1抗体(pd-1)和exm3作为单剂(图10a)、两种剂的组合(图10b)或三种剂的组合(图10c)施用时在植入有4t1肿瘤的balb/c小鼠中的功效,其中所有三种剂的组合显示了肿瘤消退,如实施例7中所描述。
图11a至图11b示出了用idoi、抗pd-1抗体和/或exm3处理的4t1肿瘤中的cd8(图11a)和foxp3(图11b)的mrna水平,并且显示仅所有三种剂的组合显著增加了cd8mrna水平并显著降低了foxp3mrna水平。
定义
为了更容易理解本公开,以下首先定义某些术语。针对以下术语和其他术语的额外定义可在整个说明书中列出。如果以下列出的术语的定义与以引用的方式并入的申请或专利中的定义不一致,则应当使用本申请中列出的定义来理解该术语的含义。
如本说明书和所附权利要求书中所使用,除非上下文另外明确指出,否则单数形式“一(a/an)”和“该(the)”包括复数个参考物。因此,举例来说,提及“一种方法”包括属于本文所描述的类型和/或在阅读本公开内容后对本领域技术人员将显而易见的一种或多种方法和/或步骤等等。
施用:如本文所使用,将组合物“施用”至受试者意指给予、施加或使组合物与受试者接触。施用可以通过许多途径中的任一种来实现,包括例如局部、口服、皮下、肌肉内、腹膜内、静脉内、鞘内和皮内。
抗体:如本文所使用,术语“抗体”是指免疫球蛋白或其抗原结合结构域。该术语包括但不限于多克隆抗体、单克隆抗体、单特异性抗体、多特异性抗体、非特异性抗体、人源化抗体、人抗体、单链抗体、嵌合抗体、合成抗体、重组抗体、杂合抗体、突变抗体、移植抗体和体外产生的抗体。抗体可包括恒定区或其部分,诸如κ、λ、α、γ、δ、ε和μ恒定区基因。举例来说,可以使用各种同型的重链恒定区,包括:igg1、igg2、igg3、igg4、igm、iga1、iga2、igd和ige。举例来说,轻链恒定区可以是κ或λ。
抗原结合结构域:如本文所使用,术语“抗原结合结构域”是指抗体分子中包含负责抗体与抗原之间的特异性结合的氨基酸的部分。对于某些抗原,抗原结合结构域可能仅结合至抗原的一部分。被抗体特异性识别并结合的抗原部分称为“表位”或“抗原决定子”。抗原结合结构域包括:fab(抗原结合片段);f(ab')2片段,具有两个fab片段的二价片段,所述fab片段在铰链区通过二硫桥连接;fv片段;单链fv片段(scfv),参见例如bird等(1988)science242:423-426,和huston等(1988)proc.natl.acad.sci.usa85:5879-5883);fd片段,其具有两个vh和ch1结构域;dab(ward等,(1989)nature341:544-546);以及保留抗原结合功能的其他抗体片段。fab片段具有在恒定区之间通过二硫键共价连接的vh-ch1和vl-cl结构域。fv片段较小并且具有非共价连接的vh和vl结构域。为了克服非共价连接的结构域解离的趋势,可以构建scfv。scfv含有柔性多肽,其(1)将vh的c末端连接至vl的n末端,或(2)将vl的c末端连接至vh的n末端。可以使用15聚体(gly4ser)3肽作为接头,但本领域已知其他接头。使用本领域技术人员已知的常规技术获得这些抗体片段,并且用与完整抗体相同的方式来评估所述片段的功能。
反义链:双链核酸抑制剂分子包含两个寡核苷酸链:反义链和有义链。反义链或其区域与靶核酸的对应区域部分地、基本上或完全互补。另外,双链核酸抑制剂分子的反义链或其区域与双链核酸抑制剂分子的有义链或其区域部分地、基本上或完全互补。在某些实施方案中,反义链还可能含有与靶核酸序列非互补的核苷酸。非互补核苷酸可以在互补序列的任一侧,或者可以在互补序列的两侧。在某些实施方案中,当反义链或其区域与有义链或其区域部分或基本上互补时,非互补核苷酸可位于一个或多个互补区(例如,一个或多个错配)之间。双链核酸抑制剂分子的反义链也称为向导链。
大约:如本文所使用,术语“大约”或“约”在应用到一个或多个目标值时是指与所述参考值类似的值。在某些实施方案中,除非另外说明或以其他方式从上下文显而易见(除了在此类数值将超过可能值的100%时),否则术语“大约”或“约”是指在所述参考值的任一方向(大于或小于)上25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小范围内的值范围。
β-连环蛋白:如本文所使用,“β-连环蛋白”是指多肽或编码此类β-连环蛋白的核酸序列。当提及多肽时,“β-连环蛋白”是指β-连环蛋白基因/转录物(ctnnb1)(genbank登录号nm_001904.3(人β-连环蛋白转录物变体1)、nm_001098209.1(人β-连环蛋白转录物变体2)、nm_001098210.1(人β-连环蛋白转录物变体3)以及nm_007614.2和nm_007614.3(小鼠β-连环蛋白))的多肽基因产物。
互补:如本文所使用,术语“互补”是指两个核苷酸(例如,在两个相对的核酸上或者在单个核酸链的相对区域上)之间的结构关系,其允许两个核苷酸彼此形成碱基对。举例来说,一个核酸的嘌呤核苷酸与相对核酸的嘧啶核苷酸互补可以通过彼此形成氢键而碱基配对在一起。在一些实施方案中,互补核苷酸能够以沃森-克里克(watson-crick)方式或以允许形成稳定双链体的任何其他方式进行碱基配对。“完全互补”或100%互补是指第一寡核苷酸链或第一寡核苷酸链区段的各个核苷酸单体可以与第二寡核苷酸链或第二寡核苷酸链区段的各个核苷酸单体形成碱基对的情况。小于100%互补性是指两个寡核苷酸链(或两个寡核苷酸链的两个区段)的一些而非全部核苷酸单体可以彼此形成碱基对的情况。“基本上互补”是指两个寡核苷酸链(或两个寡核苷酸链的区段)表现出彼此具有90%或更高的互补性。“足够互补”是指靶mrna与核酸抑制剂分子之间互补,使得靶mrna编码的蛋白质的量减少。
互补链:如本文所使用,术语“互补链”是指双链核酸抑制剂分子中与另一个链部分、基本上或完全互补的链。
脱氧呋喃核糖基:如本文所使用,术语“脱氧呋喃核糖基”是指在天然存在的dna中发现并且在2'-碳上具有氢基的呋喃糖基,如以下所示:
脱氧核糖核苷酸:如本文所使用,术语“脱氧核糖核苷酸”是指在糖部分的2'位置具有氢基的天然核苷酸(如本文所定义)或修饰核苷酸(如本文所定义)。
dsrnai抑制剂分子:如本文所使用,术语“dsrnai抑制剂分子”是指具有有义链(随从)和反义链(向导)的双链核酸抑制剂分子,其中所述反义链或所述反义链的一部分被阿格核酸酶2(ago2)内切核酸酶用于切割靶mrna。
双链体:如本文所使用,术语“双链体”在提及核酸(例如,寡核苷酸)时是指通过两个反向平行核苷酸序列的互补碱基配对形成的结构。
赋形剂:如本文所使用,术语“赋形剂”是指可以包括在组合物中,例如以提供或有助于所需的稠度或稳定效果的非治疗剂。
呋喃糖基:如本文所使用,术语“呋喃糖基”是指包含具有四个碳原子和一个氧原子的5元环的结构。
核苷酸间连接基团:如本文所使用,术语“核苷酸间连接基团”或“核苷酸间键联”是指能够共价连接两个核苷部分的化学基团。典型地,所述化学基团是含有磷酸或亚磷酸基团的含磷键联基团。磷酸连接基团意在包括磷酸二酯键联、二硫代磷酸酯键联、硫代磷酸酯键联、磷酸三酯键联、硫羰基烷基膦酸酯键联、硫羰基烷基磷酸三酯键联、亚磷酰胺键联、膦酸酯键联和/或硼烷磷酸酯键联。许多含磷键联在本领域中是众所周知的,举例来说,如以下美国专利号中所公开:3,687,808;4,469,863;4,476,301;5,023,243;5,177,196;5,188,897;5,264,423;5,276,019;5,278,302;5,286,717;5,321,131;5,399,676;5,405,939;5,453,496;5,455,233;5,466,677;5,476,925;5,519,126;5,536,821;5,541,306;5,550,111;5,563,253;5,571,799;5,587,361;5,194,599;5,565,555;5,527,899;5,721,218;5,672,697;以及5,625,050。在其他实施方案中,寡核苷酸含有一个或多个不含磷原子的核苷酸间连接基团,诸如短链烷基或环烷基核苷酸间键联、混合杂原子和烷基或环烷基核苷酸间键联,或者一个或多个短链杂原子或杂环核苷酸间键联,包括但不限于具有以下主链的那些核苷酸间键联:硅氧烷主链;硫醚、亚砜和砜主链;甲酰基和硫代甲酰基主链;亚甲基甲酰基和硫代甲酰基主链;核糖乙酰基主链;含烯烃主链;氨基磺酸酯主链;亚甲基亚氨基和亚甲基肼基主链;磺酸酯和磺酰胺主链;以及酰胺主链。非含磷键联在本领域中是众所周知的,举例来说,如以下美国专利号中所公开:5,034,506;5,166,315;5,185,444;5,214,134;5,216,141;5,235,033;5,264,562;5,264,564;5,405,938;5,434,257;5,466,677;5,470,967;5,489,677;5,541,307;5,561,225;5,596,086;5,602,240;5,610,289;5,602,240;5,608,046;5,610,289;5,618,704;5,623,070;5,663,312;5,633,360;5,677,437;5,792,608;5,646,269;以及5,677,439。
免疫检查点分子:如本文所使用,术语“免疫检查点分子”是指诸如t细胞等免疫细胞上在正常生理条件下对于当免疫系统对外来病原体有应答时维持自身耐受性(或预防自身免疫)以及保护宿主细胞和组织来说很重要的分子。某些免疫检查点分子是放大涉及t细胞对抗原应答的信号的共刺激分子,而某些免疫检查点分子是减小涉及t细胞对抗原应答的信号的抑制性分子(例如ctla-4或pd-1)。
修饰的核碱基:如本文所使用,术语“修饰的核碱基”是指并非天然核碱基或通用核碱基的任何核碱基。合适的修饰的核碱基包括二氨基嘌呤及其衍生物、烷基化的嘌呤或嘧啶、酰化的嘌呤或嘧啶、硫醇化的嘌呤或嘧啶等等。其他合适的修饰的核碱基包括嘌呤和嘧啶的类似物。合适的类似物包括但不限于1-甲基腺嘌呤、2-甲基腺嘌呤、n6-甲基腺嘌呤、n6-异戊基腺嘌呤、2-甲硫基-n6-异戊基腺嘌呤、n,n-二甲基腺嘌呤、8-溴腺嘌呤、2-硫代胞嘧啶、3-甲基胞嘧啶、5-甲基胞嘧啶、5-乙基胞嘧啶、4-乙酰胞嘧啶、1-甲基鸟嘌呤、2-甲基鸟嘌呤、7-甲基鸟嘌呤、2,2-二甲基鸟嘌呤、8-溴鸟嘌呤、8-氯鸟嘌呤、8-氨基鸟嘌呤、8-甲基鸟嘌呤、8-硫代鸟嘌呤、5-氟尿嘧啶、5-溴尿嘧啶、5-氯尿嘧啶、5-碘尿嘧啶、5-乙基尿嘧啶、5-丙基尿嘧啶、5-甲氧基尿嘧啶、5-羟甲基尿嘧啶、5-(羧基羟甲基)尿嘧啶、5-(甲基氨基甲基)尿嘧啶、5-(羧甲基氨基甲基)-尿嘧啶、2-硫代尿嘧啶、5-甲基-2-硫代尿嘧啶、5-(2-溴乙烯基)尿嘧啶、尿嘧啶-5-氧乙酸、尿嘧啶-5-氧乙酸甲酯、假尿嘧啶、1-甲基假尿嘧啶、辫苷(queosine)、次黄嘌呤、黄嘌呤、2-氨基嘌呤、6-羟基氨基嘌呤、硝基吡咯基、硝基吲哚基和二氟甲苯基、6-硫代嘌呤以及2,6-二氨基嘌呤硝基吡咯基、硝基吲哚基和二氟甲苯基。典型地,核碱基含有含氮碱基。在某些实施方案中,核碱基不含氮原子。参见例如美国公开专利申请号20080274462。
修饰的核苷:如本文所使用,术语“修饰的核苷”是指与未连接至磷酸酯基或修饰的磷酸酯基(如本文所定义)并且含有修饰的核碱基(如本文所定义)、通用核碱基(如本文所定义)或修饰的糖部分(如本文所定义)中的一者或多者的糖(例如脱氧核糖或核糖或其类似物)的n-糖苷键联中的杂环含氮碱基。修饰的或通用的核碱基(本文也称为碱基类似物)一般位于核苷糖部分的1'位,并且是指1'位上除腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶和尿嘧啶以外的核碱基。在某些实施方案中,所述修饰的或通用的核碱基是含氮碱基。在某些实施方案中,所述修饰的核碱基不含氮原子。参见例如美国公开专利申请号20080274462。在某些实施方案中,所述修饰的核苷酸不含核碱基(无碱基)。本文描述了在本公开的上下文中合适的修饰的或通用的核碱基或者修饰的糖。
修饰的核苷酸:如本文所使用,术语“修饰的核苷酸”是指与未连接至磷酸酯基或修饰的磷酸酯基(如本文所定义)并且含有修饰的核碱基(如本文所定义)、通用核碱基(如本文所定义)或修饰的糖部分(如本文所定义)中的一者或多者的糖(例如核糖或脱氧核糖或其类似物)的n-糖苷键联中的杂环含氮碱基。修饰的或通用的核碱基(本文也称为碱基类似物)一般位于核苷糖部分的1'位,并且是指1'位上除腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶和尿嘧啶以外的核碱基。在某些实施方案中,所述修饰的或通用的核碱基是含氮碱基。在某些实施方案中,所述修饰的核碱基不含氮原子。参见例如美国公开专利申请号20080274462。在某些实施方案中,所述修饰的核苷酸不含核碱基(无碱基)。本文描述了在本公开的上下文中合适的修饰的或通用的核碱基、修饰的糖部分或者修饰的磷酸酯基。
修饰的磷酸酯基:如本文所使用,术语“修饰的磷酸酯基”是指天然核苷酸中不存在的磷酸酯基修饰,并且包括如本文所述的非天然存在的磷酸酯模拟物,包括含磷原子的磷酸酯模拟物和不含磷酸酯的阴离子磷酸酯模拟物(例如乙酸酯)。修饰的磷酸酯基还包括非天然存在的核苷酸间连接基团,包括如本文所述的含磷核苷酸间连接基团(包括例如硫代磷酸酯)和非含磷连接基团。
修饰的糖部分:如本文所使用,“修饰的糖部分”是指取代的糖部分(如本文所定义)或糖类似物(如本文所定义)。
天然核苷:如本文所使用,术语“天然核苷”是指与糖(例如脱氧核糖或核糖或其类似物)的n-糖苷键联中的杂环含氮碱基。天然杂环含氮碱基包括腺嘌呤、鸟嘌呤、胞嘧啶、尿嘧啶和胸腺嘧啶。
天然核苷酸:如本文所使用,术语“天然核苷酸”是指与连接至磷酸酯基的糖(例如核糖或脱氧核糖或其类似物)的n-糖苷键联中的杂环含氮碱基。天然杂环含氮碱基包括腺嘌呤、鸟嘌呤、胞嘧啶、尿嘧啶和胸腺嘧啶。
天然核碱基:如本文所使用,术语“天然核碱基”是指rna和dna的五种主要的天然存在的杂环核碱基,即嘌呤碱基:腺嘌呤(a)和鸟嘌呤(g),以及嘧啶碱基:胸腺嘧啶(t)、胞嘧啶(c)和尿嘧啶(u)。
天然核苷:如本文所使用,术语“天然核苷”是指与未连接至磷酸酯基的天然糖部分(如本文所定义)的n-糖苷键联中的天然核碱基(如本文所定义)。
天然核苷酸:如本文所使用,术语“天然核苷酸”是指与连接至磷酸酯基的天然糖部分(如本文所定义)的n-糖苷键联中的天然核碱基(如本文所定义)。
天然糖部分:如本文所使用,术语“天然糖部分”是指呋喃核糖基(如本文所定义)或脱氧呋喃核糖基(如本文所定义)。
非t细胞炎症表型:如本文所使用,“非t细胞炎症表型”是指不存在针对肿瘤的既有t细胞应答的肿瘤微环境,如通过肿瘤微环境中很少至没有累积浸润cd8+t细胞所证明。典型地,非t细胞炎症表型还以不促进肿瘤微环境中cd8+t细胞的募集和积累的有限趋化因子分布和/或最低限度的或不存在i型ifn基因标志为特征。
非wnt激活的疾病或病症:如本文所使用,“非wnt激活的”疾病或病症是指与wnt/β-连环蛋白途径的激活无关的疾病或病症。“非wnt激活的”疾病或病症包括某些癌症和/或增殖性疾病、病状或病症,包括某些结肠直肠癌、硬纤维瘤、子宫内膜癌、胃癌、肝细胞癌、肝母细胞瘤、肾癌(维尔姆斯瘤)、成髓细胞瘤、黑色素瘤、成神经细胞瘤、卵巢(子宫内膜样)癌、胰腺癌、毛母质瘤、前列腺癌、肾癌、甲状腺(间变性)癌和子宫(子宫内膜)癌。在一个实施方案中,“非wnt激活的”疾病或病症是结肠直肠癌、肝细胞癌或黑色素瘤。在一个实施方案中,“非wnt激活的”疾病或病症是成神经细胞瘤、肾癌或黑色素瘤。应当理解,疾病或病症,包括上文列出的癌症和/或增殖性疾病,可以包括所述疾病或病症的非wnt激活亚型和所述疾病或病症的wnt激活亚型,与下文提供的wnt激活的疾病或病症的定义一致。
核酸抑制剂分子:如本文所使用,术语“核酸抑制剂分子”是指降低或消除靶基因表达的寡核苷酸分子,其中所述寡核苷酸分子含有特异性靶向靶基因mrna中的序列的区域。典型地,核酸抑制剂分子的靶向区包含与靶基因mrna上的序列足够互补以指引所述核酸抑制剂分子对指定靶基因的作用的序列。核酸抑制剂分子可包括核糖核苷酸、脱氧核糖核苷酸和/或修饰核苷酸。
核碱基:如本文所使用,术语“核碱基”是指天然的核碱基(如本文所定义)、修饰的核碱基(如本文所定义)或通用的核碱基(如本文所定义)。
核苷:如本文所使用,术语“核苷”是指天然的核苷(如本文所定义)或修饰的核苷(如本文所定义)。
核苷酸:如本文所使用,术语“核苷酸”是指天然的核苷酸(如本文所定义)或修饰的核苷酸(如本文所定义)。
突出端:如本文所使用,术语“突出端”是指在双链核酸抑制剂分子的任一个链的任一端的末端非碱基配对核苷酸。在某些实施方案中,突出端由一个链或区域延伸超出与第一链或区域形成双链体的互补链的末端而产生。能够通过碱基对的氢键合形成双链体的两个寡核苷酸区域中的一个或两个的5'端和/或3'端可延伸超出两个多核苷酸或区域共用的互补性的3'端和/或5'端。延伸超出双链体的3'端和/或5'端的单链区域称为突出端。
药物组合物:如本文所使用,术语“药物组合物”包含药理学有效量的β-连环蛋白核酸抑制剂分子或免疫治疗剂,诸如抗体(包括例如抗ctla-4、抗pd-1或抗pd-l1抗体中的一种或多种)和药学上可接受的赋形剂。
药学上可接受的赋形剂:如本文所使用,术语“药学上可接受的赋形剂”意指赋形剂为适合用于人类和/或动物而没有与合理的效益/风险比相称的不当不良副作用(诸如毒性、刺激和过敏应答)的赋形剂。
磷酸酯模拟物:如本文所使用,术语“磷酸酯模拟物”是指在寡核苷酸的5'末端的模拟磷酸酯基的静电和空间性质的化学部分。已经开发了许多可连接至寡核苷酸5'端的磷酸酯模拟物(参见例如美国专利号8,927,513;prakash等,nucleicacidsres.,2015,43(6):2993-3011)。典型地,这些5'-磷酸酯模拟物含有磷酸酶抗性键联。合适的磷酸酯模拟物包括:5'-膦酸酯,诸如5'-亚甲基膦酸酯(5'-mp)和5'-(e)-乙烯基膦酸酯(5'-vp),以及与寡核苷酸的5'末端核苷酸的糖部分(例如核糖或脱氧核糖或其类似物)的4'-碳结合的4'-磷酸酯类似物,诸如4'-氧甲基膦酸酯、4'-硫代甲基膦酸酯或4'-氨基甲基膦酸酯,如国际公开号wo2018/045317中所描述,该案特此通过引用整体并入。在某些实施方案中,4'-氧甲基膦酸酯由式-o-ch2-po(oh)2或-o-ch2-po(or)2表示,其中r独立地选自h、ch3、烷基或保护基。在某些实施方案中,烷基是ch2ch3。更典型地,r独立地选自h、ch3或ch2ch3。已经开发了针对寡核苷酸5'端的其他修饰(参见例如wo2011/133871)。
加强:如本文所使用的术语“加强(potentiate或potentiating)”是指一种治疗剂(例如β-连环蛋白核酸抑制剂分子)增加或增强另一种治疗剂(例如诸如ctla-4或pd-1等抑制性免疫检查点分子的拮抗剂,或共刺激性检查点分子的激动剂)的治疗效果的能力。
保护基:如本文所使用,术语“保护基”在常规化学意义上用作在所需反应的某些条件下可逆地致使官能团不可反应的基团。在所需的反应之后,可以除去保护基以使被保护的官能团脱保护。所有保护基都应当为在不会使相当大比例的合成分子降解的条件下可除去的。
降低:如本文所使用的术语“降低(reduce或reduces)”是指其在本领域中一般被接受的含义。关于核酸抑制剂分子,该术语一般是指基因表达降低,或者编码一种或多种蛋白质或蛋白质亚基的rna分子或等效rna分子的水平降低,或者一种或多种蛋白质或蛋白质亚基的活性降低,低于不存在所述核酸抑制剂分子时所观测到的水平。
抗性:术语“抗性”或“有抗性的”在关于免疫疗法使用时是指癌症和/或增殖性疾病、病状或病症没有显示出对免疫疗法的医学上显著的应答。如本文所公开,可以通过降低β-连环蛋白表达来逆转对免疫疗法的抗性。
呋喃核糖基:如本文所使用,术语“呋喃核糖基”是指在天然存在的rna中发现并且在2'-碳上具有羟基的呋喃糖基,如以下所示:
核糖核苷酸:如本文所使用,术语“核糖核苷酸”是指在糖部分的2'位置具有羟基的天然核苷酸(如本文所定义)或修饰核苷酸(如本文所定义)。
有义链:双链核酸抑制剂分子包含两个寡核苷酸链:反义链和有义链。有义链或其区域与双链核酸抑制剂分子的反义链或其区域部分地、基本上或完全互补。在某些实施方案中,有义链还可能含有与反义链非互补的核苷酸。非互补核苷酸可以在互补序列的任一侧,或者可以在互补序列的两侧。在某些实施方案中,当有义链或其区域与反义链或其区域部分或基本上互补时,非互补核苷酸可位于一个或多个互补区(例如,一个或多个错配)之间。有义链也称为随从链。
受试者:如本文所使用,术语“受试者”意指任何哺乳动物,包括小鼠,兔子和人类。在一个实施方案中,受试者是人类。术语“个体”或“患者”意在可与“受试者”互换。
取代基或取代的:如本文所使用的术语“取代基”或“取代的”是指指定结构中的氢基被取代基置换。除非另外指出,否则当任何指定结构中的超过一个位置可以被超过一个取代基取代时,每个位置上的取代基可以相同或不同。如本文所使用,术语“取代的”预期包括与有机化合物相容的所有容许取代基。容许取代基包括有机化合物的无环和环状、支链和无支链、碳环和杂环、芳族和非芳族取代基。本公开内容无意以任何方式受有机化合物的容许取代基限制。
取代的糖部分:如本文所使用,“取代的糖部分”包括包含一个或多个修饰的呋喃糖基。典型地,修饰发生在糖的2'-碳、3'-碳、4'-碳或5'-碳位置。
糖类似物:如本文所使用,术语“糖类似物”是指不包含呋喃糖基并且能够置换核苷酸中天然存在的糖部分,使得所得核苷酸能够(1)并入寡核苷酸中和(2)与互补核苷酸杂交的结构。此类结构典型地包括对呋喃糖基的相对简单的改变,诸如包含不同数目的原子的环(例如4元环、6元环或7元环);用非氧原子(例如碳、硫或氮)置换呋喃糖基的氧;或者既改变原子数又置换氧。此类结构还可以包含与针对取代的糖部分所描述的那些取代相对应的取代。糖类似物还包括更复杂的糖替代物(例如,肽核酸的非环系统)。糖类似物包括但不限于吗啉基、环己烯基和环己六醇类。
糖部分:如本文所使用,术语“糖部分”是指核苷酸或核苷的天然糖部分或修饰糖部分。
靶位点:如本文所使用,术语“靶位点”、“靶序列”、“靶核酸”、“靶区域”、“靶基因”可互换使用,并且是指“被靶向”例如以便进行由在其向导/反义区内含有与该靶序列部分、基本上或者完全或充分互补的序列的dsrnai抑制剂分子介导的切割的rna或dna序列。
t细胞炎症肿瘤表型:如本文所使用,“t细胞炎症表型”是指存在针对肿瘤的既有t细胞应答的肿瘤微环境,如通过肿瘤微环境中累积浸润cd8+t细胞所证明。典型地,t细胞炎症表型还以能够将cd8+t细胞募集至肿瘤微环境的广泛趋化因子分布(包括cxcl9和/或cxcl10)和/或i型ifn基因标志为特征。
治疗有效量:如本文所使用,“治疗有效量”或“药理学有效量”是指对产生预期药理学、治疗或预防结果有效的β-连环蛋白核酸抑制剂分子或免疫治疗剂诸如抗体(包括例如抗ctla-4、抗pd-1或抗pd-l1抗体中的一种或多种)的量。
通用核碱基:如本文所使用,“通用核碱基”是指可与典型地在天然存在的核酸中发现的超过一个碱基配对的碱基,并且因此可以替代双链体中的此类天然存在的碱基。碱基不必能够与天然存在的碱基中的每一个配对。举例来说,某些碱基仅或选择性地与嘌呤配对,或者仅或选择性地与嘧啶配对。通用核碱基可以通过沃森-克里克或非沃森-克里克相互作用(例如胡斯坦(hoogsteen)相互作用)形成氢键而进行碱基配对。代表性通用核碱基包括肌苷及其衍生物。
wnt激活的疾病或病症:如本文所使用,“wnt激活的”疾病或病症是指与激活的wnt/β-连环蛋白途径有关的疾病或病症。“wnt相关的”疾病或病症包括癌症和/或增殖性疾病、病状或病症,包括结肠直肠癌、硬纤维瘤、子宫内膜癌、胃癌、肝细胞癌、肝母细胞瘤、肾癌(维尔姆斯瘤)、成髓细胞瘤、黑色素瘤、卵巢(子宫内膜样)癌、胰腺癌、毛母质瘤、前列腺癌、甲状腺(间变性)癌和子宫(子宫内膜)癌。在一个实施方案中,“wnt激活的”疾病或病症是结肠直肠癌、肝细胞癌或黑色素瘤。应当理解,疾病或病症,包括上文列出的癌症和/或增殖性疾病,可以包括所述疾病或病症的wnt激活型式和所述疾病或病症的非wnt激活型式,与上文提供的非wnt激活的疾病或病症的定义一致。
wnt/β-连环蛋白途径:如本文所使用,“wnt/β-连环蛋白途径”是指细胞中通过引发涉及β-连环蛋白的下游信号传导途径的wnt配体、受体和共受体的组合介导的分子信号传导途径(参见例如图6)。在不存在wnt信号传导时,靶向β-连环蛋白以便经由细胞质中的泛素化进行降解。在存在wnt配体和wnt信号传导时,β-连环蛋白被稳定化并且输送至细胞核,在此它可与转录因子,诸如t细胞转录因子(tcf)和淋巴增强转录因子(lef)相互作用并激活基因转录。wnt/β-连环蛋白途径的调控异常和激活最常由β-连环蛋白基因或者负调控β-连环蛋白功能的编码结肠腺瘤性息肉病(apc)的基因中的突变引起,但也可能由编码wnt/β-连环蛋白途径的其他组分,诸如axin、lef和icat的基因中的突变引起。
具体实施方式
本申请提供了一种有效的优化的双链β-连环蛋白核酸抑制剂分子,其具有独特的修饰核苷酸模式。如实施例所示,改变双链核酸分子的有义链和反义链中核苷酸的修饰模式可以改善诸多性质,包括降低免疫原性和改善肿瘤细胞中β-连环蛋白mrna表达降低,即使当有义链和反义链的核苷酸序列相同时。还提供了在体外或体内使用优化的双链β-连环蛋白核酸抑制剂分子和包含其的组合物降低β-连环蛋白基因的水平或表达的方法,包括治疗癌症的方法和组合物,包括对免疫疗法(例如阻断免疫检查点分子)无应答的癌症。
优化的β-连环蛋白核酸抑制剂分子
本文描述的双链β-连环蛋白核酸抑制剂分子包含独特的核苷酸修饰模式,并且相对于不具有相同核苷酸修饰模式的β-连环蛋白核酸抑制剂分子具有改善的性质。在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子的有义链包含seqidno:11的核酸。在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子的有义链由seqidno:11的核酸组成。在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子的反义链包含seqidno:12的核酸。在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子的反义链由seqidno:12的核酸组成。在一个实施方案中,所述有义链由seqidno:11的核酸组成,并且所述反义链由seqidno:12的核酸组成。在一个实施方案中,所述有义链包含seqidno:11的核酸,并且所述反义链包含seqidno:12的核酸。
在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子是包括有义链和反义链的双链核酸抑制剂分子,其中所述有义链包含seqidno:11的核酸或由其组成,并且所述反义链包含seqidno:12的核酸或由其组成,并且所述有义链和反义链一起形成26个碱基对的双链体区,并且其中所述反义链包括在其3'末端的2个单链核苷酸和在其5'末端的10个单链核苷酸。
这种优化的β-连环蛋白核酸抑制剂分子的示意图示于图2a(“exm3”)中,示出了有义链和反义链的序列、在有义链与反义链之间的互补区,以及独特的修饰核苷酸模式。
所述独特的修饰核苷酸模式还示于seqidno:11和seqidno:12中。如seqidno:11和seqidno:12中所示,修饰的β-连环蛋白核酸抑制剂分子中大部分核苷酸的糖部分被2'-f或2'-och3修饰。具体来说,对于有义链(seqidno:11),核苷酸1、3、7、9-11、13、15、19和20中每一个的糖部分被2'-f修饰,并且核苷酸2、4-6、8、12、14、16-18和24中每一个的糖部分被2'-och3修饰,如图2a中所描绘。对于反义链(seqidno:12),核苷酸2、6、19、21、23、25、30、31、33和35中每一个的糖部分被2'-f修饰,并且核苷酸1、3-5、7-9、11-15、20、22、24、26、32、34和36-38中每一个的糖部分被2'-och3修饰,如图2中所描绘。所述优化的β-连环蛋白核酸抑制剂分子中的其余核苷酸没有被2'-f或2'-och3修饰。更具体来说,对于有义链(seqidno:11),核苷酸25和26是脱氧核糖核苷酸,并且核苷酸21-23是核糖核苷酸。典型地,核苷酸25和26是天然脱氧核糖核苷酸,并且核苷酸21-23是天然核糖核苷酸。对于反义链(seqidno:12),核苷酸10是脱氧核糖核苷酸,并且核苷酸16-18和27-29是核糖核苷酸。典型地,核苷酸10是天然脱氧核糖核苷酸,并且核苷酸16-18和27-29是天然核糖核苷酸。
在一个实施方案中,所述优化的β-连环蛋白核酸抑制剂分子是包括有义链和反义链的双链核酸抑制剂分子;
其中所述有义链包含seqidno:13的核酸序列(agaauacaaaugauguagaaacagcc)或由其组成,并且所述反义链包含seqidno:14的核酸序列(uagcuaucgtggcuguuucuacaucauuuguauucugc)或由其组成,并且所述有义链和反义链一起形成26个碱基对的双链体区,并且所述反义链包括在其3'末端的2个单链核苷酸和在其5'末端的10个单链核苷酸;
其中seqidno:13的核苷酸1、3、7、9-11、13、15、19和20中每一个的糖部分经2'-f修饰,seqidno:13的核苷酸2、4-6、8、12、14、16-18和24中每一个的糖部分经2'-och3修饰,seqidno:13的核苷酸25和26是天然脱氧核糖核苷酸,并且seqidno:13的核苷酸21-23是天然核糖核苷酸;
其中seqidno:14的核苷酸2、6、19、21、23、25、30、31、33和35中每一个的糖部分经2'-f修饰,seqidno:14的核苷酸1、3-5、7-9、11-15、20、22、24、26、32、34和36-38中每一个的糖部分经2'-och3修饰,seqidno:14的核苷酸10是天然脱氧核糖核苷酸,并且seqidno:14的核苷酸16-18和27-29是天然核糖核苷酸。
一个相关方面针对一种包含seqidno:11的核酸或由其组成的寡核苷酸。另一个方面针对一种包含seqidno:12的核酸或由其组成的寡核苷酸。
还提供了一种包含seqidno:13的核酸或由其组成的寡核苷酸,其中核苷酸1、3、7、9-11、13、15、19和20中每一个的糖部分被2'-f修饰;核苷酸2、4-6、8、12、14、16-18和24中每一个的糖部分被2'-och3修饰;核苷酸25和26是脱氧核糖核苷酸;并且核苷酸21-23是核糖核苷酸。典型地,核苷酸25和26是天然脱氧核糖核苷酸,并且核苷酸21-23是天然核糖核苷酸。
还提供了一种包含seqidno:14的核酸或由其组成的寡核苷酸,其中核苷酸2、6、19、21、23、25、30、31、33和35中每一个的糖部分被2'-f修饰;核苷酸1、3-5、7-9、11-15、20、22、24、26、32、34和36-38中每一个的糖部分被2'-och3修饰;核苷酸10是脱氧核糖核苷酸;并且核苷酸16-18和27-29是核糖核苷酸。典型地,核苷酸10是天然脱氧核糖核苷酸,并且核苷酸16-18和27-29是天然核糖核苷酸。
其他修饰
如本文所描述,所述优化的β-连环蛋白核酸抑制剂分子包含独特的核苷酸修饰模式,包括在某些核苷酸的糖部分的2'-碳处的独特的2'-f和2'-ome修饰模式,如seqidno:11和seqidno:12中所示。
在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子的核苷酸含有发生在核苷酸的其他部分,包括核碱基、磷酸酯基或糖部分的其他部分的一个或多个额外的修饰。
举例来说,在某些实施方案中,糖部分的环结构可能经过修饰,包括但不限于锁核酸(“lna”)(参见例如koshkin等,(1998),tetrahedron,54,3607-3630)、桥核酸(“bna”)(参见例如美国专利号7,427,672和mitsuoka等,(2009),nucleicacidsres.,37(4):1225-38)和解锁核酸(“una”)(参见例如snead等(2013),moleculartherapy–nucleicacids,2,e103(doi:10.1038/mtna.2013.36))中存在的经修饰的环结构。额外的修饰还可以发生在核苷酸的糖部分的其他部分,诸如5'-碳,如本文所描述。
在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子还可以包括除了在1'位的腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶和尿嘧啶以外的一个或多个修饰的核碱基,如本领域已知和本文所描述。在某些实施方案中,所述修饰的或通用的核碱基是含氮碱基。在某些实施方案中,所述修饰的核碱基不含氮原子。参见例如美国公开专利申请号20080274462。在某些实施方案中,所述修饰的核苷酸不含核碱基(无碱基)。修饰的核碱基的典型实例是5'-甲基胞嘧啶。
在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子还可以包括一个或多个修饰的磷酸酯基。修饰的磷酸酯基是指天然核苷酸中不存在的磷酸酯基修饰,并且包括如本文所描述的非天然存在的磷酸酯模拟物,包括含磷原子的磷酸酯模拟物和不含磷酸酯的阴离子磷酸酯模拟物(例如乙酸酯)。修饰的磷酸酯基还包括非天然存在的核苷酸间连接基团,包括如本文所描述的含磷核苷酸间连接基团和非含磷连接基团。典型地,所述优化的β-连环蛋白核酸抑制剂分子含有一个或多个含磷核苷酸间连接基团,如本文所描述。在其他实施方案中,所述核酸抑制剂分子的一个或多个核苷酸间连接基团是非含磷键联。在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子含有一个或多个含磷核苷酸间连接基团和一个或多个非含磷核苷酸间连接基团,如本文所描述。
所述核酸抑制剂分子的5'端可以包括天然取代基,诸如羟基或磷酸酯基。在某些实施方案中,羟基连接至所述核酸抑制剂分子的有义链或反义链的5'末端。在某些实施方案中,磷酸酯基连接至所述核酸抑制剂分子的5'末端。典型地,磷酸酯在寡核苷酸合成前添加至单体。在其他实施方案中,在核酸抑制剂分子例如通过胞液clp1激酶引入胞液中后自然地实现5'-磷酸化。在一些实施方案中,5'末端磷酸酯是磷酸酯基,诸如5'-单磷酸酯[(ho)2(o)p-o-5']、5'-二磷酸酯[(ho)2(o)p-o-p(ho)(o)-o-5']或5'-三磷酸酯[(ho)2(o)p-o-(ho)(o)p-o-p(ho)(o)-0-5']。
在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子的一个或两个核苷酸被谷胱甘肽敏感部分可逆地修饰。典型地,所述谷胱甘肽敏感部分位于糖部分的2'-碳处,并且包含二硫桥或磺酰基。在某些实施方案中,所述谷胱甘肽敏感部分与亚磷酰胺寡核苷酸合成方法相容,如例如国际申请号pct/us2017/048239中所描述,该案特此通过引用整体并入。在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子的超过两个核苷酸被谷胱甘肽敏感部分可逆地修饰。在某些实施方案中,大部分核苷酸被谷胱甘肽敏感部分可逆地修饰。在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子的所有或基本上所有核苷酸都被谷胱甘肽敏感部分可逆地修饰。
至少一个谷胱甘肽敏感部分典型地位于双链核酸抑制剂分子的随从链或向导链的5'或3'末端核苷酸处。然而,至少一个谷胱甘肽敏感部分可以位于所述优化的β-连环蛋白核酸抑制剂分子中的任何目标核苷酸处。
降低β-连环蛋白表达的方法
如本文所描述的优化的核酸抑制剂分子可用于降低β-连环蛋白mrna表达的方法。典型地,降低β-连环蛋白mrna表达的方法包括以足以降低β-连环蛋白基因表达的量向样品或有需要的受试者施用如本文所描述的优化的核酸抑制剂分子。所述方法可在体外或体内进行。
β-连环蛋白rna的水平或活性可以通过本领域目前已知或随后开发的合适的方法来测定。可以理解,用于测量靶rna和/或靶基因的“表达”的方法可以取决于所述靶基因及其编码的rna的性质。举例来说,在靶β-连环蛋白rna序列编码蛋白质时,术语“表达”可以指蛋白质或源自β-连环蛋白基因(基因组来源或外源来源)的β-连环蛋白rna/转录物。在此类情况下,可以通过直接测量β-连环蛋白rna/转录物的量或者通过测量β-连环蛋白的量来测定靶β-连环蛋白rna的表达。可以在蛋白质测定中,诸如通过染色或免疫印迹,或者在蛋白质催化可测量的反应时通过测量反应速率来测量蛋白质。所有此类方法都是本领域中已知的并且可以使用。在将要测量靶β-连环蛋白rna水平时,可以使用本领域公认的检测rna水平的方法(例如rt-pcr、rna印迹(northernblotting)等)。在靶向β-连环蛋白rna时,测量核酸抑制剂分子在降低受试者、组织中、细胞中(体外或体内)或细胞提取物中的β-连环蛋白rna或蛋白质的水平方面的功效还可以用于测定β-连环蛋白相关表型(例如疾病或病症,例如癌症或肿瘤形成、生长、转移、扩散等)的降低程度,如例如国际申请号pct/us2017/022510中所公开。可以对细胞、细胞提取物、组织、组织提取物或其他合适的源材料进行上述测量。
药物组合物
本公开内容提供了药物组合物,其包含治疗有效量的如本文所描述的优化的β-连环蛋白核酸抑制剂分子和药学上可接受的赋形剂。
这些药物组合物可以通过常规灭菌技术进行灭菌,或者可以进行无菌过滤。所得水溶液可以经包装以供依原样使用,或经冻干,在施用前将冻干制剂与无菌水性赋形剂组合。制剂的ph典型地将在3与11之间,更优选在5与9之间或在6与8之间,并且最优选在7与8之间,诸如7至7.5。
本公开的药物组合物应用于治疗用途。因此,本公开的一个方面提供了一种药物组合物,其可用于通过向受试者施用治疗有效量的本公开的药物组合物来治疗所述受试者,包括但不限于罹患疾病或病状的人。典型地,所述疾病或病状是癌症,如本文所描述。
在某些实施方案中,本公开的特征在于治疗有效量的如本文所描述的药物组合物用于制造药物以供治疗有需要的受试者的用途。典型地,所述受试者患有癌症,如本文所描述。
药学上可接受的赋形剂
可用于本公开的药学上可接受的赋形剂是常规的。remington’spharmaceuticalsciences,e.w.martin,mackpublishingco.,easton,pa,第15版(1975)描述了适用于药物递送一种或多种治疗组合物的组成和配方。可用作药学上可接受的赋形剂的材料的一些实例包括:糖,诸如乳糖、葡萄糖和蔗糖;淀粉,诸如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,诸如羧甲基纤维素钠、乙基纤维素和醋酸纤维素;麦芽;明胶;赋形剂,诸如可可脂和栓剂蜡;油,诸如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;缓冲剂,诸如氢氧化镁和氢氧化铝;(等渗盐水;林格氏溶液);乙醇;ph缓冲溶液;多元醇,诸如甘油、丙二醇、聚乙二醇等等;以及药物制剂中采用的其他无毒相容物质。
剂型
药物组合物可以与常规赋形剂一起配制以用于任何预期施用途径,其可以根据常规实践进行选择。
在一个实施方案中,所述药物组合物含有如本文所描述的优化的β-连环蛋白核酸抑制剂分子,并且适合肠胃外施用。所述药物组合物任选地含有免疫治疗剂,诸如抑制性免疫检查点分子的拮抗剂(例如抗ctla-4、抗pd-1或抗pd-l1抗体中的一种或多种)或共刺激检查点分子的激动剂。典型地,本公开的含有寡核苷酸的药物组合物配制成液体形式以供肠胃外施用,例如通过皮下、肌肉内、静脉内或硬膜外注射。
适合肠胃外施用的剂型典型地包括一种或多种适合肠胃外施用的媒介物,包括例如无菌水溶液、生理盐水、低分子量醇类诸如丙二醇、聚乙二醇、植物油、明胶、脂肪酸酯诸如油酸乙酯等等。肠胃外制剂可以含有糖、醇类、抗氧化剂、缓冲液、抑细菌剂、使制剂与预期接受者的血液等渗的溶质或者悬浮剂或增稠剂。可以例如通过使用表面活性剂来维持适当的流动性。液体制剂可以冻干并储存,以便稍后用无菌可注射溶液复原后使用。
药物组合物还可以使用众所周知的技术进行配制以用于其他施用途径,包括局部或透皮施用、直肠或阴道施用、经眼施用、经鼻施用、经口腔施用或经舌下施用。
递送剂
如本文所描述的优化的β-连环蛋白核酸抑制剂分子可以与其他分子、分子结构或化合物混合物混合、包封、缀合或者以其他方式相关联,包括例如脂质体和脂质,诸如美国专利号6,815,432、6,586,410、6,858,225、7,811,602、7,244,448和8,158,601中公开的那些;聚合物材料,诸如美国专利号6,835,393、7,374,778、7,737,108、7,718,193、8,137,695以及美国公开专利申请号2011/0143434、2011/0129921、2011/0123636、2011/0143435、2011/0142951、2012/0021514、2011/0281934、2011/0286957和2008/0152661中公开的那些;衣壳、类壳体(capsoid)或受体靶向性分子,以辅助摄取、分布或吸收。
在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子被配制在脂质纳米颗粒(lnp)中。脂质-核酸纳米颗粒典型地在将脂质与核酸混合以形成复合物时自发形成。取决于所需的粒度分布,所得纳米颗粒混合物可以任选地使用例如热桶挤出机,诸如
在某些实施方案中,所述lnp包含核心脂质组分,所述核心脂质组分包含阳离子脂质体和聚乙二醇化脂质。所述lnp还可以包含一种或多种被膜脂质,诸如阳离子脂质、结构或中性脂质、固醇、聚乙二醇化脂质或其混合物。
用于lnp中的阳离子脂质是本领域已知的,如例如美国公开专利申请号2015/0374842和2014/0107178中所论述。典型地,所述阳离子脂质是在生理ph下具有净正电荷的脂质。在某些实施方案中,所述阳离子脂质体是dodma、dotma、dl-048或dl-103。在某些实施方案中,所述结构或中性脂质是dspc、dppc或dopc。在某些实施方案中,所述固醇是胆固醇。在某些实施方案中,所述聚乙二醇化脂质是dmpe-peg、dspe-peg、dsg-peg、dmpe-peg2k、dspe-peg2k、dsg-peg2k或dsg-mpeg。在一个实施方案中,所述阳离子脂质是dl-048,所述聚乙二醇化脂质是dsg-mpeg,并且所述一种或多种被膜脂质是dl-103、dspc、胆固醇和dspe-mpeg。参见例如图5,其示出了可用于配制优化的β-连环蛋白核酸抑制剂分子的lnp的一个非限制性实施方案。
在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子与指引寡核苷酸递送至目标组织的配体共价缀合。已经探讨了许多这样的配体。参见例如winkler,ther.deliv.4(7):791-809(2013)。举例来说,所述优化的β-连环蛋白核酸抑制剂分子可以与一个或多个糖配体部分(例如n-乙酰半乳糖胺(galnac))缀合,以指引寡核苷酸摄取至肝脏中。参见例如美国专利号5,994,517、美国专利号5,574,142、wo2016/100401。典型地,所述优化的β-连环蛋白核酸抑制剂分子与三个或四个糖配体部分缀合。可以使用的其他配体包括但不限于甘露糖-6-磷酸、胆固醇、叶酸、转铁蛋白和半乳糖(关于其他具体示例性配体,参见例如wo2012/089352)。
施用/治疗的方法
一个实施方案针对一种治疗β-连环蛋白相关病症的方法,所述方法包括向受试者施用包含治疗有效量的如本文所描述的优化的β-连环蛋白核酸抑制剂分子的药物组合物。在某些实施方案中,所述β-连环蛋白相关病症是癌症。
此类癌症的非限制性实例包括胆道癌、膀胱癌、移行细胞癌、尿路上皮癌、脑癌、胶质瘤、星形细胞瘤、乳腺癌、化生性癌、宫颈癌、宫颈鳞状细胞癌、直肠癌、结肠直肠癌、结肠癌、遗传性非息肉病性结肠直肠癌、结肠直肠腺癌、胃肠间质瘤(gist)、子宫内膜癌、子宫内膜间质肉瘤、食管癌、食管鳞状细胞癌、食管腺癌、眼黑色素瘤、葡萄膜黑色素瘤、胆囊癌、胆囊腺癌、肾细胞癌、肾透明细胞癌、移行细胞癌、尿路上皮癌、维尔姆斯瘤、白血病、急性淋巴细胞白血病(all)、急性骨髓性白血病(aml)、慢性淋巴细胞白血病(cll)、慢性骨髓性白血病(cml)、慢性骨髓单核细胞白血病(cmml)、肝癌、肝癌瘤、肝细胞瘤、肝细胞癌、胆管癌、肝母细胞瘤、肺癌、非小细胞肺癌(nsclc)、间皮瘤、b细胞淋巴瘤、非霍奇金淋巴瘤(non-hodgkinlymphoma)、弥漫性大b细胞淋巴瘤、套细胞淋巴瘤、t细胞淋巴瘤、非霍奇金淋巴瘤、前体t成淋巴细胞淋巴瘤/白血病、外周t细胞淋巴瘤、多发性骨髓瘤、鼻咽癌(npc)、成神经细胞瘤、口咽癌、口腔鳞状细胞癌、骨肉瘤、卵巢癌、胰腺癌、胰腺导管腺癌、假乳头状赘瘤、腺泡细胞癌、前列腺癌、前列腺腺癌、皮肤癌、黑色素瘤、恶性黑色素瘤、皮肤黑色素瘤、小肠癌、胃癌、胃癌瘤、胃肠间质瘤(gist)、子宫癌或子宫肉瘤。在某些实施方案中,本公开内容的特征在于治疗肝癌、肝癌瘤、肝细胞瘤、肝细胞癌、胆管癌和肝母细胞瘤的方法。在所述治疗方法的某些实施方案中,所述癌症是结肠直肠癌、肝细胞癌或黑色素瘤。在所述治疗方法的某些实施方案中,所述癌症是黑色素瘤、成神经细胞瘤或肾癌。
在某些实施方案中,本文公开的药物组合物可用于治疗或预防与wnt激活的疾病或病症诸如癌症有关的症状。在其他实施方案中,本文公开的药物组合物可用于治疗或预防与非wnt激活的疾病或病症诸如癌症有关的症状。
在一些实施方案中,所述癌症与激活的wnt/β-连环蛋白途径相关。在其他实施方案中,所述癌症是非wnt激活的癌症。在某些实施方案中,所述受试者在施用优化的β-连环蛋白核酸抑制剂分子之前已被鉴定为患有非wnt激活的癌症。可以使用本领域技术人员可获得的任何方法将所述受试者鉴定为患有非wnt激活的癌症。然而,典型地,分析来自受试者的样品以确定受试者是否患有非wnt激活的癌症。在某些实施方案中,所述样品包含组织、细胞、血液或尿液。在某些实施方案中,分析所述样品中与激活的wnt/β-连环蛋白途径、无活性wnt/β-连环蛋白途径和/或非t细胞炎症表型相关的一种或多种生物标记物。可以使用任何合适的测定法或技术分析任何适当的生物标记物,包括但不限于核酸(例如mrna)、蛋白质和肽。在某些实施方案中,所述生物标记物是与激活的wnt/β-连环蛋白途径相关的基因突变,诸如编码β-连环蛋白或apc或涉及wnt/β-连环蛋白途径的一种或多种其他组分诸如axin、lef和icat的基因中的突变。
在某些实施方案中,所述治疗癌症的方法还包括施用治疗有效量的免疫治疗剂。在一些实施方案中,所述免疫治疗剂作为抑制性免疫检查点分子的拮抗剂或共刺激检查点分子的激动剂。在某些实施方案中,所述抑制性免疫检查点分子的拮抗剂是抗ctla-4、抗pd-1、抗pd-l1抗体或其组合。
在某些实施方案中,所述癌症对免疫疗法有抗性,但通过施用免疫疗法与β-连环蛋白核酸抑制剂分子(诸如本文描述的优化的β-连环蛋白核酸抑制剂分子)的组合可以逆转对免疫疗法的抗性。典型地,对免疫疗法无应答的癌症以非t细胞炎症性表型(也称为冷或非炎症性肿瘤)为特征,其中在肿瘤微环境中很少至没有浸润cd8+t细胞。降低β-连环蛋白表达可以将冷或非炎症性肿瘤转化为热或炎症性肿瘤,并加强免疫疗法的效果,即使在没有激活的wnt/β-连环蛋白途径的肿瘤中。换句话说,通过将β-连环蛋白抑制剂与免疫疗法组合,有可能治疗通常对免疫疗法无应答的冷或非炎症性肿瘤。已经证明这种组合治疗方法有效抑制多种癌症的体内肿瘤生长,包括具有和不具有激活的wnt/β-连环蛋白途径的癌症,如例如美国临时申请号62/477,783中所描述,该案特此通过引用整体并入。在某些实施方案中,所述癌症是非wnt激活的癌症。在某些实施方案中,所述癌症是wnt激活的癌症。
在一些实施方案中,本公开内容提供了一种加强针对癌症的体内免疫应答的方法,所述方法包括以足以加强免疫疗法对癌症的治疗效果或者以其他方式致使癌症易受免疫疗法影响的量向患有癌症的受试者施用如本文所描述的优化的β-连环蛋白核酸抑制剂分子。典型地,在施用所述优化的β-连环蛋白核酸抑制剂分子前,所述癌症与对免疫疗法有抗性的非t细胞炎症性表型相关,并且施用所述修饰的β-连环蛋白核酸抑制剂分子将所述非t细胞炎症性表型转化为t细胞炎症性表型,从而使得所述癌症对免疫疗法有应答。在某些实施方案中,所述对免疫疗法有抗性的癌症是wnt激活的癌症。在其他实施方案中,所述对免疫疗法有抗性的癌症是非wnt激活的癌症。
剂量和时间表
典型地,所述优化的β-连环蛋白核酸抑制剂分子经肠胃外施用(诸如经由静脉内、肌肉内或皮下施用)。在其他实施方案中,所述药物组合物经由局部施用或全身施用来递送。然而,本文公开的药物组合物还可以通过本领域已知的任何方法施用,包括例如口腔、舌下、直肠、阴道、尿道内、局部、眼内、鼻内和/或耳内,该施用可能包括片剂、胶囊剂、颗粒剂、水性混悬剂、凝胶剂、喷雾剂、栓剂、油膏剂、软膏剂等等。
在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子是以每天每千克接受者体重20微克至10毫克、每千克100微克至5毫克、每千克0.25毫克至5.0毫克或每千克0.5至3.0毫克的剂量施用。典型地,所述优化的β-连环蛋白核酸抑制剂分子是以每天每千克接受者体重约0.25至2.0毫克的剂量施用。
本发明的药物组合物可以每天或间歇性地施用。举例来说,间歇施用所述优化的β-连环蛋白核酸抑制剂分子可以是每周一至六天、每月一至六天、每周一次、每隔一周一次、每个月一次、每隔一个月一次或者每年一次或两次或者分成多个年剂量、月剂量、周剂量或日剂量施用。典型地,每周或每两周施用所述优化的β-连环蛋白核酸抑制剂分子。在一些实施方案中,间歇给药可能意指周期性施用,其中初始优化的β-连环蛋白核酸抑制剂分子或免疫治疗剂施用继之以不进行施用持续长达一周、长达一个月、长达两个月、长达三个月或长达六个月或更长时间的休息期,或者它可能意指隔数天、数周、数月或数年施用。
当与免疫治疗剂组合时,所述β-连环蛋白核酸抑制剂分子典型地与免疫治疗剂分开并且按与免疫治疗剂不同的时间表施用。含有免疫治疗剂的药物组合物典型地经静脉内施用。举例来说,当作为单剂使用时,伊匹单抗(ipilimumab)(抗ctla-4抗体)以3mg/kg的推荐剂量在90分钟内经静脉内施用,每3周一次,共计4个剂量。类似地,当作为单剂使用时,纳武单抗(nivolumab)(抗pd-1抗体)以240mg(或3mg/kg)的推荐剂量在60分钟内经静脉内施用,每2周一次。当纳武单抗与伊匹单抗组合施用时,纳武单抗的推荐剂量为在60分钟内经静脉内施用1mg/kg,继而在同一天以3mg/kg的推荐剂量施用伊匹单抗,每3周一次,共计4个剂量,然后以240mg的推荐剂量施用纳武单抗,每2周一次。
在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子在免疫治疗剂之前施用。在某些实施方案中,所述优化的β-连环蛋白核酸抑制剂分子在免疫治疗剂之后施用。在某些实施方案中,患者在开始用优化的β-连环蛋白核酸抑制剂分子治疗之前,先前已经用治疗剂治疗过。所述优化的β-连环蛋白核酸抑制剂分子或免疫治疗剂的治疗有效量可以取决于施用途径和患者的身体特征,诸如受试者的体型和体重、疾病进展或渗透的程度、受试者的年龄、健康和性别,并且可以取决于这些和其他因素进行必要的调整。
实施例
实施例1:修饰的β-连环蛋白(bcat)核酸抑制剂分子
以不同的修饰模式制造了若干种靶向β-连环蛋白基因的核酸抑制剂分子,以评价修饰模式如何影响分子的不同性质,诸如免疫原性、β-连环蛋白mrna表达的调节和/或ago2结合。为此目的,测试了双链核酸抑制剂分子的替代结构类别,包括如图1a中所示的在分子的右手侧(即,随从链的3'末端和向导链的5'末端)具有平端的上一代“非延伸”分子,以及如图2a中所示的具有在其5'末端有10个核苷酸的单链延伸的向导链的下一代“延伸”分子。在图1a和图2a中,无阴影的核苷酸含有核糖,浅阴影的核苷酸含有具有2'-ome修饰的核糖,较深阴影的核苷酸含有具有2'-f修饰的核糖,而被加粗方框包围的核苷酸含有脱氧核糖。
非延伸核酸抑制剂分子
构建了三个非延伸核酸抑制剂分子:非延伸m1(nexm1)、非延伸m2(nexm2)和非延伸m3(nexm3)。nexm1具有分别由25和27个碱基对组成的随从链和向导链。随从链和向导链一起形成由25个碱基对组成的双链体区,在向导链的3'端有两个碱基对的单链突出端。将许多个2'-ome修饰(浅阴影方框)并入nexm1的随从链和导向链中。随从链3'末端的最后两个核苷酸含有脱氧核糖。图1a。
将若干个2'-f修饰(较深阴影的碱基)引入至nexm1中以产生nexm2。除了碱基修饰模式的变化以外,nexm2的随从链和向导链的核苷酸序列与nexm1的相同。图1a。接下来,通过向nexm2添加四个额外的2'-f修饰来产生非延伸m3(nexm3)。nexm2和nexm3的随从链和向导链具有与nexm1相同的核苷酸序列、25个碱基对的双链体区和3'突出端,唯一的区别是2'-f修饰模式。
nexm1转化至nexm2或nexm3结构不影响内在效能,如那些构建体在细胞中的ic50值(分别为0.9pm、0.8pm和0.8pm)所证明,如图1a中所示。为了确定这些序列中的修饰模式是否影响双链核酸构建体的免疫原性,在用nexm1、nexm2和nexm3处理人pbmc之后测量干扰素应答。通过使用泛影葡胺(ficoll-histophaque)进行梯度离心从来自不同供体的人血样品中分离出pbmc。用与dotap(脂质体转染试剂和免疫佐剂)混合的双链核酸构建体将分离的pbmc处理不同的时间,并通过固态cdna合成继之以qpcr来监测if1t1诱导(干扰素诱导的基因)。将靶向bcl2基因的未修饰双链核酸抑制剂分子(长度为21个核苷酸)与dotap(avantipolarlipids,alabaster,al)混合,并用作本实验的参考物。nexm1显示if1t1显著升高,而nexm2显示中度升高。另一方面,nexm3与nexm1和nexm2相比非常安静,表明nexm3中2'-ome与2'-f修饰的特定组合显著降低了nexm3在人pbmc中诱导的干扰素应答(图1b)。
延伸核酸抑制剂分子
通过在向导链的5'端添加10个碱基对的单链突出端来产生下一代延伸双链核酸构建体。这种10个碱基对的单链突出端还包括额外的2'-ome和2'-f修饰。还在所述10个碱基对的单链突出端之前在双链体右手侧并入了额外的c/g碱基对,如图2a中所示。将额外的c/g碱基对和10个碱基对的延伸并入至nexm1、nexm2和nexm3构建体中分别产生了exm1、exm2和exm3构建体,如图2a中所示。
exm1的内在效能受到轻微影响,但所述并入基本上不影响exm2和exm3的效能,如图2a中的ic50值所示。在实施例2中如上文所描述来测量exm1、exm2和exm3在人pbmc中的干扰素应答。从exm1至exm2至exm3观察到免疫刺激降低的趋势(图2b),与在非延伸构建体中观察到的趋势类似,表明延伸双链核酸构建体中2'-ome与2'-f修饰的特定组合降低了干扰素应答。
实施例2:进一步评估所选择的bcat构建体
比较了具有最小干扰素应答的非延伸构建体(nexm3)与具有最小干扰素应答的延伸构建体(exm3)在来自4个不同供体的人pbmc中的干扰素应答(如先前所描述通过if1t1诱导测量)。所述比较中还包括nexm1。
nexm3和exm3在所有4个供体的pbmc中基本上没有干扰素应答,而nexm1在用来自供体1、2和4的pmbc处理时显示出适度干扰素应答,并且在用来自过敏性供体3的pmbc处理时显示出相当大的干扰素应答(图3a)。因此,nexm3和exm3中2'-ome与2'-f修饰的特定组合成功地降低了人pbmc中由这些核酸构建体引起的干扰素应答。
实施例3:肿瘤中的β-连环蛋白(ctnnb1)mrna敲低
为了观察修饰模式如何影响肿瘤中的靶标啮合,将nexm1、nexm3和exm3构建体配制在encore脂质纳米颗粒(lnp)中并测试活性。在不同的时间点在携带肿瘤的小鼠中评估核酸配制的lnp。为了产生肿瘤,将6至8周龄hsd:无胸腺裸foxn1nu小鼠在右肩下经皮下注射ls411n(5×106个细胞)。每2至3天测量肿瘤体积以监测肿瘤生长。当肿瘤达到200至250mm3时,将动物随机分组并分配至不同的组群中,并且注射携带不同的双链核酸抑制剂分子构建体的lnp,如图3b中所列。经由侧尾静脉经静脉内施用lnp,总体积为10ml/kg。在给药后24和120小时收集肿瘤样品并进行mrna分析。exm3显示出效能与nexm3相比时略强,但给药后24小时的效能与nexm1类似(图3b)。然而,exm3显示出给药后120小时效能与nexm1相比有所提高,但效能与nexm3类似。基于干扰素应答以及效能和持续时间效应,选择exm3进行进一步表征。
实施例4:比较nexm1与exm3
通过将exm3与上一代nexm1相比较来进一步评估其性质。为了研究这种增高的效能的可能机制,还比较了各构建体在肿瘤匀浆中的暴露水平和ago2结合水平(risc并入)。在以3mg/kg处理携带ls411n肿瘤的小鼠3天(肿瘤移植后第14天、15天和第16天)后,在肿瘤移植后第16天检测肿瘤组织中的exm3(反义链),其水平比nexm1高出大约5至100倍(图4a)。另外,在以3mg/kg处理携带ls411n肿瘤的小鼠3天(肿瘤移植后第14天、第15天和第16天)后,在肿瘤移植后第16天,exm3(反义链)显示出比nexm1高出大约5至10倍的ago2结合/risc负载(图4b),证明exm3似乎比前一代nexm1更加稳定和活跃。
为了观察改善的exm3性质是否转化为抗肿瘤功效,将携带sw403肿瘤的小鼠用lnp配制的nexm1或exm3以及安慰剂和pbs以qdx3、3mg/kg剂量水平进行处理(2个周期)。在每周两次给药周期(qdx3,3mg/kg)之后,相对于媒介物处理的动物,nexm1诱导约55%的肿瘤生长抑制,而exm3诱导超过80%生长抑制(图4c)。在研究结束时,还对肿瘤进行β-连环蛋白染色。如图4d中所示,exm3处理的肿瘤在β-连环蛋白水平方面与nexm1处理的肿瘤相比显著降低,表明exm3构建体引起的效能和持续时间的改善在用exm3处理的肿瘤中引起了抗肿瘤功效的增强。
实施例5:抑制wnt活性4t1肿瘤中的β-连环蛋白
将balb/c小鼠植入4t1肿瘤。在4t1肿瘤细胞植入后六天,平均肿瘤大小为150至200mm3,将小鼠分选为两组,并在植入后第6天和第7天以及第12天和第13天用安慰剂或exm3以3mg/kg进行处理,如图7a中所示。最后一个剂量后48小时,收集肿瘤并通过免疫组织化学分析β-连环蛋白、cd8和ido1蛋白水平。如图7b中所示,在两轮处理后,exm3处理降低了β-连环蛋白水平并且增高了cd8水平,但没有显著降低ido1水平。
在另一项研究中,将4t1肿瘤细胞植入balb/c小鼠中,并且在植入后4天将小鼠随机分为两组,并且用安慰剂或exm3处理。在第4天和第5天以3mg/kg向小鼠施用两个剂量的安慰剂或exm3,如图7c中所示。然后在第9天和第10天重复此组合给药周期。通过在治疗周期过程中测量肿瘤大小来监测肿瘤生长。单独用exm3处理小鼠引起约40%的肿瘤生长抑制。图7c。
在另一项类似的研究中,在植入后第6天和第7天以及第12天和第13天,用pbs或exm3以3mg/kg处理携带4t1肿瘤的小鼠,如图8a中所示。最后一个剂量后24小时收集肿瘤,并且进行流式细胞术以测量由提取的肿瘤制备的单细胞混悬液上的表面标记物。尽管pbs对照物对肿瘤免疫微环境没有显著影响,但exm3处理引起细胞毒性t细胞(cd8)和多个检查点(pd-1、lag-3和tim-3)显著增加。图8b。exm3处理显著增加了调控t细胞(treg),所述调控t细胞在调控或抑制免疫系统的其他细胞方面起重要作用。图8b。未观察到对免疫抑制性mdsc细胞的影响。图8b。
实施例6:抑制wnt活性4t1肿瘤中的ido1
在4t1肿瘤中用ido1抑制剂依帕卡司他(idoi)进行了另一项功效研究。将携带4t1肿瘤的小鼠随机分为两组,并且在植入后第6天和第8天用媒介物或idoi口服处理,每天两次,每次剂量为100mg/kg,如图9a中所示。最后一个剂量后48小时收集肿瘤,并且进行免疫组织化学以检查β-连环蛋白、cd8和ido1水平。100mg/kg的idoi几乎完全降低了ido1水平。图9b。β-连环蛋白水平适度降低,而cd8水平略微增高。图9b。在一项相关研究中,在植入后第6天和第8天对携带4t1肿瘤的小鼠施用安慰剂或idoi,每天两次,每天100mg/kg,如图9c中所示。通过在治疗周期过程中测量肿瘤大小来监测肿瘤生长。单独用idoi处理小鼠引起肿瘤生长抑制,表明除了β-连环蛋白以外,4t1肿瘤的肿瘤生长还依赖于ido1。图9c。
实施例7:抑制wnt活性4t1肿瘤中的ido1与β-连环蛋白抑制和/或检查点抑制剂组合
接下来,在4t1肿瘤中评价利用exm3和idoi或者exm3和检查点抑制剂(抗pd-1抗体)或者exm3、ido1和抗pd-1抗体三联疗法的组合疗法。将携带4t1肿瘤的小鼠分选为8组(n=5),并且在植入后第4天和第6天用idoi(口服,每次剂量为100mg/kg)并且在植入后第5天和第6天用exm3或安慰剂(静脉内,每次剂量为3mg/kg),然后在植入后第7天和第8天用抗pd-1抗体(腹膜内,每次剂量为5mg/kg)预处理,每天两次,如图10c中所示。小鼠还接受了作为单剂(图10a)和两种剂的组合(图10b)形式的exm3、idoi和pd-1抗体。接受作为单一疗法形式的exm3、idoi或抗pd1抗体的小鼠显示出适度抗肿瘤功效。图10a。接受exm3和抗pd-1抗体或exm3和idoi组合疗法的小鼠显示出肿瘤停滞,从而降低了肿瘤生长速率。图10b。值得注意的是,用所有三种剂(exm3、idoi和抗pd-1抗体)处理的小鼠显示出肿瘤消退,如图10c中所示,其中在施用所有三种剂之后,肿瘤体积开始明显减小。值得注意的是,如图10c中所示,exm3、依帕卡司他(idoi)和抗pd-1抗体三联组合的抗肿瘤作用明显优于在依帕卡司他(idoi)和抗pd-1二元组合下观察到的作用,目前正在iii期研究中进行评估。
在研究结束时(最后一次抗pd-1抗体处理后72小时),收集肿瘤并进行qpcr以分析某些t细胞标记物。观察到接受三联组合处理的小鼠中的cd8mrna与其他组相比显著增加。图11a。foxp3是被称为treg的免疫抑制性t细胞的标记物。当抗pd-1抗体加入安慰剂或exm3处理时,foxp3mrna水平增高。图11b。这些水平在添加idoi的情况下返回到背景水平。图11b。不希望受任何理论束缚,这些mrna数据表明,exm3、idoi和抗pd-1抗体三联组合既引起cd8t细胞显著增加,又引起免疫抑制性treg水平降低,而且4t1肿瘤微环境内t细胞群体的这些变化可能有助于所观察到的肿瘤消退。
- 还没有人留言评论。精彩留言会获得点赞!