用于制备液体培养基的精简型方法与流程
背景技术:
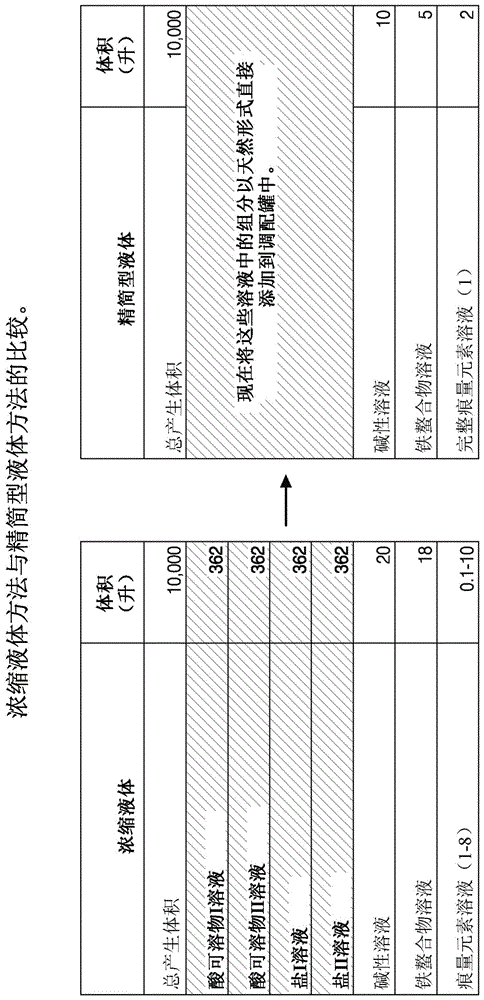
:液体细胞培养基制造工艺利用大量的酸和碱来使某些培养基组分溶解。此类向液体调配物的添加会引起批次间变化,可能随时间推移而修饰或破坏敏感培养基组分,并且可能导致金属离子浓度发生变化。长期需要一种可靠、有效的用于制备液体细胞培养基的方法,在所述方法中金属离子的浓度可以得到控制并且重金属的引入会减少,从而减少了下游环境关注。附图说明图1描绘了通过浓缩液体方法(左表)与通过精简型液体方法(右表)制备的液体培养基的比较。在一个实施例中,浓缩液体技术采用平均7小时制备时间而精简型液体采用平均3-4小时制备时间。图2浓缩液体方法在液体储备组分的制备期间使用大量的酸和碱。所述表显示,在通过浓缩技术制备的示例性液体培养基中,酸&碱占最终体积的1.88%。在此,浓缩技术使用了18.804ml/l的酸/碱。精简型液体方法完全消除了12n浓酸的使用并且显著减少了5n酸和5n碱的使用,从而减少了将金属污染物引入到最终调配物中。图3描绘了在酸(5nhcl)和碱(5nnaoh)中所测量的各种金属浓度(污染物)。针对金属污染物,通过icp-ms对四批5nhcl和5nnaoh进行了分析。目前的浓缩液体技术使用大量的酸和碱,这促成最终液体培养基中的金属污染物浓度的变化。(a)描绘了与(b)中显示的少于30μg/l的金属相比以更高浓度存在的金属的量。精简型液体方法消除了12n浓酸的使用并且显著减少了5n酸和5n碱的使用,从而减少了与金属污染物相关联的浓度和变化。图4显示了通过浓缩液体方法与通过精简型液体方法制备的培养基中的金属水平的比较。通过icp-ms对通过两种这些方法制备的培养基进行分析。对金属浓缩物进行了归一化,使得100%表示存在于“浓缩”方法(对照)中的金属。(a)与在通过“浓缩”方法(对照)制备时相比,用于制备液体cdchotm培养基(来自加利福尼亚州卡尔斯巴德生命技术公司(lifetechnologies,corp.,carlsbad,ca))的精简型方法产生了较低金属浓度的:铬、铜、锰和镍。(b)与在通过“浓缩”方法(对照)制备时相比,用于制备任何液体293培养基(来自加利福尼亚州卡尔斯巴德生命技术公司)的精简型方法产生了较低金属浓度的:铬、铁、锰和镍。图5描绘了通过(a)cho-s细胞与(b)293细胞的活细胞密度(vcd)测量的细胞生长的比较,所述cho-s细胞显示与浓缩液体对照相比在精简型液体培养基中的生长提高了147%,所述293细胞与浓缩液体对照相比在精简型液体培养基中具有类似的生长性能(105%)。图6显示了通过浓缩液体方法与通过精简型液体方法制备的液体cdchotm培养基中的igg效价性能比较。与通过传统“浓缩”对照方法制备的液体培养基中的蛋白质生产率相比,在通过“精简型”方法制备的培养基中,cho-s细胞展示出蛋白质生产率提高了约124%。本公开提供了一种制备液体培养基的方法,其包括:i)基于培养基组分的ph、溶解度和浓度将其分成组;ii)根据调配物中的组分转化氨基酸的游离碱形式/盐形式,以针对特定ph;iii)以允许所述组最佳溶解的顺序执行所述组的添加;其中与未使用以上步骤i)、ii)和iii)(步骤i)、ii)和iii)形成精简型方法)制备的培养基相比,所得液体培养基使所述组溶解所需要的酸和/或碱添加较少。与通过不使用如上所述的步骤i)、ii)和iii)的用于液体培养基制备的另一方法制备的液体培养基相比,使用此方法的所述所得液体培养基:(a)使所述组分溶解所需要的酸和/或碱添加较少;和/或(b)来自酸和/或碱添加的金属污染物减少;和/或(c)金属的批次间变化较少;并且(d)因为需要制备较少的溶液,所以需要较少的调配时间。通过上文描述的方法制备的液体培养基具有几种优点:例如,在一个实施例中,由于液体中的金属引起的批次间变化减少了小于10%。在其它实施例中,总金属浓度的批次间变化的减少小于约0.001%、小于约0.01%、小于约0.1%、小于约1%、小于约1-2%、小于约1-3%、小于约1-4%、小于约1-5%、小于约1-6%、小于约1-10%、小于约1-20%、小于约1-30%、小于约1-40%、小于约1-50%、小于约1-60%、小于约1-70%、小于约1-80%或小于约1-90%。在其它实施例中,任何金属浓度的批次间变化小于约0.001%、小于约0.01%、小于约0.1%、小于约1%、小于约2%、小于约3%、小于约4%、小于约5%、小于约6%、小于约10%、小于约15%、小于约20%、小于约30%、小于约40%、小于约50%、小于约0.001-1%、小于约0.001-5%、小于约0.001-10%、小于约1-10%、小于约10-20%、小于约20-30%、小于约30-40%、小于约40-50%、小于约50-100%、小于约50-90%、小于约50-80%、小于约50-70%、小于约50-60%。使用精简型方法的另一优点是添加到液体中的酸和/或碱的量减少了。例如,在一些实施例中,酸和/或碱的体积的减少为约10-40倍。在特定实施例中,酸和/或碱的体积的减少为约22倍。在某个实施例中,在精简型方法中消除了12n浓酸的使用。在一方面,与通过任何其它方法,例如,浓缩方法制备的液体培养基相比,在所述液体培养基中,一种或多种污染物金属的减少为约0.0001%到100%。在其它方面,与通过任何其它方法,例如,制备液体培养基的浓缩方法制备的液体培养基相比,一种或多种污染物金属的减少为约0.0001%到0.001%、约0.0001%到0.01%、约0.0001%到0.1%、约0.0001%到1%、约0.0001%到2%、约0.0001%到3%、约0.0001%到4%、约0.0001%到5%、约0.0001%到10%、约1%-5%、约1%-10%、约1%-15%、约1%-20%、约1%-25%、约1%-35%、约10-20%、约10-30%、约10-40%、约10-50%、约10-60%、约10-70%、约10-80%、约10-90%、约10-100%。在一方面,所述液体培养基中减少的所述污染物金属选自由以下组成的组:cr、fe、mg、cu、mn、ni、zn、mo、al和ca。在另一方面,与通过任何其它方法,例如,浓缩方法制备的液体培养基相比,金属污染%减少如下:cr减少约40-100%;fe减少约0.01-20%;cu减少约0.1-15%;mn减少约0.25-60%;ni减少约5-100%;zn减少约5%;并且mo减少约15%。在特定方面,与通过另一方法制备的液体培养基相比,所述液体细胞培养基的污染物金属水平较低。本公开还提供了一种无血清的液体细胞培养基、一种无蛋白质的液体细胞培养基或两者。本公开还提供了用于培养细胞的方法,其包括使所述细胞与使用以上所描述的方法制备的液体细胞培养基接触。在优选实施例中,所述细胞选自由以下组成的组:原代上皮细胞(例如,角质形成细胞、宫颈上皮细胞、支气管上皮细胞、气管上皮细胞、肾上皮细胞和视网膜上皮细胞)、已确立的细胞系和其细胞株、重组工程化细胞、二倍体细胞、杂交瘤(hybrioma)、中国仓鼠卵巢(cho)、hek293细胞、trg-2细胞、imr-33细胞、don细胞、ghk-21细胞、瓜氨酸血症细胞、登普西(dempsey)细胞、底特律(detroit)551细胞、底特律510细胞、底特律525细胞、底特律529细胞、底特律532细胞、底特律539细胞、底特律548细胞、底特律573细胞、hel299细胞、imr-90细胞、mrc-5细胞、wi-38细胞、wi-26细胞、micl1细胞、cv-1细胞、cos-1细胞、cos-3细胞、cos-7细胞、vero细胞、dbs-frhl-2细胞、balb/3t3细胞、f9细胞、sv-t2细胞、m-msv-balb/3t3细胞、k-balb细胞、blo-11细胞、nor-10细胞、c3h/ioti/2细胞、hsdm1c3细胞、kln2o5细胞、mccoy细胞、小鼠l细胞、细胞株2071(小鼠l)细胞、l-m细胞株(小鼠l)细胞、l-mtk-(小鼠l)细胞、nctc克隆2472和2555、scc-psa1细胞、瑞士/3t3细胞、印度麂细胞、sirc细胞、cii细胞和jensen细胞、sp2/0、ns0、ns1细胞或其衍生物以及ipsc细胞。本公开进一步提供了可以表达以下的所述细胞:重组产物、蛋白质或重组蛋白、融合产物或蛋白、抗体或抗体片段、融合抗体或经过修饰的抗体、病毒或病毒产物或组分、病毒样颗粒(vlp)、细胞、核酸、脂质、激素、类固醇或糖蛋白。本公开进一步提供了用于在根据权利要求13到18制备的液体培养基中制备生物产物的方法,其中所述生物产物为重组产物、蛋白质或重组蛋白、融合产物或蛋白、抗体或抗体片段、融合抗体或经过修饰的抗体、病毒或病毒产物或组分、病毒样颗粒(vlp)、细胞、核酸、脂质、激素、类固醇或糖蛋白。本公开提供了一种液体细胞培养基,其与使用另一方法制备的液体培养基相比,包括减少的金属污染物和/或显示减少的金属的批次间变化,在所述另一方法中,使用了酸和/或碱添加以使其组分溶解。本公开还提供了一种根据上文描述的方法(精简型方法)制备的液体细胞培养基,其中与通过任何其它方法,例如,制备液体培养基的浓缩方法制备的液体培养基相比,所述液体培养基的污染物金属较少。本公开还提供了一种试剂盒或组合,所述试剂盒或组合包括:(i)根据权利要求1到12所述的方法制备的液体细胞培养基;(ii)细胞;以及任选地(iii)细胞培养补充剂或添加剂。具体实施方式1.细胞培养基细胞培养基由多种成分构成并且这些成分在培养基之间有所不同。细胞培养基可以是完整的调配物,即,不需要对培养细胞进行补充的细胞培养基;或者可以是不完整的调配物,即,细胞培养基可能需要补充或可以用作用于补充不完整调配物的补充剂;或在完整调配物的情况下,可以改进细胞培养性能或培养结果(效价)。通常,细胞培养基可以具有在溶剂中溶解的溶质。溶质提供渗透力,以平衡跨细胞壁(或壁)的渗透压力。另外,溶质可以为细胞提供营养物。一些营养物可以是用于细胞运作的化学燃料;一些营养物可以是细胞在合成代谢中使用的原料;一些营养物可以是机械的,如促进细胞代谢的酶或载剂;一些营养物可以是结合并缓冲成分以供细胞使用或者结合或螯合有害细胞产物的结合剂。根据细胞和细胞的预期用途,可以在用于平衡/优化细胞培养性能的浓度下确定细胞培养基的成分。性能可以根据一个或多个所期望特性测定,例如,细胞数量、细胞质量、细胞密度、o2消耗、如葡萄糖或核苷酸等培养成分的消耗、生物分子的产生、生物分子的分泌、废弃产物或副产物(例如,代谢物)的形成、指示剂或信号分子上的活动等。成分中的每种成分或选择的成分因此可以由优选地被优化到工作浓度,用于预期用途。本发明的培养基或补料补充剂可以以干燥形式获得,所述干燥形式需要仅添加如水等溶剂。干燥形式包含但不限于干燥粉末形式(dpm)、附聚(agttm)形式、高级粉末培养基(apm)或其它适合的干燥形式,并且已经在其它专利中进行了描述。优选地,一旦添加了水,溶解应当快速发生并且所得液体可以过滤并直接添加到细胞中,无需任何ph调节。经过重构的培养基或经过浓缩的补充剂可以被制备成不同的体积,并且适合于灭菌,特别是通过电离或紫外线辐射。培养基(干燥和液体)通常包括以下:a.碳水化合物细胞培养基成分通常包含碳水化合物、氨基酸、盐、痕量元素和维生素。对于哺乳动物细胞,细胞培养基中使用的主要碳水化合物为葡萄糖,所述葡萄糖常规地以5nm到25nm补充。参见“药物疗法和基于细胞的疗法的细胞培养技术(cellculturetechnologyforpharmaceuticalandcell-basedtherapies)”,51(sadettinozturk和wei-shouhu编辑,泰勒弗朗西斯集团(taylorandfrancisgroup)2006)。除了葡萄糖外,还可使用如半乳糖、果糖或甘露糖等己糖或这些的组合。此外,哺乳动物细胞还可以使用谷氨酰胺作为主要能源。谷氨酰胺通常以比其它氨基酸(2-8mm)更高的浓度而被包含。然而,如上所述,谷氨酰胺可以自发地分解以形成氨,并且某些细胞系更快速地产生氨,这是有毒的。因此,已将谷氨酸和谷氨酰胺二肽用作谷氨酰胺的替代物,以减少有毒氨在细胞培养基中的积聚。b.氨基酸氨基酸在细胞培养基中对于维持所培养细胞的代谢功能是重要的。细胞培养基通常包含必须的氨基酸(即,通常不会通过哺乳动物在体内合成的那些氨基酸)以及某些不必须的氨基酸。如果细胞系不能合成氨基酸或如果细胞系不能产生充足量的氨基酸来支持最大生长,则细胞培养基中通常包含非必须氨基酸。示例性氨基酸包含l-丙氨酸、l-精氨酸、l-天冬酰胺、l-天冬氨酸、l-半胱氨酸、l-谷氨酸、l-谷氨酰胺、甘氨酸、l-组氨酸、l-异亮氨酸,l-亮氨酸、l-赖氨酸、l-甲硫氨酸、l-苯丙氨酸、l-脯氨酸、l-羟脯氨酸、l-丝氨酸、l-苏氨酸、l-色氨酸、l-酪氨酸和l-缬氨酸。本公开的方法涉及基于例如表1所显示的氨基酸的性质对其进行区分类。此分类是众所周知的。然而,本公开的目的在于以ph和浓度对氨基酸进行分组和匹配并对其添加进行匹配,以在不损害来自使用浓缩技术的先前使用的方法的细胞培养物生长和效价性能的情况下,减少或消除酸或碱的添加以获得所期望的ph。培养基浓缩技术已经在例如美国专利申请5474931中进行了描述,所述美国专利申请的公开内容在此通过引用并入。氨基酸的示例性分类在以下显示在表1中,其中基于氨基酸的酸性质、碱性质或中性性质对其进行了分组。在不添加如5474931中描述的并且如以下实例中显示的那样多的酸和/或碱的情况下,氨基酸组的效价以及在制备液体培养基的同时基于ph和浓度对组的匹配可以实现期望的ph。表1:性质氨基酸碱性arg、lys、his酸性asp、glu中性(非极性)ala、asn、gln、gly、ile、leu、met、phe、pro、val中性(微极性)cys、trp中性(极性)ser、thr、tyrc.盐将盐添加到细胞培养基中,以保持等压条件并防止渗透失衡。标准哺乳动物细胞培养基的同渗重摩为约300mosm/kg,但是许多细胞系可以耐受此值的大约10%的变化。一些昆虫细胞培养物的同渗重膜趋向于高于300mosm/kg,并且此同渗重膜可能比300mosm/kg高0.5%、1%、2到5%、5-10%、10-15%、15-20%、20-25%、25-30%。细胞培养基中最常用的盐包含na+、k+、mg2+、ca2+、cl-、so42-、po43-和hco3-(例如,cacl2、kcl、nacl、nahco3、na2hpo4)。因此,细胞培养基的用于培养特定细胞类型的期望的同渗重膜还可以通过本领域的普通技术人员使用本领域已知的方法凭经验确定。d.无机元素以痕量存在于血清中的其它无机元素可以包含在如us2005/0287666中描述的细胞培养基中,所述专利在此通过引用以其整体并入。所述其它无机元素包含mn、cu、zn、mo、va、se、fe、ca、mg、si和ni。已经添加到细胞培养基中但是并非那么频繁地添加的其它无机元素包含al、ag、ba、br、cd、co、cr、f、ge、j、rb和zr。这些元素中的许多元素涉及酶活性。所述元素可以以盐的形式提供,如cacl2、fe(n03)3、mgcl2、mgso4、mncl2、nacl、nahco3、na2hpo4、以及如硒、钒和锌等痕量元素的离子。这些痕量元素可以以各种形式提供,优选地以盐的形式提供,如na2seo3、nh4vo3等。这些无机盐和痕量元素可以例如从西格玛(sigma)公司(密苏里州圣路易斯)商购获得。e.维生素维生素通常被细胞用作辅因子。每个细胞系的维生素要求变化很大,但是如果细胞培养基含有少量血清或无血清或者如果细胞以高密度生长,则通常需要额外的维生素。示例性维生素包含生物素、氯化胆碱、叶酸、i-肌醇、烟酰胺、d-ca++-泛酸盐、吡哆醛、核黄素、硫胺素、吡哆醇、烟酰胺、a、b6、b12、c、d3、e、k和对氨基苯甲酸(paba)。f.任选地:血清或重组血清蛋白细胞培养基中可以使用血清,凝结血液的上清液,来提供促进细胞生长和/或生产率的组分。这些血清组分包含附着因子、微量营养素(例如,痕量元素)、生长因子(例如,激素、蛋白酶)和保护性元素(例如,抗毒素、抗氧化剂、抗蛋白酶)。血清可从各种动物来源获得,包含牛和马。当包含在细胞培养基中时,血清通常以5-10%的浓度添加。某些细胞培养基为不含血清的。g.生长因子为了促进在不存在血清的情况下或在血清减少的培养基中的细胞生长,可以向细胞培养基中添加以下多肽中的一种或多种:例如,成纤维细胞生长因子(fgf)(包含酸性fgf和碱性fgf)、胰岛素、胰岛素样生长因子(igf)、上皮生长因子(egf)、神经生长因子(ngf)、血小板-衍生生长因子(pdgf)和转化生长因子(tgf)(包含tgfα和tgfβ)、任何细胞因子(如白介素1、2、6)、粒细胞刺激因子、白细胞抑制因子(lif)等。在某些实施例中,细胞培养基不含有生长因子。在无蛋白质培养基中,可以用如wo98/08934中描述的锌或含锌化合物代替胰岛素,所述专利在此通过引用以其整体并入。h.脂质还可以向细胞培养基中添加一种或多种脂质。血清通常含有脂质,如脂肪酸(例如,亚油酸、亚麻酸、花生四烯酸、棕榈油酸、油酸、多烯酸和/或12个、14个、16个、18个、20个或24个碳原子的脂肪酸,每个碳原子为分支的或不分支的)、磷脂、卵磷脂(磷脂酰胆碱)和胆固醇。可替代地,这些脂质中的一种或多种脂质可以作为补充剂包含在无血清培养基中。磷脂酸和溶血磷脂酸刺激某些锚定依赖性细胞,如mdck、小鼠上皮细胞系和其它肾细胞系的生长,而磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰肌醇刺激人成纤维细胞在无血清培养基中的生长。乙醇胺和胆固醇也显示促进某些细胞系的生长。在某些实施例中,细胞培养基不含有脂质。i.任选地:载体蛋白还可以向细胞培养基中添加一种或多种载剂蛋白,如牛血清白蛋白(bsa)或转铁蛋白。载体蛋白可以帮助某些营养物或痕量元素的输送。bsa通常用做如亚油酸或油酸等脂质的载体,所述脂质可溶于水性溶液中。另外,bsa还可以充当某些金属的载体,如fe、cu和ni。在无蛋白质调配物中,可以将bsa的非动物衍生替代物,如环糊精,用作脂质载体。转铁蛋白涉及跨细胞膜输送铁。在某些情况下,人血清白蛋白对于细胞(对于,例如无异种蛋白(xf)培养物)的培养可能是需要的,所述细胞对于产生用于下游治疗用途的产物而言是期望的。在其它情况下,重组人血清白蛋白在细胞培养基中可以用于细胞的培养。在特定情况下,重组人血清白蛋白可以源自植物来源、海藻来源或真菌来源,如水稻、玉米、马铃薯、小麦、甚至酵母等,以提供对细胞的无动物源(aof)培养。在无蛋白质调配物中,转铁蛋白可以被如wo98/08934中描述的铁盐和/或亚铁盐代替(所述专利在此通过引用以其整体并入),或者如us2007/0254358中描述的羟基吡啶衍生物(所述专利通过引用整体以其整体并入)。另外,在无蛋白质调配物中,胰岛素可以由锌、钒或其它适合的二价盐替代。j.任选地:附着蛋白还可以向细胞培养基中添加一种或多多种附着蛋白,如纤连蛋白、层粘连蛋白和pronectin,以帮助促进锚定依赖性细胞到底物的附着。k.缓冲剂细胞培养基可以任选地包含一种或多种缓冲剂。适合的缓冲剂包含但不限于n-[2-羟基乙基]-哌嗪-n′-[2-乙磺酸](hepes)、mops、mes、磷酸盐、碳酸氢盐和其它适合用于细胞培养应用的缓冲剂。适合的缓冲剂是提供缓冲能力而对所培养的细胞无显著细胞毒性的缓冲剂。对适合的缓冲剂的选择处于细胞培养的本领域的普通技术人员的范围内。1.聚阴离子化合物或聚阳离子化合物聚阴离子化合物或聚阳离子化合物可以防止细胞结块并促进细胞在悬浮液中的生长。参见wo98/08934,其在此通过引用以其整体并入。示例性聚阴离子化合物包含多磺酸化合物化或多硫酸化化合物,如肝素、硫酸葡聚糖、硫酸乙酰肝素、硫酸皮肤素、硫酸软骨素、多硫酸戊聚糖、蛋白多糖等。另外,细胞培养基可以包括本文描述的一种或多种成分。在一个实施例中,细胞培养基可以任选地包括以下成分中的一种或多种成分:乙醇胺、d-葡萄糖、hepes、胰岛素、细胞因子(例如,il-6)、肝素、硫酸葡萄糖、亚油酸、硫辛酸、酚红、腐胺、丙酮酸钠、转铁蛋白、l-丙氨酸、l-精氨酸、l-天冬酰胺、l-天冬氨酸、l-半胱氨酸、l-谷氨酸、l-谷氨酰胺、甘氨酸、l-组氨酸、l-异亮氨酸、l-亮氨酸、l-赖氨酸、l-甲硫氨酸、l-苯丙氨酸、l-脯氨酸、l-丝氨酸、l-苏氨酸、l-色氨酸、l-酪氨酸、l-缬氨酸、生物素、氯化胆碱、d-ca++-泛酸、叶酸、i-肌醇、烟酰胺、吡哆醇、核黄素、硫胺、维生素b12、一种或多种钙盐、fe(no3)3、kcl、一种或多种镁盐、一种或多种锰盐、nacl、nahco3、na2hpo4、一种或多种硒盐、一种或多种钒盐和一种或多种锌盐。所描述的液体培养基可以为1x调配物或者在单个组分的溶解度允许时可以被浓缩为大于1x调配物的任何物品,例如,浓缩为2x、5x、10x、20x、50x、500x或1000x培养基调配物。如果通过浓缩方法将培养基成分制备为浓缩储备溶液,则将适当(充足)量的每种浓缩储备物与稀释液组合以产生1x培养基调配物。通常,所使用的稀释液为水但是可以使用其它溶液,包含水性缓冲液、水性盐溶液或其它水性溶液。1x溶液通过精简型方法直接制备,并且在下文和实例中进行了进一步描述。在精简型方法中不需要制备浓缩储备溶液。用于制备液体培养基的方法传统浓缩方法可以使用如美国专利第5,474,931号中所描述的“浓缩”技术制备液体1x。在“此”浓缩方法中,可以制备组分或成分(如表2-5中所见),并将其储存在溶液中。优选地,在浓缩溶液中对成分进行分组并储存。例如,分组可以为图1中所显示的氨基酸成分的组。表2的成分的示例性分组可以为:i)一组中的酸可溶性氨基酸,ii)基于其反应性、浓度和相容性一起分组的某种维生素和盐;iii)根据其可溶性性质分组的痕量金属;iv)基于其反应性、浓度和相容性一起分组的普朗尼克、葡萄糖、缓冲液、其它维生素和盐。所分组成分的储备溶液可以被制备为浓缩储备物。例如,可能的是制备10x到100x化学储备溶液,所述化学原料溶液可以作为液体储存或以适当的等分式样大小冷冻,以供以后使用。储备溶液提供了多个优点。例如,在1x培养基中可以使用较高最终浓度的给定成分。另外,当储存于浓缩储备溶液中时,一些成分更稳定。此外,相比于对于1x培养基而言所需的,对于浓缩储备溶液而言需要更少的储存量。参见美国专利第5,474,931号。对于关于如何使用“浓缩”方法制备储备溶液的示例性方法或者对于酸可溶物i、酸可溶物ii、盐i、盐i的示例性分组,参见美国专利第8,198,084号(第25、26、27、28-29列并且美国专利第8,198,084的表2在此通过引用以其整体并入)。精简型方法另一方面,使用“精简型”方法制备的液体进行如下:i)分组:按照类型、ph、浓度和可溶性对组分进行分组,例如将如arg&lys等碱性氨基酸一起分组;或者根据ph用酸性组、碱性组和中性组并且按照基于理论可溶性、ph和台上测试而优化的添加的顺序将氨基酸分组成多个子组。将氨基酸添加到调配罐的示例性顺序将如下:1)酸性,2)碱性以及3)中性;ii)根据调配物中的组分转化氨基酸的游离碱形式或盐形式,以针对特定ph;和/或将酪氨酸和胱氨酸从游离碱形式转化为二钠盐形式,,这视调配而定;和/或将磷酸盐形式从磷酸氢二钠转化为单碱形式和双碱形式的组合,以实现所需的最终目标ph;iii)减少酸和/或碱的添加:来自原材料的不一致的痕量金属污染物的最大来源来自于酸和碱,例如,用于调节ph并且用于溶解组分的5nhcl和naoh、12nhcl等。由于提议的精简型工艺限制,并且在许多情况下消除了大量添加酸和碱的需要,因此批次间变化由于酸和碱中金属元素浓度的贡献减少了(参见图3);iv)制备较少的侧溶液(sidesolution):精简型方法的一部分是最小化溶液(或储备溶液,也被称为侧溶液)和预先溶解步骤的数量。因此,与在“浓缩技术”中制备储备溶液不同,可以直接使用干/湿组分并不将其“制备为溶液”。因此,在精简型方法中,相反地将大量存在的组分,如被制备成溶液的酸可溶物分组i&ii、盐i&ii以其天然形式直接添加(也就是说,如果原材料为干粉末,则将干粉末直接添加到调配制备罐中,或者如果原材料为液体,则直接添加液体)到调配罐中。v)汇集痕量溶液:传统地在“浓缩”方法中-将多种痕量元素溶液制备为储备溶液。相反地,在精简型方法中,将多种痕量元素溶液一起组合成一种完整的“痕量元素溶液”,产生一次主要罐添加而非高达八次添加。通常,在添加低浓度更敏感的组分之前,首先添加如氨基酸和盐等高浓度组分。用于添加组分的一般顺序可以如图1:右边的“精简型液体表”所显示的,其中在一个实施例中,按所显示的表的从上到下的顺序添加成分。因此,通过精简型方法制备液体:(a)使组分溶解所需要的酸和/或碱添加较少;和/或(b)来自酸和/或碱添加的金属污染物减少;和/或(c)金属的批次间变化较少,(d)与通过所述浓缩方法制备的液体培养基相比,因为需要制备较少的(侧)溶液并且由于组分的经过优化的分组,所以需要较少的调配时间。需要更多时间完全溶解具有浓缩方法的宽范围的ph和溶解度的组分。通常,由于添加了酸和/或碱以用于组分溶解,因此至少在金属离子浓度中存在批次间变化。由于添加酸和碱的量的减少并且由于精简型方法在方案中完全消除了12n浓酸,因此精简型的酸/碱添加的倍数减少为约1-10倍、1-20倍、1-30倍或1-40倍,这取决于调配。在一个实施例中,酸/碱量的减少为约22倍。金属的批次间变化可以通过各种分析方法测量,包含但不限于icp-ms、ms/ms等。可以使用适合的分析方法对总金属离子浓度或具体金属离子浓度进行测量并且对批次之间的金属离子差异进行比较。在某个实施例中,精简型方法中的总金属浓度的批次间变化减少了高达10%。在其它实施例中,总金属批次间变化减少了:约0.001%、约0.01%、约0.1%、约1%、约1-2%、约1-3%、约1-4%、约1-5%、约1-6%、约1-10%、约1-20%、约1-30%、约1-40%、约1-50%、约1-60%、约1-70%、约1-80%或约1-90%。在其它实施例中,可以测量各个液体批次之间的单个金属浓度。所测量的金属选自由以下组成的组:cr、fe、mg、cu、mn、ni、zn、mo、al和ca。精简型培养基的批次之间的任何金属的减少如下:小于约0.001%、小于约0.01%、小于约0.1%、小于约1%、小于约2%、小于约3%、小于约4%、小于约5%、小于约6%、小于约10%、小于约15%、小于约20%、小于约30%、小于约40%、小于约50%、小于约0.001-1%、小于约0.001-5%、小于约0.001-10%、小于约1-10%、小于约10-20%、小于约20-30%、小于约30-40%、小于约40-50%、小于约50-100%、小于约50-90%、小于约50-80%、小于约50-70%、小于约50-60%。一种或多种污染金属的减少可以与通过任何其它方法,例如,制备液体培养基的浓缩方法制备的液体培养基进行比较。在某个实施例中,减少为约0.0001%到100%。或者与通过任何其它方法,例如,浓缩方法制备的液体培养基相比,在通过精简型方法制备的所得液体中,一种或多种污染物金属的减少为约0.0001%到0.001%、约0.0001%到0.01%、约0.0001%到0.1%、约0.0001%到1%、约0.0001%到2%、约0.0001%到3%、约0.0001%到4%、约0.0001%到5%、约0.0001%到10%、约1%-5%、约1%-10%、约1%-15%、约1%-20%、约1%-25%、约1%-35%、约10-20%、约10-30%、约10-40%、约10-50%、约10-60%、约10-70%、约10-80%、约10-90%、约10-100%。在某些实施例中,与通过任何其它方法,例如,浓缩方法制备的液体培养基相比,单个金属污染%减少如下:cr减少约40-100%;fe减少约0.01-20%;cu减少约0.1-15%;mn减少约0.25-60%;ni减少约5-100%;zn减少约5%;并且mo减少约15%。通过精简型方法制备的液体培养基可以是无血清的或无蛋白质的或两者、低血清的、低蛋白质的或其组合。所述液体培养基可以用于培养细胞。2.无血清培养基与血清相关联的潜在问题,包含批次间变化、高蛋白含量、污染物(例如,病毒、支原菌、朊病毒)风险、有限可用性和高成本驱使无血清培养基的产生。此外,相对于在生长于用血清补充的培养基中的细胞中看到的表达的水平,重组蛋白质表达的水平提高可以从生长于无血清培养基中的细胞中获得(battista,p.j.等人,美国生物技术实验室(am.biotechlab.)12:64-68(1994))。在这些无血清培养基中,可以用所限定的激素或激素混合物(如hites或ites)替代血清,所述激素或激素混合物含有氢化可的松、胰岛素、转铁蛋白、乙醇胺和亚硒酸盐。可替代地,无血清培养基可以含有来自内分泌腺的生长因子提取物,如表皮生长因子或成纤维细胞生长因子。无血清培养基还可以含有其它组分作为血清的替代品,包含经过纯化的蛋白质(动物或重组)、蛋白胨、氨基酸、无机盐和动物或植物水解产物(或其级分)。无血清培养基可以是化学限定的或未化学限定的。在化学限定的培养基中,组分的标识和其量是已知的,然而对于未化学限定的培养基,正好相反。因此,对化学限定的培养基部分地进行了设计,以减少污染物的风险并减少批次间变化。可以向细胞培养基中添加的化学限定的补充剂包含生长因子、激素、载体蛋白和/或附着因子。在优选实施例中,与包括小肽的培养基或补料一起使用的基础培养基为化学限定的培养基。在另一优选实施例中,本发明的包括小肽的浓缩细胞培养基或浓缩补料也是化学限定的组合物。在又另一优选实施例中,本发明的包括包含半胱氨酸和酪氨酸的小肽的浓缩补料或培养基是单部分补料并且是化学限定的。在另一方面,包括包含半胱氨酸和酪氨酸的小肽的所有上述组合物是自动ph和自动同渗重摩平衡的。在又另一方面,包括包含半胱氨酸和酪氨酸的小肽的所有上述组合物是化学计量平衡的。3.无蛋白质培养基与含有血清的细胞培养基相比,无血清培养基含有减少量的蛋白质。然而,无血清培养基可以仍含有各种动物衍生的组分中的一种或多种,包含白蛋白、胎球蛋白、各种激素和其它蛋白质。蛋白质的存在使重组蛋白质的纯化变得困难、耗时且昂贵,并且还可能导致产物产率和/或纯度降低。因此,在一个实施例中,细胞培养基是无蛋白质的。无蛋白质培养基可以通过本领域已知的方法获得,如通过从无血清培养基中除去任何剩余蛋白质。尽管从细胞培养基中除去此类蛋白质可能损害培养基的支持细胞生长的能力,但是还可以向培养基中添加其它组分,以消除从培养基中除去蛋白质的影响。例如,如上文所讨论的,环糊精可以替代bsa并且铁盐或羟基吡啶衍生物可以替代转铁蛋白。在其它情况下,已将动物组织或植物水解产物(或其级分)用于补充无蛋白质培养基。4.补料分批培养(fed-batchcultivation)细胞的补料分批培养通常用于如蛋白质等生物分子的工业生产,以增加细胞浓度并延长培养物寿命,以实现高产物浓度和体积生产率。补料分批培养涉及以可以含有被细胞快速利用的营养物(如葡萄糖、氨基酸)的补料形式,向基础培养基控制性添加一种或多种营养物。一种或多种营养物通过尝试防止营养物耗尽和副产物累积帮助将细胞培养物的生长、如ph、同渗重膜和co2浓度等重要参数控制在促进细胞生长或使细胞死亡最小化的水平内,以实现最优产物表达。参见“药物疗法和基于细胞的疗法的细胞培养技术”,349-386(sadettinozturk和wei-shouhu编辑,泰勒弗朗西斯集团,2006)。即使如此,补料分批培养通常产生高浓度的抑制性代谢物和高同渗重膜,所述抑制性代谢物和高同渗重膜最终与细胞活力不相容。在补料分批培养中,通常使用基础培养基以分批模式使细胞生长到某个时间点。随后,添加包括含单种营养物或多种营养物的浓缩溶液的培养基补充剂(浓缩补料)以提供营养物,同时最小化体积增加或培养物稀释。在将培养基补充剂添加到基础培养基中时,其如所展示的例如通过更快速的细胞生长、降低的倍增时间、更高的可实现细胞密度或更高的生物分子(如蛋白质,例如抗体或其它治疗相关的蛋白质)的生产或产率提高细胞培养。5.基础培养基基础培养基通常用于维持细胞培养并且可以包括多种成分,包含氨基酸、维生素、有机盐和无机盐、糖和其它组分,每种成分以支持细胞体外培养的量存在。可用于原核细胞培养的基础培养基可以与小肽一起使用,所述原核细胞培养包含细菌培养和古细菌培养、病毒培养、植物细胞培养、昆虫细胞培养、哺乳动物细胞培养。基础培养基的实例包含伊格尔氏(eagle’s)基础培养基(bme)、伊格尔氏最小必需培养基(emem)、达尔伯克氏(dulbecco’s)改良伊格尔氏培养基(dmem)、glasgow’s改良伊格尔氏培养基(gmem)、joklik’s改良版伊格尔氏培养基、α改良版伊格尔氏培养基、洛斯维·帕克纪念研究所(roswellparkmemorialinstitute)(rpmi)培养基、fischer’s培养基、leibovitzl-15培养基、trowell’st-8培养基、williams’培养基e、biggers’培养基、康诺特医学研究实验室(connaughtmedicalresearchlaboratories)(cmrl)1066培养基、ham’sf10培养基、ham’sf12培养基、iscove’s改良版达尔伯克氏培养基(imdm)、mcdb104、mcdb110、mcdb153、培养基199、nctc135培养基和waymouth’s培养基mb752/1。对于cho细胞,优选基础培养基包含cdchotm培养基、cdoptichotm培养基和dynamistm培养基(所有均来自加利福尼亚州卡尔斯巴德生命技术公司)。cho细胞的优选浓缩补料补充剂包含但不限于efficientfeed(五)a+agt(五)(英杰公司(invitrogen)目录号:a25023)、efficientfeed(五)b+agt(五)(英杰公司目录号:a25030)、feed(五)试剂盒a+、b+、c+(英杰公司目录号:a3315801)、efficientfeed(五)c+agt(五)(英杰公司目录号:a25031,加利福尼亚州卡尔斯巴德生命技术公司)。6.细胞本公开涉及用于在根据精简型方法制备的液体培养基中培养细胞的方法,其中所述细胞包含原代上皮细胞(例如,角质形成细胞、宫颈上皮细胞、支气管上皮细胞、气管上皮细胞、肾上皮细胞和视网膜上皮细胞)以及已确立的细胞系和其细胞株(例如,cho细胞、293胚肾细胞、bhk细胞、用于疫苗产生的包含mrc-5、2bs和其它的二倍体细胞、杂交瘤、hela宫颈上皮细胞和per-c6视网膜细胞、mdbk(nbl-1)细胞、911细胞、crfk细胞、mdck细胞、bewo细胞、张氏(chang)细胞、底特律562细胞、hela229细胞、helas3细胞、hep-2细胞、kb细胞、ls180细胞、ls174t细胞、nci-h-548细胞、rpmi2650细胞、sw-13细胞、t24细胞、wi-28va13、2ra细胞、wish细胞、bs-c-i细胞、llc-mk2细胞、克隆m-3细胞、1-10细胞、rag细胞、tcmk-1细胞、y-1细胞、llc-pk1细胞、pk(15)细胞、gh1细胞、gh3细胞、l2细胞、llc-rc256细胞、mh1c1细胞、xc细胞、mdok细胞、vsw细胞和th-i、b1细胞或其衍生物)、来自任何组织或器官(包含但不限于心、肝、肾、结肠、肠、食道、胃、神经组织(脑、脊髓)、肺、血管组织(动脉、静脉、毛细)、淋巴组织(淋巴腺、腺样、扁桃体、骨髓和血液)、脾)的成纤维细胞、以及成纤维细胞系和成纤维样细胞系(例如,cho细胞、trg-2细胞、imr-33细胞、don细胞、ghk-21细胞、瓜氨酸血症细胞、登普西细胞、底特律551细胞、底特律510细胞、底特律525细胞、底特律529细胞、底特律532细胞、底特律539细胞、底特律548细胞、底特律573细胞、hel299细胞、imr-90细胞、mrc-5细胞、wi-38细胞、wi-26细胞、micl1细胞、cv-1细胞、cos-1细胞、cos-3细胞、cos-7细胞、vero细胞、dbs-frhl-2细胞、balb/3t3细胞、f9细胞、sv-t2细胞、m-msv-balb/3t3细胞、k-balb细胞、blo-11细胞、nor-10细胞、c3h/ioti/2细胞、hsdm1c3细胞、kln2o5细胞、mccoy细胞、小鼠l细胞、细胞株2071(小鼠l)细胞、l-m细胞株(小鼠l)细胞、l-mtk-(小鼠l)细胞、nctc克隆2472和2555、scc-psa1细胞、swiss/3t3细胞、印度麂细胞、sirc细胞、cii细胞和jensen细胞、sp2/0、ns0、ns1细胞或其衍生物)、干细胞、ipsc细胞等。上述细胞中的任何细胞可以被工程化以表达:重组产物、蛋白质或重组蛋白质、融合产物或蛋白质、抗体或抗体片段、融合抗体或经过修饰的抗体、病毒或病毒产物或组分、病毒样颗粒(vlp)、细胞、核酸、脂质、激素、类固醇或糖蛋白。因此,本公开还涉及用于在根据精简型方法制备的液体培养基中制备生物产物的方法,其中所述生物产物为重组产物、蛋白质或重组蛋白质、融合产物或蛋白质、抗体或抗体片段、融合抗体或经过修饰的抗体、病毒或病毒产物或组分、病毒样颗粒(vlp)、细胞、核酸、脂质、激素、类固醇或糖蛋白。实例1:利用最少添加酸/碱制备液体培养基目前常见的液体制造工艺利用大量酸和碱使如氨基酸等组分的分类组溶解。此工艺具有几个缺点。过量酸和碱使用与由于金属污染物和对培养基组分的潜在改良或破坏引起的批次间变化相关联。生物生产产业已经表示出对在细胞培养基中缺乏金属浓度的一致性和对金属浓度的控制以及由于金属引起的潜在细胞毒性的担忧。另外,监管机构要求产物中具有较低水平的重金属,以便于更好地处理并解决环境问题。为了减少此变化,开发了一种新颖制造方法,其依赖于组分(例如,氨基酸)的分组、优化组分形式以及优化添加顺序,以显著降低先前用于使培养基成分溶解的酸和碱的量。在一个实例中,基于1)ph,2)浓度和3)组分敏感度或反应性通过并入最可溶形式的组分并且通过优化组分的分组和添加的顺序对用于培养基cdchotm(来自加利福尼亚州卡尔斯巴德生命技术公司,参见以下表2)的液体制造工艺进行改良。新工艺引起了5n酸和碱的使用的22倍减少以及完全消除了12n浓酸。此方法展示了与酸/碱相关联的污染物金属的减少,其中最终调配物中铬减少了3倍并且镍减少了2倍。新方法还使制造工艺精简型化并且通过减少侧溶液的数量、ph调节和调配工艺时间简化了所述制造工艺,这引起显著的制造成本减少以及安全性提高。尤其是,利用cdchotm,侧溶液的数量减少了27%并且酸/碱添加的数量和ph调节减少了33%;这总体上引起调配时间减少了43%。此方法还实现了批次间金属离子浓度的更高的一致性,这可能有助于性能的更少变化。事实上,观察到通过精简型方法制备的cdchotm的改进的性能优于通过浓缩技术制备的cdchotm培养基,如图6中可以看到的。方法初始地,针对最佳溶解度以期望的ph对组分进行评估。然后将组分分组成组分类别,例如,氨基酸、维生素、盐、糖、痕量金属、缓冲液;以及包括敏感组分或反应组分的组。敏感组或反应组包含这些组分但不限于仅这些组分,即:多胺、反应性氯化镁、氯化胆碱、吸湿性葡萄糖和普朗尼克。这些组分中的一些组分可能展示出由于长的混合时间引起的差的溶解度或ph漂移。针对可称量性以最终g/l浓度(当前为1mg/l)对组分进行评估。阈值以下的组分需要新近制备的浓缩侧溶液。基于默克索引(merckindex)或基于文献中已知的共同知识针对溶解度上限对组分进行评估,或者使用本领域中常规的方法对组分进行内部标准化。高于限制的组分在主罐添加之前需要用最少的酸或碱溶解。需要单独新近制备需要化学反应的组分(例如,铁螯合物),以管理反应需要(例如,管理ph、工艺、时间线)。对组分的每个组重新检查以确定最优ph分组,并且将具有类似ph的组分分离到酸性子组、碱性子组和中性子组。这对于氨基酸来说尤为关键。氨基酸的示例性分类被显示在表2中。在制备最终调配物之前,高度推荐分组的台上确认。将组分添加到最终调配物罐的顺序基于:1)ph和2)浓度和3)组分敏感度或反应性。这些都是用以20升的最小规模运行的台上试验标准化的/确认的,另外的测试为100升。实例1中的cd培养基组分被显示在表2中:表2:cd培养基组分在过滤灭菌之前,如图1所指示的将铁螯合物化合物添加到1×培养基中。用于使用精简型方法制备液体培养基的示例性方法:如以上表2和以下表3-5中显示的任何示例性液体条调配物可以用于精简型方法。1)根据调配物中的组分修饰并转化氨基酸的游离碱形式/盐形式,以针对特定ph。2)根据ph用酸性分组、碱性分组和中性分组以基于理论溶解度、ph和台上测试所优化的添加的顺序将氨基酸组修饰成多个子组。将氨基组添加到调配罐的示例性顺序被确定为:1)酸性,2)碱性以及3)中性。3)将等摩尔的磷酸盐形式从所有磷酸氢二钠修饰并转化为单碱形式和双碱形式的组合,以实现所需的最终目标ph。4)任选地,将等摩尔的精胺形式转化为精胺盐酸盐。5)除去不需要的侧溶液并并入作为主调配物罐直接添加物(意指,与溶液相反,以其天然形式直接添加组分)。6)利用产生并且添加一种完整的痕量元素融合(组合痕量元素溶液)将当前多种痕量元素测溶液添加修饰成主调配罐。7)将叶酸(高于溶液度限制)的溶解工艺从新近制备的ph溶液修饰成最小氢氧化钠溶解的侧溶液。8)基于铁和edta浓度并入目标酸添加的新的新近制备的铁螯合溶液最佳实践。9)修饰维生素组以将氯化胆碱(吸湿性)移除到单独组中。10)将葡萄糖修饰成其自身的新组(潜在反应性且最频繁的自定义修改)。11)以大约85%的最终理论氯化钠产生较高浓度盐组。(先前仅为同渗重摩调节添加)。12)产生约7.5%普朗尼克侧溶液,以使罐中的泡沫形成最小化并将减少用于溶解的混合时间。(先前为在末端处直接添加)。可以根据上文描述的方法将下文中的以下表3-5中所列的成分一起掺和,以形成通过精简型方法制备的完整液体培养基。这些完整培养基适合用于各种哺乳动物细胞,例如,293细胞的培养。293细胞也被称为hek293细胞。基于表3-5中呈现的信息以及本领域的普通技术人员具有的知识,可以在没有过度实验的情况下获得操作性精简型液体培养基调配物。表3:完整培养基成分的优选范围***添加以调节同渗浓摩。调配物之间数量将发生些许变化。添加nacl以将osmo从约160调节到275+/-5mosmo内的值。表4:示例性培养基***添加以调节同渗浓摩。调配物之间数量将发生些许变化。添加nacl以将osmo从约160调节到275+/-5mosmo内的值。表5:良好定义的培养基***添加以调节同渗浓摩。调配物之间数量将发生些许变化。添加nacl以将osmo从约160调节到275+/-5mosmo内的值。虽然已经结合其具体描述对本发明进行了描述,但前面的描述旨在说明而非限制本发明的范围,本发明的范围由所附权利要求书的范围限定。其它方面、优点以及修改都处于以下权利要求的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1