聚苯撑化合物的制作方法
本发明涉及聚苯撑(polyphenylene)化合物和使用其的燃料电池。
背景技术:
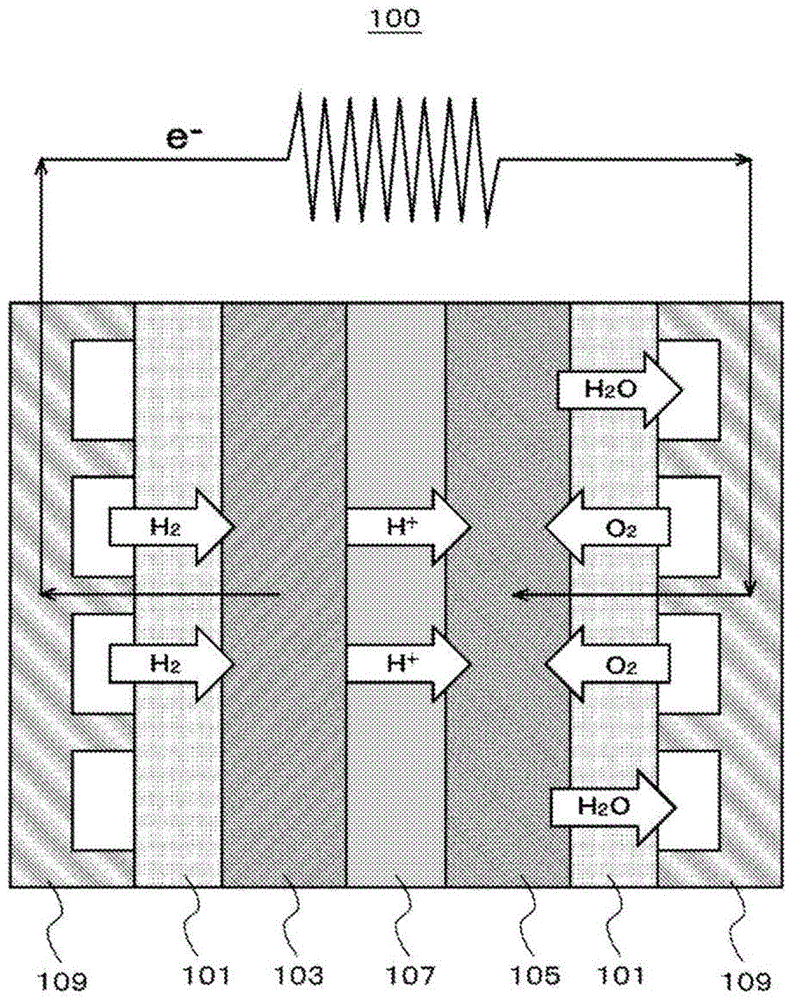
:固体高分子燃料电池(pefc)具有阳极催化剂层、阴极催化剂层和被两催化剂层夹持的固体电解质膜。固体电解质膜中所使用的电解质要求具有质子传导性、气体阻隔性、电子绝缘性和耐久性。作为满足这样的特性的电解质,可使用氟系离聚物。然而,氟系离聚物成本高且也有环境负荷,因此研究了替代材料。另一方面,阳极催化剂层和阴极催化剂层中也含有电解质。作为该电解质,有时使用与固体电解质膜相同的材料,但催化剂层的电解质除了质子传导性以外,还要求具有透气性,并且要求具有电子传导性。专利文献1和专利文献2中公开了,将骨架中具有芳香族,且在骨架中导入了磺基的烃离聚物作为氟系离聚物的替代材料用于固体电解质膜和催化剂层的电解质。现有技术文献专利文献专利文献1:美国专利公报7301002号专利文献2:日本特开2015-95424号公报技术实现要素:发明所要解决的课题如上述所示,催化剂层的电解质要求具有质子传导性、透气性、耐久性和电子传导性,从该观点出发,专利文献1和2公开的材料需要进一步改善。本发明的目的在于,提供一种质子传导性优异、能适宜用于固体高分子燃料电池的无卤化合物。用于解决课题的技术方案本发明例如具有以下结构。[1]一种具有下述通式(i)表示的结构的化合物。【化1】(上述通式(i)中,l、n为使l+n=1.0时的摩尔分率,0≤l<1.0,0<n≤1.0,a为下述通式(ii)或(iii)表示的结构,b为下述通式(vii)表示的结构,各结构单元无规共聚,且式(i)中的至少一个苯环具有至少一个磺基。)【化2】【化3】(上述通式(ii)或(iii)中,r1~r4各自独立选自氢和碳原子数1~3的烷基;或者r1与r2一起形成芳香环或稠合芳香环,且r3与r4一起形成芳香环或稠合芳香环;或者r1、r3、r4为氢,且r2为单键且与c位的碳键合,x为单键、或者下述式(iv)、下述式(v)或下述式(vi)表示的结构,当x为单键时,键a相对于与x键合的碳均键合于邻位、或均键合于间位;当x为下述式(iv)表示的结构时,键a相对于与x键合的碳均键合于对位;当为下述式(v)表示的结构时,键a相对于与x键合的碳均键合于对位、或均键合于间位,当x为下述式(vi)表示的结构时,上述通式(ii)或(iii)中的键a仅为一个,a通过一个键a和键b与其他结构或结构单元键合。)【化4】【化5】[2]在[1]的化合物中,上述通式(i)中,a表示的结构为选自以下结构中的至少1种,【化6】[3][1]或[2]的化合物,其中,上述化合物用于燃料电池的。[4][3]的化合物,其中,上述化合物被用作燃料电池的阳极催化剂层和/或阴极催化剂层的电解质。[5]一种燃料电池的催化剂层,其包含[1]~[4]中的任意一种化合物。[6][1]的化合物的制造方法,其包括:工序1,其中,使下述式(viii)表示的化合物、下述式(ix)表示的化合物和任选的下述式(x)表示的化合物反应,得到下述式(xi)表示的化合物,【化7】(上述通式(ix)和(xi)中,l、n、a和b与式(i)同义,但各苯环不具有磺基);工序2,其中,将上述式(xi)表示的化合物磺化,得到上述式(i)表示的化合物。[7][1]的化合物的制造方法,其包括以下工序:使在下述式(viii)化合物中具有至少1个成为胺盐的磺基的化合物、下述式(ix)表示的化合物和任选的下述式(x)表示的化合物反应,得到上述式(i)表示的化合物。【化8】(上述通式(ix)中,a与式(i)同义。)发明效果本发明的化合物在用于固体高分子燃料电池的催化剂层时,发挥优异的质子传导性。附图说明图1是表示实施方式中的燃料电池的结构的示意图。具体实施方式本发明涉及具有下述通式(i)表示的结构的化合物。【化9】(上述通式(i)中,l、n为使l+n=1.0时的摩尔分率,0≤l<1.0、0<n≤1.0,a为下述通式(ii)或(iii)表示的结构,b为下述通式(vii)表示的结构,各结构单元无规共聚,且式(i)中的至少一个苯环具有至少一个磺基。)【化10】【化11】(上述通式(ii)或(iii)中,r1~r4各自独立选自氢和碳原子数1~3的烷基;或者r1与r2一起形成芳香环或稠合芳香环,且r3与r4一起形成芳香环或稠合芳香环;或者r1、r3、r4为氢,且r2为单键且与c位的碳键合,x为单键、或者下述式(iv)、下述式(v)或下述式(vi)表示的结构,当x为单键时,键a相对与x键合的碳均键合于邻位、或均键合于间位;当x为下述式(iv)表示的结构时,键a相对于与x键合的碳均键合于对位;当为下述式(v)表示的结构时,键a相对于与x键合的碳均键合于对位、或均键合于间位,当x为下述式(vi)表示的结构时,上述通式(ii)或(iii)中的键a仅为一个,a通过一个键a和键b与其他结构或结构单元键合。)【化12】【化13】作为r1~r4的选项即碳原子数1~3的烷基,可列举甲基、乙基、正丙基、异丙基。其中,优选甲基。采用这样的结构,是因为考虑到:在因为是聚苯撑结构而体积大的基础上,a优选相对于主链扭转键合,由此,透气性优异;并且,通过具有磺基,质子传导性优异;进而,通过具有任选的苯撑结构,能够发挥柔软性。作为a,可例示以下结构。通式(ii)或(iii)中,r1~r4,各自独立为选自氢或碳原子数1~3的烷基;x为单键;键a相对于与x键合的碳均键合于邻位,或均键合于间位。作为示例,可举出:【化14】上述通式(ii)或(iii)中,r1~r4各自独立为氢或碳原子数1~3的烷基;x由式(iv)表示;键a相对于与x键合的碳均键合于对位。作为示例,可举出:【化15】上述通式(ii)中,r1与r2一起形成芳香环或稠合芳香环,且r3与r4一起形成芳香环或稠合芳香环;x为单键;键a相对于与x键合的碳均键合于邻位、或均键合于间位。作为示例,可举出:【化16】上述通式(iii)中,r1与r2一起形成芳香环或稠合芳香环,且r3与r4一起形成芳香环或稠合芳香环;x为单键;键a相对于与x键合的碳均键合于邻位。作为示例,可举出:【化17】上述通式(ii)或(iii)中,r1~r4各自独立为氢或碳原子数1~3的烷基;x由式(v)表示;键a相对于与x键合的碳均键合于对位。作为示例,可举出:【化18】上述通式(ii)中,r1、r3、r4为氢,且r2为单键且与c位的碳键合;x由式(v)表示;键a相对于与x键合的碳均键合于间位。作为示例,可举出:【化19】上述通式(ii)中,r1、r3、r4为氢,且r2为单键且与c位的碳键合;x由式(vi)表示;式(ii)中的键a仅为一个;a通过一个键a和键b与其他结构或结构单元键合。作为示例,可举出:【化20】其中,从质子传导率和透气性的观点出发,式(i)中的a优选为选自以下结构中的至少1种,【化21】其中,更优选为选自以下结构中的至少1种结构,【化22】进一步优选为以下结构。【化23】作为b,可例示以下结构。【化24】式(i)表示的化合物中,从透气性和柔软性的观点出发,各结构单元的含有比例,以使l+n=1.0时的摩尔分率计,为0≤l<1.0、0<n≤1.0。此外,摩尔分率为l和n的各结构单元无规共聚。具体而言,由后述的制造方法可知,a与b不邻接。式(i)表示的化合物中的至少一个苯环具有至少一个磺基。该苯环也包含a、b中所包含的苯环。从质子传导性的观点出发,优选磺基在式(i)表示的化合物中至少存在于侧链的苯环中。从质子传导率的观点出发,形成侧链和主链的总苯环每一个的磺基数量优选为1~11,更优选为2~6,进一步优选为4。式(i)表示的化合物的利用实施例记载的方法测得的重均分子量(mw)优选为1×103~1×106,更优选为5×103~5×105,进一步优选为1×104~2×105。式(i)表示的化合物的质子交换容量(iec)优选为0.5~5.0meq/g,更优选为0.8~3.0meq/g,进一步优选为0.9~2.0meq/g。应予说明,该值为利用实施例记载的方法测得的值。[化合物的制造方法](a)diels-alder反应后进行磺化的制造方法式(i)表示的化合物可通过包括以下工序的制造方法来制造。工序1:其中,使下述式(viii)表示的化合物、下述式(ix)表示的化合物和任选的下述式(x)表示的化合物反应,得到下述式(xi)表示的化合物,【化25】(上述通式(ix)和(xi)中,l、n和a、b与式(i)同义,但各苯环不具有磺基);和工序2:其中,将上述式(xi)表示的化合物磺化,得到上述式(i)表示的化合物。(1)工序1工序1中,上述式(viii)表示的化合物、上述式(ix)表示的化合物和任选的上述式(x)表示的化合物通过diels-alder反应,上述式(viii)表示的化合物的五元环与上述式(ix)表示的化合物和任选的上述式(x)表示的化合物的三键反应形成六元环的同时,上述式(viii)表示的化合物的羰基脱离,进行不可逆反应,得到式(xi)表示的化合物。反应温度通常为100~300℃。此外,关于上述式(ix)表示的化合物和任选的上述式(x)表示的化合物,例如可通过使卤化的起始物质与乙炔基三甲基硅烷反应后使三甲基硅烷基脱离来获得。(2)工序2工序2中,在式(xi)中的一个以上的苯环上导入磺基。作为与式(xi)反应的试剂,可列举三甲基甲硅烷基氯磺酸、氯磺酸、发烟硫酸、硫酸等,优选这些试剂以相对于使用式(xi)中的摩尔分率算出的每个单元结构的分子量以当量比计为0.5~6倍的量来进行反应。反应温度通常为0~100℃。在包括a、b所包含的苯环的式(xi)中的任意一个苯环上也可导入磺基,例如,作为式(i)化合物,可举出以下化合物。【化26】(式中l、n与式(i)同义,0<x≤14。)(b)diels-alder反应之前进行磺化的制造方法(1)工序1工序1中,在式(viii)中的一个以上的苯环上导入磺基。作为与式(viii)反应的试剂,可列举三甲基甲硅烷基氯磺酸、氯磺酸、发烟硫酸、硫酸等,优选这些试剂以相对于使用式(xi)中的摩尔分率算出的每个单元结构的分子量以当量比计为0.5~6倍的量来进行反应。反应温度通常为0~100℃。在包括a、b所包含的苯环的式(viii)中的任意一个苯环上也可导入磺基,另外,磺基的数量也没有特别限制,例如可举出以下化合物(xii)。【化27】(2)工序2工序2中,使工序1中导入得到的式(viii)化合物中的磺基成为胺盐。作为与导入磺基得到的式(viii)化合物反应的试剂,可列举三乙胺。反应温度没有特别限制,在室温进行。(3)工序3工序3中,使工序2中得到的导入有至少一个成为胺盐的磺基的式(viii)化合物、上述式(ix)表示的化合物和任选的上述式(x)表示的化合物进行diels-alder反应,得到式(i)表示的化合物。关于该反应的进行,与制造方法(a)中的描述相同。反应温度通常为100~300℃。根据制造方法(b)可控制导入的磺基的数量。[燃料电池]图1是示意性地表示燃料电池的结构的截面图。燃料电池100具有阳极催化剂层103、阴极催化剂层105和被两催化剂层夹持的固体电解质膜107,各催化剂层在外侧具有气体扩散层(gasdiffusionlayer,以下也称为“gdl”)101。该结构称为膜电极接合体(membraneelectrodeassembly,以下也称为“mea”)。燃料电池通常使该膜电极接合体(mea)夹持于隔离件109。上述式(i)表示的化合物可用于燃料电池的阳极催化剂层103、阴极催化剂层105和固体电解质膜107,优选用于燃料电池的阳极催化剂层103、阴极催化剂层105,从抑制高电流驱动时的氧气扩散性降低所引起的过电压上升的观点出发,更优选至少用于阴极催化剂层105。催化剂层103、105分别包含催化剂成分、用于担载催化剂成分的催化剂载体和电解质。作为阳极催化剂层103中的催化剂成分,没有特别限制,可使用公知的催化剂;作为阴极催化剂层105中的催化剂成分,没有特别限制,可使用公知的催化剂。作为这样的用于阳极催化剂层103和阴极催化剂层105的催化剂成分,例如可列举铂、金、银、钌、铱、铑、钯、锇、钨,铅、铁、铬、钴、镍、锰、钒、钼、镓、铝等金属和它们的合金等。作为催化剂载体,例如可列举炭黑、活性炭、焦炭、天然石墨、人造石墨等碳颗粒。作为电解质,可使用上述式(i)表示的化合物。催化剂层103、105可利用以下公知的制造方法来制造:将包含上述催化剂成分、用于担载催化剂成分的催化剂载体和电解质,且使它们分散于分散介质中得到的组合物涂布于固体电解质膜上或气体扩散层的方法;将包含上述催化剂成分、用于负载催化剂成分的催化剂载体和电解质,且使它们分散于分散介质中得到的组合物涂布于基材上,进行干燥而形成催化剂层后,将该催化剂层转印至固体电解质的方法等。由于上述式(i)表示的化合物能以适度的厚度覆盖担载于催化剂载体的催化剂,因此,在保持催化剂的功能的同时,气体的扩散性和质子传导性良好。上述式(i)表示的化合物相对于催化剂的使用量优选为0.1~10倍。作为固体电解质膜107的材料,可列举nafion(注册商标,杜邦株式会社制)、aquivion(注册商标,solvay株式会社制)、flemion(注册商标,旭硝子株式会社制)、aciplex(注册商标,旭化成株式会社制)等全氟磺酸聚合物,从质子传导性的观点出发,可列举上述式(i)表示的化合物。作为气体扩散层101,没有特别限制,可适当使用具有导电性的多孔材料。作为这样的材料,例如可列举碳性的纸及无纺布、毛毡(felt)、无纺布等。【实施例】[测定方法](1)重均分子量和数均分子量基于凝胶渗透色谱(以下简称为gpc)的测定结果。测定使用东曹(株)制gpc装置,测定条件等如以下所示。gpc柱:tskgelsuperhzm-n;tskgelsuperhz3000;tskgelsuperhz2000(东曹(株))柱温:40℃溶剂:四氢呋喃(thf)流量:0.6ml/min标准试样:聚苯乙烯(东曹(株))(2)质子交换容量将通过后述的方法得到的膜在室温下浸渍于2mnacl水溶液中24小时,利用0.02mnaoh水溶液对该浸渍液进行中和滴定。由中和需要的0.02mnaoh的量和浸渍前的膜重量算出质子交换容量。(3)质子传导率使用scribner公司的膜电阻测定系统mts740,将温度和加湿条件设定为80℃和湿度60%,测定膜厚方向的离子传导率,由其算出质子传导性。(4)透氧性将通过后述的方法得到的膜制成42×42mm,使用该膜和gtrtech公司制gtr-10xf,将温度设定为80℃,将膜两面湿度设定为90%rh,测定透氧率。测定方法依照日本工业标准jisk7126-2(gc)。[合成例1:化合物m-1的合成]【化28】在氮气氛下,在反应容器中分别加入2,2’-(1,4-亚苯基)双(1-亚苯基-1,2-二酮)(5.16g、1,3-二苯基丙烷-2-酮6.66g,添加乙醇320ml。加热反应液并使其回流后,滴加利用氢氧化钠1.69g和乙醇8ml制备的溶液,在加热回流条件下搅拌30分钟。放冷至室温后,一边利用冰浴冷却一边进一步搅拌1小时,其后进行过滤。将得到的过滤物干燥,得到8.94g目标物m-1(收率86%)。[合成例2:化合物m-2的合成]【化29】在氮气氛下,在反应容器中加入4,4”-二溴-1,1’:3’,1”-三联苯3.00g、pdcl2(pph3)20.22g、碘化铜0.030g、三苯基膦0.17g、二异丙胺30ml和乙炔基三甲基硅烷1.64g,在加热回流条件下搅拌3小时。将反应液冷却至室温后,添加甲醇,进行过滤。收集过滤物,添加二氯甲烷65ml使其溶解后,添加使氢氧化钠1.53g溶解于甲醇30ml而制备的溶液,在室温下搅拌。15分钟后在反应液中添加离子交换水并进行分液,利用饱和食盐水清洗有机相,其后,进行硅胶过滤。减压蒸馏去除滤液的溶剂后,进行干燥,得到1.61g目标物m-2(收率75%)。[合成例3:化合物m-3的合成]【化30】(1)m-3tms的合成在氮气氛下,在反应容器中加入2,2'-二溴-9,9'-螺双芴2.00g、pdcl2(pph3)20.12g、碘化铜0.016g、三苯基膦0.089g、二异丙胺20ml和乙炔基三甲基硅烷0.90g,在加热回流条件下搅拌3小时。将过滤反应液得到的滤液浓缩、干燥。在浓缩残渣中添加氯仿使其溶解,利用柱色谱进行分离、提纯,得到1.10g目标物m-3tms(收率51%)。(2)m-3的合成在氮气氛下,在反应容器中加入m-3tms1.10g、碳酸钾2.11g、thf/meoh(1:1=v/v)混合溶剂200ml,在室温下搅拌2小时。向反应液中添加二氯甲烷和离子交换水并进行分液。将得到的有机相浓缩、干燥,利用柱色谱进行分离提纯,得到0.56g目标物m-3(收率70%)。[合成例4:化合物m-4的合成]【化31】(1)m-4tms的合成在氮气氛下,在反应容器中加入2,7-二溴-9,9'-螺双芴3.00g、pdcl2(pph3)20.18g、碘化铜0.024g、三苯基膦0.13g、二异丙胺30ml和乙炔基三甲基硅烷1.44g,在加热回流条件下搅拌6小时。在反应液中添加甲醇后,过滤,将得到的过滤物干燥,得到2.69g目标物m-4tms(收率84%)。(2)m-4的合成在氮气氛下,在反应容器中加入m-4tms2.69g和二氯甲烷30ml,确认溶解后,滴加利用氢氧化钠1.05g和甲醇20ml制备的溶液,在室温下搅拌30分钟。在反应液中添加离子交换水并进行分液,利用饱和食盐水清洗有机相之后,进行浓缩、干燥,得到1.85g目标物m-4(收率96%)得た。[实施例1:试样1的制造](1)bp-1的合成【化32】在氮气氛下,在反应容器中加入2.48gm-1、1.00gm-2和25ml硝基苯,在190℃下搅拌24小时。将反应液滴加至乙酸乙酯500ml中,进行搅拌后,进行过滤,将过滤物干燥,得到3.13g目标物bp-1(收率95%)。得到的bp-1为mn33000、mw95800、pd(mw/mn)2.9。(2)试样1的合成【化33】在氮气氛下,在反应容器中添加0.20gbp-1、5ml二氯甲烷,在室温下搅拌,使其溶解。确认溶解后滴加利用三甲基硅烷磺酰氯0.083g和二氯甲烷0.5ml制备的溶液,在室温下搅拌5.5小时。在反应液中添加乙醇使反应停止后,将反应液滴加至丙酮中,在室温下搅拌。进行过滤后,将过滤物干燥,得到0.18g目标物试样1(上述化学式中试样1,以下相同)。质子交换容量(iec)1.16meq/g[实施例2:试样2的制造](1)bp-2的合成【化34】在氮气氛下,加入3.24gm-1、1.71gm-4、35ml硝基苯,在190℃下搅拌15小时。将反应液滴加至乙酸乙酯中,在室温下搅拌后,进行过滤。将过滤物干燥,得到2.68g目标物bp-2(收率57%)。mn16400,mw40800,pd2.5(2)试样2的合成【化35】在氮气氛下,在反应容器中加入0.20gbp-2、5ml二氯甲烷,在室温下搅拌,使其溶解。确认溶解后,滴加利用三甲基硅烷磺酰氯0.076g和二氯甲烷0.5ml制备的溶液,在室温下搅拌3小时。在反应液中添加乙醇使反应停止后,将反应液滴加至甲醇中,在室温下搅拌。进行过滤,将过滤物干燥,得到0.18g目标物试样2。[实施例3:试样3的制造](1)bp-3的合成【化36】在氮气氛下,加入0.57gm-1、0.30gm-3、3ml硝基苯,在170℃下搅拌20小时。在反应液中添加硝基苯后,滴加至甲醇中,在室温下搅拌后进行过滤。将过滤物干燥,得到0.77g目标物bp-3(收率91%)。mn20200,mw64700,pd3.2(2)试样3的合成【化37】在氮气氛下,在反应容器中加入0.30gbp-3、5ml二氯甲烷,在室温下搅拌,使其溶解。确认溶解后滴加利用三甲基硅烷磺酰氯0.11g和二氯甲烷0.5ml制备的溶液,在室温下搅拌1小时。在反应液中添加乙醇使反应停止后,将反应液滴加至正己烷中,在室温下搅拌。进行过滤,将过滤物干燥,得到0.26g目标物试样3。[实施例4:试样4的制造](1)bp-4的合成【化38】在氮气氛下,在反应容器中加入0.60gm-1、0.077g1,4-二乙炔基苯、0.095gm-3和3ml硝基苯,在190℃下搅拌8小时。将反应液冷却至100℃左右,添加硝基苯并搅拌后,将该溶液滴加至甲醇中,在室温下搅拌。进行过滤,将得到的过滤物干燥,得到0.69g目标物bp-4(收率92%)。mn26000,mw77000,pd3.0(2)试样4的合成【化39】在氮气氛下,在反应容器中加入0.30gbp-4、5ml二氯甲烷,在室温下搅拌,使其溶解。确认溶解后,滴加利用三甲基硅烷磺酰氯0.14g和二氯甲烷0.5ml制备的溶液,在室温下搅拌1.5小时。在反应液中添加乙醇使反应停止后,将反应液滴加至丙酮中,在室温下搅拌。进行过滤,将过滤物干燥,得到0.26g目标物试样4。[实施例5:试样5的制造](1)bp-5的合成【化40】在氮气氛下,在反应容器中加入0.60gm-1、0.088g1,4-二乙炔基苯、0.064gm-3和3ml硝基苯,在190℃下搅拌24小时。将反应液冷却至100℃左右,添加甲苯并搅拌后,将该溶液滴加至甲醇中。在室温下搅拌。进行过滤,在得到的过滤物中添加甲苯制成溶液后,再次滴加至甲醇中,在室温下进行搅拌。进行过滤,将得到的过滤物干燥,得到0.67g目标物bp-5(收率95%)。mn44100,mw146000,pd3.3(2)试样5的合成【化41】在氮气氛下,在反应容器中加入0.30gbp-5、7ml二氯甲烷,在室温下搅拌,使其溶解。确认溶解后滴加利用三甲基硅烷磺酰氯0.14g和二氯甲烷0.5ml制备的溶液,在室温下搅拌30分钟。在反应液中添加乙醇使反应停止后,将反应液滴加至丙酮中,在室温下搅拌。进行过滤,将过滤物干燥,得到0.28g目标物试样5。质子交换容量(iec)0.93meq/g[实施例6:试样6的制造](1)bp-5的合成与实施例5的(1)同样进行,合成bp-5。(2)试样6的合成【化42】在氮气氛下,在反应容器中加入0.15gbp-5、3.5ml二氯甲烷,在室温下搅拌,使其溶解。确认溶解后,滴加利用三甲基硅烷磺酰氯0.14g和二氯甲烷0.5ml制备的溶液,在室温下搅拌2.5小时。在反应液中添加乙醇使反应停止后,将反应液滴加至正己烷中,在室温下搅拌。进行过滤,将过滤物干燥,得到0.13g目标物试样6。质子交换容量(iec)1.59meq/g[实施例7:试样7的制造](1)m-5的合成【化43】在氮气氛下,在反应容器中加入4.00gm-1和300ml二氯甲烷后,滴加三甲基甲硅烷基氯磺酸(trimethylsilylchlorosulfonate)8.76g,在室温下搅拌18小时。在反应液中添加乙醇5ml使反应停止后,将反应液滴加至二乙醚中,在室温下搅拌した。进行过滤,将过滤物干燥,得到4.27g目标物m-5(收率:73%)。1hnmr(500mhz,dmso-d6)δ(ppm):6.86(s,4h),6.92(d,j=7.5hz,4h),7.07(d,j=8.5hz,4h),7.13(d,j=8.5hz,4h),7.25(t,j=7.5hz,4h),7.33(t,j=7.5hz,2h),7.47(d,j=8.0hz,4h),7.51(d,j=8.0hz,4h).(2)m-6的合成【化44】在反应容器中加入4.00gm-5、185ml正丁醇和91ml三乙胺,在室温下搅拌20分钟。将反应液过滤后,将过滤物干燥,得到5.2g目标物m-6(收率:93%)。1hnmr(500mhz,dmso-d6)δ(ppm):1.17(t,j=7.5hz,36h),3.09(q,j=7.5hz,24h),6.87(s,4h),6.92(d,j=7.0hz,4h),7.08(d,j=8.5hz,4h),7.14(d,j=8.5hz,4h),7.26(t,j=7.0hz,4h),7.34(m,2h),7.48(m,4h),7.51(d,j=8.0hz,4h).(3)试样7的合成【化45】在氮气氛下,在反应容器中加入0.997gm-6、0.0706g1,4-二乙炔基苯、0.0513gm-3和9ml硝基苯,在180℃下加热搅拌16小时。取出反应容器内的不溶物,使其溶解于dmf后,滴加至乙酸乙酯中使其再沉淀。进行过滤,将得到的过滤物干燥,得到0.956g的聚合物。在该聚合物中添加甲醇,在得到的悬浊液中滴加2mkoh甲醇溶液75ml,在室温下搅拌2小时。其后,进行过滤、干燥,得到0.859g的聚合物钾盐后,在其中添加离子交换水,制成悬浊液。在该悬浊液中添加2mh2so4水溶液,在室温下搅拌2小时。进行过滤,将得到的过滤物干燥,得到0.293g目标物磺酸聚合物即试样7(收率:59%)。mn38400,mw48400,pd1.3[比较例1]按照美国专利公报7301002号公报的记载,制造下述式的化合物,作为试样7。【化46】<成膜方法>对于得到的试样1、6和7,利用以下方法进行成膜。在试样50mg中,添加n,n-二甲基乙酰胺450mg,使其溶解后,进行0.2μm的ptfe制过滤器过滤,涂布于玻璃基板上。使溶剂在热板上在60℃蒸发2小时,在80℃蒸发6小时,在100℃蒸发2小时后,进而利用80℃的真空干燥机进行6小时干燥,得到试样1、6和7的自支撑膜。对由试样1、6和7得到的自支撑膜测定质子交换容量、质子传导率和透氧性,将结果示于表2。【表1】【表2】聚合物透氧系数(cm3·cm/cm2·sec·cmhg)实施例19.9×10-10实施例61.4×10-9比较例11.5×10-9由上述结果可知,将比较例1与实施例1和6进行比较,虽然实施例1和6低于比较例1的离子交换容量,但显示更高的质子传导性。另外可知,导入特定数量的磺基的实施例7中,显示非常高的质子传导性。符号说明100燃料电池101气体扩散层103阳极催化剂层105阴极催化剂层107固体电解质膜109隔离件。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1