杂环线粒体活性抑制剂及其用途的制作方法
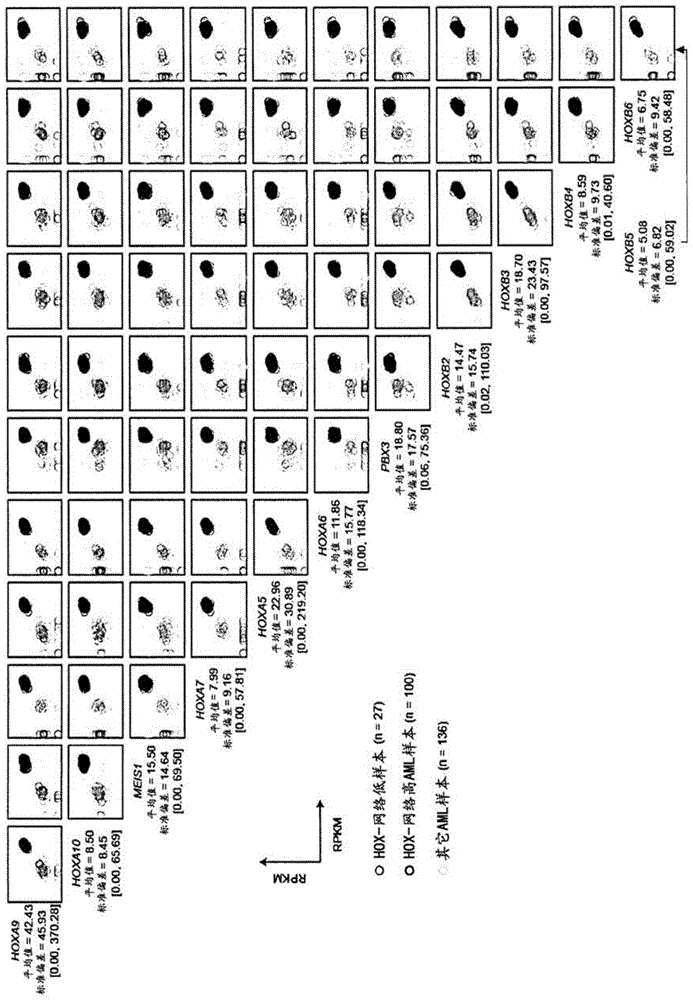
相关申请本申请根据适用法律和法规要求于2017年11月3日提交的美国申请no.62/581,239和2018年2月16日提交的加拿大申请no.2,980,431的优先权,将其全部内容通过引用并于本申请用于所有目的。本申请通常涉及抑制线粒体活性,例如用于治疗诸如急性骨髓性白血病(aml)的癌症,更具体地是通常与不良预后相关的aml亚型。
背景技术:
:越来越多的证据表明,线粒体的生物能学、生物合成和信号传导与肿瘤发生有关。例如,已显示抑制线粒体etc复合物i的抗糖尿病药物二甲双胍和苯乙双胍,抑制包括肺癌、淋巴瘤和乳腺癌在内的各种癌症的肿瘤生长。乳腺癌细胞中,二甲双胍和苯乙双胍通过复合物i抑制减少三羧酸(tca)循环中间体产生(janzera等人,procnatlacadsciusa.2014;111:10574-10579)。线粒体产生活性氧类别(ros)为电子传递链(etc)活性的天然副产物。一些抗癌药物是ros的产生剂、氧化应激的诱导剂和细胞凋亡的引发剂。线粒体etc抑制后,经常产生ros,其包括自由基例如超氧化物(o2·–)、羟基自由基(ho·)和过氧化氢(h2o2)(li等人,2003.j.biol.chem.278,8516-8525;muller等人,2004.j.biol.chem.279,49064-49073),并且至少部分通过自噬诱导的细胞死亡导致肿瘤细胞死亡(chen等人,journalofcellscience2007120:4155-4166)。因此,显著增加肿瘤细胞中的ros水平的靶向线粒体活性/代谢,构成有希望的癌症治疗方法。急性骨髓性白血病(aml)是特别致命的癌症,大多数患者在诊断后两年内就死亡。它是年轻人死亡的主要原因之一。aml具有异质性病理生理学、遗传学和预后的肿瘤的总称。主要基于细胞遗传学和分子分析,aml患者目前分类为预后明显不同的aml组或亚组。根据是否存在特异性复发性细胞遗传学异常,所有aml患者中的约45%目前分为预后不同的不同组。用flt3酪氨酸激酶抑制剂(tki)靶向flt3受体酪氨酸激酶在治疗flt3-突变的aml(通常与不良的临床结果相关)方面显示出令人鼓舞的结果,但在大多数患者中,反应不完全并且不能持久。此外,诱导获得的对tki的抗性已经作为临床问题出现。此外,aml例如c-kit和jak2中的其它病理激活激酶的抑制剂仅获得罕见的骨髓反应。需要鉴定用于治疗癌症的新的治疗策略,所述癌症包括aml,例如与不良预后相关的aml。技术实现要素:根据一个方面,本申请的技术通常涉及式i化合物或其药学上可接受的盐:其中:x1表示-n=、-ch=或-o-;x2表示-ch=、-c(r2)=或共价键;x3表示-ch=、-c(r2)=或共价键;x4表示-o-、-c(r3)=、-n=或-s-;x5表示共价键、-c(r3)=或-o-;条件是x2和x3之一为-c(r2)=并且x2和x3中的另一个为-ch=或共价键,并且条件是x2、x3和x5中的最多仅一个表示共价键;r2表示芳基c(r3)=c(h)-、杂芳基c(r3)=c(h)-、芳基n(r3)c(o)-、杂芳基n(r3)c(o)-、芳基环丙基-、杂芳基环丙基-、r3oc(o)c(h)=c(h)-、r3oc(o)-、芳基-c≡c-、杂芳基-c≡c-、芳基-、杂芳基-、芳基-ch(r3)-ch(r3)-或杂芳基-ch(r3)-ch(r3)-,其中芳基基团和杂芳基基团任选地被一个至三个r4基团取代,r4基团相同或不同;r3每次出现时独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基,烷基、烯基、炔基和环烷基任选地被-or6、-n(r6)2、-c(o)or6、-cn或-c(o)n(r6)2取代;r4每次出现时独立地表示-f、-cl、-br、-i、-sr3、-sor5、-s(o)2r5、-s(o)2n(r3)2、-三唑基、-cn、-c(o)or3、-c(o)r3、-no2、-c(o)n(r3)2、-or3、-c(r3)2oh、-n(r3)2、-n(r3)c(o)r3、-n(r3)c(o)or5、-oc(o)n(r3)2、-n3、-r3,r5每次出现时独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基,烷基、烯基、炔基和环烷基任选地被-or6、-n(r6)2、-c(o)or6、-cn或-c(o)n(r6)2取代;r6独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基;l1表示-chr3-o-、-ch2-nh-、-c(o)nh-、-c(o)-chr6、-cr6=cr6-、-ch2-s-、-ch2-或-ch2-o-ch2-;x6和x7独立地表示-cr3=或-n=;l2表示共价键、-c(o)-、-c(r3)(oh)-、-o-、-s-、-chr3-、-ch(r3)-s-或-ch(r3)-o-;m每次出现时独立地表示1至4的整数。p表示1至6的整数;和r1表示杂芳基、芳基、-n3、-oh、-oc(o)n(r7)2、-c(o)n(r7)2、-n(r7)2、-n(r7)c(o)r7、-n(r7)c(o)or8、-n(r7)c(o)-l3-or7或-n(r7)c(o)-l3-oc(o)n(r7)2,杂芳基和芳基任选地被一个或多个r9取代,r9相同或不同,其中:l3表示c1-c5亚烷基、c2-c5亚烯基、c2-c5亚炔基或c1-c4氟亚烷基,亚烷基、亚烯基和亚炔基任选地被一个或多个r9取代,r9相同或不同,r7独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基;烷基、烯基、炔基和环烷基任选地被一个或多个r9取代,r9相同或不同,或当两个r7基团连接至相同的氮原子时,两个r7基团与它们所连接的氮原子一起任选地形成5-7元杂环烷基,杂环烷基任选地包含一个或多个其它杂原子,其它杂原子独立地选自-o-、-n(r3)-、-s-、-s(o)-和-so2-,所述杂环烷基任选地被一个或多个r9取代,r9相同或不同,r8独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基;烷基、烯基、炔基和环烷基任选地被一个或多个r9取代,r9相同或不同,和r9独立地表示-c1-c6烷基、-c0-c6烷基-or11、-c3-c6环烷基、-c3-c6环烷基-or11、-c1-c6烷基-oc(o)r11、-c1-c6烷基-oc(o)n(r11)2、-c1-c6烷基-oc(o)n(r11)-l4-or11、-c0-c6烷基-c(o)or11、-c0-c6烷基-c(o)n(r11)2、-c1-c6烷基-n(r11)2、-c1-c6烷基-n(r11)c(o)r11、-c1-c6烷基-n(r11)c(o)-l4-n(r11)-c(o)r11、-c1-c6烷基-n(r11)s(o)2r10、-c1-c6烷基-n(r11)s(o)2-l4-n(r11)-c(o)or10、-si(c1-c5烷基)3、-c(o)-o-c1-c6烷基、任选地被r4取代的苯基、任选地被r4取代的苄基、任选地被r4取代的吡啶基或其中:l4表示c1-c5亚烷基、c2-c5亚烯基、c2-c5亚炔基或c1-c4氟亚烷基;和r10独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基,所述烷基、烯基、炔基和环烷基任选地被-or6、-n(r6)2、-c(o)or6、-cn或-c(o)n(r6)2取代;r11独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基,烷基、烯基、炔基和环烷基任选地被-or6、-n(r6)2、-c(o)or6、-cn或-c(o)n(r6)2取代,或当两个r11基团连接至相同的氮原子时,两个r11基团与它们所连接的氮原子一起任选地形成5-7元杂环烷基,杂环烷基任选地包含一个或多个其它杂原子,其它杂原子独立地选自-o-、-n(r3)-、-s-、-s(o)-和-so2-。根据一个实施方案,式i化合物中,基团r5、r8和r10都不是-h。单独或组合中使用的化合物的其它实施方案如下文所定义。在另一个方面,本申请涉及本申请定义的化合物或其药学上可接受的盐用于治疗患者的急性骨髓性白血病(aml)的用途。相反,本申请涉及本申请定义的化合物或其药学上可接受的盐,其用于治疗急性骨髓性白血病(aml)。或者,本申请涉及本申请定义的化合物或其药学上可接受的盐在制备用于治疗患者的急性骨髓性白血病(aml)的药物中的用途。在一个进一步的方面,本申请涉及用于治疗急性骨髓性白血病(aml)的方法,所述方法包括向有此需要的受试者给药有效量的本申请定义的化合物或其药学上可接受的盐。例如,受试者为儿科受试者。或者,受试者为成年人受试者。在一个实施方案中,aml为不良预后的aml。在另一个实施方案中,aml包含以下特征中的至少之一:(a)一种或多种同源异型框(hox)-网络基因的高水平表达;(b)表1中描述的一种或多种基因的高水平表达;(c)表2中描述的一种或多种基因的低水平表达;(d)以下细胞遗传或分子危险因素中的一种或多种:中等细胞遗传学风险,正常核型(nk),突变的npm1,突变的cebpa,突变的flt3,突变的dna甲基化基因,突变的runx1,突变的wt1,突变的srsf2,具有异常核型的中等细胞遗传学风险(intern(abnk)),三体性8(+8),和异常chr(5/7);和(e)白血病干细胞(lsc)频率为至少约1lsc每总的1x106个细胞。例如,aml包含一个或多个hox-网络基因的高水平表达,例如,一个或多个hox-网络基因为hoxb1、hoxb2、hoxb3、hoxb5、hoxb6、hoxb7、hoxb9、hoxb-as3、hoxa1、hoxa2、hoxa3、hoxa4、hoxa5、hoxa6、hoxa7、hoxa9、hoxa10、hoxa10-as、hoxa11、hoxa11-as、meis1和/或pbx3。例如,一个或多个hox-网络基因为hoxa9和/或hoxa10。在另一个实施方案中,aml包含下表1中描述的一个或多个基因的高水平表达。在进一步的实施方案中,aml包含表2中描述的一个或多个基因的低水平表达。还在另一个实施方案中,aml包含以上第(d)项定义的细胞遗传或分子危险因素中的一种或多种,例如,aml为中等细胞遗传学风险aml和/或nk-aml,和/或aml包含所述细胞遗传或分子危险因素中的至少两种或所述细胞遗传或分子危险因素中的至少三种。在一个进一步的实施方案中,aml包含突变的npm1、突变的flt3和/或突变的dna甲基化基因,例如dnmt3a或idh1。在另一个实施方案中,aml包含突变的npm1、突变的flt3和突变的dna甲基化基因,优选dna甲基化基因为dnmt3a。例如,突变的flt3为内部串联重复的flt3(flt3-itd)。还在另一个实施方案中,aml包含lsc频率为至少约1lsc每总的1x106个细胞或lsc频率为至少约1lsc每总的5x105个细胞。在一个进一步的实施方案中,aml包含以上特征(a)至(e)中的至少两个或特征(a)至(e)中的至少三个。在另一个实施方案中,aml为npm1突变的nk-aml。根据另一个方面,在本申请定义的用途、使用的化合物或方法中,化合物或其药学上可接受的盐存在于药物组合物中。在一个进一步的方面,本申请说明书涉及用于确定患有急性骨髓性白血病(aml)的受试者对用本申请定义的化合物或其药学上可接受的盐治疗有反应的可能性的方法,所述方法包括确定是否aml来自所述受试者的细胞包含以上定义的特征的至少之一,其中所述aml细胞中存在以下特征的至少之一表示受试者对治疗有反应的可能性高。通过阅读以下对示例性实施方案的非限制性描述,本发明的化合物、组合物、方法和用途的另外目的和特征将变得更明显,示例性实施方案不应解释为对本发明范围的限制。附图说明图1a-d显示hox-网络基因的表达与aml预后之间的联系。图1a:鉴定在本申请研究的预后leucegeneaml队列(263例aml患者)(可得到足够的信息以进行生存研究的一队列aml患者)中具有一致性高表达的hox-网络基因成员(黑色,每个图的右上角)并且具有一致性低表达的hox-网络基因成员(灰色,每个图的左下角)的患者样本。括号中的值表示每个基因的表达范围。图1b:属于hox-网络高(下部线,n=100)对低(上部线,n=27)亚组的aml患者的总生存率。图1c:鉴定hoxa9/hoxa10高aml样本人群。图1d:属于hoxa9/hoxa10高组(下部线,n=131)和hoxa9/hoxa10中/低组(上部线,n=132)的aml患者的总生存率。图1b和图1d中,p值通过log-rank检验来确定。缩写词:aml:急性骨髓性白血病;hox:同源异型框;meis1:meis同源异型框1;rpkm:每百万定位的读段数中每千碱基的读段数;std:标准偏差。图2a-h显示表征hox-高aml细胞的药理反应。图2a:60种化合物的初步筛选工作流程概述(表4)。hoxa9和hoxa10用作代表性基因以区分hox-高(深灰色,n=131)对hox-中/低(浅灰色,n=132)患者样本。图2b:初步筛选结果的总结导致鉴定莫立替尼为靶向hox-高aml患者细胞的候选药物。水平虚线对应p=0.05,垂直虚线指示ec50值的2.5倍差异。图2c:验证屏幕中包括的aml患者样本包含hox-高(深灰色,右上)和hox-中/低(浅灰色)标本。图2d:验证屏幕中测得的hox-高对hox-中/低aml样本的ec50差异值。p值通过mann-whitney检验来确定。图2e:200个不同aml标本中测量的莫立替尼ec50值的频率定义莫立替尼敏感(ec50<375nm,n=100)和莫立替尼耐药(ec50≥375nm,n=100)组。正常的原始cd34阳性脐血细胞对莫立替尼适度敏感(ec50>375nm)。图2f:患者的差异的总生存率属于莫立替尼敏感对耐药组。p值通过log-rank检验来确定。图2g:莫立替尼敏感对莫立替尼耐药标本的转录组学特征突出显示hox-网络基因的过表达。图2h:莫立替尼敏感对莫立替尼耐药标本的转录组学特征突出显示最大差异表达基因(标准:log(倍数变化)>0.8(=6倍),rpkm>0.1)。缩写词:aml:急性骨髓性白血病;ankrd18b:锚蛋白重复结构域18b;bend6:包含ben结构域的6;col4a5:iv型胶原α5;fdr:错误发现率;hox:同源异型框;kirrel:类irre家系;linc:长链非编码:lsc:白血病干细胞;meis1:meis同源异型框1;mir:微小rna;msln:间皮素;nkx2.3:nk2同源异型框3;pi3k:磷脂酰肌醇-4,5-二磷酸3-激酶;ppbp:前血小板碱性蛋白;prdm16:pr/set结构域16;prg3:蛋白聚糖3;rpkm:每百万定位的读段数中每千碱基的读段数;rtk:受体酪氨酸激酶;s100a16:s100钙结合蛋白a16;snord:小分子rna;st18:抑制致瘤性18,锌指;znf:锌指蛋白。图3a-h显示根据各种遗传和临床特征来表征莫立替尼敏感aml标本。图3a:根据细胞遗传学风险分类的莫立替尼ec50值。图3b:根据bonferroni校正的精确fisher检验进行的高度敏感莫立替尼aml标本(ec50<100nm,n=59)对莫立替尼高度耐药aml标本(ec50>1μm,n=58)中富含的突变。图3c:根据存在突变的基因的莫立替尼ec50值。图3d:根据遗传学亚组的莫立替尼ec50值。图3e:莫立替尼敏感的患者样本特征总结。图3f:携带npm1、flt3-itd和dnmt3a的突变(m)的预后不良的患者标本(papaemmanuil,e.等人,nengljmed374,2209-2221)对其它aml样本的ec50值。图3g-h:属于正常核型(nk)亚组(图3g)和属于携带突变的npm1(npm1m)的nk亚组(图3h)的莫立替尼敏感对耐药组的患者样本的白血病干细胞(lsc)频率。图3d-h中,p值通过mann-whitney检验来计算。所有组中的水平线表示中位值。缩写词:aml:急性骨髓性白血病;abnchr:染色体异常;asxl1:附加性梳样1,转录调控子;cebpa:ccaat/增强子结合蛋白α;复合物:复杂核型;dnmt3a:dna(胞嘧啶-5-)-甲基转移酶3α;evi1:热带病毒整合位点1;flt3:fms相关酪氨酸激酶3;hox:同源异型框;idh:异柠檬酸脱氢酶(nadp(+));inter(abnk):核型异常的中等细胞遗传学风险;m;突变的;mll:混合谱系白血病1;nk:正常核型;npm1:核磷蛋白(核仁磷酸蛋白b23,numatrin);nras:神经母细胞瘤ras病毒癌基因同源物;nup98:核孔蛋白98kda;runx1:runt相关转录因子1;srsf2:丝氨酸/精氨酸丰富剪接因子2;tet2:tet甲基胞嘧啶双加氧酶2;tp53:肿瘤蛋白p53;wt1:维耳姆斯瘤1;+8:三体性8。图4a-4g显示关于评估莫立替尼对肿瘤细胞作用的实验的结果。图4a:用不同浓度的莫立替尼处理oci-aml3四天后(碘化丙锭(pi)-阴性)细胞可存活的数量。图4b:与dmso处理的细胞相比,用不同浓度的莫立替尼处理oci-aml327小时后的pi阳性细胞(死细胞)中的富集倍数。图4c:用对照dmso、100nm或10μm莫立替尼处理24小时后,oci-aml3细胞中的早期凋亡和晚期凋亡细胞的百分比。图4d:aml患者的细胞相对于莫立替尼对二甲苯磺酸拉帕替尼(erbb2抑制剂)的敏感性。图4e:用莫立替尼或两种已知erbb2抑制剂:二甲苯磺酸拉帕替尼或沙普替尼处理后的oci-aml3剂量反应曲线。图4f:莫立替尼敏感对莫立替尼耐药患者样本的erbb2基因表达。图4g:通过流式细胞术测量的erbb2过表达bt474乳腺癌细胞系和oci-aml3莫立替尼敏感aml细胞系中的erbb2蛋白表达对同型对照。样本或用莫立替尼在2μm处理24小时,或用dmso模拟处理。缩写词:aml:急性骨髓性白血病;erbb2:erb-b2受体酪氨酸激酶2;fitc:异硫氰酸荧光素;pe:藻红蛋白;pos:阳性。图5a-5j显示关于评估莫立替尼用于介导肿瘤细胞死亡的作用方式的实验结果。图5a:将oci-aml3白血病细胞或用6mm的n-乙酰半胱氨酸(nac)、活性氧类别(ros)清除剂或用媒介物(水)预培育4小时,然后用100nm莫立替尼或媒介物(dmso)处理24h。通过流式细胞术经膜联蛋白v和碘化丙锭(pi)染色评估莫立替尼处理后的经历凋亡死亡的细胞。当在nac存在下培养细胞时,莫立替尼诱导的细胞死亡减少。图5b:使用测量细胞内的羟基、过氧化氢和其它ros活性的2’,7’-二氯荧光素二乙酸酯(dcfda)(一种荧光染料)的流式细胞术染色,表明莫立替尼治疗(500nm,24h)诱导oci-aml3白血病细胞的ros活性。图5c和5d显示分别在用莫立替尼治疗或不用莫立替尼治疗的oci-aml3中的谷胱甘肽的还原水平和氧化水平,如通过液相色谱-质谱法(lc/ms)检测。图5e显示评估莫立替尼(1μm)对oci-aml3白血病细胞中的耗氧率(ocr)的作用的实验结果,如使用seahorse细胞外流量分析仪测量的。图5f显示评估莫立替尼对线粒体电子传递链(etc)复合物i(线粒体呼吸/活性的关键)的作用的实验结果,如使用无细胞测定(mitotoxtm复合物ioxphos活性微孔板测定,abcam)测量的。图5g是描绘oci-aml3和oci-aml5细胞系的莫立替尼处理后的剂量-反应曲线(384孔板中的6天培养测定)的图。图5h-j是用其它etc抑制剂治疗oci-aml3和oci-aml5细胞系后的剂量反应曲线图,其它etc抑制剂即寡霉素(复合物v的抑制剂,图5h)、鱼藤酮(复合物i的抑制剂,图5i)和鱼藤素(复合物i的抑制剂,图5j)。图6a-6e是莫立替尼治疗对oci-aml3细胞中柠檬酸循环的不同中间体水平的作用的图,不同中间体即柠檬酸盐(图6a)、α-酮戊二酸盐(图6b)、琥珀酸盐(图6c)、富马酸盐(图6d)和苹果酸盐(图6e)。图7是显示在白血病干细胞活性保守培养条件下,检测莫立替尼和二甲双胍酸盐对aml样本20aml标本的抑制作用对于在1μm对莫立替尼和二甲双胍盐酸盐的敏感性的图(pabst等人,2014,naturemethods11(4):436-42)。图8a和8b是显示莫立替尼对oci-aml3细胞的复合物i酶活性(心肌黄酶型活性)的作用的图,如使用复合物i酶活性微孔板检测试剂盒根据制造商的说明评估的(abcam,catalogno.ab109721)。复合物i活性通过将nadh氧化为nad+并且同时还原染料,从而导致在od=450nm处的吸光度增加来确定。图8a:对复合物i泛素化(ubiquitone)依赖性活性的作用。图8b:对复合物i泛素化非依赖性活性的作用。图9是莫立替尼诱导肿瘤细胞死亡的推定作用机制的示意图。具体实施方式本申请中使用的所有技术与科学术语和表达都具有与本技术所属领域的技术人员通常理解的定义相同的定义。然而,下面提供使用的一些术语和表达的定义。在通过引用并入本申请的出版物、专利和专利申请中的术语的定义与本申请说明书中所述的定义相反的情况下,以本说明书中的定义为准。本申请所使用的章节标题仅出于组织的目的,并不应解释为限制所公开的主题。i.定义本申请描述的化学结构根据常规标准来绘制。此外,当所绘出的原子例如碳原子包括不完全的化合价时,则推定通过一个或多个氢原子来满足该化合价,即使未必明确绘出这些氢原子。应该推断氢原子是化合物的一部分。在此,在化学名称与化学结构不一致的情况下,以化学结构为准。本申请所使用的术语仅出于描述特定实施方案的目的,并不意在进行限制。应该注意,单数形式“一个”、“一种”和“所述”也包括复数形式,除非内容中另有明确规定。因此,例如,提及包含“化合物”的组合物也预想到两种或更多种化合物的混合物。还应注意,除非内容中另外明确指出,否则术语“或”通常以包括“和/或”的含义来使用。整个该说明书中,除非上下文另外要求,否则措词“包括”、“含有”和“包含”将理解为隐含包括所述的步骤或要素或步骤或要素的组,但不排除任何其它步骤或要素或步骤或要素的组。此外,就具体实施方式和/或权利要求中使用的术语“包括”、“包含”、“具有”、“有”、“带有”或其变体而言,这些术语意在包括与术语“包含”类似的方式。除非本申请另有说明或另外与上下文明显矛盾,否则本申请所描述的所有方法都可以任何适宜顺序进行。除非另外要求,否则使用本申请提供的任何和所有实例或示例性语言(“例如”、“诸如”)仅意在更好地说明本发明,并非对本发明的范围构成限制。术语“约”或“大约”意指在特定值的可接受的误差范围内,如本领域技术人员所确定的,这将部分取决于该值如何测量或确定,即,测量系统的局限性。例如,按照本领域的实践,“约”可以意指在1个或大于1个标准偏差内。或者,“约”可意指相对于给定值的至多20%、优选至多10%、更优选至多5%、还更优选至多1%的范围。或者,特别是就生物系统或过程而言,该术语可意指在值的一个数量级内、优选5倍以内、更优选2倍以内。当本申请和权利要求书中描述到特定值时,除非另有说明,否则应推定术语“约”意指在特定值的可接受的误差范围内。除非另有说明,否则当适用时,本申请所述的结构还意在包括该结构的所有同分异构(例如,对映异构、非对映异构和几何(或构象))形式;例如,各个不对称中心的r和s构型。因此,本申请化合物的单一立体化学异构体以及对映体、非对映体和几何(或构象)混合物在本申请说明书的范围内。除非另有说明,否则治疗性化合物也涵盖所述化合物的所有可能的互变异构形式,如果有的话。该术语还包括同位素标记的化合物,其中一个或多个原子的原子质量与自然界中发现的最丰富的原子质量不同。可并入本申请化合物的同位素的实例包括但不限于,2h(d)、3h(t)、11c、13c、14c、15n、18o、17o、硫的同位素的任一种等。化合物也可以非溶剂合形式以及溶剂合形式存在,包括水合形式。化合物可以多种结晶或无定形形式存在。通常,所有物理形式对于本申请所预期的用途是等同的,并且意在落入本发明的范围内。措辞“药学上可接受的盐”是指本申请说明书的化合物的那些盐,其在合理的医学判断范围内,适用于与人和低等动物的组织接触而没有过度毒性、刺激、过敏反应等,并且与合理的获益/风险比相称。药学上可接受的盐是本领域众所周知的。例如,s.m.berge等人描述了j.pharmaceuticalsciences,66:1-19(1977)中详述的药学上可接受的盐。术语“溶剂合物”是指本申请化合物的一种与一种或多种包括水和非水溶剂分子在内的溶剂分子的物理缔合。该物理缔合可包括氢键。在某些情况下,例如,当一种或多种溶剂分子并入结晶固体的晶格中时,溶剂化物将能够分离。术语“溶剂合物”涵盖溶液相和可分离的溶剂合物两者。示例性溶剂合物包括但不限于其它生理上可接受的溶剂的水合物、半水合物、乙醇合物、半乙醇合物、n-丙醇合物、异丙醇合物、1-丁醇合物、2-丁醇合物和溶剂合物,例如internationalconferenceonharmonization(ich),guideforindustry,q3cimpurities:residualsolvents(1997)中描述的3类溶剂。因此,本申请所述的化合物还包括其溶剂合物及其混合物中的每一种。在此,式(i)的通用化学结构具有各种取代基(r1至r11、x1至x7等)和为这些取代基所列举的各种基团(烷基、杂环等),意在用作分别指通过任何取代基的任何基团的组合得到的每个分子的取代基的简写方法。每个单独的分子并入说明书中,就如它在本申请中单独记载那样。此外,通用化学结构内的分子的所有子集也并入说明书中,就如它们在本申请中单独记载那样。类似地,几个要素的列举,例如化合物1、2、3等,意在描述列出的所有要素以及每个单独的要素的集合,因此将其并入说明书中,就好像在本申请单独记载一样。此外,这些列出的要素的所有子集也并入说明书中,如同它们在本申请中单独记载一样。本申请中,术语“烷基”、“亚烷基”、“烯基”、“亚烯基”、“炔基”、“亚炔基”及其衍生物(例如烷氧基、亚烷基氧基等)具有本领域的其普通含义。为了更加确定:烷基为通式cnh2n+1的单价饱和脂族烃基,但在一些情况下仍可用于指定多价基团(例如亚烷基);烯基是类似于烷基但包含至少一个双键的单价脂族烃基;炔基是类似于烷基但包含至少一个三键的单价脂族烃基;亚烷基为通式-cnh2n-的二价饱和脂族烃基(也称为烷二基);亚烯基是类似于亚烷基但包含至少一个双键的二价脂族烃基;亚炔基是类似于亚烷基但包含至少一个三键的二价脂族烃基;烷基氧基或烷氧基是式-o-烷基的单价基团;亚烷基氧基是式-o-亚烷基的二价基团(例如亚烷基氧基为-o-ch2-ch2,其称为亚乙基氧基,其中包含连接在一起的两个或更多个亚乙基氧基基团的直链(即-o-ch2-ch2-]n-)可以称为聚乙二醇(peg)、聚环氧乙烷(peo)或聚氧乙烯(poe)链;烯氧基是式-o-烯基的一价基团;亚烯基氧基是式-o-亚烯基-的二价基团;炔基氧基是式-o-炔基的一价基团;和亚炔基氧基是式-o-亚炔基的二价基团。要指出的是,除非另有说明,否则上述基团的烃链可以是直链或支链的。此外,除非另有说明,否则这些基团可包含1至18个碳原子,更具体地1至12个碳原子、1至6个碳原子、1至3个碳原子或包含1或2个或1个碳原子或2个碳原子。本申请中,术语“环烷基”、“芳基”、“杂环烷基”和“杂芳基”具有本领域的普通含义。为了更加确定:芳基为单价芳族烃基,其在一个或多个环中排列的碳原子之间具有离域共轭π系统,最常见的是单键和双键交替的排列,其中环可以稠合(即共享两个环原子),例如萘,或通过共价键连接在一起,例如联苯,或通过允许环之间继续存在离域共轭π体系的基团(例如-c(=o)-、-nrr-)连接在一起,例如二苯甲酮;杂芳基为其中至少一个环碳原子被杂原子例如氮或氧替代的芳基,其中杂芳基的实例包括单环或稠合环,以及通过允许在环之间继续存在离域共轭π体系的基团(例如-c(=o)-、-nrr-)连接在一起的多个环,例如吲哚-5-羰基苯;环烷基为通式cnh2n-1的单价饱和脂族烃基,其中所述碳原子排列成一个或多个环(也称为环),其可以是螺合、稠合或桥联的。杂环烷基是其中至少一个碳原子被杂原子替代的环烷基。注意的是,术语“杂环”涵盖包括非芳族(即脂族)饱和环(即杂环烷基)或具有一个或多个双键和/或三键共价键的环(杂环烯基、杂环炔基和杂环烯炔基)以及杂芳基。要注意的是,除非另有说明,否则上述基团的一个或多个环可各自包含4个至8个环原子、优选5个或6个环原子。另外,除非另有说明,否则上述基团可优选地包含一个或多个环、优选1个或2个环、更优选单个环。杂芳基的实例包括噻吩基、呋喃基(furanyl)(呋喃基(furyl))、吡咯基、咪唑基、吡唑基,三唑基、四唑基、噁唑基、异噁唑基、噁二唑基、噻唑基、异噻唑基、噻二唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基、吲哚基、3h-吲哚基、吲哚满基、异吲哚基、吲嗪基、苯并噻吩基(benzothienyl)(苯并噻吩基(benzothiophenyl))、苯并呋喃基、异苯并呋喃基、二苯并呋喃基、吲唑基、苯并咪唑基、苯并噁唑基、苯并噻唑基、苯并三唑基、吡咯并吡啶基(例如吡咯并[3,2-b]吡啶基或吡咯并[3,2-c]吡啶基)、吡唑并吡啶基(例如吡唑并[1,5-a]吡啶基)、呋喃并吡啶基、嘌呤基、咪唑并吡嗪基(例如咪唑并[4,5]-b]吡嗪基)、喹啉基(quinolyl)(喹啉基(quinolinyl))、异喹啉基(isoquinolyl)(异喹啉基(isoquinolinyl))、喹诺酮基(quinolonyl)、异喹诺酮基(isoquinolonyl)、噌啉基、酞嗪基、喹唑啉基、喹喔啉基、4h-喹嗪基、萘啶基和蝶啶基咔唑基、吖啶基、菲啶基、吩嗪基、吩噻嗪基、苯并噁嗪基、四氢喹啉基、四氢异喹啉基和吡啶并[2,3-b]-l,4-恶嗪-3(4h)-酮。本申请中,术语“杂原子”是指氮、氧、硫(包括当在-so2-中时)、磷,优选氮或氧。术语“受试者”和“患者”在本申请中可互换使用,并且是指动物、优选哺乳动物、最优选人。在一个实施方案中,患者是成年人癌症(例如aml)患者。在一个实施方案中,患者小于60岁。在另一个实施方案中,患者为60岁或更大。在另一个实施方案中,aml患者是儿童癌症(例如aml)患者。本申请使用的遗传学、分子生物学、生物化学和核酸的术语和符号遵循本领域的标准论文和文本的术语和符号,例如greenandsambrook,molecularcloning:alaboratorymanual,4thedition,2012(coldspringharborlaboratorypress);ausubel等人,currentprotocolsinmolecularbiology(2001及其后更新);kornbergandbaker,dnareplication,secondedition(wuniversitysciencebooks,2005);lehninger,biochemistry,sixthedition(whfreeman&co(sd),newyork,2012);strachanandread,humanmoleculargenetics,secondedition(wiley-liss、newyork,1999);eckstein,editor,oligonucleotidesandanalogs:apracticalapproach(oxforduniversitypress,newyork,1991);gait,editor,oligonucleotidesynthesis:apracticalapproach(irlpress,oxford,1984)等。所有术语应以相关领域中确立的典型含义来理解。还预想到本申请公开的实施方案和特征的任何和所有组合与子组合。例如,本申请识别的2、3、4、5个或更多个基因的任意组合的表述可用于本申请所述的方法。除非本申请另外指出,否则本申请中数值范围的列举仅意在用作分别指代落入该范围内的每个单独值的简写方法,并且每个单独值并入说明书中就如同其在本申请中单独记载那样。范围内的值的所有子集也并入说明书中,就如同其在本申请中单独记载那样。本申请所述的研究中,表明与不良预后/存活相关的表达高水平hox-网络基因的aml细胞对杂环化合物莫立替尼敏感。还显示莫立替尼敏感的aml细胞富含aml标本(其具有某些特征,例如特定基因的过表达或低表达,具有某些细胞遗传或分子危险因素,例如正常核型(nk)、突变的npm1、flt3-itd和dnmt3a标本),并且富含具有高白血病干细胞(lsc)频率的标本。还表明表征为酪氨酸激酶人表皮生长因子受体2(her2/erbb2)的抑制剂的莫立替尼不靶向aml细胞中的该蛋白,并且提供有力证据以表明莫立替尼通过抑制线粒体活性/呼吸、更特别是通过抑制etc来诱导aml细胞凋亡,从而导致敏感的aml细胞中的ros产生增加。基于这些结果,开发了与莫立替尼结构相关的几种杂环化合物,并且显示抑制肿瘤细胞系oci-aml3和mll-af9的生长。ii.杂环化合物本申请说明书涉及结构上与莫立替尼及其化学上可接受的盐有关的杂环化合物例如在用于治疗癌症、例如白血病、包括aml中的用途,更特别地,下面描述了莫立替尼敏感的aml亚型。本申请所述的几种化合物是新颖的,因此本申请还涉及这些化合物或其药学上可接受的盐本身,即独立于它们的用途。杂环化合物的实例通过通式i表示:或其药学上可接受的盐,其中:x1表示-n=、-ch=或-o-;x2表示-ch=、-c(r2)=或共价键;x3表示-ch=、-c(r2)=或共价键;x4表示-o-、-c(r3)=、-n=或-s-;和x5表示共价键、-c(r3)=或-o-;条件是x2和x3之一为-c(r2)=并且x2和x3中的另一个为-ch=或共价键,并且条件是x2、x3和x5中的最多仅一个表示共价键;r2表示芳基c(r3)=c(h)-、杂芳基c(r3)=c(h)-、芳基n(r3)c(o)-、杂芳基n(r3)c(o)-、芳基环丙基-、杂芳基环丙基-、r3oc(o)c(h)=c(h)-、r3oc(o)-、芳基-c≡c-、杂芳基-c≡c-、芳基-、杂芳基-、芳基-ch(r3)-ch(r3)-或杂芳基-ch(r3)-ch(r3)-,其中芳基基团和杂芳基基团任选地被一个至三个r4基团取代,r4基团相同或不同;r3每次出现时独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基,烷基、烯基、炔基和环烷基任选地被-or6、-n(r6)2、-c(o)or6、-cn或-c(o)n(r6)2取代;r4每次出现时独立地表示-f、-cl、-br、-i、-sr3、-sor5、-s(o)2r5、-s(o)2n(r3)2、-三唑基、-cn、-c(o)or3、-c(o)r3、-no2、-c(o)n(r3)2、-or3、-c(r3)2oh、-n(r3)2、-n(r3)c(o)r3、-n(r3)c(o)or5、-oc(o)n(r3)2、-n3、-r3,r5每次出现时独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基,烷基、烯基、炔基和环烷基任选地被-or6、-n(r6)2、-c(o)or6、-cn或-c(o)n(r6)2取代;r6独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基;l1表示-chr3-o-、-ch2-nh-、-c(o)nh-、-c(o)-chr6、-cr6=cr6-、-ch2-s-、-ch2-或-ch2-o-ch2-;x6和x7独立地表示-cr3=或-n=;l2表示共价键、-c(o)-、-c(r3)(oh)-、-o-、-s-、-chr3-、-ch(r3)-s-或-ch(r3)-o-;m每次出现时独立地表示1至4的整数。p表示1至6的整数;和r1表示杂芳基、芳基、-n3、-oh、-oc(o)n(r7)2、-c(o)n(r7)2、-n(r7)2、-n(r7)c(o)r7、-n(r7)c(o)or8、-n(r7)c(o)-l3-or7或-n(r7)c(o)-l3-oc(o)n(r7)2,杂芳基和芳基任选地被一个或多个r9取代,r9相同或不同,其中:l3表示c1-c5亚烷基、c2-c5亚烯基、c2-c5亚炔基或c1-c4氟亚烷基,亚烷基、亚烯基和亚炔基任选地被一个或多个r9取代,r9相同或不同,r7独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基;烷基、烯基、炔基和环烷基任选地被一个或多个r9取代,r9相同或不同,或当两个r7基团连接至相同的氮原子时,两个r7基团与它们所连接的氮原子一起任选地形成5-7元杂环烷基,杂环烷基任选地包含一个或多个其它杂原子,其它杂原子独立地选自-o-、-n(r3)-、-s-、-s(o)-和-so2-,杂环烷基任选地被一个或多个r9取代,r9相同或不同,r8独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基;烷基、烯基、炔基和环烷基任选地被一个或多个r9取代,r9相同或不同,和r9独立地表示-c1-c6烷基、-c0-c6烷基-or11、-c3-c6环烷基、-c3-c6环烷基-or11、-c1-c6烷基-oc(o)r11、-c1-c6烷基-oc(o)n(r11)2、-c1-c6烷基-oc(o)n(r11)-l4-or11、-c0-c6烷基-c(o)or11、-c0-c6烷基-c(o)n(r11)2、-c1-c6烷基-n(r11)2、-c1-c6烷基-n(r11)c(o)r11、-c1-c6烷基-n(r11)c(o)-l4-n(r11)-c(o)r11、-c1-c6烷基-n(r11)s(o)2r10、-c1-c6烷基-n(r11)s(o)2-l4-n(r11)-c(o)or10、-si(c1-c5烷基)3、-c(o)-o-c1-c6烷基、任选地被r4取代的苯基、任选地被r4取代的苄基、任选地被r4取代的吡啶基或其中:l4表示c1-c5亚烷基、c2-c5亚烯基、c2-c5亚炔基或c1-c4氟亚烷基;和r10独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基,烷基、烯基、炔基和环烷基任选地被-or6、-n(r6)2、-c(o)or6、-cn或-c(o)n(r6)2取代;r11独立地表示-h、-c1-c5烷基、-c2-c5烯基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基,烷基、烯基、炔基和环烷基任选地被-or6、-n(r6)2、-c(o)or6、-cn或-c(o)n(r6)2取代,或当两个r11基团连接至相同的氮原子时,两个r11基团与它们所连接的氮原子一起任选地形成5-7元杂环烷基,杂环烷基任选地包含一个或多个其它杂原子,其它杂原子独立地选自-o-、-n(r3)-、-s-、-s(o)-和-so2-。根据一个实例,化合物具有式i,其中r5、r8和r10不是-h。本申请中,式i中包含的以下基团:(其为芳环),在本申请中可以称为基团“z”。从上述将会明显看出,式ii中,x2、x3和x5可各自表示共价键,条件是x2、x3和x5中的最多仅一个表示共价键。换句话说,式ⅱ的基团是五元或六元的芳族环(术语芳族也包括杂芳族)。此外,上述通式化学式包括以下条件:x2和x3之一为-c(a)=并且x2和x3中的另一个为-ch=或共价键。这意指当x3表示共价键时,则x2和x5不是共价键并且x2必须是-c(r2)=。换句话说,当x3表示共价键时,式ii对应于下式iii:其中x5为-c(r3)=或-o-。类似地,当x2表示共价键时,x3和x5不是共价键并且x3必须是-c(r2)=,因此式ii也对应于其中x5为-c(r3)=或-o-的式iii。因此,在一些实例中,x2和x3之一表示共价键,x2和x3中的另一个表示-c(r2)=并且x5表示-c(r3)=或-o-,同时x1和x4如本申请所定义。当x5表示共价键时,x2或x3可为共价键,其意指其中之一为-c(r2)=并且另一个为-ch=。换句话说,当x5表示共价键时,式ii对应于下式iv和iv’:当x2为-c(r2)=并且x3为-ch=时得到;和当x2为-ch=并且x3为-c(r2)=时得到。还包括式ii中的x2、x3和x5都不是共价键的化合物。在此情况下,x2和x3之一为-c(r2)=并且另一个为-ch=,同时x5为-c(r3)=或-o-并且x1和x4如上定义。式ii的优选的这种基团包括:在一些实施方案中,x3为-ch=。在替代的实施方案中,x3为共价键。还在其它实施方案中,x3为-c(r2)=。在一些其它实施方案中,x2为-ch=。在替代的实施方案中,x2为共价键。还在其它实施方案中,x2为-c(r2)=。在进一步的实施方案中,x1为-n=或-ch=。在其它实施方案中,x1为-n=。在替代的实施方案中,x1为-ch=。在其它实施方案中,x1为-o-。在实施方案中,x4为-o-。在替代的实施方案中,x4为-c(r3)=,例如,其中r3为h(即,x4是-ch=)。在其它替代的实施方案中,x4为-n=。还在其它替代的实施方案中,x4为-s-。在实施方案中,x5为共价键。在替代的实施方案中,x5为-c(r3)=,例如,其中r3为h(即,x5是-ch=)。在其它替代的实施方案中,x5为-o-。在一些实施方案中,式ii的基团中,x1和x3各自为-ch=,x2为-c(r2)=并且x4和x5各自为-c(r3)=,其中,在进一步的实施方案中,r3优选地表示h。在其它实施方案中,式ii的基团中,x1和x3各自表示-ch=,x2表示-c(r2)=,x4为-n=和x5表示-c(r3)=,其中,在进一步的实施方案中,r3优选表示h。在优选的实施方案中,式iii的基团中,x2和x3之一为共价键并且另一个为-c(r2)=。在优选的这种实施方案中,x1表示-n=,x4表示-o-或-s-、优选-o-并且x5表示-c(r3)=,其中,在进一步的实施方案中,r3优选表示h。如上所述,r2表示芳基c(r3)=c(h)-、杂芳基c(r3)=c(h)-、芳基n(r3)c(o)-、杂芳基n(r3)c(o)-、芳基环丙基-、杂芳基环丙基-、r3oc(o)c(h)=c(h)-、r3oc(o)-、芳基-c≡c-、杂芳基-c≡c-、芳基-、杂芳基-、芳基-ch(r3)-ch(r3)-或杂芳基-ch(r3)-ch(r3)-。在优选的实施方案中,r2表示芳基c(r3)=c(h)-、杂芳基c(r3)=c(h)-、芳基n(r3)c(o)-、芳基环丙基-、r3oc(o)c(h)=c(h)-、r3oc(o)-、芳基-、杂芳基-或芳基-ch(r3)-ch(r3)-。在更优选的实施方案中,r2表示芳基c(r3)=c(h)-或杂芳基,更优选芳基c(r3)=c(h)-。在优选的实施方案中,r2中的芳基基团为苯基或萘基,更优选苯基。在优选的实施方案中,r2中的杂芳基选自:(其中n表示0至3的整数,x8表示-nh-、-o-或-s-、优选-nh-,x9为-n=或-ch=、优选-ch=)、吡啶基、嘧啶基、噻吩基、异噁唑基、喹啉基、异喹啉基、吲哚基、吲哚满基、苯并[b]噻吩基、苯并咪唑基、苯并噁唑基、苯并呋喃基、异苯并呋喃基和苯并噻唑基,包括其任何互变异构体。优选地,杂芳基基团包括或吡啶基,更优选如上所述,所有的这些芳基和杂芳基基团任选地被一个至三个r4基团取代,r4基团相同或不同。r2中,芳基c(r3)=c(h)-的优选实施方案包括r2中,杂芳基c(r3)=c(h)-的优选实施方案包括r2中,芳基环丙基-的优选实施方案包括r2中,芳基n(r3)c(o)-的优选实施方案包括r2中,r3oc(o)-的优选实施方案包括meoc(o)-。r2中,芳基-ch(r3)-ch(r3)-的优选实施方案包括r2中,芳基的优选实施方案包括r2中,杂芳基的优选实施方案包括其中n表示0至3的整数,x8表示-nh-、-o-或-s-、优选-nh-,x9为-n=或-ch=、优选-ch=。在r2的任何和所有的上述实施方案中,r3优选地表示h或ch3,更优选h。在r2的任何和所有的上述实施方案中,n表示0至3的整数,r4如上定义。换句话说,r2中包含的芳基和/或杂芳基任选地被一个至三个(优选一个至两个)r4基团取代,r4基团相同或不同、优选不同。换句话说,其中存在r4的上式中,n为0至3,优选n为0至2。在实施方案中,这些基团是未取代的(n=0)。在替代的实施方案中,这些基团被一个至三个(即,n为1至3)、优选一个至两个(n为1或2)r4基团取代,r4基团相同或不同、优选不同。在实施方案中,这些基团被一个r4基团(n=1)取代。在实施方案中,这些基团被两个r4基团(n=2)取代,r4基团相同或不同、优选不同。在实施方案中,这些基团被三个r4基团(n=3)取代,r4基团相同或不同、优选不同。任选地取代r2中包含的芳基和/或杂芳基的r4基团可以位于任何位置。包含其中一个r4基团优选位于2号位置的6元芳基和杂芳基基团的r2基团的实例包括:●芳基c(r3)=c(h)-优选为和●杂芳基c(r3)=c(h)-,更优选包含其中一个r4基团优选位于3号位置的6元芳基和杂芳基基团的r2基团的实例包括芳基c(r3)=c(h)-,优选包含其中一个r4基团优选位于4号位置的6元芳基和杂芳基基团的r2基团的实例包括:●芳基c(r3)=c(h)-,优选●芳基环丙基-,优选和●芳基-,优选此外,当所述一个r4基团取代基团时,其优选位于5或6号、优选5号位置。优选在5或6号位取代的这类基团为其中x8优选-nh-。或者,当有两个r4基团(相同或不同)(优选不同的、取代6元芳基和杂芳基、优选芳基、优选苯基的r4基团)时,它们优选位于2和4号位、3和4号位或2和6号位,更优选位于2和4号位。包含两个r4基团因此位于其中的6元芳基基团的r2基团的实例包括芳基c(r3)=c(h)-和芳基n(r3)c(o)-,优选芳基c(r3)=c(h)-,其中芳基为苯基。此外,当两个r4基团取代基团时,它们优选位于5和7号位。优选在5和7号位取代的优选的这种基团为其中x8优选-nh-。或者,当有三个r4基团(相同或不同)(优选相同的、取代6元芳基和杂芳基、优选芳基、优选苯基的r4基团)时,它们优选位于3、4和5号位。包含三个r4基团因此位于其中的6元芳基基团的r2基团的实例包括芳基c(r3)=c(h)-,其中芳基为苯基。如上将指出的,r4的定义在许多情况下是指r3基团。优选的r3基团(当在r4中时)包括-h、-c1-c5烷基、-c2-c5炔基或-c1-c4氟烷基。在这种实施方案中,优选的c1-c5烷基为甲基。此外,优选的c2-c5炔基基团包括-c≡ch和-ch2-c≡ch。此外,优选的-c1-c4氟烷基为-cf3。在优选的实施方案中,r4表示-f、-cl、-br、-i、-s(o)2-c1-c5烷基、-三唑基、-cn、-c(o)or3、-no2、-c(o)n(r3)2、-or3、-c(r3)2oh、-n(r3)2、-n3、-r3、在更优选的实施方案中,r4表示-f、-br、-cl、-cf3、-s(o)2me、-三唑基、-cn、-no2、-ocf3、-ome、-c(o)ome、-ch2oh、-oh、-c(o)nh2、-nh2、-n3、-c(o)nhch2c≡ch、-c≡ch,最优选的r4基团包括-f、-br、-cl、-cf3、-s(o)2me、-cn、-no2、-oh、-ome、-ocf3、-n3、ch2oh或-c(o)ome。当仅有一个r4基团时,r4优选地表示f、cl、br、cn、co2me、no2、oh、ocf3、ch2oh或cf3,优选-f、-cl、-br、-cn、-co2me、-no2、-ocf3、-ch2oh或-cf3,更优选-f、-br、-cl、-cf3、co2me、-no2、-cn、-ocf3和-ome,还更优选-f、-br、-cf3、co2me、-no2和-cn,甚至更优选-f、co2me、-br、-no2和-cn,并且最优选f或no2。当有两个r4基团时,r4在每次出现时优选为独立地表示-f、-br、-cl、-cf3、-s(o)2me、-no2、-ocf3、-ome、-c(o)ome、-nh2、-n3、或-三唑基,优选f、cl、br、so2me、cn、co2me、no2、ome、ocf3、n3或cf3,更优选f、cl、br、cn、co2me、no2、ocf3或cf3,还更优选-f、-br、-cl、-cf3、cn、no2、ocf3或-no2,并且最优选f、cn、no2、ocf3或cf3。优选的r4对包括其中两个r4基团之一为f或-cf3的那些。优选的r4对包括cl/cl、f/n3、f/br、f/cl、f/nh2、f/cn、f/cf3、f/s(o)2me、f/no2、f/ocf3、f/ome、f/c(o)ome、f/f、f/三唑基、f/n3、cf3/cf3/no2或no2/优选f/br、f/cl、f/cn、f/cf3、f/s(o)2me、f/no2、f/ocf3、f/ome、f/c(o)ome、f/n3、f/no2和f/f,更优选f/f、f/cl、f/br、f/cn、f/co2me、f/no2、f/ocf3或f/cf3,并且最优选f/cn、f/no2、f/ocf3或f/cf3。当有三个r4基团时,所有r4优选为表示-f。本申请中,术语“三唑基”表示三唑的单价基团,其中三唑可以是其任何异构体和互变异构体。三唑在本领域中定义为分子式c2h3n3的杂环化合物,其具有两个碳原子和三个氮原子的五元环。有两组异构体,它们的三个氮原子的相对位置不同。这些各自具有两个互变异构体,其中氮具有的与其键合的氢不同。因此,术语“三唑”包括:本申请中,三唑基可以通过任何可用的环原子连接至分子的其余部分。优选的三唑基基团包括1,2,3-三唑-1-基、1,2,3-三唑-2-基和1,2,4-三唑-1-基。最优选的三唑基(在r4中)包括1,2,3-三唑-2-基。优选的基团包括其中r3为h、p为2和/或r6为h的那些。的优选实施方案因此包括在(如在r4中可见的)的优选的实施方案中,其中x6和x7两者都为-ch=;l2为共价键,m为1至4、优选4,和/或r1为杂芳基、更优选如本申请定义的三唑基基团。优选的三唑基基团包括1,2,4-三唑-1-基和1,2,3-三唑-1-基。最优选的基团包括:优选在式i的优选的实施方案中,l1表示-chr3-o-、-ch2-nh-、-c(o)nh-、-cr6=cr6-、-ch2-s-或-ch2-,优选-chr3-o-、-ch2-nh-或-cr6=cr6-,并且最优选-chr3-o-。在优选的实施方案中,在l1中,r3为h。在优选的实施方案中,在l1中,r6为h。在式i的优选的实施方案中,x6和x7两者都表示-cr3=,或x6和x7之一表示-cr3=并且另一个表示-nh=,优选地x6和x7两者都表示-cr3=。在优选的实施方案中,在x6和x7中,r3为h。在式i的优选的实施方案中,l2表示共价键、-c(o)-、-c(r3)(oh)-、-o-、-s-或-chr3-o-,在更优选的实施方案中,l2优选地表示共价键、-c(o)-、-c(r3)(oh)-或-s-,最优选共价键或-s-。在优选的实施方案中,在l2中,r3为h。在优选的实施方案中,m表示2、3或4,优选3或4,并且更优选4。在式i的优选的实施方案中,r1表示杂芳基、-n3、-oh、-oc(o)n(r7)2、-c(o)n(r7)2、-n(r7)c(o)r7、-n(r7)c(o)or8或-n(r7)c(o)-l3-oc(o)n(r7)2,优选杂芳基、-n(r7)c(o)r7或-n(r7)c(o)-l3-oc(o)n(r7)2,并且更优选杂芳基,杂芳基任选地被一个或多个r9取代,r9相同或不同,r7、r8、r9和l3如上所定义。在优选的实施方案中,r7为-h或-c1-c5烷基,烷基任选地被一个或多个r9取代,r9相同或不同,或当两个r7基团连接至相同的氮原子时,两个r7基团与它们所连接的氮原子一起任选地形成5-7元杂环烷基,杂环烷基包含一个或多个其它杂原子基团或独立地选自-o-、-n(r3)-、-s-、-s(o)-和-so2-的含杂原子基团,杂环烷基任选地被一个或多个r9取代,r9相同或不同。在优选的实施方案中,r7中的烷基为甲基、乙基或丁基(其更优选叔丁基)。在优选的实施方案中,任选地当两个r7基团连接至相同的氮原子时形成的杂环烷基为6元杂环烷基。在实施方案中,杂环烷基包含一个或多个、优选一个其它杂原子。在优选的实施方案中,该杂原子为氧。在最优选的实施方案中,杂环烷基为4-吗啉基。如上所述,杂环烷基任选地被一个或多个r9取代,r9相同或不同。在优选的实施方案中,杂环烷基为未取代的。如上所述,r7中的烷基、烯基、炔基、环烷基、亚烷基和杂环烷基任选地被一个或多个r9取代,r9相同或不同(并且其如上所定义)。在优选的实施方案中,这些基团为未取代的。在替代的实施方案中,r1中的这些基团优选被一个或两个r9取代,更优选被一个r9取代。在这种具体实施方案中,当r9取代r7中的烷基、烯基、炔基、环烷基或亚烷基基团、优选烷基时表示-oh。在优选的实施方案中,r8为-h或-c1-c5烷基,烷基任选地被一个或多个r9取代,r9相同或不同。更优选地,r8中的烷基为甲基、乙基或丁基(其更优选叔丁基)。如上所述,r8中的烷基、烯基、炔基、环烷基、亚烷基和杂环烷基任选地被一个或多个r9取代,r9相同或不同(并且其如上所定义)。在优选的实施方案中,这些基团为未取代的。在替代的实施方案中,r1中的这些基团优选被一个或两个r9取代,更优选被一个r9取代。在这种具体实施方案中,当r9取代r8中的烷基、烯基、炔基、环烷基或亚烷基基团、优选烷基时表示-oh。在优选的实施方案中,l3表示c1-c5亚烷基、优选亚乙基。如上所述,l3中的亚烷基、亚烯基和亚炔基任选地被一个或多个r9取代,r9相同或不同(并且其如上所定义)。在优选的实施方案中,这些基团为未取代的。在优选的实施方案中,r1中的杂芳基为三唑基、咪唑基、吡唑基、吡啶基、噻唑基、嘧啶基、四唑基、吡嗪基、哒嗪基、噁二唑基或噻二唑基,优选三唑基、咪唑基、吡啶基、噻唑基、嘧啶基、哒嗪基或四唑基,更优选三唑基、哒嗪基或咪唑基,并且最优选哒嗪基或三唑基,其各自任选地被一个或多个r9取代,r9相同或不同。在实施方案中,r1中的三唑基为1,2-3-三唑基或1,2-4-三唑基,最优选1,2,3-三唑-1-基或1,2,4-三唑-1-基,其如上所述任选地被一个或多个r9取代,r9相同或不同。本申请中,术语“咪唑基”表示咪唑及其任何互变异构体的单价基团。咪唑基可以通过任何其可用的环原子连接至分子的其余部分。在一些实施方案中,r1中的咪唑基为咪唑-1-基(即,通过其一个氮原子连接),其如上所述任选地被一个或多个r9取代,r9相同或不同。本申请中,术语“吡唑基”表示吡唑及其任何互变异构体的单价基团。吡唑基可以通过任何其可用的环原子连接至分子的其余部分。在实施方案中,r1中的吡唑基为吡唑-1-基(即,通过其一个氮原子连接),其如上所述任选地被一个或多个r9取代,r9相同或不同。本申请中,为同义的术语“吡啶基(pyridyl)”和“吡啶基(pyridinyl)”都表示吡啶的单价基团。吡啶基可以通过任何其可用的环原子连接至分子的其余部分。在实施方案中,r1中的吡啶基为吡啶-3-基或吡啶-4-基,其如上所述任选地被一个或多个r9取代,r9相同或不同。本申请中,术语“噻唑基”表示噻唑的单价基团。噻唑基可以通过任何其可用的环原子连接至分子的其余部分。在实施方案中,r1中的噻唑基为噻唑-2-基,其如上所述任选地被一个或多个r9取代,r9相同或不同。本申请中,术语“嘧啶基”表示嘧啶的单价基团。嘧啶基可以通过任何其可用的环原子连接至分子的其余部分。在实施方案中,r1中的嘧啶基为嘧啶-5-基,其如上所述任选地被一个或多个r9取代,r9相同或不同。本申请中,术语“四唑基”表示四唑及其任何互变异构体的单价基团。四唑基可以通过任何其可用的环原子连接至分子的其余部分。在一些实施方案中,r1中的四唑基为1,2,3,4-四唑-1-基或1,2,3,4-四唑-2-基,其如上所述任选地被一个或多个r9取代,r9相同或不同。本申请中,术语“吡嗪基”表示吡嗪的单价基团。吡嗪基可以通过任何其可用的环原子连接至分子的其余部分。本申请中,术语“哒嗪基”表示哒嗪的单价基团。哒嗪基可以通过任何其可用的环原子连接至分子的其余部分。本申请中,术语“噁二唑基”表示噁二唑及其任何互变异构体的单价基团。噁二唑在本领域中定义为分子式c2h2n2o的杂环化合物。噁二唑有四种异构体:噁二唑基可以通过任何其可用的环原子连接至分子的其余部分。在一些实施方案中,r1中的噁二唑基为1,2,4-噁二唑基(其实例是通过两个氮原子之间的碳连接),其如上所述任选地被一个或多个r9取代,r9相同或不同。本申请中,术语“噻二唑基”表示噻二唑及其任何互变异构体的单价基团。噻二唑在本领域中定义为分子式c2h2n2s的杂环化合物。噻二唑有四种异构体:噻二唑可以通过任何其可用的环原子连接至分子的其余部分。在一些实施方案中,r1中的噻二唑为1,2,4-噻二唑,其如上所述任选地被一个或多个r9取代,r9相同或不同。在更优选的实施方案中,r1中的杂芳基为1,2,3-三唑基、1,2,4-三唑基、咪唑基、吡唑基、吡啶基、哒嗪基、噻唑基、嘧啶基或1,2,3,4-四唑基,优选咪唑基、哒嗪基或1,2,3-三唑基,更优选哒嗪基或1,2,3-三唑基。还在更优选的实施方案中,r1中的杂芳基为1,2,3-三唑-1-基、1,2,4-三唑基、咪唑-1-基、吡唑-1-基、吡啶-3-基、吡啶-4-基、哒嗪-3-基、噻唑-2-基、嘧啶-5-基、1,2,3,4-四唑-1-基或1,2,3,4-四唑-2-基,优选1,3-咪唑-1-基、哒嗪-3-基或1,2,3-三唑-1-基,更优选哒嗪-3-基或1,2,3-三唑-1-基。如上所述,r1中的芳基和杂芳基任选地被一个或多个r9取代,r9相同或不同(并且其如上所定义)。在优选的实施方案中,r1中的芳基和杂芳基为未取代的。在替代的实施方案中,r1中的芳基和杂芳基优选被一个或两个r9取代,更优选被一个r9取代。在一些实施方案中,r9(特别是当取代r1中的芳基和杂芳基时)为-c1-c6烷基、-c0-c6烷基-or11、-c3-c6环烷基-or11、-c1-c6烷基-oc(o)n(r11)2、-c1-c6烷基-oc(o)n(r11)-l4-or11、-c0-c6烷基-c(o)or11、-c0-c6烷基-c(o)n(r11)2、-c1-c6烷基-n(r11)2、-c1-c6烷基-n(r11)c(o)r11、-c1-c6烷基-n(r11)s(o)2r10或si(c1-c5烷基)3,优选-c1-c6烷基-oc(o)n(r11)2、-c1-c6烷基-oc(o)n(r11)-l4-or11、-c0-c6烷基-c(o)n(r11)2、-c1-c6烷基-n(r11)2、-c1-c6烷基-n(r11)s(o)2r10或si(c1-c5烷基)3,更优选-c1-c6烷基-oc(o)n(r11)2、-c1-c6烷基-oc(o)n(r11)-l4-or11、-c1-c6烷基-n(r11)2或si(c1-c5烷基)3,并且最优选si(c1-c5烷基)3。在一些实施方案中,r9中的-c1-c6烷基部分为-c1-c4,优选-c1-c2,更优选-c2烷基部分;和/或-c0-c6烷基部分为-c0-c4,优选-c0-c2,更优选-c0(即,烷基部分不存在)或-c2烷基部分。如上述将指出的,r9的定义(通常和优选)是指基团r10、r11和l4。在r9中,r10、r11和l4基团如上定义。在更优选的实施方案中,r11为h、-c1-c5烷基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基,或两个r11基团与它们所连接的氮原子一起任选地形成5-7元杂环烷基,杂环烷基任选地包含一个或多个其它杂原子,其它杂原子独立地选自-o-、-n(r3)-、-s-、s(o)和s(o)2。在一些实施方案中,r11中的-c1-c5烷基为甲基、乙基、丙基(优选异丙基)、丁基(优选地叔丁基)或苯基。在其它实施方案中,r11中的-c2-c5炔基为-ch2ch2-c≡ch或-ch2c≡ch。在实施方案中,r11中的-c1-c4氟烷基为-cf3。在实施方案中,r11中的c3-c7环烷基为环戊基。在进一步的实施方案中,r11中的烷基和炔基基团为未取代的。在实施方案中,任选地当两个r11基团连接至相同的氮原子时形成的杂环烷基为6元杂环烷基。在实施方案中,杂环烷基包含一个或多个、优选一个其它杂原子。优选地,该杂原子为-so2。在最优选的实施方案中,杂环烷基为在其它优选的实施方案中,r10为-c1-c5烷基、-c2-c5炔基、-c1-c4氟烷基或-c3-c7环烷基。在一些实施方案中,r10中的-c1-c5烷基为甲基、乙基、丙基(优选异丙基)、丁基(优选地叔丁基)或苯基。在其它实施方案中,r10中的-c2-c5炔基为-ch2ch2-c≡ch或-ch2c≡ch。在实施方案中,r10中的-c1-c4氟烷基为-cf3。在实施方案中,r10中的c3-c7环烷基为环戊基。在进一步的实施方案中,r10中的烷基和炔基基团为未取代的。在其它实施方案中,l4表示c1-c5亚烷基、优选亚乙基。在实施方案中,在r9中的c1-c6烷基-or11中,r11表示h。在实施方案中,在r9中的-c3-c6环烷基-or11中,r11表示h。在实施方案中,在r9中的-c1-c6烷基-oc(o)n(r11)2中,两个r11基团都表示甲基,或一个r11基团表示h并且另一个表示丙基(优选异丙基)、丁基(优选叔丁基)或环戊基。在实施方案中,在r9中的-c1-c6烷基-oc(o)n(r11)-l4-or11中,n(r11)表示nh,l4表示亚乙基和/或or11表示oh。在实施方案中,在r9中的-c0-c6烷基-c(o)or11中,r11表示乙基或叔丁基。在实施方案中,在r9中的-c0-c6烷基-c(o)n(r11)2中,一个r11表示h并且另一个表示炔基、优选-ch2-c≡ch。在实施方案中,在r9中的-c1-c6烷基-n(r11)2中,两个r11基团都表示h,或一个r11基团表示h并且另一个表示甲基,或两个r11与它们所连接的氮原子一起形成在实施方案中,在r9中的-c1-c6烷基-n(r11)c(o)r11中,n(r11)表示nh和/或c(o)r11表示c(o)-炔烃,优选c(o)-ch2ch2-c≡ch。在实施方案中,在r9中的-c1-c6烷基-n(r11)s(o)2r10中,n(r11)表示nh和/或s(o)2r10表示s(o)2me或s(o)2cf3。在最优选的实施方案中,r9(特别是取代r1中的芳基或杂芳基时)表示me、-sime3、-ch2oh、-(ch2)2oh、-(ch2)3oh、-(ch2)4oh、-ch2nh2、-(ch2)2nh2、-ch2nhme、-c(o)oet、-(ch2)2o-c(o)nme2、-(ch2)2nh-so2-me、-(ch2)2nh-so2-cf3、-(ch2)2o-c(o)nh-(ch2)2ome、-(ch2)2o-c(o)nh-异丙基、-(ch2)2o-c(o)nh-环戊基、-(ch2)4-c(o)-nh-ch2-c≡ch、-(ch2)2nhc(o)(ch2)2-c≡ch或在优选的实施方案中,r1中的杂芳基为:优选更优选其中r13、r14和r15独立地为h或r9,其中r9如本申请所定义(包括一般定义及其优选实施方案)。总得说来,在更优选的实施方案中,r1表示-n3、-c(o)-n(h)-ch2-c≡ch、-oh、-oc(o)-(n-吗啉)、-o-c(o)-nme2、-o-c(o)-net2、-n(h)c(o)h、-n(h)-c(o)o-叔丁基;-n(h)-c(o)-(ch2)2oh、-n(h)-c(o)-(ch2)2oc(o)nme2、优选更优选其中r13、r14和r15独立地为h或r9,其中r9如本申请所定义(包括一般定义及其优选实施方案)。在优选的实施方案中,r13表示h、me、sime3、-ch2oh、-(ch2)2oh、-(ch2)3oh、-(ch2)4oh、-c(o)oet、-ch2nhme、-ch2nh2、-(ch2)2nh2、-(ch2)4-c(o)-nh-c≡ch、-(ch2)2nhc(o)(ch2)2-c≡ch、-(ch2)2oconme2、-(ch2)2o-c(o)nh-(ch2)2ome、-(ch2)2o-c(o)nh-异丙基、-(ch2)2o-c(o)nh-叔丁基或-(ch2)2o-c(o)nh-环戊基,优选h、-(ch2)2nhc(o)(ch2)2-c≡ch、-(ch2)2oconme2、-(ch2)2o-c(o)nh-异丙基、-(ch2)2o-c(o)nh-环戊基、-(ch2)2o-c(o)nh-(ch2)2ome、或-sime3,更优选h或-sime3,并且最优选h。在优选的实施方案中,r14表示h、-c(o)oet、-ch2oh、-(ch2)2oh或优选h。在优选的实施方案中,r15表示h、-(ch2)2oh、-(ch2)2nh2、-(ch2)2oc(o)-nme2、-(ch2)2nh-so2me或-(ch2)2nh-so2cf3,优选h、-(ch2)2oconme2、-(ch2)2nh-so2me或-(ch2)2nh-so2cf3,更优选h或-(ch2)2oconme2,并且最优选h。在更优选的实施方案中,特别当r1为时:-r13和r14两者都为h;-r13为r9,其中r9如上述权利要求中任一项所定义,并且r14为h;-r13和r14两者都为-c(o)oet;-r13和r14两者都为-ch2oh;或-r13为h,并且r14为最优选r13和r14两者都为h。在其它优选的实施方案中,特别当r1为时,r13和r14两者都为h,并且r15为h、-(ch2)2oh、-(ch2)2nh2、-(ch2)2oc(o)-nme2、-(ch2)2nh-so2me或-(ch2)2nh-so2cf3,优选h。在其它优选的实施方案中,特别当r1为时,r13为h。在其它优选的实施方案中,特别当r1为时,r13、r14和r15各自为h。在其它优选的实施方案中,特别当r1为时,r13为h或甲基。在其它优选的实施方案中,特别当r1为时,r13为h或甲基并且r14为h。在其它优选的实施方案中,特别当r1为时,r13和r14各自为h。在其它优选的实施方案中,特别当r1为时,r13、r14和r15各自为h。在式i化合物的一些实施方案中:x1为-n=,x2为共价键,x3为-c(r2)=,x4为-o-或-s-,并且x5为-c(r3)=,其中r2表示芳基c(r3)=c(h)-、杂芳基c(r3)=c(h)-、杂芳基-,或其中:芳基基团和杂芳基基团任选地被一个至三个r4基团取代,r4基团相同或不同,n表示0至3的整数;x8表示-nh-或-o-;和x9为-ch=;r3独立地表示-h、-c1-c5烷基、-c1-c4氟烷基或-c3-c7环烷基,烷基任选地被-or6取代;r4独立地表示-f、-cl、-br、-i、-s(o)2r5、-cn、-c(o)or3、-no2、-or3、-c(r3)2oh、-n3或-r3;r5独立地表示-c1-c5烷基、-c1-c4氟烷基或-c3-c7环烷基,烷基任选地被-or6取代;r6为-h;l1表示-chr3-o-、-ch2-nh-、-ch=ch-或-ch2-o-ch2-;l2表示共价键、-c(o)-、-ch(oh)-或-s-;x6和x7独立地表示-ch=或-n=;m为1至4的整数;和r1表示杂芳基或-n(r7)c(o)r7,杂芳基任选地被一个或多个r9取代,r9相同或不同,其中:r7独立地表示-c1-c5烷基;r9独立地表示-c1-c6烷基、-c0-c6烷基-or11、-c1-c6烷基-oc(o)n(r11)2、-c0-c6烷基-c(o)n(r11)2、-c1-c6烷基-n(r11)s(o)2r10或-si(c1-c5烷基)3;r10独立地表示-c1-c5烷基、-c2-c5炔基或-c3-c7环烷基,并且烷基、炔基和环烷基任选地被-or6取代;r11独立地表示-c1-c5烷基、-c2-c5炔基或-c3-c7环烷基,并且烷基、炔基和环烷基任选地被-or6取代,或当两个r11基团连接至相同的氮原子时,则两个r11基团与它们所连接的氮原子一起任选地形成5至7元杂环烷基,杂环烷基任选地包含一个或多个其它杂原子,其它杂原子独立地选自-o-、-n(r3)-、-s-、-s(o)-和-so2-。在另外的实施方案中:表示其中r2表示:r3oc(o)-、和r1表示:oh、-oc(o)n(r7)2、-n(r7)c(o)r7、-n(r7)c(o)or8、-n(r7)c(o)-l3-or7或-n(r7)c(o)-l3-oc(o)n(r7)2,其中r13,r14和r15独立地为h或r9。在优选的实施方案中:表示其中x1为-n=,x4为-o-或-s-,并且x5为-ch=;其中r2表示:r3oc(o)-、其中r3为h或-c1-c3烷基,并且n为0或n为1至3和r4每次出现时独立地表示:-f、cl、br、i、-sr3、-sor5、-s(o)2r5、-s(o)2n(r3)2、cn、-c(o)or3、no2、-c(o)nh2、-or3、-c(r3)2oh、-c(o)nh-ch2-c≡ch,oh、ome、ocf3、ch2oh、-n(r3)2、n3和-r3;--其中x6和x7各自表示-ch=,l2为共价键,m为4,并且r1为其中r13和r14各自为h;或-其中r3为h,p为2和r6为h;l1表示-ch2-o-、-ch2-nh-、-c(o)nh-、-ch=ch-、-ch2-s-或-ch2-;l2表示共价键、-c(o)-、-ch(oh)-、-s-或-ch2-o-;x6和x7各自表示-ch=,或x6和x7之一表示-ch=并且另一个表示-n=;m为1至4的整数;和r1表示oh、-oc(o)n(r7)2、-n(r7)c(o)r7、-n(r7)c(o)or8、-n(r7)c(o)-l3-or7或-n(r7)c(o)-l3-oc(o)n(r7)2,其中:r13、r14和r15独立地为h、甲基、-c0-c6烷基-or11、-c3-c6环烷基-or11、-c0-c6烷基-c(o)or11、-c1-c6烷基-oc(o)n(r11)2、-c1-c6烷基-oc(o)n(r11)-l4-or11、-c0-c6烷基-c(o)n(r11)2、-c1-c6烷基-n(r11)2、-c1-c6烷基-n(r11)c(o)r11、-c1-c6烷基-n(r11)s(o)2r10、-sime3,或其中r3为-h、-c1-c5烷基或-c1-c4氟烷基,p为1至6的整数;l3表示c1-c5亚烷基;r7独立地表示-h或-c1-c5烷基或两个r7基团与它们所连接的氮原子一起任选地形成杂环烷基,其为r8表示-c1-c5烷基;l4表示c1-c5亚烷基;r10表示-c1-c5烷基、-c2-c5炔基或-c3-c7环烷基;和r11为-h、-c1-c5烷基、-c2-c5炔基或-c3-c7环烷基,或两个r11基团与它们所连接的氮原子一起任选地形成5-7元杂环烷基,其为在更优选的实施方案中:表示其中x1为-n=,x4为-o-或-s-,并且x5为-ch=;其中r2表示:r3oc(o)-或其中r3为h或甲基,x8为-nh-、-o-或-s-,n为0或n为1至3和r4每次出现时独立地表示:-f、cl、br、-s(o)2me、cn、-co2me、no2、-c(o)nh2、-c(o)nh-ch2-c≡ch、-oh、-ome、-ocf3、-ch2oh、-nh2、n3、cf3、-c≡ch;--其中x6和x7各自表示-ch=,l2为共价键,m为4,并且r1为其中r13和r14各自为h;或-其中r3为h,p为2和r6为h;l1表示-ch2-o-、-ch2-nh-、-c(o)nh-、-ch=ch-、-ch2-s-或-ch2-;x6和x7各自表示-ch=,或x6和x7之一表示-ch=并且另一个为-n=;l2表示共价键并且m为3或4,或l2表示-c(o)-、-ch(oh)-或-s-并且m为3,或l2表示-ch2-o-并且m为2;和r1表示-其中r14为h,并且r13选自○h、甲基,○-c0-c6烷基-or11,其中c0-c6烷基为乙基或丁基并且r11为h,○-c3-c6环烷基-or11,其中c3-c6环烷基为环戊基和r11为h,○-c0-c6烷基-c(o)or11,其中c0-c6烷基为c0烷基(即,不存在)和r11为乙基,○-c1-c6烷基-oc(o)n(r11)2,其中c1-c6烷基为乙基,并且两个r11基团都为甲基,或一个r11基团为异丙基或环戊基并且另一个r11基团为h,○-c1-c6烷基-oc(o)n(r11)-l4-or11,其中c1-c6烷基为乙基,n(r11)为nh,l4为乙基,并且-or11为-ome,○-c0-c6烷基-c(o)n(r11)2,其中c0-c6烷基为丁基,并且一个r11基团为-ch2-c≡ch,另一个r11基团为h,○-c1-c6烷基-n(r11)2,其中c1-c6烷基为甲基,并且两个r11都为h,或一个r11为h并且另一个r11为甲基,或两个r11基团与它们所连接的氮原子一起形成5-7元杂环烷基,其为○-c1-c6烷基-n(r11)c(o)r11,其中c1-c6烷基为乙基,n(r11)为nh,并且c(o)r11为c(o)-ch2-c≡ch,○-sime3,和○其中r3为-h并且p为2;或r13和r14两者都为co2et或ch2oh;或r13为h,并且r14为c1-c6烷基-n(r11)2,其中c1-c6烷基为甲基并且两个r11基团与它们所连接的氮原子一起形成5-7元杂环烷基,其为-其中r13和r14为h并且r15选自:○h,○-c0-c6烷基-or11,其中c0-c6烷基为乙基并且r11为h,○-c1-c6烷基-oc(o)n(r11)2,其中c1-c6烷基为乙基,并且两个r11基团都为甲基,○-c1-c6烷基-n(r11)2,其中c1-c6烷基为乙基,并且两个r11基团都为h,和○-c1-c6烷基-n(r11)s(o)2r10,其中c1-c6烷基为乙基,r11为h,和r10为me或so2cf3;-其中r13、r14和r15各自为h;-其中r13为h或甲基并且r14为h;--其中r13为h或甲基;-其中r13为h;-oh;--oc(o)n(r7)2,其中两个r7都为甲基或乙基,或两个r7基团与它们所连接的氮原子一起形成杂环烷基,其为--n(r7)c(o)r7,其中r7每次出现时为h;--n(r7)c(o)or8,其中r7为h,并且r8为叔丁基;--n(r7)c(o)-l3-or7,其中n(r7)为nh,l3为亚乙基,并且or7为oh;或--n(r7)c(o)-l3-oc(o)n(r7)2,其中-n(r7)c(o)-为-nhc(o)-,l3为亚乙基,并且n(r7)2为nh2。还在更优选的实施方案中:表示其中x1为-n=,x4为-o-或-s-,并且x5为-ch=;其中r2表示:-其中r3为h,并且○n为0;○n为3,r4位于3、4和5号位置并且每次出现时为f;○n为2,r4位于2和4号位置并且每次出现时独立地选自f、cl、br、so2me、cn、co2me、no2、ome、ocf3、n3和cf3;○n为2,r4位于3和4号位置并且每次出现时为f;或○n为1和r4位于2或4号位置并且选自f、cl、br、cn、co2me、no2、oh、ocf3、ch2oh和cf3;-其中r3为h,n为0或n为1,并且r4位于2号位置并且为f,或-其中x8为-nh-、-o-或-s-,和○n为0;○n为2,r4位于5和7号位置并且每次出现时为f;或○n为1和r4位于5或6号位置并且为f或no2;l1表示-ch2-o-、-ch2-o-ch2-、-ch2-nh-或-ch=ch-;x6和x7各自表示-ch=,或x6和x7之一表示-ch=并且另一个为-n=;l2表示共价键并且m为4,或l2表示-c(o)-、-ch(oh)-或-s-并且m为3,或l2表示-ch2-o-并且m为2;和r1表示-其中r14为h,并且r13选自:○h、甲基,○-c1-c6烷基-oc(o)n(r11)2,其中c1-c6烷基为乙基,并且两个r11基团都为甲基,或一个r11基团为异丙基或环戊基并且另一个r11基团为h,○-c1-c6烷基-oc(o)n(r11)-l4-or11,其中c1-c6烷基为乙基,n(r11)为nh,l4为乙基,并且-or11为-ome,○-c0-c6烷基-c(o)n(r11)2,其中c0-c6烷基为丁基,并且一个r11基团为-ch2-c≡ch,另一个r11基团为h,○-c1-c6烷基-n(r11)2,其中c1-c6烷基为甲基并且两个r11基团与它们所连接的氮原子一起形成杂环烷基,其为和○-sime3;-其中r13和r14为h并且r15选自:○h,○-c1-c6烷基-oc(o)n(r11)2,其中c1-c6烷基为乙基,并且两个r11基团都为甲基,和○-c1-c6烷基-n(r11)s(o)2r10,其中c1-c6烷基为乙基,r11为h,并且r10为me或cf3;--其中r13为h;或--n(r7)c(o)-l3-oc(o)n(r7)2,其中-n(r7)c(o)-为-nhc(o)-,l3为亚乙基,并且n(r7)2为nh2。在其它优选的实施方案中:表示其中x1为-n=,x4为-o-或-s-,并且x5为-ch=;其中r2表示:-其中r3为h,并且○n为0;○n为3,r4位于3、4和5位置并且每次出现时为f;○n为2,r4位于2和4号位置并且为:■2号位置的f和4号位置的f、cl、br、so2me、cn、co2me、no2、ome、ocf3、n3或cf3;■2号位置的cl和4号位置的f;或■2和4号位置的cl;○n为2,r4位于3和4号位置并且每次出现时为f;或○n为1和r4位于2或4号位置并且选自f、cl、br、cn、co2me、no2、oh、ocf3、ch2oh和cf3;-其中r3为h,n为0或n为1,并且r4位于2号位置并且为f,或-其中x8为-nh-、-o-或-s-,和○n为2,r4位于5和7号位置并且每次出现时为f;或○n为1和r4位于5或6号位置并且为f或no2;l1表示-ch2-o-、-ch2-nh-或-ch=ch-;x6和x7各自表示-ch=;l2表示共价键并且m为4,或l2表示-c(o)-、-ch(oh)-或-s-并且m为3;和r1表示-其中r14为h,并且r13选自○h、甲基,○-c1-c6烷基-oc(o)n(r11)2,其中c1-c6烷基为乙基,并且两个r11基团都为甲基,或一个r11基团为异丙基或环戊基并且另一个r11基团为h,○-c1-c6烷基-oc(o)n(r11)-l4-or11,其中c1-c6烷基为乙基,n(r11)为nh,l4为乙基,并且-or11为-ome,○-c1-c6烷基-n(r11)2,其中c1-c6烷基为甲基并且两个r11基团与它们所连接的氮原子一起形成杂环烷基,其为和○-sime3;-其中r13和r14为h并且r15为h或-c1-c6烷基-oc(o)n(r11)2,其中c1-c6烷基为乙基,并且两个r11基团都为甲基;--其中r13为h;或--n(r7)c(o)-l3-oc(o)n(r7)2,其中-n(r7)c(o)-为-nhc(o)-,l3为亚乙基,并且n(r7)2为nh2。还在其它优选实施方案中:表示其中x1为-n=,x4为-o-和x5为-ch=;其中r2表示:-其中r3为h,并且○n为2,r4位于2和4号位置并且为2号位置的f和4号位置的f、cl、br、so2me、cn、co2me、no2、ocf3或cf3;○n为2,r4位于3和4号位置并且每次出现时为f;或○n为1和r4位于4号位置并且为cn或co2me;或-其中x8为-nh-或-o-,并且○n为2,r4位于5和7号位置并且每次出现时为f;或○n为1和r4位于5或6号位置并且为f或no2;l1表示-ch2-o-;x6和x7各自表示-ch=;l2表示共价键并且m为4,或l2表示-c(o)-、-ch(oh)-或-s-并且m为3;和r1表示:--其中r14为h,并且r13为h或-sime3;或-其中r13,r14和r15各自为h。还在其它优选实施方案中:表示其中x1为-n=,x4为-o-和x5为-ch=;其中r2表示:-其中r3为h,n为2,r4位于2和4号位置并且为2号位置的f和4号位置的f、cl、br、so2me、cn、co2me、no2、ocf3或cf3;或-其中x8为-nh-,并且○n为2,r4位于5和7号位置并且每次出现时为f;或○n为1和r4位于5或6号位置并且为f或no2;l1表示-ch2-o-;x6和x7各自表示-ch=;l2表示共价键并且m为4,或l2表示-s-并且m为3;和r1表示其中r13和r14各自为h。在实施方案中,化合物为以下化合物(其中化合物编号对应于实施例6中使用的那些)之一或其药学上可接受的盐:●化合物1:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基-2-(4-三氟甲基)苯乙烯基)噁唑;●化合物2:(e)-4-((4-(1h-1,2,3-三唑-1-基-)丁基)苯氧基)甲基)-2-(4-三氟甲氧基)苯乙烯基)噁唑;●化合物3a:(e)-2-(4-溴-2-氟苯乙烯基)-4-((4-(4-(4-(三甲基甲硅烷基)-1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑;●化合物3b:(e)-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-溴-2-氟苯乙烯基)噁唑;●化合物4:(e)-2-(1-(4-(4-((2-(4-三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基-1h-1,2,3-三唑-4-基)乙醇;●化合物5:(e)-4-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基-甲氧基)苯基)丁基-1h-1,2,3-三唑-4-基)丁烷-1-醇;●化合物6:(e)-1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4,5-二甲酸二乙酯;●化合物7:(e)-n-甲基-1-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)甲胺;●化合物8:(e)-1-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)环戊醇;●化合物9:(e)-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4,5-二基)二甲醇;●化合物10:(e)-4-((1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)甲基)硫代吗啉1,1-二氧化物;●化合物11:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙基)噁唑;●化合物12:(e)-n-(丙-2-炔-1-基)-5-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)戊酰胺;●化合物13:(e)-2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙胺;●化合物14:(e)-n-(2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基)戊-4-炔酰胺;●化合物15:(e)-4-((1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-5-基)甲基)硫代吗啉1,1-二氧化物;●化合物16:(e)-4-(1h-1,2,3-三唑-1-基)-1-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-酮;●化合物17:(e)-4-(1h-1,2,3-三唑-1-基)-1-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-醇;●化合物18:(e)-4-(1h-1,2,3-三唑-1-基)-1-(4-((2-(4-(三氟甲氧基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-酮;●化合物19:(e)-4-(1h-1,2,3-三唑-1-基)-1-(4-((2-(4-(三氟甲氧基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-醇;●化合物20:(e)-1-(4-((2-(4-溴-2-氟苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮;●化合物21:(e)-1-(4-((2-(4-溴-2-氟苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-醇;●化合物22:(e)-1-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮;●化合物23:(e)-1-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-醇;●化合物24:(e)-1-(4-((2-(2-氟-4-硝基苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮;●化合物25:(e)-1-(4-((2-(2-氟-4-硝基苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-醇;●化合物26:(e)-4-(4-(1h-1,2,3-三唑-1-基)丁基)-n-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲基)苯胺;●化合物27:(e)-4-(4-(1h-1,2,3-三唑-1-基)丁基)-n-((2-(4-溴-2-氟苯乙烯基)噁唑-4-基)甲基)苯胺;●化合物28:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯基)噁唑;●化合物29:(e)-n-(4-(4-羟基丁基)苯基)-2-(4-(三氟甲基)苯乙烯基)噁唑-4-甲酰胺;●化合物30:(e)-n-(4-(4-(1h-1,2,3-三唑-1-基)丁基)苯基)-2-(4-(三氟甲基)苯乙烯基)噁唑-4-甲酰胺;●化合物31:(e)-5-(二甲基氨基)-n-(2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基)萘-1-磺酰胺;●化合物32:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-甲氧基苯乙烯基)噁唑;●化合物33:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-溴苯乙烯基)噁唑;●化合物34:(e)-二乙基氨基甲酸4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基酯;●化合物35:(e)-吗啉-4-甲酸-4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基酯;●化合物36:(e)-二甲基氨基甲酸4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基酯;●化合物37:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苄腈;●化合物38:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-氯苯乙烯基)噁唑;●化合物39:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-氟苯乙烯基)噁唑;●化合物40:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-硝基苯乙烯基)噁唑;●化合物41:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟苯乙烯基)噁唑;●化合物42:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-硝基苯乙烯基)噁唑;●化合物43:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(3-硝基苯乙烯基)噁唑;●化合物44:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(三氟甲基)苯乙烯基)噁唑;●化合物45:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2,4-二氟苯乙烯基)噁唑;●化合物46:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2,6-二氟苯乙烯基)噁唑;●化合物47:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-苯乙烯基噁唑;●化合物48:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物49:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(3-(三氟甲基)苯乙烯基)噁唑;●化合物50:(e)-4-((4-(3-(1h-1,2,3-三唑-1-基)丙基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑;●化合物51:(e)-2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙醇;●化合物52:(e)-2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙胺;●化合物53:(e)-二甲基氨基甲酸2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙基酯;●化合物54:(e)-n-(2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙基)甲磺酰胺;●化合物55:(e)-1,1,1-三氟-n-(2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙基)甲磺酰胺;●化合物56:(e)-1-(4-(4-((3-(4-(三氟甲基)苯乙烯基)苄基)氧基)苯基)丁基)-1h-1,2,3-三唑;●化合物57:(e)-1-(4-(4-((4-(4-(三氟甲基)苯乙烯基)苄基)氧基)苯基)丁基)-1h-1,2,3-三唑;●化合物58:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯甲酸甲酯;●化合物59:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-n-(丙-2-炔-1-基)苯甲酰胺;●化合物60:(e)-(4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯基)甲醇;●化合物61:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-甲氧基苯乙烯基)噁唑;●化合物62:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯酚;●化合物63:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯甲酰胺;●化合物64:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-乙炔基苯乙烯基)噁唑;●化合物65:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑;●化合物66:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-3-氟苯胺;●化合物67:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-叠氮基-2-氟苯乙烯基)噁唑;●化合物68:(e)-二甲基氨基甲酸2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯;●化合物69:(e)-(2-甲氧基乙基)氨基甲酸2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯;●化合物70:(e)-异丙基氨基甲酸2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯;●化合物71:(e)-4-((1-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)甲基)硫代吗啉1,1-二氧化物;●化合物72:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-n-(2-(5-(二甲基氨基)萘-1-磺酰胺基)乙基)苯甲酰胺;●化合物73:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(5-氟-1h-吲哚-2-基)噁唑;●化合物74:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(4-(三氟甲基)苯基)丙-1-烯-1-基)噁唑;●化合物75:5-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯基)吡啶;●化合物76:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(4-(三氟甲基)苯基)环丙基)噁唑;●化合物77:2-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-4-甲酸甲酯;●化合物78:2-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-n-(2-硝基-4-(三氟甲基)苯基)噁唑-4-甲酰胺;●化合物79:(e)-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)氨基甲酸叔丁酯;●化合物80:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(吡啶-4-基)乙烯基)噁唑;●化合物81:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(3-氟吡啶-4-基)乙烯基)噁唑;●化合物82:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(吡啶-3-基)乙烯基)噁唑;●化合物83:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(2-氟吡啶-3-基)乙烯基)噁唑;●化合物84:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(吡啶-2-基)乙烯基)噁唑;●化合物85:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(3-氟吡啶-2-基)乙烯基)噁唑;●化合物86:(e)-3-羟基-n-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)丙酰胺;●化合物87:(e)-二甲基氨基甲酸3-氧代-3-((4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)氨基)丙基酯;●化合物88:(e)-4-((4-(4-(1h-1,2,4-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物89:(e)-2-(2-(4-(4-(1h-1,2,4-三唑-1-基)丁基)苯氧基)-4-(三氟甲基)苯乙烯基)-4-((4-(4-(1h-1,2,4-三唑-1-基)丁基)苯氧基)甲基)噁唑;●化合物90:(e)-4-((4-(4-(1h-四唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物91:(e)-4-((4-(4-(1h-吡唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物92:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(4-甲基-1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑;●化合物93:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(3-甲基-1h-1,2,4-三唑-1-基)丁基)苯氧基)甲基)噁唑;●化合物94:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(5-甲基-2h-四唑-2-基)丁基)苯氧基)甲基)噁唑;●化合物95:(e)-2-(1-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙醇;●化合物96:(e)-(2-甲氧基乙基)氨基甲酸2-(1-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯;●化合物97:(e)-环戊基氨基甲酸2-(1-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯;●化合物98:(e)-异丙基氨基甲酸2-(1-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯;●化合物99:(e)-4-((4-(4-(1h-咪唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑;●化合物100:(e)-4-((4-(4-(1h-咪唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物101:(e)-2-(2-(4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)-4-硝基苯乙烯基)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑;●化合物102:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(吡啶-3-基)丁基)苯氧基)甲基)噁唑;●化合物103:(e)-2-(2-氟-4-硝基苯乙烯基)-4-((4-(4-(吡啶-3-基)丁基)苯氧基)甲基)噁唑;●化合物104:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(吡啶-4-基)丁基)苯氧基)甲基)噁唑;●化合物105:(e)-4-((4-(3-(1h-1,2,3-三唑-1-基)丙基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物106:(e)-4-((4-(3-(1h-1,2,3-三唑-1-基)丙基)苯氧基)甲基)-2-(2-(2h-1,2,3-三唑-2-基)-4-(三氟甲基)苯乙烯基)噁唑●化合物107:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(噻唑-2-基)丁基)苯氧基)甲基)噁唑;●化合物108:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(嘧啶-5-基)丁基)苯氧基)甲基)噁唑;●化合物109:(e)-4-((4-(3-(1h-1,2,3-三唑-1-基)丙氧基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物110:(e)-4-((4-(4-(2h-四唑-2-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物111:4-((e)-4-(4-(1h-1,2,3-三唑-1-基)丁基)苯乙烯基)-2-((e)-2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物112:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(5-氟苯并呋喃-2-基)噁唑;●化合物113:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(5-氟苯并[b]噻吩-2-基)噁唑;●化合物114:(e)-1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-甲酸乙酯;●化合物115:(e)-4-((4-((2-(1h-1,2,3-三唑-1-基)乙氧基)甲基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物116:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-氯-2-氟苯乙烯基)噁唑;●化合物117:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氯-4-氟苯乙烯基)噁唑;●化合物118:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氯苯乙烯基)噁唑;●化合物119:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2,4-二氯苯乙烯基)噁唑;●化合物120:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(3,4,5-三氟苯乙烯基)噁唑;●化合物121:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(3,4-二氟苯乙烯基)噁唑;●化合物122:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-3-氟苄腈;●化合物123:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(甲磺酰基)苯乙烯基)噁唑;●化合物124:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲氧基)苯乙烯基)噁唑;●化合物125:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-3-氟苯甲酸甲酯;●化合物126:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(5-氟-7-硝基-1h-吲哚-2-基)噁唑;●化合物127:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(6-氟-1h-吲哚-2-基)噁唑;●化合物128:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4,6-二氟-1h-吲哚-2-基)噁唑;●化合物129:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(6-硝基-1h-吲哚-2-基)噁唑;●化合物130:(e)-4-((4-((3-(1h-1,2,3-三唑-1-基)丙基)硫基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物131:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噻唑;●化合物132:(e)-4-(((4-(3-(1h-1,2,3-三唑-1-基)丙基)苯基)硫基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物133:(e)-4-(((6-(4-(1h-1,2,3-三唑-1-基)丁基)吡啶-3-基)氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物134:(e)-4-(4-(4-(1h-1,2,3-三唑-1-基)丁基)苄基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物135:(e)-4-((4-(4-(4h-1,2,4-三唑-4-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;●化合物136:(e)-n-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)甲酰胺;●化合物137:(e)-4-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)硫代吗啉1,1-二氧化物;●化合物138:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(哒嗪-3-基)丁基)苯氧基)甲基)噁唑;●化合物139:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(嘧啶-2-基)丁基)苯氧基)甲基)噁唑;●化合物140:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(吡啶-2-基)丁基)苯氧基)甲基)噁唑;●化合物141:(e)-4-(2-(4-((4-((3-(1h-1,2,3-三唑-1-基)丙基)硫基)苯氧基)甲基)噁唑-2-基)乙烯基)-3-氟苄腈;●化合物142:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(6-氟苯并呋喃-2-基)噁唑;●化合物143:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(6-氟苯并[b]噻吩-2-基)噁唑;●化合物144:4-((4-((3-(1h-1,2,3-三唑-1-基)丙基)硫基)苯氧基)甲基)-2-(4,6-二氟-1h-吲哚-2-基)噁唑;●化合物145:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)-5-甲基噁唑;●化合物146:(e)-4-(((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯基)硫基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑;和●化合物147:(e)-4-((4-((2-(1h-1,2,3-三唑-1-基)乙基)硫基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑。注意的是,上述化合物1对应于莫立替尼(cas号366017-09-6),也称为tak-165或(1-(4-{4-[(2-{(e)-2-[4-(三氟甲基)苯基]乙烯基}-1,3-噁唑-4-基)甲氧基]苯基}丁基)-1h-1,2,3-三唑,其具有以下结构:在优选的实施方案中,化合物为以下化合物之一:化合物1、2、3a、3b、10、12、17、19、21至23、25、27、33、37至41、45至48、53至55、58、60至62、65、67、68、70、71、73、80至83、87、92、96至100、102、103、105、109至113、115至125、127至131、133、135至138和141至147或其药学上可接受的盐。在更优选的实施方案中,化合物为以下化合物之一:化合物1、3a、10、17、19、21、22、23、25、27、33、37、38、39、40、41、45、47、48、53、58、60、61、65、67、68、70、71、73、81、82、83、87、96至100、103、109至113、116至125、127至131、133、136、138和141至147或其药学上可接受的盐。在其它更优选的实施方案中,化合物为以下化合物之一:化合物1、3a、10、17、21、23、27、38、40、45、48、53、65、71、73、81、98、112、116、120、121、122、124、125、127、128、129、130、133、138、141、144和147或其药学上可接受的盐。还在更优选的实施方案中,化合物为以下化合物之一:化合物3a、22、23、37、48、99、112、121、122、124、125、127、128、129和130或其药学上可接受的盐。还在更优选的实施方案中,化合物为以下化合物之一:化合物3a、10、65、71、73、120、122、124、127、128、129、130、138、141、144和147或其药学上可接受的盐。在最优选的实施方案中,化合物为以下化合物之一:化合物65、122、124、127、128、129、130、138、141、144和147或其药学上可接受的盐。其它方面也涉及根据本申请定义的任何实施方案的化合物,其具有以下条件的一个或多个:-条件是不表示其中x3为共价键,x1为-n=,x4为-o-,并且x5为-ch=;-条件是r2不是芳基c(r3)=c(h)-,其中r3为h,并且芳基为对三氟甲基苯基;-条件是l1不是-ch2-o-;-条件是x6和x7两者不都是-ch=;-条件是l2不是共价键;-条件是m不是4;-条件是r1不是其中r13和r14各自为h;和/或-条件是化合物不是化合物1。或者,具有以下条件的一个或多个:-条件是不表示以下的任何之一、任何子集或全部:○其中x1为-n=,x3为共价键、x4为-o-和x5为-ch=;和/或○其中x1为-ch=,x2为-ch=,x3为-c(r2)=,x4为-n=和x5为-ch=;-条件是r2不表示以下的任何之一、任何子集或全部:○芳基c(r3)=c(h)-;○芳基c(r3)=c(h)-,其中r3为h,并且芳基为对三氟甲基苯基;○芳基c(r3)=c(h)-,其中r3为h,并且芳基为对三氟甲氧基苯基;○芳基c(r3)=c(h)-,其中r3为h,并且芳基为对甲氧基苯基;○芳基c(r3)=c(h)-,其中r3为h,并且芳基为对氟苯基;○芳基c(r3)=c(h)-,其中r3为h,并且芳基为2,4-二氟苯基;○芳基c(r3)=c(h)-,其中r3为h,并且芳基为2,6-二氟苯基;○芳基c(r3)=c(h)-,其中r3为h,并且芳基为苯基;○芳基c(r3)=c(h)-,其中r3为h,并且芳基为2-氟-4-三氟甲基苯基;○芳基c(r3)=c(h)-,其中r3为h,并且芳基为3-三氟甲基苯基;○杂芳基,其任选地被一个至三个r4基团取代;○○其中x8为-nh-和/或x9为-ch=;○○芳基任选地被一个至三个r4基团取代;○苯基任选地被一个至三个r4基团取代;○对三氟甲基苯基;○芳基(n(r3)c(o)-;和/或○芳基(n(r3)c(o)-,其中芳基为2-硝基-4-三氟甲基苯基,并且r3为h;-条件是l1不表示以下的任何之一、任何子集或全部:○-ch2-o-;○-ch2-nh-;和/或○-c(o)nh-;-条件是x6和x7两者不都是-ch=;-条件是l2不表示以下的任何之一、任何子集或全部:○共价键;○-c(o)-;○-c(r3)(oh)-;和/或○-ch(oh)-;-条件是m不是3和/或4;-条件是r1不表示以下的任何之一、任何子集或全部:○○其中r13和r14各自为h;○○其中r13和r14各自为h;○其中r13和r14各自为h,并且r15为-(ch2)2oh;○其中r13和r14各自为h,并且r15为-(ch2)2nh2;○其中r13和r14各自为h,并且r15为-(ch2)2nhso2ch3;和/或○其中r13和r14各自为h,并且r15为-(ch2)2nhso2cf3;和/或-条件是化合物不是以下的任何之一、任何子集或全部:化合物1、2、18、19、26、30、32、39、45、46、47、48、49、50、51、52、54、55、73、75和/或78。本申请所定义的化合物可以是任何无定形、结晶或多晶型形式,包括其盐和/或溶剂合物或其组合或混合物。本申请所述的化合物可以通过熟练的药物化学家已知的任何方法来制备。示例性方法在实施例部分中给出。在一个实施方案中,化合物或其药学上可接受的盐抑制白血病细胞的生长(例如,oci-aml3细胞生长),其中ec50为约1μm或更小、500nm或更小、100nm或更小、75nm或更小、50nm或更小、10nm或更小、5nm或更小或1nm或更小。在另一个实施方案中,化合物或其药学上可接受的盐抑制白血病细胞的生长(例如、oci-aml3细胞生长),其中ec50为约100nm或更小,例如约100nm至约1nm。在另一个实施方案中,化合物或其药学上可接受的盐抑制白血病细胞的生长(例如,oci-aml3细胞生长),其中ec50为约50nm或更小,例如约50nm至约1nm。在一个实施方案中,ec50使用下面的实施例中描述的测定法来评估。iii.方法、用途、制剂和给药线粒体etc复合物i抑制剂、例如线粒体活性/呼吸抑制剂已经显示出抑制包括肺癌、淋巴瘤和肺癌在内的多种癌症的肿瘤生长。本申请所述结果还表明,莫立替尼和与结构相关的杂环化合物抑制aml肿瘤细胞的生长。因此,在一个方面,本申请提供抑制肿瘤生长和/或诱导肿瘤细胞死亡的方法,所述方法包括使肿瘤与本申请所述的有效量的式i或其药学上可接受的盐接触。本申请还提供本申请所述的式i化合物或其药学上可接受的盐在用于抑制肿瘤生长和/或诱导肿瘤细胞死亡或用于制造抑制肿瘤生长和/或诱导肿瘤细胞死亡的药物中的用途。本申请还提供本申请所述的式i化合物或其药学上可接受的盐,其用于抑制肿瘤生长和/或诱导肿瘤细胞死亡。在一个实施方案中,方法/用途是体外的。在另一个实施方案中,方法/用途是体内的。在另一个方面,本申请提供用于治疗受试者的癌症的方法,所述方法包括向有此需要的受试者给药有效量的本申请所述的式i化合物或其药学上可接受的盐。本申请还提供本申请所述式i化合物或其药学上可接受的盐用于治疗患有癌症的受试者或用于制备用于治疗患有癌症的受试者的药物中的用途。本申请还提供本申请所述式i化合物或其药学上可接受的盐,其用于治疗患有癌症的受试者。在另一个方面,本申请提供用于治疗aml、例如不良预后或不良风险aml的方法,所述方法包括向有此需要的受试者给药本申请所述有效量的式i化合物或其药学上可接受的盐。本申请还提供本申请所述式i化合物或其药学上可接受的盐,用于治疗患有aml例如不良预后或不良风险aml的受试者或用于制备用于治疗患有aml、例如不良预后或不良风险aml的受试者的药物中的用途。本申请还提供本申请所述式i化合物或其药学上可接受的盐,其用于治疗患有aml、例如不良预后或不良风险aml的受试者。在另一个方面,本申请提供用于抑制细胞(体外或体内)、例如癌细胞如aml细胞(不良预后或不良风险aml细胞)中的线粒体活性/呼吸的方法,所述方法包括使细胞与有效量的本申请所述式i化合物或其药学上可接受的盐接触。本申请还提供本申请所述式i化合物或其药学上可接受的盐,用于抑制细胞中的线粒体活性/呼吸或用于制备用于抑制细胞中的线粒体活性/呼吸的药物中的用途。本申请还提供本申请所述式i化合物或其药学上可接受的盐,其用于抑制细胞中的线粒体活性/呼吸。本申请所用的术语“抑制线粒体活性”(或“抑制线粒体呼吸”)是指抑制氧化细胞能量产生过程,通常是抑制有氧细胞代谢。它包括抑制细胞三羧酸(tca)循环(也称为柠檬酸循环,cac或克雷布斯循环)(将碳水化合物,脂肪和蛋白质化学转化为二氧化碳和水以产生可用能量的形式),和抑制细胞氧化(有氧)糖酵解(葡萄糖在细胞质中代谢为丙酮酸)或糖酵解底物(丙酮酸)的氧化磷酸化。根据本申请的线粒体活性抑制是阻断导致产生活性氧类别(ros,例如h2o2)(即细胞中ros水平增加)的etc或氧化磷酸化的能力,即是诱导ros的线粒体活性抑制。本申请所述的式i化合物或其药学上可接受的盐的有效量是对肿瘤细胞例如aml细胞有毒性(抑制肿瘤细胞增殖和/或诱导肿瘤细胞死亡)、但对正常非肿瘤细胞无毒性(或明显较少毒性)的量。在一个实施方案中,式i化合物或其药学上可接受的盐抑制etc,并且诱导ros在细胞中的产生(即,相对于未处理的细胞增加ros的水平),即是诱导ros的etc抑制剂。etc(也称为呼吸链)是位于真核细胞线粒体膜间隙的一系列蛋白质复合物,它们通过氧化还原反应将电子从电子供体转移到电子受体,并且将该电子转移与质子(h+离子)转移进行跨膜偶联,从而产生电化学质子梯度,其驱动三磷酸腺苷(atp)的合成。etc的组分有机组成4个复合物(复合物i至iv),每个复合物包含几个不同的电子载体。复合物i(也称为nadh辅酶q还原酶或nadh脱氢酶)接受来自nadh的电子,并且充当糖酵解、柠檬酸循环、脂肪酸氧化和etc之间的联系。复合物ii,也称为琥珀酸辅酶q还原酶或琥珀酸脱氢酶,包括琥珀酸脱氢酶,并且充当柠檬酸循环与etc之间的直接联系。复合物i和ii两者都产生还原型辅酶q、coqh2,其为复合物iii的底物。复合物iii,也称为辅酶q还原酶,将来自coqh2的电子转移以还原作为复合物iv底物的细胞色素c。最后,复合物iv,也称为细胞色素c还原酶,将电子从细胞色素c转移以将分子氧还原为水。在一个实施方案中,本申请所述式i化合物或其药学上可接受的盐抑制人线粒体etc的复合物i和/或复合物iii的活性,认为所述人线粒体etc的复合物i和/或复合物iii是ros产生的主要位点。在一个进一步的实施方案中,式i化合物或其药学上可接受的盐抑制人线粒体etc的复合物i。在一个进一步的实施方案中,本申请所述式i化合物或其药学上可接受的盐是根据如下的分类的a类复合物i抑制剂:fato等人,(biochimbiophysacta,2009may;1787(5):384-392)。本申请所用术语“a类复合物i抑制剂”是指诱导ros在细胞中产生的复合物i抑制剂,即是诱导ros的复合物i抑制剂。本申请所用的术语癌症是指哺乳动物的生理状况,通常以细胞生长/增殖不受控制为特征,其包括不同类型的癌症,包括:癌,肉瘤,神经胶质瘤,白血病(急性和慢性白血病),淋巴瘤(霍奇金淋巴瘤和非霍奇金淋巴瘤),例如上皮肿瘤、鳞状细胞瘤,基底细胞,肿瘤,过渡细胞乳头状瘤和腺瘤,腺瘤和腺癌,附件和皮肤附属肿瘤,粘液表皮样肿瘤,囊性肿瘤,粘液性和浆液性肿瘤,导管、小叶和髓样肿瘤,腺泡细胞瘤,复合体上皮肿瘤,特异的性腺肿瘤,神经节瘤和球体瘤,痣和黑素瘤,软组织瘤,包括肉瘤,纤维瘤性肿瘤,粘液瘤性肿瘤,脂肪瘤性肿瘤,肌瘤性肿瘤,复杂的混合性和间质性肿瘤,纤维上皮肿瘤,滑膜样肿瘤,间皮肿瘤,生殖细胞肿瘤,滋养细胞肿瘤,中肾间质瘤(mesonephromas),血管肿瘤,淋巴管肿瘤,骨和软骨瘤,巨细胞瘤,杂类骨肿瘤,神经胶质瘤,成胶质细胞瘤,少突胶质细胞瘤,神经上皮瘤性肿瘤,脑膜瘤,神经鞘膜瘤,颗粒细胞瘤和肺泡软组织肉瘤,其它淋巴网状肿瘤,浆细胞瘤和肥大细胞瘤。癌症可以是任何组织/器官的癌症,例如,肺癌、乳腺癌、结肠癌、皮肤癌、肝癌或血液癌。在一个实施方案中,癌细胞/肿瘤细胞不表达erb-b2受体酪氨酸激酶2(erbb2或her2)蛋白。在另一个实施方案中,癌症是白血病,优选aml。在一个实施方案中,癌细胞/肿瘤细胞对ros水平增加或氧化应激敏感。本申请所述的研究表明,对莫立替尼较敏感的aml标本具有某些特性/特征,包括(i)相对于对莫立替尼较耐药的aml标本,某些基因(参见表1和2b)、特别是同源异型框(hox)-网络基因的较高表达,(ii)相对于对莫立替尼较耐药的aml标本,某些基因(参见表2和2a)的较低表达;(iii)某些细胞遗传或分子危险因素,例如中等细胞遗传学风险、正常核型(nk)、高hox状态、突变的npm1、突变的cebpa、突变的flt3、突变的dna甲基化基因(dnmt3a、tet2、idh1、idh2)、突变的runx1、突变的wt1、突变的srsf2、具有异常核型的中等细胞遗传学风险(intern(abnk))、三体性8(+8)和异常chr(5/7);和(iv)相对于较耐药的aml标本,较高的白血病干细胞(lsc)频率,即约1lsc每1x106总的细胞或更多的lsc频率。表1:莫立替尼敏感对耐药aml标本中的过表达的基因(参见表2b)hoxa5hoxa9prdm16loc285758hoxa3hoxa.as3hoxb5hoxa11bend6mir4740col4a5hoxa6hoxb9hoxa10.aslinc00982cyp7b1ankrd18bhoxa4hoxa11.asnkx2.3hoxa7hoxb.as3表2:莫立替尼敏感对耐药aml标本中的低表达的基因(参见表2a)orm1snord116.4mslnms4a2prg3pramesnord116.24tinagl1snord116.20st18myzapznf521s100a16kirrelsnord116.21因此,在一个实施方案中,通过本申请所述的方法/用途治疗的受试者患有的aml特征在于以下特征的至少之一(即,肿瘤细胞表现出以下特征的至少之一):(a)一种或多种同源异型框(hox)-网络基因的高水平表达;(b)表1和/或2b中描述的一个或多个基因的高水平表达;(c)表2和/或2a中描述的一个或多个基因的低水平表达;(d)以下细胞遗传或分子危险因素中的一种或多种:中等细胞遗传学风险,正常核型(nk),突变的npm1,突变的cebpa,突变的flt3,突变的dna甲基化基因,突变的runx1,突变的wt1,突变的srsf2,具有异常核型的中等细胞遗传学风险(intern(abnk)),三体性8(+8),和异常chr(5/7);和(e)白血病干细胞(lsc)频率为约1lsc每1x106总的细胞或更多。在另一个方面,本申请提供用于治疗aml的方法,所述方法包括向有此需要的受试者给药有效量的本申请所述式i化合物或其药学上可接受的盐,其中所述aml具有以下特征的至少之一:(a)一个或多个hox-网络基因的高水平表达;(b)表1和/或2b中描述的一个或多个基因的高水平表达;(c)表2和/或2a中描述的一个或多个基因的低水平表达;(d)以下细胞遗传或分子危险因素中的一种或多种:中等细胞遗传学风险,正常核型(nk),突变的npm1,突变的cebpa,突变的flt3,突变的dna甲基化基因,突变的runx1,突变的wt1,突变的srsf2,具有异常核型的中等细胞遗传学风险(intern(abnk)),三体性8(+8),和异常chr(5/7);和(e)白血病干细胞(lsc)频率为约1lsc每1x106总的细胞或更多。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于治疗患有aml的受试者的用途,其中所述aml具有以上定义的特征(a)-(e)的至少之一。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于制备用于治疗患有aml的受试者的药物中的用途,其中所述aml具有以上定义的特征(a)-(e)的至少之一。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐,其用于治疗患有aml的受试者,其中所述aml具有以上定义的特征(a)-(e)的至少之一。在一个实施方案中,已经确定待治疗的受试者具有上述特征(a)-(e)的一个或多个。在另一个实施方案中,所述方法进一步包括以下步骤:在给药式i化合物或其药学上可接受的盐前,通过进行适宜测定来鉴定具有上述特征的一个或多个的受试者。在另一个方面,本申请提供用于确定患有aml的受试者的适宜治疗的方法,所述方法包括确定来自受试者的aml细胞样本中是否存在至少一种本申请定义的特征(a)-(e)的至少之一,其中存在特征(a)-(e)的至少之一表明受试者是包含本申请所述式i化合物或其药学上可接受的盐的治疗的适宜候选者,并且其中不存在特征(a)-(e)表明受试者不是包含本申请所述式i化合物或其药学上可接受的盐的治疗的适宜候选者,即,是不含式i化合物或其药学上可接受的盐的治疗的候选者。在另一个方面,本申请提供用于治疗不良预后或不良风险aml的方法,所述方法包括向有此需要的受试者给药有效量的本申请所述式i化合物或其药学上可接受的盐。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于治疗不良预后或不良风险aml患者的用途。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于制备用于治疗不良预后或不良风险aml患者的药物中的用途。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐,其用于治疗不良预后或不良风险aml的患者。在另一个方面,本申请提供用于治疗中间风险aml的方法,所述方法包括向有此需要的受试者给药有效量的本申请所述式i化合物或其药学上可接受的盐。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于治疗中间风险aml患者的用途。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于制备用于治疗中间风险aml患者的药物中的用途。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐,其用于治疗中间风险aml患者。在另一个方面,本申请提供用于治疗不良和/或中间风险aml的方法,所述方法包括向有此需要的受试者给药有效量的本申请所述式i化合物或其药学上可接受的盐。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于治疗不良和/或中间风险aml患者的用途。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于制备用于治疗不良和/或中间风险aml患者的药物中用途。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐,其用于治疗不良和/或中间风险aml的患者。本申请所用的术语“预后”是指对aml可能结果或病程的预测;患者恢复或存活的机会。本申请所用的术语“不良预后aml”或“不良风险aml”是指根据目前可用的疗法,aml与少于约25%或20%的长期生存率(5年或更多)相关。不良预后aml通常与如下有关:例如,染色体5或7的一部分缺失,染色体9和11之间的易位,染色体3的易位或倒位,染色体6和9之间的易位,染色体9和22之间的易位,染色体11的异常,flt3基因突变,高的evi1表达,复杂核型(>3异常),和高的hox-网络基因表达。本申请所用术语“中间风险aml”是指根据目前可用的疗法,aml与约60%至约25%的长期生存率(5年或更多)相关。中间风险aml通常与有利和特别不利的细胞遗传学异常(即“非信息性”细胞遗传学异常)无关,并且占aml患者的很大比例(约55%)。中间风险aml的实例包括正常核型(nk)aml,aml中的nup98-nsd1融合与正常核型(nk),三体性8单独的aml,和中间体异常核型aml。在另一个方面,本申请提供用于治疗aml(例如,不良风险或不良预后aml)的方法,所述方法包括向有此需要的受试者给药有效量的本申请所述式i化合物或其药学上可接受的盐,其中所述aml表现出一个或多个hox-网络基因的高水平表达(即hox-高aml)。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于治疗aml(例如,不良风险或不良预后aml)的用途,所述aml表现出一个或多个hox-网络基因的高水平表达。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于制备用于治疗aml(例如,不良风险或不良预后aml)的药物中的用途,所述aml表现出一个或多个hox-网络基因的高水平表达。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐,其用于治疗aml(例如,不良风险或不良预后aml),所述aml表现出一个或多个hox-网络基因的高水平表达。本申请还提供用于确定患有aml的受试者对用本申请所述式i化合物或其药学上可接受的盐治疗有反应的可能性的方法,所述方法包括确定来自所述受试者的aml细胞是否表现出一个或多个hox-网络基因的高水平表达,其中所述aml细胞中一个或多个hox-网络基因的高水平表达表示所述受试者对所述治疗有反应的可能性高。hox-meis-pbx网络(hox网络)的失调是aml患者中常见的分子异常(lawrence,h.j.等人,leukemia13,1993-1999(1999))。它例如在两种aml亚型中检测到:在具有携带核磷蛋白基因突变的正常核型(nk)的aml患者(nknpm1m,占患者的约25%)中,和在具有涉及11q23上的混合谱系白血病基因(mll)的染色体易位的患者亚组(患者的8%)中。本申请所用的术语“hox-网络基因”是指与转录因子(tf)家族hox调控网络有关并且在造血谱系细胞中表达的基因。在造血谱系细胞中表达的“hox-网络基因”成员包括hox基因簇a、b和c,例如hoxb1、hoxb2、hoxb3、hoxb4、hoxb5、hoxb6、hoxb7、hoxb9、hoxb-as3、hoxa1、hoxa2、hoxa3、hoxa4、hoxa5、hoxa6、hoxa7、hoxa9、hoxa10、hoxa10-as、hoxa11、hoxa11-as和hoxa-as3,以及其它基因例如meis1和pbx3。在一个实施方案中,至少一个hox-网络基因在aml中高表达。在一个实施方案中,至少2个hox-网络基因在aml中高表达。在一个实施方案中,至少3个hox-网络基因在aml中高表达。在一个实施方案中,至少4个hox-网络基因在aml中高表达。在一个实施方案中,至少5个hox-网络基因在aml中高表达。在一个实施方案中,至少10个hox-网络基因在aml中高表达。在一个实施方案中,至少15个hox-网络基因在aml中高表达。在一个实施方案中,至少20个hox-网络基因在aml中高表达。在一个实施方案中,hoxa9和hoxa10的至少之一在aml中高表达。在一个实施方案中,hoxa9和hoxa10两者都在aml中高表达。高hox基因表达的aml定义了aml的独特生物学亚型,特征在于不良预后(不良生存),中间风险的细胞遗传学,较高水平的flt3表达,频繁的flt3和npm1突变以及和高lsc频率(参见例如,roche等人,leukemia(2004)18,1059-1063;kramarzova等人,journalofhematology&oncology20147:94)。在一个实施方案中,在aml中高表达的一个或多个hox-网络基因是表1中所列的一个或多个hox-网络基因。在一个实施方案中,上述方法进一步包括测量在包含来自受试者的白血病细胞的样本中一个或多个hox-网络基因的表达水平,并且将该水平与参考水平或对照进行比较以确定一个或多个hox-网络基因在白血病细胞是否高表达或过表达,并且一个或多个hox-网络基因在白血病细胞中是否高表达或过表达,选择受试者以用本申请所述式i化合物或其药学上可接受的盐治疗。本申请还提供用于治疗aml的方法,所述方法包括向有此需要的受试者给药有效量的本申请所述式i化合物或其药学上可接受的盐,其中所述aml表现出表1中描述的一个或多个基因的高水平表达。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于治疗患有aml的受试者的用途,其中所述aml表现出表1中描述的一个或多个基因的高水平表达。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于制备用于治疗患有aml的受试者的药物中的用途,其中所述aml表现出表1中描述的一个或多个基因的高水平表达。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐,其用于治疗患有aml的受试者,其中所述aml表现出表1中描述的一个或多个基因的高水平表达。本申请还提供用于确定患有aml的受试者对用本申请所述式i化合物或其药学上可接受的盐治疗有反应的可能性的方法,所述方法包括确定来自所述受试者的aml细胞是否表现出表1中描述的一个或多个基因的高水平表达,其中所述aml细胞中一个或多个基因的高水平表达表示受试者对所述治疗有反应的可能性高。在一个实施方案中,表1的至少一个基因在aml中高表达(过表达)。在一个实施方案中,表1的至少2个基因在aml中高表达。在一个实施方案中,表1的至少3个基因在aml中高表达。在一个实施方案中,表1的至少4个基因在aml中高表达。在一个实施方案中,表1的至少5个基因在aml中高表达。在一个实施方案中,表1的至少10个基因在aml中高表达。在一个实施方案中,表1中所列至少1、2、3、4、5、10或更多个基因在aml中高表达。在一个实施方案中,表1中所列的所有基因在aml中高表达。在一个实施方案中,上述方法进一步包括测量表1的一个或多个基因在包含来自受试者的白血病细胞样本中的表达水平,并且将该水平与参考水平或对照进行比较以确定一个或多个基因在白血病细胞中是否高表达或过表达,并且一个或多个基因在白血病细胞中是否高表达或过表达,选择受试者以用本申请所述式i化合物或其药学上可接受的盐治疗。本申请还提供用于治疗aml的方法,所述方法包括向有此需要的受试者给药有效量的本申请所述式i化合物或其药学上可接受的盐,其中所述aml表现出表2中描述的一个或多个基因的低水平表达。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于治疗患有aml的受试者的用途,其中所述aml表现出表2中描述的一个或多个基因的低水平表达。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于制备用于治疗患有aml的受试者的药物中的用途,其中所述aml表现出表2中描述的一个或多个基因的低水平表达。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐,其用于治疗患有aml的受试者,其中所述aml表现出表2中描述的一个或多个基因的低水平表达。本申请还提供用于确定患有aml的受试者对用本申请所述式i化合物或其药学上可接受的盐治疗有反应的可能性的方法,所述方法包括确定来自所述受试者的aml细胞是否表现出表2中描述的一个或多个基因的低水平表达,其中所述aml细胞中一个或多个基因的低水平表达表示所述受试者对所述治疗有反应的可能性高。在一个实施方案中,表2的至少一个基因在aml中弱表达(低表达)。在一个实施方案中,表2的至少2个基因在aml中弱表达。在一个实施方案中,表2的至少3个基因在aml中弱表达。在一个实施方案中,表2的至少4个基因在aml中弱表达。在一个实施方案中,表2的至少5个基因在aml中弱表达。在一个实施方案中,表2的至少10个基因在aml中弱表达。在一个实施方案中,所有上述基因在aml中上调。在一个实施方案中,表2中所列至少1、2、3、4、5、10或更多个基因在aml中弱表达。在一个实施方案中,表2中所列的所有基因在aml中弱表达。在一个实施方案中,上述方法进一步包括测量表2的一个或多个基因在包含来自受试者的白血病细胞的样本中的表达水平,并且将该水平与参考水平或对照进行比较以确定一个或多个基因在白血病细胞中是否弱表达或低表达,并且其中一个或多个基因在白血病细胞中是否弱表达或低表达,选择受试者以用式i化合物或其药学上可接受的盐治疗。确定表达本申请公开的一个或多个基因或编码基因产物(例如,mrna,蛋白质)(例如,hox-网络基因,表1至3中基因)可以使用检测核酸或蛋白质的任何已知方法来进行。在实施方案中,将所述表达与对照或参考水平(例如,来自已知对式i化合物或其药学上可接受的盐耐药或敏感的aml受试者的样本所得到的水平进行比较,以评估受试者对本申请所述式i化合物或其药学上可接受的盐有反应的可能性并且确定受试者是否可以用式i化合物或其药学上可接受的盐治疗。对应于上述基因(例如,转录本)的核酸水平然后可以根据通常使用的方法例如下文公开的方法在使用或不使用核酸扩增方法的情况下来评估。在一些实施方案中,核酸扩增方法可用于检测一个或多个基因的表达水平。例如,寡核苷酸引物和/或探针可用于扩增和检测方法,所述方法使用通过多种众所周知和建立的方法的任一种分离的核酸底物(例如,sambrook等人,同上;lin等人,diagnosticmolecularmicrobiology,principlesandapplications,pp.605-16(persing等人,eds.(1993);ausubel等人,currentprotocolsinmolecularbiology(2001及其后更新))。扩增核酸的方法包括但不限于,例如聚合酶链反应(pcr)和逆转录pcr(rt-pcr)(参见例如,u.s.pat.no.4,683,195;4,683,202;4,800,159;4,965,188),连接酶链反应(lcr)(参见例如,weiss,science254:1292-93(1991)),链置换扩增(sda)(参见例如,walker等人,proc.natl.acad.sci.usa89:392-396(1992);u.s.pat.no.5,270,184and5,455,166),嗜热sda(tsda)(参见例如,欧洲专利no.0684315),和如下中描述的方法:u.s.pat.no.5,130,238;lizardi等人,biotechnol.6:1197-1202(1988);kwoh等人,proc.natl.acad.sci.usa86:1173-77(1989);guatelli等人,proc.natl.acad.sci.usa87:1874-78(1990);u.s.pat.no.5,480,784;5,399,491;u.s.公开no.2006/46265。所述方法包括使用转录介导扩增(tma),其利用rna聚合酶产生靶区域的多个rna转录本(参见例如,u.s.pat.no.5,480,784;5,399,491和u.s.公开no.2006/46265)。核酸水平也可以通过“下一代测序”(ngs)方法例如rna测序(rna-seq)测量。在一个实施方案中,测量一个或多个基因表达水平的方法包括核酸扩增步骤。核酸或扩增产物可以通过使探针(例如,标记的探针)与核酸或扩增产物的一部分杂交来检测或定量。引物和/或探针可以用可检测标记来标记,所述可检测标记可以是例如,荧光部分、化学发光部分、放射性同位素、生物素、抗生物素蛋白、酶、酶底物或其它反应性基团。本申请所用的术语“可检测标记”是指发射信号(例如,光)的部分,所述信号可以使用适当的检测系统进行检测。任何适宜的可检测标记可用于本申请所述的方法中。可检测标记包括例如,酶或酶底物,反应基团,发色团例如染料或有色颗粒,发光部分,所述发光部分包括生物发光、磷光或化学发光部分,以及荧光部分。在一个实施方案中,可检测标记是荧光部分。其他众所周知的检测技术包括,例如凝胶过滤、凝胶电泳和扩增子可视化以及高效液相色谱(hplc)。在某些实施方案中,例如使用实时tma或实时pcr,随着产物积累,检测到扩增产物的水平。在一个实施方案中,测量一个或多个基因表达水平的方法包括用探针检测或定量核酸或扩增产物的步骤。在一个实施方案中,上述方法包括使基因表达水平归一化的步骤,即针对稳定表达的对照基因(或管家基因)对上述基因的测量水平进行归一化,以促进不同样本之间的比较。本申请所用的“归一化(normalizing)”或“归一化(normalization)”是指对不同样本之间的原始基因表达值/数据进行校正,以考虑样本之间的差异,并且考虑“外在”参数的差异,例如细胞输入,核酸(rna)或蛋白质质量,逆转录(rt)、扩增、标记、纯化的效率等,即差异并非由于样本中细胞表达基因的实际“内在”差异。这种归一化通过如下进行:基于针对一个或多个“管家”或“对照”基因测量的基因表达值/数据来校正测试基因(或关注的基因)的原始基因表达值/数据,即,已知所述“管家”或“对照”基因表达在不同组织的细胞之间以及在不同的实验条件下是恒定的(即显示相对低的变异性)。因此,在一个实施方案中,上述方法进一步包括测量生物样本中管家基因的表达水平。适宜管家基因是本领域已知的,并且在wo2014/134728中描述几个实例。在一个实施方案中,用于测量一个或多个基因表达水平的方法进一步包括测量来自受试者的生物样品中一个或多个管家基因的表达水平。在另一个实施方案中,一个或多个基因或编码基因产物的表达在蛋白质水平测量。测量蛋白质含量/水平的方法是本领域众所周知的。蛋白质水平可以使用与蛋白质例如抗体或其片段特异性结合的配体直接检测。在实施方案中,这类结合分子或试剂(例如抗体)进行标记/偶联,例如,放射性标记、发色团标记、荧光团标记或酶标记以促进复合物的检测和定量(直接检测)。或者,蛋白质水平可以进行间接检测,使用结合分子或试剂,然后使用特异性识别结合分子或试剂的第二配体(或第二结合分子)检测[蛋白质/结合分子或试剂]复合物(间接检测)。这类第二配体可以进行放射性标记、发色团标记、荧光团标记或酶标记以促进复合物的检测和定量。用于标记用于免疫测定的抗体的酶是本领域已知的,最广泛使用的是辣根过氧化物酶(hrp)和碱性磷酸酶(ap)。结合分子或试剂的实例包括抗体(单克隆或多克隆)、天然或合成配体等。测量样品中蛋白质含量/水平的方法的实例包括但不限于:蛋白质免疫印迹,免疫印迹,酶联免疫吸附测定(elisa),“三明治”免疫测定,放射免疫测定(ria),免疫沉淀,表面等离子体共振(spr),化学发光,荧光偏振,磷光,免疫组化(ihc)分析,基质辅助激光解吸/电离飞行时间(maldi-tof)质谱,微细胞计数,微阵列,抗体阵列,显微镜(例如,电子显微镜),流式细胞术,基于蛋白质组学的测定,和基于蛋白质的性质或活性的测定,其包括但不限于与其它蛋白质伴侣的配体结合或相互作用,酶活性,荧光。例如,如果关注的蛋白质是已知的给定靶标磷酸化的激酶,则可以通过在测试化合物存在下测量靶标的磷酸化水平来确定关注的蛋白质的水平或活性。如果关注的蛋白质是已知诱导表达一个或多个给定靶基因的转录因子,则关注的蛋白质的水平或活性可以通过测量一个或多个靶基因的表达水平来确定。“对照水平”或“参考水平”在本申请中可互换使用,并且广泛地指在可比较的“对照”样本中测量的单独的基线水平,所述“对照”样本通常来自具有关注的基因的已知表达水平和/或其对式i化合物或其药学上可接受的盐的反应是已知的受试者,例如来自已知对式i化合物或其药学上可接受的盐不产生反应的受试者的aml样本。相应的对照水平可以是与基于在多个参考或对照受试者中测量的水平计算出的平均值或中位数水平相对应的水平(例如,预定或建立的标准水平)。对照水平可以是本领域认可的或基于来自一个或一组对照受试者(例如,一组已知对式i化合物或其药学上可接受的盐无反应的一组受试者)的样本中测量的水平建立的预定“截断”值。例如,“阈值参考水平”可以是对应一个或多个基因的最低表达水平(截断)的水平,所述水平允许以统计学上显著的方式来区分可能对本申请所述式i化合物或其药学上可接受的盐产生反应(敏感)的aml受试者与不可能对本申请所述式i化合物或其药学上可接受的盐产生反应(耐药)的受试者,其可以使用来自aml患者的样本通过例如对本申请所述式i化合物或其药学上可接受的盐的不同药理反应来确定。或者,“阈值参考水平”可以是对应基因表达水平(截断)的水平,所述水平允许以统计学上显著的方式最佳地或理想地区分对式i化合物或其药学上可接受的盐敏感的aml受试者与对线粒体活性抑制剂(例如,莫立替尼)耐药的aml受试者。相应的参考/对照水平可以根据年龄、性别、种族或其它参数来调整或归一化。“对照水平”可以因此是单个数字/值,其分别同样适用于各个受试者,或者对照水平可以根据患者的特定亚群进行变化。因此,例如,老年男性可具有与青年男性不同的对照水平,女性可具有与男性不同的对照水平。可以安排预定的标准水平,例如,在将测试人群均等(或不均等)分组(例如低可能性组、中等可能性组和/或高可能性组)或进行四分或五分的情况下。还将会理解,除了预定水平或标准外,对照水平还可以是在与实验样本平行测试的其它样品(例如,来自具有关注的基因的已知表达水平和/或其对式i化合物或其药学上可接受的盐的反应是已知的受试者)。参考或对照水平可以对应于归一化水平,即基于表达管家基因进行归一化的参考或对照值。本申请所用的“较高表达”或“较高水平的表达”(过表达)是指(i)存在于样本中的或多个给定细胞中的一个或多个上述基因(蛋白质和/或mrna)的较高表达(相对于对照)和/或(ii)样本中表达一个或多个基因的较高量的细胞(相对于对照)。本申请所用“低/弱表达”或“较低/较弱水平的表达”(低表达)是指(i)存在于样本中的一个或多个给定细胞中的一个或多个基因(蛋白质和/或mrna)的较低表达(相对于对照)和/或(ii)样本中表达一个或多个基因的较低量的细胞(相对于对照)。在一个实施方案中,较高或较低是指高于或低于对照水平的表达水平(例如,预定的截断值)。在另一个实施方案中,较高或较低是指高于或低于对照水平(例如,预定的截断值)至少一个标准偏差的表达水平(例如,使用适宜的统计分析确定的在统计学上显著的表达水平),“相似的表达”或“相似的表达水平”是指高于或低于对照水平(例如,预定的截断值)小于一个标准偏差的表达水平(例如使用适宜的统计分析确定的在统计学上不显著的表达水平,例如错误发现率(fdr)/q-值,学生t检验/p值,mann-whitney检验/p值)。在实施方案中,较高或较低是指高于或低于对照水平(例如,预定的截断值)至少1.5、2、2.5、3、4或5个标准偏差的表达水平。在另一个实施方案中,“较高表达”是指测试样本中相对于对照水平高出至少10%、20%、30%、40%、45%或50%的表达。在一个实施方案中,“较低表达”是指测试样本中相对于对照水平低出至少10%、20%、25%、30%、35%、40%、45%或50%的表达。在另一个实施方案中,较高或较低是指测试样本中相对于对照样本高出或低出至少1.5倍、2倍、5倍、10倍、25倍或50倍的表达水平。在另一个方面,本申请提供用于治疗aml的方法,所述方法包括向有此需要的受试者给药有效量的本申请所述式i化合物或其药学上可接受的盐,其中所述aml表现出以下细胞遗传或分子危险因素中的一种或多种:正常核型(nk),突变的npm1,突变的cebpa(例如,单等位基因或双等位基因),突变的flt3,突变的dnmt3a,突变的tet2,突变的idh1,突变的idh2,突变的runx1,突变的wt1,突变的srsf2,中等细胞遗传学风险,具有异常核型的中等细胞遗传学风险(intern(abnk)),三体性8(+8),和异常chr(5/7)的。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于治疗患有aml的受试者的用途,其中所述aml表现出上述细胞遗传或分子危险因素中的一种或多种。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐用于制备用于治疗患有aml的受试者的药物中的用途,其中所述aml表现出上述细胞遗传或分子危险因素中的一种或多种。在另一个方面,本申请提供本申请所述式i化合物或其药学上可接受的盐,其用于治疗aml,其中所述aml表现出上述细胞遗传或分子危险因素中的一种或多种。在一个实施方案中,受试者患有特征在于以下的aml:中等细胞遗传学风险,正常核型(nk),和/或高hox表达。在一个实施方案中,受试者患有具有中等细胞遗传学风险的aml。在一个实施方案中,受试者患有具有正常核型(nk)的aml。在一个实施方案中,受试者患有具有高hox表达的aml。本申请还提供用于确定患有aml的受试者对本申请所述式i化合物或其药学上可接受的盐的治疗有反应的可能性的方法,所述方法包括确定来自所述受试者的aml细胞是否表现出以下细胞遗传或分子危险因素中的一种或多种:正常核型(nk),突变的npm1,突变的cebpa,突变的flt3,突变的dnmt3a,突变的tet2,突变的idh1,突变的idh2,突变的runx1,突变的wt1,突变的srsf2,中等细胞遗传学风险,具有异常核型的中等细胞遗传学风险(intern(abnk)),三体性8(+8),和异常chr(5/7),其中所述aml细胞中存在所述一个或多个细胞遗传学或分子危险因素表示所述受试者对所述治疗有反应的可能性高。在一个实施方案中,上述突变的基因中的突变位于表3b中描述的一个或多个位置。在一个进一步的实施方案中,上述突变的基因中的突变是表3b中描述的一个或多个突变。在一个实施方案中,方法/用途用于治疗nk-aml。在一个实施方案中,方法/用途用于治疗具有突变的flt3(例如,内部串联重复的flt3,flt3-itd)的aml。在一个实施方案中,方法/用途用于治疗具有突变的cebpa的aml。在一个实施方案中,方法/用途用于治疗具有突变的dnmt3a的aml。在一个实施方案中,方法/用途用于治疗具有突变的tet2的aml。在一个实施方案中,方法/用途用于治疗具有突变的idh1的aml。在一个实施方案中,方法/用途用于治疗具有突变的idh2的aml。在一个实施方案中,方法/用途用于治疗具有突变的runx1的aml。在一个实施方案中,方法/用途用于治疗aml具有突变的wt1。在一个实施方案中,方法/用途用于治疗具有突变的srsf2的aml。在一个实施方案中,方法/用途用于治疗具有异常核型的中等细胞遗传学风险(intern(abnk))的aml。在一个实施方案中,方法/用途用于治疗具有三体性8(+8)的aml。在一个实施方案中,方法/用途用于治疗具有异常染色体(5/7)的aml。在一个实施方案中,方法用于治疗具有上述细胞遗传或分子危险因素的2种、3种、4种、5种或更多种的任何组合的aml。在一个实施方案中,aml不是具有mll易位的aml。在一个实施方案中,aml不是evi1重排的aml。在一个实施方案中,aml不是核心结合因子(cbf)aml,例如不是具有t(8:21)或inv(16)染色体重排的aml。在一个实施方案中,aml不是具有突变的nras的aml、突变的c-kit和/或突变的tp53。在一个实施方案中,aml为具有突变的npm1的nk-aml。在一个实施方案中,aml细胞包含突变的npm1,突变的flt3(例如,内部串联重复的flt3,flt3-itd),和突变的dna甲基化基因,例如dnmt3a。在一个进一步的实施方案中,aml细胞包含突变的npm1,突变的flt3(例如,内部串联重复的flt3,flt3-itd),突变的dna甲基化基因,例如dnmt3a,并且不包含突变的nras。本申请定义的细胞遗传学和分子危险因素基于2008年世界卫生组织(who)分类(vardiman等人,blood2009114:937-951),以及基因组分类的最新进展(papaemmanuil,e.等人,nengljmed374,2209-2221,2016)。在另一个实施方案中,上述方法/用途进一步包括确定包含来自受试者的白血病细胞的样本中存在(或不存在)本申请定义的细胞遗传和分子危险因素中的一种或多种,其中如果存在细胞遗传和分子危险因素中的一种或多种,则选择受试者以用本申请所述式i化合物或其药学上可接受的盐治疗。鉴定细胞遗传或分子危险因素(一个或多个突变、易位、融合、染色体异常等)的方法和试剂盒是本领域众所周知的,包括例如,核型、荧光原位杂交(fish)、逆转录聚合酶链反应(rt-pcr)、dna测序和微阵技术(参见例如,gulley等人,jmoldiagn.2010jan;12(1):3-16)。确定样本中一个或多个突变、易位、融合等的存在可以使用任何适宜方法进行(参见例如,natrevgenet.2001dec;2(12):930-42)。例如,可以在基因组dna、转录本(rna或cdna)或蛋白质水平上检测到一个或多个突变的存在。在核酸水平上确定序列和多态性的适宜方法的实例包括例如,在基因组dna或转录本(cdna)中对包含一个或多个突变的核酸序列进行测序,例如通过如下进行:“下一代测序”方法(例如,基因组测序、rna测序(rna-seq))或其它测序方法;能够与包含一个或多个突变的核酸序列特异性杂交并且不与(或在较小程度上与)不包含一个或多个突变的对应核酸序列特异性杂交(在可比杂交条件,例如严格杂交条件下)的核酸探针(例如,分子信标)的杂交;限制性片段长度多态性分析(rflp);扩增片段长度多态性pcr(aflp-pcr);使用与包含一个或多个突变的核酸序列特异性杂交的引物来扩增包含一个或多个突变的核酸片段,其中如果存在一个或多个突变则引物产物扩增产物并且当不包含一个或多个突变的核酸序列用作扩增模板时引物不产生相同扩增产物,基于核酸序列的扩增(nasba),引物延伸测定,flap核酸内切酶测定(侵染检测,olivierm.(2005).mutatres.573(1-2):103-10),5’-核酸酶测定(mcguiganf.e.和ralstons.h.(2002)psychiatrgenet.12(3):133-6),寡核苷酸连接酶测定。其它方法包括原位杂交分析和单链构象多态性分析。几种snp基因分型平台是商购可得的。另外方法对于本领域技术人员来说将是明显的。还可以在多肽/蛋白质水平上确定一个或多个突变和/或一个或多个融合的存在。用于检测在多肽水平上的改变的适宜方法的实例包括对编码的多肽的测序;消化编码的多肽,然后进行肽片段的质谱或hplc分析,其中与未突变的多肽相比,突变的多肽导致质谱或hplc光谱发生变化;和使用免疫试剂(例如,抗体、配体)进行的免疫检测,其相对于对应的未突变的多肽表现出与突变的多肽的改变的免疫反应性。免疫检测可通过使用附着在抗蛋白抗体或与抗蛋白抗体结合的二抗上的酶标记、色动力学标记、放射性标记、磁性标记或发光标记来测量多肽分子与抗蛋白抗体之间的结合量。另外,可以使用其它高亲和力配体。可以使用的免疫测定包括例如elisa、蛋白质印迹和本领域技术人员已知的其它技术(参见harlowandlane,antibodies:alaboratorymanual,coldspringharborlaboratorypress,coldspringharbor,n.y.,1999和edwardsr,immunodiagnostics:apracticalapproach,oxforduniversitypress,oxford;england,1999)。所有这些检测技术也可以以微阵列,例如snp微阵列、dna微阵列、蛋白质阵列、抗体微阵列、组织微阵列、电子生物芯片或基于蛋白质芯片的技术的形式使用(参见schenam.,microarraybiochiptechnology,eatonpublishing,natick,mass.,2000)。在另一个实施方案中,本申请所述的鉴定aml细胞中一个或多个特征存在的方法进一步包括从受试者获得或收集生物样本。在各个实施方案中,样本可来自包含适宜于检测一个或多个突变的生物材料的任何来源,例如基因组dna、rna(cdna)和/或蛋白质,例如包含癌细胞、例如白血病细胞(例如,aml细胞)的来自受试者的组织或细胞样本(血细胞、免疫细胞(例如,淋巴细胞)等。可以对样品进行细胞纯化/富集技术以获得富含特定细胞亚群或细胞类型的细胞群。可以对样品进行常用的分离和/或纯化技术以富集核酸(基因组dna、cdna、mrna)和/或蛋白质。因此,在一个实施方案中,方法可以在分离的核酸和/或蛋白质样本、例如分离的基因组dna上进行。可以使用任何用于收集生物流体、组织或细胞样本的方法来收集生物样本,例如通过静脉穿刺来收集血细胞样本。本申请还提供用于治疗aml的方法,所述方法包括向有此需要的受试者给药有效量的本申请所述式i化合物或其药学上可接受的盐,其中所述aml表现出白血病干细胞(lsc)频率为约1lsc每1x106总的细胞或更多。本申请还提供用于确定患有aml的受试者对用本申请所述式i化合物或其药学上可接受的盐治疗有反应的可能性的方法,所述方法包括确定来自所述受试者的aml细胞中的lsc频率,其中lsc频率为约1lsc每1x106总的细胞或更多表示受试者对所述治疗有反应的可能性高。在一个实施方案中,aml表现出lsc频率为约1lsc每9x105总的细胞或更多。在一个实施方案中,aml表现出lsc频率为约1lsc每8x105总的细胞或更多。在一个实施方案中,aml表现出lsc频率为约1lsc每7x105总的细胞或更多。在一个实施方案中,aml表现出lsc频率为约1lsc每6x105总的细胞或更多。在一个实施方案中,aml表现出lsc频率为约1lsc每5x105总的细胞或更多。在一个实施方案中,aml表现出lsc频率为约1lsc每4x105总的细胞或更多。在一个实施方案中,aml表现出lsc频率为约1lsc每3x105总的细胞或更多。在一个实施方案中,aml表现出lsc频率为约1lsc每2x105总的细胞或更多。在一个实施方案中,aml表现出lsc频率为约1lsc每1x105总的细胞或更多。aml细胞样本中的lsc频率可以使用本领域已知的方法测量,例如使用利用lsc相关标记(cd34+cd38-)和光散射畸变进行基于流式细胞仪的测定(terwijn等人,plosone.2014sep22;9(9):e107587)或在基于nod/scid/il2rγc缺陷(nsg)小鼠的异种移植模型中使用有限稀释测定(lda)(sarry等人,jclininvest.2011;121(1):384-395;pabst,c.等人,blood127,2018-2027,和us专利公开no.2014/0343051a1)),如在以下描述的研究中使用的。在一个实施方案中,lsc频率如在以下实施例中描述的nsg小鼠中使用有限稀释测定进行测量。在一个实施方案中,上述方法进一步包括在包含来自受试者的白血病细胞的样本中测量lsc频率,并且其中如果lsc频率为约1lsc每1x106总的细胞或更多,则选择受试者以用本申请所述式i化合物或其药学上可接受的盐治疗。在另一个方面,本申请提供确定患有癌症aml的受试者是否可能对用式i化合物或其药学上可接受的盐的治疗有反应的方法,所述方法包括确定aml是否具有以下特征的至少之一:(a)一种或多种同源异型框(hox)-网络基因的高水平表达;(b)表1中描述的一种或多种基因的高水平表达;(c)表2中描述的一种或多种基因的低水平表达;(d)以下细胞遗传或分子危险因素中的一种或多种:中等细胞遗传学风险,正常核型(nk),突变的npm1,突变的cebpa,突变的flt3,突变的dna甲基化基因,突变的runx1,突变的wt1,突变的srsf2,具有异常核型的中等细胞遗传学风险(intern(abnk)),三体性8(+8),和异常chr(5/7);和(e)白血病干细胞(lsc)频率为约1lsc每1x106总的细胞或更多;其中所述aml中存在这些特征中的至少之一表示患者可能对用式i化合物或其药学上可接受的盐的治疗有反应。测量上述特征的方法是本领域众所周知的,并且代表性方法如上所述。在另一个实施方案中,给药本申请所述式i化合物或其药学上可接受的盐/将本申请所述式i化合物或其药学上可接受的盐用作前药,例如作为药学上可接受的酯。术语“前药”是指药理学上可接受并且对给药的受试者基本无毒的活性剂(式i化合物或其药学上可接受的盐)的类似物。更具体地,前药保留活性剂的生物有效性和特性,并且随后当吸收至温血动物的血液中时以产生母体活性剂的方式进行分解或代谢。产生化合物的前药的方法是本领域已知的。在本申请的方法/用途中,式i化合物或其药学上可接受的盐可以使用任何常规途径来给药,所述途径例如口服、静脉内、肠胃外、皮下、肌肉内、腹膜内、鼻内或肺部(例如,气雾剂)。在一个实施方案中,上述治疗包括使用/给药活性/治疗剂或疗法的多于一种(即组合),其中之一使用式i化合物或其药学上可接受的盐。本申请的预防/治疗剂和/或组合物的组合可以任何常规剂型给药或共同给药(例如,连续地、同时地、在不同时间)。在本申请上下文中的共同给药是指在协调治疗的过程中给药多于一种的治疗剂以实现改善的临床效果。这种共同给药也可以是同延的,即在重叠时间段内发生。例如,在施用第二活性剂或疗法之前、同时、之前和之后、或之后,可以向患者给药第一试剂(例如,式i化合物或其药学上可接受的盐)。在一个实施方案中,一种或多种活性剂与目前用于预防或治疗讨论的病症的一种或多种试剂例如用于治疗癌症例如aml的化疗药物组合使用/给药。式i化合物或其药学上可接受的盐也可以与一种或多种其它癌症疗法例如干细胞/骨髓移植、放射和/或手术进行组合使用。在一个实施方案中,式i化合物或其药学上可接受的盐存在于药物组合物中。因此,在另一个方面,本申请的技术提供用于治疗受试者的aml的组合物,组合物包含式i化合物或其药学上可接受的盐。在一个实施方案中,组合物包含一种或多种药学上可接受的载体或赋形剂。补充活性化合物也可以并入组合物中。载体/赋形剂可以例如适于静脉内、肠胃外、皮下、肌内、腹膜内、鼻内或肺部(例如,气雾剂)给药(参见remington:thescienceandpracticeofpharmacy,loydvallen编著,jr,2012,22ndedition,pharmaceuticalpress;handbookofpharmaceuticalexcipients,rowe等人编著,2012,7thedition,pharmaceuticalpress)。药物组合物可以使用本领域已知的标准方法通过将具有所需纯度的莫立替尼或其药学上可接受的盐与一种或多种任选的药学上可接受的载体和/或赋形剂混合来制备。本申请所用的术语“药学上可接受的载体或赋形剂”具有本领域的正常含义,并且指不是活性成分(线粒体活性抑制剂,例如莫立替尼或其药学上可接受的盐)本身的任何成分,其不干扰活性成分的生物活性的有效性并且对受试者没有毒性,即,是一种载体或赋形剂和/或以对受试者没有毒性的量使用。赋形剂/载体包括例如粘合剂、润滑剂、稀释剂、填充剂、增稠剂、崩解剂/溶解促进剂、增塑剂、涂料、阻隔层制剂、润滑剂、表面活性剂、稳定剂、延迟释放剂、渗透促进剂、助流剂、抗结块剂、抗粘剂、稳定剂、抗静电剂、溶胀剂和其它组分。如本领域技术人员将理解的,单个赋形剂可以一次性地完成多于两种的功能,例如,既可以充当粘合剂又可以充当增稠剂。如本领域技术人员还将理解的,这些术语不必相互排斥。有用的稀释剂例如填充剂包括例如但不限于磷酸二钙、焦磷酸钙、碳酸钙、硫酸钙、乳糖、纤维素、高岭土、氯化钠、淀粉、糖粉、胶体二氧化硅(colloidalsilicondioxide)、氧化钛、氧化铝、滑石、胶体二氧化硅(colloidalsilica)、微晶纤维素、硅化微晶纤维素及其组合。可以以最小药物剂量增加片剂体积以产生足够大小和重量的片剂的填充剂,包括交联羧甲基纤维素钠nf/ep(例如,ac-di-soitm);无水乳糖nf/ep(例如,pharmatosetmdcl21);和/或聚维酮usp/ep。粘合剂材料包括例如但不限于,淀粉(包括玉米淀粉和预糊化淀粉)、明胶、糖(包括蔗糖、葡萄糖、右旋糖和乳糖)、聚乙二醇、聚维酮、蜡以及天然和合成树胶例如阿拉伯胶、海藻酸钠、聚乙烯吡咯烷酮、纤维素聚合物(例如,羟丙基纤维素、羟丙基甲基纤维素、甲基纤维素、羟乙基纤维素、羧甲基纤维素、胶体二氧化硅nf/ep(例如,cab-o-siltmm5p)、硅化微晶纤维素(smcc)例如硅化微晶纤维素nf/ep(例如,prosolvtmsmcc90)和二氧化硅,其混合物等)、硅酸镁铝及其组合。有用的润滑剂包括例如,低芥酸菜子油、棕榈硬脂酸甘油酯、氢化植物油(i型)、氧化镁、硬脂酸镁、矿物油、泊洛沙姆、聚乙二醇、月桂基硫酸钠、硬脂酸钠富马酸酯、硬脂酸、滑石和硬脂酸锌、山嵛酸甘油酯、月桂基硫酸镁、硼酸、苯甲酸钠、乙酸钠、苯甲酸钠/乙酸钠(组合)、dl-亮氨酸、硬脂酸钙、硬脂富马酸钠、其混合物等。增量剂包括例如:微晶纤维素,例如(fmccorp.)或(mendellinc.),其也具有粘合剂性质;磷酸二钙,例如(mendellinc.);硫酸钙,例如(mendellinc.);和淀粉,例如淀粉1500;和聚乙二醇崩解或溶解促进剂包括:淀粉、粘土、纤维素、藻酸盐、树胶、交联聚合物、胶体二氧化硅、酶原、其混合物等,例如交联羧甲基纤维素钠交联羧甲纤维素钠、淀粉乙醇酸钠交联的聚乙烯基聚吡咯烷酮氯化钠、蔗糖、乳糖和甘露醇。可用于固体口服剂型的核心和/或包衣的抗粘剂和助流剂包括滑石、淀粉(例如,玉米淀粉)、纤维素、二氧化硅、月桂基硫酸钠、胶体二氧化硅和金属硬脂酸盐等。二氧化硅流量调节剂的实例包括胶体二氧化硅、硅酸铝镁和瓜尔豆胶。适宜的表面活性剂包括药学上可接受的非离子、离子和阴离子表面活性剂。表面活性剂的实例是月桂基硫酸钠。如果需要,待给药的药物组合物也可包含少量的无毒辅助物质,例如润湿剂或乳化剂、ph缓冲剂等,例如乙酸钠、失水山梨糖醇单月桂酸酯、三乙醇胺乙酸钠、三乙醇胺油酸酯等。如果需要,也可以加入调味剂、着色剂和/或甜味剂。稳定剂的实例包括阿拉伯胶、白蛋白、聚乙烯醇、海藻酸、膨润土、磷酸二钙、羧甲基纤维素、羟丙基纤维素、胶体二氧化硅、环糊精、单硬脂酸甘油酯、羟丙基甲基纤维素、三硅酸镁、硅酸铝镁、丙二醇、藻酸丙二醇酯、海藻酸钠、巴西棕榈蜡、黄原胶、淀粉、硬脂酸酯、硬脂酸、硬脂酸单甘油酯和硬脂醇。增稠剂的实例可以是例如滑石粉usp/ep、天然胶树胶例如瓜尔豆胶或阿拉伯胶,或纤维素衍生物例如微晶纤维素nf/ep(例如,aviceltmph102)、甲基纤维素、乙基纤维素或羟乙基纤维素。有用的增稠剂为羟丙基甲基纤维素(hpmc),一种可用于各种粘度等级的佐剂。增塑剂的实例包括:乙酰化单甘油酯;这些可用作食品添加剂;柠檬酸烷基酯,其用于食品包装、医疗产品、化妆品和儿童玩具中;柠檬酸三乙酯(tec);乙酰柠檬酸三乙酯(atec),比tec沸点高和挥发性低;柠檬酸三丁酯(tbc);乙酰基柠檬酸三丁酯(atbc),可与pvc和氯乙烯共聚物相容;柠檬酸三辛酯(toc),也用于树胶和控制释放药物;乙酰基柠檬酸三辛酯(atoc);柠檬酸三己酯(thc),可与pvc相容,也用于控制释放药物;乙酰基柠檬酸三己酯(athc),可与pvc相容;丁酰基柠檬酸三己酯(bthc,邻丁酰基柠檬酸三己酯),可与pvc相容;柠檬酸三甲酯(tmc),可与pvc相容;烷基磺酸苯酯、聚乙二醇(peg)或其任何组合。任选地,增塑剂可包含柠檬酸三乙酯nf/ep。渗透促进剂的实例包括:亚砜(例如二甲亚砜,dmso)、氮酮(例如月桂氮卓酮)、吡咯烷酮(例如2-吡咯烷酮,2p)、醇和链烷醇(乙醇或癸醇)、二醇(例如丙二醇和聚乙二醇)、表面活性剂和萜烯。在一个实施方案中,药物组合物是口服制剂,用于口服给药。在一个实施方案中,药物组合物是片剂或丸剂形式。适宜于口服给药的制剂可以包括(a)液体溶液,例如有效量的一种或多种活性剂/悬浮于稀释剂例如水、盐水或peg400中的一种或多种组合物;(b)各自包含预定量作为液体、固体、颗粒或明胶的活性成分的胶囊、药囊或片剂;(c)在适当液体中的悬浮液;和(d)适宜的乳液。片剂形式可以包括以下物质中的一种或多种:乳糖、蔗糖、甘露醇、山梨糖醇、磷酸钙、玉米淀粉、马铃薯淀粉、微晶纤维素、明胶、胶体二氧化硅、滑石、硬脂酸镁、硬脂酸和其它赋形剂、着色剂、填充剂、粘合剂、稀释剂、缓冲剂、湿润剂、防腐剂、调味剂、染料、崩解剂和药学上可相容的载体。锭剂形式可包含调味剂例如蔗糖中的活性成分;以及锭剂包含惰性基质例如明胶和甘油或蔗糖和阿拉伯胶胶乳、凝胶等中的活性成分,其除活性剂外还包含本领域已知的载体。任何适宜量的式i化合物或其药学上可接受的盐或包含其的药物组合物可以给药至受试者。剂量将取决于许多因素,包括给药方式。通常,单剂量内所含化合物的量将是有效地预防、延迟或治疗癌症(例如,aml)而不会引起明显毒性的量。为了预防、治疗或减少癌症(例如,aml)的严重程度,适当剂量的式i化合物或其药学上可接受的盐或组合物将取决于例如,待治疗的癌症类型药物、癌症的严重程度和病程、式i化合物或其药学上可接受的盐或组合物是出于预防的目的给药还是治疗的目的给药、既往治疗、患者的临床病史和对式i化合物或其药学上可接受的盐的反应以及主治医师的酌处权。式i化合物或其药学上可接受的盐或组合物可以一次或通过一系列治疗适宜地给药至患者。优选地,在人体中进行测试之前,期望先在体外、然后在有用的动物模型中确定剂量-反应曲。。本申请提供式i化合物或其药学上可接受的盐和包含其的组合物的剂量。例如,取决于癌症(例如,aml)的类型和严重程度,可以每天给药约1μg/kg至约1000mg每kg(mg/kg)体重的线粒体活性抑制剂。在实施方案中,有效剂量可以是0.5mg/kg、1mg/kg、5mg/kg、10mg/kg、15mg/kg、20mg/kg/25mg/kg、30mg/kg、35mg/kg、40mg/kg、45mg/kg、50mg/kg、55mg/kg、60mg/kg、70mg/kg、75mg/kg、80mg/kg、90mg/kg、100mg/kg、125mg/kg、150mg/kg、175mg/kg、200mg/kg,并且可以25mg/kg的增量增加直至1000mg/kg或可以在前述值的任何两个值之间。典型的每日剂量范围可以为约1μg/kg至100mg/kg或更多,其取决于上述因素。为了在几天或更长时间内重复给药,视情况而定,持续治疗直至出现所需的疾病症状抑制。然而,其它剂量方案可以是有用的。通过常规技术和测定容易地监测该疗法的进展。线粒体活性抑制剂例如莫立替尼或其药学上可接受的盐可以根据任何适宜的剂量程序/方案给药,例如每天两次、每天一次、每两天一次、每周两次、每周一次等。在一个实施方案中,给药是每天一次。在一个实施方案中,药物组合物包含约0.1mg至约100mg的式i化合物或其药学上可接受的盐。在进一步的实施方案中,药物组合物包含约1mg至约50mg、约2mg至约30mg、约5mg至约25或20mg或约10mg的式i化合物或其药学上可接受的盐。在一个实施方案中,组合物包含式i化合物或其药学上可接受的盐和另外的活性剂例如化疗剂。将活性剂组合/配制为单一组合物,并且因此同时给药用于上述方法/用途。本申请中对变化的实施方案的记载包括作为任何单一实施方案或其与任何其它实施方案或其部分的组合的所述实施方案。本申请中对一个实施方案的记载包括作为任何单一实施方案或其与任何其它实施方案或其部分的组合的所述实施方案。实施例以下非限制性实施例是说明性的实施方案,并且不应解释为进一步限制本发明的范围。参考附图将更好地理解这些实施例。下文所述的实施例提供了某些示例性化合物所获得的合成和实验结果。除非另有说明,否则在本申请说明书和权利要求书中使用的所有表示成分、反应条件、浓度、性质、稳定性等的量都要理解为在所有情况都用术语“约”进行修饰。至少,每个数值参数应至少根据报告的有效数字的量并且通过应用普通的舍入技术来解释。因此,除非有相反的指示,否则本申请说明书和所附权利要求书中提出的数字参数都是近似值,其可以根据试图获得的性质而变化。尽管阐述实施方案的宽泛范围的数值范围和参数是近似值,但在具体实施例中阐述的数值尽可能精确地进行报告。然而,任何数值都会固有地包含某些误差,这些误差是由于实验、测试测量、统计分析等方面的变化所引起的。实施例1:材料和方法人白血病样本这项研究得到了蒙特利尔大学研究伦理委员会(reb)、maisonneuve-rosemont医院和charleslemoyne医院(longueuil,qc,canada)的批准。在2001年至2017年之间,根据魁北克省细胞研究委员会(bclq)的程序,在知情同意下收集所有aml样本。从同意的母亲收集脐带血(cb)单元,并且使用阳性选择试剂盒分离人cd34+cb细胞(stemcelltechnologies,vancouver,canada,catalognumber18056)(fares等人,science.2014sep19;345(6203):1509-12)。化学筛选原代细胞:将冷冻的aml单核细胞在iscove改良的dulbecco's培养基(imdm)中在37℃解冻,该培养基含有20%fbs和dnasei(100μg/ml)。然后如先前报道在优化aml生长培养基中培养细胞(pabst,c.等人,naturemethods11,436-442,2014):imdm,15%bit(牛血清白蛋白,胰岛素,运铁蛋白;stemcell),100ng/mlscf,50ng/mlflt3-l,20ng/mlil-3,20ng/mlg-csf10-4mβ-巯基乙醇,500nmsr1500nmum729(由免疫学和癌症研究所(iric)的药物化学核心设施合成),庆大霉素(50μg/ml),和环丙沙星(10μg/ml)。扩增的cb细胞是由新鲜cb细胞的um171补充培养6天所产生的细胞,如fares等人同上所述。新鲜cb细胞是cd34阳性选择后直接从脐带血标本中收集的细胞(kit,stemcelltechnologies,vancouver,canada),如fares等人,science.2014sep19;345(6203):1509-12中所述。cb细胞(新鲜和扩增)在(stemcelltechnologies09855)中培养,包含scf100ng/ml、tpo100ng/ml、flt3-l50ng/ml1x,ldl10μg/ml、环丙沙星10μg/ml、500nmsr1和35nmum171(由免疫学和癌症研究所(iric)的药物化学核心设施合成)。细胞系.oci-aml3细胞保存在α-mem,20%fbs中,而乳腺肿瘤bt474细胞保存在dmem10%fbs中。bt474(htb-20tm)是来自sylviemader实验室的慈善赠品,而oci-aml3和oci-aml5细胞购自德国细胞库(dsmz,登记号分别是acc582和acc247)。化合物。将所有粉末溶解在dmso中并且在培养基中稀释,然后立即使用。在所有条件下,最终dmso浓度都为0.1%。60种化合物购自不同家供应商,包括santacruz、selleckchem、calbiochem、adooqbioscience、caymanchemical和synkinase。细胞剂量反应活力测定.将患者细胞以5,000个细胞/孔/50μl的密度接种到384孔板中。在初始筛选中,将化合物加入至连续稀释(10倍稀释,1:3,从10μm或20μm开始)的接种的细胞,重复一次。以0.1%dmso处理而不以其它化合物处理的细胞用作阴性对照。培养6天后,使用assay根据制造商的说明来评估每孔的活细胞计数。抑制百分比计算如下:100-(100×(平均发光(化合物)/平均发光(dmso));其中平均发光(化合物)对应于化合物处理的细胞获得的发光信号的平均值,和平均发光(dmso)对应于对照dmso处理的细胞获得的发光信号的平均值。ec50值(对应于达到50%抑制作用所需的化合物浓度)使用sarviewsuite(idbs,london,uk)和prism4.03(lajolla,ca,usa)通过四参数非线性曲线拟合方法来计算。白血病干细胞(lsc)频率评估。如前所述,使用有限稀释测定在免疫受损的nsg小鼠中评估lsc频率(pabst,c.等人,blood127,2018-2027,2016)。nod.cg-prkdcscidil2rgtm1wjl/szj(nsg)小鼠购自jackson(barharbor,maine)并且在无病原体的动物设施中饲养。所有aml样本都通过尾静脉移植至8至12周龄的亚致死量辐射(250cgy,137cs-γ源)的nsg小鼠中。解冻后,将aml细胞直接以四个不同细胞剂量移植至四只受者小鼠的组中。在移植后10到16周之间,通过流式细胞术确定小鼠骨髓中的人类白血病植入。平均获得150,000个门控事件。如果人细胞占骨髓细胞群的>1%,则认为小鼠是阳性的。仅在明显的与白血病无关的死亡病例(例如,放疗后的前两周)中排除小鼠。为了区分未分类患者样本中存在的白血病细胞和正常细胞的植入,认为仅有其中cd45+cd33+或cd45+cd34+细胞的比例高于cd19+cd33-或cd3+的比例的受体具有白血病起源的细胞。流式细胞术染色使用以下facs抗体:抗人cd45太平洋蓝(biolegend304029),cd45异硫氰酸荧光素(fitc;biolegend304006),cd33藻红蛋白(pe;bdbioscience555450),cd33bv421(bd562854),cd34抗原呈递细胞(apc;bdbioscience555824),cd34apc(stemcelltechnologies10613),cd3fitc(bdbioscience555332),cd4apc-cy7(bd560158),cd8apc(bd555369),cd3pe-cy5(bd555334),cd19pe-cy7(bdbioscience557835),抗小鼠cd45.1apc-efluor730(ebioscience47-0453-82),erbb2-pe(324406),膜联蛋白vfitc(bd556419)。死细胞使用碘化丙锭以1μg/ml终浓度染色。为了ros定量,将细胞在正常生长条件下用1μmh2dcfda(thermofisher,d399)进行染色。在流式细胞仪(bd)、bdii细胞仪(bdbioscience)或iquescreener上分析细胞,并且用bd荧光激活细胞分选仪(facs)4.1和x软件来分析结果。下一代测序和突变定量测序、突变分析和转录本定量的工作流程已在前面进行描述(lavallée,v.-p.等人,blood125,140-143,2014;lavallée,v.-p.等人,nat.genet.47,1030-1037,2015)。简而言之,使用rna/dna样品制备试剂盒构建库。使用hiseq2000在200次循环配对末端运行进行测序。,使用casava1.8.2软件包和elandv2作图软件根据refseq注释将序列数据映射至参考基因组hg19(ucsc,2014年4月16日)。使用casava1.8.2和融合或较大突变例如部分串联复制用tophat2.0.7和cufflinks2.1.1鉴定变体。以每百万定位的读段数中每千碱基的读段数(rpkm)给出转录水平并且根据refseq注释(ucsc,2014年4月16日)进行注释基因。lc/ms代谢物测量(柠檬酸循环中间体和谷胱甘肽)lc/ms代谢物测量是在mcgill代谢组学平台上进行的。真实的代谢物标准品购自sigma-aldrichco.,同时以下lc/ms级溶剂和添加剂则购自fisher:乙酸铵、甲酸、水、甲醇和乙腈。将oci-aml3细胞(500万个细胞,一式四份,用dmso或莫立替尼500nm处理20h)用冰冷的150mm甲酸铵(ph为7.2)洗涤两次。然后使用380μllc/ms等级的50%甲醇/50%水混合物和220μl冷乙腈提取代谢物。样本然后通过1.4mm陶瓷珠在30hz打浆22min进行均匀化(tissuelyser,qiagen)。将体积为300μl的冰冷水和600μl的冰冷二氯甲烷加入裂解物中。将样品涡旋并且使其在冰上静置10min以进行相分离,然后以4,000rpm离心5min。将上层水层转移至新鲜的预冷管中。样品最终通过在-4℃(labconco)进行真空离心干燥,并且在-80℃保存,直到准备进行lc-ms/ms数据收集为止。对于lc-ms/ms分析,首先将标本重悬于50μl水中,并且通过在1℃以15,000rpm离心15min进行澄清。在自动进样器中进行lc-ms/ms分析的过程中,样本保持在4℃。标本通过u-hplc(超高效液相色谱法)(1290infinity,agilenttechnologies)使用scherzosm-c18(3mmx150mm)3μm柱和保护柱(imtaktusa)在10℃操作进行分离。海马代谢通量实验耗氧率和细胞外酸化率使用96孔seahorse生物分析仪或根据制造商的说明(agilenttechnologies)测量。seahorsexf基础培养基在线粒体压力测试的情况下补充有1mm丙酮酸、2mm谷氨酰胺和10mm葡萄糖并且在糖酵解压力测试的情况下补充有1mm丙酮酸、2mm谷氨酰胺和不补充葡萄糖。然后在测定之前将海马培养基的ph调节至7.4。简而言之,将白血病细胞接种至seahorse96孔(或24孔)板中,所述板的每个孔用聚赖氨酸(sigma-aldrich,p4707)以密度75,000个细胞/孔/100μl(或150,000个细胞/孔/150μl)的温度/co2预先调节的海马培养基进行预包被3h。然后将海马板以1400rpm离心5min。然后加入另外的75μl(或375μl)的海马培养基,并且将细胞按照制造商的说明通过加入恒定体积为25μl(或75μl)的化合物进行最终分析。将化合物急性注射至细胞中,终浓度对于莫立替尼为1μm、对于寡霉素为1μm、对于fccp为0.5μm、对于鱼藤酮/抗霉素a为0.5μm、对于葡萄糖为10mm和对于2-脱氧葡萄糖为50mm。etc复合物i活性的无细胞检测etc复合物i活性的无细胞试剂盒检测购自mitosciences(abcam,cambridge,uk)并且按照制造商的规程使用。ic50值使用prism4.03(lajolla,ca,usa)通过四参数非线性曲线拟合方法来计算。统计学差异基因表达分析使用wilcoxon秩和检验进行并且将错误发现率(fdr)方法应用于全基因分析,如前所述(lavallée,v.-p.等人,blood125,140-143,2014)。差异的总生存率的p值通过对属于预后leucegene队列的患者进行log-rank检验来计算。实施例2:hox-高aml患者一般疾病预后较差。显示细胞样本中属于hox网络基因的一致高表达(图1a)与患者总生存率的显著降低有关联(图1b)。图1c显示白血病细胞中hoxa9和hoxa10表达之间的相关性,并且图1d显示属于hoxa9/hoxa10高组的aml患者的存活类似于图1b中所示的属于hox-网络高亚组的患者的存活,表明hoxa9和hoxa10的高表达可以用作用于检测hox网络-高患者的替代。总得说来,这些数据显示,具有表现出hox-网络基因高表达的aml细胞的患者具有不良预后并且将受益于适宜的aml治疗。实施例3:莫立替尼有效地抑制hox-高aml细胞评估以下:使用高表达hoxa9和hoxa10作为用于检测hox-网络-高患者样本的替代,与60种靶向受体酪氨酸激酶(rtk)抑制剂接触的hox-高对hox-中/低标本的存活,ras和pi3k途径的成员(图2a)。当与hox-中/低样本相比时,hox-高患者细胞对rtkerbb2抑制剂莫立替尼显著更敏感(图2b)。对于测试的其它化合物,观察到敏感度方面无统计学显著性差异。大队列的aml样本的剂量反应验证筛选确认,与hox-中/低aml细胞相比,hox-高患者细胞对莫立替尼显著更敏感(图2c-d)。测试的aml群体中的莫立替尼ec50中位数为约375nm(图2e)。属于莫立替尼敏感组的患者(ec50<375nm)相对于莫立替尼耐药组的患者具有显著降低的总生存率(ec50≥375nm,图2f)。属于莫立替尼敏感组的标本过表达hox网络基因(图2g),其与实施例2所示结果一致。图2h中显示差异表达最大的基因(rpkm值为6倍差异,rpkm>0.1),并且表2b(在莫立替尼敏感细胞中基因过表达大于5倍的rpkm值,rpkm>0.1)和表2a(在莫立替尼敏感细胞中基因低表达大于5倍的rpkm值,rpkm>0.1)中显示aml的完整的莫立替尼敏感性转录组签名。总之,这些数据表明,莫立替尼是治疗aml患者、特别是hox-网络基因高表达的患者的良好候选药物。表2a:莫立替尼敏感对莫立替尼耐药的低表达基因**莫立替尼敏感(n=100,通过整个队列的中位数分隔,ec50=375nm)对莫立替尼耐药(n=100)aml标本,根据错误发现率(fdr)校正的多次mann-whitney检验,适用于rna测序数据。使用的截断:表达>0.1rpkm,敏感和耐药标本之间的log(倍数变化)>0.7(=基因表达差异5倍)。表2b:莫立替尼敏感对莫立替尼耐药的过表达基因**莫立替尼敏感(n=100,通过整个队列的中位数分隔,ec50=375nm)对莫立替尼耐药(n=100)aml标本,根据错误发现率(fdr)校正的多次mann-whitney检验,适用于rna测序数据。使用的截断:表达>0.1rpkm,敏感和耐药标本之间的log(倍数变化)>0.7(=基因表达差异5倍)。实施例4:根据经典遗传/细胞遗传学分类的莫立替尼目标人群图3a-f和表3a和5a-5b中描绘了一组旨在鉴定对莫立替尼更敏感的aml亚型的实验结果。图3a和3e显示莫立替尼敏感aml细胞最常属于中等细胞遗传学风险类别,通常在npm1、idh1、srsf2、cebpa、dnmt3a或flt3-itd中携带突变(图3b、3c和3f),并且通常具有正常核型(nk,表3c及图3d和3e)。莫立替尼敏感对耐药标本中最明显富含突变的是idh1、srsf2和cebpa,而在nras、kit、flt3而不是itd和tp53中的aml样本突变在莫立替尼敏感组相对于莫立替尼耐药组中的代表性不足(表3a)。表3b描述了突变的细节。表3a:莫立替尼敏感对莫立替尼耐药aml样本中根据存在的突变基因的患者样本富集倍数。表3b:aml样本中存在的突变。*=引入终止密码子的突变;-=移码突变asxl1=nm_015338;cebpa=nm_004364;dnmt3a=nm_022552;flt3=nm_004119;idh1=nm_005896;idh2=nm_002168;kit=nm_001093772;npm1=nm_002520;nras=nm_002524;runx1=nm_001754;srsf2=nm_003016;tet2=nm_017628;tp53=nm_001276760;wt1=nm_024426。表3c:莫立替尼敏感对耐药aml标本中富含的临床特征**莫立替尼敏感(ec50<375nm,n=100)对耐药(ec50≥375nm,n=100)aml标本,根据bonferroni校正的fisher精确检验。特别是,npm1、dnmt3a和近来与特别不利的预后相关的flt3-itd(papaemmanuil,e.等人,nengljmed374,2209-2221,2016)中同时突变的aml标本显示对莫立替尼特别敏感(中位数ec50是96nm,与其它aml亚型中的423nm相比,图3f)。集中于具有nk的标本(占aml患者的30%,图3g)或具有nk和npm1突变的样本(占aml患者样本的25%,图3h),免疫受损的小鼠中进行的有限稀释测定表明,相对于莫立替尼耐药样本,莫立替尼敏感标本具有显著较高的白血病干细胞(lsc)频率。高lsc频率已证明通常与增加的微小残留病(mrd)和不良预后相关(参见例如,moshaverb.等人,stemcells26,3059-3067(2008))。总得说来,这些结果为选择可最受益于莫立替尼治疗的aml患者人群提供有用的指示,并且提供对莫立替尼的敏感性与患者样本中lsc频率之间潜在联系的证据。实施例5:莫立替尼在aml中的作用机制评估莫立替尼治疗以剂量依赖的方式诱导活细胞计数的减少(通过碘化丙锭(pi)-阴性细胞的减少来衡量)(图4a)。细胞丧失是由于死亡(pi阳性)细胞的数量增加引起的(图4b),其看来通过凋亡而死亡,如通过莫立替尼敏感aml细胞系、oci-aml3中的膜联蛋白v染色(凋亡标志物)增加所表明(图4c)。将莫立替尼描述为特异性erbb2抑制剂(nagasawa,j.等人,intjurol13,587-592,2006),接着评估莫立替尼是否通过该靶标对aml细胞起作用。初级筛选中包括另一种有效的erbb2抑制剂拉帕替尼(图2a);令人惊讶的是,与莫立替尼相比,试验的所有41个aml患者标本对拉帕替尼有耐药性(图4d)。类似地,oci-aml3细胞对莫立替尼敏感,但对另外两种有效的erbb2抑制剂拉帕替尼或沙普替尼不敏感(图4e),提供证据证明莫立替尼对aml细胞的作用不被erbb2抑制剂类别所共有。总得说来,对莫立替尼敏感的aml患者细胞具有与莫立替尼耐药标本相同低水平的erbb2基因表达水平(中位数约0.5rpkm,图4f)。最后,erbb2表达的流式细胞术分析已表明,莫立替尼敏感aml细胞系oci-aml3不表达可检测水平的erbb2蛋白质,其与阳性对照乳腺癌细胞系bt474相反(图4g)。总之,这些结果表明,莫立替尼通过erbb2以外的靶标诱导aml细胞的细胞死亡。接着,评估通过莫立替尼治疗诱导的凋亡是否涉及例如通过活性氧类别(ros)增加引起的氧化应激。如图5a中所示,当在ros清除剂n-乙酰半胱氨酸(nac)存在下孵育aml3白血病细胞时,莫立替尼诱导的凋亡明显减少。此外,在用莫立替尼治疗的aml3细胞中通过2’,7’–二氯荧光素二乙酸酯(dcfda)荧光染料评估的ros活性(羟基、过氧基)水平增加(图5b)。此外,在这些白血病细胞中,莫立替尼处理后(500nm,24h),相对于dmso对照,氧化的谷胱甘肽水平增加(图5c),同时还原的谷胱甘肽水平降低(图5d),表明莫立替尼在敏感的白血病细胞中诱导氧化应激。为了评估莫立替尼诱导的氧化应激是否在敏感的白血病细胞中涉及线粒体活性、即电子传递链(etc)的活性,测量莫立替尼治疗的细胞中的耗氧率。如图5e中所示,在oci-aml3白血病细胞中急性注射莫立替尼(1μm)损耗这些细胞中的耗氧率。图5f中所示数据表明,莫立替尼表现出对etc复合物i活性的抑制作用。图5g显示与oci-aml3细胞相比,白血病细胞系oci-aml5对莫立替尼诱导的细胞死亡有抗性,其表明这些细胞系表现出代谢或线粒体功能差异。与该假设一致,显示与oci-aml5相比,oci-aml3对其它线粒体活性抑制剂例如寡霉素(f1–f0atp合酶的抑制剂,复合物v,图5h)、鱼藤酮(a类复合物i的抑制剂,图5i)和鱼藤素(a类复合物i的抑制剂,图5j)更敏感。图6a-6e中所述结果显示,莫立替尼治疗降低oci-aml3细胞中柠檬酸循环的几种中间体的水平,所述中间体即柠檬酸盐(图6a)、α-酮戊二酸盐(图6b)、琥珀酸盐(图6c)、富马酸盐(图6d)和苹果酸盐(图6e),证实莫立替尼损害这些白血病细胞中的线粒体活性/呼吸。莫立替尼治疗显示以间接方式抑制丙酮酸脱氢酶(pdh),并且诱导oci-aml3细胞中的糖酵解转变。已显示抗糖尿病药物二甲双胍抑制肿瘤细胞系(前列腺、恶性黑色素瘤和乳腺)的增殖,并且通过增强自噬作用使flt3-itd+aml细胞对激酶抑制剂索拉非尼协同增敏(wang等人,2015.leukemiaresearch39:1421-1427)。还已显示二甲双胍抑制hct116p53-/-结肠癌细胞中的线粒体复合物i,但是与鱼藤酮和抗霉素相反,其不增加通过这些细胞的ros(h2o2)产生(wheaton等人,2014.elife.13(3):e02242)。因此,接着测试莫立替尼和二甲双胍对aml细胞的作用之间是否有相关性。如图7中所示,在测试的20个aml标本中由各化合物诱导的aml细胞抑制百分比的比较显示,莫立替尼和二甲双胍在白血病细胞中的抑制作用之间缺乏相关性(皮尔逊相关系数r=-0.17),提供证据证明这两种化合物通过不同的作用机制起作用并且靶向不同aml细胞,并且针对aml细胞的莫立替尼活性涉及诱导ros的产生。莫立替尼在oci-aml3细胞中对复合物i酶活性的抑制作用进一步使用复合物i酶活性微孔板检测试剂盒根据制造商的说明进行评估(abcam,catalogno.ab109721)。该测定测量复合物i的心肌黄酶型活性,其不依赖于泛醌的存在,因此,在泛醌结合位点处或附近结合的抑制剂例如鱼藤酮不抑制该测定。图8a和b中所述结果显示莫立替尼对复合物i的抑制作用不依赖于nadh(即依赖泛醌),如关于a类抑制剂例如鱼藤酮所述(fato等人,biochimbiophysacta,2009may;1787(5):384-392),与莫立替尼增加这些细胞中ros的能力相一致。图9描绘莫立替尼诱导肿瘤细胞死亡的推测作用机制。莫立替尼以泛醌依赖性的方式结合并且抑制复合物i,导致诱导敏感细胞中ros的产生和ros诱导的细胞死亡。鉴于这些结果,合成与莫立替尼具有结构相似性的杂环化合物并且测试其抑制oci-aml3细胞生长的能力,这些化合物显示对莫立替尼所诱导的ros产生是敏感的。实施例6:化合物的合成术语表●t-buoh:叔丁醇●dcm:二氯甲烷●dipea:二异丙基乙胺●dmf:二甲基甲酰胺●dmso:二甲基砜●ea:乙酸乙酯●edc:(3-二甲基氨基丙基)-n’-乙基碳二亚胺盐酸盐●hatu:1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐●hx:己烷●hobt:羟基苯并三唑●isco:teledyneiscocombiflash色谱系统●me-thf:2-甲基四氢呋喃●min:分钟●rt:室温化合物1:莫立替尼,即(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基-2-(4-三氟甲基)苯乙烯基)噁唑:步骤1:4-(4-甲氧基苯基)丁基甲烷磺酸酯在0℃经5分钟将甲磺酰氯(2.81ml,36.1mmol)逐滴加入到4-(4-甲氧基苯基)丁烷-1-醇(5g,27.7mmol)和三乙胺(5.22ml,37.4mmol)在(75.0ml,1165mmol)ch2cl2中的混合物中。在0℃搅拌10分钟,然后缓慢温热至20℃。1h后,用水(50ml)、hcl2%(60ml)和nahco34重量%(60ml)洗涤。有机层经mgso4干燥,过滤并且浓缩至干,得到7.32g(102%)的标题化合物。步骤2:1-(4-叠氮基丁基)-4-甲氧基苯方法a:叠氮化钠(2.346g,36.1mmol)加入到经加入的4-(4-甲氧基苯基)丁基甲烷磺酸酯(7.17g,27.8mmol)在dmf中的溶液中,并且在室温搅拌过夜。然后,将其加热至40℃持续48h。反应混合物冷却至20℃,用水(10ml)淬灭,用et2o(3x50ml)萃取。将合并的有机相用水(50ml)、然后用盐水(50ml)洗涤。有机层经mgso4干燥,过滤并且浓缩,得到棕褐色的油。将残留物在isco上使用柱(hex/etoac)纯化,得到5.45g的1-(4-叠氮基丁基)-4-甲氧基苯。方法b:可选地,制备:偶氮二甲酸二异丙酯(diad)(13,46g,66,6mmol)逐滴加入到三苯基膦(17,46g,66,6mmol)在thf(77ml)中的冷溶液中。20min后,逐滴加入在thf(77ml)中的4-(4-甲氧基苯基)丁烷-1-醇(9,60ml,55,5mmol),搅拌40min,然后逐滴加入叠氮化磷酸二苯酯(15,54ml,72,1mmol)。将混合物恢复至室温,放置过夜。在减压下浓缩反应物,将粗制化合物首先通过硅胶垫(洗脱液:hex/etoac(95/5)然后通过isco使用柱(hex/etoac(0-10%))纯化,得到5.36g的标题化合物。步骤3:1-(4-(4-甲氧基苯基)丁基-1h-1,2,3-三唑将在密封管中的在乙酸乙烯酯(45.0ml,488mmol)中的混合物1-(4-叠氮基丁基)-4-甲氧基苯(3.0g,14.62mmol)加热至120℃过夜。将溶液浓缩至干,将残留物在isco上使用柱(dcm/ea)纯化,得到3.38g(92%)的标题化合物。lrms+h+=232.1。步骤4:4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚将在hbr-水48重量%(9.57ml,85mmol)中的1-(4-(4-甲氧基苯基)丁基)-1h-1,2,3-三唑(3.38g,14.61mmol)加热至90℃,搅拌过夜。逐滴加入在水中的氢氧化钠4m(38.3ml,153mmol),水层用甲苯(15ml)洗涤。将水层通过加入在水中的hcl6m(7.79ml,46.8mmol)调节至ph为6.0-6.5,混合物用ea(35.9ml,367mmol)和thf(17.94ml,219mmol)的混合物萃取。有机层用水(15ml)洗涤,向有机层中加入活性炭(270mg)。将其搅拌15分钟,过滤并且浓缩至干。用乙酸乙酯-己烷重结晶,得到2.80g(88%)的标题产物。步骤5:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基-2-(4-三氟甲基)苯乙烯基)噁唑将根据国际专利公开号wo01/77107制备的(e)-4-(氯甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑(0.058g,0.203mmol)、碳酸钾(0.038g,0.276mmol)和前述苯酚(0.040g,0.184mmol)在dmf(0.368ml)中的混合物在80℃加热5h。将其冷却至室温,用1ml水-meoh(3-1)淬灭。将沉淀物过滤,在isco上使用柱(dcm/meoh;0-10%)纯化,得到0.040g(46%)的标题化合物。lrms+h+=469.1;(参见wo01/77107al)。化合物2:(e)-4-((4-(1h-1,2,3-三唑-1-基-)丁基)苯氧基)甲基)-2-(4-三氟甲氧基)苯乙烯基)噁唑步骤1:1-(4-(4-甲氧基苯基)丁基)-4-(三甲基甲硅烷基)-1h-1,2,3-三唑向乙炔基三甲基硅烷(0.700g,7.12mmol)在dcm(5ml)-tbuoh(5ml)-水(5ml)中的溶液中加入1-(4-叠氮基丁基)-4-甲氧基苯(0.87g,4.24mmol)、步骤2的化合物1、随后加入cuso4.5h2o(0.159g,0.636mmol)和抗坏血酸钠(0.378g,1.907mmol)。将混合物搅拌过夜,过滤并且除去大部分溶剂。然后将其用ea(2x)萃取,合并,经na2so4干燥,过滤并且除去溶剂。在isco上使用柱(hx/ea;0-80%)纯化,得到0.22g(17%)的标题化合物。步骤2:4-(4-(4-(三甲基甲硅烷基)-1h-1,2,3-三唑-1-基)丁基)苯酚:将bbr3(2.17ml,2.17mmol)逐滴加入到1-(4-(4-甲氧基苯基)丁基)-4-(三甲基甲硅烷基)-1h-1,2,3-三唑(0.22g,0.72mmol)在dcm(5.0ml)中的-78℃溶液中。在-78℃下45min后,将溶液恢复至0℃,在相同温度放置过夜。将反应用2mlmeoh淬灭,与nahco3饱和溶液搅拌1h。将其用dcm稀释,分离有机相,经na2so4干燥,过滤并且除去溶剂,得到0.175g(83%)的粗制物质。步骤3:(e)-4-((4-(1h-1,2,3-三唑-1-基-)丁基)苯氧基)甲基)-2-(4-三氟甲氧基)苯乙烯基)噁唑在0℃将nah60%(7.90mg,0.198mmol)加入到4-(4-(4-(三甲基甲硅烷基)-1h-1,2,3-三唑-1-基)丁基)苯酚(0.052g,0.181mmol)在thf(0.823ml)中的溶液中。10min后,加入(e)-4-(氯甲基)-2-(4-(三氟甲氧基)苯乙烯基)噁唑(0.050g,0.165mmol),在80℃加热过夜。混合物用nh4cl溶液淬灭,用ea萃取2次。合并的有机溶液经na2so4干燥,过滤,并且在制备型hplc(水-meoh,5%hco2h;35%-100%)上纯化,得到0.024g(30%)的标题化合物。1hnmr(400mhz,cdcl3)δppm1.61-1.67(m,2h)1.89-2.00(m,2h)2.58-2.65(m,2h)4.40(t,j=7.04hz,2h)5.02(d,j=0.78hz,2h)6.88-6.95(m,3h)7.08(d,j=8.61hz,2h)7.25(d,j=9.00hz,2h)7.49-7.59(m,4h)7.69(d,j=13.69hz,2h)。lrms+h+:485.2。化合物3a和3b:(e)-2-(4-溴-2-氟苯乙烯基)-4-((4-(4-(4-(三甲基甲硅烷基)-1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑和(e)-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-溴-2-氟苯乙烯基)噁唑步骤1:(e)-3-(4-溴-2-氟苯基)丙烯酰胺在0℃将草酰氯(0.429ml,4.90mmol)加入到(e)-3-(4-溴-2-氟苯基)丙烯酸(1g,4.08mmol)在dcm(27.2ml)中的悬浮液中,加入dmf(8.74μl,0.122mmol)。恢复至室温,放置2h。除去溶剂,将残留物溶于ea中并且除去溶剂。将其溶于ea中,缓慢加入浓nh4oh(6.15ml,86mmol)。将其搅拌30分钟,用ea稀释。分离有机相,用盐水洗涤,经na2so4干燥,过滤并且除去溶剂,得到0.88g的标题化合物。1hnmr(400mhz,cccl3)δppm5.60(br.s.,2h)6.59(d,j=16.04hz,1h)7.28-7.34(m,2h)7.35-7.42(m,1h)7.66(d,j=16.04hz,1h)。步骤2:(e)-2-(4-溴-2-氟苯乙烯基)-4-(氯甲基)噁唑将(e)-3-(4-溴-2-氟苯基)丙烯酰胺(0.876g,3.59mmol)和1,3-二氯丙烷-2-酮(0.911g,7.18mmol)在甲苯(7.18ml)中的混合物用dean-stark加热至回流持续24h。除去溶剂,残留物用dcm吸附在sio2上。在isco上使用柱(hx-ea;0-40%)纯化,得到0.61g的标题化合物。lrms+h+:315.9。步骤3:(e)-2-(4-溴-2-氟苯乙烯基)-4-((4-(4-(4-(三甲基甲硅烷基)-1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑和(e)-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-溴-2-氟苯乙烯基)噁唑将nah60%(6.89mg,0.172mmol)加入到来自化合物2的步骤2的加合物(0.042g,0.144mmol)在dmf(0.718ml)中的溶液中。然后在0℃加入前述噁唑(0.050g,0.158mmol)。恢复至室温3h后,将其用nh4cl溶液淬灭。用ea萃取2次,经na2so4干燥,过滤,在isco上使用柱(hx-ea;0-100%)纯化,得到0.010g的(e)-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-溴-2-氟苯乙烯基)噁唑3a。1hnmr(400mhz,cdcl3)δppm1.61-1.67(m,2h)1.89-2.00(m,2h)2.58-2.65(m,2h)4.40(t,j=7.04hz,2h)5.02(d,j=0.78hz,2h)6.88-6.95(m,3h)7.08(d,j=8.61hz,2h)7.25(d,j=9.00hz,2h)7.49-7.59(m,4h)7.69(d,j=13.69hz,2h)。hrms+h+:499.0946。第二加合物需要在制备型hplc(水-meoh,5%hco2h,35%-100%)上进一步纯化,得到0.036g(e)-2-(4-溴-2-氟苯乙烯基)-4-((4-(4-(4-(三甲基甲硅烷基)-1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑3b。1hnmr(400mhz,cdcl3)δ0.31(s,9h)1.58-1.70(m,2h)1.85-1.98(m,2h)2.60(t,j=7.63hz,2h)4.37(t,j=7.24hz,2h)5.01(s,2h)6.91(d,j=8.61hz,2h)7.05-7.10(m,3h)7.28-7.34(m,2h)7.41(d,j=7.83hz,1h)7.45(s,1h)7.57(d,j=16.82hz,1h)7.67(s,1h)。hrms+h+:571.1344。化合物4:(e)-2-(1-(4-(4-((2-(4-三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基-1h-1,2,3-三唑-4-基)乙醇步骤1:(e)-4-(4-((2-(4-三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-醇将(e)-4-(氯甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑(0.249g,0.866mmol)、4-(4-羟基丁基)苯酚(0.12g,0.722mmol)、k2co3(0.120g,0.866mmol)和nai(0.108g,0.722mmol)在丙酮(3.61ml)中的混合物加热回流6h。反应用ea和水稀释。分离有机相,用ea萃取水相,与有机相合并。然后将其经na2so4干燥,过滤并且除去溶剂。在isco上使用柱(tol-ea;0-100%)纯化,得到0.115g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.33-1.47(m,2h)1.49-1.62(m,2h)3.39(q,j=6.26hz,2h)4.34(t,j=5.28hz,1h)4.99(s,2h)6.90-6.97(m,2h)7.11(m,j=8.61hz,2h)7.34(d,j=16.82hz,1h)7.62(d,j=16.43hz,1h)7.76(m,j=8.22hz,2h)7.95(m,j=8.22hz,2h),8.24(s,1h)。步骤2:(e)-4((4-(4-叠氮基丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物1的步骤2(方法b)类似的方式制备。1hnmr(400mhz,cdcl3)δppm1.58-1.75(m,4h)2.61(t,j=7.24hz,2h)3.29(t,j=6.65hz,2h)5.04(d,j=0.78hz,2h)6.90-6.97(m,2h)7.03(d,j=16.43hz,1h)7.12(m,j=8.61hz,2h)7.56(d,j=16.43hz,1h)7.61-7.68(m,4h)7.69(s,1h)。步骤3:(e)-2-(1-(4-(4-((2-(4-三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基-1h-1,2,3-三唑-4-基)乙醇将cuso4.5h2o(2.1mg,8.4μmol)和在thf(0.28ml)中的丁-3-炔-1-醇(3.9mg,0.05mmol)和三乙胺(9.4μl,0.06mmol)搅拌15min,然后,加入前述叠氮基类似物(0.025g,0.057mmol),将反应搅拌过夜。加入sio2,除去溶剂。在isco上使用柱(hx-ea;0-100%)纯化,得到0.012g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.42-1.55(m,2h)1.71-1.84(m,2h)2.51-2.57(m,2h)2.74(t,j=7.04hz,2h)3.61(q,j=5.80hz,2h)4.31(t,j=7.04hz,2h)4.67(t,j=5.28hz,1h)4.98(s,2h)6.94(m,j=8.61hz,2h)7.10(m,j=8.22hz,2h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(m,j=8.22hz,2h)7.83(s,1h)7.95(m,j=8.22hz,2h)8.24(s,1h)。hrms+h+:513.2129。化合物5:(e)-4-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基-甲氧基)苯基)丁基-1h-1,2,3-三唑-4-基)丁烷-1-醇将该化合物以与化合物4类似的方式用己-5-炔-1-醇制备。1hnmr(400mhz,dmso-d6)δppm1.46(quin,j=7.60hz,2h)1.72-1.82(m,2h)3.97(s,2h)4.31(t,j=7.04hz,2h)4.98(s,2h)6.93(m,2h)7.07(m,2h)7.15-7.31(m,5h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(m,2h)7.82(s,1h)7.95(m,2h)8.24(s,1h)。lrms+h+:541.2。化合物6:(e)-1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4,5-二甲酸二乙酯将(e)-4((4-(4-叠氮基丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑(0.025g,0.057mmol)和在甲苯(0.283ml)中的丁-2-炔二酸二乙酯(0.019g,0.113mmol)加热至105℃过夜。在制备型hplc(水-meoh,5%hcooh;35%-100%)上纯化,得到0.015g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.21-1.31(m,6h)1.51(quin,j=7.40hz,2h)1.83(quin,j=7.24hz,2h)2.52-2.58(m,2h)4.26-4.40(m,4h)4.56(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,1h)7.09(d,j=8.61hz,1h)7.34(d,j=16.43hz,1h)7.61(d,j=16.43hz,1h)7.76(d,j=8.22hz,2h)7.95(d,j=8.22hz,2h)8.23(s,1h)。lrms+h+:613.2。化合物7:(e)-n-甲基-1-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)甲胺向n-甲基丙-2-炔-1-胺(0.016g,0.226mmol)在dcm(0.251ml)、tbuoh(0.251ml)和水(0.251ml)中的溶液中加入(e)-4-((4-(4-叠氮基丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑(0.050g,0.113mmol),随后加入cuso4.5h2o(0.021g,0.085mmol),随后加入抗坏血酸钠(0.034g,0.170mmol)。将其搅拌过夜,用2-甲基四氢呋喃稀释,加热,得到溶液。将其用nh4cl溶液淬灭,分离有机相,用2-甲基四氢呋喃萃取。将合并的有机相经na2so4干燥,过滤,在isco上使用柱dcm-meoh-nh4oh(77.5-22-2.5%)纯化,得到0.016g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.40-1.63(m,4h)2.51-2.56(m,2h)2.72(t,j=7.04hz,2h)4.99(s,2h)6.95(d,j=8.61hz,2h)7.13(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.61(d,j=16.82hz,1h)7.76(d,j=8.61hz,2h)7.95(d,j=8.22hz,2h)8.24(s,1h)8.43(br.s.,1h)。lrms+h+:512.2。化合物8:(e)-1-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)环戊醇向1-乙炔基环戊醇(0.025g,0.226mmol)在dcm(0.251ml)-tbuoh(0.251ml)-水(0.251ml)中的溶液中首先加入(e)-4-((4-(4-叠氮基丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑(0.050g,0.113mmol),随后加入cuso4.5h2o(0.021g,0.085mmol)和抗坏血酸钠(0.034g,0.170mmol)。将其搅拌过夜。将其溶于2-甲基四氢呋喃,加热,得到溶液,用nh4cl溶液淬灭。分离,用me-thf萃取。合并,na2so4干燥,除去溶剂。将其吸附在sio2上,在isco上使用柱hx-ea(30-100%)纯化,得到40mg的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.51(quin,j=7.60hz,2h)1.61-1.71(m,2h)1.74-1.86(m,6h)1.89-2.00(m,2h)2.54(t,j=7.63hz,2h)4.32(t,j=7.04hz,2h)4.93(s,1h)4.99(s,2h)6.94(d,j=8.61hz,2h)7.10(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(d,j=8.22hz,2h)7.85(s,1h)7.95(d,j=8.22hz,2h)8.24(s,1h)。lrms+h+:553.2。化合物9:(e)-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4,5-二基)二甲醇将(e)-4((4-(4-叠氮基丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑(0.030g,0.068mmol)和丁-2-炔-1,4-二醇(0.025ml,0.339mmol)的混合物加热至90℃达8h。粗制物在isco上使用柱(dcm-meoh;0-10%%)纯化,得到0.016g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.55(quin,j=7.80hz,2h)1.83(quin,j=7.20hz,1h)2.55(t,j=7.43hz,2h)4.34(t,j=7.24hz,2h)4.49(d,j=5.48hz,2h)4.58(d,j=5.48hz,2h)4.95-5.03(m,3h)5.31(t,j=5.48hz,1h)6.94(m,j=8.61hz,2h)7.11(m,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(m,j=8.22hz,2h)7.95(m,j=8.22hz,2h)8.24(s,1h)。lrms+h+:529.2。化合物10:(e)-4-((1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)甲基)硫吗啉1,1-二氧化物将该化合物以与化合物7类似的方式用4-(丙-2-炔-1-基)硫吗啉1,1-二氧化物制备。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.53hz,2h)1.80(quin,j=7.34hz,2h)2.52-2.57(m,2h)2.83-2.90(m,4h)3.05-3.12(m,4h)3.75(s,2h)4.35(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=9.00hz,2h)7.09(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(d,j=8.22hz,2h)7.95(d,j=8.22hz,2h)8.01(s,1h)8.23(s,1h)。lrms+h+:616.1。化合物11:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙基)噁唑将化合物48(31mg,0.064mmol)和pd-c10%、degussa型、50%湿(5.43mg,2.55μmol)在ea(2ml)中的悬浮液在氢气气氛下搅拌1.5h。将混合物过滤,再加载有pd-c10%、degussa型、50%湿(5.43mg,2.55μmol),ea(2ml)和meoh(2ml)并且在氢气气氛下搅拌5h。将混合物在45μm注射器过滤器上过滤,用meoh(1ml)、然后ea(2ml)洗涤,并且浓缩,得到标题化合物。1hnmr(500mhz,cccl3)δppm1.59-1.67(m,2h)1.94(dt,j=14.98,7.33hz,2h)2.61(t,j=7.57hz,2h)3.06-3.15(m,2h)3.16-3.24(m,2h)4.40(t,j=7.25hz,2h)4.95(d,j=0.95hz,2h)6.86-6.92(m,2h)7.03-7.09(m,2h)7.28-7.35(m,3h)7.50(s,1h)7.59(s,1h)7.70(s,1h)。lrms+h+:489.3。化合物12:(e)-n-(丙-2-炔-1-基)-5-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)戊酰胺步骤1:(e)-5-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)戊酸向在tbuoh(2.5ml)-dcm(2.500ml)-水(2.500ml)中的(e)-4((4-(4-叠氮基丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑(0.150g,0.339mmol)和庚-6-炔酸(0.064g,0.509mmol)首先加入五水硫酸铜(ii)(0.063g,0.254mmol),随后加入抗坏血酸钠(0.101g,0.509mmol)。1h后,将其用ea-水稀释并且在硅藻土上过滤。分离有机相,水相用ea萃取。将有机相合并,经na2so4干燥,过滤并且除去溶剂。将粗制残留物吸附在sio2上并且在sio2短垫上用100%ea、随后用ea中的5%meoh纯化,得到0.146g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.43-1.63(m,6h)1.72-1.84(m,2h)2.23(t,j=6.85hz,2h)2.52-2.56(m,2h)2.59(t,j=7.24hz,2h)4.30(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(d,j=8.22hz,2h)7.82(s,1h)7.95(d,j=7.83hz,2h)8.24(s,1h)11.99(br.s.,1h)。步骤2:(e)-n-(丙-2-炔-1-基)-5-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)戊酰胺将hatu(0.067g,0.176mmol)加入到在dmf(1.0ml)中的(e)-5-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)戊酸(0.080g,0.141mmol)。10min后,加入许尼希碱(0.074ml,0.422mmol)、随后加入丙-2-炔-1-胺(9.69mg,0.176mmol)并且放置过夜。然后将其用ea-nahco3溶液稀释,分离有机相,水相用ea萃取。将合并的有机相经na2so4干燥,过滤,并且吸附在sio2上,以在isco上使用柱使用dcm-meoh-nh4oh(77.5-20-2.5)纯化,得到0.056g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.43-1.59(m,6h)1.78(quin,j=7.40hz,2h)2.10(t,j=6.85hz,2h)2.52-2.55(m,2h)2.58(t,j=6.85hz,2h)3.07(t,j=2.35hz,1h)3.83(dd,j=5.28,2.54hz,2h)4.30(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.34(d,j=16.82hz,1h)7.62(d,j=16.43hz,1h)7.76(d,j=8.22hz,2h)7.81(s,1h)7.95(d,j=8.22hz,2h)8.19-8.29(m,2h)。lrms+h+:606.6。化合物13:(e)-2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙胺将该化合物以与化合物7类似的方式用丁-3-炔-1-胺制备。1hnmr(400mhz,dmso-d6)δppm1.49(dt,j=15.06,7.73hz,2h)1.78(quin,j=7.34hz,2h)2.52-2.56(m,2h)2.66(br.s.,2h)2.78(br.s.,2h)4.31(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.10(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(d,j=8.22hz,2h)7.84(s,1h)7.95(d,j=8.22hz,2h)8.24(s,1h)。hrms+h+:512.2280。化合物14:(e)-n-(2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基)戊-4-炔酰胺将该化合物以与化合物12的步骤2类似的方式用戊-4-炔酸和化合物13制备。1hnmr(400mhz,dmso-d6)δppm1.49(quin,j=7.20hz,2h)1.78(quin,j=7.40hz,2h)2.20-2.27(m,2h)2.30-2.37(m,2h)2.52-2.58(m,2h)2.69-2.78(m,3h)3.25-3.31(m,2h)4.31(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.10(d,j=8.22hz,2h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(d,j=8.22hz,2h)7.85(s,1h)7.91-8.02(m,3h)8.24(s,1h)。lrms+h+:592.2。化合物15:(e)-4-((1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-5-基)甲基)硫吗啉1,1-二氧化物步骤1:4-((1-(4-(4-甲氧基苯基)丁基)-1h-1,2,3-三唑-5-基)甲基)硫吗啉1,1-二氧化物在室温将氯(五甲基环戊二烯基)钌(ii)四聚体(0.039g,0.036mmol)加入到化合物1的步骤2的中间体和4-(丙-2-炔-1-基)硫吗啉1,1-二氧化物(0.169g,0.974mmol)在dmf(6.50ml)中的脱气溶液中。1h后,将混合物用ea-水稀释。分离有机相,水相用ea萃取。然后将它们合并,经na2so4干燥,过滤并且除去溶剂。将其吸附在sio2上在isco上使用柱(dcm-meoh-nh4oh;77.5-20-2.5)纯化,得到0.160g的标题化合物与起始炔烃的1:1混合物。步骤2:4-((1-(4-(4-羟基苯基)丁基)-1h-1,2,3-三唑-5-基)甲基)硫吗啉1,1-二氧化物在95℃将前述混合物在hbr(48%,在水中;2.5ml)中的混合物加热3.5h。然后将其用甲苯稀释,并且除去溶剂。将残留物溶于dcm,用nahco3溶液淬灭。分离有机相,水相用dcm萃取。将它们合并,经na2so4干燥,过滤并且除去溶剂。然后将其吸附在sio2上并且在isco上使用柱(dcm/meoh;0-10%)纯化,得到0.036g的标题化合物。步骤3:(e)-4-((1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-5-基)甲基)硫吗啉1,1-二氧化物将该化合物以与化合物1的步骤5类似的方式用前述苯酚和(e)-4-(氯甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑制备。1hnmr(400mhz,dmso-d6)δppm1.55(quin,j=7.30hz,2h)1.80(quin,j=7.34hz,2h)2.55(t,j=7.63hz,2h)2.86(br.s.,4h)3.02-3.11(m,4h)3.77(s,2h)4.35(t,j=7.24hz,2h)4.99(s,2h)6.94(d,j=8.61hz,2h)7.11(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.57-7.66(d,2h)7.76(d,j=8.22hz,2h)7.95(d,j=8.22hz,2h)8.23(s,1h)。lrms+h+:616.1。化合物16:(e)-4-(1h-1,2,3-三唑-1-基)-1-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-酮步骤1:1-(4-甲氧基苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮在三个单独实验中将由国际专利公开号wo2006/032453制备的在乙酸乙烯酯(100ml)中的4-叠氮基-1-(4-甲氧基苯基)丁烷-1-酮(1.32g,6.02mmol)在微波炉中在120℃加热14h并且在实验结束时进行合并。除去溶剂,将粗制品在isco上使用柱(hx-ea;25-100%)纯化,得到1.22g的标题化合物。步骤2:1-(4-羟基苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮在90℃将前述酮(0.500g,2.039mmol)在hbr48%中在水(5.0ml,92mmol)中的混合物加热24h。除去溶剂,残留物用ea稀释。将溶液用nahco3溶液中和并且用酒石酸溶液酸化。分离有机相,水相用ea萃取3次。将有机相合并,经na2so4干燥,过滤并且除去溶剂,得到0.25g粗制标题化合物。步骤3:(e)-4-(1h-1,2,3-三唑-1-基)-1-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-酮将该化合物以与化合物1的步骤5类似的方式用前述苯酚和(e)-4-(氯甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑制备。1hnmr(400mhz,dmso-d6)δppm2.15(quin,j=7.00hz,2h)3.00(t,j=7.04hz,2h)4.45(t,j=7.04hz,2h)7.16(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.63(d,j=16.82hz,1h)7.73(s,1h)7.76(d,j=8.22hz,2h)7.87-7.99(m,4h)8.17(s,1h)8.30(s,1h)。lrms+h+:483.3。化合物17:(e)-4-(1h-1,2,3-三唑-1-基)-1-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-醇将前述酮(0.013g,0.027mmol)inmeoh(1.5ml)在微波炉中在140℃加热4分钟,得到溶液中的产物。然后在室温加入nabh4(0.005mg,0.132μmol)。将混合物用hoac淬灭,除去溶剂。在isco上使用柱(hx-ea;80-100%)纯化,得到0.0044g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.42-1.60(m,2h)1.68-1.82(m,1h)1.82-1.95(m,1h)4.37(t,j=7.04hz,2h)4.45-4.54(m,1h)5.00(s,2h)5.14(d,j=4.70hz,1h)6.97(d,j=9.00hz,2h)7.21(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.62(d,j=16.83hz,1h)7.70(s,1h)7.76(d,j=8.22hz,2h)7.95(d,j=8.22hz,2h)8.09(s,1h)8.24(s,1h)。hrms+h+:485.1774。化合物18:(e)-4-(1h-1,2,3-三唑-1-基)-1-(4-((2-(4-(三氟甲氧基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-酮将该化合物如国际专利公开号wo2006/032453的实施例1(第20页)中所述合成。化合物19:(e)-4-(1h-1,2,3-三唑-1-基)-1-(4-((2-(4-(三氟甲氧基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-醇将该化合物如国际专利公开号wo2006/032453的实施例2(第22页和化合物22)中所述合成。lrms+h+:501.2。化合物20:(e)-1-(4-((2-(4-溴-2-氟苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮步骤1:(e)-3-(4-溴-2-氟苯基)丙烯酰胺在0℃将草酰氯(0.429ml,4.90mmol)加入到(e)-3-(4-溴-2-氟苯基)丙烯酸(1g,4.08mmol)在dcm(27.2ml)中的悬浮液中,加入dmf(8.74μl,0.122mmol)。将温度恢复至室温并且放置2h。除去溶剂,将残留物溶于ea,除去溶剂。将其重新溶于ea,缓慢加入nh4oh浓(6.15ml,86mmol)。搅拌30min后,将其用ea稀释,分离有机相。将其用盐水洗涤,经na2so4干燥,过滤并且除去溶剂,得到0.88g的标题化合物。步骤2:(e)-2-(4-溴-2-氟苯乙烯基)-4-(氯甲基)噁唑将(e)-3-(4-溴-2-氟苯基)丙烯酰胺(0.876g,3.59mmol)和1,3-二氯丙烷-2-酮(0.911g,7.18mmol)在甲苯(7.18ml)中的混合物用dean-stark加热至回流持续24h。除去溶剂,残留物吸附在sio2上。在isco上使用柱(hx-ea;0-40%)纯化,得到0.61g的标题化合物。1hnmr(400mhz,cdcl3)δppm4.55(d,j=0.78hz,2h)7.03(d,j=16.82hz,1h)7.28-7.35(m,2h)7.38-7.47(m,1h)7.58(d,j=16.82hz,1h)7.66(s,1h)。步骤3:(e)-1-(4-((2-(4-溴-2-氟苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮将该化合物由前述氯化物和1-(4-羟基苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮以与化合物1的步骤5类似的方式制备。1hnmr(400mhz,dmso-d6)δppm2.15(quint,j=7.20,hz,2h)3.00(t,j=7.24hz,2h)4.45(t,j=7.24hz,2h)5.14(s,2h)7.15(d,j=9.00hz,2h)7.27(d,j=16.43hz,1h)7.45-7.55(m,2h)7.66(dd,j=10.56,1.96hz,1h)7.73(s,1h)7.85-7.91(m,1h)7.92(d,j=9.00hz,2h)8.17(s,1h)8.29(s,1h)。lrms+h+:511.1。化合物21:(e)-1-(4-((2-(4-溴-2-氟苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-醇将该化合物以与化合物17类似的方式制备。1hnmr(400mhz,dmso-d6)δppm1.42-1.62(m,2h)1.68-1.81(m,1h)1.81-1.94(m,1h)4.37(t,j=7.04hz,2h)4.46-4.53(m,1h)4.99(s,2h)5.14(d,j=4.30hz,1h)6.97(d,j=8.61hz,2h)7.21(d,j=8.61hz,2h)7.27(d,j=16.43hz,1h)7.49(s,2h)7.66(dd,j=10.56,1.96hz,1h)7.69(d,j=0.78hz,1h)7.88(t,j=8.41hz,1h)8.09(s,1h)8.23(s,1h)。lrms+h+:515.0913。化合物22:(e)-1-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮将该化合物以与化合物20类似的方式用(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑制备(参见化合物48)。1hnmr(400mhz,dmso-d6)δppm2.15(quin,j=7.00hz,2h)3.00(t,j=7.04hz,2h)4.45(t,j=7.04hz,2h)5.15(s,2h)7.16(d,j=9.00hz,2h)7.40(d,j=16.82hz,1h)7.60(d,j=16.43hz,1h)7.65(d,j=8.61hz,1h)7.72(s,1h)7.78(d,j=10.96hz,1h)7.93(d,j=8.61hz,2h)8.12-8.20(m,2h)8.32(s,1h)。lrms+h+:501.0。化合物23:(e)-1-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-醇将nabh4(2.4mg,0.064mmol)加入到(e)-1-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮(0.016g,0.032mmol)在meoh(2.0ml)-thf(2.0ml)中的溶液。30min后,除去溶剂,将残留物溶于ea和nh4cl溶液。分离有机相,经na2so4干燥,过滤,并且吸附在sio2上。在isco上使用柱(hx-ea;40-100%)纯化,得到0.010g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.44-1.58(m,2h)1.68-1.81(m,1h)1.82-1.95(m,1h)4.37(t,j=7.04hz,2h)4.45-4.54(m,1h)5.01(s,2h)5.14(d,j=4.30hz,1h)6.97(d,j=8.61hz,2h)7.18-7.25(m,2h)7.39(d,j=16.43hz,1h)7.59(d,j=16.83hz,1h)7.65(d,j=8.22hz,1h)7.69(s,1h)7.78(d,j=10.17hz,1h)8.09(s,1h)8.16(t,j=7.63hz,1h)8.27(s,1h)。lrms+h+-h2o:485.0。化合物24:(e)-1-(4-((2-(2-氟-4-硝基苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮步骤1:(e)-3-(2-氟-4-硝基苯基)丙烯酸乙酯将2-(三苯基亚正膦基)乙酸乙酯(4.12g,11.83mmol)加入到2-氟-4-硝基苯甲醛(1.00g,5.91mmol)在thf(11.83ml)中的溶液中,将其加热5h。除去溶剂,残留物在甲苯中稀释并且在sio2hx-ea(9-1)的短垫上纯化。将其然后用在50ml甲苯中的5%mol碘在100℃处理过夜。除去溶剂,得到1.25g的标题化合物。1hnmr(400mhz,cdcl3d)δppm1.37(t,j=7.24hz,3h)4.31(q,j=7.17hz,2h)6.68(d,j=16.43hz,1h)7.68-7.76(m,1h)7.69-7.76(m,1h)8.00(dd,j=9.98,2.15hz,1h)8.07(dd,j=8.41,2.15hz,1h)。步骤2:(e)-3-(2-氟-4-硝基苯基)丙烯酰胺将naoh(3.92ml,7.84mmol)加入到(e)-3-(2-氟-4-硝基苯基)丙烯酸乙酯(1.25g,5.23mmol)在thf(10.45ml)中的溶液中,随后加入几滴meoh直到得到一个相。将其加热至50℃持续1h。然后,经hcl10%淬灭,用ea稀释,用ea萃取4次,并且用盐水洗涤合并的有机相。将有机相经na2so4干燥,过滤,吸附在sio2上,除去溶剂。将该粗制羧酸然后根据化合物20的步骤1的方法转化为标题化合物。1hnmr(400mhz,dmso-d6)δppm6.90(d,j=16.04hz,1h)7.36(br.s.,1h)7.52(d,j=16.04hz,1h)7.77(br.s.,1h)7.95(t,j=8.02hz,1h)8.13(dd,j=8.61,1.96hz,1h)8.19(dd,j=10.56,2.35hz,1h)。步骤3:(e)-4-(氯甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑将(e)-3-(2-氟-4-硝基苯基)丙烯酰胺(0.100g,0.47mmol)和在甲苯(0.25ml)中的1,3-二氯丙烷-2-酮(0.181g,1.42mmol)的混合物加热至120℃持续8h。将其用ea稀释并且吸附在sio2上。在isco上使用柱(hx-ea;0-70%)纯化,得到0.071g的标题化合物。1hnmr(400mhz,dmso-d6)δppm4.73(s,2h)7.47(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)8.09-8.15(m,2h)8.18-8.29(m,3h)。步骤4:(e)-1-(4-((2-(2-氟-4-硝基苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮将该化合物以与化合物25类似的方式用(e)-4-(氯甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑和1-(4-羟基苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-酮制备。1hnmr(400mhz,dmso-d6)δppm2.15(quin,j=7.00hz,2h)3.00(t,j=7.04hz,2h)4.45(t,j=7.24hz,2h)5.16(s,2h)7.16(d,j=8.61hz,2h)7.48(d,j=16.83hz,1h)7.62(d,j=16.43hz,1h)7.72(s,1h)7.93(d,j=8.61hz,2h)8.09-8.14(d,1h)8.17(s,1h)8.18-8.26(d,2h)8.35(s,1h)。hrms+h+:478.1503。化合物25:(e)-1-(4-((2-(2-氟-4-硝基苯乙烯基)噁唑-4-基)甲氧基)苯基)-4-(1h-1,2,3-三唑-1-基)丁烷-1-醇将该化合物以与化合物23类似的方式由前述酮(不需要微波)制备。1hnmr(400mhz,dmso-d6)δppm1.44-1.58(m,2h)1.68-1.81(m,1h)1.82-1.95(m,1h)4.37(t,j=7.04hz,2h)4.45-4.54(m,1h)5.01(s,2h)5.14(d,j=4.30hz,1h)6.97(d,j=8.61hz,2h)7.18-7.25(m,2h)7.39(d,j=16.43hz,1h)7.59(d,j=16.83hz,1h)7.65(d,j=8.22hz,1h)7.69(s,1h)7.78(d,j=10.17hz,1h)8.09(s,1h)8.16(t,j=7.63hz,1h)8.27(s,1h)。lrms+h+-h2o:462.0。化合物26:(e)-4-(4-(1h-1,2,3-三唑-1-基)丁基)-n-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲基)苯胺步骤1:4-(4-硝基苯基)丁-3-炔-1-醇向ph3p(0.130g,0.495mmol)、1-溴-4-硝基苯(5.00g,24.75mmol)和4-(4-硝基苯基)丁-3-炔-1-醇(4.55g,23.80mmol,96%收率)在et3n(103ml)-甲苯(165ml)中的脱气溶液中加入碘化铜(i)(0.236g,1.238mmol)和pdcl2(pph3)2(0.521g,0.743mmol)。将混合物在其过滤结束时加热至90℃持续24h,除去溶剂。将残留物用nh4cl溶液和ea稀释。分离有机相,水相用ea萃取2次。合并的有机相用水洗涤,经na2so4干燥,过滤,并且吸附在sio2上。在isco上使用柱(hx-ea;10-1000%)纯化,得到4.55g的标题化合物。步骤2:4-(4-氨基苯基)丁烷-1-醇在1大气压和室温将4-(4-硝基苯基)丁-3-炔-1-醇(1.00g,5.23mmol)和pto2(0.125g)在etoh(52ml)中的混合物氢化4h。将反应过滤并且除去溶剂,得到0.77g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.34-1.44(m,2h)1.44-1.53(m,2h)2.38(t,j=7.43hz,2h)3.35-3.41(m,2h)4.32(t,j=5.09hz,1h)4.77(s,1h)6.41-6.51(m,2h)6.82(m,j=8.22hz,2h)。步骤3:(e)-4-(4-(((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲基)氨基)苯基)丁烷-1-醇在75℃将(e)-4-(氯甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑(0.100g,0.348mmol)、4-(4-氨基苯基)丁烷-1-醇(0.057g,0.348mmol)和k2co3(0.072g,0.521mmol)在dmf(0.695ml)中的混合物加热过夜。将其用nh4cl溶液和ea稀释。分离有机相,水相用ea萃取2次。将它们合并并且用水洗涤,经na2so4干燥,过滤,吸附在sio2上,在isco上使用柱(hx-ea;10-100%)纯化,得到0.077g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.35-1.44(m,2h)1.45-1.55(m,2h)2.40(t,j=7.43hz,2h)3.38(q,j=6.00hz,2h)4.14(d,j=5.87hz,2h)4.32(t,j=5.09hz,1h)5.81(t,j=5.87hz,1h)6.56(d,j=8.61hz,2h)6.90(d,j=8.22hz,2h)7.30(d,j=16.43hz,1h)7.56(d,j=16.43hz,1h)7.75(d,j=8.22hz,2h)7.90-8.00(m,3h)。步骤4:(e)-4-(4-叠氮基丁基)-n-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲基)苯胺将该化合物以与化合物1的步骤2(方法b)类似的方式用(e)-4-(4-(((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲基)氨基)苯基)丁烷-1-醇制备,得到标题化合物。lrms+h+:442.3。步骤5:(e)-4-(4-(1h-1,2,3-三唑-1-基)丁基)-n-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲基)苯胺将该化合物以与化合物1的步骤3类似的方式用乙酸乙烯酯和(e)-4-(4-叠氮基丁基)-n-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲基)苯胺制备。1hnmr(400mhz,dmso-d6)δppm1.51(quin,j=7.63hz,2h)1.83(quin,j=7.34hz,2h)2.57(t,j=7.43hz,2h)4.40(t,j=7.04hz,2h)7.11-7.22(m,3h)7.37-7.49(m,3h)7.61-7.78(m,6h)8.09-8.16(m,1h)8.76(s,1h)10.07(s,1h)。lrms+h+:468.1。化合物27:(e)-4-(4-(1h-1,2,3-三唑-1-基)丁基)-n-((2-(4-溴-2-氟苯乙烯基)噁唑-4-基)甲基)苯胺步骤1:(e)-4-(4-(((2-(4-溴-2-氟苯乙烯基)噁唑-4-基)甲基)氨基)苯基)丁烷-1-醇将该化合物以与化合物26的步骤3类似的方式用(e)-2-(4-溴-2-氟苯乙烯基)-4-(氯甲基)噁唑制备。1hnmr(400mhz,dmso-d6)δppm1.34-1.45(m,2h)1.45-1.55(m,2h)2.40(t,j=7.43hz,2h)3.38(q,j=6.26hz,2h)4.14(d,j=6.26hz,2h)4.32(t,j=5.28hz,1h)5.82(t,j=1.00hz,1h)6.56(d,j=8.22hz,2h)6.89(d,j=8.22hz,2h)7.23(d,j=16.43hz,1h)7.42-7.52(m,2h)7.65(dd,j=10.56,1.96hz,1h)7.86(t,j=1.00hz,1h)7.96(s,1h)。步骤2:(e)-4-(4-叠氮基丁基)-n-((2-(4-溴-2-氟苯乙烯基)噁唑-4-基)甲基)苯胺将该化合物以与化合物1的步骤2(方法b)类似的方式制备。步骤3:(e)-4-(4-(1h-1,2,3-三唑-1-基)丁基)-n-((2-(4-溴-2-氟苯乙烯基)噁唑-4-基)甲基)苯胺将该化合物以与化合物1的步骤3类似的方式用(e)-4-(4-叠氮基丁基)-n-((2-(4-溴-2-氟苯乙烯基)噁唑-4-基)甲基)苯胺制备。1hnmr(400mhz,dmso-d6)δppm1.32-1.48(m,2h)1.72-1.81(m,2h)2.41(t,j=7.63hz,2h)4.11(d,j=5.87hz,2h)4.35(t,j=7.04hz,2h)5.82(t,j=5.87hz,1h)6.54(d,j=8.22hz,2h)6.86(d,j=8.61hz,2h)7.17-7.25(m,1h)7.38-7.53(m,2h)7.61-7.66(m,1h)7.68(s,1h)7.79-7.89(m,1h)7.94(s,1h)8.08(s,1h)。lrms+h+:496.1。化合物28:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯基)噁唑步骤1:4-(氯甲基)-2-(4-(三氟甲基)苯基)噁唑将4-(三氟甲基)苯甲酰胺(1.00g,5.29mmol)和1,3-二氯丙烷-2-酮(1.343g,10.57mmol)在甲苯(15.11ml)中的混合物加热至回流达24h。加入0.5eq的另外1,3-二氯丙烷-2-酮并且在回流下放置过夜。除去溶剂,残留物吸附在sio2上在isco上使用柱(hx-ea;0-70%)纯化。这得到0.62g的标题化合物。1hnmr(400mhz,cdcl3)δppm4.60(d,=0.78hz,2h)7.74(d,j=8.22hz,2h)7.76-7.78(d,1h)8.17(d,j=7.83hz,2h)。步骤2:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯基)噁唑在0℃将nah60%(6.6mg,0.16mmol)加入到4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚(0.030g,0.138mmol)在dmf(0.690ml)中的溶液中。恢复至室温,加入4-(氯甲基)-2-(4-(三氟甲基)苯基)噁唑(0.042g,0.159mmol)并且放置过夜。将反应用nh4cl溶液淬灭和用ea稀释。分离有机相,水相用ea萃取。将它们合并并且用盐水洗涤,经na2so4干燥,过滤,并且吸附在sio2上。在isco上使用柱(hx-ea;0-100%)纯化,得到0.042g的标题化合物。1hnmr(400mhz,cdcl3)δppm1.58-1.70(m,2h)1.88-2.00(m,1h)2.62(t,j=7.43hz,2h)4.40(t,j=7.24hz,2h)5.08(d,j=0.78hz,2h)6.90-6.97(m,2h)7.09(d,j=8.61hz,2h)7.50(d,j=0.78hz,1h)7.70-7.74(m,2h)7.75(s,1h)7.79(s,1h)8.18(d,j=8.22hz,2h)。化合物29:(e)-n-(4-(4-羟基丁基)苯基)-2-(4-(三氟甲基)苯乙烯基)噁唑-4-甲酰胺向来自pct国际申请2004096796的(e)-2-(4-(三氟甲基)苯乙烯基)噁唑-4-甲酸(0.263g,0.929mmol)、三乙胺(0.25ml,1.85mmol)、4-(4-氨基苯基)丁烷-1-醇(0.184g,1.11mmol)和hobt(0.171g,1.114mmol)在dmf(1.857ml)中的混合物中,加入edc(0.196g,1.022mmol)。5h后,将其用nh4cl溶液和ea稀释。分离有机相,水相用ea萃取2次。将它们合并并且用水洗涤,将其经na2so4干燥,过滤,并且吸附在sio2上。在isco上使用柱(hx-ea;10-100%)纯化,得到0.174g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.36-1.48(m,2h)1.52-1.63(m,2h)2.55(t,j=7.63hz,2h)3.37-3.44(m,2h)4.36(t,j=5.09hz,1h)7.17(d,j=8.61hz,2h)7.36(d,j=16.43hz,1h)7.70(d,j=8.61hz,2h)7.74(d,j=16.43hz,1h)7.79(m,j=8.22hz,2h)7.98(m,j=8.22hz,2h)8.81(s,1h)10.08(s,1h)。化合物30:(e)-n-(4-(4-(1h-1,2,3-三唑-1-基)丁基)苯基)-2-(4-(三氟甲基)苯乙烯基)噁唑-4-甲酰胺步骤1:(e)-n-(4-(4-叠氮基丁基)苯基)-2-(4-(三氟甲基)苯乙烯基)噁唑-4-甲酰胺将该化合物根据化合物1的步骤2的方法b和(e)-n-(4-(4-羟基丁基)苯基)-2-(4-(三氟甲基)苯乙烯基)噁唑-4-甲酰胺制备。1hnmr(400mhz,dmso-d6)δppm1.43-1.68(m,4h)2.58(t,j=7.24hz,2h)3.35(t,j=6.65hz,2h)7.18(d,j=8.22hz,2h)7.36(d,j=16.43hz,1h)7.69-7.77(m,3h)7.80(m,j=8.22hz,2h)7.98(m,j=8.22hz,2h)8.82(s,1h)10.09(s,1h)。步骤2:(e)-n-(4-(4-(1h-1,2,3-三唑-1-基)丁基)苯基)-2-(4-(三氟甲基)苯乙烯基)噁唑-4-甲酰胺将该化合物根据化合物1的步骤3所述的方法用前述中间体制备。1hnmr(400mhz,dmso-d6)δppm1.51(quin,j=7.40hz,2h)1.83(quin,j=7.34hz,1h)2.57(t,j=7.63hz,2h)4.40(t,j=6.85hz,2h)7.15(d,j=8.22hz,2h)7.36(d,j=16.43hz,1h)7.67-7.77(m,4h)7.79(d,j=8.61hz,2h)7.98(d,j=8.22hz,2h)8.12(s,1h)8.81(s,1h)10.08(s,1h)。lrms+h+:482.1。化合物31:(e)-5-(二甲基氨基)-n-(2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基)萘-1-磺酰胺步骤1:n-(丁-3-炔-1-基)-5-(二甲基氨基)萘-1-磺酰胺将meoh(0.013ml,0.315mmol)加入到丁-3-炔-1-胺盐酸盐(0.075g,0.710mmol)、三乙胺(1.0ml,7.14mmol)和5-(二甲基氨基)萘-1-磺酰氯(0.085g,0.315mmol)在thf(2.5ml)中的混合物中。5min后,将其用ea-水稀释,分离有机相,用水洗涤。将其然后经na2so4干燥,过滤并且除去溶剂。在isco上使用柱(hx-ea;0-60%)纯化,得到0.055g的标题化合物。lrms+h+:303.1。步骤2:(e)-5-(二甲基氨基)-n-(2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基)萘-1-磺酰胺将该化合物以与化合物8类似的方式用(e)-4((4-(4-叠氮基丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑和前述中间体制备。1hnmr(400mhz,dmso-d6)δppm1.45(quin,j=7.20hz,2h)1.71(quin,j=7.34hz,2h)2.68(t,j=7.43hz,2h)3.04(q,j=6.70hz,2h)4.22(t,j=7.04hz,2h)4.98(s,2h)6.93(d,j=8.61hz,2h)7.08(d,j=8.61hz,2h)7.24(d,j=7.43hz,1h)7.34(d,j=16.43hz,1h)7.53-7.64(m,3h)7.67(s,1h)7.76(d,j=8.61hz,2h)7.95(d,j=8.22hz,2h)8.05(t,j=5.67hz,1h)8.10(dd,j=7.43,1.17hz,1h)8.23(s,1h)8.27(d,j=8.61hz,1h)8.45(d,j=8.61hz,1h)。lrms+h+:745.2。化合物32:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-甲氧基苯乙烯基)噁唑步骤1:(e)-4-(氯甲基)-2-(4-甲氧基苯乙烯基)噁唑在145℃将由在甲苯(6.2ml)中的相应羧酸根据化合物3的步骤1制备的(e)-3-(4-甲氧基苯基)丙烯酰胺(359mg,2,026mmol)和1,3-二氯丙烷-2-酮(514mg,4,05mmol)用dean-stark加热17h。将混合物在减压下浓缩,残留吸附在硅胶上,在isco上使用柱(hx-ea;0-35%)纯化,得到420mg的标题化合物。1hnmr(400mhz,cdcl3)δppm3.85(s,3h)4.54(d,j=0.78hz,2h)6.79(d,j=16.43hz,1h)6.90-6.95(m,2h)7.45-7.53(m,3h)7.61(s,1h)。步骤2:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-甲氧基苯乙烯基)噁唑在75℃将(e)-4-(氯甲基)-2-(4-甲氧基苯乙烯基)噁唑(100mg,0.400mmol)、4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚(96mg,0.441mmol)和k2co3(60.9mg,0.441mmol)在dmf(653μl,8.43mmol)中的混合物加热3小时。将其冷却至室温并且使化合物沉淀。将其加热以得到溶液,加入meoh(653μl,16.14mmol)和水(1088μl,60.4mmol)。冷却至20℃,搅拌45min。将固体收集在buchner上,将滤饼用水(2x1ml)洗涤,在35℃干燥,得到0.144g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.40-1.54(m,2h)1.81(quin,j=7.34hz,2h)2.52-2.57(m,2h)3.79(s,3h)4.39(t,j=7.04hz,2h)4.95(s,2h)6.89-7.04(m,5h)7.06-7.13(m,2h)7.47(d,j=16.43hz,1h)7.62-7.72(m,3h)8.09-8.17(m,2h)。lrms+h)+:431.1。化合物33:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-溴苯乙烯基)噁唑步骤1:(e)-2-(4-溴苯乙烯基)-4-(氯甲基)噁唑根据化合物32的步骤1,由相应羧酸根据化合物3的步骤1制备的(e)-3-(4-溴苯基)丙烯酰胺和1,3-二氯丙烷-2-酮得到标题化合物。1hnmr(400mhz,cdcl3)δppm4.54(d,j=0.78hz,2h)6.91(d,j=16.04hz,1h)7.39(m,j=8.61hz,2h)7.48(d,j=16.43hz,1h)7.53(m,j=8.61hz,2h)7.64(s,1h)。步骤2:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-溴苯乙烯基)噁唑根据化合物1的步骤5的方法,将(e)-2-(4-溴苯乙烯基)-4-(氯甲基)噁唑与4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚反应。1hnmr(400mhz,dmso-d6)dppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.58(m,2h)4.39(t,j=7.04hz,2h)4.97(s,2h)6.93(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.21(d,j=16.43hz,1h)7.51(d,j=16.43hz,1h)7.57-7.65(m,2h)7.69(d,j=8.61hz,3h)8.11(d,j=0.78hz,1h)8.20(s,1h)。hrms+h+:481.1037。化合物34:(e)-二乙基氨基甲酸4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基酯将二乙基氨基甲酰氯(6.8μl,0.054mmol)加入到(e)-4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-醇(0.015g,0.036mmol)在吡啶(0.012ml)中的悬浮液中,在100℃将溶液加热8h。除去溶剂,残留物在isco上使用柱(dcm-meoh;0-20%)纯化,得到0.012g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.03(t,j=7.04hz,6h)1.46-1.65(m,4h)2.51-2.58(m,2h)3.19(q,j=7.04hz,4h)3.99(t,j=6.06hz,2h)4.99(s,2h)6.95(d,j=8.61hz,2h)7.12(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(d,j=8.22hz,2h)7.95(d,j=8.22hz,2h)8.24(s,1h)。lrms+h+:517.2。化合物35:(e)-吗啉-4-甲酸4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基酯将该化合物以与化合物34类似的方式用吗啉-4-碳酰氯制备。1hnmr(400mhz,dmso-d6)δppm1.43-1.64(m,4h)2.51-2.57(m,2h)3.53(t,j=4.89hz,4h)3.95-4.04(m,2h)4.99(s,2h)6.95(d,j=8.61hz,2h)7.12(d,j=8.22hz,2h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(d,j=8.22hz,2h)7.95(d,j=7.83hz,2h)。lrms+h+:531.2。化合物36:(e)-二甲基氨基甲酸4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基酯将该化合物以与化合物34类似的方式用二甲基氨基甲酰氯制备。1hnmr(400mhz,dmso-d6)δppmppm1.47-1.64(m,4h)2.51-2.57(m,2h)2.81(br.s.,6h)3.93-4.00(m,2h)4.99(s,2h)6.95(d,j=8.61hz,2h)7.12(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(d,j=8.61hz,2h)7.95(d,j=8.22hz,2h)8.24(s,1h)。lrms+h+:489.2。化合物37至48以下化合物(37-48)在三个步骤中根据以下方法制备。步骤1:丙烯酰胺由相应羧酸根据化合物3的步骤1的方法制备;氯甲基噁唑由相应的丙烯酰胺根据化合物3的步骤2的方法制备(或其可在没有溶剂的情况下在130℃制备直至完成)。最后一个步骤用4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚和相应的氯甲基噁唑根据化合物1的步骤5来完成。化合物37:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苄腈1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.24hz,2h)2.52-2.57(m,2h)4.39(t,j=7.04hz,2h)4.98(s,2h)6.94(m,j=8.61hz,2h)7.09(m,j=8.61hz,2h)7.37(d,j=16.43hz,1h)7.60(d,j=16.43hz,1h)7.70(s,1h)7.87(d,j=8.61hz,2h)7.93(d,j=8.22hz,2h)8.11(s,1h)8.24(s,1h)。lrms+h+:426.2。化合物38:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-氯苯乙烯基)噁唑1hnmr(400mhz,dmso-δ6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.57(m,2h)4.39(t,j=7.04hz,2h)4.97(s,2h)6.93(m,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.19(d,j=16.43hz,1h)7.47(d,j=8.61hz,2h)7.53(d,j=16.43hz,1h)7.68-7.72(m,1h)7.76(d,j=8.61hz,2h)8.11(s,1h)8.19(s,1h)。lrms+h+:435.1。化合物39:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-氟苯乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.57(m,2h)4.39(t,j=7.04hz,2h)4.96(s,2h)6.93(d,j=8.22hz,2h)7.05-7.18(m,3h)7.25(t,j=8.80hz,2h)7.53(d,j=16.43hz,1h)7.70(s,1h)7.79(dd,j=8.61,5.87hz,2h)8.11(s,1h)8.18(s,1h)。lrms+h+:419.1。化合物40:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-硝基苯乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.58(m,2h)4.39(t,j=7.04hz,2h)4.99(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.42(d,j=16.82hz,1h)7.66(d,j=16.43hz,1h)7.70(s,1h)8.01(d,j=9.00hz,2h)8.11(s,1h)8.20-8.31(m,3h)。lrms+h+:446.1。化合物41:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟苯乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.24hz,2h)2.51-2.57(m,2h)4.39(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.23(d,j=16.82hz,1h)7.26-7.33(m,2h)7.39-7.48(m,1h)7.58(d,j=16.82hz,1h)7.70(s,1h)7.91(t,j=7.83hz,1h)8.11(s,1h)8.21(s,1h)。lrms+h+:419.1。化合物42:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-硝基苯乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.58(m,2h)4.39(t,j=7.04hz,2h)4.99(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.22hz,2h)7.24(d,j=16.04hz,1h)7.59-7.67(m,1h)7.70(s,1h)7.74-7.83(m,2h)8.06(d,j=8.22hz,2h)8.11(s,1h)8.25(s,1h)。lrms+h+:446.1。化合物43:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(3-硝基苯乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.24hz,2h)2.52-2.57(m,2h)4.39(t,j=7.04hz,2h)4.99(s,2h)6.94(d,j=8.61hz,2h)7.10(d,j=8.61hz,2h)7.41(d,j=16.43hz,1h)7.63-7.76(m,3h)8.11(s,1h)8.16-8.28(m,3h)8.57(s,1h)。lrms+h+:446.1。化合物44:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(三氟甲基)苯乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.57(m,2h)4.39(t,j=7.04hz,2h)4.99(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.31(d,j=16.04hz,1h)7.55-7.63(m,1h)7.66-7.78(m,3h)7.81(d,j=7.83hz,1h)8.07-8.17(m,2h)8.24(s,1h)。lrms+h+:469.1。化合物45:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2,4-二氟苯乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.24hz,2h)2.52-2.57(m,2h)4.39(t,j=7.04hz,2h)4.97(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.14-7.25(m,2h)7.36(ddd,j=11.35,9.19,2.54hz,1h)7.52(d,j=16.82hz,1h)7.70(s,1h)7.99(td,j=8.80,7.04hz,1h)8.11(s,1h)8.21(s,1h)。lrms+h+:437.1。化合物46:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2,6-二氟苯乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.56(m,2h)4.39(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.16(d,j=16.82hz,1h)7.23(t,j=8.80hz,2h)7.42-7.54(m,2h)7.70(s,1h)8.08-8.13(m,1h)8.25(s,1h)。lrms+h+:437.1。化合物47:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-苯乙烯基噁唑1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.57(m,2h)4.39(t,j=7.04hz,2h)4.97(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.22hz,2h)7.16(d,j=16.43hz,1h)7.33-7.47(m,3h)7.53(d,j=16.43hz,1h)7.66-7.77(m,3h)8.11(s,1h)8.18(s,1h)。lrms+h+:401.2。化合物48:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑1hnmr(500mhz,cdcl3)dppm1.60-1.67(m,2h)1.95(dt,j=15.05,7.45hz,2h)2.61(t,j=7.57hz,2h)4.40(t,j=7.09hz,2h)5.03(d,j=0.95hz,2h)6.91-6.94(m,2h)7.06-7.10(m,2h)7.14(d,j=16.71hz,1h)7.39(d,j=10.40hz,1h)7.45(d,j=8.51hz,1h)7.50(d,j=0.95hz,1h)7.62-7.72(m,4h)。lrms+h+:487.3。化合物49:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(3-(三氟甲基)苯乙烯基)噁唑步骤1:(e)-3-(3-(三氟甲基)苯基)丙烯酰胺将该化合物以与化合物3的步骤1类似的方式从(e)-3-(3-(三氟甲基)苯基)丙烯酸开始制备。lrms+h+:216.2。步骤2:(e)-4-(氯甲基)-2-(3-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物3的步骤2类似的方式制备。lrms+h+:288.1。步骤3:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(3-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物3的步骤3类似的方式用前述中间体和4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚制备。1hnmr(500mhz,cdcl3)δppm1.60-1.68(m,2h)1.95(dt,j=14.90,7.53hz,2h)2.62(t,j=7.57hz,2h)4.40(t,j=7.09hz,2h)5.03(d,j=0.95hz,2h)6.93(d,j=8.50hz,2h)7.01(d,j=16.39hz,1h)7.08(d,j=8.50hz,2h)7.50(d,j=0.95hz,1h)7.53(t,j=7.60hz,1h)7.56(d,j=16.71hz,1h)7.59-7.62(m,1h)7.67-7.73(m,3h)7.77(s,1h)。lrms+h+:469.3。化合物50:(e)-4-((4-(3-(1h-1,2,3-三唑-1-基)丙基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑步骤1:(e)-3-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丙烷-1-醇向4-(3-羟基丙基)苯酚(116mg,0.765mmol)在dmf(6953μl)中的溶液中加入nah(64.0mg,1.599mmol)。30min后,将(e)-4-(氯甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑(200mg,0.695mmol)加入到冷冻的溶液中。2h后,在室温将混合物倒入水中,用ea萃取。有机层用水、1nnaoh、然后盐水洗涤,经na2so4干燥,过滤,并且浓缩。将残留物吸附到硅胶上,通过isco使用柱(hx_ea;0-100%)纯化,得到0.186mg的标题化合物。lrms+h+:404.3。步骤2:(e)-4-((4-(3-碘丙基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑向(e)-3-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丙烷-1-醇(186mg,0.461mmol)在ea(4.61ml)中的冷冻溶液中加入三乙胺(96μl,0.692mmol),逐滴加入甲磺酰氯(53.9μl,0.692mmol)。在0℃下30min后,使得混合物温热至室温。1h后,加入另外的甲磺酰氯(6μl)和三乙胺(10μl),并且在室温搅拌过夜。加入另外的甲磺酰氯(10μl)和三乙胺(20μl),搅拌1.5h。将混合物用冰水、然后盐水洗涤。有机层经na2so4干燥,过滤并且浓缩,得到(e)-甲磺酸3-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丙基酯(235mg)。向前述加合物在丙酮(2.102ml)中的溶液中,加入nai(366mg,2.440mmol),将混合物在回流下搅拌1.5h。将浓缩的残留物溶解在乙酸乙酯(20ml)中,用水、硫代硫酸钠水溶液、然后盐水洗涤。有机层经na2so4干燥,过滤并且浓缩,得到251mg的标题化合物。lrms+h+:5142。步骤3:(e)-4-((4-(3-(1h-1,2,3-三唑-1-基)丙基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑向(e)-4-((4-(3-碘丙基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑(250mg,0.488mmol)和1h-1,2,3-三唑(42.4μl,0.732mmol)在dmf(4880μl)中的溶液中加入k2co3(101mg,0.732mmol)。在60℃将混合物搅拌整个周末持续48h。将混合物用乙酸乙酯(20ml)稀释,用水、然后盐水洗涤。有机层经na2so4干燥,过滤,并且浓缩。残留物通过isco使用柱(hx-ea;0-100%)纯化,得到0.095g的标题化合物。1hnmr(500mhz,cdcl3)δppm2.25(quin,j=7.25hz,2h)2.62(t,j=7.41hz,2h)4.40(t,j=7.09hz,2h)5.04(d,j=0.95hz,2h)6.93-6.97(m,2h)7.03(d,j=16.39hz,1h)7.10-7.14(m,2h)7.53(s,1h)7.57(d,j=16.39hz,1h)7.61-7.69(m,4h)7.73(s,1h)7.70(s,1h)。lrms+h+:455.3。化合物51:(e)-2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙醇该化合物根据国际专利公开号wo01/77107的实施例17(第98页)制备。lrms+h+:512.3。化合物52:(e)-2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙胺向(e)-2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙醇(100mg,0.195mmol)、三苯基膦(56.4mg,0.215mmol)和异吲哚啉-1,3-二酮(31.6mg,0.215mmol)在thf(1.955ml)中的溶液中,加入diad(119mg,0.586mmol)。在室温将混合物搅拌3h。将反应用ea稀释,用1nnaoh水溶液、盐水洗涤,经na2so4干燥,过滤,并且浓缩。将该残留物悬浮在etoh(5ml,86mmol)中,用2-氨基乙醇(11.94mg,0.195mmol)在回流下处理1h,在室温将悬浮液静置整个周末。将混合物浓缩,用ea稀释,用水、然后盐水洗涤,经na2so4干燥,过滤,并且浓缩。残留物通过isco使用柱(dcm-meoh;0-30%)纯化,得到0.065g的标题化合物。参考:pct2003031442。1hnmr(500mhz,cdcl3)δppm1.57-1.65(m,2h)1.71-1.79(m,2h)2.60(t,j=7.41hz,2h)2.76(t,j=6.62hz,2h)3.15(t,j=6.46hz,2h)3.85(t,j=7.25hz,2h)5.03(d,j=0.95hz,2h)6.81(d,j=1.26hz,1h)6.90-6.97(m,3h)7.02(d,j=16.39hz,1h)7.06-7.11(m,2h)7.56(d,j=16.71hz,1h)7.61-7.68(m,4h)7.69(s,1h)。化合物53:(e)-二甲基氨基甲酸2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙基酯向(e)-2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙醇(16mg,0.031mmol)和三乙胺(6.50μl,0.047mmol)在thf(2ml)中的冷冻溶液中,加入二甲基氨基甲酰氯(3.15μl,0.034mmol)。在室温使混合物搅拌5h。加入另外的et3n(43.3μl,0.311mmol)和二甲基氨基甲酰氯(14.31μl,0.155mmol),搅拌两天。将其然后加热至50℃持续10h。将混合物在ea和稀释的nahco3之间分配,然后用ea(3x50ml)萃取。将合并的有机相经na2so4干燥,过滤,并且浓缩。残留物通过isco使用柱(hx-ea;0-100%)、然后转换为dcm-meoh(0-60%)纯化,得到0.0055g的标题化合物。1hnmr(500mhz,cdcl3)δppm1.57-1.66(m,2h)1.71-1.81(m,2h)2.59(t,j=7.57hz,2h)2.84-2.97(m,6h)3.02(t,j=7.25hz,2h)3.89(t,j=7.09hz,2h)4.42(t,j=7.25hz,2h)5.03(d,j=0.95hz,2h)6.81(d,j=1.26hz,1h)6.89-6.96(m,2h)6.97(d,j=1.26hz,1h)7.02(d,j=16.39hz,1h)7.05-7.12(m,2h)7.56(d,j=16.39hz,1h)7.60-7.67(m,4h)7.69(s,1h)。lrms+h+:583.3。化合物54:(e)-n-(2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙基)甲磺酰胺向(e)-2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙胺(35mg,0.069mmol)在吡啶(0.5ml)中的溶液中,加入甲磺酰氯(6.68μl,0.086mmol)。在室温将乳状悬浮液搅拌1.5h,加热至50℃持续1h。加入另外的甲磺酰氯(6.68μl,0.086mmol),在室温搅拌2h,然后加热至50℃达1h并且在室温放置过夜。将混合物以ea和水分配,然后用ea萃取两次。合并的有机相经na2so4干燥,过滤,并且浓缩。残留物通过isco使用柱以dcm-meoh(0-30%)纯化,得到0.025g的标题化合物。1hnmr(500mhz,cdcl3)δppm1.55-1.69(m,2h)1.69-1.80(m,2h)2.60(t,j=7.41hz,2h)2.89(br.s.,2h)2.96(s,3h)3.52-3.64(m,2h)3.83(t,j=7.09hz,2h)5.03(d,j=0.95hz,2h)6.12(br.s.,1h)6.83(s,1h)6.86-6.98(m,3h)7.02(d,j=16.39hz,1h)7.05-7.12(m,2h)7.56(d,j=16.39hz,1h)7.59-7.68(m,4h)7.70(s,1h)。lrms+h+:589.3。化合物55:(e)-1,1,1-三氟-n-(2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙基)甲磺酰胺向(e)-2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-咪唑-2-基)乙胺(29mg,0.057mmol)在吡啶(0.5ml)中的冷冻溶液中,加入三氟甲磺酸酐(0.048ml,0.284mmol)。在室温将其搅拌1.5h,混合物用水稀释,用ea萃取两次。水层用nh4cl饱和,再用ea萃取两次。合并的有机层经na2so4干燥,过滤,并且浓缩。粗制品通过isco使用柱(dcm-meoh;0-50%)纯化,得到0.005g的标题化合物。1hnmr(500mhz,cdcl3)δppm1.21-1.32(m,2h)1.60-1.70(m,2h)1.72-1.82(m,2h)2.62(t,j=7.41hz,2h)2.89(t,j=5.83hz,1h)3.72(t,j=5.83hz,1h)3.84(t,j=7.25hz,2h)5.04(d,j=0.95hz,2h)6.85(s,1h)6.90-6.99(m,3h)7.04(d,j=16.39hz,1h)7.07-7.14(m,2h)7.58(d,j=16.39hz,1h)7.61-7.69(m,5h)7.69-7.73(m,1h)。lrms+h+:643.3。化合物56:(e)-1-(4-(4-((3-(4-(三氟甲基)苯乙烯基)苄基)氧基)苯基)丁基)-1h-1,2,3-三唑步骤1:(3-甲基苄基)三苯基氯化鏻将1-(氯甲基)-3-甲基苯(10ml,76mmol)and三苯基膦(22.82g,87mmol)在二甲苯(106ml,288mmol)中的混合物加热至回流过夜。将其冷却至20℃,搅拌1小时。将固体收集在buchner上,滤饼用对二甲苯(4x25ml)洗涤,在20℃在高真空下干燥直到恒重。这得到28g的标题化合物。lrms+367.1。步骤2:(e)-1-甲基-3-(4-(三氟甲基)苯乙烯基)苯将叔丁醇钾(2.198g,19.59mmol)加入到在乙醇(21.91ml,375mmol)中的(3-甲基苄基)三苯基氯化鏻(7.52g,18.67mmol)和4-(三氟甲基)苯甲醛(2.5ml,18.31mmol)。1h后,加入水(8.79ml,488mmol),将所得白色悬浮液搅拌30分钟。将固体收集在buchner上,滤饼用etoh:水(7:4,2x5ml)洗涤,在20℃在高真空下干燥直到恒重。这得到2.52g标题化合物。1hnmr(500mhz,cdcl3)dppm2.40(s,3h)7.18(d,j=16.43hz,1h)7.13(d,j=7.04hz,1h)7.12(d,j=16.43hz,1h)7.26-7.31(m,1h)7.37(s,1h)7.34(s,1h)7.61(s,4h)。步骤3:(e)-1-(溴甲基)-3-(4-(三氟甲基)苯乙烯基)苯将在ccl4(11.41ml,118mmol)中的(e)-1-甲基-3-(4-(三氟甲基)苯乙烯基)苯(1g,3.81mmol)加热至70℃持续30分钟,加入n-溴琥珀酰亚胺(0.780g,4.38mmol)和aibn(0.063g,0.381mmol)。6h后,冷却至65℃,过滤以除去琥珀酰亚胺。浓缩滤液,残留物在isco上使用柱(hex/etoac;0-30)纯化,得到0.753g的标题化合物。步骤4:(e)-1-(4-(4-((3-(4-(三氟甲基)苯乙烯基)苄基)氧基)苯基)丁基)-1h-1,2,3-三唑根据类似于化合物3的方法,4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚和(e)-1-(溴甲基)-3-(4-(三氟甲基)苯乙烯基)苯得到标题化合物。1hnmr(400mhz,dmso-d6)δppm1.47(quin,j=7.63hz,2h)1.80(quin,j=7.34hz,2h)2.52-2.56(m,2h)4.38(t,j=7.04hz,2h)5.09(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.33-7.51(m,4h)7.61(d,j=7.43hz,1h)7.67-7.76(m,4h)7.83(d,j=8.22hz,2h)8.10(s,1h)。lrms+h+:478.1。化合物57:(e)-1-(4-(4-((4-(4-(三氟甲基)苯乙烯基)苄基)氧基)苯基)丁基)-1h-1,2,3-三唑步骤1:(4-甲基苄基)三苯基氯化鏻将该化合物以与类似的方式化合物56的步骤1制备。lrms+367.1。步骤2:(e)-1-甲基-4-(4-(三氟甲基)苯乙烯基)苯用3%碘在回流的甲苯(0.2m)中热力学平衡过夜后,将该化合物以与化合物56的步骤2类似的方式制备。1hnmr(500mhz,cdcl3)δppm2.38(s,3h)7.08(d,j=16.43hz,1h)7.18(d,j=16.40hz,1h)7.20(d,j=7.83hz,2h)7.44(d,j=8.22hz,2h)7.60(s,4h)。步骤3:(e)-1-(溴甲基)-4-(4-(三氟甲基)苯乙烯基)苯将该化合物以与化合物56的步骤3类似的方式制备。1hnmr(500mhz,cdcl3)δppm4.53(s,2h)7.10-7.22(m,2h)7.39-7.45(m,2h)7.52(d,j=8.22hz,2h)7.58-7.64(m,4h)。步骤4:(e)-1-(4-(4-((4-(4-(三氟甲基)苯乙烯基)苄基)氧基)苯基)丁基)-1h-1,2,3-三唑将该化合物以与化合物56的步骤4类似的方式制备。1hnmr(400mhz,dmso-d6)δppm1.47(quin,j=7.53hz,2h)1.80(quin,j=7.34hz,2h)2.52-2.56(m,2h)4.38(t,j=7.04hz,2h)5.08(s,2h)6.92(d,j=8.61hz,2h)7.08(d,j=8.61hz,2h)7.15(s,1h)7.32-7.50(m,4h)7.63-7.76(m,4h)7.79-7.86(m,2h)8.11(d,j=0.78hz,1h)。lrms+h+:478.1。化合物58:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯甲酸甲酯步骤1:(e)-3-(4-(甲氧羰基)苯基)丙烯酸将4-甲酰基苯甲酸甲酯(5g,30.5mmol)、丙二酸(4.75g,45.7mmol)和哌啶(0.244ml,2.467mmol)在吡啶(30.5ml,377mmol)中的混合物加热至85-90℃。3h后,冷却至20℃,倒入在(305ml,609mmol)水中的hcl2m。将所得白色悬浮液冷却至0℃,搅拌45分钟。将固体收集在buchner上,将滤饼用水(15ml)、然后ch3cn(2x15ml)洗涤。将产物在20℃在高真空下干燥直到恒重。这得到5.94g的标题产物。1hnmr(400mhz,dmso-d6)δppm3.86(s,3h)6.66(d,j=16.04hz,1h)7.64(d,j=16.04hz,1h)7.84(d,j=8.61hz,2h)7.97(d,j=8.22hz,2h)12.58(s,1h)。步骤2:(e)-4-(3-氨基-3-氧代丙-1-烯-1-基)苯甲酸甲酯将该化合物以与化合物3的步骤1类似的方式用前述中间体制备。1hnmr(400mhz,dmso-d6)δppm3.86(s,3h)6.73(d,j=16.04hz,1h)7.21(br.s.,1h)7.46(d,j=16.04hz,1h)7.61(br.s.,1h)7.70(d,j=8.22hz,2h)7.98(d,j=8.22hz,2h)。步骤3:(e)-4-(2-(4-(氯甲基)噁唑-2-基)乙烯基)苯甲酸甲酯在微波小瓶中加入(e)-甲基4-(3-氨基-3-氧代丙-1-烯-1-基)苯甲酸酯(0.750g,3.65mmol)和1,3-二氯丙烷-2-酮(0.557g,4.39mmol),将其在130℃加热。1h后,冷却至20℃,将所得固体溶解在ch2cl2(10ml)中,经玻璃棉过滤以除去深色的不可溶固体。除去溶剂后,残留物在isco上使用柱(hex/etoac;0-50%)纯化,得到0.258g的标题化合物。1hnmr(400mhz,dmso-d6)δppm3.87(s,3h)4.71(s,2h)7.31(d,j=16.43hz,1h)7.60(d,j=16.43hz,1h)7.88(d,j=8.22hz,2h)7.97(d,j=8.22hz,2h)8.22(s,1h)。步骤4:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯甲酸甲酯将该化合物以与化合物32的步骤2类似的方式由(e)-甲基4-(2-(4-(氯甲基)噁唑-2-基)乙烯基)苯甲酸酯和4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚制备。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.57(m,2h)3.86(s,3h)4.39(t,j=7.04hz,2h)4.98(s,2h)6.94(m,j=8.22hz,2h)7.09(m,j=8.61hz,2h)7.31(d,j=16.43hz,1h)7.59(d,j=16.43hz,1h)7.70(s,1h)7.87(d,j=8.22hz,2h)7.97(d,j=8.22hz,2h)8.11(s,1h)8.23(s,1h)。lrms+h+:459.1。化合物59:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-n-(丙-2-炔-1-基)苯甲酰胺步骤1:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯甲酸将naoh0.5m(0.654ml,0.327mmol)加入到在thf(1.5ml)中的(e)-甲基4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯甲酸酯(0.150g,0.327mmol)。48h后,加入在水(0.294ml,0.147mmol)中的naoh0.5m。68h后,加入在水(0.981ml,0.491mmol)中的hcl0.5m,将所得悬浮液搅拌持续1h。将固体收集在buchner上,将滤饼用水(3x1ml)洗涤,在40℃在高真空下干燥直到恒重。这得到0.132g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.24hz,2h)2.52-2.57(m,2h)4.39(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.30(d,j=16.43hz,1h)7.59(d,j=16.43hz,1h)7.70(s,1h)7.84(d,j=8.22hz,2h)7.95(d,j=8.61hz,2h)8.11(s,1h)8.23(s,1h)13.03(br.s.,1h)。lrms+h+:445.2。步骤2:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-n-(丙-2-炔-1-基)苯甲酰胺基)苯甲酰胺将edc(19.41mg,0.101mmol)加入到在dmf(500μl,6.45mmol)中的(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯甲酸(30mg,0.067mmol)和丙炔胺(10.81μl,0.169mmol)并且放置过夜。加入meoh(500μl,12.35mmol)和水(850μl,47.2mmol),将所得悬浮液搅拌1小时。将固体收集在buchner上,将滤饼用水(3x0.5ml)洗涤,在40℃在高真空下干燥,得到0.022g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(dt,j=14.97,7.19hz,2h)2.52-2.58(m,2h)3.13(t,j=2.54hz,1h)4.07(dd,j=5.28,2.54hz,2h)4.39(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.28(d,j=16.43hz,1h)7.57(d,j=16.43hz,1h)7.70(s,1h)7.82(d,j=8.61hz,2h)7.89(d,j=8.61hz,2h)8.11(s,1h)8.22(s,1h)8.98(t,j=5.48hz,1h)。lrms+h+:482.2。化合物60:(e)-(4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯基)甲醇将lialh4(9.1mg,0.24mmol)加入到在thf(3.00ml,36.6mmol)中的(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯甲酸甲酯(0.050g,0.109mmol),将反应搅拌过夜。向反应混合物中加入水(9μl)、naoh3m(11.3μl)和水(27μl)。15分钟搅拌后,加入无水mgso4,搅拌15分钟。将其过滤,除去溶剂。这得到0.042g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.60hz,2h)1.81(quin,j=7.30hz,2h)2.52-2.57(m,2h)4.39(t,j=7.04hz,2h)4.52(d,j=5.48hz,2h)4.96(s,2h)5.24(t,j=5.50hz,1h)6.94(d,j=8.61hz,2h)7.06-7.16(m,3h)7.35(d,j=7.83hz,2h)7.51(d,j=16.43hz,1h)7.67(d,j=8.22hz,2h)7.70(s,1h)8.11(s,1h)8.17(s,1h)。lrms+h+:431.2。化合物61:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-甲氧基苯乙烯基)噁唑步骤1:(e)-3-(2-氟-4-甲氧基苯基)丙烯酸将该化合物以与类似的方式化合物58的步骤1用2-氟-4-(三氟甲氧基)苯甲醛制备。lrms–h+:249.1步骤2:(e)-3-(2-氟-4-甲氧基苯基)丙烯酰胺将该化合物以与化合物3的步骤1类似的方式用前述中间体制备。1hnmr(400mhz,dmso-d6)δppm3.80(s,3h)6.56(d,j=16.04hz,1h)6.84(dd,j=8.61,2.74hz,1h)6.91(dd,j=12.91,2.35hz,1h)7.08(br.s.,1h)7.41(d,j=16.04hz,1h)7.50-7.60(m,2h)。步骤3:(e)-4-(氯甲基)-2-(2-氟-4-甲氧基苯乙烯基)噁唑将(e)-3-(2-氟-4-甲氧基苯基)丙烯酰胺(0.250g,1.281mmol)和1,3-二氯丙烷-2-酮(0.195g,1.537mmol)加热至130℃持续1h。冷却至20℃,将所得黑色固体溶解在ch2cl2(4ml)中,经玻璃棉过滤以除去深色的不可溶固体。浓缩至干,残留物在isco上使用柱(hex/etoac;0-50%)纯化,得到89mg的标题化合物。1hnmr(400mhz,dmso-d6)δppm3.82(s,3h)4.69(s,2h)6.86(dd,j=8.61,2.35hz,1h)6.93(dd,j=13.11,2.54hz,1h)7.06(d,j=16.43hz,1h)7.51(d,j=16.43hz,1h)7.83(t,j=9.00hz,1h)8.15(s,1h)。步骤4:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-甲氧基苯乙烯基)噁唑将在dmf(183μl,2.360mmol)中的(e)-4-(氯甲基)-2-(2-氟-4-甲氧基苯乙烯基)噁唑(30mg,0.112mmol)、4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚(26.8mg,0.123mmol)和k2co3(17.04mg,0.123mmol)加热至75℃持续5h。将其冷却至20℃,加入meoh(183μl,4.52mmol)和水(305μl,16.90mmol)。将混合物搅拌过夜。将固体收集在buchner上,将滤饼用水(3x0.5ml)洗涤,在40℃干燥,得到0.042g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.56(m,2h)3.82(s,3h)4.39(t,j=7.04hz,2h)4.96(s,2h)6.81-6.97(m,4h)7.02-7.12(m,3h)7.50(d,j=16.82hz,1h)7.70(s,1h)7.82(t,j=9.00hz,1h)8.11(s,1h)8.17(s,1h)。lrms+h+:449.2。化合物62:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯酚将(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-甲氧基苯乙烯基)噁唑(50mg,0.116mmol)在hbr48wt%中在水(201μl,1.777mmol)中的混合物加热至90℃。2h后,加入水(1ml)和meoh(1ml),将混合物用ch2cl2(3x2ml)萃取。将有机相合并,除去溶剂。残留物在isco上使用柱(ch2cl2/meoh;0-100%)纯化。将由此得到的固体悬浮在ch3cn(0.5ml)中,加热至回流持续15分钟。将其冷却至20℃,搅拌1小时。将固体收集在buchner上,将滤饼用ch3cn(2x0.15ml)洗涤,在40℃在高真空下干燥。这得到0.006g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.70hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.56(m,2h)4.39(t,j=7.04hz,2h)4.94(s,2h)6.79(m,j=8.61hz,2h)6.85-6.97(m,3h)7.09(m,j=8.61hz,2h)7.42(d,j=16.43hz,1h)7.54(d,j=8.61hz,2h)7.70(s,1h)8.11(s,1h)8.11(s,1h)9.85(s,1h)。lrms+h+:417.1。化合物63:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯甲酰胺将在etoh(1777μl,30.4mmol)和dmf(901μl,11.63mmol)中的(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苄腈(50mg,0.118mmol)加热至50℃持续5分钟,得到溶液。然后加入在水(96μl,0.288mmol)中的naoh3m和在水(48.0μl,0.470mmol)中的过氧化氢30wt%。3小时后,然后冷却至20℃,继续搅拌。加入水(900μl,49.9mmol),将悬浮液搅拌1小时。将固体然后收集在buchner上,将滤饼用水(3x0.5ml)洗涤,在40℃在高真空下干燥直到。这得到0.044g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.57(m,2h)4.39(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.22hz,2h)7.27(d,j=16.43hz,1h)7.41(br.s.,1h)7.57(d,j=16.43hz,1h)7.70(s,1h)7.80(d,j=8.61hz,2h)7.90(d,j=8.22hz,2h)8.02(br.s.,1h)8.11(s,1h)8.21(s,1h)。化合物64:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-乙炔基苯乙烯基)噁唑向容纳(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-溴苯乙烯基)噁唑(75mg,0.156mmol)、碘化铜(i)(2.9mg,0.016mmol)和(ph3p)2pdcl2(10.98mg,0.016mmol)的n2吹扫的小瓶中,加入dmf(608μl,7.85mmol)、三乙胺(607μl,4.36mmol)和三甲基甲硅烷基乙炔(110μl,0.782mmol)。反应加热至60℃过夜,经0.45μm过滤器过滤,除去溶剂。残留物溶解在thf(3000μl,36.6mmol)中,冷却至0℃。加入在thf(203μl,0.203mmol)中的tbaf1m,30分钟后,加入ch2cl2(20ml)。将其用水(20ml)洗涤,有机层经mgso4干燥,过滤,并且浓缩。残留物在isco上使用柱(ch2cl2/meoh;0-10%)纯化,得到0.024g棕褐色固体,将其悬浮在ch3cn(0.5ml)中,加热至回流持续15分钟。冷却至20℃,搅拌30分钟。将固体收集在buchner上,将滤饼用ch3cn(1x0.5ml)洗涤,在40℃在高真空下干燥,得到0.0045g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.70hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.58(m,2h)4.39(t,j=7.04hz,2h)4.97(d,j=2.35hz,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.22hz,2h)7.21(d,j=16.43hz,1h)7.27(d,j=16.43hz,1h)7.46-7.61(m,2h)7.65(d,j=8.22hz,1h)7.70(s,1h)7.74(d,j=8.22hz,1h)7.80(d,j=8.22hz,1h)8.11(s,1h)8.21(d,j=6.26hz,1h)。化合物65:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑在75℃将(e)-4-(氯甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑(0.118g,0.418mmol)、4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚(0.100g,0.460mmol)和k2co3(0.069g,0.502mmol)的混合物在dmf(0.837ml)中加热过夜。将温度恢复至50℃,加入meoh(0.677ml,16.74mmol)、随后加入水(1.131ml,62.8mmol)。将温度恢复至室温,将混合物过滤,并且吸附在sio2上,在isco上使用柱(dcm-meoh;0-10%)纯化,得到0.099g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.60hz,2h)1.81(quin,j=7.60hz,2h)2.53(t,j=7.60hz,2h)4.39(t,j=7.04hz,2h)5.00(s,2h)6.94(2,j=8.61hz,2h)7.10(2,j=8.61hz,2h)7.47(d,j=16.82hz,1h)7.61(d,j=16.82hz,1h)7.70(s,1h)8.09-8.15(m,2h)8.17-8.26(m,2h)8.29(s,1h)。化合物66:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-3-氟苯胺向(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑(0.096g,0.207mmol)在thf(3.0ml)-etoac(4.0ml)中的混合物中,加入sncl2.h2o(0.234g,1.036mmol),将其加热至75℃持续5h。用nahco3溶液溶胶淬灭后,将其用ea稀释,在硅藻土上过滤,分离有机相。水相用ea萃取,合并的有机相用盐水洗涤,经na2so4干燥进行干燥。过滤后,除去溶剂。这得到0.069g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.34hz,2h)2.52-2.56(m,2h)4.39(t,j=7.04hz,2h)4.93(s,2h)5.95(s,2h)6.34(dd,j=13.89,2.15hz,1h)6.42(dd,j=8.61,1.96hz,1h)6.79(d,j=16.43hz,1h)6.93(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.40(d,j=16.43hz,1h)7.49(t,j=8.80hz,1h)7.70(s,1h)8.10(d,j=8.22hz,2h)。化合物67:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-叠氮基-2-氟苯乙烯基)噁唑向(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-3-氟苯胺(0.068g,0.157mmol)在乙腈(1.05ml)中的0℃的悬浮液中,加入亚硝酸叔丁酯(0.026ml,0.220mmol),随后加入三甲基甲硅烷基叠氮化物(0.025ml,0.188mmol)。将其恢复至室温,3h后,除去溶剂。在isco上使用柱(dcm-meoh)纯化,得到0.039g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.63hz,2h)1.81(quin,j=7.60hz,2h)2.52-2.57(m,2h)4.39(t,j=7.04hz,2h)4.97(s,2h)6.93(d,j=8.61hz,2h)7.05(dd,j=8.22,2.35hz,1h)7.09(d,j=8.61hz,2h)7.12-7.24(m,2h)7.52(d,j=16.43hz,1h)7.70(s,1h)7.95(t,j=8.61hz,1h)8.11(s,1h)8.20(s,1h)。化合物68:(e)-二甲基氨基甲酸2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯将二甲基氨基甲酰氯(5.43μl,0.059mmol)加入到在吡啶(0.013ml)中的化合物4(0.020g,0.039mmol),使其恢复至100℃持续10h。然后将其用ea稀释,用cuso4溶液淬灭。分相,水相用ea萃取2次。将它们合并,经na2so4干燥,过滤,并且在制备型hplc(35-100%meoh(5%hco2h)-水(5%hco2h)上纯化,得到0.007g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.47(quin,j=7.53hz,2h)1.78(quin,j=7.60hz,2h)2.51-2.56(m,2h)2.76(br.s.,6h)2.91(t,j=6.65hz,2h)4.17(t,j=6.65hz,2h)4.33(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.61(d,j=16.43hz,1h)7.76(d,j=8.22hz,2h)7.89(s,1h)7.95(d,j=7.83hz,2h)8.24(s,1h)。化合物69:(e)-(2-甲氧基乙基)氨基甲酸2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯在室温将1-异氰酸根合-2-甲氧基乙烷(7.89mg,0.078mmol)加入到化合物4(0.020g,0.039mmol)和许尼希碱(0.014ml,0.078mmol)在dcm(0.098ml)中的悬浮液中。3h后,除去溶剂,残留物吸附在sio2上。在isco上使用柱(hx-ea;20-100%)纯化,得到0.017g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.49(quin,j=7.20hz,2h)1.79(quin,j=7.24hz,2h)2.52-2.57(m,2h)2.89(t,j=6.85hz,2h)3.07-3.15(m,2h)3.21(s,3h)3.27-3.31(m,2h)4.16(t,j=6.85hz,2h)4.32(t,j=6.85hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.10(d,j=8.22hz,2h)7.15(t,j=5.67hz,1h)7.34(d,j=16.43hz,1h)7.62(d,j=16.43hz,1h)7.76(d,j=8.22hz,2h)7.90(s,1h)7.95(d,j=8.22hz,2h)8.23(s,1h)。化合物70:(e)-异丙基氨基甲酸2-(1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯将该化合物以与化合物69类似的方式用2-异氰酸根合丙烷制备。1hnmr(400mhz,dmso-d6)δppm1.02(d,j=6.26hz,6h)1.49(quin,j=7.40hz,2h)1.78(quin,j=7.24hz,2h)2.51-2.56(m,2h)2.89(t,j=6.65hz,2h)3.48-3.63(m,1h)4.15(t,j=6.85hz,2h)4.32(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.22hz,2h)7.01(d,j=7.04hz,1h)7.10(d,j=8.61hz,2h)7.34(d,j=16.83hz,1h)7.62(d,j=16.43hz,1h)7.76(d,j=8.61hz,2h)7.89(s,1h)7.95(d,j=8.22hz,2h)8.24(s,1h)。化合物71:(e)-4-((1-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)甲基)硫吗啉1,1-二氧化物步骤1:(e)-4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-醇在75℃将(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑(1.159g,3.79mmol)、k2co3(0.786g,5.69mmol)和4-(4-羟基丁基)苯酚(0.63g,3.79mmol)在dmf(12ml)中的混合物加热过夜。除去溶剂,残留物在isco上使用柱(hx-ea;20-100%)纯化,得到1.00g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.42(s,2h)1.49-1.61(m,2h)3.39(q,j=5.50hz,2h)4.35(t,j=5.28hz,1h)4.99(s,2h)6.94(d,j=8.61hz,2h)7.11(d,j=8.22hz,2h)7.39(d,j=16.43hz,1h)7.59(d,j=16.82hz,1h)7.64(d,j=8.22hz,1h)7.77(s,1h)8.16(t,j=7.83hz,1h)8.26(s,1h)。步骤2:(e)-4-((4-(4-叠氮基丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物1的步骤2类似的方式用(e)-4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-醇,方法b制备。lrms+h+:461.0。步骤3:(e)-4-((1-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)甲基)硫吗啉1,1-二氧化物将该化合物以与化合物12的步骤1类似的方式用前述中间体和4-(丙-2-炔-1-基)硫吗啉1,1-二氧化物制备。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.20hz,2h)1.80(quin,j=7.24hz,2h)2.51-2.57(m,2h)2.89(br.s.,4h)3.09(br.s.,4h)3.76(br.s.,2h)4.36(t,j=7.04hz,2h)4.99(s,2h)6.94(d,j=8.22hz,2h)7.09(d,j=8.61hz,2h)7.39(d,j=16.43hz,1h)7.59(d,j=16.43hz,1h)8.02(s,1h)8.16(s,1h)8.26(s,1h)。化合物72:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-n-(2-(5-(二甲基氨基)萘-1-磺酰胺基)乙基)苯甲酰胺步骤1:n-(2-氨基乙基)-5-(二甲基氨基)萘-1-磺酰胺在100ml圆底烧瓶中加入在ch2cl2(13.75ml)中的乙二胺(2.503ml,37.1mmol),得到无色溶液。冷却至0℃。经45分钟逐滴加入5-(二甲基氨基)萘-1-磺酰氯(0.5g,1.854mmol)在ch2cl2(15.00ml)中的溶液。温热至20℃,搅拌一个晚上。22h后,加入在水(46.3ml,93mmol)中的hcl2m,剧烈搅拌10分钟。分层。水层用ch2cl2(10ml)洗涤。用在水(5.00ml,58.4mmol)中45wt%的koh使水层碱化至ph为9。用ch2cl2(2x15ml)萃取水层。合并的有机层经mgso4干燥,过滤并且浓缩至干,得到n-(2-氨基乙基)-5-(二甲基氨基)萘-1-磺酰胺(457mg,1.558mmol,84%收率)为黄色泡沫。1hnmr(400mhz,dmso-d6)δppm2.47(m,j=6.30hz,2h)2.77(m,j=12.90,6.30hz,2h)2.83(s,6h)3.35(br.s.,2h)7.26(d,j=7.43hz,1h)7.36(s,1h)7.55-7.67(m,2h)8.06-8.13(m,1h)8.30(d,j=8.61hz,1h)8.46(d,j=8.61hz,1h)。步骤2:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-n-(2-(5-(二甲基氨基)萘-1-磺酰胺基)乙基)苯甲酰胺将该化合物以与化合物59的步骤2类似的方式使用(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)苯甲酸和前述胺制备。1hnmr(400mhz,dmso-d6)δppm1.48(quin,j=7.50hz,2h)1.81(quin,j=7.50hz,2h)2.52-2.58(m,2h)2.81(s,6h)2.95(q,j=6.52hz,2h)3.22-3.31(m,2h)4.39(t,j=7.04hz,2h)4.97(s,2h)6.94(m,j=8.61hz,2h)7.09(m,j=8.61hz,2h)7.20-7.32(m,2h)7.51-7.65(m,3h)7.70(s,1h)7.73-7.81(m,4h)8.03-8.14(m,3h)8.21(s,1h)8.28(d,j=8.61hz,1h)8.39-8.49(m,2h)。化合物73:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(5-氟-1h-吲哚-2-基)噁唑将该化合物如美国专利申请公开号2006/0063812的实施例3(第18页)中所述制备。lrms+h+:432.1。化合物74:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(4-(三氟甲基)苯基)丙-1-烯-1-基)噁唑在5ml圆底烧瓶中加入在dmso(500μl)中的在矿物油(8.53mg,0.213mmol)中的nah60wt%,得到灰色悬浮液。一次性加入三甲基碘化亚砜(46.9mg,0.213mmol)。在20℃将反应混合物搅拌30分钟。加入(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-(三氟-甲基)苯乙烯基)噁唑(42.5mg,0.091mmol)。加热至35℃持续22小时。在5ml小瓶中加入在dmso(500μl)中的在矿物油(8.53mg,0.213mmol)中的nah60wt%,得到灰色悬浮液。加入三甲基碘化亚砜(100mg,0.454mmol)。搅拌30分钟。向反应烧瓶中加入内鎓盐混合物,用dmso(500μl)漂洗小瓶。在35℃继续搅拌12天。将反应混合物倒入水(5ml)中,用meoh(1.5ml)漂洗烧瓶,,将其加入到所得悬浮液中。搅拌悬浮液一个晚上。将混合物用ch2cl2(2x5ml)萃取。合并的有机层用水(10ml)洗涤。有机层经mgso4干燥,过滤并且浓缩,残留物在isco上使用柱(hex-etoac;0-100%)纯化,得到(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(4-(三氟甲基)苯基)丙-1-烯-1-基)噁唑(8mg,0.017mmol,18.28%收率)。1hnmr(400mhz,dmso-d6)δppm8.22(s,1h),8.11(s,1h),7.86(d,j=8.2hz,2h),7.77(d,j=8.6hz,2h),7.70(s,1h),7.07-7.13(m,j=8.6hz,2h),6.91-6.99(m,j=8.6hz,2h),6.82(s,1h),5.01(s,2h),4.39(t,j=7.0hz,2h),2.61-2.69(m,2h),2.52-2.58(m,3h),1.81(quin,j=7.2hz,2h),1.40-1.54(m,2h)。化合物75:5-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯基)吡啶步骤1:6-(4-(三氟甲基)苯基)烟酸甲酯在200ml圆底烧瓶中加入在二噁烷(43.7ml)中的6-氯烟酸甲酯(2g,11.66mmol)和(4-(三氟甲基)苯基)硼酸(2.435g,12.82mmol),得到棕褐色溶液。加入氟化铯(6.20g,40.8mmol)。将氮气鼓入烧瓶中持续5分钟。加入pd(dppf)cl2·dcm(0.286g,0.350mmol)。将氮气鼓入烧瓶中持续5分钟。加热至100℃持续2天。反应混合物用etoac(50ml)稀释。混合物在硅藻土上过滤,用etoac(2x25ml)漂洗。浓缩至干,残留物在isco上使用gold柱(hex-etoac;0-40%)纯化,得到2.35g的标题化合物。1hnmr(400mhz,dmso-d6)δppm9.21(d,j=2.0hz,1h),8.34-8.46(m,3h),8.25(d,j=8.6hz,1h),7.90(d,j=8.2hz,2h),3.92(s,3h)。步骤2:(6-(4-(三氟甲基)苯基)吡啶-3-基)甲醇向6-(4-(三氟甲基)苯基)烟酸甲酯(2.35g,8.36mmol)在thf(25.7ml)中的0℃-5℃溶液中,加入lialh4(0.327g,8.61mmol)。在0℃将其搅拌1小时,用et2o(75ml)稀释。然后缓慢加入水(0.327ml),随后加入在水(0.327ml)中的naoh15wt%,随后加入水(0.980ml)。温热至20℃,搅拌15分钟。加入无水mgso4,搅拌15分钟。过滤混合物以除去盐,用et2o(3x15ml)漂洗。浓缩至干,得到2.05g的标题化合物。1hnmr(400mhz,dmso-d6)δppm8.66(d,j=2.0hz,1h),8.30(d,j=8.2hz,2h),8.05(d,j=7.8hz,1h),7.80-7.90(m,3h),5.39(t,j=5.8hz,1h),4.60(d,j=5.8hz,2h)。步骤3:5-(氯甲基)-2-(4-(三氟甲基)苯基)吡啶在100ml圆底烧瓶中加入在ch2cl2(19ml)中的(6-(4-(三氟甲基)苯基)吡啶-3-基)甲醇(1g,3.95mmol)。冷却至0℃,逐滴加入socl2(0.576ml,7.90mmol)。在0℃搅拌5分钟,然后温热至20℃。30分钟后,将反应混合物倒入冰+饱和nahco3(10g+30ml)中。搅拌5分钟。用etoac(2x30ml)萃取。合并的有机层用水(30ml)、然后盐水(25ml)洗涤。有机层经mgso4干燥,过滤并且浓缩,得到1.07g的标题化合物。1hnmr(400mhz,dmso-d6)δppm8.79(d,j=2.3hz,1h),8.29-8.35(m,j=8.2hz,2h),8.12(d,j=8.2hz,1h),8.02(dd,j=8.2,2.3hz,1h),7.83-7.90(m,j=8.2hz,2h),4.90(s,2h)。步骤4:5-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯基)吡啶将该化合物根据化合物1的步骤5制备。1hnmr(400mhz,dmso-d6)δppm8.79(d,j=1.6hz,1h),8.28-8.36(m,j=8.2hz,2h),8.08-8.14(m,2h),8.00(dd,j=8.2,2.0hz,1h),7.83-7.89(m,j=8.2hz,2h),7.70(s,1h),7.06-7.14(m,j=8.6hz,2h),6.92-6.99(m,j=8.6hz,2h),5.18(s,2h),4.39(t,j=7.0hz,2h),2.52-2.58(m,2h),1.80(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。化合物76:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(4-(三氟甲基)苯基)环丙基)噁唑步骤1:(e)-3-(4-(三氟甲基)苯基)丙烯酸乙酯在100ml圆底烧瓶中加入在无水乙醇(20.00ml)中的(e)-3-(4-(三氟甲基)苯基)丙烯酸(2g,9.25mmol)和硫酸(0.200ml,3.75mmol),得到白色悬浮液。加热至回流,搅拌19小时。将反应混合物浓缩至干。残留物用饱和nahco3(15ml)中和。用etoac(3x15ml)萃取。合并的有机层用盐水(15ml)洗涤。有机层经mgso4干燥,过滤并且浓缩,得到(e)-3-(4-(三氟甲基)苯基)丙烯酸乙酯(2.20g,9.01mmol,97%收率)为白色固体。1hnmr(400mhz,dmso-d6)δppm7.95(d,j=8.2hz,2h),7.77(d,j=8.2hz,2h),7.72(d,j=16.0hz,1h),6.79(d,j=16.0hz,1h),4.21(q,j=7.0hz,2h),1.27(t,j=7.0hz,3h)。步骤2:2-(4-(三氟甲基)苯基)环丙烷甲酸乙酯在100ml圆底烧瓶中加入在dmso(22ml)中的在矿物油(0.649g,16.22mmol)中的nah60wt%,得到灰色悬浮液。分批加入三甲基碘化亚砜(3.57g,16.22mmol)。搅拌30分钟。加入(e)-3-(4-(三氟甲基)苯基)丙烯酸乙酯(2.2g,9.01mmol)在dmso(9ml)和thf(9ml)中的溶液。在20℃搅拌19小时。反应混合物用hcl1m(10ml)淬灭。将混合物用etoac(2x20ml)萃取。合并的有机层用水(3x20ml)、然后盐水(20ml)洗涤。有机层经mgso4干燥,过滤并且浓缩,得到1.8g为橙色油。残留物在isco上使用柱(hexane-et2o;0-50%)纯化,得到0.703g的标题化合物。1hnmr(400mhz,dmso-d6)δppm7.57-7.66(m,j=8.2hz,2h),7.37-7.45(m,j=7.8hz,2h),4.11(q,j=7.3hz,2h),2.51-2.59(m,1h),2.00-2.09(m,1h),1.52(dt,j=9.5,4.8hz,1h),1.41-1.49(m,1h),1.20(t,j=7.2hz,3h)。步骤3:2-(4-(三氟甲基)苯基)环丙烷甲酸在50ml圆底烧瓶中加入在乙醇(7ml)中的2-(4-(三氟甲基)苯基)环丙烷甲酸乙酯(0.700g,2.71mmol),得到无色溶液。加入在水(7.00ml,7.00mmol)中的naoh1m。在20℃将所得混合物搅拌1.5小时。在旋转蒸发仪上浓缩至约5ml。用在水(2.60ml,5.20mmol)中的hcl2m酸化至ph为3。用etoac(2x15ml)萃取水层。合并的有机层用盐水(15ml)洗涤。有机层经mgso4干燥,过滤并且浓缩,得到2-(4-(三氟甲基)苯基)环丙烷甲酸(582mg,2.53mmol,93%收率)。1hnmr(400mhz,dmso-d6)δppm12.42(br.s.,1h),7.58-7.65(m,j=8.2hz,2h),7.36-7.44(m,j=8.2hz,2h),2.52-2.54(m,1h),1.87-1.96(m,1h),1.49(dt,j=9.2,4.8hz,1h),1.41(ddd,j=8.4,6.3,4.5hz,1h)。步骤4:2-(4-(三氟甲基)苯基)环丙烷甲酰胺在100ml圆底烧瓶中加入在ch2cl2(16ml)中的2-(4-(三氟甲基)苯基)环丙烷甲酸(0.58g,2.52mmol)和dmf(9.76μl,0.126mmol),得到浅黄色溶液。冷却至0℃。缓慢加入草酰氯(0.287ml,3.28mmol)。温热至20℃,搅拌1小时。将反应混合物浓缩至干。所得残留物溶解在ch2cl2(13ml)中,冷却至0℃。加入nh4oh浓(0.851ml,12.60mmol)。30分钟后,在旋转蒸发仪上浓缩至干。所得固体悬浮在etoh(6ml)中,加热至回流,得到溶液。缓慢加入水(6ml)。将所得浆液冷却至20℃。加入水(6ml),搅拌所得悬浮液1小时。将固体收集在buchner上,将滤饼用水(3x3ml)洗涤。在20℃在高真空下干燥产物直到恒重,得到2-(4-(三氟甲基)苯基)环丙烷甲酰胺(525mg,2.291mmol,91%收率)。1hnmr(400mhz,dmso-d6)δppm7.62(d,j=8.2hz,3h),7.35(d,j=8.2hz,2h),6.95(br.s.,1h),2.26-2.37(m,1h),1.86-1.96(m,1h),1.39(dt,j=9.1,4.6hz,1h),1.28(ddd,j=8.3,5.8,4.3hz,1h)。步骤5:4-(氯甲基)-2-(2-(4-(三氟甲基)苯基)环丙基)噁唑在15ml密封管中加入在甲苯(1.5ml)和dmf(0.3ml)中的2-(4-(三氟甲基)苯基)环丙烷甲酰胺(0.250g,1.091mmol)和1,3-二氯丙烷-2-酮(0.208g,1.636mmol),得到棕褐色溶液。密封小瓶,加热至120℃持续22小时。使混合物冷却至20℃,加入ch2cl2(5ml),搅拌持续15分钟。用移液管在玻璃棉上过滤,除去深色的不可溶固体。浓缩至干。残留物在isco上使用柱(hex-etoa:,0-50%)纯化,得到4-(氯甲基)-2-(2-(4-(三氟甲基)苯基)环丙基)噁唑(187mg,0.620mmol,56.8%收率)。1hnmr(400mhz,dmso-d6)δppm8.04(s,1h),7.60-7.68(m,j=8.2hz,2h),7.43-7.49(m,j=8.2hz,2h),4.62(s,2h),2.59-2.69(m,1h),2.52-2.59(m,1h),1.66-1.73(m,1h),1.63(dt,j=8.9,5.5hz,1h)。步骤6:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(4-(三氟甲基)苯基)环丙基)噁唑将该化合物根据化合物1的步骤5制备。1hnmr(400mhz,dmso-d6)δppm8.24(s,1h),8.11(s,1h),7.91-8.00(m,j=8.2hz,2h),7.73-7.81(m,j=8.2hz,2h),7.70(s,1h),7.62(d,j=16.4hz,1h),7.34(d,j=16.4hz,1h),7.05-7.13(m,j=8.2hz,2h),6.90-6.98(m,j=8.6hz,2h),4.98(s,2h),4.39(t,j=7.0hz,2h),2.52-2.57(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。化合物77:2-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-4-甲酸甲酯步骤1:2-(二氯甲基)-4,5-二氢噁唑-4-甲酸甲酯在200ml圆底烧瓶中加入在meoh(1.690ml,9.10mmol)中在meoh(18ml)中的甲醇钠30wt%,得到无色溶液。冷却至-10℃。经15分钟逐滴加入2,2-二氯乙腈(7.30ml,91mmol)。在此温度继续搅拌20分钟。将2-氨基-3-羟基丙酸甲酯盐酸盐(14.15g,91mmol)在meoh(15ml)中的悬浮液加入到反应混合物中。缓慢温热至20℃,搅拌19.5小时。加入ch2cl2(51ml)和水(29ml)。剧烈搅拌5分钟。分层。将有机层在旋转蒸发仪上浓缩至干。用ch2cl2(29ml)萃取水层2次。将合并的萃取液加入到浓缩的第一有机层中。有机层经mgso4干燥,过滤并且浓缩至干,得到2-(二氯甲基)-4,5-二氢噁唑-4-甲酸甲酯(17.64g,83mmol,91%收率)。1hnmr(400mhz,cdcl3)δppm6.29(s,1h),4.85-4.96(m,1h),4.76(t,j=8.6hz,1h),4.61-4.72(m,1h),3.83(s,3h)。步骤2:2-(氯甲基)-4-甲氧基-4,5-二氢噁唑-4-甲酸甲酯在200ml圆底烧瓶中加入2-(二氯甲基)-4,5-二氢噁唑-4-甲酸甲酯(17.64g,83mmol)inmeoh(19ml),得到橙色溶液。冷却至0℃。经50分钟逐滴加入在甲醇(15.46ml,83mmol)中的甲醇钠30wt%。将所得浅橙色悬浮液缓慢温热至20℃,搅拌18小时。加入ch2cl2(54ml)和水(30ml)。剧烈搅拌5分钟。分层。将有机层在旋转蒸发仪上浓缩至干。水层用ch2cl2(30ml)萃取2次。将合并的萃取液加入到浓缩的第一有机层中。有机层经mgso4干燥,过滤并且浓缩,得到2-(氯甲基)-4-甲氧基-4,5-二氢噁唑-4-甲酸甲酯(16.25g,78mmol,94%收率)。1hnmr(400mhz,cdcl3)δppm4.59(d,j=10.6hz,1h),4.39(d,j=10.6hz,1h),4.15-4.27(m,2h),3.85(s,3h),3.41(s,3h)。步骤3:2-(氯甲基)噁唑-4-甲酸甲酯在200ml圆底烧瓶中加入在甲苯(38ml)中的2-(氯甲基)-4-甲氧基-4,5-二氢噁唑-4-甲酸甲酯(16.25g,78mmol),得到橙色溶液。加入csa(2.73g,11.74mmol)。加热至70℃持续1小时,然后冷却至20℃。有机层用在水(23ml)中的k2co310wt%、然后水(30ml)洗涤。合并水层,用甲苯(45ml)反萃取。合并的有机层经mgso4干燥,过滤并且浓缩,得到9.8g为褐色固体。残留物在isco上使用柱(hexane-et2o;0-90%)纯化,得到2-(氯甲基)噁唑-4-甲酸甲酯(4.94g,28.1mmol,35.9%收率)。1hnmr(400mhz,dmso-d6)δppm8.93(s,1h),4.95(s,2h),3.82(s,3h)。步骤4:甲基2-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-4-甲酸酯将该化合物根据化合物1的步骤5制备。1hnmr(400mhz,dmso-d6)δppm8.91(s,1h),8.10(s,1h),7.70(s,1h),7.07-7.15(m,j=8.6hz,2h),6.90-6.97(m,j=8.6hz,2h),5.25(s,2h),4.38(t,j=7.0hz,2h),3.81(s,3h),2.52-2.57(m,2h),1.80(quin,j=7.3hz,2h),1.47(quin,j=7.7hz,2h)。化合物78:2-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-n-(2-硝基-4-(三氟甲基)苯基)噁唑-4-甲酰胺步骤1:2-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-4-甲酸在10ml圆底烧瓶中加入在thf(2.3ml)中的2-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-4-甲酸甲酯(0.23g,0.645mmol),得到棕褐色悬浮液。加入在水(1.291ml,0.645mmol)中的naoh0.5m。在20℃搅拌17小时。加入另外的在水(0.581ml,0.290mmol)中的naoh0.5m。19小时后,通过缓慢加入在水(1.936ml,0.968mmol)中的hcl0.5m进行酸化(加入1ml后,所得悬浮液搅拌15分钟,然后加入剩余的hcl)。将所得白色悬浮液搅拌2小时。加入水(1ml),继续搅拌持续1小时。将固体收集在buchner上,将滤饼用水(2x1ml)洗涤。在30℃在高真空下干燥产物直到恒重,得到2-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-4-甲酸(208mg,0.608mmol,94%收率)。1hnmr(400mhz,dmso-d6)δppm13.14(br.s.,1h),8.77(s,1h),8.09(s,1h),7.68(s,1h),7.04-7.13(m,j=8.2hz,2h),6.87-6.97(m,j=8.6hz,2h),5.21(s,2h),4.37(t,j=7.0hz,2h),2.50-2.56(m,2h),1.78(quin,j=7.3hz,2h),1.46(quin,j=7.6hz,2h)。步骤2:2-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-n-(2-硝基-4-(三氟甲基)苯基)噁唑-4-甲酰胺在10ml圆底烧瓶中加入在thf(750μl)和ch2cl2(750μl,11.65mmol)中的2-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-4-甲酸(75mg,0.219mmol),得到白色悬浮液。加入cdi(39.1mg,0.241mmol)。加热至40-45℃。45分钟后,加入另外的cdi(39.1mg,0.241mmol)。加入2-硝基-4-(三氟甲基)苯胺(49.7mg,0.241mmol),冷却至20℃。19.5小时后,加入另外的2-硝基-4-(三氟甲基)苯胺(49.7mg,0.241mmol)。26.5小时后,加入在2-methf(2ml)中的dbu(16.51μl,0.110mmol)。加热至65℃持续30分钟,然后在20℃持续18小时。将悬浮液冷却至0℃,搅拌1小时。将固体收集在buchner上,将滤饼用冷的2-methf(3x0.5ml)洗涤。在40℃在高真空下干燥产物直到恒重,得到2-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-n-(2-硝基-4-(三氟甲基)苯基)噁唑-4-甲酰胺(61mg,0.115mmol,52.5%收率)。1hnmr(400mhz,dmso-d6)δppm11.44(s,1h),9.02(s,1h),8.60(d,j=8.6hz,1h),8.44(s,1h),8.16-8.22(m,1h),8.10(s,1h),7.70(s,1h),7.09-7.16(m,j=8.6hz,2h),6.96-7.02(m,j=8.6hz,2h),5.32(s,2h),4.39(t,j=7.0hz,2h),2.54(t,j=7.4hz,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。化合物79:(e)-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)氨基甲酸叔丁酯步骤1:4-(4-甲氧基苯基)丁烷-1-胺在25ml圆底烧瓶中加入在thf(4.7ml)中的1-(4-叠氮基丁基)-4-甲氧基苯(1.75g,8.53mmol),得到无色溶液。加入三苯基膦(3.35g,12.79mmol)和水(0.230ml,12.79mmol)。在20℃搅拌持续22小时。在旋转蒸发仪上浓缩至干。残留物在isco上使用柱(dcm-dcm//meoh/nh4oh(77.5-22-2.5%);0-100%)纯化,得到4-(4-甲氧基苯基)丁烷-1-胺(1.51g,8.42mmol,99%收率)。1hnmr(400mhz,dmso-d6)δppm7.04-7.13(m,j=8.2hz,2h),6.78-6.86(m,2h),3.71(s,3h),2.43-2.59(m,4h),1.53(quin,j=7.6hz,2h),1.32(quin,j=7.2hz,2h)。步骤2:4-(4-氨基丁基)苯酚氢溴酸盐在50ml圆底烧瓶中加入在水(15ml,133mmol)中在hbr48wt%中的4-(4-甲氧基苯基)丁烷-1-胺(1.5g,8.37mmol),得到白色悬浮液。加热至回流(120℃)持续4小时。冷却至0℃,搅拌所得悬浮液1小时。将固体收集在buchner上。在20℃在高真空下干燥产物直到恒重,得到4-(4-氨基丁基)苯酚氢溴酸盐(1.40g,5.69mmol,68.0%收率)。1hnmr(400mhz,dmso-d6)δppm9.13(s,1h),7.60(br.s.,3h),6.94-7.01(m,j=8.2hz,2h),6.64-6.69(m,j=8.6hz,2h),2.70-2.84(m,2h),2.43-2.48(m,2h),1.42-1.62(m,4h)。步骤3:(4-(4-羟基苯基)丁基)氨基甲酸叔丁酯在250ml圆底烧瓶中加入在二噁烷(56ml)中的4-(4-氨基丁基)苯酚氢溴酸盐(1.4g,5.69mmol),得到棕褐色悬浮液。加入碳酸氢钠(1.911g,22.75mmol)在水(56ml)中的溶液。冷却至0℃。加入boc-酸酐(1.453ml,6.26mmol)。缓慢温热至20℃。21小时后,用etoac(209ml)稀释反应混合物。分层。用水(75ml)、然后盐水(75ml)洗涤有机层。有机层经mgso4干燥,过滤并且浓缩,得到1.89g为无色油。残留物在isco上使用柱(hex-etoac;0-60%)纯化,得到(4-(4-羟基苯基)丁基)氨基甲酸叔丁酯(1.23g,4.64mmol,81%收率)。1hnmr(400mhz,dmso-d6)δppm9.08(s,1h),6.92-6.99(m,j=8.2hz,2h),6.77(t,j=5.7hz,1h),6.61-6.67(m,j=8.2hz,2h),2.90(q,j=6.7hz,2h),2.43(t,j=7.4hz,2h),1.46(quin,j=7.3hz,2h),1.29-1.41(m,11h)。步骤4:(e)-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)氨基甲酸叔丁酯在25ml圆底烧瓶中加入在dmf(2.8ml)中的(e)-4-(氯甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑(500mg,1.738mmol)、(4-(4-羟基苯基)丁基)氨基甲酸叔丁酯(484mg,1.825mmol)和k2co3(264mg,1.912mmol),得到黄色悬浮液。加热至75℃持续48小时。冷却至20℃。加入meoh(2.8ml)和水(4.7ml)。搅拌5小时。将固体收集在buchner上,将滤饼用水(3x3ml)洗涤。湿固体溶解在温热dmf(2.8ml)中。加入meoh(2.8ml),随后缓慢加入水(4.7ml)。搅拌所得suspension持续2天。加入meoh(2.8ml)。搅拌2小时。将固体收集在buchner上,将滤饼用meoh(3x1.5ml)洗涤。在30℃在高真空下干燥产物直到恒重,得到(e)-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)氨基甲酸叔丁酯(352mg,0.681mmol,39.2%收率)。1hnmr(400mhz,dmso-d6)δppm8.24(s,1h),7.91-8.00(m,j=8.2hz,2h),7.73-7.81(m,j=8.2hz,2h),7.62(d,j=16.4hz,1h),7.34(d,j=16.4hz,1h),7.06-7.16(m,j=8.2hz,2h),6.88-6.98(m,j=8.6hz,2h),6.73-6.82(m,1h),4.99(s,2h),2.92(q,j=6.7hz,2h),2.47-2.49(m,2h),1.43-1.56(m,2h),1.28-1.43(m,11h)。化合物80:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(吡啶-4-基)乙烯基)噁唑步骤1:2-((二乙氧基磷酰基)甲基)噁唑-4-甲酸甲酯在15ml圆底烧瓶中加入在亚磷酸三乙酯(3.59ml,20.50mmol)中的2-(氯甲基)噁唑-4-甲酸甲酯(化合物85步骤3)(2.0g,11.39mmol),得到白色悬浮液。加热至150℃持续5.5小时,然后冷却至20℃,搅拌16小时。残留物在isco上使用柱(hexane-et2o;0-100%)纯化,得到2-((二乙氧基磷酰基)甲基)噁唑-4-甲酸甲酯(2.95g,10.64mmol,93%收率)。1hnmr(400mhz,dmso-d6)δppm8.80-8.85(m,1h),4.05(quin,j=7.3hz,4h),3.80(s,3h),3.69(s,1h),3.64(s,1h),1.22(t,j=7.0hz,6h)。步骤2:(e)-2-(2-(吡啶-4-基)乙烯基)噁唑-4-甲酸甲酯在15ml圆底烧瓶中加入在thf(1.9ml)中在矿物油(0.063g,1.587mmol)中的nah60wt%,得到灰色悬浮液。冷却至-15℃。逐滴加入2-((二乙氧基磷酰基)甲基)噁唑-4-甲酸甲酯(0.4g,1.443mmol)在thf(2.8ml)中的溶液。在-15℃搅拌10分钟。一次性加入异烟醛(0.140ml,1.486mmol),缓慢温热至0℃。2.5小时后,通过加入meoh(1.0ml)淬灭。温热至20℃,搅拌30分钟。在旋转蒸发仪上浓缩至干。残留物在isco上使用柱(ch2cl2-meoh;0-100%)纯化,得到(e)-2-(2-(吡啶-4-基)乙烯基)噁唑-4-甲酸甲酯(320mg,1.390mmol,96%收率)。1hnmr(400mhz,dmso-d6)δppm8.94(s,1h),8.62(d,j=5.9hz,2h),7.72(d,j=6.3hz,2h),7.61(d,j=16.4hz,1h),7.50(d,j=16.4hz,1h),3.84(s,3h)。步骤3:(e)-(2-(2-(吡啶-4-基)乙烯基)噁唑-4-基)甲醇在15ml圆底烧瓶中加入在ch2cl2(4ml)中的(e)-2-(2-(吡啶-4-基)乙烯基)噁唑-4-甲酸甲酯(0.15g,0.652mmol),得到无色溶液。冷却至-78℃。在将二氯甲烷(1.955ml,1.955mmol)中的dibal-h1m缓慢加入到白色悬浮液中。在-78℃搅拌所得橙色溶液30分钟,然后温热至0℃。30分钟后,将反应混合物倒入ch2cl2(7.5ml)与饱和罗谢尔盐溶液(13.5ml)的两相混合物中,剧烈搅拌1小时。分层。用ch2cl2(2x10ml)萃取水层。合并的有机层经mgso4干燥,过滤并且浓缩,得到108mg为白色固体。残留物在isco上使用柱(dcm-dcm(20%meoh;0-100%)纯化,得到(e)-(2-(2-(吡啶-4-基)乙烯基)噁唑-4-基)甲醇(54mg,0.267mmol,41.0%收率)。1hnmr(400mhz,dmso-d6)δppm8.60(d,j=6.3hz,2h),7.99(s,1h),7.68(d,j=5.9hz,2h),7.36-7.51(m,2h),5.23(t,j=5.6hz,1h),4.41(d,j=5.6hz,2h)。步骤4:(e)-4-(氯甲基)-2-(2-(吡啶-4-基)乙烯基)噁唑在10ml圆底烧瓶中加入在ch2cl2(2.5ml)中的(e)-(2-(2-(吡啶-4-基)乙烯基)噁唑-4-基)甲醇(54mg,0.267mmol),得到白色悬浮液。冷却至0℃。加入socl2(58.5μl,0.801mmol)。在0℃搅拌5分钟,然后温热至20℃。30分钟后,用饱和nahco3(5ml)淬灭反应混合物。用etoac(2x5ml)萃取混合物。合并的有机层用水(5ml)、然后盐水(5ml)洗涤。有机层经mgso4干燥,过滤并且浓缩,得到(e)-4-(氯甲基)-2-(2-(吡啶-4-基)乙烯基)噁唑(55mg,0.249mmol,93%收率)。1hnmr(400mhz,dmso-d6)δppm8.61(d,j=5.9hz,2h),8.24(s,1h),7.70(d,j=5.9hz,2h),7.40-7.56(m,2h),4.72(s,2h)。步骤5:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(吡啶-4-基)乙烯基)噁唑在10ml圆底烧瓶中加入在dmf中(0.75ml)在矿物油(9.71mg,0.243mmol)中的nah60wt%,得到灰色悬浮液。冷却至0℃。加入4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚(52.7mg,0.243mmol)。温热至20℃,搅拌30分钟。冷却至0℃。加入(e)-4-(氯甲基)-2-(2-(吡啶-4-基)乙烯基)噁唑(51mg,0.231mmol)。在0℃搅拌约1小时,然后缓慢温热至20℃,搅拌17小时。加入dmf(0.25ml),加热至40℃持续4小时。冷却至20℃,加入在矿物油中的约5mgnah60wt%。23小时后,加入meoh(1ml),随后加入水(1ml)。搅拌所得悬浮液17小时。将固体收集在buchner上,滤饼用水(3x1ml)、然后己烷(1ml)洗涤。在40℃在高真空下干燥产物直到恒重,得到(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(吡啶-4-基)乙烯基)噁唑49.5mg,0.123mmol,53.3%收率)。1hnmr(400mhz,dmso-d6)δppm8.60(d,j=5.9hz,2h),8.26(s,1h),8.11(s,1h),7.66-7.73(m,3h),7.40-7.56(m,2h),7.05-7.14(m,j=8.6hz,2h),6.90-6.98(m,j=8.6hz,2h),4.99(s,2h),4.39(t,j=7.0hz,2h),2.52-2.58(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。化合物81-85化合物81-85根据化合物80的步骤1至5由适当的起始吡啶制备。化合物81:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(3-氟吡啶-4-基)乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm8.65(d,j=2.0hz,1h),8.48(d,j=5.1hz,1h),8.29(s,1h),8.11(s,1h),7.88-7.96(m,1h),7.70(s,1h),7.42-7.58(m,2h),7.04-7.14(m,j=8.6hz,2h),6.91-6.99(m,j=8.6hz,2h),5.00(s,2h),4.39(t,j=7.0hz,2h),2.52-2.58(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。化合物82:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(吡啶-3-基)乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm8.84-8.91(m,1h),8.54(dd,j=4.7,0.8hz,1h),8.22(s,1h),8.19(d,j=7.8hz,1h),8.11(s,1h),7.70(s,1h),7.56(d,j=16.4hz,1h),7.44(dd,j=8.0,4.9hz,1h),7.32(d,j=16.8hz,1h),7.06-7.13(m,j=8.6hz,2h),6.90-6.98(m,j=8.2hz,2h),4.98(s,2h),4.39(t,j=7.0hz,2h),2.52-2.58(m,2h),1.81(quin,j=7.2hz,2h),1.48(quin,j=7.6hz,2h)。化合物83:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(2-氟吡啶-3-基)乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm8.42-8.50(m,1h),8.20-8.28(m,2h),8.11(s,1h),7.70(s,1h),7.50(d,j=16.4hz,1h),7.41-7.47(m,1h),7.33(d,j=16.4hz,1h),7.06-7.12(m,j=8.2hz,2h),6.91-6.97(m,j=8.6hz,2h),4.99(s,2h),4.39(t,j=7.0hz,2h),2.52-2.56(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。化合物84:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(吡啶-2-基)乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm8.63(d,j=4.3hz,1h),8.24(s,1h),8.11(s,1h),7.85(td,j=7.6,1.6hz,1h),7.67-7.74(m,2h),7.57(d,j=16.0hz,1h),7.44(d,j=16.0hz,1h),7.36(dd,j=7.2,4.9hz,1h),7.05-7.14(m,j=8.6hz,2h),6.91-6.98(m,j=8.6hz,2h),4.98(s,2h),4.39(t,j=7.0hz,2h),2.52-2.58(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。化合物85:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-(3-氟吡啶-2-基)乙烯基)噁唑1hnmr(400mhz,dmso-d6)δppm8.52(d,j=4.7hz,1h),8.27(s,1h),8.11(s,1h),7.78-7.85(m,1h),7.60-7.72(m,2h),7.43-7.54(m,2h),7.06-7.14(m,j=8.6hz,2h),6.90-6.98(m,j=8.6hz,2h),4.99(s,2h),4.39(t,j=7.0hz,2h),2.52-2.57(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。化合物86:(e)-3-羟基-n-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)丙酰胺步骤1:3-(三苯甲氧基)丙酸叔丁酯在50ml圆底烧瓶中加入在ch2cl2(14ml)中的3-羟基丙酸叔丁酯(0.55g,3.76mmol)和吡啶(0.913ml,11.29mmol)得到无色溶液。冷却至0℃。分批加入三苯甲基氯(1.049g,3.76mmol)。缓慢温热至20℃。22小时后,在旋转蒸发仪上浓缩至干。将所得白色固体悬浮在etoac(30ml)中。用水(15ml)、5%柠檬酸(20ml)和盐水(10ml)洗涤。有机层经mgso4干燥,过滤并且浓缩,得到1.45g为白色油状固体。残留物在isco上使用柱(hex-etoac;0-20%)纯化,得到3-(三苯甲氧基)丙酸叔丁酯(915mg,2.355mmol,62.6%收率)。1hnmr(400mhz,dmso-d6)δppm7.30-7.41(m,12h),7.22-7.30(m,3h),3.17(t,j=6.1hz,2h),2.45(t,j=6.1hz,2h),1.40(s,9h)。步骤2:3-(三苯甲氧基)丙酸在25ml圆底烧瓶中加入在etoh(9ml)中的3-(三苯甲氧基)丙酸叔丁酯(0.915g,2.355mmol),得到无色溶液。加入在水(0.785ml,4.71mmol)中的naoh6m。加热至回流。4.5小时后,在旋转蒸发仪上浓缩至干。残留物溶解在ch2cl2(40ml)中,用3%柠檬酸溶液(30ml)洗涤。用盐水(20ml)洗涤有机层。有机层经mgso4干燥,过滤并且浓缩至干。所得白色固体悬浮在i-pr2o(20ml)中,在20℃搅拌18小时。将固体收集在buchner上,将滤饼用i-pr2o(3x3ml)洗涤。在30℃在高真空下干燥产物直到恒重,得到3-(三苯甲氧基)丙酸(575mg,1.730mmol,73.4%收率)。1hnmr(400mhz,dmso-d6)δppm12.22(br.s.,1h),7.30-7.41(m,12h),7.22-7.30(m,3h),3.19(t,j=6.5hz,2h),2.47(s,2h)。步骤3:(e)-4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-胺盐酸盐在15ml圆底烧瓶中加入在meoh(1.5ml)中的(e)-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)氨基甲酸叔丁酯(0.3g,0.581mmol),得到白色悬浮液。加入在二噁烷(0.726ml,2.90mmol)中的hcl4m。搅拌所得稀棕褐色悬浮液3小时。加入etoac(4.5ml),搅拌悬浮液持续1小时。将固体收集在buchner上,将滤饼用etoac(3x1ml)洗涤。在20℃在高真空下干燥产物直到恒重,得到(e)-4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-胺盐酸盐(232mg,0.512mmol,88%收率)。1hnmr(400mhz,dmso-d6)δppm8.25(s,1h),7.95(d,j=8.2hz,2h),7.72-7.89(m,5h),7.61(d,j=16.4hz,1h),7.34(d,j=16.4hz,1h),7.10-7.17(m,j=8.6hz,2h),6.92-7.00(m,j=8.6hz,2h),4.99(s,2h),2.77(br.s.,2h),2.52-2.57(m,2h),1.45-1.65(m,4h)。步骤4:(e)-n-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-3-(三苯甲氧基)丙酰胺在15ml圆底烧瓶中加入在dmf(2.25ml)中的(e)-4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-胺盐酸盐(0.150g,0.331mmol)和3-(三苯甲氧基)丙酸(0.121g,0.364mmol)。加入dipea(0.145ml,0.828mmol)和edc(0.079g,0.414mmol)。在20℃搅拌20小时。加入3-(三苯甲氧基)丙酸(化合物94步骤2)(0.220g,0.662mmol)、dipea(0.260ml,1.490mmol)和edc(0.140g,0.729mmol)。43小时后,反应混合物倒入etoac(25ml)中,用水(10ml)、然后hcl0.5m(10ml)、然后10%khco3(10ml)、然后盐水(10ml)洗涤。有机层经mgso4干燥,过滤并且浓缩,得到无色油。残留物在isco上使用柱(hex-etoac;0-100%)纯化,得到(e)-n-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-3-三苯甲氧基)丙酰胺(223mg,0.305mmol,92%收率)。1hnmr(400mhz,dmso-d6)δppm8.23(s,1h),7.95(d,j=7.8hz,3h),7.76(d,j=8.2hz,2h),7.61(d,j=16.4hz,1h),7.33-7.39(m,7h),7.30(t,j=7.6hz,6h),7.20-7.27(m,3h),7.02-7.10(m,j=8.6hz,2h),6.87-6.94(m,j=8.6hz,2h),4.98(s,2h),3.04-3.17(m,4h),2.45-2.48(m,2h),2.34(t,j=6.3hz,2h),1.49-1.61(m,2h),1.36-1.49(m,2h)。步骤5:(e)-3-羟基-n-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)丙酰胺在25ml圆底烧瓶中加入在meoh(3ml)和chcl3(3ml)中的(e)-n-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-3-(三苯甲氧基)丙酰胺(0.22g,0.301mmol)。加入p-tsoh(5.73mg,0.030mmol)。在20℃搅拌3.5小时。将反应混合物在旋转蒸发仪上浓缩至干。残留物在isco上使用柱(ch2cl2-meoh)纯化,得到(e)-3-羟基-n-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)丙酰胺(142mg,0.291mmol,97%收率)。1hnmr(400mhz,dmso-d6)δppm8.24(s,1h),7.95(d,j=8.2hz,2h),7.71-7.80(m,3h),7.62(d,j=16.4hz,1h),7.34(d,j=16.8hz,1h),7.07-7.15(m,j=8.6hz,2h),6.90-6.98(m,j=8.6hz,2h),4.99(s,2h),4.52(t,j=5.3hz,1h),3.54-3.61(m,2h),3.04(q,j=6.7hz,2h),2.52-2.56(m,2h),2.20(t,j=6.7hz,2h),1.52(quin,j=7.4hz,2h),1.38(quin,j=7.4hz,2h)。化合物87:(e)-二甲基氨基甲酸3-氧代-3-((4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)氨基)丙基酯在5ml圆底烧瓶中加入在dmf(0.5ml)中的在矿物油(3.60mg,0.090mmol)中的nah60wt%,得到灰色悬浮液。加入(e)-3-羟基-n-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)丙酰胺(化合物94)(40mg,0.082mmol)。在20℃搅拌30分钟。冷却至0℃。逐滴加入二甲基氨基甲酰氯(8.28μl,0.090mmol)。30分钟后,加入二甲基氨基甲酰氯(8.28μl,0.090mmol)。1小时后,加入在矿物油(1.638mg,0.041mmol)中的nah60wt%,随后加入二甲基氨基甲酰氯(8.28μl,0.090mmol)。1.5小时后,加入meoh(0.5ml),随后逐滴加入水(0.5ml)。将白色悬浮液搅拌1小时。将固体收集在buchner上,将滤饼用meoh:水(1:1,3x0.75ml)、随后己烷(2x0.5ml)洗涤。在30℃在高真空下干燥产物直到恒重,得到(e)-二甲基氨基甲酸3-氧代-3-((4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)氨基)丙基酯(40mg,0.071mmol,87%收率)为白色固体。1hnmr(400mhz,dmso-d6)δppm8.24(s,1h),7.92-8.00(m,j=8.2hz,2h),7.89(t,j=5.5hz,1h),7.73-7.80(m,j=8.2hz,2h),7.61(d,j=16.4hz,1h),7.34(d,j=16.8hz,1h),7.06-7.15(m,j=8.2hz,2h),6.90-6.98(m,j=8.6hz,2h),4.99(s,2h),4.13(t,j=6.3hz,2h),3.06(q,j=6.5hz,2h),2.70-2.83(m,6h),2.52(br.s.,2h),2.35(t,j=6.3hz,2h),1.52(quin,j=7.5hz,2h),1.38(quin,j=7.1hz,2h)。化合物88:(e)-4-((4-(4-(1h-1,2,4-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:1-(4-(4-甲氧基苯基)丁基)-1h-1,2,4-三唑1h-1,2,4-三唑(802mg,11.61mmol)溶解在thf(15ml)中,冷却至0℃,加入nah60%(418mg,10.45mmol),在室温搅拌1h。将该混合物加入到在微波管中的4-(4-甲氧基苯基)丁基甲烷磺酸酯(600mg,2.323mmol)在dmf(4.00ml)和thf(3.0ml)中的溶液中,微波管密封并且加热至60℃持续3h。将混合物用ea(20ml)稀释,通过硅藻土垫过滤。将滤液浓缩至干,残留物纯化使用isco柱(dcm至40%在dcm中的acoet),得到标题化合物(0.45g,84%收率)为无色油。1hnmr(400mhz,cdcl3)δppm1.59(t,j=7.63hz,2h)1.83-2.00(m,2h)2.58(t,j=7.63hz,2h)3.78(s,3h)4.16(t,j=7.24hz,2h)6.82(m,j=8.61hz,2h)7.05(m,j=8.61hz,2h)7.93(s,1h)8.00(s,1h)。步骤2:4-(4-(1h-1,2,4-三唑-1-基)丁基)苯酚在25ml烧瓶中加入在水(1.526ml,13.49mmol)中的在溴化氢48%中的1-(4-(4-甲氧基苯基)丁基)-1h-1,2,4-三唑(0.52g,2.248mmol),得到浅黄色溶液。反应混合物加热至90℃,搅拌18h,然后冷却至室温。加入etoac(30ml)和thf(20ml)。有机层用饱和nahco3溶液(10ml)和水(10ml)洗涤,干燥并且浓缩,得到标题化合物0.48g。1hnmr(400mhz,cdcl3)δppm1.53(t,j=7.63hz,2h),1.77-1.93(m,2h),2.52(t,j=7.43hz,2h),4.11(t,j=7.04hz,2h),6.70(d,j=8.22hz,2h),6.93(d,j=8.61hz,2h)7.88(s,1h),7.97(s,1h)。步骤3:(e)-4-((4-(4-(1h-1,2,4-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑在8ml小瓶中加入在dmf(253μl,3.27mmol)中的(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑(40mg,0.131mmol)和k2co3(19.90mg,0.144mmol),得到黄色悬浮液。将混合物加热至75℃持续6h,然后冷却至20℃。加入meoh(220μl)和h2o(360μl),搅拌10min。收集固体,用水(3x0.5ml)洗涤,在高真空下干燥。粗制品纯化使用isco柱(a:纯dcm,b:20%在dcm中的meoh。0%b至30%b),得到标题化合物(40mg,62.8%收率)为米色固体,1hnmr(400mhz,dmso-d6)δppm1.44(t,j=7.43hz,2h)1.66-1.83(m,2h)2.50-2.54(m,2h)4.16(t,j=6.85hz,2h)4.97(s,2h)6.92(d,j=8.61hz,2h)7.08(d,j=8.22hz,2h)7.37(d,j=16.43hz,1h)7.52-7.67(m,2h),7.76(d,j=10.56hz,1h)7.92(s,1h)8.07-8.19(m,1h)8.24(s,1h)8.48(s,1h)。化合物89:(e)-2-(2-(4-(4-(1h-1,2,4-三唑-1-基)丁基)苯氧基)-4-(三氟甲基)苯乙烯基)-4-((4-(4-(1h-1,2,4-三唑-1-基)丁基)苯氧基)甲基)噁唑(5mg,5.6%收率)1hnmr(400mhz,cd3od)δppm1.49-1.67(m,4h)1.88(dt,j=15.75,7.97hz,4h)2.57(t,j=7.43hz,2h)2.66(t,j=7.63hz,2h)4.23(dt,j=11.05,6.99hz,4h)4.96(s,2h)6.90(d,j=8.22hz,2h)6.97(m,j=8.22hz,2h)7.03(s,1h)7.07(m,j=8.22hz,2h)7.20-7.27(m,3h)7.42(d,j=7.83hz,1h)7.86(d,j=16.83hz,1h)7.92(s,1h)7.96(d,j=2.74hz,3h)8.43(d,j=9.00hz,2h)化合物90:(e)-4-((4-(4-(1h-四唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:1-(4-(4-甲氧基苯基)丁基)-1h-四唑将1h-四唑(987mg,14.09mmol)溶解在thf(15ml)中,冷却至0℃,加入nah(499mg,12.46mmol),在室温搅拌1h。将该混合物加入到在微波管中的4-(4-甲氧基苯基)丁基甲烷磺酸酯(700mg,2.71mmol)在dmf(3.00ml)和thf(3.00ml)中的溶液中,微波管密封并且加热至60℃持续3h。将混合物用ea(20ml)稀释,通过硅藻土垫过滤。将滤液浓缩至干,残留物使用isco柱(dcm至40%在dcm中的acoet)纯化,得到0.17g的标题化合物。1hnmr(400mhz,cdcl3)δppm1.63(t,j=7.63hz,2h)1.88-2.06(m,2h)2.61(t,j=7.43hz,2h)3.78(s,2h)4.41(t,j=7.24hz,2h)6.76-6.89(m,2h)7.05(m,j=8.61hz,2h)8.51(s,1h)和区域异构体2-(4-(4-甲氧基苯基)丁基)-2h-四唑。1hnmr(400mhz,cdcl3)δppm1.62(t,j=7.63hz,2h)1.95-2.15(m,2h)2.60(t,j=7.63hz,2h)3.78(s,2h)4.65(t,j=7.04hz,2h)6.73-6.89(m,2h)7.06(m,j=8.61hz,2h)8.49(s,1h)步骤2:4-(4-(1h-四唑-1-基)丁基)苯酚将该化合物以与化合物1的步骤4类似的方式用前述中间体制备。1hnmr(400mhz,cdcl3)δppm1.50-1.66(m,2h)1.85-1.97(m,2h)2.54(t,j=7.43hz,2h)4.36(t,j=7.04hz,2h)6.71(m,j=8.61hz,2h)6.92(m,j=8.22hz,2h)8.54(s,1h)步骤3:(e)-4-((4-(4-(1h-四唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物1的步骤5类似的方式用前述中间体制备。1hnmr(400mhz,dmso-d6)δppm1.47(t,j=7.63hz,2h)1.73-1.92(m,2h)2.50-2.55(m,2h)4.45(t,j=7.04hz,2h)4.97(s,2h)6.93(m,j=8.61hz,2h)7.08(m,j=8.61hz,2h)7.37(d,j=16.43hz,1h)7.57(d,j=16.43hz,1h)7.63(d,j=8.22hz,1h)7.77(d,j=10.96hz,1h)8.14(t,j=8.02hz,1h)8.24(s,1h)9.38(s,1h)化合物91:(e)-4-((4-(4-(1h-吡唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:1-(4-(4-甲氧基苯基)丁基)-1h-吡唑将该化合物以与化合物88的步骤1类似的方式用1h-吡唑制备。1hnmr(400mhz,cdcl3)δppm1.60(br.s.,2h)1.81-1.97(m,2h)2.57(t,j=7.63hz,2h)3.78(s,3h)4.13(t,j=7.04hz,2h)6.22(t,j=1.96hz,1h)6.81(m,j=8.61hz,2h)7.06(m,j=8.61hz,2h)7.34(d,j=2.35hz,1h)7.49(d,j=1.57hz,1h)步骤2:4-(4-(1h-吡唑-1-基)丁基)苯酚将该化合物以与化合物88的步骤2类似的方式用前述中间体制备。1hnmr(400mhz,cd3od)δppm1.41-1.61(m,2h)1.73-1.92(m,2h)2.51(t,j=7.63hz,2h)4.14(t,j=7.04hz,2h)6.25(t,j=1.96hz,1h)6.61-6.70(m,2h)6.95(m,j=8.61hz,2h)7.45(d,j=1.96hz,1h)7.57(d,j=2.35hz,1h)步骤3:(e)-4-((4-(4-(1h-吡唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物88的步骤3类似的方式用前述中间体制备。1hnmr(400mhz,cdcl3)δppm1.59-1.65(m,2h)1.81-1.98(m,2h)2.58(t,j=7.43hz,2h)4.13(t,j=7.04hz,2h)5.02(s,2h)6.16-6.32(m,1h)6.90(m,j=8.61hz,2h)7.07(m,j=8.61hz,2h)7.13(d,j=16.43hz,1h)7.34(d,j=1.96hz,1h)7.38(d,j=10.56hz,1h)7.44(d,j=8.22hz,1h)7.47-7.53(m,1h)7.60-7.68(m,2h)7.69(s,1h)化合物92:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(4-甲基-1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑步骤1:1-(4-(4-甲氧基苯基)丁基)-4-甲基-1h-1,2,3-三唑向微波管中,将4-甲基-1h-1,2,3-三唑(473mg,5.69mmol)溶解在thf(10ml)中并且冷却至0℃,加入nah(341mg,8.54mmol),在室温搅拌1h。然后加入甲烷磺酸4-(4-甲氧基苯基)丁基酯(490mg,1.897mmol)在dmf(2.00ml)和thf(1.0ml)中的溶液,将其加热至60℃持续3h。将混合物用ea(20ml)稀释,通过硅藻土垫过滤。将滤液浓缩至干。粗制品使用isco柱(dcm至40%在dcm中的ea)纯化,得到两个异构体。标题化合物(0.13g),1hnmr(400mhz,cdcl3)δppm1.57-1.64(m,2h)1.88-2.02(m,2h)2.29(s,2h)2.57(t,j=7.63hz,2h)3.78(s,3h)4.35(t,j=7.04hz,2h)6.76-6.86(m,2h)7.06(m,j=8.22hz,2h)7.31(s,1h)和2-(4-(4-甲氧基苯基)丁基)-4-甲基-2h-1,2,3-三唑(0.18g)。1hnmr(400mhz,cdcl3)δppm1.60-1.68(m,2h)1.80-1.97(m,2h)2.26(s,1h)2.33(s,2h)2.52-2.66(m,2h)3.78(s,3h)4.16-4.36(m,2h)6.82(m,j=8.22hz,2h)7.05(d,j=8.61hz,2h)7.32(m,1h)步骤2:4-(4-(4-甲基-1h-1,2,3-三唑-1-基)丁基)苯酚将该化合物以与化合物88的步骤2类似的方式用1-(4-(4-甲氧基苯基)丁基)-4-甲基-1h-1,2,3-三唑制备。1hnmr(400mhz,cd3od)δppm1.44-1.58(m,2h)1.78-1.97(m,2h)2.26(s,3h)2.51(t,j=7.63hz,2h)4.34(t,j=7.04hz,2h)6.62-6.71(m,2h)6.94(d,j=8.22hz,2h)7.40(s,1h)步骤3:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(4-甲基-1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑将该化合物以与化合物88的步骤3类似的方式用前述中间体制备。1hnmr(400mhz,cdcl3)δppm1.63-1.68(m,2h)1.81-1.97(m,2h)2.26(s,1h)2.33(s,2h)2.59(td,j=7.43,2.74hz,2h)4.18-4.38(m,2h)5.02(s,2h)6.91(d,j=8.61hz,2h)7.06(s,1h)7.09(d,j=9.00hz,1h)7.15(s,1h)7.21(s,1h)7.37(d,j=10.56hz,1h)7.41-7.47(m,1h)7.60-7.68(m,2h)7.69(s,1h)化合物93:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(3-甲基-1h-1,2,4-三唑-1-基)丁基)苯氧基)甲基)噁唑步骤1:1-(4-(4-甲氧基苯基)丁基)-3-甲基-1h-1,2,4-三唑将该化合物以与化合物88的步骤1类似的方式用3-甲基-1h-1,2,4-三唑制备。1hnmr(400mhz,cdcl3)δppm1.76-1.96(m,2h)2.40(d,j=10.56hz,2h)2.58(t,j=7.63hz,2h)3.78(s,3h)4.05(q,j=7.17hz,2h)6.82(m,j=8.61hz,2h)7.06(m,j=8.22hz,2h)步骤2:4-(4-(3-甲基-1h-1,2,4-三唑-1-基)丁基)苯酚将该化合物以与化合物88的步骤2类似的方式用前述中间体制备。1hnmr(400mhz,methanol-d4)δppm1.45-1.64(m,2h)1.82(dd,j=15.06,7.24hz,2h)2.32(s,2h)2.41(s,1h)2.53(td,j=7.53,3.33hz,2h)4.12(td,j=6.95,4.11hz,2h)6.67(d,j=8.22hz,2h)6.90-7.01(m,2h)7.77-7.79(m,1h)步骤3:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(3-甲基-1h-1,2,4-三唑-1-基)丁基)苯氧基)甲基)噁唑将该化合物以与化合物88的步骤3类似的方式用前述中间体制备。1hnmr(400mhz,cdcl3)δppm1.59-1.67(m,2h)1.79-1.96(m,2h)2.40(d,j=11.35hz,3h)2.59(t,j=7.63hz,2h)4.06(q,j=7.43hz,2h)5.02(s,2h)6.91(m,j=8.61hz,2h)7.07(m,j=8.61hz,2h)7.13(d,j=16.43hz,1h)7.38(d,j=10.56hz,1h)7.44(d,j=8.22hz,1h)7.60-7.68(m,2h)7.69(s,1h)化合物94:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(5-甲基-2h-四唑-2-基)丁基)苯氧基)甲基)噁唑步骤1:1-(4-(4-甲氧基苯基)丁基)-5-甲基-1h-四唑和2-(4-(4-甲氧基苯基)丁基)-5-甲基-2h-四唑向微波管中,将5-甲基-1h-四唑(797mg,9.48mmol)溶解在thf(10ml)中并且冷却至0℃,加入nah60%(341mg,8.54mmol),在室温搅拌1h。然后加入4-(4-甲氧基苯基)丁基甲烷磺酸酯(490mg,1.897mmol)在dmf(2.00ml)和thf(1.0ml)中的溶液,加热至6℃持续3h。将混合物用ea(20ml)稀释,通过硅藻土垫过滤。将滤液浓缩至干,残留物使用isco柱(dcm至40%在dcm中的ea)纯化,得到2-(4-(4-甲氧基苯基)丁基)-5-甲基-2h-四唑和1-(4-(4-甲氧基苯基)丁基)-5-甲基-1h-四唑(0.34g)的混合物,lrms+h+=247.2步骤2:4-(4-(5-甲基-1h-四唑-1-基)丁基)苯酚和4-(4-(5-甲基-2h-四唑-2-基)丁基)苯酚在25ml烧瓶中加入1-(4-(4-甲氧基苯基)丁基)-5-甲基-1h-四唑和2-(4-(4-甲氧基苯基)丁基)-5-甲基-2h-四唑(0.340g,1.380mmol)在溴化氢48%中在水(0.937ml,8.28mmol)中的混合物,得到浅黄色溶液。反应混合物加热至90℃,搅拌18h,然后冷却至室温。加入ea(20ml)和thf(10ml)。有机层用饱和nahco3(5ml)和水(10ml)洗涤。将其干燥,浓缩至干,得到4-(4-(5-甲基-2h-四唑-2-基)丁基)苯酚和4-(4-(5-甲基-1h-四唑-1-基)丁基)苯酚(0.32g)的混合物。lrms+h+:233.1步骤3:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(5-甲基-2h-四唑-2-基)丁基)苯氧基)甲基)噁唑在8ml小瓶中加入(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑和(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑(40mg,0.131mmol)、k2co3(19.90mg,0.144mmol)在dmf(300μl)中的混合物,得到黄色悬浮液。反应混合物加热至75℃持续6h,然后冷却至20℃。加入甲醇(220μl)和水(360μl)。收集固体,用水(3x0.5ml)洗涤。粗制品进一步通过制备型hplc(meoh-水5%hco2h;35%-100%)纯化,得到20mg的标题化合物。1hnmr(400mhz,cdcl3)δppm1.59-1.68(m,2h)2.01(quin,j=7.43hz,2h)2.47-2.54(m,3h)2.55-2.66(m,2h)4.55(t,j=7.04hz,2h)5.02(s,2h)6.85-6.97(m,2h)7.05-7.10(m,2h)7.13(d,j=16.43hz,1h)7.38(d,j=10.56hz,1h)7.44(d,j=8.22hz,1h)7.61-7.68(m,2h)7.69(s,1h)。化合物95:(e)-2-(1-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙醇将该化合物以与类似的方式化合物8用丁-3-炔-1-醇和(e)-4-((4-(4-叠氮基丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑制备。1hnmr(400mhz,dmso-d6)δppm1.49(quin,j=7.60hz,2h)1.78(quin,j=7.24hz,2h)2.51-2.57(m,2h)2.74(t,j=7.04hz,2h)3.56-3.65(m,2h)4.31(t,j=7.04hz,2h)4.66(t,j=5.28hz,1h)4.99(s,2h)6.94(m,j=8.61hz,2h)7.10(m,j=8.61hz,2h)7.39(d,j=16.43hz,1h)7.59(d,j=16.82hz,1h)7.64(d,j=8.61hz,1h)7.78(d,j=10.96hz,1h)7.83(s,1h)8.16(t,j=7.63hz,1h)8.26(s,1h)。lrms+h+:531.0。化合物96:(e)-(2-甲氧基乙基)氨基甲酸2-(1-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯将该化合物以与化合物69类似的方式用化合物95和1-异氰酸根合-2-甲氧基乙烷制备。1hnmr(400mhz,dmso-d6)δppm1.49(quin,j=7.20hz,2h)1.78(quin,j=7.24hz,2h)2.52-2.58(m,2h)2.89(t,j=6.85hz,2h)3.07-3.14(m,2h)3.21(s,3h)4.15(t,j=6.85hz,2h)4.32(t,j=7.04hz,2h)4.99(s,2h)6.94(m,j=8.61hz,2h)7.10(m,j=8.61hz,2h)7.15(t,j=5.48hz,1h)7.39(d,j=16.43hz,1h)7.59(d,j=16.43hz,1h)7.65(d,j=8.22hz,1h)7.79(d,j=10.96hz,1h)7.90(s,1h)8.16(t,j=7.63hz,1h)8.26(s,1h)。化合物97:(e)-环戊基氨基甲酸2-(1-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯将该化合物以与化合物69类似的方式用化合物95和异氰酸根合环戊烷制备。1hnmr(400mhz,dmso-d6)δppm1.30-1.63(m,8h)1.68-1.84(m,4h)2.51-2.57(m,2h)2.89(t,j=6.85hz,2h)4.15(t,j=6.65hz,2h)4.32(t,j=7.04hz,2h)4.99(s,2h)6.94(d,j=8.61hz,2h)7.02-7.15(m,3h)7.39(d,j=16.43hz,1h)7.59(d,j=16.43hz,1h)7.64(d,j=7.83hz,1h)7.78(d,j=10.96hz,1h)7.89(s,1h)8.16(t,j=7.83hz,1h)8.26(s,1h)。化合物98:(e)-异丙基氨基甲酸2-(1-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-基)乙基酯将该化合物以与化合物69类似的方式用化合物95和2-异氰酸根合丙烷制备。1hnmr(400mhz,dmso-d6)δppm1.02(d,j=6.26hz,6h)1.49(quin,j=7.40hz,2h)1.78(quin,j=7.40hz,1h)2.51-2.57(m,2h)2.89(t,j=6.85hz,2h)3.51-3.64(m,1h)4.15(t,j=6.65hz,2h)4.32(t,j=7.04hz,2h)4.99(s,2h)6.94(m,j=8.61hz,2h)7.01(d,j=7.04hz,1h)7.10(m,j=8.61hz,2h)7.39(d,j=16.43hz,1h)7.59(d,j=16.43hz,1h)7.64(d,j=8.22hz,1h)7.78(d,j=10.56hz,1h)7.89(s,1h)8.16(t,j=7.63hz,1h)8.26(s,1h)。化合物99:(e)-4-((4-(4-(1h-咪唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑步骤1:1-(4-(4-(苄氧基)苯基)丁基)-1h-咪唑在0℃将nah60%(0.074g,1.843mmol)加入到咪唑(0.125g,1.843mmol)在dmf(2.5ml)中的溶液中,在0℃搅拌30min。然后,缓慢加入在dmf(2.5ml)中的1-(苄氧基)-4-(4-碘丁基)苯(参见wo01/77107a1中所述的方法)(0.54g,1.474mmol)。将其恢复至室温持续3h,用nh4cl溶液淬灭,用ea萃取3次。将有机相合并,用水洗涤,经na2so4干燥,过滤并且除去溶剂,得到0.45g标题化合物粗制品。lrms+h+:307.0。步骤2:4-(4-(1h-咪唑-1-基)丁基)苯酚在室温将1-(4-(4-(苄氧基)苯基)丁基)-1h-咪唑(0.45g,1.47mmol)和pd10%(0.67g)在meoh-ea(7.2ml)中的混合物氢化持续3h。将反应过滤并且除去溶剂,得到0.31g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.42(quin,j=7.63hz,2h)1.67(quin,j=7.34hz,2h)2.45(t,j=7.63hz,2h)3.95(t,j=7.04hz,2h)6.64(d,j=8.22hz,2h)6.86(s,1h)6.94(d,j=8.22hz,2h)7.13(s,1h)7.60(s,1h)9.11(s,1h)。步骤3:(e)-4-((4-(4-(1h-咪唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑将该化合物以与化合物1的步骤5类似的方式用(e)-4-(氯甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑制备。1hnmr(400mhz,dmso-d6)δppm1.49(quin,j=7.40hz,2h)1.81(quin,j=7.43hz,2h)2.55(t,j=7.63hz,2h)4.20(t,j=7.04hz,2h)5.00(s,2h)6.95(d,j=8.61hz,2h)7.11(d,j=8.61hz,2h)7.47(d,j=16.43hz,1h)7.61(d,j=16.82hz,1h)7.68(s,1h)7.78(s,1h)8.12(dd,j=8.61,2.35hz,1h)8.18-8.27(m,2h)8.29(s,1h)9.11(s,1h)。化合物100:(e)-4-((4-(4-(1h-咪唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物由制备型hplc(水-meoh,5%三氟乙酸;35-100%)以与化合物99类似的方式用(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑制备为tfa盐。1hnmr(400mhz,dmso-d6)δppm1.47(quin,j=7.63hz,2h)1.78(quin,j=7.34hz,2h)2.44-2.49(m,2h)4.21(t,j=7.24hz,2h)5.42(s,2h)6.59-6.68(m,2h)6.95(d,j=8.22hz,2h)7.37(d,j=16.43hz,1h)7.59(d,j=16.43hz,1h)7.65(d,j=8.22hz,1h)7.74-7.84(m,3h)8.14(t,j=7.83hz,1h)8.33(s,1h)9.14(br.s.,1h)9.27(s,1h)。化合物101:(e)-2-(2-(4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)-4-硝基苯乙烯基)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑将nah60%(0.017g,0.421mmol)加入到4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚(0.080g,0.39mmol)在dmf(0.876ml)中的0℃溶液中。将其恢复至室温20分钟,然后回至0℃。将在dmf(0.876ml)中的(e)-4-(氯甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑(0.104g,0.368mmol)加入到溶液中,使其恢复至室温过夜。混合物用nh4cl溶液淬灭,用ea萃取2次。合并的有机溶液经na2so4干燥,过滤,在isco上使用柱(dcm-meoh;0-10%)纯化,得到0.038g双加成产物。1hnmr(400mhz,dmso-d6)δppm1.35-1.61(m,4h)1.67-1.90(m,4h)2.51-2.56(m,2h)2.64(t,j=7.63hz,2h)4.32-4.45(m,4h)4.97(s,2h)6.93(d,j=8.61hz,2h)7.09(t,j=8.22hz,4h)7.29(d,j=8.61hz,2h)7.44-7.53(m,2h)7.70(d,j=3.91hz,2h)7.78(d,j=16.43hz,1h)8.00(dd,j=8.61,2.35hz,1h)8.11(d,j=7.04hz,2h)8.21-8.29(m,2h)。化合物102:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(吡啶-3-基)丁基)苯氧基)甲基)噁唑步骤1:3-(4-(4-(苄氧基)苯基)丁-1-炔-1-基)吡啶向3-碘吡啶(0.109g,0.533mmol)和1-(苄氧基)-4-(丁-3-炔-1-基)苯(j.org.chem.2017,82,7070,(0.120g,0.508mmol)在三乙胺(2.83ml,20.31mmol)中的脱气混合物中,加入碘化铜(i)(2.90mg,0.015mmol)和pdcl2(pph3)2(10.69mg,0.015mmol),在80℃加热过夜。将其然后冷却,用ea稀释,过滤,吸附在sio2上,除去溶剂。在isco上使用柱(hx-ea;0-50%)纯化,得到0.117g的标题化合物。步骤2:4-(4-(吡啶-3-基)丁基)苯酚在室温过夜氢化3-(4-(4-(苄氧基)苯基)丁-1-炔-1-基)吡啶(0.117g,0.37mmol)和pd10%(0.023g)在meoh-ea(2.5ml)中的混合物。将反应过滤并且除去溶剂,得到0.070g的标题化合物。1hnmr(400mhz,cdcl3)δppm1.58-1.71(m,4h)2.56(t,j=7.24hz,2h)2.67(t,j=7.43hz,2h)3.91(s,3h)4.58(s,1h)6.74(d,j=8.61hz,2h)7.02(d,j=8.61hz,2h)7.31-7.38(m,2h)7.79-7.88(m,2h)。步骤3:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(吡啶-3-基)丁基)苯氧基)甲基)噁唑将nah(8.01mg,0.200mmol)加入到在dmf(0.513ml)中的4-(4-(吡啶-3-基)丁基)苯酚(0.035g,0.154mmol),随后加入(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑(0.052g,0.169mmol),使搅拌过夜。混合物用nh4cl溶液淬灭,用ea萃取2次。合并的有机溶液经na2so4干燥,过滤,在isco上使用柱(hx-ea;15-100%)纯化,得到0.036g的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.47-1.60(m,4h)2.52(t,j=7.04hz,2h)2.59(t,j=7.00hz,1h)4.97(s,2h)6.92(m,j=8.61hz,2h)7.08(m,j=8.61hz,2h)7.27(dd,j=7.83,4.70hz,1h)7.37(d,j=16.43hz,1h)7.54-7.60(m,2h)7.63(d,j=8.61hz,1h)7.77(d,j=10.56hz,1h)8.14(t,j=7.43hz,1h)8.24(s,1h)8.36(d,j=4.70hz,1h)8.39(d,j=2.35hz,1h)。化合物103:(e)-2-(2-氟-4-硝基苯乙烯基)-4-((4-(4-(吡啶-3-基)丁基)苯氧基)甲基)噁唑将该化合物以与化合物102类似的方式用(e)-4-(氯甲基)-2-(2-氟-4-硝基苯乙烯基)噁唑和4-(4-(吡啶-3-基)丁基)苯酚制备。1hnmr(400mhz,dmso-d6)δppm1.47-1.61(m,4h)2.53(t,j=6.85hz,2h)2.59(t,j=7.04hz,2h)4.98(s,2h)6.92(m,j=8.61hz,2h)7.09(m,j=8.22hz,2h)7.27(dd,j=7.83,4.70hz,1h)7.42-7.50(m,1h)7.54-7.64(m,2h)8.10(dd,j=8.61,1.96hz,1h)8.16-8.24(m,2h)8.27(s,1h)8.34-8.43(m,2h)。化合物104:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(吡啶-4-基)丁基)苯氧基)甲基)噁唑步骤1:4-(4-(吡啶-4-基)丁基)苯酚将该化合物以与化合物102的步骤1和2类似的方式以4-碘吡啶开始制备。1hnmr(400mhz,cdcl3)δppm1.58-1.71(m,4h)2.56(t,j=7.24hz,2h)2.67(t,j=7.43hz,2h)3.91(s,3h)4.58(s,1h)6.74(d,j=8.61hz,2h)7.02(d,j=8.61hz,2h)7.31-7.38(m,2h)7.79-7.88(m,2h)。步骤2:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(吡啶-4-基)丁基)苯氧基)甲基)噁唑将该化合物以与化合物102的步骤3类似的方式用(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑和4-(4-(吡啶-4-基)丁基)苯酚制备。1hnmr(400mhz,dmso-d6)δppm1.46-1.61(m,4h)2.52(t,j=7.04hz,2h)2.59(t,j=7.04hz,2h)4.97(s,2h)6.92(m,j=8.61hz,2h)7.08(m,j=8.22hz,2h)7.18(d,j=5.48hz,2h)7.37(d,j=16.43hz,1h)7.57(d,j=16.43hz,1h)7.62(d,j=8.22hz,1h)7.76(d,j=10.56hz,1h)8.14(t,j=7.83hz,1h)8.24(s,1h)8.41(d,j=5.48hz,2h)。化合物105:(e)-4-((4-(3-(1h-1,2,3-三唑-1-基)丙基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物50类似的方式用(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑制备,并且进一步在制备型hplc(水-meoh,5%三氟乙酸;40-100%)上纯化。1hnmr(500mhz,cdcl3)δppm1.59-1.67(m,2h)1.94(dt,j=14.98,7.33hz,2h)2.61(t,j=7.57hz,2h)3.06-3.15(m,2h)3.16-3.24(m,2h)4.40(t,j=7.25hz,2h)4.95(d,j=0.95hz,2h)6.86-6.92(m,2h)7.03-7.09(m,2h)7.28-7.35(m,3h)7.50(s,1h)7.59(s,1h)7.70(s,1h)。lrms+h+:473.3。化合物106:(e)-4-((4-(3-(1h-1,2,3-三唑-1-基)丙基)苯氧基)甲基)-2-(2-(2h-1,2,3-三唑-2-基)-4-(三氟甲基)苯乙烯基)噁唑当制备化合物105时,还分离出第二加合物、化合物106:1hnmr(500mhz,cdcl3)δppm2.19-2.31(m,2h)2.62(t,j=7.57hz,2h)4.39(t,j=7.09hz,2h)5.02(s,2h)6.94(m,j=8.51hz,2h)6.99(d,j=15.76hz,1h)7.11(m,j=8.51hz,2h)7.53(br.s.,1h)7.66(s,1h)7.70-7.77(m,2h)7.85(d,j=16.08hz,1h)7.90(d,j=8.20hz,1h)7.93-7.99(m,2h)8.05(s,1h)。化合物107:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(噻唑-2-基)丁基)苯氧基)甲基)噁唑步骤1:1-(4-(苄氧基)苯基)丁-3-炔-1-醇向在thf(37.7ml)中的4-(苄氧基)苯甲醛(4.0g,18.85mmol)加入3-溴丙-1-炔(3.16ml,28.3mmol)、然后活化锌(3.70g,56.5mmol),搅拌悬浮液24h。然后将其用nh4cl溶液稀释,过滤,固体用ea洗涤。分离有机相,经na2so4干燥,过滤,除去溶剂。在isco上使用柱(hexane-ea;0-40%)纯化,得到4.8g的标题化合物。1hnmr(400mhz,cdcl3)δppm2.07(t,j=2.74hz,1h)2.27(d,j=3.52hz,1h)2.57-2.67(m,2h)4.84(td,j=6.36,3.33hz,1h)5.07(s,2h)6.87-7.00(m,2h)7.29-7.35(m,3h)7.35-7.45(m,4h)。步骤2:1-(苄氧基)-4-(丁-3-炔-1-基)苯向三乙基硅烷(6.08ml,38.0mmol)和1-(4-(苄氧基)苯基)丁-3-炔-1-醇(4.8g,19.02mmol)在dcm(190ml)中的0℃溶液中,加入bf3.oet2(4.82ml,38.0mmol),搅拌2h30。将其用dcm稀释,用nahco3溶液淬灭。分离有机相,经na2so4干燥,过滤,除去溶剂。在isco上使用柱(hexane-ea;0-50%)纯化,得到3.14g的标题化合物。1hnmr(400mhz,cdcl3)δppm1.98(t,j=2.54hz,1h)2.46(td,j=7.53,2.54hz,2h)2.80(t,j=7.43hz,2h)5.06(s,2h)6.87-6.96(m,2h)7.13-7.18(m,2h)7.30-7.36(m,1h)7.39(t,j=7.24hz,2h)7.42-7.48(m,2h)步骤3:2-(4-(4-(苄氧基)苯基)丁-1-炔-1-基)噻唑将该化合物以与化合物102的步骤1类似的方式用前述炔烃和2-溴噻唑制备。lrms+h+:320.0。步骤4:4-(4-(噻唑-2-基)丁基)苯酚将前述炔烃与pd/c在meoh-ea中在1大气压氢化,残留物然后通过如下脱保护:经1h将2.8当量bcl3(1.0m)加入到残留物(0.05m)在含有5.0当量五甲基苯的dcm中的-78℃溶液中。混合物用nahco3溶液淬灭,使其恢复至室温。分相,水相用dcm萃取,合并。将其然后经na2so4干燥,过滤,除去溶剂。在isco上使用柱(hexane-ea;0-70%)纯化,得到标题化合物。1hnmr(400mhz,cdcl3)δppm1.62-1.72(m,2h)1.83(quin,j=7.63hz,2h)2.58(t,j=7.63hz,2h)3.05(t,j=7.43hz,2h)5.41(br.s.,1h)6.65-6.77(m,2h)7.01(m,j=8.61hz,2h)7.18(d,j=3.13hz,1h)7.67(d,j=3.52hz,1h)。步骤5:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(噻唑-2-基)丁基)苯氧基)甲基)噁唑将该化合物以与类似的方式化合物102的步骤3用前述苯酚和相应噁唑制备。1hnmr(400mhz,dmso-d6)δppm1.58(m,j=7.04hz,2h)1.64-1.74(m,2h)2.53(t,j=7.43hz,2h)2.98(t,j=7.43hz,2h)4.97(s,2h)6.92(m,j=8.61hz,2h)7.09(m,j=8.61hz,2h)7.37(d,j=16.80hz,1h)7.52(d,j=3.52hz,1h)7.57(d,j=16.80hz,1h)7.62(br.d,j=8.50hz,1h)7.65(d,j=3.13hz,1h)7.76(br.d,j=11.00hz,1h)8.14(t,j=8.00hz,1h)8.24(s,1h)。lrms+h+=503.1。化合物108:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(嘧啶-5-基)丁基)苯氧基)甲基)噁唑步骤1:2-(4-(4-(苄氧基)苯基)丁-1-炔-1-基)嘧啶将该化合物以与化合物107的步骤3类似的方式用2-溴嘧啶制备。lrms+h+=315.0。步骤2:4-(4-(嘧啶-5-基)丁基)苯酚将该化合物以与化合物107的步骤4类似的方式制备。lrms+h+=229.2。步骤3:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(嘧啶-5-基)丁基)苯氧基)甲基)噁唑将该化合物以与类似的方式化合物102的步骤3用前述苯酚制备。1hnmr(400mhz,dmso-d6)δppm1.55(quint,j=7.40hz,2h)1.73(quint,j=7.60hz,2h)2.53(t,j=7.63hz,2h)2.85(t,j=7.43hz,2h)4.97(s,2h)6.92(m,j=8.61hz,2h)7.08(m,j=8.22hz,2h)7.29(t,j=4.89hz,1h)7.37(d,j=16.43hz,1h)7.57(d,j=16.82hz,1h)7.62(d,j=8.22hz,1h)7.76(d,j=10.96hz,1h)8.14(t,j=7.63hz,1h)8.24(s,1h)8.68(d,j=4.70hz,2h)。lrms+h+=498.2。化合物109:(e)-4-((4-(3-(1h-1,2,3-三唑-1-基)丙氧基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:甲磺酸3-(4-甲氧基苯氧基)丙基酯将该化合物以与化合物1的步骤1类似的方式以3-(4-甲氧基苯氧基)丙烷-1-醇(1.045g,5.73mmol)开始制备。1hnmr(400mhz,cdcl3)δppm2.20(t,j=6.06hz,2h)2.99(s,3h)3.77(s,3h)4.04(t,j=5.87hz,2h)4.44(t,j=6.26hz,2h)6.83(s,4h)。步骤2:1-(3-叠氮基丙氧基)-4-甲氧基苯将叠氮化钠(0.225g,3.46mmol)加入到在n,n-二甲基甲酰胺(1ml)中的3-(4-甲氧基苯氧基)丙基甲磺酸酯(0.6g,2.305mmol)。反应混合物加热至50℃持续16h,然后冷却至20℃,用水(3ml)淬灭。反应混合物用et2o(3x10ml)萃取,有机层用水(10ml)和盐水(10ml)洗涤,经mgso4干燥,过滤并且浓缩,得到标题化合物(0.46g,96%)为油。1hnmr(400mhz,meoh-d4)δppm2.03(t,j=6.26hz,2h)3.51(t,j=6.65hz,2h)3.77(s,2h)4.00(t,j=5.87hz,2h)6.84(s,3h)。步骤3:1-(3-(4-甲氧基苯氧基)丙基)-1h-1,2,3-三唑将在微波管中的1-(3-叠氮基丙氧基)-4-甲氧基苯(0.3g,1.45mmol)和乙酸乙烯酯(3.96ml,43.4mmol)的混合物加热至120℃持续21h。将混合物浓缩至干,残留物在isco上使用柱(dcm至40%在dcm中的acoet)纯化,得到标题化合物(0.27g,80%收率)为无色油。1hnmr(400mhz,cdcl3)δppm2.38(quin,j=6.26hz,2h)3.77(s,2h)3.89(t,j=5.87hz,2h)4.62(t,j=6.85hz,2h)6.76-6.88(m,3h)7.54(s,1h)7.69(s,1h)。步骤4:4-(3-(1h-1,2,3-三唑-1-基)丙氧基)苯酚将该化合物以与化合物1的步骤4类似的方式制备。1hnmr(400mhz,cdcl3)δppm2.32(t,j=5.87hz,2h)3.83(t,j=5.67hz,2h)4.58(t,j=6.85hz,2h)6.71(d,j=1.57hz,4h)7.55(s,1h)7.64(s,1h)。步骤5:(e)-4-((4-(3-(1h-1,2,3-三唑-1-基)丙氧基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物1的步骤5类似的方式制备。1hnmr(400mhz,cdcl3)δppm2.39(t,j=6.06hz,2h)3.90(t,j=5.67hz,2h)4.62(t,j=6.85hz,2h)4.99(s,2h)6.76-6.86(m,2h)6.88-6.99(m,2h)7.13(d,j=16.82hz,1h)7.33-7.48(m,2h)7.55(s,1h)7.59-7.72(m,3h)。lrms+h+=489.1。化合物110:(e)-4-((4-(4-(2h-四唑-2-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:2-(4-(4-甲氧基苯基)丁基)-2h-四唑在制备化合物90时将该化合物分离为区域异构体。lrms+h+=233.1。步骤2:4-(4-(2h-四唑-2-基)丁基)苯酚将该化合物以与化合物1的步骤3类似的方式制备。1hnmr(400mhz,cdcl3)δppm1.58-1.68(m,2h)1.92-2.11(m,2h)2.56-2.63(m,2h)4.78(s,0h)4.65(t,j=7.04hz,2h)6.69-6.80(m,2h)7.01(m,j=8.61hz,2h)8.49(s,1h)。步骤3:(e)-4-((4-(4-(2h-四唑-2-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物1的步骤5类似的方式制备。1hnmr(400mhz,cdcl3)δppm1.63(t,j=7.63hz,2h)1.95-2.15(m,2h)2.61(t,j=7.43hz,2h)4.65(t,j=7.04hz,2h)5.02(s,2h)6.91(d,j=8.22hz,2h)7.03-7.19(m,3h)7.33-7.49(m,2h)7.57-7.76(m,3h)8.49(s,1h)。hrms+h+:488.1747。化合物111:4-((e)-4-(4-(1h-1,2,3-三唑-1-基)丁基)苯乙烯基)-2-((e)-2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:(e)-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲基)三苯基氯化鏻将三苯基膦(0.113g,0.429mmol)和(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑(0.125g,0.409mmol)在acn(4.09ml)中的混合物加热至95℃过夜。除去溶剂,将残留物溶于ea,再次除去溶剂。得到固体,在乙酸乙酯与2-3%ea中搅拌。将固体过滤,在高真空下干燥,得到0.092g的标题化合物。lrms+h+:532.2。步骤2:4-(4-羟基丁-1-炔-1-基)苯甲醛将该化合物以与化合物102的步骤1类似的方式用4-溴苯甲醛制备。步骤3:4-(4-羟基丁基)苯甲醛将前述醛(0.400g,2.3mmol)和pd/c(0.040g)在ea(23ml)中的混合物氢化直至完成。将混合物过滤,除去溶剂。在isco上使用柱(hx-ea;0-60%)纯化,得到0.147g的标题化合物。1hnmr(400mhz,cdcl3)δppm1.59-1.66(m,2h)1.68-1.80(m,2h)2.73(t,j=7.63hz,2h)3.68(t,j=6.26hz,2h)7.35(m,j=7.83hz,2h)7.80(m,j=8.22hz,2h)9.97(s,1h)。步骤4:4-(4-(1h-1,2,3-三唑-1-基)丁基)苯甲醛将该化合物以与化合物109的步骤1、2和3类似的方式由前述醇制备,直接用于下一步骤。步骤5:4-((e)-4-(4-(1h-1,2,3-三唑-1-基)丁基)苯乙烯基)-2-((e)-2-氟-4-(三氟甲基)苯乙烯基)噁唑在室温向(e)-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲基)三苯基氯化鏻(0.092g,0.161mmol)和4-(4-(1h-1,2,3-三唑-1-基)丁基)苯甲醛(0.037g,0.161mmol)在etoh(0.538ml)中的溶液中加入固体叔丁醇钾(0.020g,0.178mmol)。放置4h。将反应用水淬并且用ea稀释。分层,水层用ea萃取,合并,经na2so4干燥,过滤并且除去溶剂。将残留物吸附在sio2上,在isco上使用柱(hexane-ea;0-100%)纯化,得到0.041g的顺式和反式混合物。将6mg混合物溶于碘在甲苯中的5%溶液,在100c加热过夜。除去溶剂,将残留物溶于ea,再次除去溶剂,得到4.5mg反式加合物。1hnmr(400mhz,dmso-d6)δppm1.55(quint,j=7.40hz,2h)1.73(quint,j=7.60hz,2h)2.53(t,j=7.63hz,2h)2.85(t,j=7.43hz,2h)4.97(s,2h)6.92(m,j=8.61hz,2h)7.08(m,j=8.22hz,2h)7.29(t,j=4.89hz,1h)7.37(d,j=16.43hz,1h)7.57(d,j=16.82hz,1h)7.62(d,j=8.22hz,1h)7.76(d,j=10.96hz,1h)8.14(t,j=7.63hz,1h)8.24(s,1h)8.68(d,j=4.70hz,2h)。lrms+h+=483.1。化合物112:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(5-氟苯并呋喃-2-基)噁唑步骤1:5-氟苯并呋喃-2-甲酰胺将该化合物以与化合物76的步骤4类似的方式使用5-氟苯并呋喃-2-甲酸制备。1hnmr(400mhz,dmso-d6)δppm8.14(br.s.,1h),7.72(br.s.,1h),7.67(dd,j=9.0,4.3hz,1h),7.59(dd,j=8.6,2.7hz,1h),7.52(s,1h),7.30(td,j=9.2,2.7hz,1h)。步骤2:4-(氯甲基)-2-(5-氟苯并呋喃-2-基)噁唑将该化合物以与化合物61的步骤3类似的方式使用前述中间体制备。1hnmr(400mhz,dmso-d6)δppm8.39(s,1h),7.78(dd,j=9.0,4.3hz,1h),7.65(s,1h),7.59(dd,j=8.8,2.5hz,1h),7.33(td,j=9.4,2.7hz,1h),4.78(s,2h)。步骤3:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(5-氟苯并呋喃-2-基)噁唑将该化合物根据化合物1的步骤5制备。1hnmr(400mhz,dmso-d6)δppm8.40(s,1h),8.11(s,1h),7.77(dd,j=9.0,4.3hz,1h),7.70(s,1h),7.63(s,1h),7.58(dd,j=8.8,2.5hz,1h),7.32(td,j=9.2,2.7hz,1h),7.07-7.14(m,j=8.6hz,2h),6.91-7.00(m,j=8.6hz,2h),5.05(s,2h),4.39(t,j=7.0hz,2h),2.54(t,j=7.8hz,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。化合物113:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(5-氟苯并[b]噻吩-2-基)噁唑步骤1:5-氟苯并[b]噻吩-2-甲酰胺将该化合物以与化合物76的步骤4类似的方式使用5-氟苯并[b]噻吩-2-甲酸制备。1hnmr(400mhz,dmso-d6)δppm8.26(br.s.,1h),8.00-8.09(m,2h),7.77(dd,j=9.8,2.7hz,1h),7.65(br.s.,1h),7.34(td,j=9.0,2.7hz,1h)。步骤2:4-(氯甲基)-2-(5-氟苯并[b]噻吩-2-基)噁唑将该化合物以与化合物61的步骤3类似的方式使用前述中间体制备。1hnmr(400mhz,dmso-d6)δppm8.34(s,1h),8.13(dd,j=8.8,4.9hz,1h),8.08(s,1h),7.81(dd,j=9.6,2.5hz,1h),7.38(td,j=9.0,2.3hz,1h),4.76(s,2h)。步骤3:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(5-氟苯并[b]噻吩-2-基)噁唑将该化合物根据化合物1的步骤5制备。1hnmr(400mhz,dmso-d6)δppm8.36(s,1h),8.09-8.15(m,2h),8.06(s,1h),7.81(dd,j=9.6,2.5hz,1h),7.70(s,1h),7.37(td,j=9.0,2.7hz,1h),7.07-7.14(m,j=8.6hz,2h),6.92-6.99(m,j=8.6hz,2h),5.03(s,2h),4.39(t,j=7.0hz,2h),2.54(t,j=7.4hz,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.5hz,2h)。化合物114:(e)-1-(4-(4-((2-(4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)-1h-1,2,3-三唑-4-甲酸乙酯将该化合物以与化合物4类似的方式用(e)-4((4-(4-叠氮基丁基)苯氧基)甲基)-2-(4-(三氟甲基)苯乙烯基)噁唑和丙酸乙酯制备。1hnmr(400mhz,dmso-d6)δppm1.29(t,j=7.04hz,3h)1.47(quin,j=7.60hz,2h)1.84(quin,j=7.40hz,2h)2.51-2.57(m,2h)4.30(q,j=7.17hz,2h)4.43(t,j=7.04hz,2h)4.98(s,2h)6.94(d,j=8.61hz,2h)7.10(d,j=8.61hz,2h)7.34(d,j=16.43hz,1h)7.61(d,j=16.43hz,1h)7.76(m,j=8.22hz,2h)7.95(d,j=8.22hz,2h)8.23(s,1h)8.78(s,1h)。lrms+h+=541.1。化合物115:(e)-4-((4-((2-(1h-1,2,3-三唑-1-基)乙氧基)甲基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:(4-(氯甲基)苯氧基)三异丙基硅烷在0℃向(4-((三异丙基甲硅烷基)氧基)苯基)甲醇(1.5g,5.35mmol)在dcm(10.70ml)中的溶液中逐滴加入亚硫酰氯(0.624ml,8.56mmol)。加入后,移去冰浴,在室温搅拌反应混合物2h。将混合物用dcm(20ml)稀释,用水(3x10ml)洗涤,干燥并且浓缩。残留物使用isco柱(hx至20%acoet)纯化,得到标题化合物(1.3g,81%收率)。1hnmr(400mhz,cdcl3)δppm1.09(d,j=7.04hz,18h)1.19-1.30(m,3h)4.55(s,2h)6.84(d,j=8.61hz,2h)7.23(d,j=8.61hz,2h)。步骤2:4-((2-叠氮基乙氧基)甲基)苯酚将氢化钠(0.039g,1.606mmol)加入到2-叠氮基乙醇(0.140g,1.606mmol)在dmf(3ml)中的冷溶液中,随后加入bu4ni(9.42mg,0.067mmol)。15min后,加入(4-(氯甲基)苯氧基)三异丙基硅烷(0.4g,1.3mmol),将反应混合物搅拌过夜。将混合物用acoet(20ml)稀释,通过硅藻土垫过滤,将滤液浓缩至干。残留物在isco上使用柱(dcm/ea;0-40%)纯化,得到0.060g(23%)的标题化合物。1hnmr(400mhz,cdcl3)δppm3.39(t,j=5.09hz,2h)3.63(t,j=5.09hz,2h)3.81(s,2h)4.51(s,2h)6.89(d,j=8.61hz,1h)7.28(d,j=8.61hz,1h)。步骤3:4-((2-(1h-1,2,3-三唑-1-基)乙氧基)甲基)苯酚在微波管中将4-((2-叠氮基乙氧基)甲基)苯酚(0.06g,0.311mmol)在乙酸乙烯酯(0.851ml,9.32mmol)中的混合物加热至120℃持续21h。在高真空下将混合物浓缩至干,得到所需4-((2-(1h-1,2,3-三唑-1-基)乙氧基)甲基)苯酚(64mg,0.29mmol,94%收率)为无色油,其纯度足以无需进一步纯化即可用于下一步反应。1hnmr(400mhz,cdcl3)δppm3.82(t,j=5.09hz,2h)4.41(s,2h)4.58(t,j=5.09hz,2h)5.09(s,1h)6.80(m,j=8.22hz,2h)7.11(m,j=8.22hz,2h)7.69(d,j=4.30hz,2h)。步骤4:(e)-4-((4-((2-(1h-1,2,3-三唑-1-基)乙氧基)甲基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物32类似的方式由前述苯酚和(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑制备。1hnmr(400mhz,cdcl3)δppm3.83(t,j=5.09hz,2h)4.44(s,2h)4.58(t,j=5.09hz,2h)5.04(s,2h)6.96(d,j=8.61hz,2h)7.09-7.21(m,3h)7.38(d,j=10.56hz,1h)7.44(d,j=8.22hz,1h)7.58-7.75(m,5h)。lrms+h+=489.2。化合物116:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-氯-2-氟苯乙烯基)噁唑步骤1:(e)-2-(4-氯-2-氟苯乙烯基)-4-(氯甲基)噁唑将该化合物以与化合物3a/b的步骤1和2类似的方式由相应(e)-3-(4-氯-2-氟苯基)丙烯酸制备。1hnmr(dmso-d6)δ:8.21(s,1h),7.96(t,j=8.4hz,1h),7.48-7.58(m,2h),7.37(dd,j=8.6,1.6hz,1h),7.25(d,j=16.8hz,1h),4.71(s,2h)。步骤2:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4-氯-2-氟苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述氯化物和相应苯酚制备。1hnmr(dmso-d6)δ:8.22(s,1h),8.11(s,1h),7.95(t,j=8.4hz,1h),7.70(s,1h),7.48-7.58(m,2h),7.37(d,j=8.6hz,1h),7.25(d,j=16.8hz,1h),7.05-7.14(d,j=8.6hz,2h),6.90-6.98(d,j=8.2hz,2h),4.98(s,2h),4.39(t,j=7.0hz,2h),2.52-2.58(m,2h),1.81(quin,j=7.2hz,2h),1.48(quin,j=7.5hz,2h)。lrms+h+=453.1。化合物117:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氯-4-氟苯乙烯基)噁唑步骤1:(e)-2-(2-氯-4-氟苯乙烯基)-4-(氯甲基)噁唑(e)-2-(2-氯-4-氟苯乙烯基)-4-(氯甲基)噁唑将该化合物以与化合物3a/b的步骤1和2类似的方式由相应(e)-3-(2-氯-4-氟苯基)丙烯酸制备。1hnmr(dmso-d6)δ:8.21(s,1h),8.09(dd,j=8.6,6.3hz,1h),7.72(d,j=16.0hz,1h),7.56(dd,j=8.8,2.5hz,1h),7.32(td,j=8.6,2.7hz,1h),7.25(d,j=16.0hz,1h),4.72(s,2h)。步骤2:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氯-4-氟苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述氯化物和相应苯酚制备。1hnmr(dmso-d6)δ:8.22(s,1h),8.04-8.13(m,2h),7.67-7.76(m,2h),7.56(dd,j=8.6,2.3hz,1h),7.32(td,j=8.5,2.5hz,1h),7.25(d,j=16.4hz,1h),7.06-7.13(d,j=8.6hz,2h),6.90-6.97(d,j=8.6hz,2h),4.98(s,2h),4.39(t,j=7.0hz,2h),2.52-2.58(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.5hz,2h)。lrms+h+=453.1.lrms+h+=453.1。化合物118:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氯苯乙烯基)噁唑步骤1:(e)-4-(氯甲基)-2-(2-氯苯乙烯基)噁唑将该化合物以与化合物3a/b的步骤1和2类似的方式由相应(e)-3-(2-氯苯基)丙烯酸制备。1hnmr(dmso-d6)δ:8.21(s,1h),8.09(dd,j=8.6,6.3hz,1h),7.72(d,j=16.0hz,1h),7.56(dd,j=8.8,2.5hz,1h),7.32(td,j=8.6,2.7hz,1h),7.25(d,j=16.0hz,1h),4.72(s,2h)。步骤2:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氯苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述氯化物和相应苯酚制备。1hnmr(dmso-d6)δ:8.23(s,1h),8.11(s,1h),7.98-8.05(m,1h),7.78(d,j=16.4hz,1h),7.70(s,1h),7.50-7.58(m,1h),7.36-7.44(m,2h),7.27(d,j=16.4hz,1h),7.05-7.14(d,j=8.6hz,2h),6.91-6.98(d,j=8.6hz,2h),4.99(s,2h),4.39(t,j=7.0hz,2h),2.52-2.58(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。lrms+h+=435.1。化合物119:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2,4-二氯苯乙烯基)噁唑步骤1:(e)-4-(氯甲基)-2-(2,4-二氯苯乙烯基)噁唑将该化合物以与化合物3a/b的步骤1和2类似的方式由相应(e)-3-(2,4-二氯苯基)丙烯酸制备。1hnmr(dmso-d6)δ:8.22(s,1h),8.05(d,j=8.6hz,1h),7.67-7.76(m,2h),7.50(dd,j=8.6,2.3hz,1h),7.30(d,j=16.4hz,1h),4.72(s,2h)。步骤2:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2,4-二氯苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述氯化物和相应苯酚制备。1hnmr(dmso-d6)δ:8.24(s,1h),8.11(s,1h),8.05(d,j=8.6hz,1h),7.67-7.75(m,3h),7.50(dd,j=8.6,2.0hz,1h),7.31(d,j=16.4hz,1h),7.06-7.13(d,j=8.6hz,2h),6.90-6.98(d,j=8.2hz,2h),4.99(s,2h),4.39(t,j=7.0hz,2h),2.52-2.57(m,2h),1.80(quin,j=7.2hz,2h),1.47(quin,j=7.6hz,2h)。lrms+h+=469.1。化合物120:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(3,4,5-三氟苯乙烯基)噁唑步骤1:(e)-4-(氯甲基)-2-(3,4,5-三氟苯乙烯基)噁唑将该化合物以与类似的方式化合物58的步骤1-3由相应醛制备。1hnmr(dmso-d6)δ:7.48-7.63(m,3h),7.36(d,j=15.7hz,1h),7.21(br.s.,1h),6.64(d,j=15.7hz,1h)。步骤2:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(3,4,5-三氟苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述氯化物和相应苯酚制备。1hnmr(dmso-d6)δ:8.22(s,1h),8.11(s,1h),7.80(dd,j=9.0,7.0hz,2h),7.70(s,1h),7.49(d,j=16.4hz,1h),7.30(d,j=16.4hz,1h),7.05-7.14(m,j=8.6hz,2h),6.89-6.98(m,j=8.2hz,2h),4.97(s,2h),4.39(t,j=7.0hz,2h),2.52-2.58(m,2h),1.81(quin,j=7.2hz,2h),1.48(quin,j=7.6hz,2h)。lrms+h+=455.2。化合物121:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(3,4-二氟苯乙烯基)噁唑步骤1:(e)-4-(氯甲基)-2-(3,4-二氟苯乙烯基)噁唑将该化合物以与化合物58的步骤1-3类似的方式由相应醛制备。1hnmr(dmso-d6)δ:8.18(s,1h),7.93(ddd,j=12.1,7.8,2.0hz,1h),7.56-7.62(m,1h),7.42-7.56(m,2h),7.21(d,j=16.4hz,1h),4.70(s,2h)。步骤2:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(3,4-二氟苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述氯化物和相应苯酚制备。1hnmr(dmso-d6)δ:8.20(s,1h),8.11(d,j=0.8hz,1h),7.92(ddd,j=12.1,7.8,2.0hz,1h),7.70(d,j=0.8hz,1h),7.55-7.62(m,1h),7.41-7.55(m,2h),7.22(d,j=16.4hz,1h),7.05-7.13(d,j=8.6hz,2h),6.88-6.98(m,2h),4.97(s,2h),4.39(t,j=7.0hz,2h),2.52-2.57(m,2h),1.81(quin,j=7.3hz,2h),1.42-1.54(m,2h)。lrms+h+=437.2。化合物122:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-3-氟苄腈步骤1:(e)-4-(2-(4-(氯甲基)噁唑-2-基)乙烯基)-3-氟苄腈将该化合物以与化合物58的步骤1-3类似的方式由相应醛制备。1hnmr(dmso-d6)δ:8.25(s,1h),8.14(t,j=7.8hz,1h),7.96(dd,j=11.0,1.2hz,1h),7.77(d,j=9.0hz,1h),7.58(d,j=16.8hz,1h),7.42(d,j=16.8hz,1h),4.72(s,2h)。步骤2:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-3-氟苄腈将该化合物以与化合物32的步骤2类似的方式由前述氯化物和相应苯酚制备。1hnmr(dmso-d6)δ:8.27(s,1h),8.14(t,j=8.0hz,1h),8.11(d,j=0.8hz,1h),7.95(dd,j=10.6,1.2hz,1h),7.76(dd,j=8.2,1.2hz,1h),7.68-7.72(m,1h),7.57(d,j=16.8hz,1h),7.42(d,j=16.8hz,1h),7.06-7.12(d,j=8.6hz,2h),6.90-6.97(m,2h),4.99(s,2h),4.39(t,j=7.0hz,2h),2.52-2.56(m,2h),1.81(quin,j=7.2hz,2h),1.41-1.54(m,2h)。lrms+h+=444.2。化合物123:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(甲磺酰基)苯乙烯基)噁唑步骤1:(e)-4-(氯甲基)-2-(2-氟-4-(甲磺酰基)苯乙烯基)噁唑将该化合物以与化合物58的步骤1-3类似的方式由相应醛制备。1hnmr(dmso-d6)δ:8.26(s,1h),8.22(t,j=7.6hz,1h),7.86(dd,j=10.0,1.4hz,1h),7.80(dd,j=8.0,1.4hz,1h),7.61(d,j=16.4hz,1h),7.42(d,j=16.8hz,1h),4.73(s,2h),3.30(s,3h)。步骤2:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(甲磺酰基)苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述氯化物和相应苯酚制备。1hnmr(dmso-d6)δ:8.27(s,1h),8.22(t,j=7.8hz,1h),8.08-8.13(m,1h),7.86(dd,j=10.0,1.8hz,1h),7.80(dd,j=8.2,1.6hz,1h),7.70(d,j=0.8hz,1h),7.60(d,j=16.8hz,1h),7.43(d,j=16.4hz,1h),7.05-7.13(d,j=8.6hz,2h),6.90-6.98(m,2h),5.00(s,2h),4.39(t,j=7.0hz,2h),3.30(s,3h),2.52-2.57(m,2h),1.81(quin,j=7.2hz,2h),1.48(quin,j=7.6hz,2h)。lrms+h+=497.2。化合物124:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲氧基)苯乙烯基)噁唑步骤1:(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲氧基)苯乙烯基)噁唑将该化合物以与化合物58的步骤1-3类似的方式由相应醛制备。1hnmr(dmso-d6)δ:8.22(s,1h),8.07(t,j=8.6hz,1h),7.55(d,j=16.4hz,1h),7.50(d,j=12.5hz,1h),7.32(d,j=9.0hz,1h),7.27(d,j=16.8hz,1h),4.71(s,2h)。步骤2:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲氧基)苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述氯化物和相应苯酚制备。1hnmr(dmso-d6)δ:8.23(s,1h),8.09-8.13(m,1h),8.06(t,j=8.8hz,1h),7.67-7.73(m,1h),7.46-7.59(m,2h),7.23-7.35(m,2h),7.05-7.14(d,j=8.6hz,2h),6.89-6.98(d,2h),4.98(s,2h),4.39(t,j=7.0hz,2h),2.52-2.57(m,2h),1.81(quin,j=7.3hz,2h),1.42-1.54(m,2h)。lrms+h+=503.1。化合物125:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-3-氟苯甲酸甲酯步骤1:(e)-4-(2-(4-(氯甲基)噁唑-2-基)乙烯基)-3-氟苯甲酸甲酯将该化合物以与化合物58的步骤1-3类似的方式由相应醛制备。1hnmr(dmso-d6)δ:8.24(s,1h),8.08(t,j=7.8hz,1h),7.73-7.84(m,2h),7.60(d,j=16.4hz,1h),7.37(d,j=16.8hz,1h),4.72(s,2h),3.88(s,3h)。步骤2:(e)-4-(2-(4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)噁唑-2-基)乙烯基)-3-氟苯甲酸甲酯将该化合物以与化合物32的步骤2类似的方式由前述氯化物和相应苯酚制备。1hnmr(dmso-d6)δ:8.26(s,1h),8.04-8.12(m,2h),7.82(dd,j=8.0,1.4hz,1h),7.77(dd,j=11.2,1.4hz,1h),7.70(s,1h),7.59(d,j=16.4hz,1h),7.38(d,j=16.4hz,1h),7.06-7.12(d,j=8.2hz,2h),6.90-6.97(d,j=8.6hz,2h),4.99(s,2h),4.39(t,j=7.0hz,2h),3.88(s,3h),2.52-2.58(m,2h),1.81(quin,j=7.2hz,2h),1.48(quin,j=7.6hz,2h)。lrms+h+=477.2。化合物126:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(5-氟-7-硝基-1h-吲哚-2-基)噁唑步骤1:5-氟-7-硝基-1h-吲哚-2-甲酸乙酯将nano2(2.320g,33.6mmol)在水(nano2)(8.69ml,482mmol)中的溶液经20分钟逐滴加入到在水(苯胺)(11.14ml,618mmol)和浓hcl(13.15ml,160mmol)中的4-氟-2-硝基苯胺(5g,32.0mmol)中。在容纳冷却至0-5℃的在etoh(33.1ml,567mmol)中的2-甲基乙酰乙酸乙酯(4.66ml,32.0mmol)的分离器中逐滴加入在水(8.23ml,96mmol)中的koh45wt%,随后加入冰冷的水(66.1ml,3667mmol),将其搅拌10分钟。向该溶液中逐滴加入第一溶液并且将其搅拌过夜。形成橙色悬浮液和大块黑色块状物。反应混合物用et2o(3x100ml)萃取,合并的有机层用水(2x100ml)、然后盐水(100ml)洗涤。有机层经mgso4干燥,过滤并且浓缩至干,得到粗制品(e)-乙基2-(2-(4-氟-2-硝基苯基)肼叉)丙酸乙酯(7.30g,27.1mmol,85%收率)。将在多磷酸(41.5ml,873mmol)中的前述化合物加热至110℃持续1小时,然后冷却至75℃。3h后,将混合物冷却至20℃,加入水(100ml),搅拌30分钟。然后加入ea(600ml),水相用饱和nahco3(300ml)中和(不接近中性ph)。加入另外的水(500ml),然后加入固体nahco(约250g)。加入另外的水(500ml)和etoac(500ml),将混合物过滤。固体是用水(500ml)和etoac(500ml)洗涤的固体。分层,有机层用水(500ml)和盐水(300ml)洗涤。有机层经mgso4干燥,过滤并且浓缩,得到3.42g为褐色固体。残留物在isco上使用redisepgold柱(hex/etoac)纯化。将粗制产物溶解并且加载在前置柱(将粗制品溶解在etoac中)上。需要第二次纯化以获取5-氟-7-硝基-1h-吲哚-2-甲酸乙酯(585mg,8.55%收率)。1hnmr(dmso-d6)δ:11.59(br.s.,1h),8.18(dd,j=9.0,2.3hz,1h),8.12(dd,j=8.6,2.3hz,1h),7.44(s,1h),4.39(q,j=7.0hz,2h),1.36(t,j=7.0hz,3h)。步骤2:5-氟-7-硝基-1h-吲哚-2-甲酸向在乙醇(5.76ml,99mmol)中的5-氟-7-硝基-1h-吲哚-2-甲酸乙酯(0.585g,2.320mmol)加入氢氧化钾(0.390g,6.96mmol)在水(1.529ml,85mmol)中的溶液。在20℃搅拌。在室温持续1h后,将其加热至60℃持续2h。将其浓缩至干,通过加热至60℃将粗制品溶解在水(30ml)中。加入hcl(3.02ml,6.03mmol),开始结晶。冷却至20℃,搅拌1小时。过滤固体,将滤饼用水(2x2.5ml)洗涤,在高真空下干燥直到恒重(500mg,96%收率)。1hnmr(dmso-d6)δ:10.80(br.s.,1h),8.05-8.08(m,j=2.3,2.3,2.3hz,1h),8.02-8.05(m,1h),7.12(s,1h)步骤3:4-(氯甲基)-2-(5-氟-7-硝基-1h-吲哚-2-基)噁唑将该化合物以与化合物3a/b的步骤1和2类似的方式由前述羧酸制备。1hnmr(dmso-d6)δ:11.95(br.s.,1h),8.40(s,1h),8.03-8.13(m,2h),7.39(s,1h),4.80(s,2h)。步骤4:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(5-氟-7-硝基-1h-吲哚-2-基)噁唑向nah60%wt.(6.39mg,0.160mmol)在dmf(565μl,7.29mmol)中的冷却的0℃的悬浮液加入4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚(26.2mg,0.121mmol)。将其温热至20℃,搅拌30分钟,冷却回至0℃。加入4-(氯甲基)-2-(5-氟-7-硝基-1h-吲哚-2-基)噁唑(35mg,0.118mmol)在0℃将其搅拌1小时,缓慢温热至20℃过夜。加入另外的nah约60wt%直到完成。42小时后,加入hplcl.meoh(565μl,13.97mmol),随后加入水(565μl,31.4mmol),开始结晶。搅拌3h后,收集固体,将滤饼用meoh:水(1:1,3x0.5ml)、然后己烷(3x1ml)洗涤。将产物在高真空下干燥直到恒重。(47mg,83%收率)。1hnmr(dmso-d6)δ:11.97(br.s.,1h),8.41(s,1h),8.10-8.13(m,1h),8.06(dq,j=9.0,2.1hz,2h),7.68-7.73(m,1h),7.36(s,1h),7.08-7.14(d,j=8.6hz,2h),6.93-7.01(m,2h),5.06(s,2h),4.39(t,j=7.0hz,2h),2.54(t,j=7.8hz,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。lrms+h+=477.2。化合物127:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(6-氟-1h-吲哚-2-基)噁唑步骤1:4-(氯甲基)-2-(6-氟-1h-吲哚-2-基)噁唑将该化合物以与化合物3a/b的步骤1和2类似的方式由4-(氯甲基)-2-(6-氟-1h-吲哚-2-基)噁唑制备。1hnmr(dmso-d6)δ:12.19(br.s.,1h),8.27(s,1h),7.65(dd,j=8.6,5.5hz,1h),7.15(dd,j=10.0,2.2hz,1h),7.11(d,j=1.6hz,1h),6.90-6.99(m,1h),4.77(s,2h)。步骤2:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(6-氟-1h-吲哚-2-基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述氯化物和相应苯酚制备。1hnmr(dmso-d6)δ:12.18(s,1h),8.30(s,1h),8.11(s,1h),7.70(s,1h),7.65(dd,j=8.8,5.7hz,1h),7.14(dd,j=10.0,2.2hz,1h),7.10(d,j=8.2hz,3h),6.90-6.99(m,3h),5.03(s,2h),4.39(t,j=7.0hz,2h),2.52-2.57(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。lrms+h+=432.1。化合物128:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(4,6-二氟-1h-吲哚-2-基)噁唑将该化合物以与化合物127类似的方式以4,6-二氟-1h-吲哚-2-甲酸开始制备。1hnmr(dmso-d6)δ:12.56(s,1h),8.33(s,1h),8.11(s,1h),7.70(s,1h),7.07-7.14(m,3h),7.04(dd,j=9.2,1.8hz,1h),6.88-6.99(m,3h),5.04(s,2h),4.39(t,j=7.0hz,2h),2.52-2.57(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。lrms+h+=450.1。化合物129:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(6-硝基-1h-吲哚-2-基)噁唑将该化合物以与化合物127类似的方式以6-硝基-1h-吲哚-2-甲酸开始制备。1hnmr(dmso-d6)δ:12.90(br.s.,1h),8.42(s,1h),8.31(d,j=1.6hz,1h),8.11(s,1h),7.95(dd,j=8.8,2.2hz,1h),7.85(d,j=9.0hz,1h),7.70(s,1h),7.29(s,1h),7.07-7.13(d,j=8.2hz,2h),6.93-6.99(d,j=8.2hz,2h),5.07(s,2h),4.39(t,j=7.0hz,2h),2.52-2.57(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.5hz,2h)。lrms+h+=459.1。化合物130:(e)-4-((4-((3-(1h-1,2,3-三唑-1-基)丙基)硫基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:3-(1h-1,2,3-三唑-1-基)丙烷-1-醇和3-(4-(三甲基甲硅烷基)-1h-1,2,3-三唑-1-基)丙烷-1-醇将这些化合物以与化合物2的步骤1类似的方式制备,并且作为混合物用于下一步骤。第一化合物的1hnmr(cdcl3):δ2.00(br.s.,1h)2.14(quin,j=6.20hz,2h)3.65(t,j=5.87hz,2h)4.56(t,j=6.65hz,2h)7.59(s,1h)7.71(s,1h),第二化合物的1hnmr(cdcl3):δppm0.32(s,9h)2.13(quint,j=6.20,2h)3.65(t,j=5.67hz,2h)4.54(t,j=6.65hz,2h)7.54(s,1h)。步骤2:4-((3-(1h-1,2,3-三唑-1-基)丙基)硫基)苯酚将前述醇的混合物根据化合物1的步骤1所述的类似步骤转化为甲磺酸酯,在60℃将粗制品与4-甲氧基苯硫醇和碳酸钾在dmf中加热过夜。然后将其用水-ea稀释,分离,水层用ea萃取。合并的有机层经na2so4干燥,过滤并且除去溶剂。将得到的粗制品在hbr水溶液(48%)中加热过夜,然后除去溶剂。残留物在ea-nahco3(水)中稀释,ph调节为几乎中性。分离有机相,干燥,除去溶剂。在isco上使用柱(hx/ea;20-100%)纯化,得到标题化合物。lrms+h+=236.1。步骤3:(e)-4-((4-((3-(1h-1,2,3-三唑-1-基)丙基)硫基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述苯酚和相应氯化物制备。1hnmr(dmso-d6)δ:2.01(quint,j=7.00,7.00,7.00,7.00,7.00,7.00hz,2h)2.80(t,j=7.24hz,2h)4.46(t,j=6.85hz,2h)5.02(s,2h)6.98-7.03(m,2h)7.28-7.34(m,2h)7.38(d,j=16.82hz,1h)7.58(d,j=16.43hz,1h)7.63(d,j=7.83hz,1h)7.68-7.71(m,1h)7.76(d,j=9.78hz,1h)8.09(d,j=0.78hz,1h)8.14(t,j=8.02hz,1h)8.26(s,1h)。lrms+h+=504.9。化合物131:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噻唑步骤1:(e)-3-(2-氟-4-(三氟甲基)苯基)丙烯酰胺将该化合物以与化合物3a/b的步骤1类似的方式由相应羧酸制备。1hnmr(dmso-d6)δ:6.83(d,j=16.04hz,1h)7.31(br.s.,1h)7.50(d,j=16.04hz,1h)7.64(d,j=7.83hz,1h)7.68-7.80(m,2h)7.85-7.93(m,1h)。步骤2:(e)-3-(2-氟-4-(三氟甲基)苯基)丙-2-烯硫代酰胺在25ml圆底烧瓶中加入在thf(7.80ml,95mmol)中的(e)-3-(2-氟-4-(三氟甲基)苯基)丙烯酰胺(0.4g,1.716mmol),得到无色溶液。将劳森试剂(0.416g,1.029mmol)加入到在thf(7.80ml,95mmol)中的前述酰胺(0.4g,1.716mmol)中,在室温搅拌过夜。将其然后加热至回流持续48h。在回流下继续搅拌额外16小时,然后冷却至20℃,浓缩至干。将粗制品溶解在ch2cl2(7.78ml,121mmol)中,加入硅胶(3g)。在减压下浓缩,残留物在isco上使用redisep柱(hex/etoac;0-100%)纯化,得到标题化合物(245mg,0.983mmol,57.3%收率)为黄色固体。1hnmr(dmso-d6)δ:9.78(br.s.,1h),9.46(br.s.,1h),7.92(t,j=7.8hz,1h),7.79(d,j=10.6hz,1h),7.74(d,j=15.7hz,1h),7.65(d,j=8.2hz,1h),7.18(d,j=15.7hz,1h)。步骤3:(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噻唑将(e)-3-(2-氟-4-(三氟甲基)苯基)丙-2-烯硫代酰胺(100mg,0.401mmol)和1,3-二氯丙烷-2-酮(61.1mg,0.481mmol)在etoh(820μl,14.04mmol)中的混合物在密封小瓶中加热至回流(约85℃)持续1h。除去溶剂,残留物在isco上使用redisep柱(hex/etoac;0-50%)纯化,取得标题化合物(69mg,0.214mmol,53.5%收率)。1hnmr(dmso-d6)δ:8.13(t,j=7.8hz,1h),7.84(s,1h),7.77(d,j=11.0hz,1h),7.73(d,j=16.4hz,1h),7.64(d,j=7.8hz,1h),7.58(d,j=16.4hz,1h),4.87(s,2h)。步骤4:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噻唑将该化合物以与化合物32的步骤2类似的方式由前述氯化物、相应苯酚制备。1hnmr(dmso-d6)δ:8.08-8.17(m,2h),7.69-7.80(m,4h),7.64(d,j=7.8hz,1h),7.58(d,j=16.4hz,1h),7.06-7.14(d,j=8.6hz,2h),6.91-6.99(d,j=8.6hz,2h),5.16(s,2h),4.39(t,j=7.0hz,2h),2.52-2.57(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。lrms+h+=503.1。化合物132:(e)-4-(((4-(3-(1h-1,2,3-三唑-1-基)丙基)苯基)硫基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:二甲基硫代氨基甲酸o-(4-(3-(1h-1,2,3-三唑-1-基)丙基)苯基)酯将二甲基硫代氨基甲酰氯(0.365g,2.95mmol)加入到在dmf(5.88ml,76mmol)中的4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚(0.3g,1.476mmol)中,将其加热至70℃过夜。将反应混合物倒入水(18ml)中,用et2o(5x15ml)萃取。合并的有机层用1wt%naoh(10ml)、然后盐水(10ml)洗涤。有机层经mgso4干燥,过滤并且浓缩,得到黄色油。残留物在isco上使用redisep柱(hex/etoac;0-100%)纯化,得到标题化合物(236mg,0.813mmol,55.1%收率)。1hnmr(dmso-d6)δ:8.17(s,1h),7.74(s,1h),7.16-7.27(d,j=8.2hz,2h),6.93-7.02(d,j=8.2hz,2h),4.39(t,j=7.0hz,2h),3.35(s,3h),3.29(s,3h),2.52-2.59(m,2h),2.14(quin,j=7.4hz,2h)。步骤2:二甲基硫代氨基甲酸s-(4-(3-(1h-1,2,3-三唑-1-基)丙基)苯基)酯将二甲基硫代氨基甲酸o-(4-(3-(1h-1,2,3-三唑-1-基)丙基)苯基)酯(230mg,0.792mmol)在二苯醚(1206μl,7.58mmol)中的溶液放入微波中,加热至250℃持续10h。残留物在isco上使用redisep柱(己烷)纯化。将粗制产物溶解并且加载在前置柱(介质,10gsio2,将粗制品溶解在meoh中)上。收集的级分:无。这样做是为了除去phoph。残留物在isco上使用redisep12g柱(hex/etoac)用如上准备的干法填装纯化,得到标题化合物(129mg,56.1%收率)。1hnmr(dmso-d6)δ:8.17(s,1h),7.74(s,1h),7.32-7.38(d,j=7.8hz,2h),7.22-7.28(d,j=7.8hz,2h),4.40(t,j=7.0hz,2h),3.03(br.s.,3h),2.92(br.s.,3h),2.55-2.62(m,2h),2.14(quin,j=7.4hz,2h)。步骤3:4-(3-(1h-1,2,3-三唑-1-基)丙基)苯硫醇向二甲基硫代氨基甲酸s-(4-(3-(1h-1,2,3-三唑-1-基)丙基)苯基)酯(130mg,0.448mmol)在thf(578μl,7.05mmol)中的溶液中加入koh(60.3mg,1.074mmol)在meoh(230μl,5.69mmol)中的溶液。将其搅拌过夜,搅拌结束将混合物倒入水(5ml)中,用hcl(187μl,1.119mmol)酸化。水层用etoac(10ml)萃取,有机层用水(5ml)、然后用盐水(5ml)洗涤。有机层经mgso4干燥,过滤并且浓缩至干。残留物在isco上使用redisep柱(ch2cl2/meoh;0-50%)纯化。将粗制产物溶解并且加载在前置柱(小,4gsio2,将粗制品溶解在ch2cl2中)上,得到标题化合物(56mg,57.0%收率)。1hnmr(dmso-d6)δ:8.15(s,1h),7.73(s,1h),7.18-7.23(m,j=8.2hz,2h),7.05-7.12(m,2h),5.28(s,1h),4.36(t,j=7.2hz,2h),2.43-2.48(m,2h),2.09(quin,j=7.5hz,2h)。lrms+h+=220.1。步骤4:(e)-4-(((4-(3-(1h-1,2,3-三唑-1-基)丙基)苯基)硫基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述硫醇、相应氯化物制备。1hnmr(dmso-d6)δ:8.09-8.18(m,2h),7.97(s,1h),7.77(d,j=10.6hz,1h),7.72(s,1h),7.63(d,j=8.2hz,1h),7.53(d,j=16.4hz,1h),7.28-7.38(m,3h),7.16(d,j=8.2hz,2h),4.37(t,j=7.0hz,2h),4.12(s,2h),2.52-2.56(m,2h),2.11(quin,j=7.4hz,2h)。lrms+h+=489.2。化合物133:(e)-4-(((6-(4-(1h-1,2,3-三唑-1-基)丁基)吡啶-3-基)氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:4-(4-甲氧基苯基)丁-3-炔-1-醇向2-溴-5-甲氧基吡啶(1.00g,5.3mmol)和丁-3-炔-1-醇(0.224g,3.19mmol)在et3n(17.79ml,128mmol)中的脱气溶液中加入碘化铜(i)(0.018g,0.096mmol)和pdcl2(pph3)2(0.067g,0.096mmol)。在80℃将其搅拌过夜。将其然后过滤,除去溶剂。粗制品使用isco柱(dcm-meoh;0-15%)纯化,得到标题化合物(1.3g,81%收率)。1hnmr(400mhz,cdcl3)δ2.70(t,j=6.26hz,2h)3.74-3.92(m,5h)7.13(dd,j=8.61,2.74hz,1h)7.34(d,j=8.61hz,1h)8.23(br.s.,1h)。步骤2:4-(4-甲氧基苯基)丁烷-1-醇将前述炔烃(0.41g,2.3mmol)在甲醇-乙酸乙酯(1/1;158ml)中在钯炭10%下用氢气球过夜氢化。将混合物过滤,除去溶剂,得到标题化合物(0.33g,79%)。1hnmr(dmso-d6)δ:1.31-1.46(m,2h)1.57(quin,j=7.63hz,2h)2.54(t,j=7.63hz,2h)3.39(q,j=6.26hz,2h)4.36(t,j=5.28hz,1h)7.16(m,j=8.22hz,2h)7.45(m,j=8.22hz,2h)。步骤3:1-(4-(4-甲氧基苯基)丁基)-1h-1,2,3-三唑1-(4-叠氮基丁基)-4-甲氧基苯以与化合物1的步骤2、方法b类似的方式由前述醇制备,然后用乙酸乙烯酯以与化合物1的步骤3类似的方式处理,取得标题化合物。1hnmr(dmso-d6)δ:1.55(quint,j=7.60hz,2h)1.80(quin,j=7.34hz,1h)2.66(t,j=7.63hz,2h)3.76(d,j=1.57hz,3h)4.37(t,j=6.85hz,2h)7.13(d,j=8.22hz,1h)7.27(dd,j=8.61,3.13hz,1h)7.68(s,1h)8.09(s,1h)8.15(d,j=3.13hz,1h)。步骤4:4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚在105℃将2-(4-(1h-1,2,3-三唑-1-基)丁基)-5-甲氧基吡啶(0.074,0.319mmol)在hbr(2ml,17.68mmol)中的混合物加热过夜,然后在120c加热8h。氮气鼓泡15min,然后加入ea,混合物用固体na2co3淬灭。分层,水层用ea萃取。合并有机层,用盐水洗涤,经na2so4干燥,过滤并且除去溶剂,得到标题化合物(0.060g,86%)。1hnmr(dmso-d6)δ:1.55(quint,j=7.60hz,2h)1.81(quint,j=7.40,hz,2h)2.62(t,j=7.63hz,2h)4.38(t,j=7.04hz,2h)6.91-7.08(m,2h)7.70(d,j=0.78hz,1h)8.01(d,j=1.96hz,1h)8.10(d,j=0.78hz,1h)9.59(s,1h)。步骤5:(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物3a/b的步骤1-2类似的方式由(e)-3-(2-氟-4-(三氟甲基)苯基)丙烯酸制备。1hnmr(dmso-d6)δ:4.70(s,2h)7.36(d,j=16.43hz,1h)7.57(d,j=16.82hz,1h)7.62(d,j=8.22hz,1h)7.75(d,j=9.78hz,1h)8.13(t,j=7.83hz,1h)8.22(s,1h)。步骤6:(e)-4-(((6-(4-(1h-1,2,3-三唑-1-基)丁基)吡啶-3-基)氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式由前述苯酚(步骤4)和步骤5的氯化物制备。1hnmr(dmso-d6)δ:1.58(quin,j=7.63hz,2h)1.82(quin,j=7.34hz,2h)2.69(t,j=7.63hz,2h)4.39(t,j=6.85hz,2h)5.09(s,2h)7.35-7.44(m,2h)7.60(d,j=16.20hz,1h)7.65(d,j=8.22hz,1h)7.70(s,1h)7.79(d,j=10.96hz,1h)8.11(s,1h)8.16(t,j=7.83hz,1h)8.26(d,j=3.13hz,1h)8.30(s,1h)。lrms+h+=488.0。化合物134:(e)-4-(4-(4-(1h-1,2,3-三唑-1-基)丁基)苄基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:4-(4-溴苯基)丁烷-1-醇将bh3.thf(6.17ml,6.17mmol)加入到4-(4-溴苯基)丁酸(1.0g,4.11mmol)在thf(13.71ml)中的0℃溶液中,使其恢复至室温过夜。将其冷却回至0℃,加入相同量的bh3.thf,在室温放置过夜。混合物用hoac(2.5ml)淬灭,使其恢复至室温保持30min。将其用ea稀释,分层。水层用ea萃取,合并有机层,用盐水洗涤。经na2so4干燥后,将其过滤,除去溶剂,得到标题化合物(0.85g,90%)。1hnmr(dmso-d6)δ:1.31-1.46(m,2h)1.57(quin,j=7.63hz,2h)2.54(t,j=7.63hz,2h)3.39(q,j=6.26hz,2h)4.36(t,j=5.28hz,1h)7.16(m,j=8.22hz,2h)7.45(m,j=8.22hz,2h)。步骤2:1-(4-(4-溴苯基)丁基)-1h-1,2,3-三唑将该化合物以与化合物133的步骤3类似的方式制备。1hnmr(dmso-d6)δ:1.42-1.56(m,2h)1.74-1.85(m,2h)2.57(t,j=7.83hz,2h)4.39(t,j=7.04hz,2h)7.09-7.16(m,2h)7.40-7.48(m,2h)7.70(d,j=0.78hz,1h)8.11(d,j=0.78hz,1h)。步骤3:1-(4-(4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)苯基)丁基)-1h-1,2,3-三唑在100℃将前述溴化物(1.0eq.)、乙酸钾(5.0eq.)、双(频哪醇合)二硼(1.5eq.)和pdcl2.dppf(0.2eq.)的脱气混合物加热2h。混合物用nh4cl溶液淬灭,用ea稀释。分层,水层用ea萃取。合并的有机层用盐水洗涤,将na2so4干燥,过滤,除去溶剂。在isco上使用柱(hx/ea;20-100%)纯化,得到标题化合物(0.072g,61%)。1hnmr(dmso-d6)δ:1.28(s,12h)1.51(quin,j=7.53hz,2h)1.80(quin,j=7.34hz,1h)2.61(s,2h)4.39(t,j=7.04hz,2h)7.18(m,j=7.83hz,2h)7.58(m,j=7.43hz,2h)7.70(s,1h)8.10(s,1h)。步骤4:化合物134:(e)-4-(4-(4-(1h-1,2,3-三唑-1-基)丁基)苄基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑在80℃将前述三唑(1.0eq.)、碳酸钠(1.0eq.)、(ph3)p)4pd(0.05eq,)和(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑的脱气混合物加热过夜。混合物用nh4cl溶液淬灭,用ea稀释。分层,水层用ea萃取。合并的有机层用盐水洗涤,经na2so4干燥,过滤,除去溶剂。在isco上使用柱(hx/ea;5-100%)纯化,得到不纯的化合物。需要使用甲苯-ea(0-70%)进行第二次纯化,得到标题化合物(0.015g,14%)。1hnmr(dmso-d6)δ:1.49(quin,j=7.63hz,2h)1.81(quin,j=7.60hz,2h)2.56(t,j=7.63hz,2h)3.82(s,2h)4.39(t,j=7.04hz,2h)7.10(d,j=8.22hz,2h)7.18(d,j=7.83hz,2h)7.33(d,j=16.43hz,1h)7.51(d,j=16.43hz,1h)7.62(d,j=8.22hz,1h)7.70(s,1h)7.76(d,j=9.78hz,1h)7.92(s,1h)8.07-8.19(m,2h)。lrms+h+=471.1。化合物135:(e)-4-((4-(4-(4h-1,2,4-三唑-4-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑和化合物136:(e)-n-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)甲酰胺步骤1:(e)-4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-胺向在thf(0.29ml)中的(e)-4-((4-(4-叠氮基丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑(0.200g,0.43mmol)加入ph3p(0.171g,0.65mmol)和水(0.012ml,0.65mmol)。将混合物搅拌18h,除去溶剂。在isco上使用柱(dcm-meoh-nh4oh;77.5-22-2.5%;0-70%)纯化,得到0.168g胺产物。步骤2:(e)-n-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)甲酰胺将在meoh(0.12ml)中的原甲酸三乙酯(0.055ml,0.33mmol)和甲酰肼(0.013g,0.22mmol)加热至70℃持续2.5h。然后加入前述胺(0.080g,0.184mmol),将混合物加热过夜。将其吸附在sio2上,在isco上使用柱(hex/etoac;0-100%)、随后在ea中的meoh(7%)纯化,得到12mg化合物135;1hnmr(400mhz,dmso-d6)δppm1.32-1.45(m,2h)1.47-1.58(m,2h)3.09(q,j=6.65hz,2h)5.00(s,2h)6.91-6.98(m,2h)7.12(m,j=8.61hz,2h)7.39(d,j=16.43hz,1h)7.59(d,j=16.82hz,1h)7.65(d,j=8.22hz,1h)7.78(d,j=9.78hz,1h)7.93-8.05(m,2h)8.16(t,j=7.83hz,1h)8.27(s,1h)和54mg化合物136(e)-n-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)甲酰胺1hnmr(400mhz,dmso-d6)δppm1.32-1.45(m,2h)1.47-1.58(m,2h)3.09(q,j=6.65hz,2h)5.00(s,2h)6.91-6.98(m,2h)7.12(d,j=8.61hz,2h)7.39(d,j=16.43hz,1h)7.59(d,j=16.82hz,1h)7.65(d,j=8.22hz,1h)7.78(d,j=9.78hz,1h)7.93-8.05(m,2h)8.16(t,j=7.83hz,1h)8.27(s,1h)。化合物137:(e)-4-(4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁基)硫吗啉1,1-二氧化物将在甲苯(2.5ml)中的(乙烯砜基)乙烯(5.7μl,0.058mmol)分批加入到(e)-4-(4-((2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑-4-基)甲氧基)苯基)丁烷-1-胺(0.025g,0.058mmol)在异丙醇(5.7ml)中的80℃溶液中。加热5h后,除去溶剂,将粗制品在isco上使用柱hex/etoac;0-100%)纯化,得到22mg的标题化合物。1hnmr(400mhz,dmso-d6)δppm1.33-1.46(m,2h)1.48-1.59(m,2h)2.45(t,j=7.24hz,2h)2.51-2.56(m,2h)2.83(br.s.,4h)3.04(d,j=5.09hz,4h)5.00(s,2h)6.94(d,j=8.61hz,2h)7.12(d,j=8.61hz,2h)7.39(d,j=16.43hz,1h)7.59(d,j=16.43hz,1h)7.66(s,1h)8.16(t,j=7.83hz,1h)8.27(s,1h)。化合物138:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(哒嗪-3-基)丁基)苯氧基)甲基)噁唑步骤1:3-(4-(4-(苄氧基)苯基)丁-1-炔-1-基)哒嗪在85℃将1-(苄氧基)-4-(丁-3-炔-1-基)苯(0.250g;1.06mmol)、3-溴哒嗪(0.185g;1.16mmol)、碘化铜(0.008g;0.042mmol)和pdcl2(ph3p)2(0.030g,0.042mmol)在三乙胺(5.3ml)中的脱气混合物加热过夜。然后将其用水-ea稀释,分离有机相。水相用ea萃取两次,然后合并,干燥,除去溶剂。在isco上使用柱hex/etoac;0-100%)纯化,得到163mg的标题化合物。1hnmr(400mhz,dmso-d6)δppm2.72-2.79(m,2h)2.80-2.87(m,2h)5.05(s,2h)6.84-6.98(m,2h)7.23(d,j=8.61hz,2h)7.31(s,1h)7.36(t,j=7.24hz,2h)7.39-7.44(m,2h)7.58-7.71(m,2h)9.14(dd,j=4.11,2.54hz,1h)。步骤2:3-(4-(4-(苄氧基)苯基)丁基)哒嗪将前述炔烃根据化合物99的步骤2在meoh中氢化。lrms+h+:319.1。步骤3:4-(4-(哒嗪-3-基)丁基)苯酚根据化合物107的步骤4进行脱苄基。1hnmr(400mhz,cdcl3)δppm1.62-1.72(m,2h)1.83(quin,j=7.63hz,2h)2.58(t,j=7.63hz,2h)3.05(t,j=7.43hz,2h)5.41(br.s.,1h)6.65-6.77(m,2h)7.01(d,j=8.61hz,2h)7.18(d,j=3.13hz,1h)7.67(d,j=3.52hz,1h)。步骤4:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(哒嗪-3-基)丁基)苯氧基)甲基)噁唑将该化合物由前述苯酚根据化合物88的步骤3制备。1hnmr(400mhz,dmso-d6)δppm1.56(quin,j=7.34hz,2h)1.69(quin,j=7.40hz,2h)2.54(t,j=7.43hz,2h)2.90(t,j=7.63hz,2h)4.97(s,2h)6.92(d,j=8.61hz,2h)7.09(d,j=8.61hz,2h)7.37(d,j=16.60hz,1h)7.51-7.65(m,4h)7.76(d,j=10.17hz,1h)8.14(t,j=7.63hz,1h)8.24(s,1h)9.04(dd,j=4.70,1.96hz,1h)。化合物139:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(嘧啶-2-基)丁基)苯氧基)甲基)噁唑步骤1:2-(4-(4-(苄氧基)苯基)丁-1-炔-1-基)嘧啶将该化合物以与化合物108的步骤1类似的方式用2-碘嘧啶制备。lrms+h+:315.1。步骤2:4-(4-(嘧啶-2-基)丁基)苯酚将该化合物制备通过在pd/c下在meoh-ea中在1大气压在甲醇中氢化。lrms+h+:229.1。步骤3:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(嘧啶-2-基)丁基)苯氧基)甲基)噁唑将该化合物用前述苯酚和(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑以与化合物26的步骤3类似的方式制备。1hnmr(400mhz,dmso-d6)δppm1.55(quin,j=7.50hz,2h)1.72(quin,j=7.53hz,2h)2.53(t,j=7.63hz,2h)2.85(t,j=7.43hz,2h)4.97(s,2h)6.92(d,j=8.61hz,2h)7.08(d,j=8.61hz,2h)7.29(t,j=4.89hz,1h)7.37(d,j=16.43hz,1h)7.57(d,j=16.43hz,1h)7.62(d,j=8.22hz,1h)7.76(d,j=10.56hz,1h)8.14(t,j=7.83hz,1h)8.24(s,1h)8.68(d,j=4.70hz,2h)。lrms+h+=498.0。化合物140:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-4-((4-(4-(吡啶-2-基)丁基)苯氧基)甲基)噁唑将该化合物以与化合物138类似的方式以2-溴吡啶开始制备。1hnmr(400mhz,dmso-d6)δ1.47-1.59(m,2h)1.59-1.70(m,2h)2.52(t,j=7.40hz,2h)2.71(t,j=7.43hz,2h)4.97(s,2h)6.91(d,j=8.22hz,2h)7.08(d,j=8.22hz,2h)7.15(dd,j=6.65,5.09hz,1h)7.20(d,j=7.83hz,1h)7.37(d,j=16.43hz,1h)7.57(d,j=16.43hz,1h)7.60-7.68(m,2h)7.77(d,j=10.17hz,1h)8.14(t,j=7.83hz,1h)8.24(s,1h)8.43(d,j=4.70hz,1h)。lrms+h+=497.0。化合物141:(e)-4-(2-(4-((4-((3-(1h-1,2,3-三唑-1-基)丙基)硫基)苯氧基)甲基)噁唑-2-基)乙烯基)-3-氟苄腈将该化合物由(e)-4-(2-(4-(氯甲基)噁唑-2-基)乙烯基)-3-氟苄腈和4-((3-(1h-1,2,3-三唑-1-基)丙基)硫基)苯酚根据化合物130的步骤3制备。1hnmr(400mhz,dmso-d6)δ8.29(s,1h),8.09-8.17(m,2h),7.95(d,j=10.6hz,1h),7.76(d,j=8.2hz,1h),7.71(s,1h),7.57(d,j=16.4hz,1h),7.43(d,j=16.4hz,1h),7.30-7.36(d,j=8.6hz,2h),6.99-7.06(d,j=8.6hz,2h),5.03(s,2h),4.48(t,j=6.8hz,2h),2.82(t,j=7.0hz,2h),2.03(quin,j=7.0hz,2h)。lrms+h+=462.1。化合物142:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(6-氟苯并呋喃-2-基)噁唑步骤1:6-氟苯并呋喃-2-甲酰胺将该化合物由6-氟苯并呋喃-2-甲酸乙酯的水解(koh)根据用于制备化合物3的步骤1的步骤制备。1hnmr(400mhz,dmso-d6)δ8.10(br.s.,1h),7.80(dd,j=8.8,5.7hz,1h),7.67(br.s.,1h),7.58(dd,j=9.4,2.0hz,1h),7.55(d,j=0.8hz,1h),7.23(ddd,j=9.8,8.8,2.2hz,1h)。步骤2:4-(氯甲基)-2-(6-氟苯并呋喃-2-基)噁唑将该化合物由前述中间体以与化合物58的步骤3类似的方式制备。1hnmr(400mhz,dmso-d6)δ8.37(s,1h),7.81(dd,j=8.8,5.7hz,1h),7.72(dd,j=9.4,2.0hz,1h),7.69(s,1h),7.22-7.31(m,1h),4.77(s,2h)。步骤3:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(6-氟苯并呋喃-2-基)噁唑将该化合物以与化合物113的步骤3类似的方式用前述中间体和4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚制备。1hnmr(400mhz,dmso-d6)δ8.39(s,1h),8.11(s,1h),7.80(dd,j=8.6,5.5hz,1h),7.65-7.75(m,3h),7.26(td,j=9.3,2.2hz,1h),7.07-7.13(d,j=8.2hz,2h),6.93-6.99(d,j=8.6hz,2h),5.04(s,2h),4.39(t,j=7.0hz,2h),2.52-2.58(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。化合物143:4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(6-氟苯并[b]噻吩-2-基)噁唑将该化合物以与化合物140类似的方式以6-氟苯并[b]噻吩-2-甲酸乙酯开始制备。1hnmr(400mhz,dmso-d6)δ8.34(s,1h),8.10(d,j=7.0hz,2h),7.97-8.05(m,2h),7.70(s,1h),7.36(td,j=9.1,2.2hz,1h),7.07-7.14(d,j=8.6hz,2h),6.93-7.00(d,j=8.6hz,2h),5.02(s,2h),4.39(t,j=6.8hz,2h),2.52-2.57(m,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。lrms+h+=449.1。化合物144:4-((4-((3-(1h-1,2,3-三唑-1-基)丙基)硫基)苯氧基)甲基)-2-(4,6-二氟-1h-吲哚-2-基)噁唑将该化合物以与化合物128类似的方式用4-(氯甲基)-2-(4,6-二氟-1h-吲哚-2-基)噁唑和4-((3-(1h-1,2,3-三唑-1-基)丙基)硫基)苯酚制备。1hnmr(400mhz,dmso-d6)δ12.56(br.s.,1h),8.35(s,1h),8.11(s,1h),7.71(s,1h),7.34(d,j=8.6hz,2h),7.12(s,1h),7.04(d,j=8.6hz,3h),6.93(td,j=10.4,2.0hz,1h),5.08(s,2h),4.48(t,j=7.0hz,2h),2.82(t,j=7.2hz,2h),2.04(quin,j=7.0hz,2h)。lrms+h+=468.1。化合物145:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)-5-甲基噁唑步骤1:(e)-2-(3-(2-氟-4-(三氟甲基)苯基)丙烯酰胺基)-3-氧代丁酸乙酯在0℃将三乙胺(1.34ml,9.2mmol)加入到(e)-3-(2-氟-4-(三氟甲基)苯基)丙烯酰氯(1.08g,4.28mmol)和2-氨基-3-氧代丁酸乙酯盐酸盐(0.971g,5.34mmol)在二氯甲烷(25.03ml,389mmol)中的溶液中。30分钟后,将混合物倒入水(15ml)中,剧烈搅拌。分层,有机层经mgso4干燥,过滤,并且浓缩。残留物在isco上使用redisep80g柱(hex/etoac;0-100%)纯化,取得标题产物(145mg)。lrms+h+=362.1。步骤2:(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-5-甲基噁唑-4-甲酸乙酯将在三氯氧磷(2.00ml,21.47mmol)中的(e)-2-(3-(2-氟-4-(三氟甲基)苯基)丙烯酰胺基)-3-氧代丁酸乙酯(0.145g,0.40mmol)加热至105℃持续2h。将混合物浓缩,用饱和nahco3(10ml)中和,用ch2cl2(10ml)萃取。水层用ch2cl2(5ml)萃取,合并的有机层用水(5ml)洗涤。有机层经mgso4干燥,过滤,并且浓缩。得到深橙色油。残留物在isco上使用redisep24g柱(hex/etoac;0-60%)纯化,得到80mg的标题化合物。1hnmr(dmso-d6)δ:8.15(t,j=7.8hz,1h),7.79(d,j=11.0hz,1h),7.65(d,j=8.6hz,1h),7.57(d,j=16.4hz,1h),7.37(d,j=16.8hz,1h),4.29(q,j=7.2hz,2h),2.65(s,3h),1.31(t,j=7.0hz,3h)。步骤3:(e)-(2-(2-氟-4-(三氟甲基)苯乙烯基)-5-甲基噁唑-4-基)甲醇向在0℃的在et2o(1.50ml,14.43mmol)中的lialh4(0.011g,0.303mmol)加入(e)-2-(2-氟-4-(三氟甲基)苯乙烯基)-5-甲基噁唑-4-甲酸乙酯(0.080g,0.233mmol)在thf(0.50ml,6.11mmol)和et2o(1.000ml,9.62mmol)中的溶液。30分钟后,将其温热至20℃,搅拌15分钟。加入一些mgso4,将混合物过滤。将滤液浓缩至干,取得标题化合物(53mg,75%收率)。lrms+h+=302.1。步骤4:(e)-4-(氯甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)-5-甲基噁唑在0℃将亚硫酰氯(0.064ml,0.88mmol)逐滴加入到(e)-(2-(2-氟-4-(三氟甲基)苯乙烯基)-5-甲基噁唑-4-基)甲醇(0.053g,0.176mmol)在二氯甲烷(2.50ml,38.8mmol)中的溶液中。15分钟后,将其然后温热至20℃持续45分钟。除去溶剂后,残留物在isco上使用redisep12g柱(hex/etoac;0-30%)纯化,取得标题化合物(37mg,65.8%收率)。1hnmr(dmso-d6)δ:8.14(t,j=7.6hz,1h),7.77(d,j=11.0hz,1h),7.64(d,j=8.2hz,1h),7.51(d,j=16.8hz,1h),7.32(d,j=16.4hz,1h),4.73(s,2h),2.43(s,3h)。步骤5:(e)-4-((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)-5-甲基噁唑将该化合物以与化合物88的步骤3类似的方式用前述氯化物制备。1hnmr(dmso-d6)δ:8.14(t,j=8.0hz,1h),8.08-8.12(m,1h),7.77(d,j=10.2hz,1h),7.70(s,1h),7.63(d,j=7.8hz,1h),7.50(d,j=16.4hz,1h),7.33(d,j=16.4hz,1h),7.06-7.13(d,j=8.6hz,2h),6.89-6.96(d,j=8.6hz,2h),4.94(s,2h),4.39(t,j=7.0hz,2h),2.52-2.57(m,2h),2.42(s,3h),1.81(quin,j=7.2hz,2h),1.48(quin,j=7.6hz,2h)。lrms+h+=501.2。化合物146:(e)-4-(((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯基)硫基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:二甲基硫代氨基甲酸o-(4-(4-(1h-1,2,3-三唑-1-基)丁基)苯基)酯将该化合物以与化合物132的步骤1类似的方式用4-(4-(1h-1,2,3-三唑-1-基)丁基)苯酚制备。1hnmr(dmso-d6)δ:8.12(s,1h),7.68-7.73(m,1h),7.13-7.21(m,2h),6.91-6.97(m,2h),4.41(t,j=7.0hz,2h),3.35(s,3h),3.29(s,3h),2.60(t,j=7.8hz,2h),1.83(quin,j=7.3hz,2h),1.47-1.58(m,2h)。步骤2:二甲基硫代氨基甲酸s-(4-(4-(1h-1,2,3-三唑-1-基)丁基)苯基)酯将该化合物以与化合物132的步骤2类似的方式由前述中间体制备。1hnmr(dmso-d6)δ:8.09-8.13(m,1h),7.70(d,j=0.8hz,1h),7.29-7.35(d,2h),7.18-7.24(d,j=8.2hz,2h),4.40(t,j=7.0hz,2h),2.85-3.09(m,6h),2.62(t,j=7.6hz,2h),1.83(quin,j=7.3hz,2h),1.45-1.58(m,2h)。步骤3:4-(4-(1h-1,2,3-三唑-1-基)丁基)苯硫醇将该化合物以与化合物132的步骤3类似的方式由前述中间体制备。1hnmr(dmso-d6)δ:8.10(s,1h),7.70(s,1h),7.14-7.22(d,j=7.8hz,2h),7.00-7.09(d,j=8.2hz,2h),5.23(s,1h),4.38(t,j=7.0hz,2h),2.52-2.56(m,2h),1.79(quin,j=7.3hz,2h),1.47(quin,j=7.6hz,2h)。步骤4:(e)-4-(((4-(4-(1h-1,2,3-三唑-1-基)丁基)苯基)硫基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物132的步骤4类似的方式由前述中间体制备。1hnmr(dmso-d6)δ:8.14(t,j=7.8hz,1h),8.10(s,1h),7.96(s,1h),7.77(d,j=11.0hz,1h),7.70(s,1h),7.64(d,j=8.2hz,1h),7.53(d,j=16.8hz,1h),7.34(d,j=16.8hz,1h),7.25-7.31(d,j=8.2hz,2h),7.08-7.16(d,j=8.2hz,2h),4.39(t,j=7.0hz,2h),4.11(s,2h),2.56(t,j=7.6hz,2h),1.81(quin,j=7.3hz,2h),1.48(quin,j=7.6hz,2h)。lrms+h+=503.2。化合物147:(e)-4-((4-((2-(1h-1,2,3-三唑-1-基)乙基)硫基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑步骤1:(2-叠氮基乙基)(4-甲氧基苯基)硫烷将2-((4-甲氧基苯基)硫基)乙醇如所述用甲磺酰氯和三乙胺在二氯甲烷中处理,取得粗制甲磺酸酯,将其进而在70℃以与化合物109的步骤2类似的方式转化为相应叠氮化物。将粗制品用于下一步骤。1hnmr(400mhz,dmso-d6)δppm3.04(t,j=6.46hz,2h)3.40(t,j=6.65hz,2h)3.73(s,3h)6.84-6.96(m,2h)7.25-7.41(m,2h)。步骤2:1-(2-((4-甲氧基苯基)硫基)乙基)-1h-1,2,3-三唑将该化合物以与化合物1的步骤3类似的方式制备。粗制品用于下一步骤。1hnmr(400mhz,dmso-d6)δppm3.32(t,j=7.00hz,1h)3.74(s,3h)4.47(t,j=6.85hz,1h)6.80-6.97(m,2h)7.29-7.41(m,2h)7.69(d,j=1.17hz,1h)8.12(d,j=0.78hz,1h)。步骤3:4-((2-(1h-1,2,3-三唑-1-基)乙基)硫基)苯酚将该化合物以与化合物15的步骤2类似的方式制备。粗制品用于下一步骤。lrms-h+=220.0。步骤4:(e)-4-((4-((2-(1h-1,2,3-三唑-1-基)乙基)硫基)苯氧基)甲基)-2-(2-氟-4-(三氟甲基)苯乙烯基)噁唑将该化合物以与化合物32的步骤2类似的方式制备。1hnmr(400mhz,dmso-d6)δppm3.34(t,j=6.85hz,2h)4.49(t,j=6.85hz,2h)5.03(s,2h)6.96-7.07(m,2h)7.33-7.44(m,3h)7.58(d,j=16.43hz,1h)7.63(d,j=7.83hz,1h)7.69(d,j=1.17hz,1h)7.76(d,j=9.78hz,1h)8.10-8.18(m,2h)8.28(s,1h)。实施例7:实施例6的杂环化合物的生物活性使用类似于在实施例1中关于mutritinib描述的方法,测试了实施例6化合物抑制oci-aml3细胞生长的效力。简而言之,将购自德国细胞库的oci-aml3细胞(dsmz,登录号acc582)保存在α-mem,20%fbs中。小鼠mll-af9白血病细胞(雌性细胞)通过感染vsv-g-假型mscvmll-af9irespuro(从构建体通过frédéricbarabé,lavalu,québec,qc,canada亚克隆)而产生。将oci-aml3细胞在384孔板中以每个孔在50μl中150个细胞的密度进行接种,并且将mll-af9细胞以每个孔90个细胞的密度进行接种。向接种的细胞中加入以10μm至0.5nm的连续稀释的化合物,一式两份或一式四份。细胞用0.1%dmso处理而无另外化合物用作阴性对照。使用分析根据制造商的说明,在培养oci-aml3细胞6天和培养mll-af9细胞5天后,评估每个孔的活细胞计数。抑制百分比计算如下:100-(100×(平均发光(化合物)/平均发光(dmso));其中平均发光(化合物)对应于化合物处理的细胞获得的发光信号的平均值,和平均发光(dmso)对应于对照dmso处理的细胞获得的发光信号的平均值。ec50值(对应于达到50%抑制作用所需的化合物浓度)使用sarviewsuite(idbs,london,uk)和prism4.03(lajolla,ca,usa)通过四参数非线性曲线拟合方法来计算。结果汇总于下表4中。表4:测试杂环化合物诱导oci-aml3和mll-af9细胞死亡的效力活性表示如下:对于ec50>10μm,使用符号“-”;对于1μm<ec50≤10μm,使用符号“+”;对于0.5μm<ec50≤1μm,使用符号“++”;对于0.1μm<ec50≤0.5μm,使用符号“+++”;对于0.05μm<ec50≤0.1μm,使用符号“++++”;对于ec50≤0.05μm,使用符号“+++++”;nt表示未测出。在不脱离本发明的范围的情况下,可以对上述实施方案中的任一个进行许多修改。出于所有目的,本申请文件中引用的任何参考文献、专利或科学文献文件都通过引用其整体内容并入本申请。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1