与特异性促炎症消退介质的盐有关的组合物和方法与流程
发明领域
本发明涉及为脂质分子的盐形式的新化学实体及其用途。
发明背景
动物组织中的炎症反应具有两个阶段,起始和消退。在细胞水平,起始的特征在于水肿和免疫细胞(如嗜中性粒细胞、单核细胞和巨噬细胞)的积累。炎症反应的起始阶段长期以来被认识到是由花生四烯酸的代谢物(例如作为嗜酸性细胞、嗜中性粒细胞和单核细胞的化学引诱剂的前列腺素pge2和pgd2)以及白三烯(特别是引起白细胞的粘附、趋化性和聚集的ltb4)驱动的主动过程。为了使发炎的组织恢复到健康状态,必须清除过量的炎症细胞、细胞碎片和宿主防御的其他残余物以及任何入侵的微生物。多年来,炎症反应的这种“消退”阶段被认为是被动过程,是起始阶段的化学引诱剂稀释的结果。今天,炎症的消退被认识到是由各种分子驱动的主动过程。例如,保护素和消退素是在炎症部位局部产生的内分泌物。它们通过募集非炎症单核细胞来帮助炎症消退,所述非炎症单核细胞分化成可以除去过量嗜中性粒细胞和细胞碎片的巨噬细胞。这些分子是炎症的“特异性促炎症消退介质”(specializedpro-resolvingmediators,“spm”)类别的一部分。其他spm包括脂氧素、阿司匹林触发的消退素和阿司匹林触发的保护素。参见serhan等人,“lipidmediatorsofinflammation”,coldspringharbperspectbiol2015;7:a016311。
过度炎症被广泛认为是许多慢性疾病(包括血管疾病、代谢疾病和神经病学疾病)的统一组分部分。参见例如serhan,c.n.,nature2014510:92-101。因此,消退过度炎症的能力对于人和动物健康是重要的。
研究人员已经在多种疾病模型中建立各种spm的作用,包括与阿尔茨海默病、烧伤伤口、慢性胰腺炎、糖尿病伤口、皮炎、肺部炎症、周围神经损伤、肥胖、过敏性气道反应、肌萎缩侧索硬化、急性肺损伤、纤维化、细菌感染、腹膜炎、干眼、组织再生、疼痛、脂肪组织炎症、局部侵袭性牙周炎、结肠炎、颞下颌关节炎、关节炎、术后疼痛、术后认知下降、内毒素休克、hsv-角膜炎、同种异体移植物排斥、心脏缺血、细菌性肺炎、香烟烟雾引起的肺部炎症、血管炎症、纤维肌痛和迷走神经切断术有关的那些疾病模型。参见例如serhan等人,“lipidmediatorsofinflammation”,coldspringharbperspectbiol2015;7:a016311。美国专利号8,008,282和6,627,658描述脂氧素类似物及其作为血管生成抑制剂的用途。美国专利号5,441,951、5,648,512、6,048,897、6,316,648、6,569,075、6,887,901、7,288,569和7,294,728、7,741,369和7,741,369描述脂氧素化合物及其在治疗细胞增殖性障碍中的用途。美国专利号8,119,691描述治疗哮喘和炎症性气道疾病中的脂氧素和阿司匹林触发的脂氧素及其类似物。
us20060293288描述消退素治疗胃肠道炎症和疾病(例如溃疡性结肠炎、克罗恩病、感染性肠炎、抗生素联合性腹泻、艰难梭菌结肠炎、显微镜下或淋巴细胞性结肠炎、胶原性结肠炎、结肠息肉、家族性息肉、家族性息肉综合征、加德纳综合征、幽门螺杆菌、肠易激综合征、非特异性腹泻病和肠癌)的用途。
美国专利号6,670,396、7,053,230、7,709,669、7,737,178和8,349,896描述阿司匹林触发的脂质介质及其在治疗炎症的方法中的用途,例如其中炎症表现为克罗恩病、溃疡性结肠炎、远端直肠炎、类风湿性脊椎炎、关节炎、类风湿性关节炎、骨关节炎、痛风性关节炎、牛皮癣、皮炎、湿疹性皮炎、特应性或脂溢性皮炎、过敏性或刺激性接触性皮炎、干裂性湿疹(eczemacraquelee)、光过敏性皮炎、光毒性皮炎、植物光化性皮炎、放射性皮炎、淤滞性皮炎、动脉炎、冠状动脉梗塞损伤、再狭窄、葡萄膜炎、虹膜炎、结膜炎、成人呼吸窘迫综合征、支气管炎、囊性纤维化、致痉性病症、哮喘、特发性支气管哮喘、动脉平滑肌收缩、冠状动脉痉挛、心肌梗死、缺血性心肌损伤、脑痉挛、中风、炎症肠道疾病、痉挛性结肠、粘液性结肠炎、过敏性病症、湿疹、过敏性肠病、乳糜泻、过敏性眼病、枯草热、过敏性鼻炎、过敏性结膜炎,涉及血小板聚集、冠状动脉血栓形成、静脉炎或静脉血栓形成的病症,以及治疗心血管疾病的方法。
us20120245229描述通过施用消退素来治疗神经性疼痛(包括与糖尿病性神经病或hiv感染相关的疼痛)的方法,治疗术后疼痛、炎症性疼痛、与癌症相关的疼痛和与纤维肌痛相关的疼痛的方法。
lim等人描述spm在大量炎症性疼痛模型中的镇痛效力,并将消退素和相关物质表征为用于预防炎症和病理性疼痛恶化的治疗候选物。参见lim等人“biologicalrolesofresolvinsandrelatedsubstancesintheresolutionofpain”biomedresearchinternational2015,pp.1-14,articleid830930。lin还指出,这些分子的“强大效力”和“可忽略的不良作用”使它们成为临床使用的有吸引力的候选试剂。
us20150126602描述具有抗炎活性的油,其含有天然的特异性促炎症消退介质及其前体,例如18hepe和17hdha,以及使用它们治疗炎症性病症如心血管疾病(包括动脉粥样硬化、高血压、高胆固醇血症、高甘油三酯血症、内皮低反应性、心肌梗塞和脑卒中)、代谢综合征(例如,以胰岛素敏感性丧失、肥胖、肝脂肪变性和/或胆汁淤积为特征)、神经退行性疾病(例如阿尔茨海默病、帕金森病、多发性硬化症和失用症)、特应性/过敏反应、骨关节炎、类风湿性关节炎、炎症性疼痛、痤疮、牛皮癣、红斑痤疮、哮喘、急性肺损伤、慢性阻塞性肺病、囊性纤维化、败血症、过敏性鼻炎、窦炎、牙周炎、炎症性肠病、克罗恩病、黄斑变性、干眼综合征、胃溃疡、癌症和自身炎症性障碍的方法。
us7,378,444和us7,595,341描述衍生自ω-3脂肪酸的脂质介质的类似物和用于治疗炎症、血管增生性、心血管性、血栓性静脉性(thrombophlebotic)、血管性、眼部、皮肤病、神经变性、肺部、内分泌、生殖、风湿病和胃肠疾病的方法。
需要开发能够以治疗有效量向靶组织递送spm和炎症的其他脂质介质(包括其类似物和衍生物)的组合物,以实现这些化合物的治疗前景,并将许多有希望的体外和细胞药理学观察结果转化成临床益处。本发明致力于这些需求。
发明概述
本发明提供新的盐形式的特异性促炎症消退介质(在本文中称为“spm”),其包括脂氧素、消退素、保护素和它们的阿司匹林触发的对应物(counterpart)。本文所述的spm盐含有至少一个或两个spm分子,其离子性结合到由式i-iv中所述的骨架提供的至少一个碱性官能团(basicfunction)。例如,在式i和iii的化合物中,骨架是基于肽的;在式iv的化合物中,骨架是二价金属-氨基酸螯合物或二价金属-肽螯合物;且在式ii的化合物中,骨架是二肽或一价金属或非金属二肽。
形成本文所述的盐的阴离子抗衡离子组分的所述至少一个或两个spm分子可称为本文所述的化合物和组合物的“spm组分”。在实施方案中,spm组分包含e系列消退素或由其组成。在实施方案中,e系列消退素选自消退素e1(rve1)、消退素e2(rve2)、消退素e3(rve3)和这些消退素的阿斯匹林触发(at)的对应物at-rve1、at-rve2和at-rve3。在实施方案中,spm组分包含选自消退素d1(rvd1)、消退素d2(rvd2)、消退素e1(rve1)、保护素dx(pdx)和脂氧素a4(lxa4)的spm或由其组成。在实施方案中,spm组分包含选自阿司匹林触发的(at)消退素、脂氧素或保护素的spm或由其组成。在实施方案中,at消退素、脂氧素或保护素选自at-rvd1、at-rvd2、at-pd1、at-lxa4和at-rve1。在实施方案中,spm组分选自rve1、lxa4、at-lxa4和at-rve1。在实施方案中,spm组分由rve1或lxa4组成。这些spm化合物的化学名称和式在下表1-4中提供,供参考。
在表5中显示式i、iii和iv的一些化合物的结构的具体非限制性实例。
在实施方案中,与spm的游离酸形式相比,本文所述的spm盐对化学降解是稳定的。在实施方案中,与spm的游离酸形式相比,本文描述的spm盐具有改善的生物利用度。
本文描述的化合物可以彼此和与其他生物活性剂容易地组合(例如通过物理混合)以产生固体剂型,或溶解在水性介质中以产生液体剂型。因此,本文所述的化合物除了用于配制成固体剂型(例如口服或直肠剂型)的适用性外,它们适合于配制成水性液体,例如用于胃肠外施用形式,包括经由静脉内和肌肉内注射。以下更详细地描述这些和其他优点。
在实施方案中,本文所述的化合物和组合物可用于治疗以过度炎症为特征的疾病或障碍。
在实施方案中,所述疾病或障碍是选自溃疡性结肠炎、克罗恩病、直肠炎、结肠袋炎、结肠袋克罗恩病、嗜酸细胞性结肠炎、淋巴细胞性结肠炎、胶原性结肠炎、转移性结肠炎、化学性结肠炎和缺血性结肠炎的炎症性肠病(ibd)相关的疾病或障碍。在实施方案中,ibd相关的疾病或障碍是溃疡性结肠炎或克罗恩病。在实施方案中,ibd相关的疾病或障碍是结肠袋炎。
在实施方案中,所述疾病或障碍是选自嗜酸细胞性食管炎、白塞氏病、肠易激综合征、乳糜泻、肠粘膜炎、憩室炎和短肠综合征的胃肠疾病或障碍。在实施方案中,胃肠疾病或障碍是肠粘膜炎。
在实施方案中,所述疾病或障碍是选自皮炎、糖尿病伤口、湿疹、瘙痒、愈合伤口、痤疮和类固醇诱导的红斑痤疮的皮肤病学疾病或障碍。在实施方案中,皮肤病学疾病或障碍选自皮炎、湿疹、瘙痒、痤疮和类固醇诱导的红斑痤疮。
在实施方案中,所述疾病或障碍是选自哮喘、缺血再灌注损伤、莱姆关节炎、牙周炎、腹膜炎、牛皮癣、类风湿性关节炎、硬皮病、口腔粘膜炎、口腔炎、唇炎、舌炎、干燥综合征和全身性炎症反应综合征的炎症性疾病或障碍。在实施方案中,炎症性疾病或障碍选自哮喘、牛皮癣、硬皮病和口腔粘膜炎。
在实施方案中,所述疾病或障碍是选自术后谵妄、急性术后疼痛、纤维肌痛、子宫内膜异位症、外阴痛、慢性下背痛、骨关节炎相关疼痛的治疗或管理、糖尿病周围神经病和肌肉骨骼损伤或创伤的神经病学疾病或障碍。
在实施方案中,本公开提供了包含双rve1二赖氨酸镁的药物组合物,其还可以简称为rve1-mg-二赖氨酸盐,以及其用于治疗胃肠道,尤其是下胃肠道的炎症性疾病和障碍,尤其是炎症性肠病(ibd)的方法。术语“下胃肠道”是指空肠,回肠,结肠和直肠。在实施方案中,ibd选自溃疡性结肠炎和克罗恩病。本公开进一步提供了适于口服递送的包含双rve1二赖氨酸镁的药物组合物,特别是适于靶向递送至下胃肠道,优选递送至回肠,结肠或直肠,最优选递送至结肠的口服剂型,它们在炎症性肠病(ibd)的治疗中特别有用,并且更特别地在溃疡性结肠炎或克罗恩病的治疗中特别有用。在实施方案中,口服剂型包含适合于靶向释放至下胃肠道,优选释放至回肠和/或结肠的一种或多种特征,包括例如肠溶衣,易蚀和/或可降解基质材料,可胶凝或可溶胀的聚合物,致孔剂和渗透泵机制中的一种或多种。
在一些实施方案中,包含双rve1二赖氨酸镁的药物组合物适合于直肠递送,例如以灌肠剂或栓剂的形式。
靶向下胃肠道(包括空肠,回肠,结肠和/或直肠)的剂型由于以双rve1二赖氨酸镁形式递送的rve1的独特药代动力学而特别有利于治疗如本文所述的下胃肠道的炎症性疾病和障碍。如下文所详述,本公开提供了以双rve1二赖氨酸镁形式口服施用的rve1以治疗相关量直接经肠腔和/或结肠腔吸收到小肠和结肠的靶组织中。此特征与适合于将双rve1二赖氨酸镁靶向递送至下胃肠道的口服剂型相结合,将使靶组织中rve1的局部浓度以及rve1的浓度达到或高于治疗阈值的时间量两者最大化。靶向递送和局部吸收的这种结合还避免了rve1损失至非靶组织,并使全身吸收和脱靶效应最小化。
另外,并且如下文更详细地讨论,本公开还提供了使用双rve1二赖氨酸镁与第二ibd治疗剂,任选地5-氨基水杨酸盐(5-asa)组合治疗,用于治疗ibd的方法和相关组合物。在实施方案中,第二ibd治疗剂可以选自皮质类固醇,5-asa和咪唑硫嘌呤。在实施方案中,本公开提供了双rve1二赖氨酸镁,用于与5-asa,咪唑硫嘌呤和皮质类固醇中的任何一种或多种组合来治疗ibd的方法中。
式i的化合物
在实施方案中,本公开提供式i的化合物或其对映异构体、多晶型物、溶剂化物或水合物:
其中
a和b各自独立地是spm分子;
a和b可以相同或不同;
a或b可以不存在,但不同时不存在,
r1和r2各自独立地是包含至少一个碱性官能团的c1-c10烷基且任选地为支化的;
x是h或co-z,且z是单个氨基酸残基或包含2-18个氨基酸残基的肽;
当a或b不存在时:
r1、r2和co-z中的一个被质子化;或
x是h并带正电荷;和
所述质子化的r1、r2和co-z中的一个或所述带正电荷的h与a或b形成离子键;和
当a和b都存在时:
r1、r2和co-z中的两个被质子化;或
r1、r2和co-z中的一个被质子化,且x是h并带正电荷;和
所述质子化的r1、r2和co-z中的两个或所述质子化的r1、r2和co-z中的一个和所述带正电荷的h各自分别与a和b形成离子键。
式i的化合物包含由至少2个氨基酸部分组成的肽组分,和作为spm组分的一个或两个spm分子(a,b)。在实施方案中,a和b相同或不同,且各自独立地选自e系列消退素。在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,a和b相同,且各自独立地选自lxa4、at-lxa4、pdx、rve1、at-rve1、rvd1、at-rvd1、rvd2和at-rvd2。spm组分在下面更详细地描述。
肽组分的长度可以是2至10或2至20个氨基酸,优选长度为2、3、4或5个氨基酸。当x是h时,肽组分由2个氨基酸残基组成,或当x是co-z时,是3至5、3至10或3至20个氨基酸残基的肽。
在实施方案中,x是h且肽组分由独立地选自赖氨酸、精氨酸和谷氨酰胺的氨基酸的二肽、或前述一种或多种的衍生物组成。在实施方案中,x是h且肽组分由赖氨酸的二肽组成。
在实施方案中,x是h且r1和r2各自独立地选自-(ch2)3–nhc(nh2+)-nh2、-(ch2)4–nh3+和-(ch2)2–c(o)nh3+。在实施方案中,r1和r2相同。在实施方案中,r1和r2不同。
在实施方案中,a和b相同且选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3;r1和r2都是-(ch2)4–y2,y2是nh3+,且x是h。该r1、r2和y2的选择在本文中可称为“赖氨酰赖氨酸”(在本文中可简称为“lys-lys”)二肽。在该实施方案中,肽组分是赖氨酸二肽。
在实施方案中,a和b相同且选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-pd1、at-lxa4和at-rve1;r1和r2都是-(ch2)4–y2,y2是nh3+,且x是h。如上所述,该r1、r2和y2的选择在本文中可称为“赖氨酰赖氨酸”二肽或“lys-lys”二肽。在该实施方案中,肽组分是赖氨酸二肽。
在实施方案中,式i的化合物选自单或双rve1lys-lys。在实施方案中,式i的化合物是双rve1lys-lys。在实施方案中,式i的化合物选自单或双at-rve1lys-lys。在实施方案中,式i的化合物是双at-rve1lys-lys。
在实施方案中,式i的化合物选自单或双rve2lys-lys。在实施方案中,式i的化合物是双rve2lys-lys。在实施方案中,式i的化合物选自单或双at-rve2lys-lys。在实施方案中,式i的化合物是双at-rve2lys-lys。
在实施方案中,式i的化合物选自单或双rve3lys-lys。在实施方案中,式i的化合物是双rve3lys-lys。在实施方案中,式i的化合物选自单或双at-rve3lys-lys。在实施方案中,式i的化合物是双at-rve3lys-lys。
在实施方案中,式i的化合物选自单或双lxa4lys-lys。在实施方案中,式i的化合物是双lxa4lys-lys。在实施方案中,式i的化合物选自单或双at-lxa4lys-lys。在实施方案中,式i的化合物是双at-lxa4lys-lys。
在实施方案中,式i的化合物选自单或双rvd1lys-lys。在实施方案中,式i的化合物选自单或双at-rvd1lys-lys。
在实施方案中,式i的化合物选自单或双rvd2lys-lys。在实施方案中,式i的化合物选自单或双at-rvd2lys-lys。
在实施方案中,式i的化合物选自单或双pdxlys-lys。
在表5中提供式i的赖氨酰赖氨酸实施方案的示例性化合物。在实施方案中,式i的化合物选自表5的化合物4,9,44,49,54和59(e系列)。在实施方案中,式i的化合物选自表5的化合物4,9,14,19,24,29,34和39。在实施方案中,式i的化合物选自表5的化合物4,9,24,29,34和39。在实施方案中,式i的化合物选自表5的化合物4和9。
在实施方案中,式i的化合物或包含其的组合物用于治疗以过度炎症为特征的疾病或障碍的方法。在实施方案中,所述疾病或障碍是选自溃疡性结肠炎、克罗恩病、直肠炎、结肠袋炎、结肠袋克罗恩病、嗜酸细胞性结肠炎、淋巴细胞性结肠炎、胶原性结肠炎、转移性结肠炎、化学性结肠炎和缺血性结肠炎的ibd相关的疾病或障碍。在实施方案中,ibd相关的疾病或障碍是溃疡性结肠炎或克罗恩病。在实施方案中,ibd相关的疾病或障碍是结肠袋炎。
在实施方案中,本公开提供治疗如上所述的ibd相关的疾病或障碍的方法,该方法包括向需要这种治疗的受试者施用式i的化合物。在所述方法的实施方案中,式i的化合物选自单或双rve1lys-lys,单或双at-rve1lys-lys,单或双rve2lys-lys,单或双at-rve2lys-lys,单或双rve3lys-lys,和单或双at-rve3lys-lys。在所述方法的实施方案中,式i的化合物选自单或双rve1lys-lys,单或双at-rve1lys-lys,单或双lxa4lys-lys,和单或双at-lxa4lys-lys。
式ii的化合物
在实施方案中,本公开提供式ii的化合物或其对映异构体、多晶型物、溶剂化物或水合物:
其中r1是h或不存在。x1和x2各自独立地是氨基酸残基的侧链。m是带正电荷的任选分子。b是spm分子。
式ii的化合物至少由(i)二肽组分和(ii)spm组分(b)与带正电荷的任选分子(m)组成。二肽组分含有x1和x2,它们可以相同或不同,且各自是氨基酸残基的侧链。在实施方案中,x1和x2中的至少一个是选自丝氨酸、苏氨酸、甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸和苯丙氨酸的氨基酸残基的侧链。在实施方案中,在x1和x2之一是选自丝氨酸、苏氨酸、甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸和苯丙氨酸的氨基酸残基的侧链的情况下,x1和x2的其余部分是独立地选自赖氨酸、精氨酸、组氨酸、天冬氨酸根(盐/酯)、谷氨酸根(盐/酯)、丝氨酸、苏氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、甘氨酸、脯氨酸、丙氨酸、缬氨酸、异亮氨酸、亮氨酸、蛋氨酸、苯丙氨酸、酪氨酸和色氨酸的氨基酸的侧链。在实施方案中,其余部分是赖氨酸的侧链。在实施方案中,x1和x2中的至少一个是甘氨酸、缬氨酸、丝氨酸、亮氨酸或组氨酸的侧链,且其余部分是赖氨酸的侧链。
带正电荷的任选分子(m)具有至少一个质子化形式的碱性官能团,其与氨基酸组分的末端羧基形成离子键。在实施方案中,m是一价金属阳离子(例如na+,k+),或具有至少一个碱性官能团的分子,例如基于一价胺的阳离子(例如三乙醇胺,或三乙胺),或碱性药物化合物(如二甲双胍或加巴喷丁)。
如下面更详细描述的,式ii的化合物包括二肽和spm的简单盐(式iia),二肽和spm与一价金属的简单金属盐(式iib),以及二肽和spm与具有至少一个碱性官能团的非金属分子的简单非金属盐(式iic)。
在式ii的化合物的实施方案中,b是e系列消退素。在式ii的化合物的实施方案中,b选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。
在式ii的化合物的实施方案中,b选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-lxa4和at-rve1。
在实施方案中,式ii的化合物是甘氨酸二肽,其中r1是h,x1和x2各自是h,m不存在且b选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。
在实施方案中,式ii的化合物是甘氨酸二肽,其中r1是h,x1和x2各自是h,m不存在且b选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-lxa4和at-rve1。
在实施方案中,本公开提供用于治疗选自如上所述的ibd相关的疾病或障碍的疾病或障碍的方法,该方法包括向需要这种治疗的受试者施用式ii的化合物。
式iii的化合物
在实施方案中,本公开提供式iii的化合物或其对映异构体、多晶型物、溶剂化物或水合物:
其中
r2是包含至少一个碱性官能团的c1-c10烷基;
a和b各自独立地是spm分子;
a和b可以相同或不同;和
a或b可以不存在,但不同时不存在。
在实施方案中,r2是选自赖氨酸、精氨酸和谷氨酰胺的氨基酸残基的侧链。在实施方案中,r2选自(ch2)3–nhc(nh2+)nh2、-(ch2)4–nh3+和-(ch2)2–c(o)nh3+。在实施方案中,r2是-(ch2)4–nh3+。
在式iii的化合物的实施方案中,a和b相同或不同且各自独立选自e系列消退素,且r2是-(ch2)4–nh3+。在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。这种r2的选择在本文中可称为“线性赖氨酰赖氨酸”(线性lys-lys)二肽。在该实施方案中,肽组分是赖氨酸二肽。在实施方案中,a和b相同。
在式iii的化合物的实施方案中,a和b相同且选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-pd1、at-lxa4和at-rve1,且r2是-(ch2)4–nh3+。这种r2的选择在本文中可称为“线性赖氨酰赖氨酸”(线性“lys-lys”)二肽。在该实施方案中,肽组分是赖氨酸二肽。
在实施方案中,式iii的化合物选自单或双rve1线性lys-lys。在实施方案中,式iii的化合物是双rve1线性lys-lys。在实施方案中,式iii的化合物选自单或双at-rve1线性lys-lys。在实施方案中,式iii的化合物是双at-rve1线性lys-lys。
在实施方案中,式iii的化合物选自单或双rve2线性lys-lys。在实施方案中,式iii的化合物是双rve2线性lys-lys。在实施方案中,式iii的化合物选自单或双at-rve2线性lys-lys。在实施方案中,式iii的化合物是双at-rve2线性lys-lys。
在实施方案中,式iii的化合物选自单或双rve3线性lys-lys。在实施方案中,式iii的化合物是双rve3线性lys-lys。在实施方案中,式iii的化合物选自单或双at-rve3线性lys-lys。在实施方案中,式iii的化合物是双at-rve3线性lys-lys。
在实施方案中,式iii的化合物选自单或双lxa4线性lys-lys。在实施方案中,式iii的化合物是双lxa4线性lys-lys。在实施方案中,式iii的化合物选自单或双at-lxa4lys-lys。在实施方案中,式iii的化合物是双at-lxa4线性lys-lys。
在实施方案中,式iii的化合物选自单或双rvd1线性lys-lys。在实施方案中,式iii的化合物选自单或双at-rvd1线性lys-lys。
在实施方案中,式iii的化合物选自单或双rvd2线性lys-lys。在实施方案中,式iii的化合物选自单或双at-rvd2线性lys-lys。
在实施方案中,式iii的化合物选自单或双pdx线性lys-lys。
在表5中提供示例性的式iii的化合物。在实施方案中,式iii的化合物选自表5的化合物5,10,45,50,55和60(e系列)。在实施方案中,式iii的化合物选自表5的化合物5、10、15、20、25、30、35和40。在实施方案中,式iii的化合物选自表5的化合物5和10(rve1和at-rve1实施方案)。在实施方案中,式iii的化合物选自表5的化合物15和20(lxa4和at-lxa4实施方案)。
在实施方案中,式iii的化合物或包含其的组合物用于治疗以过度炎症为特征的疾病或障碍的方法。在实施方案中,所述疾病或障碍是选自溃疡性结肠炎、克罗恩病、直肠炎、结肠袋炎、结肠袋克罗恩病、嗜酸细胞性结肠炎、淋巴细胞性结肠炎、胶原性结肠炎、转移性结肠炎、化学性结肠炎和缺血性结肠炎的ibd相关的疾病或障碍。在实施方案中,ibd相关的疾病或障碍是溃疡性结肠炎或克罗恩病。在实施方案中,ibd相关的疾病或障碍是结肠袋炎。
在实施方案中,本公开提供用于治疗如上所述的ibd相关的疾病或障碍的方法,该方法包括向需要这种治疗的受试者施用式iii的化合物。在该方法的实施方案中,式iii的化合物选自单或双rve1线性lys-lys,单或双at-rve1线性lys-lys,单或双rve2线性lys-lys,单或双at-rve2线性lys-lys,单或双rve3线性lys-lys,以及单或双at-rve3线性lys-lys。在实施方案中,用于该方法的式iii的化合物选自单或双rve1线性lys-lys,单或双at-rve1线性lys-lys,单或双lxa4线性lys-lys,和单或双at-lxa4线性lys-lys。
式iv的化合物
在实施方案中,本公开提供式iv的化合物或其对映异构体、多晶型物、溶剂化物或水合物:
其中
m是二价金属;
a和b各自独立地是spm阴离子;
a和b可以相同或不同;
a或b可以不存在,但不同时不存在;
r1和r2各自独立地是包含至少一个碱性官能团的c1-c10烷基;
x1和x2各自独立地是h或co-z,且z是包含1至5个氨基酸的肽或其药学上可接受的盐;
当a或b不存在时:
r1、r2和两个co-z中的一个被质子化;或
两个h中的一个带正电荷;和
所述质子化的r1、r2和两个co-z中的一个或所述带正电荷的h中的一个与a或b形成离子键;和
当a和b都存在时:
r1、r2和两个co-z中的两个被质子化;或
r1、r2和两个co-z中的一个被质子化,且两个h中的一个带正电荷;和
所述质子化的r1、r2和两个co-z中的两个或所述质子化的r1、r2和两个co-z中的一个和所述带正电荷的h各自分别与a和b形成离子键。
式iv的化合物具有作为氨基酸组分的围绕二价金属阳离子配位的两个氨基酸部分,和作为spm组分的一个或两个spm分子。在实施方案中,二价金属是mg2+、ca2+、mn2+、fe2+、cu2+、co2+、ni2+、mo2+或zn2+。在实施方案中,二价金属是mg2+。在实施方案中,二价金属是ca2+。在实施方案中,二价金属是zn2+。在实施方案中,氨基酸组分包括赖氨酸或精氨酸或由其组成。在实施方案中,氨基酸组分包括赖氨酸或精氨酸。在实施方案中,r1和r2的碱性官能团选自伯胺、仲胺、叔胺和胍。在实施方案中,碱性官能团是指–nh3、–nhc(nh2+)-nh2、–nhr6r7或–nr6r7r8,其中r6、r7、r8各自独立地是氢、-cn、-cooh、-conh2、未被取代的烷基、未被取代的杂烷基、未被取代的环烷基、未被取代的杂环烷基、未被取代的芳基或未被取代的杂芳基;与相同氮原子键合的r6和r7取代基可任选地接合以形成未被取代的杂环烷基或未被取代的杂芳基。在实施方案中,碱性官能团是氢键受体。在实施方案中,碱性官能团是氢键供体。在实施方案中,碱性官能团是带正电荷的胺。
在实施方案中,r1和r2各自是具有碱性官能团的氨基酸残基的侧链。在实施方案中,r1和r2相同且氨基酸残基是赖氨酸或精氨酸。
在实施方案中,r1和r2独立地选自-(ch2)3–y1和-(ch2)4–y2,其中y1和y2各自是碱性官能团,其可以相同或不同。在实施方案中,r1是–ch2ch2nh3。在实施方案中,r2是–ch2ch2nh3。在实施方案中,r1是–ch2ch2ch2ch2nh3。在实施方案中,r2是–ch2ch2ch2ch2nh3。
在实施方案中,r1和r2都是-(ch2)4–y2,且y2是-nh3+。
在实施方案中,r1和r2都是-(ch2)3–y1,且y1是-nhc(nh2+)nh2。
在实施方案中,r1是-(ch2)3–y1,y1是-nhc(nh2+)nh2,r2是-(ch2)4–y2,且y2是nh3+。在实施方案中,r1是-(ch2)4–y2,y2是nh3+,r2是-(ch2)3–y1,且y1是nhc(nh2+)nh2。
在实施方案中,x1和x2相同且是氢(h)。
在实施方案中,a和b的spm分子如下文所述。
在式iv的化合物的实施方案中,a和b相同或不同且各自独立地选自e系列消退素。在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2,和at-rve3,m是mg2+,ca2+,或zn2+,r1和r2都是-(ch2)4–y2且y2是nh3+;且x1和x2是h。这种r1、r2和y2的选择在本文中可称为金属“二赖氨酸盐”,例如“二赖氨酸镁”或“mg-二赖氨酸盐”。在表5中,金属二赖氨酸盐名称缩写为“spm-mlys”,其中“m”是金属,例如mg,ca,或zn。在该实施方案中,肽组分由赖氨酸二肽组成。在实施方案中,a和b相同。
在式iv的化合物的实施方案中,a和b相同且选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-pd1、at-lxa4和at-rve1;m是mg2+、ca2+或zn2+,r1和r2都是(ch2)4–y2且y2是nh3+;且x1和x2是h。这种r1、r2和y2的选择在本文中可称为金属“二赖氨酸盐”,例如“二赖氨酸镁”或“mg-二赖氨酸盐”。在该实施方案中,肽组分由赖氨酸二肽组成。
在实施方案中,式iv的化合物选自单或双rve1mg-二赖氨酸盐。在实施方案中,式iv的化合物是双rve1mg-二赖氨酸盐。在实施方案中,式iv的化合物选自单或双at-rve1mg-二赖氨酸盐。在实施方案中,式iv的化合物是双at-rve1mg-二赖氨酸盐。
在实施方案中,式iv的化合物选自单或双rve2mg-二赖氨酸盐。在实施方案中,式iv的化合物是双rve2mg-二赖氨酸盐。在实施方案中,式iv的化合物选自单或双at-rve2mg-二赖氨酸盐。在实施方案中,式iv的化合物是双at-rve2mg-二赖氨酸盐。
在实施方案中,式iv的化合物选自单或双rve3mg-二赖氨酸盐。在实施方案中,式iv的化合物是双rve3mg-二赖氨酸盐。在实施方案中,式iv的化合物选自单或双at-rve3mg-二赖氨酸盐。在实施方案中,式iv的化合物是双at-rve3mg-二赖氨酸盐。
在实施方案中,式iv的化合物选自单或双lxa4mg-二赖氨酸盐。在实施方案中,式iv的化合物是双lxa4mg-二赖氨酸盐。在实施方案中,式iv的化合物选自单或双at-lxa4mg-二赖氨酸盐。在实施方案中,式iv的化合物是双at-lxa4mg-二赖氨酸盐。
在实施方案中,式iv的化合物选自单或双rvd1mg-二赖氨酸盐。在实施方案中,式iv的化合物选自单或双at-rvd1mg-二赖氨酸盐。
在实施方案中,式iv的化合物选自单或双rvd2mg-二赖氨酸盐。在实施方案中,式iv的化合物选自单或双at-rvd2mg-二赖氨酸盐。
在实施方案中,式iv的化合物选自单或双pdxmg-二赖氨酸盐。
在表5中提供示例性的式iv的化合物。在实施方案中,式iv的化合物选自表5的化合物1-3,6-8,41-43,46-48,51-53和56-58(e系列)。在实施方案中,式iv的化合物选自表5的化合物1-3、6-8、11-13、16-18、21-23、26-28、31-33和36-38。在实施方案中,式iv的化合物选自表5的化合物1-3和6-8(rve1和at-rve1实施方案)。在实施方案中,式iv的化合物选自表5的化合物11-13和16-18(lxa4和at-lxa4实施方案)。在实施方案中,式iv的化合物选自表5的化合物21-23和26-28(rvd1和at-rvd1实施方案)。
在实施方案中,式iv的化合物或包含其的组合物用于治疗以过度炎症为特征的疾病或障碍的方法。在实施方案中,所述疾病或障碍是选自溃疡性结肠炎、克罗恩病、直肠炎、结肠袋炎、结肠袋克罗恩病、嗜酸细胞性结肠炎、淋巴细胞性结肠炎、胶原性结肠炎、转移性结肠炎、化学性结肠炎和缺血性结肠炎的ibd相关的疾病或障碍。在实施方案中,ibd相关的疾病或障碍是溃疡性结肠炎或克罗恩病。在实施方案中,ibd相关的疾病或障碍是结肠袋炎。
在实施方案中,本公开提供用于治疗选自如上所述的ibd相关的疾病或障碍的疾病或障碍的方法,该方法包括向需要这种治疗的受试者施用式iv的化合物。在该方法的实施方案中,式iv的化合物选自单或双rve1mg,ca或zn二赖氨酸盐,单或双at-rve1mg,ca或zn二赖氨酸盐,单或双rve2mg,ca或zn二赖氨酸盐,单或双at-rve2mg,ca或zn二赖氨酸盐,单或双rve3mg,ca或zn二赖氨酸盐,以及单或双at-rve3mg,ca或zn二赖氨酸盐。在实施方案中,式iv的化合物选自单或双rve1mg、ca或zn二赖氨酸盐,单或双at-rve1mg、ca或zn二赖氨酸盐,单或双lxa4mg、ca或zn二赖氨酸盐,和单或双at-lxa4mg、ca或zn二赖氨酸盐。在实施方案中,二赖氨酸盐是二赖氨酸镁。
spm组分
如上所讨论的,由式i-iv表示的化合物各自含有:至少一个或两个spm分子,其在本文中可称为化合物的“spm组分”;以及离子性结合有该spm组分的骨架部分。术语“单”和“双”是指盐化合物中的一个(单)或两个(双)spm分子。
术语“spm”是指spm,例如保护素和消退素,以及脂氧素和阿司匹林触发的脂质介质(例如,阿司匹林触发的脂氧素和保护素),如下文更详细描述的。可形成本文所述的化合物的spm组分的特定spm分子及其前体分子的实例在下表1-4中给出。应当理解,如果在适当的ph下溶剂化,这些表中描述的中性化合物可带电荷(即去质子化)。
在实施方案中,本文所述的化合物的spm组分包含一个或两个spm分子或由其组成,所述spm分子选自:衍生自花生四烯酸(aa)的介质(表1),衍生自二十碳五烯酸(epa)的介质(表2);衍生自二十二碳六烯酸(dha)的介质(表3);和阿司匹林触发的介质(表4)。在实施方案中,本文描述的化合物的spm组分包含选自表1-4的两个spm分子或由其组成。在实施方案中,两个spm分子相同或不同。在实施方案中,两个spm分子相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,两个spm分子相同且选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-pd1、at-lxa4和at-rve1。在实施方案中,本文所述的化合物的spm组分由一个或两个spm分子组成,所述spm分子选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,本文所述的化合物的spm组分由一个或两个spm分子组成,所述spm分子选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-pd1、at-lxa4和at-rve1。在实施方案中,spm组分选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,spm组分选自rve1、at-rve1、lxa4和at-lxa4。
本公开还提供包含本文所述的单一化合物的组合物,或包含本文所述的两种或更多种不同化合物的混合物的组合物。在实施方案中,所述组合物是药物或兽医用组合物,且所述载体对于施用给人或动物是可接受的。
在实施方案中,组合物是固体口服剂型、适于直肠施用的剂型或肠胃外剂型的药物组合物。在实施方案中,适于直肠施用的剂型是软膏、栓剂或灌肠剂。在实施方案中,肠胃外剂型适合于静脉内、动脉内或肌肉内施用,例如经由注射水性液体。
本公开还提供本文所述的化合物以及包含其的组合物的使用方法。在实施方案中,本文描述的化合物或包含其的组合物可用于治疗其中炎症消退提供有益效果的疾病或障碍,例如以慢性或过度炎症为特征的那些。例如,本文所述的化合物和组合物可用于治疗胃肠疾病和障碍,肺疾病和障碍,关节炎疾病和障碍,心血管疾病和障碍,代谢疾病和障碍,感染性疾病和障碍,以及神经病学疾病和障碍。
在实施方案中,本公开提供通过向需要这种治疗的受试者施用式i、ii、iii或iv的化合物来治疗胃肠疾病或障碍的方法,其中所述胃肠疾病或障碍选自在下文标题为“药物用途”的部分中描述的那些。在所述方法的实施方案中,所述化合物是式i的化合物,其具有赖氨酰-赖氨酸二肽组分和选自e系列消退素的spm组分;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在所述方法的实施方案中,所述化合物是式i的化合物,其具有赖氨酰-赖氨酸二肽组分和选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-lxa4和at-rve1的spm组分。在实施方案中,spm组分选自rve1、at-rve1、lxa4和at-lxa4。在所述方法的实施方案中,所述化合物是式iv的化合物,其具有镁、钙或锌二赖氨酸盐肽组分和选自e系列消退素的spm组分;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在该方法的实施方案中,所述化合物是式iv的化合物,其具有镁、钙或锌二赖氨酸盐肽组分和选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-lxa4和at-rve1的spm组分。在实施方案中,spm组分选自rve1、at-rve1、lxa4和at-lxa4。spm组分可以是单或双,但优选是双。
本公开还提供包装或试剂盒,其包含:本文所述的化合物的单位剂型或包含其的组合物,用于容纳所述单位剂型的至少一个容器,以及使用说明书。
附图简述
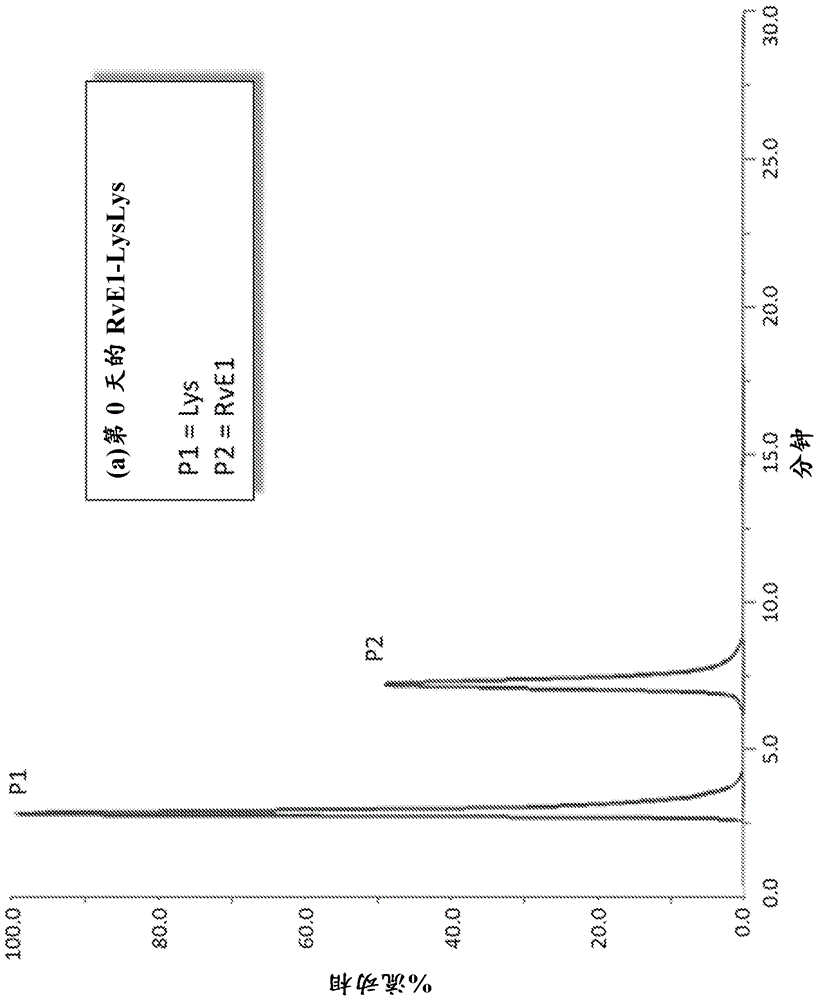
图1a、b:rve1的化学稳定性。a,在时间零点时rve1游离酸的hplc迹线。b,在8周时rve1的hplc迹线。
图2a、b:rve1mg-二赖氨酸盐的化学稳定性。a,在时间零点时rve1mg-二赖氨酸盐的hplc迹线。b,在8周时rve1mg-二赖氨酸盐的hplc迹线。
图3a、b:rve1ca-二赖氨酸盐的化学稳定性。a,在时间零点时rve1ca-二赖氨酸盐的hplc迹线。b,在6周时rve1ca-二赖氨酸盐的hplc迹线。
图4a、b:rve1赖氨酰赖氨酸的化学稳定性。a,在时间零点时rve1赖氨酰赖氨酸的hplc迹线。b,在8周时rve1赖氨酰赖氨酸的hplc迹线。
发明详述
本发明提供新的盐形式的特异性促炎症消退介质(在本文中称为“spm”),其包括脂氧素、消退素、保护素和它们的阿司匹林触发的对应物,如下文更详细描述的。本文所述的化合物有利地提供药理学上有用形式的spm分子,这至少部分是由于它们增加的物理和/或化学稳定性。
本文所述的化合物含有至少一个或两个spm分子,其离子性结合到至少一个碱性官能团,所述碱性官能团由如下式i-iv中所述的骨架提供。通常,形成本文所述的化合物的spm组分的spm分子(一个或多个)的羧酸部分被去质子化以与该化合物的骨架部分的碱性官能团(一个或多个)形成离子键。
本文所述的化合物可以非溶剂化形式以及溶剂化形式(包括水合形式)存在。通常,溶剂化形式等同于非溶剂化形式且旨在包括在本发明的范围内。通常,所有物理形式对于本发明所预期的用途是等同的且旨在落入本发明的范围内。
本文使用的缩写具有其在化学和生物学领域中的常规含义。本文所述的化学结构和式根据化学领域中已知的化学价的标准规则构建。例如,在其中取代基例如-nh3以无电荷来显示的情况下,应当理解为具有形式电荷(formalcharge),即nh3+。
除非另有说明,术语“烷基”本身或作为另一个取代基的一部分,是指直的(即未支化)或支化碳链(或碳)或其组合,其可以是完全饱和的、单或多不饱和的且可以包括具有指定的碳原子数的一价、二价和多价基团(即,c1-c10表示1-10个碳)。
术语“碱性官能团”是指带正电荷或质子化的伯胺、带正电荷的仲胺、带正电荷的叔胺或带正电荷的胍。在实施方案中,碱性官能团是指–nh3+、-nhc(nh2+)nh2、–nhr6r7、–nr6r7r8,其中r6、r7和r8各自独立地是氢、-cn、-cooh、-conh2、未被取代的烷基、未被取代的杂烷基、未被取代的环烷基、未被取代的杂环烷基、未被取代的芳基或未被取代的杂芳基;与相同氮原子键合的r6和r7取代基可任选地接合以形成未被取代的杂环烷基或未被取代的杂芳基。在实施方案中,碱性官能团是氢键受体。在实施方案中,碱性官能团是带正电荷的胺。
应当理解,由于共振,电荷可以分布在整个分子上。本文所述的化学结构和式是根据化学领域中已知的化学价的标准规则构建的,且因此本领域技术人员将认识到具有共振结构的部分的等同性。
例如,-nhc(nh2+)nh2是指
在实施方案中,如本文所用的“氨基酸的侧链”或“侧链”或“侧-链”根据其普通含义使用,且是指天然存在的氨基酸上包含的功能性取代基。天然存在的氨基酸是由遗传密码编码的氨基酸(例如丙氨酸,精氨酸,天冬酰胺,天冬氨酸,半胱氨酸,谷氨酰胺,谷氨酸,甘氨酸,组氨酸,异亮氨酸,亮氨酸,赖氨酸,蛋氨酸,苯丙氨酸,脯氨酸,丝氨酸,苏氨酸,色氨酸,酪氨酸或缬氨酸),以及后来被改性的那些氨基酸,例如羟脯氨酸,γ-羧基谷氨酸根(盐/酯)和o-磷酸丝氨酸。在实施方案中,氨基酸的侧链被离子化(例如它具有形式电荷)。
在实施方案中,侧链选自h,
在实施方案中,所述侧链是h。在实施方案中,所述侧链是
在实施方案中,侧链可任选地与相邻的氮接合以形成未被取代的杂环烷基(例如,吡咯烷基)。
在实施方案中,所述侧链是
甘氨酸的侧链是h。精氨酸的侧链是
术语“非天然氨基酸侧链”是指具有与天然存在的氨基酸相同基本化学结构(即与氢、羧基、氨基和r基团结合的α碳)的化合物的功能性取代基,例如高丝氨酸,正亮氨酸,蛋氨酸亚砜,蛋氨酸甲基锍,烯丙基丙氨酸,2-氨基异丁酸。非天然氨基酸是天然存在或化学合成的非蛋白原氨基酸。这种类似物具有改性的r基团(例如正亮氨酸)或改性的肽主链,但保留与天然存在的氨基酸相同的基本化学结构。非限制性实例包括外-顺-3-氨基双环[2.2.1]庚-5-烯-2-羧酸盐酸盐,顺-2-氨基环庚烷羧酸盐酸盐,顺-6-氨基-3-环己烯-1-羧酸盐酸盐,顺-2-氨基-2-甲基环己烷羧酸盐酸盐,顺-2-氨基-2-甲基环戊烷羧酸盐酸盐,2-(boc-氨基甲基)苯甲酸,2-(boc-氨基)辛二酸,boc-4,5-脱氢-leu-oh(二环己基铵),boc-4-(fmoc-氨基)-l-苯丙氨酸,boc-β-homopyr-oh,boc-(2-茚满基)-gly-oh,4-boc-3-吗啉乙酸,4-boc-3-吗啉乙酸,boc-五氟-d-苯丙氨酸,boc-五氟-l-苯丙氨酸,boc-phe(2-br)-oh,boc-phe(4-br)-oh,boc-d-phe(4-br)-oh,boc-d-phe(3-cl)-oh,boc-phe(4-nh2)-oh,boc-phe(3-no2)-oh,boc-phe(3,5-f2)-oh,2-(4-boc-哌嗪子基)-2-(3,4-二甲氧基苯基)乙酸purum,2-(4-boc-哌嗪子基)-2-(2-氟苯基)乙酸purum,2-(4-boc-哌嗪子基)-2-(3-氟苯基)乙酸purum,2-(4-boc-哌嗪子基)-2-(4-氟苯基)乙酸purum,2-(4-boc-哌嗪子基)-2-(4-甲氧基苯基)乙酸purum,2-(4-boc-哌嗪子基)-2-苯基乙酸purum,2-(4-boc-哌嗪子基)-2-(3-吡啶基)乙酸purum,2-(4-boc-哌嗪子基)-2-[4-(三氟甲基)苯基]乙酸purum,boc-β-(2-喹啉基)-ala-oh,n-boc-1,2,3,6-四氢-2-吡啶羧酸,boc-β-(4-噻唑基)-ala-oh,boc-β-(2-噻吩基)-d-ala-oh,fmoc-n-(4-boc-氨基丁基)-gly-oh,fmoc-n-(2-boc-氨基乙基)-gly-oh,fmoc-n-(2,4-二甲氧基苄基)-gly-oh,fmoc-(2-茚满基)-gly-oh,fmoc-五氟-l-苯丙氨酸,fmoc-pen(trt)-oh,fmoc-phe(2-br)-oh,fmoc-phe(4-br)-oh,fmoc-phe(3,5-f2)-oh,fmoc-β-(4-噻唑基)-ala-oh,fmoc-β-(2-噻吩基)-ala-oh,4-(羟甲基)-d-苯丙氨酸。
式i化合物
在实施方案中,本公开提供式i的化合物,包括其对映异构体、多晶型物、溶剂化物和水合物:
其中
a和b各自独立地是spm分子;
a和b可以相同或不同;
a或b可以不存在,但不同时不存在,
r1和r2各自独立地是包含至少一个碱性官能团的c1-c10烷基;
x是h或co-z,且z是单个氨基酸残基或包含2-18个氨基酸残基的肽;
当a或b不存在时:
r1、r2和co-z中的一个被质子化;或
h带正电荷;和
所述质子化的r1、r2和co-z中的一个或所述带正电荷的h与a或b形成离子键;和
当a和b都存在时:
r1、r2和co-z中的两个被质子化;或
r1、r2和co-z中的一个被质子化,且h带正电荷;和
所述质子化的r1、r2和co-z中的两个或所述质子化的r1、r2和co-z中的一个和所述带正电荷的h各自分别与a和b形成离子键。
式i的化合物包含由至少2个氨基酸部分组成的肽组分,和作为spm组分的一个或两个spm分子(a,b)。spm组分在下面更详细地描述。在实施方案中,spm组分包含选自e系列消退素的spm或由其组成;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,spm组分包含选自rvd1,rvd2,rve1,pdx和lxa4的spm或由其组成。在实施方案中,spm组分包含选自阿司匹林触发的(at)消退素、脂氧素或保护素的spm或由其组成。在实施方案中,at消退素、脂氧素或保护素选自at-rve1,at-rve2和at-rve3。在实施方案中,at消退素、脂氧素或保护素选自at-rve1、at-rvd1、at-rvd2、at-pd1和at-lxa4。在实施方案中,spm组分由e系列消退素组成;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,spm组分由rve1、at-rve1、lxa4或at-lxa4组成。在实施方案中,spm组分由rve1或lxa4组成。
肽组分的长度可以是2至10或2至20个氨基酸,优选长度为2、3、4或5个氨基酸。当x是h时,肽组分由2个氨基酸残基组成,或当x是co-z时,是3至5、3至10或3至20个氨基酸残基的肽。
肽组分的每个氨基酸部分可以独立地包含单个天然或非天然存在的氨基酸残基或由其组成。在实施方案中,氨基酸残基独立地选自甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、半胱氨酸、苏氨酸、蛋氨酸、脯氨酸、苯丙氨酸、酪氨酸、色氨酸、组氨酸、赖氨酸、精氨酸、天冬氨酸、谷氨酸、天冬酰胺和谷氨酰胺的残基。
r1和r2各自独立地是未被取代的c1-c10烷基,包括至少一个碱性官能团。在实施方案中,碱性官能团是氨基酸部分的侧链。在实施方案中,氨基酸部分选自赖氨酸、精氨酸和谷氨酰胺。在实施方案中,碱性官能团选自带正电荷的伯胺、带正电荷的仲胺、带正电荷的叔胺和带正电荷的胍。
在实施方案中,碱性官能团是指–nh3、–nhc(nh2+)nh2、–nhr6r7或–nr6r7r8,其中r6、r7、r8各自独立地是氢、-cn、-cooh、-conh2、未被取代的烷基、未被取代的杂烷基、未被取代的环烷基、未被取代的杂环烷基、未被取代的芳基或未被取代的杂芳基;与相同氮原子键合的r6和r7取代基可以任选地连接以形成未被取代的杂环烷基或未被取代的杂芳基。在实施方案中,碱性官能团是带正电荷的胺。在实施方案中,碱性官能团是伯胺。在实施方案中,碱性官能团是-nh3+。
在实施方案中,x是h,且肽组分由独立地选自赖氨酸、精氨酸和谷氨酰胺的氨基酸的二肽,或前述一种或多种的衍生物组成。
在实施方案中,x是co-z,且z是单个氨基酸残基或2至10或2至5个氨基酸残基的肽,且肽组分包含独立地选自赖氨酸、精氨酸和谷氨酰胺的至少一个或两个氨基酸。
在实施方案中,x是h且r1和r2各自独立地选自-(ch2)3–nhc(nh2+)nh2,-(ch2)4–nh3+,和-(ch2)2–c(o)nh3+。在实施方案中,r1和r2相同。在实施方案中,r1和r2不同。
在实施方案中,x是co-z,且z是单个氨基酸残基或2至10或2至5个氨基酸残基的肽,且r1和r2各自独立地选自-(ch2)3–nhc(nh2+)nh2,-(ch2)4–nh3+和-(ch2)2–c(o)nh3+。在实施方案中,r1和r2相同。在实施方案中,r1和r2不同。
在实施方案中,-nhc(nh2+)nh2是
在实施方案中,a或b不存在。当a或b不存在时,该化合物可称为“单”盐。在实施方案中,a和b都存在。当a和b都存在时,该化合物可称为“双”盐。在一个实施方案中,a和b各自是spm,且a和b是相同或不同的。
在实施方案中,a和b相同或不同,且各自独立地选自e系列消退素。在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,a和b相同且选自脂氧素a4、保护素dx、消退素e1、消退素d2和阿司匹林触发的消退素d1。
在实施方案中,式i的化合物是单或双spm赖氨酰-赖氨酸(lys-lys)化合物,其选自rve1lys-lys,rve2lys-lys,rve3lys-lys,at-rve1lys-lys,at-rve2lys-lys和at-rve3lys-lys。在实施方案中,式i的化合物是单或双spm赖氨酰-赖氨酸(lys-lys)化合物,其选自lxa4lys-lys、at-lxa4lys-lys、rvd1lys-lys、at-rvd1lys-lys、rve1lys-lys、at-rve1lys-lys、pdxlys-lys、rvd2lys-lys和at-rvd2lys-lys。在实施方案中,式i的化合物是单或双spmlys-lys化合物,其选自at-rvd1lys-lys、at-rvd2lys-lys和at-lxa4lys-lys。在实施方案中,式i的化合物选自单或双rve1lys-lys和单或双at-rve1lys-lys。在实施方案中,式i的化合物选自单或双lxa4lys-lys和单或双at-lxa4lys-lys。
在表5中提供式i的赖氨酰-赖氨酸实施方案的示例性化合物。在实施方案中,式i的化合物选自表5的化合物4,9,44,49,54和59(e系列)。在实施方案中,式i的化合物选自表5的化合物4、9、14、19、24、29、34和39。在实施方案中,式i的化合物选自表5的化合物4、9、24、29、34和39。在实施方案中,式i的化合物选自化合物4和9(rve1和at-rve1实施方案)。在实施方案中,式i的化合物选自化合物14和19(lxa4和at-lxa4实施方案)。
在实施方案中,式i的化合物是赖氨酰-谷氨酰胺化合物,其选自赖氨酰-谷氨酰胺单或双rve1,赖氨酰-谷氨酰胺单或双rve2,赖氨酰-谷氨酰胺单或双rve3,赖氨酰-谷氨酰胺单或双at-rve1,赖氨酰-谷氨酰胺单或双at-rve2,和赖氨酰-谷氨酰胺单或双at-rve3。在实施方案中,式i的化合物是赖氨酰-谷氨酰胺化合物,其选自赖氨酰-谷氨酰胺单或双脂氧素a4(lxa4),赖氨酰-谷氨酰胺单或双阿司匹林触发的消退素d1(at-rvd1),赖氨酰-谷氨酰胺单或双消退素e1(rve1),赖氨酰-谷氨酰胺单或双保护素dx(pdx)和赖氨酰-谷氨酰胺单或双消退素d2(rvd2)。
式ii化合物
在实施方案中,本公开提供式ii的化合物或其对映异构体、多晶型物、溶剂化物或水合物:
其中r1为h或不存在,x1和x2各自独立地是氨基酸残基的侧链,m为带正电荷的任选分子,且b为spm分子。
在实施方案中,r1是h,且x1和x2是甘氨酸的侧链。
在实施方案中,r1是h,且x1是赖氨酸的侧链,且x2选自缬氨酸的侧链、丝氨酸的侧链、亮氨酸的侧链、组氨酸的侧链。
式ii的化合物至少由(i)二肽组分和(ii)spm组分(b)与带正电荷的任选分子(m)组成。二肽组分含有x1和x2,它们可以相同或不同,且各自是氨基酸残基的侧链。在实施方案中,x1和x2中的至少一个是选自丝氨酸、苏氨酸、甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸和苯丙氨酸的氨基酸残基的侧链。在实施方案中,在x1和x2之一是选自丝氨酸、苏氨酸、甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、蛋氨酸和苯丙氨酸的氨基酸残基的侧链的情况下,x1或x2的其余部分是独立地选自赖氨酸、精氨酸、组氨酸、天冬氨酸根(盐/酯)、谷氨酸根(盐/酯)、丝氨酸、苏氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、甘氨酸、脯氨酸、丙氨酸、缬氨酸、异亮氨酸、亮氨酸、蛋氨酸、苯丙氨酸、酪氨酸和色氨酸的氨基酸的侧链。在实施方案中,其余部分是赖氨酸的侧链。在实施方案中,x1和x2中的至少一个是甘氨酸、缬氨酸、丝氨酸、亮氨酸或组氨酸的侧链,且其余部分是赖氨酸的侧链。
在实施方案中,spm组分(b)包含e系列消退素或由其组成。在式ii的化合物的实施方案中,b选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,spm组分(b)包含选自rvd1、rvd2、rve1、pdx和lxa4的spm或由其组成。在实施方案中,spm组分包含选自阿司匹林触发的(at)消退素、脂氧素或保护素的spm或由其组成。在实施方案中,at消退素、脂氧素或保护素选自at-rve1、at-rvd1、at-rvd2、at-pd1和at-lxa4。在实施方案中,spm组分由rve1、at-rve1、lxa4或at-lxa4组成。在实施方案中,spm组分由rve1或lxa4组成。
带正电荷的任选分子(m)具有与氨基酸组分的末端羧基形成离子键的至少一个碱性官能团。在实施方案中,m是一价金属阳离子(例如na+,k+),或具有至少一个碱性官能团的分子,例如基于一价胺的阳离子(例如三乙醇胺,或三乙胺)或碱性药物化合物(如二甲双胍或加巴喷丁)。
如下面更详细描述的,式ii的化合物包括二肽和spm的简单盐(式iia),二肽和spm与一价金属的简单金属盐(式iib),和二肽和spm与具有至少一个碱性官能团的非金属分子的简单非金属盐(式iic)。
提供式iia、iib和iic的化合物的以下非限制性实例以说明所述化合物的性质,且不旨在将本公开限制于下文描述的特定化合物。对于以下任何实施方案,a和b如上文和下文所述。
式iia实例
作为式ii的化合物的gly-gly-spm,其中
r1是h,
x1和x2各自是h,和
m不存在:
作为式ii的化合物的lys-lys-spm,其中
r1是h,
x1和x2各自是,和
m不存在。
作为式ii的化合物的lys-val-spm,其中
r1各自是h,
x1是赖氨酸的侧链(丁胺),
x2是缬氨酸的侧链(异丙基),和
m不存在:
作为式ii的化合物的lys-ser-spm,其中
r1是h,
x1是赖氨酸的侧链(丁胺),
x2是丝氨酸的侧链,和
m不存在:
作为式ii的化合物的lys-gly-spm,其中
r1是h,
x1是赖氨酸的侧链(丁胺),
x2是甘氨酸的侧链,和
m不存在:
作为式ii的化合物的lys-leu-spm,其中
r1为h,
x1是赖氨酸的侧链(丁胺),
x2是亮氨酸的侧链(异丁基),和
m不存在:
作为式ii的化合物的lys-his-spm,其中
r1为h,
x1是赖氨酸的侧链(丁胺),
x2是组氨酸的侧链(咪唑);
m不存在:
其中二肽是gly-gly且spm是lxa4、pdx或at-rvd1的式iia的三个实施方案的说明性结构如下所示:
式iib实例
在实施方案中,m是一价金属阳离子,例如na+或k+(式iib)。式iib化合物的非限制性实例包括以下:
作为式iib的化合物的na+-gly-gly-spm,其中
r1不存在,
x1和x2各自是h,和;
m是na:
其中spm是at-rvd1、lxa4或pdx且m是钠阳离子的式iib的三个实施方案的说明性结构如下所示:
(spm=at-rvd1)
式iic实例
在实施方案中,m是具有至少一个碱性官能团的非金属分子,所述碱性官能团是例如基于一价胺的阳离子,例如三乙醇胺,或三乙胺或碱性药物化合物,例如二甲双胍或加巴喷丁。式iic化合物的非限制性实例包括以下:
作为式ii的化合物的三乙醇胺-gly-gly-spm,其中
r1不存在,
x1和x2各自是h,和
m是三乙醇胺:
作为式ii的化合物的二甲双胍-gly-gly-spm,其中
r1不存在,
x1和x2各自是h,和
m是二甲双胍:
式iii化合物
在实施方案中,本公开提供式iii的化合物或其对映异构体、多晶型物、溶剂化物或水合物:
其中
r2是包含至少一个碱性官能团的c1-c10烷基;
a和b各自独立地是spm分子;
a和b可以相同或不同;和
a或b可以不存在,但不同时不存在。
在实施方案中,r2是选自赖氨酸、精氨酸和谷氨酰胺的氨基酸残基的侧链。在实施方案中,r2是赖氨酸的侧链。在实施方案中,r2选自-(ch2)3–nhc(nh2+)nh2,-(ch2)4–nh3+,和-(ch2)2–c(o)nh3+。在实施方案中,r2是-(ch2)4–nh3+。
在实施方案中,r2的碱性官能团选自带正电荷的伯胺,带正电荷的仲胺,带正电荷的叔胺和带正电荷的胍。
在实施方案中,r2的碱性官能团是指–nh3,–nhc(nh2+)nh2,–nhr6r7或–nr6r7r8,其中r6、r7、r8各自独立地是氢、-cn、-cooh、-conh2、未被取代的烷基、未被取代的杂烷基、未被取代的环烷基、未被取代的杂环烷基、未被取代的芳基或未被取代的杂芳基;与相同氮原子键合的r6和r7取代基可任选地接合以形成未被取代的杂环烷基或未被取代的杂芳基。在实施方案中,碱性官能团是带正电荷的胺。在实施方案中,碱性官能团是伯胺。在实施方案中,碱性官能团是-nh3+。
在实施方案中,r2是赖氨酸的侧链,a和b是相同的分子且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,r2是赖氨酸的侧链,a和b是相同的分子且选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-pd1、at-rve1和at-lxa4。
在实施方案中,spm组分(a,b)包含选自e系列消退素的spm或由其组成;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,spm组分(a,b)包含选自rvd1、at-rvd1、rvd2、at-rvd2、rve1、at-rve1、pdx、at-pd1、lxa4和at-lxa4的spm或由其组成。在实施方案中,spm组分由rve1、at-rve1、lxa4或at-lxa4组成。在实施方案中,spm组分由rve1或lxa4组成。
在实施方案中,式iii的化合物是单或双spm线性赖氨酰-赖氨酸(线性lys-lys)化合物,其选自rve1线性lys-lys,rve2线性lys-lys,rve3线性lys-lys,at-rve1线性lys-lys,at-rve2线性lys-lys和at-rve3线性lys-lys。
在实施方案中,式iii的化合物是单或双spm线性赖氨酰-赖氨酸化合物,其选自rve1线性lys-lys、at-rve1线性lys-lys、lxa4线性lys-lys、at-lxa4线性lys-lys、rvd1线性lys-lys、at-rvd1线性lys-lys、pdx线性lys-lys和rvd2线性lys-lys。在实施方案中,式iii的化合物是单或双spm赖氨酰-赖氨酸化合物,其选自at-rvd1线性lys-lys、at-rvd2线性lys-lys和at-lxa4线性lys-lys。在实施方案中,式iii的化合物是单或双spm赖氨酰-赖氨酸化合物,其选自rve1线性lys-lys、at-rve1线性lys-lys、lxa4线性lys-lys和at-lxa4线性lys-lys。
式iii的示例性化合物在表5中提供。在实施方案中,式iii的化合物选自表5的化合物5,10,45,50,55和60(e系列)。在实施方案中,式iii的化合物选自表5的化合物5、10、15、20、25、30、35和40。在实施方案中,式iii的化合物选自表5的化合物5和10(rve1和at-rve1实施方案)。在实施方案中,式iii的化合物选自表5的化合物15和20(lxa4和at-lxa4实施方案)。
式iv化合物
在实施方案中,本公开提供式iv的化合物或其对映异构体、多晶型物、溶剂化物或水合物:
其中
m是二价金属;
a和b各自独立地是spm分子;
a和b可以相同或不同;
a或b可以不存在,但不同时不存在;
r1和r2各自独立地是包含至少一个碱性官能团的c1-c10烷基;
x1和x2各自独立地是h或co-z,且z是包含1至5个氨基酸的肽或其药学上可接受的盐;
当a或b不存在时:
r1、r2和两个co-z中的一个被质子化;或
两个h中的一个带正电荷;和
所述质子化的r1、r2和两个co-z中的一个或所述带正电荷的h的一个与a或b形成离子键;和
当a和b都存在时:
r1、r2和两个co-z中的两个被质子化;或
r1、r2和两个co-z中的一个被质子化,且两个h中的一个带正电荷;和
所述质子化的r1、r2和两个co-z中的两个或所述质子化的r1、r2和两个co-z中的一个和所述带正电荷的h各自分别与a和b形成离子键。
式iv的化合物具有作为氨基酸组分的围绕二价金属阳离子配位的两个氨基酸部分,和作为spm组分的一个或两个spm分子。在实施方案中,二价金属阳离子是mg2+,ca2+,mn2+,fe2+,cu2+,co2+,ni2+,mo2+或zn2+。在实施方案中,二价金属阳离子是mg2+。在实施方案中,二价金属阳离子是ca2+。在实施方案中,二价金属阳离子是zn2+。
在实施方案中,氨基酸组分包括赖氨酸或精氨酸或由其组成。在实施方案中,氨基酸组分包括赖氨酸或精氨酸。在实施方案中,r1和r2的碱性官能团选自伯胺、仲胺、叔胺和胍。在实施方案中,碱性官能团是指–nh3,–nhc(nh2+)nh2,–nhr6r7或–nr6r7r8,其中r6、r7、r8各自独立地是氢、-cn、-cooh、-conh2、未被取代的烷基、未被取代的杂烷基、未被取代的环烷基、未被取代的杂环烷基、未被取代的芳基或未被取代的杂芳基;与相同氮原子键合的r6和r7取代基可任选地接合以形成未被取代的杂环烷基或未被取代的杂芳基。在实施方案中,碱性官能团是氢键受体。在实施方案中,碱性官能团是氢键供体。在实施方案中,碱性官能团是带正电荷的胺。
在实施方案中,r1和r2各自是具有碱性官能团的氨基酸残基的侧链。在实施方案中,r1和r2相同且氨基酸残基是赖氨酸或精氨酸。
在实施方案中,r1和r2独立地选自-(ch2)3-y1和-(ch2)4-y2,其中y1和y2各自是碱性官能团,其可以相同或不同。
在实施方案中,r1和r2都是-(ch2)4-y2,且y2是-nh3+。
在实施方案中,r1和r2都是-(ch2)3-y1,且y1是-nhc(nh2+)nh2。
在实施方案中,r1是-(ch2)3-y1,y1是-nhc(nh2+)nh2,y2是-(ch2)4-y2,且y2是-nh3+。在实施方案中,r1是-(ch2)4-y2,y2是-nh3+,r2是-(ch2)3-y1且y1是nhc(nh2+)nh2。
在实施方案中,x1和x2相同且是氢(h)。在实施方案中,x1是氢。在实施方案中,x2是氢。
在实施方案中,spm组分(a、b)包含e系列消退素或由其组成;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。
在实施方案中,spm组分(a、b)包含选自rvd1、at-rvd1、rvd2、at-rvd2、rve1、at-rve1、pdx、at-pd1、lxa4和at-lxa4的spm或由其组成。在实施方案中,spm组分由rve1、at-rve1、lxa4或at-lxa4组成。在实施方案中,spm组分由rve1或lxa4组成。
在实施方案中,式iv的化合物是选自rve1m-lys-lys,rve2m-lys-lys,rve3m-lys-lys,at-rve1m-lys-lys,at-rve2m-lys-lys和at-rve3m-lys-lys的单或双spm镁、钙或锌二赖氨酸盐(m-lys-lys或m-二赖氨酸盐)化合物。
在实施方案中,式iv的化合物是选自rvd1m-lys-lys、at-rvd1m-lys-lys、rvd2m-lys-lys、at-rvd2m-lys-lys、rve1m-lys-lys、at-rve1m-lys-lys、pdxm-lys-lys、lxa4m-lys-lys和at-lxa4m-lys-lys的单或双spm镁、钙或锌二赖氨酸盐(m-lys-lys或m-二赖氨酸盐)化合物。
在实施方案中,式iv的化合物是选自rve1mg-lys-lys,rve2mg-lys-lys,rve3mg-lys-lys,at-rve1mg-lys-lys,at-rve2mg-lys-lys和at-rve3mg-lys-lys的单或双spmmg二赖氨酸盐化合物。
在实施方案中,式iv的化合物是选自rve1ca-lys-lys,rve2ca-lys-lys,rve3ca-lys-lys,at-rve1ca-lys-lys,at-rve2ca-lys-lys和at-rve3ca-lys-lys的单或双spmca二赖氨酸盐化合物。
在实施方案中,式iv的化合物是选自rve1zn-lys-lys,rve2zn-lys-lys,rve3zn-lys-lys,at-rve1zn-lys-lys,at-rve2zn-lys-lys和at-rve3zn-lys-lys的单或双spmzn二赖氨酸盐化合物。
在实施方案中,式iv的化合物是选自rve1mg-lys-lys、at-rvd1mg-lys-lys、rvd2mg-lys-lys、pdxmg-lys-lys和lxa4mg-lys-lys的单或双spmmg-二赖氨酸盐化合物。
在实施方案中,式iv的化合物是单或双rve1mg-lys-lys或单或双at-rve1mg-lys-lys。
在实施方案中,式iv的化合物是单或双lxa4mg-lys-lys或单或双at-lxa4mg-lys-lys。
在实施方案中,式iv的化合物是选自rve1ca-lys-lys、at-rve1ca-lys-lys、lxa4ca-lys-lys和at-lxa4ca-lys-lys的单或双spmca-二赖氨酸盐化合物。
在实施方案中,式iv的化合物是单或双rve1calys-lys或单或双at-rve1calys-lys。
在实施方案中,式iv的化合物是单或双lxa4ca-lys-lys或单或双at-lxa4ca-lys-lys。
在实施方案中,式iv的化合物是选自rve1zn-lys-lys、at-rve1zn-lys-lys、lxa4zn-lys-lys和at-lxa4zn-lys-lys的单或双spmzn-二赖氨酸盐化合物。
在实施方案中,式iv的化合物是单或双rve1znlys-lys或单或双at-rve1znlys-lys。
在实施方案中,式iv的化合物是单或双lxa4zn-lys-lys或单或双at-lxa4zn-lys-lys。
在表5中提供式iv的示例性化合物。在实施方案中,式iv的化合物选自表5的化合物1-3,6-8,41-43,46-48,51-53和56-58(e系列)。在实施方案中,式iv的化合物选自表5的化合物1-3、6-8、11-13、16-18、21-23、26-28、31-33、和36-38。在实施方案中,式iv的化合物选自表5的化合物1-3和6-8(rve1和at-rve1实施方案)。在实施方案中,式iv的化合物选自表5的化合物11-13和16-18(lxa4和at-lxa4实施方案)。在实施方案中,式iv的化合物选自表5的化合物21-23和26-28(rvd1和at-rvd1实施方案)。
spm组分
如本文所用,术语“spm”用于指spm,例如保护素和消退素,以及脂氧素和阿司匹林触发的脂质介质(例如,阿司匹林触发的脂氧素和保护素)。这些分子描述于例如us5,441,951和us8,119,691(脂氧素和阿司匹林触发的脂氧素),us6,670,396(阿司匹林触发的脂质介质),us2006-0293288(消退素),us7,378,444和us7,595,341(衍生自ω-3脂肪酸的脂质介质的类似物)。
可用于形成本文描述的化合物和组合物的spm组分的spm分子的一些具体实例包括:衍生自花生四烯酸(aa)的介质(表1),衍生自二十碳五烯酸(epa)的介质(表2);衍生自二十二碳六烯酸(dha)的介质(表3);和阿司匹林触发的介质(表4)。
在实施方案中,本文描述的化合物或组合物的spm组分选自花生四烯酸(aa)衍生的脂质介质。在实施方案中,aa衍生的脂质介质选自脂氧素a4或脂氧素b4。
在实施方案中,本文描述的化合物或组合物的spm组分选自二十碳五烯酸(epa)衍生的脂质介质。在实施方案中,epa衍生的脂质介质选自脂氧素a5、脂氧素b5、消退素e1、消退素e2和消退素e3。
在实施方案中,本文描述的化合物或组合物的spm组分选自二十二碳六烯酸(dha)衍生的脂质介质。在实施方案中,dha衍生的脂质介质选自消退素d1、消退素d2、消退素d3、消退素d4、消退素d5、消退素d6、保护素d1和保护素dx。
在实施方案中,本文描述的化合物或组合物的spm组分选自阿司匹林触发的脂质介质。在实施方案中,阿司匹林触发的脂质介质选自15-epi-脂氧素a4、15-epi-脂氧素b4、阿司匹林触发的消退素d1,阿司匹林触发的消退素d2,阿司匹林触发的消退素d3,阿司匹林触发的消退素d4,阿司匹林触发的消退素d5,阿司匹林触发的消退素d6和阿司匹林触发的保护素d1。在实施方案中,阿司匹林触发的脂质介质选自at-rve1,at-rve2和at-rve3。
在实施方案中,本文描述的化合物或组合物的spm组分选自表1、表2、表3或表4中列出的化合物。
在某些实施方案中,本发明提供本文所述的化合物的溶剂化物。“溶剂化物”是指通过非共价键与另一个分子(例如极性溶剂)结合的盐的形式。这种溶剂化物通常是结晶固体,其具有基本上固定的溶质和溶剂的摩尔比。当溶剂是水时,形成的溶剂化物是水合物。水合物的实例包括半水合物、一水合物、二水合物等。
在实施方案中,本发明提供本文所述的化合物的结晶形式。在一个实施方案中,本发明提供本文所述的离子盐的多晶型物。
物理性质
与游离spm相比,本文所述的化合物和包含其的组合物具有有利的化学和物理性质。例如,在实施方案中,与相应的游离spm相比,本文描述的化合物可以对化学降解稳定。在实施方案中,所述化合物对化学降解(包括氧化降解)稳定。在实施方案中,所述化合物对通过暴露于空气、氧和湿气引起的降解稳定,如通过物理性质(例如流动性质)或化学性质中缺乏变化所证明,例如通过光谱技术例如核磁共振(nmr)或高压液相色谱(hplc)测量。在实施方案中,通过在2、4或8周后缺乏化学降解证明增加的稳定性。在实施方案中,与游离spm相比,本文所述的化合物对化学降解稳定,如在2或8周时缺乏降解产物所证明。
在实施方案中,化合物是物理上固体的、自由流动的物质,适于配制成固体剂型,例如粉末、片剂、胶囊或囊片。此外,本发明的化合物和组合物可以容易地与其他生物活性剂在固体剂型中组合,例如通过物理混合。
药代动力学性质
在实施方案中,本文描述的化合物表现出非常有利的药代动力学性质。例如,在实施方案中,化合物在口服或肠胃外(包括经由静脉内、动脉内或肌肉内注射)施用后在血液或血清中提供可检测水平的游离spm,如下文实施例中更详细讨论的。在实施方案中,配制成口服剂型的本发明的化合物向血液/血清递送比用口服施用例如游离spm本身可实现的更高量的游离spm组分。
组合物
本公开提供包含一种或多种本文所述的化合物的组合物,包括含有本文所述的两种或更多种不同化合物的混合物的组合物。在实施方案中,本文所述的化合物或化合物的混合物可以配制成药物组合物,或配制成食品添加剂或补充剂,这意味着制剂中的化合物本身和任何添加剂或赋形剂适合于施用到人或动物。在实施方案中,组合物是药物组合物。在实施方案中,组合物是非药物组合物。
包含一种或多种本发明的化合物的组合物可以配制成适于口服递送的固体或液体剂型。口服剂型可以是固体形式,例如片剂,含有颗粒、液体或粉末的胶囊,锭剂(包括液体填充的),树胶或凝胶。在一个实施方案中,剂型是固体口服剂型。在实施方案中,组合物是适合于在水性液体中重构的粉末。例如,这种粉末可用于制备适于胃肠外施用的液体,例如经由静脉内、肌肉内或腹膜内注射。
在实施方案中,可将包含一种或多种本文所述的化合物的组合物配制成适于直肠递送的剂型。在实施方案中,适于直肠递送的剂型是软膏、栓剂或灌肠剂。在实施方案中,剂型适于每天递送一次。在实施方案中,固体剂型适于每天递送两次。
在实施方案中,包含式i-iv中任一的化合物的组合物可以是该化合物的单位剂量的形式。在实施方案中,单位剂量是片剂、胶囊、栓剂或灌肠剂的形式。在实施方案中,单位剂量含有1微克(μg)至50毫克(mg)的spm,其形成式i、ii、iii或iv的化合物的spm组分。在实施方案中,化合物是式i或iv的化合物。在实施方案中,单位剂量含有1、5、10、25、50、100、250或500微克的spm。在实施方案中,单位剂量含有1、5、10或20毫克的spm。
在式i的实施方案中,化合物的spm组分由50%至75重量%spm组成。在式i的实施方案中,化合物是赖氨酰赖氨酸的单spm盐,spm是e系列消退素且spm占化合物的50-60重量%。在式i的实施方案中,化合物是双盐且spm占化合物的60-75重量%。根据前述实施方案的任一个,e系列消退素可以选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。
在式i的实施方案中,化合物的spm组分由50%至75重量%spm组成。在式i的实施方案中,化合物是赖氨酰赖氨酸的单spm盐,spm选自rvd1,rvd2,rve1,pdx,lxa4,at-pd1,at-rvd1,at-rvd2,at-lxa4和at-rve1,且spm占化合物的50-60重量%。在式i的实施方案中,化合物是双盐且spm占化合物的60-75重量%。
在式iv的实施方案中,化合物的spm组分由50%至75重量%spm组成。在式iv的实施方案中,化合物是e系列spm的双spm二赖氨酸镁盐(mg-lys-lys),且spm占化合物的60-75重量%。在spm是单盐的实施方案中,spm占化合物的约50-60重量%。在实施方案中,spm选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且spm占化合物的约65重量%。在实施方案中,spm选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3且spm占化合物的约70重量%。
在式iv的实施方案中,化合物的spm组分由50%至75重量%spm组成。在式iv的实施方案中,化合物是选自rvd1、rvd2、rve1、pdx、lxa4、at-pd1、at-rvd1、at-rvd2、at-lxa4和at-rve1的spm的双spm二赖氨酸镁(mg-lys-lys)盐且spm占化合物的60-75重量%。在其中spm是单盐的实施方案中,spm占化合物的约50-60重量%。在实施方案中,spm是rve1或at-rve1且spm占化合物的约65重量%。在实施方案中,spm是rvd1、rvd2、at-rvd1或at-rvd2,且spm占化合物的约70重量%。
本文描述的化合物可以单独配制或与一种或多种另外的活性药物成分(api)或生物活性剂组合配制。还提供包含一种或多种本文所述的化合物或其混合物、以及第二活性剂的组合物。在实施方案中,第二活性剂是生物活性剂或活性药物成分(api)。在实施方案中,本文描述的化合物与一种或多种另外的api或生物活性剂以单一剂型配制。在实施方案中,剂型是固体或液体剂型。在实施方案中,固体剂型是适于在水性介质中重构的粉末。在实施方案中,固体剂型是软膏、栓剂或灌肠剂。
取决于组成本文描述的组合物的化合物和赋形剂的性质,该组合物可适用于药物或兽医用途,或适用于膳食添加剂或补充剂,或这些用途的任何组合。到在以下部分中作为“药物组合物”或“添加剂和补充剂”讨论的各种组合物的程度,这些术语不表示限制性的,仅是描述性的。
可以使用一种或多种合适的赋形剂或载体配制本文所述的组合物。合适的赋形剂或载体是适合于人或动物用途的赋形剂或载体。术语“赋形剂”是指除了载体之外在组合物中服务于某目的的添加剂,例如作为稳定剂、掩味剂(例如甜味剂)、增溶剂或悬浮剂。通常,载体将服务于作为简单的载体或稀释剂和赋形剂的双重目的。因此,药学上可接受的赋形剂的实例可包括载体。用于本发明的组合物的赋形剂的非限制性实例包括无菌液体,水,缓冲盐水,乙醇,多元醇(例如甘油、丙二醇、液体聚乙二醇等),油,洗涤剂,悬浮剂,碳水化合物(例如葡萄糖、乳糖、蔗糖或葡聚糖),抗氧化剂(例如抗坏血酸或谷胱甘肽),螯合剂,低分子量蛋白质及其合适的混合物。
合适的赋形剂或载体通常是药学上可接受的载体或赋形剂,用于动物或人(或二者)。术语“药学上可接受的”表示由联邦或州政府的管理机构批准或在美国药典或其他一般公认的药典如欧洲药典中列出的、用于动物(且更特别地,人)。在本发明的药物组合物的语境中,“载体”是指例如溶剂、稀释剂或媒介物,本发明的离子盐与其一起配制用于递送。用于本发明的组合物的药学上可接受的载体的实例包括但不限于:用于液体剂型的无菌水性和非水性液体,水,缓冲盐水,乙醇,多元醇(例如甘油、丙二醇、液体聚乙二醇等)和油;或用于固体剂型的碳水化合物(例如葡萄糖、乳糖、蔗糖或葡聚糖)。
本文描述的化合物可以以任何合适的形式配制,并用于任何合适的预期施用途径。通常,剂型至少部分地由预期的施用途径决定。在实施方案中,本文描述的化合物是通过口服、直肠或肠胃外途径施用的制剂。
在一个实施方案中,剂型是适于施用到眼睛的液体。制剂可以是适于眼部施用、例如适合于局部施用到眼的溶液、悬浮液或凝胶,也称为眼科制剂。
在一个实施方案中,眼科制剂是水性制剂。在一个实施方案中,眼科制剂包含甘油、羟丙甲纤维素、丙二醇或聚乙二醇中的一种或多种。在一个实施方案中,眼科制剂还包含聚山梨醇酯80、卡波姆共聚物a型、纯净水、氢氧化钠、抗坏血酸、苯扎氯铵、硼酸、右旋糖、磷酸二钠、甘氨酸、氯化镁、氯化钾、硼酸钠、氯化钠、柠檬酸钠、乳酸钠、乙二胺四乙酸二钠、盐酸、氢氧化钠、氨基甲基丙醇、羟丙基瓜尔胶、聚季铵盐-i或山梨糖醇中的一种或多种。
在一个实施方案中,眼科制剂包含表面活性剂、张力剂、缓冲液、防腐剂、共溶剂和增粘剂中的一种或多种。可以采用各种张力剂来调节组合物的张力,优选至用于眼科组合物的天然泪液的张力。例如,可以向组合物中加入氯化钠、氯化钾、氯化镁、氯化钙、右旋糖和/或甘露醇以接近生理学张力。优选地,张力剂以足以使最终组合物具有眼科上可接受的同渗重摩(通常约150-450mosm,优选250-350mosm)的量存在。可以向组合物中加入适当的缓冲体系(例如磷酸钠、乙酸钠、柠檬酸钠、硼酸钠或硼酸)以防止在储存条件下ph漂移。具体浓度将根据所用的试剂而变化。然而,优选地,将选择缓冲液以将目标ph维持在ph6-7.5的范围内。
制备这些制剂或组合物的方法包括使本发明的化合物与载体和任选的一种或多种辅助成分缔合的步骤。通常,通过将本发明的化合物与液体载体均匀且紧密地缔合来制备制剂。
在实施方案中,组合物是药物组合物,其包含:本文所述的化合物或其任何混合物,和任选的药学上可接受的载体和/或赋形剂。在实施方案中,组合物还包含另外的活性剂,例如api,如下所述。
在一个实施方案中,提供固体剂型,其包含与一种或多种另外的活性药物成分(api)物理混合的本发明的化合物。在实施方案中,一种或多种另外的api是抗高血脂试剂、抗糖尿病试剂、抗癫痫试剂或抗炎试剂。在一个实施方案中,api是抗高血脂试剂或抗糖尿病试剂。在一个实施方案中,抗高血脂试剂选自hmgcoa酶抑制剂(例如他汀类)、胆固醇吸收抑制剂和胆固醇酯酶转移蛋白(cetp)抑制剂。在一个实施方案中,抗高血脂试剂是他汀类。在一个实施方案中,他汀类选自阿托伐他汀、瑞舒伐他汀(risuvostatin)、辛伐他汀、普伐他汀及其药学上可接受的盐或前药。在一个实施方案中,他汀类以5mg至100mg范围的量存在。在一个实施方案中,他汀类是普伐他汀。在一个实施方案中,抗高血脂试剂是胆固醇吸收抑制剂。在一个实施方案中,胆固醇吸收抑制剂是依泽替米贝,也称为zetia。在一个实施方案中,抗高血脂试剂是cetp抑制剂。在一个实施方案中,cetp抑制剂是anacetrapib,或其水合物或溶剂化物。
包含本文所述的化合物及其混合物的药物组合物可用于治疗对用spm、其衍生物和类似物治疗有反应的各种疾病和障碍的方法。以下更详细地描述这些用途。
经肠制剂
在实施方案中,将包含本文所述的化合物及其混合物的药物组合物配制成经肠剂型。在实施方案中,经肠剂型选自口服或直肠制剂。口服制剂可以是例如片剂、溶液、悬浮液或乳液的形式。直肠制剂可以是例如软膏、栓剂或灌肠剂的形式。
肠胃外制剂
在实施方案中,将包含本文所述的化合物及其混合物的药物组合物配制成肠胃外剂型。在实施方案中,肠胃外剂型选自静脉内剂型、动脉内剂型或肌肉内剂型。根据这些实施方案中的任一个,剂型可以是透明水溶液的形式或冻干固体的形式,例如包含在容器(例如小瓶或安瓿)中,其适于用特定量的无菌水或水性缓冲液重构,用于通过肠胃外途径例如静脉内、动脉内或肌肉内施用。
眼科制剂
在实施方案中,本文所述的化合物可用于治疗或改善眼部疾病或障碍的一种或多种症状,如下文更详细描述。因此,本发明提供在适合于对眼睛局部施用的药物组合物(也称为眼科制剂)中的式i-vi中任一的化合物。制剂可以是适于眼部施用的溶液、悬浮液或凝胶。
在一个实施方案中,眼科制剂是水性制剂。在一个实施方案中,眼科制剂包含甘油、羟丙甲纤维素、丙二醇或聚乙二醇中的一种或多种。在一个实施方案中,眼科制剂还包含聚山梨醇酯80、卡波姆共聚物a型、纯净水、氢氧化钠、抗坏血酸、苯扎氯铵、硼酸、右旋糖、磷酸二钠、甘氨酸、氯化镁、氯化钾、硼酸钠、氯化钠、柠檬酸钠、乳酸钠、乙二胺四乙酸二钠、盐酸、氢氧化钠、氨基甲基丙醇、羟丙基瓜尔胶、聚季铵盐-i或山梨糖醇中的一种或多种。
在一个实施方案中,眼科制剂包含表面活性剂、张力剂、缓冲液、防腐剂、共溶剂和增粘剂中的一种或多种。可以采用各种张力剂来调节组合物的张力,优选至用于眼科组合物的天然泪液的张力。例如,可以向组合物中加入氯化钠、氯化钾、氯化镁、氯化钙、右旋糖和/或甘露醇以接近生理学张力。优选地,张力剂以足以使最终组合物具有眼科上可接受的同渗重摩(通常约150-450mosm,优选250-350mosm)的量存在。可以向组合物中加入适当的缓冲体系(例如磷酸钠、乙酸钠、柠檬酸钠、硼酸钠或硼酸)以防止在储存条件下ph漂移。具体浓度将根据所用的试剂而变化。然而,优选地,选择缓冲液以将目标ph维持在ph6-7.5的范围内。
配制用于治疗干眼型疾病和障碍的组合物还可包含水性载体,其设计用于立即、短期缓解干眼型病症。这些载体可以配制成磷脂载体或人工泪液载体,或二者的混合物。如本文所用,“磷脂载体”和“人工泪液载体”是指水性组合物,其中:(i)包含一种或多种磷脂(在磷脂载体的情况下)或其他化合物,其润滑,“润湿”,接近内源性泪液的稠度,有助于自然泪液积聚,或者在眼部施用时提供干眼症状和病症的暂时缓解;(ii)安全;和(iii)提供用于局部施用有效量的一种或多种本发明的脂肪酸盐的适当的递送媒介物。
可用作人工泪液载体的实例或人工泪液组合物包括但不限于商业产品,例如tearsnaturale™,tearsnaturalen™,tearsnaturalefree™,和biontears™(alconlaboratories,inc.,fortworth,tex.)。磷脂载体制剂的实例包括美国专利号4,804,539(guo等人)、4,883,658(holly)、4,914,088(glonek)、5,075,104(gressel等人)、5,278,151(korb等人)、5,294,607(glonek等人)、5,371,108(korb等人)、5,578,586(gionek等人)中公开的那些;上述专利通过引用至它们公开可用作本发明的磷脂载体的磷脂组合物的程度而并入本文。
意在润滑,“润湿”,接近内源性泪液的稠度,有助于自然泪液积聚,或者在眼部施用时提供干眼症状和病症的暂时缓解的其他化合物在本领域是已知的。这些化合物可以增强组合物的粘度,且包括但不限于:单体多元醇,例如甘油、丙二醇、乙二醇;聚合多元醇,如聚乙二醇、羟丙基甲基纤维素(“hpmc”)、羧甲基纤维素钠、羟丙基纤维素(“hpc”)、葡聚糖(如葡聚糖70);水溶性蛋白质,如明胶;和乙烯基聚合物,如聚乙烯醇、聚乙烯吡咯烷酮、聚维酮和卡波姆(如卡波姆934p、卡波姆941、卡波姆940、卡波姆974p)。
粘度增强剂的实例包括但不限于:多糖,如透明质酸及其盐、硫酸软骨素及其盐、葡聚糖、纤维素家族的各种聚合物;乙烯基聚合物;和丙烯酸聚合物。通常,磷脂载体或人工泪液表现出1至400厘泊(“cps”)的粘度。局部眼科产品通常以多剂量形式包装。在使用期间可能需要防腐剂来防止微生物污染。合适的防腐剂包括苯扎氯铵、氯丁醇、苯度溴铵、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯乙醇、乙二胺四乙酸二钠、山梨酸、聚季铵盐-1或本领域技术人员已知的其他试剂。这些防腐剂通常以0.001至1.0%w/v的水平使用。本发明的单位剂量组合物是无菌的,但通常是未防腐的。因此,这种组合物通常将不含防腐剂。
其他润湿剂、乳化剂和润滑剂(例如十二烷基硫酸钠和硬脂酸镁),以及着色剂、隔离剂(releaseagent)、包衣剂和加香剂、防腐剂和抗氧化剂也可以存在于组合物中。
药学上可接受的抗氧化剂的实例包括:水溶性抗氧化剂,例如抗坏血酸、半胱氨酸盐酸盐、硫酸氢钠、偏亚硫酸氢钠、亚硫酸钠等;油溶性抗氧化剂,如抗坏血酸棕榈酸酯、丁基化羟基苯甲醚(bha)、丁基化羟基甲苯(bht)、卵磷脂、没食子酸丙酯、α-生育酚等;和金属螯合剂,如柠檬酸、乙二胺四乙酸(edta)、山梨糖醇、酒石酸、磷酸等。
隐形眼镜可任选地用于允许血管活性物质在更长时间段内外渗。血管活性物质如凝血酶和血栓素a可经由小静脉的血管收缩进一步诱导泪液体积增加,并通过泪腺、附属泪腺和表面微脉管增加灌注;其中增加毛细血管渗透性的增加的细胞旁内皮开口可以进一步增强这种益处。
制备这些制剂或组合物的方法包括使本发明的化合物与载体和任选的一种或多种辅助成分缔合的步骤。通常,通过将本发明的化合物与液体载体均匀且紧密地缔合来制备制剂。
药物用途
本文所述的化合物和组合物可用于治疗以过度炎症为特征的疾病和障碍的方法。例如,本文所述的化合物和组合物可用于治疗以过度炎症为特征的慢性疾病,包括胃肠疾病和障碍、感染性疾病、肺部和血管疾病和障碍、代谢疾病和障碍以及神经病学疾病和障碍。因此,本公开提供治疗以过度炎症为特征的疾病或障碍的方法,该方法包括向有此需要的受试者、优选人受试者施用有效于治疗该疾病或障碍的量的式i、ii、iii、iv的化合物。根据本文所述的方法的任何实施方案,化合物可以以药物组合物、或兽医用组合物、或营养添加剂或补充剂的形式施用。
在实施方案中,本公开提供治疗选自炎症性肠病(ibd)、溃疡性结肠炎、克罗恩病、直肠炎、结肠袋炎、结肠袋克罗恩病、嗜酸细胞性结肠炎、淋巴细胞性结肠炎、胶原性结肠炎、转移性结肠炎、化学结肠炎、缺血性结肠炎、感染性结肠炎、伪膜性结肠炎和不确定性结肠炎的胃肠疾病或障碍的方法,该方法包括施用有效于治疗该疾病或障碍的量的式i-iv的化合物。在实施方案中,所述疾病或障碍是选自溃疡性结肠炎、克罗恩病、直肠炎、结肠袋炎、结肠袋克罗恩病、嗜酸细胞性结肠炎、淋巴细胞性结肠炎、胶原性结肠炎、转移性结肠炎、化学性结肠炎和缺血性结肠炎的ibd相关的疾病或障碍。在实施方案中,ibd相关的疾病或障碍是溃疡性结肠炎或克罗恩病。在实施方案中,ibd相关的疾病或障碍是结肠袋炎。
在实施方案中,本公开提供治疗选自肠梗阻、慢性胰腺炎、结肠炎、结肠癌、先天性胃肠异常、腹裂、高输出性瘘、肠外营养相关肝病、术后肠梗阻(poi)、术后肠道炎症、短肠综合征和散发性息肉病的胃肠疾病或障碍的方法。
在实施方案中,胃肠疾病或障碍是如上所述的ibd相关的疾病或障碍。在实施方案中,本公开提供通过向有此需要的人类患者施用式i-iv的化合物来治疗ibd相关的疾病或障碍的方法。在实施方案中,化合物是式i或iv的化合物。
在本文所述的方法的实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,化合物选自单或双rve1赖氨酰-赖氨酸,单或双at-rve1赖氨酰-赖氨酸,单或双rve2赖氨酰-赖氨酸,单或双at-rve2赖氨酰-赖氨酸,单或双rve3赖氨酰-赖氨酸,和单或双at-rve3赖氨酰-赖氨酸。
在实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是上述的ibd相关的疾病或障碍。在实施方案中,ibd相关的疾病或障碍是溃疡性结肠炎或克罗恩病。在实施方案中,ibd相关的疾病或障碍是结肠袋炎。
在实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自嗜酸细胞性食管炎、白塞氏病、肠易激综合征、乳糜泻、肠粘膜炎、憩室炎和短肠综合征的胃肠疾病或障碍。在实施方案中,胃肠疾病或障碍是肠粘膜炎。
在实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自皮炎、糖尿病伤口、湿疹、瘙痒、愈合伤口、痤疮和类固醇诱导的红斑痤疮的皮肤病学疾病或障碍。在实施方案中,皮肤病学疾病或障碍选自皮炎、湿疹、瘙痒、痤疮和类固醇诱导的红斑痤疮。
在实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自哮喘、缺血再灌注损伤、莱姆关节炎、牙周炎、腹膜炎、牛皮癣、类风湿性关节炎、硬皮病、口腔粘膜炎、口腔炎、唇炎、舌炎、干燥综合征和全身性炎症反应综合征的炎症性疾病或障碍。在实施方案中,炎症性疾病或障碍选自哮喘、牛皮癣、硬皮病和口腔粘膜炎。
在实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自术后谵妄、急性术后疼痛、纤维肌痛、子宫内膜异位症、外阴痛、慢性下背痛、骨关节炎相关疼痛的治疗或管理、糖尿病周围神经病和肌肉骨骼损伤或创伤的神经病学疾病或障碍。
在本文所述的方法的实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,化合物选自单或双rve1线性赖氨酰-赖氨酸,单或双at-rve1线性赖氨酰-赖氨酸,单或双rve2线性赖氨酰-赖氨酸,单或双at-rve2线性赖氨酰-赖氨酸,单或双rve3线性赖氨酰-赖氨酸,和单或双at-rve3线性赖氨酰-赖氨酸。
在实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是上述的ibd相关的疾病或障碍。在实施方案中,ibd相关的疾病或障碍是溃疡性结肠炎或克罗恩病。在实施方案中,ibd相关的疾病或障碍是结肠袋炎。
在实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自嗜酸细胞性食管炎、白塞氏病、肠易激综合征、乳糜泻、肠粘膜炎、憩室炎和短肠综合征的胃肠疾病或障碍。在实施方案中,胃肠疾病或障碍是肠粘膜炎。
在实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自皮炎、糖尿病伤口、湿疹、瘙痒、愈合伤口、痤疮和类固醇诱导的红斑痤疮的皮肤病学疾病或障碍。在实施方案中,皮肤病学疾病或障碍选自皮炎、湿疹、瘙痒、痤疮和类固醇诱导的红斑痤疮。
在实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自哮喘、缺血再灌注损伤、莱姆关节炎、牙周炎、腹膜炎、牛皮癣、类风湿性关节炎、硬皮病、口腔粘膜炎、口腔炎、唇炎、舌炎、干燥综合征和全身性炎症反应综合征的炎症性疾病或障碍。在实施方案中,炎症性疾病或障碍选自哮喘、牛皮癣、硬皮病和口腔粘膜炎。
在实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自术后谵妄、急性术后疼痛、纤维肌痛、子宫内膜异位症、外阴痛、慢性下背痛、骨关节炎相关疼痛的治疗或管理、糖尿病周围神经病和肌肉骨骼损伤或创伤的神经病学疾病或障碍。
在本文所述的方法的实施方案中,施用的化合物选自式iv的镁、钙或锌二赖氨酸盐,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3。在实施方案中,化合物选自单或双rve1mg二赖氨酸盐,单或双at-rve1mg二赖氨酸盐,单或双rve2mg二赖氨酸盐,单或双at-rve2mg二赖氨酸盐,单或双rve3mg二赖氨酸盐,和单或双at-rve3mg二赖氨酸盐。
在实施方案中,施用的化合物选自式iv的镁、钙或锌二赖氨酸盐,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是上述的ibd相关的疾病或障碍。在实施方案中,ibd相关的疾病或障碍是溃疡性结肠炎或克罗恩病。在实施方案中,ibd相关的疾病或障碍是结肠袋炎。
在实施方案中,施用的化合物选自式iv的镁、钙或锌二赖氨酸盐,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自嗜酸细胞性食管炎、白塞氏病、肠易激综合征、乳糜泻、肠粘膜炎、憩室炎和短肠综合征的胃肠疾病或障碍。在实施方案中,胃肠疾病或障碍是肠粘膜炎。
在实施方案中,施用的化合物选自式iv的镁、钙或锌二赖氨酸盐,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自皮炎、糖尿病伤口、湿疹、瘙痒、愈合伤口、痤疮和类固醇诱导的红斑痤疮的皮肤病学疾病或障碍。在实施方案中,皮肤病学疾病或障碍选自皮炎、湿疹、瘙痒、痤疮和类固醇诱导的红斑痤疮。
在实施方案中,施用的化合物选自式iv的镁、钙或锌二赖氨酸盐,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自哮喘、缺血再灌注损伤、莱姆关节炎、牙周炎、腹膜炎、牛皮癣、类风湿性关节炎、硬皮病、口腔粘膜炎、口腔炎、唇炎、舌炎、干燥综合征和全身性炎症反应综合征的炎症性疾病或障碍。在实施方案中,炎症性疾病或障碍选自哮喘、牛皮癣、硬皮病和口腔粘膜炎。
在实施方案中,施用的化合物选自式iv的镁、钙或锌二赖氨酸盐,其中a和b相同且选自e系列消退素;在实施方案中,e系列消退素选自rve1,rve2,rve3,at-rve1,at-rve2和at-rve3,且疾病或障碍是选自术后谵妄、急性术后疼痛、纤维肌痛、子宫内膜异位症、外阴痛、慢性下背痛、骨关节炎相关疼痛的治疗或管理、糖尿病周围神经病和肌肉骨骼损伤或创伤的神经病学疾病或障碍。
在本文所述的方法的实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-lxa4和at-rve1。在实施方案中,化合物选自单或双rve1赖氨酰赖氨酸,单或双at-rve1赖氨酰赖氨酸,单或双lxa4赖氨酰赖氨酸,单或双at-lxa4赖氨酰赖氨酸,单或双rvd1赖氨酰赖氨酸,单或双at-rvd1赖氨酰赖氨酸,单或双rvd2赖氨酰赖氨酸,单或双at-rvd2赖氨酰赖氨酸,单或双pdx赖氨酰赖氨酸。在实施方案中,化合物选自单或双rve1赖氨酰赖氨酸,单或双at-rve1赖氨酰赖氨酸,单或双lxa4赖氨酰赖氨酸和单或双at-lxa4赖氨酰赖氨酸。
在实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是如上所述的ibd相关的疾病或障碍。在实施方案中,ibd相关的疾病或障碍是溃疡性结肠炎或克罗恩病。在实施方案中,ibd相关的疾病或障碍是结肠袋炎。
在实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是胃肠疾病或障碍,其选自嗜酸细胞性食管炎、白塞氏病、肠易激综合征、乳糜泻、肠粘膜炎、憩室炎和短肠综合征。在实施方案中,胃肠疾病或障碍是肠粘膜炎。
在实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是选自皮炎、糖尿病伤口、湿疹、瘙痒、愈合伤口、痤疮和类固醇诱导的红斑痤疮的皮肤病学疾病或障碍。在实施方案中,皮肤病学疾病或障碍选自皮炎、湿疹、瘙痒、痤疮和类固醇诱导的红斑痤疮。
在实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是选自哮喘、缺血再灌注损伤、莱姆关节炎、牙周炎、腹膜炎、牛皮癣、类风湿性关节炎、硬皮病、口腔粘膜炎、口腔炎、唇炎、舌炎、干燥综合征和全身性炎症反应综合征的炎症性疾病或障碍。在实施方案中,炎症性疾病或障碍选自哮喘、牛皮癣、硬皮病和口腔粘膜炎。
在实施方案中,施用的化合物选自式i的赖氨酰-赖氨酸二肽,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是选自术后谵妄、急性术后疼痛、纤维肌痛、子宫内膜异位症、外阴痛、慢性下背痛、骨关节炎相关疼痛的治疗或管理、糖尿病周围神经病和肌肉骨骼损伤或创伤的神经病学疾病或障碍。
在本文所述的方法的实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-lxa4和at-rve1。在实施方案中,化合物选自单或双rve1线性赖氨酰赖氨酸,单或双at-rve1线性赖氨酰赖氨酸,单或双lxa4线性赖氨酰赖氨酸,单或双at-lxa4线性赖氨酰赖氨酸,单或双rvd1线性赖氨酰赖氨酸,单或双at-rvd1线性赖氨酰赖氨酸,单或双rvd2线性赖氨酰赖氨酸,单或双at-rvd2线性赖氨酰赖氨酸,单或双pdx线性赖氨酰赖氨酸。在实施方案中,化合物选自单或双rve1线性赖氨酰赖氨酸,单或双at-rve1线性赖氨酰赖氨酸,单或双lxa4线性赖氨酰赖氨酸,和单或双at-lxa4线性赖氨酰赖氨酸。
在实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是如上所述的ibd相关的疾病或障碍。在实施方案中,ibd相关的疾病或障碍是溃疡性结肠炎或克罗恩病。在实施方案中,ibd相关的疾病或障碍是结肠袋炎。
在实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是选自嗜酸细胞性食管炎、白塞氏病、肠易激综合征、乳糜泻、肠粘膜炎、憩室炎和短肠综合征的胃肠疾病或障碍。在实施方案中,胃肠疾病或障碍是肠粘膜炎。
在实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是选自皮炎、糖尿病伤口、湿疹、瘙痒、愈合伤口、痤疮和类固醇诱导的红斑痤疮的皮肤病学疾病或障碍。在实施方案中,皮肤病学疾病或障碍选自皮炎、湿疹、瘙痒、痤疮和类固醇诱导的红斑痤疮。
在实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是选自哮喘、缺血再灌注损伤、莱姆关节炎、牙周炎、腹膜炎、牛皮癣、类风湿性关节炎、硬皮病、口腔粘膜炎、口腔炎、唇炎、舌炎、干燥综合征和全身性炎症反应综合征的炎症性疾病或障碍。在实施方案中,炎症性疾病或障碍选自哮喘、牛皮癣、硬皮病和口腔粘膜炎。
在实施方案中,施用的化合物选自式iii的线性赖氨酰-赖氨酸二肽,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是选自术后谵妄、急性术后疼痛、纤维肌痛、子宫内膜异位症、外阴痛、慢性下背痛、骨关节炎相关疼痛的治疗或管理、糖尿病周围神经病和肌肉骨骼损伤或创伤的神经病学疾病或障碍。
在本文所述的方法的实施方案中,施用的化合物选自式iv的二赖氨酸镁、二赖氨酸钙或二赖氨酸锌,其中a和b相同且选自rvd1、rvd2、rve1、pdx、lxa4、at-rvd1、at-rvd2、at-lxa4和at-rve1。在实施方案中,化合物选自单或双rve1mg-二赖氨酸盐,单或双at-rve1mg-二赖氨酸盐,单或双lxa4mg-二赖氨酸盐,单或双at-lxa4mg-二赖氨酸盐,单或双rvd1mg-二赖氨酸盐,单或双at-rvd1mg-二赖氨酸盐,单或双rvd2mg-二赖氨酸盐,单或双at-rvd2mg-二赖氨酸盐和单或双pdxmg-二赖氨酸盐。在实施方案中,化合物选自单或双rve1mg-二赖氨酸盐,单或双at-rve1mg-二赖氨酸盐,单或双lxa4mg-二赖氨酸盐,和单或双at-lxa4mg-二赖氨酸盐。
在实施方案中,施用的化合物选自式iv的二赖氨酸镁、二赖氨酸钙或二赖氨酸锌,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是如上所述的ibd相关的疾病或障碍。在实施方案中,ibd相关的疾病或障碍是溃疡性结肠炎或克罗恩病。在实施方案中,ibd相关的疾病或障碍是结肠袋炎。
在实施方案中,施用的化合物选自式iv的二赖氨酸镁、二赖氨酸钙或二赖氨酸锌,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是选自嗜酸细胞性食管炎、白塞氏病、肠易激综合征、乳糜泻、肠粘膜炎、憩室炎和短肠综合征的胃肠疾病或障碍。在实施方案中,胃肠疾病或障碍是肠粘膜炎。
在实施方案中,施用的化合物选自式iv的二赖氨酸镁、二赖氨酸钙或二赖氨酸锌,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是选自皮炎、糖尿病伤口、湿疹、瘙痒、愈合伤口,痤疮和类固醇诱导的红斑痤疮的皮肤病学疾病或障碍。在实施方案中,皮肤病学疾病或障碍选自皮炎、湿疹、瘙痒、痤疮和类固醇诱导的红斑痤疮。
在实施方案中,施用的化合物选自式iv的二赖氨酸镁、二赖氨酸钙或二赖氨酸锌,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是选自哮喘、缺血再灌注损伤、莱姆关节炎、牙周炎、腹膜炎、牛皮癣、类风湿性关节炎、硬皮病、口腔粘膜炎、口腔炎、唇炎、舌炎、干燥综合征和全身性炎症反应综合征的炎症性疾病或障碍。在实施方案中,炎症性疾病或障碍选自哮喘、牛皮癣、硬皮病和口腔粘膜炎。
在实施方案中,施用的化合物选自式iv的二赖氨酸镁、二赖氨酸钙或二赖氨酸锌,其中a和b相同且选自rve1、lxa4、at-lxa4和at-rve1,且疾病或障碍是选自术后谵妄、急性术后疼痛、纤维肌痛、子宫内膜异位症、外阴痛、慢性下背痛、骨关节炎相关疼痛的治疗或管理、糖尿病周围神经病和肌肉骨骼损伤或创伤的神经病学疾病或障碍。
以下描述另外的用途。
在本文所述的方法的语境中,术语“治疗”或“有效于治疗”可以指与所治疗的疾病或障碍相关的一种或多种症状的改善或稳定。术语“治疗”还可以包括疾病或障碍的管理,指的是受试者源自不会导致潜在疾病或障碍的治愈的疗法的有益效果。本发明的组合物还可用于预防某些疾病、障碍和病症。在该语境中,术语“预防”是指预防疾病、障碍或病症的一种或多种症状的复发、发展、进展或发作。
根据本文所述的方法,将治疗有效量的本文所述的化合物施用到受试者,治疗有效量是足以治疗该疾病或障碍、或足以实现期望的治疗结果(例如改善或稳定所治疗的疾病或障碍的一种或多种症状)的化合物(或两种或更多种化合物的混合物)的量,或在预防的语境下,足以实现预防疾病、障碍或病症的一种或多种症状复发、发展、进展或发作的量。
在本发明的任何方法的语境中,受试者可以是人或非人哺乳动物。非人哺乳动物可以是,例如,非人灵长类动物、狗、猫、啮齿动物(例如小鼠、大鼠、兔子)、马、牛、绵羊、山羊、鸟、鸡或任何其他非人哺乳动物。优选地,受试者是人。
在实施方案中,受试者是人受试者。在一个实施方案中,人是成年人、儿科人或老年人,如那些术语被开业医师所理解的,例如由美国食品和药物管理局所定义的。
本文描述的化合物或组合物可用作单一疗法或辅助疗法。本发明的组合物可以单独施用或与一种或多种另外的治疗剂(即另外的api)或疗法组合施用,例如作为包括例如饮食和运动方面的治疗方案的一部分。在某些实施方案中,本发明的方法包括施用本发明的组合物作为主要疗法。在其他实施方案中,施用本发明的组合物是辅助疗法。在任一种情况下,本发明的方法预期将本发明的组合物与一种或多种另外的治疗剂和/或疗法组合施用,用于治疗或预防疾病或障碍。术语“疗法(therapy)”和“疗法(therapies)”是指可用于预防、治疗、管理或改善疾病或障碍或其一种或多种症状的任何方法、方案和/或试剂。
本文所述的化合物或组合物也可用于组合疗法。如本文所用,“组合疗法”或“共同疗法”包括施用治疗有效量的一种或多种本文所述的化合物作为特定治疗方案的一部分,旨在从所述一种或多种化合物和另外的活性剂(例如如上所述的另外的api或活性生物试剂)的共同作用提供有益效果。该组合的有益效果包括但不限于由该组合产生的药代动力学或药效学共同作用。该组合的有益效果还可以涉及与组合中的另一种试剂相关的毒性、副作用或不良事件的缓解。“组合疗法”不旨在包括:作为单独的单一疗法方案的一部分的两种或更多种化合物的施用,其偶然地且任意地产生非预期或预测的有益效果。
皮肤病学病症和障碍
在实施方案中,本公开提供通过向受试者施用有效量的式i-vi中任一的化合物或其混合物或包含其的组合物来治疗有此需要的受试者中的皮肤病学病症或障碍的方法。
在实施方案中,皮肤病学障碍是皮炎。
在实施方案中,皮肤病学病症是糖尿病伤口。
在实施方案中,皮肤病学障碍是湿疹。
在实施方案中,皮肤病学障碍是瘙痒。
在实施方案中,皮肤病学病症是愈合伤口。
在实施方案中,皮肤病学病症是痤疮。
在实施方案中,皮肤病学病症是类固醇诱导的红斑痤疮。
胃肠疾病和障碍
在实施方案中,本公开提供通过向受试者施用有效量的式i-vi中任一的化合物或其混合物或包含其的组合物来治疗有此需要的受试者中的胃肠疾病或障碍的方法。
在实施方案中,胃肠疾病或障碍选自ibd、溃疡性结肠炎、克罗恩病、直肠炎、结肠袋炎、结肠袋克罗恩病、嗜酸细胞性结肠炎、淋巴细胞性结肠炎、胶原性结肠炎、转移性结肠炎、化学性结肠炎、缺血性结肠炎、感染性结肠炎、假膜性结肠炎和不确定性结肠炎。在实施方案中,胃肠疾病或障碍选自ibd、溃疡性结肠炎和克罗恩病。
在实施方案中,胃肠疾病或障碍选自肠梗阻、慢性胰腺炎、结肠炎、结肠癌、先天性胃肠异常、腹裂、高输出性瘘、肠外营养相关肝病、术后肠梗阻、术后肠炎、短肠综合征和散发性息肉病。在实施方案中,胃肠疾病或障碍选自嗜酸细胞性食管炎、白塞氏病、肠易激综合征、乳糜泻、肠粘膜炎、nsaid肠病、肠道感染、憩室病、憩室炎、胃炎、胰腺炎、病毒性肠胃炎和惠普尔病(whipple'sdisease)。
在实施方案中,胃肠疾病或障碍是术后肠炎、术后肠梗阻或其组合。在实施方案中,胃肠道炎症性疾病或障碍是术后肠梗阻(poi)。
在优选的实施方案中,胃肠疾病或障碍是ibd,这是针对两种病况给出的术语,克罗恩病和溃疡性结肠炎,均以胃肠道的慢性炎症为特征。克罗恩病可影响胃肠道的任何部分,包括口腔和肛门,但最常见的是影响下胃肠道,尤其是回肠。溃疡性结肠炎影响大肠/结肠和直肠。在本公开中,术语“大肠”和“结肠”可互换使用。
ibd的护理治疗标准旨在通过控制胃肠道靶组织中的炎症来达到并维持缓解。在成人中,单独或与皮质类固醇结合的5氨基水杨酸盐(5-asa)可用于引起缓解。通常,施用皮质类固醇治疗进行短期症状控制,例如治疗急性发作和引起疾病症状的缓解。长期或维持疗法通常涉及使用非甾体类药物(包括5-asa)和免疫调节剂(如咪唑硫嘌呤)。
在实施方案中,本公开提供了双rve1二赖氨酸镁形式的ibd的另外的治疗,作为单一治疗或与第二ibd治疗剂的组合治疗。在实施方案中,第二ibd治疗剂选自皮质类固醇,5-asa和咪唑硫嘌呤。在实施方案中,本公开提供了用于与ibd维持疗法,任选地5-asa或咪唑硫嘌呤组合治疗ibd的方法中的双rve1二赖氨酸镁。在实施方案中,本公开提供了与5-asa,咪唑硫嘌呤和皮质类固醇中的任何一种或多种组合用于治疗ibd的方法中的双rve1二赖氨酸镁。在实施方案中,本公开提供了用于与皮质类固醇组合治疗ibd的方法中的双rve1二赖氨酸镁。根据双rve1二赖氨酸镁与皮质类固醇的组合疗法的前述实施方案,所述皮质类固醇可以选自泼尼松,泼尼松龙,布地奈德,氢化可的松和倍氯米松二丙酸酯,其中剂型是口服剂型,或选自氢化可的松,泼尼松龙和布地奈德,其中剂型适合于直肠递送,例如以灌肠剂或栓剂的形式。
由感染原引起的感染性疾病和障碍
在实施方案中,本公开提供通过向受试者施用有效量的式i-v中任一的化合物或其混合物或包含其的组合物来治疗有此需要的受试者中由感染原(例如细菌、真菌或病毒)引起的疾病或障碍的方法。
在实施方案中,疾病或障碍是细菌感染。在实施方案中,细菌感染是细菌性肺炎。在实施方案中,细菌感染是大肠杆菌感染。在实施方案中,细菌感染是结核分枝杆菌感染。
在实施方案中,疾病或障碍是酵母感染。在实施方案中,酵母感染是假丝酵母感染。
在实施方案中,疾病或障碍是败血症。在实施方案中,败血症是烧伤伤口败血症。
炎症性障碍
由于spm介导炎症消退的能力,以及本文所述的化合物递送治疗有效量的spm到需要治疗炎症的受试者的组织的能力,本文所述的化合物可特别有用于治疗具有显著炎症性组成部分的疾病和障碍。此外,本文所述的化合物和组合物可用于治疗将从炎症快速消退中受益的病症。因此,本文所述的化合物和组合物可用于促进伤口愈合,包括烧伤伤口和糖尿病伤口的愈合。可根据本文所述的方法治疗的其他病症包括慢性胰腺炎、皮炎、腹膜炎、干眼、细菌感染、脂肪组织炎症、局部侵袭性牙周炎、颞下颌关节炎、关节炎、术后疼痛、术后认知下降、内毒素休克、hsv-角膜炎、同种异体移植物排斥和心脏缺血。
在实施方案中,本公开提供通过向受试者施用有效量的式i-vi中任一的化合物或其混合物或包含其的组合物来治疗有此需要的受试者中的炎症性疾病或障碍的方法。在实施方案中,有效量有效于治疗炎症性疾病或障碍的一种或多种症状。
在实施方案中,炎症性疾病或障碍选自哮喘、缺血再灌注损伤、莱姆关节炎、牙周炎、腹膜炎、牛皮癣、类风湿性关节炎、硬皮病和全身性炎症反应综合征。
在实施方案中,炎症性疾病或障碍选自口腔粘膜炎、口腔炎、唇炎、舌炎和干燥综合征。
在实施方案中,炎症性疾病或障碍是骨关节炎或类风湿性关节炎。
在实施方案中,炎症性疾病或障碍是脂肪组织炎症。
在实施方案中,炎症性疾病或障碍是血管炎症。
在实施方案中,炎症性疾病或障碍是心脏缺血。
在实施方案中,炎症性疾病或障碍是子宫内膜异位症。
在实施方案中,炎症性疾病或障碍是口腔粘膜炎。
在实施方案中,炎症性疾病或障碍是眼系统的疾病或障碍。在实施方案中,眼系统的疾病或障碍选自眼睛的炎症性疾病、干眼综合征、黄斑水肿和视网膜病。在实施方案中,该方法是用于促进角膜伤口愈合的方法。
在实施方案中,该方法是治疗干眼的方法。干眼疾病或综合征是泪液和眼表面的多因素障碍,其特征在于干燥和刺激的症状。炎症是干眼的发展和传播的重要组成部分(stevenson等人,arch.ophthalmol.,2012,130(1),90-100;rashid等人,arch.ophthalmol,2008,126(2),219-225)。
术语“干眼”是指泪液产生不足和/或泪液组成异常。如本文定义的干眼疾病的原因包括但不限于以下:特发性、先天性无泪,眼球干燥症,泪腺消融,和感觉性去神经支配;胶原血管疾病,包括类风湿性关节炎、韦格纳肉芽肿病和系统性红斑狼疮;干燥综合征和与干燥综合征相关的自身免疫性疾病;由睑缘炎或红斑痤疮引起的脂质泪层异常;由维生素a缺乏引起的粘蛋白泪层异常;沙眼,白喉角膜结膜炎;粘膜皮肤障碍;老化;绝经期;和糖尿病。此外,术语“干眼”包括前眼科手术例如白内障手术和屈光手术后并伴有过敏性结膜炎的干眼。如本文定义的干眼综合征也可能由其他情况引起,所述情况包括但不限于以下:延长的视觉任务;在电脑上工作;在干燥的环境中;眼刺激;隐形眼镜,lasik和其他屈光手术;疲劳;和药物,如异维甲酸、镇静剂、利尿剂、三环类抗抑郁药、抗高血压药、口服避孕药、抗组胺药、鼻减充血药、β-受体阻滞剂、吩噻嗪类、阿托品和镇痛阿片剂如吗啡。
在实施方案中,该方法还包括施用本文所述的化合物与抗炎剂。在实施方案中,化合物和抗炎剂包含在相同的剂型中。
代谢疾病和障碍
在实施方案中,本公开提供通过向受试者施用有效量的式i-v中任一的化合物或其混合物或包含其的组合物来治疗有此需要的受试者中的代谢疾病或障碍的方法。在实施方案中,受试者是人,且化合物是式i或iv的化合物。
在实施方案中,代谢疾病或障碍是糖尿病(包括2型糖尿病,或前驱糖尿病)中表现出的异常葡萄糖代谢,胰岛素抗性,表现为高甘油三酯血症、即甘油三酯升高的异常脂质代谢,混合性血脂异常,高胆固醇血症,脂肪肝,和肥胖中表现出的组合的异常葡萄糖和脂质代谢;或选自高甘油三酯血症、高胆固醇血症和混合性血脂异常的血脂异常障碍。
在实施方案中,代谢疾病或障碍是胰岛素抗性、混合性血脂异常、非酒精性脂肪性肝炎(nash)、2型糖尿病、原发性胆汁综合征和原发性硬化性胆管炎。
在实施方案中,将本文描述的化合物配制成具有至少一种另外的api的单一固体剂型。在实施方案中,所述至少一种另外的api是抗高血脂试剂或抗糖尿病试剂。可以使用的抗高血脂试剂包括hmgcoa酶抑制剂(例如他汀类)、胆固醇吸收抑制剂和胆固醇酯酶转移蛋白(cetp)抑制剂。在实施方案中,抗高血脂试剂选自他汀类、胆固醇吸收抑制剂、cetp抑制剂和前述任一的药学上可接受的盐和前药。药学上可接受的盐可以选自丙酸盐、癸酸盐、辛酸盐、丙烯酸盐、甲酸盐、异丁酸盐、癸酸盐、庚酸盐、丙炔酸盐、草酸盐、丙二酸盐、琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、丁炔-1,4-二酸盐、己炔-1,6-二酸盐、苯甲酸盐、氯苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、邻苯二甲酸盐、对苯二甲酸盐、磺酸盐、二甲苯磺酸盐、苯基乙酸盐、苯基丙酸盐、苯基丁酸盐、柠檬酸盐、乳酸盐、对羟基丁酸盐、乙醇酸盐、酒石酸盐、甲磺酸盐、丙磺酸盐、萘-1-磺酸盐、萘-2-磺酸盐、扁桃酸盐、马尿酸盐、葡萄糖酸盐和乳糖醛酸盐。
在实施方案中,抗高血脂试剂是他汀类。在实施方案中,他汀类选自阿托伐他汀、瑞舒伐他汀、辛伐他汀、普伐他汀和前述任一的药学上可接受的盐和前药。在实施方案中,他汀类以5mg至100mg范围的量存在。在一个实施方案中,他汀类是普伐他汀。
在实施方案中,抗高血脂试剂是胆固醇吸收抑制剂。在一个实施方案中,胆固醇吸收抑制剂是依泽替米贝,也称为zetia。
在实施方案中,抗高血脂试剂是cetp抑制剂。在一个实施方案中,cetp抑制剂是anacetrapib,或其水合物或溶剂化物。
神经病学障碍
在实施方案中,本公开提供通过向受试者施用有效量的式i-vi中任一的化合物或其混合物或包含其的组合物来治疗有此需要的受试者中的神经病学障碍的方法。在实施方案中,化合物是式i或iv的化合物。在实施方案中,可以治疗的神经病学疾病和障碍包括但不限于阿尔茨海默病、外周神经损伤、肌萎缩侧索硬化、疼痛和纤维肌痛。在实施方案中,神经病学疾病或障碍选自术后谵妄、急性术后疼痛、纤维肌痛、子宫内膜异位症、外阴痛、慢性下背痛、骨关节炎相关疼痛的治疗或管理、糖尿病性周围神经病和肌肉骨骼损伤或创伤。
在实施方案中,所述量有效于治疗神经病学障碍的一种或多种症状。
在实施方案中,神经病学障碍是精神病学障碍。在实施方案中,精神病学障碍选自注意力缺陷多动障碍(adhd)和抑郁。在实施方案中,神经病学疾病或障碍是术后认知功能障碍(pocd)或术后谵妄。
本公开还提供治疗或管理疼痛的方法。在实施方案中,疼痛是伤害性疼痛且该方法包括向需要治疗伤害性疼痛的受试者施用包含有效量的本文所述的化合物或其混合物的药物组合物。在实施方案中,该方法还包括施用至少一种另外的api。在实施方案中,另外的api是加巴喷丁,或其药学上可接受的盐或前药。
在实施方案中,本公开还提供治疗或管理与炎症相关的疼痛的方法。
在实施方案中,本公开还提供治疗或管理与纤维肌痛相关的疼痛的方法。
在实施方案中,本公开还提供治疗或管理与子宫内膜异位症相关的疼痛的方法。
在实施方案中,本公开还提供治疗或控制与外阴痛相关的疼痛的方法。
在实施方案中,本公开还提供治疗或管理急性术后疼痛的方法。
在实施方案中,本公开还提供治疗或管理慢性下背痛的方法。
在实施方案中,本公开还提供骨关节炎相关疼痛的治疗或管理的方法。
在实施方案中,本公开还提供治疗或管理与糖尿病性周围神经病相关的疼痛的方法。
在实施方案中,本公开还提供治疗或管理与肌肉骨骼损伤或创伤相关的疼痛的方法。
肺部和血管疾病和障碍
在实施方案中,本公开提供通过向受试者施用有效量的式i-vi中任一的化合物或其混合物或包含其的组合物来治疗有此需要的受试者中的肺部障碍的方法。在实施方案中,受试者是人且化合物是式i或iv的化合物。
在实施方案中,可以治疗的肺部和血管疾病和障碍包括但不限于肺部炎症,支气管肺发育不良(也称为婴儿期慢性肺病),囊性纤维化,过敏性气道反应,急性肺损伤,肺损伤,特发性肺纤维化,细菌性肺炎,香烟烟雾引起的肺脏炎症,和血管炎症。
在实施方案中,肺部障碍选自急性肺损伤,支气管肺发育不良(也称为婴儿期慢性肺病),囊性纤维化,特发性肺纤维化,肺损伤和肺部炎症。
在实施方案中,肺部障碍是支气管肺发育不良,也称为婴儿期慢性肺病。
在实施方案中,肺部障碍是囊性纤维化。
在实施方案中,肺部障碍是特发性肺纤维化。
非药物用途
在一个实施方案中,本发明提供包含本文所述的化合物及其混合物的组合物用于非药物用途,例如用作膳食补充剂。
在实施方案中,非药物用途可包括向受试者施用有效量的包含本文所述的化合物、或两种或更多种本文所述的化合物的混合物的组合物。在实施方案中,有效量是有效于维持、促进或改善受试者的总体健康的量。
在一个实施方案中,所述组合物可以用于抵消受试者中的饮食缺乏或营养障碍的方法。在一个实施方案中,组合物可以用于维持、促进或改善受试者的总体健康的方法。
在一个实施方案中,该方法是用于改善心脏健康的方法。
在一个实施方案中,该方法是用于改善关节健康的方法。
在一个实施方案中,该方法是用于改善眼睛健康的方法。
在一个实施方案中,该方法是用于改善认知健康的方法。
组合疗法
在上述方法的语境中,该方法还可以包括将本文所述的化合物作为组合疗法与一种或多种旨在治疗或改善该疾病或障碍的一种或多种症状、或提供如上所述的另外的非药物益处的另外的api或非药物试剂一起施用。在实施方案中,本文描述的化合物可以与至少一种另外的api或非药物试剂一起施用,或与另外的api或非药物试剂分开施用。在一起递送的情况下,本发明的组合物可以与另外的api或非药物试剂相同的剂型递送,或以不同的剂型递送。如上讨论,本发明的优点之一是易于将本文所述的组合物与另外的api或非药物试剂和赋形剂配制在单一的固体剂型中,这是因为它们作为化学和物理稳定的自由流动粉末的形式(与相对不稳定的油性液体形式的游离spm及其酯相反)。
在实施方案中,本公开提供了包含双rve1二赖氨酸镁和另外的ibd治疗剂,任选地皮质类固醇,5-asa或咪唑硫嘌呤的组合物,用于治疗ibd的方法,如上所述。在实施方案中,该方法包括与另外的ibd治疗剂分开地施用包含双rve1二赖氨酸镁的组合物,所述另外的ibd治疗剂任选地为皮质类固醇,5-asa或咪唑硫嘌呤。在另外的ibd治疗剂是皮质类固醇的实施方案中,皮质类固醇可以选自泼尼松,泼尼松龙,布地奈德,氢化可的松和倍氯米松二丙酸酯,其中剂型是口服剂型,或选自氢化可的松,泼尼松龙和布地奈德,其中剂型适合于直肠递送,例如以灌肠剂或栓剂的形式。
在以下实施例中进一步描述本发明,这些实施例不限制权利要求中描述的本发明的范围。
式i和iv的示例性化合物的结构显示在下表5中。
实施例
使用除下面例举的那些之外的其他二价金属阳离子,本文所述的化合物的肽-金属盐组分的化学合成可以通过使用本领域已知的技术调整本文所述的方法来实现。例如,如us5,061,815中所述,其通过引用以其整体并入本文。此外,技术人员将了解,来自下文例举的那些的不同spm分子可以以相同方式与下文描述的金属-二肽和二肽骨架组合。
本文提供合成代表性spm分子的示例性方法,例如rve1、at-rvd1、rvd2、pdx和lxa4。这些旨在是非限制性的,因为技术人员可以采用用于获得本文所述的化合物的spm组分的备选方法。例如,合成方法描述于li等人,beilsteinj.org.chem.2013,9,2762–2766和vik等人,bioorganicandmed.chem.let2017。另外,可以从诸如caymenchemicalco.(annarbor,mi)的供应商处购得一种或多种spm。
实施例1:rve1的合成
(5s,6z,8e,10e,12r,14z,16e,18r)-5,12,18-三羟基二十碳-6,8,10,14,16-五烯酸)
步骤1:(5s,8e,10e,12r,16e,18r)-5,12,18-三羟基二十碳-8,10,16-三烯-6,14-二炔酸异丙酯
向(r,e)-1-碘代戊-1-烯-3-醇(3.62g,17.07mmol)、二氯双(三苯基膦)钯(ii)(0.464g,0.661mmol)、四(三苯基膦)钯(0)(0.482g,0.417mmol)和碘化铜(i)(0.255g,1.34mmol)在苯(25ml)中的脱气溶液中加入(5s,8e,10e,12r)-5,12-二羟基十五碳-8,10-二烯-6,14-二炔酸异丙酯(3.972g,13.05mmol)在苯(50ml)中的脱气溶液。将混合物脱气并用氮气(2x)吹扫,加入哌啶(6.5ml,65.8mmol),将溶液脱气并用氮气吹扫,并将混合物在室温下在氮气氛下搅拌。在2小时后,tlc(50%etoac/己烷,高锰酸盐染色)显示限量试剂的消耗。反应用etoac(240ml)稀释并用饱和氯化铵水溶液(2×100ml)和盐水(100ml)洗涤。将有机溶液干燥(na2so4)并真空浓缩。粗制的粘稠深琥珀色油/红色固体通过快速色谱法(0.75l硅胶,40%etoac/己烷,然后一旦产物开始洗脱则50%)纯化以得到4.22g(83%)作为粘稠琥珀色油的(5s,8e,10e,12r,16e,18r)-5,12,18-三羟基二十碳-8,10,16-三烯-6,14-二炔酸异丙酯。1hnmr(400mhz,氯仿-d)δ6.56(dd,j=15.5,10.9hz,1h),6.33(dd,j=14.9,11.1hz,1h),6.08(dd,j=15.9,6.1hz,1h),5.85(dd,j=15.2,5.9hz,1h),5.73–5.59(m,2h),5.00(七重峰,j=6.2hz,1h),4.51(q,j=4.8,3.7hz,1h),4.35(q,j=6.1hz,1h),4.13–4.01(m,1h),2.68–2.50(m,2h),2.39–2.28(m,2h),1.86–1.68(m,4h),1.56(p,j=7.4hz,2h),1.22(d,j=6.3hz,6h),0.92(t,j=7.4hz,3h)。
步骤2:(5s,6z,8e,10e,12r,14z,16e,18r)-5,12,18-三羟基二十碳-6,8,10,14,16-五烯酸异丙酯
将锌粉(208g,3.2mol)和水(1.2l)加入烧瓶中,并通过使氮气流通过溶液而脱气15min。加入乙酸铜(ii)一水合物(20.9g,105mmol)并继续脱气15min。加入硝酸银(21g,123mmol)并将混合物在连续氮气脱气下搅拌30min。过滤混合物(#2滤纸,18.5cm布氏漏斗)且剩余的固体用水(2×200ml)、甲醇(2×200ml)、丙酮(2×200ml)和二乙醚(2×200ml)洗涤。将活化的锌快速转移到含有1:1甲醇/水(1.2l)的烧瓶中,并用温热至40℃并在氮气下搅拌过夜的(5s,8e,10e,12r,16e,18r)-5,12,18-三羟基二十碳-8,10,16-三烯-6,14-二炔酸异丙酯(2.1g,5.4mmol)在甲醇(56ml)和三甲基甲硅烷基氯(9.3ml,73mmol)中的溶液处理。通过gc-ms监测反应,并在22小时后显示99%转化率。将混合物过滤(在布氏漏斗中的两个185mm#2滤纸之间的250ml硅藻土),并用甲醇冲洗滤饼直到滤饼上没有产物残留。将滤液真空浓缩(水浴温度<40℃)直到除去~99%的初始体积。向剩余溶液中加入盐水(50ml)、少量氯化钠和etoac(50ml)。收集有机层且水层用etoac(2×20ml)萃取。将合并的有机溶液干燥(na2so4)并真空浓缩(水浴温度<30℃)。通过使用biotageisolera的快速色谱法(120g硅胶,10-60%etoac/己烷,产物在60%etoac/己烷中洗脱)纯化粗制黄色油以得到1.27g(60%)作为透明黄色油的(5s,6z,8e,10e,12r,14z,16e,18r)-5,12,18-三羟基二十碳-6,8,10,14,16-五烯酸异丙酯。1hnmr(400mhz,氯仿-d)δ6.49(ddd,j=15.8,11.2,4.5hz,2h),6.35–6.04(m,4h),5.78(dd,j=15.2,6.9hz,1h),5.72(dd,j=15.2,6.9hz,1h),5.44(ddd,j=16.0,10.5,8.1hz,2h),5.00(七重峰,j=6.1hz,1h),4.58(q,j=6.8,6.3hz,1h),4.26(q,j=6.4hz,1h),4.15–4.05(m,1h),2.48(七重峰,j=7.6hz,2h),2.30(t,j=7.0hz,2h),1.87–1.45(m,9h),1.23(s,3h),1.21(s,3h),0.92(t,j=7.4hz,3h)。
步骤3:(5s,6z,8e,10e,12r,14z,16e,18r)-5,12,18-三羟基二十碳-6,8,10,14,16-五烯酸(rve1)
(5s,6z,8e,10e,12r,14z,16e,18r)-5,12,18-三羟基二十碳-6,8,10,14,16-五烯酸异丙酯(2.51g,6.08mmol)在thf(37ml)中的溶液用1mlioh溶液(26ml,26mmol)处理。在室温下搅拌2小时后,tlc(etoac)显示完成。反应混合物用etoac(250ml)稀释,并用ph7的0.2m磷酸钠缓冲液(28ml)酸化至ph7-8。分离各层并将氯化钠加入水层中直到其饱和。用etoac洗涤水层直到没有剩余产物。将合并的有机溶液用盐水洗涤,干燥(na2so4),加入生育酚(1滴),并真空浓缩。将粗制的粘稠琥珀色油溶于15%meoh/dcm中,并通过快速色谱法(125ml硅胶,0-20%meoh/dcm)纯化以得到1.38g(65%)作为琥珀色油的(5s,6z,8e,10e,12r,14z,16e,18r)-5,12,18-三羟基二十碳-6,8,10,14,16-五烯酸。1hnmr(400mhz,甲醇-d4)δ6.52(ddd,j=19.6,14.7,11.3hz,2h),6.36–6.18(m,2h),6.07(t,j=11.0hz,2h),5.75(dd,j=14.6,6.5hz,1h),5.65(dd,j=15.2,6.7hz,1h),5.44(dt,j=10.3,7.5hz,1h),5.41–5.31(m,1h),4.56(q,j=7.0hz,1h),4.16(q,j=6.5hz,1h),4.00(q,j=6.5hz,1h),2.44(七重峰,j=7.3hz,2h),2.30(t,j=6.9hz,2h),1.73–1.40(m,6h),0.90(t,j=7.4hz,3h)。
实施例2:rve1(l,l)-赖氨酰赖氨酸盐的合成
用l-赖氨酰-l-赖氨酸(30mg,0.109mmol)处理rve1(38.1mg,0.109mmol)在甲醇(0.75ml)和生育酚(1.7mg预溶于0.2ml乙酸乙酯)中的溶液且将混合物在50℃下搅拌20min。将溶液稍微冷却,真空浓缩,且然后置于室温下的真空烘箱中3小时以得到63mg(93%)作为非常浅橙色易碎泡沫的rve1(l,l)-赖氨酰赖氨酸盐。1hnmr(400mhz,甲醇-d4)δ6.62–6.44(m,2h),6.37–6.16(m,2h),6.07(q,j=10.7hz,2h),5.74(dd,j=14.8,6.6hz,1h),5.65(dd,j=15.2,6.7hz,1h),5.45(dt,j=10.8,7.7hz,1h),5.42–5.30(m,1h),4.57(q,j=7.1hz,1h),4.26(dd,j=7.9,5.2hz,1h),4.16(q,j=6.5hz,1h),4.01(q,j=6.6hz,1h),2.90(t,j=7.2hz,4h),2.43(tt,j=14.5,7.8hz,2h),2.18(t,j=6.8hz,2h),1.87(td,j=13.4,7.9hz,2h),1.75–1.40(m,16h),0.91(t,j=7.4hz,3h)。
实施例3:双rve1mg二-(l)-赖氨酸盐的合成
将rvel(60.3mg,0.172mmol)在甲醇(1ml)和生育酚(2.1mg预溶于0.2ml乙酸乙酯)中的溶液用赖氨酸镁(27.1mg,0.086mmol)处理,并将混合物在50°c下搅拌20min。将溶液稍微冷却,真空浓缩,且然后置于室温下的真空烘箱中3小时以得到85mg(97%)作为非常浅橙色易碎泡沫的双(rve1)l-赖氨酸镁盐。1hnmr(400mhz,乙酸-d4)δ6.61–6.46(m,4h),6.33(dd,j=14.8,10.6hz,2h),6.24(dd,j=14.6,10.5hz,2h),6.10(td,j=11.1,4.1hz,4h),5.79(dd,j=14.9,6.7hz,2h),5.69(dd,j=15.2,6.8hz,2h),5.45(dt,j=14.6,8.9hz,4h),4.71(q,j=7.5,6.9hz,2h),4.30(q,j=6.5hz,2h),4.15(q,j=6.6hz,2h),4.04(t,j=6.2hz,2h),3.07(t,j=7.4hz,4h),2.50(ddq,j=28.8,14.7,7.0hz,4h),2.39(t,j=7.1hz,4h),2.02–1.90(m,4h),1.81–1.46(m,20h),0.89(t,j=7.4hz,6h)。
实施例4:双rve1ca二-(l)-赖氨酸盐的合成
将rve1(74.2mg,0.212mmol)在甲醇(0.7ml)和生育酚(2.6mg预溶于0.2ml乙酸乙酯)中的溶液用赖氨酸钙(35mg,0.106mmol)在meoh(0.6ml)中的溶液处理并将混合物在50℃下搅拌20min。将溶液稍微冷却,真空浓缩,且然后置于室温下的真空烘箱中3小时以得到104mg(96%)作为浅橙色固体的双(rve1)l-赖氨酸钙盐。1hnmr(400mhz,氧化氘)δ6.64(td,j=11.5,2.9hz,2h),6.54(dd,j=15.3,11.1hz,2h),6.42–6.29(m,4h),6.20(t,j=11.0hz,4h),5.89–5.79(m,2h),5.76(dd,j=15.3,7.0hz,2h),5.57–5.46(m,2h),5.44(t,j=10.0hz,2h),4.67(q,j=6.8hz,2h),4.32(q,j=6.5hz,2h),4.13(q,j=6.7hz,2h),3.59(t,j=6.1hz,2h),3.06–2.95(m,4h),2.51(t,j=7.2hz,4h),2.20(t,j=7.0hz,4h),1.81(dtd,j=9.1,6.4,2.7hz,4h),1.75–1.37(m,24h),0.88(t,j=7.4hz,6h)。
实施例5:at-rvd1的合成
(4z,7s,8r,9e,11e,13z,15e,17r,19z)-7,8,17-三羟基二十二碳-4,9,11,13,15,19-六烯酸(17-epi-rvd1)
步骤1:(z)-6-((4s,5r)-5-((r,1e,3e,7e,11z)-9-羟基十四碳-1,3,7,11-四烯-5-炔-1-基)-2,2-二甲基-1,3-二氧戊环-4-基)己-4-烯酸甲酯
(r,1e,5z)-1-碘代辛-1,5-二烯-3-醇(1.18g,4.03mmol)和(z)-6-((4s,5r)-5-((1e,3e)-己-1,3-二烯-5-炔-1-基)-2,2-二甲基-1,3-二氧戊环-4-基)己-4-烯酸甲酯(1.13g,3.71mmol)的混合物用无水乙腈(25ml)共沸干燥。混合物溶于无水乙腈(43ml)中,脱气并用氮气(2x)吹扫,用双(三苯基膦)氯化钯(ii)(388.3mg,0.553mmol)和碘化铜(516.9mg,2.71mol)处理,脱气,冷却至0℃,用三乙胺(2.7ml,19.4mmol)处理,在0℃下搅拌2小时,温热至室温,且搅拌过夜。在18.5小时后,tlc(30%etoac/己烷)显示限量试剂被消耗,并将ph7的0.2m磷酸钠缓冲液(20ml)和etoac(80ml)加入烧瓶中。分离各层,且合并的有机溶液用水(直到cu消失)、盐水(50ml)洗涤,干燥(na2so4),并真空浓缩。通过快速色谱法(140ml硅胶,20-30%etoac/己烷)纯化粗制油以得到0.46g(29%)(z)-6-((4s,5r)-5-((r,1e,3e,7e,11z)-9-羟基十四碳-1,3,7,11-四烯-5-炔-1-基)-2,2-二甲基-1,3-二氧戊环-4-基)己-4-烯酸甲酯。1hnmr(400mhz,氯仿-d)δ6.59(dd,j=15.4,11.0hz,1h),6.42(dd,j=14.6,14.1hz,1h),6.33(m,1h),6.16(dd,j=15.9,5.6hz,1h),5.88(m,1h),5.75(m,1h),5.67–5.54(m,1h),5.44(p,j=6.5,5.9hz,2h),5.41–5.28(m,1h),4.59(t,j=7.0hz,1h),4.34–4.14(m,2h),3.67(s,3h),2.40–2.30(m,6h),2.30–2.21(m,1h),2.21–2.12(m,1h),2.12–2.01(m,2h),1.70(d,j=4.0hz,1h),1.49(s,3h),1.36(s,3h),0.97(t,j=7.6hz,3h)。
步骤2:(4z,7s,8r,9e,11e,15e,17r,19z)-7,8,17-三羟基二十二碳-4,9,11,15,19-五烯-13-炔酸甲酯
(z)-6-((4s,5r)-5-((r,1e,3e,7e,11z)-9-羟基十四碳-1,3,7,11-四烯-5-炔-1-基)-2,2-二甲基-1,3-二氧戊环-4-基)己-4-烯酸甲酯(0.38g,0.883mmol)在甲醇(31ml)中的溶液用1mhcl(8ml,8mmol)处理并在室温下搅拌。在4小时后,tlc(50%etoac/己烷,高锰酸盐染色)显示完成。反应用饱和碳酸氢钠水溶液(40ml)淬灭且然后用etoac(100ml)萃取。将合并的有机溶液用水(60ml)、盐水(30ml)洗涤,干燥(na2so4),并真空浓缩。通过使用biotageisolera的快速色谱法(25g二氧化硅,45-90%etoac/己烷)纯化粗产物以得到0.34g(99%)作为黄色油的(4z,7s,8r,9e,11e,15e,17r,19z)-7,8,17-三羟基二十二碳-4,9,11,15,19-五烯-13-炔酸甲酯。1hnmr(400mhz,氯仿-d)δ6.60(dd,j=15.4,10.9hz,1h),6.38(dd,j=15.4,10.8hz,1h),6.16(dd,j=15.8,5.6hz,1h),5.93–5.82(m,2h),5.75(dd,j=15.4,2.0hz,1h),5.66–5.54(m,1h),5.48(td,j=4.8,2.3hz,2h),5.40–5.28(m,1h),4.23(m,2h),3.72(dq,j=8.2,4.0hz,1h),3.67(s,3h),2.53(d,j=4.0hz,1h),2.48–2.15(m,9h),2.05(d,j=10.0hz,2h),1.71(d,j=4.3hz,1h),0.97(t,j=7.5hz,3h)。
步骤3:(4z,7s,8r,9e,11e,13z,15e,17r,19z)-7,8,17-三羟基二十二碳-4,9,11,13,15,19-六烯酸甲酯
将锌粉(22.3g,341mmol)和水(250ml)加入烧瓶中,并通过使氮气流通过溶液而脱气15min。加入乙酸铜(ii)一水合物(2.24g,11.2mmol)并继续脱气15min。加入硝酸银(2.24g,13.2mmol)并在连续氮气脱气下将混合物搅拌30min。将混合物通过中等烧结的布氏漏斗过滤,并将剩余的固体用水(2×50ml)、甲醇(2×50ml)、丙酮(2×50ml)和二乙醚(2×50ml)洗涤。将锌混合物快速转移到含有1:1甲醇/水(220ml)的烧瓶中,并用(4z,7s,8r,9e,11e,15e,17r,19z)-7,8,17-三羟基二十二碳-4,9,11,15,19-五烯-13-炔酸甲酯(350mg,0.901mmol)在甲醇(325ml)、三甲基甲硅烷基氯(1.56ml,12.2mmol)的溶液处理,并搅拌过夜。通过gcms监测反应并在22小时后显示100%转化率。将混合物通过硅藻土垫(100ml,滤饼用甲醇冲洗直到所有产物已通过硅藻土)过滤,并将滤液真空浓缩(水浴温度<30℃)直到~80%的初始体积被除去。向剩余溶液中加入盐水(50ml)和etoac(80ml)。收集有机层且水层用etoac(30ml)萃取。将合并的有机溶液用盐水(20ml)洗涤,干燥(na2so4),并真空浓缩(水浴温度<30℃)。通过快速色谱法(40ml硅胶,50%etoac/己烷)纯化粗产物以得到288mg(82%)作为玻璃状淡黄色固体的(4z,7s,8r,9e,11e,13z,15e,17r,19z)-7,8,17-三羟基二十二碳-4,9,11,13,15,19-六烯酸甲酯。注意:在除去溶剂前,将一滴(+)-α-生育酚加入到纯化的产物中。1hnmr(400mhz,氯仿-d)δ6.79–6.65(m,2h),6.40(dd,j=15.1,10.8hz,1h),6.27(dd,j=14.6,10.8hz,1h),6.08–5.96(m,2h),5.80(ddd,j=15.1,12.6,6.5hz,2h),5.64–5.54(m,1h),5.49(t,j=5.0hz,2h),5.41–5.31(m,1h),4.30–4.19(m,2h),3.71(dt,j=7.9,4.0hz,1h),3.66(s,3h),2.51–2.15(m,10h),2.14–2.01(m,2h),1.75(s,1h),0.97(t,j=7.5hz,3h)。
步骤4:(4z,7s,8r,9e,11e,13z,15e,17r,19z)-7,8,17-三羟基二十二碳-4,9,11,13,15,19-六烯酸(17-epi-rvdl)
(4z,7s,8r,9e,11e,13z,15e,17r,19z)-7,8,17-三羟基二十二碳-4,9,11,13,15,19-六烯酸甲酯(246mg,0.630mmol)在thf(13ml)中的冷却(3℃)溶液用1mlioh水溶液(3.8ml,3.8mmol)处理。在3℃下搅拌22小时后,tlc(etoac,cam染色)显示完成。反应混合物用etoac(60ml)稀释并用ph7的0.2m磷酸钠缓冲液(~17ml)酸化至ph7-8。分离各层且水层用etoac洗涤直到产物不再在水层中(6×10ml)。将合并的有机溶液用水(25ml)、盐水(15ml)洗涤,干燥(na2so4),加入生育酚(4.2mg),并真空浓缩以得到207mg(87%)作为半透明黄色油的(4z,7s,8r,9e,11e,13z,15e,17r,19z)-7,8,17-三羟基二十二碳-4,9,11,13,15,19-六烯酸(17-epi-rvd1)。1hnmr(400mhz,氯仿-d)δ6.69(m,1h),6.42–6.27(m,1h),6.29–6.16(m,1h),6.04–5.92(m,2h),5.77(m,2h),5.59–5.40(m,3h),5.38–5.27(m,1h),4.28–4.07(m,2h),3.74–3.61(m,1h),2.47–2.12(m,8h),2.05(m,2h),1.44–1.36(m,1h),1.34–1.15(m,2h),1.01–0.88(m,3h),0.88–0.76(m,1h)。
实施例6:at-rvd1(l,l)-赖氨酰赖氨酸盐的合成
将17-epi-rvd1(27.4mg,72.8μmol)在甲醇(0.5ml)和生育酚(0.9mg预溶于0.2ml乙酸乙酯)中的溶液用l-赖氨酰-l-赖氨酸(19.9mg,72.5µmol)处理且将混合物在50℃下搅拌20min。将溶液稍微冷却,真空浓缩,且然后置于室温下的真空烘箱中3小时以得到47mg(100%)作为淡橙色易碎泡沫的17-epi-rvdl(l,l)-赖氨酰赖氨酸盐。1hnmr(400mhz,甲醇-d4)δ6.80–6.68(m,2h),6.40(dd,j=14.8,11.0hz,1h),6.29(dd,j=14.5,10.8hz,1h),6.00(p,j=10.8hz,2h),5.87(dd,j=15.0,6.8hz,1h),5.73(dd,j=15.1,6.5hz,1h),5.57–5.42(m,3h),5.43–5.32(m,1h),4.26(dd,j=7.8,5.3hz,1h),4.17(q,j=6.8hz,1h),4.02(t,j=6.1hz,1h),3.58–3.49(m,1h),3.43–3.35(m,1h),2.91(t,j=7.4hz,4h),2.40–2.15(m,8h),2.06(p,j=8.1,7.7hz,2h),1.86(dt,j=13.2,6.5hz,2h),1.75–1.58(m,6h),1.45(dq,j=16.5,9.0,8.0hz,4h),0.96(t,j=7.5hz,3h)。
实施例7:双at-rvd1mgdi-(l)-赖氨酸盐的合成
将17-epi-rvd1(35.9mg,95.4μmol)在甲醇(0.5ml)和生育酚(1.3mg预溶于0.2ml乙酸乙酯)中的溶液用l-赖氨酸镁(15mg,47.7μmol)处理且将混合物在50℃下搅拌20min。将溶液稍微冷却,真空浓缩,且然后置于室温下的真空烘箱中3小时以得到51mg(100%)作为玻璃状橙色固体的双(17-epi-rvd1)l-赖氨酸镁盐。1hnmr(400mhz,乙酸-d4)δ6.81–6.69(m,4h),6.41(dd,j=15.2,10.8hz,2h),6.28(dd,j=14.6,10.7hz,2h),6.09–5.94(m,4h),5.86(dd,j=15.1,7.2hz,2h),5.77(dd,j=15.1,6.6hz,2h),5.49(m,6h),5.36(dt,j=11.7,7.5hz,2h),4.35–4.23(m,4h),4.08–4.00(m,2h),3.86–3.77(m,2h),3.13–3.02(m,4h),2.45–2.25(m,16h),2.09–1.91(m,8h),1.75(dt,j=14.4,7.4hz,4h),1.58(m,4h),0.94(t,j=7.5hz,6h)。
实施例8:rvd2的合成
(4z,7s,8e,10z,12e,14e,16r,17s,19z)-7,16,17-三羟基二十二碳-4,8,10,12,14,19-六烯酸)
步骤1:(s,4z,8e,12e,14e)-15-((4r,5s,)-2,2-二甲基-5-((z)-戊-2-烯-1-基)-1,3-二氧戊环-4-基)-7-羟基十五碳-4,8,12,14-四烯-10-炔酸甲酯
(4r,5s)-4-((1e,3e)-4-碘代丁-1,3-二烯-1-基)-2,2-二甲基-5-((z)-戊-2-烯-1-基)-1,3-二氧戊环(1.68g,4.83mmol)和(s,4z,8e)-7-羟基十一碳-4,8-二烯-10-炔酸甲酯(0.919g,4.41mmol)的混合物用无水乙腈(3×5ml)共沸干燥。将混合物溶于无水乙腈(50ml)中,在真空下脱气并用氮气(2x)吹扫,用双(三苯基膦)氯化钯(ii)(0.318g,0.453mmol)和碘化铜(0.315g,1.65mmol)处理,脱气,冷却至0℃,用三乙胺(3.05ml,21.9mmol)处理,在0℃下搅拌2小时,并温热至室温过夜。在18小时后,tlc(20%etoac/己烷)显示反应完成并将ph7的0.2m磷酸钠缓冲液(75ml)加入烧瓶中。分离各层,且水层用etoac(150ml)洗涤。将合并的有机溶液用水(2x75ml)、盐水(50ml)洗涤,干燥(na2so4),并真空浓缩。通过快速色谱法(30%etoac/己烷)纯化粗制油以得到1.48g(79%)作为棕色油的(s,4z,8e,12e,14e)-15-((4r,5s,)-2,2-二甲基-5-((z)-戊-2-烯-1-基)-1,3-二氧戊环-4-基)-7-羟基十五碳-4,8,12,14-四烯-10-炔酸甲酯。1hnmr(400mhz,氯仿-d)δ6.59(dd,j=15.4,10.9hz,1h),6.32(dd,j=15.0,10.9hz,1h),6.17(dd,j=15.8,5.5hz,1h),5.90(d,j=15.8hz,1h),5.81–5.70(m,2h),5.48(m,3h),5.31(m,1h),4.63–4.54(m,1h),4.26(m,1h),4.23–4.13(m,1h),3.67(s,3h),2.43–2.33(m,6h),2.27(dt,j=14.1,7.2hz,1h),2.20–2.09(m,1h),2.03(m,2h),1.50(s,3h),1.37(s,3h),0.96(t,j=7.5hz,3h)。
步骤2:(4z,7s,8e,12e,14e,16r,17s,19z)-7,16,17-三羟基二十二碳-4,8,12,14,19-五烯-10-炔酸甲酯
(s,4z,8e,12e,14e)-15-((4r,5s,)-2,2-二甲基-5-((z)-戊-2-烯-1-基)-1,3-二氧戊环-4-基)-7-羟基十五碳-4,8,12,14-四烯-10-炔酸甲酯(1.48g,3.45mmol)在甲醇(75ml)中的溶液用1mhcl(19ml,18.9mmol)处理。在搅拌2小时后,tlc(50%etoac/己烷,高锰酸盐染色)显示反应完成。反应用饱和nahco3水溶液(60ml)淬灭并用etoac(2×150ml)萃取。将有机溶液用水(100ml)洗涤,干燥(na2so4),用一滴(+)-α-生育酚处理,并真空浓缩。通过快速色谱法(50%etoac/己烷)纯化粗产物以得到1.03g(77%)(4z,7s,8e,12e,14e,16r,17s,19z)-7,16,17-三羟基二十二碳-4,8,12,14,19-五烯-10-炔酸甲酯。1hnmr(400mhz,氯仿-d)δ6.60(dd,j=15.4,10.9hz,1h),6.37(dd,j=15.2,11.0hz,1h),6.17(dd,j=15.8,5.5hz,1h),5.95–5.81(m,2h),5.75(d,j=14.1hz,1h),5.64–5.48(m,2h),5.51–5.40(m,1h),5.37(m,1h),4.31–4.20(m,2h),3.73(dt,j=8.6,4.3hz,1h),3.67(s,3h),2.44–2.34(m,6h),2.29(dt,j=16.1,8.2hz,1h),2.21–2.12(m,1h),2.10–1.98(m,2h),0.97(t,j=7.5hz,3h)。
步骤3:(4z,7s,8e,10z,12e,14e,16r,17s,19z)-7,16,17-三羟基二十二碳-4,8,10,12,14,19-六烯酸甲酯
将锌粉(63.68g,973.6mmol)和水(750ml)加入烧瓶中并通过使氮气流通过溶液而脱气15min。加入乙酸铜(ii)一水合物(6.35g,31.81mmol)并再继续脱气15min。加入硝酸银(6.35g,37.38mmol)并将混合物在继续的氮气脱气下搅拌30min。将混合物通过中等烧结的布氏漏斗过滤,并将剩余的固体用水(2×160ml)、甲醇(2×160ml)、丙酮(2×160ml)和醚(2×160ml)洗涤。将活化的锌快速转移到含有1:1甲醇/水(320ml)的烧瓶中,并用(4z,7s,8e,12e,14e,16r,17s,19z)-7,16,17-三羟基二十二碳-4,8,12,14,19-五烯-10-炔酸甲酯(1.03g,2.65mmol)在甲醇(1l)、三甲基甲硅烷基氯(4.4ml,34.4mmol)中的溶液处理,并搅拌过夜。通过gcms监测反应,并在22小时后显示100%转化率。将混合物通过硅藻土垫(滤饼用甲醇冲洗)过滤,并将滤液真空浓缩(水浴温度保持低于27℃)直到~70%的初始体积被除去。向剩余溶液中加入水和etoac直到形成两层。收集有机层且水层用etoac(2×100ml)萃取。将合并的有机溶液干燥(na2so4),用一滴(+)-α-生育酚处理,并真空浓缩(水浴温度保持低于27℃)以得到1.27g(82%)作为淡黄色油的粗产物。1hnmr(600mhz,氯仿-d)δ6.78–6.67(m,1h),6.37(m,1h),6.32–6.22(m,1h),6.03(m,1h),5.84–5.73(m,1h),5.60–5.42(m,3h),5.40–5.32(m,1h),4.25(d,j=26.6hz,2h),3.73(dq,j=9.1,4.6hz,1h),3.67(s,3h),2.45–2.32(m,6h),2.32–2.23(m,1h),2.22–2.13(m,1h),2.05(m,2h),0.96(t,j=7.6hz,3h)。
步骤4:(4z,7s,8e,10z,12e,14e,16r,17s,19z)-7,16,17-三羟基二十二碳-4,8,10,12,14,19-六烯酸(rvd2)
(4z,7s,8e,10z,12e,14e,16r,17s,19z)-7,16,17-三羟基二十二碳-4,8,10,12,14,19-六烯酸甲酯(1.03g,2.64mmol)在thf(54ml)中的冷却(0℃)溶液在氮气下用1mlioh溶液(16.5ml,16.5mmol)处理并在4℃下搅拌1天。反应混合物用etoac(150ml)稀释并用ph7的0.2m磷酸钠缓冲液(175ml)酸化(ph7-8)。分离各层且水溶液用etoac(6×75ml)充分萃取。将合并的有机溶液用水、盐水洗涤,干燥(na2so4),并真空浓缩以得到0.94g(75%)作为不透明黄色油的(4z,7s,8e,10z,12e,14e,16r,17s,19z)-7,16,17-三羟基二十二碳-4,8,10,12,14,19-六烯酸(rvd2)。1hnmr(600mhz,氯仿-d)δ6.76–6.67(m,2h),6.40(dd,j=15.2,10.8hz,1h),6.26(dd,j=14.7,10.8hz,1h),6.06–5.97(m,2h),5.79(m,2h),5.59–5.44(m,3h),5.40–5.33(m,1h),4.28(q,j=5.9hz,1h),4.24(dd,j=6.9,3.6hz,1h),3.73(dt,j=8.2,4.2hz,1h),2.50–2.32(m,6h),2.31–2.23(m,1h),2.18(dt,j=14.8,5.8hz,1h),2.05(m,j=7.1hz,2h),0.96(t,j=7.5hz,3h)。
实施例9:rvd2(l,l)-赖氨酰赖氨酸盐的合成
将l,l-赖氨酰赖氨酸(58.9mg,0.215mmol)在甲醇(0.5ml)中的50℃溶液用生育酚溶液(2.8mg在0.2mletoac中)和rvd2(84.5mg,0.224mmol)在甲醇(0.5ml)中的溶液处理。将溶液搅拌20分钟,稍微冷却,并真空浓缩。将油重新悬浮在hplc级乙腈(~3ml)中,冷却至0℃,并搅拌3小时以研磨固体。仅形成少量可过滤的固体并将悬浮液在-20℃下储存过夜。将材料过滤并在真空烘箱(环境温度)中干燥过夜以得到46mg(33%)作为浅橙色固体的rvd2l,l-赖氨酰赖氨酸盐。1hnmr(400mhz,甲醇-d4)δ6.81–6.70(m,2h),6.39(dd,j=14.7,10.9hz,1h),6.29(dd,j=14.4,10.9hz,1h),6.08–5.95(m,2h),5.85(dd,j=15.0,7.1hz,1h),5.76(dd,j=15.1,6.3hz,1h),5.58–5.36(m,4h),4.27(dd,j=7.8,5.3hz,1h),4.18(q,j=6.3hz,1h),4.05–3.97(m,1h),3.54(dt,j=8.2,4.8hz,1h),3.41(t,j=6.6hz,1h),2.92(t,j=7.4hz,4h),2.34(m,5h),2.26–2.14(m,3h),2.10–2.05(m,2h),1.87(m,2h),1.68(m,6h),1.47(m,4h),0.97(t,j=7.5hz,3h)。
实施例10:双rvd2mg二-(l)-赖氨酸盐的合成
l-赖氨酸镁(40mg,0.127mmol)在甲醇(0.5ml)中的50℃溶液用生育酚溶液(3.1mg在0.2mletoac中)和rvd2(104.6mg,0.278mmol)在甲醇(0.5ml)中的溶液处理。将混合物搅拌20分钟,稍微冷却,并真空浓缩。将泡沫重新悬浮在hplc级乙腈(~3ml)中,搅拌1.5小时以研磨固体,过滤,并在真空烘箱(环境温度)中干燥过夜以得到107mg(79%)作为浅橙色固体的双(rvd2)l-赖氨酸镁盐。1hnmr(400mhz,乙酸-d4)δ6.83–6.69(m,4h),6.41(dd,j=15.1,10.8hz,2h),6.29(dd,j=14.5,10.8hz,2h),6.10–5.96(m,4h),5.87(dd,j=15.1,7.3hz,2h),5.79(dd,j=15.1,6.6hz,2h),5.54–5.34(m,8h),4.33(q,j=6.3hz,2h),4.27(dd,j=7.1,3.6hz,2h),4.05(t,j=6.1hz,2h),3.82(m,2h),3.08(t,j=7.3hz,4h),2.39–2.27(m,16h),2.10–1.93(m,8h),1.76(m,4h),1.60(m,4h),0.94(t,j=7.5hz,6h)。
实施例11:pdx(l,l)-赖氨酰赖氨酸盐的合成
将l,l-赖氨酰赖氨酸(55.7mg,0.203mmol)在甲醇(0.5ml)中的50℃溶液用生育酚溶液(1.8mg在0.2mletoac中)和pdx(80.0mg,0.222mmol)在甲醇(0.5ml)中的溶液处理。将溶液搅拌20分钟,稍微冷却,并真空浓缩。将泡沫重新悬浮在hplc级乙腈(~3ml)中,搅拌3小时以研磨固体,过滤,并在真空烘箱(环境温度)中干燥过夜以得到52mg(39%)作为非常粘稠橙色固体的pdxl,l-赖氨酰赖氨酸盐。1hnmr(400mhz,甲醇-d4)δ6.70(dd,j=14.6,9.3hz,2h),6.01–5.89(m,2h),5.71(ddd,j=14.8,8.0,6.4hz,2h),5.51–5.25(m,6h),4.24(dd,j=7.7,5.3hz,1h),4.14(m,2h),3.38(t,j=6.5hz,1h),2.89(t,j=7.3hz,4h),2.82(t,j=6.4hz,2h),2.40–2.21(m,6h),2.21–2.13(m,2h),2.04(m,2h),1.91–1.78(m,2h),1.66(m,6h),1.45(m,4h),0.94(t,j=7.5hz,3h)。
实施例12:双pdxmg二-(l)-赖氨酸盐的合成
将l-赖氨酸镁(40.1mg,0.127mmol)在甲醇(0.5ml)中的50℃溶液用生育酚溶液(2.2mg在0.2mletoac中)和pdx(103.0mg,0.286mmol)在甲醇(0.5ml)中的溶液处理。将溶液搅拌20分钟,稍微冷却并真空浓缩。将该油重新悬浮在hplc级乙腈(~3ml)中,搅拌1.5小时以研磨固体,过滤,并在真空烘箱(环境温度)中干燥过夜以得到68mg(50%)作为稍微粘稠橙色固体的双(pdx)l-赖氨酸镁盐。1hnmr(400mhz,乙酸-d4)δ6.74(dd,j=15.2,7.8hz,4h),6.04–5.92(m,4h),5.76(ddd,j=15.0,6.4,3.6hz,4h),5.53–5.29(m,12h),4.30(dq,j=13.0,6.4hz,4h),4.04(t,j=5.3hz,2h),3.07(t,j=7.3hz,4h),2.83(t,j=5.4hz,4h),2.53–2.24(m,16h),2.10–1.92(m,8h),1.75(m,4h),1.59(dt,j=15.1,6.4hz,4h),0.93(t,j=7.5hz,6h)。
实施例13:lxa4的合成
(5s,6r,7e,9e,11z,13e,15s)-5,6,15-三羟基二十碳-7,9,11,13-四烯酸)
步骤1:4-((4s,5r)-5-((s,1e,3e,7e)-9-羟基十四碳-1,3,7-三烯-5-炔-1-基)-2,2-二甲基-1,3-二氧戊环-4-基)丁酸乙酯
将4-((4s,5r)-5-((1e,3e)-己-1,3-二烯-5-炔-1-基)-2,2-二甲基-1,3-二氧戊环-4-基)丁酸乙酯(2.28g,7.80mmol)在苯(10ml)中的脱气溶液在氩气下加入(s,e)-1-碘代辛-1-烯-3-醇(2.64g,10.39mmol)、双(三苯基膦)二氯化钯(ii)(363mg,0.517mmol)和碘化铜(i)(181mg,0.950mmol)在苯(34ml)中的脱气溶液中。加入哌啶(3.8ml,38.5mmol),将混合物脱气并用氩气吹扫,并在室温下在氩气氛下搅拌。在2小时后,tlc(20%etoac/己烷,高锰酸盐染色)显示限量试剂的消耗。反应用etoac(125ml)稀释,并用饱和氯化铵水溶液(2×40ml)和盐水(40ml)洗涤。将有机溶液干燥(na2so4)并真空浓缩。将粗制油溶于50%etoac/己烷中,并通过快速色谱法(700ml硅胶,40-50%etoac/己烷)纯化以得到2.84g(86%)作为浅琥珀色油的4-((4s,5r)-5-((s,1e,3e,7e)-9-羟基十四碳-1,3,7-三烯-5-炔-1-基)-2,2-二甲基-1,3-二氧戊环-4-基)丁酸乙酯。1hnmr(400mhz,氯仿-d)δ6.58(dd,j=15.5,10.9hz,1h),6.29(dd,j=15.2,10.9hz,1h),6.14(dd,j=15.9,6.2hz,1h),5.84(dt,j=15.9,1.8hz,1h),5.78–5.65(m,2h),4.55(t,j=7.0hz,1h),4.22–4.06(m,4h),2.32(td,j=7.4,2.4hz,2h),1.79(ddtd,j=12.6,10.1,7.4,5.4hz,1h),1.72–1.48(m,5h),1.48(s,3h),1.47–1.36(m,2h),1.35(s,3h),1.30(q,j=3.7,2.8hz,4h),1.25(t,j=7.1hz,3h),0.94–0.79(m,3h)。
步骤2:(5s,6r,7e,9e,13e,15s)-5,6,15-三羟基二十碳-7,9,13-三烯-11-炔酸乙酯
4-((4s,5r)-5-((s,1e,3e,7e)-9-羟基十四碳-1,3,7-三烯-5-炔-1-基)-2,2-二甲基-1,3-二氧戊环-4-基)丁酸乙酯(2.84g,6.79mmol)在etoh(110ml)中的溶液用1mhcl(34ml,34mmol)处理并在室温下搅拌。在16小时后,tlc(etoac,高锰酸盐染色)显示完成。反应用饱和碳酸氢钠水溶液(50ml)淬灭,并用etoac(3×40ml)萃取。将合并的有机溶液用水(100ml)、盐水(150ml)洗涤,干燥(na2so4),并真空浓缩。琥珀色油通过快速色谱法(400ml硅胶,50%然后80%etoac/己烷)纯化以得到1.57g(61%)作为黄色油的(5s,6r,7e,9e,13e,15s)-5,6,15-三羟基二十碳-7,9,13-三烯-11-炔酸乙酯。1hnmr(400mhz,氯仿-d)δ6.58(dd,j=15.4,10.9hz,1h),6.35(dd,j=15.3,10.9hz,1h),6.15(dd,j=15.8,6.1hz,1h),5.83(dd,j=15.3,6.9hz,2h),5.75(dd,j=15.4,2.2hz,1h),4.14(dtd,j=17.6,6.9,3.3hz,4h),3.70(dq,j=8.3,3.7hz,1h),2.34(td,j=7.3,2.2hz,2h),1.83(ddq,j=13.2,9.2,7.0,6.5hz,1h),1.75–1.61(m,1h),1.59–1.28(m,10h),1.25(td,j=7.1,2.3hz,3h),0.89(t,j=6.7hz,3h)。
步骤3:(5s,6r,7e,9e,11z,13e,15s)-5,6,15-三羟基二十碳-7,9,11,13-四烯酸乙酯
将锌粉(104.6g,1.6mol)和水(1.2l)加入烧瓶中,并通过使氮气流通过溶液脱气15min。加入乙酸铜(ii)一水合物(10.4g,52mmol)并继续脱气15min。加入硝酸银(10.3g,61mmol)并将混合物在继续的氮气脱气下搅拌30min。过滤混合物(#2滤纸,布氏漏斗)且剩余的固体用水(2×100ml)、甲醇(2×100ml)、丙酮(2×100ml)和二乙醚(2×100ml)洗涤。将锌快速转移到含有1:1甲醇/水(840ml)的烧瓶中并用(5s,6r,7e,9e,13e,15s)-5,6,15-三羟基二十碳-7,9,13-三烯-11-炔酸乙酯(1.57g,4.15mmol)在甲醇(400ml)和三甲基甲硅烷基氯(7ml,55mmol)中的溶液处理。将悬浮液在室温下在氮气下搅拌过夜。通过gc-ms监测反应,并在23小时后显示>99%转化率。将混合物过滤(在布氏漏斗中的两个185mm#2滤纸之间的100ml硅藻土),并用甲醇冲洗滤饼,直到滤饼上没有产物残留。将滤液真空浓缩(水浴温度<35℃)直到初始体积的~99%被除去。将剩余溶液用etoac(50ml)和盐水(30ml)稀释,并加入少量氯化钠。收集有机层,且水层用etoac(2×20ml)萃取。将合并的有机溶液干燥(na2so4)并真空浓缩(水浴温度<30℃)。将粗制黄色蜡溶于1:1dcm/己烷中并通过快速色谱法(300ml硅胶,50%etoac/己烷,然后一旦产物开始洗脱则75%)纯化以得到1.26g(80%)作为粘稠半透明黄色蜡的(5s,6r,7e,9e,11z,13e,15s)-5,6,15-三羟基二十碳-7,9,11,13-四烯酸乙酯。1hnmr(400mhz,氯仿-d)δ6.76–6.63(m,1h),6.44–6.19(m,4h),6.10–5.96(m,1h),5.77(ddd,j=15.6,9.1,6.9hz,2h),4.24–4.17(m,1h),4.12(qd,j=7.2,2.7hz,3h),3.70(s,1h),2.40–2.31(m,2h),1.89–1.77(m,2h),1.75–1.64(m,2h),1.53–1.19(m,14h),0.94–0.82(m,3h)。
步骤4:(5s,6r,7e,9e,11z,13e,15s)-5,6,15-三羟基二十碳-7,9,11,13-四烯酸(lxa4)
(5s,6r,7e,9e,11z,13e,15s)-5,6,15-三羟基二十碳-7,9,11,13-四烯酸乙酯(1.26g,3.31mmol)在thf(70ml)中的冷却(4℃)溶液用1mlioh溶液(20ml,20mmol)处理。在4℃下搅拌15小时后,tlc(etoac,高锰酸盐染色)显示完成。反应混合物用etoac(250ml)稀释,并用ph7的0.2m磷酸钠缓冲液(~30ml)酸化至ph7-8。分离各层,且水层用etoac洗涤直到产物不再在水层中。将合并的有机溶液用水(30ml)、盐水(30ml)洗涤,干燥(na2so4),加入生育酚(5mg),并真空浓缩以得到0.77g(66%)作为不透明的浅黄色粉末的(5s,6r,7e,9e,11z,13e,15s)-5,6,15-三羟基二十碳-7,9,11,13-四烯酸。1hnmr(400mhz,甲醇-d4)δ6.82–6.64(m,2h),6.38(dd,j=14.7,10.6hz,1h),6.27(dd,j=14.5,10.8hz,1h),6.07–5.93(m,2h),5.83(dd,j=15.0,6.9hz,1h),5.71(dd,j=15.0,6.6hz,1h),4.12(q,j=5.9hz,1h),3.98(ddd,j=6.6,5.1,1.1hz,1h),3.50(ddd,j=9.3,5.0,3.0hz,1h),2.31(t,j=7.3hz,2h),1.90–1.76(m,1h),1.70–1.26(m,11h),0.97–0.84(m,3h)。
实施例14:双lxa4mg二-(l)-赖氨酸盐的合成
将lxa4(84.4.3mg,0.240mmol)在甲醇(1.6ml)和生育酚(3.3mg预溶于0.2ml乙酸乙酯中)中的溶液用l-赖氨酸镁(37.7mg,0.120mmol)处理且将混合物在50℃下搅拌20min。将溶液稍微冷却,真空浓缩,且然后置于室温下的真空烘箱中过夜以得到122mg(100%)作为非常浅橙色固体的双(lxa4)l-赖氨酸镁盐。1hnmr(400mhz,甲醇-d4)δ6.80–6.64(m,4h),6.37(ddd,j=15.1,10.8,1.1hz,2h),6.27(dd,j=14.5,10.8hz,2h),6.06–5.92(m,4h),5.83(dd,j=15.0,6.9hz,2h),5.70(dd,j=15.0,6.7hz,2h),4.12(q,j=5.9hz,2h),3.99(ddd,j=6.5,5.0,1.1hz,2h),3.57–3.47(m,4h),2.91(dd,j=8.2,6.8hz,4h),2.19(ddd,j=9.0,7.0,2.3hz,4h),1.91–1.41(m,24h),1.37–1.26(m,12h),0.94–0.86(m,6h)。
实施例15:式i和iv的化合物显示的对降解的增加的稳定性
评估基于式i和iv的所选spm及其离子衍生物的稳定性。将母体spm及其固体离子衍生物置于开放的试管中,并在68-72f之间的室温和20-40%之间的相对湿度下保持6或8周。使用标准高压液相色谱(hplc)分析方法确定稳定性的定性证明。简而言之,hplc分析在安装在配备有els检测器的gilsonhplc系统上的pfp柱(poroshell120,pfp,4.6x150mm,2.7m,agilent)上进行。流动相由均含有0.1%三氟乙酸的溶液a(水)和溶液b(乙腈)之间的梯度组成。关于溶液b,梯度程序为30-80%。流速为0.5ml/min。与在初始时间点的基线hplc迹线相比,新hplc峰的出现表明分解产物和缺乏稳定性。随后的时间点没有这种新的hplc峰表明稳定性。
在初始时间点,rve1在保留时间(rt)7分钟时洗脱为单个主峰,具有在15和17.5分钟时的微小降解产物(图1a)。在暴露于上述测试条件8周后,rve1已经大量降解,如在右侧(rt)15至25分钟出现对应于降解产物的多个峰所指示(图1b)。
相反,在相同条件下,rve1二赖氨酸镁(mg)没有表现出任何降解产物。在初始时间点,rve1二赖氨酸mg洗脱为两个峰,表示其从rve1mg二赖氨酸盐离解成rve1(在右侧7min)和赖氨酸(在右侧3min)(比较图2a和2b)。
类似地,rve1的二赖氨酸钙(ca)盐形式表现出对于mg二赖氨酸盐形式观察到的相同的增强的稳定性分布(比较图3a至3b)。在该实施例中且如对mg二赖氨酸盐观察到的,在初始时间点和暴露于测试条件6周后,化合物洗脱为两个峰,rve1(右侧7min)和赖氨酸(右侧3min),反映rve1ca二赖氨酸盐的解离。没有观察到对应于降解产物的额外峰。
代表性的式i的化合物,rve1的赖氨酰赖氨酸(lyslys)盐形式,显示相同的增强的稳定性。与式iv的化合物一样,在初始时间点,rve1lyslys洗脱为两个峰,rve1(右侧7min)和赖氨酸(右侧3min)(图4a)。在上述测试条件下8周后,存在这两个相同的峰,而没有降解产物(图4b)。
总之,这些结果显示在暴露于测试条件的8周期间,rve1的游离酸形式经历显著降解(比较图1a至1b),而具有rve1作为spm组分的式i和iv的代表性化合物在相同条件下相同或相似的时间段未显示spm的降解。这些结果表明,式i和iv的化合物可显著改善spm的游离酸形式的稳定性,要不然spm在本文使用的条件下是不稳定的。
实施例16:rve1-mg-二赖氨酸盐在结肠炎的临床前小鼠模型中显示功效
炎症性肠病(ibd),例如溃疡性结肠炎和克罗恩病是特发性的,慢性复发和缓解的非特异性炎症性疾病,主要影响小肠,结肠和直肠。ibd的急性发作可能使人虚弱,以腹泻、直肠出血和腹痛为特征。
测试了式iv的代表性化合物rve1-mg-二赖氨酸盐在结肠炎的葡聚糖硫酸钠(dss)小鼠模型中的功效。在该模型系统中,dss暴露破坏肠屏障功能,刺激局部炎症并诱发模拟ibd的临床和组织病理学特征的结肠炎表型。参见例如larouih等人dextransodiumsulfate(dss)inducescolitisinmicebyformingnano-lipocomplexeswithmedium-chain-lengthfattyacidsinthecolon.plosone.2012;7(3):e32084。
在本研究中,将8周龄的雄性c57bl/6j小鼠按体重随机分为三个实验组,并施用在饮用水中2%dss(w/v),持续7天。从研究第0天开始,通过每日一次经口管饲法向动物施用rve1-mg-二赖氨酸盐(rve1-mg-lys),等摩尔剂量的rve1或媒介物。每天使用已建立的疾病活动指数(dai)评估疾病活动。参见,例如,morinc,blierpu,fortins.mag-epareducesseverityofdss-inducedcolitisinrats.amjphysiolgastrointestliverphysiol.2016;310(10):g808-21。在暴露于dss7天后处死所有动物,并收集结肠和脾脏。评估疾病活动的总体形态学标志,包括结肠长度和标准化脾脏重量(mg/g体重)。
如表6所示,相对于研究第7天的媒介物对照,rve1-mg-lys治疗与dai的统计学显著降低相关,表明结肠炎的临床指征降低。另外,rve1-mg-lys与结肠长度的统计学显著增加和标准化脾脏重量减少的趋势相关,表明肠和全身炎症减少。
表6:rve1-mg-二赖氨酸盐在结肠炎的临床前小鼠模型中显示功效
这些数据证明,rve1-mg-lys具有口服活性,并且在充分确立的ibd动物模型中具有治疗功效。有趣的是,与rve1-mg-lys相关的dai,结肠长度和标准化脾脏重量的改善大于与等摩尔剂量的rve1本身相关的改善。尽管这些差异没有达到统计学意义,但它们表明rve1-mg-lys与rve1本身相比可能具有增加的生物学活性。
实施例17:rve1-mg-二赖氨酸盐在亚慢性结肠炎的临床前小鼠模型中显示功效
实施例16中所述的模型系统代表人ibd的急性模型,其中以预防性模式使用每日一次的15ug/天剂量的rve1-mg-二赖氨酸盐治疗以减轻由dss的施用诱导的肠和全身炎症的发作。这与需要维持治疗以防止活动性疾病复发的患者有关。
在实施例17中描述的研究中,亚慢性模型用于通过由10天恢复期分开的两个dss周期在8周龄的c57bl6/j小鼠中诱导结肠炎。在建立dss诱导的结肠炎后,在第20天开始每日一次rve1-mg-二赖氨酸盐治疗(15ug/天),并通过经口管饲法继续进行7天,在第27天结束时处死小鼠。该亚慢性2周期dss方案用于诱导具有比单周期dss更好地模拟人ibd的免疫学特征的炎症。ohsy等人,comparisonofexperimentalmousemodelsofinflammatoryboweldisease.intjmolmed.2014;33(2):333-40。该实验系统还提供了用于治疗活动性疾病患者的代表性模型,其中治疗目的是诱导缓解。这在人ibd中很重要,因为大多数患者都有反复的疾病发作。此外,本研究将rve1-mg-二赖氨酸盐与5-氨基水杨酸盐(5-asa)进行了比较,5-氨基水杨酸盐(5-asa)被用作护理标准的一线疗法,用于诱导和维持溃疡性结肠炎以及某些表型的克罗恩病的缓解。
使用与实施例16中所用相同的疾病活动指数(dai)每天评估疾病活动。处死后,切除结肠,用冰冷的pbs冲洗,测量其长度。随后,还使用建立的组织病理学疾病活动评分系统对每只动物的h&e染色结肠组织切片进行评分。参见dielemanla,palmenmj,akolh,等人,chronicexperimentalcolitisinducedbydextransulphatesodium(dss)ischaracterizedbyth1andth2cytokines.clinexpimmunol.1998;114(3):385-91。
如表7所示,相对于媒介物对照,在研究第27天,rve1-mg-二赖氨酸盐治疗与dai的统计学显著降低相关,表明结肠炎的临床指征降低。
值得注意的是,在第21天和第23天,rve1-mg-二赖氨酸盐与相对于疾病对照的dai显著降低相关(第21天,降低24%,p<0.01;第23天,降低18%,p<0.05)。由于这是疾病对照小鼠达到dai峰值的时间表,该观察结果表明rve1-mg-二赖氨酸盐具有抑制炎症发作的能力。此外,由于这些时间点仅代表rve1-mg-二赖氨酸盐治疗开始后的1-2天,因此该观察结果表明rve1-mg-二赖氨酸盐有可能迅速起效,这与治疗活动性疾病有关。
此外,rve1-mg-二赖氨酸盐与和疾病对照相比结肠长度的统计显著的增加(p<0.05),标准化脾脏重量的统计显著的减少(p<0.05)和处死时测得的和疾病对照相比组织病理学上疾病活动非显著的减少有关。总之,这些观察结果表明rve1-mg-二赖氨酸盐治疗能够在持续炎症的情况下促进组织修复和愈合。
重要的是,与rve1-mg-二赖氨酸盐有关的dai,结肠长度和组织病理学疾病活动的改善大于与5-asa有关的改善。尽管这些差异没有达到统计学显著性,但它们表明rve1-mg-二赖氨酸盐具有与广泛用于人ibd治疗的临床验证治疗剂相当的作用。总之,这些数据提供了进一步的证据,证明口服施用rve1-mg-二赖氨酸盐治疗ibd的治疗功效。
表7
实施例18:rve1-mg-二赖氨酸盐和5-asa的共同施用
在这项研究中,我们再次使用了上述的两周期dss结肠炎模型,但每日一次使用rve1-mg-二赖氨酸盐(1.5ug/天)和5-asa(625ug/天)共同治疗。之所以使用这种共同治疗模型,是因为许多rve1-mg-二赖氨酸盐治疗的候选患者可能会继续服用5-asa,因为这是常见的临床做法,即使当患者用5-asa单一疗法没有得到良好控制。
如表8所示,rve1-mg-二赖氨酸盐(1.5μg/d)的作用与5-asa相当,两种药物在施用剂量下与dai末期评分的相似降低有关。共同疗法与高于单独使用任何一种药物的作用有关,第21天(44%p<0.01),22天(47%,p<0.01),23天(47%,p<0.01)和27天(47%,p<0.05,表8)的单日dai显著降低。共同疗法与比单独施用任何一种药物结肠长度或脾脏重量的更大变化有关,尽管这些变化没有达到统计学意义。最后,共同疗法与比单独任何一种药物更大的组织病理学疾病活动的显著降低有关(p<0.05)。这些发现表明rve1-mg-二赖氨酸盐可能会增强5-asa的治疗功效的可能性,可能导致改善的患者结果。
表8
尽管已显示rve1在腹膜内(ip)注射施用时在多种结肠炎动物模型中具有治疗作用,包括葡聚糖硫酸钠(dss),三硝基苯磺酸(tnbs)和t细胞过继转移小鼠uc模型,就我们所知,上面讨论的研究是基于rve1的疗法首次在结肠炎模型中口服施用时显示具有治疗作用。参见ishidat等人,resolvine1,anendogenouslipidmediatorderivedfromeicosapentaenoicacid,preventsdextransulfatesodium-inducedcolitis.inflammboweldis.2010;16(1):87-95;aritam等人,resolvine1,anendogenouslipidmediatorderivedfromomega-3eicosapentaenoicacid,protectsagainst2,4,6-trinitrobenzenesulfonicacid-inducedcolitis.procnatlacadsciusa.2005;102(21):7671-6;campbellel等人,resolvine1-inducedintestinalalkalinephosphatasepromotesresolutionofinflammationthroughlpsdetoxification.procnatlacadsciusa.2010;107(32):14298-303;savinainen等人,resolvine1(rx-10001)inhibitsinflammationinacuteandchronicmurinemodelsofcolitis.inflamresassocannualmeeting.2008.。
实施例19:单次口服药代动力学研究
为建立rve1-mg-二赖氨酸盐的口服药代动力学(pk),进行了研究,以研究在8周龄的雄性c57bl6/j小鼠中,口服单剂量rve1-mg-二赖氨酸盐(10mg/kg)后,在给药后直至8小时的不同时间点,在血浆、小肠组织和结肠组织中的rve1暴露。通过hplc-ms/ms在所有组织样品中定量rve1水平。表9显示了所有组织区室的药代动力学曲线,且表10中显示了药代动力学指标的总结。
表9
表10
总之,单次口服rve1-mg-二赖氨酸盐后血浆、小肠和结肠中rve1暴露的模式揭示了rve1-mg-二赖氨酸盐的药代动力学曲线的几个特征,这是基于先前报道的腹膜内施用rve1的数据所无法预料的。首先,口服施用后小肠(2小时)和结肠(4小时)中rve1cmax的发生时间与小鼠的正常胃肠通过时间相关。这些数据表明,rve1-mg-二赖氨酸盐递送的rve1的很大一部分未被吸收到全身循环中,而是保留在胃肠道中并通过胃肠道。由于小肠和结肠组织样品被彻底冲洗以去除肠内容物,因此在这些样品中检测到的rve1可能存在于组织内,表明从肠腔和结肠腔局部吸收到这些组织中。第二,在对应于小肠和结肠cmax的时间点观察到血浆rve1水平的微小增加,表明吸收到这些组织中的rve1并未大量转移到全身循环中。虽然在血浆cmax时(15分钟)观察到小肠和结肠中rve1的小量增加,但这些浓度远低于肠和结肠cmax,并且贡献结肠组织中检测到的rve1总量的低于2%。
总之,这些数据表明,口服施用rve1-mg-二赖氨酸盐导致rve1的大部分通过直接从肠腔和结肠腔吸收而递送至小肠和结肠组织。口服施用的rve1的剩余部分被吸收到全身循环中,在那里其对于首过肝脏代谢敏感,也可能引起在其他组织中的脱靶效应。我们的数据表明,适于在下胃肠道中释放rve1-mg-二赖氨酸盐的靶向口服剂型将是高效的递送媒介物。例如,这种靶向剂型将通过增加靶组织中rve1的局部浓度和该浓度在靶组织中达到或高于治疗阈值的时间量而有助于治疗功效。重要的是,在我们的pk研究中观察到的结肠组织cmax显著高于皮摩尔至低纳摩尔浓度范围,据报道该浓度范围内源性rve1具有抗炎和消炎作用(参见serhanc.n.discoveryofspecializedpro-resolvingmediatorsmarksthedawnofresolutionphysiologyandpharmacology.molaspectsmed.2017;58:1-11),表明从腔吸收的rve1存在的浓度足以发挥药理作用。
实施例20:dss结肠炎模型中的结肠内递送
为了进一步测试以rve1-mg-二赖氨酸盐形式口服施用的rve1的腔吸收对疾病活动的生物学作用,我们比较了直接结肠内施用(类似于灌肠)与口服施用。然而之前我们已经确定口服施用rve1-mg-二赖氨酸盐导致全身和局部结肠暴露于rve1,结肠内施用则主要导致局部暴露。
我们再次使用上述的两周期dss结肠炎模型,在第20天开始治疗并持续7天,在第27天结束时处死小鼠。为了促进结肠内药物递送,通过暴露于2-4%的异氟烷气体来麻醉小鼠。进行rve1-mg-二赖氨酸盐或媒介物的结肠内施用,所有动物在给药后倒置5分钟。结肠内施用rve1-mg-二赖氨酸盐与显著降低的dai(p<0.01),结肠长度(p<0.05),脾脏重量(p<0.05)和组织病理学疾病活动(p<0.05)有关。值得注意的是,结肠内rve1-mg-二赖氨酸盐对这些终点的作用与在相同的两周期dss结肠炎模型中口服施用的同等剂量的rve1-mg-二赖氨酸盐相当(见下表11)。
表11
在结肠内功效研究过程中收集了血液和结肠组织样品的药代动力学分析,这些证实了结肠内施用rve1-mg-二赖氨酸盐与主要局部rve1暴露和循环摄入量极低有关。在给药后15分钟,在血液和结肠中都发生rve1tmax。结肠cmax为2.8ng/mg组织,与先前描述的单次口服剂量pk研究中观察到的结肠水平相当,而血液cmax为0.48ng/ml,表明结肠内施用后结肠中rve1水平为血液中的6倍。
综上所述,此处提供的数据支持口服施用rve1-mg-二赖氨酸盐作为单一疗法以及与5-氨基水杨酸盐(5-asa)的共同疗法两者,用于治疗炎症性肠病(ibd),其包括溃疡性结肠炎和克罗恩病两者。基于上述模型系统中的结果对克罗恩病和溃疡性结肠炎两者的治疗都是合理的,因为两者均以胃肠道(尤其是下胃肠道)的慢性炎症为特征,这是在这些系统中模拟的病况。尽管克罗恩病可能会影响胃肠道的任何部分,包括口腔和肛门,但它最常影响到恰在结肠之前的小肠部分,而溃疡性结肠炎影响结肠和直肠。我们的结果表明,口服施用的rve1-mg-二赖氨酸盐所递送的一部分rve1从肠腔和结肠腔直接吸收到这些靶组织中,以治疗克罗恩病和溃疡性结肠炎。如上所述,该特征为靶向口服剂型提供了基础,该靶向口服剂型可有望具有很高的治疗功效,例如,因为靶组织中rve1的局部浓度以及该浓度达到或高于那些组织中的治疗阈值的时间量与非靶向治疗相比得到改善。靶向递送和局部吸收的这种结合还避免了至非靶组织的损失,并使全身吸收和脱靶效应最小化。另外,实施例18证明rve1-mg-二赖氨酸盐可以有利地与5-氨基水杨酸盐(5-asa)作为共同疗法施用,5-氨基水杨酸盐(5-asa)是诱导和维持溃疡性结肠炎和某些类型克罗恩病的缓解的一线疗法。
rve1的抗炎和促炎症消退性质已经在控制良好的实验系统中得到了彻底确立。但是,要将这种活性转化为成功的医学疗法,需要正确的一种或多种组织以足够高的水平和足够长的时间暴露于rve1,以便其发挥其治疗作用。本公开提供了通过口服递送的rve1-mg-二赖氨酸盐实现这些目的的第一基础。
等同物
本领域技术人员将认识到或能够使用不超过常规的实验确定本文所述的本发明的具体实施方案的许多等同物。这些等同物旨在由以下权利要求涵盖。
本文引用的所有参考文献均通过引用以其整体且为了所有目的并入本文,其程度如同每个单独的出版物或专利或专利申请被具体和单独地指出为通过引用以其整体为了所有目的并入。
本发明的范围不受本文所述的具体实施方案限制。实际上,除了本文所述的那些之外,本发明的各种修改对于本领域技术人员来说将从前面的描述和附图而变得显而易见。这些修改旨在落入所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!