分析物的浓缩的制作方法
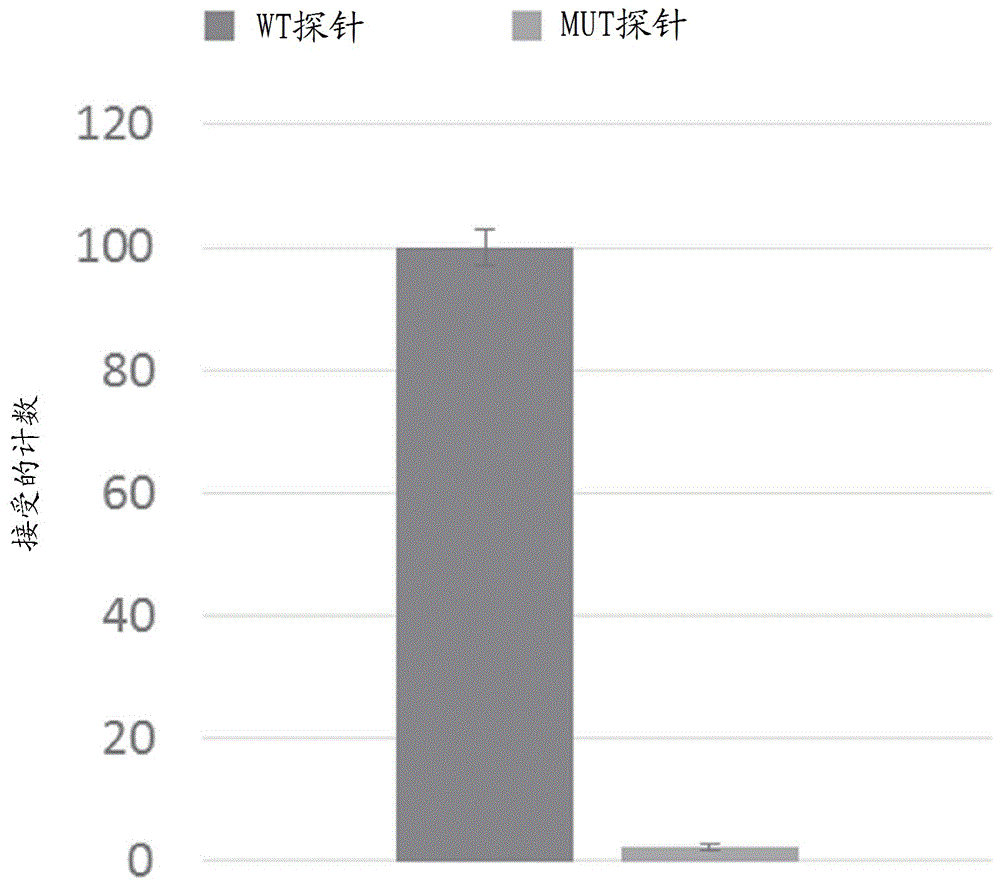
本申请要求2018年6月29日提交的美国临时专利申请系列号62/692,001和2017年12月14日提交的美国临时专利申请系列号62/598,802的优先权,其各自的内容经此引用全文并入本文。关于联邦政府赞助的研究或开发的声明本发明在美国陆军研究实验室陆军研究办公室(aro)提供的w911nf-12-1-0420和美国国立卫生研究院提供的gm062357的政府支持下完成。政府拥有本发明的某些权利。本文中提供了涉及检测分析物的技术,特别但非排它地涉及在表面浓缩分析物以便对低丰度分析物进行成像和检测的组合物、方法和系统。发明背景一些分子诊断技术能够识别极低丰度的生物标志物,如包含大量过量的非肿瘤dna的血液样本中的少量肿瘤来源dna,或混合在含有其它丰度更高或野生型等位基因的混合样品中的罕见遗传等位基因。在一些样品中,这些信息性生物标志物以低至每毫升生物流体(血液、血浆、尿液等等)几个(例如1-1000个)拷贝的丰度存在。分析以低浓度(例如每毫升生物流体小于1飞摩尔和/或大约1-1000个分子)存在的生物标志物对许多技术提出了灵敏度挑战,尤其是对于涉及表面固定化的技术(例如微阵列(参见例如schulze&downward(2001)“navigatinggeneexpressionusingmicroarrays–atechnologyreview”nat.cellbiol.lond.3:e190-95)、使用靶标特异性、颜色编码的探针对对核酸进行直接数字检测(例如nanostringncounter,参见例如kulkarni(2001)“digitalmultiplexedgeneexpressionanalysisusingthenanostringncountersystem”incurrentprotocolsinmolecularbiology(johnwiley&sons,inc.))和大多数下一代测序平台(参见例如metzker(2010)“sequencingtechnologies–thenextgeneration”nat.rev.genet.11:31-46;eid等人(2009)“real-timednasequencingfromsinglepolymerasemolecules”science323:133-38))。一些现有技术使用表面捕获或分析物提取来提高低丰度分析物的浓度(例如用于下一代测序的表面捕获、用于液滴数字pcr的液滴生成等等)。但是,这些技术是昂贵和/或耗时的(例如需要数小时),尤其是在处理大体积生物流体以进行分析时。其它技术已经采用核酸扩增技术(如pcr)来提高样品中靶标核酸的量。但是,核酸扩增向扩增产物中引入了化学损伤和复制错误(参见例如potapov&ong(2017)“examiningsourcesoferrorinpcrbysingle-moleculesequencing”plosone12:e0169774)。虽然原则上可以通过添加独特的分子标识符(或条码序列)并伴随高读取深度识别和去除这些错误(schmitt等人(2012)“detectionofultra-raremutationsbynext-generationsequencing”proc.natl.acad.sci.109:14508-13),这种策略显著增加了测定的成本和分析复杂性。此外,虽然可以通过pcr来扩增分析物如dna和rna序列,其它生物标志物(例如甲基化和其它修饰的核碱基、肽、蛋白质、复合碳水化合物、糖蛋白、脂质、翻译后修饰、代谢产物等等)不能通过pcr或任何类似方法来复制。发明概述因此,本文中提供了一种用于浓缩分析物(例如生物分子(例如核酸(例如dna、rna、甲基化和其它修饰的或非天然存在的核碱基)、多肽(例如肽、蛋白质、糖蛋白)、碳水化合物、脂质、翻译后修饰、氨基酸、代谢产物)、小分子等等)的技术。在一些实施方案中,该技术涉及使用双水相体系(atps)在表面处浓缩分析物。在一些实施方案中,该技术涉及分析物在表面处的电泳浓缩的用途。在一些实施方案中,分析物在表面浓缩后进行分析物的表面捕获(例如分析物在表面处的固定化)。在一些实施方案中,在分析物在表面处的浓缩和任选的分析物在表面处的表面捕获后进行分析物的分析。在本文中描述的技术的实施方案的开发过程中,使用atps的试验表明,使用包含聚(乙二醇)(peg)3350、柠檬酸钠和氯化钠的atps,该技术的实施方案在捕获的肿瘤dna序列的表面密度方面提供了超过80倍的提高。捕获的分析物表面密度的提高将后续检测的灵敏度提高超过80倍。此外,在本文中提供的该技术的实施方案的开发过程中,使用电泳浓缩的试验显示分析物的电泳浓缩(例如带电荷的分析物(例如带负电荷、带正电荷))在分析物浓度方面提供了至少50倍至100倍的提高。在一些实施方案中,该技术包括2017年12月14日提交的美国临时专利申请系列号62/598,802中描述的atps的用途,该专利申请经此引用全文并入本文。当两种水溶性组分——例如两种聚合物或聚合物与盐——超过阈值浓度并分离为具有不同组成的两个水相时,出现双水相体系atps(参见例如iqbal等人(2016)“aqueoustwo-phasesystem(atps):anoverviewandadvancesinitsapplications”biol.proced.online18,经此引用全文并入本文)。几种类型的atps选择性地将生物分子(包括dna和蛋白质)划分到两相之一中。在一些atps体系中,生物分子在所述相之一中的浓度是该分子在另一相中的浓度的1000倍以上(alberts(1967)“efficientseparationofsingle-strandedanddouble-strandeddeoxyribonucleicacidinadextran-polyethyleneglycoltwo-phasesystem”biochemistry(mosc.)6:2527-32,经此引用全文并入本文)。当两种atps组分之一相对于另一种过量存在时,两种所得相在平衡时可以具有不等的体积,使得能够在较小的相中浓缩感兴趣的生物分子(参见例如iqbal,同上)。在本文中提供的技术的一些实施方案中,atps体系用于在小的成像表面区域上浓缩dna的非常稀的溶液以快速和有效地捕获分析物(参见例如图1a)。在一些实施方案中,方法包括加热样品(例如使生物分子(例如核酸(例如rna、dna)、蛋白质)、或其它分子、生物分子、和/或分子复合物变性),将该样品与形成atps的组分剧烈混合,随后将包含样品(例如包含来自该样品的分析物)的atps短暂离心以便将富含分析物的下相放置在成像表面附近。特别地,方法的实施方案包括加热dna样品(例如使dna变性),将dna样品与形成atps的组分剧烈混合,随后将atps与dna短暂离心以便将富含dna的下相放置在成像表面附近。该技术非常简单,在1-10分钟内完成。电泳捕获(例如分析物)包括使用电压将分析物(例如带电荷的分析物(例如带正电荷、带负电荷))移动至表面和/或在表面处浓缩分析物(例如带电荷的分析物(例如带正电荷、带负电荷))(例如移动分析物以接触表面)。在一些实施方案中,该分析物在表面上的特定位置处浓缩(例如在表面上的特定的、限定的、和/或可寻址的位置处)。在一些实施方案中,将分析物输送至表面上并使其在表面上扩散,以提供分析物在该表面上的均匀分布。在一些实施方案中,在将该分析物输送至表面上之后和/或在使该分析物与表面接触之后,在表面处捕获该分析物(例如如本文中所述(例如通过捕获探针))。在一些实施方案中,分析物的电泳捕获包括使用电泳样品池(例如如本文中所述),该电泳样品池包括内部腔室、外部腔室和跨内部腔室与外部腔室施加的电压。在一些实施方案中,该电泳样品池包含允许电流在内部腔室与外部腔室之间通过并尽量减少和/或消除内部腔室与外部腔室之间的分析物流动的多孔材料。因此,在一些实施方案中,该技术提供了在基底上对分析物进行分析的方法。例如,在一些实施方案中,该方法包括提供包含分析物的双水相体系(atps);将分析物浓缩到该atps的第一相中;并使所述第一相接触基底。在一些实施方案中,该方法进一步包括将所述第一相与第二相分离,例如通过离心或重力。在一些实施方案中,该分析物在第一相中的浓度大于该分析物在第二相中的浓度(例如是该分析物在第二相中浓度的至少大约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20倍)。在一些实施方案中,第二相的体积大于第一相的体积(例如是第一相体积的至少大约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20倍)。在一些实施方案中,第一相与基底接触发生大约20秒以上(例如超过大约20、30、40、50、60、70、80、90、100、110或120秒)。在一些实施方案中,第一相与基底接触发生大约60秒以上。在一些实施方案中,提供所述atps包括提供在混合时形成atps的第一组合物和第二组合物。在一些实施方案中,提供所述atps包括提供第一组合物与第二组合物的混合物,在将包含所述分析物的水性样品添加到所述混合物中之后形成atps。在一些实施方案中,提供所述atps包括混合第一组合物和第二组合物以形成混合物,所述混合物形成atps。在一些实施方案中,提供所述atps包括混合第一组合物和第二组合物并向所述混合物中添加包含所述分析物的水性样品。在一些实施方案中,提供的混合物为固体、纯净的混合物,或包含固体和纯净的组分。在一些实施方案中,该atps包含聚乙二醇(peg)和柠檬酸盐。在一些实施方案中,该atps包含聚乙二醇(peg)、柠檬酸盐和盐(例如氯化钠)。在一些实施方案中,该atps的第一相(例如包含浓缩的分析物的相)包含柠檬酸盐。在一些实施方案中,方法包括加热包含所述分析物的所述样品和/或加热包含所述分析物的所述atps。在一些实施方案中,该分析物是核酸,方法包括使所述核酸变性。在一些实施方案中,提供包含分析物的所述双水相体系(atps)包括向形成atps的第一组合物和第二组合物中添加包含所述分析物的水性样品。在一些实施方案中,在将包含所述分析物的所述水性样品添加到形成该atps的所述第一组合物和所述第二组合物中之间,将该分析物变性。在一些实施方案中,通过加热将该分析物变性。并且,在一些实施方案中,该分析物是核酸。在一些实施方案中,atps包含peg、柠檬酸盐和盐,例如,在一些实施方案中,该混合物中peg的质量分数为大于30%,该混合物中柠檬酸盐的质量分数为小于2.5%,并且盐的浓度为大于0.25m。在一些实施方案中,所述peg的分子量为600至6000da。在一些实施方案中,柠檬酸盐以提供5.5至8.5的ph的比的柠檬酸与柠檬酸钠的形式存在。在涉及atps技术的一些实施方案中,该atps进一步包含酶、去污剂(detergent)、离液剂和/或寡核苷酸。在一些实施方案中,该技术涉及使用电泳池在表面处移动和/或浓缩分析物。例如,一些实施方案提供了在基底上对分析物进行分析的方法,例如一种方法,其包括提供电泳池,所述电泳池包括包含含有分析物的溶液的内部腔室和包含含有电解质的溶液的外部腔室;跨内部腔室与外部腔室提供电压;并使该电泳池接触基底。在一些实施方案中,该方法包括提供用于外部腔室的多孔基层(porousbase)。在一些实施方案中,所述多孔基层包含电流经此流动并尽量减少和/或消除分析物穿过其的流动的材料(例如聚合物)。在一些实施方案中,基于分析物的分子量和/或流体动力学半径来抑制分析物穿过该多孔基层的流动,例如,在一些实施方案中,该分析物的分子量和/或流体动力学半径超出了不流经该多孔基层的阈值。在一些实施方案中,通过交流电源提供所述电压。在一些实施方案中,通过直流电源提供所述电压。在一些实施方案中,所述电压以大约1分钟的周期改变(例如0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5或10分钟)。在一些实施方案中,所述电压为0至大约50至120v不等(例如0、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115或120v)。在一些实施方案中,包括使用电泳池的方法进一步包括通过固定在所述基底上的捕获探针来捕获该分析物。在一些实施方案中,犯法进一步包括检测基底上的该分析物,例如通过分析可检测地标记的查询探针对该分析物的缔合与解离动力学(例如通过simreps)来检测基底上的该分析物。在一些实施方案中,方法包括以单分子灵敏度检测基底上的该分析物。在一些实施方案中,该捕获探针包含核酸、多肽、糖或脂质。在一些实施方案中,该查询探针(queryprobe)包含核酸、多肽、糖或脂质。在一些实施方案中,该分析物包含核酸、多肽、代谢产物、脂质、小分子或碳水化合物。进一步的实施方案包括提供包含所述分析物的样品。在一些实施方案中,所述样品是生物样品。在一些实施方案中,所述样品是生物流体。在一些实施方案中,包含所述分析物的所述溶液在0.01至100mm2(例如0.01、0.02、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100mm2)的面积上接触基底。在一些实施方案中,所述内部腔室包含宽度为大约0.01至10mm(例如0.01、0.02、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、1、2、3、4、5、6、7、8、9或10mm)的开口。在一些实施方案中,所述分析物是核酸.例如,在一些实施方案中,所述分析物是包含少于200个碱基对或核苷酸的核酸。在一些实施方案中,所述分析物是包含少于40个碱基对或核苷酸的核酸。在一些实施方案中,所述分析物是单链核酸。在一些实施方案中,所述分析物是双链核酸。在特定实施方案中,所述样品包含细胞、单个细胞、至少1个细胞、至少10个细胞、至少100个细胞、至少1000个细胞、或细胞群;生物流体;细胞裂解液、来自细胞的裂解液、来自单个细胞的裂解液、来自至少1个细胞的裂解液、来自至少10个细胞的裂解液、来自至少100个细胞的裂解液、来自至少1000个细胞的裂解液、或来自细胞群的裂解液;亚细胞区室(subcellularcompartment)、单个亚细胞区室、至少1个亚细胞区室、至少10个亚细胞区室、至少100个亚细胞区室、至少1000个亚细胞区室;和/或亚细胞区室的裂解液、单个亚细胞区室的裂解液、至少1个亚细胞区室的裂解液、至少10个亚细胞区室的裂解液、至少100个亚细胞区室的裂解液、或至少1000个亚细胞区室的裂解液。在相关实施方案中,该技术提供了用于检测分析物的系统。例如,系统的实施方案包含电泳池,所述电泳池包含能够容纳含有分析物的溶液的内部腔室,和能够容纳含有电解质的溶液的外部腔室;用于捕获所述分析物的基底;电压源;以及配置为通过分析可检测地标记的查询探针对该分析物的缔合与解离动力学来检测该基底上的所述分析物的系统。在一些实施方案中,所述基底包含固定的捕获探针。在一些实施方案中,该查询探针是荧光标记的核酸,其以大于0.1min-1的动力学速率常数koff和/或大于0.1min-1的动力学速率常数kon反复与该分析物缔合。在一些实施方案中,配置为检测所述分析物的所述系统包含荧光检测器。在一些实施方案中,配置为检测所述分析物的所述系统包含配置为将二态模型与查询探针结合数据拟合的软件组件。如本文中所述,该技术涉及使用atps或电泳池以便在表面处浓缩分析物。在一些实施方案中,该技术提供使用atps或电泳池以便在表面处浓缩分析物,由此通过分析可检测地标记的查询探针对该分析物的缔合与解离动力学来检测该基底上的所述分析物。一些实施方案涉及使用atps或电泳池以便在表面处浓缩分析物,例如用于量化所述分析物。在一些实施方案中,使用atps或电泳池以便在表面处浓缩分析物用于浓缩包含核酸、多肽、代谢产物、脂质、小分子或碳水化合物的分析物。在一些实施方案中,该方法进一步包括在该基底表面处捕获该分析物(例如通过固定在所述基底上的捕获探针)。在一些实施方案中,方法进一步包括检测该基底上的该分析物(例如通过分析可检测地标记的查询探针对该分析物的缔合与解离动力学来检测该基底上的该分析物)。在一些实施方案中,方法包括表征该基底上的分析物、量化该基底上的分析物、和/或对该基底上的分析物进行成像。在一些实施方案中,以单分子灵敏度对该分析物进行检测、表征、量化和/或成像。在捕获探针方面,该技术没有限制。例如,在一些实施方案中,该捕获探针包含核酸、多肽、糖或脂质。在查询探针方面,该技术没有限制。例如,在一些实施方案中,该查询探针包含核酸、多肽、糖或脂质。在分析物方面,该技术没有限制。例如,在一些实施方案中,该分析物包含核酸、多肽、代谢产物、脂质、小分子或碳水化合物。在一些实施方案中,该分析物是核酸(例如包含小于200个碱基对或核苷酸(例如小于200、195、190、185、180、185、180、175、170、165、160、155、150、145、140、135、130、125、120、115、110、100、95、90、85、80、75、70、65、60、55、50、45、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9或8个碱基对或核苷酸)的核酸)。在一些实施方案中,该分析物是包含小于40个碱基对或核苷酸(例如小于40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9或8个碱基对或核苷酸)的核酸。在一些实施方案中,该分析物是单链核酸。在一些实施方案中,该分析物是双链核酸。在本文中的其它地方提供了捕获探针、查询探针和分析物的进一步描述。一些实施方案进一步包括提供包含分析物的样品。在包含分析物的样品方面,该技术没有限制。例如,在一些实施方案中,该样品是或包含生物样品和/或生物流体。例如,在一些实施方案中,该样品包含细胞、单个细胞、至少1个细胞、至少10个细胞、至少100个细胞、至少1000个细胞、或细胞群;生物流体;细胞裂解液、来自细胞的裂解液、来自单个细胞的裂解液、来自至少1个细胞的裂解液、来自至少10个细胞的裂解液、来自至少100个细胞的裂解液、来自至少1000个细胞的裂解液、或来自细胞群的裂解液;亚细胞区室、单个亚细胞区室、至少1个亚细胞区室、至少10个亚细胞区室、至少100个亚细胞区室、至少1000个亚细胞区室;和/或亚细胞区室的裂解液、单个亚细胞区室的裂解液、至少1个亚细胞区室的裂解液、至少10个亚细胞区室的裂解液、至少100个亚细胞区室的裂解液、或至少1000个亚细胞区室的裂解液。在本文中的其它地方提供了样品的进一步描述。在一些实施方案中,该技术涉及将分析物输送至基底(例如以便在基底表面处浓缩该分析物和/或在基底表面处固定该分析物)。此外,在一些实施方案中,该技术涉及通过提高基底上的分析物浓度来改善分析物检测的灵敏度,对所述分析物进行分析以检测该分析物。因此,在涉及atps的一些实施方案中,该第一相在0.01至100mm2(例如0.01、0.02、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100mm2)的受限面积上接触基底。在一些实施方案中,该第一相接触该基底包括使用含有受限开口的样品槽,所述受限开口的面积为0.01至100mm2(例如0.01、0.02、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100mm2)。此外,在涉及使用电泳池的一些实施方案中,包含该分析物的样品在0.01至100mm2(例如0.01、0.02、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100mm2)的受限面积上接触基底。在一些实施方案中,包含该分析物的样品接触该基底包括使用包含内部腔室的电泳池,所述内部腔室包含面积为0.01至100mm2(例如0.01、0.02、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100mm2)的受限开口。在一些实施方案中,该方法进一步包括添加寡核苷酸以尽量减少和/或消除杂交和/或由所述核酸形成二级结构。在一些实施方案中,在使所述分析物变性之前添加酶。在一些实施方案中,在使所述分析物变性之前添加蛋白酶和/或脂肪酶。在一些实施方案中,在使所述分析物变性之前添加去污剂和/或离液剂。该技术的附加实施方案涉及检测分析物的系统。例如,在一些实施方案中,该技术提供了一种系统,其包含双水相体系(atps)以便在该atps的第一相中浓缩分析物;用于由该atps的所述第一相捕获所述分析物的基底;和配置为通过分析可检测地标记的查询探针对所述分析物的缔合与解离动力学来检测该基底上的所述分析物的系统。在一些实施方案中,该基底包含固定的捕获探针。在一些实施方案中,该查询探针是荧光标记的核酸,其以大于0.1min-1的动力学速率常数koff和/或大于0.1min-1的动力学速率常数kon反复与该分析物缔合。在一些实施方案中,配置为检测所述分析物的系统包含荧光检测器。在一些实施方案中,配置为检测所述分析物的系统包含配置为将二态模型与查询探针结合数据拟合的软件组件。在一些实施方案中,该系统进一步包含离心机。在一些实施方案中,该系统进一步包含样品槽,所述样品槽包含面积为0.01至10mm(例如0.01、0.02、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、1、2、3、4、5、6、7、8、9或10mm)的受限开口。系统的这些各种组件(例如atps、计算机、样品槽、查询探针、捕获探针、基底以及动力学检测方面)在本申请通篇中更充分地予以描述,其相关部分经此引用并入本文。一些实施方案涉及用于检测分析物的附加系统实施方案。例如,在一些实施方案中,该技术提供了包含电泳浓缩池的系统(例如包含能够容纳含有分析物的溶液的内部腔室和能够容纳缓冲液的外部腔室);用于由所述内部腔室捕获所述分析物的基底;和配置为通过分析可检测地标记的查询探针对所述分析物的缔合与解离动力学来检测该基底上的所述分析物的系统。在一些实施方案中,系统包含多孔材料(例如聚合物)以提供电泳样品池外部腔室的基层,其中所述多孔材料允许电流在电泳池的外部腔室与内部腔室之间流动,但尽量减少和/或消除电泳池的外部腔室与内部腔室之间的分析物流动。在一些实施方案中,提供包含单体的组合物,使用者聚合所述单体以便在构建该电泳样品池时提供所述基层供使用。在一些实施方案中,该基层的多孔基质附加地通过在向样品腔室中加入分析物之前引入内部腔室并通过施加电压迁移到基层中的带电荷的支链聚合物(例如葡聚糖硫酸酯)的分解来堵塞。在一些实施方案中,该基底包含固定的捕获探针。在一些实施方案中,该查询探针是荧光标记的核酸,其以大于0.1min-1的动力学速率常数koff和/或大于0.1min-1的动力学速率常数kon反复与该分析物缔合。在一些实施方案中,配置为检测所述分析物的系统包含荧光检测器。在一些实施方案中,配置为检测所述分析物的系统包含配置为将二态模型与查询探针结合数据拟合的软件组件。在一些实施方案中,该系统进一步包含电压源(例如直流电源或交流电源)。在一些实施方案中,该电泳池的内部腔室包含面积为0.01至10mm(例如0.01、0.02、0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、1、2、3、4、5、6、7、8、9或10mm)的受限开口。系统的这些各种组件(例如电泳池、计算机、内部腔室和外部腔室、查询探针、捕获探针、基底以及动力学检测方面)在本申请通篇中更充分地予以描述,其相关部分经此引用并入本文。该技术的实施方案涉及组合物,例如双水相体系(atps)。在一些实施方案中,该atps包含聚乙二醇(peg)和柠檬酸盐。在一些实施方案中,该atps进一步包含盐(例如氯化钠)。在atps的一些实施方案中,该atps包含大于30%的peg的质量分数、小于2.5%的柠檬酸盐的质量分数,并且盐的浓度大于0.25m。在一些实施方案中,所述peg的分子量为1000至6000da。在一些实施方案中,所述柠檬酸盐以提供5.5至8.5的ph的比的柠檬酸与柠檬酸钠的形式存在。也就是说,在一些实施方案中,该技术提供了一种组合物(例如atps),其包含在该组合物中的质量分数大于30%(例如大于30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、70、71、72、73、74或75%)的peg;包含在该组合物的质量分数小于2.5%(例如小于1.00、1.25、1.50、1.75、2.00、2.25或2.50%)的柠檬酸盐。在一些实施方案中,该技术提供了一种组合物,该组合物以超过0.25m(例如超过0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、1.0、1.1、1.2、1.3、1.4或超过1.5m)的浓度包含氯化钠。在一些实施方案中,该peg在该组合物中具有600至8000da(例如600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900、3000、3100、3200、3300、3400、3500、3600、3700、3800、3900、4000、4100、4200、4300、4400、4500、4600、4700、4800、4900、5000、5100、5200、5300、5400、5500、5600、5700、5800、5900、6000、7000或8000da)的平均分子量。在一些实施方案中,该组合物中柠檬酸对柠檬酸钠的比提供了5.5至8.5的ph(例如5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4或8.5的ph)。在一些实施方案中,该atps进一步包含分析物。在一些实施方案中,该atps包含第一相和第二相,并且该第一相包含所述分析物的浓度大于第二相中该分析物的浓度(例如是第二相中该分析物浓度的至少大约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20倍)。在一些实施方案中,该atps包含第一相和第二相,并且该第二相的体积大于该第一相的体积(例如是第一相体积的至少大约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20倍)。在一些实施方案中,该分析物是核酸(例如包含小于200个碱基对或核苷酸(例如小于200、195、190、185、180、185、180、175、170、165、160、155、150、145、140、135、130、125、120、115、110、100、95、90、85、80、75、70、65、60、55、50、45、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9或8个碱基对或核苷酸)的核酸)。在一些实施方案中,该分析物是包含小于40个碱基对或核苷酸(例如小于40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9或8个碱基对或核苷酸)的核酸。在一些实施方案中,该分析物是单链核酸。在一些实施方案中,该分析物是双链核酸。在本文中的其它地方提供了捕获探针、查询探针和分析物的进一步描述。一些实施方案涉及试剂盒。例如,实施方案提供包含聚乙二醇(peg)和柠檬酸盐的试剂盒。在一些实施方案中,试剂盒进一步包含含有受限开口的样品槽。一些实施方案包含电泳样品池、电压源、和/或提供本文中所述的样品池的外部腔室的多孔基层的多孔材料(例如聚合物)。一些试剂盒包含用于捕获和/或固定分析物的基底。在本文中的其它地方描述了atps样品槽和电泳样品池,并且适当的描述经此引用并入本文。在一些实施方案中,该方法、系统、atps组合物和试剂盒可用于分析单个细胞、细胞器、无膜细胞器、细胞群、囊泡(例如外泌体)或分子。基于本文中包含的教导,附加实施方案对相关领域技术人员将显而易见。附图概述参照以下附图将更好地理解本技术的这些和其它特征、方面与优点:图1a、1b和1c显示了使用双水相体系来浓缩表面附近的dna生物标志物,以提高捕获效率和检测灵敏度,这可以通过在双链突变dna的simreps测定中增加检测到的分子来证实。图1a是显示使用双水相体系来浓缩表面附近的生物标志物以提高捕获效率和检测灵敏度的技术的实施方案的步骤的图。在图1a中,dna分析物在双水相体系的少数相(例如体积较小的相)中浓缩,随后在表面处(例如通过单分子分析(例如通过本文中所述的simreps))从少数相中捕获该分析物用于分析。通常在大约1000×g下离心10-120分钟以便在盖玻片表面处提供分析物的高捕获效率。但是,在本文中提供的技术的开发过程中进行的试验表明,在1000×g下离心大约1分钟足以提供相分离。图1b显示了未根据本文中提供的atps技术进行浓缩(“–atps”)和在根据本文中提供的atps技术进行浓缩之后(“+atps”)在表面上捕获和成像的分析物的两张照片。每张照片显示大约52×52µm2的显微镜视野。在图1b中,该分析物是编码egfr的t790m取代(一种在临床上重要的egfr突变,导致在非小细胞肺癌中的治疗耐受性)的28个碱基对的dna片段。图1c是显示使用双水相体系(例如包含peg3350(例如大约39%w/w)、柠檬酸钠(例如大约1.2w/w)和氯化钠(例如大约2.8%w/w))将egfr变体t790m的动力学指纹分析的灵敏度提高80倍以上的图。对表面捕获的egfr变体t790m分析物进行成像并通过图像分析技术。在不存在根据本文中提供的atps技术的浓缩的情况下计数的密度为每大约118×118µm2面积25个固定在表面上的分析物。相反,在根据本文中提供的atps技术在表面处浓缩分析物之后计数的密度为每大约118×118µm2面积2001个固定在表面上的分析物。图2显示了定制的样品槽的图和照片,这些样品槽形成了与下方基底的受限接触面积(0.01-1mm2),由此可以将富含分析物的相集中在固体支承物(例如盖玻片)的小区域上,从而对分析物进行有效的表面捕获和检测。图3显示了使用通过平衡泊松采样的单分子识别(simreps)或单分子动力学指纹分析以高特异性和单分子灵敏度对分析物进行检测。图3a是描绘适于dna检测的试验simreps方法的图。在高浓度单链dt10载体的存在下采用短暂的热变性将双链(双螺旋)dna转化为单链dna,从而不利于互补分析物链的再退火。通过固定在载玻片表面上的靶标基因特异性锁定核酸捕获链来捕获单链靶标dna,剩余的未结合dna被洗掉,随后用突变特异性荧光探针进行动力学指纹分析,所述荧光探针经过优化以具有快速结合和解离动力学。图3b显示了dna链型和短暂热变性对两个突变体靶标dna等位基因检测到的分子数量的影响(显示为“计数”)。数据以平均值±s.e.m.表示,n=3个独立测量值。图3c至3d显示了对(c)egfr外显子19/缺失(c.2236_2250del15)和(d)egfr外显子20t790/m(c.2369c>t)使用具有突变体dna(mutdna)、具有野生型dna(wtdna)或不具有dna(无dna对照物)的突变体特异性荧光探针的代表性动力学迹线。试验过程中记录的荧光强度迹线以黑色显示(“噪声”迹线);来自隐马尔可夫模型的2态理想化显示为灰色线(“噪声”迹线的平滑、平方拟合)。(e)egfr外显子19缺失和egfr外显子20t790m的来自simreps测定的标准曲线。误差加权线性拟合被约束为0的y截距;r2=0.982(外显子19缺失)、0.999(t790m)。数据以平均值±s.e.m.表示,n=3个独立测量值。fov,视野。图4是由浊点浊度测定收集的数据绘制的双结点曲线。数据表明在存在2.8%w/wnacl的情况下产生单一水相(曲线下方)或两个水相(曲线上方)的二水合柠檬酸钠与peg-3350的浓度。图5是显示在三种不同基质中温育1小时后通过simreps动力学指纹法在每个视野中检测到的28个核苷酸的dna寡核苷酸的分子数量(“接受计数”)的图:pbs(100µl样品体积);pbs+peg/柠檬酸钠/naclatps(100µl在pbs中的样品体积,在添加到形成atps的组分中之前);pbs+peg/柠檬酸钠/naclatps(20µl在pbs中的样品体积,在添加到形成atps的组分中之前)。图6是显示从人尿液样品中分离并随后借助双水相体系通过simreps动力学指纹法分析的来自egfr基因的内源性低分子量dna片段的无pce检测的图,所述双水相体系由peg3350(39%w/w)、柠檬酸钠(1.2%w/w)和nacl(2.8%w/w)组成。该双水相体系产生足够的灵敏度以便用野生型探针(wt)检测野生型dna,但是在高于背景的水平下未检测到突变体dna(mut探针)。图7是显示通过包含互补寡核苷酸以防止双链dna在热变性和在双水相体系中浓缩后的再杂交所提供的检测灵敏度提高的图。在存在(+tile)或不存在(–tile)与28个碱基对的双链体的靶标链部分互补但不掩盖其与14个碱基对(这会干扰表面捕获)的14个碱基的寡核苷酸(“tile”)的情况下对28个碱基对的双链dna片段(10fm的对应于egfr基因区域的靶标dna)进行热变性。在热变性后将混合物冷却,随后与冻干成分充分混合以形成双水相体系(1.2%w/w柠檬酸钠、2.8%w/wnacl、39%w/wpeg3350),由此浓缩dna以便固定在涂有含lna的捕获探针的盖玻片上,该捕获探针与28个碱基对的双链体的靶标链部分互补。图8是显示在包含互补的短寡核苷酸(例如长度为14个碱基对)或“模块(tiles)”以防止靶标的两个互补链的再杂交时,以更高的效率捕获更长的双链dna靶标的图。从其中模块用于改善捕获含t790m突变的egfr基因的60bp和160bp片段的试验中收集数据。通过包含模块寡核苷酸,捕获效率提高了~8至9倍。图9是本文中描述的电泳样品池的实施方案的示意图。图10是在本文中描述的技术的实施方案的开发过程中构建并测试的电泳样品池的实施方案的照片。图11a是描述使用电泳样品池在表面(例如盖玻片)处浓缩分析物(例如dna)的示意图。图11b是显示施加于本文中所述的电泳样品池的电压与表面处的归一化dna浓度随时间而变的图。电压在0v和大约170v之间循环;通过测量附着在dna上的荧光标记在表面处的荧光来检测表面处的dna浓度。dna浓度为大约0-50至大约350(无单位,归一化浓度),并通过迹线显示,高峰值在大约10-15分钟处。大约50-100的浓度处的平滑线是表面处的归一化dna浓度的滑动平均。图12a显示了聚丙烯酰胺电泳凝胶试验的图像,该实验量化了peg/柠檬酸钠/氯化钠双水相体系中28个核苷酸的单链dna的分配。图12b是柱形图,显示了来自图12a的凝胶带的量化,以测量平衡后peg和柠檬酸钠/氯化钠相中28个核苷酸的单链dna的量。在装载到凝胶上之前,将富含柠檬酸盐的相相对于富含peg的相稀释500倍,以允许在单个仪器上同时在两个泳道中对dna进行量化而不会使检测器饱和。用sybr金进行染色。图13是柱形图,其显示了通过后接sybr金染色的聚丙烯酰胺凝胶电泳测得的在存在或不存在2.8%w/wnacl的情况下在peg/柠檬酸钠atps中28个核苷酸的单链dna寡核苷酸的分配的量化。在装载到凝胶上之前,将富含柠檬酸盐的相相对于富含peg的相稀释500倍,以允许在单个仪器上同时在两个泳道中对dna进行量化而不会使检测器饱和。误差条表示基于三个独立的重复试验的+/-一个标准偏差。图14是柱形图,其显示了在具有或不具有用peg/柠檬酸钠/naclatps的预富集的情况下通过simreps对微小rna的量化。使用该atps可以将灵敏度显著提高大约9倍。误差条表示来自两个独立的重复试验的一个标准偏差。要理解的是,附图不一定按比例绘制,附图中的对象也不一定彼此关联地按比例绘制。附图是意在使本文中公开的设备、系统和方法的不同实施方案清晰明了的描述。在可能时,在附图通篇中使用相同的附图标记来指示相同或类似的部分。此外,应当理解,附图并非意在以任何方式限制本教导的范围。发明详述本文中提供了涉及检测分析物的技术,特别但非排它地涉及在表面浓缩分析物以便对低丰度分析物进行成像和检测的组合物、方法和系统。在极低浓度(例如小于10–15m或1飞摩尔,fm)下检测分析物(例如生物分子)在医学诊断(例如用于非侵入性液体活检)、研究(例如用于单细胞分析)和更广泛地在分析化学领域中引起人们极大的兴趣,但是对大多数分析物而言实现这一点是富有挑战性的。例如,常规的酶联免疫吸附测定法(elisa)通常可以实现10-1000fm的检测限(参见例如rissin等人(2010)“single-moleculeenzyme-linkedimmunosorbentassaydetectsserumproteinsatsubsubfemtomolarconcentrations”nat.biotechnol.28:595-99)。尽管可以采用扩增(例如通过利用聚合酶链反应pcr的方法)以<10个拷贝的绝对数量检测核酸,但是此类扩增引入人工痕迹(参见例如potapov&ong(2017)0“examiningsourcesoferrorinpcrbysingle-moleculesequencing”plosone12:e0169774)如复制错误、热诱导的化学损伤(如胞嘧啶脱氨基为尿嘧啶)、以及某些方案所需的扩增或衔接子序列的连接反应中的序列依赖性偏置(参见例如thiel等人(2011)“核苷酸biasobservedwithashortselexrnaaptamerlibrary”nucleicacidther.21:253-63;paweletz等人(2016)“bias-correctedtargetednext-generationsequencingforrapid,multiplexeddetectionofactionablealterationsincell-freednafromadvancedlungcancerpatients”clin.cancerres.22:915-22)。此外,dna或rna的扩增通常不会拷贝表观遗传修饰,如修饰的碱基(例如5-甲基胞嘧啶、5-羟甲基胞嘧啶或n6-甲基腺嘌呤),需要亚硫酸氢盐处理以区分修饰和未修饰的碱基;但是,亚硫酸氢盐处理导致高达80%的dna的断裂和损坏(参见例如grunau等人(2001)“bisulfitegenomicsequencing:systematicinvestigationofcriticalexperimentalparameters”nucleicacidsres.29:e65),并且不能区分许多类型的在生物学上重要的修饰(如区分5-甲基胞嘧啶和5-羟甲基胞嘧啶;参见例如huang等人(2010)“thebehaviourof5-hydroxymethylcytosineinbisulfitesequencing”plosone5:e8888)。最后,核酸的短片段(<40个碱基对),如在尿液的跨肾dna中发现的那些,因其小尺寸和pcr底物的长度要求很难或无法直接通过pcr来扩增。由于极低的总输入材料、许多分析物的低拷贝数、连接酶的序列偏差和许多加工酶在此类低输入下的低效率,即使采用基于pcr的方法(在核酸的情况下),对从单个细胞中分离的许多分析物的分析也是低效的。一些超灵敏的下一代方法已经报道了低飞摩尔和亚飞摩尔检测限,但通常仍具有比分析物的单拷贝水平高几个数量级的检测限(参见例如rissin等人(2010)“single-moleculeenzyme-linkedimmunosorbentassaydetectsserumproteinsatsubfemtomolarconcentrations”nat.biotechnol.28:595-99(2010);cohen等人(2017)“digitaldirectdetectionofmicrornasusingsinglemoleculearrays”nucleicacidsres.45:e137)。共同待决的申请美国专利申请系列号14/589,467;国际专利申请号pct/us2015/044650;国际专利申请号pct/us2017/016977;和美国临时申请系列号62/468,578(其各自经此引用全文并入本文)描述了称为“通过平衡泊松采样的单分子识别”(simreps)的技术,该技术以理论上无限的精度检测单个分析物(例如微小rna分子)的存在(还参见例如johnson-buck等人(2015)“kineticfingerprintingtoidentifyandcountsinglenucleicacids”nat.biotechnol.33:730-32)。在这种方法中,通常使用稳定结合的捕获探针(如锁定核酸探针)在固体支承物的离散区域中捕获相关分析物,并随后通过查询探针反复探测该分析物的第二表位或结合区。在一些实施方案中,该技术检测分析物如单链核酸;此外,在一些实施方案中,通过在表面捕获之前采用变性方案,该技术还检测双链核酸(参见例如图3a),并表现出大于99.99998%的对点突变(egfrt790m)的特异性。但是,尽管该方法检测单个分子,但是数据表明,实现极低检测限(亚飞摩尔,最终可与基于pcr的方法相比)的限制因素在于实现分析物向用于检测的固体支承物的有效传质。因此,本文中描述的技术涉及提高分析物向固体支承物的传质效率(例如提高在固体支承物区域上捕获的分析物的分数或量和/或能够在合理量的测量时间内进行测量)。在开发本文中提供的技术的实施方案的过程中,进行了试验以便通过多种策略来提高分析物向固体支承物的传质,这些策略包括但不限于:(1)分析物与捕获探针或固体支承物之间的缔合速率常数,如通过改变ph、盐组成或浓度;(2)提高分析物在固体支承物附近的有效浓度或实际浓度,如通过蒸发、施加电场(对带电荷的分析物)或引入分子拥挤剂(molecularcrowdingagent)如聚乙二醇(peg)或葡聚糖;和/或(3)提高温育时间(参见例如实施例10)。进行了试验,其中测试了这些策略以提供用于simreps试验的固定化分析物,并收集了描述这些方法对simreps测定(特别是用于检测核酸)的灵敏度的影响的数据。数据表明,对含有egfr突变的dna的28个核苷酸片段,该测定的灵敏度提高大约2至5倍(参见例如实施例10)。在这些测定中,通过以下方法确定相对灵敏度:在采用所示策略后测定每个视野(fov)的阳性检测事件,并将其除以使用标准温育条件(pbs缓冲液,1小时)的每视野fov阳性检测事件,并四舍五入为最接近的整数。令人惊讶的是,将捕获温育时间提高18倍仅使灵敏度提高大约2倍,表明捕获反应在远小于18小时内达到平衡,并且捕获探针的有限亲和力或对样品池壁的非特异性分析物吸附限制了可以捕获的分析物的量。在含有通常用于杂交反应的添加剂(例如甲酰胺、吐温20、葡聚糖硫酸酯等等)的不同缓冲液中的温育在灵敏度方面的改善同样不佳。预期降低捕获面积(由25mm2的标准面积降低至<1mm2)预期将捕获的分析物的密度提高最多25倍,但是实际上提高约3倍。还使用注射泵尝试重复混合溶液以克服因dna在>1mm的距离上的缓慢扩散造成的捕获效率限制;但是,这并未显著改善灵敏度。也许最令人惊讶的是,在乙醇沉淀后将分析物重新悬浮在较小体积的溶液中也没有发现显著的改善,也许是因为乙醇沉淀的过程破坏了捕获表面(例如沉淀晶体对表面的微尺度磨损,或引入有机溶剂)。虽然原则上可以在单独的容器中进行较小体积的乙醇沉淀和再悬浮,但这在有效地在极小体积(例如1µl)内再悬浮少量物质并有效转移该小体积方面带来了实际挑战。将样品分配到样品槽中之后蒸发50-99%的溶剂效果更好,但灵敏度的提高不超过5倍,即使样品体积的减少远超过5倍(例如接近完全蒸发,留下样品体积的<5%),即使将缓冲液成分的浓度降低至10倍以抵消溶剂蒸发后缓冲液和盐结晶的问题。如在本文中描述的技术的实施方案的开发过程中进行的试验所示,改善simreps的灵敏度的成功方法包括例如将simreps与使用双水相体系(atps)或电泳样品池预浓缩分析物相结合。当两种水溶性组分——例如两种聚合物或聚合物与盐——超过阈值浓度并分离为具有不同组成的两个水相时,出现双水相体系或atps(iqbal等人(2016)“aqueoustwo-phasesystem(atps):anoverviewandadvancesinitsapplications”biol.proced.online18)。几种类型的atps选择性地将生物分子(包括dna和蛋白质)划分到两相之一中,有时对其中一个相具有>1000倍的偏好(alberts(1967)“efficientseparationofsingle-strandedanddouble-strandeddeoxyribonucleicacidinadextran-polyethyleneglycoltwo-phasesystem”biochemistry(mosc.)6:2527-32)。当两种atps组分之一相对于另一种过量存在时,两种所得相在平衡时可以具有不等的体积,使得能够在较小的相中浓缩感兴趣的生物分子(iqbal等人(2016)“aqueoustwo-phasesystem(atps):anoverviewandadvancesinitsapplications”biol.proced.online18)。作为增强单分子测定灵敏度的方法的一个具体实施方案,该技术包括使用atps在小的成像表面区域上浓缩dna的非常稀(大约等于或小于10fm)的溶液以快速和有效地捕获分析物(参见例如实施例1和图1)。在该方法中,将dna样品热变性,与形成atps的组分剧烈混合,随后短暂离心以便将富含dna的下相放置在成像表面附近。该方法是非常简单的过程,在仅几分钟内完成,尽管通常离心持续10、30、60或120分钟以提高富含分析物的相与分析物捕获至其上的固体支承物(如盖玻片)之间的接触时间量。或者,可以采用短暂离心(例如1分钟)来分离该atps的相,随后进行10、30、60或120分钟(或至多24小时)的较长的温育时间,而不离心以便进行分析物捕集。几种atps组合物已经显示可以选择性分配dna,包括聚乙二醇(peg)/柠檬酸钠(sc)(参见例如gomes等人(2009)“purificationofplasmiddnawithaqueoustwophasesystemsofpeg600andsodiumcitrate/ammoniumsulfate”sep.purif.technol.65:22-30)、peg/硫酸钠(参见例如nazer等人(2017)“partitioningofpyrimidinesinglestrandedoligonucleotideusingpolyethyleneglycol–sodiumsulfateaqueoustwo-phasesystems;experimentalandmodeling”fluidphaseequilibria432:45-53)和peg/葡聚糖(参见例如alberts(1967)“efficientseparationofsingle-strandedanddouble-strandeddeoxyribonucleicacidinadextran-polyethyleneglycoltwo-phasesystem”biochemistry(mosc.)6:2527-32)。尽管已经显示质粒dna对一个相表现出超出另一相100至1000倍的选择性(参见例如alberts,同上;参见例如nazer,同上),并且一项研究已经检查了长度为大约20个核苷酸的单链聚嘧啶dna分子在peg/硫酸钠体系中的分配(参见例如nazer,同上),先前无法预测或得知atps技术能否将短核酸片段(例如在生物流体中存在的双链dna片段、短rna如微小rna、或不同序列的含有嘌呤或嘧啶碱基的单链dna)浓缩到小体积中。此外,硫酸钠在水中的溶解度不佳也限制了peg/硫酸钠atps的实用性,这常常导致在atps形成时产生沉淀,这特别限制了基于表面的测定的适用性。此外,尽管最近已经报道了使用电泳捕获dna的亚纳克级输入以进行测序的策略(larkin等人(2017)“length-independentdnapackingintonanoporezero-modewaveguidesforlow-inputdnasequencing”nat.nanotechnol.),该技术需要电子束光刻法以便在传感器芯片下方的膜中产生纳米孔隙阵列(larkin等人(2014)“reversiblepositioningofsinglemoleculesinsidezero-modewaveguides”nanolett.14:6023-29),这增加了制造该测序平台中使用的零模波导的已然不菲的成本。相反,本文中描述的电泳浓缩方法提供了对包含许多类型的稀分析物的样品进行有效的表面基分析的低成本和通用的方法。基于simreps开发过程中收集的数据以及检测分析物的其它试验,建立了适用于simreps和其它灵敏的分析物检测技术的atps和电泳浓缩方法的标准。atps和电泳浓缩方法的主要目的是有效地将相关分析物分配到较小的体积中,从而实现分析物浓度的净提高。此外,该技术:(1)不会破坏分析物捕获所需的表面化学(例如链亲和素-生物素相互作用);(2)不干扰固体支承物的钝化(例如通过涂布peg、peg-生物素、或疏水性分子),这可以在单分子测定过程中将查询探针的非特异性结合提高至抑制水平,导致假阳性或假阴性信号;并且(3)不干扰捕获化学(例如不降低分析物对固体支承物或捕获探针的亲和力,并且不降低该分析物与固体支承物结合的动力学)。此外,适当的atps技术优选将分析物分配到两相中更稠密的部分中,允许通过重力或离心使富含分析物的相与固体支承物接触(参见例如图1a),尽管通过反转样品槽与固体支承物的相对方向,也可以利用在较不稠密的相中的富集,只要防止气泡积聚。在本文中提供的技术的实施方案的开发过程中进行的试验之前,还不知晓或可预测双水相体系能否满足对给定分析物和simreps测定的所有要求;确实,虽然在这些试验过程中收集的数据表明,peg/葡聚糖atps非常有效地分配了短单链dna,peg/葡聚糖atps方法在改善分析物向基底的递送和/或改善simreps的灵敏度方面并不像基于peg/柠檬酸钠的atps那么成功(参见例如实施例10)。不受理论的束缚,peg/葡聚糖atps的限制可能是由于富含葡聚糖和富含dna的相的高粘度,这会限制捕获动力学。对于将atps应用于短的单链和双链dna(例如小于200、190、180、170、160、150、140、130、120、110、100、95、90、85、80、75、70、65、60、55、50、45、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10或小于10个nt或bp),在本文中描述的技术的实施方案的开发过程中收集的数据表明,包含peg3350、柠檬酸钠和氯化钠的混合物的atps有效地分配和浓缩了短的单链或双链dna(例如长度小至20-30个bp),将用于egfrt790m的simreps测定的灵敏度提高了大约80倍(图1b;图1c),这表明大约100个分子拷贝的检测,并由此接近基于pcr的分析的灵敏度。在在本文中描述的技术的实施方案的开发过程中收集的分光光度法数据进一步显示了包含peg3350、柠檬酸钠和氯化钠的混合物的atps将长度小至8个核苷酸的dna优先分配到富含柠檬酸盐的相中的能力,尽管其分配系数比20个核苷酸的dna链的分配系数要低,并且其方式容易被dna的化学修饰干扰(例如有机荧光团cy5缀合到8个核苷酸的dna单链dna分子上,导致该dna优先分配到富含peg的相中,而不是富含柠檬酸盐的相中;对长于20个核苷酸的dna分子没有观察到这种反转)。在一些实施方案中,通过使用定制样品池来改善该测定的灵敏度,该样品池在狭窄的、界限分明的用于分析物捕获的区域上与固体支承物接触(参见例如图2;实施例2)。优化构建此类样品池以允许使用移液管或其它混合和分配设备,同时避免溶液或气泡在底部附近的潜在截留(例如通过确保下方的固体支承物与样品池内壁之间的接触角>45°(相对于垂直方向限定))。当使用本文中描述的atps体系的实施方案时,特别重要的是将两相形成试剂(例如peg和柠檬酸钠)的总浓度维持在高于形成两个水相所需的阈值之上。例如,在peg-3350/柠檬酸钠/nacl体系中,保持nacl浓度恒定,使用浊点测定法进行试验以确定产生单相或两相行为的混合物组合物(参见例如实施例4和图4),由所谓双结点线分隔。此外,重要的是选择一种其中柠檬酸钠含量远低于peg-3350(例如1-5%的柠檬酸钠(例如1、1.5、2、2.5、3、3.5、4、4.5或5%的柠檬酸钠)和30-45%的peg-3350(例如30、31、32、33、34、35、36、37、38、39、40、41、42、43、44或45%的peg-3350))的组合物,使得富含dna的柠檬酸盐相占该体系的质量与体积的一小部分(例如<5%),由此相对于其原始浓度将dna浓缩>10倍。在本文中提供的技术的实施方案的开发过程中收集的数据表明,添加1-15%(例如1、2、3、4、5、6、7、8、9、10、11、12、13、14或15%)的氯化钠可以增强短核酸(特别是在10-40个核苷酸的范围内)在柠檬酸钠相中的分配(参见例如实施例5)。虽然先前在文献中已经报道了nacl改变某些蛋白质的分配并改变peg/柠檬酸钠混合物的相行为(参见例如azevedo等人(2009)“partitioningofhumanantibodiesinpolyethyleneglycol–sodiumcitrateaqueoustwo-phasesystems”sep.purif.technol.65:14-21),先前还不知道或可以预测添加nacl可以增强核酸(尤其是短的寡核苷酸)在peg/柠檬酸盐atps中的分配。此外,由本文中描述的技术的实施方案的开发过程中进行的试验收集的数据显示了荧光标记和未标记的dna寡核苷酸、单链和双链dna寡核苷酸以及荧光标记和未标记的微小rna的类似分配(参见例如实施例9)。尽管通常通过混合相形成组分的浓缩水性贮存液来形成atps,但在本文中提供的技术的实施方案的开发过程中进行的试验表明,重要的是从贮存液混合物中尽可能多地减少水分以最大程度地浓缩稀分析物,以提高基于表面的测量的灵敏度。但是,考虑到高浓度因子(例如柠檬酸盐和peg之间<1:10的比例)所需的一些组分的质量分数较低,以及许多应用的输入体积较小(例如<100微升),难以以可重复行为所需的精度(例如在重复测量之间的变异系数<25%)和灵敏度来等分固体试剂如peg-3350、柠檬酸钠和nacl。在本文中提供的技术的实施方案的开发过程中进行的试验期间收集的数据表明,这种方法有时导致两相的体积可变,有时导致无法形成两相。预混合更大量的固体粉末或纯净液体(例如在peg-600的情况下,其有时代替该atps中的peg-3350)类似地产生不佳的可重复性,可能是因为该固体固有的粒度和离散性。相反,在本文中提供的技术的实施方案的开发过程中进行的试验表明,制备包含正确比例的组分(例如6.934克的peg-3350、0.498克的nacl、0.208克的柠檬酸钠和30毫升去离子水)的单相预混料,等分并冻干该混合物以获得已知质量的成分明确的丸粒,并随后将设定体积的分析物溶液或混合物添加到这些冻干丸粒中,产生了可重复性高得多的结果(参见例如实施例5和表1)。这些试验过程中收集的数据表明,改变冻干混合物中柠檬酸钠的浓度改变了富含dna的相的体积分数,并因此改变了最终混合物中dna的浓度。在本文中描述的技术的实施方案的开发过程中进行的试验表明了与使用atps以提高单分子和基于表面的测定(例如用于短双链dna的simreps测定)的灵敏度有关的几个方面。首先,由于高盐浓度,peg/柠檬酸钠/nacl体系在宽范围的包含分析物(例如去离子水、pbs、te、tbe或生物流体(例如尿液上清液))或添加剂(例如sds(例如2%)/蛋白酶k)的输入组合物方面表现出色。其次,用于制造冻干混合物的柠檬酸钠/柠檬酸的ph值可以在6.5至8.5之间改变,对simreps测定的灵敏度影响最小,尽管低于大约7.0的ph观察到计数的略微降低(参见例如实施例11)。有趣的是,虽然在ph5.91处仅观察到一个相,peg/柠檬酸钠混合物相对于单独的pbs仍显著提高了测定的灵敏度,尽管未能达到相同的peg/柠檬酸钠组成的双水相体系的程度。第三,dna溶液的输入体积可以从100µl降低到20µl,而灵敏度没有成比例下降,表明以低输入体积提供了更高的灵敏度(就检测到的分析物的总拷贝数而言),这允许分析物通过少量的下相快速扩散至固体支承物以进行捕获。为了展示应用于临床相关试样,使用peg/柠檬酸钠/naclatps增强表面捕获,在本文中提供的技术的开发过程中进行的实验表明,对从人类尿液中分离并对低分子量(<500bp)dna所选的dna中的egfr基因的片段,该技术检测到了明显的阳性信号(例如参见图6和实施例7),所述方法意在从衍生自尿道上皮细胞的dna中分离跨肾dna。相反,在健康尿液dna样品中未检测到t790m突变(mut)的统计学显著的阳性信号,表明该atps不干扰特异性(参见例如图6和实施例7)。此外,通过用尿嘧啶-dna糖基化酶处理以去除脱氨基的胞嘧啶(尿嘧啶)进一步降低了统计上不显著的mut信号,这是在胞嘧啶-胸腺嘧啶突变(如t790m)的生物学测定中常见的假阳性来源。将atps用于双链dna或在捕获前必须与结合配偶体解离的其它分析物的另一个要点在于,使用atps组分(通常为分子拥挤剂或盐)可能会在无意间促进再结合或再杂交,这会降低表面捕获的效率。例如,高浓度(例如>0.1m)的盐(如柠檬酸钠和nacl)可以极大提高dna杂交的动力学——通常提高几个数量级(参见例如dupuis等人(2013)“single-moleculekineticsrevealcation-promoteddnaduplexformationthroughorderingofsingle-strandedhelices”biophys.j.105:756-66)。由于缔合动力学几乎总是与试剂浓度成正比,将此类材料浓缩到较小的相中可能会对再结合产生相似甚至更强的影响。分析物与其结合配偶体的再结合可能依赖于其在表面的捕获而对测定的灵敏度产生不利影响。为了避免这一问题,在本文中提供的技术的开发过程中进行了试验,其中相对于该分析物以过量引入短的互补寡核苷酸以防止一旦dna在柠檬酸盐相中浓缩时该互补链的再杂交。在双链dna热变性之前或在变性之后立即引入该寡核苷酸。在这些试验过程中收集的数据表明,添加该寡核苷酸后,simreps测定对t790m的灵敏度提高了大约6倍(参见例如图7和实施例8)。类似地,在这些试验过程中收集的数据表明,向样品中添加短的互补寡核苷酸促进了更长(例如60或160个碱基对)的dna链的变性(参见例如图8和实施例8)和/或螯合可能干扰分析物在表面的捕获或查询探针的探测的二级结构。总之,本文中描述的技术的实施方案涉及通过使用双水相体系预浓缩分析物在不进行扩增的情况下检测低级拷贝数(例如大约100个)的分析物,并改善其在表面的捕获效率,随后用单分子灵敏的测定(例如simreps)检测该分析物。在一些实施方案中,选择atps以促进分析物的有效浓缩并促进有效捕获。在一些实施方案中,该atps与下游的测定要求(如表面化学和对探针结合的钝化)相容。虽然浓缩可能引入附加的灵敏度挑战,但在该技术的实施方案的开发过程中进行的试验表明,可以通过引入合适的载体或再结合的非特异性抑制剂(如dt10)或特定竞争者(如互补的模块寡核苷酸)来克服这些挑战。该方法可用于临床和生物医学应用,如检测从生物流体(例如尿液)中分离的低丰度和低分子量dna片段。它对添加去污剂和酶的敏感性和鲁棒性进一步使其成为单细胞分析的诱人选项,包括低丰度组分(如稀有的微小rna、dna序列和蛋白质)的多重分析。在各种实施方案的详述中,出于解释的目的,阐述了大量具体细节以提供公开的实施方案的彻底理解。但是,本领域技术人员将了解,可以在有或没有这些具体细节的情况下实践这些各种实施方案。在其它情况下,以框图形式显示了结构和装置。此外,本领域技术人员可以容易地认识到,呈现和执行所述方法的具体顺序是示例性的,并且可以设想的是,所述顺序可以改变并仍保留在本文中公开的各种实施方案的精神和范围内。本申请中引用的所有文献和类似的材料(包括但不限于专利、专利申请、文章、书籍、论文和因特网网页)出于任何目的明确地经此引用整体并入本文。除非另行限定,本文中使用的所有技术和科学术语具有与本文描述的各个实施方案所属领域的普通技术人员通常理解相同的含义。当并入的参考文献中的术语的定义看起来不同于在本教导中提供的定义时,以本教导中提供的定义为准。在本文中使用的章节标题仅仅用于组织目的,不应解释为以任何方式限制所述主题。说明如本文中所述,该技术提供了用于在表面处移动和/或浓缩分析物的组合物、方法和系统,例如用于低丰度分析物的成像和检测。例如,在一些实施方案中,使用电泳池在表面处浓缩分析物(例如通过使用电压以便在表面处移动和浓缩分析物)。此外,在其它示例性实施方案中,分析物(例如核酸(例如dna)、蛋白质等等)优先分配到双水相体系的两相之一中。在涉及双水相体系的一些实施方案中,富含分析物的相的体积小于原始分析物混合物,这在新的富含分析物的相中产生了更高的分析物浓度。例如,在开发本文中提供的技术的实施方案的过程中,进行了试验,在该试验中,使用包含peg3350、柠檬酸钠和氯化钠的atps将dna浓缩10倍以上,随后在表面上捕获浓缩的dna用于后续分析。在一些实施方案中,将富含分析物的相暴露于(例如接触)表面以便进行后续分析(例如通过诸如(但不限于)荧光显微镜法、simreps等等的方法)。此外,例如,在开发本文中提供的技术的实施方案的过程中,进行了试验,在该试验中,使用电泳池将dna在表面处浓缩10倍以上。在一些实施方案中,将包含分析物的溶液暴露于(例如接触)表面以便进行后续分析(例如通过诸如(但不限于)荧光显微镜法、simreps等等的方法)。在一些实施方案中,该表面是盖玻片、显微镜载玻片、胶体粒子或相界。在一些实施方案中,在分析之前(例如使用亲和试剂)在表面上捕获分析物。在一些实施方案中,在分析之前不在表面上捕获分析物。在一些实施方案中,该技术可用于单分子检测测定(参见例如美国专利申请系列号14/589,467;国际专利申请号pct/us2015/044650;国际专利申请号pct/us2017/016977;和美国临时申请系列号62/468,578;其各自经此引用全文并入本文。还参见johnson-buck等人(2015)“kineticfingerprintingtoidentifyandcountsinglenucleicacids”naturebiotechnology33:730-32,经此引用全文并入本文)。在一些实施方案中,该技术可用于分析物的定性检测(例如确定其存在)。在一些实施方案中,该技术可用于分析物的量、浓度、丰度等等的量化测量(例如计数)。例如,在一些实施方案中,该技术可用于将生物流体中存在的低丰度核酸分析物,例如来自血浆、尿液、唾液或其它体液的肿瘤dna浓缩到较小体积中以便进行分析。定义为了便于理解本技术,在下文中定义了大量术语和短语。在发明详述通篇中描述了附加的定义。在本说明书与权利要求书通篇中,除非上下文另行清楚地指明,以下术语采取明确结合在本文中的含义。本文中所用的短语“在一个实施方案中”不一定是指相同的实施方案,尽管可能如此。此外,本文中使用的短语“在另一实施方案中”不一定是指不同的实施方案,尽管可能如此。由此,如下文所述,本发明的各种实施方案可以容易地组合,而不离开本发明的范围或精神。此外,除非上下文明确地另行说明,本文中所用的术语“或”是包含性的“或者”算符,并等同于术语“和/或”。除非上下文明确地另行说明,术语“基于”不是排它性的,并允许基于未描述的附加因素。此外,在本说明书通篇中,“一个”、“一种”和“该”的含义包括复数指代物。“在……中”的含义包括“在……中”和“在……上”。本文中所用的术语“大约”、“大致”、“基本上”和“显著地”是本领域普通技术人员所理解的,并且将在使用它们的上下文中有所不同。如果在给定使用它们的上下文的情况下使用对本领域普通技术人员而言尚不清楚的这些术语,“大约”和“大致”是指加减小于或等于特定术语的10%,“基本上”和“显著地”是指该特定术语的加减大于10%。本文中所用的术语“受试者”和“患者”是指任何生物,包括植物、微生物和动物(例如哺乳动物,如狗、猫、家畜和人)。本文中所用的术语“分析物”是指待测试、测定、检测、成像、表征和/或量化的物质。示例性的分析物包括但不限于生物分子(例如核酸(例如dna、rna、甲基化和其它修饰的核碱基)、多肽(例如肽、蛋白质、糖蛋白)、碳水化合物、脂质、翻译后修饰、氨基酸和代谢产物)、小分子(药物、生物活性剂、毒素)等等。本说明书与权利要求书中的术语“样品”以其最宽的含义使用。在一些实施方案中,样品是或包含动物细胞或组织。在一些实施方案中,样品包括获自任何来源的样本或培养物(例如微生物培养物),以及生物和环境样品。生物样品可以获自植物或动物(包括人)并涵盖流体、固体、组织和气体。环境样品包括环境材料,如表面物质、土壤、水和工业样品。这些实例不应解释为限制适用于本技术的样品类型。本文中所用的“生物样品”是指生物组织或流体的样品。例如,生物样品可以是获自动物(包括人)的样品;流体、固体或组织样品;以及液体和固体食品与饲料产品和成分,如乳制品、蔬菜、肉和肉副产品,以及废物。生物样品可以或自家养动物的所有各种族类,以及未驯服的或野生的动物,包括但不限于诸如有蹄动物、熊、鱼、兔类动物、啮齿类动物等等的动物。生物样品的实例包括组织切片、血液、血液级分、血浆、血清、尿或来自其它周围来源的样品,或细胞培养物、细胞菌落、单个细胞或单个细胞的集合。此外,生物样品包括上述样品的集合或混合物。生物样品可以通过从受试者取出细胞样品来提供,但是也可以通过使用先前分离的样品来提供。例如,通过常规活组织检查技术,可以从疑似患有疾病的受试者处取出组织样品。在一些实施方案中,血液样品取自受试者。来自患者的生物样品是指来自疑似受疾病影响的受试者的样品。环境样品包括环境材料,如表面物质、土壤、水和工业样品,以及获自食品和乳制品加工仪器、装置、设备、器具、一次性和非一次性项目的样品。这些实例不应解释为限制适用于本发明的样品类型。本文中所用的术语“生物流体”是指生物的流体(例如体液)。例如,在一些实施方案中,生物流体是分泌物(例如尿液、汗液、渗出液(例如包括植物渗出液)),并在一些实施方案中,生物流体是分泌物(例如母乳、胆汁)。在一些实施方案中,使用针头获得生物流体(例如血液、脑脊液、淋巴液)。在一些实施方案中,由于病理过程而产生生物流体(例如水疱、囊肿液)。在一些实施方案中,生物流体衍生自另一生物流体(例如血浆、血清)。示例性的生物流体包括但不限于羊水、房水、玻璃体液、胆汁、血液、血浆、血清、母乳、脑脊液、耵聍(耳垢)、乳糜、chime、内淋巴液、外淋巴液、渗出液、粪便、女性射液、胃酸、胃液、淋巴液、黏液(例如鼻腔引流、痰)、心包液、腹膜液、胸膜液、脓汁、眵、唾液、皮脂(例如皮肤油)、浆液、精液、包皮垢、痰涎、滑膜液、汗液、眼泪、尿液、阴道分泌物和呕吐物。本文中所用的术语“标记”是指任何原子、分子、分子复合物(例如金属螯合物)或胶体粒子(例如量子点、纳米粒子、微粒等等),其可用于提供可检测(优选可量化)的效果,并且其可以连接到核酸或蛋白质上。标记包括但不限于染料(例如光学可检测的标记、荧光染料或部分等等);放射性标记,如32p;结合部分,如生物素;半抗原,如地高辛;发光、磷光、光学可检测或荧光部分;质量标签;以及单独的或与可以通过荧光共振能量转移(fret)抑制或改变发射光谱的部分组合的荧光染料。标记可以提供信号,所述信号可以通过荧光、发光、放射性、比色法、重量分析法、x-射线衍射或吸收、磁性、酶活性、质量特征或受质量影响的行为(例如,maldi飞行时间质谱法;荧光偏振)等等来检测。标记可以是带电荷的部分(正电荷或负电荷),或者替代地,可以是电荷中性的。标记可以包括核酸或蛋白序列或由其组成,只要包含该标记的序列是可检测的。本文中所用的“支承物”或“固体支承物”是指分析物(例如生物分子(例如核酸(例如dna、rna、甲基化和其它修饰的核碱基)、多肽(例如肽、蛋白质、糖蛋白)、碳水化合物、脂质、翻译后修饰、氨基酸、代谢产物)、小分子等等)可以浓缩和/或固定在其上或其中的表面或基质,例如分析物可以共价或非共价地连接于其上、或分析物可以部分或完全包埋在其中或其上以便在很大程度上或完全防止分析物自由扩散或相对于彼此移动的表面。本文中所用的“部分”是指某物可以分成的两个或多个部分之一,例如,寡核苷酸、分子、化学基团、结构域、探针等等的各个部分。本文中所用的“核酸”或“核酸序列”是指嘧啶和/或嘌呤碱基,优选分别为胞嘧啶、胸腺嘧啶和尿嘧啶,以及腺嘌呤和鸟嘌呤的聚合物或低聚物(参见albertl.lehninger,principlesofbiochemistry,第793-800页(worthpub.1982))。本技术设想任何脱氧核糖核苷酸、核糖核苷酸或肽核酸组分、以及其任何化学变体,如这些碱基的甲基化、羟甲基化或糖基化形式等等。该聚合物或低聚物在组成方面可以是异源的或同源的,并可以分离自天然存在的来源,或可以人工地或合成地产生。此外,该核酸可以是dna或rna或其混合物,并可以永久或暂时地以单链或双链形式存在(包括同源双链、异源双链和杂合状态)。在一些实施方案中,核酸或核酸序列包含其它种类的核酸结构,如dna/rna螺旋、肽核酸(pna)、吗啉代、锁核酸(lna)和/或核酶。因此,术语“核酸”或“核酸序列”也可以涵盖包含可以表现出与天然核苷酸相同功能的非天然核苷酸、修饰核苷酸和/或非核苷酸结构单元(例如“核苷酸类似物”)的链;此外,本文中所用的术语“核酸序列”是指寡核苷酸、核苷酸或多核苷酸、以及其片段或部分,并且是指基因组或合成起源的dna或rna,其可以是单链或双链的,且代表有义链或反义链。本文中所用的术语“核苷酸类似物”是指修饰的或非天然存在的核苷酸,包括但不限于:具有改变的堆叠相互作用的类似物,如7-脱氮嘌呤(即7-脱氮-datp和7-脱氮-dgtp);具有替代氢键合构型的碱基类似物(如iso-c和iso-g和授予s.benner并经此引用并入本文的美国专利号6,001,983中描述的其它非标准碱基对);非氢键合类似物(例如非极性的芳族核苷类似物,如2,4-二氟甲苯,由b.a.schweitzer和e.t.kool,j.org.chem.,1994,59,7238-7242,b.a.schweitzer和e.t.kool,j.am.chem.soc.,1995,117,1863-1872描述;其各自经此引用并入本文);“通用”碱基如5-硝基吲哚和3-硝基吡咯;以及通用嘌呤和嘧啶(分别例如“k”和“p”核苷酸;p.kong等人,nucleicacidsres.,1989,17,10373-10383,p.kong等人,nucleicacidsres.,1992,20,5149-5152)。核苷酸类似物包括在糖部分上具有修饰的核苷酸,如二脱氧核苷酸和2'-o-甲基核苷酸。核苷酸类似物包括脱氧核糖核苷酸以及核糖核苷酸的修饰形式。“肽核酸”是指包含肽样聚酰胺主链的dna模仿物。本文中所用的术语“互补”或“互补性”在通过碱基配对规则关联的多核苷酸(例如核苷酸序列,如寡核苷酸捕获探针、查询探针或作为核酸的靶标分析物)方面使用。例如,序列“5'-a-g-t-3'”与序列“3'-t-c-a-5'”互补。互补性可以是“部分的”,其中仅一部分核酸碱基根据碱基配对规则是匹配的。或者,在核酸之间可能存在“完全”或“全部”互补性。核酸链之间的互补性程度对核酸链之间的杂交的效率和强度存在显著影响。这在扩增反应以及依赖于核酸之间的结合的检测方法中特别重要。任一术语也可以就单个核苷酸来使用,尤其在多核苷酸的情况下。例如,可以为寡核苷酸中的特定核苷酸指出其与另一核酸链中的核苷酸的互补性或其缺乏,这不同于该寡核苷酸的剩余部分与该核酸链之间的互补性或与之形成对比。在一些情况下,术语“互补性”和相关术语(例如“互补的”、“互补物”)是指可以通过氢键结合到另一核酸序列上的核酸序列的核苷酸,例如能够碱基配对的核苷酸(例如通过沃森-克里克碱基配对或其它碱基配对)。可以形成碱基对(例如彼此互补)的核苷酸是以下配对:胞嘧啶和鸟嘌呤、胸腺嘧啶和腺嘌呤、腺嘌呤和尿嘧啶、以及鸟嘌呤和尿嘧啶。不需要在核酸序列的整个长度上计算百分比互补性。互补性的百分比可以限于碱基配对的核酸序列的特定区域,例如从第一个碱基配对的核苷酸开始并终结于最后一个碱基配对的核苷酸。本文中所用的核酸序列的互补物是指此类寡核苷酸:其与核酸序列对齐以使一个序列的5'末端与另一序列的3'末端配对时处于“反平行缔合”。通常不存在于天然核酸中的某些碱基可以包含在本发明的核酸中,并包括例如肌苷和7-脱氮鸟嘌呤。互补性不一定是完美的;稳定双链体可以含有错配的碱基对或不匹配的碱基。核酸
技术领域:
的技术人员在经验地考虑许多变量的情况下可以确定双链体稳定性,所述变量包括例如寡核苷酸的长度、寡核苷酸的碱基组成和序列、离子强度和错配碱基对的发生率。由此,在一些实施方案中,“互补”是指在8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100或更多个核碱基的区域上与第二核碱基序列的互补物具有至少60%、65%、70%、75%、80%、85%、90%、95%、97%、98%或99%同一性的第一核碱基序列,或两个序列在严格杂交条件下杂交。“完全互补”是指第一核酸的每个核碱基能够与第二核酸中的相应位置处的每个核碱基配对。例如,在某些实施方案中,寡核苷酸(其中每个核碱基具有与核酸的互补性)具有如下核碱基序列:其在8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100或更多个核碱基的区域上与所述核酸的互补物相同。“错配”是指不能与第二核酸的相应位置处的核碱基配对的第一核酸的核碱基。术语“结构域”在就多肽而言使用时是指多肽的子部分,其具有独特的结构和/或功能特征;通常,该特征在不同的多肽之间是类似的。该子部分通常包含连续的氨基酸,尽管其也可以包含一致地起作用或因折叠或其它构型而紧密靠近的氨基酸。蛋白结构域的实例包括跨膜结构域、糖基化位点等等。术语“基因”是指包含对rna、或多肽或其前体(例如胰岛素原)的生产所必需的编码序列的核酸(例如dna或rna)序列。功能性多肽可以由全长编码序列或由编码序列的任何部分编码,只要保持多肽的所需活性或功能性质(例如酶促活性、配体结合、信号转导等等)即可。术语“部分”在就基因而言使用时是指基因的片段。片段的尺寸可以由几个核苷酸至整个基因序列减去一个核苷酸。由此,“包含基因的至少一部分的核苷酸”可以包含该基因的片段或整个基因。术语“基因”还涵盖了结构基因的编码区,并包括在5′和3′两端上与编码区相邻定位(在任一端相距大约1kb)的序列,使得该基因对应于全长mrna的长度。位于编码区的5′并存在于mrna上的序列被称为5′非翻译序列。位于编码区的3′或下游并存在于mrna上的序列被称为3′非翻译序列。术语“基因”涵盖了基因的cdna和基因的基因组形式。基因的基因组形式或克隆含有被称为“内含子”或“间隔区”或“间隔序列”的非编码序列间断的编码区。内含子是被转录为核rna(hnrna)的基因片段;内含子可以含有调节元件如增强子。将内含子从核或初级转录物中移除或“剪掉”;因此内含子不存在于信使rna(mrna)转录物中。mrna在翻译过程中起作用以限定在新生多肽中氨基酸的序列或次序。除了含有内含子外,基因的基因组形式还可以包括位于存在于rna转录物上的序列的5′和3′两个末端的序列。这些序列被称为“侧翼”序列或区域(这些侧翼序列位于存在于mrna转录物上的非翻译序列的5′或3′)。5′侧翼区域可以含有调节序列如启动子和增强子,其控制或影响基因的转录。3′侧翼区域可以含有引导转录终止、转录后切割和多腺苷酸化的序列。术语“野生型”是指基因或基因产物,其在从天然存在来源中分离时具有该基因或基因产物的特征。野生型基因是在群体中最频繁地被观察到并因此任意地命名为该基因的“正常”或“野生型”形式的基因。相反,术语“修饰的”、“突变体”或“多态的”是指与野生型基因或基因产物相比时表现出序列和/或功能性质方面的改变(即改变的特征)的基因或基因产物。要指出的是,可以分离天然存在的突变体;这些通过以下事实来识别:在与野生型基因或基因产物相比时,它们具有改变的特征。由此,术语“变体”和“突变体”在就核苷酸序列而言使用时是指与另一个通常相关的核苷酸序列相差一个或多个核苷酸的核酸序列。“变异”是两个不同的核苷酸序列之间的差异;在一些实施方案中,一个序列是参考序列。术语“等位基因”是指在基因中不同的变异;变异包括但不限于变体和突变体、多态性基因座和单核苷酸多态性基因座、移码和剪接突变。等位基因可以天然地存在于群体中,或其可以在群体的任何特定个体的寿命期间产生。本文中所用的术语“杂交”就互补核酸的配对而言使用。杂交和杂交的强度(例如核酸之间的缔合的强度)受诸如核酸之间的互补程度、涉及的条件的严格性、和形成的杂合物的tm的因素影响。“杂交”方法涉及一个核酸与另一个互补核酸(例如具有互补核苷酸序列的核酸)的退火。含有互补序列的两种核酸聚合物找到彼此并通过碱基配对相互作用退火的能力是公认的现象。在marmur和lane,proc.natl.acad.sci.usa46:453(1960)以及doty等人,proc.natl.acad.sci.usa46:461(1960)对“杂交”过程的初始观察后,已经将该过程细化为现代生物学的基本工具。本文中所用的术语“tm”参照“解链温度”使用。解链温度是双链核酸分子的群体变得半解离成单链时的温度。几种用于计算核酸的tm的方程式在本领域中是公知的。如标准参考文献所述,可以通过以下方程式计算tm值的简单估算值:当核酸在1mnacl的水溶液中时,tm=81.5+0.41*(%g+c)(参见例如anderson和young,quantitativefilterhybridization,innucleicacidhybridization(1985))。其它参考文献(例如allawi和santalucia,biochemistry36:10581-94(1997))包括更复杂的计算,其考虑了结构、环境和序列特征来计算tm。例如,在一些实施方案中,这些计算提供了对短核酸探针和靶标(例如如实施例中所用)的tm的改善的估算。术语“蛋白质”和“多肽”是指包含经由肽键连接的氨基酸的化合物,并可互换使用。由基因编码的“蛋白质”或“多肽”不限于由基因编码的氨基酸序列,而是包括该蛋白质的翻译后修饰。当术语“氨基酸序列”在本文中提及以指蛋白质分子的氨基酸序列时,“氨基酸序列”和类似术语如“多肽”或“蛋白质”并非意在将氨基酸序列限制为与所述蛋白质分子相关的完全天然的氨基酸序列。此外,“氨基酸序列”可以由编码该蛋白质的核酸序列来推演。常规的单字母和三字母氨基酸代码在本文中如下使用——丙氨酸:ala,a;精氨酸:arg,r;天冬酰胺:asn,n;天冬氨酸:asp,d;半胱氨酸:cys,c;谷氨酸:glu,e;谷氨酰胺:gln,q;甘氨酸:gly,g;组氨酸:his,h;异亮氨酸:ile,i;亮氨酸:leu,l;赖氨酸:lys,k;甲硫氨酸:met,m;苯丙氨酸:phe,f;脯氨酸:pro,p;丝氨酸:ser,s;苏氨酸:thr,t;色氨酸:trp,w;酪氨酸:tyr,y;缬氨酸:val,v。本文中所用的代码xaa和x是指任何氨基酸。术语“变体”和“突变体”在就多肽而言使用时是指与另一通常相关的多肽相差一个或多个氨基酸的氨基酸序列。本文中所用的术语“解链”在就核酸而言使用时是指双链核酸或核酸区域解离为单链核酸或核酸区域。本文中所用的“查询探针”或“读取探针”是识别分析物(例如与分析物结合,例如特异性地结合分析物)的任何实体(例如分子、生物分子等等)。在示例性实施方案中,该查询探针是识别分析物的蛋白质。在一些其它示例性实施方案中,该查询探针是识别分析物的核酸(例如dna、rna、包含dna和rna的核酸、包含修饰的碱基和/或修饰的碱基间连接的核酸;例如如上所述的核酸、核酸适体)。在一些实施方案中,该查询探针例如被可检测标记(如本文中所述的荧光部分)标记。在一些实施方案中,该查询探针包含超过一种类型的分子(例如蛋白、核酸、化学接头或化学部分中的超过一种)。该技术的实施方案包含与分析物瞬时且反复地结合的查询探针(例如可检测地标记的查询探针),例如每个观察窗口与靶标分析物结合和解离数次(例如大于1、2、3、4、5、6、7、8、9、10或更多次)的查询探针。在一些实施方案中,该查询探针在测定条件下具有大于大约1纳摩尔(例如大于0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或5.0纳摩尔或更高)的对该分析物的解离常数(kd)。在一些实施方案中,该查询探针具有大于大约1min–1(例如大于0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或5.0min–1或更高)的对该分析物的结合和/或解离常数。在查询探针方面,该技术没有限制。在一些实施方案中,该查询探针是抗体或抗体片段。在一些实施方案中,该查询探针是低亲和力抗体或抗体片段。在一些实施方案中,该查询探针是纳米抗体、dna结合蛋白质或蛋白质结构域、甲基化结合结构域(mbd)、激酶、磷酸酶、乙酰基转移酶、脱乙酰酶、酶或多肽。在一些实施方案中,该查询探针是与靶标分析物相互作用的寡核苷酸。例如,在一些实施方案中,该查询探针是与靶标分析物杂交以形成熔融温度在进行观察的温度的大约10℃内的双链体的寡核苷酸(例如对室温下进行的观察为大约7-12个核苷酸)。在一些实施方案中,该查询探针是单核苷酸。在一些实施方案中,该查询探针是小有机分子(例如分子量小于大约2000道尔顿,例如小于2100、2050、2000、1950、1900、1850、1800、1750、1700、1650、1600、1550、1500道尔顿或更小的分子)。在一些实施方案中,该查询探针是药剂,例如药物或其它生物活性分子。在一些实施方案中,该查询探针是金属离子络合物。在一些实施方案中,该查询探针是甲基结合结构域(例如mbd1)。在一些实施方案中,该查询探针用本文中所述的可检测标记物来标记。在一些实施方案中,该查询探针共价连接到可检测标记物上。在一些实施方案中,该查询探针与可检测标记物间接和/或非共价地连接和/或缔合。在一些实施方案中,该可检测标记物是荧光的。在一些实施方案中,该查询探针是小鼠单克隆抗体。在其中该分析物包含碳水化合物或多糖的一些实施方案中,该查询探针包含碳水化合物结合蛋白质,如凝集素,或碳水化合物结合抗体。本文中所用的“事件”是指查询探针与分析物结合的情况,或查询探针与分析物解离的情况,如通过监测指示查询探针与分析物结合和/或查询探针与分析物解离的可检测性质所测得的那样。本文中所用的“捕获探针”是识别分析物(例如结合分析物,例如特异性结合分析物)并将分析物连接至固体支承物上的任何实体(例如分子、生物分子等等)。在示例性实施方案中,该捕获探针是识别分析物的蛋白质。在另一些示例性实施方案中,捕获探针是识别分析物的核酸(例如dna、rna、包含dna和rna的核酸、包含修饰的碱基和/或修饰的碱基间连接的核酸;例如如上所述的核酸、核酸适体)。在一些实施方案中,捕获探针例如被可检测标记(如本文中所述的荧光部分)标记。在一些实施方案中,该捕获探针包含超过一种类型的分子(例如蛋白、核酸、化学接头或化学部分中的超过一种)。该技术的实施方案包括捕获分析物。在一些实施方案中,该分析物被捕获和固定。在一些实施方案中,该分析物稳定地连接到固体支承物上。在一些实施方案中,该固体支承物相对于接触该固体支承物的本体液相是不动的。在一些实施方案中,该固体支承物在接触该固体支承物的本体液相中是可扩散的。在一些实施方案中,通过高亲和力或不可逆相互作用提供靶标分析物向表面或其它固体基底的稳定连接(如本文中所用的“不可逆相互作用”是指解离半衰期长于观察时间的相互作用,例如在一些实施方案中为1至10分钟(例如60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590或600秒或更长)的时间)。在用于捕获分析物的组分和/或方法方面,该技术没有限制。例如,通过多种方法提供该稳定连接,包括但不限于以下的一种或多种。在一些实施方案中,分析物被表面结合的捕获探针固定,该探针对该分析物的解离常数(kd)小于大约1纳摩尔(nm)(例如小于1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5纳摩尔),并且对该分析物的解离速率常数小于大约1min–1(例如小于大约1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5min–1)。示例性的表面结合的捕获探针包括例如抗体、抗体片段、纳米抗体或其它蛋白质;高亲和力dna结合蛋白质或核糖核蛋白复合体如cas9、dcas9、cpf1、转录因子、或转录激活因子样效应子核酸酶(talens);寡核苷酸;小有机分子;或金属离子络合物。在一些实施方案中,分析物通过直接非共价连接到表面上来固定(例如通过该分析物与表面,例如玻璃表面或尼龙、硝酸纤维素或聚偏二氟乙烯膜之间的相互作用)。在一些实施方案中,分析物通过将该分析物化学连接到固体支承物上(例如通过共价键)来固定。在一些实施方案中,该分析物通过例如碳二亚胺、n-羟基琥珀酰亚胺酯(nhs)酯、马来酰亚胺、卤代乙酰基、酰肼或烷氧基胺化学连接到固体支承物上。在一些实施方案中,分析物通过将靶标分析物辐射(例如紫外线)诱导交联到该表面和/或连接在该表面上的捕获探针上来固定。在一些实施方案中,该捕获探针是兔单克隆抗体。在其中该分析物包含碳水化合物或多糖的一些实施方案中,该捕获探针包含碳水化合物结合蛋白质,如凝集素,或碳水化合物结合抗体。或者,代替将靶标分析物固定到如上所述相对于接触固体支承物的本体相而言相对固定的固体支承物上,一些实施方案使靶标分析物与自由扩散的粒子缔合,所述粒子在接触该自由扩散粒子的本体液相中扩散。因此,在一些实施方案中,该靶标分析物共价或非共价地键合到自由扩散基底上。在一些实施方案中,自由扩散基底是例如胶体粒子(例如直径为大约10-1000nm(例如10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950或1000nm)的粒子)。在一些实施方案中,自由扩散的基底包含和/或由例如聚苯乙烯、二氧化硅、葡聚糖、金或dna折纸(origami)制成。在一些实施方案中,该靶标分析物与相对于查询探针的扩散而言缓慢扩散的自由扩散粒子缔合,例如该靶标分析物的扩散系数小于该查询探针的扩散系数的大约10%(例如小于15、14、13、12、11、10.5、10.4、10.3、10.2、10.1、10.0、9.9、9.8、9.7、9.6、9.5或9.0%或更小)。此外,在一些实施方案中,该靶标分析物与自由扩散的粒子缔合,并且靶标分析物的位置是可以独立于查询探针结合的观察和/或记录来观察和/或记录的。例如,在一些实施方案中,可检测标记物(例如荧光团、荧光蛋白、量子点)共价或非共价地连接到靶标分析物上,例如用于检测和定位该靶标分析物。因此,在一些实施方案中,同时并独立地测得靶标分析物的位置和查询探针结合事件的位置。本文中所用的术语“灵敏度”是指当样品包含分析物时测定给出该分析物的阳性结果的可能性。由真阳性结果的数量除以真阳性与假阴性之和来计算灵敏度。灵敏度是测定方法如何良好地检测分析物的量度。本文中所用的术语“特异性”是指当样品不包含分析物时测定方法给出阴性结果的可能性。由真阴性结果的数量除以真阴性与假阳性之和来计算特异性。特异性是本发明的方法如何良好地从确实包含分析物的样品中排除不包含分析物的样品的量度。本文中所用的“平衡常数”(keq)、“平衡缔合常数”(ka)和“缔合结合常数”(或“结合常数”(kb))可互换地用于平衡时a和b的以下结合反应:其中a和b是彼此缔合的两个实体(例如捕获探针和分析物、查询探针和分析物)且keq=[ab]/([a]×[b])。解离常数kd=1/kb。kd是一种描述一个结合配偶体a对与其缔合的配偶体b的亲和力的有用方式,例如数值kd代表产生显著量的ab所需的a或b的浓度。keq=koff/kon;kd=koff/kon。如本文中所用,彼此缔合的两个实体的产物(例如根据上述方程式由a和b形成ab)的“显著量”是指等于或大于a或b的游离浓度(以较小的为准)的ab的浓度。本文中所用的“纳摩尔亲和力范围”是指具有在纳摩尔范围内的平衡解离常数kd(例如koff/kon的比),例如1×10–10至1×10–5m(例如在一些实施方案中1×10–9至1×10–6m)的解离常数(kd)的两种组分的缔合。解离常数具有摩尔单位(m)。解离常数越小,两种组分(例如捕获探针和分析物;查询探针和分析物)之间的亲和力越高。本文中所用的“弱亲和力”或“弱结合”或“弱缔合”是指具有大约100纳摩尔(例如大约10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、300、400或500纳摩尔)和/或在一些实施方案中1纳摩尔至10微摩尔的范围的kd的缔合。术语“特异性结合”或“特异性地结合”在就彼此缔合的两种组分a和b的相互作用而言使用时是指kd小于a或b与溶液中的其它类似组分(例如溶液中不是a或b的至少一种其它分子物类)的相互作用的kd的a与b的缔合。本文中所用的词语“存在”或“不存在”(或者“存在的”或“不存在的”)以相对意义使用,来描述特定实体(例如分析物)的量或水平。例如,当分析物被称为“存在”于样品中时,这意味着该分析物的水平或量高于预定的阈值;相反,当分析物被称为“不存在”于样品中时,这意味着该分析物的水平或量低于预定的阈值。预定的阈值可以是与用于检测该分析物的特定测试相关的检测能力的阈值或任何其它阈值。当在样品中“检测”到分析物时,该分析物“存在”于样品中;当“未检测”到分析物时,该分析物“不存在”于样品中。此外,其中“检测”到分析物或分析物“存在”于其中的样品是对该分析物为“阳性”的样品。其中“未检测”到分析物或分析物“不存在”于其中的样品是对该分析物为“阴性”的样品。本文中所用的“提高”或“降低”是指相对于先前测得的变量值、相对于预建立的值和/或相对于标准对照物的值,变量值的可检测的(例如实测的)正或负改变。提高是相对于先前测得的变量值、预建立的值和/或标准对照物的值优选至少10%、更优选50%、再更优选2倍、甚至更优选至少5倍和最优选至少10倍的正改变。类似地,降低是先前测得的变量值,预建立的值和/或标准对照物的值的优选至少10%、更优选50%、还更优选至少80%和最优选至少90%的负改变。指示数量变化或差异的其它术语,如“更多”或“更少”,在本文以与上述相同的方式使用。术语“检测测定”是指用于检测分析物的存在或不存在或分析物的活性或效果或用于检测分析物的变体的存在或不存在的测定。“系统”表示一组组分(真实或抽象的),其包含其中各组分与整体内的至少一种其它组分相互作用或与整体内的至少一种其它组分相关的整体。在一些实施方案中,该技术包含抗体组分或部分,例如抗体或其片段或衍生物。本文中所用的“抗体”,也称为“免疫球蛋白”(例如igg、igm、iga、igd、ige),包含彼此通过二硫键连接的两条重链和各自通过二硫键与重链相连的两条轻链。抗体的特异性在于抗体的抗原结合位点(或互补位)与抗原决定簇(或表位)之间的结构互补性。抗原结合位点由主要来自高变区或互补决定区(cdr)的残基构成。有时,来自非高变区或框架区的残基影响总体结构域结构并因此影响结合位点。一些实施方案包含抗体的片段,例如,包含至少一部分免疫球蛋白分子的任何蛋白质或含多肽分子,如允许所述分子与抗原之间的特异性相互作用。免疫球蛋白分子部分可以包括但不限于重链或轻链的至少一个互补决定区(cdr)或其配体结合部分、重链或轻链可变区、重链或轻链恒定区、框架区或其任何部分。如本领域中已知和/或如本文中所述,此类片段可以通过酶法裂解、合成或重组技术产生。抗体还可以使用其中一个或多个终止密码子已被引入天然终止位点的上游的抗体基因以各种截短形式产生。抗体的各个部分可以通过常规技术化学地连接在一起,或可以使用基因工程改造技术作为连续蛋白制备。抗体片段包括但不限于fab(例如通过木瓜蛋白酶消化)、f(ab')2(例如通过胃蛋白酶消化)、fab'(例如通过胃蛋白酶消化和部分还原)以及fv或scfv(例如通过分子生物学技术)片段。fab片段可以通过用蛋白酶木瓜蛋白酶处理抗体来获得。此外,fab可通过将编码抗体的fab的dna插入用于原核表达系统或用于真核表达系统的载体,并将载体引入原核细胞或真核细胞以表达fab来制得。f(ab')2可以通过用蛋白酶胃蛋白酶处理抗体来获得。此外,f(ab')2可以通过经由硫醚键或二硫键结合fab'而制得。fab可以通过用还原剂(例如二硫苏糖醇)处理f(ab')2来获得。此外,fab'可以通过将编码抗体的fab'片段的dna插入原核细胞表达载体或真核细胞表达载体,并将载体引入原核细胞或真核细胞以表达其而制得。fv片段例如可以在4℃和ph4.0下通过胃蛋白酶的限制性裂解而制得(称为“冷胃蛋白酶消化”的方法)。该fv片段由通过强非共价相互作用保持在一起的重链可变结构域(vh)和轻链可变结构域(vl)组成。scfv片段可以通过如先前所述获得编码vh和vl结构域的cdna,构建编码scfv的dna,将dna插入原核细胞表达载体或真核细胞表达载体,并随后将表达载体引入原核细胞或真核细胞以表达scfv来制得。一般而言,抗体通常可以使用本领域中目前公知的许多常规技术对任何抗原产生。本文中所用的术语“缀合”是指当一个分子或试剂物理或化学地偶联或粘附到另一分子或试剂上时。缀合的实例包括共价连接和静电复合。术语“复合”、“与……复合”和“缀合”在本文中可互换使用。本文中所用的“稳定相互作用”或提及“稳定结合”相互作用是指在该相互作用的热力学平衡条件下相对持久的缔合。在一些实施方案中,“稳定相互作用”是kd小于大约10–9m的或在一些实施方案中kd小于10–8m的两种组分之间的相互作用。在一些实施方案中,“稳定相互作用”具有小于1/小时的解离速率常数koff或在一些实施方案中小于1/分钟的解离速率常数koff。在一些实施方案中,“稳定的相互作用”被定义为不是“瞬时相互作用”。在一些实施方案中,“稳定的相互作用”包括通过共价键介导的相互作用和通常不通过kd值来描述,而是涉及每个相互作用长于大约1分钟(例如30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175或180秒)的两个实体之间的平均缔合寿命的其它相互作用。在一些实施方案中,“稳定相互作用”与“瞬时相互作用”之间的区别通过kd和/或koff和/或描述该缔合的另一动力学或热力学值的截止值来确定,其中该截止值用于区分如果以kd和/或koff或描述该缔合的另一动力学或热力学值的绝对术语描述时将被不同地表征的稳定和瞬时相互作用。例如,通过kd值表征的“稳定的相互作用”在甚至更稳定的另一相互作用的情况下也可能被表征为“瞬时相互作用”。本领域技术人员将理解稳定和瞬时相互作用的其它相对比较,例如,通过kd值表征的“瞬时相互作用”在甚至更瞬时(更不稳定)的另一相互作用的情况下也可能被表征为“稳定的相互作用”。本文中所用的“部分”是指某物可以分成的两个或更多个部分之一,例如寡核苷酸、分子、化学基团、结构域、探针、“r”基团、多肽等等的各个部分。在一些实施方案中,本文中所用的“信号”是与所测定的样品的一种或多种性质(例如查询探针与分析物的结合和/或查询探针与分析物解离)相关的时间改变量。信号可以是时域连续的或时域离散的。作为数学抽象概念,连续时间信号的域是实数(或其区间)的集合,且离散时间信号的域是整数(或其区间)的集合。离散信号通常通过连续信号的“数字采样”产生。例如,声音信号由在一条线上的连续波动电压组成,其可以通过以规律间隔(例如每50微秒)读取该线上的电压水平来数字化。得到的数字串作为离散时间数字信号储存。在一些实施方案中,信号作为空间位置(例如x、y坐标;例如x、y、z坐标)的函数记录。在一些实施方案中,信号作为时间的函数记录。在一些实施方案中,信号作为时间和位置的函数记录。本文中所用的术语“基本上”是一个宽泛的术语,并以其普通意义使用,包括但不限于在很大程度上但不必然完全是所指定的事物。如本文使用的术语“算法”是一个宽泛的术语,并以其普通意义使用,包括但不限于涉及将信息从一个状态变换为另一个状态的计算过程(例如程序),例如使用计算机处理。本文中所用的术语“多孔介质”或“多孔材料”是指包含孔隙或空隙的材料。多孔材料具有仅允许小于该孔隙尺寸的某些物质穿过,同时阻拦大于该孔隙尺寸的其它物质的性质。多孔介质用作分子、原子和/或离子的筛。本文中所用的术语“纳孔”是指包含尺寸为100nm或更小的孔隙的材料。本文中所用的术语“微孔”是指包含尺寸为0.2至2nm的孔隙的材料。本文中所用的术语“介孔”是指包含尺寸为2至50nm的孔隙的材料。本文中所用的术语“大孔”是指包含尺寸为50至1000nm的孔隙的材料。双水相体系该技术的实施方案涉及使用双水相体系(atps)来浓缩分析物。自1955年albertsson的开创性工作以来,已经研究了atps用于各种制备和分析程序,包括例如蛋白质、核酸、病毒、细胞器和细胞(参见例如walter,h.partitioninginaqueoustwo–phasesystem:theory,methods,uses,andapplicationstobiotechnology.(elsevier,2012),经此引用并入本文)。自此,已经描述了许多类型的atps,例如包含以下的atps:两种有机聚合物(聚合物-聚合物体系)、聚合物和一种或多种盐(聚合物-盐体系)、离子液体、短链醇、包含粒子或非离子型表面活性剂的胶束或反胶束(参见例如iqbal,m.等人,aqueoustwo-phasesystem(atps):anoverviewandadvancesinitsapplications.biolprocedonline18,(2016),经此引用并入本文)和凝聚物(参见例如jia,hentrich,&szostak,rapidrnaexchangeinaqueoustwo-phasesystemandcoacervatedroplets.originsoflifeandevolutionofbiospheres44,1–12(2014),经此引用并入本文)。最常见的聚合物-聚合物体系包含聚乙二醇(peg)和葡聚糖,或peg和葡聚糖硫酸盐(例如葡聚糖硫酸钠),但已经描述了其它几种。例如,已经报道了包含热分离聚合物的atps(参见例如persson,等人,aqueouspolymertwo-phasesystemsformedbynewthermoseparatingpolymers.bioseparation9,105–116(2000),经此引用并入本文),例如环氧乙烷和环氧丙烷的共聚物(eo-po)、聚(n-异丙基丙烯酰胺)(聚nipam)、聚乙烯基己内酰胺(聚vcl)、以及n-异丙基丙烯酰胺和乙烯基己内酰胺与乙烯基咪唑的的共聚物(分别为聚(nipam-vi)和聚(vcl-vi))。聚合物-盐体系的实例包括例如peg和盐,如磷酸钠、硫酸钠、硫酸铵、柠檬酸钠(参见例如iqbal,同上)或硫酸镁(参见例如mattiasson,b.applicationsofaqueoustwo-phasesystemsinbiotechnology.trendsinbiotechnology1,16–20(1983),经此引用并入本文),有时与其它添加的盐如氯化钠或氯化钾(参见例如gündüz&korkmazbovineserumalbuminpartitioninginanaqueoustwo-phasesystem:effectofphandsodiumchlorideconcentration.journalofchromatographyb:biomedicalsciencesandapplications743,255–258(2000),经此引用并入本文)。凝聚物的一个实例是atp/聚-l-赖氨酸凝聚物体系,其已经显示可以分配短rna分子(参见例如jiaandszostak,同上)。还已经描述了包含超过两个相的体系(参见例如hatti-kaul,r.aqueoustwo-phasesystems.molbiotechnol19,269–277(2001),经此引用并入本文)。在含有聚合物的atps如peg-葡聚糖或peg-盐体系中,相分离行为(由双结点线的形状和位置来反映,该双结点线表明了导致一个或两个相的组合物之间的边界)可能受各种因素的影响,如ph和聚合物分子量(参见例如alves等人,aqueoustwo-phasesystemsofpoly(ethyleneglycol)andsodiumcitrate:experimentalresultsandmodeling.j.chem.eng.data53,1587–1594(2008),经此引用并入本文)、聚合物或盐的浓度(参见例如azevedo等人,partitioningofhumanantibodiesinpolyethyleneglycol–sodiumcitrateaqueoustwo-phasesystems.separationandpurificationtechnology65,14–21(2009),经此引用并入本文)、和温度(参见例如persson,同上)。通常,溶解或悬浮在给定atps中的生物分子或生物分子复合物(包括核酸、碳水化合物、蛋白质、肽、病毒)将在一个相中表现出不同于在另一相中的化学势,导致该生物分子在平衡状态下在两相之一中具有更高的浓度(例如分配系数大于或小于1;参见例如iqbal,同上)。如果混合物中的生物分子比同一混合物中的杂质更强烈地分配到atps的两相之一中,该atps可用于纯化该生物分子,除去杂质。例如,peg/葡聚糖、peg/柠檬酸钠和peg/硫酸铵体系已经用于从复杂的混合物中分离质粒dna(参见例如gomes等人,purificationofplasmiddnawithaqueoustwophasesystemsofpeg600andsodiumcitrate/ammoniumsulfate.separationandpurificationtechnology65,22–30(2009),经此引用并入本文)或用于分离单链和双链质粒dna(参见例如alberts,b.m.efficientseparationofsingle-strandedanddouble-strandeddeoxyribonucleicacidinadextran-polyethyleneglycoltwo-phasesystem.biochemistry6,2527–2532(1967),经此引用并入本文)。报道了包含葡聚糖硫酸钠、甲基纤维素、聚乙烯醇和聚乙二醇的atps可用于纯化和浓缩病毒颗粒(参见例如philipson等人,thepurificationandconcentrationofvirusesbyaqueouspolymerphasesystems.virology11,553–571(1960),经此引用并入本文)。在一些情况下,ph或添加剂(例如盐或亲和配体)的浓度显示影响生物分子分配到两相之一中。例如,ph和氯化钠浓度影响牛血清白蛋白在peg/柠檬酸钠体系中的分配(参见例如gündüz,同上)。在peg/硫酸钠体系中,发现ph、peg分子量和盐(如磷酸钠和氯化钾)的浓度显著影响单链荧光嘧啶dna寡核苷酸的分配(参见例如nazer等人,partitioningofpyrimidinesinglestrandedoligonucleotideusingpolyethyleneglycol–sodiumsulfateaqueoustwo-phasesystems;experimentalandmodeling.fluidphaseequilibria432,45–53(2017),经此引用并入本文)。用亲和配体对形成atps的组分之一(如peg或葡聚糖聚合物)进行共价修饰已经用于诱导或增强生物分子向一个相中的分配,该策略称为亲和性分配(参见例如walter&krob,hydrophobicaffinitypartitioninaqueoustwo-phasesystemscontainingpolyethyleneglycol)-palmitateofrightside-outandinside-outvesiclesfromhumanerythrocytemembranes.febsletters61,290–293,经此引用并入本文)。虽然atps已经广泛用于制备应用,如天然产物的纯化和分离,但很少用于基于表面的分析应用。一个例外是报道了使用peg-葡聚糖体系在表面的离散区域上捕集检测试剂以防止多重elisa中的交叉反应(参见例如frampton,j.p.等人,aqueoustwo-phasesystempatterningofdetectionantibodysolutionsforcross-reaction-freemultiplexelisa.scientificreports4,4878(2014);simon,a.,frampton,j.,white,j.&takayama,s.systemsandmethodsformultiplexsolutionassays.(2014),经此引用并入本文)。据报道,peg/葡聚糖atps通过将pcr抑制剂分配到与核酸分析物不同的相中来提高软奶酪中单核细胞增生利斯特氏菌的聚合酶链反应(pcr)分析的灵敏度(参见例如lantz等人,enhancedsensitivityinpcrdetectionoflisteriamonocytogenesinsoftcheesethroughuseofanaqueoustwo-phasesystemasasamplepreparationmethod.appl.environ.microbiol.60,3416–3418(1994),经此引用并入本文);据报道,使用peg/葡聚糖系统作为pcr检测人类粪便中幽门螺杆菌的制备步骤也有相似的结果(参见例如id)。其它报道的分析应用包括蛋白质异质性研究、蛋白质之间或蛋白质与低分子量化合物之间的相互作用、以及ph对蛋白质理化性质的影响(参见例如walter,h.partitioninginaqueoustwo–phasesystem:theory,methods,uses,andapplicationstobiotechnology.(elsevier,2012),经此引用并入本文)。尽管在开发本文中描述的技术之前已经注意到了atps在两相之一(通常为体积较小的相)中浓缩生物分子、细胞、病毒颗粒或细胞器的能力(iqbal,同上),但还不清楚atps是否能提供有效策略以便通常对生物分子分析物(或特别对核酸)显著提高(例如大于10倍)基于表面的生物分子测定的灵敏度。例如,还不清楚高离子强度(例如按重量计大于10%的柠檬酸钠)或富聚合物相的高粘度(例如按重量计大于10%的peg或大于5%的葡聚糖)的效果是否会在基于表面的测定中不利地影响分析物的表面捕获,例如通过分析物捕获中涉及的生物化学组分的变性、通过诱导分析物的聚集、通过降低分析物对捕获配体的亲和力、或通过减慢分析物向用于捕获的表面的扩散。与先前的技术相比,在本文中提供的技术的实施方案的开发过程中进行的试验表明,通过采用使用atps的预浓缩步骤,基于表面的单分子测定的灵敏度提高了超过一个数量级(例如大约10到50倍),所述预浓缩步骤使富含分析物的相与用于分析物捕获的表面接触,特别是如果将分析物溶液添加到形成atps的组分的冻干(干燥)混合物中以限制最终混合物的总体积,由此与原始混合物相比提高了浓缩该分析物的倍数。此外,在这些试验过程中收集的数据表明,包含peg、柠檬酸钠和氯化钠的atps特别有效地提高了包括微小rna和短dna片段(例如小于或等于160个碱基对)的小核酸的基于表面的测定的灵敏度,因为它们具有高分配系数(例如>1000)、富含分析物的相的粘度相对较低、并且与有效表面捕获相容。在该技术的实施方案的开发过程中进行的试验表明,考虑到已经描述的多种atps以及可以使用atps分配的分析物的多样性,该技术设想了几种可用于基于表面的测定的其它atps组合物。因此,可以从先前描述的体系中选择atps以最大化给定分析物的分配和表面捕获。包含在本文所述技术中的可用atps体系的共同特征是该atps对相关分析物产生小于0.1或大于10的分配系数,例如因为它们产生了分析物的最大潜在浓缩因子。如上所述,atps组合物已经显示可以选择性分配dna,包括聚乙二醇(peg)/柠檬酸钠(sc)(参见例如gomes等人(2009)“purificationofplasmiddnawithaqueoustwophasesystemsofpeg600andsodiumcitrate/ammoniumsulfate”sep.purif.technol.65:22-30,经此引用全文并入本文)、peg/硫酸钠(参见例如nazer等人(2017)“partitioningofpyrimidinesinglestrandedoligonucleotideusingpolyethyleneglycol–sodiumsulfateaqueoustwo-phasesystems;experimentalandmodeling”fluidphaseequilibria432:45-53)、和peg/葡聚糖(参见例如alberts,同上,经此引用全文并入本文)。虽然已经显示质粒dna表现出对一个相超出另一相高达100倍至1000倍的选择性(参见例如alberts,同上;参见例如nazer,同上,其各自经此引用全文并入本文)。短的核酸(例如在生物流体中发现的dna片段)预期不会表现出进入atps的相的同样高的分配系数。虽然先前已经描述了双水相体系,本文中描述的技术涉及使用atps来分析大量生物流体(如尿液)中稀有和/或稀释的分析物(例如肿瘤dna)。此外,该技术涉及使用atps将非常稀的分析物输送至表面以便进行固定和分析(例如通过单分子技术如simreps)。特别地,该技术的实施方案在peg/柠檬酸钠atps中使用氯化钠来增强核酸(例如低分子量dna(例如包含少于200个碱基对或核苷酸(例如小于200、190、180、170、160、150、140、130、120、110、100、95、90、85、80、75、70、65、60、55、50、45、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10或少于10个nt或bp)的dna片段))向富盐相中的分配(例如分配系数大于100)。在本文中描述的技术的开发过程中进行试验,表明该技术提供了dna的大约100倍浓缩,并保留至少50%的分析物。此外,该技术的实施方案提供了在小于5分钟内通过atps来浓缩分析物(例如核酸)。相比之下,醇介导的(例如乙醇或丁醇介导的)dna沉淀更加费时费力。特别地,dna的标准乙醇沉淀包括大于2小时(用于dna的沉淀、离心和再悬浮),并产生结晶固体,其会通过磨损作用破坏固体支承物,此外还需要使用与许多意在以水溶液使用的表面化学品不相容的有机溶剂。此外,使用柱法(例如结合到q-sepharose树脂上并从中洗脱)提取dna已用于分析尿液中的肿瘤dna,但是这些现有的柱技术比本文中描述的atps技术更费时费力,并且不能轻易地将分析物浓缩到仅仅几微升的体积中。在一些实施方案中,该技术包括使用2017年12月14日提交的美国临时专利申请系列号62/598,802中描述的atps,其经此引用全文并入本文。simreps本文中所用的术语“通过平衡泊松采样的单分子识别”及其缩写“simreps”是指用于通过动力学指纹分析识别和计数生物流体中的单个微小rna分子的一种无扩增、单分子检测方法。该技术例如描述在美国专利申请系列号14/589,467;国际专利申请号pct/us2015/044650;国际专利申请号pct/us2017/016977;和美国临时申请系列号62/468,578中;其各自经此引用全文并入本文。还参见johnson-buck等人(2015)“kineticfingerprintingtoidentifyandcountsinglenucleicacids”naturebiotechnology33,经此引用全文并入本文。简而言之,simreps计数包括直接观察荧光探针与表面捕获的分析物(例如核酸、蛋白质等等)的重复结合,其产生特异性的(例如对核酸产生序列特异性的)动力学指纹。该动力学指纹以单分子分辨率高度可靠地识别分析物。动力学指纹克服了先前受热力学特异性屏障限制的技术,由此尽量减少和/或消除了假阳性。由此,该simreps技术提供了可用于检测例如稀有分析物(如稀有或低丰度突变体dna等位基因)的超高特异性。先前的工作表明,simreps能够进行单核苷酸区分(参见例如johnson-buck等人(2015)“kineticfingerprintingtoidentifyandcountsinglenucleicacids”nat.biotechnol.33:730-32;su等人(2017)“single-moleculecountingofpointmutationsbytransientdnabinding”scirep7:43824,其各自经此引用并入本文)。该技术例如在类似分析物的存在下,并在一些实施方案中在背景噪声的存在下,提供了靶标分析物的检测。在一些实施方案中,来源于查询探针与靶标分析物的瞬时结合的信号可以与未结合的查询探针所产生的信号区分(例如通过观察、监测和/或记录结合事件过程中信号强度的局部变化)。在一些实施方案中,通过诸如全内反射荧光(tirf)或近tirf显微术、零模式波导(zmw)、光片显微术、受激发射损耗(sted)显微术或共焦显微术的技术提供对该查询探针(例如荧光标记的查询探针)与靶标分析物的瞬时结合的观察。在一些实施方案中,本文中提供的技术使用具有在未结合靶表分析物时淬灭的荧光发射和/或在结合靶表分析物时被去淬灭的荧光发射的查询探针。该技术包括在观察的面积的离散区域和/或体积的离散区域内,例如在平面或体积的特定空间坐标处定位和/或观察查询探针与分析物的瞬时结合。在一些实施方案中,相对于固定(例如表面结合)的靶标分析物之间的平均间距,在确定结合或解离事件的空间坐标方面的误差(例如由于受限的信号、检测器噪声或检测器中的空间分箱)较小(例如最小化、消除)。在包括使用宽视野荧光显微术的一些实施方案中,通过在样本平面中使用不大于固定(例如表面结合)的靶标分析物之间的平均距离的有效检测器像素尺寸和在每个检测时间点收集许多荧光光子(在一些实施方案中超过100个,例如超过80、85、90、95、100、105、110、115、120、125或130个或更多),由此最小化和/或消除测量误差。在一些实施方案中,当可检测的(例如荧光的)查询探针接近固体支承物的表面(例如在固体支承物的表面大约100nm内)时,其会产生荧光发射信号。在未结合时,查询探针快速扩散,并由此不可单独地检测;因此,当处于未结合状态时,该查询探针产生低水平的扩散背景荧光。因此,在一些实施方案中,结合的查询探针的检测包括使用全内反射荧光显微术(tirf)、hilo显微术(参见例如us20090084980、ep2300983b1、wo2014018584a1、wo2014018584a1,经此引用并入本文)、共焦扫描显微术或包含照明方案的其它技术,所述照明方案仅照亮(例如激发)在固体支承物表面附近或上面的那些查询探针分子。由此,在一些实施方案中,仅有与表面附近或上面的固定化靶标结合的查询探针会产生点状发射信号(例如“斑点”),其可以证实为源于单个分子。在一些实施方案中,该查询探针包含具有发射波长的荧光标记。在荧光标记的发射波长处的荧光发射的检测表明该查询探针结合到固定化的靶标分析物上。该查询探针与靶标分析物的结合是“结合事件”。在该技术的一些实施方案中,结合事件具有实测强度大于限定的阈值的荧光发射。例如,在一些实施方案中,结合事件具有高于背景荧光强度(例如在不存在靶标分析物的情况下观察到的荧光强度)的荧光强度。在一些实施方案中,结合事件具有比背景荧光强度(例如在不存在靶标分析物的情况下观察到的荧光强度)高至少1、2、3、4个或更多标准偏差的荧光强度。在一些实施方案中,结合事件具有比背景荧光强度(例如在不存在靶标分析物的情况下观察到的荧光强度)高至少2个标准偏差的荧光强度。在一些实施方案中,结合事件的荧光强度是背景荧光强度(例如在不存在靶标分析物的情况下观察到的平均荧光强度)的至少1.5、2、3、4或5倍。因此,在一些实施方案中,在强度高于限定的阈值(例如比背景强度高至少2个标准偏差)的查询探针的发射波长处检测荧光表明结合事件已经发生(例如在固定靶标分析物的固体支承物上的离散位置处)。此外,在一些实施方案中,在强度高于限定的阈值(例如比背景强度高至少2个标准偏差)的查询探针的发射波长处检测荧光表明结合事件已经开始。因此,在一些实施方案中,在强度高于限定的阈值(例如比背景强度高至少2个标准偏差)的查询探针的发射波长处检测不存在荧光表明结合事件已经结束(例如所述查询探针已经从靶标分析物上解离)。结合事件开始与结合事件结束之间的时间长度(例如在强度高于限定的阈值(例如比背景强度高至少2个标准偏差)的荧光探针的发射波长处检测到荧光的时间长度)是结合事件的停留时间。“转换”是指查询探针与靶标分析物的结合与解离(例如开/关事件),例如,查询探针从结合状态解离或查询探针与来自未结合状态的靶标分析物缔合。该技术的方法包括在作为“获取时间”的确定的时间间隔(例如几十至几百至几千秒的时间间隔,例如5、10、15、20、25、30、35、40、45、50、55或60秒;例如5、10、15、20、25、30、35、40、45、50、55或0分钟;例如,1、1.5、2、2.5或3小时)期间计数在固体支承物上的每个离散位置处(例如在通过x,y坐标确定的位置处)发生的查询探针结合事件的数量。在一些实施方案中,获取时间为大约1至10秒到1至10分钟(例如大约1至100秒,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、90或100秒,例如1至100分钟,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50、60、70、80、90或100分钟)。此外,查询探针在结合事件期间保持与靶标分析物结合的时间长度是该结合事件的“停留时间”。在获取时间过程中检测到的结合事件的数量和/或对结合事件记录的停留时间的长度是查询探针与靶标分析物结合的特征,并由此指示靶标分析物固定在所述离散位置并由此该靶标分析物存在于该样品中。在限定的时间间隔期间(例如在获取时间期间)监测(例如使用光源以激发荧光探针并检测来自结合的查询探针的荧光发射,例如使用荧光显微镜)和/或记录该查询探针与固定的靶标分析物的结合和/或该查询探针与固定的靶标分析物的解离。测定在获取时间期间该查询探针与核酸结合的次数和/或在每个结合事件过程中该查询探针保持结合到核酸上的时间长度和在每个结合事件之间该查询探针保持未与核酸结合的时间长度(例如分别在结合和未结合状态下的“停留时间”),例如通过使用计算机和软件(例如使用隐马尔科夫模型和泊松统计学来分析该数据)。在一些实施方案中,测量阳性和/或阴性对照样品(例如已知包含或不包含靶标的对照样品)。在阴性对照样品中检测到的荧光是“背景荧光”或“背景(荧光)强度”或“基线”。在一些实施方案中,将包含在查询探针的发射波长处的荧光强度的测量结果的数据记录为时间的函数。在一些实施方案中,从该数据确定(例如通过确定荧光强度高于阈值背景荧光强度的次数和时间长度)结合事件的数目和结合事件的停留时间(例如对每种固定的分析物)。在一些实施方案中,对固定该靶标分析物的固体支承物上的每个离散位置计数转换(例如查询探针的结合和解离)。在一些实施方案中,转换的阈值数目用于区分靶标分析物在固体支承物上的离散位置处的存在与背景信号、非靶标分析物和/或查询探针的假性结合。在一些实施方案中,确定每个固定的靶标的转换次数的分布——例如对每个观察到的固定分析物计数转换数目。在一些实施方案中,产生直方图。在一些实施方案中,确定该分布的特征参数,例如确定分布的平均值、中值、峰、形状等等。在一些实施方案中,例如使用人工智能、模式识别、机器学习、统计推断、神经网络等等,通过识别数据中的模式和规律的算法来分析数据和/或参数(例如荧光数据(例如时域中的荧光数据)、动力学数据、该分布的特征参数等)。在一些实施方案中,该分析包括使用频率分析,并且在一些实施方案中,该分析包括使用贝叶斯分析。在一些实施方案中,使用已知的“训练”数据(例如使用监督学习)来训练模式识别系统,并在一些实施方案中使用算法来发现先前未知的模式(例如无监督学习)。参见例如duda等人(2001)patternclassification(第2版),wiley,newyork;bishop(2006)patternrecognitionandmachinelearning,springer。模式识别(例如使用训练集、监督学习、无监督学习和未知样品的分析)将识别的模式与分析物关联,使得特定模式提供可用于检测、定量和识别分析物的特定分析物的“指纹”。在一些实施方案中,由靶标分析物产生的分布明显不同于由非靶标分析物产生的分布或在不存在靶标分析物的情况下产生的分布。在一些实施方案中,对多个固定的靶标分析物确定转换的平均数目。在一些实施方案中,对包含靶标分析物的样品观察到的转换的平均数目近似线性相关为时间的函数,并具有正斜率(例如转换的平均数目随时间大致线性地增加)。在一些实施方案中,使用统计学(例如泊松统计学)处理该数据以确定在固体支承物上的每个离散位置处作为时间的函数发生的转换的概率。在一些特定实施方案中,在固体支承物上的离散位置处作为时间的函数发生的转换事件的相对恒定的概率指示靶标分析物在固体支承物上的所述离散位置处的存在。在一些实施方案中,从在固体支承物上的离散位置处作为时间的函数发生的转换事件的概率计算与事件数目和消逝时间有关的相关系数。在一些实施方案中,当从在固体支承物上的离散位置处作为时间的函数发生的转换事件的概率计算时大于0.95的与事件数目和消逝时间有关的相关系数指示靶标分析物在固体支承物上的所述离散位置处的存在。在一些实施方案中,结合的查询探针(τon)和未结合的查询探针(τoff)的停留时间用于识别靶标分析物在样品中的存在和/或区分包含靶标分析物的样品与包含非靶标分析物和/或不包含靶标分析物的样品。例如,靶标分析物的τon大于非靶标分析物的τon;并且,靶标分析物的τoff小于非靶标分析物的τoff。在一些实施方案中,对阴性对照物和样品测量τon和τoff指示靶标分析物在该样品中存在或不存在。在一些实施方案中,对在固体支承物上成像的多个斑点中的每一个,例如对对照物(例如阳性和/或阴性对照物)和疑似包含靶标分析物的样品确定多个τon和τoff值。在一些实施方案中,对固体支承物上成像的多个斑点中的每一个,例如对对照物(例如阳性和/或阴性对照物)和疑似包含靶标分析物的样品确定平均τon和/或τoff。在一些实施方案中,所有成像的斑点的τonvsτoff(例如平均τon和τoff、时均τon和τoff等等)的曲线图指示靶标分析物在样品中存在或不存在。如本文中所述,该技术通过动力学检测技术来检测分析物。因此,该技术的特定实施方案涉及通过分析查询探针与待检测分析物的相互作用的动力学来检测分析物。对于查询探针q(例如在平衡浓度[q]处)与靶标分析物t(例如在平衡浓度[t]处)的相互作用,动力学速率常数kon描述了包含杂交到分析物t上的探针q的复合物qt的时间依赖性形成。在特定实施方案中,虽然qt复合物的形成与依赖于查询探针浓度并具有m-1min-1(或类似单位)的单位的二阶速率常数相关,qt复合物的形成足以通过kon来描述,所述kon是与qt复合物的形成相关的假一阶速率常数。由此,本文中使用的kon是表观(“假”)一阶速率常数。同样,动力学速率常数koff描述了复合物qt向探针q和分析物t的时间依赖性解离。动力学速率在本文中通常以min-1或s-1的单位提供。结合状态下的查询探针q的“停留时间”(τon)是在查询探针q与分析物t结合以形成qt复合物的每个情况过程中探针q杂交到分析物t上的时间间隔(例如时间长度)。未结合状态下的查询探针q的“停留时间”(τoff)是在查询探针q与该分析物结合以形成qt复合物的每个情况之间探针q未杂交到分析物t上的时间间隔(例如时间长度)(例如在查询探针q与靶标分析物t的连续结合事件之间该查询探针q从靶标分析物t上解离的时间)。可以作为对大量结合和非结合事件积分的平均值或加权平均值来提供停留时间。此外,在一些实施方案中,将探针(例如可检测标记的查询探针(例如荧光探针))对靶标分析物的重复的、随机结合建模为每单位时间以恒定概率发生的泊松过程,并且其中每单位时间的结合和解离事件的数目的标准偏差(nb+d)增加为(nb+d)1/2。由此,统计噪音随观察时间的增加变成nb+d的较小分数。因此,在一些实施方案中按需延长观察来实现对靶标和脱靶结合的区分。并且,随着获取时间提高,在nb+d直方图中的信号和背景峰变得越来越分离,并且信号分布的宽度随着nb+d的平方根增加,这与动力学montecarlo模拟一致。此外,在一些实施方案中,控制测定条件经调谐动力学行为,由此改善查询探针与靶标分析物的结合事件和背景结合的区分。例如,在一些实施方案中,该技术包括控制测定条件,如使用设计为与靶标分析物弱相互作用(例如在纳摩尔亲和力范围内)的查询探针;控制温度,使得查询探针与靶标分析物弱相互作用;控制溶液条件,例如离子强度、离子组成、添加离液剂和添加竞争探针。一些实施方案提供了通过重复性查询探针结合来识别分析物的方法。在一些实施方案中,方法包括将分析物固定到固体支承物上。在一些实施方案中,该固体支承物是表面(例如基本上平坦的表面、圆形表面),例如与本体溶液(例如包含分析物的本体溶液)接触的表面。在一些实施方案中,该固体支承物是可自由扩散的固体支承物(例如珠粒、胶体粒子,例如直径为大约10-1000nm(例如10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950或1000nm)的胶体粒子),例如在本体溶液(例如包含分析物的本体溶液)内自由扩散的固体支承物。在一些实施方案中,将分析物固定到固体支承物上包括固体支承物与分析物之间的共价相互作用。在一些实施方案中,将分析物固定至固体支承物上包括固体支承物与分析物之间的非共价相互作用。在一些实施方案中,分析物(例如分子,例如蛋白、肽、核酸、小分子、脂质、代谢产物、药物等等之类的分子)稳定地固定到表面上,并且方法包括查询探针与靶标分析物的重复(例如瞬时、低亲和力)结合。在一些实施方案中,方法包括检测查询探针与靶标分析物的重复(例如瞬时、低亲和力)结合。在一些实施方案中,方法包括产生包含由查询探针与分析物结合所产生的信号的数据集(例如查询探针信号作为时间的函数的数据集)和描述该查询探针与分析物结合的在表面上的空间位置的信息(例如坐标,例如x、y坐标)。在一些实施方案中,处理(例如操纵、转换、可视化等等)该数据集,例如以改进查询探针结合事件的空间分辨率。例如,在特定实施方案中,对数据集(例如包含作为时间的函数的查询探针信号和描述表面上查询探针与分析物结合的空间位置的信息(例如坐标,例如x、y坐标))进行处理。在一些实施方案中,该处理包括逐帧减法处理以产生差示强度分布图,其显示时间序列数据的每一帧内的查询探针结合或解离事件。在开发本文中描述的技术过程中收集的数据表明,差示强度分布图具有比查询探针结合信号对比位置图更高的分辨率。在一些实施方案中,在确定每个查询探针结合和/或解离事件的空间位置(例如x、y坐标)之后,多个事件根据空间位置簇集,并对每个簇内的事件的动力学进行统计学分析以确定该事件簇是否源于给定的靶标分析物。例如,用于量化一种或多种表面固定的或扩散的靶标分析物的方法的一些实施方案包含一个或多个步骤,其包括例如以单分子灵敏度测量查询探针与固定靶标分析物的一种或多种瞬时结合的信号。在一些实施方案中,方法包括独立于查询探针结合对靶标分析物进行跟踪(例如检测和/或记录其位置)。在一些实施方案中,该方法进一步包括计算在表面处作为位置(例如x、y位置)的函数的时间依赖性探针结合信号强度变化。在一些实施方案中,计算在表面处作为位置(例如x、y位置)的函数的时间依赖性查询探针结合信号强度变化产生对于查询探针与分析物结合的“差示强度分布图”。在一些实施方案中,该方法包括以亚像素精度从差示强度分布图确定每个查询探针结合和解离事件(“事件”)的位置(例如x、y位置)。在一些实施方案中,方法包括通过表面上的位置(例如x、y位置)将事件分组为局部簇,例如对单个固定靶标分析物关联事件。在一些实施方案中,该方法包括从每个事件局部簇计算动力学参数以确定该簇是否源于特定的分析物,例如源于与特定分析物的瞬时探针结合。在检测的分析物方面,方法的实施方案没有限制。例如,在一些实施方案中,该分析物是多肽,例如蛋白质或肽。在一些实施方案中,该靶标分析物是核酸。在一些实施方案中,该靶标分析物是小分子。在一些实施方案中,靶标分析物与查询探针之间的相互作用可以不同地受靶标分析物的共价修饰的影响。例如,在一些实施方案中,该分析物是包含翻译后修饰的多肽,例如包含翻译后修饰的蛋白质或肽。在一些实施方案中,多肽的翻译后修饰影响查询探针与分析物的瞬时结合,例如查询探针信号随多肽上存在或不存在翻译后修饰而变。例如,在一些实施方案中,该分析物是包含外遗传修饰的核酸,例如包含甲基化碱基的核酸。在一些实施方案中,该分析物是包含对靶标分析物的核碱基、核糖或脱氧核糖部分的共价修饰的核酸。在一些实施方案中,核酸的修饰影响查询探针与分析物的瞬时结合,例如该查询探针信号随核酸上存在或不存在修饰而变。在一些实施方案中,翻译后修饰与查询探针之间的瞬时相互作用由化学亲和标签(例如包含核酸的化学亲和标签)来介导。在一些实施方案中,该查询探针是核酸或适体。在一些实施方案中,该查询探针是低亲和力抗体、抗体片段或纳米抗体。在一些实施方案中,该查询探针是dna-结合蛋白、rna-结合蛋白或dna-结合核糖核蛋白复合物。在一些实施方案中,每个结合或解离事件的位置,例如(x,y)位置,通过使差示强度分布图经历形心确定、最小二乘拟合至高斯函数、最小二乘拟合至艾里斑函数、最小二乘拟合至多项式函数(例如抛物线)或最大似然估计法来确定。在一些实施方案中,该捕获探针是高亲和力抗体、抗体片段或纳米抗体。在一些实施方案中,该捕获探针是核酸。在一些实施方案中,通过将靶标分析物共价键交联至该表面来介导捕获。在一些实施方案中,在表面固定之前,靶标分析物在载体的存在下经历热变性。在一些实施方案中,在表面固定之前,该分析物在载体的存在下经历化学变性,例如该分析物用变性剂如尿素、甲酰胺、氯化胍、高离子强度、低离子强度、高ph、低ph或十二烷基硫酸钠(sds)来变性。atps方法与组合物在一些实施方案中,该技术提供了用于分析分析物(例如生物分子分析物)的方法,例如来自生物衍生的混合物(例如生物流体或其它样品)。例如,在一些实施方案中,本技术提供了一种方法,该方法包括将含有分析物的组合物(例如生物流体或样品)添加到双水相体系(atps)(例如在混合时形成双水相体系的材料的混合物)中。在一些实施方案中,该atps是固相atps。在一些实施方案中,该atps是纯净的。在一些实施方案中,该分析物浓缩到该atps的两相之一中。例如,在一些实施方案中,分析物相对于其在atps形成之前的浓度浓缩至少10倍(例如至少10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950或100倍或更多)。在一些实施方案中,两相具有不同的体积,例如在一些实施方案中,一个相的体积是该体系的第二相的体积的2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50或100倍或更多。在一些实施方案中,该分析物优先分配到体积较小的相中;由此,在一些实施方案中,该分析物被浓缩到体积较小的相中。在一些实施方案中,方法包括分离两相(例如通过向atps施加力(例如重力或离心))。在一些实施方案中,在大约1000×g下离心10-120分钟;在一些实施方式中,在大约1000×g下离心大约1分钟。在一些实施方案中,离心在大约1000×g(例如在500、600、700、800、850、900、925、950、975、1000、1025、1050、1075、1100、1150、1200、1250、1300、1400或1500×g)下进行大约1至120分钟(例如0.5、0.75、1、1.25、1.5、1.75、2、2.25、2.5、2.75、3.0、3.25、3.5、3.75、4、4.25、4.5、4.75、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、85、90、95、100、115、120或110分钟)。在一些实施方案中,该方法包括通过使富含分析物的相与表面接触以便从富含分析物的相中捕获该分析物。例如,在一些实施方案中,该技术包括使表面与富含分析物的相接触大于1分钟(例如超过1、2、3、4、5、6、7、8、9、10、20、30、40、60或120分钟)。在一些实施方案中,通过使表面与atps接触,同时对该atps施加力以分离各相,使得产生(例如与贫分析物的相分离)富含分析物的相并接触该表面,从而保持富含分析物的相与表面之间的接触。也就是说,在一些实施方案中,在离心或通过重力进行相分离的过程中,该表面接触该atps(例如接触该atps的富含分析物的相)。在一些实施方案中,方法包括检测固相基底上的分析物。在一些实施方案中,检测该分析物包括使用单分子检测法。在一些实施方案中,检测该分析物包括以单分子灵敏度分析可检测标记的查询探针与该分析物的结合与解离的动力学(参见例如美国专利申请系列号14/589,467;国际专利申请号pct/us2015/044650;国际专利申请号pct/us2017/016977;和美国临时申请系列号62/468,578;其各自经此引用全文并入本文。还可以参见johnson-buck等人(2015)“kineticfingerprintingtoidentifyandcountsinglenucleicacids”naturebiotechnology33:730-32,经此引用全文并入本文)。在一些实施方案中,该技术提供了分析核酸的方法。在一些实施方案中,该技术提供了分析包含少于200个碱基对或核苷酸(例如包含少于200、190、180、170、160、150、140、130、120、110、100、95、90、85、80、75、70、65、60、55、50、45、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10或少于10个nt或bp)的核酸的方法。在一些实施方案中,该技术提供了用于分析样品(例如生物样品(例如生物流体))中或来自样品的核酸的方法。在一些实施方案中,该技术提供了分析衍生自生物流体、细胞裂解液、单个细胞的裂解液、单个亚细胞区室的裂解液的核酸的方法。例如,在一些实施方案中,方法包括将包含核酸的样品(例如生物样品(例如生物流体))添加到双水相体系(atps)中(例如在混合时形成双水相体系的材料的混合物(例如包含聚乙二醇(peg)、柠檬酸钠/柠檬酸、和第二种盐(例如氯化钠、硫酸钠、氯化锂、氯化钾或氯化镁)的组合物))。在一些实施方案中,相对于在没有第二种盐的情况下核酸进入富含柠檬酸盐的相的分配系数,第二种盐提高了核酸进入富含柠檬酸盐的相的分配系数。此外,实施方案包括混合该atps组合物(例如在一些实施方案中,以完全溶解固体混合物)并形成两个水相。在一些实施方案中,方法包括分离两相(例如通过重力、离心或通过类似的力)以便将核酸浓缩在两相之一中。在一些实施方案中,该核酸在富含柠檬酸钠的相中浓缩。在一些实施方案中,在该atps的相的一个中,该核酸浓缩至少10倍(例如至少10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950或1000倍或更多)。在一些实施方案中,两相具有不同的体积,例如在一些实施方案中,一个相的体积是该体系的第二相的体积的2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、30、40、50或100倍或更多。在一些实施方案中,该核酸优先分配到体积较小的相中;由此,在一些实施方案中,该核酸被浓缩到体积较小的相中。此外,在一些实施方案中,该方法包括在固相基底的表面处从该atps的相(例如富含柠檬酸盐的相,该相具有较小的体积)捕获该核酸。在一些实施方案中,方法包括分离两相(例如通过向该atps施加力(例如重力或离心))。在一些实施方案中,该方法包括通过使富含核酸的相(例如富含柠檬酸盐的相)与表面接触,由此从富含核酸的相(例如富含柠檬酸盐的相)中捕获该核酸。例如,在一些实施方案中,所述技术包括使表面与富含核酸的相(例如富含柠檬酸盐的相)接触大于1分钟(例如超过1、2、3、4、5、6、7、8、9、10、20、30、60或120分钟)。在一些实施方案中,通过使表面与该atps接触并同时对该atps施加力以分离各相,从而产生(例如从贫核酸的相中分离)富含核酸的相(例如富含柠檬酸盐的相)并接触该表面,从而保持富含核酸的相(例如富含柠檬酸盐的相)与该表面之间的接触。也就是说,在一些实施方案中,在离心或通过重力进行相分离的过程中,该表面接触该atps(例如接触该atps的富含核酸的相(例如富含柠檬酸盐的相))。在一些实施方案中,方法包括检测固相基底处的核酸。在一些实施方案中,检测该核酸包括使用单分子检测法。在一些实施方案中,检测该核酸包括以单分子灵敏度分析可检测标记的查询探针与该核酸的结合与解离的动力学(参见例如美国专利申请系列号14/589,467;国际专利申请号pct/us2015/044650;国际专利申请号pct/us2017/016977;和美国临时申请系列号62/468,578;其各自经此引用全文并入本文。还可以参见johnson-buck等人(2015)“kineticfingerprintingtoidentifyandcountsinglenucleicacids”naturebiotechnology33:730-32,经此引用全文并入本文)。在一些实施方案中,该技术包含变性步骤。例如,在该方法的一些实施方案中,将样品加热至使样品中的生物分子分析物变性的温度。在一些实施方案中,该变性步骤在将样品与该atps混合的步骤之前进行。在一些实施方案中,该变性步骤在将样品与该atps混合的步骤之后进行。在一些实施方案中,该变性步骤包括加热样品(例如加热到至少40、45、50、55、60、65、70、75、80、85、90、95、100、105或110℃的温度)。在一些实施方案中,用化学变性剂处理样品。在一些实施方案中,变性(例如热变性)在防止二级结构的形成或靶标与混合物中的其它核酸的其它杂交的载体寡核苷酸或一种或多种寡核苷酸的存在下进行。因此,一些实施方案包括添加载体寡核苷酸或一种或多种寡核苷酸,例如以防止形成二级结构或靶标与混合物中的其它核酸的其它杂交。在一些实施方案中,将防止二级结构的形成或靶标与混合物中的其它核酸的其它杂交的载体寡核苷酸或一种或多种寡核苷酸添加到该样品中;在一些实施方案中,将防止二级结构的形成或靶标与混合物中的其它核酸的其它杂交的载体寡核苷酸或一种或多种寡核苷酸添加到该atps中;在一些实施方案中,将防止二级结构的形成或靶标与混合物中的其它核酸的其它杂交的载体寡核苷酸或一种或多种寡核苷酸添加到包含样品与该atps的组合物中。在一些实施方案中,在变性之前(例如在热变性之前)添加酶(例如蛋白酶(例如蛋白酶k、肽水解酶)、脂肪酶)。在一些实施方案中,将酶添加到样品中;在一些实施方案中,将酶添加到该atps中;在一些实施方案中,将酶添加到包含样品与atps的组合物中。在一些实施方案中,在变性之前添加去污剂(例如包括但不限于sds(例如0-5%)、tritonx-100、tritonx-114、脱氧胆酸盐、brij-35、brij-58、tween20、tween80、辛基葡糖苷、辛基硫代葡糖苷、chaps、chapso等等的去污剂);在一些实施方案中,将去污剂添加到该atps中;在一些实施方案中,将去污剂添加到包含样品与atps的组合物中。在一些实施方案中,该样品包含细胞(例如分离的单个细胞)或亚细胞组分(例如分离的亚细胞组分),例如线粒体、细胞核、外泌体、细胞外囊泡等等。在一些实施方案中,通过微流体技术、液包液乳液技术、微量吸移管操作技术或本领域中已知的其它技术来分离细胞或亚细胞组分。在一些实施方案中,该技术涉及包含形成atps的两种或多种水溶液的组合物,例如在混合所述两种或多种水溶液时。在一些实施方案中,该技术涉及包含peg和柠檬酸盐缓冲液(例如柠檬酸和柠檬酸盐)的组合物。在一些实施方案中,该技术涉及包含peg、柠檬酸盐缓冲液(例如柠檬酸和柠檬酸盐)和第二种盐(例如氯化钠)的组合物。在一些实施方案中,本技术提供了一种包含peg的组合物,所述peg在该组合物中的质量分数为大于30%(例如大于30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、70、71、72、73、74或75%)。在一些实施方案中,该技术提供了包含柠檬酸盐的组合物,所述柠檬酸盐在该组合物中的质量分数为小于2.5%(例如小于1.00、1.25、1.50、1.75、2.00、2.25或2.50%)。在一些实施方案中,所述技术提供了包含浓度大于0.25m(例如超过0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、1.0、1.1、1.2、1.3、1.4或超过1.5m)的氯化钠的组合物。在一些实施方案中,该peg在该组合物中具有600至8000da(例如600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900、3000、3100、3200、3300、3400、3500、3600、3700、3800、3900、4000、4100、4200、4300、4400、4500、4600、4700、4800、4900、5000、5100、5200、5300、5400、5500、5600、5700、5800、5900、6000、7000或8000da)的平均分子量。在一些实施方案中,该组合物中柠檬酸对柠檬酸钠的比提供了5.5至8.5的ph(例如5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4或8.5的ph)。在一些实施方案中,该技术包含在如2017年12月14日提交的美国临时专利申请序列号62/598,802中描述的方法中使用atps,其经此引用全文并入本文。电泳池在一些实施方案中,该技术涉及用于在小的表面积上浓缩包含净正电荷或负电子电荷的分析物(例如稀分析物)(包括但不限于带电荷的生物分子,如核酸、蛋白质、代谢产物和脂质)的方法、装置与系统,例如用于随后的固定和通过合适的技术(例如通过平衡泊松采样simreps进行的单分子识别,如本文中所述)的分析。该方法例如可用于极低浓度的分析物的灵敏检测的应用,但是其中一次仅可以分析成像表面的有限区域。在一些实施方案中,使用电泳池将分析物递送至表面、接触表面、集中在表面处和/或固定在表面处。在一些实施方案中,该电泳池(10)包括内部腔室(11)和外部腔室(12)(参见例如图9)。该内部腔室能够容纳包含分析物(13)的溶液。该外部腔室能够容纳缓冲剂(16)(例如包含电解质(例如离子(例如阳离子、阴离子))的溶液)。内部腔室(11)包括围绕内部体积的壁。该壁将内部体积与外部腔室(12)中的缓冲剂物理和电气地分开。因此,在一些实施方案中,该壁是绝缘体(例如非导体)。在一些实施方案中,该内部腔室(11)包含开口(15),其使包含该分析物的溶液与表面(14)接触。在一些实施方案中,该内部腔室(11)的开口(15)的宽度小于大约10、9、8、7、6、5、4、3、2或1mm(例如小于10000、9500、9000、8500、8000、7500、7000、6500、6000、5500、5000、4500、4000、3500、3000、2500、2000、1500、1000、950、900、850、800、750、700、650、600、550、500、450、400、350、300、250、200、150或100μm)。因此,在一些实施方案中,包含分析物(13)的组合物在宽度小于大约10、9、8、7、6、5、4、3、2或1mm(例如小于10000、9500、9000、8500、8000、7500、7000、6500、6000、5500、5000、4500、4000、3500、3000、2500、2000、1500、1000、950、900、850、800、750、700、650、600、550、500、450、400、350、300、250、200、150或100μm;例如在小于大约100mm2,例如小于100、95、90、85、80、75、70、65、60、55、50、45、40、35、30、25、20、18、16、14、12、10、9、8、7、6、5、4、3、2、1、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、0.08、0.06、0.05、0.02或0.01mm2的区域上接触该表面(14)。在一些实施方案中,该外部腔室(12)包含基层(17)。在一些实施方案中,该基层(17)包含多孔材料(例如纳米孔、微孔、介孔),其允许电解质在内部腔室(11)和外部腔室(12)之间通过,并尽量减少和/或消除分析物在内部腔室(11)与外部腔室(12)之间的流动。在一些实施方案中,该基层(17)包括作为聚合物的多孔材料。在一些实施方案中,该基层(17)包括作为聚丙烯酰胺的多孔材料。任选地,在一些实施方案中,用合适的材料(例如支链聚合物(例如葡聚糖硫酸酯))封闭基层(17)的孔隙以尽量减少或消除分析物向外部腔室基层(17)中的迁移。该技术不限于任何用于基层(17)的特定材料,只要其是包含小到足以排除该分析物并同时足够大和连续以允许电流(例如电解质)在内部腔室(11)与外部腔室(12)之间流动的孔隙尺寸的多孔材料。在一些实施方案中,内部腔室(11)的壁不接触表面(14)。因此,在一些实施方案中,该电泳池(10)包含在内部腔室(11)的壁与表面(14)之间的间隙(18)。在一些实施方案中,内部腔室(11)的壁与表面(14)间隔大约10至100μm(例如10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100μm)的距离以便在内部腔室(11)的壁与表面(14)之间提供间隙(18)(参见例如图9)。在一些实施方案中,间隙(18)允许电流在内部腔室(11)与外部腔室(12)之间流动(参见例如图9)。在一些实施方案中,间隙(18)包含与基层(17)相同的材料。在一些实施方案中,该电泳池(10)包含阳极和阴极。在一些实施方案中,阳极和阴极提供跨越内部腔室(11)和外部腔室(12)的电压(例如电势)(19)。在一些实施方案中,阳极电连接到内部腔室(11)上,阴极电连接到外部腔室(12)上(以便例如将带负电荷的分析物移动到表面(14)上)。在一些实施方案中,阴极电连接到内部腔室(11)上且阳极电连接到外部腔室(12)上(以便例如将带正电荷的分析物移动到表面(14)上)。相关实施方案提供了用于将分析物移动到表面上和/或将分析物浓缩到表面上的方法。例如,方法包括如下的一个或多个步骤:提供如本文中所述的电泳池,提供表面(例如在其上固定和/或浓缩分析物),提供包含分析物的溶液(例如样品),将包含分析物的溶液放置在电泳池的内部腔室中,使包含该分析物的溶液与表面接触,提供包含电解质的缓冲液,将包含电解质的缓冲液放置在电泳池的外部腔室中,并提供跨越内部腔室与外部腔室的电压(例如电势)。一些实施方案包括使用直流(dc)电源来提供电压。一些实施方案包括使用交流(ac)电源来提供电压。在一些实施方案中,电压在大约0至200v(例如0到10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200v)之间交替。在一些实施方案中,电压是恒定的并在10-200v的范围内(例如10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200v)。在一些实施方案中,电压以大约0.1至10分钟(例如0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5或10.0分钟)的周期变化。此外,一些实施方案包括在表面处对该分析物进行成像、量化表面处的该分析物(例如通过本文中所述的动力学检测方法)、或测定表面处该分析物的浓度。在一些实施方案中,该分析物如本文所述固定在表面上(例如通过用本文中描述的捕获探针来捕获)。一些实施方案包括例如通过挤出成型、三维打印、热固成型等等来制造该内部腔室和/或外部腔室。一些实施方案包括提供外部腔室的基层,例如提供聚合物以提供外部腔室的基层。因此,一些实施方案包括聚合组合物,例如以提供该外部腔室的基层。在一些实施方案中,相对于其在通过电泳法浓缩之前的浓度,该分析物在表面处浓缩至少10倍(例如至少10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、90、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950或100倍或更高)。电泳池技术可用于本文中描述的测定和检测技术。例如,该技术可用于从生物样品(例如血浆、尿液、唾液或其它体液)中浓缩和/或表面固定核酸(例如肿瘤衍生的dna或rna),以便随后通过灵敏和特异性的分子分析方法进行分析。例如,该技术可用于来自生物样品(例如血浆、尿液、唾液或其它体液)的蛋白质(例如蛋白质生物标志物)的浓缩和表面固定,以便随后通过灵敏和特异性的分子分析方法进行分析。特别地,该技术可用于在表面处浓缩分析物以便通过本文中描述的通过平衡泊松采样的单分子识别simreps进行进行分析。例如,在一些实施方案中,该方法包括通过使电泳池与表面接触并在电泳池的内部腔室和外部腔室之间施加电压(例如0-120v(例如5、10、15、20、30、40、50、60、70、80、90、100、110或120v)),由此从电泳池的内部腔室捕获该分析物。例如,在一些实施方案中,该技术包括使表面与电泳池接触并施加0-120v(例如5、10、15、20、30、40、50、60、70、80、90、100、110或120v)ac的电压,时间为大约1分钟,持续超过1分钟(例如超过1、2、3、4、5、6、7、8、9、10、20、30、40、60或120分钟)。在一些实施方案中,方法包括在固相基底处检测分析物。在一些实施方案中,检测分析物包括使用单分子检测法。在一些实施方案中,检测该分析物包括以单分子灵敏度分析可检测标记的查询探针与该分析物的结合与解离的动力学(参见例如美国专利申请系列号14/589,467;国际专利申请号pct/us2015/044650;国际专利申请号pct/us2017/016977;和美国临时申请系列号62/468,578;其各自经此引用全文并入本文。还可以参见johnson-buck等人(2015)“kineticfingerprintingtoidentifyandcountsinglenucleicacids”naturebiotechnology33:730-32,经此引用全文并入本文)。在一些实施方案中,该技术提供了用于分析核酸的方法。在一些实施方案中,该技术提供了用于分析包含少于200个碱基对或核苷酸(例如包含少于200、190、180、170、160、150、140、130、120、110、100、95、90、85、80、75、70、65、60、55、50、45、40、39、38、37、36、35、34、33、32、31、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10或少于10个nt或bp)的核酸的方法。在一些实施方案中,该技术提供了用于分析样品(例如生物样品(例如生物流体))中或来自所述样品的核酸的方法。在一些实施方案中,所述技术提供了用于分析衍生自生物流体、细胞裂解液、单个细胞的裂解液、单个亚细胞区室的裂解液的核酸的方法。例如,在一些实施方案中,方法包括将包含核酸的样品(例如生物样品(例如生物流体))添加到电泳池中(例如添加到电泳池的内部腔室中)并如本文中所述在电解槽的内部腔室和外部腔室之间施加电压。在一些实施方案中,方法包括将缓冲液添加到外部腔室中,并向外部腔室提供多孔基层(例如聚合物)。此外,在一些实施方案中,该方法包括在固相基底的表面处捕获核酸。在一些实施方案中,涉及使用电泳池的技术包含变性步骤。例如,在该方法的一些实施方案中,将样品加热至使样品中的生物分子分析物变性的温度。在一些实施方案中,该变性步骤在向内部腔室与外部腔室之间施加电压之前进行。在一些实施方案中,该变性步骤在向内部腔室与外部腔室之间施加电压之后进行。在一些实施方案中,该变性步骤包括加热样品(例如加热到至少40、45、50、55、60、65、70、75、80、85、90、95、100、105或110℃的温度)。在一些实施方案中,用化学变性剂处理样品。在一些实施方案中,变性(例如热变性)在防止二级结构的形成或靶标与混合物中的其它核酸的其它杂交的载体寡核苷酸或一种或多种寡核苷酸的存在下进行。因此,一些实施方案包括添加载体寡核苷酸或一种或多种寡核苷酸,例如以防止形成二级结构或靶标与混合物中的其它核酸的其它杂交。在一些实施方案中,将防止二级结构的形成或靶标与混合物中的其它核酸的其它杂交的载体寡核苷酸或一种或多种寡核苷酸添加到该样品中;在一些实施方案中,将防止二级结构的形成或靶标与混合物中的其它核酸的其它杂交的载体寡核苷酸或一种或多种寡核苷酸添加到该电泳池中。在一些实施方案中,在变性之前(例如在热变性之前)添加酶(例如蛋白酶(例如蛋白酶k、肽水解酶)、脂肪酶)。在一些实施方案中,将酶添加到样品中;在一些实施方案中,将酶添加到该电泳池中;在一些实施方案中,将酶添加到包含该样品的组合物中。在一些实施方案中,该酶具有与分析物的电荷相反的电荷。在一些实施方案中,在变性之前添加去污剂(例如包括但不限于sds(例如0-5%)、tritonx-100、tritonx-114、脱氧胆酸盐、brij-35、brij-58、tween20、tween80、辛基葡糖苷、辛基硫代葡糖苷、chaps、chapso等等的去污剂);在一些实施方案中,将去污剂添加到该样品中;在一些实施方案中,将去污剂添加到该电泳池中;在一些实施方案中,将去污剂添加到包含该样品的组合物中。在一些实施方案中,该去污剂是非离子的或不带电荷的(例如无电荷去污剂)。在一些实施方案中,该去污剂具有与分析物的电荷相反的电荷。在一些实施方案中,该样品包含细胞(例如分离的单个细胞)或亚细胞组分(例如分离的亚细胞组分),例如线粒体、细胞核、外泌体、细胞外囊泡等等。在一些实施方案中,通过微流体技术、液包液乳液技术、微量吸移管操作技术或本领域中已知的其它技术来分离细胞或亚细胞组分。系统该技术的实施方案涉及用于检测分析物的系统。例如,在一些实施方案中,该技术提供用于量化一种或多种靶标分析物的系统,其中该系统包含稳定结合靶标分析物的表面-结合捕获探针或表面-结合部分。在一些实施方案中,表面-结合捕获探针或表面-结合部分经由结合位点、表位或识别位点(例如第一结合位点、第一表位或第一识别位点)稳定结合分析物。在一些实施方案中,系统进一步包含在第二结合位点、第二表位或第二识别位点以低亲和力结合靶标分析物的查询探针。在一些实施方案中,该查询探针在接触系统表面的本体溶液中可以自由扩散。此外,一些系统实施方案包含检测组件,其记录来自查询探针与靶标分析物的相互作用的信号。例如,在一些实施方案中,检测组件记录由查询探针与靶标分析物的相互作用所产生的作为时间的函数的信号变化。在一些实施方案中,检测组件记录该查询探针与所述靶标分析物结合和从所述靶标分析物上解离的事件的空间位置(例如作为x、y坐标对)和强度。在一些实施方案中,检测组件记录查询探针与所述靶标分析物结合和从所述靶标分析物上解离的事件的空间位置(例如作为x、y坐标对)和开始和/或结束时间。在一些实施方案中,检测组件记录查询探针与所述靶标分析物结合和从所述靶标分析物上解离的事件的空间位置(例如作为x、y坐标对)和时间长度。系统的实施方案进一步包含如本文中所述的atps或电泳池,例如用于浓缩分析物以便递送至该系统的表面(例如包含稳定结合靶标分析物的表面结合捕获探针或表面结合部分的表面)。例如,在一些实施方案中,系统实施方案包含含有两种或多种水溶液的组合物,该水溶液形成atps,例如在两种或多种水溶液混合时。在一些实施方案中,系统包含peg和柠檬酸盐缓冲液(例如柠檬酸和柠檬酸盐)。在一些实施方案中,系统包含peg、柠檬酸盐缓冲液(例如柠檬酸和柠檬酸盐)和第二种盐(例如氯化钠)。在一些实施方案中,系统包括含有peg的组合物,所述peg在该组合物中的质量分数为大于30%(例如大于30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、70、71、72、73、74或75%)。在一些实施方案中,系统包括含有柠檬酸盐的组合物,所述柠檬酸盐在该组合物中的质量分数为小于2.5%(例如小于1.00、1.25、1.50、1.75、2.00、2.25或2.50%)。在一些实施方案中,系统包括以超过0.25m(例如超过0.25、0.3、0.35、0.4、0.45、0.5、0.55、0.6、0.65、0.7、0.75、0.8、0.85、0.9、1.0、1.1、1.2、1.3、1.4或超过1.5m)的浓度含有氯化钠的组合物。在一些实施方案中,系统包含peg,其在组合物中的平均分子量为1000至6000da(例如1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900、3000、3100、3200、3300、3400、3500、3600、3700、3800、3900、4000、4100、4200、4300、4400、4500、4600、4700、4800、4900、5000、5100、5300、5400、5500、5600、5700、5800、5900或6000da)。在一些实施方案中,系统在组合物中包含柠檬酸和柠檬酸钠,其中该组合物中柠檬酸与柠檬酸钠的比提供5.5至8.5的ph(例如5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4或8.5的ph)。一些系统实施方案包括如本文中所述的电泳池。例如,在一些实施方案中,系统包含电泳池(10),该电泳池包含内部腔室(11)和外部腔室(12)(参见例如图9)。该内部腔室能够容纳包含分析物(13)的溶液。该外部腔室能够容纳缓冲剂(16)(例如包含电解质(例如离子(例如阳离子、阴离子))的溶液)。内部腔室(11)包括围绕内部体积的壁。该壁将内部体积与外部腔室(12)中的缓冲剂物理和电气地分开。因此,在一些系统实施方案中,该壁是绝缘体(例如非导体)。在一些实施方案中,该内部腔室(11)包含开口(15),其使包含该分析物的溶液与系统的表面(14)接触。在一些实施方案中,该内部腔室(11)的开口(15)的宽度小于大约10、9、8、7、6、5、4、3、2或1mm(例如小于10000、9500、9000、8500、8000、7500、7000、6500、6000、5500、5000、4500、4000、3500、3000、2500、2000、1500、1000、950、900、850、800、750、700、650、600、550、500、450、400、350、300、250、200、150或100μm)。因此,在一些实施方案中,包含分析物(13)的组合物在宽度小于大约10、9、8、7、6、5、4、3、2或1mm(例如小于10000、9500、9000、8500、8000、7500、7000、6500、6000、5500、5000、4500、4000、3500、3000、2500、2000、1500、1000、950、900、850、800、750、700、650、600、550、500、450、400、350、300、250、200、150或100μm;例如在小于大约100mm2,例如小于100、95、90、85、80、75、70、65、60、55、50、45、40、35、30、25、20、18、16、14、12、10、9、8、7、6、5、4、3、2、1、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、0.08、0.06、0.05、0.02或0.01mm2的区域上接触该表面(14)。在一些实施方案中,该外部腔室(12)包含基层(17)。在一些实施方案中,该基层(17)包含多孔材料(例如纳米孔、微孔、介孔),其允许电解质在内部腔室(11)和外部腔室(12)之间通过,并尽量减少和/或消除分析物在内部腔室(11)与外部腔室(12)之间的流动。在一些实施方案中,该基层(17)包括作为聚合物的多孔材料。在一些实施方案中,该基层(17)包括作为聚丙烯酰胺的多孔材料。任选地,在一些实施方案中,用合适的材料(例如支链聚合物(例如葡聚糖硫酸酯))封闭基层(17)的孔隙以尽量减少或消除分析物向外部腔室基层(17)中的迁移。该技术不限于任何用于基层(17)的特定材料,只要其是包含小到足以排除该分析物并同时足够大和连续以允许电流(例如电解质)在内部腔室(11)与外部腔室(12)之间流动的孔隙尺寸的多孔材料。因此,一些系统实施方案包含可用于为外部腔室提供基层的多孔材料。在一些实施方案中,系统包含用于产生多孔材料(例如聚合物)以便为外部腔室提供基层的组合物(例如包含单体的组合物)。在一些实施方案中,内部腔室(11)的壁不接触系统的表面(14)。因此,在一些实施方案中,该电泳池(10)包含在内部腔室(11)的壁与表面(14)之间的间隙(18)。在一些实施方案中,内部腔室(11)的壁与表面(14)间隔大约10至100μm(例如10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100μm)的距离以便在内部腔室(11)的壁与表面(14)之间提供间隙(18)(参见例如图9)。在一些实施方案中,间隙(18)允许电流在内部腔室(11)与外部腔室(12)之间流动(参见例如图9)。在一些实施方案中,间隙(18)包含与基层(17)相同的材料。在一些实施方案中,该电泳池(10)包含阳极和阴极。在一些实施方案中,阳极和阴极提供跨越内部腔室(11)和外部腔室(12)的电压(例如电势)(19)。在一些实施方案中,阳极电连接到内部腔室(11)上,阴极电连接到外部腔室(12)上(以便例如将带负电荷的分析物移动到表面(14)上)。在一些实施方案中,阴极电连接到内部腔室(11)上且阳极电连接到外部腔室(12)上(以便例如将带正电荷的分析物移动到表面(14)上)。一些系统实施方案进一步包含电压供应。在一些实施方案中,该电压供应是直流电源,并在一些实施方案中,该电压供应是交流电源。在一些实施方案中,该电压供应提供0-120v之间的电压(例如0、5、10、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120v)。在一些实施方案中,该电压供应提供以大约1分钟的周期变化的电压。系统实施方案包含分析过程(例如体现为一组指令,例如在软件中编码,该指令引导微处理器进行该分析过程)以鉴定靶标分析物的单个分子。在一些实施方案中,分析过程使用对所述靶标分析物的重复结合和解离事件的空间位置数据和时机(例如开始、结束或时间长度)作为输入数据。系统的实施方案在检测的分析物方面没有限制。例如,在一些实施方案中,该分析物是多肽,例如蛋白质或肽。在一些实施方案中,该靶标分析物是核酸。在一些实施方案中,该靶标分析物是小分子。在一些实施方案中,靶标分析物与查询探针之间的相互作用可以不同地受靶标分析物的共价修饰的影响。例如,在一些实施方案中,该分析物是包含翻译后修饰的多肽,例如包含翻译后修饰的蛋白质或肽。在一些实施方案中,多肽的翻译后修饰影响查询探针与分析物的瞬时结合,例如查询探针信号随多肽上存在或不存在翻译后修饰而变。例如,在一些实施方案中,该分析物是包含外遗传修饰的核酸,例如包含甲基化碱基的核酸。在一些实施方案中,核酸的修饰影响查询探针与分析物的瞬时结合,例如该查询探针信号随核酸上存在或不存在修饰而变。在一些实施方案中,翻译后修饰与查询探针之间的瞬时相互作用由化学亲和标签(例如包含核酸的化学亲和标签)来介导。在一些实施方案中,该查询探针是核酸或适体。在一些实施方案中,该查询探针是低亲和力抗体、抗体片段或纳米抗体。在一些实施方案中,该查询探针是dna-结合蛋白、rna-结合蛋白或dna-结合核糖核蛋白复合物。在一些实施方案中,该分析物是包含对靶标分析物的核碱基、核糖或脱氧核糖部分的共价修饰的核酸。在一些实施方案中,该捕获探针是高亲和力抗体、抗体片段或纳米抗体。在一些实施方案中,该捕获探针是核酸。在一些实施方案中,通过将靶标分析物共价键交联至该表面来介导捕获。在一些实施方案中,在表面固定之前,靶标分析物在载体的存在下经历热变性。在一些实施方案中,在表面固定之前,该分析物在载体的存在下经历化学变性,例如该分析物用变性剂如尿素、甲酰胺、氯化胍、高离子强度、低离子强度、高ph、低ph或十二烷基硫酸钠(sds)来变性。该技术的一些系统实施方案包含用于检测和量化靶标分析物的组件。根据该技术的系统包含例如固体支承物(例如显微镜载玻片、盖玻片、抗生物素蛋白(例如链亲和素)缀合的显微镜载玻片或盖玻片、包含零模式波导阵列的固体支承物等等)和如本文中所述的查询探针。一些系统实施方案包含检测组件,所述检测组件是荧光显微镜,其包含照明配置以激发结合的查询探针(例如棱镜型全内反射荧光(tirf)显微镜、物镜型tirf显微镜、近tirf或hilo显微镜、共焦激光扫描显微镜、零模式波导和/或能够平行监测载玻片或盖玻片的大面积(>100μm2)并同时将照明限制在表面附近空间的小区域内的照明配置)。一些实施方案包含荧光检测器,例如包含增强型电荷耦合器件(iccd)、电子倍增电荷耦合器件(em-ccd)、互补金属氧化物半导体(cmos)、光电倍增管(pmt)、雪崩型光电二极管(apd)和/或能够检测来自单一发色团的荧光发射的另一检测器的检测器。一些特定实施方案包括配置用于无透镜成像的组件,例如无透镜显微镜,例如用于在检测器(例如cmos)上直接成像而不使用透镜的检测和/或成像组件。一些实施方案包括计算机和软件,该软件编码由计算机执行的指令,以便例如控制数据采集和/或用于处理数据的分析过程。一些实施方案包含光学器件,如透镜、反射镜、分色镜、滤光器等等,以便例如选择性地检测特定波长范围或多个波长范围内的荧光。例如,在一些实施方案中,使用基于计算机的分析软件将由检测测定产生的原始数据(例如一种或多种分析物的存在、不存在或量,例如作为表面上的时间和/或位置(例如x、y坐标)的函数)转化为临床医生的预测值的数据。临床医生可以使用任何合适的手段来访问预测数据。一些系统实施方案包含计算机系统,本技术的实施方案可以在该计算机系统上实施。在各种实施方案中,计算机系统包括用于传送信息的总线或其它通信机制以及与总线耦合的用于处理信息的处理器。在各种实施方案中,该计算机系统包括耦合到总线上的存储器和要由处理器执行的指令,该存储器可以是随机存取存储器(ram)或其它动态存储设备。存储器还可用于在执行要由处理器执行的指令期间存储临时变量或其它中间信息。在各种实施方案中,计算机系统可以进一步包括耦合到总线上的只读存储器(rom)或其它静态存储设备,以便用于存储用于处理器的静态信息和指令。可以提供存储设备如磁盘或光盘,并将其耦合到总线上以便存储信息和指令。在各种实施方案中,计算机系统经由总线耦合到显示器上,如阴极射线管(crt)或液晶显示器(lcd),以便向计算机用户显示信息。包括字母数字键和其它键的输入设备可以耦合到总线上,以便向处理器传送信息和命令选择。另一类型的用户输入设备是光标控制,如鼠标、轨迹球或光标方向键,以便向处理器传送方向信息和命令选择,并用于控制显示器上的光标移动。该输入设备通常在两个轴(第一轴(例如x)和第二轴(例如y))上具有两个自由度,这允许设备指定平面中的位置。计算机系统可以执行本技术的实施方案。与本技术的某些实施方式一致,结果可以由计算机系统响应处理器执行存储器中包含的一个或多个指令的一个或多个序列来提供。此类指令可以从另一计算机可读介质如存储设备读入存储器。执行存储器中包含的指令序列可以使处理器执行本文中描述的方法。或者,可以使用硬连线电路来代替软件指令或与软件指令组合来实现本教导。因此,本技术的实现不限于硬件电路和软件的任何特定组合。本文中所用的术语“计算机可读介质”是指参与向处理器提供指令以供执行的任何介质。此类介质可以采取许多形式,包括但不限于非易失性介质、易失性介质和传输介质。非易失性介质的实例可以包括但不限于光盘或磁盘,如存储设备。易失性介质的实例可以包括但不限于动态存储器。传输介质的实例可以包括但不限于同轴电缆、铜线和光纤,包括包含总线的导线。计算机可读介质的常见形式包括例如软盘、柔性盘、硬盘、磁带或任何其它磁介质、cd-rom、任何其它光介质、打孔卡、纸带、任何其它具有孔图案的物理介质、ram、prom和eprom、flash-eprom、任何其它存储器芯片或盒式磁带、或计算机可以由此读取的任何其它有形介质。各种形式的计算机可读介质可用于将一个或多个指令的一个或多个序列传送到处理器以供执行。例如,指令最初可以被携带在远程计算机的磁盘上。远程计算机可以将指令加载到其动态存储器中,并且通过网络连接(例如lan、wan、因特网、电话线)发送指令。本地计算机系统可以接收数据并将其发送到总线。总线可以将数据传送到存储器,处理器从存储器检索并执行指令。由存储器接收的指令可以可选地在由处理器执行之前或之后存储在存储设备上。根据各种实施方案,被配置为由处理器执行以实施方法的指令存储在计算机可读介质上。计算机可读介质可以是存储数字信息的设备。例如,计算机可读介质包括本领域已知的用于存储软件的光盘只读存储器(cd-rom)。计算机可读介质由适于执行被配置为要被执行的指令的处理器访问。根据此类计算机系统,本文中提供的技术的一些实施方案进一步包括用于收集、存储和/或分析数据(例如分析物的存在、不存在、浓度)的功能。例如,一些实施方案设想了一种系统,其包括处理器、存储器和/或数据库,用于例如存储和执行指令、分析荧光、图像数据、使用数据执行计算、变换数据以及存储数据。在一些实施方案中,算法将统计模型(例如泊松模型或隐马尔可夫模型)应用于数据。许多诊断涉及确定一种或多种核酸的存在或一种或多种核酸的核苷酸序列。在一些实施方案中,包含代表一种或多种分析物的存在、不存在、浓度、量或序列性质的变量的方程产生可用于进行诊断或评估分析物的存在或品质的值。由此,在一些实施方案中,该值由设备呈现,例如由与结果相关的指示器(例如led、显示器上的图标、声音等等)来呈现。在一些实施方案中,设备存储该值、传递该值、或使用该值用于附加计算。在一些实施方案中,方程包括表示一种或多种分析物的存在、不存在、浓度、量或性质的变量。由此,在一些实施方案中,本技术提供了进一步的益处:临床医生(其可能没有经过分析测定培训)无需理解原始数据。该数据以其最有用形式直接呈现给临床医生。临床医生随后能够利用该信息来优化受试者的护理。本技术设想了能够接收、处理来自进行测定的实验室、信息提供者、医学人员和/或受试者的信息和将信息传递至进行测定的实验室、信息提供者、医学人员和/或受试者的任何方法。例如,在本技术的一些实施方案中,从受试者获得样品并经受位于世界任何部分(例如在不同于受试者所居住的国家或最终使用所述信息的国家的国家)的概况分析服务(例如医疗设施的临床实验室、基因组概况分析商业机构等等)以产生原始数据。当该样品包含组织或其它生物样品时,受试者可以访问医学中心以获得样品并将其送至概况分析中心,或者受试者可以自行收集样品并直接将其送至概况分析中心。当样品包含先前确定的生物学信息时,该信息可以由受试者直接送至概况分析服务(例如可以由计算机扫描含有信息的信息卡,并使用电子通信系统将数据传送至概况分析中心的计算机)。一旦被概况分析服务接收到,处理该样品并产生对受试者需要的诊断或预后信息而言特异性的概况。然后以适于由主治临床医生解释的形式制备概况数据。例如,不是提供原始表达数据,制备的格式可能呈现受试者的诊断或风险评估,以及关于具体治疗选择的推荐。所述数据可以通过任意合适的方法显示给临床医生。例如,在一些实施方案中,所述概况分析服务产生这样的报告:其可以打印给临床医生(例如在护理点)或在计算机监视器上显示给临床医生。在一些实施方案中,首先在护理点处或在区域设施处分析信息。然后将原始数据发送至中心处理设施以便进一步分析和/或将原始数据转化成对于临床医生或患者有用的信息。该中心处理设施提供数据分析的私密性(所有数据都以一致的安全协议存储在中心设施中)、速度和一致性的优点。该中心处理设施随后可以在治疗受试者之后控制数据的命运。例如,使用电子通信系统,中心设施可以将数据提供给临床医生、受试者或研究人员。在一些实施方案中,受试者能够使用电子通信系统访问数据。受试者可以根据结果选择进一步干预或咨询。在一些实施方案中,将该数据用于研究用途。例如,可以将所述数据用于进一步优化标志物的包含或消除作为与疾病有关的特定情况的有用指标。该技术提供了基于由查询探针与分析物的瞬时结合所产生的信号向提供与分析物的鉴定、检测、量化和/或表征相关的信息的数据的转化对分析物进行超分辨率鉴定、检测、量化和/或表征。一些实施方案包含如本文中所述的一个或多个步骤,例如本文中描述的一个或多个有序步骤。在一些实施方案中,一个或多个步骤取决于并跟随一个或多个其它步骤;但是,一些实施方案包含一个或多个所述步骤,而不考虑任何特定顺序。本文中所用的术语“数据集”或“影片”涉及包含传感器阵列数据(例如来自ccd、增强ccd、电子倍增ccd、cmos传感器等等)的时间序列的数据,其中传感器阵列数据的时间序列的每个时间点(或“帧”)包含随传感器阵列内的位置(例如x、y坐标)而变的一组信号强度值。在一些实施方案中,该(x、y)位置是指在二维传感器阵列内,例如在影片数据集的帧中在水平(x)和垂直(y)方向上的传感器元素(例如像素)的坐标。在一些实施方案中,从包含查询探针的样品收集所描述的数据集(例如一些实施方案包括从包含查询探针的样品收集数据集)。在一些实施方案中,该样品包含分析物。在一些实施方案中,据信该样品包含分析物。在一些实施方案中,不知道样品是否包含分析物。一些实施方案包含生成差示强度图影片。例如,一些实施方案包括从影片的下一帧n+1中相同像素p的相应强度值减去影片的每一帧n中每个像素p的强度值。这些减法的结果是时间序列的差示强度图,其与初始影片相比少包含一个帧。一些实施方案包括从影片的帧n+2、n+3、n+4、n+n中相同像素p的相应强度值减去影片的每一帧n中每个像素p的强度值,以产生时间序列的差示强度图,其与初始影片相比包含少2、3、4或n个帧。一些实施方案包含记录在差示强度图的每一帧内的每个强度最大值(例如对应于查询探针结合事件)的位置、强度和/或帧数量中的一种或多种。在一些实施方案中,通过数据的转化来确定位置,所述转化包括例如二维高斯拟合、形心拟合或用于确定粒子的位置的其它方法,例如在一些实施方案中误差为1个像素或更小。一些实施方案包含记录在差示强度图的每一帧内的每个强度最小值(例如对应于查询探针解离事件)的位置、强度(例如强度绝对值)和/或帧数量中的一种或多种。在一些实施方案中,通过数据的转化来确定位置,所述转化包括例如二维高斯拟合、形心拟合或用于确定粒子的位置的其它方法,例如在一些实施方案中误差为1个像素或更小。一些实施方案包含组合强度最大值和/或强度最小值的(x、y)位置。一些实施方案进一步包含对强度最大值和/或强度最小值的(x、y)位置进行簇集分析(例如分层簇集)以鉴定查询探针结合和解离事件的高密度区域。在一些实施方案中,簇集分析产生簇,其中每个簇含有1个或多个结合和/或解离事件,其在传感器的有限区域内检出。一些实施方案包含对每个簇内的事件计算一个或多个统计学度量,包括但不限于查询探针结合和/或解离事件的数量;给定的结合事件与下一解离事件之间的帧数量的平均值、中值、最大值、最小值、范围和标准偏差中的一种或多种;给定的解离事件与下一结合事件之间的帧数量的平均值、中值、最大值、最小值、范围和标准偏差中的一种或多种;查询探针结合和解离事件的(x、y)位置的平均值、中值、最大值、最小值、范围和标准偏差中的一种或多种;和/或与查询探针结合和解离事件有关的信号强度变化的平均值、中值、最大值、最小值、范围和标准偏差中的一种或多种。一些实施方案包含将对查询探针结合事件的每个簇如上所述测得的统计学与使用标准参考材料(例如阳性对照物)测得的统计学进行比较。一些实施方案包含将对查询探针结合事件的每个簇如上所述测得的统计学与使用阴性对照物(例如不包含分析物、与分析物密切相关的物质、包含修饰和/或不包含修饰的分析物等等)测得的统计学进行比较。在一些实施方案中,将对查询探针结合事件的每个簇如上所述测得的统计学与使用标准参考材料和/或阴性对照物测得的统计学进行比较用于确定查询探针结合事件的簇是否可能源自查询探针与靶标分析物的单分子的结合。一些实施方案包含计算代表查询探针与靶标分析物结合的数据集中的簇数量。在一些实施方案中,计算代表查询探针与靶标分析物结合的数据集中的簇数量包括使用一种或多种上述统计学检验。在一些实施方案中,计算代表查询探针与靶标分析物结合的数据集中的簇数量提供了通过该方法测定的成像表面的区域中存在的分析物数量(例如分析物的表观数量)的量度。在一些实施方案中,计算代表查询探针与靶标分析物结合的数据集中的簇数量提供了分析物浓度的量度,提供了分析物在样品中存在或不存在的指示,和/或提供了样品中的分析物的状态(例如修饰、未修饰)的指示。一些实施方案任选地包括将如上所述的分析物的表观数量、浓度、状态、存在或不存在与对已知分析物浓度的分析物的表观数量、浓度、状态、存在或不存在的先前测定的值进行比较。一些实施方案包括使用标准曲线(例如用一种或多种包含具有已知浓度的靶标分析物的标准参考材料的组合物产生)以确定样品中靶标分析物的浓度。在一些实施方案中,所述方法的步骤以软件代码实施,例如,命令计算机和/或微处理器如上所述产生和/或转化数据的一系列程序步骤。在一些实施方案中,软件指令用编程语言编码,如basic、c、c++、java、matlab、mathematica、perl、python或r。在一些实施方案中,分析物的超分辨率鉴定、检测、量化和/或表征的一个或多个步骤或组件以在模块系统中连接的单个软件对象形式来提供。在一些实施方案中,软件对象是可扩展的和可移植的。在一些实施方案中,对象包含数据结构和转化对象数据的操作。在一些实施方案中,对象通过操作它们的数据和调用它们的方法来使用。因此,实施方案提供软件对象,其模拟、建模或提供真实的实体,例如对于可操作的数量、形状、数据结构。在一些实施方案中,软件对象在计算机或微处理器中操作。在一些实施方案中,软件对象储存在计算机可读介质上。在一些实施方案中,本文中描述的方法的步骤作为对象方法提供。在一些实施方案中,本文中描述的数据和/或数据结构作为对象数据结构提供。分析物该技术在被检测、量化、鉴定或以其它方式表征(例如存在、不存在、量、浓度、状态)的分析物方面没有限制。本文中所用的术语“分析物”是一个宽泛的术语。并以其普通意义使用,包括但不限于是指可以分析的样品如生物流体(例如血液、间质液、脑脊液、淋巴液或尿液)中的物质或化学成分。分析物可以包括天然存在的物质、人工物质、代谢产物和/或反应产物。在一些实施方案中,该分析物包含盐、糖、蛋白质、脂肪、维生素或激素。在一些实施方案中,该分析物天然存在于生物样品中(例如是“内源性的”);例如,在一些实施方案中,该分析物是代谢产物、激素、抗原、抗体等等。或者,在一些实施方案中,该分析物被引入生物有机体中(例如是“外源性的),例如药物、药物代谢产物、药物前体(例如前药)、用于成像的造影剂、放射性同位素、化学试剂等等。药物和药物组合物的代谢产物也是设想的分析物。在一些实施方案(例如涉及电泳池的实施方案)中,该分析物是带电的。例如,在一些实施方案中,该分析物携带负电荷(例如净负电荷)。在一些实施方案中,该分析物携带正电荷(例如净正电荷)。在一些实施方案中,该分析物携带部分电荷(例如分析物携带部分负电荷或部分正电荷)。在一些实施方案中,该分析物的电荷状态是未知的。在一些实施方案中,该分析物通过向阳极或阴极移动来响应电势(例如电压)。在一些实施方案中,分析物用产生带电分子(例如带负电荷的分子、带正电荷的分子、部分带负电荷的分子、部分带正电荷的分子)的部分衍生化(例如共价地、非共价地)。在一些实施方案中,该分析物结合到产生带电复合物(例如带负电的复合物、带正电的复合物、部分带负电的复合物、部分带正电的复合物)的部分上。由此,在一些实施方案中,分子(例如用部分衍生的分析物)通过向阳极或阴极移动来响应电势(例如电压)。在一些实施方案中,复合物(例如与部分结合的分析物)通过向阳极或阴极移动来响应电势(例如电压)。在一些实施方案中,该分析物是多肽、核酸、小分子、脂质、碳水化合物、多糖、脂肪酸、磷脂、糖脂、鞘脂、有机分子、无机分子、辅因子、药物、生物活性剂、细胞、组织、生物体等等。在一些实施方案中,该分析物包括多肽、核酸、小分子、脂质、碳水化合物、多糖、脂肪酸、磷脂、糖脂、鞘脂、有机分子、无机分子、辅因子、药物、生物活性剂、细胞、组织、生物体等等。在一些实施方案中,分析物包括多肽、核酸、小分子、脂质、碳水化合物、多糖、脂肪酸、磷脂、糖脂、鞘脂、有机分子、无机分子、辅因子、药物、生物活性剂、细胞、组织、生物体等等中的一种或多种的组合。在一些实施方案中,该分析物是多分子复合物的一部分,例如多蛋白复合物、核酸/蛋白质复合物、分子机器、细胞器(例如无细胞线粒体,例如在血浆中;质体;高尔基体、内质网、液泡、过氧化物酶体、溶酶体和/或细胞核)、细胞、病毒颗粒、组织、生物体或任何大分子复合物或结构或可以被捕获并适于通过本文中描述的技术分析的其它实体(例如核糖体、剪接体、穹窿体、蛋白酶体、dna聚合酶iii全酶、rna聚合酶ii全酶、对称病毒衣壳、groel/groes;膜蛋白复合物:光合系统i、atp合酶、核小体、中心蛋白和微管组织中心(mtoc)、细胞骨架、鞭毛、核细胞、应激颗粒、生殖细胞颗粒或神经元转运颗粒)。例如,在一些实施方案中,多分子复合物被分离,并且该技术可用于表征、鉴定、量化和/或检测与多分子复合物相关(例如为其组分)的一种或多种分子(分析物)。在一些实施方案中,分离胞外囊泡,并且该技术可用于表征、鉴定、量化和/或检测与囊泡相关的一种或多种分子(分析物)。在一些实施方案中,该技术可用于表征、鉴定、量化和/或检测存在于囊泡内部的蛋白质(例如表面蛋白)和/或分析物,例如,蛋白质、核酸或本文中描述的其它分析物。在一些实施方案中,在分析之前固定并透性化该囊泡。在一些实施方案中,该分析物经化学修饰以提供用于查询探针结合的位点。例如,在一些实施方案中,磷酸丝氨酸和磷酸苏氨酸在强碱性条件下的β-消除用于引入烯烃,接着将亲核试剂如二硫醇迈克尔加成到烯烃上。随后剩余的游离硫醇用于缀合到具有与寡核苷酸查询探针互补的序列的含有马来酰亚胺的寡核苷酸上。磷酸丝氨酸和磷酸苏氨酸的翻译后修饰随后可以使用查询探针探测并如本文中所述进行分析。本文中所用的“检测分析物”或“检测物质”将理解为涵盖直接检测分析物本身或通过检测其副产物间接检测该分析物。样品在一些实施方案中,从生物样品中分离分析物。分析物可以获自任何材料(例如细胞材料(活的或死的)、细胞外材料、病毒材料、环境样品(例如宏基因组样品)、合成材料(例如扩增子,如通过pcr或其它扩增技术提供的)),获自动物、植物、细菌、古细菌、真菌或任何其它生物体。用于本技术的生物样品包括病毒颗粒或其制品。分析物可以直接获自生物体或获自由生物体获得的生物样品,例如获自血液、尿液、脑脊液、精液、唾液、痰、粪便、毛发、汗液、泪水、皮肤和组织。示例性的样品包括但不限于全血、淋巴流体、血清、血浆、口颊细胞、汗液、泪水、唾液、痰、毛发、皮肤、活组织检查、脑脊液(csf)、羊水、精液、阴道排泄物、浆液、滑液、心包液、腹膜液、胸膜液、漏出液、渗出液、囊液、胆汁、尿、胃液、肠液、粪便样品和拭子、抽吸物(例如骨髓、细针等等)、洗液(例如口腔、鼻咽、支气管、支气管肺泡、眼、直肠、肠、阴道、表皮等等)、呼吸冷凝液和/或其它样本。任何组织或体液样本可以用作在该技术中使用的分析物的来源,包括法医样本、存档样本、保留样本和/或长时间储存的样本,例如新鲜-冷冻的、甲醇/乙酸固定的或福尔马林固定的石蜡包埋的(ffpe)样本和样品。分析物还可以分离自培养的细胞,如原代细胞培养物或细胞系。可以用病毒或其它细胞内病原体感染获取分析物的细胞或组织。样品还可以是从生物样本、cdna文库、病毒或基因组dna提取的总rna。样品也可以是来自非细胞起源的分离的dna,例如已经在冰柜中储存的扩增的/分离的dna。例如,可以通过多种技术,如maniatis等人(1982)molecularcloning:alaboratorymanual,coldspringharbor,n.y.(参见例如第280–281页)描述的那些,例如通过提取从生物样品中获得分析物(例如核酸分子、多肽、脂质)。在一些实施方案中,该技术提供了分析物的尺寸选择,例如提供限定尺寸范围的分子(包括靶标分析物)。用途各种实施方案涉及多种分析物的检测。例如,在一些实施方案中,该技术用于检测核酸(例如dna或rna)。在一些实施方案中,该技术用于检测包含特定靶标序列的核酸。在一些实施方案中,该技术用于检测包含特定突变(例如单核苷酸多态性、插入、缺失、错义突变、无义突变、基因重排、基因融合等等)的核酸。在一些实施方案中,该技术用于检测多肽(例如蛋白质、肽)。在一些实施方案中,该技术用于检测由包含突变的核酸编码的多肽(例如包含置换的多肽、截短的多肽、突变体或变体多肽)。在一些实施方案中,该技术用于检测多肽的翻译后修饰(例如磷酸化、甲基化、乙酰化、糖基化(例如o-连接糖基化、n-连接糖基化、遍在蛋白化、官能团连接(例如豆蔻酰化、棕榈酰化、异戊二烯化、异戊烯化、法尼基化、香叶基化、香叶基香叶基化、糖基磷脂酰肌醇化、糖基磷脂酰肌醇(gpi)锚形成)、羟基化、生物素化、聚乙二醇化、氧化、sumo化、二硫桥形成、二硫桥裂解、蛋白水解裂解、酰胺化、硫酸化、吡咯烷酮羧酸形成)。在一些实施方案中,该技术用于检测这些特征的丢失,例如去磷酸化、去甲基化、去乙酰化、去糖基化、去酰胺化、去羟基化、去遍在蛋白化等。在一些实施方案中,该技术用于检测dna或rna的外遗传修饰(例如甲基化(例如cpg位点的甲基化)、羟基甲基化)。在一些实施方案中,该技术用于检测这些特征的丢失,例如,dna或rna的去甲基化等等。在一些实施方案中,该技术用于检测染色质结构、核小体结构、组蛋白修饰等的改变,和用于检测对核酸的损伤。在一些实施方案中,该技术用作分子诊断测定,例如测定具有小样本体积的样品(例如一滴血液,例如用于邮寄服务)。在一些实施方案中,该技术使用极低丰度分析物生物标志物的灵敏检测来提供癌症或感染性疾病的早期检测。在一些实施方案中,该技术用于分子诊断以测定蛋白生物标志物的外遗传修饰(例如翻译后修饰)。在一些实施方案中,该技术该技术用于表征多分子复合物(例如表征多分子复合物的一个或多个组分),例如多蛋白复合物、核酸/蛋白质复合物、分子机器、细胞器(例如无细胞线粒体,例如在血浆中)、细胞、病毒颗粒、生物体、组织或可以捕获并适于通过本文中描述的技术分析的任何大分子结构或实体。例如,在一些实施方案中,分离多分子复合物,并且该技术用于表征、鉴定、量化和/或检测与多分子复合物相关的一种或多种分子(分析物)。在一些实施方案中,分离细胞外囊泡,并且该技术用于表征、鉴定、量化和/或检测与囊泡相关的一种或多种分子(分析物)。在一些实施方案中,该技术用于表征、鉴定、量化和/或检测囊泡内部存在的蛋白(例如表面蛋白)和/或分析物,例如蛋白、核酸或本文中描述的其它分析物。在一些实施方案中,在分析之前固定并透性化该囊泡。在一些实施方案中,分离(例如在分开的孔、微孔、微流体通道、样品室、试管、微量离心管或其它容器或隔室中,或在同一隔室的分开的区域中)单个细胞(例如人、哺乳动物、脊椎动物、真核或原核细胞)、单个细胞器(例如线粒体、细胞核、高尔基体)、亚细胞囊泡(例如外泌体)和/或亚细胞粘着颗粒(例如无膜细胞器(例如细胞内外泌体、蛋白质聚集体))。在一些实施方案中,通过物理提取(例如使用抽吸、流体力或光学捕获)从活的或化学固定的细胞、组织、集落或生物流体中分离单个细胞、细胞器、亚细胞囊泡和/或亚细胞粘附颗粒。在一些实施方案中,从福尔马林固定、石蜡包埋(ffpe)的组织中分离单个细胞、细胞器、亚细胞囊泡和/或亚细胞粘附颗粒。在一些实施方案中,通过流体(例如通过荧光激活细胞分选facs)或微流体操作,或通过分离到培养皿、显微镜载玻片或盖玻片的分开的孔或区域中,或在3d细胞培养基或基质的不同区域中,从悬浮液中分离单个细胞、细胞器、亚细胞囊泡和/或亚细胞粘附颗粒。在一些实施方案中,使用电场和/或磁场来实现单个细胞、细胞器、亚细胞囊泡和/或亚细胞粘附颗粒与其它生物组分的分离。也就是说,在一些实施方案中,使用电场和/或磁场来分离单个细胞、细胞器、亚细胞囊泡和/或亚细胞粘附颗粒。在一些实施方案中,处理(例如用细胞裂解缓冲液;去污剂如sds、tritonx-100或脱氧胆酸盐;和/或酶如蛋白酶、脂肪酶或核酸酶)单个细胞(例如人、哺乳动物、脊椎动物、真核或原核细胞)、单个细胞器(例如线粒体、细胞核、高尔基体)、亚细胞囊泡(例如外分泌体)和/或亚细胞粘附颗粒(例如无膜细胞器(例如细胞内外泌体、蛋白质聚集体))以便从每个单个细胞、细胞器、亚细胞囊泡和/或亚细胞粘附颗粒中释放分析物。在一些实施方案中,在固体支承物上或附近原位处理单个细胞、细胞器、亚细胞囊泡和/或亚细胞粘着颗粒,以释放分析物,由此捕获在固体支承物的附近区域上。在一些实施方案中,在固体支承物的表面处捕获该分析物。在一些实施方案中,在固体支承物上捕获之前,通过将单个细胞、细胞器、亚细胞小泡和/或亚细胞粘附颗粒的内容物与另一种混合物混合以形成双水相体系来浓缩该分析物。在一些实施方案中,通过单分子检测方法(例如simreps)来检测该分析物。虽然该公开内容本文中涉及某些说明性实施方案,要理解的是,这些实施方案以举例方式而非以限制方式呈现。实施例方法本研究中使用的所有未修饰的dna寡核苷酸均购自integrateddnatechnologies(idt),进行标准脱盐纯化。荧光探针寡核苷酸购自idt,进行5’或3’荧光团修饰和高效液相色谱(hplc)纯化。生物素化的lna捕获探针购自exiqon,进行hplc纯化。通过在退火缓冲液(10mmtris-hcl[25℃下ph8.0],50mmnacl,1mmedta)中组合互补寡核苷酸(每条链20μm),在95℃下加热5分钟,随后在室温下缓慢冷却15分钟来制备双链dna底物。simreps试验在olympusix-81物镜型tirf显微镜上进行,该显微镜装备有60×油浸物镜(apon60xotirf,1.49na),具有cell^tirf和z-漂移控制模块,以及emccd照相机(ixon897,andor,emgain150)。在一些试验中,如先前所述构建样品细胞(参见例如johnson-buck等人(2015)“kineticfingerprintingtoidentifyandcountsinglenucleicacids”nat.biotechnol.33:730-32,经此引用并入本文)。简而言之,用生物素-peg-5000和mpeg-5000的1:10混合物(laysanbio,inc.)钝化玻璃盖玻片,并在氮气下在黑暗中储存长达两周。在单分子试验之前,将20μl移液管尖端(eppendorf,低附着性)切至1厘米的总长度,并将未切割的基层经环氧树脂(doublebubble,hardmanadhesives)附着到涂覆的玻璃盖玻片上以形成完整的水密样品池。当指出时,使用包含限制性开口和atps浓度的样品槽将分析物沉积到样品细胞上。该研究中使用的simreps方案基于先前描述的方法(参见例如johnson-buck等人(2015)“kineticfingerprintingtoidentifyandcountsinglenucleicacids”nat.biotechnol.33:730-32,经此引用并入本文),具有三处主要修改:(1)在表面涂覆过程中lna浓度由20nm提高至100nm,(2)在分析物捕获之前直接添加对本文中所用低和亚纳摩尔dna浓度有效的热变性步骤,以增加对靶标dna链的接近,和(3)当探测t790m样品时,将包括lna阻断剂和野生型竞争剂(wtc)的两种附加的寡核苷酸添加到成像溶液中。所有dna处理在genemate低粘附1.7ml微离心管中进行,并且所有稀释和变性步骤在2μmpoly-t寡脱氧核糖核苷酸(dt10)的存在下进行。如下进行更新的方案。首先,用t50缓冲液(10mmtris-hcl[25℃下ph8.0],1mmedta)洗涤样品细胞,随后与40μl1mg/ml链亲和素一起温育10分钟。样品细胞随后用t50缓冲液洗涤以除去过量的链亲和素,与40μl100nm生物素化lna一起温育10分钟,并用1×pbs洗涤。随后在热循环仪中在95℃将靶标dna寡核苷酸变性3分钟(除非另行说明),在室温水中冷却5分钟(经部分浸没),随后立即添加至lna涂覆的表面。在潮湿的室内在室温下进行dna捕获1小时。捕获后,用4×pbs除去过量的dna。在邻成像前,将含有25nm荧光探针、4×pbs、5mm3,4-二羟基苯甲酸盐、50nm原儿茶酸双加氧酶和1mmtrolox的成像缓冲液添加到样品细胞中。在特异性探测t790m时,还向成像溶液中添加25nmlna阻断剂和1μmwtc。在500ms曝光时间的通过640nm激光的tirf照射下监测荧光探针的瞬时结合10分钟(获得1200个总帧数)。在本研究中使用两种不同的分析管线来研究动力学数据。称为“衍射限制”的第一分析管线采用定制matlab代码来识别荧光探针结合和解离的位点,并计算强度对时间的轨迹(参见例如johnson-buck等人(2015)“kineticfingerprintingtoidentifyandcountsinglenucleicacids”nat.biotechnol.33:730-32,经此引用并入本文)。随后使用qub软件套装(stateuniversityofnewyorkatbuffalo)应用隐马尔可夫建模(hmm)来确定每种候选分子的结合和解离事件(nb+d)的数目以及中值荧光探针结合(τbound)和未结合(τunbond)时间(blanco&walter(2010)“analysisofcomplexsingle-moleculefrettimetrajectories”methodsenzymol.472:153-78,经此引用并入本文)。基于(i)无dna,(ii)仅野生型dna,和(iii)仅突变体dna对照试验,定义动力学阈值以实现标称假阳性频率,同时保持对真突变体候选物的高灵敏度。应用于所有dna靶标的阈值包括信噪比>3,平均结合状态强度高于平均背景强度>500计数,最大τbound中位数≤20秒,最大τunbround中位数≤30秒,且nb+d≥20。对于外显子19缺失量化,最小τbround和τunbround的中值阈值被设定为≥2.5秒,而对于t790m量化,最小τbround和τunbround的中值阈值被设定为≥3秒。双链dna底物通过使化学合成的寡核苷酸(“合成”底物,参见上文)退火或通过质粒dna的限制酶消化(“克隆”底物)来制备。所用的克隆策略是使所得的克隆dna底物在序列上与合成底物相同。本研究中使用的所有质粒均可通过addgene获得(www.addgene.org)。使用购自newenglandbiolabs的酶,使用标准分子生物学技术制备含有4个拷贝的所需野生型或突变体片段的质粒。简而言之,部分互补的正向和反向寡核苷酸购自idt,并根据制造商的建议使用t4多核苷酸激酶(#m0201s)磷酸化。通过以1:1化学计量比组合互补链并使用热循环仪加热和缓慢冷却,将磷酸化的寡核苷酸退火。时候用t4dna聚合酶(#m0203s)或大肠杆菌dna聚合酶i(大的klenow片段,#m0210s)填充退火的寡核苷酸以产生完全互补的平端片段,随后连接到用smai线性化的puc19载体中,并转化到大肠杆菌的jm109菌株(promega,p9751)中。通过pcr筛选菌落,并选择含有≥4拷贝插入片段的克隆。所有克隆的质粒序列通过sanger测序法确认。野生型t790和突变t790m克隆底物通过用mlyi和zrai(#r0610s和#r0659s)消化它们相应的多插入物质粒(puc19_4xt790_28bp和puc19_4xt790m_28bp)来制备。在凝胶电泳和在20%非变性聚丙烯酰胺凝胶上的sybr金染色后,通过与标准曲线比较来确定限制性消化片段的浓度。使用双尾、未配对t检验(graphpadquickcalcs,www.graphpad.com)来确定每个视野的平均计数之间差异的统计学显著性。使用originpro8软件进行曲线拟合,并使用仪器加权通过线性回归过程中各自的误差值对数值进行加权。实施例1在开发本文中提供的技术的实施方案的过程中,进行试验以便在表面处浓缩小核酸用于分析。根据本文中所述和图1a中描绘的方法进行试验。简而言之,dna分析物浓缩在双水相体系的少数相中,随后在表面处从少数相中捕获该分析物以便进行分析(例如通过单分子分析(例如通过本文中描述的simreps))。在该方法中,离心通常在大约1000×g下进行10-120分钟,以便在盖玻片表面处提供该分析物的高捕获效率。但是,在本文提供的技术的开发过程中进行的试验表明,在1000×g离心大约1分钟足以提供相分离。此外,在这些试验过程中收集的附加的数据表明,包含peg3350、柠檬酸钠和氯化钠的混合物的atps有效地分配和浓缩短的单链或双链dna(例如10-100个nt或bp(例如15-50个nt或bp(例如20-30个nt或bp)))。在一个特定实施方案中,通过本文中描述的atps技术浓缩核酸使表皮生长因子受体(egfr)变体t790m的测定的灵敏度提高了大约80倍(参见例如图1b和1c),这获得了大约100个分子拷贝的检测限。该技术由此具有与pcr分析相似的灵敏度。实施例2在开发本文中提供的技术的实施方案的过程中,生产和测试定制的样品槽,其被设计用于使该atps的富含分析物的相接触捕获基底。特别地,生产了定制的样品槽,其在槽底部包含受限的开口(例如包含大约0.01-1mm2的面积)(参见例如图2)。包含受限开口的样品槽提供了该atps的富含分析物的相与下方的基底之间大约0.01-1mm2的接触面积。因此,包含该受限开口的样品槽将富含分析物的相集中在小区域(例如大约0.01-1mm2)上以便进行有效的表面捕获,并在一些实施方案中对分析物进行检测。实施例3在本文中提供的技术的实施方案的开发过程中,进行试验以便采用通过平衡泊松采样的单分子识别(simreps)或单分子动力学指纹法以高特异性和单分子灵敏度来检测分析物(图3a至图3e)。检测方法包括加热样品以使双链(双链体)dna变性,并将其转化为单链dna。在高浓度的单链dt10载体存在下进行短暂的热变性步骤以抑制互补分析物链的再退火。接着,通过固定在载玻片表面的靶标基因特异性lna捕获探针来捕获单链靶标dna。在使用本文中描述的动力学指纹法进行分析之前洗去剩余的未结合dna。在这些试验中,使用了突变体特异性荧光探针,其被优化以具有快速结合和解离动力学。在该技术的实施方案的开发过程中,进行试验以测试两个突变靶标dna等位基因的dna链型和热变性对所检测(例如定量)的分子的影响(图3b至3e)。如图3b中所示,变性双链dna将靶标dna的检测提高到与单链dna的检测类似的水平。相对于样品中未变性的双链dna靶标的检测,变性双链dna极大地提高了靶标dna的检测。此外,在本文中描述的技术的实施方案的开发过程中,使用具有突变体dna(mutdna)、具有野生型dna(wtdna)或没有dna(无dna对照物)的突变特异性荧光探针进行了试验以记录动力学迹线(例如使用simreps)(图3c和3d)。使用了用于检测egfr外显子19/缺失(c.2236_2250del15)和egfr外显子20t790/m(c.2369c>t)的探针(分别为图3c和3d)。动力学迹线数据用于构建egfr外显子19缺失和egfr外显子20t790m的simreps测定的标准曲线(图3e)。实施例4在本文中描述的技术的实施方案的开发过程中,进行试验以确定产生单一水相或两个水相的peg、柠檬酸盐和nacl的浓度。收集浊点浊度测定数据以产生双结点曲线(图4)。数据表明peg-3350与二水合柠檬酸钠的组合产生单一水相,或在2.8%w/wnacl的存在下产生两个水相。实施例5在本文中提供的技术的实施方案的开发过程中,进行试验以测试nacl对分析物分配到atps的下相中的影响。从试验中收集数据,其中在不同的水性体系中测量cy5标记的34-核苷酸单链dna分子的分配。对于每个试验,在下列体系中测试100μl的1μm的cy5-寡核苷酸溶液:(1)水对照物(2)300µl60%peg3350+25µl33%柠檬酸钠(3)300µl60%peg3350+25µl33%柠檬酸钠+25µl5mnacl(4)300µl60%peg3350+25µl33%柠檬酸钠+50µl5mnacl(5)300µl60%peg3350+15µl33%柠檬酸钠+50µl5mnacl(6)300µl60%peg3350+25µl33%柠檬酸钠+100µl5mnacl。收集的数据表明混合物(2)和(5)表现出体积类似的富含柠檬酸盐和富含dna的下相,但混合物(5)包含更高浓度的dna,如对混合物(5)观察到的更强的蓝色所显示的那样。因此,数据表明添加nacl改善了dna寡核苷酸向下相的分配。此外,进行了如下试验,其中将1μm的cy5标记的34-核苷酸dna溶液添加到柠檬酸钠、nacl和peg3350的冻干混合物中以测试atps混合物中该dna的浓度。该组分的最终浓度显示在下表1中:表1混合物柠檬酸钠(w/w)nacl(w/w)peg3350(w/w)dna在下相中的浓度(μm)11.20%2.80%39%61.0+/-4.821.50%2.80%39%23.9+/-1.332.00%2.80%39%13.1+/-0.4通过紫外-可见分光光度法测量下相中的dna浓度。数据表明该atps通过降低体系中柠檬酸钠的质量分数并同时保持peg3350和nacl浓度恒定而提高了下相中的dna浓度。实施例6在开发本文中提供的技术的实施方案的过程中,进行试验以测试在三种不同基质中温育dna1小时后通过simreps动力学指纹法每个视野的dna检测:pbs(100μl样品体积)、peg/柠檬酸钠/naclatps(100μl样品体积);和peg/柠檬酸钠/naclatps(20μl样品体积)。将所示样品体积添加到pbs或atps中,使下相与表面接触以便进行固定化并通过simreps进行测定。收集的数据表明该技术将dna的输入体积降低了5倍,同时保持atps的灵敏度提高一半以上(图5)。实施例7在本文中提供的技术的实施方案的开发过程中,进行试验以测试借助atps通过simreps进行的无pcr检测。特别地,从试验收集数据,其中从人尿液样品分离来自egfr基因的内源性低分子量dna片段,然后借助包含peg3350(39%w/w)、柠檬酸钠(1.2%w/w)和nacl(2.8%w/w)的双水相体系通过simreps动力学指纹法进行分析。在载体寡(dt)10链的存在下,在95℃下将dna变性3分钟,随后冷却至室温,随后与peg3350、柠檬酸钠和nacl的冻干固体混合物混合。虽然simreps在没有atps的情况下具有大约1fm的检测限,但是在这里使用atps能够检测亚飞摩尔浓度的dna。双水相体系产生足够的灵敏度以检测野生型dna,但在高于背景的水平下未检测到突变体dna(图6)。实施例8在本文中提供的技术的实施方案的开发过程中,进行试验以测试使用互补寡核苷酸来防止双链dna在热变性和在双水相体系中浓缩后的再杂交。在这组试验中,28个碱基对的双链dna片段(对应于egfr基因的区域)在存在或不存在14个碱基的寡核苷酸(“模块”)的情况下在1×pbs中在95℃下热变性,所述14个碱基的寡核苷酸与28个碱基对的双链体的靶标链部分互补,但不掩盖剩余的14个碱基对(其将干扰表面捕获)。热变性后将混合物冷却,随后与冻干组分充分混合以形成双水相体系(1.2%w/w柠檬酸钠,2.8%w/wnacl,39%w/wpeg3350)。在下相中浓缩dna之后,将包含浓缩的dna的atps的下相与涂有含lna的捕获探针的盖玻片接触,该捕获探针与28个碱基对的双链体的靶标链的一部分互补。收集的数据表明,包括“模块”寡核苷酸将simreps动力学指纹法的灵敏度提高了大约6倍(通过接受的计数来判断,图7)。靶标dna以10fm(10-14m)的标称浓度存在,并且在添加形成atps的组分之前以10μl的体积制备。这些浓度对应于混合物中大约60,000个分析物分子的总拷贝数。成像效率由此为每个视野大约6.7%(4000个计数/60,000个分析物分子),并且分析物的总捕获效率估计为33%(由于单个孔的直径为大约300μm,包括相当于大约5个视野的面积,导致估计20,000个分子被固定在盖玻片的整个可成像区域上)。此外,当包括互补的短寡核苷酸(例如长度为14个碱基对)或“模块”以防止或减缓靶标的两条互补链的再杂交时,以更高的效率捕获更长的双链dna靶标。从试验收集数据,其中使用模块改善含有t790m突变的egfr基因的60个bp和160个bp片段的捕获。通过包含模块寡核苷酸,捕获效率提高大约8至9倍(图8)。实施例9在本文中描述的技术的实施方案的开发过程中,进行试验以测试atps是否可用于浓缩rna分析物。在这些试验过程中收集的数据表明,根据本文中描述的技术,rna分析物浓缩在体积较小的相中。在这些试验中,使用了两个荧光标记的长度为大约22个核苷酸的微小rna(例如mir-21和mir-200a)。收集的数据表明,荧光团标记的mir-21和mir-200a被隔离在双水相体系的富含柠檬酸盐的底部相中,所述双水相体系包含peg3350(16%w/w)、柠檬酸钠(6%w/w)和nacl(2.8%w/w)。实施例10在本文中提供的技术的实施方案的开发过程中,测试了各种浓缩策略以提高基于tirf的simreps测定对dna的灵敏度。尝试了几种策略,包括预浓缩、延长温育、施加外部电压或减少捕获面积(表2)。但是,产生10倍以上的灵敏度的唯一策略是含有peg3350、柠檬酸钠和nacl的双水相体系。与这种atps组合,使用定制样品槽几何形状限制捕获区域(参见图2)提供了超过50倍的灵敏度的可再现改进。表2策略相对灵敏度(计数/fov)在pbs缓冲液中温育,1小时1在pbs缓冲液中温育,18小时~2在2xssc,ph6.4,10%葡聚糖硫酸酯,0.1%tween-20,20%甲酰胺中温育,18小时~1在pbs+10%葡聚糖硫酸酯中温育,18小时3将捕获区域限制为<1mm2~3平行板电容器(施加的外部电压)≤3重复混合w/注射泵,1小时1dynabead(~1um)捕获和磁沉积<1用涂布链亲和素的二氧化硅珠粒(~100nm)捕获并通过离心沉积<1通过蒸发溶剂来浓缩≤5乙醇沉淀+再悬浮在较小体积中~1含有peg/葡聚糖的atps~1含有peg3350、柠檬酸钠、nacl的atps>10含有peg3350、柠檬酸钠、nacl的atps+将捕获区域限制为<1mm2>60实施例11在本文中提供的技术的实施方案的开发过程中,进行试验以测试atps中的样品ph和柠檬酸盐ph对单分子测定的灵敏度的影响。改变包含dna分析物的pbs缓冲液的ph,并在simreps试验中分析效果。此外,改变peg/柠檬酸盐/naclatps中的柠檬酸盐的ph并测量效果。当样品的ph改变时(ph为8.74、8.54和7.92),可接受的计数随着ph从pbs的标准ph8.04降低而非常轻微地降低。atps的柠檬酸盐支配该atps的缓冲能力,由此pbs的ph变化对本文中描述的通过atps浓缩分析物而言可以忽略不计。为了改变atps组分的ph,使用柠檬酸盐/柠檬酸比率或添加hcl来降低atps的ph(测试了7.58、6.37和5.91的ph)。数据表明,降低atps柠檬酸盐缓冲液ph降低了接受的计数。因此,数据表明,添加到atps中的dna样品的ph似乎不会显著影响simreps计数。数据表明降低atps体系的ph似乎减少了该计数。实施例12在本文中提供的技术的实施方案的开发过程中,进行试验以设计和制造用于在表面14处电泳输送和浓缩分析物的样品池(参见例如图9)。样品池10包含内部腔室11和外部腔室12。该内部腔室11设计为容纳包含分析物的组合物(例如包含分析物的样品)13,以提供包含分析物的组合物13与表面的接触,并将分析物沉积在表面上。因此,内部腔室11包含接触表面14的开口15,包含该分析物的组合物通过该开口接触该表面14。在一些实施方案中,该内部腔室开口15具有小于大约10、9、8、7、6、5、4、3、2或1mm(例如小于10000、9500、9000、8500、8000、7500、7000、6500、6000、5500、5000、4500、4000、3500、3000、2500、2000、1500、1000、950、900、850、800、750、700、650、600、550、500、450、400、350、300、250、200、150或100µm)的宽度。因此,在一些实施方案中,包含分析物13的组合物在宽度小于大约10、9、8、7、6、5、4、3、2或1mm(例如小于10000、9500、9000、8500、8000、7500、7000、6500、6000、5500、5000、4500、4000、3500、3000、2500、2000、1500、1000、950、900、850、800、750、700、650、600、550、500、450、400、350、300、250、200、150或100µm)的面积上接触该表面14(例如在小于大约100mm2的面积上,例如小于100、95、90、85、80、75、70、65、60、55、50、45、40、35、30、25、20、18、16、14、12、10、9、8、7、6、5、4、3、2、1、0.8、0.7、0.6、0.5、0.4、0.3、0.2、0.1、0.08、0.06、0.05、0.02或0.01mm2)。.该外部腔室12容纳缓冲剂16(例如包含小电解质(例如离子(例如阳离子、阴离子)))并围绕内部腔室11。该外部腔室12包含基层17,所述基层17包含纳米孔、介孔、或微孔多孔材料,其允许小电解质(例如缓冲液组分(例如离子(例如阳离子、阴离子)))的自由流动,同时防止该分析物迁移离开该内部腔室11(参见例如图9)。在一些实施方案中,该纳米孔、介孔、或微孔多孔材料是聚合物(例如琼脂糖、聚丙烯酰胺等等)。在一些实施方案中,该内部腔室壁不接触表面14。在一些实施方案中,内部腔室壁与表面隔开大约10至100μm(例如10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100μm)的距离以便在内部腔室11与表面14之间提供间隙18(参见例如图9)。在一些实施方案中,该间隙18允许电流在内部腔室11和外部腔室12之间流动(参见例如图9)。在一些实施方案中,该表面14是玻璃显微镜盖玻片。在一些实施方案中,跨越内部腔室11和外部腔室12施加电压19以使带电荷的分析物(例如带负电荷的dna)向表面14迁移。虽然图9显示了放置在外部腔室的正端子和放置在内部腔室的负端子,该技术不限于这种布置,并包括其中正端子放置在内部腔室且负端子放置在外部腔室的实施方案。在一些实施方案中,外部腔室基层17(例如包含琼脂糖或聚丙烯酰胺基质)防止水性缓冲溶液在内部腔室11和外部腔室12之间流动,并最小化或消除分析物迁移离开内部腔室池的基层。任选地,在一些实施方案中,用合适的材料(例如分支聚合物(例如葡聚糖硫酸酯))封闭基层17(例如琼脂糖或聚丙烯酰胺)的孔隙以尽量减少或消除分析物迁移到外部腔室基层17中。在该技术的实施方案的开发过程中,使用荧光标记的dna来证实葡聚糖硫酸酯防止了dna迁移离开该内部腔室。在该技术的实施方案的开发过程中,使用三维打印技术来制造用于电泳递送和在表面处浓缩分析物的样品池(参见例如图10)。在该技术的实施方案的开发过程中,构建如本文中所述的样品池,并将其用于在表面处浓缩dna。进行试验以证明电泳用于在成像表面附近浓缩荧光标记的dna的用途。将荧光标记的dna溶液添加到电泳池的内部腔室中,并施加交变电压(在大约0和60-200v之间),振荡期为大约1分钟,以实现dna向表面迁移,并由此在该表面处浓缩该dna(参见例如图11a)。dna不可渗透的多孔材料(例如已经用葡聚糖硫酸酯预封闭的聚丙烯酰胺)防止dna迁移离开该孔。收集荧光显微镜法(全内反射荧光,tirf)数据,以量化在交变电压下在表面处的dna浓度(图11b)。如收集的数据所示,在电泳电压的存在下在本体溶液中在表面处的dna的时间平均浓度比不存在电泳电压的情况下的浓度高50倍至100倍。此外,在试验过程中收集的数据表明,用5-50mg/ml葡聚糖硫酸酯预封闭的32%聚丙烯酰胺基质足以防止短dna片段(例如大约30个碱基对)迁移离开该内部腔室。特别地,在用5mg/ml葡聚糖硫酸酯预封闭和不进行预封闭的情况下制备聚丙烯酰胺多孔基质。将可见染色的34-核苷酸的寡核苷酸用于试验以评估核酸通过多孔基底的电泳。电泳后拍摄包含葡聚糖硫酸酯和不含葡聚糖硫酸酯的多孔基层的照片。照片表明,在电泳后,34-核苷酸的寡核苷酸迁移离开内部腔室并进入多孔基层(32%聚丙烯酰胺),但是向多孔基层中的迁移被用5mg/ml葡聚糖硫酸酯封闭的聚丙烯酰胺抑制。在一些实施方案中,在将dna引入内部腔室之前,将葡聚糖硫酸酯从内部腔室电泳到聚丙烯酰胺中。虽然试验测试了用葡聚糖硫酸酯封闭的聚丙烯酰胺的用途,但该技术不限于这种特定材料。例如,也可以使用多孔二氧化硅、再生纤维素和其它基质,其孔隙尺寸小到足以排除该分析物,同时足够大和连续以允许电流流动。此外,实施方案包括用例如1、2、3、4、5、6、7、8、9、10、12、15、20、22、25、30、35、40、45或50mg/ml浓度的阻断剂(例如葡聚糖硫酸酯)进行预阻断。在一些实施方案中,使用交变电压导致分析物向表面迁移,并且电压的周期性降低使得该分析物在表面上自由扩散,以便在表面处进行有效和均匀的捕获。该技术提供高浓度倍数(例如相对于原始溶液在表面处至少50倍至100倍的浓度)。此外,该技术与多种分析物相容,包括蛋白质和核酸,只要它们能够在与其稳定性相容的ph下带电荷。该技术可用于在非常小的捕获区域(<1mm)上从非常大体积的溶液(例如几毫升)中浓缩分析物,而无需后续的溶液移液或操作。实施例13–测定核酸的atps分配系数在本文中描述的技术的实施方案的开发过程中,进行试验以确定28个核苷酸的单链dna分子(例如gtccaggaggcagctaatacttgttgcg;seqidno:1)在peg/柠檬酸钠/氯化钠双水相体系中的分配系数。由储备溶液制造peg/柠檬酸钠/氯化钠的atps,并将28个核苷酸的单链dna分子添加到该atps中。当核酸在两相之间平衡后,从每一相中取样。样品在变性聚丙烯酰胺凝胶上电泳,以表征dna向富含柠檬酸盐的下相和富含peg的上相的分配(图12a)。在负载在凝胶上之前,相对于富含peg的相将富含柠檬酸盐的相稀释500倍,以允许在单一仪器上同时量化两个泳道中的dna,而不使检测器饱和。用sybr金进行染色。通过对染色凝胶进行成像来量化凝胶上的带强度以确定分配系数(图12b)。对富含柠檬酸盐相的500倍稀释因子校正在每个相中量化的dna量。该dna寡核苷酸的表观分配系数确定为1590。接下来,在本文中提供的技术的实施方案的开发过程中进行试验,以测量在存在或不存在2.8%w/wnacl的情况下28个核苷酸的单链dna寡核苷酸(例如gtccaggaggcagctaatacttgttgcg;seqidno:1)在peg/柠檬酸钠atps中的分配。如以上试验中定量两相之间的分配,例如使用聚丙烯酰胺凝胶电泳,并随后进行sybr金染色和密度测定法来量化凝胶上的带。在负载在凝胶上之前,相对于富含peg的相将富含柠檬酸盐的相稀释500倍,以允许在单一仪器上同时定量两个泳道中的dna,而不使检测器饱和。在存在和不存在nacl的情况下,计算的分配系数分别为2030和249(图13)。误差条表示基于三次独立重复的+/-一个标准偏差。最后,在本文中提供的技术的实施方案的开发过程中,进行试验以测试核酸的atps富集的使用,以提供用于simreps测定的样品。特别地,从simreps测定收集数据以检测微小rnamir-16,其中预先使用和不使用peg/柠檬酸钠/naclatps来富集样品中的微小rna。使用该atps富集核酸时,simreps的灵敏度明显提高大约9倍(图14)。误差条表示来自两个独立重复的一个标准偏差。在上述说明书中提及的所有出版物和专利出于所有目的均经此引用全文并入本文。在不离开所述技术的范围和精神的情况下,该技术的所述组合物、方法和用途的各种修改和变化对本领域技术人员将显而易见。尽管已经结合具体的示例性实施方案描述了本技术,但是应当理解的是,所要求保护的本发明不应不适当地限于这些具体实施方案。实际上,对本领域技术人员显而易见的用于实施本发明的所述模式的各种修改均意在落入所附权利要求的范围。序列表<110>theregentsoftheuniversityofmichigan<120>分析物的浓缩<130>um-35600/wo-1/ord<150>us62/692,001<151>2018-06-29<150>us62/598,802<151>2017-12-14<160>1<170>patentinversion3.5<210>1<211>28<212>dna<213>人工序列<220><223>合成<400>1gtccaggaggcagctaatacttgttgcg28当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1