中间位使能T细胞的制作方法
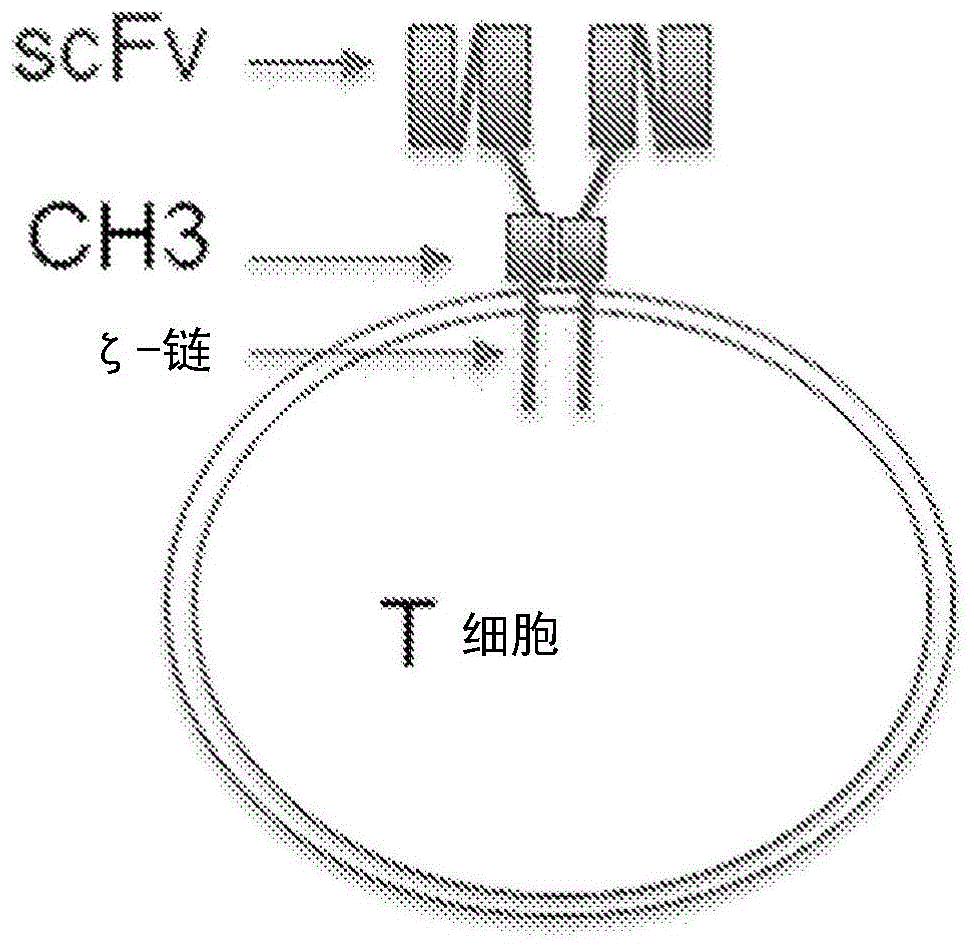
相关申请的交叉引用本申请要求2017年12月29日提交的美国临时申请号62/611,924和2018年6月4日提交的美国临时申请号62/680,442的优先权,所述申请通过引用全文纳入本文并用于所有目的。引用“序列表”,以ascii文件提交的表格或计算机程序列表附件以文件048440-621001wo_sequence_listing_st25形式写成的序列表通过引用纳入本文,其创建于2018年12月31日,29,672字节,ibm-pc机器格式,mswindows操作系统。技术实现要素:一方面,提供第一重组蛋白。第一重组蛋白包括:(i)第一非cdrfab结合肽结构域;(ii)第一胞内t细胞信号传导结构域;和(iii)第一跨膜结构域,连接第一非cdrfab结合肽结构域与第一胞内t细胞信号传导结构域。在实施方案中,所述第一重组蛋白包括第一间隔区,连接第一非cdrfab结合肽结构域与第一跨膜结构域。在实施方案中,所述第一间隔区是第一ch3区。一方面,提供编码本文所提供第一重组蛋白的分离核酸,包括其实施方案。一方面,提供含本文所提供的核酸的表达载体,包括其实施方案。在实施方案中,所述载体是慢病毒或致癌反转录病毒。一方面,提供含本文所提供的表达载体的t淋巴细胞,包括其实施方案。一方面,提供含本文所提供的第一重组蛋白的t淋巴细胞,包括其实施方案。一方面,提供含本文所提供的第一重组蛋白的t淋巴细胞,包括其实施方案,其中所述跨膜结构域在t淋巴细胞的细胞膜内。一方面,提供治疗癌的方法。所述方法包括向需要对象施用有效量的本文所提供t淋巴细胞,包括其实施方案,其中第一抗原结合域和第二抗原结合域是独立的抗癌症抗原结合域。一方面,提供重组蛋白。重组蛋白包括:(i)非cdrfab结合肽结构域;(ii)胞内t细胞信号传导结构域;和(iii)跨膜结构域,连接非cdrfab结合肽结构域与胞内t细胞信号传导结构域。一方面,提供编码本文所提供的重组蛋白的分离核酸,包括其实施方案。一方面,提供含本文所提供的核酸的表达载体,包括其实施方案。一方面,提供含本文所提供的表达载体的t淋巴细胞,包括其实施方案。一方面,提供含本文所提供的重组蛋白的t淋巴细胞,包括其实施方案。一方面,提供含本文所提供的重组蛋白的t淋巴细胞,包括其实施方案,其中所述跨膜结构域在t淋巴细胞的细胞膜内。一方面,提供治疗癌的方法。所述方法包括向需要对象施用有效量的本文所提供t淋巴细胞,包括其实施方案,以及能够结合非cdrfab结合肽结构域的抗原结合域,其中抗原结合域是癌症抗原结合域。附图简要说明图1a-1c.图1a)嵌合抗原受体(car)t细胞通常如下产生:融合抗原特异单链fab可变区(如mab的重和轻链可变结构域)与cd3δ链。如此,各cart细胞需要建立新基因以改变靶特异性。图1b)为移除此限制,申请人使用中间位技术以‘扣紧(snap)’抗体片段与工程t细胞。特定地,申请人用cqfd中间位取代scfv。图1c)动画演示用于单抗原特异cart细胞的当前技术以及中间位技术如何能用于创建通用car。图2a-2c.图2a)cho-s细胞无载体(模拟)转染,用亲代car(1)、中间位-ch3(3)或中间位-cd28(2)转染,用于测试以下的结合:缀合荧光染料alexafluor647的中间位使能(enabled)i83e曲妥单抗igg(647^183eigg)、缀合荧光染料alexafluor647的中间位使能i83e曲妥单抗fab(647^i83efab)以及缀合荧光染料alexafluor647的中间位使能i83e易普利姆玛igg(647^ipiigg)。活的转染细胞用fsc/ssc→pi-→cd19+门控来鉴定(见图3a)。就apc信号的平均荧光强度(mfi)分析细胞。图2b)用无载体(模拟),亲代car(1)或中间位-cd28(2)转染的细胞无法显示mfi移位,其用647^183eigg、647^i83efab或647^ipiigg染色。图2c)用中间位-ch3(3)转染的细胞在647^183eigg或647^i83efab染色时显示mfi明显位移,但647^ipiigg染色时仅极小位移。图3a-3b.流式细胞术分析的门控策略。图3a)细胞由fsc/ssc(左幅)、pi染色(指示活细胞;中幅)和cd19表达(转染标记;右幅)门控。图3b)进一步分析门控细胞测量了647(左幅)和vioblue(右幅)信号,分别指示抗体和her2结合。图4a-4c.中间位使能igg和fab结合中间位-ch3car。图4a)活的转染细胞用fsc/ssc→pi-→cd19+门控来鉴定。就apc信号的平均荧光强度(mfi)分析细胞。无染色的细胞用于对apc+细胞门控。用非中间位使能647^ipiigg染色的细胞显示apcmfi的位移极小。用中间位使能647^i83eigg和fab染色的细胞显示apcmfi明显位移,证明647缀合蛋白与中间位-ch3表达细胞结合。图4b)此趋势在中间位-cd28构建体内未发现。图4c)就647^igg或647^fab而言阳性的活cd19+细胞比例(门控细胞:fsc/ssc→pi-→cd19+→apc+;亲代群体的apc+细胞频率)。图5a-5b.中间位-ch3表达细胞结合中间位使能抗体,其能随后结合抗原。图5a)中间位-ch3car细胞上her2平均荧光强度(mfi)直方图,所述细胞是apc+(门控细胞:fsc/ssc→pi-→cd19+→apc+)。图5b)her2阳性的活cd19+647+细胞比例(祖代群体的her2+细胞频率,与上面相同的门控策略)。图6a-6c.鉴定647+her2+双阳性细胞。活的转染细胞用fsc/ssc→pi-→cd19+门控来鉴定(见图3a)。然后,分析细胞的647(x轴)和her2水平(vioblue)。值得注意的是,许多647-细胞在y轴上。图6a)分析用中间位使能647^i83efab染色的细胞。图6b)分析用中间位使能647^i83eigg染色的细胞。图6c)分析用非中间位使能647^ipiigg染色的细胞。图7.鉴定her2+细胞。活的转染细胞用fsc/ssc→pi-→cd19+门控来鉴定。用来自无pacblue^her2样品的分析绘制(drawn)下一个门以鉴定her2+细胞。随后分析细胞的her2(vioblue)水平。图8a-8b.中间位使能西妥昔单抗和曲妥单抗fab结合中间位-ch3car。图8a)647^fab阳性的活cd19+细胞比例(门控细胞:fsc/ssc→pi-→cd19+→apc+;亲代群体的apc+细胞频率)。图8b)转染有中间位-ch3的活细胞用fsc/ssc→pi-→cd19+门控来鉴定。就apc信号的平均荧光强度(mfi)分析细胞。无染色的细胞用于对apc+细胞门控。用非中间位使能647^ipifab染色的细胞显示apcmfi的位移最小。用中间位使能647^i83e西妥昔单抗(cetux)fab和647^i83e曲妥单抗(tras)fab染色的细胞显示apcmfi明显位移,证明647缀合蛋白与中间位-ch3表达细胞结合。图9a-9b.鉴定647+her2+双阳性细胞。活的转染细胞用fsc/ssc→pi-→cd19+门控来鉴定。然后,分析细胞的647(x轴)和her2水平(pacificblue)。图9a)分析用中间位使能647^i83e西妥昔单抗(cetux)fab染色的细胞。图9b)分析用中间位使能647^i83e曲妥单抗(tras)fab染色的细胞。图10.图显示卵巢癌细胞系中的肿瘤杀伤试验,采用不同浓度的中间位使能her2。图11.图显示乳腺癌细胞系中的肿瘤杀伤试验,采用不同浓度的中间位使能her2。图12.图显示fabrackt细胞。图13.图显示可切换fabcar-t细胞。图14.jurkat细胞用中间位-car转导且共表达截短的cd19作为标记物。转导后,挑出cd19阳性细胞并扩增用于下列实验。图15.表达中间位-car的jurkat细胞用曲妥单抗孵育,有或没有中间位位点,随后用抗-κ-647(abcam#202832)或抗-人-iggfc-488(赛默飞世尔(thermofisher)#h10120)二抗染色。结果显示在细胞通过流式细胞术分析后,仅memab曲妥单抗能结合表达中间位-car的jurkat细胞。图16.左:癌细胞、jurkat-nfat-luc中间位-car细胞和memab曲妥单抗在白壁96孔板中共孵育。图中的最高浓度是15nm,然后是4倍连续稀释。6小时孵育后,各孔中加入荧光素酶底物并立即用读板仪测量发光。memab曲妥单抗存在时,jurkat细胞活化以剂量依赖性增加,尽管在15nm开始(settingin)钩状效应。各细胞系的ec50是0.35nm(skov3)、0.83nm(skbr3)、0.42nm(mcf7)、0.27nm(ovcar3)和0.26nm(bt474)。jurkat细胞活化水平与癌细胞上的her2表达正相关,除了bt474细胞系。尽管bt474具有高her2表达,其不激活jurkat细胞到与其他高her2表达细胞(skov3和skbr3)相同的水平。右:5x105细胞用100nmmemab曲妥单抗处理30分钟,溶于含1%fbs的pbs。洗3次后,细胞用二抗-κ-647抗体标记30分钟。细胞的荧光团强度通过bdaccuric6流式细胞仪分析。红峰是用二抗-κ-647抗体单独处理的细胞。绿峰是用memab曲妥单抗和抗-κ-647二抗处理的细胞。流式细胞术用于分析her2表达水平,这是通过比较单独二抗染色或memab曲妥单抗与二抗染色的细胞。平均荧光强度(mfi)就mcf7细胞而言是338和985;就skbr3细胞而言是330和34405;就bt474细胞而言是392和31720;就skov3细胞而言是370和43191;就ovcar3细胞而言是307和1436。her2表达从高到低的细胞是skov3、skbr3、bt474、ovcar3和mcf7。图17.左:癌细胞、fabrackjurkat-nfat-luc细胞和西妥昔单抗在白壁96孔板中共孵育。图中的最高浓度是60nm,然后是4倍连续稀释。6小时孵育后,各孔中加入荧光素酶底物并立即用读板仪测量发光。各细胞系的ec50是0.14nm(skov3)、0.12nm(skbr3)、0.12nm(mcf7)、0.11nm(ovcar3)和1.1nm(bt474)。右:5x105细胞用100nm西妥昔单抗处理30分钟,溶于含1%fbs的pbs。洗3次后,细胞用抗-κ-647二抗标记30分钟。细胞的荧光团强度通过bdaccuric6流式细胞仪分析。红峰是用抗-κ-647二抗单独处理的细胞。绿峰是用西妥昔单抗和抗-κ-647二抗处理的细胞。平均荧光强度显示egfr表达从高到低的细胞是ovcar3(4819)、skov3(4479)、skbr3(2865)、bt474(651)和mcf7(480)。图18.图显示jurkat或癌细胞,用memab曲妥单抗预混并洗涤。jurkat或癌细胞用memab曲妥单抗预结合,然后洗涤。癌细胞(2.5x104/100ul)接种于96孔白壁板。细胞附着过夜后,移出板中的培养基并向各孔加入jurkat-nfat-luc中间位-car细胞(1x105/60ul)。memab曲妥单抗持续存在或预结合jurkat-nfat-lucmedi-car或癌细胞,洗涤。(图中的柱从左到右是:无处理;赫塞汀(4nm)持续存在;memab曲妥单抗(4nm)持续存在;fabrackjurkat-nfat-luc细胞,预结合memab曲妥单抗(100nm)然后洗涤;癌细胞,预结合memab曲妥单抗(100nm)然后洗涤。)细胞在37℃孵育6小时,然后向各孔加入50ul荧光素酶底物(英杰公司(invivogen)#rep-qlc2)。用伯腾(biotek)synergy4多功能微孔板检测仪立即测量发光。图19.图显示有memab预结合的t细胞(左)和有memab预结合的癌细胞(右)。图20.图显示赫塞汀阻断i83e介导的jurkat-nfat-luc活化。memab曲妥单抗和赫塞汀持续存在。癌细胞(2.5x104/100ul)接种于96孔白壁板。细胞附着过夜后,移出板中的培养基并向各孔加入jukat-nfat-lucme-car细胞(1x105/60ul)。memab曲妥单抗持续存在或预结合jurkat或癌细胞,洗涤。(图中的柱从左到右是:memab曲妥单抗(4nm)持续存在;memab曲妥单抗(4nm)和赫塞汀(40nm)持续存在;memab曲妥单抗(4nm)和赫塞汀(400nm)持续存在。)细胞在37℃孵育6小时,然后向各孔加入50ul荧光素酶底物(英杰公司#rep-qlc2)。用伯腾synergy4多功能微孔板检测仪立即测量发光。4nmmemab曲妥单抗持续存在时,jurkat-nfat-lucmedi-car细胞被激活,这归因于通过memab曲妥单抗结合癌细胞。赫塞汀在孵育期间持续存在能阻断jurkat细胞活化,因为赫塞汀具有与memab曲妥单抗相同的表位且能在her2上竞争同一结合位点。赫塞汀(400nm)是memab曲妥单抗(4nm)的100倍浓度,几乎完全阻断jurkat细胞活化,证明jurkat细胞活化通过memab曲妥单抗结合与赫塞汀所识别相同的表位而导致。图21.图显示在jurkat细胞与memab曲妥单抗预结合及洗涤后,赫塞汀阻断memab介导的jurkat-nfat-luc活化。memab曲妥单抗首先预结合jurkat细胞并洗涤。赫塞汀持续存在。癌细胞(2.5x104/100ul)接种于96孔白壁板。细胞附着过夜后,移出板中的培养基并向各孔加入jukat-nfat-lucme-car细胞(1x105/60ul)。memab曲妥单抗持续存在或预结合jurkat-nfat-lucmedi-car细胞,洗涤。(图中的柱从左到右是:memab曲妥单抗(4nm)持续存在;jurkat-nfat-lucmedi-car细胞,预结合memab曲妥单抗(100nm)然后洗涤;jurkat-nfat-lucmedi-car细胞,预结合memab曲妥单抗(100nm)然后洗涤+赫塞汀(40nm)持续存在;jurkat-nfat-lucmedi-car细胞,预结合memab曲妥单抗(100nm)然后洗涤+赫塞汀(400nm)持续存在。)细胞在37℃孵育6小时,然后向各孔加入50ul荧光素酶底物(英杰公司#rep-qlc2)。用伯腾synergy4多功能微孔板检测仪立即测量发光。当与高her2表达细胞(skbr3、bt474和skov3)共孵育时,预结合memab曲妥单抗然后洗涤的jurkat-nfat-lucmedi-car细胞的发光活性相较memab持续存在的细胞显著下降,但在低her2表达细胞(mcf7和ovcar3)不是。赫塞汀在孵育期间持续存在能阻断jurkat细胞活化。各jurkat细胞上的medi-car数目或各癌细胞上的靶分子数目可确定各t细胞中显示多少活化或有多少t细胞被激活。图22.图显示在癌细胞与memab预结合及洗涤后,赫塞汀几乎不阻断memab曲妥单抗介导的jurkat-nfat-luc活化。memab曲妥单抗首先预结合癌细胞并洗涤。赫塞汀持续存在。预结合memab曲妥单抗然后洗涤的癌细胞的发光活性相较memab持续存在的细胞未大幅下降。赫塞汀在孵育期间持续存在对jurkat细胞活化没有或有一些阻断效应。此数据证明一旦memab曲妥单抗结合癌细胞上的her2,其难以竞争无中间位结合位点的曲妥单抗。癌细胞(2.5x104/100ul)接种于96孔白壁板。细胞附着过夜后,移出板中的培养基并向各孔加入jukat-nfat-lucme-car细胞(1x105)。memab曲妥单抗持续存在或预结合癌细胞,洗涤。(图中的柱从左到右是:memab曲妥单抗(4nm)持续存在;癌细胞,预结合memab曲妥单抗(100nm)然后洗涤;癌细胞,预结合memab曲妥单抗(100nm)然后洗涤+赫塞汀(40nm)持续存在;癌细胞,预结合memab曲妥单抗(100nm)然后洗涤+赫塞汀(400nm)持续存在。)细胞在37℃孵育6小时,然后向各孔加入50ul荧光素酶底物(英杰公司#rep-qlc2)。用伯腾synergy4多功能微孔板检测仪立即测量发光。图23.图显示t细胞可杀伤预结合memab曲妥单抗及洗涤的癌细胞。活力(%)=[luc(癌细胞+t细胞+抗体)–luc(t细胞+抗体)]/[luc(癌细胞+t模拟细胞)–luc(t模拟细胞)]。0.1nm或0.5nmmem抗体持续存在时,与fabrackt细胞共孵育的癌细胞活力与模拟t细胞共孵育相比下降。乳腺癌细胞中的细胞活力在0.1和0.5nm剂量依赖性下降,而卵巢癌细胞在这2个浓度显示类似活力。预结合抗体及冲洗的癌细胞仍能被人fabrackt细胞杀伤,尽管活力相较持续抗体处理的癌细胞减少5-18%。对于肿瘤杀伤试验,有或没有抗体时,癌细胞(2.5x104/100ul)和人t细胞(6,250/100ul)接种于96孔圆底板。72小时孵育后,细胞在250xg离心5分钟,移出各孔中的100ul培养基。为测试细胞活力,向各孔加入来自普洛麦格(promega)celltiter试剂盒的100ul试剂。2分钟孵育后,将100ul混合物移入白壁96孔板并用伯腾synergy4多功能微孔板检测仪测量。图24.图显示fabrackt细胞在较低剂量的memab曲妥单抗有效杀伤癌细胞。癌细胞在memab曲妥单抗存在下与模拟t细胞或fabrackt细胞孵育3天。此数据显示fabrackt细胞有效杀伤her2阳性癌细胞,因为其通过memab曲妥单抗结合癌细胞。与memab曲妥单抗和fabrackt细胞共孵育的癌细胞ic50是0.33nm(bt474)、0.11nm(skbr3)、0.069nm(mcf7)、0.046nm(skov3)和0.027nm(ovcar3)。杀伤效果与癌细胞的her2表达水平不相关。对于肿瘤杀伤试验,有或没有抗体时,癌细胞(2.5x104/100ul)和人t细胞(6,250/100ul)接种于96孔圆底板。72小时孵育后,细胞在250xg离心5分钟,移出各孔中的100ul培养基。为测试细胞活力,向各孔加入来自普洛麦格celltiter试剂盒的100ul试剂。2分钟孵育后,将100ul混合物移入白壁96孔板并用伯腾synergy4多功能微孔板检测仪测量。图25.图显示中间位-car相较scfvcar和fabcart细胞(表达本文所提供重组蛋白的t细胞,包括其实施方案)的肿瘤杀伤。图26.图显示卵巢癌的肿瘤杀伤试验(facs)。流式细胞术用于分析在癌细胞与fabrackt细胞和memab曲妥单抗共孵育后,相较癌细胞与her2scfvcar或her2fabcart细胞孵育作为正对照,有多少癌细胞仍活着。孵育3天后,与fabrackt细胞和memab曲妥单抗共孵育时,活的癌细胞大幅减少。fabrackt细胞的杀伤效果与her2scfvcar或her2fabcart细胞类似或甚至更优。图27.图显示乳腺癌的肿瘤杀伤试验(facs)。流式细胞术用于分析在癌细胞与fabrackt细胞和memab曲妥单抗共孵育后,相较癌细胞与her2scfvcar或her2fabcart细胞孵育作为正对照,有多少癌细胞仍活着。孵育3天后,与fabrackt细胞和memab曲妥单抗共孵育时,活的癌细胞大幅减少。fabrackt细胞的杀伤效果与her2scfvcar或her2fabcart细胞类似或甚至更优。图28.图显示t细胞中cd107a和ifn-g表达的直方图。流式细胞术显示约40%的人t细胞用中间位-car成功转导。当癌细胞与memab曲妥单抗一起孵育、预混合及洗涤或持续存在memab曲妥单抗时,fabrackt细胞增加cd107a和ifnγ表达。为分析cd107a和ifnγ表达,癌细胞(5x104/100ul)接种于96孔圆底板,向存在癌细胞的各孔加入人t模拟或fabrack细胞(5x104/100ul)。效应物与靶标之比是1:1。在孵育期间向各孔加入cd107a-fitc(bd#555800)抗体和转运抑制剂golgistop(bd#554724)。5小时孵育后,细胞用可固定的活力染料(赛默飞世尔科技(thermofisherscientific)#l34965)在4℃避光染色30分钟。洗2次后,细胞用cd4-percp(bd#347324)、cd8-apccy7(bd#348793)和cd19-pecy7(bd#557835)在4℃避光染色30分钟。洗2次后,细胞通过bdcytofix/cytoperm试剂盒(bd554714)固定和透化,然后通过ifn-apc(bd#554702)室温避光胞内染色ifn30分钟。洗2次后,细胞以100ul终体积重悬并通过流式细胞仪分析40ul样品。图29.图显示cd107a和ifn-γ。图30.图显示i83e曲妥单抗不能激活无靶细胞的fabrackt细胞。可用于测试的活化标记:上调cd69(短暂)、cd137(4-1bb)、cd44、cd27、cd45ro、cd154;下调cd62l、ccr7(cd197)(cd25、cd69、cd137(4-1bb)、klrg、cd62l、cd45ro、cd27、cd28)。fabrackt细胞与0.5nmmemab曲妥单抗孵育5小时时,不显示增加cd107a和ifnγ表达。图31.产生4个构建体。顶部2张图表包括待用作转化细胞标记物的截短cd19基因。这两者的差异在于共刺激信号c28或41bb。底部2张图表同样减去cd19读出标记物。图32.在分选前后,jurkat-nfat-luc细胞中截短cd19(cd19t)表达的直方图。细胞用cd19-pe-cy7染色,且cd19t阳性通过bdariasorp流式细胞仪挑出。转化细胞的均质群体通过细胞分选用截短cd19标记物来分离。图33a-33c.应急返回(takehome):图33a)中间位使能igg仅结合4个变体之一(有或没有cd19t以及cd28或41bb共刺激信号)。图33b)非转化jurkat细胞不结合igg。图33c)同样,亲代抗体(例如非中间位使能)不结合fabrackjurkat细胞。换言之,不同的memab能组合不同的fabrack变体。图34.乳腺(mcf7、skbr3和bt474)或卵巢(skov3和ovcar3)癌细胞系显示memab结合her2或egfr。有或没有memab结合的细胞平均荧光强度(mfi)示于各图。her2、egfr和cd20抗原密度用分析型细胞计数在一系列细胞系中独立定量,该方法随后用于广泛检测转换抗原特异性的能力和fabrack功效。图35.乳腺或卵巢癌细胞(2.5e4)接种于96孔白壁板。细胞附着过夜后,移出板中的培养基并向各孔加入jukat-nfat-lucfabrack细胞(cd28形式,1e5),有不同剂量的memab(抗her2或抗egfr)。细胞在37℃孵育6小时,然后向各孔加入荧光素酶底物(英杰公司#rep-qlc2)。用伯腾synergy4多功能微孔板检测仪立即测量发光。所有细胞的‘ec50’低于1nm,然而,稳定水平差异很大。增加与抗原表达相关联,除了bt474细胞。此例外需要进一步研究(her3或其他分子干扰?)。右幅的egfr也观察到类似趋势。采用西妥昔单抗,bt474的mfi是651;mcf7是480;ovcar3是4819;skbr3是2865;且skov3是4479。尽管bt474表达的egfr略多于mcf7,稳定水平的趋势往往遵循抗原密度。bt474细胞系的一些性质可参见网页ncbi.nlm.nih.gov/pmc/articles/pmc3236329/。图36.表达cd19的癌细胞(5e4)接种于96孔白壁板并与jukat-nfat-lucfabrack细胞(41bb或cd28形式,1e5)共培养,有不同剂量的cd19memab。细胞在37℃孵育6小时,然后向各孔加入荧光素酶底物(英杰公司#rep-qlc2)。用伯腾synergy4多功能微孔板检测仪立即测量发光。左幅显示能靶向不同cd19表达细胞。稳定水平随着抗原密度而变化。raji的mfi是21566;daudi是12263;sup-b15是12617。右幅表明cd28活化信号强于41bb。图37.在memab和靶细胞存在下激活fabrackjurkat细胞。不同剂量fab的memab曲妥单抗igg存在于含fabrackjurkat细胞的孔并靶向细胞6小时。孵育结束时,向各孔加入荧光素酶底物,通过读板仪立即读取发光。乳腺或卵巢癌细胞(2.5e4)接种于96孔白壁板。细胞附着过夜后,移出板中的培养基并向各孔加入jukat-nfat-lucfabrack细胞(cd28形式,1e5),有不同剂量的memab曲妥单抗或非memab帕妥珠单抗。细胞在37℃孵育6小时,然后向各孔加入荧光素酶底物(英杰公司#rep-qlc2)。用伯腾synergy4多功能微孔板检测仪立即测量发光。根据我们的facs数据,mcf7表达最低量的her2(mfi=985)。ovcar3表达略多(mfi=1435)。skbr3(mfi=34405)和skov3(mfi=43191)表达大于mcf7和ovcar3。也结合her2的帕妥珠单抗不是中间位使能,但确实包含fc。这不指示需要中间位使能fab/mab(如所预测)。采用igg形式时,钩状效应在所有细胞系中有活性。此效应对抗原密度‘较低’的细胞在早期设定(‘拟合’峰就mcf7和ovcar3而言小于10nm,就skbr3和skov3而言大于10nm)。该发现与细胞衍生抗原在较低浓度饱和一致。化合价具有强烈影响(例如,相较fab{单价},钩状效应在用igg{二价}时于较低浓度设定)。有趣的是,‘稳定水平’在用fab时高许多。我们发现的差异表明能调整memab性质以优化效果。这还表明能使用钩状效应作为安全机制。应注意,图8和图9中,钩状效应不明显。这部分归因于这些研究中使用较低范围的浓度(抗体浓度仅达到10nm,在此达1um)。关于钩状效应的信息可参见网页en.wikipedia.org/wiki/hook_effect。图38.在4nmmemab曲妥单抗存在下激活与癌细胞共培养的fabrackjurkat细胞,memab曲妥单抗预结合靶细胞或memab曲妥单抗预结合fabrackjurkat细胞。癌细胞或fabrackjurkat细胞与100nmmemab曲妥单抗预结合,然后冲洗。用4nm赫塞汀处理的fabrackjurkat细胞活化水平与无处理的水平类似。方法:癌细胞(2.5x104/100ul)接种于96孔白壁板。细胞附着过夜后,移出板中的培养基并向各孔加入jurkat-nfat-luc中间位-car细胞(1x105/60ul)。memab曲妥单抗持续存在或者预结合jurkat-nfat-lucmedi-car或癌细胞,洗涤。图中的柱从左到右代表:memab曲妥单抗(4nm)持续存在、fabrackjurkat-nfat-luc细胞,预结合memab曲妥单抗(100nm)然后洗涤、癌细胞,预结合memab曲妥单抗(100nm)然后洗涤、赫塞汀(4nm)持续存在、且无处理。细胞在37℃孵育6小时,然后向各孔加入50ul荧光素酶底物(英杰公司#rep-qlc2)。用伯腾synergy4多功能微孔板检测仪立即测量发光。所有情况中,向混合jurkat-nfat-luc即‘中间位car’的肿瘤细胞加入4nmmemab曲妥单抗可生成最大信号。另2个样品预孵育,洗涤,随后加入第三组分。一种情况中,向肿瘤细胞加入memab曲妥单抗,洗涤,随后暴露于jurkat-nfat-luc即‘中间位car’。另一种情况中,向jurkat-nfat-luc即‘中间位car’加入memab曲妥单抗,洗涤,随后加入肿瘤细胞。对于抗原表达高的细胞,肿瘤细胞预处理导致活化更高。对于抗原表达低的细胞(mcf7和ovcar3),用jurkat-nfat-luc即‘中间位car’预孵育使得活化水平更高。重要的是应注意,‘洗涤’细胞后的memab浓度未知,但必定小于4nm。此不同处理可能引起4nm处理中的较高信号。图39.赫塞汀阻断fabrackjurkat细胞活化,所述细胞与癌细胞和4nmmemab曲妥单抗共孵育。赫塞汀和memab曲妥单抗在整个处理阶段中持续存在。方法:癌细胞(2.5x104/100ul)接种于96孔白壁板。细胞附着过夜后,移出板中的培养基并向各孔加入jukat-nfat-lucme-car细胞(1x105/60ul)。图中的柱从左到右代表:memab曲妥单抗(4nm)持续存在、memab曲妥单抗(4nm)和赫塞汀(40nm)持续存在、以及memab曲妥单抗(4nm)和赫塞汀(400nm)持续存在。细胞在37℃孵育6小时,然后向各孔加入50ul荧光素酶底物(英杰公司#rep-qlc2)。用伯腾synergy4多功能微孔板检测仪立即测量发光。结果:持续存在4nmmemab曲妥单抗时,jurkat-nfat-lucmedi-car细胞由于通过memab曲妥单抗结合癌细胞而活化。孵育期间持续存在赫塞汀能阻断jurkat细胞活化,因为赫塞汀具有与memab曲妥单抗相同的表位且能在her2上竞争同一结合位点。赫塞汀(400nm)是memab曲妥单抗(4nm)的100倍浓度,几乎完全阻断jurkat细胞活化,证明jurkat细胞活化通过memab曲妥单抗结合与赫塞汀所识别相同的表位而导致。fabrackt细胞活化需要中间位相互作用,提供关于所建议作用机制的进一步证据。图40.赫塞汀预结合癌细胞可阻断fabrackjurkat细胞活化,所述细胞与癌细胞和4nmmemab曲妥单抗共孵育。癌细胞与40nm或400nm赫塞汀预结合,然后冲洗。赫塞汀与memab曲妥单抗之间的唯一区别在于后者是中间位使能。通过用赫塞汀预处理细胞,抗原入口被阻断。在memab曲妥单抗/fabrackjurkat处理前洗涤经赫塞汀处理细胞可移除未结合的赫塞汀。然而,结合的赫塞汀会随着时间与细胞分离。因此,此实验中的活化降低不剧烈(相较图41)。图41.赫塞汀略微阻断fabrackjurkat细胞活化,所述细胞与预结合memab的癌细胞共培养。癌细胞与100nmmemab曲妥单抗预结合,然后冲洗。癌细胞与memab曲妥单抗预结合然后冲洗,不会大幅降低发光活性。赫塞汀在孵育期间持续存在对jurkat细胞活化的阻断影响小。此数据证明一旦memab曲妥单抗结合癌细胞上的her2,结合,所述结合被临床曲妥单抗略微阻断。方法:癌细胞(2.5x104/100ul)接种于96孔白壁板。细胞附着过夜后,移出板中的培养基并向各孔加入jukat-nfat-lucme-car细胞(1x105)。memab曲妥单抗持续存在或预结合癌细胞,洗涤。(图中的柱从左到右代表:memab曲妥单抗(4nm)持续存在;癌细胞,预结合memab曲妥单抗(100nm),然后洗涤;癌细胞,预结合memab曲妥单抗(100nm),然后洗涤+赫塞汀(40nm)持续存在;癌细胞,预结合memab曲妥单抗(100nm),然后洗涤+赫塞汀(400nm)持续存在。)细胞在37℃孵育6小时,然后向各孔加入50ul荧光素酶底物(英杰公司#rep-qlc2)。用伯腾synergy4多功能微孔板检测仪立即测量发光。一旦memab曲妥单抗结合细胞,其阻断赫塞汀结合细胞衍生抗原。图42.fabrackt细胞的活化标记物和细胞因子的表达。fabrackt细胞与卵巢癌细胞skov3和ovcar3或乳腺癌细胞skbr3、bt474和mcf7共培养5小时,存在0.5nmmemab曲妥单抗。效应物与靶标之比是1:1。her2scfv和fabcar用作阳性对照。5小时孵育后,活化标记物通过流式细胞术分析。多个对照用于这些实验。这里所用scfvcar和fabcar的cdr环与用于fabrack的memab相同。模拟物是非转化t细胞。细胞计数用于测量cd69和cd25的水平,其是t细胞活化标记物。没有肿瘤细胞时未观察到任何变体激活。同样,就fabrackt细胞(无memab)、模拟或模拟和i83ememab曲妥单抗观察到很少或没有激活,存在携带抗原的肿瘤细胞。最后,就fabrackt细胞+i83ememab曲妥单抗和scfvcart细胞观察到显著t细胞活化增加。fab-cart细胞也活化,但显示更高可变性。图43.fabrackt细胞与卵巢癌细胞skov3和ovcar3或乳腺癌细胞skbr3、bt474和mcf7共培养5小时,存在0.5nmmemab曲妥单抗。效应物与靶标之比是1:1。her2scfvcar用作正对照。5小时孵育后,脱粒标记物cd107a和ifnγ通过流式细胞术分析。fabt细胞具有与传统cart细胞相似的行为方式。图44.癌细胞与模拟t细胞或fabrackt细胞孵育3天,存在不同剂量的memab曲妥单抗。效应物与靶标之比是1:4。孵育结束时,细胞活力根据普洛麦格celltiter试剂盒说明测量。结果:癌细胞在memab曲妥单抗存在下与模拟t细胞或fabrackt细胞孵育3天。此数据显示fabrackt细胞有效杀伤her2阳性癌细胞,因为其通过memab曲妥单抗结合癌细胞。与memab曲妥单抗和fabrackt细胞共孵育的癌细胞ic50是0.33nm(bt474)、0.11nm(skbr3)、0.069nm(mcf7)、0.046nm(skov3)和0.027nm(ovcar3)。杀伤效果与癌细胞的her2表达水平不相关。方法:对于肿瘤杀伤试验,有或没有抗体时,癌细胞(2.5x104/100ul)和人t细胞(6,250/100ul)接种于96孔圆底板。72小时孵育后,细胞在250xg离心5分钟,移出各孔中的100ul培养基。为测试细胞活力,向各孔加入来自普洛麦格celltiter试剂盒的100ul试剂。2分钟孵育后,将100ul混合物移入白壁96孔板并用伯腾synergy4多功能微孔板检测仪测量。图45.与memab曲妥单抗和fabrackt细胞共孵育的癌细胞ic50是0.33nm(bt474)、0.11nm(skbr3)、0.069nm(mcf7)、0.046nm(skov3)和0.027nm(ovcar3)。图46.结果:在0.1nm或0.5nmmemab抗体持续存在情况下,与fabrackt细胞共孵育的癌细胞活力(中间柱)相较模拟t细胞共孵育(左柱)下降。乳腺癌细胞中的细胞活力在0.1和0.5nm剂量依赖性下降,而卵巢癌细胞在这2个浓度显示相似活力。预结合抗体并冲洗(右柱)的癌细胞仍能由人fabrackt细胞杀伤,尽管活力相较持续抗体处理的癌细胞减少5-18%。方法:对于肿瘤杀伤试验,有或没有memab抗体时,癌细胞(2.5x104/100ul)和人t细胞(6,250/100ul)接种于96孔圆底板。72小时孵育后,细胞在250xg离心5分钟,移出各孔中的100ul培养基。为测试细胞活力,向各孔加入来自普洛麦格celltiter试剂盒的100ul试剂。2分钟孵育后,将100ul混合物移入白壁96孔板并用伯腾synergy4多功能微孔板检测仪测量。图47.流式细胞术用于分析dapi染色后的癌细胞存活。her2scfvcar和her2fabcar用作正对照。结果:流式细胞术用于分析在癌细胞与fabrackt细胞和memab曲妥单抗共孵育后,相较癌细胞与her2scfvcar或her2fabcart细胞孵育作为正对照,有多少癌细胞仍活着。孵育3天后,与fabrackt细胞和memab曲妥单抗共孵育时,活的癌细胞大幅减少。fabrackt细胞的杀伤效果与her2scfvcar或her2fabcart细胞类似或甚至更优。采用替代性方法读出细胞活力可产生相似结果。图48.流式细胞术用于分析dapi染色后的癌细胞存活。her2scfvcar和her2fabcar用作正对照。结果:流式细胞术用于分析在癌细胞与fabrackt细胞和memab曲妥单抗共孵育后,相较癌细胞与her2scfvcar或her2fabcart细胞孵育作为正对照,有多少癌细胞仍活着。孵育3天后,与fabrackt细胞和memab曲妥单抗共孵育时,活的癌细胞大幅减少。fabrackt细胞的杀伤效果与her2scfvcar或her2fabcart细胞类似或甚至更优。图49.与靶细胞和不同浓度memab曲妥单抗共培养的t细胞数目倍数变化。孵育期间效应物与靶细胞之比是1:4。这些实验表明t细胞活化引起的细胞增殖取决于memab的存在。图50.乳腺癌细胞(2.5x104)接种于96孔白壁板。细胞附着过夜后,移出板中的培养基并向各孔加入jukat-nfat-lucfabrack细胞(41bb形式,1x105),有不同剂量的2n1memab。细胞在37℃孵育6小时,然后向各孔加入荧光素酶底物。用伯腾synergy4多功能微孔板检测仪立即读取发光。发明详述定义尽管本发明的多个实施方案和方面如本文所示和描述,本领域技术人员清楚了解这类实施方案和方面仅通过举例方式提供。多种变化、改变和取代现在可以被本领域技术人员想到,而不偏离本发明。应理解本文所述发明实施方案的多种替代方案可用于实施本发明。本文所用的栏目标题仅用于组织目的,而不视作限制所述主题。本申请引用的所有文献或文献部分明确通过引用全文纳入本文以用于任何目的,包括但不限于专利、专利申请、文章、书、手册和论文。本文所用的缩写具有其在化学和生物领域内的常规意义。本文所示化学结构和化学式根据化学领域已知的化学价标准规则构建。取代基由其从左到右写的常规化学式指定,其同样涵盖化学性质相同的取代基,这通过从右到左写结构获得,例如-ch2o-等同于-och2-。除非另有说明,术语“烃基(alkyl)”其本身或作为另一取代基的一部分,指直链(即未分支)或分支非环碳链(或碳)或其组合,其可以完全饱和、单不饱和或多不饱和并且能包括二价和多价基团,具有指定碳原子数(即c1-c10指1-10个碳)。饱和烃基示例包括但不限于基团如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、异丁基、仲丁基、(环己基)甲基,例如正戊基、正己基、正庚基、正辛基的同系物和异构体等。不饱和烃基具有一个或多个双键或三键。不饱和烃基示例包括但不限于乙烯基、2-丙烯基、巴豆基、2-异戊烯基、2-(丁间二烯基)、2,4-戊二烯基、3-(1,4-戊二烯基)、乙炔基、1-和3-丙炔基、3-丁炔基以及其同系物和异构体。烷氧基的烃基经氧街头(-o-)附于分子剩余部分。烃基部分可以是烯基部分。烃基部分可以是炔基部分。烃基部分可以完全饱和。除非另有说明,术语“亚烃基(alkylene)”其本身或作为另一取代基的一部分,指衍生自烃基的二价基团,例如但不限于-ch2ch2ch2ch2-。通常,烃基(或亚烃基)具有1-24个碳原子,本发明中这些基团优选具有10个或更少碳原子。“低级烃基”或“低级亚烃基”是短链烃基或亚烃基,一般具有8个或更少碳原子。除非另有说明,术语“亚烯基”其本身或作为另一取代基的一部分,指衍生自烯烃的二价基团。除非另有说明,术语“杂烃基(heteroalkyl)”其本身或联合另一术语,指稳定的非环直链或支链或其组合,包括至少一个碳原子和至少一个杂原子(如o、n、p、si或s)且其中氮和硫原子可以任选地氧化,氮杂原子可以任选地季胺化。杂原子o、n、p、s和si可在杂烃基任何内部位置或烃基附于分子剩余部分的位置处取代。示例包括但不限于:-ch2-ch2-o-ch3、-ch2-ch2-nh-ch3、-ch2-ch2-n(ch3)-ch3、-ch2-s-ch2-ch3、-ch2-ch2、-s(o)-ch3、-ch2-ch2-s(o)2-ch3、-ch=ch-o-ch3、-si(ch3)3、-ch2-ch=n-och3、-ch=ch-n(ch3)-ch3、-o-ch3、-o-ch2-ch3和-cn。多至2或3个杂原子可以是连续的,例如-ch2-nh-och3和–ch2-o-si(ch3)3。杂烃基部分可包括1个杂原子(如o、n、s、si或p)。杂烃基部分可包括2个任选地不同的杂原子(如o、n、s、si或p)。杂烃基部分可包括3个任选地不同的杂原子(如o、n、s、si或p)。杂烃基部分可包括4个任选地不同的杂原子(如o、n、s、si或p)。杂烃基部分可包括5个任选地不同的杂原子(如o、n、s、si或p)。杂烃基部分可包括多至8个任选地不同的杂原子(如o、n、s、si或p)。类似地,除非另有说明,术语“杂亚烃基(heteroalkylene)”其本身或作为另一取代基的一部分,指衍生自杂烃基的二价基团,例如但不限于-ch2-ch2-s-ch2-ch2-和-ch2-s-ch2-ch2-nh-ch2-。对于杂亚烃基,杂原子还能占据任一或两个链末端(如亚烷氧基、亚烷二氧基、亚烷氨基、亚烷二氨基等)。更进一步,对于亚烃基和杂亚烃基连接基团,通过连接基团分子式所写的方向没有暗示连接基团的定向。例如,分子式-c(o)2r'-代表-c(o)2r'-和-r'c(o)2-。如上所述,本文所用的杂烃基包括经杂原子附于分子剩余部分的基团,如-c(o)r'、-c(o)nr'、-nr'r”、-or'、-sr'和/或-so2r'。引用“杂烃基”然后列举特定杂烃基如-nr'r”等时,应理解术语杂烃基和-nr'r”不是余或互斥的。相反,列举特定杂烃基以更加清晰。因此,术语“杂烃基”在本文不应解释为排除特定杂烃基如-nr'r”等。除非另有说明,术语“环烃基(cycloalkyl)”和“杂环烃基(heterocycloalkyl)”其本身或联合其他术语,分别指“烃基”和“杂烃基”的非芳香的环状形式,其中构成一个或多个环的碳不必定需要结合氢,因为碳的化合价参与带非氢原子的键。另外,对于杂环烃基,杂原子能占据杂环附于分子剩余部分的位置。环烃基示例包括但不限于环丙基、环丁基、环戊基、环己基、1-环己烯基、3-环己烯基、环庚基、3-羟基-环丁-3-烯-1,2,二酮、1h-1,2,4-三唑-5(4h)-酮、4h-1,2,4-三基等。杂环烃基示例包括但不限于1-(1,2,5,6-四氢吡啶)、1-哌啶基、2-哌啶基、3-哌啶基、4-吗啉基、3-吗啉基、四氢呋喃-2-基、四氢呋喃-3-基、四氢噻吩-2-基、四氢噻吩-3-基、1-哌嗪基、2-哌嗪基等。“亚环烃基”和“杂亚环烃基”单独或作为另一取代基的一部分,指分别衍生自环烃基和杂环烃基的二价基团。杂环烃基部分可包括一个环杂原子(如o、n、s、si或p)。杂环烃基部分可包括2个任选地不同的环杂原子(如o、n、s、si或p)。杂环烃基部分可包括3个任选地不同的环杂原子(如o、n、s、si或p)。杂环烃基部分可包括4个任选地不同的环杂原子(如o、n、s、si或p)。杂环烃基部分可包括5个任选地不同的环杂原子(如o、n、s、si或p)。杂环烃基部分可包括多至8个任选地不同的环杂原子(如o、n、s、si或p)。除非另有说明,术语“卤代”和“卤素”其本身或作为另一取代基的一部分,指氟、氯、溴或碘原子。另外,术语如“卤代烃基(haloalkyl)”意在包括单卤代烃基和多卤代烃基。例如,术语“卤代(c1-c4)烃基”包括但不限于氟甲基、二氟甲基、三氟甲基、2,2,2-三氟乙基、4-氯丁基、3-溴丙基等。除非另有说明,术语“酰基”指-c(o)r,其中r是取代或未取代的烃基、取代或未取代的环烃基、取代或未取代的杂烃基、取代或未取代的杂环烃基、取代或未取代的芳基或者取代或未取代的杂芳基。除非另有说明,术语“芳基”指多不饱和芳族烃取代基,其可以是单环或多环(优选1-3个环),稠合在一起(即稠环芳基)或共价连接。稠环芳基指稠合在一起的多个环,其中至少一个稠环是芳环。术语“杂芳基”指芳基(或环)包含至少一个杂原子如n、o或s,其中氮和硫原子可选氧化,氮原子可选季胺化。因此,术语“杂芳基”包括稠环杂芳基(即多个环稠合在一起,其中至少一个稠环是杂芳环)。5,6-稠环杂亚芳基指2个环稠合在一起,其中一个环有5元(member)且另一环有6元,且其中至少一个环是杂芳环。同样,6,6-稠环杂亚芳基指2个环稠合在一起,其中一个环有6元且另一环有6元,且其中至少一个环是杂芳环。6,5-稠环杂亚芳基指2个环稠合在一起,其中一个环有6元且另一环有5元,且其中至少一个环是杂芳环。杂芳基能经碳或杂原子附于分子剩余部分。芳基和杂芳基的非限制性示例包括苯基、1-萘基、2-萘基、4-联苯、1-吡咯基、2-吡咯基、3-吡咯基、3-吡唑基、2-咪唑基、4-咪唑基、吡嗪基、2-恶唑基、4-恶唑基、2-苯基-4-恶唑基、5-恶唑基、3-异恶唑基、4-异恶唑基、5-异恶唑基、2-噻唑基、4-噻唑基、5-噻唑基、2-呋喃基、3-呋喃基、2-噻吩基、3-噻吩基、2-吡啶基、3-吡啶基、4-吡啶基、2-嘧啶基、4-嘧啶基、5-苯并噻唑基、嘌呤基、2-苯并咪唑基、5-吲哚基、1-异喹啉基、5-异喹啉基、2-喹喔啉基、5-喹喔啉基、3-喹啉基和6-喹啉基。各上述芳基和杂芳基环系的取代基选自下述可接受取代基。“亚芳基”和“杂亚芳基”单独或作为另一取代基的一部分,分别指衍生自芳基和杂芳基的二价基团。芳基和杂芳基的非限制性示例包括吡啶基、嘧啶基、苯硫基、噻吩基、呋喃基、吲哚基、苯并二唑、苯并二氧戊环、苯并二恶烷、苯并噻吩基、吡咯并吡啶基、吲唑基、喹啉基、喹喔啉基、吡啶并吡嗪、喹唑啉酮、苯异恶唑、咪唑并吡啶、苯并呋喃、苯并噻吩、苯并苯硫基、苯基、萘基、联苯、吡咯基、吡唑基、咪唑基、吡嗪基、恶唑基、异恶唑基、噻唑基、呋喃噻吩基、吡啶基、吡啶基、苯并噻唑基、嘌呤基、苯并咪唑基、异喹啉基、噻二唑、恶二唑、吡咯基、二唑、三唑、四唑、苯并噻二唑、异噻唑基、唑并嘧啶、吡咯并嘧啶、苯并三唑基、苯并恶唑基或喹啉基。上面的示例可以是取代或未取代的,上面各杂芳基示例的二价基团是杂亚芳基的非限制性示例。杂芳基部分可包括一个环杂原子(如o、n或s)。杂芳基部分可包括2个任选地不同的环杂原子(如o、n或s)。杂芳基部分可包括3个任选地不同的环杂原子(如o、n或s)。杂芳基部分可包括4个任选地不同的环杂原子(如o、n或s)。杂芳基部分可包括5个任选地不同的环杂原子(如o、n或s)。芳基部分可具有单环。芳基部分可具有2个任选地不同的环。芳基部分可具有3个任选地不同的环。芳基部分可具有4个任选地不同的环。杂芳基部分可具有1个环。杂芳基部分可具有2个任选地不同的环。杂芳基部分可具有3个任选地不同的环。杂芳基部分可具有4个任选地不同的环。杂芳基部分可具有5个任选地不同的环。稠环杂环烃基-芳基是与杂环烃基稠合的芳基。稠环杂环烃基-杂芳基是与杂环烃基稠合的杂芳基。稠环杂环烃基-环烃基是与环烃基稠合的杂环烃基。稠环杂环烃基-杂环烃基是与另一杂环烃基稠合的杂环烃基。稠环杂环烃基-芳基、稠环杂环烃基-杂芳基、稠环杂环烃基-环烃基或稠环杂环烃基-杂环烃基可各自独立地是未取代或取代有本文所述一个或多个取代基。本文所用的术语“氧基”指双键结合碳原子的氧。本文所用的术语“烃基磺酰”指具有式-s(o2)-r'的部分,其中r'是如上所定义取代或未取代的烃基。r'可具有指定数目的碳(如"c1-c4烃基磺酰")。上面术语中的每一个(如“烃基”、“杂烃基”、“环烃基”、“杂环烃基”、“芳基”和“杂芳基”)包括取代和未取代形式的所示基团。各类基团的优选取代基如下所提供。烃基和杂烃基的取代基(包括那些通常称为亚烃基、烯基、杂亚烃基、杂烯基、炔基、环烃基、杂环烃基、环烯基和杂环烯基的基团)可以是选自但不限于以下的各种基团中的一个或多个:-or'、=o、=nr'、=n-or'、-nr'r”、-sr'、-卤素、-sir'r”r”'、-oc(o)r'、-c(o)r'、-co2r'、-conr'r”、-oc(o)nr'r”、-nr”c(o)r'、-nr'-c(o)nr”r”'、-nr”c(o)2r'、-nr-c(nr'r”)=nr”'、-s(o)r'、-s(o)2r'、-s(o)2n(r)('r”-nrso2r')、-cn和-no2,数字范围是0-(2m'+1),其中m'是这类基团中碳原子的总数。r'、r”、r”'和r””各自优选独立指氢,取代或未取代的杂烃基,取代或未取代的环烃基,取代或未取代的杂环烃基,取代或未取代的芳基(如取代有1-3个卤素的芳基),取代或未取代的烃基、烷氧基或硫代烷氧基或芳基烃基。当本发明化合物包括一个以上r基团时,例如,各r基团独立选择作为各r'、r”、r”'和r””基团,此时存在一个以上这些基团。当r'和r”附于同一氮原子时,其能联合氮原子以形成4-、5-、6-或7-元环。例如,-nr'r”包括但不限于1-吡咯烃基和4-吗啉基。通过上述取代基的讨论,本领域技术人员会理解术语“烃基”意在包括结合氢基以外基团的碳原子,如卤代烃基(例如-cf3和-ch2cf3)和酰基(例如-c(o)ch3、-c(o)cf3、-c(o)ch2och3等)。与就烃基所述取代基类似,芳基和杂芳基的取代基可变且选自例如:-or'、-nr'r”、-sr'、-卤素、-sir'r”r”'、-oc(o)r'、-c(o)r'、-co2r'、-conr'r”、-oc(o)nr'r”、-nr”c(o)r'、-nr'-c(o)nr”r”'、nr”c(o)2r'、nrc(nr'r”)=nr”'、s(o)r'、-s(o)2r'、-s(o)2n(r')(r”、-nrso2r')、-cn、-no2、-r'、-n3、-ch(ph)2、氟(c1-c4)烷氧基和氟(c1-c4)烃基,数字范围是0到芳环系统上开放价的总数;且其中r'、r”、r”'和r””优选独立选自氢,取代或未取代的烃基,取代或未取代的杂烃基,取代或未取代的环烃基,取代或未取代的杂环烃基,取代或未取代的芳基以及取代或未取代的杂芳基。当本发明化合物包括一个以上r基团时,例如,各r基团独立选择作为各r'、r”、r”'和r””基团,此时存在一个以上这些基团。当一个部分用r取代基置换时,该基团可称为“r-取代”。当一个部分是r-取代时,该部分用至少一个r取代基置换且各r取代基可选不同。例如,当本文的部分是r1a-取代或未取代烃基时,多个r1a取代基可附于烃基部分,其中各r1a取代基可选不同。当r-取代部分用多个r取代基置换时,各r取代基可在本文中区分,采用上撇号(')如r',r”等。例如,当一个部分是r3a-取代或未取代烃基且该部分用多个r3a取代基置换时,多个r3a取代基可作为r3a',r3a”,r3a”'等区分。在一些实施方案中,所述多个r取代基是3。在一些实施方案中,所述多个r取代基是2。2个或更多取代基可选连接以形成芳基、杂芳基、环芳基或杂环芳基。这类所谓成环取代基通常(虽然不一定)发现附于环基结构。在一个实施方案中,所述成环取代基附于基础结构的相邻的元。例如,附于环基结构相邻的元的2个成环取代基形成稠环结构。在另一个实施方案中,所述成环取代基附于基础结构的单一元。例如,附于环基结构单一元的2个成环取代基形成螺环结构。在另一个实施方案中,所述成环取代基附于基础结构的非相邻的元。芳香或杂芳香环中相邻原子的2个取代基可选形成式-t-c(o)-(crr')q-u-的环,其中t和u独立地是-nr-、-o-、-crr'-或单键,q是0-3的整数。或者,芳香或杂芳香环中相邻原子的2个取代基可选用式-a-(ch2)r-b-的取代基取代,其中a和b独立地是-crr'-、-o-、-nr-、-s-、-s(o)-、-s(o)2-、-s(o)2nr'-或单键,r是1-4的整数。如此形成的新环单键之一可选用双键取代。或者,芳香或杂芳香环中相邻原子的2个取代基可选用式-(crr')s-x'-(c”r”r”')d-的取代基取代,其中变量s和d独立地是0-3的整数,x'是-o-、-nr'-、-s-、-s(o)-、-s(o)2-或-s(o)2nr'-。取代基r、r'、r”和r”'优选独立选自氢,取代或未取代的烃基,取代或未取代的杂烃基,取代或未取代的环烃基,取代或未取代的杂环烃基,取代或未取代的芳基以及取代或未取代的杂芳基。本文所用的术语“杂原子”或“环杂原子”意在包括氧(o)、氮(n)、硫(s)、磷(p)和硅(si)。本文所用的术语“取代基”指选自下列部分的基团:(a)氧基、卤素、-cf3、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so2cl、-so3h、-so4h、-so2nh2,-nhnh2、-onh2、-nhc=(o)nhnh2,-nhc=(o)nh2、-nhso2h、-nhc=(o)h、-nhc(o)-oh、-nhoh,-ocf3、-ochf2、未取代烃基、未取代杂烃基、未取代环烃基、未取代杂环烃基、未取代芳基、未取代杂芳基,和(b)烃基、杂烃基、环烃基、杂环烃基、芳基、杂芳基,用选自以下的至少一个取代基置换:(i)氧基、卤素、-cf3、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so2cl、-so3h、-so4h、-so2nh2,-nhnh2、-onh2、-nhc=(o)nhnh2,-nhc=(o)nh2,-nhso2h、-nhc=(o)h、-nhc(o)-oh、-nhoh,-ocf3、-ochf2、未取代烃基、未取代杂烃基、未取代环烃基、未取代杂环烃基、未取代芳基、未取代杂芳基,和(ii)烃基、杂烃基、环烃基、杂环烃基、芳基、杂芳基,用选自以下的至少一个取代基置换:(a)氧基、卤素、-cf3、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so2cl、-so3h、-so4h、-so2nh2,-nhnh2、-onh2、-nhc=(o)nhnh2,-nhc=(o)nh2、-nhso2h、-nhc=(o)h、-nhc(o)-oh、-nhoh,-ocf3、-ochf2、未取代烃基、未取代杂烃基、未取代环烃基、未取代杂环烃基、未取代芳基、未取代杂芳基,和(b)烃基、杂烃基、环烃基、杂环烃基、芳基、杂芳基,用选自以下的至少一个取代基置换:氧基、卤素、-cf3、-cn、-oh、-nh2、-cooh、-conh2、-no2、-sh、-so2cl、-so3h、-so4h、-so2nh2,-nhnh2、-onh2、-nhc=(o)nhnh2,-nhc=(o)nh2,-nhso2h、-nhc=(o)h、-nhc(o)-oh、-nhoh,-ocf3、-ochf2、未取代烃基、未取代杂烃基、未取代环烃基、未取代杂环烃基、未取代芳基、未取代杂芳基。本文所用的“尺寸限制取代基”或“尺寸限制取代基团”指选自上面就“取代基”所述全部取代基的基团,其中各取代或未取代的烃基是取代或未取代的c1-c20烃基,各取代或未取代的杂烃基是取代或未取代的2-20元杂烃基,各取代或未取代的环烃基是取代或未取代的c3-c8环烃基,各取代或未取代的杂环烃基是取代或未取代的3-8元杂环烃基,各取代或未取代的芳基是取代或未取代的c6-c10芳基,且各取代或未取代的杂芳基是取代或未取代的5-10元杂芳基。本文所用的“低级取代基”或“低级取代基团”指选自上面就“取代基”所述全部取代基的基团,其中各取代或未取代的烃基是取代或未取代的c1-c8烃基,各取代或未取代的杂烃基是取代或未取代的2-8元杂烃基,各取代或未取代的环烃基是取代或未取代的c3-c7环烃基,各取代或未取代的杂环烃基是取代或未取代的3-7元杂环烃基,各取代或未取代的芳基是取代或未取代的c6-c10芳基,且各取代或未取代的杂芳基是取代或未取代的5-9元杂芳基。在一些实施方案中,本文化合物中的所述各取代基用至少一个取代基置换。更特定地,在一些实施方案中,本文化合物中的所述各取代烃基、取代杂烃基、取代环烃基、取代杂环烃基、取代芳基、取代杂芳基、取代亚烃基、取代杂亚烃基、取代环亚烃基、取代杂环亚烃基、取代亚芳基和/或取代杂亚芳基用至少一个取代基置换。在其他实施方案中,至少一个或所有这些基团用至少一个尺寸限制取代基置换。在其他实施方案中,至少一个或所有这些基团用至少一个低级取代基置换。在本文化合物的其他实施方案中,各取代或未取代的烃基可以是取代或未取代的c1-c20烃基,各取代或未取代的杂烃基是取代或未取代的2-20元杂烃基,各取代或未取代的环烃基是取代或未取代的c3-c8环烃基,各取代或未取代的杂环烃基是取代或未取代的3-8元杂环烃基,各取代或未取代的芳基是取代或未取代的c6-c10芳基,各取代或未取代的芳基是取代或未取代的c6-c10芳基,和/或各取代或未取代的杂芳基是取代或未取代的5-10元杂芳基。在本文化合物的一些实施方案中,各取代或未取代的亚烃基是取代或未取代的c1-c20亚烃基,各取代或未取代的杂亚烃基是取代或未取代的2-20元杂亚烃基,各取代或未取代的环亚烃基是取代或未取代的c3-c8c3-c8环亚烃基,各取代或未取代的杂环亚烃基是取代或未取代的3-8元杂环亚烃基,各取代或未取代的亚芳基是取代或未取代的c6-c10亚芳基,和/或各取代或未取代的杂亚芳基是取代或未取代的5-10元杂亚芳基。在一些实施方案中,各取代或未取代的烃基是取代或未取代的c1-c8烃基,各取代或未取代的杂烃基是取代或未取代的2-8元杂烃基,各取代或未取代的环烃基是取代或未取代的c3-c7环烃基,各取代或未取代的杂环烃基是取代或未取代的3-7元杂环烃基,各取代或未取代的芳基是取代或未取代的c6-c10芳基,和/或各取代或未取代的杂芳基是取代或未取代的5-9元杂芳基。在一些实施方案中,各取代或未取代的亚烃基是取代或未取代的c1-c8亚烃基,各取代或未取代的杂亚烃基是取代或未取代的2-8元杂亚烃基,各取代或未取代的环亚烃基是取代或未取代的c3-c7环亚烃基,各取代或未取代的杂环亚烃基是取代或未取代的3-7元杂环亚烃基,各取代或未取代的亚芳基是取代或未取代的c6-c10亚芳基,和/或各取代或未取代的杂亚芳基是取代或未取代的5-9元杂亚芳基。在一些实施方案中,所述化合物是下面实施例部分、图或表所列的化学物种。本文所用的术语“缀合”指原子或分子之间的关联。所述关联可以是直接或间接的。例如,核酸与蛋白之间的缀合可以是直接的如通过共价键,或间接的如通过非共价键(例如静电作用(如离子键、氢键、卤键)、范德华相互作用(如偶极-偶极、偶极-诱发偶极、伦敦分散)、芳环堆积(pi效应)、疏水作用等)。在实施方案中,缀合用缀合化学形成,包括但不限于亲核取代(例如胺和醇与卤化酰基、活性酯的反应)、亲电取代(例如烯胺反应)和加入碳-碳及碳-杂原子多重键(例如迈克尔反应,diels-alder加成)。这些和其他有用的反应讨论于例如march,《高等有机化学》(advancedorganicchemistry),第3版,纽约的约翰·威利父子公司(johnwiley&sons),1985;hermanson,生物缀合技术(bioconjugatetechniques),圣地亚哥的学术出版社(academicpress),1996;和feeney等,《蛋白修饰》(modificationofproteins);《化学进展系列》(advancesinchemistryseries),第198卷,华盛顿特区的美国化学学会(americanchemicalsociety)。在实施方案中,所述微粒非共价连接固体支撑物,这是通过微粒组分与固体支撑物组分之间的非共价化学反应。在其他实施方案中,所述微粒包括一个或多个反应性部分,例如共价反应性部分,如本文所述(例如胺反应性部分)。在其他实施方案中,所述微粒包括接头与一个或多个反应性部分,例如共价反应性部分,如本文所述(例如胺反应性部分)。本文用于缀合化学(包括本领域已知的“点击化学”)的有用反应性部分或官能团包括例如:(a)羧基和其多个衍生物,包括但不限于n-羟基丁二酰亚胺酯、n-羧基苯并三唑酯、酸性卤化物、酰基咪唑、硫酯、对硝基苯酯、烃基、烯基、炔基和芳香酯;(b)羟基,其能转变成酯、醚、醛等;(c)卤代烃基,其中卤化物可以稍后用亲核基团替换,例如胺、羧酸根阴离子、硫醇阴离子、负碳离子或烷氧离子,从而导致新基团在卤素原子位点共价结合;(d)亲二烯基团,其能参与diels-alder反应,例如马来酰亚胺基团;(e)醛或酮基,从而后续衍生通过形成羰基衍生物而可行,例如亚胺、腙、缩氨基脲或肟,或通过机制如grignard加成或烃基锂加成;(f)磺酰卤化物基团,用于与胺后续反应,例如形成磺酰胺;(g)硫醇基,其能转变成二硫化物,与卤化酰基反应,或键合到金属如金;(h)胺或巯基,其可以是例如酰化、烃基化或氧化;(i)烯烃,其能经历例如环加成、酰化、迈克尔加成等;(j)环氧化物,其能与例如胺和羟基化合物反应;(k)亚磷酰胺和用于核酸合成的其他标准官能团;(l)金属氧化物硅键合;(m)金属键合反应性磷基团(如磷化氢)以形成例如磷酸双酯键;和(n)砜,例如乙烯砜。通过连接小模块单元用缀合(‘点击’)化学进行组合物的化学合成为本领域熟知并描述于例如h.c.kolb,m.g.finn和k.b.sharpless((2001)."点击化学:来自一些良好反应的多样化化学功能(clickchemistry:diversechemicalfunctionfromafewgoodreactions)".angewandtechemieinternationaledition40(11):2004–2021);r.a.evans((2007)."叠氮化物–炔烃1,3-两极'点击'环加成和其应用于聚合物科学及表面修饰(theriseofazide–alkyne1,3-dipolar'click'cycloadditionanditsapplicationtopolymerscienceandsurfacemodification)".australianjournalofchemistry60(6):384–395;w.c.guida等.med.res.rev.p31996;spiteri,christian和moses,johne.((2010)."铜催化叠氮化物–炔烃环加成:位置选择性合成1,4,5-三取代1,2,3-三唑(copper-catalyzedazide–alkynecycloaddition:regioselectivesynthesisof1,4,5-trisubstituted1,2,3-triazoles)".angewandtechemieinternationaledition49(1):31–33);hoyle,charlese.和bowman,christophern.((2010)."硫醇烯点击化学(thiol–eneclickchemistry)".angewandtechemieinternationaledition49(9):1540–1573);blackman,melissal.和royzen,maksim及fox,josephm.((2008)."四嗪连接:基于反电子需求diels-alder反应性的快速生物缀合(tetrazineligation:fastbioconjugationbasedoninverse-electron-demanddiels-alderreactivity)".journaloftheamericanchemicalsociety130(41):13518–13519);devaraj,nealk.和weissleder,ralph及hilderbrand,scotta.((2008)."基于四嗪的环加成:应用于预靶向活细胞标记(tetrazinebasedcycloadditions:applicationtopretargetedlivecelllabeling)".bioconjugatechemistry19(12):2297–2299);henning;neves,andre;stairs,shaun;brindle,kevin;leeper,finian((2011)."探索基于异氰化物的点击化学以连接生物分子(exploringisonitrile-basedclickchemistryforligationwithbiomolecules)".organic&biomolecularchemistry),全部通过引用全文纳入本文并用于所有目的。反应性官能团能选择成其不参与或干扰本文所述蛋白或核酸的化学稳定性。举例来说,核酸能包括乙烯砜或其他反应性部分(如马来酰亚胺)。可选地,核酸能包括具有式-s-s-r的反应性部分。r可以是例如保护基。r可选是己醇。本文所用的术语己醇包括具有式c6h13oh的化合物,且包括1-己醇、2-己醇、3-己醇、2-甲基-1-戊醇、3-甲基-1-戊醇、4-甲基-1-戊醇、2-甲基-2-戊醇、3-甲基-2-戊醇、4-甲基-2-戊醇、2-甲基-3-戊醇、3-甲基-3-戊醇、2,2-二甲基-1-丁醇、2,3-二甲基-1-丁醇、3,3-二甲基-1-丁醇、2,3-二甲基-2-丁醇、3,3-二甲基-2-丁醇和2-乙基-1-丁醇。任选地,r是1-己醇。本文所用的术语“约”指一定范围的值,包括规定值,本领域普通技术人员会认为其相当类似规定值。在实施方案中,术语“约”指在标准偏差内,采用本领域普遍能接受的测量。在实施方案中,约是指延伸到规定值+/-10%的范围。在实施方案中,约是指规定值。本文所用的术语“一(a)”或“一(an)”指一个或多个。另外,本文所用的短语“用a[n]取代”指特定基团可用一个或多个的任意或所有命名取代基置换。例如,当基团如烃基或杂芳基“用未取代c1-c20烃基或未取代2-20元杂烃基取代”时,该基团可包含一个或多个未取代c1-c20烃基和/或一个或多个未取代2-20元杂烃基。此外,当一个部分用r取代基置换时,该基团可称为“r取代”。当一个部分是r取代时,该部分用至少一个r取代基置换且各r取代基可选不同。除非另有定义,本文所用技术和科学术语与本领域普通技术人员通常所理解的意义相同。参见例如singleton等,《微生物学与分子生物学词典》(dictionaryofmicrobiologyandmolecularbiology)第2版,j.wiley&sons(newyork,ny1994);sambrook等,《分子克隆,实验室手册》(molecularcloning,alaboratorymanual),冷泉港实验室出版社(coldspringsharborpress)(纽约冷泉港1989)。与本文所述类似或等同的任何方法、装置和材料能用于实施本发明。提供下列定义以促进理解本文经常使用的某些术语且不意在限制本公开范围。“生物样品”或“样品”指获自或衍生自对象或患者的材料。生物样品包括组织切片如活检和尸检样品,以及获取用于组织学目的的冷冻切片。这类样品包括体液如血液和血液部分或产品(如血清、血浆、血小板、红血球等)、痰、组织、培养细胞(如原始培养物、外植体和转化细胞)、粪便、尿、滑液、关节组织、滑膜组织、滑膜细胞、成纤维样滑膜细胞、巨噬细胞样滑膜细胞、免疫细胞、造血细胞、成纤维细胞、巨噬细胞、t细胞等。生物样品通常获自真核生物,如哺乳动物例如灵长类动物,如黑猩猩或人;牛;狗;猫;啮齿动物如豚鼠、大鼠、小鼠;兔;或鸟;爬行动物;或鱼。本文所用的“细胞”指行使代谢或其他功能足以保护活复制其基因组dna的细胞。细胞能通过本领域熟知方法鉴定,包括例如存在完整膜,由特定染料染色,生成后代的能力或在配子的情况中,联合第二配子生成可存活后代的能力。细胞可包括原核和真核细胞。原核细胞包括但不限于细菌。真核细胞包括但不限于酵母细胞和衍生自植物及动物的细胞,例如哺乳动物、昆虫(如夜蛾)和人细胞。当细胞是天然非粘附或处理成不附于表面例如通过胰蛋白酶化时,所述细胞可能有用。术语“多肽”、“肽”和“蛋白”在本文中可互换使用以指氨基酸残基的聚合物,其中该聚合物可以任选地缀合不由氨基酸组成的部分。所述术语适用于氨基酸聚合物,其中一个或多个氨基酸残基是人工化学模拟物,对应于天然产生的氨基酸以及天然产生的氨基酸聚合物和非天然产生的氨基酸聚合物。“融合蛋白”指编码2种或更多单独蛋白序列的嵌合蛋白,其重组表达为单一部分。术语“肽基”和“肽基部分”指附于分子剩余部分的肽(如本文提供的重组蛋白或本文所提供重组蛋白的肽结构域形成部分)。肽基部分可用化学接头取代,该接头用于使肽基部分附于重组蛋白剩余部分(如跨膜结构域、间隔区或肽基接头)。肽基部分也可用额外化学接头(如额外r取代基)取代。在实施方案中,所述非cdrfab结合肽结构域包括肽基部分。在实施方案中,所述非cdrfab结合肽结构域是肽基部分。本文所用的术语“中间位”指纳入本文所述肽结构域的肽基部分。因此,在实施方案中,所述非cdrfab结合肽结构域是中间位。在实施方案中,所述非cdrfab结合肽结构域包括中间位。肽基部分(如中间位)可以是线性或环状肽部分。多种肽部分环化方法可用于例如针对体内稳定性和使化学选择性控制可行以用于后续缀合化学。在一些实施方案中,所述环化策略是内酰胺环化策略,包括头到尾(头-尾)内酰胺环化(无环肽的末端残基之间)和/或其他残基之间的内酰胺连接。内酰胺形成也可如下实现:将残基如甘氨酸、β-ala和/或7-氨基庚酸等纳入无环肽环化前体以生成不同内酰胺环尺寸和连接模式。另外的环化策略如“点击”化学和烯烃复分解反应也能使用。这类肽和模拟肽环化方法为本领域熟知。在实施方案中,所述肽基部分(如中间位)是线性肽基部分(如线性中间位)。在实施方案中,所述肽基部分(如中间位)是环状肽基部分(如环状中间位)。“标记”、“可检测结构域”或“可检测部分”是通过光谱、光化学、生化、免疫化学、化学或其他物理方式可检测的组合物。例如,有用的标记包括32p、荧光染料、电子致密试剂、酶(如通常用于elisa)、生物素、地高辛或半抗原和蛋白或能够可检测的其他实体,例如通过将放射性标记纳入肽或抗体,其与靶肽有特异反应性。可采用本领域已知用于缀合抗体与标记的任何适当方法,如采用hermanson,《生物缀合技术》(bioconjugatetechniques)1996,圣地亚哥的学术出版社有限公司(academicpress,inc.)所述方法。“标记蛋白或多肽”通过共价或非共价结合标记,前者经接头或化学键,后者经离子、范德华力、静电或氢键,从而标记蛋白或多肽的存在可通过检测结合标记蛋白或多肽的标记存在来测得。或者,用高亲和相互作用的方法可实现相同结果,其中一对结合伴侣之一彼此结合,如生物素、链霉亲和素。术语“氨基酸”指天然产生和合成的氨基酸,以及氨基酸类似物和氨基酸模拟物,其发挥功能的方式类似天然产生的氨基酸。天然产生的氨基酸是由遗传密码编码的那些,以及稍后修饰的那些氨基酸,如羟脯氨酸、γ-羧基谷氨酸和o-磷酸丝氨酸。氨基酸类似物指基本化学结构与天然产生氨基酸相同的化合物,即α碳结合氢、羧基、氨基和r基,如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍。这种类似物具有经修饰r基(如正亮氨酸)或经修饰肽骨架,但保留与天然产生氨基酸相同的基本化学结构。氨基酸模拟物指结构不同于氨基酸一般化学结构,但发挥功能的方式类似天然产生氨基酸的化合物。氨基酸在本文中可通过其通常已知的三字母符号或iupac-iub生物化学命名委员会推荐的单字母符号提及。同样,核苷酸可通过其公认的单字母密码提及。氨基酸或核苷酸碱基“位置”通过数字指示,根据其相对于n末端(或5'末端)位置来依序鉴定参照序列中的各氨基酸(或核苷酸碱基)。由于缺失、插入、截短、融合和确定最优排列时纳入考虑的其他方面,一般,测试序列中通过从n末端简单计数来确定的氨基酸残基数不必定与参照序列中其对应位置的数目相同。例如,在变体相比对齐参照序列有缺失的情况中,变体中没有氨基酸对应参照序列在缺失位点的位置。对齐参照序列中有插入时,该插入不对应参照序列的有编号氨基酸位置。在截短或融合情况中,参照或对齐序列中可能有氨基酸延伸物,其不对应相应序列的任何氨基酸。术语“参照编号”或“对应于”用于给定氨基酸或多核苷酸序列编号的上下文时,指当给定氨基酸或多核苷酸序列相较参照序列,规定参照序列残基的编号。蛋白中的氨基酸残基占据与给定残基相同的蛋白内必要结构位置时,其“对应”给定残基。例如,所选残基占据与kabat40位处轻链苏氨酸相同的必要空间或其他结构关系时,选定抗体(或fab结构域)中的所选残基对应于kabat40位的轻链苏氨酸。在选定蛋白对齐以与抗体轻链(或fab结构域)有最大同源性的一些实施方案中,所述与苏氨酸40对准的对齐选定蛋白中的位置被称为对应苏氨酸40。除了初级序列对齐,还能使用三维结构对齐,例如其中选定蛋白的结构对齐以与kabat40位的轻链苏氨酸有最大对应性,并比较总体结构。此情况中,占据与结构模型中苏氨酸40相同的必要位置的氨基酸被称为对应于苏氨酸40残基。“保守修饰变体”适用于氨基酸和核酸序列。关于特定核酸序列,保守修饰变体指编码相同或基本相同氨基酸序列的那些核酸,或其中核酸不编码氨基酸序列到基本相同序列。由于遗传密码的简并性,大量功能相同核酸序列编码任意给定氨基酸残基。例如,密码子gca,gcc,gcg和gcu都编码氨基酸丙氨酸。因此,在丙氨酸由密码子指定的每一个位置,该密码子能改变成所述任何对应密码子,而不改变所编码多肽。这类核酸变化是“沉默变化”,其是一种保守修饰变化。本文编码多肽的每一个氨基酸序列也描述核酸的每一种可能沉默变化。技术人员应认识到,核酸的每一个密码子(除了aug和tgg,前者通常是甲硫氨酸的唯一密码子,后者通常是色氨酸的唯一密码子)能修饰成产生功能相同分子。因此,编码多肽的核酸各沉默变化隐含于各所述序列,涉及表达产物,但不涉及实际探针序列。关于氨基酸序列,技术人员应认识到,个别取代、缺失或加入核酸、肽、多肽或蛋白序列会改变、添加或缺失所编码序列中的单一氨基酸或一小部分氨基酸,其是“保守修饰变体”,其中所述改变导致氨基酸被化学性质类似氨基酸取代。提供功能相似氨基酸的保守取代表为本领域熟知。这种保守修饰变体是除了本发明多态变体、种间同系物和等位基因以外且不排除他们。下列8组各包含彼此保守取代的氨基酸:1)丙氨酸(a)、甘氨酸(g);2)天冬氨酸(d)、谷氨酸(e);3)天冬酰胺(n)、谷氨酰胺(q);4)精氨酸(r)、赖氨酸(k);5)异亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、缬氨酸(v);6)苯丙氨酸(f)、酪氨酸(y)、色氨酸(w);7)丝氨酸(s)、苏氨酸(t);和8)半胱氨酸(c)、甲硫氨酸(m)(参见例如creighton、《蛋白》(proteins)(1984))。“核酸”指脱氧核糖核苷酸或核糖核苷酸以及其采用单链或双链形式的聚合物,和其互补物。术语“多核苷酸”指核苷酸线性序列。术语“核苷酸”通常指单一单元的多核苷酸,即单体。核苷酸可以是核糖核苷酸、脱氧核糖核苷酸或其修饰形式。本文考虑的多核苷酸示例包括单链和双链dna,单链和双链rna(包括sirna),以及具有单链和双链dna及rna混合物的杂交分子。本文所用核酸也指基本化学结构与天然产生核酸相同的核酸。这种类似物具有经修饰糖和/或修饰取代基,但保留与天然产生核酸相同的基本化学结构。核酸模拟物指结构不同于核酸一般化学结构,但发挥功能的方式类似天然产生核酸的化合物。类似物示例包括但不限于硫代磷酸酯、氨基磷酸酯、甲基膦酸酯、手性甲基膦酸酯、2-o-甲基核糖核苷酸和肽核酸(pna)。“序列相同性百分比”通过在比较窗口中比较2种最优对齐序列来确定,其中比较窗口内的部分多核苷酸或多肽序列可包括添加或缺失(即空位),与参照序列(其不包括添加或缺失)相比以最优对齐2种序列。百分比如下计算:确定2种序列中出现相同核酸碱基或氨基酸残基的位置数以产生匹配位置数,将匹配位置数除以比较窗口中的位置总数,结果乘以100从而产生序列相同性百分比。术语“相同”或“相同性”百分比在2种或更多核酸或多肽序列背景下,指当比较和对齐以用于比较窗口或指定区域中的最大对应性,如用下列序列比较算法之一或通过手动对齐和目测时,相同或具有规定百分比相同氨基酸残基或核苷酸(即60%相同性,任选地在规定区域例如本发明完整多肽序列或本发明多肽个体结构域中的65%、70%、75%、80%、85%、90%、95%、98%或99%相同性)的2种或更多序列或子序列。这类序列随后被称为“基本相同”。此定义也指测试序列的互补物。任选地,相同性在至少约50个核苷酸长度区域中存在,或更优选在100-500或1000个或更多核苷酸长度区域中。本发明包括与任何seqidno:1-35基本相同的多肽。对于序列比较,通常一种序列用作参照序列,测试序列与其对比。当使用序列比较算法时,将测试和参照序列输入计算机,指定序列补体子序列坐标,如有必要,并且指定序列算法程序参数。可使用默认程序参数,或能指定替代参数。序列比较算法随后就测试序列相对于参照序列,基于程序参数计算序列相同性百分比。本文所用的“比较窗口”包括选自下组的任意一个连续位置数区段:例如,全长序列或20-600、约50-约200或约100-约150个氨基酸或核苷酸,其中在2种序列最优对齐后,序列可与相同数目连续位置的参照序列作比较。对齐序列以比较的方法为本领域熟知。可实施最优对齐序列以比较,例如通过smith和waterman的局部同源性算法(1970)adv.appl.math.2:482c,needleman和wunsch的同源对齐算法(1970)j.mol.biol.48:443,pearson和lipman的相似性搜索方法(1988)proc.nat’l.acad.sci.usa85:2444,这些算法的计算机化实施(gap,bestfit,fasta,和wisconsingenetics软件包中的tfasta,(gcg)geneticscomputergroup,575sciencedr.,威斯康星州麦迪逊),或手动对齐和目测(参见例如ausubel等,《精编分子生物学实验指南》(currentprotocolsinmolecularbiology)(1995增刊))。适合确定序列相同性和序列相似性百分比的算法示例是blast和blast2.0算法,所述算法分别描述于altschul等.(1977)nuc.acidsres.25:3389-3402和altschul等.(1990)j.mol.biol.215:403-410。用于进行blast分析的软件可通过美国国家生物技术信息中心(http://www.ncbi.nlm.nih.gov/)公开获得。此算法涉及首先鉴定高得分序列对(hsp),这是通过鉴定查询序列中长度w的短字,当与数据库序列中相同长度的字对齐时,其匹配或满足一些正值阈值得分t。t被称为相邻字得分阈值(altschul等,同上)。这些初始相邻字命中用作起始搜索的种子以发现含有其的较长hsp。字命中沿着各序列的2个方向延伸,只要累积对齐得分能增加。对于核苷酸序列,累积分用参数m(匹配残基对的奖励分;总是>0)和n(错配残基的罚分;总是<0)计算。对于氨基酸序列,得分矩阵用于计算累积分。各方向的字命中延伸在以下情况时停止:累积对齐得分从其最高实现值减少量x;累积分达到零或以下,这归因于一个或多个负分残基对齐积聚;或到达任一序列末端。blast算法参数w,t和x确定对齐的敏感性和速度。blastn程序(用于核苷酸序列)使用的默认值是字长(w)11,预期(e)10,m=5,n=-4和2条链的比较。对于氨基酸序列,blastp程序使用的默认值是字长3,预期(e)10和blosum62得分矩阵(参见henikoff和henikoff(1989)proc.natl.acad.sci.usa89:10915)对齐(b)50,预期(e)10,m=5,n=-4和2条链的比较。blast算法也进行2种序列之间相似性的统计分析(参见例如karlin和altschul(1993)proc.natl.acad.sci.usa90:5873-5787)。一种由blast算法提供的相似性量度是最小概率和(p(n)),其指示2种核苷酸或氨基酸序列之间偶然发生匹配的概率。例如,若测试核酸与参照核酸比较中的最小概率和低于约0.2,更优选低于约0.01且最优选低于约0.001,则认为核酸类似参照序列,2种核酸序列或多肽基本相同的指征在于,由第一核酸编码的多肽与抗体可免疫交叉反应,所述抗体针对第二核酸所编码多肽而提高,如下所述。因此,多肽通常与第二多肽基本相同,例如其中2种多肽的差异仅在于保守取代。2种核酸序列基本相同的另一迹象在于,2个分子或其互补物在严格条件下彼此杂交,如下所述。2种核酸序列基本相同的另一迹象在于,相同引物能用于扩增序列。本文关于基因所用的单词“表达”或“表达的”指基因的转录和/或翻译产物。细胞中dna分子的表达水平可基于细胞内所存在对应mrna量或细胞所产生dna编码的蛋白量来确定。非编码核酸分子(如sirna)的表达水平可通过本领域熟知的标准pcr或northern印迹方法检测。参见sambrook等,1989《分子克隆:实验室手册》(molecularcloning:alaboratorymanual),18.1-18.88。转染基因的表达能在细胞中瞬时或稳定出现。“瞬时表达”期间,转染基因在细胞分裂中未转移到子细胞。由于其表达限于转染细胞,基因表达随着时间而丢失。相反,当基因与赋予转染细胞选择优势的另一基因共转染时,转染基因的稳定表达可出现。这类选择优势可以是呈递给细胞的针对某一毒素的抗性。转染基因的表达能进一步通过转座子介导的插入宿主基因组来实现。转座子介导的插入期间,基因以可预测方式位于2个转座子接头序列之间,这允许插入宿主基因组以及后续切除。转染基因的稳定表达能进一步通过细胞感染慢病毒载体来实现,所述载体在感染后形成部分(整合入)细胞基因组,从而引起基因稳定表达。术语“质粒”、“载体”或“表达载体”指编码基因表达所需基因和/或调节元件的核酸分子。来自质粒的基因表达可以顺式或反式出现。如果基因顺式表达,基因和调节元件由同一质粒编码。反式表达指基因和调节元件由分开质粒编码的情况。术语“转染(transfection,transfecting)”或“转导(transduction,transducing)”能互换使用并定义为向细胞引入核酸分子或蛋白的过程。核酸用基于非病毒或病毒的方法引入细胞。核酸分子可以是编码蛋白或其功能部分的基因序列。转染的非病毒方法包括不采用病毒dna或病毒粒子作为递送系统将核酸分子引入细胞的任何适当转染方法。示范性非病毒转染方法包括磷酸钙转染、脂质体转染、核转染、声孔作用、经热休克转染、磁性转染和电穿孔。在一些实施方案中,所述核酸分子用电穿孔遵循本领域熟知的标准程序引入细胞。对于基于病毒的转染方法,任何有用的载体可用于本文所述方法。病毒载体示例包括但不限于逆转录病毒、腺病毒、慢病毒和腺相关病毒载体。在一些实施方案中,所述核酸分子用逆转录病毒载体遵循本领域熟知的标准程序引入细胞。术语“转染”或“转导”也指从外部环境引入蛋白到细胞。通常,转导或转染蛋白取决于能穿过细胞膜的肽或蛋白附于感兴趣蛋白。参见例如ford等.(2001)genetherapy8:1-4和prochiantz(2007)nat.methods4:119-20。“抗体”指含框架区的多肽,该框架区来自特异结合并识别抗原的免疫球蛋白基因或其片段。经识别的免疫球蛋白基因包括κ、λ、α、γ、δ、ε和μ恒定区基因以及无数免疫球蛋白可变区基因。轻链分为κ或λ。重链分为γ、μ、α、δ或ε,这进而分别定义免疫球蛋白类别igg、igm、iga、igd和ige。通常,抗体的抗原结合区在确定结合的特异性和亲和性中起重要作用。在一些实施方案中,抗体或抗体片段可衍生自不同生物,包括人、小鼠、大鼠、仓鼠、骆驼等。本发明抗体可包括在一个或多个氨基酸位置修饰或突变的抗体,以改善或调整抗体的想要的功能(如糖基化、表达、抗原识别、效应子功能、抗原结合、特异性等)。抗体是大的复合分子(分子量为~150,000da或约1320个氨基酸),有复杂的内部结构。天然抗体分子包含2对相同多肽链,各对具有一条轻链和一条重链。各轻链和重链进而由2个区域组成:参与结合靶抗原的可变(“v”)区,和与其他免疫系统组分相互作用的恒定(“c”)区。轻和重链可变区在三维空间中集合形成结合抗原的可变区(例如,细胞表面的受体)。在各轻或重链可变区内,有3个短区段(平均10个氨基酸长度),称为互补决定区(“cdr”)。抗体可变域的6个cdr(3个来自轻链,3个来自重链)在三维空间中折叠在一起形成实际抗体结合位点(抗体决定簇),其结合于靶抗原(表位)上。cdr的位置和长度通过kabat,e.等,《免疫学上感兴趣的蛋白序列》(sequencesofproteinsofimmunologicalinterest),美国卫生和公众服务部,1983,1987精确定义。不含于cdr的可变区部分被称为框架(“fr”),其形成cdr的环境。本文提供的“抗体变体”指能结合抗原且包括抗体或其片段一个或多个结构域(如轻链可变域、重链可变域)的多肽。抗体变体的非限制性示例包括单域抗体或纳米抗体、单特异性fab2,双特异性fab2、三特异性fab3、单价igg、scfv、双特异性双链抗体、三特异性三链抗体、scfv-fc、微抗体、ignar、v-nar、hcigg、vhh或肽体。本文提供的“肽体”指附于(经共价或非共价接头)抗体fc结构域的肽部分。本领域已知的抗体变体更多非限制性示例包括由软骨鱼或骆驼生成的抗体。关于来自骆驼的抗体和其可变区以及其生成、分离和使用方法的一般描述可参见文献wo97/49805和wo97/49805,所述文献通过引用全文纳入本文并用于所有目的。同样,来自软骨鱼的抗体和其可变区以及其生成、分离和使用方法可参见wo2005/118629,所述文献通过引用全文纳入本文并用于所有目的。本文提供的术语“cdrl1”、“cdrl2”和“cdrl3”指抗体可变轻(l)链的互补决定区(cdr)1、2和3。在实施方案中,本文提供的可变轻链从n末端到c末端方向包括cdrl1、cdrl2和cdrl3。同样,本文提供的术语“cdrh1”、“cdrh2”和“cdrh3”指抗体可变重(h)链的互补决定区(cdr)1、2和3。在实施方案中,本文提供的可变重链从n末端到c末端方向包括cdrh1、cdrh2和cdrh3。本文提供的术语“frl1”、“frl2”、“frl3”和“frl4”根据其在本领域的普通含义使用,并且指抗体可变轻(l)链的框架区(fr)1、2、3和4。在实施方案中,本文提供的可变轻链从n末端到c末端方向包括frl1、frl2、frl3和frl4。同样,本文提供的术语“frh1”、“frh2”、“frh3”和“frh4”根据其在本领域的普通含义使用,并且指抗体可变重(h)链的框架区(fr)1、2、3和4。在实施方案中,本文提供的可变重链从n末端到c末端方向包括frh1、frh2、frh3和frh4。术语“抗体”根据其在本领域的通常已知含义使用。例如,抗体作为完整免疫球蛋白或通过多种肽酶消化作为一些明确片段存在。因此,例如,胃蛋白酶消化铰链区二硫键下的抗体以生成fab二聚体f(ab)'2,其本身是通过二硫键连接vh-ch1的轻链。f(ab)'2可在温和条件下还原以破坏铰链区二硫键,从而使f(ab)'2二聚体转变成fab'单体。fab'单体本质上是fab,有部分铰链区(参见《基础免疫学》(fundamentalimmunology)(paul编,第3版.1993))。尽管多个抗体片段按照完整抗体消化来定义,技术人员应理解这类片段可用化学方法或重组dna方法从头合成。因此,本文所用的术语抗体也包括抗体片段,通过修饰全抗体生成,或用重组dna方法(如单链fv)从头合成的那些或用噬菌体展示库鉴定的那些(参见例如mccafferty等,nature348:552-554(1990))。示范性免疫球蛋白(抗体)结构单元包括四聚体。各四聚体由2对相同多肽链构成,每对具有一条“轻”链(约25kd)和一条“重”链(约50-70kd)。各链的n末端定义约100-110或更多氨基酸的可变区,主要负责抗原识别。术语可变轻链(vl)或轻链可变区和可变重链(vh)或重链可变区分别指这些轻和重链区。本文所指的术语可变轻链(vl)和轻链可变区能互换使用。本文所指的术语可变重链(vh)和重链可变区能互换使用。fc(即可结晶片段区)是免疫球蛋白的“基底”或“尾”,通常由2条重链构成,其根据抗体种类贡献2个或3个恒定域。通过结合特定蛋白,fc区确保各抗体对给定抗原产生适当免疫应答。fc区也结合多个细胞受体如fc受体,和其他免疫分子如补体蛋白。本文提供的术语“抗原”指能结合本文所提供抗体结合域的分子。本文提供的“抗原结合域”是结合抗原(表位)的抗体区域。如上所述,抗原结合域一般由各重和轻链的一个恒定域及一个可变域构成(分别是ch、cl、vh和vl)。抗体决定簇或抗原结合位点在抗原结合域n末端上形成。抗原结合域的2个可变域通常结合抗原上的表位。例如,抗体作为完整免疫球蛋白或通过多种肽酶消化作为一些明确片段存在。因此,例如,胃蛋白酶消化铰链区二硫键下的抗体以生成fab二聚体f(ab)'2,其本身是通过二硫键连接vh-ch1的轻链。f(ab)'2可在温和条件下还原以破坏铰链区二硫键,从而使f(ab)'2二聚体转变成fab'单体。fab'单体本质上是抗原结合部分,有部分铰链区(参见《基础免疫学》(paul编,第3版.1993))。尽管多个抗体片段按照完整抗体消化来定义,技术人员应理解这类片段可用化学方法或重组dna方法从头合成。因此,本文所用的术语抗体也包括抗体片段,通过修饰全抗体生成,或用重组dna方法(如单链fv)从头合成的那些或用噬菌体展示库鉴定的那些(参见例如mccafferty等,nature348:552-554(1990))。单链可变片段(scfv)通常是免疫球蛋白重(vh)和轻链(vl)可变区的融合蛋白,用10-约25个氨基酸的短接头肽连接。接头通常甘氨酸富集以用于灵活性,以及丝氨酸或苏氨酸富集以用于溶解度。接头能连接vh的n末端与vl的c末端,或反之亦然。mab的表位是mab结合的抗原区域。如果2个抗体各自竞争性抑制(阻断)另一抗体结合抗原,则2个抗体结合同一或重叠表位。即1x、5x、10x、20x或100x过量的抗体抑制另一抗体结合达至少30%,但优选50%、75%、90%或甚至99%,如竞争结合试验所测(参见例如junghans等,cancerres.50:1495,1990)。或者,如果减少或消除一种抗体结合的抗原中几乎所有氨基酸突变会减少或消除另一抗体结合,则2种抗体具有同一表位。如果减少或消除一种抗体结合的一些氨基酸突变会减少或消除另一抗体结合,则2种抗体具有重叠表位。为制备本发明合适抗体和根据本发明使用如重组、单克隆或多克隆抗体,能使用本领域已知的许多技术(参见例如kohler&milstein,nature256:495-497(1975);kozbor等,immunologytoday4:72(1983);cole等,第77-96页,收录于《单克隆抗体和癌症治疗》(monoclonalantibodiesandcancertherapy),alanr.liss出版有限公司(alanr.liss,inc.)(1985);coligan,《免疫学实验指南》(currentprotocolsinimmunology)(1991);harlow&lane,《抗体,实验室手册》(antibodies,alaboratorymanual)(1988);和goding,《单克隆抗体:原理和实践》(monoclonalantibodies:principlesandpractice)(第2版.1986))。编码感兴趣抗体重和轻链的基因能克隆自细胞,如编码单克隆抗体的基因能克隆自杂交瘤并用于生成重组单克隆抗体。编码单克隆抗体重和轻链的基因库也能制备自杂交瘤或浆细胞。重和轻链基因产物的随机组合产生有不同抗原特异性的大抗体库(参见例如kuby,《免疫学》(immunology)(第3版.1997))。生成单链抗体或重组抗体的技术(美国专利4,946,778,美国专利号4,816,567)能适应于生成本发明多肽的抗体。转基因小鼠或其他生物如其他哺乳动物也可用于表达人源化或人抗体(参见例如美国专利号5,545,807;5,545,806;5,569,825;5,625,126;5,633,425;5,661,016,marks等,bio/technology10:779-783(1992);lonberg等,nature368:856-859(1994);morrison,nature368:812-13(1994);fishwild等,naturebiotechnology14:845-51(1996);neuberger,naturebiotechnology14:826(1996);和lonberg&huszar,intern.rev.immunol.13:65-93(1995))。或者,噬菌体展示技术能用于鉴定特异性结合选定抗原的抗体和杂聚fab片段(参见例如mccafferty等,nature348:552-554(1990);marksetal.,biotechnology10:779-783(1992))。抗体也能变成双特异性,即能够识别2种不同抗原(参见例如wo93/08829,traunecker等,emboj.10:3655-3659(1991);和suresh等,《酶学方法》(methodsinenzymology)121:210(1986))。抗体也可以是异源缀合物,如2个共价连接抗体或免疫毒素(参见例如美国专利号4,676,980,wo91/00360;wo92/200373;和ep03089)。人源化或灵长类化非人抗体的方法为本领域熟知(例如美国专利号4,816,567;5,530,101;5,859,205;5,585,089;5,693,761;5,693,762;5,777,085;6,180,370;6,210,671;和6,329,511;wo87/02671;ep专利申请0173494;jones等.(1986)nature321:522;和verhoyen等.(1988)science239:1534)。人源化抗体进一步描述于例如winter和milstein(1991)nature349:293。一般,人源化抗体具有从非人来源引入的一个或多个氨基酸残基。这些非人氨基酸通常称为输入残基,其通常取自输入可变域。人源化能基本根据winter和同事的方法实施(参见例如morrison等,pnasusa,81:6851-6855(1984),jones等,nature321:522-525(1986);riechmann等,nature332:323-327(1988);morrison和oi,adv.immunol.,44:65-92(1988),verhoeyen等,science239:1534-1536(1988)和presta,curr.op.struct.biol.2:593-596(1992),padlan,molec.immun.,28:489-498(1991);padlan,molec.immun.,31(3):169-217(1994)),这是通过将啮齿动物cdr或cdr序列取代对应人抗体序列。因此,这类人源化抗体是嵌合抗体(美国专利号4,816,567),其中远小于完整的人可变域被来自非人物种的对应序列取代。在实践中,人源化抗体通常是人抗体,其中一些cdr残基和可能的一些fr残基由来自啮齿动物抗体类似位点的残基取代。例如,多核苷酸包括编码人源化免疫球蛋白框架区的第一序列和编码所需免疫球蛋白互补决定区的第二序列,所述多核苷酸能合成或通过组合适当cdna与基因组dna区段来生成。人恒定区dna序列能根据熟知程序分离自多种人细胞。“嵌合抗体”是抗体分子,其中恒定区或其部分改变、取代或交换,从而抗原结合位点(可变区)连接不同或改变种类、效应子功能和/或物种或者完全不同分子的恒定区,其赋予嵌合抗体新性质,例如酶、毒素、激素、生长因子、药物等;或(b)可变区或其部分,用具有不同或变化抗原特异性的可变区改变、取代或交换。本发明的优选抗体和用途包括人源化和/或嵌合单克隆抗体。本文提供的“治疗抗体”指用于治疗癌症、自体免疫疾病、移植排斥、心血管疾病或诸如本文所述其他疾病或病症的任何抗体或其功能片段。治疗抗体的非限制性示例包括鼠抗体、鼠源化或人源化嵌合抗体或人抗体,包括但不限于爱必妥(西妥昔单抗)、reopro(阿昔单抗)、舒莱(巴利昔单抗)、类克(英夫利昔);orthocloneokt3(muromonab-cd3);美罗华(利妥昔单抗)、百克沙(托西莫单抗)、修美乐(阿达木单抗)、坎帕斯(阿仑单抗)、舒莱(巴利昔单抗)、阿瓦斯丁(贝伐单抗)、cimzia(赛妥珠单抗)、赛尼哌(达克珠单抗)、soliris(依库丽单抗)、瑞体肤(依法珠单抗)、麦罗塔(吉妥珠单抗)、泽娃灵(替伊莫单抗)、tysabri(那他珠单抗)、索雷尔(奥马珠单抗)、synagis(帕利珠单抗)、维克替比(帕尼单抗)、诺适得(兰尼单抗)和赫塞汀(曲妥单抗)。熟知用于缀合治疗剂与抗体的技术(参见例如arnon等,"癌症治疗中用于免疫靶向药物的单克隆抗体(monoclonalantibodiesforimmunotargetingofdrugsincancertherapy)",收录于《单克隆抗体与癌症治疗》(monoclonalantibodiesandcancertherapy),reisfeld等(编),第243-56页(alanr.liss出版有限公司.1985);hellstrom等,"用于药物递送的抗体(antibodiesfordrugdelivery)",收录于《药物控释系统》(controlleddrugdelivery)(第2版),robinson等(编),第623-53页(马塞尔·德克尔出版社(marceldekker,inc.)1987);thorpe,"癌症治疗中细胞毒素剂的抗体载体:综述(antibodycarriersofcytotoxicagentsincancertherapy:areview)",收录于《单克隆抗体‘84:生物和临床应用》(monoclonalantibodies‘84:biologicalandclinicalapplications),pinchera等(编),第475-506页(1985);和thorpe等,"抗体-毒素偶联物的制备和细胞毒性特性(thepreparationandcytotoxicpropertiesofantibody-toxinconjugates)",immunol.rev.,62:119-58(1982))。本文所用的术语“抗体-药物缀合物”或“adc”指治疗剂缀合或共价结合抗体。本文所指的术语“治疗剂”是用于治疗或预防疾病如癌症的组合物。短语“特异性(或选择性)结合”抗体或或“特异性(或选择性)与…免疫反应”涉及蛋白或肽时,指确定蛋白存在的结合反应,通常在蛋白和其他生物制剂的异源群体中。因此,在指定免疫测定条件下,规定抗体与特定蛋白的结合是背景的至少2倍,且更常是背景的10-100倍。这种条件下的特异性结合通常需要根据对具体蛋白特异性而选择的抗体。例如,多克隆抗体能选择成仅获得抗体子集,其与选定抗原而非其他蛋白有特异性免疫反应。此选择可通过减去与其他分子交叉反应的抗体来实现。多种免疫测定模式可用于选择和特定蛋白特异性免疫反应的抗体。例如,固相elisa免疫测定常规用于选择和蛋白特异性免疫反应的抗体(参见例如harlow&lane,《使用抗体,实验室手册》(usingantibodies,alaboratorymanual)(1998),用于描述能测定特异免疫反应性的免疫测定模式和条件)。“配体”指能结合受体的物质,例如多肽或其他分子。术语“重组”涉及例如细胞、核酸、蛋白或载体使用时,表明细胞、核酸、蛋白或载体通过实验室方法改良或是其结果。因此,例如,重组蛋白包括由实验室方法生成的蛋白。重组蛋白能包括天然(非重组形式)蛋白内未发现的氨基酸残基或可包括经修饰如标记的氨基酸残基。当对于核酸部分使用时,术语“异源”表明核酸包括天然情况下彼此在相同关系中未发现的2个或更多子序列。例如,核酸通常重组生成,具有2个或更多来自不相关基因的序列,以排列形成新功能性核酸,如来自一种来源的启动子和来自另一来源的编码区。类似地,异源蛋白表明蛋白包括天然情况下彼此在相同关系中未发现的2个或更多子序列(如融合蛋白)。术语“分离”用于核酸或蛋白时,指示核酸或蛋白基本没有在天然状态下相关的其他细胞组分。例如,其可以是均一状态且可以是干的或在水性溶液中。纯度和均一性通常用分析化学技术确定,如聚丙烯酰胺凝胶电泳或高效液相层析。作为制品中所存在优势种类的蛋白基本被纯化。“接触”根据其一般意义使用,并且指允许至少2个不同种类(如包括生物分子或细胞在内的化合物)足够接近以反应、相互作用或物理接触。然而,应理解,所得反应产物能直接生成自添加的试剂之间的反应或来自一个或多个添加的试剂的中间物,其能在反应混合物中生成。术语“接触”可包括允许2个种类反应、相互作用或物理接触,其中2个种类可以是例如本文所述重组蛋白和抗原结合域。在实施方案中,接触包括例如允许本文所述重组蛋白与抗原结合域相互作用。“对照”样品或值是指用作参照的样品,通常是已知参照,用于和测试样品比较。例如,测试样品能取自测试条件,如存在测试化合物,与来自已知条件的样品作比较,如没有测试化合物(负对照),或存在已知化合物(正对照)。对照也能代表聚集自一些测试或结果的平均值。本领域技术人员应认识到,对照能设计用于评估任何数目的参数。例如,对照能设计成比较基于药理数据(如半衰期)或治疗措施(如比较副作用)的治疗益处。本领域技术人员应理解,哪个对照在给定情况下有价值且能够基于对比对照值来分析数据。对照也对确定数据显著性有价值。例如,若对照中给定参数的值广泛变化,则测试样品的变化被视作显著。“患者”或“有需要的对象”指患有或倾向于有疾病或病症的活生物体,所述疾病或病症能通过施用本文所提供组合物或药物组合物来治疗。非限制性示例包括人、其他哺乳动物、牛、大鼠、小鼠、狗、猴、山羊、绵羊、奶牛、鹿和其他非哺乳动物类动物。在一些实施方案中,患者是人。术语“疾病”或“病症”指患者或对象的存在状态或健康状态,所述患者或对象能用本文所提供化合物、药物组合物或方法处理。在实施方案中,所述疾病是癌症(如肺癌、卵巢癌、骨肉瘤、膀胱癌、宫颈癌、肝癌、肾癌、皮肤癌(例如merkel细胞癌)、睪丸癌、白血病、淋巴瘤、头颈癌、结直肠癌、前列腺癌、胰腺癌、黑素瘤、乳腺癌、成神经细胞瘤)。术语“治疗(treating或treatment)”指成功治疗或缓解任何损伤、疾病、病状或症状的任意标记,包括任何客观或主观参数如减轻;缓解;减少症状或导致损伤,患者更可忍受的病状或症状;减缓退化或减少的速度;使最后退化点不太衰落;改善患者身体或心理健康。治疗或缓解症状能基于客观或主观参数;包括身体检查、神经精神测试和/或精神鉴定的结果。术语“治疗”和其词形变化包括预防损伤、病状、症状或疾病。在实施方案中,“治疗”指治疗癌症。“有效量”是足以使化合物实现特定目的的量,这相对于没有化合物(如实现其施用的效果,治疗疾病,降低酶活性,增加酶活性,减少信号通路,或减少疾病或病症的一种或多种症状)。“治疗有效量”的示例是足以有助于治疗、预防或减少一种或多种疾病症状的量,这也能称为“治疗有效量”。“减少”一种或多种症状(和此短语的语法等同物)意味着减少症状严重度或频率或者消除症状。实际量取决于治疗目的,且可由本领域技术人员用已知技术确定(参见例如lieberman,pharmaceuticaldosageforms(第1-3卷,1992);lloyd,《药物复合的艺术、科学和技术》(theart,scienceandtechnologyofpharmaceuticalcompounding)(1999);pickar,《剂量计算》(dosagecalculations)(1999);和《雷明顿:药学科学和实践》remington:thescienceandpracticeofpharmacy,20thedition,2003,gennaro,ed.,lippincott,williams&wilkins)。本文所用的术语“her2蛋白”或“her2”包括任何重组或天然产生形式的受体酪氨酸蛋白激酶erbb-2,也称为cd340(分化簇340),原癌基因neu、erbb2(啮齿动物)或erbb2(人),或其维持her2活性的变体或同系物(如相较her2在至少50%、80%、90%、95%、96%、97%、98%、99%或100%活性内)。在一些方面,所述变体或同系物相较天然产生的her2蛋白,在完整序列或部分序列(如50、100、150或200个连续氨基酸部分)中具有至少90%、95%、96%、97%、98%、99%或100%氨基酸序列相同性。在实施方案中,所述her2蛋白与uniprot参考号p04626所鉴别的蛋白基本相同或是与其具有高相同性的变体或同系物。本文所用的术语“egfr蛋白”或“egfr”包括任何重组或天然产生形式的表皮生长因子受体(egfr),在人中也称为erbb-1或her1,或其维持egfr活性的变体或同系物(如相较egfr在至少50%、80%、90%、95%、96%、97%、98%、99%或100%活性内)。在一些方面,所述变体或同系物相较天然产生的egfr蛋白,在完整序列或部分序列(如50、100、150或200个连续氨基酸部分)中具有至少90%、95%、96%、97%、98%、99%或100%氨基酸序列相同性。在实施方案中,所述egfr蛋白与uniprot参考号p00533所鉴别的蛋白基本相同或是与其具有高相同性的变体或同系物。本文所用的术语“cd19蛋白”或“cd19”包括任何重组或天然产生形式的b淋巴细胞抗原cd19,也称为cd19分子(分化簇19),b淋巴细胞表面抗原b4,t细胞表面抗原leu-12和cvid3,或其维持cd19活性的变体或同系物(如相较cd19在至少50%、80%、90%、95%、96%、97%、98%、99%或100%活性内)。在一些方面,所述变体或同系物相较天然产生的cd19蛋白,在完整序列或部分序列(如50、100、150或200个连续氨基酸部分)中具有至少90%、95%、96%、97%、98%、99%或100%氨基酸序列相同性。在实施方案中,所述cd19蛋白与uniprot参考号p15391所鉴别的蛋白基本相同或是与其具有高相同性的变体或同系物。本文所用的术语“cd20蛋白”或“cd20”包括任何重组或天然产生形式的b淋巴细胞抗原cd20或分化簇20(cd20),或其维持cd20活性的变体或同系物(如相较cd20在至少50%、80%、90%、95%、96%、97%、98%、99%或100%活性内)。在一些方面,所述变体或同系物相较天然产生的cd20蛋白,在完整序列或部分序列(如50、100、150或200个连续氨基酸部分)中具有至少90%、95%、96%、97%、98%、99%或100%氨基酸序列相同性。在实施方案中,所述cd20蛋白与uniprot参考号p11836所鉴别的蛋白基本相同或是与其具有高相同性的变体或同系物。重组蛋白组合物本文提供由t细胞表达的重组蛋白,能结合抗原结合域(如抗体、变体或其片段)并从而使t细胞靶向表达抗原结合域所结合抗原的细胞(如肿瘤细胞)。通过使t细胞所表达重组蛋白与抗原结合域结合以及抗原结合域与靶细胞所表达抗原结合,t细胞被活化,变成细胞毒性并从而消除靶细胞(癌细胞)。本文提供的重组蛋白允许迅速增加过继性免疫治疗功能并用于各种治疗和诊断目的。例如,包括其实施方案的本文所提供重组蛋白可用作指导效应t细胞(如自体t细胞)和治疗性抗体到其作用位点的方式,从而降低脱靶效应。本文提供的组合物允许快速有效地改变靶特异性,而不产生和优化个体cart细胞。本文提供的重组蛋白是连续的单链多肽,其包括例如非cdrfab结合肽结构域、胞内t细胞信号传导结构域和跨膜结构域,所述跨膜结构域连接非cdrfab结合肽结构域与胞内t细胞信号传导结构域。本文提供的重组蛋白可包括更多元件如间隔区、肽接头、胞内共刺激信号传导结构域,其都形成所述连续单链多肽的一部分。本文提供的连续单链多肽指一条多肽链,其包括彼此共价结合的元件,从而形成连续多肽链。因此,一方面,提供重组蛋白。所述重组蛋白包括:(i)非cdrfab结合肽结构域;(ii)胞内t细胞信号传导结构域;和(iii)跨膜结构域,其连接非cdrfab结合肽结构域与胞内t细胞信号传导结构域。在实施方案中,所述胞内t细胞信号传导结构域是cd3δ胞内t细胞信号传导结构域。本文提供的“非cdrfab结合肽结构域”指肽或包括肽的肽结构域,其能结合抗体、抗体变体或其片段的非cdr结合位点。在实施方案中,所述非cdrfab结合肽结构域是肽。在实施方案中,所述非cdrfab结合肽结构域包括肽。在实施方案中,所述非cdrfab结合肽结构域结合非cdr结合位点。在实施方案中,所述非cdrfab结合肽结构域是肽基部分。在实施方案中,所述肽基部分是公开的美国申请us20120301400a1所述部分,该申请通过引用全文纳入本文并用于所有目的。在实施方案中,所述非cdrfab结合肽结构域包括具有下式的肽部分:x0-x1-x2-x3-x4-x5-x6-x7-x8-x9-x10-x11-x12(i).在式(i),x0是ser或空。x1是ser、cys、gly,β-丙氨酸、二氨基丙酸、β-叠氮丙氨酸或空。x2是gln或空。x3是phe、tyr、β,β’-联苯-ala、his、asp、2-溴-l-苯丙氨酸、3-溴-l-苯丙氨酸、4-溴-l-苯丙氨酸、asn、gln、修饰的phe、可水合含羰基残基或含硼酸残基。x4是asp或asn。x5是leu、β,β’-联苯-ala、phe、trp、tyr、苯丙氨酸、色氨酸或酪氨酸的非天然类似物、可水合含羰基残基或含硼酸残基。x6是cys或ser。x7是cys、thr或ser。x8是受保护的arg、arg或ala。x9是cys、arg或ala。x10是leu、gln、glu、β,β’-联苯-ala、phe、trp、tyr;苯丙氨酸、色氨酸或酪氨酸的非天然类似物、可水合含羰基残基或含硼酸残基。x11是cys、gln、lys或arg。x12是ser、cys、gly、7-氨基庚酸、β-丙氨酸、二氨基丙酸、炔丙基甘氨酸、异天冬氨酸或空。任选地,将x1和x12连接形成环肽基部分。在实施方案中,所述非cdrfab结合肽结构域包括具有下式的肽部分:x0-x1-x2-x3-x4-x5-x6-x7-x8-x9-x10-x11-x12(i).在式(i),x0是ser或空。x1是ser、cys、gly、β-丙氨酸或空。x2是gln或空。x3是phe、tyr、his、asp、asn或gln。x4是asp或asn。x5是leu、phe、trp、tyr、色氨酸或酪氨酸。x6是cys或ser。x7是cys、thr或ser。x8是arg或ala。x9是cys、arg或ala。x10是leu、gln、glu、phe、trp、tyr、色氨酸或酪氨酸。x11是cys、gln、lys或arg。x12是ser、cys、gly、或空。任选地,将x1和x12连接形成环肽基部分。在实施方案中,所述非cdrfab结合肽结构域包括seqidno:32的序列。在实施方案中,所述非cdrfab结合肽结构域具有seqidno:32的序列。在实施方案中,所述重组蛋白还包括具有seqidno:37的序列的信号肽。在实施方案中,所述信号肽结合非cdrfab结合肽结构域的n末端。本文提供的术语“非cdr结合位点”指抗原结合域(如抗体、抗体变体或其片段的fab结构域)的结合位点,不包括抗体重链cdr残基和轻链cdr残基。“非cdr肽结合位点”是抗原结合域的某一区域,能非共价结合本文所提供重组蛋白的非cdrfab结合肽结构域。在实施方案中,所述非cdr结合位点包括框架区氨基酸残基。在实施方案中,所述非cdr结合位点包括重链或轻链的fr残基。在实施方案中,所述非cdr结合位点包括重链和轻链的fr残基。在实施方案中,所述非cdr结合位点包括所处位置对应kabat83位的残基,所处位置对应kabat30位的的残基或所处位置对应kabat52位的的残基。在实施方案中,所述非cdr结合位点包括所处位置对应kabat40位的残基,所处位置对应kabat41位的的残基,所处位置对应kabat30位的的残基,所处位置对应kabat52位的的残基,所处位置对应kabat83位的的残基或所处位置对应kabat85位的的残基。在实施方案中,所述非cdr结合位点包括所处位置对应kabat40位的的残基。在实施方案中,所述非cdr结合位点包括所处位置对应kabat41位的的残基。在实施方案中,所述非cdr结合位点包括所处位置对应kabat30位的的残基。在实施方案中,所述非cdr结合位点包括所处位置对应kabat52位的的残基。在实施方案中,所述非cdr结合位点包括所处位置对应kabat83位的的残基。在实施方案中,所述非cdr结合位点包括所处位置对应kabat85位的的残基。在实施方案中,所述形成非cdr结合位点的残基是公开的美国申请us20120301400a1所述残基,该申请通过引用全文纳入本文并用于所有目的。本文提供的非cdr结合位点也可称为“中间位结合位点”。在实施方案中,所述重组蛋白经非cdrfab结合肽结构域结合非cdr结合位点,其不影响(如适度影响)抗原结合域与表位结合。换言之,在实施方案中,占据非cdr结合位点不影响抗原结合。在实施方案中,所述非cdr结合位点与本文所提供的重组蛋白的非cdrfab结合肽结构域(如中间位)非共价相互作用,包括其实施方案。能与非cdrfab结合肽结构域(如中间位)相互作用的氨基酸残基可形成抗体、fab、抗体变体或其片段的部分。非cdr结合位点可经工程化到任何适当抗体、其变体或其片段内,从而形成有非cdr结合位点的抗原结合域(抗原结合域)。含非cdr结合位点的抗原结合域在本文中也称为“中间位使能抗体”、“中间位使能结构域”或“中间位使能抗体区域”。本文提供的“抗原结合域”是结合抗原(表位)的抗体、变体或其片段区域。本文所述的抗原结合域一般由各重和轻链的一个恒定及一个可变域构成(分别是vl、vh、cl和ch1)。补位或抗原结合位点在抗原结合域的n末端上形成。抗原结合域的2个可变域通常结合抗原上的表位。在实施方案中,所述抗原结合域形成抗体的部分。在实施方案中,所述抗原结合域形成治疗性抗体的部分。在实施方案中,所述抗原结合域形成fab的部分。在实施方案中,所述抗原结合域是fab。在实施方案中,所述抗原结合域包括重链恒定区(ch)和轻链恒定区(cl)。在实施方案中,所述重链恒定区(ch)是抗体或其片段的重链恒定区。在实施方案中,所述轻链恒定区(cl)是抗体或其片段的轻链恒定区。在实施方案中,所述重链恒定区(ch)是fab的恒定区。在实施方案中,所述轻链恒定区(cl)是fab的轻链恒定区。在实施方案中,所述重链恒定区(ch)是f(ab)’2二聚体的恒定区。在实施方案中,所述轻链恒定区(cl)是f(ab)’2二聚体的轻链恒定区。在实施方案中,所述抗原结合域包括fc结构域。在实施方案中,所述抗原结合域是人源化的抗原结合域。在实施方案中,所述抗原结合域是人源化的小鼠抗原结合域。在实施方案中,所述抗原结合域是曲妥单抗中间位使能结构域、帕妥珠单抗中间位使能结构域、m5a中间位使能结构域或利妥昔单抗中间位使能结构域。在实施方案中,所述抗原结合域是人源化利妥昔单抗中间位使能结构域。在实施方案中,本文提供的抗原结合域,包括其实施方案,与一种或多种已知抗体竞争抗原结合,特异性结合与之相同的抗原或表位,和/或包含所述一或多种已知抗体的一个、多个或所有cdr(或与所述cdr有至少或至少约75、80、85、90、91、92、93、94、95、96、97、98或99%相同性的cdr),例如如包括重链cdr1、2和/或3和/或轻链cdr1、2和/或3,所述已知抗体包括任何市售可得抗体,如阿巴伏单抗、阿昔单抗、阿达木单抗、阿德木单抗、阿仑单抗、阿妥莫单抗、喷替酸阿妥莫单抗、麻安莫单抗、麻安莫单抗(anatumomabmafenatox)、阿西莫单抗、阿特利单抗、巴利昔单抗、贝妥莫单抗、ectumomab、贝利单抗、benralizumab、贝伐单抗、本妥昔单抗、康纳单抗、卡罗单抗、卡罗单抗喷地肽、卡妥索单抗、赛妥珠单抗、clivatuzumabtetraxetan、达克珠单抗、狄诺塞麦、依库丽单抗、依决洛单抗、依法珠单抗、伊瑞西珠、厄妥索单抗、法索单抗、fbta05、fontolizumab、吉妥珠单抗、吉瑞昔单抗、戈利木单抗、替伊莫单抗、伊戈伏单抗、英利昔单抗、易普利姆玛、拉贝珠单抗、美泊利单抗、鼠源单克隆抗体、muromonab-cd3、那他珠单抗、耐昔妥珠单抗、尼妥珠单抗、奥法木单抗、奥马珠单抗、奥戈伏单抗、帕利珠单抗、帕尼单抗、兰尼单抗、利妥昔单抗、沙妥莫单抗、硫索单抗、替伊莫单抗、替伊莫单抗(ibritumomabtiuxetan)、托珠单抗、托西莫单抗、曲妥单抗、trbs07、优特克单抗、维西珠单抗、伏妥莫单抗、扎鲁木单抗和/或布罗达单抗;和/或安芦珠单抗、巴匹珠单抗、dalotuzumab,地昔单抗(demcizumab)、盖尼塔单抗、奥英妥珠单抗、马夫利列单抗、moxetumomabpasudotox、rilotumumab、西法木单抗、他尼珠单抗、tralokinumab、替西木单抗、urelumab,由杂交瘤10b5生成的抗体(参见edelson&unanue,curropinimmunol,2000年8月;12(4):425-31)、b6h12.2(abcam)或其他抗cd47抗体(参见chao等,cell,142,699–713,2010年9月3日)。在实施方案中,所述抗原结合域特异性结合选自下的抗原:ca-125、糖蛋白(gp)iib/iiia受体、tnf-α、cd52、tag-72、癌胚抗原(cea)、白介素-6受体(il-6r)、il-2、白介素-2受体a-链(cd25)、cd22、b细胞活化因子、白介素-5受体(cd125)、vegf、vegf-a、cd30、il-1β、前列腺特异膜抗原(psma)、cd3、epcam、egf受体(egfr)、muc1、人白介素-2受体、tac、rank配体、补体蛋白如c5、epcam、cd11a如人cd11a、整合素如α-vβ-3整合素、玻璃体结合蛋白受体αvβ3整合素、her2、neu、cd3、cd15、cd20(小和/或大环)、干扰素γ、cd33、ca-ix、tnfα、ctla-4、癌胚抗原、il-5、cd3ε、cam、α-4-整合素、ige如igefc区、rsv抗原如呼吸道合胞体病毒(rsv)的f蛋白、tag-72、nca-90(粒细胞细胞抗原)、il-6、gd2、gd3、il-12、il-23、il-17、ctaa16.88、il13、白介素-1β、β-淀粉样蛋白、igf-1受体(igf-1r)、δ-样配体4(dll4),粒细胞巨噬细胞集落刺激因子的α亚基、肝细胞生长因子、ifn-α、神经生长因子、il-13、cd326、程序性细胞死亡1配体1(pd-l1、a.k.a.cd274、b7-h1)、cd47和cd137。在实施方案中,所述抗原结合域是抗cd19蛋白、抗cd20蛋白、抗cd22蛋白、抗cd30蛋白、抗cd33蛋白、抗cd44v6/7/8蛋白、抗cd123蛋白、抗cea蛋白、抗egp-2蛋白、抗egp-40蛋白、抗erb-b2蛋白、抗erb-b2,3,4蛋白、抗fbp蛋白、抗胎儿型乙酰胆碱受体蛋白、抗gd2蛋白、抗gd3蛋白、抗her2/neu蛋白、抗il-13r-a2蛋白、抗kdr蛋白、抗k轻链蛋白、抗ley蛋白、抗l1细胞粘附分子蛋白、抗mage-a1蛋白、抗间皮素蛋白、抗鼠cmv感染细胞蛋白、抗muc2蛋白、抗nkgd2蛋白、抗癌胚抗原蛋白、抗pcsa蛋白、抗psma蛋白、抗taa(由mabife靶向)蛋白、抗egfr蛋白、抗tag-72蛋白或抗vegf-72蛋白。在实施方案中,所述抗原结合域不是西妥昔单抗。除了非共价结合非cdrfab结合肽结合域,抗原结合域可修饰(如基因或化学上)成包括治疗部分或者成像或可检测部分。因此,在实施方案中,所述抗原结合域包括治疗部分或可检测部分。本文提供的术语“治疗部分”根据其一般意义使用,指施用需要的对象时,具有治疗益处(如预防、根除、缓解所治疗的潜在疾病)的单价化合物。本文提供的治疗部分可包括担不限于肽、蛋白、核酸、核酸类似物、小分子、抗体、纳米抗体、酶、前药、细胞毒素剂(如毒素),包括但不限于蓖麻毒素、阿霉素、道诺霉素、紫杉醇、溴化乙锭、丝裂霉素、依托泊苷、替尼泊苷、长春新碱、长春花碱、秋水仙碱、二羟基炭疽菌素二酮、放线菌素d、白喉毒素、绿脓杆菌外毒素(pe)a、pe40、相思豆毒素和糖皮质激素。在实施方案中,所述治疗部分是本文所述抗癌剂或化疗剂。在实施方案中,所述治疗部分是核酸部分、肽部分或小分子药物部分。在实施方案中,所述治疗部分是核酸部分。在实施方案中,所述治疗部分是抗体部分。在实施方案中,所述治疗部分是肽部分。在实施方案中,所述治疗部分是小分子药物部分。在实施方案中,所述治疗部分是核酸酶。在实施方案中,所述治疗部分是免疫刺激剂。在实施方案中,所述治疗部分是毒素。在实施方案中,所述治疗部分是核酸酶。在实施方案中,所述治疗部分是细胞因子(如il-2)。在实施方案中,所述治疗部分包括非天然氨基酸。在实施方案中,所述治疗部分包括sirna。在实施方案中,所述治疗部分是sirna。在实施方案中,所述治疗部分包括反义核酸。在实施方案中,所述治疗部分是反义核酸。本文提供的“成像或可检测部分”是单价化合物,可通过光谱学、光化学、生化、免疫化学、化学或其他物理方式检测。在实施方案中,所述成像部分共价结合肽化合物。示范性成像部分不限于32p、放射性核素、正电子发射同位素、荧光染料、荧光团、抗体、生物发光分子、化学发光分子、光敏分子、金属、电子致密试剂、酶(如常用于elisa)、磁造影剂、量子点、纳米粒子、生物素、地高辛、半抗原和蛋白或能变为可检测的其他实体,如通过放射性标记纳入肽或抗体与靶肽特异性反应。可采用本领域已知缀合抗体与部分的任何方法,例如使用hermanson,《生物缀合技术》1996,圣地亚哥的学术出版社,所述方法。示范性荧光团包括荧光素、若丹明、gfp、香豆素、fitc、alexafluor、cy3、cy5、bodipy和花青染料。示范性放射性核素包括氟-18、镓-68和铜-64。示范性磁造影剂包括钆、氧化铁和铁铂矿和锰。在实施方案中,所述成像部分是生物发光分子。在实施方案中,所述成像部分是光敏分子。在实施方案中,所述成像部分是金属。在实施方案中,所述成像部分是纳米粒子。本文提供的重组蛋白包括多个结构域(如胞内t细胞信号传导结构域、跨膜结构域、间隔区、胞内共刺激信号传导结构域),其都形成连续单链多肽的部分。本文提供的“胞内t细胞信号传导结构域”包括能响应抗原结合本文所提供抗体区(包括其实施方案)提供主要信号传导的氨基酸序列。在实施方案中,所述胞内t细胞信号传导结构域的信号传导可导致表达其的t细胞活化。在实施方案中,所述胞内t细胞信号传导结构域的信号传导可导致表达其的t细胞增殖(细胞分裂)。在实施方案中,所述胞内t细胞信号传导结构域的信号传导可导致所述t细胞表达蛋白(如ctla-4、pd-1、cd28、cd69),本领域已知所述蛋白是活化t细胞的特征。在实施方案中,所述胞内t细胞信号传导结构域包括人cd3复合体δ链的信号传导结构域。在实施方案中,所述胞内t细胞信号传导结构域是cd3δ胞内t细胞信号传导结构域。在实施方案中,所述胞内t细胞信号传导结构域包括seqidno:34的序列。在实施方案中,所述胞内t细胞信号传导结构域是seqidno:34的序列。在实施方案中,所述胞内t细胞信号传导结构域包括seqidno:11的序列。在实施方案中,所述胞内t细胞信号传导结构域是seqidno:11的序列。对于本文提供的重组蛋白,跨膜结构域连接非cdrfab结合肽结构域和胞内t细胞信号传导结构域。在实施方案中,所述跨膜结构域在非cdrfab结合肽结构域与胞内t细胞信号传导结构域之间。换言之,跨膜结构域直接或间接(如经间隔子)连接非cdrfab结合肽结构域的c末端以及直接或间接连接胞内t细胞信号传导结构域的n末端。本文提供的“跨膜结构域”指形成部分生物膜的多肽。本文提供的跨膜结构域能够从膜一侧跨越生物膜(如细胞膜)到膜另一侧。在实施方案中,所述跨膜结构域从细胞膜的胞内侧跨越到胞外侧。跨膜结构域可包括非极性、疏水残基,其使本文所提供蛋白锚定于生物膜(如t细胞的细胞膜),包括其实施方案。考虑能够锚定本文所提供蛋白的任何跨膜结构域,包括其实施方案。在实施方案中,所述跨膜结构域是l-选择素。本文提供的“l-选择素”包括任何重组或天然产生形式的l-选择素蛋白,也称为cd62l,维持l-选择素活性(如相较l-选择素在至少50%、80%、90%、95%、96%、97%、98%、99%或100%活性内)的变体或同系物。在实施方案中,所述变体或同系物相较天然产生的l-选择素多肽,在完整序列或部分序列(如50、100、150或200个连续氨基酸部分)中具有至少90%、95%、96%、97%、98%、99%或100%氨基酸序列相同性。在实施方案中,所述l-选择素是由ncbi序列参考gi:262206315鉴别的蛋白,其同系物或功能片段。跨膜结构域的非限制性示例包括cd8α、cd4或cd3-δ的跨膜结构域。在实施方案中,所述跨膜结构域是cd8α跨膜结构域、cd28跨膜结构域、cd4跨膜结构域或cd3δ跨膜结构域。在实施方案中,所述跨膜结构域是cd28跨膜结构域。本文提供的术语“cd28跨膜结构域”包括任何重组或天然产生形式的cd28跨膜结构域,或维持cd28跨膜结构域活性(如相较cd28跨膜结构域在至少50%,80%,90%,95%,96%,97%,98%,99%或100%活性内)的其变体或同系物。在一些方面,所述变体或同系物相较天然产生的cd28跨膜结构域多肽,在完整序列或部分序列(如50,100,150或200个连续氨基酸部分)中具有至少90%、95%、96%、97%、98%、99%或100%氨基酸序列相同性。在实施方案中,所述cd28跨膜结构域是由seqidno:18或seqidno:2鉴别的蛋白,其变体、同系物或功能片段。在实施方案中,cd28是由ncbi序列参考gi:340545506鉴别的蛋白,其同系物或其功能片段。在实施方案中,所述跨膜结构域是由seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:18鉴别的蛋白结构域,其同系物或其功能片段。在实施方案中,所述跨膜结构域包括由seqidno:1、seqidno:2、seqidno:3、seqidno:4、seqidno:5、seqidno:6、seqidno:7、seqidno:8、seqidno:9、seqidno:10、seqidno:18鉴别的蛋白结构域,其同系物或其功能片段。同样,本文提供的术语“cd8α跨膜结构域”包括任何重组或天然产生形式的cd8α跨膜结构域,或维持cd8α跨膜结构域活性(如相较cd8α跨膜结构域在至少50%、80%、90%、95%、96%、97%、98%、99%或100%活性内)的其变体或同系物。在一些方面,所述变体或同系物相较天然产生的cd8α跨膜结构域多肽,在完整序列或部分序列(如50、100、150或200个连续氨基酸部分)中具有至少90%、95%、96%、97%、98%、99%或100%氨基酸序列相同性。本文提供的术语“cd4跨膜结构域”包括任何重组或天然产生形式的cd4跨膜结构域,或维持cd4跨膜结构域活性(如相较cd4跨膜结构域在至少50%、80%、90%、95%、96%、97%、98%、99%或100%活性内)的其变体或同系物。在一些方面,所述变体或同系物相较天然产生的cd4跨膜结构域多肽,在完整序列或部分序列(如50、100、150或200个连续氨基酸部分)中具有至少90%、95%、96%、97%、98%、99%或100%氨基酸序列相同性。本文提供的术语“cd3-δ跨膜结构域”包括任何重组或天然产生形式的cd3-δ跨膜结构域,或维持cd3-δ跨膜结构域活性(如相较cd3-δ跨膜结构域在至少50%、80%、90%、95%、96%、97%、98%、99%或100%活性内)的其变体或同系物。在一些方面,所述变体或同系物相较天然产生的cd3-δ跨膜结构域多肽,在完整序列或部分序列(如50、100、150或200个连续氨基酸部分)中具有至少90%、95%、96%、97%、98%、99%或100%氨基酸序列相同性。在实施方案中,所述重组蛋白包括连接非cdrfab结合肽结构域与跨膜结构域的间隔区。在实施方案中,所述间隔区在跨膜结构域与非cdrfab结合肽结构域之间。换言之,所述间隔区直接或间接(如经肽接头)连接非cdrfab结合肽结构域的c末端以及直接或间接(如经另一肽接头)连接跨膜结构域的n末端。因此,本文提供的重组蛋白可包括第一肽接头和第二肽接头,其中第一肽接头连接非cdrfab结合肽结构域的c末端与间隔区的n末端,第二肽接头连接间隔区的c末端与跨膜结构域的n末端。本文提供的“间隔区”是连接非cdrfab结合肽结构域与跨膜结构域的多肽。在实施方案中,所述非cdrfab结合肽结构域与抗原结合域(如fab)的亲和性相较没有间隔区时增加。在实施方案中,所述非cdrfab结合肽结构域与抗原结合域(如fab)之间的位阻在间隔区存在时降低。在实施方案中,所述间隔区包括fc区。就本文所提供组合物和方法考虑的间隔区示例包括但不限于免疫球蛋白分子或其分子(如igg1、igg2、igg3、igg4)和含突变的免疫球蛋白分子或其分子(如igg1、igg2、igg3、igg4),所述突变影响fc受体结合。在实施方案中,所述间隔区是igg(如igg4)片段,其中所述片段包括ch2结构域缺失。在实施方案中,所述间隔区是igg(如igg4)片段,其中所述片段包括ch3区。在实施方案中,所述间隔区是ch3区。在实施方案中,所述间隔区包括ch3区。在实施方案中,所述间隔区是ch2区。在实施方案中,所述间隔区包括ch2区。间隔区可以是肽接头。在实施方案中,所述间隔区是丝氨酸-甘氨酸接头。在实施方案中,所述间隔区具有序列ggsg。在实施方案中,所述间隔区包括序列ggsg。在实施方案中,所述间隔区具有序列gsgsgsgs(seqidno:24)。在实施方案中,所述间隔区包括序列gsgsgsgs(seqidno:24)。在实施方案中,所述间隔区长度是至少4个氨基酸。在实施方案中,所述间隔区长度是约4个氨基酸。在实施方案中,所述间隔区长度是4-250个氨基酸。间隔区可包括能够体内(如血浆)延长本文所提供蛋白半衰期的残基。在实施方案中,所述间隔区长度是约4个氨基酸。在实施方案中,所述间隔区长度是10个氨基酸。在实施方案中,所述间隔区长度是229个氨基酸。在实施方案中,所述间隔区是gggssgggsg(seqidno:31)。在实施方案中,所述间隔区包括序列gggssgggsg(seqidno:31)。间隔区可以是“pas化的(pasylated)”。术语“pas化的”或“pas化”以其通常意义使用,指氨基酸序列,由于其脯氨酸、丙氨酸和丝氨酸含量高,形成高水溶性生物聚合物。因此,在实施方案中,所述间隔区包括约200个组合脯氨酸、丙氨酸和丝氨酸残基。在实施方案中,所述间隔区包括约10-约200个组合脯氨酸、丙氨酸和丝氨酸残基。在实施方案中,所述间隔区包括亲水残基。在实施方案中,所述重组蛋白不包括间隔区。在实施方案中,所述间隔区包括序列seqidno:33。在实施方案中,所述间隔区具有序列seqidno:33。在实施方案中,所述重组蛋白包括连接非cdrfab结合肽结构域与间隔区的肽接头。在实施方案中,所述肽接头在非cdrfab结合肽结构域与间隔区之间。换言之,所述肽接头直接或间接(如经肽接头)连接非cdrfab结合肽结构域的c末端以及直接或间接(如经另一肽接头)连接间隔区的n末端。本文提供的肽接头(如第一或第二肽接头)可以是5-50个氨基酸长度。在实施方案中,所述肽接头(如第一或第二肽接头)是5-45个氨基酸长度。在实施方案中,所述肽接头(如第一或第二肽接头)是5-40个氨基酸长度。在实施方案中,所述肽接头(如第一或第二肽接头)是5-35个氨基酸长度。在实施方案中,所述肽接头(如第一或第二肽接头)是5-30个氨基酸长度。在实施方案中,所述肽接头(如第一或第二肽接头)是5-25个氨基酸长度。在实施方案中,所述肽接头(如第一或第二肽接头)是5-20个氨基酸长度。在实施方案中,所述肽接头(如第一或第二肽接头)是5-15个氨基酸长度。在实施方案中,所述肽接头(如第一或第二肽接头)是5-10个氨基酸长度。在实施方案中,所述肽接头(如第一或第二肽接头)长度是5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、34、3536、37、38、39、40、41、42、43、44、45、46、47、48、49或50个氨基酸。在实施方案中,所述肽接头(如第一或第二肽接头)是18个氨基酸长度。在实施方案中,所述肽接头具有序列seqidno:25。在实施方案中,所述肽接头包括序列seqidno:25。在实施方案中,所述肽接头是序列sapassasapsaasapag(seqidno:26)。在实施方案中,所述肽接头是第一肽接头且重组蛋白包括第二肽接头,其中第二肽接头连接了间隔区与跨膜结构域。因此,在实施方案中,所述第二肽接头在间隔区与跨膜结构域之间。换言之,所述第一肽接头连接非cdrfab结合肽结构域的c末端并连接间隔区的n末端;第二肽接头连接间隔区的c末端并连接跨膜结构域的n末端。在实施方案中,本文提供的重组蛋白包括胞内共刺激信号传导结构域,其连接跨膜结构域与胞内t细胞信号传导结构域。在实施方案中,所述胞内共刺激信号传导结构域在跨膜结构域与胞内t细胞信号传导结构域之间。换言之,所述胞内共刺激信号传导结构域直接或间接(如经肽接头)连接跨膜结构域的c末端或间接(如经另一肽接头)连接胞内t细胞信号传导结构域的n末端。本文提供的“胞内共刺激信号传导结构域”包括能够提供共刺激信号传导的氨基酸序列,所述信号传导响应抗原与本文所提供抗体区的结合,包括其实施方案。在实施方案中,所述共刺激信号传导结构域的信号传导引起细胞因子生成和表达其的t细胞增殖。在实施方案中,所述胞内共刺激信号传导结构域是cd28胞内共刺激信号传导结构域、4-1bb胞内共刺激信号传导结构域、icos胞内共刺激信号传导结构域或ox-40胞内共刺激信号传导结构域。在实施方案中,所述胞内共刺激信号传导结构域包括cd28胞内共刺激信号传导结构域。在实施方案中,所述胞内共刺激信号传导结构域是cd28胞内共刺激信号传导结构域。在实施方案中,所述胞内共刺激信号传导结构域包括4-1bb胞内共刺激信号传导结构域。在实施方案中,所述胞内共刺激信号传导结构域是4-1bb胞内共刺激信号传导结构域。在实施方案中,所述胞内共刺激信号传导结构域是cd28胞内共刺激信号传导结构域、4-1bb胞内共刺激信号传导结构域、icos胞内共刺激信号传导结构域、ox-40胞内共刺激信号传导结构域或其任何组合。表2列出示范性胞内共刺激信号传导结构域,包括序列和登录号。在实施方案中,所述胞内共刺激信号传导结构域包括由seqidno:12、seqidno:13、seqidno:14、seqidno:15或seqidno:16鉴别的蛋白。在实施方案中,所述胞内共刺激信号传导结构域是seqidno:12、seqidno:13、seqidno:14、seqidno:15或seqidno:16。在实施方案中,所述胞内共刺激信号传导结构域是seqidno:13。在实施方案中,所述胞内共刺激信号传导结构域是seqidno:14。在实施方案中,所述重组蛋白包括可检测结构域,其结合胞内t细胞信号传导结构域的c末端。在实施方案中,所述可检测结构域是截短的cd19(cd19t)结构域。术语“cd19t”指缺乏胞内信号传导功能的截短的cd19蛋白。本文所用的截短的cd19是用作可检测结构域的惰性分子,从而鉴定t细胞,包括本文提供的重组蛋白。在实施方案中,所述可检测结构域包括序列seqidno:22。在实施方案中,所述可检测结构域是序列seqidno:22。在实施方案中,所述重组蛋白包括自切割肽基序列,其连接胞内t细胞信号传导结构域与可检测结构域。在实施方案中,所述自切割肽基接头序列是t2a序列或2a序列。在实施方案中,所述自切割肽基序列在胞内t细胞信号传导结构域与可检测结构域之间。换言之,所述自切割肽基序列直接或间接(如经肽接头)连接胞内t细胞信号传导结构域的c末端以及直接或间接(如经另一肽接头)连接可检测结构域的n末端。在实施方案中,所述自切割肽基接头具有序列pvkqllnfdllklagdvesnpgp(seqidno:27)。在实施方案中,所述自切割肽基接头具有马甲型鼻炎病毒序列的序列。在实施方案中,所述自切割肽基接头具有序列qctnyallklagdvesnpgp(seqidno:28)。在实施方案中,所述自切割肽基具有猪捷申病毒1型序列的序列。在实施方案中,所述自切割肽基具有序列atnfsllkqagdveenpgp(seqidno:29)。在实施方案中,所述自切割肽基接头具有thoseaasigna病毒序列的序列。在实施方案中,所述自切割肽基接头具有序列egrgslltcgdvesnpgp(seqidno:30)。在实施方案中,所述自切割肽基接头具有序列seqidno:21。在实施方案中,所述自切割肽基接头是序列seqidno:21。在实施方案中,所述重组蛋白形成细胞的部分。在实施方案中,所述重组蛋白形成t细胞的部分。在实施方案中,所述跨膜结构域形成t细胞细胞膜的部分。如上所述,本文提供的重组蛋白可结合抗原结合域。本文提供的重组蛋白元件包括其实施方案(如非cdrfab结合肽结构域、跨膜结构域、胞内t细胞信号传导结构域、胞内共刺激信号传导结构域),彼此共价结合并因而形成连续单链多肽,重组蛋白非共价结合抗原结合域。在实施方案中,所述非cdrfab结合肽结构域可结合抗原结合域。在实施方案中,所述非cdrfab结合肽结构域非共价结合抗原结合域。如上所述,抗原结合域可以是fab、igg或双特异性抗体。在实施方案中,所述抗原结合域是西妥昔单抗中间位使能结构域、曲妥单抗中间位使能结构域、帕妥珠单抗中间位使能结构域、m5a中间位使能结构域或利妥昔单抗中间位使能结构域。在实施方案中,所述抗原结合域能够结合癌症抗原。在实施方案中,所述抗原结合域能够非共价结合癌症抗原。在实施方案中,所述癌症抗原是her2、egfr、cd19或cd20。在实施方案中,所述癌症抗原形成部分细胞。在实施方案中,所述癌症抗原在细胞表面表达。在实施方案中,所述细胞是癌细胞。在实施方案中,所述癌是卵巢癌、肾细胞癌、b细胞恶性肿瘤、白血病、淋巴瘤、乳腺癌、结直肠癌、前列腺癌、成神经细胞瘤、黑素瘤、成神经管细胞瘤、肺癌、骨肉瘤、成胶质细胞瘤或胶质瘤。本文提供的组合物可包括多种(即多于一种,至少2种)本文所提供重组蛋白,包括其实施方案。组合物包括一种以上本文所提供重组蛋白,包括其实施方案时,所述重组蛋白在本文称为第一、第二、第三、第四等重组蛋白。因此,形成所述第一、第二、第三、第四等重组蛋白的元件在本文分别称为第一、第二、第三或第四非cdrfab结合肽结构域,第一、第二、第三或第四胞内t细胞信号传导结构域,第一、第二、第三或第四跨膜结构域,第一、第二、第三或第四间隔区,或者第一、第二、第三或第四胞内共刺激信号传导结构域。组合物包括多种本文所提供重组蛋白,包括其实施方案时,所述重组蛋白可不同或相同。换言之,重组蛋白可包括相同结构域或不同结构域(如非cdrfab结合肽结构域,胞内t细胞信号传导结构域,跨膜结构域,间隔区,胞内共刺激信号传导结构域),或其能结合相同或不同抗原结合域。本文所提供组合物包括多种本文所提供重组蛋白时,所述重组蛋白可通过非共价结合其各自间隔区而相互二聚化。例如,第一重组蛋白可包括第一ch3结构域,其非共价结合第二重组蛋白的第二ch3结构域。因此,在实施方案中,所述重组蛋白是第一重组蛋白,非cdrfab结合肽结构域是第一非cdrfab结合肽结构域,胞内t细胞信号传导结构域是第一胞内t细胞信号传导结构域,跨膜结构域是第一跨膜结构域,间隔区是第一间隔区且胞内共刺激信号传导结构域是第一胞内共刺激信号传导结构域。在实施方案中,所述第一重组蛋白非共价结合第二重组蛋白,第二重组蛋白包括:(i)第二非cdrfab结合肽结构域;(ii)第二胞内t细胞信号传导结构域;(iii)第二跨膜结构域,连接第二非cdrfab结合肽结构域与第二胞内t细胞信号传导结构域;和(iv)第二间隔区,其中第二间隔区连接第二非cdrfab结合肽结构域与第二跨膜结构域,其中第一间隔区非共价结合第二间隔区。在实施方案中,所述第一间隔区和第二间隔区是第一恒定重链3(ch3)结构域和第二恒定重链3(ch3)结构域。在实施方案中,所述第一非cdrfab结合肽结构域和第二非cdrfab结合肽结构域在化学性质上不同。在实施方案中,所述第一非cdrfab结合肽结构域和第二非cdrfab结合肽结构域在化学性质上相同。在实施方案中,所述第一非cdrfab结合肽结构域非共价结合第一抗原结合域。在实施方案中,所述第二非cdrfab结合肽结构域非共价结合第二抗原结合域。在实施方案中,所述第一抗原结合域和第二抗原结合域在化学性质上不同或相同。在实施方案中,所述第一抗原结合域和第二抗原结合域独立地是西妥昔单抗中间位使能结构域、曲妥单抗中间位使能结构域、帕妥珠单抗中间位使能结构域、m5a中间位使能结构域或利妥昔单抗中间位使能结构域。在一个实施方案中,所述重组蛋白包括seqidno:32的非cdrfab结合肽结构域,seqidno:33的间隔区,seqidno:18的cd28跨膜结构域,seqidno:13的cd28胞内共刺激信号传导结构域,seqidno:34的cd3δ胞内t细胞信号传导结构域,seqidno:21的自切割肽基接头序列和seqidno:22的可检测结构域。在一个实施方案中,所述重组蛋白包括seqidno:32的非cdrfab结合肽结构域,seqidno:33的间隔区,seqidno:18的cd28跨膜结构域,seqidno:14的4-1bb胞内共刺激信号传导结构域,seqidno:34的cd3δ胞内t细胞信号传导结构域,seqidno:21的自切割肽基接头序列和seqidno:22的可检测结构域。在一个实施方案中,所述重组蛋白包括seqidno:32的非cdrfab结合肽结构域,seqidno:33的间隔区,seqidno:18的cd28跨膜结构域,seqidno:13的cd28胞内共刺激信号传导结构域和seqidno:34的cd3δ胞内t细胞信号传导结构域。在一个实施方案中,所述重组蛋白包括seqidno:32的非cdrfab结合肽结构域,seqidno:33的间隔区,seqidno:18的cd28跨膜结构域,seqidno:14的4-1bb胞内共刺激信号传导结构域和seqidno:34的cd3δ胞内t细胞信号传导结构域。在一个实施方案中,所述重组蛋白包括seqidno:32的非cdrfab结合肽结构域,seqidno:25的肽接头,seqidno:33的间隔区,seqidno:18的cd28跨膜结构域,seqidno:13的cd28胞内共刺激信号传导结构域,seqidno:34的cd3δ胞内t细胞信号传导结构域,seqidno:21的自切割肽基接头序列和seqidno:22的可检测结构域。在一个实施方案中,所述重组蛋白包括seqidno:32的非cdrfab结合肽结构域,seqidno:25的肽接头,seqidno:33的间隔区,seqidno:18的cd28跨膜结构域,seqidno:14的4-1bb胞内共刺激信号传导结构域,seqidno:34的cd3δ胞内t细胞信号传导结构域,seqidno:21的自切割肽基接头序列和seqidno:22的可检测结构域。在一个实施方案中,所述重组蛋白包括seqidno:37的信号肽。在一个实施方案中,所述信号肽结合非cdrfab结合肽结构域的n末端。在一个实施方案中,所述重组蛋白包括seqidno:32的非cdrfab结合肽结构域,seqidno:25的肽接头,seqidno:33的间隔区,seqidno:18的cd28跨膜结构域,seqidno:13的cd28胞内共刺激信号传导结构域和seqidno:34的cd3δ胞内t细胞信号传导结构域。在一个实施方案中,所述重组蛋白包括seqidno:32的非cdrfab结合肽结构域,seqidno:25的肽接头,seqidno:33的间隔区,seqidno:18的cd28跨膜结构域,seqidno:14的4-1bb胞内共刺激信号传导结构域和seqidno:34的cd3δ胞内t细胞信号传导结构域。在一个实施方案中,所述重组蛋白包括序列seqidno:35。在一个实施方案中,所述重组蛋白是序列seqidno:35。在一个实施方案中,所述重组蛋白包括序列seqidno:36。在一个实施方案中,所述重组蛋白是序列seqidno:36。在实施方案中,所述重组蛋白从n末端到c末端包括:非cdrfab结合肽结构域,间隔区,cd28跨膜结构域,cd28胞内共刺激信号传导结构域,cd3δ胞内t细胞信号传导结构域,自切割肽基接头序列和可检测结构域。在实施方案中,所述重组蛋白从n末端到c末端包括:非cdrfab结合肽结构域,间隔区,cd28跨膜结构域,4-1bb胞内共刺激信号传导结构域,cd3δ胞内t细胞信号传导结构域,自切割肽基接头序列和可检测结构域。在实施方案中,所述重组蛋白从n末端到c末端包括:非cdrfab结合肽结构域,间隔区,cd28跨膜结构域,cd28胞内共刺激信号传导结构域和cd3δ胞内t细胞信号传导结构域。在实施方案中,所述重组蛋白从n末端到c末端包括:非cdrfab结合肽结构域,间隔区,cd28跨膜结构域,4-1bb胞内共刺激信号传导结构域和cd3δ胞内t细胞信号传导结构域。在实施方案中,所述重组蛋白从n末端到c末端包括:非cdrfab结合肽结构域,肽接头,间隔区,cd28跨膜结构域,cd28胞内共刺激信号传导结构域,cd3δ胞内t细胞信号传导结构域,自切割肽基接头序列和可检测结构域。在实施方案中,所述重组蛋白从n末端到c末端包括:非cdrfab结合肽结构域,肽接头,间隔区,cd28跨膜结构域,4-1bb胞内共刺激信号传导结构域,cd3δ胞内t细胞信号传导结构域,自切割肽基接头序列和可检测结构域。在实施方案中,所述重组蛋白从n末端到c末端包括:非cdrfab结合肽结构域,肽接头,间隔区,cd28跨膜结构域,cd28胞内共刺激信号传导结构域和cd3δ胞内t细胞信号传导结构域。在实施方案中,所述重组蛋白从n末端到c末端包括:非cdrfab结合肽结构域,肽接头,间隔区,cd28跨膜结构域,4-1bb胞内共刺激信号传导结构域和cd3δ胞内t细胞信号传导结构域。核酸组合物本文提供编码本文所提供重组蛋白的核酸,包括其实施方案。因此,一方面,提供编码本文所提供重组蛋白的核酸,包括其实施方案。另一方面,提供含本文所提供核酸的表达载体,包括其实施方案。在实施方案中,所述表达载体是慢病毒或致癌反转录病毒。在实施方案中,所述表达载体是慢病毒。在实施方案中,所述表达载体是致癌反转录病毒。细胞组合物本文提供的重组蛋白和核酸可形成部分细胞(即纳入细胞和/或由细胞表达)。因此,一方面,提供含本文所提供表达载体的t淋巴细胞,包括其实施方案。另一方面,提供含本文所提供重组蛋白的t淋巴细胞,包括其实施方案。本文提供的部分重组蛋白可形成其所表达细胞的细胞膜的部分。例如,跨膜结构域能够从膜一侧跨越t细胞细胞膜到膜另一侧。在实施方案中,所述跨膜结构域从细胞膜的胞内侧跨越到胞外侧。因此,非cdrfab结合肽结构域和间隔区位于细胞膜的胞外侧,而胞内t细胞信号传导结构域位于细胞的胞内侧。在实施方案中,所述跨膜结构域在t淋巴细胞的细胞膜内。在实施方案中,所述t淋巴细胞是自体t淋巴细胞。在实施方案中,所述t淋巴细胞是异源t淋巴细胞。在实施方案中,所述非cdrfab结合肽结构域可结合抗原结合域。在实施方案中,所述抗原结合域是fab、igg或双特异性抗体。在实施方案中,所述抗原结合域结合癌症抗原。抗原结合域可以是含第一fab结构域和第二fab结构域的抗体,重组蛋白可结合第一fab结构域的非cdr结合位点且第二fab结构域可结合癌症抗原。在实施方案中,所述重组蛋白结合第一fab结构域的非cdr结合位点且第一fab结构域结合癌症抗原。在实施方案中,所述重组蛋白结合第一fab结构域的非cdr结合位点,第一fab结构域结合第一癌症抗原且第二fab结构域结合第二癌症抗原。在实施方案中,所述第一重组蛋白结合第一fab结构域的非cdr结合位点,第二重组蛋白结合第二fab结构域的非cdr结合位点。在另一实施方案中,所述第一fab结构域结合第一癌症抗原且第二fab结构域结合第二癌症抗原。在实施方案中,所述癌症抗原是her2、egfr、cd19或cd20。在实施方案中,所述抗原结合域是癌症抗原结合域。在实施方案中,所述抗原结合域是西妥昔单抗中间位使能结构域、曲妥单抗中间位使能结构域、帕妥珠单抗中间位使能结构域、m5a中间位使能结构域或利妥昔单抗中间位使能结构域。治疗方法包括其实施方案在内的本文所提供组合物,用于提供疾病如癌症的有效治疗。因此,一方面,提供治疗癌症的方法。所述方法包括向需要的对象施用有效量的本文所提供的t淋巴细胞,包括其实施方案,以及有效量的能够结合非cdrfab结合肽结构域的抗原结合域,其中所述抗原结合域是癌症抗原结合域。在实施方案中,所述t淋巴细胞和抗原结合域同时或依序施用。在实施方案中,所述t淋巴细胞和抗原结合域同时施用。t淋巴细胞和抗原结合域可伴随(如作为混合物)、分开但同时(如经分开的静脉通道)或依序(如首先施用一种物质,然后施用第二物质)施用。因此,术语组合用于指伴随、同时或依序施用t淋巴细胞和抗原结合域。在t淋巴细胞和抗原结合域依序施用的实施方案中,所述t淋巴细胞在第一时间点施用且抗原结合域在第二时间点施用,其中第一时间点在第二时间点之前。根据对象具体特征和所选治疗类型,治疗过程在个体基础上最优确定。如本文所示,治疗能每天一次、每天二次、双周、每月或在任何适用基础上治疗有效地施用于对象。治疗能单独施用或联合本文所示或本领域已知的任何其他治疗。额外治疗能与第一治疗同时、不同时间或以完全不同治疗安排(如第一治疗可以是每天,而额外治疗是每周)施用。因此,在实施方案中,所述t淋巴细胞和抗原结合域同时或依序施用。在实施方案中,所述t淋巴细胞在第一时间点施用且抗原结合域在第二时间点施用,其中第一时间点在第二时间点之前。在实施方案中,所述第二时间点离开第一时间点小于约120、90、60、50、40、30、20、19、18、17、16、15、14、13、12、10、11、9、8、7、6、5、4、3、2或1天内。在实施方案中,所述第二时间点离开第一时间点小于约120天内。在实施方案中,所述第二时间点离开第一时间点小于约90天内。在实施方案中,所述第二时间点离开第一时间点小于约60天内。在实施方案中,所述第二时间点离开第一时间点小于约50天内。在实施方案中,所述第二时间点离开第一时间点小于约40天内。在实施方案中,所述第二时间点离开第一时间点小于约30天内。在实施方案中,所述第二时间点离开第一时间点小于约20天内。在实施方案中,所述抗原结合域在第一时间点施用且t淋巴细胞在第二时间点施用,其中第一时间点在第二时间点之前。在实施方案中,所述第二时间点离开第一时间点小于约120、90、60、50、40、30、20、19、18、17、16、15、14、13、12、10、11、9、8、7、6、5、4、3、2或1天内。在实施方案中,所述第二时间点离开第一时间点小于约120天内。在实施方案中,所述第二时间点离开第一时间点小于约90天内。在实施方案中,所述第二时间点离开第一时间点小于约60天内。在实施方案中,所述第二时间点离开第一时间点小于约50天内。在实施方案中,所述第二时间点离开第一时间点小于约40天内。在实施方案中,所述第二时间点离开第一时间点小于约30天内。在实施方案中,所述第二时间点离开第一时间点小于约20天内。在实施方案中,所述t淋巴细胞和抗原结合域在施用前混合。在实施方案中,所述方法包括:(i)在施用前,允许非cdrfab结合肽结构域体外结合抗原结合域,从而形成t淋巴细胞-重组蛋白复合体;和(ii)向对象施用t淋巴细胞-重组蛋白复合体,因而治疗对象的癌症。在实施方案中,所述t淋巴细胞和抗原结合域依序施用。在实施方案中,所述t淋巴细胞在第一时间点施用且所述抗原结合域在第二时间点施用,其中第一时间点在第二时间点之前。在实施方案中,所述抗原结合域在第一时间点施用且所述t淋巴细胞在第二时间点施用,其中第一时间点在第二时间点之前。在实施方案中,所述癌是卵巢癌、肾细胞癌、b细胞恶性肿瘤、白血病、淋巴瘤、乳腺癌、结直肠癌、前列腺癌、成神经细胞瘤、黑素瘤、成神经管细胞瘤、肺癌、骨肉瘤、成胶质细胞瘤或胶质瘤。在实施方案中,所述抗原结合域是西妥昔单抗中间位使能结构域、曲妥单抗中间位使能结构域、帕妥珠单抗中间位使能结构域、m5a中间位使能结构域或利妥昔单抗中间位使能结构域。本文所用的术语“癌症”指哺乳动物中发现的所有类型癌、赘生物或恶性肿瘤,包括白血病、淋巴瘤、黑素瘤、神经内分泌瘤、癌和肉瘤。可用本文所提供化合物、药物组合物或方法治疗的癌示例包括淋巴瘤、肉瘤、膀胱癌、骨癌、脑肿瘤、宫颈癌、结肠癌、食管癌、胃癌、头颈癌、肾癌、骨髓瘤、甲状腺癌、白血病、前列腺癌、乳腺癌(例如三阴性、er阳性、er阴性、化疗抗性、赫塞汀抗性、her2阳性、阿霉素抗性、它莫西芬抗性、导管癌、小叶癌、原发性、转移性)、卵巢癌、胰腺癌、肝癌(例如肝细胞癌)、肺癌(例如非小细胞肺癌、肺鳞状细胞癌、腺癌、大细胞肺癌、小细胞肺癌、类癌、肉瘤)、多形性成胶质细胞瘤、胶质瘤、黑素瘤、前列腺癌、去势难治性前列腺癌、乳腺癌、三阴性乳腺癌、成胶质细胞瘤、卵巢癌、肺癌、鳞状细胞癌(例如头部、颈部或食管)、结直肠癌、白血病、急性髓性白血病、淋巴瘤、b细胞淋巴瘤或多发性骨髓瘤。额外示例包括甲状腺癌、内分泌系统癌、脑癌、乳腺癌、宫颈癌、结肠癌、头颈癌、食管癌、肝癌、肾癌、肺癌、非小细胞肺癌、黑素瘤、间皮瘤、卵巢癌、肉瘤、胃癌、子宫癌或成神经管细胞瘤、霍奇金病、非霍奇金淋巴瘤、多发性骨髓瘤、成神经细胞瘤、胶质瘤、多形性成胶质细胞瘤、卵巢癌、横纹肌肉瘤、原发性血小板增多症、原发性巨球蛋白血症、原发性脑肿瘤、癌、恶性胰胰岛瘤(malignantpancreaticinsulanoma)、恶性类癌、尿膀胱癌、癌前皮肤病灶、睪丸癌、淋巴瘤、甲状腺癌、成神经细胞瘤、食管癌、泌尿生殖道癌、恶性高钙血症、子宫内膜癌、肾上腺皮质癌、内分泌或胰腺外分泌肿瘤、髓样甲状腺癌、甲状腺髓样癌、黑素瘤、结直肠癌、乳头状甲状腺癌、肝细胞癌、佩吉特乳头病、乳腺叶状肿瘤、小叶癌、导管癌、胰腺星状细胞癌、肝星状细胞癌或前列腺癌。术语“白血病”广义上指造血器官的进行性、恶行疾病,一般表征为血液及骨髓中白血球和其前体的畸形增殖及发育。白血病一般基于以下临床分类:(1)疾病急性或慢性的持续时间和特性;(2)所涉及细胞的类型;骨髓的(骨髓性)、淋巴的(淋巴原的)或单核细胞的;和(3)血液-白血病或非白血病性(亚白血病性)中异常细胞数的增加或未增加。可用本文所提供化合物、药物组合物或方法治疗的白血病示例包括例如急性非淋巴性白血病、慢性非淋巴性白血病、急性粒细胞白血病、慢性粒细胞白血病、急性早幼粒细胞白血病、成人t细胞白血病、非白血性白血病、白细胞增多性白血病、嗜碱性白血病、干细胞性白血病、牛白血病、慢性粒细胞白血病、皮肤白血病、干细胞性白血病、嗜酸性粒细胞白血病、格罗斯白血病、毛细胞白血病、成血细胞性白血病、成血细胞白血病、组织细胞性白血病、干细胞白血病、急性单核细胞白血病、白细胞减少性白血病、淋巴性白血病、成淋巴细胞性白血病、淋巴细胞性白血病、淋巴球性白血病、淋巴系白血病、淋巴肉瘤细胞白血病、肥大细胞白血病、巨核细胞性白血病、微髓细胞白血病(micromyeloblasticleukemia)、单核细胞性白血病、髓性白血病、髓细胞性白血病、髓性粒细胞白血病、髓细胞单核细胞白血病、内格利型白血病、浆细胞白血病、多发性骨髓瘤、浆细胞性白血病、早幼粒细胞白血病、里德尔细胞白血病、希林氏白血病、干细胞白血病、亚白血病性白血病或未分化细胞白血病。术语“肉瘤”一般指由如胚胎结缔组织的基质组成且一般由包埋于纤维状或均匀基质的紧密聚集细胞构成的肿瘤。可用本文所提供化合物、药物组合物或方法治疗的肉瘤包括软骨肉瘤、纤维肉瘤、淋巴肉瘤、黑肉瘤、粘液肉瘤、骨肉瘤、艾伯内西氏肉瘤(abemethy'ssarcoma)、脂肉瘤、脂肪肉瘤、泡状软组织肉瘤、成釉细胞肉瘤、葡萄状肉瘤、绿色肉瘤、绒毛膜癌、胚肉瘤、维尔姆斯肉瘤、子宫内膜肉瘤、基质肉瘤、尤文氏肉瘤、筋膜肉瘤、成纤维细胞性肉瘤、巨细胞肉瘤、粒细胞肉瘤、霍奇金肉瘤、多发性特发性出血性肉瘤、b细胞成免疫细胞肉瘤、淋巴瘤、t细胞成免疫细胞肉瘤、延森氏肉瘤、卡波济氏肉瘤、库普弗细胞肉瘤、血管肉瘤、白血病性肉瘤、恶性间叶瘤肉瘤、骨膜外肉瘤、网状细胞肉瘤、劳氏肉瘤、浆液囊性肉瘤、滑膜肉瘤或毛细血管扩张性肉瘤。术语“黑素瘤”用于指皮肤和其他器官的黑素细胞系统引起的肿瘤。可用本文所提供化合物、药物组合物或方法治疗的黑素瘤包括例如肢端雀斑样痣黑素瘤、无黑素性黑素瘤、良性幼年黑素瘤、cloudman黑素瘤、s91黑素瘤、harding-passey黑素瘤、少年黑素瘤、恶性雀斑样痣黑素瘤、恶性黑素瘤、结节性黑素瘤、甲下黑素瘤或浅表扩散性黑素瘤。术语“癌”指由上皮细胞组成的恶性新生长,倾向于渗透周边组织并引起转移。可用本文所提供化合物、药物组合物或方法治疗的癌示例包括例如甲状腺髓样癌、家族性甲状腺髓质癌、腺泡癌、腺泡状癌、囊性腺样癌、腺样囊性癌、腺癌、肾上腺皮质癌、肺泡癌、肺泡细胞癌、基底细胞癌、基底样细胞瘤、基底样癌、基底鳞状细胞癌、细支气管肺泡细胞癌、细支气管癌、支气管癌、脑样癌、胆管细胞癌、绒膜上皮癌、胶样癌、粉刺性癌、子宫体癌、筛状癌、铠甲状癌、皮肤癌、柱状癌、柱状细胞癌、导管癌、腺管癌、硬癌、胚胎性癌、髓样癌、表皮样癌、腺样上皮细胞癌、外植癌、溃疡性癌、纤维癌、凝胶样癌、胶状癌、巨细胞性癌、巨细胞癌、腺癌、粒层细胞癌、基底细胞癌、多血癌、肝细胞癌、hurthle细胞癌、胶样癌、肾上腺样癌、幼稚型胚胎性癌、原位癌、表皮内癌、上皮内癌、侵蚀性溃疡、库尔奇茨基细胞癌、大细胞癌、豆状癌、豆状癌、脂肪瘤、小叶癌、淋巴上皮癌、髓样癌、髓质癌、黑色素癌、软癌、粘液癌、粘液癌、(carcinomamuciparum)、粘液细胞癌、粘液表皮样癌、粘液癌(carcinomamucosum)、粘液癌(mucouscarcinoma)、粘液瘤样癌、鼻咽癌、燕麦细胞癌、骨样癌、骨化性癌、乳头状癌、门静脉周癌、浸润前癌、棘细胞癌、脑样癌、肾细胞癌、储备细胞癌、肉瘤样癌、施奈德癌、硬癌、阴囊癌、印戒细胞癌、单纯癌、小细胞癌、马铃薯状癌、球状细胞癌、梭形细胞癌、髓样癌、鳞状癌、鳞状细胞癌、串癌(stringcarcinoma)、毛细管扩张性癌、血管扩张性癌、移行细胞癌、结节性皮癌、小管癌、结节状皮癌、疣状癌或绒毛状癌。本文所用的术语“转移”、“转移性”和“转移癌症”能互换使用并且指增殖性疾病或紊乱如癌症,从一个器官扩散到另一非相邻器官或身体部分。癌症在初始位点如乳房出现,该位置称为原发性癌,如原发性乳腺癌。原发性肿瘤或初始位点处的一些癌细胞获得渗透和浸润局部区域中周边正常组织的能力和/或渗透淋巴系统或血管系统壁在系统中循环到身体其他位点和组织的能力。形成自原发性肿瘤中癌细胞的第二临床可检测肿瘤被称为转移或继发性肿瘤。当癌细胞转移时,推定该转移瘤和其细胞与原始瘤的类似。因此,如果肺癌转移到乳房,在乳房位点的继发性肿瘤由异常肺细胞和非异常乳房细胞组成。乳房处的继发性肿瘤被称为转移性肺癌。因此,短语转移癌指其中对象具有或曾经有原发性肿瘤并且有一种或多种继发性肿瘤的疾病。短语非转移癌或患非转移癌的对象涉及其中对象有原发性肿瘤,但没有一种或多种继发性肿瘤的疾病。例如,转移性肺癌指患有原发性肺肿瘤或有原发性肺肿瘤史,且在第二位置或多个位置如乳房有一种或多个继发性肿瘤的对象的疾病。“抗癌剂”根据其一般意义使用,指具有抗肿瘤性质或者抑制细胞生长或增殖能力的组合物(如化合物、药物、拮抗剂、抑制剂、调节剂)。在实施方案中,抗癌剂是化学疗剂。在实施方案中,抗癌剂是本文所鉴定在治疗癌症方法中具有效用的的药剂。在实施方案中,抗癌剂是由fda或美国以外国家类似管理机构批准的用于治疗癌的药剂。术语“相关”或“与…相关”在与疾病(如癌症(例如前列腺癌、肾癌、转移癌、黑素瘤、去势难治性前列腺癌、乳腺癌、三阴性乳腺癌、成胶质细胞瘤、卵巢癌、肺癌、鳞状细胞癌(如头、颈或食管)、结直肠癌、白血病、急性髓性白血病、淋巴瘤、b细胞淋巴瘤或多发性骨髓瘤))相关的物质或物质活性或功能背景下,指疾病(如肺癌、卵巢癌、骨肉瘤、膀胱癌、宫颈癌、肝癌、肾癌、皮肤癌(如merkel细胞癌)、睪丸癌、白血病、淋巴瘤、头颈癌、结直肠癌、前列腺癌、胰腺癌、黑素瘤、乳腺癌、成神经细胞瘤)由物质或者物质活性或功能导致(全部或部分),或疾病症状由物质或者物质活性或功能导致(全部或部分)。“化疗剂(chemotherapeutic或chemotherapeuticagent)”根据其一般意义使用,指具有抗肿瘤性质或者抑制细胞生长或增殖能力的组合物或化合物。本文所用的术语“异常的”指与正常的不同。当用于描述酶活性时,异常的指高于或小于正常对照或是正常非患病对照样品均值的活性。异常的活性可指导致疾病的活性量,其中使异常活性恢复到正常或非疾病相关量(如通过使用本文所述方法)引起疾病或者一种或多种疾病症状减少。实施例cart细胞显示治疗液体瘤的显著成功并且迅速扩大到治疗实体瘤和其他疾病。当前方法是建立靶向单抗原的cart细胞。尽管对消除表达指定抗原的细胞有效,不表达该抗原的肿瘤细胞幸免且能增殖,通常变得更具侵入性。因此,为靶向这些细胞,需要建立表达不同肿瘤靶向scfv的全新cart细胞。在此,申请人用中间位技术解决此问题。特定地,申请人用超高亲和性中间位(非cdrfab结合肽结构域)取代肿瘤靶向scfv。肿瘤特异性随后用抗原特异性、中间位使能fab或mab(抗原结合域)增加。申请人使用中间位-相互作用以建立通用cart细胞。特定地,申请人用中间位(非cdrfab结合肽结构域)取代抗原靶向区域,证明申请人能添加中间位使能fab/mab,且申请人能使抗原特异结合fab。申请人能制备中间位-δ链t细胞并在疾病特异性中间位使能fab中交换或覆盖多个抗原。cart细胞领域快速发展且作为临床结果可用,显而易见需要改变cart细胞的特异性。申请人展示通用cart细胞平台,其中申请人用中间位(非cdrfab结合肽结构域)取代cart细胞并用中间位使能fab/mab(抗原结合域)来增加抗原特异性。此平台技术允许申请人迅速且有效改变靶特异性,而不建立和优化个体cart细胞。申请人通过fac展示概念验证,采用2种不同中间位使能mab。申请人可优化接头设计和对接,通过原位改变中间位-car抗原特异性在动物模型中证明功效。表达中间位的单一t细胞能混合并与肿瘤内靶向不同抗原/表位的fab/mab混合及匹配,可能生成适用于多种癌形式的优势产品。fab/mab一般比scfv更稳定,一般对抗原的亲和性高于scfv,容易生成一组结合抗原上不同表位的fab,能够快速优化(如该领域内的当前问题是受体表位与肿瘤膜之间的距离如何影响功效)。申请人可以在慢病毒中包装所述中间位以产生fabrack(本文提供的重组蛋白),并在体外和体内表征肿瘤消灭。申请人可以改变原位特异性,并表征。申请人可以改变接头(例如去除ch3结构域)以建立单价fabrack,产生、表征和改变特异性。常规car和中间位car:基本概念。scfv变体用于临床。‘最简单的’fabrack结合中间位使能igg或fab片段。值得注意的是,其不限于igg或fab,我们能制备双特异igg或仿生(bionics)或单臂fab。基本上,我们可向中间位使能fab融合任何东西。fabrack-t细胞能结合肿瘤细胞,由中间位使能igg介导。有多种组合/相互作用能导致生产性互动。一个fab臂结合fabrackt细胞,且另一臂结合肿瘤细胞。同一fab臂结合fabrackt细胞和肿瘤抗原。2个fab臂都结合肿瘤,一个或另一fab臂结合fabrackt细胞。2个fab臂都结合fabrackt细胞和肿瘤等。中间位car构建体能装在慢病毒载体中。胞外域包括中间位(非cdrfab结合肽结构域)、接头(肽接头)和igg的ch3结构域(间隔区),且之后是cd28跨膜结构域(cd28tm)、cd28共刺激结构域(cd28)和cd3δ细胞裂解结构域(本文也称为胞内t细胞信号传导结构域)(cd3δ)。cd3δ和cd19t由t2a序列分开。memab(中间位使能单克隆抗体)能结合靶细胞和携带nfat响应荧光素酶的fabrack表达jurkat细胞。这是简单的读出以测试移到t细胞前的概念memab(中间位使能单克隆抗体;抗原结合域)可预结合fabrack细胞(表达本文所提供重组蛋白的t细胞)或memab(抗原结合域)可预结合靶细胞(如癌细胞)。靶细胞上的抗原表达水平影响t细胞活化。就预结合memab的t细胞和预结合memab的癌细胞而言,t细胞活化相当,其中癌细胞上的抗原表达低。当癌细胞预结合memab且如果癌上的抗原表达高,则能实现最高t细胞活化。类似地,当t细胞预结合memab(中间位使能单克隆抗体,抗原结合域)且癌上的抗原表达水平高时,t细胞活化较高。参见图19。材料与方法克隆。亲代抗her2scfv_igg4op(hl-ch3)_cd28gg_op-zeta_op-t2a-cd19t_ephiv7载体由c.brown博士友情提供。gm-csfr分泌信号_中间位_paslinker17基因盒由dna2.0合成并插入car载体,其有或没有igg4op(hl-ch3)结构域(分别是中间位-ch3和中间位-cd28),采用nhei和sbfi限制性位点。克隆质粒用maxiprep试剂盒(凯杰公司(qiagen))纯化。可溶性蛋白的荧光团标记。alexafluor染料(赛默飞世尔(thermofisher))根据厂商操作使用胺缀合来结合可溶性蛋白。简言之,alexafluor647nhs酯染料缀合曲妥单抗i83eigg和fab以及易普利姆玛igg。用a280和amax计算标记程度(dol),在每分子1≤dol≤3染料之间。海水蓝nhs酯染料缀合sher2。蛋白相互作用的特征是尺寸排阻层析(sec),然后是facs试验以评估结合活性。转染。第0天,9次传代的cho-s细胞(英杰公司(invitrogen))不用载体(模拟)或用亲代car、中间位-ch3或中间位-cd28载体转染。细胞用freestylemax转染试剂盒(赛默飞世尔)根据厂商操作转染。流式细胞术。第5天,收获细胞并计数。将3e6细胞加入5mlfacs管(vwr)和qs’d到1e6细胞/ml,采用facs染色溶液(2%fcs,0.5%nan3,溶于hanks’平衡盐溶液,批次#05092016)。向v形底96孔板(康宁(corningcostar))各孔加入0.1e6细胞,每条件3个孔。细胞用100μl染色溶液洗2次,在4℃,300g旋转3分钟,弃上清。细胞在4℃重悬于100μl初次染色溶液(pe-cy7^cd-19稀释1:100和100nm647^igg,100nm647^ipi,或200nm647^fab)30分钟,避光。细胞用100μl染色溶液洗2次,4℃重悬于二次染色溶液(200nmpacblue^her2)30分钟,避光。细胞用100μl染色溶液洗2次,重悬于150μlpi溶液(在染色溶液中pi稀释1:100)。细胞样品用macsquant仪器(#2,westsideofbrownlab)分析,采用40μl/样品。电压如下:fsc=358v,ssc=520v。分析通道:pe(pi),pe-cy7(cd19),apc(647)和vioblue(her2)。门控策略:fsc/ssc→pe-→pe-cy7+→apc+→vioblue+fsc/ssc→pi-→cd19+→647+→her2+动物计划。每组有4只小鼠。1.仅肿瘤:ovcar3-luc或skov3-luc是好的2.有her-2cart细胞的肿瘤:fabcarorscfvcart细胞是好的。每只小鼠有1e7阳性细胞。3.有模拟t细胞的肿瘤:每只小鼠有1e7模拟t细胞。4.有中间位-cart细胞的肿瘤:每只小鼠有1e7阳性cart细胞。5.有模拟t细胞+her2抗体预混的肿瘤:每只小鼠有1e7模拟t细胞。her2抗体在t细胞注射前一天ip4mg/kg。t细胞与100nm抗体预混合并洗出。抗体一周二次ip4mg/kg施用,持续2周。6.有中间位-cart细胞+her2抗体预混的肿瘤:每只小鼠有1e7cart细胞。her2抗体在t细胞注射前一天ip4mg/kg。t细胞与100nm抗体预混合并洗出。抗体一周二次ip4mg/kg施用,持续2周。7.有中间位-cart细胞+her2抗体但无预混的肿瘤:每只小鼠有1e7cart细胞。her2抗体在t细胞注射前一天ip4mg/kg。t细胞未与抗体预混合。抗体一周二次ip4mg/kg施用,持续2周。fabrack动物数据方法(ovcar3)500万ovcar3-gfp-luc细胞在第1天腹膜内(ip)注入小鼠。在fabrackt细胞处理的小鼠(组6和7)中,小鼠每3天施用4mg/kgmemab曲妥单抗(共5剂),第一剂ab在第8天施用。1000万人t细胞在第9天ip注入小鼠。组6中,fabrackt细胞与memab预混合并洗出。在150μl萤光素(28.57mg/ml)ip注入小鼠后,通过发光测量小鼠的肿瘤负荷。(组1:仅肿瘤;组2:模拟t细胞;组3:仅fabrackt细胞;组4:模拟tcells+ab;组5:her2scfvcar;组6:fabrackt细胞(预混)+ab;组7:fabrackt细胞+ab)结果(ovcar3)在施用fabrackt细胞和memab(组6和7)时,小鼠显示肿瘤尺寸大幅减少,无论fabrackt是否与memab预混合。然而,肿瘤在约第14天复发。肿瘤复发不归因于her2抗原损失,这是基于显示小鼠腹腔液中her2+肿瘤细胞的流式细胞术结果。肿瘤复发可能是由于t细胞的非持续性,因为小鼠血液和腹腔液中几乎没有fabrackt细胞剩余。优化肿瘤根除的给药方案在起步中。方法(mcf7)500万mcf7-gfp-luc细胞在第1天腹膜内(ip)注入小鼠。fabrack组中,小鼠大约每4天施用4mg/kgmemab曲妥单抗,第一剂ab与t细胞一起施用。第一剂的200万人t细胞在第8天ip注入小鼠。大约每6天进一步施用200万fabrackt细胞。在150μl萤光素(28.57mg/ml)ip注入小鼠后,通过发光测量小鼠的肿瘤负荷。结果(mcf7)在施用fabrackt细胞和memab的小鼠中于第11天和第14天观察到肿瘤尺寸减少。然而,在第16天观察到肿瘤复发。第22天的小鼠血液分析显示存在fabrackt细胞且memab结合fabrackt细胞。第45天的小鼠腹腔液分析显示,没有抗原逃离肿瘤细胞。肿瘤复发可能归因于来自ab的钩状效应,其剂量可使肿瘤和t细胞上的ab结合位点饱和。fabrackt细胞的剂量在异种移植研究中是200万,相比之下ovcar3研究中是1000万,因而用于ab结合的fabrackt细胞更少。另外,mcf7和ovcar3是低her2表达,因此其her2容易被ab饱和。优化肿瘤根除的给药方案在起步中。表格。表1.跨膜结构域的实例蛋白ncbi登录号长度跨膜结构域序列cd3zgi:62304121aalcylldgilfiygviltalfl(seqidno:1)cd28gi:34054550627aafwvlvvvggvlacysllvtvafiifwv(seqidno:2)cd4gi:17914322aamalivlggvaglllfiglgiff(seqidno:3)cd8gi:22500753421aaiyiwaplagtcgvlllslvit(seqidno:4)cd8gi:22500753423aaiyiwaplagtcgvlllslvitly(seqidno:5)cd8gi:22500753424aaiyiwaplagtcgvlllslvitlyc(seqidno:6)41bbgi:31525909927aaiisfflaltstallfllffltlrfsvv(seqidno:7)ox40gi:31536063721aavaailglglvlgllgplaill(seqidno:8)icosgi:25182395121aafwlpigcaafvvvcilgcili(seqidno:9)cd62lgi:26220631423aaplfipvavmvtafsglafiiwla(seqidno:10)表2.信号传导结构域的实例p实施方案实施方案p1.第一重组蛋白,所述蛋白包括:(i)第一非cdrfab结合肽结构域;(ii)第一胞内t细胞信号传导结构域;和(iii)第一跨膜结构域,其连接所述第一非cdrfab结合肽结构域与所述第一胞内t细胞信号传导结构域。实施方案p2.如实施方案p1所述的第一重组蛋白,其中所述第一重组蛋白还包括第一间隔区,其连接所述第一非cdrfab结合肽结构域与所述第一跨膜结构域。实施方案p3.如实施方案p2所述的第一重组蛋白,其中所述第一间隔区是第一ch3区。实施方案p4.如实施方案p3所述的第一重组蛋白,其中所述第一重组蛋白非共价结合第二重组蛋白,所述第二重组蛋白包括:(i)第二非cdrfab结合肽结构域;(ii)第二胞内t细胞信号传导结构域;(iii)第二跨膜结构域,连接所述第二非cdrfab结合肽结构域与所述第二胞内t细胞信号传导结构域;和(iv)第二间隔区,其中所述第二间隔区连接所述第二非cdrfab结合肽结构域与所述第二跨膜结构域,其中所述第二间隔区包括第二ch3区且其中所述第一ch3区结合所述第二ch3区。实施方案p5.如实施方案p1-p5中任一项所述的第一重组蛋白,其中所述第一非cdrfab结合肽结构域和所述第二非cdrfab结合肽结构域在化学性质上不同。实施方案p6.如实施方案p1-p5中任一项所述的第一重组蛋白,其中所述第一非cdrfab结合肽结构域和所述第二非cdrfab结合肽结构域在化学性质上相同。实施方案p7.如实施方案p1-p6中任一项所述的第一重组蛋白,其中所述第一和所述第二胞内t细胞信号传导结构域独立地是cd3δ胞内t细胞信号传导结构域。实施方案p8.如实施方案p1-p7中任一项所述的第一重组蛋白,其中所述第一非cdrfab结合肽结构域非共价结合第一抗原结合域。实施方案p9.如实施方案p1-p8中任一项所述的第一重组蛋白,其中所述第二非cdrfab结合肽结构域非共价结合第二抗原结合域。实施方案p10.一种编码实施方案1-3中任一项所述的第一重组蛋白的分离核酸。实施方案p11.一种包括实施方案p10所述的核酸的表达载体。实施方案p12.如实施方案p11所述的表达载体,其中所述病毒是慢病毒或致癌反转录病毒。实施方案p13.一种包括实施方案p11-p12中之一所述的表达载体的t淋巴细胞。实施方案p14.一种包括实施方案p1-p9中任一项所述的第一重组蛋白的t淋巴细胞。实施方案p15.一种包括实施方案p1-p9中任一项所述的第一重组蛋白的t淋巴细胞,其中所述跨膜结构域在所述t淋巴细胞的细胞膜内。实施方案p16.一种治疗癌症的方法,所述方法包括向有需要的对象施用有效量的实施方案p15所述的t淋巴细胞,其中所述第一抗原结合域和第二抗原结合域是独立的抗癌症抗原结合域。实施方案实施方案1.一种重组蛋白,所述蛋白包括:(i)非cdrfab结合肽结构域;(ii)胞内t细胞信号传导结构域;和(iii)跨膜结构域,其连接所述非cdrfab结合肽结构域与所述胞内t细胞信号传导结构域。实施方案2.如实施方案1所述的重组蛋白,其中所述胞内t细胞信号传导结构域是cd3δ胞内t细胞信号传导结构域。实施方案3.如实施方案1或2所述的重组蛋白,其中所述跨膜结构域是cd8α跨膜结构域、cd28跨膜结构域、cd4跨膜结构域或cd3-δ跨膜结构域。实施方案4.如实施方案1-3中任一项所述的重组蛋白,其中所述跨膜结构域是cd28跨膜结构域。实施方案5.如实施方案1-4中任一项所述的重组蛋白,其中所述重组蛋白还包括间隔区,其连接所述非cdrfab结合肽结构域与所述跨膜结构域。实施方案6.如实施方案5所述的重组蛋白,其中所述间隔区是恒定重链3(ch3)结构域。实施方案7.如实施方案1-6中任一项所述的重组蛋白,其中所述重组蛋白还包括肽接头,其连接所述非cdrfab结合肽结构域与所述间隔区。实施方案8.如实施方案1-7中任一项所述的重组蛋白,其中所述重组蛋白还包括胞内共刺激信号传导结构域,其连接所述跨膜结构域与所述胞内t细胞信号传导结构域。实施方案9.如实施方案8所述的重组蛋白,其中所述胞内共刺激信号传导结构域是cd28胞内共刺激信号传导结构域、4-1bb胞内共刺激信号传导结构域、icos胞内共刺激信号传导结构域或ox-40胞内共刺激信号传导结构域。实施方案10.如实施方案8或9所述的重组蛋白,其中所述胞内共刺激信号传导结构域是cd28胞内共刺激信号传导结构域。实施方案11.如实施方案8-10中任一项所述的重组蛋白,其中所述胞内共刺激信号传导结构域是4-1bb胞内共刺激信号传导结构域。实施方案12.如实施方案1-11中任一项所述的重组蛋白,其中所述重组蛋白还包括结合所述胞内t细胞信号传导结构域c末端的可检测结构域。实施方案13.如实施方案12所述的重组蛋白,其中所述可检测结构域是截短的cd19蛋白。实施方案14.如实施方案1-13中任一项所述的重组蛋白,其中所述重组蛋白还包括自切割肽基序列,其连接所述胞内t细胞信号传导结构域与所述可检测结构域。实施方案15.如实施方案14所述的重组蛋白,其中所述自切割肽基接头序列是t2a序列或2a序列。实施方案16.如实施方案1-15中任一项所述的重组蛋白,其中所述重组蛋白形成细胞的部分。实施方案17.如实施方案1-16中任一项所述的重组蛋白,其中所述重组蛋白形成t细胞的部分。实施方案18.如实施方案1-17中任一项所述的重组蛋白,其中所述非cdrfab结合肽结构域与抗原结合域结合。实施方案19.如实施方案18所述的重组蛋白,其中所述抗原结合域是fab、igg或双特异性抗体。实施方案20.如实施方案18-19中任一项所述的重组蛋白,其中所述抗原结合域是西妥昔单抗中间位使能结构域、曲妥单抗中间位使能结构域、帕妥珠单抗中间位使能结构域、m5a中间位使能结构域或利妥昔单抗中间位使能结构域。实施方案21.如实施方案18-20中任一项所述的重组蛋白,其中所述抗原结合域能够结合癌症抗原。实施方案22.如实施方案18-21中任一项所述的重组蛋白,其中所述抗原结合域能够结合癌症抗原。实施方案23.如实施方案21或22所述的重组蛋白,其中所述癌症抗原是her2、egfr、cd19或cd20。实施方案24.如实施方案21或22所述的重组蛋白,其中所述癌症抗原形成细胞的部分。实施方案25.如实施方案24所述的重组蛋白,其中所述细胞是癌细胞。实施方案26.如实施方案25所述的重组蛋白,其中所述癌症是卵巢癌、肾细胞癌、b细胞恶性肿瘤、白血病、淋巴瘤、乳腺癌、结直肠癌、前列腺癌、成神经细胞瘤、黑素瘤、成神经管细胞瘤、肺癌、骨肉瘤、成胶质细胞瘤或胶质瘤。实施方案27.一种编码实施方案1-26中任一项所述重组蛋白的分离核酸。实施方案28.一种包括实施方案27所述核酸的表达载体。实施方案29.如实施方案28所述的表达载体,其中所述病毒是慢病毒或致癌反转录病毒。实施方案30.一种包括实施方案28-29中任一项所述表达载体的t淋巴细胞。实施方案31.一种包括实施方案1-26中任一项所述重组蛋白的t淋巴细胞。实施方案32.一种包括实施方案1-26中任一项所述重组蛋白的t淋巴细胞,其中所述跨膜结构域在所述t淋巴细胞的细胞膜内。实施方案33.如实施方案30-32中任一项所述的t淋巴细胞,其中所述t淋巴细胞是自体t淋巴细胞。实施方案34.如实施方案30-32中任一项所述的t淋巴细胞,其中所述t淋巴细胞是异源t淋巴细胞。实施方案35.如实施方案30-34中任一项所述的t淋巴细胞,其中所述非cdrfab结合肽结构域与抗原结合域结合。实施方案36.如实施方案35所述的t淋巴细胞,其中所述抗原结合域是fab、igg或双特异性抗体。实施方案37.如实施方案35或36所述的t淋巴细胞,其中所述抗原结合域结合癌症抗原。实施方案38.如实施方案37所述的t淋巴细胞,其中所述癌症抗原是her2、egfr、cd19或cd20。实施方案39.如实施方案35-38中任一项所述的t淋巴细胞,其中所述抗原结合域是癌症抗原结合域。实施方案40.如实施方案35-39中任一项所述的t淋巴细胞,其中所述抗原结合域是西妥昔单抗中间位使能结构域、曲妥单抗中间位使能结构域、帕妥珠单抗中间位使能结构域、m5a中间位使能结构域或利妥昔单抗中间位使能结构域。实施方案41.一种治疗癌的方法,所述方法包括向有需要的对象施用有效量的实施方案30-34中任一项所述t淋巴细胞和能够结合所述非cdrfab结合肽结构域的抗原结合域,其中所述抗原结合域是癌症抗原结合域。实施方案42.如实施方案41所述的方法,其中所述t淋巴细胞和所述抗原结合域同时或依序施用。实施方案43.如实施方案41或42所述的方法,其中所述t淋巴细胞在第一时间点施用且所述抗原结合域在第二时间点施用,其中第一时间点在第二时间点之前。实施方案44.如实施方案41或42所述的方法,其中所述抗原结合域在第一时间点施用且所述t淋巴细胞在第二时间点施用,其中第一时间点在第二时间点之前。实施方案45.如实施方案41所述的方法,其中所述方法包括:(i)在所述施用前,允许所述非cdrfab结合肽结构域体外结合所述抗原结合域,从而形成t淋巴细胞-重组蛋白复合体;和(ii)向所述对象施用所述t淋巴细胞-重组蛋白复合体,因而治疗所述对象的癌症。实施方案46.如实施方案41-45中任一项所述的方法,其中所述癌是卵巢癌、肾细胞癌、b细胞恶性肿瘤、白血病、淋巴瘤、乳腺癌、结直肠癌、前列腺癌、成神经细胞瘤、黑素瘤、成神经管细胞瘤、肺癌、骨肉瘤、成胶质细胞瘤或胶质瘤。实施方案47.如实施方案41-46中任一项所述的方法,其中所述抗原结合域是西妥昔单抗中间位使能结构域、曲妥单抗中间位使能结构域、帕妥珠单抗中间位使能结构域、m5a中间位使能结构域或利妥昔单抗中间位使能结构域。实施方案48.如实施方案1-26中任一项所述的重组蛋白,其中所述重组蛋白是第一重组蛋白,所述非cdrfab结合肽结构域是第一非cdrfab结合肽结构域,所述胞内t细胞信号传导结构域是第一胞内t细胞信号传导结构域,所述跨膜结构域是第一跨膜结构域,所述间隔区是第一间隔区,所述胞内共刺激信号传导结构域是第一胞内共刺激信号传导结构域。实施方案49.如实施方案48所述的重组蛋白,其中所述第一重组蛋白非共价结合第二重组蛋白,所述第二重组蛋白包括:(i)第二非cdrfab结合肽结构域;(ii)第二胞内t细胞信号传导结构域;(iii)第二跨膜结构域,连接所述第二非cdrfab结合肽结构域与所述第二胞内t细胞信号传导结构域;和(iv)第二间隔区,其中所述第二间隔区连接所述第二非cdrfab结合肽结构域与所述第二跨膜结构域,其中所述第一间隔区非共价结合所述第二间隔区。实施方案50.如实施方案49所述的重组蛋白,其中所述第一间隔区和所述第二间隔区是第一恒定重链3(ch3)结构域和第二恒定重链3(ch3)结构域。实施方案51.如实施方案48-50中任一项所述的重组蛋白,其中所述第一非cdrfab结合肽结构域和所述第二非cdrfab结合肽结构域在化学性质上不同。实施方案52.如实施方案48-50中任一项所述的重组蛋白,其中所述第一非cdrfab结合肽结构域和所述第二非cdrfab结合肽结构域在化学性质上相同。实施方案53.如实施方案48-52中任一项所述的重组蛋白,其中所述第一非cdrfab结合肽结构域非共价结合第一抗原结合域。实施方案54.如实施方案49-53中任一项所述的重组蛋白,其中所述第二非cdrfab结合肽结构域非共价结合第二抗原结合域。实施方案55.如实施方案53或54所述的重组蛋白,其中所述第一抗原结合域和所述第二抗原结合域在化学性质上不同或相同。实施方案56.如实施方案53-55中任一项所述的重组蛋白,其中所述第一抗原结合域和所述第二抗原结合域独立地是西妥昔单抗中间位使能结构域、曲妥单抗中间位使能结构域、帕妥珠单抗中间位使能结构域、m5a中间位使能结构域或利妥昔单抗中间位使能结构域。信息序列表cd3z;gi:623041(seqidno:1)lcylldgilfiygviltalflcd28;gi:340545506(seqidno:2)fwvlvvvggvlacysllvtvafiifwvcd4;gi:179143(seqidno:3)malivlggvaglllfiglgiffcd8;gi:225007534(seqidno:4)iyiwaplagtcgvlllslvitcd8;gi:225007534(seqidno:5)iyiwaplagtcgvlllslvitlycd8;gi:225007534(seqidno:6)iyiwaplagtcgvlllslvitlyc41bb;gi:315259099(seqidno:7)iisfflaltstallfllffltlrfsvvox40;gi:315360637(seqidno:8)vaailglglvlgllgplaillicos;gi:251823951(seqidno:9)fwlpigcaafvvvcilgcilicd62l;gi:262206314(seqidno:10)plfipvavmvtafsglafiiwlacd3δ;gi:623041;seqidno:11:rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkpqrrknpqeglycd28;gi:340545506;seqidno:12:rskrsrllhsdymnmtprrpgptrkhyqpyapprdfaayrscd28gg*;gi:340545506;seqidno:13:rskrsrgghsdymnmtprrpgptrkhyqpyapprdfaayrs(ref)41bb;gi:315259099;seqidno:14:krgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelox40;gi:315360637;seqidno:15:alyllrrdqrlppdahkppgggsfrtpiqeeqadahstlakiicos;gi:251823951;seqidno:16:cwltkkkysssvhdpngeymfmravntakksrltdvtl间隔子(包括igg4-ch3)seqidno:17:gggssgggsggqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgkcd28跨膜seqidno:18:mfwvlvvvggvlacysllvtvafiifwvcd28cyto(llmgg)seqidno:19:rskrsrgghsdymnmtprrpgptrkhyqpyapprdfaayrs胞内t细胞信号传导结构域(cd3-δ)seqidno:20:rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr自切割肽基接头(t2a)seqidno:21:legggegrgslltcgdveenpgptr标记肽(cd19t)seqidno:22:mppprllffllfltpmevrpeeplvvkveegdnavlqclkgtsdgptqqltwsresplkpflklslglpglgihmrplaiwlfifnvsqqmggfylcqpgppsekawqpgwtvnvegsgelfrwnvsdlgglgcglknrssegpsspsgklmspklyvwakdrpeiwegeppcvpprdslnqslsqdltmapgstlwlscgvppdsvsrgplswthvhpkgpksllslelkddrpardmwvmetglllprataqdagkyychrgnltmsfhleitarpvlwhwllrtggwkvsavtlaylifclcslvgilhlqralvlrrkr自切割肽基接头(2a)seqidno:23:ggstsegrgslltcgdveenpgp间隔区seqidno:24gsgsgsgs肽接头seqidno:25sapassasapsaasapagseqidno:26sapassasapsaasapag自切割肽基接头seqidno:27pvkqllnfdllklagdvesnpgp自切割肽基接头seqidno:28qctnyallklagdvesnpgp自切割肽基接头seqidno:29atnfsllkqagdveenpgp自切割肽基接头seqidno:30egrgslltcgdvesnpgp间隔区seqidno:31gggssgggsgseqidno:32;中间位(非cdrfab结合肽结构域)cqfdlstrrlqcseqidno:33;ch3(间隔区)qprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgkseqidno:34;cd3δ链(胞内t细胞信号传导结构域)rvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprseqidno:35;完整4-1bbfabrack序列mlllvtslllcelphpafllipcqfdlstrrlqcsapassasapsaasapaggqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgkmfwvlvvvggvlacysllvtvafiifwvkrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelgggrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprlegggegrgslltcgdveenpgptrmppprllffllfltpmevrpeeplvvkveegdnavlqclkgtsdgptqqltwsresplkpflklslglpglgihmrplaiwlfifnvsqqmggfylcqpgppsekawqpgwtvnvegsgelfrwnvsdlgglgcglknrssegpsspsgklmspklyvwakdrpeiwegeppcvpprdslnqslsqdltmapgstlwlscgvppdsvsrgplswthvhpkgpksllslelkddrpardmwvmetglllprataqdagkyychrgnltmsfhleitarpvlwhwllrtggwkvsavtlaylifclcslvgilhlqralvlrrkrseqidno:36;完整cd28fabrack序列mlllvtslllcelphpafllipcqfdlstrrlqcsapassasapsaasapaggqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslgkmfwvlvvvggvlacysllvtvafiifwvrskrsrgghsdymnmtprrpgptrkhyqpyapprdfaayrsgggrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalpprlegggegrgslltcgdveenpgprmppprllffllfltpmevrpeeplvvkveegdnavlqclkgtsdgptqqltwsresplkpflklslglpglgihmrplaiwlfifnvsqqmggfylcqpgppsekawqpgwtvnvegsgelfrwnvsdlgglgcglknrssegpsspsgklmspklyvwakdrpeiwegeppcvpprdslnqslsqdltmapgstlwlscgvppdsvsrgplswthvhpkgpksllslelkddrpardmwvmetglllprataqdagkyychrgnltmsfhleitarpvlwhwllrtggwkvsavtlaylifclcslvgilhlqralvlrrkrseqidno:37;信号肽mlllvtslllcelphpafllip序列表<110>希望之城j·c·威廉斯c·布朗k·詹金斯<120>中间位使能t细胞<130>048440-621001wo<150>62/611,924<151>2017-12-29<150>62/680,442<151>2018-06-04<160>37<170>patentinversion3.5<210>1<211>21<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>1leucystyrleuleuaspglyileleupheiletyrglyvalileleu151015thralaleupheleu20<210>2<211>27<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>2phetrpvalleuvalvalvalglyglyvalleualacystyrserleu151015leuvalthrvalalapheileilephetrpval2025<210>3<211>22<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>3metalaleuilevalleuglyglyvalalaglyleuleuleupheile151015glyleuglyilephephe20<210>4<211>21<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>4iletyriletrpalaproleualaglythrcysglyvalleuleuleu151015serleuvalilethr20<210>5<211>23<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>5iletyriletrpalaproleualaglythrcysglyvalleuleuleu151015serleuvalilethrleutyr20<210>6<211>24<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>6iletyriletrpalaproleualaglythrcysglyvalleuleuleu151015serleuvalilethrleutyrcys20<210>7<211>27<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>7ileileserphepheleualaleuthrserthralaleuleupheleu151015leuphepheleuthrleuargpheservalval2025<210>8<211>21<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>8valalaalaileleuglyleuglyleuvalleuglyleuleuglypro151015leualaileleuleu20<210>9<211>21<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>9phetrpleuproileglycysalaalaphevalvalvalcysileleu151015glycysileleuile20<210>10<211>23<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>10proleupheileprovalalavalmetvalthralapheserglyleu151015alapheileiletrpleuala20<210>11<211>60<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>11argvallyspheserargseralaaspalaproalatyrglnglngly151015glnasnglnleutyrasngluleuasnleuglyargarggluglutyr202530aspvalleuasplysargargglyargaspproglumetglyglylys354045proglnargarglysasnproglngluglyleutyr505560<210>12<211>41<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>12argserlysargserargleuleuhisserasptyrmetasnmetthr151015proargargproglyprothrarglyshistyrglnprotyralapro202530proargaspphealaalatyrargser3540<210>13<211>41<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>13argserlysargserargglyglyhisserasptyrmetasnmetthr151015proargargproglyprothrarglyshistyrglnprotyralapro202530proargaspphealaalatyrargser3540<210>14<211>42<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>14lysargglyarglyslysleuleutyrilephelysglnprophemet151015argprovalglnthrthrglnglugluaspglycyssercysargphe202530proglugluglugluglyglycysgluleu3540<210>15<211>42<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>15alaleutyrleuleuargargaspglnargleuproproaspalahis151015lysproproglyglyglyserpheargthrproileglngluglugln202530alaaspalahisserthrleualalysile3540<210>16<211>38<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>16cystrpleuthrlyslyslystyrserserservalhisaspproasn151015glyglutyrmetphemetargalavalasnthralalyslysserarg202530leuthraspvalthrleu35<210>17<211>117<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>17glyglyglyserserglyglyglyserglyglyglnproargglupro151015glnvaltyrthrleuproproserglngluglumetthrlysasngln202530valserleuthrcysleuvallysglyphetyrproseraspileala354045valglutrpgluserasnglyglnprogluasnasntyrlysthrthr505560proprovalleuaspseraspglyserphepheleutyrserargleu65707580thrvalasplysserargtrpglngluglyasnvalphesercysser859095valmethisglualaleuhisasnhistyrthrglnlysserleuser100105110leuserleuglylys115<210>18<211>28<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>18metphetrpvalleuvalvalvalglyglyvalleualacystyrser151015leuleuvalthrvalalapheileilephetrpval2025<210>19<211>41<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>19argserlysargserargglyglyhisserasptyrmetasnmetthr151015proargargproglyprothrarglyshistyrglnprotyralapro202530proargaspphealaalatyrargser3540<210>20<211>112<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>20argvallyspheserargseralaaspalaproalatyrglnglngly151015glnasnglnleutyrasngluleuasnleuglyargarggluglutyr202530aspvalleuasplysargargglyargaspproglumetglyglylys354045proargarglysasnproglngluglyleutyrasngluleuglnlys505560asplysmetalaglualatyrsergluileglymetlysglygluarg65707580argargglylysglyhisaspglyleutyrglnglyleuserthrala859095thrlysaspthrtyraspalaleuhismetglnalaleuproproarg100105110<210>21<211>24<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>21leugluglyglyglygluglyargglyserleuleuthrcysglyasp151015valglugluasnproglyproarg20<210>22<211>323<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>22metproproproargleuleuphepheleuleupheleuthrpromet151015gluvalargproglugluproleuvalvallysvalglugluglyasp202530asnalavalleuglncysleulysglythrseraspglyprothrgln354045glnleuthrtrpserarggluserproleulyspropheleulysleu505560serleuglyleuproglyleuglyilehismetargproleualaile65707580trpleupheilepheasnvalserglnglnmetglyglyphetyrleu859095cysglnproglyproproserglulysalatrpglnproglytrpthr100105110valasnvalgluglyserglygluleupheargtrpasnvalserasp115120125leuglyglyleuglycysglyleulysasnargsersergluglypro130135140serserproserglylysleumetserprolysleutyrvaltrpala145150155160lysaspargprogluiletrpgluglygluproprocysvalpropro165170175argaspserleuasnglnserleuserglnaspleuthrmetalapro180185190glyserthrleutrpleusercysglyvalproproaspservalser195200205argglyproleusertrpthrhisvalhisprolysglyprolysser210215220leuleuserleugluleulysaspaspargproalaargaspmettrp225230235240valmetgluthrglyleuleuleuproargalathralaglnaspala245250255glylystyrtyrcyshisargglyasnleuthrmetserphehisleu260265270gluilethralaargprovalleutrphistrpleuleuargthrgly275280285glytrplysvalseralavalthrleualatyrleuilephecysleu290295300cysserleuvalglyileleuhisleuglnargalaleuvalleuarg305310315320arglysarg<210>23<211>23<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>23glyglyserthrsergluglyargglyserleuleuthrcysglyasp151015valglugluasnproglypro20<210>24<211>8<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>24glyserglyserglyserglyser15<210>25<211>18<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>25seralaproalaserseralaseralaproseralaalaseralapro151015alagly<210>26<211>18<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>26seralaproalaserseralaseralaproseralaalaseralapro151015alagly<210>27<211>23<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>27provallysglnleuleuasnpheaspleuleulysleualaglyasp151015valgluserasnproglypro20<210>28<211>20<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>28glncysthrasntyralaleuleulysleualaglyaspvalgluser151015asnproglypro20<210>29<211>19<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>29alathrasnpheserleuleulysglnalaglyaspvalglugluasn151015proglypro<210>30<211>18<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>30gluglyargglyserleuleuthrcysglyaspvalgluserasnpro151015glypro<210>31<211>10<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>31glyglyglyserserglyglyglysergly1510<210>32<211>12<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>32cysglnpheaspleuserthrargargleuglncys1510<210>33<211>106<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>33glnproarggluproglnvaltyrthrleuproproserglngluglu151015metthrlysasnglnvalserleuthrcysleuvallysglyphetyr202530proseraspilealavalglutrpgluserasnglyglnprogluasn354045asntyrlysthrthrproprovalleuaspseraspglyserphephe505560leutyrserargleuthrvalasplysserargtrpglngluglyasn65707580valphesercysservalmethisglualaleuhisasnhistyrthr859095glnlysserleuserleuserleuglylys100105<210>34<211>112<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>34argvallyspheserargseralaaspalaproalatyrglnglngly151015glnasnglnleutyrasngluleuasnleuglyargarggluglutyr202530aspvalleuasplysargargglyargaspproglumetglyglylys354045proargarglysasnproglngluglyleutyrasngluleuglnlys505560asplysmetalaglualatyrsergluileglymetlysglygluarg65707580argargglylysglyhisaspglyleutyrglnglyleuserthrala859095thrlysaspthrtyraspalaleuhismetglnalaleuproproarg100105110<210>35<211>692<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>35metleuleuleuvalthrserleuleuleucysgluleuprohispro151015alapheleuleuileprocysglnpheaspleuserthrargargleu202530glncysseralaproalaserseralaseralaproseralaalaser354045alaproalaglyglyglnproarggluproglnvaltyrthrleupro505560proserglngluglumetthrlysasnglnvalserleuthrcysleu65707580vallysglyphetyrproseraspilealavalglutrpgluserasn859095glyglnprogluasnasntyrlysthrthrproprovalleuaspser100105110aspglyserphepheleutyrserargleuthrvalasplysserarg115120125trpglngluglyasnvalphesercysservalmethisglualaleu130135140hisasnhistyrthrglnlysserleuserleuserleuglylysmet145150155160phetrpvalleuvalvalvalglyglyvalleualacystyrserleu165170175leuvalthrvalalapheileilephetrpvallysargglyarglys180185190lysleuleutyrilephelysglnprophemetargprovalglnthr195200205thrglnglugluaspglycyssercysargpheprogluglugluglu210215220glyglycysgluleuglyglyglyargvallyspheserargserala225230235240aspalaproalatyrglnglnglyglnasnglnleutyrasngluleu245250255asnleuglyargarggluglutyraspvalleuasplysargarggly260265270argaspproglumetglyglylysproargarglysasnproglnglu275280285glyleutyrasngluleuglnlysasplysmetalaglualatyrser290295300gluileglymetlysglygluargargargglylysglyhisaspgly305310315320leutyrglnglyleuserthralathrlysaspthrtyraspalaleu325330335hismetglnalaleuproproargleugluglyglyglygluglyarg340345350glyserleuleuthrcysglyaspvalglugluasnproglyprothr355360365argmetproproproargleuleuphepheleuleupheleuthrpro370375380metgluvalargproglugluproleuvalvallysvalgluglugly385390395400aspasnalavalleuglncysleulysglythrseraspglyprothr405410415glnglnleuthrtrpserarggluserproleulyspropheleulys420425430leuserleuglyleuproglyleuglyilehismetargproleuala435440445iletrpleupheilepheasnvalserglnglnmetglyglyphetyr450455460leucysglnproglyproproserglulysalatrpglnproglytrp465470475480thrvalasnvalgluglyserglygluleupheargtrpasnvalser485490495aspleuglyglyleuglycysglyleulysasnargserserglugly500505510proserserproserglylysleumetserprolysleutyrvaltrp515520525alalysaspargprogluiletrpgluglygluproprocysvalpro530535540proargaspserleuasnglnserleuserglnaspleuthrmetala545550555560proglyserthrleutrpleusercysglyvalproproaspserval565570575serargglyproleusertrpthrhisvalhisprolysglyprolys580585590serleuleuserleugluleulysaspaspargproalaargaspmet595600605trpvalmetgluthrglyleuleuleuproargalathralaglnasp610615620alaglylystyrtyrcyshisargglyasnleuthrmetserphehis625630635640leugluilethralaargprovalleutrphistrpleuleuargthr645650655glyglytrplysvalseralavalthrleualatyrleuilephecys660665670leucysserleuvalglyileleuhisleuglnargalaleuvalleu675680685argarglysarg690<210>36<211>690<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>36metleuleuleuvalthrserleuleuleucysgluleuprohispro151015alapheleuleuileprocysglnpheaspleuserthrargargleu202530glncysseralaproalaserseralaseralaproseralaalaser354045alaproalaglyglyglnproarggluproglnvaltyrthrleupro505560proserglngluglumetthrlysasnglnvalserleuthrcysleu65707580vallysglyphetyrproseraspilealavalglutrpgluserasn859095glyglnprogluasnasntyrlysthrthrproprovalleuaspser100105110aspglyserphepheleutyrserargleuthrvalasplysserarg115120125trpglngluglyasnvalphesercysservalmethisglualaleu130135140hisasnhistyrthrglnlysserleuserleuserleuglylysmet145150155160phetrpvalleuvalvalvalglyglyvalleualacystyrserleu165170175leuvalthrvalalapheileilephetrpvalargserlysargser180185190argglyglyhisserasptyrmetasnmetthrproargargprogly195200205prothrarglyshistyrglnprotyralaproproargasppheala210215220alatyrargserglyglyglyargvallyspheserargseralaasp225230235240alaproalatyrglnglnglyglnasnglnleutyrasngluleuasn245250255leuglyargarggluglutyraspvalleuasplysargargglyarg260265270aspproglumetglyglylysproargarglysasnproglnglugly275280285leutyrasngluleuglnlysasplysmetalaglualatyrserglu290295300ileglymetlysglygluargargargglylysglyhisaspglyleu305310315320tyrglnglyleuserthralathrlysaspthrtyraspalaleuhis325330335metglnalaleuproproargleugluglyglyglygluglyarggly340345350serleuleuthrcysglyaspvalglugluasnproglyproargmet355360365proproproargleuleuphepheleuleupheleuthrprometglu370375380valargproglugluproleuvalvallysvalglugluglyaspasn385390395400alavalleuglncysleulysglythrseraspglyprothrglngln405410415leuthrtrpserarggluserproleulyspropheleulysleuser420425430leuglyleuproglyleuglyilehismetargproleualailetrp435440445leupheilepheasnvalserglnglnmetglyglyphetyrleucys450455460glnproglyproproserglulysalatrpglnproglytrpthrval465470475480asnvalgluglyserglygluleupheargtrpasnvalseraspleu485490495glyglyleuglycysglyleulysasnargsersergluglyproser500505510serproserglylysleumetserprolysleutyrvaltrpalalys515520525aspargprogluiletrpgluglygluproprocysvalproproarg530535540aspserleuasnglnserleuserglnaspleuthrmetalaprogly545550555560serthrleutrpleusercysglyvalproproaspservalserarg565570575glyproleusertrpthrhisvalhisprolysglyprolysserleu580585590leuserleugluleulysaspaspargproalaargaspmettrpval595600605metgluthrglyleuleuleuproargalathralaglnaspalagly610615620lystyrtyrcyshisargglyasnleuthrmetserphehisleuglu625630635640ilethralaargprovalleutrphistrpleuleuargthrglygly645650655trplysvalseralavalthrleualatyrleuilephecysleucys660665670serleuvalglyileleuhisleuglnargalaleuvalleuargarg675680685lysarg690<210>37<211>22<212>prt<213>artificialsequence<220><223>syntheticpolypeptide<400>37metleuleuleuvalthrserleuleuleucysgluleuprohispro151015alapheleuleuilepro20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1