离子液体催化合成苯丙酸酯类衍生物的方法与流程
本发明涉及有机合成方法,具体涉及合成苯丙酸诺龙、苯丙酸睾酮等苯丙酸酯类衍生物的方法。
背景技术:
苯丙酸诺龙和苯丙酸睾酮都是甾类苯丙酸酯药物。苯丙酸诺龙又名苯丙酸去甲睾酮、多乐宝灵,是一类蛋白同化激素类药,既能促进从氨基酸合成蛋白质,又能抑制氨基酸分解生成尿素,并有促进体内钙质蓄积的功能,主要用于蛋白质缺乏症,如严重灼伤、恶性肿瘤患者手术前后、骨折后不易愈合和严重骨质疏松症、早产儿生长发育显著迟缓等。苯丙酸睾酮又名苯丙酸睾丸素,作用与睾丸酮相似,用于治疗雄激素缺乏症和月经过多或子宫肌瘤等症。此外,苯丙酸甲酯、苯丙酸乙酯、苯丙酸苄酯等苯丙酸酯都是重要的医药、化工中间体。因此,苯丙酸诺龙和苯丙酸睾酮等苯丙酸酯类衍生物作为一类重要的化合物,在医药、化工等行业有着非常大的市场需求。
丙酸诺龙和苯丙酸睾酮等苯丙酸酯类衍生物的合成方法,主要是以苯丙酸为原料,经过酰化、酯化两步反应得到相应的苯丙酸酯化合物。但在该方法中,需要用到酰化试剂(如氯化亚砜等具有易挥发、刺激性大、不稳定的试剂);反应的后处理过程中需要用到大量的碱中和反应所产生的酸;并且中间产物苯丙酰氯遇水易分解生成盐酸,操作控制难度较大;且存在生产周期长、能耗高、设备腐蚀严重、后处理麻烦等弊端,增加了生产成本。随着人们对于环保的重视,这种高污染、高能耗的合成技术必须要进行改进。因此,发展新的绿色合成苯丙酸酯类化合物的方法具有重要的应用价值。
技术实现要素:
本发明的目的在于提供一种新的苯丙酸酯类化合物的制备方法,在一定程度上解决背景技术中提到的问题。
为实现上述目的,本发明采用以下技术方案。
本发明的苯丙酸酯类化合物具有如式i所示的结构,
其中,r1、r2、r3、r4、r5分别为氢、卤素、烷基、烷氧基、硝基、氰基、氨基、二甲氨基、二乙氨基、吡咯烷(四氢吡咯)、哌啶(六氢吡啶)、吗啉中的一种;r1、r2、r3、r4、r5可以相同,也可以不相同。
本发明的苯丙酸酯类化合物的制备方法,包括如下步骤:
在离子液体催化剂的参与下,使结构如式ii所示的化合物(肉桂醛或其衍生物)与结构如式iii所示的化合物(醇或酚类衍生物)反应,得到所述的苯丙酸酯类化合物;
其中,r1、r2、r3、r4、r5分别为氢、卤素、烷基、烷氧基、硝基、氰基、氨基、二甲氨基、二乙氨基、吡咯烷(四氢吡咯)、哌啶(六氢吡啶)、吗啉中的一种;r1、r2、r3、r4、r5可以相同,也可以不相同;r为烷基、苄基、取代苄基、甾体、萜类、芳基、取代芳基中的一种。
在本发明的优选的实施方案中,所述的离子液体催化剂具有如式iv所示的结构:
式iv中,n=1~10,阴离子[b—]为醋酸根、钼酸根、钨酸根中的一种。
所述的离子液体催化剂的制备方法,包括如下步骤:
(1)将一定质量的咪唑卤代盐配制成质量分数为40~70%的乙醇溶液,通过强碱性离子交换树脂进行阴离子交换,得到氢氧化咪唑盐;
(2)按等摩尔计量比,将氢氧化咪唑盐分别与醋酸、钨酸或钼酸在40℃下搅拌反应6~8h,反应过程结束后分离脱去水,真空干燥后即得离子液体催化剂。
在本发明的优选的实施方案中,反应温度为50~150℃,更优选的反应温度为80~130℃。
在本发明的优选的实施方案中,反应时间为0.1~4h,更优选的为反应时间0.5~2h。
在本发明的优选的实施方案中,结构如式ii所示的化合物与结构如式iii所示的化合物的摩尔比为1~5:1,更优选的摩尔比为1.5~3:1;离子液体催化剂的用量为结构如式ii所示的化合物摩尔量的1%~30%,更优选为5%~15%。
在本发明的优选的实施方案中,反应所用溶剂为1,4-二氧六环(二恶烷)、n,n-二甲基甲酰胺(dmf)、二甲亚砜(dmso)、甲苯、1,2-二氯乙烷、二甲苯、氮甲基吡咯烷酮中的一种,更优选为甲苯或1,4-二氧六环。
本发明的方法的最大特点是利用离子液体作为催化剂,以肉桂醛或其衍生物和醇或酚类衍生物为原料,无需外加任何酸碱,经一步反应合成苯丙酸酯类化合物。与现有合成方法相比,本发明缩短了反应步骤和反应时间,大幅提高了苯丙酸酯类的收率,苯丙酸酯类化合物收率最高可达90%以上,避免了环境污染和设备腐蚀等问题,生产成本大幅降低,催化剂的回收套用十分简便。因此,本发明的方法是一种高效合成苯丙酸酯类化合物的新方法,绿色化程度极高,具有广阔的工业化应用前景。苯丙酸酯类化合物中的苯丙酸诺龙、苯丙酸睾酮等是原料药或药物中间体。
附图说明
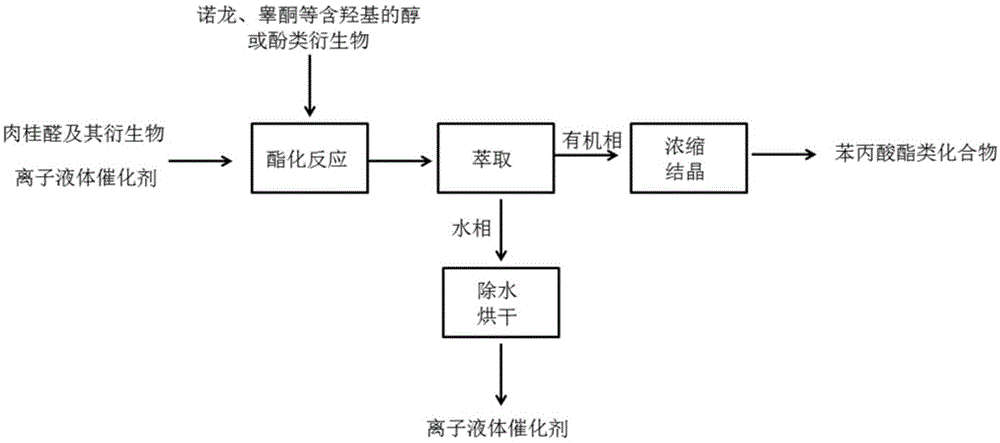
图1是本发明的方法的具体实施方式的流程示意图。
图2~40是苯丙酸酯类化合物的结构表征图。
具体实施方式
下面将结合实施例1~20来详细说明本发明所具有的有益效果,旨在帮助阅读者更好的理解本发明的实质,但不能对本发明的实施和保护范围构成任何限定。
苯丙酸酯类化合物的合成路线如下:
反应完毕后经简单萃取、浓缩或结晶即可得到产品苯丙酸酯类化合物。水相经过除水烘干即可实现离子液体催化剂的回收循环套用。
实施例1:苯丙酸正丁酯的合成
苯丙酸正丁酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑钨酸(简写为:([bmim]2[wo4]),其结构式为:
在100ml反应瓶中,加入0.397g(3mmol)肉桂醛、0.111g(1.5mmol)正丁醇、0.158g(0.3mmol)[bmim]2[wo4]催化剂、10ml甲苯,加热升温至120℃后反应2h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为93%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.31–7.24(m,2h),7.19(d,j=6.7hz,3h),4.06(t,j=6.7hz,2h),2.94(t,j=7.8hz,2h),2.62(t,j=7.8hz,2h),1.62–1.52(m,2h),1.39–1.28(m,2h),0.91(t,j=7.4hz,3h).
13cnmr(100mhz,cdcl3)δ173.01,140.61,128.49,128.31,126.25,64.35,35.96,31.04,30.69,19.14,13.72.
esi-ms:[m+h]+:calcd:207.3;found:207.6
实施例2:苯丙酸环己酯的合成
苯丙酸环己酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑醋酸(简写为:([bmim][oac]),其结构式为:
在100ml反应瓶中,加入0.265g(2mmol)肉桂醛、0.150g(1.5mmol)环己醇、0.04g(0.2mmol)[bmim][oac]催化剂、10ml的1,4-二氧六环,加热升温至100℃后反应1h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为65%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.30–7.24(m,2h),7.22–7.16(m,3h),4.75(td,j=8.8,4.1hz,1h),2.94(t,j=7.8hz,2h),2.60(t,j=7.8hz,2h),1.80(d,j=9.2hz,2h),1.73–1.63(m,2h),1.57–1.47(m,1h),1.42–1.28(m,4h),1.28–1.18(m,1h).
13cnmr(100mhz,cdcl3)δ172.38,140.66,128.45,128.33,126.19,72.66,36.28,31.63,31.11,25.40,23.75.
esi-ms:[m+h]+:calcd:233.3;found:233.1
实施例3:邻甲氧基苯丙酸正丁酯的合成
邻甲氧基苯丙酸正丁酯的结构为:
参与反应的离子液体催化剂为1-己基-3-甲基咪唑钼酸(简写为:([hmim]2[moo4]),其结构式为:
在100ml反应瓶中,加入0.486g(3mmol)邻甲氧基肉桂醛、0.111g(1.5mmol)正丁醇、0.075g(0.15mmol)[hmim]2[moo4]催化剂、10ml的1,4-二氧六环,加热升温至120℃后反应3h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为94%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.22-7.12(m,2h),6.85(dd,j=17.3,7.9hz,2h),4.06(t,j=6.7hz,2h),3.81(s,3h),2.93(t,j=7.8hz,2h),2.65-2.55(m,2h),1.64-1.52(m,2h),1.41-1.27(m,2h),0.92(t,j=7.4hz,3h).
13cnmr(100mhz,cdcl3)δ173.49,157.51,129.92,128.92,127.56,120.41,110.20,64.20,55.17,34.26,30.72,26.16,19.15,13.73.
esi-ms:[m+h]+:calcd:236.3;found:236.4
实施例4:对氯苯丙酸正丁酯的合成
对氯苯丙酸正丁酯的结构为:
参与反应的离子液体催化剂1-辛基-3-甲基咪唑醋酸(简写为:([omim][oac]),其结构式为:
在100ml反应瓶中,加入0.501g(3mmol)对氯基肉桂醛、0.111g(1.5mmol)正丁醇、0.127g(0.5mmol)[omim][oac]催化剂、10ml甲苯,加热升温至110℃后反应0.5h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为85%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.25(d,j=8.4hz,2h),7.13(d,j=8.3hz,2h),4.06(t,j=6.7hz,2h),2.91(t,j=7.7hz,2h),2.60(t,j=7.7hz,2h),1.62–1.52(m,2h),1.33(dq,j=14.6,7.4hz,2h),0.91(t,j=7.4hz,3h).
13cnmr(100mhz,cdcl3)δ172.69,139.02,132.03,129.69,128.57,64.43,35.74,30.65,30.33,19.10,13.67.
esi-ms:[m+h]+:calcd:240.7;found:240.9
实施例5:邻甲氧基苯丙酸环己酯的合成
邻甲氧基苯丙酸环己酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑钨酸(简写为:([bmim]2[wo4]),其结构式为:
在100ml反应瓶中,加入0.486g(3mmol)邻甲氧基肉桂醛、0.150g(1.5mmol)环己醇、0.158g(0.3mmol)[bmim]2[wo4]催化剂、10mldmf,加热升温至100℃后反应1.5h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为77%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.16(dd,j=18.8,7.7hz,2h),6.85(dd,j=16.9,7.9hz,2h),4.74(dd,j=8.2,4.5hz,1h),3.81(s,3h),2.93(t,j=7.8hz,2h),2.58(t,j=7.8hz,2h),1.81(d,j=9.9hz,2h),1.70(d,j=5.5hz,2h),1.57-1.48(m,1h),1.43-1.30(m,4h),1.26(dd,j=18.6,10.3hz,1h).
13cnmr(100mhz,cdcl3)δ172.86,157.52,129.94,128.98,127.51,120.38,110.19,72.46,55.18,34.58,31.67,26.18,25.44,23.78.
esi-ms:[m+h]+:calcd:256.3;found:256.6
实施例6:苯丙酸诺龙的合成
苯丙酸诺龙的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑钨酸(简写为:([bmim]2[wo4]),其结构式为:
在100ml反应瓶中,加入0.397g(3mmol)肉桂醛、0.411g(1.5mmol)诺龙、0.158g(0.3mmol)[bmim]2[wo4]催化剂、10ml1,4-二氧六环,加热升温至120℃后反应2.5h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,结晶得到目标产物,产率为74%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.27-7.30(m,2h),7.20-7.21(m,3h),5.83(s,1h),4.60-4.64(m,1h),2.94-2.97(m,2h),2.62-2.66(m,2h),2.62-2.70(m,2h),2.39-2.50(m,2h),2.23-2.29(m,3h),2.05-2.11(m,1h),1.81-1.84(m,2h),1.64-1.71(m,2h),1.42-1.56(m,2h),1.31-1.37(m,2h),1.17-1.26(m,3h),1.05-1.12(m,2h),0.84-0.88(m,1h),0.79(s,3h).
13cnmr(100mhz,cdcl3)δ199.93,172.92,166.43,140.51,128.47,128.29,126.24,124.67,82.55,49.51,49.37,42.72,42.72,40.56,36.56,36.51,36.03,35.44,31.09,30.63,27.42,26.59,26.01,23.33,12.03.
esi-ms:[m+h]+:calcd:407.6;found:407.7
实施例7:苯丙酸睾酮的合成
苯丙酸睾酮的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑醋酸(简写为:([bmim][oac]),其结构式为:
在100ml反应瓶中,加入0.397g(3mmol)肉桂醛、0.411g(1.5mmol)诺龙、0.06g(0.3mmol)[bmim][oac]催化剂、10ml1,4-二氧六环,加热升温至120℃后反应2h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,结晶得到目标产物,产率为64%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.28(d,j=7.5hz,2h),7.21(d,j=6.5hz,3h),5.73(s,1h),4.60(t,j=8.4hz,1h),2.95(t,j=7.8hz,2h),2.64(t,j=7.8hz,2h),2.44-2.33(m,3h),2.28(d,j=14.2hz,1h),2.22–2.09(m,1h),2.07-1.98(m,1h),1.89-1.80(m,1h),1.69(ddd,j=20.0,12.7,7.0hz,3h),1.61-1.52(m,2h),1.50-1.41(m,1h),1.41-1.29(m,2h),1.18(s,3h),1.13(dd,j=12.9,4.1hz,1h),1.09-0.99(m,2h),0.98-0.89(m,1h),0.78(s,3h).
13cnmr(100mhz,cdcl3)δ199.49,172.92,170.97,140.52,128.48,128.29,126.24,123.96,82.49,53.70,50.23,42.50,38.62,36.57,36.03,35.71,35.40,33.94,32.75,31.49,31.09,27.46,23.49,20.51,17.41,12.01.
esi-ms:[m+h]+:calcd:421.6;found:421.5
实施例8:苯丙酸芳樟酯的合成
苯丙酸芳樟酯的结构式为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑醋酸(简写为:([bmim][oac]),其结构式为:
在100ml反应瓶中,加入0.397g(3mmol)肉桂醛、0.230g(1.5mmol)芳樟醇、0.06g(0.3mmol)[bmim][oac]催化剂、10ml甲苯,加热升温至110℃后反应4.5h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为74%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.51-7.19(m,5h),6.68-6.62(m,4h),5.85-5.80(m,1h),5.16-4.97(m,3h),1.96(m,2h),1.65-1.60(m,4h),1.53-1.48(m,4h),1.20(s,3h).
13cnmr(101mhz,cdcl3)δ193.68,152.76,145.08,134.04,131.29,129.13,128.64,128.51,124.35,111.66,77.38,77.06,76.74,73.43,42.09,27.88,25.70,22.81,17.70.
esi-ms:[m+h]+:calcd:286.4;found:286.3
实施例9:苯丙酸苄酯的合成
苯丙酸苄酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑钨酸(简写为:([bmim]2[wo4]),其结构式为:
在100ml反应瓶中,加入0.397g(3mmol)肉桂醛、0.162g(1.5mmol)苯甲醇、0.162g(0.3mmol)[bmim]2[wo4]催化剂、10mldmso,加热升温至130℃后反应4.5h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为84%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.37-7.23(m,7h),7.18(t,j=7.7hz,3h),5.10(s,2h),2.96(t,j=7.8hz,2h),2.67(t,j=7.8hz,2h).
13cnmr(100mhz,cdcl3)δ172.74,140.47,136.01,128.60,128.57,128.37,128.27,126.33,66.32,35.95,31.01.
esi-ms:[m+h]+:calcd:241.3;found:241.0
实施例10:邻甲氧基苯丙酸苄酯的合成
邻甲氧基苯丙酸苄酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑钼酸(简写为:([bmim]2[moo4]),其结构式为:
在100ml反应瓶中,加入0.486g(3mmol)邻甲氧基肉桂醛、0.162g(1.5mmol)苯甲醇、0.131g(0.3mmol)[bmim]2[moo4]催化剂、10ml甲苯,加热升温至110℃后反应3.5h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为79%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.40-7.26(m,5h),7.23-7.16(m,1h),7.12(d,j=7.3hz,1h),6.84(dd,j=15.0,7.8hz,2h),5.10(s,2h),3.79(s,3h),2.96(t,j=7.8hz,2h),2.66(t,j=7.8hz,2h).
13cnmr(100mhz,cdcl3)δ173.23,157.53,136.16,130.00,128.77,128.55,128.21,128.16,127.64,120.47,110.24,66.15,55.19,34.25,26.17.
esi-ms:[m+h]+:calcd:271.3;found:271.7
实施例11:对氯苯丙酸苄酯的合成
对氯苯丙酸苄酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑醋酸(简写为:([bmim][oac]),其结构式为:
在100ml反应瓶中,加入0.501g(3mmol)对氯基肉桂醛、0.162g(1.5mmol)苯甲醇、0.06g(0.3mmol)[bmim][oac]催化剂、10ml1,4-二氧六环,加热升温至110℃后反应2.5h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为84%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.32(dd,j=7.9,5.7hz,3h),7.29-7.26(m,2h),7.21(d,j=8.4hz,2h),7.09(d,j=8.4hz,2h),5.09(s,2h),2.92(t,j=7.6hz,2h),2.64(t,j=7.6hz,2h).
13cnmr(101mhz,cdcl3)δ172.43,138.86,135.86,132.09,129.75,128.64,128.60,128.31,128.29,66.39,35.74,30.31.
esi-ms:[m+h]+:calcd:275.7;found:275.7
实施例12:苯丙酸苯酯的合成
苯丙酸苯酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑醋酸(简写为:([bmim][oac]),其结构式为:
在100ml反应瓶中,加入0.397g(3mmol)肉桂醛、0.150g(1.5mmol)苯酚、0.06g(0.3mmol)[bmim][oac]催化剂、10ml1,4-二氧六环,加热升温至110℃后反应2h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为88%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.38-7.28(m,4h),7.28-7.17(m,4h),7.00(d,j=7.9hz,2h),3.07(t,j=7.7hz,2h),2.87(t,j=7.7hz,2h).
13cnmr(100mhz,cdcl3)δ171.41,150.72,140.19,129.44,128.64,128.46,126.50,125.83,121.58,36.04,31.01.
esi-ms:[m+h]+:calcd:226.3;found:226.2
实施例13:对氯苯丙酸苯酯的合成
对氯苯丙酸苯酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑醋酸(简写为:([bmim][oac]),其结构式为:
在100ml反应瓶中,加入0.501g(3mmol)对氯基肉桂醛、0.150g(1.5mmol)苯酚、0.06g(0.3mmol)[bmim][oac]催化剂、10ml1,4-二氧六环,加热升温至110℃后反应2h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为73%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.35(t,j=7.9hz,2h),7.28(d,j=8.4hz,2h),7.20(dd,j=13.1,8.0hz,3h),7.00(d,j=7.7hz,2h),3.02(t,j=7.5hz,2h),2.85(t,j=7.5hz,2h).
13cnmr(100mhz,cdcl3)δ171.12,150.63,138.63,132.29,129.85,129.47,128.74,125.91,121.52,35.82,30.28.
esi-ms:[m+h]+:calcd:261.7;found:261.2
实施例14:邻甲氧基苯丙酸苯酯的合成
邻甲氧基苯丙酸苯酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑钼酸(简写为:([bmim]2[moo4]),其结构式为:
在100ml反应瓶中,加入0.486g(3mmol)邻甲氧基肉桂醛、0.150g(1.5mmol)苯酚、0.131g(0.3mmol)[bmim]2[moo4]催化剂、10ml1,4-二氧六环,加热升温至110℃后反应2h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为76%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.34(t,j=7.5hz,2h),7.25-7.15(m,3h),7.02(d,j=8.5hz,2h),6.93–6.82(m,2h),3.82(d,j=1.0hz,3h),3.06(t,j=7.6hz,2h),2.86(t,j=7.5hz,2h).
13cnmr(100mhz,cdcl3)δ171.87,157.62,150.86,130.19,129.40,128.49,127.86,125.72,121.67,120.53,110.35,55.26,34.35,26.30.
esi-ms:[m+h]+:calcd:257.3;found:257.2
实施例15:苯丙酸萘酯的合成
苯丙酸萘酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑钨酸(简写为:([bmim]2[wo4]),其结构式为:
在100ml反应瓶中,加入0.397g(3mmol)肉桂醛、0.216g(1.5mmol)萘酚、0.162g(0.3mmol)[bmim]2[wo4]催化剂、10ml1,4-二氧六环,加热升温至120℃后反应2h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为80%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.83(d,j=8.1hz,1h),7.71(d,j=8.2hz,1h),7.58(d,j=8.3hz,1h),7.50-7.39(m,3h),7.38-7.30(m,4h),7.27(t,j=6.7hz,1h),7.16(d,j=7.5hz,1h),3.17(t,j=7.3hz,2h),3.06(t,j=7.3hz,2h).
13cnmr(100mhz,cdcl3)δ171.47,146.62,140.15,134.67,128.74,128.57,128.01,126.79,126.59,126.44,126.05,125.41,121.20,118.05,36.02,31.13.
esi-ms:[m+h]+:calcd:277.3;found:277.1
实施例16:苯丙酸对甲基苯酯的合成
苯丙酸对甲基苯酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑钨酸(简写为:([bmim]2[wo4]),其结构式为:
在100ml反应瓶中,加入0.397g(3mmol)肉桂醛、0.162g(1.5mmol)对甲基苯酚、0.162g(0.3mmol)[bmim]2[wo4]催化剂、10ml1,4-二氧六环,加热升温至120℃后反应2h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为78%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.34-7.20(m,5h),7.14(d,j=8.1hz,2h),6.88(d,j=7.5hz,2h),3.06(t,j=7.7hz,2h),2.86(dd,j=8.1,7.1hz,2h),2.32(s,3h).
13cnmr(100mhz,cdcl3)δ171.62,148.47,140.24,135.45,129.95,128.62,128.46,126.46,121.24,36.04,31.04,20.89.
esi-ms:[m+h]+:calcd:241.3;found:241.4
实施例17:对氯苯丙酸对甲基苯酯的合成
对氯苯丙酸对甲基苯酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑醋酸(简写为:([bmim][oac]),其结构式为:
在100ml反应瓶中,加入0.501g(3mmol)对氯基肉桂醛、0.162g(1.5mmol)对甲基苯酚、0.06g(0.3mmol)[bmim][oac]催化剂、10ml1,4-二氧六环,加热升温至120℃后反应2h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,结晶得到目标产物,产率为82%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.27(d,j=8.0hz,2h),7.16(dd,j=15.8,8.0hz,4h),6.88(d,j=8.0hz,2h),3.02(t,j=7.5hz,2h),2.84(t,j=7.5hz,2h),2.32(s,3h).
13cnmr(100mhz,cdcl3)δ171.33,148.37,138.67,135.54,132.25,129.90,128.71,121.16,35.82,30.31,20.87.
esi-ms:[m+h]+:calcd:275.4;found:275.4
实施例18:邻甲氧基苯丙酸对甲基苯酯的合成
邻甲氧基苯丙酸对甲基苯酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑醋酸(简写为:([bmim][oac]),其结构式为:
在100ml反应瓶中,加入0.486g(3mmol)邻甲氧基肉桂醛、0.162g(1.5mmol)对甲基苯酚、0.06g(0.3mmol)[bmim][oac]催化剂、10ml1,4-二氧六环,加热升温至120℃后反应2h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为72%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.22(dd,j=10.4,5.7hz,2h),7.14(d,j=8.3hz,2h),6.94-6.82(m,4h),3.83(s,3h),3.05(t,j=7.7hz,2h),2.84(t,j=7.7hz,2h),2.32(s,3h).
13cnmr(100mhz,cdcl3)δ172.08,157.60,148.58,135.30,130.17,129.89,128.53,127.80,121.30,120.50,110.31,55.24,34.33,26.29,20.88.
esi-ms:[m+h]+:calcd:271.3;found:271.2
实施例19:苯丙酸对甲氧基苯酯的合成
苯丙酸对甲氧基苯酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑醋酸(简写为:([bmim][oac]),其结构式为:
在100ml反应瓶中,加入0.397g(3mmol)肉桂醛、0.186g(1.5mmol)对甲基苯酚、0.06g(0.3mmol)[bmim][oac]催化剂、10ml1,4-二氧六环,加热升温至120℃后反应2h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为76%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.35-7.28(m,2h),7.23(dd,j=15.0,7.1hz,3h),6.94-6.88(m,2h),6.88-6.82(m,2h),3.76(s,3h),3.05(t,j=7.7hz,2h),2.85(t,j=7.7hz,2h).
13cnmr(100mhz,cdcl3)δ171.83,157.28,144.19(s),140.24,128.64,128.47,126.49,122.33,114.48,55.60,35.99,31.04.
esi-ms:[m+h]+:calcd:257.3;found:257.1
实施例20:邻甲氧基苯丙酸对甲氧基苯酯的合成
邻甲氧基苯丙酸对甲氧基苯酯的结构为:
参与反应的离子液体催化剂为1-丁基-3-甲基咪唑醋酸(简写为:([bmim][oac]),其结构式为:
在100ml反应瓶中,加入0.486g(3mmol)邻甲氧基肉桂醛、0.186g(1.5mmol)对甲基苯酚、0.06g(0.3mmol)[bmim][oac]催化剂、10ml1,4-二氧六环,加热升温至120℃后反应2h,反应结束后冷却到室温,加入30ml水和20ml乙酸乙酯萃取,静置分相,有机相浓缩,精馏得到目标产物,产率为81%。产物表征数据如下:
1hnmr(400mhz,cdcl3)δ7.25-7.16(m,2h),6.96-6.88(m,3h),6.86(d,j=2.3hz,2h),6.84(d,j=2.3hz,1h),3.83(s,3h),3.76(s,3h),3.05(t,j=7.6hz,2h),2.84(t,j=7.7hz,2h).
13cnmr(100mhz,cdcl3)δ172.29,157.60,157.19,144.30,130.18,128.49,127.83,122.39,120.50,114.43,110.31,55.59,55.25,34.26,26.31.
esi-ms:[m+h]+:calcd:287.3;found:287.5
以上所述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!