一种利用微量临床穿刺样本进行染色质免疫共沉淀文库制备的方法及其应用与流程
本发明属于生物技术领域,具体涉及一种利用微量临床穿刺样本进行染色质免疫共沉淀文库制备的方法及其应用。
背景技术:
染色质免疫共沉淀测序技术(chromatinimmunoprecipitationfollowedbysequencing,chip-seq)是一种将染色质免疫共沉淀(chromatinimmunoprecipitation,chip)与高通量测序相结合的革命性技术。该技术可在全基因组范围内鉴定转录因子、组蛋白修饰、核小体和rna结合蛋白等在染色质上的结合位点。与传统的基于芯片的chip-chip(chromatinimmunoprecipitationcombinedwithdnatilingarrays)不同,chip-seq提供了一种高分辨率、高特异性、高覆盖度的研究蛋白质-dna相互作用的新策略。chip-seq技术可以应用到任何基因组序列已知的物种,可以研究任何一种dna相关蛋白与其靶定dna之间的相互作用,并能确切得到蛋白质所结合的每一个片段的序列信息。随着测序成本的降低,chip-seq逐步成为研究基因调控和表观遗传机制的常用手段。其基本原理是:在生理状态下,首先利用甲醛处理细胞,以固定蛋白质及其相互作用的dna;然后裂解细胞并分离染色质,通过超声或酶对染色质进行片段化;之后利用特异性的抗体富集与目的蛋白质相结合的dna片段;对dna片段加接头后,便可利用pcr进行文库制备和高通量测序;最后结合生物信息学分析的手段,在全基因组范围内鉴定dna结合蛋白的结合位点。利用chip-seq可获得全基因组范围内与组蛋白或转录因子等dna结合蛋白相互作用的dna序列信息,其长度大约为200bp,从而有助于深入研究dna结合蛋白的调控网络和作用机制。
传统的chip-seq技术虽然具有高分辨率、低噪音、高覆盖度等优点,但也存在一些问题:第一,目前chip-seq对样本起始量要求过高,组织样品总量至少需要200mg;第二,前期染色质免疫共沉淀实验步骤冗繁,需要经历甲醛交联、细胞裂解、超声破碎、抗体富集目的蛋白与dna复合物、目的蛋白消解及解交联、纯化目的dna片段、目的dna片段末端修复、目的dna片段末端腺苷酸化、目的dna片段连接接头、pcr扩增等步骤。步骤的繁琐性导致建库周期长、成功率低等缺陷。
chip-seq对样本起始量的要求限制了该技术在微量样本和珍稀材料,尤其是临床穿刺样本中的应用。相比较传统的建库方式需要经过dna片段化、末端修复、接头连接、文库扩增、多次纯化分选等步骤。近年来兴起的tn5转座系统建库可将dna片段化、末端修复、接头连接等多步反应转变为一步反应,极大地缩短了建库时间,提高了工作效率,已被广泛应用于高通量测序领域,如atac-seq、lianti(linearamplificationviatransposoninsertion,通过转座子的线性放大)、单倍体分型、结构变异检测等。
技术实现要素:
本发明要解决的技术问题是如何对稀有而微量的临床组织样本进行简单、快速、高效而且低成本的染色质免疫共沉淀文库制备。经过系统的评估和优化,形成了如下方案:首先,将微量的穿刺组织样本进行甲醛处理并将其匀浆破碎;其次,将组织碎片进行细胞裂解,提取细胞核;然后,使用非接触式的超声打断仪将染色质dna片段化;进而与特异性抗体共孵育,富集目的蛋白及其结合的dna片段;最后,使用tn5转座系统对富集到的dna片段进一步片段化及连接文库接头,蛋白酶消解目的蛋白后对文库进行扩增。
为了解决上述技术问题,本发明首先提供了tn5转座系统的新用途。
本发明提供了tn5转座系统在构建染色质免疫共沉淀文库中的应用。
本发明还提供了tn5转座系统在制备构建染色质免疫共沉淀文库的产品中的应用。
本发明还提供了tn5转座系统在基于微量组织样本构建染色质免疫共沉淀文库中的应用。
本发明还提供了tn5转座系统在制备基于微量组织样本构建染色质免疫共沉淀文库的产品中的应用。
上述应用中,所述组织样本的最低起始量为5mg;进一步的,所述起始量可为(5-50)mg;更进一步的,所述起始量可为(5-15)mg。
为了解决上述技术问题,本发明又提供了一种染色质免疫共沉淀文库的构建方法。
本发明提供的染色质免疫共沉淀文库的构建方法包括如下步骤:
1)将组织样本依次进行甲醛处理和染色质dna片段化,然后与特异性目的蛋白抗体孵育,得到目的蛋白-dna复合物;
2)用tn5转座系统将所述目的蛋白-dna复合物中的dna片段进行片段化、末端修复和连接接头,然后用蛋白酶消解所述目的蛋白,得到dna产物;
3)以所述dna产物为模板进行pcr扩增,得到所述染色质免疫共沉淀文库。
上述染色质免疫共沉淀文库的构建方法中,所述1)中,所述组织样本的最低起始量为5mg;进一步的,所述起始量可为(5-50)mg;更进一步的,所述起始量可为(5-15)mg。在本发明的具体实施例中,所述组织样本的起始量为7.7mg、11.4mg、5.5mg。
所述组织样本可为穿刺组织样本、动物组织样本或临床组织样本,尤其是针对临床上少量或者稀有的生理组织样本或病理组织样本,如癌组织。在本发明的具体实施例中,所述组织样本为肝穿刺组织样本。
上述染色质免疫共沉淀文库的构建方法中,所述1)可包括如下步骤:
1-1)向组织样本中加入甲醛溶液进行交联反应,得到交联产物;
1-2)将所述交联产物进行匀浆破碎,得到组织碎片;
1-3)向所述组织碎片中加入细胞裂解液,得到裂解后细胞,离心,收集沉淀,得到细胞核;
1-4)将所述细胞核内的染色质dna进行片段化,得到片段化的dna片段;
1-5)将所述片段化的dna片段与特异性目的蛋白抗体共孵育,富集所述目的蛋白及与其结合的dna片段,得到所述目的蛋白-dna复合物。
进一步的,所述1-1)前还包括洗涤组织样本的步骤,所述洗涤的方法具体可按照如下步骤进行:向组织样本中加入pbs溶液(ph7.4)洗涤组织样本,在4℃、500g条件下离心10分钟,去除pbs溶液,得到洗涤后的组织样本。
所述1-1)可包括如下步骤:向所述洗涤后的组织样本中加入甲醛溶液,静置5分钟;然后再加入甘氨酸溶液终止反应,静置3分钟,得到交联产物。
所述甲醛溶液可为体积百分比为1%的甲醛溶液;所述甘氨酸溶液可为浓度为0.125mol/l的甘氨酸溶液。
所述1-2)中,所述匀浆破碎的方法可为离心;所述离心的具体方法可按照如下步骤进行:将所述交联产物在4℃、500g条件下离心10分钟,弃上清液,收集沉淀。
所述匀浆破碎后还包括洗涤的步骤;所述洗涤的方法具体可按照如下步骤进行:向所述沉淀中加入含有pmsf的pbs溶液在4℃、500g条件下离心3分钟,洗涤2次,得到洗涤后的组织碎片。
所述1-3)可包括如下步骤:向所述洗涤后的组织碎片中加入细胞裂解缓冲液,冰浴10分钟,得到裂解后的细胞;将所述裂解后的细胞在4℃、1,000g条件下离心10分钟,弃上清液,收集沉淀,即为细胞核。
所述1-4)中,采用超声破碎的方法将所述细胞核内的染色质dna进行片段化。所述超声破碎的方法具体可按照如下步骤进行:将所述沉淀用超声缓冲液重悬在超声打断管内,然后在生物打断仪上打断10分钟(设置程序如下:工作30秒,停止30秒;共10个循环),得到超声后的溶液。
所述1-5)可包括如下步骤:将含有超声后的溶液的超声打断管放入离心管内,4℃、13,000rpm离心5分钟,然后将上清液转入新的离心管内,并加入免疫共沉淀缓冲液至总体积为200μl,再将特异性目的蛋白抗体(约2μg)加入离心管内,4℃过夜旋转混匀孵育,得到共沉淀溶液。
上述染色质免疫共沉淀文库的构建方法中,所述1)和所述2)之间还可包括用蛋白a/g磁珠进行纯化的步骤。所述用蛋白a/g磁珠进行纯化的具体方法可按照如下步骤进行:取20μl蛋白a/g磁珠于离心管内,置于磁力架上至磁珠完全吸附,去除上清液;加入200μl的含有0.1%(质量百分比)bsa的pbs溶液,混匀,然后4℃过夜旋转混匀,得到封闭后的蛋白a/g磁珠。将所述封闭后的蛋白a/g磁珠加入所述共沉淀溶液中,4℃旋转混匀2小时,得到共孵育后的溶液。将所述共孵育后的溶液置于磁力架上至澄清(之后处理都在冰上进行),去除上清液,然后用200μl漂洗缓冲液ⅰ漂洗2次,200μl漂洗缓冲液ⅱ漂洗1次,200μl漂洗缓冲液ⅲ漂洗1次;使用200μl预冷的tris-hcl(ph8.0)漂洗2次,得到漂洗后的磁珠。
上述染色质免疫共沉淀文库的构建方法中,所述2)可包括如下步骤:向目的蛋白-dna复合物中加入tn5转座系统,反应,得到反应产物;向所述反应产物中加入蛋白酶k进行解交联反应,去除所述反应产物中的目的蛋白,得到dna产物。
进一步的,所述tn5转座系统是tn5转座酶和其特异性结合的dna接头形成的复合物,是通过表达纯化的tn5转座酶与特异的双链dna接头结合形成的具有双链dna切割活性的转座酶系统。该系统可以将微量的dna有效的片段化,并将其自带接头一步连接在靶dna两端。
所述tn5转座系统可自行制备获得,具体制备方法可参照文献:picellis,
更进一步的,所述2)可包括如下步骤:
2-1)将所述漂洗后的磁珠重悬于反应缓冲液中,然后加入tn5转座系统和5×peg8000缓冲液(所述tn5转座系统和所述5×peg8000缓冲液的体积比可为3:8),在恒温旋转反应器中在55℃、500rpm条件下打断10分钟,得到磁珠反应混合液;
2-2)将所述磁珠反应混合液置于磁力架上至澄清,去除上清液,然后用漂洗缓冲液ⅰ漂洗2次,漂洗缓冲液iv漂洗2次,得到漂洗后的磁珠;
2-3)使用洗脱液重悬所述漂洗后的磁珠,并加入蛋白酶k溶液在55℃、500rpm条件下反应1小时,再在65℃、500rpm条件下解交联8小时,得到解交联后的磁珠混合液;所述蛋白酶k溶液的浓度可为10mg/ml;
2-4)将所述解交联后的磁珠混合液置于磁力架上至完全澄清,将上清液转移至收集管内,并重新加入洗脱液及蛋白酶k溶液在55℃、500rpm条件下反应1小时,然后再次收集反应液于上述收集管中,得到洗脱液(含有dna产物)。
上述染色质免疫共沉淀文库的构建方法中,所述2)和所述3)之间还可包括纯化所述dna产物的步骤。所述纯化的方法可为磁珠纯化。所述磁珠纯化的具体方法可按照如下步骤进行:将spriampurexp磁珠(简称xp磁珠)提前室温混匀平衡30分钟。然后将xp磁珠加入所述洗脱液中,轻柔混匀。室温静置5分钟,转移至磁力架静置5分钟,去除上清液,并使用新鲜的80%乙醇溶液漂洗磁珠2次。磁珠置于磁力架上晾干2分钟,加入te缓冲液重悬磁珠,吹打50次。室温静置5分钟,然后放入磁力架静置5分钟,收集上清液即为纯化后的dna产物。
上述染色质免疫共沉淀文库的构建方法中,所述3)中,所述pcr扩增的反应体系可为:上清液18.7μl、10×pfx缓冲液(invitrogen)2.5μl、10μm的上下游引物各1μl、50mm的mgso4溶液1μl、25mm的dntp0.4μl、pfx酶(invitrogen)0.4μl。
所述pcr扩增的反应程序可为:94℃反应2分钟;94℃变性15秒,62℃退火30秒,72℃延伸30秒,反应24个循环;72℃反应10分钟。
为了解决上述技术问题,本发明还提供了一种获得与目的蛋白所结合的dna片段的序列信息的方法。
本发明提供的获得与目的蛋白所结合的dna片段的序列信息的方法包括将按照上述方法构建得到的染色质免疫共沉淀文库进行测序的步骤。
所述测序的方法具体可按照如下步骤进行:使用illuminaxten测序仪对构建得到的染色质免疫共沉淀文库进行pe150双端测序。
为了解决上述技术问题,本发明最后提供一种用于构建染色质免疫共沉淀文库的试剂盒。
本发明提供的用于构建染色质免疫共沉淀文库的试剂盒包括tn5转座系统。
进一步的,所述试剂盒还可包括如下试剂中的至少一种:体积百分比为1%的甲醛溶液、终浓度为0.125mol/l的甘氨酸溶液、细胞裂解缓冲液(含5μl100×pi)、超声缓冲液、免疫共沉淀缓冲液、5×peg8000缓冲液、浓度为10mg/ml的蛋白酶k溶液、spriampurexp磁珠、蛋白a/g磁珠。
更进一步的,所述试剂盒还可包括如下试剂中的至少一种:pbs溶液(ph7.4)、含有pmsf(pmsf浓度为1μm)的pbs溶液、含有bsa(质量百分比为0.1%)的pbs溶液、漂洗缓冲液ⅰ、漂洗缓冲液ⅱ、漂洗缓冲液ⅲ、tris-hcl(ph8.0)、反应缓冲液、洗脱液、80%乙醇溶液、te缓冲液。
上述方法或上述试剂盒在如下(1)-(3)中任一种中的应用也属于本发明的保护范围:
(1)研究目的蛋白与其靶dna之间的相互作用;
(2)获得与目的蛋白所结合的dna片段的序列信息;
(3)鉴定或辅助鉴定dna结合蛋白的结合位点。
本发明的有益效果:1、能将微量的组织进行文库制备从而使一些无法满足常规染色体免疫共沉淀文库制备的样本进行有效研究,并且文库制备是针对微量样本,有效的节省试剂及实验所需费用;2、缩短了文库制备的周期。与常规染色体免疫共沉淀文库制备所需的4-5天的建库周期相比,本方法只需要约1.5天的建库周期。从而极大的节省了实验所用时间。
本发明根据tn5转座系统的特性,利用高敏型tn5转座酶成功开发了一种基于微量临床穿刺样本的染色质免疫共沉淀测序文库制备方法,可以对微量的穿刺组织样本有效、快速进行chip-seq文库构建。利用tn5转座系统构建chip-seq文库不仅高效、简单,而且成功率高,而且相比于传统的chip-seq建库方式,该方法大大降低样本起始量(5-50mg),有效缩短了建库时间(约1.5天),满足了测序市场对微量样本和大规模样本处理速度的需求。
附图说明
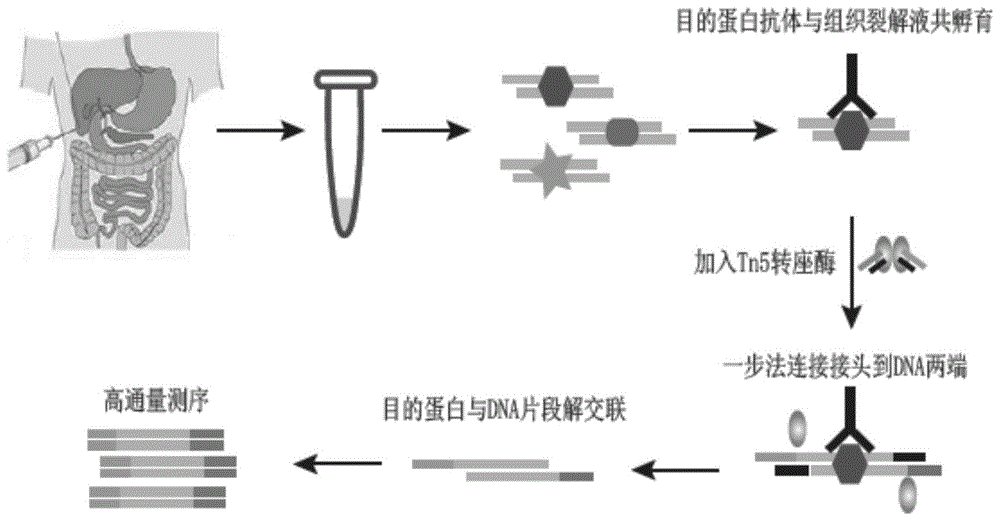
图1为基于tn5转座系统快速免疫共沉淀流程图。
图2为3个生物学重复的不同个体的临床肝组织穿刺样本h3k4me3的免疫共沉淀相关性分析。
图3为3个临床样本h3k4me3结合dna片段在转录起始位点区域(上下游2000bp)的分布情况。
图4为3个样本h3k4me3在转录起始位点区域(上下游2000bp)的结合强度的热力图。
图5为3个样本的h3k4me3在人的基因组的1号染色体约800bp区域内的富集情况展示。
图6为在人的肝组织中特异性表达的基因f2和hpx的h3k4me3结合信号。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例中所使用的溶液配方如下:
pbs溶液(ph7.4):nacl137mmol/l,kcl2.7mmol/l,na2hpo410mmol/l,kh2po42mmol/l。
细胞裂解缓冲液:50mmhepes/koh(ph7.4),140mmnacl,1mmedta,0.5mmegta,10%glycerol,0.5%np-40,0.25%tritonx-100,1×proteaseinhibitors。
超声缓冲液:10mmtris-hcl(ph7.6),1mmedta,0.1%sds。
免疫共沉淀缓冲液:20mmhepes,0.1%sds,1%tritonx-100,150mmnacl,1mmedta,0.5mmegta。
漂洗缓冲液ⅰ:20mmhepes,150mmnacl,0.1%sds,0.1%doc,1%tritonx-100,1mmedta,0.5mmegta。
漂洗缓冲液ⅱ:20mmhepes,500mmnacl,0.1%sds,0.1%doc,1%tritonx-100,1mmedta,0.5mmegta。
漂洗缓冲液ⅲ:20mmhepes,250mmlicl,0.5%doc,0.5%np-40,1mmedta,0.5mmegta。
漂洗缓冲液ⅳ:20mmhepes,1mmedta,0.5mmegta。
洗脱液:0.5%sds,300mmnacl,5mmedta,10mmtris-hcl(ph8.0)。
te缓冲液:10mmtris-hcl(ph8.0),1mmedta。
反应缓冲液:10mmtris-hcl(ph8.0),5mmmgcl2。
5×peg8000缓冲液:50mmtaps-naoh(ph8.5),25mmmgcl2,40%peg8000。
实施例1、染色质免疫共沉淀文库的制备方法
本发明的基于tn5转座系统快速免疫共沉淀流程图如图1所示。其中包括临床穿刺样本收集,经过甲醛交联、组织匀浆、细胞裂解、超声打断dna片段、目的蛋白免疫共沉淀、tn5转座系统打断目的蛋白所结合的dna片段及一步连接文库接头、蛋白消解及解交联目的蛋白所结合的dna片段、富集目的蛋白结合的dna片段并扩增等步骤。具体步骤如下:
1、将临床穿刺样本组织放入1.5ml离心管中,加入500μl预冷的pbs溶液(ph7.4)洗涤组织,利用桌面型离心机在4℃、500g条件下离心10分钟,去除pbs溶液,得到洗涤后的组织。
2、完成步骤1后,向步骤1获得的洗涤后的组织中加入1ml的1%(体积百分比)的甲醛溶液(溶剂为pbs溶液),室温静置5分钟。然后再加入甘氨酸溶液(终浓度为0.125mol/l)终止反应,室温放置3分钟,得到甲醛交联并终止后的组织。
3、完成步骤2后,将步骤2获得的甲醛交联并终止后的组织在4℃、500g条件下离心10分钟,弃上清液,收集沉淀并向沉淀中加入1ml预冷的含有pmsf(pmsf浓度为1μm)的pbs溶液在4℃、500g条件下离心3分钟,洗涤2次,得到洗涤后的组织。
4、完成步骤3后,向步骤3获得的洗涤后的组织中加入500μl细胞裂解缓冲液(含5μl100×pi),冰浴10分钟,得到裂解后的细胞。
5、完成步骤4后,将步骤4获得的裂解后的细胞在4℃、1,000g条件下离心10分钟,去除上清液,然后将沉淀的细胞核用80μl的超声缓冲液重悬在650μl的超声打断管内,在生物打断仪上打断10分钟(设置程序如下:工作30秒,停止30秒;共10个循环),得到超声后的溶液。
6、完成步骤5后,将650μl的含有超声后的溶液的超声打断管放入1.5ml离心管内,4℃、13,000rpm离心5分钟,将上清液转入新的1.5ml离心管内,并加入免疫共沉淀缓冲液至总体积为200μl,再将特异性的目的蛋白抗体(约2μg)加入离心管内,4℃过夜旋转混匀孵育,得到共沉淀溶液。
7、完成步骤6后,取20μl蛋白a/g磁珠(thermofisher)于1.5ml离心管内,置于磁力架上至磁珠完全吸附,去除上清液;加入200μl的含有0.1%(质量百分比)bsa的pbs溶液,混匀,然后4℃过夜旋转混匀,得到封闭后的蛋白a/g磁珠。
8、完成步骤7后,将步骤7获得的封闭后的蛋白a/g磁珠加入步骤6获得的共沉淀溶液中,4℃旋转混匀2小时,得到共孵育后的溶液。
9、完成步骤8后,将步骤8获得的共孵育后的溶液置于磁力架上至澄清(之后处理都在冰上进行),去除上清液,然后用200μl漂洗缓冲液ⅰ漂洗2次,200μl漂洗缓冲液ⅱ漂洗1次,200μl漂洗缓冲液ⅲ漂洗1次;使用200μl预冷的tris-hcl(ph8.0)漂洗2次,得到漂洗后的磁珠。
10、完成步骤9后,将步骤9获得的漂洗后的磁珠重悬于30μl反应缓冲液中,然后加入3μltn5转座系统(illumina,nexteratmdnasampleprepkit)和8μl5×peg8000缓冲液,在恒温旋转反应器中以55℃、500rpm的条件打断10分钟,得到磁珠反应混合液。
11、完成步骤10后,将步骤10获得的磁珠反应混合液置于磁力架上至澄清,去除上清液,然后再次用200μl漂洗缓冲液ⅰ漂洗2次,200μl漂洗缓冲液iv漂洗2次,得到漂洗后的磁珠。
12、完成步骤11后,使用70μl洗脱液重悬步骤11获得的漂洗后的磁珠,并加入2μl蛋白酶k(takara,10mg/ml)在55℃、500rpm条件下反应1小时,再在65℃、500rpm条件下解交联8小时,得到解交联后的磁珠混合液。
13、完成步骤12后,将步骤12获得的解交联后的磁珠混合液置于磁力架上至完全澄清,将约70μl的上清液转移至收集管(新的1.5ml离心管)内,并重新加入30μl的洗脱液及1μl的蛋白酶k在55℃、500rpm条件下反应1小时,然后再次收集约30μl反应液于上述收集管中,共得到100μl洗脱液。
14、完成步骤13后,将spriampurexp磁珠(简称xp磁珠,beckman)提前室温混匀平衡30分钟。然后将180μl(1.8×)的xp磁珠加入100μl步骤13获得的洗脱液中,轻柔混匀。室温静置5分钟,转移至磁力架静置5分钟,去除上清液,并使用200μl新鲜的80%乙醇溶液漂洗磁珠2次。磁珠置于磁力架上晾干2分钟,加入20μlte缓冲液重悬磁珠,吹打50次。室温静置5分钟,然后放入磁力架静置5分钟,吸取19μl上清液。
15、完成步骤14后,以步骤14获得的上清液为模板于pcr管中进行pcr反应,得到pcr反应液(25μl)。
pcr反应体系为25μl:上清液18.7μl;10×pfx缓冲液(invitrogen)2.5μl;10μm的上下游引物各1μl;50mm的mgso4溶液1μl;25mm的dntp0.4μl;pfx酶(invitrogen)0.4μl。
pcr反应程序为:94℃反应2分钟;94℃变性15秒,62℃退火30秒,72℃延伸30秒,反应24个循环;72℃反应10分钟。
16、完成步骤15后,将步骤15获得的pcr反应液(25μl)使用1×spriampurexp磁珠纯化(25μl)。具体步骤同步骤14,最后用16μlte缓冲液洗脱,得到pcr洗脱液。
17、完成步骤16后,吸取1μl步骤16获得的pcr洗脱液使用qubit3.0定量。定量合格的样品用于测序分析。
实施例2、染色质免疫共沉淀文库的制备方法的应用
一、临床穿刺样本
以3个不同个体来源的肝穿刺组织样本(来源于南昌大学第二附属医院,所有个体均知情同意)作为临床穿刺样本,临床穿刺样本起始量分别为7.7mg、11.4mg、5.5mg。
二、染色质免疫共沉淀文库的制备
基于步骤一的临床穿刺样本按照实施例1中的方法构建染色质免疫共沉淀文库。其中,目的蛋白为h3k4me3,步骤6中的特异性的目的蛋白抗体为h3k4me3抗体(activemotif)。步骤12中的上下游引物序列分别如下(nnnnnnnnn为文库index序列):
s501:
aatgatacggcgaccaccgagatctacannnnnnnntcgtcggcagcgtc;
n701:
caagcagaagacggcatacgagatnnnnnnnngtctcgtgggctcgg。
三、测序
使用illuminaxten测序仪对步骤二构建得到的染色质免疫共沉淀文库进行pe150双端测序。
四、数据分析及结果
1、数据分析方法
首先利用trimmomatic(0.36)软件过滤chip-seq原始测序数据中接头和质量低的测序数据,然后使用bowtie2软件,利用默认参数比对到人类参考基因组(hg19)。通过统计人类基因组每10kb窗口中的reads数目,比较计算三个样本之间皮尔森相关系数(pearson相关系数)。然后利用ngsplot软件计算chip-seqreads在转录起始位点上下游2kb的分布。chip-seq信号在整个基因组的分布和观察使用在线软件ucscgenomebrowser(http://genome.ucsc.edu/),具体生物信息学分析方法参照文献:dahlja,jungi,aanesh,etal.broadhistoneh3k4me3domainsinmouseoocytesmodulatematernal-to-zygotictransition[j].nature,2016,537(7621):548.中的方法。
2、数据分析结果
通过对3个样本进行相关性分析发现:3个样本间的pearson相关系数在0.85左右,相关性较高(图2)。通过对3个样本h3k4me3结合dna片段在转录起始位点区域(上下游2000bp)的分布情况进行分析发现:h3k4me3主要分布在转录起始位点(tss),具有双峰结构。与已知文献(barskia,cuddapahs,cuik,etal.high-resolutionprofilingofhistonemethylationsinthehumangenome.[j].cell,2007,129(4):823-837.)报道的人源h3k4me3chip-seq结果相一致(图3)。图4为3个样本h3k4me3在转录起始位点区域(上下游2000bp)的结合强度的热力图。图中显示h3k4me3在转录起始位点附近区域结合强度较高,主要富集在tss区域。此结果也与已知文献(barskia,cuddapahs,cuik,etal.high-resolutionprofilingofhistonemethylationsinthehumangenome.[j].cell,2007,129(4):823-837.)报道的h3k4me3主要结合在基因转录起始区域,与基因的转录活性正相关相吻合。
通过对3个样本的h3k4me3在人基因组的1号染色体约800bp区域内的富集情况进行分析发现:3个样本在不同基因区域的结合峰度具有良好的重复性,且具有较低的背景信号,从而证明本发明方法的实验结果非常特异(图5)。
通过对在人的肝组织中特异性表达的基因f2和hpx的h3k4me3结合信号进行分析发现:3个样本在基因的转录起始位点具有很强的结合信号,且重复性良好,说明这2个基因f2和hpx在肝组织中具有特异性的转录活性(图6),进一步证明了本发明方法的实验结果准确可靠。
- 还没有人留言评论。精彩留言会获得点赞!