一种人间充质干细胞的诱导组合物、诱导分化培养液及其体外诱导方法和应用与流程
本发明涉及神经细胞再生技术领域,尤其涉及一种人间充质干细胞的诱导组合物、诱导分化培养液及其体外诱导方法和应用。
背景技术:
神经系统损伤的修复在临床防治上一直是棘手的问题,显微外科技术、脑立体定向技术的发展对神经功能修复提供了技术支持,极大地推动了神经损伤的防治,也提高了防治的效果。神经干细胞移植能够促进神经系统损伤后功能的恢复,而神经干细胞主要从胚胎干细胞诱导,或着是直接从发育中和成年哺乳动物的中枢神经系统中分离培养,但伦理学、安全性以及细胞的来源和数量均有限,很难满足需求,诱导分化神经样细胞的研究具有临床意义。因此寻找一种理想的、可替代神经干细胞的细胞来源已迫在眉睫。
中国专利cn2细胞培养添加剂01710674026.8公开了一种用于将脐带间充质干细胞诱导成神经干细胞的细胞培养液及其使用方法,其中的细胞培养液含有碱性成纤维细胞生长因子、表皮细胞生长因子和黄芪甲苷,能够缩短间充质干细胞诱导为神经干细胞的时间。该现有技术虽然能够缩短神经干细胞的诱导时间,但是其还存在诱导为具体的神经细胞还需要时间,而且得到的诱导后神经细胞数量有限,诱导培养过程复杂等等缺陷。
技术实现要素:
本发明为了解决如何快速、大量的将间充质干细胞诱导为神经细胞问题,提供了一种诱导组合物,利用该诱导组合物进行间充质干细胞诱导神经细胞,诱导分化的神经细胞含量高、活性强、周期短、成本低,并且运用该诱导组合物进行诱导时的工序简单、工艺稳定,为神经系统疾病的防治提供种子细胞。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种人间充质干细胞诱导为神经细胞的诱导组合物,包括脑源性神经营养因子、神经生长因子、表皮细胞生长因子、成纤维细胞生长因子、n2细胞培养添加剂、b27细胞培养添加剂、红景天苷和黄芪多糖。
优选的,所述红景天苷为红景天的水提物,所述黄芪多糖为黄芪的水提物。
本发明提供了一种人间充质干细胞诱导为神经细胞的诱导分化培养液,包括上述技术方案所述的诱导组合物和基础液体培养基;
所述诱导分化培养液中包括:脑源性神经营养因子5~30ng/ml、神经生长因子5~30ng/ml、质量百分含量0.5%~4%的表皮细胞生长因子、成纤维细胞生长因子10~50ng/ml、体积百分含量1%~4%的n2细胞培养添加剂、b27细胞培养添加剂10~40μg/ml、红景天苷10~40mg/l和黄芪多糖10~40mg/l。
优选的,所述基础液体培养基选自dmem/f12培养基、dmem培养基或α-mem培养基。
本发明提供了一种神经细胞的体外诱导方法,包括以下步骤:
以上述技术方案所述的诱导分化培养液对3~15代的人间充质干细胞进行诱导分化,得到神经细胞;
所述诱导分化条件为:37℃、5%co2饱和湿度。
优选的,所述人间充质干细胞包括人脐带间充质干细胞、人骨髓间充质干细胞、人脂肪间充质干细胞、人表皮间充质干细胞或人胚胎间充质干细胞。
优选的,所述分化的神经细胞中包括星形胶质细胞、少突胶质细胞和神经元。
本发明还提供了前述技术方案所述诱导组合物、前述技术方案所述诱导分化培养液或上述技术方案所述体外诱导方法所得分化的神经细胞在制备神经系统疾病防治药物中的应用。
本发明还提供了一种复方神经细胞制剂,包括前述技术方案所述体外诱导方法所得分化的神经细胞、无酚红培养液和人血白蛋白。
优选的,包括分化的神经细胞0.5×106~8×106个/ml。
本发明取得的有益效果:
本发明提供了一种人间充质干细胞诱导为神经细胞的诱导组合物,包括脑源性神经营养因子、神经生长因子、表皮细胞生长因子、成纤维细胞生长因子、n2细胞培养添加剂、b27细胞培养添加剂、红景天苷和黄芪多糖。本发明提供的诱导组合物中,红景天苷、黄芪多糖和细胞因子复配,诱导分化的神经细胞含量高、活性强、周期短、成本低,能够解决在体外对人间充质干细胞诱导时分化效率低,改善诱导得到的神经细胞存活状况,对细胞的毒副作用小。
本发明将上述技术方案所述诱导组合物与基础液体培养基混合,得到诱导分化培养液。该诱导分化培养液可用于人间充质干细胞的诱导,在该诱导分化培养液的浓度下可有效提高神经细胞的诱导效率、降低对细胞的毒性。
本发明还提供了一种运用上述技术方案所述诱导组合物进行体外诱导分化神经细胞的方法,以上述技术方案所述的诱导分化培养液对3~15代的人间充质干细胞进行诱导分化,得到神经细胞;所述诱导分化条件为:37℃、5%co2饱和湿度。本发明提供的体外诱导分化方法的诱导分化条件简单,无需在诱导分化时进行缺氧处理,有效提高了细胞活性,使工艺更为稳定。采用本发明所述体外诱导分化方法得到的神经细胞活性强、分化得到的细胞数量多,诱导时间仅需7~12d。
本发明还提供了前述技术方案所述的诱导组合物或上述技术方案所述体外诱导分化方法所得分化的神经细胞在制备防治神经系统疾病药物中的应用。可用于防治的神经系统疾病包括帕金森综合征、后遗症、小儿脑瘫、脑外伤后遗症以及脊髓损伤等,制备的防治神经系统疾病药物可以是用于介入途径、脑立体定向方法以及腰穿等防治方法的药物形式。具体的,本发明还提供了一种复方神经细胞制剂,包括前述技术方案所得分化的神经细胞、人血白蛋白以及无酚红培养液。
附图说明
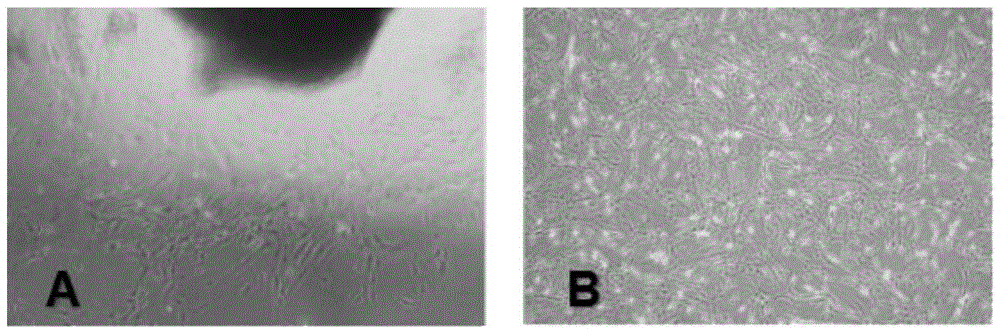
图1为细胞生长形态学镜下观察;
其中a为组织块培养7天后可见散在的贴壁细胞,b为培养第5代贴壁细胞;
图2为流式细胞术鉴定间充质干细胞表面标志结果;
图3为脐带间充质干细胞多向分化潜能鉴定的成脂肪诱导细胞图;
其中a为诱导15天,对照组细胞形态,b为诱导15天,诱导组油红o染色脂滴形成图;
图4为脐带间充质干细胞多向分化潜能鉴定的成骨诱导细胞图;
其中a为诱导21天,对照组细胞形态,b为诱导21天,诱导组茜素红染色钙结节形成图;
图5为脐带间充质干细胞向功能样神经细胞分化检测图;
其中a为诱导分化10天后细胞图;b为诱导分化10天后免疫荧光染色神经元细胞标志物map2细胞图;c为诱导分化10天后免疫荧光染色星型胶质细胞标志物gfap细胞图;d为诱导分化10天后免疫荧光染色少突胶质细胞标志物o4细胞图。
图6为两种诱导方法进行间充质干细胞向功能样神经细胞分化检测图;
其中a为采用诱导方法1细胞分化12天后细胞图,b为采用诱导方法2细胞分化12天后细胞图,c、d分别为诱导方法1和诱导方法2诱导分化12天后免疫荧光染色星型胶质细胞标志物map2细胞图,e、f分别为诱导方法1和诱导方法2诱导分化12天后免疫荧光染色神经元细胞标志物gfap细胞图。
具体实施方式
本发明提供了一种人间充质干细胞诱导为神经细胞的诱导组合物,包括脑源性神经营养因子、神经生长因子、表皮细胞生长因子、成纤维细胞生长因子、n2细胞培养添加剂、b27细胞培养添加剂、红景天苷和黄芪多糖。
在本发明中,所述脑源性神经营养因子(bdnf)能够防止神经元受损伤死亡、改善神经元的病理状态、促进受损神经元再生以及分化;神经生长因子(ngf)可调节周围和种薯神经元的生长发育,维持神经元的存活;表皮细胞生长因子(egf)能够促进细胞的增殖分化;成纤维细胞生长因子fgf能够促进成纤维细胞成长;n2细胞培养添加剂、b27细胞培养添加剂维持神经元的生长和保持其短期或长期活性。采用上述这些细胞因子虽然能够将人间充质干细胞诱导成为分化的神经细胞,但是其诱导分化所需的时间长、诱导所得的神经细胞含量低。
本发明将红景天苷、黄芪多糖和上述细胞因子复配,能够解决体外诱导分化效率低以及存活状况问题,并且具有长期使用对细胞毒副作用小的特点。
在本发明中,所述红景天苷优选的为红景天的水提物;进一步优选的,所述红景天苷浓度为20~800mg原料药/ml,更优选为300~600mg原料药/ml。本发明所述红景天苷购买市售商品或自行制备均可。
在本发明中,本发明所述红景天苷的制备方法优选的按照下述方式进行:
将红景天原料药与75%乙醇水溶液混合,在70~85℃下回流提取2~3次,合并提取液,回收乙醇,得到浓缩液;向浓缩液中滴加质量分数10%的乙酸铅溶液至沉淀析出,离心弃去沉淀,得到上清液;以水包合正丁醇萃取上清液2~3次,合并正丁醇层,再以水饱和正丁醇反萃取,回收正丁醇,干燥,得到红景天苷的水提物。在本发明中,所述回流提取时间优选为50~80min,更优选为60min。在本发明中,所述回收乙醇之前优选的对提取液进行减压浓缩。在本发明中,所述离心转速优选为3000~4500rpm,更优选为4000rpm;所述离心时间优选为5~15min,更优选为8min。在本发明中,得到所述红景天苷的水提物后,本发明优选的以生理盐水充分溶解,微孔滤膜过滤后,即得红景天苷的溶液。
在本发明中,所述黄芪多糖优选的为黄芪的水提物;进一步优选的,所述黄芪多糖浓度为20~800mg/ml,更优选为400~600mg原料药/ml。本发明所述黄芪多糖购买市售商品或自行制备均可。在本发明中,所述黄芪多糖为黄芪总多糖的提取物。
在本发明中,本发明所述黄芪多糖的制备方法优选的按照下述方式进行:
黄芪饮片与80%的乙醇水溶液混合,进行第一回流提取,过滤,得到乙醇提取液和残渣;挥干残渣中的乙醇后依次以水进行第二回流提取2次,合并液体部分,得到水提取液;合并乙醇提取液和水提液得到提取液,过滤,浓缩,加入乙醇至醇度为80%,静置过夜,离心后收集一次沉淀和上清液;上清液浓缩后重复上述加乙醇至离心沉淀的步骤,得到二次沉淀;合并一次沉淀和二次沉淀得到白色沉淀,以丙酮洗涤2~3次后干燥,即得黄芪多糖的水提物。在本发明中,所述第一回流提取的时间优选为1.5~3h,更优选为2h。在本发明中,所述残渣与水的质量比优选为1:8~10。在本发明中,所述第二回流提取的时间优选为1.5~3h,更优选为2h。在本发明中,得到所述黄芪多糖的水提物后,本发明优选的以生理盐水对其充分溶解,微孔滤膜过滤后,得到黄芪多糖的溶液。
本发明提供了一种诱导分化培养液,包括诱导组合物与基础液体培养基混合。在本发明中,所述基础液体培养基优选的选自dmem/f12培养基、dmem培养基或α-mem培养基等。
在本发明中,所述诱导分化培养液优选为:在基础液体培养基的基础上包括脑源性神经营养因子5~500ng/ml、神经生长因子5~200ng/ml、质量百分含量0.5%~10%的表皮细胞生长因子的、成纤维细胞生长因子10~500ng/ml、体积百分含量1%~20%的n2细胞培养添加剂、b27细胞培养添加剂1%~20%、红景天苷10~800mg/l和黄芪多糖10~800mg/l;更优选:在基础液体培养基的基础上包括脑源性神经营养因子10~30ng/ml、神经生长因子10~30ng/ml、质量百分比0.5%~0.8%的表皮细胞生长因子、成纤维细胞生长因子20~40ng/ml、体积百分含量1%~3%的n2细胞培养添加剂、体积百分含量1~3%的b27细胞培养添加剂、红景天苷200~400mg/l和黄芪多糖200~400mg/l。
本发明还提供一种神经细胞的体外诱导方法,包括以下步骤:
以上述技术方案所述的诱导分化培养液对3~15代的人间充质干细胞进行诱导分化,得到神经细胞;
所述诱导分化条件为:37℃、5%co2饱和湿度。
在本发明中,所述人间充质干细胞包括但不限于人脐带间充质干细胞、人骨髓间充质干细胞、人脂肪间充质干细胞、人表皮间充质干细胞或人胚胎间充质干细胞。本发明所述的人间充质干细胞来源于市售商品或自行分离离体组织中的人间充质干细胞,比如分离离体的脐带中人间充质干细胞。
在本发明中,所述人间充质干细胞的传代培养按照本领域已知的传代培养方式进行即可。本发明所述人间充质干细胞优选的传代培养至4~8代。本发明选择人间充质干细胞的传代次数有益于诱导分化,该范围内的人间充质干细胞诱导转化率高。
在本发明中,所述分化的神经细胞为异质细胞群,包括但不限于星形胶质细胞、少突胶质细胞或神经元。
本发明还提供了前述技术方案所述诱导组合物、前述技术方案所述诱导分化培养液或上述技术方案所述体外诱导方法所得分化的神经细胞在制备神经系统疾病防治药物中的应用。
在本发明中,所述神经系统疾病包括帕金森综合征、脑出血后遗症、小儿脑瘫、脑外伤后遗症以及脊髓损伤等,制备的防治神经系统疾病药物可以是用于介入途径、脑立体定向方法以及腰穿等防治方法的药物形式。
具体的,本发明还提供了一种复方神经细胞制剂,包括前述技术方案所得分化的神经细胞、人血白蛋白以及无酚红培养液。
在本发明中,所述分化的神经细胞在复方神经细胞制剂中浓度优选为0.5×106~8×106个/ml,更优选为0.6×106~2×106个/ml。
在本发明中,所述人血白蛋白在复方神经细胞制剂中的浓度优选为0.5~20%,更优选为2%。在本发明中,无酚红培养基作为神经细胞的溶媒介质,人血白蛋白可作为氮源为神经细胞提供营养,无酚红培养基和人血白蛋白还能够为神经细胞提供必需和非必需氨基酸、维生素、有机和无机化合物、激素、生长因子、微量矿物质。
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
1、脐带间充质干细胞分离培养
按照脐带的解剖结构,在无菌条件下,纵向剖开,去除血管和脐带外皮后,用生理盐水洗涤脐带至无血迹、变白,再用眼科剪将组织剪成小段,将华尔通胶剪成小片。将小片脐带组织放在50ml离心管里剪碎成泥状后种入75cm2培养瓶中,培养瓶中装有mscm-acf无血清培养液(厂家sciencell货号sc-7521),于37℃5%co2饱和湿度培养箱内培养。2h后对原代提取的脐带组织块进行加液(mscm-acf无血清培养液),以后每隔3天换一次液,重复操作直至看到有细胞从组织块边缘爬出。待细胞爬满组织块周围80~90%时,剥离组织块,弃去,用0.25%胰酶消化。
将消化得到的人间充质干细胞按照1:3或1:4传代,传代培养条件为37℃、5%co2饱和湿度,将传至5代以上的细胞用于以下实验,并于液氮中冻存部分细胞以备后续使用。
2、脐带间充质干细胞的生物学鉴定
细胞生长特点及形态特点
通过步骤1的方法培养,约需5~7天后,镜下可见有呈纺锤形贴壁细胞从组织块中爬出;将组织块去除后培养观察可见,细胞排列较为整齐;培养14~16天后,细胞可长到t75培养瓶底部的80~90%,形成漩涡型集落状,且观察细胞贴壁形态为梭形。待细胞纯化5代后,用于细胞学生物特性检测。
培养过程中发现这种细胞形态相对均一,增长速度快,贴壁速度快,易被胰酶消化,传代至15代以上,其形态及生长特点亦无明显变化。见图1。
(2)流式细胞术鉴定间充质干细胞表面标志物的鉴定
分别取第5、10、15代细胞,流式细胞术检测表面标志,动态观察培养过程中表面标志的变化。消化收集细胞,计数后去5×106个,分为9管;pbs洗一次,1500rpm离心5min;弃上清,残留100~200μl,吹打混匀细胞;加入pe标记的cd73、cd90、cd105抗体、fitc标记的cd14、cd19、cd44、cd45和hla-dr抗体各1test,并设一管为空白对照管;4℃,避光反应30min;pbs洗一次,1500rpm离心5min;弃上清,加入500μlpbs吹打混匀细胞,上流式细胞仪检测。
流式细胞仪检测细胞的表面标志,动态观察5、10、15代细胞,无明显改变。cd73、cd90、cd105表达持续为阳性,cd34、cd45、hla-dr表达为阴性。经5代以上传代后,细胞成分均一,纯度在95%以上。见图2。
3、脐带间充质干细胞多向分化潜能鉴定
(1)成脂肪诱导
选取p5代uc-mscs,取24孔板,每孔接种细胞6×104个,37℃5%co2饱和湿度培养箱内培养24h后,吸弃原有培养基,对照孔中加入完全培养基,诱导孔中加成脂诱导分化培养液(10%fbs的高糖dmem,并加入地塞米松1μm、ibmx0.5mm、胰岛素10μg/ml),此后每3天更换一次培养基,2周后进行染色,油红o染色鉴定脂滴形成。
利用体外成脂诱导培养体系,对体外培养的第5代uc-mscs进行成脂诱导培养。经倒置相差显微镜进行观察,诱导2天后,细胞胞体逐渐变大,细胞变为多边形或椭球形;诱导第4天出现小脂肪滴,随着诱导时间的延长,小脂滴慢慢聚合变大,遮光性增强,培养到第15天经油红o染色后,胞质内小油脂滴被染成红色,而细胞并不会被着色。对照组细胞形态无异常变化,胞质内观察不到小油脂滴,油红o染色没有出现显色反应。结果表明人脐带间充质干细胞在体外成脂诱导体系下已经向脂肪细胞分化。见图3。
(2)成骨诱导
选取p5代uc-mscs,取24孔板,每孔接种细胞6×104个,37℃5%co2饱和湿度培养箱内培养24h后吸弃原来培养基,对照孔中加入完全培养基,诱导孔中加入成骨诱导分化培养液(10%fbs的高糖dmem,并加入地塞米松0.1μm、抗坏血酸磷酸盐50μm、β-磷酸甘油10mm),此后每3天更换一次培养基,培养三周后进行茜素红染色鉴定骨结节形成。
利用体外成骨诱导培养体系,对体外培养的第5代uc-mscs进行成骨诱导培养。细胞被成骨诱导分化培养7天左右,细胞形态逐渐向多角形转变;2周左右,聚集现象在多孔出现,细胞之间间隙变小,细胞生长密集;在21天左右,用茜素红染色,发现有较多红色沉淀,这是钙化结节的现象,也表示茜素红染色呈阳性反应,而对照组未见红色沉淀。见图4。
4、脐带间充质干细胞向功能样神经细胞分化检测
(1)细胞成神经样细胞诱导培养
取第5代uc-mscs,5×104接种于6孔板,37℃5%co2饱和湿度培养箱内培养,待细胞生长密度达到80%时,换成诱导分化培养液;
诱导分化培养液成分为:dmem/f12含有bdnf(脑源性神经营养因子)25ng/ml、ngf(神经生长因子)15ng/ml、n2细胞培养添加剂体积百分含量2%、egf(表皮细胞生长因子)30ng/ml、fgf(成纤维细胞生长因子)为30ng/ml、b27细胞培养添加剂的体积百分含量为2%,红景天苷浓度为400mg原药材/ml、黄芪多糖浓度为400mg原药材/ml。
红景天苷的制备方法为:称量红景天药材400g,75%乙醇80℃水浴回流提取3次,每次60min,合并提取液,减压浓缩,回收乙醇至无醇味。向浓缩液中滴加质量分级10%的乙酸铅溶液,至沉淀析出,在4000rpm离心8min,除去沉淀,取上清液分别用200、150、150ml水饱和正丁醇萃取3次,合并正丁醇层,用水饱和正丁醇反萃取,回收正丁醇至干,即得红景天苷提取物,加入100ml生理盐水溶解红景天苷,充分溶解后,经0.22um滤膜滤过,即得红景天苷溶液(4g原药材/ml)。
黄芪多糖的制备方法为:称取黄芪饮片400g,加80%乙醇,回流提取2h,滤出溶液,残渣挥干乙醇,再分别加入10倍量、8倍量蒸馏水加热回流2次,提取时间均为2h,分别滤出溶液,合并2次回流滤液,滤纸过滤,浓縮得到浓缩液50ml,加入适量乙醇,调醇度为80%,室温过夜,超速离心,收集白色沉淀物(一次醇沉),并将上清液减压浓缩至50ml,再次调醇度为80%,室温放置12h,超速离心,弃上清液,收集白色沉淀物(二次醇沉),合并两次得到的白色沉淀物,用丙酮洗涤2次,过滤放入干燥器中真空干燥,即得黄芪多糖,加入100ml生理盐水溶解黄芪多糖,充分溶解后,经0.22um滤膜滤过,即得黄芪多糖溶液(4g原药材/ml)。
加入诱导分化培养液24小时后细胞形态即明显变化,光镜下间充质干细胞向核收缩,呈典型的核周体形态,3~5天后多数细胞能形成神经样细胞形态,胞体成圆形,突起较长,在突起末端出现分支,部分相邻细胞的突起连接成网,部分细胞呈星型,伸出突触,但细胞数目无明显增加;7天后大多数细胞转变为双极或多极神经样细胞形态,伸出突触,部分细胞之间拉成网状。见图5。
(2)细胞成神经样细胞诱导分化为神经样细胞检测
脐带间充质干细胞在诱导分化10天后采用免疫荧光染色。贴壁细胞去培养基,用pbs洗3次,经4%的多聚甲醛固定30min,pbs洗涤3次,0.3%tritonx-100处理20min,用pbs洗3次,10%羊血清室温封闭20min,吸出血清,分别加入鼠抗人map2(1:500)、gfap(1:500)、o4(1:100),4℃过夜,然后pbs洗3次,加入羊抗鼠-fitc(1:500)孵育30min,染色可检测map2、gfap、o4阳性细胞。结果表明成功诱导产生了神经样细胞。见图5。
实施例2不同方法诱导脐带间充质干细胞向功能样神经细胞分化对比
1、细胞成神经样细胞诱导培养
以实施例1作为诱导方法1,以常规细胞因子诱导方法作为诱导方法2,将诱导方法1和诱导方法2进行对比。
诱导方法1:
取第5代uc-mscs,5×104接种于6孔板,37℃5%co2饱和湿度培养箱内培养,待细胞生长密度达到80%时,换成诱导分化培养液;
诱导分化培养液成分为:bdnf(脑源性神经营养因子)25ng/ml、ngf(神经生长因子)15ng/ml、n2细胞培养添加剂体积百分含量2%、egf(表皮细胞生长因子)30ng/ml、fgf(成纤维细胞生长因子)为30ng/ml、b27细胞培养添加剂的体积百分含量为2%,红景天苷浓度为400mg原药材/ml、黄芪多糖浓度为400mg原药材/ml(诱导分化培养液a)。
诱导方法2:
取第5代uc-mscs,5×104接种于6孔板,37℃5%co2饱和湿度培养箱内培养,待细胞生长密度达到80%时,换成诱导分化培养液;
诱导分化培养液成分为:bdnf(脑源性神经营养因子)25ng/ml、ngf(神经生长因子)15ng/ml、n2细胞培养添加剂体积百分含量2%、egf(表皮细胞生长因子)30ng/ml、fgf(成纤维细胞生长因子)为30ng/ml、b27细胞培养添加剂的体积百分含量为2%(诱导分化培养液b)。
诱导分化培养液a加入24小时后细胞形态即明显变化,光镜下间充质干细胞向核收缩,呈典型的核周体形态,3~5天后多数细胞能形成神经样细胞形态,胞体成圆形,突起较长,在突起末端出现分支,部分相邻细胞的突起连接成网,部分细胞呈星型,伸出突触,但细胞数目无明显增加;7天后大多数细胞转变为双极或多极神经样细胞形态,伸出突触,部分细胞之间拉成网状。
诱导分化培养液b加入48小时后细胞形态变化,光镜下部分间充质干细胞向核收缩,5~7天后小部分细胞能形成神经样细胞形态,大部分细胞外观性状变化不明显,无神经样细胞外观、无明显的突触和双极结构。
可见,诱导方法1在诱导率、诱导后细胞数量及诱导时间上明显优于常规因子诱导方法(诱导方法2)。见图6。
(2)细胞成神经样细胞诱导分化为神经样细胞检测
脐带间充质干细胞在诱导分化12天后采用免疫荧光染色。贴壁细胞去培养基,用pbs洗3次,经4%的多聚甲醛固定30min,pbs洗涤3次,0.3%tritonx-100处理20min,用pbs洗3次,10%羊血清室温封闭20min,吸出血清,分别加入鼠抗人gfap(1:500)、map2(1:500),4℃过夜,然后pbs洗3次,加入羊抗鼠-fitc(1:500)孵育30min,染色可检测gfap、map2阳性细胞。见图6。
实施例3
细胞活力检测:随机从液氮库中抽取5批次第5代的人间充质干细胞,按照实施例1所述方法进行诱导分化,于诱导分化前后分别取细胞悬液1ml进行细胞活力检测,视细胞量确定是否稀释。细胞存活率的计算方法是用血球计数板网格内的活细胞数除以总细胞数。死细胞被染成蓝色,活细胞不能被染色。结果见表1。
具体操作方法是:
(1)利用计数板测定细胞悬液的细胞密度。
(2)用等渗缓冲盐溶液(即磷酸盐缓冲液)配制浓度为0.4%、ph值为7.2~7.4的台盼蓝溶液。
(3)向1ml细胞中加入0.1ml台盼蓝溶液。
(4)取适量细胞样品加至计数板上,立即在低倍显微镜下检查。
(5)计数蓝染细胞数和总细胞数
细胞存活率(%)=[1-(蓝染细胞数÷总细胞数)]×100%
计算每毫升活细胞的数量,则应使用一下公式:
活细胞数×104×1.1=每毫升细胞悬液中的活细胞数
表1诱导分化细胞的活率
由表1的数据可以看出,利用本发明所述的方法诱导分化前后的细胞活率无显著改变,表明本发明提供的诱导分化方法以及采用的诱导分化培养液对细胞无明显毒性。
实施例4
复方神经细胞制剂:按照实施例1所示方法诱导得到的神经细胞2×106个/ml、人血白蛋白2%以及无酚红培养液50ml。
实施例5
按照实施例1诱导分化方法进行诱导分化,制备的复方神经细胞制剂5ml,总细胞数为4×107个,招募脑瘫患儿(7~12岁)临床受试者3例,临床医生采用腰穿方式将复方神经细胞制剂移植到病患脑内进行给药治疗,先吸出8ml脑脊液,再注入5ml复方神经细胞制剂,再用3ml生理盐水冲管,每月给药1次,连续给药3个月,给药前和给药后6个月、12个月随访,建立给药前后脑瘫量表、生活能力量表、智力评分表,治疗后6个月进行头颅影像学检查,监测12个月,评价复方神经细胞制剂移植治疗脑瘫的安全性和有效性。
表2复方神经细胞制剂移植治疗脑瘫的安全性和有效性
注:ap<0.05表示差异性显著;bp<0.01表示差异性极显著。
由表2的数据可以看出:
1、复方神经细胞移植3个月时,患儿gmfm较移植前评分有显著提高,移植前后有显著性差异,ap<0.05。
2、复方神经细胞移植3个月后,患儿fmq、gr和vi评分均有一定提高,但无显著性差;细胞移植6个月后,fmq评分有较明显提高,有显著性差异,ap<0.05,而gr和vi评分有明显提高,具有极显著性差异。
总之,经过1年的随访,临床结果显示,应用本发明制备的复方神经干细胞制剂治疗少儿脑瘫能够确保应用的安全性,能够有效改善病患粗大运动功能和精细运动能力,该发明制剂安全有效。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!