一种钌催化的磷氮烯化合物的制备方法与流程
本发明属于医药和天然化合物化工中间体及相关化学技术领域,涉及一种钌催化的磷氮烯化合物的制备方法。
背景技术:
太阳光是人类生存的先决条件,而且便宜易得、清洁可再生,被认为是最理想的能源。光催化是一种清洁无污染、反应条件温和的合成技术,常常能避免一些强氧化还原试剂或其他有毒物质的使用,在很大程度上能够满足人们对能源和环境的要求。
磷氮烯作为磷叶立德的类似物,可以利用氮上的孤对电子与过渡金属配位,配位得到的金属配合物作为催化剂可以催化许多均相反应,包括金属催化的氢化反应、转金属化反应、碳碳偶联反应、烯烃聚合、环丙烯化反应、meyer-schuster重排、烯丙基烷基化、氧化反应以及加氢异构化。
传统合成磷氮烯的方法主要是施陶丁格反应:苯基叠氮化合物和三苯基膦的反应,此反应定量地得到了一个新的化合物磷氮烯(氮杂叶立德或者是亚胺膦),并且释放出一分子的氮气[参见:garcia-alvarez,j.,garcia-garrido,s.e.,cadierno,v.j.organomet.chem.,2014,751,792.],该方法虽然反应速度快、底物范围较广,但是存在多步反应总产率低、原料及中间体不稳定等缺点。其他的合成方法也存在着总产率低、底物适用范围小等缺点[参见:(a)tamuray,minamikawaj,harukis,etal.synthesis,1974,1974,361.(b)yavarii,zabarjad-shirazn.mol.diversity,2006,10,23.(c)armstronga,joneslh,knightjd,etal.org.lett.,2005,7,713.(d)cristauhj,hammamia,torreillese.heteroat.chem.,1999,10,49.]。
技术实现要素:
本发明提供了一种磷氮烯的制备方法,该方法在温和条件下即可得到较高收率,无需加入额外配体,底物兼容性好。
本发明的技术方案:
一种钌催化的磷氮烯化合物的制备方法,该方法以膦化合物与3-取代-1,4,2-二噁唑-5-酮为原料,以过渡金属钌作为催化剂,在光照条件下,一步合成磷氮烯化合物,合成路线如下:
式中:r1选自烷基、芳基中的一种;r2选自芳基、烷氧基中的一种。
所用的钌催化剂为双(五甲基环戊烯)钌、二茂钌、(1,5-环辛二烯)氯化钌、三(2,2’-联吡啶)二氯化钌、三氯化钌、二氯双(4-甲基异丙基苯基)钌、三(三苯基膦)氯化钌或二(三苯基膦)环戊二烯氯化钌。3-取代-1,4,2-二噁唑-5-酮与所用钌催化剂的摩尔比为1:0.01~1:0.5。
合成反应中的有机溶剂为乙醚、乙腈、二甲基亚砜、二氧六环、四氢呋喃、甲苯、甲醇、乙醇、三氯甲烷、二氯甲烷、二氯乙烷、丙酮、n,n-二甲基甲酰胺中的一种或两种以上混合。3-取代-1,4,2-二噁唑-5-酮在有机溶剂中的摩尔浓度为0.01~2mmol/ml。
3-取代-1,4,2-二噁唑-5-酮与膦化合物的摩尔比为1:1.0~1:6.0。
合成反应温度为10℃~100℃,合成反应时间为1h~36h。
光照的功率为1w~36w;光照波长为280nm~600nm中的部分或全部波段。
本发明的有益效果:该反应使用光催化反应,清洁无污染,反应条件温和,操作和后处理简单,底物兼容性好。
附图说明
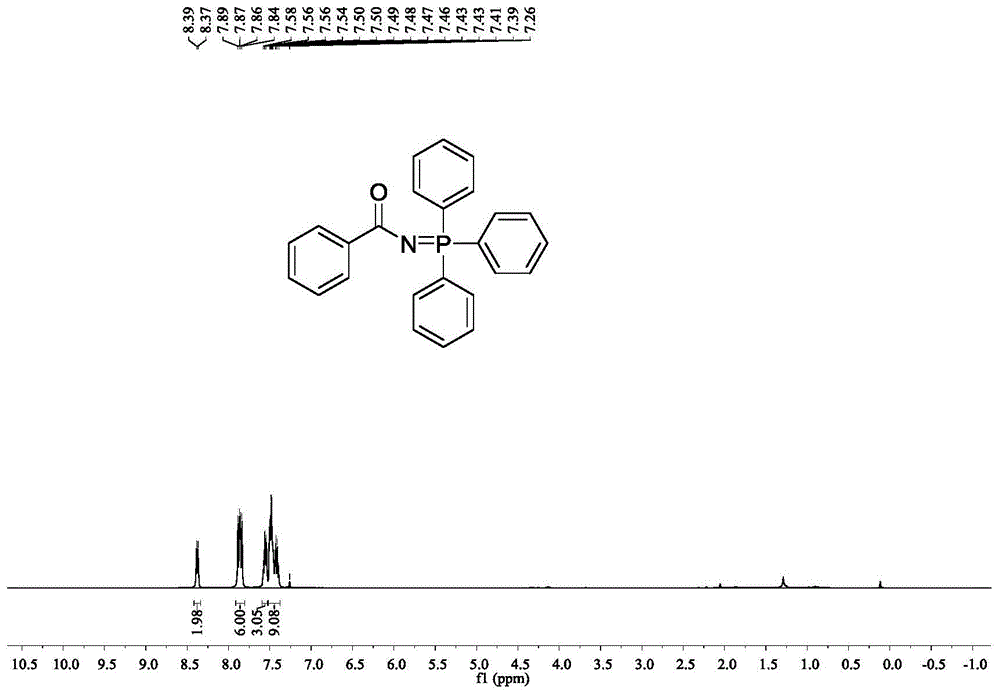
图1是实施例1中n-(三苯基-λ5-磷烷亚基)苯酰胺的1h核磁谱图。
图2是实施例2中n-(三苯基-λ5-磷烷亚基)4-甲基苯酰胺的1h核磁谱图。
图3是实施例3中n-(三苯基-λ5-磷烷亚基)3-甲氧基苯酰胺的1h核磁谱图。
图4是实施例4中n-(三苯基-λ5-磷烷亚基)4-甲氧基苯酰胺的1h核磁谱图。
图5是实施例5中n-(三苯基-λ5-磷烷亚基)4-溴苯酰胺的1h核磁谱图。
图6是实施例6中n-(三苯基-λ5-磷烷亚基)4-三氟甲基苯酰胺的1h核磁谱图。
图7是实施例7中n-(三苯基-λ5-磷烷亚基)2-氟苯酰胺的1h核磁谱图。
图8是实施例8中n-(三苯基-λ5-磷烷亚基)2-呋喃酰胺的1h核磁谱图。
图9是实施例9中n-(三苯基-λ5-磷烷亚基)甲酰胺的1h核磁谱图。
图10是实施例10中n-[三(4-甲基苯基)-λ5-磷烷亚基]苯酰胺的1h核磁谱图。
图11是实施例11中n-[三乙氧基-λ5-磷烷亚基]苯酰胺的1h核磁谱图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。在本领域内的技术人员对本发明所做的简单替换或改进均属于本发明所保护的技术方案之内。
实施例1:n-(三苯基-λ5-磷烷亚基)苯酰胺的合成
准确称取3-苯基-1,4,2-二噁唑-5-酮(48.9mg,0.3mmol)、三苯基膦(157.2mg,0.6mmol)、(1,5-环辛二烯)氯化钌(4.2mg,5mol%)加入到25ml的schlenk反应瓶中,然后加入甲苯(2ml),置于光照条件(1w,280nm)下10℃反应36h。反应结束后,减压除去溶剂,使用石油醚/乙酸乙酯作为洗脱剂,硅胶柱分离,产物的收率为95%。
1hnmr(400mhz,cdcl3)δ8.41-8.35(m,2h),7.91-7.81(m,6h),7.59-7.53(m,3h),7.52-7.38(m,9h).
实施例2:n-(三苯基-λ5-磷烷亚基)4-甲基苯酰胺的合成
准确称取3-(4-甲基苯基)-1,4,2-二噁唑-5-酮(53.1mg,0.3mmol)、三苯基膦(78.6mg,0.3mmol)、三(三苯基膦)氯化钌(2.9mg,1mol%)加入到25ml的schlenk反应瓶中,然后加入二氯甲烷(2ml),置于光照条件(15w,420nm)下20℃反应24h。反应结束后,减压除去溶剂,使用石油醚/乙酸乙酯作为洗脱剂,硅胶柱分离,产物的收率为91%。
1hnmr(400mhz,cdcl3)δ8.28(d,j=8.0hz,2h),7.91-7.82(m,6h),7.58-7.52(m,3h),7.51-7.43(m,6h),7.22(d,j=8.0hz,2h),2.40(s,3h).
实施例3:n-(三苯基-λ5-磷烷亚基)3-甲氧基苯酰胺的合成
准确称取3-(3-甲氧基苯基)-1,4,2-二噁唑-5-酮(19.3mg,0.1mmol)、三苯基膦(157.2mg,0.6mmol)、(1,5-环辛二烯)氯化钌(14mg,50mol%)加入到50ml的schlenk反应瓶中,然后加入二氯乙烷(10ml),置于光照条件(25w,450nm)下20℃反应8h。反应结束后,减压除去溶剂,使用石油醚/乙酸乙酯作为洗脱剂,硅胶柱分离,产物的收率为90%。
1hnmr(400mhz,cdcl3)δ8.05-8.00(m,1h),7.91-7.81(m,7h),7.59-7.53(m,3h),7.51-7.44(m,6h),7.36-7.30(m,1h),7.04-6.98(m,1h),3.85(s,3h).
实施例4:n-(三苯基-λ5-磷烷亚基)4-甲氧基苯酰胺的合成
准确称取3-(4-甲氧基苯基)-1,4,2-二噁唑-5-酮(57.9mg,0.3mmol)、三苯基膦(131mg,0.5mmol)、三(三苯基膦)氯化钌(28.7mg,10mol%)加入到25ml的schlenk反应瓶中,然后加入甲苯(1.5ml),置于光照条件(10w,600nm)下30℃反应10h。反应结束后,减压除去溶剂,使用石油醚/乙酸乙酯作为洗脱剂,硅胶柱分离,产物的收率为87%。
1hnmr(400mhz,cdcl3)δ8.35-8.30(m,2h),7.89-7.81(m,6h),7.57-7.51(m,3h),7.50-7.44(m,6h),6.91(d,j=8.8hz,2h),3.83(s,3h).
实施例5:n-(三苯基-λ5-磷烷亚基)4-溴苯酰胺的合成
准确称取3-(4-溴苯基)-1,4,2-二噁唑-5-酮(72.6mg,0.3mmol)、三苯基膦(157.2mg,0.6mmol)、二氯双(4-甲基异丙基苯基)钌(36mg,20mol%)加入到25ml的schlenk反应瓶中,然后加入二氧六环(2ml),置于光照条件(36w,500nm)下40℃反应10h。反应结束后,减压除去溶剂,使用石油醚/乙酸乙酯作为洗脱剂,硅胶柱分离,产物的收率为85%。
1hnmr(400mhz,cdcl3)δ8.25-8.20(m,2h),7.87-7.79(m,6h),7.59-7.53(m,4h),7.52-7.45(m,7h).
实施例6:n-(三苯基-λ5-磷烷亚基)4-三氟甲基苯酰胺的合成
准确称取3-(4-三氟甲基苯基)-1,4,2-二噁唑-5-酮(69.3mg,0.3mmol)、三苯基膦(131mg,0.5mmol)、三(三苯基膦)氯化钌(28.7mg,10mol%)加入到25ml的schlenk反应瓶中,然后加入甲苯(2ml)、二氯甲烷(2ml),置于光照条件(5w,350nm)下40℃反应8h。反应结束后,减压除去溶剂,使用石油醚/乙酸乙酯作为洗脱剂,硅胶柱分离,产物的收率为96%。
1hnmr(400mhz,cdcl3)δ8.45(d,j=8.0hz,2h),7.88-7.80(m,6h),7.66(d,j=8.4hz,2h),7.62-7.55(m,3h),7.54-7.47(m,6h).
实施例7:n-(三苯基-λ5-磷烷亚基)2-氟苯酰胺的合成
准确称取3-(2-氟苯基)-1,4,2-二噁唑-5-酮(54.3mg,0.3mmol)、三苯基膦(157.2mg,0.6mmol)、(1,5-环辛二烯)氯化钌(8.4mg,10mol%)加入到25ml的schlenk反应瓶中,然后加入二氯甲烷(2ml),置于光照条件(25w,550nm)下60℃反应8h。反应结束后,减压除去溶剂,使用石油醚/乙酸乙酯作为洗脱剂,硅胶柱分离,产物的收率为85%。
1hnmr(400mhz,cdcl3)δ8.18-8.12(m,1h),7.90-7.81(m,6h),7.59-7.53(m,3h),7.51-7.45(m,6h),7.38-7.32(m,1h),7.16-7.11(m,1h),7.10-7.04(m,1h),.
实施例8:n-(三苯基-λ5-磷烷亚基)2-呋喃酰胺的合成
准确称取3-(2-呋喃基)-1,4,2-二噁唑-5-酮(45.9mg,0.3mmol)、三苯基膦(131mg,0.5mmol)、三(三苯基膦)氯化钌(28.7mg,10mol%)加入到25ml的schlenk反应瓶中,然后加入甲苯(2ml),置于光照条件(10w,280-600nm)下10℃反应20h。反应结束后,减压除去溶剂,使用石油醚/乙酸乙酯作为洗脱剂,硅胶柱分离,产物的收率为83%。
1hnmr(400mhz,cdcl3)δ7.87-8.81(m,6h),7.78(d,j=2.4hz,1h),7.59-7.53(m,3h),7.51-7.44(m,6h),7.37(d,j=3.6hz,1h),7.06-7.02(m,1h).
实施例9:n-(三苯基-λ5-磷烷亚基)甲酰胺的合成
准确称取3-甲基-1,4,2-二噁唑-5-酮(30.3mg,0.3mmol)、三苯基膦(104.8mg,0.4mmol)、(1,5-环辛二烯)氯化钌(8.4mg,10mol%)加入到25ml的schlenk反应瓶中,然后加入二氯甲烷(2ml),置于光照条件(36w,450nm)下50℃反应5h。反应结束后,减压除去溶剂,使用石油醚/乙酸乙酯作为洗脱剂,硅胶柱分离,产物的收率为89%。
1hnmr(400mhz,cdcl3)δ7.78-7.68(m,6h),7.57-7.49(m,3h),7.48-7.40(m,6h),2.24(d,j=2.8hz,3h).
实施例10:n-[三(4-甲基苯基)-λ5-磷烷亚基]苯酰胺的合成
准确称取3-苯基-1,4,2-二噁唑-5-酮(48.9mg,0.3mmol)、三(对甲苯基)膦(121.7mg,0.4mmol)、三(三苯基膦)氯化钌(28.7mg,10mol%)加入到25ml的schlenk反应瓶中,然后加入甲苯(2ml),置于光照条件(10w,480nm)下100℃反应1h。反应结束后,减压除去溶剂,使用石油醚/乙酸乙酯作为洗脱剂,硅胶柱分离,产物的收率为94%。
1hnmr(400mhz,cdcl3)δ7.94(d,j=7.2hz,2h),7.37-7.26(m,6h),7.03-6.94(m,3h),6.89-6.82(m,6h),1.97(s,9h).
实施例11:n-[三乙氧基-λ5-磷烷亚基]苯酰胺的合成
准确称取3-苯基-1,4,2-二噁唑-5-酮(48.9mg,0.3mmol)、三乙氧基膦(66.5mg,0.4mmol)、三(三苯基膦)氯化钌(28.7mg,10mol%)加入到25ml的schlenk反应瓶中,然后加入甲苯(2ml),置于光照条件(10w,480nm)下100℃反应1h。反应结束后,减压除去溶剂,使用石油醚/乙酸乙酯作为洗脱剂,硅胶柱分离,产物的收率为88%。
1hnmr(400mhz,cdcl3)δ8.17(d,j=7.6hz,2h),7.47-7.41(m,1h),7.40-7.32(m,2h),4.35-4.22(m,6h),1.38(t,j=7hz,9h)。
- 还没有人留言评论。精彩留言会获得点赞!