一种大豆乳清废水逆pH梯度提取脂肪氧合酶的方法与流程
本发明涉及食品加工废水利用技术领域,特别涉及一种大豆乳清废水逆ph梯度提取脂肪氧合酶的方法。
背景技术:
大豆是一种蛋白质含量较为丰富的重要农作物,以其为原料加工的大豆分离蛋白是一种蛋白纯度高、具有深加工性能的精制大豆蛋白产品,可作为中间原料添加到食品生产中,用途广泛。
大豆分离蛋白可用碱溶酸沉法、超滤浓缩法、反胶束萃取法、反相高效液相色谱法等方法进行加工,其中,碱溶酸沉法是目前生产大豆分离蛋白较为成熟、广泛应用的工艺方法。但在利用碱溶酸沉工艺生产大豆分离蛋白的同时会产生大量的大豆乳清废水,并且废水中含有丰富的蛋白、糖类等物质,极易造成资源浪费及环境污染。
大豆分离蛋白被广泛应用于食品工业生产中,每年的需求量在60万吨左右,但每生产1吨spi要产生40吨左右的废水,废水的产生量很大。目前,对于大豆分离蛋白加工废水的主要处理方法是直接将其进行多级生物处理,利用厌氧和好氧法降低废水中的cod及bod,以达到国家废水排放标准,处理成本很高,废水中所含的大量的活性物质也未得到合理利用。因此,采用现代分离技术回收利用大豆乳清废水中的等高附加值产品可以回收利用有效资源,净化污水,产生较好的经济效益和社会效益。
近年来,为了减少废水排放及环境污染,许多学者开始致力于大豆乳清废水中功能性物质的分离提取,例如jiang等利用两段式泡沫分离技术从大豆乳清废水中回收大豆乳清蛋白;凌秀菊等利用膜技术提取大豆乳清废水中的低聚糖,并形成了大豆低聚糖产品。然而,关于大豆乳清废水中脂肪氧合酶分离提取的研究未见研究报道。
脂肪氧合酶(lox),又称脂肪氧化酶,脂氧酶,属于氧化还原酶,是一类含非血红素铁的蛋白质,能专一催化具有顺,顺4-烯结构的多不饱和脂肪酸,通过分子内加氧,形成具有共轭双键的氢化氧化衍生物。脂肪氧合酶(lox)可导致果蔬加工品产生不良风味,油脂和含油食品在储藏加工过程中色、香、味发生劣变等。但是,脂肪氧合酶(lox)作为绿色食品添加剂,用于小麦粉中,可氧化面粉中的色素,使之褪色,使面制品增白。脂肪氧合酶(lox)可以运用到植物抗病、抗虫和伤害反应中,脂肪氧合酶(lox)与植物抗病的关系在小麦、烟草、水稻、棉花等作物上都有报道。脂肪氧合酶(lox)在工业上可用于染料、涂料、洗涤剂等的工业化生产,还可作为药物合成的中间体。
虽然lox在食品、化工等领域中具有广泛的用途,但是直接从大豆等原材料中提取,成本太高,还没有工成为业化生产的酶制剂;而通过基因工程菌高效表达重组lox又存在着安全性等诸多问题,从而使其在大规模生产应用方面难以有较大的突破。可见,找到适合工业应用的获取脂肪氧合酶的方法是目前亟需解决的难题。
研究者前期研究中发现,在spi加工废水中含有大量的脂肪氧合酶,我国是世界上最大的spi生产国每年会产生大量的spi加工废水,鉴于此,对大豆分离蛋白加工废水中脂肪氧合酶分离提取,将spi加工废水进行资源化利用,必将产生巨大的经济及社会价值,具有十分重要的现实意义。
技术实现要素:
为了弥补现有技术的不足,本发明提供了一种大豆乳清废水逆ph梯度提取脂肪氧合酶的方法。
本发明的技术方案为:
一种大豆乳清废水逆ph梯度提取脂肪氧合酶的方法,包括步骤:
1)大豆乳清废水预处理
将大豆乳清废水进行离心去除大颗粒的杂质,保留上清液作为大豆乳清废水预处理液;
2)去除大豆乳清废水预处理液中的杂蛋白
将大豆乳清废水预处理液的ph调节至7.8~8.2,离心除去沉淀;
3)提取脂肪氧合酶
将步骤2)离心所得的上清液的ph值调节至5.7~6.0,离心去除上清液,所得沉淀物用蒸馏水溶解,即为脂肪氧合酶粗酶液。
本发明对大豆乳清废水预处理后,通过逆ph梯度法提取脂肪氧合酶,先在远离脂肪氧合酶等电点的ph下除去杂蛋白,然后再脂肪氧合酶等电点处析出脂肪氧合酶。
作为优选方案,所述大豆乳清废水逆ph梯度提取脂肪氧合酶的方法,还包括步骤4):脂肪氧合酶粗酶液利用超滤浓缩的方法初步提纯。
作为优选方案,所述大豆乳清废水逆ph梯度提取脂肪氧合酶的方法,还包括步骤5):步骤4)所得酶液利用凝胶过滤色谱法进一步提纯,得到纯的脂肪氧合酶。
作为优选方案,步骤4)中,利用30kda大小的改性聚醚砜超滤膜,在压力200~300kpa下对脂肪氧合酶粗酶液进行8~10倍超滤浓缩。
作为优选方案,步骤4)中,利用超滤系统采用两级过滤方式进行超滤浓缩
作为优选方案,步骤5)中,凝胶过滤色谱法利用2-70kda的sephadexg-75凝胶柱,以ph7.8,0.02mol/l的磷酸缓冲液平衡2~3个柱体积,平衡完毕后上样,以ph7.8,0.02mol/l的磷酸缓冲液为洗脱液洗脱;洗脱液流速为0.5ml/min。
作为优选方案,步骤2)中,将大豆乳清废水预处理液的ph调节至8.0。
作为优选方案,步骤3)中,上清液的ph值调节至6.0。
作为优选方案,步骤2)和步骤3)中,利用氢氧化钠溶液调节体系的ph。
作为优选方案,步骤1)中,以3000~15000r/min的转速离心8~20min。
本发明的有益效果为:
1、本发明提供了一种大豆乳清废水逆ph梯度提取脂肪氧合酶的方法,本发明先对大豆乳清废水预处理,然后调节ph至远离脂肪氧合酶等电点,先除杂,然后调节ph至脂肪氧合酶等电点,得到高酶活以及高酶活回收率的脂肪氧合酶,酶活回收率为73.54%,比酶活高达10661.32u/mg。
2、本发明通过等电点沉淀获得的脂肪氧合酶进一步通过超滤浓缩、凝胶过滤色谱纯化获得纯度非常高的脂肪氧合酶,最终lox纯度为90.43%,比酶活达25546.08u/mg,酶活回收率为40.29%,纯化倍数提高了25.44倍。
3、本发明利用大豆乳清废水获得工业价值高的脂肪氧合酶,而且脂肪氧合酶提取率高、纯度高、酶活性好。
4、本发明方法便于操作,安全高效,成本低,可用于工业上的大豆乳清废水中脂肪氧合酶开发利用,以实现资源化回收利用,具有显著的经济效益和社会效益。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
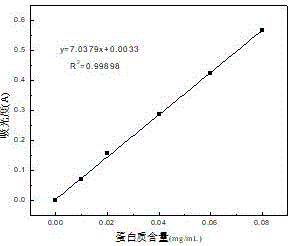
图1为蛋白质含量测定标准曲线图;
图2为各ph下脂肪氧合酶(lox)的沉淀率及比酶活图;
图3为ph梯度沉淀蛋白质电泳图;
图4为各peg6000浓度下沉淀和上清液中lox比酶活图;
图5为聚丙烯酸钠加入量对脂肪氧合酶比酶活的影响情况图;
图6为超滤膜截留分子量对lox酶活回收率和超滤时间的影响情况图;
图7为超滤操作压力对lox酶活回收率的影响情况图;
图8为超滤浓缩倍数对lox的单位酶活及酶活回收率的影响情况图;
图9为超滤方式对lox单位酶活及酶活回收率的影响情况图;
图10为sephadexg-75层析图谱;
图11为lox纯化过程的sds-page分析结果。
具体实施方式
一、本实施方式中脂肪氧合酶酶活测定方法:
酶活定义:在25℃,ph9.0条件下,以亚油酸为底物,于234nm处,反应体系1min催化生成1umol产物的加酶量定义为一个酶活单位。
底物制备:将0.25ml的吐温20分散于10ml的0.2mol/l,ph为9.0的硼酸盐缓冲液中,不断摇动并逐滴加入0.27ml的亚油酸,使其混合均匀,然后向体系中滴加一定浓度的naoh溶液使体系澄清,并调节体系ph至9.0,最后用0.2mol/l,ph9.0的硼酸盐缓冲液定容至500ml作为底物溶液,贮藏于4℃下,备用。
活性测定:将0.2ml样品溶液加入到1.5ml底物溶液中,混匀后于25℃下恒温反应3min后,加入5ml无水乙醇终止反应,再加入5ml蒸馏水使反应体系澄清,于234nm处测定吸光度。空白样为1.5ml底物溶液中先加入5ml无水乙醇,在加入0.2ml样品溶液,于25℃下恒温3min后,再加入5ml蒸馏水。
以上酶活测定方法参考以下两个文献:
1、王韧.超高压对大豆脂肪氧合酶、营养抑制因子和蛋白性质的影响[d].江南大学,2008.
2、catodl,halmosal,smalldm.measurementoflipoxygenaseinaustralianwhitewheatflour:theeffectoflipoxygenaseonthequalitypropertiesofwhitesaltednoodles[j].journalofthescienceoffoodandagriculture,2006,86(11):1670-1678.doi:10.1002/jsfa.2539.
二、本实施方式中蛋白质含量测定方法:
采用bradford的方法测定样品中蛋白质的含量,取6支干净试管并标记管号,其中一只加入1.0ml蒸馏水做空白,5支分别加入不同体积的浓度为0.1mg/ml牛血清清蛋白标准液,补充水到1.0ml。然后每支试管加入5.0ml考马斯亮蓝g-250试剂,摇匀放置5min,在紫外-可见分光光度计595nm处测定吸光值。以a595吸光值为纵坐标,牛血清清蛋白的浓度(mg/ml)为横坐标绘制标准曲线,如图1所示。
三、本实施方式中sds-page分析实验
参考laemmli法对lox样品溶液进行sds-page分析,样品用2
其中,pgpro代表沉淀中待测蛋白质灰度值;egpro代表大豆乳清废水中待测蛋白质灰度值;np和ne分别代表沉淀及大豆乳清废水稀释倍数;sgpro代表样品中待测蛋白质灰度值;sgall代表沉淀中所有蛋白质总灰度值。
四、顺ph梯度沉淀脂肪氧合酶研究
lox的等点在在ph5.7-6.0之间,故取一定量的废水处理液各6份,其中1份作为对照组,其余5份为实验组,用1mol/l的naoh分别调至ph5.0,ph6.0,ph7.0,ph8.0,ph9.0,于4℃静置5h后于离心机中离心10min,收集上清液和沉淀,其中沉淀用一定量的蒸馏水溶解并调至中性,离心10min,取上清液并测定其中lox的酶活及蛋白质含量,利用sds-page进行分析实验,并测定lox在沉淀中的沉淀率,结果如图2所示。
由图2可知,将大豆乳清废水ph调至6.0时,沉淀中lox的比酶活及沉淀率均高于其它ph条件下沉淀中的比酶活和沉淀率,而上清液中比酶活低于其他ph条件下上清液中的比酶活,其原因是由于lox的等电点位于ph6.0附近,因此当溶液ph为6.0时,沉淀中lox的比酶活为2816.56u/mg,纯化倍数提高了2.80倍,lox沉淀率达76.82%。且当废水处理液ph调至8.0时,沉淀中lox比酶活及沉淀率低于其他ph条件lox的比酶活及沉淀率,而上清液中lox的比酶活高于其他ph条件下上清液中的比酶活,这是由于废水处理液在ph8.0条件下能沉淀出较多的碱性蛋白,而lox基本保留在上清液中,因此当溶液ph为8.0时,上清液中lox的比酶活较高,当溶液ph为6.0时,沉淀中lox的比酶活及沉淀率较高。
据以上实验结果进行逆ph梯度实验,先将大豆乳清废水ph调至远离lox等电点,以除去等电点在此ph下的杂蛋白,然后将离心所得上清液调至lox等电点ph处。
实施例1
一种大豆乳清废水逆ph梯度提取脂肪氧合酶的方法,包括步骤:
1)大豆乳清废水预处理
取1000ml大豆乳清废水,于12000r/min,离心10min,保留上清液作为大豆乳清废水预处理液,以备实验所用;
2)去除大豆乳清废水预处理液中的杂蛋白
利用氢氧化钠溶液将大豆乳清废水预处理液的ph调节至8.0,离心除去沉淀;
3)提取脂肪氧合酶
利用氢氧化钠溶液将步骤2)离心所得的上清液的ph值调节至6.0,离心去除上清液,所得沉淀物用蒸馏水溶解,并调节ph至中性,即为脂肪氧合酶粗酶液,测定粗酶液中酶活及蛋白质含量,并结合sds-page对脂肪氧合酶沉淀率及纯度进行分析测定,结果如表1和图3所示。
表1逆ph梯度沉淀lox参数表
根据各ph下沉淀大豆乳清废水中lox的研究结果可知,ph6.0条件下大豆乳清废水中lox的沉淀效果较好,而ph8.0条件下能较好地除去大豆乳清废水中杂蛋白。因此,本实验先将大豆乳清废水调至ph8.0处,除去一部分杂蛋白,然后将所得上清液调至ph6.0处,沉淀目的蛋白,所得结果见图3和表2。由图可以看出,图3中条带6所含杂蛋白明显减少,且条带中蛋白质分子量有显著差别,有利于进一步分离纯化。而由表1可知,ph8.0上清液中lox的纯化倍数为3.10,酶活回收率达97.32%,说明此过程对lox起到了一定的纯化效果,且能较好的保持lox酶活力。当ph调至6.0时,其沉淀中lox的纯化倍数提高了10.62倍,比酶活高达10661.32u/mg,且lox酶活回收率和纯化分别为73.54%和39.55%,可见逆ph梯度沉淀过程对lox起到了较好的沉淀效果。
对比例1
peg6000沉淀脂肪氧合酶的方法
参考文献:余武英,赵金梅,肖青虎,等.聚乙二醇沉淀猪胰蛋白酶的研究[j].西华大学学报(自然科学版),2011,30(5):96-99。
在4℃条件下分别向一定量的大豆乳清废水预处理液中加入不同质量的50%peg6000溶液,使得溶液中peg6000的质量分数分别为5%,10%,15%,20%,25%,30%,并搅拌均匀于4℃下静止6h,待peg6000与蛋白质充分结合后,在12000r/min条件下离心10min,所得沉淀用0.2mol/lph8.0硼酸盐缓冲溶液进行溶解,测定溶液中lox酶活及蛋白质含量,采用sds-page进行实验分析,并测定沉淀中lox的沉淀率。
peg6000沉淀分离大豆乳清废水中lox的研究结果如图4所示。由图4可知,peg6000浓度不同对lox的沉淀效果有所不同,当peg6000浓度处于10%以下时,沉淀中lox比酶活均高于上清液和大豆乳清废水的比酶活,当peg6000浓度为10%时,lox纯化倍数及沉淀率最高,分别为1.70和32.83%,说明peg6000分离沉淀技术对大豆乳清废水中的lox有一定的沉淀效果。当peg6000的浓度高于10%时,沉淀中lox比酶活均低于上清液中lox比酶活,lox沉淀率呈下降趋势,而上清液中lox比酶活未有显著提高,所以当peg6000浓度高于10%时,其对大豆乳清废水中lox的沉淀效果较差。而且有研究表明:peg分子在水溶液中具有伸展性,难以除去蛋白质溶液中的peg,因此peg-蛋白质结合物纯化难度大,目的产物得量较低。
因此,综合lox沉淀率及纯化倍数可以得出等电点沉淀技术对大豆乳清废水中lox的分离效果较好。
对比例2
参考文献:杜利成,杨葵华.从鸡蛋壳中提取溶菌酶的工艺研究[j].食品与发酵科技,2005,41(2):22-25。
分别取6份20ml大豆乳清废水,依次加入2ml,3ml,4ml,5ml,6ml0.5%的聚丙烯酸钠,混合均匀后,静置絮凝沉淀24h后离心分离沉淀和上清液。向lox-聚丙烯酸钠沉淀中加入少量蒸馏水,并逐滴加入0.5mol/lna2co3使沉淀物溶解,然后加入5%cacl2解离lox和聚丙烯酸钠,直至无沉淀析出,最后于离心机中离心分离,所得上清液用于酶活测定及蛋白质含量测定,结合sds-page对lox沉淀率进行分析。
聚丙烯酸钠含有大量的羧基,可以通过静电作用结合带相反离子的蛋白质,形成聚合高分子电解质-蛋白质复合物沉淀,且其用量较少,能被水重新溶解,因此较好的保持了蛋白质活性。图5是利用0.5%聚丙烯酸钠溶液沉淀大豆乳清废水中lox的研究结果,由图5可知,聚丙烯酸钠-lox复合物沉淀中所得lox比酶活均高于上清液中lox的比酶活,其中lox纯化倍数及沉淀率最高分别达1.89和40.82%,由此可见,聚丙烯酸钠对大豆乳清废水中的lox有一定的沉淀效果,但该沉淀方法提取效果不理想。
实施例2
一种大豆乳清废水逆ph梯度提取脂肪氧合酶的方法,包括步骤:
1)大豆乳清废水预处理
取1000ml大豆乳清废水,于12000r/min离心10min,保留上清液作为大豆乳清废水预处理液,以备实验所用;
2)去除大豆乳清废水预处理液中的杂蛋白
利用氢氧化钠溶液将大豆乳清废水预处理液的ph调节至8.0,离心除去沉淀;
3)提取脂肪氧合酶
利用氢氧化钠溶液将步骤2)离心所得的上清液的ph值调节至6.0,离心去除上清液,所得沉淀物用蒸馏水溶解,并调节ph至中性,即为脂肪氧合酶粗酶液;
4)脂肪氧合酶粗酶液利用超滤浓缩的方法提纯
利用超滤系统及30kda大小的改性聚醚砜超滤膜,选用两级超滤方式,在压力200kpa下对脂肪氧合酶粗酶液进行10倍超滤浓缩。
为了进一步提高lox提取液的纯度,用超滤系统及改性聚醚砜超滤膜,对lox提取液进行超滤浓缩优化实验,从而探究最佳的超滤条件以用于工业化生产lox。
以上条件的获得通过利用超滤系统及改性聚醚砜超滤膜进行超滤浓缩优化实验。为了确保lox被完全截留,获得较高的的酶活回收率,根据lox的分子量大小及超滤膜包选用原则,应选择截留分子量为lox分子量三分之一至六分之一的超滤膜包,从而探究超滤膜截留分子量、操作压力、超滤方式及浓缩倍数等因素对超滤过程的影响。
2.1超滤膜截留分子量的优化
不同截留分子量的超滤膜对lox的酶活回收率的影响是不同的,根据lox分子量大小及超滤膜包的选择原则,并综合切向流膜包的备用套件,分别选择截留分子量为10kda、30kda及50kda的超滤膜对等电点分级沉淀所得提取液进行超滤浓缩处理。在超滤过程中,操作压力为200kpa,采用一级超滤方式对沉淀提取液进行6倍浓缩,以探究超滤膜截留分子量不同对lox酶活回收率及超滤时间的影响,结果如图6所示。
由图6可以看出,随着超滤膜截留分子量的增加,酶活回收率依次降低,而超滤浓缩相同倍数所用时间依次减少。当超滤膜截留分子量为10kda时,酶活回收率最高达70.84%,但所用超滤时间最多。当超滤膜截留分子量为30kda,酶活回收率为69.51%,所用时间为196min,与10kda的超滤膜相比,时间大大减少。而超滤膜截留分子量为50kda时lox酶活回收率最低,所用时间也最少。这是因为超滤膜截留分子量大小可影响超滤膜的膜通量,而膜通量是表征超滤膜效能的一个重要指标,即超滤膜截留分子量越大,膜通量越高,超滤时间则越短,超滤效能越高。但是为确保lox被完全截留,获得较高的酶活回收率,在超滤过程中超滤膜截留分子量应选择为lox分子量的三分之一到六分之一,使得超滤膜截留分子量低于待截留分子的分子量,并高于欲通过分子的分子量。因此,截留分子量为50kda的超滤膜对lox截留效果较差,而截留分子量为10kda的超滤膜对lox的截留效果最好,但所用时间较长,并且在工业生产中,不仅考虑lox酶活回收率,也要考虑超滤时间,因此综合考虑lox酶活回收率和超滤时间,选用截留分子量为30kda的超滤膜进行超滤处理。
2.2超滤操作压力的优化
大豆乳清废水中除含有大部分的乳清蛋白外,还含有一些小分子的多糖,如大豆低聚糖,会使得大豆乳清废水的黏度随超滤倍数的增加而越来越大,而且操作压力也会对lox产生一定的损失,因此确定合适的操作压力可较好的保持lox酶活回收率。浓缩倍数为6倍,超滤膜截留分子量为30kda,以探究超滤浓缩过程中较为合适的操作压力和时间,研究结果如图7所示。
图如7可知,随着操作压力的增大,酶活回收率及超滤时间均依次降低,当操作压力分别为100kpa和200kpa时,lox酶活回收率分别为69.51%和68.92%,所用超滤时间分别为196min和161min,由此可见,在两个操作压力lox酶活回收率相差无几,但所用超滤时间差别较多。当操作压力为300kpa时,lox酶活回收率和超滤时间分别为62.08%和144min,且压力越大lox酶活回收率和所用超滤时间均越小。这是由于在超滤过程中操作压力过大,超滤膜表面容易产生浓差极化现象,甚至可能形成凝胶层,使得物料中的某些组分在膜孔中的沉积,造成膜孔减小或堵塞,而且操作压力过大很容易造成膜包破裂。因此在超滤过程中,为提高膜分离效能,减少超滤膜污染,一般将操作压力控制在300kpa以下,故操作压力选用200kpa。
2.3浓缩倍数的优化
不同超滤倍数对lox单位酶活和酶活回收率的影响也有所不同,其影响结果如图8所示。
从图8中可以看出,随着超滤浓缩倍数的增大,lox单位酶活依次增加,而酶活回收率逐渐减小。当超滤浓缩至10倍时,lox的单位酶活及酶活回收率分别为17946.88u/ml和66.23%,而且由于超滤后的浓缩液需要进一步纯化,因此,超滤浓缩倍数越大,所得浓缩液的体积越小,进而大大减少后续纯化过程的工作量。
2.4超滤方式的优化
根据以上优化实验结果,在超滤过程中,操作压力为200kpa,并选择30kda的超滤膜对等电点分级沉淀所得提取液进行10倍浓缩,而超滤方式的选择也可对lox酶活回收率和单位酶活产生一定的影响。
分别采用一级超滤和两级超滤方式对等电点分级沉淀提取液进行浓缩处理,以确定较为合适的超滤方式,结果如图9所示。
根据图9可以看出,一级超滤所得lox单位酶活及酶活回收率分别为17946.88u/ml和66.23%,而两级超滤则是将沉淀提取液分为相等的两份,并分别浓缩3倍后混合在一起在浓缩4倍,最终所得lox酶活回收率及单位酶活分别为19713.092u/ml和71.08%。根据两种超滤方式最终所得结果,选择两级超滤方式进行样品处理。
在操作压力为200kpa的条件下,采用截留分子量为30kda的超滤膜和两级超滤方式对等电点分级沉淀所得提取液进行10倍浓缩,所得浓缩液的单位酶活性为19713.092u/ml,纯化倍数提高了16.79倍,而lox纯度及酶活回收率分别达51.85%和71.08%,由此可见,利用超滤系统进一步优化处理等电点分级沉淀所得提取液,可大大提高萃取液中lox的纯度。
实施例3
一种大豆乳清废水逆ph梯度提取脂肪氧合酶的方法,包括步骤:
1)大豆乳清废水预处理
取1000ml大豆乳清废水,于12000r/min离心10min,保留上清液作为大豆乳清废水预处理液,以备实验所用;
2)去除大豆乳清废水预处理液中的杂蛋白
利用氢氧化钠溶液将大豆乳清废水预处理液的ph调节至8.0,离心除去沉淀;
3)提取脂肪氧合酶
利用氢氧化钠溶液将步骤2)离心所得的上清液的ph值调节至6.0,离心去除上清液,所得沉淀物用蒸馏水溶解,并调节ph至中性,即为脂肪氧合酶粗酶液;
4)脂肪氧合酶粗酶液利用超滤浓缩的方法初步提纯
利用超滤系统及30kda大小的改性聚醚砜超滤膜,选用两级超滤方式,在压力200kpa对脂肪氧合酶粗酶液进行10倍超滤浓缩。
5)步骤4)所得酶液利用凝胶过滤色谱法进一步提纯,得到纯的脂肪氧合酶;凝胶过滤色谱法利用2-70kda的sephadexg-75凝胶柱,以ph7.8,0.02mol/l的磷酸缓冲液平衡2~3个柱体积,平衡完毕后上样,以ph7.8,0.02mol/l的磷酸缓冲液为洗脱液洗脱;洗脱液流速为0.5ml/min;自动收集样品,将出峰部分合并,测其溶液中lox酶活及蛋白质含量。
选择凝胶过滤色谱法对lox粗酶液进一步纯化,洗脱结果如图10所示。由图10可以看出,经过sephadexg-75凝胶层析,得到5个蛋白峰,并对每个峰所收集的样品进行酶活测定,并将具有lox酶活的样品合并浓缩。
为了进一步验证大豆乳清废水中lox的纯化结果,对每个纯化阶段的样品进行sds-page分析,所得结果如表2和图11所示。从图11中可以看到大豆乳清废水中含有较多的蛋白质条带,分子量多集中于10-100kda,泳道3中蛋白质条带有所减少,且泳道4中沉淀出较多杂蛋白,从而除去一部分杂蛋白。泳道5中脂肪氧合酶条带明显减少,而泳道6中除了沉淀出lox,还沉淀出少部分的杂蛋白,因此需要通过30kda超滤膜浓缩及凝胶过滤色谱进一步纯化。从图中可以看出,经过进一步纯化,lox提取液呈单一的蛋白条带,说明此纯化过程得到了较高纯度的lox,从而达到了分离纯化大豆乳清废水中lox的目的。
表2大豆乳清废水中lox纯化结果
将ph6.0沉淀溶解后经30kda超滤膜浓缩及sephadexg-75凝胶层析纯化后lox的最终lox纯度为90.43%,比酶活达25546.08u/mg,酶活回收率为40.29%,纯化倍数提高了25.44倍,并根据sds-page凝胶电泳分析结果可以看出,层析液中杂蛋白质条带明显减少,纯化效果较为显著。因此,该纯化方案可用于大豆乳清废水中lox的开发利用,以实现资源化回收利用大豆乳清废水中生物活性物质的目标。
- 还没有人留言评论。精彩留言会获得点赞!