一种重组人粒细胞集落刺激因子的制备方法与流程
本申请属于生物医药领域,具体涉及一种重组人粒细胞集落刺激因子的制备方法。
背景技术:
人粒细胞集落刺激因子(humangranulocyte-colonystimulatingfactors,hg-csf)由单核巨噬细胞、血管内皮细胞及成纤维细胞合成,其主要作用机理:(1)特异地作用于骨髓粒细胞巨噬细胞的前驱细胞(cfu-gm),促进其向成熟粒细胞分化、增殖;(2)作用于骨髓成熟中性粒细胞,促进其从骨髓向外周血释放;(3)激活成熟粒细胞的功能,增强其游走、吞噬及杀菌能力,延长其存活时间;(4)刺激骨髓造血干细胞向外周血释放。因此,在临床上,hg-csf用于由癌症化疗和白血病患者骨髓移植后的中性粒细胞增加。
关于hg-csf的生产,基因工程构建菌株来表达重组hg-csf(recombinanthg-csf,rhg-csf)是现在规模化生产的主要方法。国内外大多采用大肠杆菌来生产rhg-csf,pet表达系统,功能强大,可采用诱导剂控制表达,使用广泛。使用大肠杆菌表达外源蛋白时,发酵培养基大多数为lb复合培养基,但lb复合培养基在表达重组蛋白时有一系列缺点,其一:lb复合培养基的主要成分之一是酵母粉,其中掺杂着微量的乳糖,容易引起泄露表达现象。特别是在表达毒性蛋白时,在诱导后期质粒容易丢失,影响产量的同时,增加工艺控制的困难。其二:lb复合培养基本身营养成分不清楚,且容易带来氨基酸替换杂质。
利用lb复合培养基生产目的蛋白引起泄露表达和质粒丢失的文献资料较多。例如,lianghuijia等人利用重组大肠杆菌在lb复合培养基或yt培养基发酵表达重组蛋白gst-hpth时发现,当培养基中含有大量的酵母粉时,发酵接种1h~2h后就能检测到有目的蛋白,同时也会导致细胞活力下降和质粒丢失。涉及重组表达hg-csf的相关专利中,专利cn100363500c、cn103233053b、cn102154189b等均采用lb培养基进行发酵表达。如上文所述现有技术中普遍采用大肠杆菌在复合lb培养基或自诱导培养基上发酵表达重组人粒细胞集落刺激因子(rhg-csf),由此会带来发酵过程中菌株的质粒稳定性低、泄露表达严重以及氨基酸替换杂质含量高等一系列问题。
专利gb2241505b公开了一种培养基中加氨基酸如“亮氨酸和苏氨酸”来培养大肠杆菌制备多肽的方法,其中亮氨酸和苏氨酸可以抑制宿主细胞的生长,可选的实施方案中还可以加如一些物质刺激宿主细胞的生长,包括酪蛋白水解物或者正亮氨酸等。
如何通过发酵培养基及发酵策略的控制来达到增加大肠杆菌对rhg-csf蛋白表达的目的且减少发酵杂质的产生,同时保证质粒的保有率,解决现有技术中存在的问题,一直是本领域的难题。
技术实现要素:
本申请提供一种重组人粒细胞集落刺激因子的制备方法,通过本发明提供的方法可以提高大肠杆菌对rhg-csf蛋白表达量,避免质粒丢失,减少杂质的产生。
本申请提供一种重组人粒细胞集落刺激因子的制备方法,包含使用发酵培养基对重组大肠杆菌表达菌株进行发酵培养的步骤,其特征在所述发酵培养基含有至少一种氨基酸,且其氮源选自无机氮源,所述重组大肠杆菌表达菌株包含编码粒细胞集落刺激因子的核酸序列。
本申请中所述的发酵培养基不含有机氮源,有机氮源通常是指花生饼粉、黄豆饼粉、棉子饼粉、玉米浆、酵母粉、胰蛋白胨、鱼粉、蚕蛹粉、蛋白胨、麸皮、废菌丝体等物质。
本申请中所述的使用发酵培养基对重组大肠杆菌表达菌株进行发酵培养的步骤区别于诱导表达。
本申请提供的重组人粒细胞集落刺激因子的制备方法,所述的无机氮源为铵盐,具体选自硫酸铵、磷酸氢二铵、磷酸二氢铵、氨水,优选硫酸铵。
本申请提供的重组人粒细胞集落刺激因子的制备方法,铵盐的浓度为1-15g/l,优选1-5g/l(本发明所述的浓度为质量体积比)。
本申请提供的重组人粒细胞集落刺激因子的制备方法,其特征在于所述氨基酸选自异亮氨酸、甲硫氨酸、正亮氨酸、苏氨酸、天冬氨酸、谷氨酸、丝氨酸、色氨酸,优选正亮氨酸、甲硫氨酸,最优选正亮氨酸和甲硫氨酸的组合。
本申请提供的重组人粒细胞集落刺激因子的制备方法,所述氨基酸的浓度为1-25g/l,优选1-10g/l,最优选3-7g/l,氨基酸的浓度是指单一种类氨基酸的浓度。
本申请提供的重组人粒细胞集落刺激因子的制备方法,其特征在于所述发酵培养基还含有碳源,所述碳源选自葡萄糖、甘油、山梨糖醇、麦芽糖、蔗糖、淀粉、甘露糖醇,优选葡萄糖。
本申请提供的重组人粒细胞集落刺激因子的制备方法,所述发酵培养基具体包含:葡萄糖、磷酸二氢钾、磷酸氢二钾、柠檬酸、硫酸铵、七水合硫酸镁、甲硫氨酸、正亮氨酸、微量元素水溶液、水,所述的微量元素溶液的成分为七水合硫酸亚铁、四水合氯化锰、七水合硫酸钴、二水合氯化钙、二水合氯化铜、七水合硫酸锌、盐酸。
本申请提供的重组人粒细胞集落刺激因子的制备方法,其特征在于所述发酵培养基的成分及其浓度为:葡萄糖5-25g/l,磷酸二氢钾5-15g/l,磷酸氢二钾5-30g/l,柠檬酸0.5-5g/l,硫酸铵1-15g/l,七水合硫酸镁0.5-5g/l,甲硫氨酸1-25g/l,正亮氨酸1-25g/l,0.5-1.5ml微量元素溶液,所述的微量元素溶液的成分的含量为1.0-3.5g/l水合硫酸亚铁,1.0-4.0g/l四水合氯化锰,1.5-4.5g/l七水合硫酸钴,0.5-4.0g/l二水合氯化钙,0.1-1.0g/l二水合氯化铜,0.1-1.0g/l七水合硫酸锌,1mol/l盐酸,余量为水。
本申请提供的重组人粒细胞集落刺激因子的制备方法,其特征在于所述发酵培养基的成分及其浓度为:葡萄糖8-15g/l,磷酸二氢钾6-12g/l,磷酸氢二钾10-20g/l,柠檬酸1-3g/l,硫酸铵1-5g/l,七水合硫酸镁1-3g/l,甲硫氨酸1-10g/l,正亮氨酸1-10g/l,微量元素溶液0.8-1.2ml,余量为水;所述所述的微量元素溶液的成分的含量为1.0-3.5g/l水合硫酸亚铁、1.0-4.0g/l四水合氯化锰、1.5-4.5g/l七水合硫酸钴、0.5-4.0g/l二水合氯化钙、0.1-1.0g/l二水合氯化铜、0.1-1.0g/l七水合硫酸锌、1mol/l盐酸,余量为水。
本申请优选的重组人粒细胞集落刺激因子的制备方法,其特征在于所述发酵培养为分批补料式培养,即包含将重组大肠杆菌表达菌株在上述培养基初步培养后加入补料培养基继续培养的步骤。
本申请提供的重组人粒细胞集落刺激因子的制备方法,其特征在于所述补料的培养基的组成为葡萄糖水溶液和硫酸铵水溶液。
本申请提供的重组人粒细胞集落刺激因子的制备方法,其特征在于所述的补料培养基的组成为30-70%葡萄糖,15-45g/l硫酸铵溶液,余量为水;优选40-60%葡萄糖,25-40g/l硫酸铵溶液,余量为水;最优选50%葡萄糖溶液、30g/l硫酸铵溶液,余量为水。
本申请提供的重组人粒细胞集落刺激因子的制备方法,还包含重组大肠杆菌表达菌株种子培养、诱导表达的步骤,且在诱导表达过程中流加补料培养基。
本申请提供的重组人粒细胞集落刺激因子的制备方法,补料培养及诱导培养阶段,葡萄糖与硫酸铵的流加速率比选自10:1-1:1,优选5:1-1:1,最优选2:1。
本申请提供的重组人粒细胞集落刺激因子的制备方法,补料培养阶段,葡萄糖的流加速率为0.05-0.20ml/(l·min),优选0.08-0.18ml/(l·min),诱导发酵过程中葡萄糖的流加速率为0.20-0.40ml/(l·min),优选0.20-0.30ml/(l·min)。
本申请提供的制备方法中,发酵培养4-10h,优选5-8h后待溶氧反弹后向发酵体系中补加灭菌的补料培养基继续发酵2-6h,优选3h-5h后,发酵培养的菌株至od600为20-30时,优选24-29时开始诱导培养,诱导表达时间为3-8h,优选4h-6h,结束发酵,发酵液经离心收集发酵产物。
本申请中所述的重组大肠杆菌表达菌株为pet9a-gcsf/bl21(de3)该菌株含有连接rhg-csf基因的pet9a表达载体。领域已知的诱导方式包括iptg(异丙基-β-d-硫代半乳糖苷)、乳糖、nacl、热诱导,本发明优选iptg,其使用的浓度范围可选0.05-1.5mmol/l,优选0.1-1.0mmol/l。
本申请提供的重组人粒细胞集落刺激因子的制备方法,其特征在于:根据载体的抗生素标记,发酵培养基可以包含抗生素如氨苄青霉素、四环素、卡那霉素、氯霉素等。
本申请提供的重组人粒细胞集落刺激因子的制备方法包括以下步骤:
(1)种子培养:将已转化利用pet-9a载体和人g-csf基因构建得到的重组质粒的宿主菌接种于lb培养基中,接种量0.005%-0.3%,优选0.01%-0.1%;培养时间6-12h,优选8-10h;培养至od600为0.5-3.5,优选1.5-2.5时得到发酵种子液,取样镜检观察无杂菌,菌种形态正常,即为发酵罐培养用种子。
(2)发酵培养:将种子液按发酵培养基体积的1%-20%,优选4%-10%的比例及0.5-1.5ml微量元素溶液,优选0.8-1.2ml微量元素溶液接种到灭菌的发酵培养基中,发酵培养4-10h,优选5-8h,待发酵培养基中的葡萄糖消耗殆尽开始补料培养,发酵罐培养控制条件为:培养温度35-39℃,优选36-38℃;通过氨水溶液控制发酵体系ph在7.0±0.5,优选ph在7.0±0.2;发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。
(3)补料培养:待溶氧反弹后向发酵体系中补加灭菌的补料培养基继续发酵2-6h,优选3h-5h时,待发酵培养的菌株至od600为20-30时,优选24-29时开始诱导培养。
(4)诱导表达:诱导方式为iptg,诱导时间为3-8h,优选4h-6h,结束发酵,经离心收集发酵产物,诱导表达阶段流加补料培养基。
本发明提供的重组人粒细胞集落刺激因子的制备方法优选的实施方式包括以下步骤:
(1)种子培养:将已转化利用pet-9a载体和人g-csf基因构建得到的重组质粒的宿主菌接种于lb培养基中,接种量0.01%-0.1%;培养时间8-10h;培养至od600为2-2.5时得到发酵种子液,取样镜检观察无杂菌,菌种形态正常,即为发酵罐培养用种子。
(2)发酵培养:将种子液按发酵培养基体积的4%-10%的比例及0.8-1.2ml微量元素溶液接种到灭菌的发酵培养基中,发酵培养5-8h,待发酵培养基中的葡萄糖消耗殆尽开始补料培养,发酵控制条件为:培养温度36-38℃,通过氨水溶液控制发酵体系ph在7.0±0.2,发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。
(3)补料培养:待溶氧反弹后向发酵体系中补加灭菌的补料培养基继续发酵3h-5h时,待发酵培养的菌株至od600为24-29时开始诱导培养。
(4)诱导表达:诱导方式为iptg,诱导时间为4h-6h,结束发酵,经离心收集发酵产物,诱导表达阶段流加补料培养基。
本申请提供的重组人粒细胞集落刺激因子的制备方法,进一步包含包涵体复性、纯化的步骤。
通过本申请提供的制备方法,明显提高了发酵菌液的质粒保有率,解决了现有技术中质粒稳定性低、泄露表达严重的问题,具体的,本发明发酵液中重组大肠杆菌表达菌株质粒保留率大于60%,优选大于80%,最优选大于90%。
通过本申请提供的制备方法,发酵液中氨基酸替换杂质的含量明显减少,为后续纯化提供了便利,具体的发酵液中氨基酸替换杂质的含量小于2%,优选小于0.5%。
本申请另一方面提供一种重组人粒细胞集落刺激因子的水溶性聚合物修饰的偶联物的制备方法:其特征在包括上述的重组人粒细胞集落刺激因子的制备方法,还包括重组人粒细胞集落刺激因子与水溶性聚合物偶联的步骤。
本申请另一方面提供一种重组人粒细胞集落刺激因子的水溶性聚合物修饰的偶联物的制备方法中所述水溶性聚合物为聚乙二醇。
本申请提供的重组人粒细胞集落刺激因子的水溶性聚合物修饰的偶联物,其结构如式ⅰ所示
m选自50-2500的整数,优选自400-500的整数,g为重组人粒细胞集落刺激因子的蛋白序列。
本申请(1)成功地使用一种无机盐培养基利用重组大肠杆菌高密度表达出rhg-csf,相对于采用lb复合培养基,发酵过程更加稳定可控;(2)在本发明方法中,采用无机盐培养基避免了培养基中自带诱导成分,解决了利用lb复合培养基发酵过程引起的泄露表达现象,且诱导结束后质粒稳定性强。此外通过向发酵培养中添加一定浓度的氨基酸减少了氨基酸替换杂质的产生;(3)本发明对重组粒细胞集落刺激因子工程菌发酵工艺进行了深入研究和优化,通过本发明所述的技术方案,大肠杆菌pet9a-gcsf/bl21(de3)菌体得率高,目的蛋白表达量高于2g/l,目的蛋白g-csf占菌体总蛋白18.0%以上。
附图说明
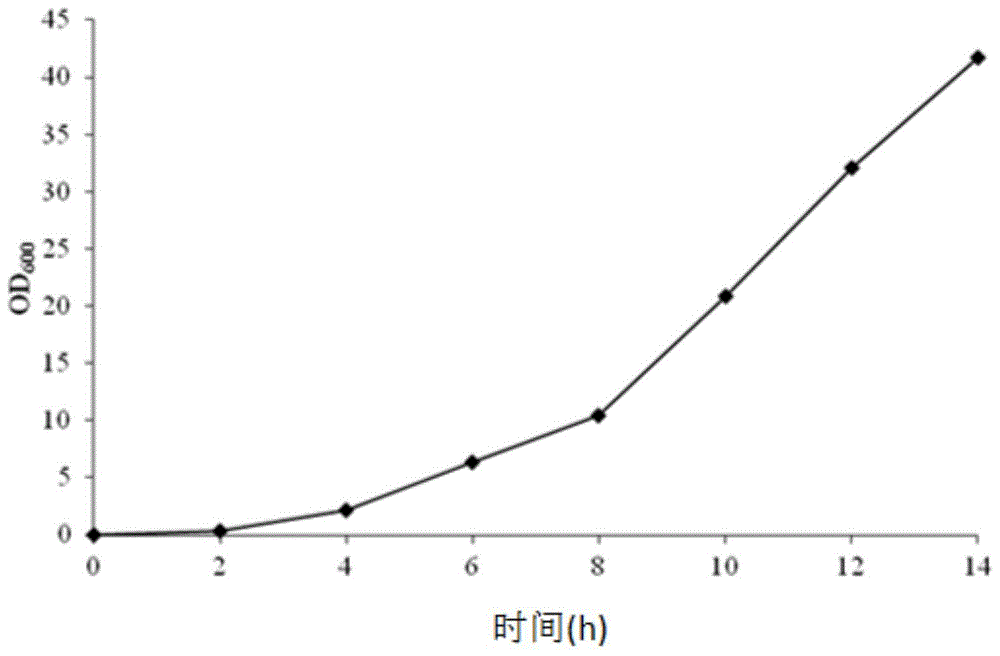
附图1.工程菌在5l发酵罐中的生长曲线图;
附图2.工程菌在50l发酵罐中的生长曲线图。
具体实施方式
以下为本申请的具体实施方式,实施例是为进一步描述本申请而不是限制本发申请,凡与本申请等效的技术方案均属于本申请的保护范围。
本申请使用的重组大肠杆菌表达菌株根据公开号为wo2017181920a实施例1公开的制备方法得到。
实施例一(以5l发酵罐为例)
1.种子的培养:在1l三角瓶中装有种子培养基200ml,121℃湿热灭菌30min,冷却到室温。取pet9a-gcsf/bl21(de3)菌种一支,接种于种子培养基中,接种量为0.03%、培养温度30℃、摇床转速为250rpm,振荡培养8h,测定od600为1.92,得到发酵种子培养液。其中种子培养基的成分及其含量为:选择性大豆蛋白胨10g/l,酵母粉5g/l,nacl5g/l,用纯化水配制而成,自然ph。显微镜镜检检查,种子培养液未见杂菌污染现象,为典型的大肠杆菌形态。
2.接种前准备:首先将发酵罐清洗干净,将发酵培养基溶于纯化水中,搅拌均匀,转移至发酵罐中,121℃蒸汽湿热灭菌30min,冷却至37℃备用。其中发酵培养基的组成为:葡萄糖10g/l,磷酸二氢钾7.5g/l,磷酸氢二钾15g/l,柠檬酸2g/l,硫酸铵2.5g/l,七水合硫酸镁2g/l,甲硫氨酸5g/l,正亮氨酸5g/l,1ml微量元素溶液,余量为水。
将补料培养基溶于纯化水中,搅拌均匀,湿热灭菌30min,冷却后备用。补料培养基的组成为:50%葡萄糖溶液、30g/l硫酸铵溶液。其中葡萄糖溶液115℃灭菌30min;硫酸铵溶液121℃灭菌30min;
3.接种:将种子液和1ml微量元素溶液接种至装有发酵培养基的5l发酵罐中,装液量3l,培养温度37℃,初始搅拌转速为200rpm,氨水溶液控制初始ph在7.0。种子液接种到发酵培养基后,设定好初始工艺参数,稳定后校正溶氧为100%。
4.发酵:发酵控制条件为培养温度36-38℃,转速200-1000rpm,通气量20-100l/min,罐压0.03-0.1mpa,通过氨水溶液控制发酵体系ph在7.0±0.2,发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。待溶氧反弹后进行补料,补料速率初始设定值:葡萄糖补料速率为0.09ml/(l·min),硫酸铵补料速率为0.045ml/(l·min),补料开始后根据溶氧反馈调节方式调整补料速率;补料速率由初始设定值逐渐调整至诱导过程中,葡萄糖补料速率为0.2ml/(l·min),硫酸铵补料速率为0.1ml/(l·min),而后以此补料速率恒速补料。培养的菌株至od600为25.6时开始诱导,诱导方式为1mmol/liptg;诱导过程中,葡萄糖补料速率为0.2ml/(l·min),硫酸铵补料速率为0.1ml/(l·min),诱导时间为4h。诱导结束后,取样发酵液一部分进行质粒保有率的测定,另一部分在离心力为12840×g条件下离心10min,弃上清液,sds-page检测菌体中目的蛋白表达量以及电泳纯度;采用管式离心机收集湿菌体,湿菌体经高压均质机破碎,洗涤后称重包涵体,发酵液中的氨基酸替换杂质含量使用hplc进行检测。
经检测,诱导结束后的发酵菌液od600达到47.6,质粒保有率为93.9%,菌体中目的蛋白表达量为2.52g/l,目的蛋白g-csf占菌体总蛋白19.6%,获得包涵体11.7g,发酵液中的氨基酸替换杂质含量为0.17%。
利用分光光度计测定大肠杆菌培养液od600值,以od600值做为纵坐标,时间为横坐标作图,得出大肠杆菌的生长曲线,如附图1所示。
实施例二(以5l发酵罐为例)
1.种子的培养:在1l三角瓶中装有种子培养基200ml,121℃湿热灭菌30min,冷却到室温。取pet9a-gcsf/bl21(de3)菌种一支,接种于种子培养基中,接种量为0.03%、培养温度30℃、摇床转速为250rpm,振荡培养9h,测定od600为2.20,得到发酵种子培养液。其中种子培养基的成分及其含量为:选择性大豆蛋白胨10g/l,酵母粉5g/l,nacl5g/l,用纯化水配制而成,自然ph。显微镜镜检检查,种子培养液未见杂菌污染现象,为典型的大肠杆菌形态。
2.接种前准备:首先将发酵罐清洗干净,将发酵培养基溶于纯化水中,搅拌均匀,转移至发酵罐中,121℃蒸汽湿热灭菌30min,冷却至37℃备用。其中发酵培养基的组成为:葡萄糖10g/l,磷酸二氢钾7.5g/l,磷酸氢二钾15g/l,柠檬酸2g/l,硫酸铵2.5g/l,七水合硫酸镁2g/l,甲硫氨酸5g/l,正亮氨酸5g/l,1ml微量元素溶液,余量为水。
将补料培养基溶于纯化水中,搅拌均匀,湿热灭菌30min,冷却后备用。补料培养基的组成为:50%葡萄糖溶液、30g/l硫酸铵溶液。其中葡萄糖溶液115℃灭菌30min;硫酸铵溶液121℃灭菌30min;
3.接种:将种子液和1ml微量元素溶液接种至装有发酵培养基的5l发酵罐中,装液量3l,培养温度37℃,初始搅拌转速为200rpm,氨水溶液控制初始ph在7.0。种子液接种到发酵培养基后,设定好初始工艺参数,稳定后校正溶氧为100%。
4.发酵:发酵控制条件为:培养温度36-38℃,转速200-1000rpm,通气量20-100l/min,罐压0.03-0.1mpa,通过氨水溶液控制发酵体系ph在7.0±0.2,发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。待溶氧反弹后进行补料,补料速率初始设定值:葡萄糖补料速率为0.09ml/(l·min),硫酸铵补料速率为0.045ml/(l·min),补料开始后根据溶氧反馈调节方式调整补料速率;补料速率由初始设定值逐渐调整至诱导过程中,葡萄糖补料速率为0.2ml/(l·min),硫酸铵补料速率为0.1ml/(l·min),而后以此补料速率恒速补料。培养的菌株至od600为28.7时开始诱导,诱导方式为1mmol/liptg;诱导过程中,葡萄糖补料速率为0.2ml/(l·min),硫酸铵补料速率为0.1ml/(l·min),诱导时间为6h。诱导结束后,取样发酵液一部分进行质粒保有率的测定,另一部分在离心力为12840×g条件下离心10min,弃上清液,sds-page检测菌体中目的蛋白表达量以及电泳纯度;采用管式离心机收集湿菌体,湿菌体经高压均质机破碎,洗涤后称重包涵体,发酵液中的氨基酸替换杂质含量使用hplc进行检测。
经检测,诱导结束后的发酵菌液od600达到50.4,质粒保有率为85.2%;菌体中目的蛋白表达量为2.86g/l,目的蛋白g-csf占菌体总蛋白22.5%,获得包涵体13.9g,发酵液中的氨基酸替换杂质含量为0.13%。
实施例三(以5l发酵罐为例)
1.种子的培养:在1l三角瓶中装有种子培养基200ml,121℃湿热灭菌30min,冷却到室温。取pet9a-gcsf/bl21(de3)菌种一支,接种于种子培养基中,接种量为0.03%、培养温度30℃、摇床转速为250rpm,振荡培养10h,测定od600为2.47,得到发酵种子培养液。其中种子培养基的成分及其含量为:选择性大豆蛋白胨10g/l,酵母粉5g/l,nacl5g/l,用纯化水配制而成,自然ph。显微镜镜检检查,种子培养液未见杂菌污染现象,为典型的大肠杆菌形态。
2.接种前准备:首先将发酵罐清洗干净,将发酵培养基溶于纯化水中,搅拌均匀,转移至发酵罐中,121℃蒸汽湿热灭菌30min,冷却至37℃备用。其中发酵培养基的组成为:葡萄糖10g/l,磷酸二氢钾7.5g/l,磷酸氢二钾15g/l,柠檬酸2g/l,硫酸铵2.5g/l,七水合硫酸镁2g/l,甲硫氨酸5g/l,正亮氨酸5g/l,1ml微量元素溶液,余量为水。
将补料培养基溶于纯化水中,搅拌均匀,湿热灭菌30min,冷却后备用。补料培养基的组成为:50%葡萄糖溶液、30g/l硫酸铵溶液。其中葡萄糖溶液115℃灭菌30min;硫酸铵溶液121℃灭菌30min;
3.接种:将种子液和1ml微量元素溶液接种至装有发酵培养基的5l发酵罐中,装液量3l,培养温度37℃,初始搅拌转速为200rpm,氨水溶液控制初始ph在7.0。种子液接种到发酵培养基后,设定好初始工艺参数,稳定后校正溶氧为100%。
4.发酵:发酵控制条件为:培养温度36-38℃,转速200-1000rpm,通气量20-100l/min,罐压0.03-0.1mpa,通过氨水溶液控制发酵体系ph在7.0±0.2,发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。待溶氧反弹后进行补料,补料速率初始设定值:葡萄糖补料速率为0.09ml/(l·min),硫酸铵补料速率为0.045ml/(l·min),补料开始后根据溶氧反馈调节方式调整补料速率;补料速率由初始设定值逐渐调整至诱导过程中,葡萄糖补料速率为0.2ml/(l·min),硫酸铵补料速率为0.1ml/(l·min),而后以此补料速率恒速补料。发酵过程中转速根据溶氧反馈调节,由转速控制范围在200rpm~1000rpm。培养的菌株至od600为27.2时开始诱导,诱导方式为0.5mmol/liptg;葡萄糖补料速率设置为0.2ml/(l·min),硫酸铵补料速率为0.1l/(l·min),诱导时间为4h。诱导结束后,取样发酵液一部分进行质粒保有率的测定,另一部分在离心力为12840×g条件下离心10min,弃上清液,sds-page检测菌体中目的蛋白表达量以及电泳纯度;采用管式离心机收集湿菌体,湿菌体经高压均质机破碎,洗涤后称重包涵体,发酵液中的氨基酸替换杂质含量使用hplc进行检测。
经检测,诱导结束后的发酵菌液od600达到42.2,质粒保有率为96.8%,菌体中目的蛋白表达量为2.14g/l,目的蛋白g-csf占菌体总蛋白18.4%,获得包涵体10.2g,发酵液中的氨基酸替换杂质含量为0.09%。
实施例四(以5l发酵罐为例)
1.种子的培养:在1l三角瓶中装有种子培养基200ml,121℃湿热灭菌30min,冷却到室温。取pet9a-gcsf/bl21(de3)菌种一支,接种于种子培养基中,接种量为0.03%、培养温度30℃、摇床转速为250rpm,振荡培养9h,测定od600为2.32,得到发酵种子培养液。其中种子培养基的成分及其含量为:选择性大豆蛋白胨10g/l,酵母粉5g/l,nacl5g/l,用纯化水配制而成,自然ph。显微镜镜检检查,种子培养液未见杂菌污染现象,为典型的大肠杆菌形态。
2.接种前准备:首先将发酵罐清洗干净,将发酵培养基溶于纯化水中,搅拌均匀,转移至发酵罐中,121℃蒸汽湿热灭菌30min,冷却至37℃备用。其中发酵培养基的组成为:葡萄糖10g/l,磷酸二氢钾7.5g/l,磷酸氢二钾15g/l,柠檬酸2g/l,硫酸铵2.5g/l,七水合硫酸镁2g/l,甲硫氨酸5g/l,正亮氨酸5g/l,1ml微量元素溶液,余量为水。
将补料培养基溶于纯化水中,搅拌均匀,湿热灭菌30min,冷却后备用。补料培养基的组成为:50%葡萄糖溶液、30g/l硫酸铵溶液。其中葡萄糖溶液115℃灭菌30min;硫酸铵溶液121℃灭菌30min;
3.接种:将种子液和1ml微量元素溶液接种至装有发酵培养基的5l发酵罐中,装液量3l,培养温度37℃,初始搅拌转速为200rpm,氨水溶液控制初始ph在7.0。种子液接种到发酵培养基后,设定好初始工艺参数,稳定后校正溶氧为100%。
4.发酵:发酵控制条件为:培养温度36-38℃,转速200-1000rpm,通气量20-100l/min,罐压0.03-0.1mpa,通过氨水溶液控制发酵体系ph在7.0±0.2,发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。待溶氧反弹后进行补料,补料速率初始设定值:葡萄糖补料速率为0.09ml/(l·min),硫酸铵补料速率为0.045ml/(l·min),补料开始后根据溶氧反馈调节方式调整补料速率;补料速率由初始设定值逐渐调整至诱导过程中,葡萄糖补料速率为0.2ml/(l·min),硫酸铵补料速率为0.1ml/(l·min),而后以此补料速率恒速补料。培养的菌株至od600为26.0时开始诱导,诱导方式为0.1mmol/liptg;葡萄糖补料速率设置为0.2ml/(l·min),硫酸铵补料速率为0.1ml/(l·min),诱导时间为4h。诱导结束后,取样发酵液一部分进行质粒保有率的测定,另一部分在离心力为12840×g条件下离心10min,弃上清液,sds-page检测菌体中目的蛋白表达量以及电泳纯度;采用管式离心机收集湿菌体,湿菌体经高压均质机破碎,洗涤后称重包涵体,发酵液中的氨基酸替换杂质含量使用hplc进行检测。
经检测,诱导结束后的发酵菌液od600达到40.1,质粒保有率为89.6%,菌体中目的蛋白表达量为2.10g/l,目的蛋白g-csf占菌体总蛋白18.8%,获得包涵体10.8g,发酵液中的氨基酸替换杂质含量为0.12%。
实施例五(以50l发酵罐为例)
1.种子的培养:在5l三角瓶中装有种子培养基1l,共配置两瓶,121℃湿热灭菌30min,冷却到室温。取pet9a-gcsf/bl21(de3)菌种一支,接种于种子培养基中,接种量为0.03%、培养温度30℃、摇床转速为250rpm,振荡培养9h,测定平均od600为2.26,得到发酵种子培养液。其中种子培养基的成分及其含量为:选择性大豆蛋白胨10g/l,酵母粉5g/l,nacl5g/l,用纯化水配制而成,自然ph。显微镜镜检检查,种子培养液未见杂菌污染现象,为典型的大肠杆菌形态。
2.接种前准备:首先将发酵罐清洗干净,将发酵培养基溶于纯化水中,搅拌均匀,转移至发酵罐中,121℃蒸汽湿热灭菌30min,冷却至37℃备用。其中发酵培养基的组成为:葡萄糖10g/l,磷酸二氢钾7.5g/l,磷酸氢二钾15g/l,柠檬酸2g/l,硫酸铵2.5g/l,七水合硫酸镁2g/l,甲硫氨酸5g/l,正亮氨酸5g/l,10ml微量元素溶液,余量为水。
将补料培养基溶于纯化水中,搅拌均匀,湿热灭菌30min,冷却后备用。补料培养基的组成为:50%葡萄糖溶液、30g/l硫酸铵溶液。其中葡萄糖溶液115℃灭菌30min;硫酸铵溶液121℃灭菌30min;
3.接种:将种子液和10ml微量元素溶液接种至装有装有30l发酵培养基的50l发酵罐中,培养温度37℃,初始搅拌转速为150rpm,氨水溶液控制初始ph在7.0。种子液接种到发酵培养基后,设定好初始工艺参数,稳定后校正溶氧为100%。
4.发酵:发酵控制条件为:培养温度36-38℃,转速150-500rpm,通气量20-100l/min,罐压0.03-0.1mpa,通过氨水溶液控制发酵体系ph在7.0±0.2,发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。待溶氧反弹后进行补料,补料速率初始设定值:葡萄糖补料速率为0.12ml/(l·min),硫酸铵补料速率为0.06ml/(l·min),补料开始后根据溶氧反馈调节方式调整补料速率;补料速率由初始设定值逐渐调整至葡萄糖补料速率为0.24in),而后以此补料速率恒速补料。培养的菌株至od600为26.2时开始诱导,诱导方式为1mmol/liptg;诱导过程中,葡萄糖补料速率为0.24ml/(l·min),硫酸铵补料速率为0.12ml/(l·min),诱导时间为4h。诱导结束后,取样发酵液一部分进行质粒保有率的测定,另一部分在离心力为12840×g条件下离心10min,弃上清液,sds-page检测菌体中目的蛋白表达量以及电泳纯度;采用管式离心机收集湿菌体,湿菌体经高压均质机破碎,洗涤后称重包涵体,发酵液中的氨基酸替换杂质含量使用hplc进行检测。
经检测,诱导结束后的发酵菌液od600达到68.2,质粒保有率为88.7%,菌体中目的蛋白表达量为5.25g/l,目的蛋白g-csf占菌体总蛋白21.5%,获得包涵体132.6g,发酵液中的氨基酸替换杂质含量为0.17%。
利用分光光度计测定大肠杆菌培养液od600值,以od600值做为纵坐标,时间为横坐标作图,得出大肠杆菌的生长曲线,如附图2所示。
实施例六(以50l发酵罐为例)
1.种子的培养:在5l三角瓶中装有种子培养基1l,共配置两瓶,121℃湿热灭菌30min,冷却到室温。取pet9a-gcsf/bl21(de3)菌种一支,接种于种子培养基中,接种量为0.03%、培养温度30℃、摇床转速为250rpm,振荡培养9.5h,测定平均od600为2.40,得到发酵种子培养液。其中种子培养基的成分及其含量为:选择性大豆蛋白胨10g/l,酵母粉5g/l,nacl5g/l,用纯化水配制而成,自然ph。显微镜镜检检查,种子培养液未见杂菌污染现象,为典型的大肠杆菌形态。
2.接种前准备:首先将发酵罐清洗干净,将发酵培养基溶于纯化水中,搅拌均匀,转移至发酵罐中,121℃蒸汽湿热灭菌30min,冷却至37℃备用。其中发酵培养基的组成为:葡萄糖10g/l,磷酸二氢钾7.5g/l,磷酸氢二钾15g/l,柠檬酸2g/l,硫酸铵2.5g/l,七水合硫酸镁2g/l,甲硫氨酸5g/l,正亮氨酸5g/l,,10ml微量元素溶液,余量为水。
将补料培养基溶于纯化水中,搅拌均匀,湿热灭菌30min,冷却后备用。补料培养基的组成为:50%葡萄糖溶液、30g/l硫酸铵溶液。其中葡萄糖溶液115℃灭菌30min;硫酸铵溶液121℃灭菌30min;
3.接种:将种子液和10ml微量元素溶液接种至装有装有30l发酵培养基的50l发酵罐中,培养温度37℃,初始搅拌转速为150rpm,氨水溶液控制初始ph在7.0。种子液接种到发酵培养基后,设定好初始工艺参数,稳定后校正溶氧为100%。
4.发酵:发酵控制条件为:培养温度36-38℃,转速150-500rpm,通气量20-100l/min,罐压0.03-0.1mpa,通过氨水溶液控制发酵体系ph在7.0±0.2,发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。待溶氧反弹后进行补料,补料速率初始设定值:葡萄糖补料速率为0.12ml/(l·min),硫酸铵补料速率为0.06ml/(l·min),补料开始后根据溶氧反馈调节方式调整补料速率;补料速率由初始设定值逐渐调整至葡萄糖补料速率为0.24ml/(l·min),硫酸铵补料速率为0.12ml/(l·min),而后以此补料速率恒速补料。培养的菌株至od600为29.1时开始诱导,诱导方式为1mmol/liptg;诱导过程中,葡萄糖补料速率为0.24ml/(l·min),硫酸铵补料速率为0.12ml/(l·min),诱导时间为6h。诱导结束后,取样发酵液一部分进行质粒保有率的测定,另一部分在离心力为12840×g条件下离心10min,弃上清液,sds-page检测菌体中目的蛋白表达量以及电泳纯度;采用管式离心机收集湿菌体,湿菌体经高压均质机破碎,洗涤后称重包涵体,发酵液中的氨基酸替换杂质含量使用hplc进行检测。
经检测,诱导结束后的发酵菌液od600达到62.1,质粒保有率为91.5%,菌体中目的蛋白表达量为5.37g/l,目的蛋白g-csf占菌体总蛋白21.5%,获得包涵体118.4g,发酵液中的氨基酸替换杂质含量为0.15%。
实施例七(以50l发酵罐为例)
1.种子的培养:在5l三角瓶中装有种子培养基600ml,共配置两瓶,121℃湿热灭菌30min,冷却到室温。取pet9a-gcsf/bl21(de3)菌种一支,接种于种子培养基中,接种量为0.03%、培养温度30℃、摇床转速为250rpm,振荡培养9h,测定平均od600为2.12,得到发酵种子培养液。其中种子培养基的成分及其含量为:选择性大豆蛋白胨10g/l,酵母粉5g/l,nacl5g/l,用纯化水配制而成,自然ph。显微镜镜检检查,种子培养液未见杂菌污染现象,为典型的大肠杆菌形态。
2.接种前准备:首先将发酵罐清洗干净,将发酵培养基溶于纯化水中,搅拌均匀,转移至发酵罐中,121℃蒸汽湿热灭菌30min,冷却至37℃备用。其中发酵培养基的组成为:葡萄糖10g/l,磷酸二氢钾7.5g/l,磷酸氢二钾15g/l,柠檬酸2g/l,硫酸铵2.5g/l,七水合硫酸镁2g/l,甲硫氨酸5g/l,正亮氨酸5g/l,10ml微量元素溶液,余量为水。
将补料培养基溶于纯化水中,搅拌均匀,湿热灭菌30min,冷却后备用。补料培养基的组成为:50%葡萄糖溶液、30g/l硫酸铵溶液。其中葡萄糖溶液115℃灭菌30min;硫酸铵溶液121℃灭菌30min;
3.接种:将种子液和10ml微量元素溶液接种至装有装有30l发酵培养基的50l发酵罐中,培养温度37℃,初始搅拌转速为150rpm,氨水溶液控制初始ph在7.0。种子液接种到发酵培养基后,设定好初始工艺参数,稳定后校正溶氧为100%。。
4.发酵:发酵控制条件为:培养温度36-38℃,转速150-500rpm,通气量20-100l/min,罐压0.03-0.1mpa,通过氨水溶液控制发酵体系ph在7.0±0.2,发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。待溶氧反弹后进行补料,补料速率初始设定值:葡萄糖补料速率为0.12ml/(l·min),硫酸铵补料速率为0.06ml/(l·min),补料开始后根据溶氧反馈调节方式调整补料速率;补料速率由初始设定值逐渐调整至葡萄糖补料速率为0.24ml/(l·min),硫酸铵补料速率为0.12ml/(l·min),而后以此补料速率恒速补料。培养的菌株至od600为26.5时开始诱导,诱导方式为0.5mmol/liptg;诱导过程中,葡萄糖补料速率设置为0.24ml/(l·min),硫酸铵补料速率为0.12ml/(l·min),诱导时间为4h。诱导结束后,取样发酵液一部分进行质粒保有率的测定,另一部分在离心力为12840×g条件下离心10min,弃上清液,sds-page检测菌体中目的蛋白表达量以及电泳纯度;采用管式离心机收集湿菌体,湿菌体经高压均质机破碎,洗涤后称重包涵体,发酵液中的氨基酸替换杂质含量使用hplc进行检测。
经检测,诱导结束后的发酵菌液od600达到60.4,质粒保有率为89.4%,菌体中目的蛋白表达量为5.79g/l,目的蛋白g-csf占菌体总蛋白24.7%,获得包涵体161.3g,发酵液中的氨基酸替换杂质含量为0.05%。
实施例八(以50l发酵罐为例)
1.种子的培养:在5l三角瓶中装有种子培养基600ml,121℃湿热灭菌30min,冷却到室温。取pet9a-gcsf/bl21(de3)菌种一支,接种于种子培养基中,接种量为0.03%、培养温度30℃、摇床转速为250rpm,振荡培养9.5h,测定平均od600为2.33,得到发酵种子培养液。其中种子培养基的成分及其含量为:选择性大豆蛋白胨10g/l,酵母粉5g/l,nacl5g/l,用纯化水配制而成,自然ph。显微镜镜检检查,种子培养液未见杂菌污染现象,为典型的大肠杆菌形态。
2.接种前准备:首先将发酵罐清洗干净,将发酵培养基溶于纯化水中,搅拌均匀,转移至发酵罐中,121℃蒸汽湿热灭菌30min,冷却至37℃备用。其中发酵培养基的组成为:葡萄糖10g/l,磷酸二氢钾7.5g/l,磷酸氢二钾15g/l,柠檬酸2g/l,硫酸铵2.5g/l,七水合硫酸镁2g/l,甲硫氨酸5g/l,正亮氨酸5g/l,10ml微量元素溶液,余量为水。
将补料培养基溶于纯化水中,搅拌均匀,湿热灭菌30min,冷却后备用。补料培养基的组成为:50%葡萄糖溶液、30g/l硫酸铵溶液。其中葡萄糖溶液115℃灭菌30min;硫酸铵溶液121℃灭菌30min;
3.接种:将种子液和10ml微量元素溶液接种至装有装有30l发酵培养基的50l发酵罐中,培养温度37℃,初始搅拌转速为150rpm,氨水溶液控制初始ph在7.0。种子液接种到发酵培养基后,设定好初始工艺参数,稳定后校正溶氧为100%。
4.发酵:发酵控制条件为:培养温度36-38℃,转速150-500rpm,通气量20-100l/min,罐压0.03-0.1mpa,通过氨水溶液控制发酵体系ph在7.0±0.2,发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。待溶氧反弹后进行补料,补料速率初始设定值:葡萄糖补料速率为0.12ml/(l·min),硫酸铵补料速率为0.06ml/(l·min),补料开始后根据溶氧反馈调节方式调整补料速率;补料速率由初始设定值逐渐调整至葡萄糖补料速率为0.24ml/(l·min),硫酸铵补料速率为0.12ml/(l·min),而后以此补料速率恒速补料。培养的菌株至od600为25.4时开始诱导,诱导方式为0.1mmol/liptg;诱导过程中,葡萄糖补料速率设置为0.24ml/(l·min),硫酸铵补料速率为0.12ml/(l·min),诱导时间为4h。诱导结束后,取样发酵液一部分进行质粒保有率的测定,另一部分在离心力为12840×g条件下离心10min,弃上清液,sds-page检测菌体中目的蛋白表达量以及电泳纯度;采用管式离心机收集湿菌体,湿菌体经高压均质机破碎,洗涤后称重包涵体,发酵液中的氨基酸替换杂质含量使用hplc进行检测。
经检测,诱导结束后的发酵菌液od600达到53.4,质粒保有率为82.6%,菌体中目的蛋白表达量为4.75g/l,目的蛋白g-csf占菌体总蛋白22.3%,获得包涵体120.2g,发酵液中的氨基酸替换杂质含量为0.10%。
不同发酵条件下的g-csf蛋白表达量,见下表1:
表1:不同发酵条件下的g-csf的表达量
对比例1:无机培养基无氨基酸(5l)
1.种子的培养:在1l三角瓶中装有种子培养基200ml,121℃湿热灭菌30min,冷却到室温。取pet9a-gcsf/bl21(de3)菌种一支,接种于种子培养基中,接种量为0.03%、培养温度30℃、摇床转速为250rpm,振荡培养9h,测定od600为2.06,得到发酵种子培养液。其中种子培养基的成分及其含量为:选择性大豆蛋白胨10g/l,酵母粉5g/l,nacl5g/l,用纯化水配制而成,自然ph。显微镜镜检检查,种子培养液未见杂菌污染现象,为典型的大肠杆菌形态。
2.接种前准备:首先将发酵罐清洗干净,将发酵培养基溶于纯化水中,搅拌均匀,转移至发酵罐中,121℃蒸汽湿热灭菌30min,冷却至37℃备用。其中发酵培养基的组成为:葡萄糖10g/l,磷酸二氢钾7.5g/l,磷酸氢二钾15g/l,柠檬酸2g/l,硫酸铵2.5g/l,七水合硫酸镁2g/l,1ml微量元素溶液,余量为水。
将补料培养基溶于纯化水中,搅拌均匀,湿热灭菌30min,冷却后备用。补料培养基的组成为:50%葡萄糖溶液、30g/l硫酸铵溶液。其中葡萄糖溶液115℃灭菌30min;硫酸铵溶液121℃灭菌30min;
3.接种:将种子液和1ml微量元素溶液接种至装有发酵培养基的5l发酵罐中,装液量3l,培养温度37℃,初始搅拌转速为200rpm,氨水溶液控制初始ph在7.0。种子液接种到发酵培养基后,设定好初始工艺参数,稳定后校正溶氧为100%,。
4.发酵:发酵控制条件为:培养温度36-38℃,转速200-1000rpm,通气量20-100l/min,罐压0.03-0.1mpa,通过氨水溶液控制发酵体系ph在7.0±0.2,发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。待溶氧反弹后进行补料,补料速率初始设定值:葡萄糖补料速率为0.09ml/(l·min),硫酸铵补料速率为0.045ml/(l·min),补料开始后根据溶氧反馈调节方式调整补料速率;补料速率由初始设定值逐渐调整至诱导过程中,葡萄糖补料速率为0.2ml/(l·min),硫酸铵补料速率为0.1ml/(l·min),而后以此补料速率恒速补料。培养的菌株至od600为27.5时开始诱导,诱导方式为0.5mmol/liptg;葡萄糖补料速率设置为0.2ml/(l·min),硫酸铵补料速率为0.1ml/(l·min),诱导时间为4h。诱导结束后,取样发酵液一部分进行质粒保有率的测定,另一部分在离心力为12840×g条件下离心10min,弃上清液,sds-page检测菌体中目的蛋白表达量以及电泳纯度;采用管式离心机收集湿菌体,湿菌体经高压均质机破碎,洗涤后称重包涵体,发酵液中的氨基酸替换杂质含量使用hplc进行检测。
经检测,诱导结束后的发酵菌液od600达到43.3,质粒保有率为92.5%,菌体中目的蛋白表达量为1.86g/l,目的蛋白g-csf占菌体总蛋白17.5%,获得包涵体9.7g,发酵液中的氨基酸替换杂质含量为3.4%。
无机盐培养基中不添加氨基酸发酵结束后的质粒保有率、目的蛋白表达量以及氨基酸替换杂质含量结果见下表2所示:
表2:发酵培养基为无机盐培养基(无氨基酸添加)下的g-csf的表达量
对比例2:复合lb培养基(5l)
1.种子的培养:在1l三角瓶中装有种子培养基200ml,121℃湿热灭菌30min,冷却到室温。取pet9a-gcsf/bl21(de3)菌种一支,接种于种子培养基中,接种量为0.03%、培养温度30℃、摇床转速为250rpm,振荡培养10h,测定od600为2.30,得到发酵种子培养液。其中种子培养基的成分及其含量为:选择性大豆蛋白胨10g/l,酵母粉5g/l,nacl5g/l,用纯化水配制而成,自然ph。显微镜镜检检查,种子培养液未见杂菌污染现象,为典型的大肠杆菌形态。
2.接种前准备:首先将发酵罐清洗干净,将发酵培养基溶于纯化水中,搅拌均匀,转移至发酵罐中,121℃蒸汽湿热灭菌30min,冷却至37℃备用。其中发酵培养基的组成为:选择性大豆蛋白胨10g/l,酵母粉5g/l,nacl5g/l,na2hpo4·12h2o11g/l,kh2po42.7g/l,消泡剂0.5g/l,121℃灭菌30min。葡萄糖5g/l,mgso40.3g/l,115℃灭菌30min。
补料培养基的组成为:50%葡萄糖溶液、复合lb溶液。其中50%葡萄糖溶液115℃灭菌30min;复合lb溶液的组成为选择性大豆蛋白胨200g/l,酵母粉100g/l,消泡剂1g/l,121℃灭菌30min。
3.接种:将种子液和1ml微量元素溶液接种至装有发酵培养基的5l发酵罐中,装液量3l,培养温度37℃,初始搅拌转速为200rpm,氨水溶液控制初始ph在7.0。种子液接种到发酵培养基后,设定好初始工艺参数,稳定后校正溶氧为100%。
4.发酵:发酵控制条件为:培养温度36-38℃,转速200-1000rpm,通气量20-100l/min,罐压0.03-0.1mpa,通过氨水溶液控制发酵体系ph在7.0±0.2,发酵培养过程通过调节转速、通气量、罐压等参数将溶氧控制在20%以上。待溶氧反弹后进行补料,补料速率初始设定值:葡萄糖补料速率为0.04ml/(l·min),lb补料速率为0.08ml/(l·min),补料开始后根据溶氧反馈调节方式调整补料速率;补料速率由初始设定值逐渐调整至诱导过程中,葡萄糖补料速率为0.12ml/(l·min),lb补料速率为0.24ml/(l·min),而后以此补料速率恒速补料。培养的菌株至od600为26.3时开始诱导,诱导方式为0.5mmol/liptg;葡萄糖补料速率设置为0.12ml/(l·min),lb补料速率为0.24ml/(l·min),诱导时间为4h。诱导结束后,取样发酵液一部分进行质粒保有率的测定,另一部分在离心力为12840×g条件下离心10min,弃上清液,sds-page检测菌体中目的蛋白表达量以及电泳纯度;采用管式离心机收集湿菌体,湿菌体经高压均质机破碎,洗涤后称重包涵体,发酵液中的氨基酸替换杂质含量使用hplc进行检测。
经检测,诱导结束后的发酵菌液od600达到47.1,质粒保有率为15.2%,菌体中目的蛋白表达量为2.35g/l,目的蛋白g-csf占菌体总蛋白19.2%,获得包涵体11.2g,发酵液中的氨基酸替换杂质含量为3.1%。
利用复合lb发酵培养基发酵结束后的质粒保有率、目的蛋白表达量以及氨基酸替换杂质含量结果见下表3所示:
表3:发酵培养基为复合lb培养基下的g-csf的表达量
- 还没有人留言评论。精彩留言会获得点赞!