一种与百草枯特异性结合的核酸适配体PQ-15及其应用的制作方法
本发明涉及一种与百草枯特异性结合的核酸适配体pq-15及其在百草枯检测中的应用,属于生物与化学交叉领域。
背景技术:
核酸适配体是指通过指数富集的配基系统进化(systematicevolutionofligandsbyexponentialenrichment,selex)技术筛选获得具有10~100个碱基和特定复杂三维结构的单寡链核苷酸,且能与金属离子、农药、生物毒素,等有害靶标发生特异性结合的ssdna或rna分子。核酸适配体具有蛋白抗体的识别特性,靶分子范围广、分子质量小、免疫原性低、易于化学合成、改造和标记等优势。核酸适配体近年来在治疗新药、药物运输、癌细胞检测、生物成像、生物标志物的发现、毒品检测、抗病毒等生物医学领域中的应用。
百草枯(1,1-二甲基-4,4-二吡啶二氯)是一种具有双苯环结构极性很强的有机小分子,被认为是世界上毒性最强的除草剂之一,在水中溶解度极高。由于生产成本较低、除草效率高,因而被广泛应用于农业生产,尤其以往在一些发展中国家被广泛使用。百草枯在食品中最大残留量为0.05mg/kg,其毒性与二价阳离子还原及自由基有关,它们会引起细胞膜、蛋白质和dna的损伤,从而对环境和人类健康造成潜在的威胁。迄今为止,由于缺乏特定的解毒剂和有效的治疗方法,已有数万例因百草枯中毒死亡病例报告。中国自2014年7月1日起便撤销了百草枯水剂登记和生产许可,直至2016年7月1日全面停止水剂销售和使用,但仍有一些固体药物生产,导致固体药物被非法使用。所以研究关于百草枯的检测与治疗,对保护人民的生命安全和社会环境安定具有极大意义与价值。
目前针对百草枯主要检测方法有免疫分析法、高效液相色谱法、色谱质谱联用法、高效毛细管电泳法等,这些检测方法需要特定的仪器设备、专业操作人员和一定的操作技能,无法广泛应用。因此为保证广大人民群众的身体健康,建立一种准确可靠、灵敏快速、广泛适用的检测百草枯的方法显得尤为重要。
技术实现要素:
本发明的目的在于,提供一种与百草枯特异性结合的核酸适配体pq-15及其在百草枯检测中的应用,可将本发明所述核酸适配体pq-15可作为百草枯的识别分子,以阳离子化合物聚集的纳米金作为传感信号,首次建立了基于核酸适配体识别的百草枯农药比色检测新方法,其最低检测限为25.2nmol/l,其它竞争性靶标对百草枯检测无明显干扰,实际样品中百草枯的加标回收率为91.13%~99.60%。此检测方法的优势在于构建方便、快速可肉眼辨别、灵敏度高所需时间短、低成本且易操作。可广泛应用于实际样品中百草枯残留的快速检测。
本发明的技术方案:一种与百草枯发生特异性结合的核酸适配体pq-15,所述适配体pq-15的核苷酸序列为:
5′-accgaccgtgctggactctcgcgcagcgccgagtccgaactgggtggggagtatgagcgagcgttgcg-3′(68bp)。
前述的能与百草枯发生特异性结合的核酸适配体pq-15中,所述pq-15的二级结构具有环和茎,吉布斯自由能为dg=-28.44。
前述的特异性识别百草枯农药的核酸适配体pq-15中,所述pq-15对百草枯的解离常数kd为54±4nmol/l。
一种前述的与百草枯发生特异性结合的核酸适配体pq-15的应用,制备成水样中百草枯的检测试剂或试剂盒类快检产品,并应用于环境、食品和农业等领域中百草枯的分析检测。
为获得本发明技术方案,申请人进行了大量实验研究,部分实验如下:
1.百草枯核酸适配体筛选
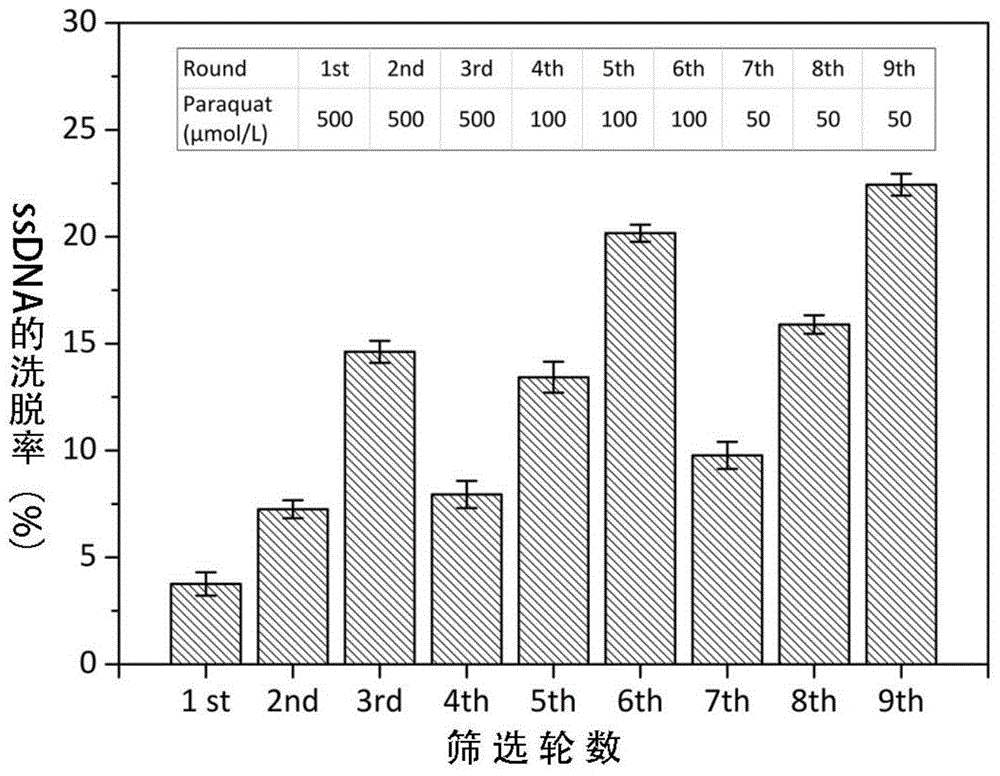
首先将ssdna随机文库与生物素修饰的p3序列通过碱基互补配对按照摩尔比1:2混匀,经退火处理后与链霉素亲和素修饰的纳米磁珠结合,再加入百草枯靶标洗脱具有亲和力的ssdna序列。实验根据洗涤下来的ssdna量/固定在磁珠上的ssdna量,计算每轮筛选的洗脱率。由于百草枯与核酸分子在260nm处的吸收峰较为接近,所以在计算洗脱率时排除百草枯自身的干扰。如图1所示,在相同百草枯浓度下,洗脱率随筛选轮数的增加越来越大,随后逐渐减小靶标浓度,百草枯洗脱下来的亲和序列亲和性越来越强。最后对9轮筛选得到的非对称pcr扩增液进行电泳与凝胶染色处理,其结果如图2所示。
2.百草枯核酸适配体序列分析
将第9轮筛选后的百草枯亲和序列进行pcr扩增后,委托上海生工生物有限公司进行克隆,然后挑选克隆子进行测序,最终获得15条与文库碱基数一致的亲和序列,并分析了它们随机区域的碱基组成与分布,所有结果归纳在图3中。通过mega软件进行发育树分析(图4),进一步分析随机序列组成与百草枯结合的关系,用mfold软件对核酸适配体pq-15进行二级结构预测如图5所示。根据预测的结果看出,pq-15二级结构主要以茎环为主。
3.核酸适配体的解离常数(kd)测定
对pq-15适配体序列进行fam标记,然后固定在亲和素磁珠上,用靶标按照筛选步骤进行洗脱,测定被洗脱的核酸适配体荧光强度,最后通过origin进行拟合测定其解离常数,结果如图6所示。亲和序列pq-15对百草枯的解离常数(kd)为54±4nmol/l。
4.aunps聚集比色检测百草枯原理及条件确定
实验利用pq-15序列作为百草枯的识别分子,选择阳离子聚合物聚二烯二甲基氯化铵(pdda)调控的aunps聚集作为信号输出,首次建立了基于核酸适配体的百草枯检测新方法。pdda水溶液具有高密度正电荷,可以打破纳米金(aunps)溶液之间电荷平衡使其聚集,颜色由红色变成蓝色。由于适配体磷酸骨架基团带有负电荷,pdda可以与pq-15适配体通过静电吸附形成“duplex”结构,此时pdda被消耗从而不会使后续加入的aunps聚集,因而整个体系展现出红色并在520nm处有最大吸收峰(图7)。当体系中存在百草枯时,则其先与pq-15适配体发生亲和作用形成复合物,后续再加入pdda后会导致aunps聚集,此时整个体系展现出蓝色并在650nm处有最大吸收峰,且这种变化趋势与体系中加入的百草枯浓度(500nmol/l和1000nmol/l)呈现正向相关(图7),表明该方法可用于百草枯的比色检测。由于纳米金的聚集程度与pq-15适配体和pdda的浓度相关,所以实验在前期预实验基础上,选取1~20nmol/l的pq-15和5~25nmol/l的pdda进行优化,以a650/520表示纳米金聚集程度与空白组纳米金a650/520的差值△(650/520)作为检测信号。如图8所示,pdda浓度为20nmol/l达到最佳饱和状态,少量的pdda不会使纳米金完全聚集,而太多的pdda会带来更高的背景信号从而降低传感体系的灵敏度。在最佳pdda浓度下,加入不同浓度的pq-15核酸适配体,其浓度为5nmol/l时检测信号达到最大值,适配体的使用量过高或过低都会影响pdda对纳米金的聚集(图9)。
5.aunps聚集比色检测百草枯性能分析
试验按照先前优化的方法在体系中加入浓度为50~2000nmol/l的百草枯,空白组则用双蒸水代替。通过酶标仪测定实验组与空白组a650/520的吸光差值△(650/520)作为检测信号。如图10所示,曲线整体呈s型分布。百草枯浓度在50~500nmol/l时,随着其浓度增大基本呈线性关系,将△(650/520)与百草枯浓度经线性拟合得到回归方程△(650/520)=0.843×10-4x+0.108(r=0.994)。通过
与现有技术相比,本发明具有以下有益效果:
1、本发明采用体外合成一条生物素修饰的碱基序列,通过氢键与随机文库3′-末端进行互补配对,将其固定在链霉亲和素修饰的纳米磁珠上。随后加入不同浓度的百草枯靶标进行孵育,通过洗脱得到百草枯的亲和性ssdna,对其进行非对称pcr扩增后得到下一轮筛选所需的富集ssdna库。经过9轮筛选后将所得亲和性ssdna进行克隆测序,最后得到15条百草枯的亲和ssdna序列。对亲和性序列进行聚类分析和二级结构预测,再根据同源性等条件从中挑选出6条ssdna序列进行亲和力测定,结果表明pq-15序列对百草枯的亲和力最高,其对靶标的解离常数(kd)为54±4nmol/l。
2、本发明将所述与百草枯特异性结合的核酸适配体pq-15作为百草枯的识别分子,以阳离子化合物聚集的纳米金作为传感信号,首次建立了基于核酸适配体识别的百草枯农药比色检测新方法,其最低检测限为25.2nmol/l,其它竞争性靶标对百草枯检测无明显干扰,实际样品中百草枯的加标回收率为91.13%~99.60%。此检测方法的优势在于构建方便、快速可肉眼辨别、灵敏度高所需时间短、低成本且易操作。可广泛应用于实际样品中百草枯残留的快速检测。
综上所述,本发明利用selex技术筛选出的核酸适配体pq-15能够高亲和力高特异性的识别并结合百草枯;核酸适配体pq-15的鉴别对于环境、食品和农业中残留的百草枯的检测,进而降低百草枯对人体的伤害具有重要意义。
附图说明
附图1为每轮筛选的洗脱率;
附图2为每轮筛选pcr产物电泳图;
附图3为mega软件分析的百草枯核酸适配体发育树;
附图4为筛选得到的适配体序列;
附图5为mfold软件预测pq-15亲和序列的二级结构;
附图6为百草枯亲和序列pq-15的解离常数(kd);
附图7为不同样品下的吸收光谱图;a.aunps.b.pdda+aunps.c.pq-15+pdda+aunps.d.pq-15+paraquat(500nmol/l)+pdda+aunps,e.pq-15+paraquat(1000nmol/l)+pdda+aunps.f.pq-15+ddh2o+pdda+aunps;
附图8为pdda浓度对百草枯检测的影响;
附图9为pq-15核酸适配体浓度对百草枯检测的影响;
附图10百草枯加入量为50-2000nmol/l时的检测信号拟合曲线;
附图11为加入500nmol/l不同种类农药后检测信号变化;
附图12为实际样品中的百草枯检测。
具体实施方式
下面结合附图和实施例来进一步说明本发明的实质性内容,实施例仅为了更好理解本发明但不局限与本发明范围,实施例中方法如无特殊说明均为常规方法,使用的试剂如无特殊说明均为常规市售试剂或按常规方法配制的试剂。
实施例1:
1.核酸适配体的体外筛选步骤
(1)随机ssdna文库的固定。取一定量的随机ssdna文库(5′-accgaccgtgctggactct-n30-agtatgagcgagcgttgcg-3′),按1:2的摩尔比与p3(5′-biotin-cgcaacgctcgc-3′)序列混合,95℃进行退火处理5min后30℃孵育60min,使随机文库的3'端12个碱基序列与p3通过氢键互补配对。将配对后的混合液移入装有磁珠的离心管中30℃孵育60min,由于磁珠表面接有链霉亲和素,所以通过生物素-亲和素作用,将随机文库固定在磁珠上。最后用bindingbuffer(bb缓冲液,100mmol/lnacl;20mmol/ltris·hcl;5mmol/lkcl;2mmol/lmgcl2·6(h2o);1mmol/lcacl2;0.02%tween-20,ph=7.4)洗涤除去未固定的随机文库和p3。
(2)ssdna序列的洗脱。在第1轮筛选时,取终浓度为500μmol/l的百草枯溶液加入到磁珠固定的随机文库中,先轻微震荡5min混匀30℃孵育60min,后置于4℃冰箱中过夜孵育洗脱。然后将上述磁珠用吸铁石充分分离,收集百草枯洗脱的ssdna上清液,用酶标仪测定吸光度,计算洗脱率。在后续的selex筛选过程中,200μl总体系中的百草枯终浓度由500μmol/l逐渐减少至50μmol/l,其它操作与第1轮的操作相同。
(3)非对称pcr扩增。利用课题组先前优化后的非对称pcr程序,扩增百草枯洗脱的亲和性序列。反应溶液体系配制如下:pcr扩增反应液500μl包含:200μl模板链(即百草枯亲和性ssdna序列),37.5μl浓度为10μmol/l的p1(5′-accgaccgtgctggactct-3′)引物,7.5μl浓度1μmol/l的p2(5′-cgcaacgctcgctcatact-3′)引物,250μl2xpcrmaster,将上述反应液用无菌ddh2o补加至500μl,混合均匀后等量分装到10个pcr管中,最后置于pcr仪上进行扩增。非对称pcr扩增条件为94℃,3min(变性);20个快速三阶段pcr循环(94℃,45s;51℃,30s;72℃,20s);最后在72℃延伸反应5min。
(4)凝胶电泳分离和ssdna纯化回收。经非对称pcr扩增后,取每轮的扩增产物9μl,各加入1μl溴酚蓝上样缓冲液混匀,1×tbe作为电泳缓冲液,16%的非变性page凝胶进行电泳分离,电压控制在100~120v。电泳结束后page胶用银染色法确定目标条带的位置。
2.百草枯核酸适配体克隆测序及二级结构预测
经过9轮的selex筛选,对最后收集到的百草枯亲和性序列进行pcr扩增,并将扩增反应液送到上海生工生物股份有限公司进行纯化和克隆测序。结构表明,与百草枯特异性结合的核酸适配体其序列自5′端至3′端为:5′-accgaccgtgctggactctcgcgcagcgccgagtccgaactgggtggggagtatgagcgagcgttgcg-3′(68bp)与百草枯特异性结合的核酸适配体pq-15的序列长度:68个碱基,序列种类:ssdna。所有测序的序列用mega软件制作发育树,二级结构通过(http://mfold.rna.albany.edu/)网站进行预测,设置温度为30℃、na+浓度为100mmol/l,mg2+浓度为2mmol/l。结果表明,pq-15适配体含有环和茎结构,吉布斯自由能dg=-28.44;结构具有较高的稳定性(见图5)
3.核酸适配体解离常数(kd)的测定
对百草枯亲和序列pq-15进行fam荧光标记。然后分别配置10μmol/l的适配体亲和序列与20μmol/l生物素标记的p3序列,按照摩尔比1:2混匀变性后60℃孵育60min。用250μlbb缓冲液洗涤磁珠三次后用200μl的bb缓冲液重溶磁珠备用。取重溶的磁珠分别与p3和适配体亲和序列杂交溶液进行混合孵育120min。最后用bb缓冲液洗涤除去未固定的亲和序列和p3,总体积控制在1500μl。测定收集洗脱液的荧光强度,计算亲和序列的固定量。最后将上述固定有亲和序列的磁珠分散到一定体积的bb溶液中,取终浓度为100μmol/l靶标溶液与固定了百草枯亲和序列的磁珠60℃孵育120min,冰箱4℃过夜孵育洗脱。最后取200μl上清液放入黑色酶标板中测定洗脱液的荧光强度。通过origin8.0软件进行曲线拟合,拟合公式为y=bmaxx/(kd+x),y:核酸与靶标的复合物浓度;x:核酸浓度;bmax:常数;kd:亲和系数。
4.aunps比色检测百草枯
(1)纳米金的制备。利用“柠檬酸三钠还原氯金酸法”制备纳米金。称取33.98mg的haucl4·xh2o和114.11mg的二水柠檬酸三钠,分别溶解在100ml双蒸水和10ml双蒸水中。先在磁力搅拌器上加热氯金酸溶液至沸腾,在剧烈搅拌过程中迅速加入10ml的柠檬酸三钠溶液,保持加热15min,溶液会由淡灰色变成蓝色再渐变为紫色,最后直至变为稳定的酒红色后停止加热。然后持续搅拌15min,冷却至室温。将上述溶液用250nm孔径的超滤膜进行过滤,将滤液装于棕色瓶中4℃储存备用。
(2)aunps比色检测百草枯。实验选取亲和性最高的序列作为百草枯的识别分子,以阳离子化合物聚集纳米金作为传感信号比色检测百草枯。在整个传感体系中,pdda和适配体浓度对纳米金聚集具有调控作用,因此需对体系中的pdda和适配体用量进行优化。由于纳米金分散时在520nm具有最大吸收峰,聚集时在650nm时具有最大吸收峰,因此取200μl反应液放入96孔板中用酶标仪测定a520nm以及a650nm的吸光值,以a650/520表示纳米金聚集程度,靶标与空白组a650/520的差值△(650/520)作为检测信号。
(3)百草枯核酸适配体的性能分析。将亲和性最强的序列与不同浓度的百草枯孵育,按照先前优化的检测方法进行灵敏度测定。随后选取甲拌磷、啶虫脒、敌敌畏、辛硫磷、丙溴磷、甲基对硫磷作为竞争性靶标,验证该方法对百草枯检测的特异性,对比各自颜色变化情况,记录各类靶标与空白平行组溶液的吸光差值△650/520。最后采集了贵州大学阅湖水(北纬26°26′47″东经106°39′24″)作为样品一,稻田水(北纬26°26′55″东经106°41′16″)为样品二,果蔬地土壤(北纬26°26′49″东经106°39′45″)为样品三,经过滤分离处理后,在上述实际样品中分别加入500nmol/l和1000nmol/l百草枯标准液,利用本方法测其回收率。
序列表
<110>贵州大学
<120>一种与百草枯特异性结合的核酸适配体pq-15及其应用
<130>0
<141>2019-01-23
<160>1
<170>siposequencelisting1.0
<210>1
<211>68
<212>dna
<213>(人工序列)
<400>1
accgaccgtgctggactctcgcgcagcgccgagtccgaactgggtggggagtatgagcga60
gcgttgcg68
- 还没有人留言评论。精彩留言会获得点赞!