嘧啶酮衍生物及其在制药中的应用的制作方法
本发明属于化学医药领域,具体涉及一种嘧啶酮衍生物及作为pcaf溴结构域抑制剂的用途。
背景技术:
溴结构域的生物学功能被广泛研究,它主要参与转录过程的调节,并已被确认能在导致高致癌融合蛋白中产生致癌重排,它的这些作用在一些恶性肿瘤的发生、发展中起了关键性的作用。溴结构域蛋白还能调节核因子-κb(nf-κb),该因子是调节炎症反应的关键。除此之外,它们还参与病毒基因组的复制并调节某些病毒基因组蛋白的转录。综上所述,作用于这些蛋白是治疗癌症、炎症以及病毒感染非常有效的手段。而要作用于溴结构域蛋白,就需要找到那些可以作为药物靶标的溴结构域。
p300/cbp相关因子(pcaf/kat2b)是含有溴结构域(brd)的组蛋白乙酰转移酶(hat),就序列同源性而言,其溴结构域属于brd第i亚家族。pcaf的hat结构域属于gcn5相关n-乙酰转移酶(gnat)亚家族,这类hat蛋白大部分含有brd。除此之外催化结构域,蛋白序列的n端结构域也作为整体的一部分。pcaf及其同源物gcn5都能识别h3kac14,并且都能乙酰化h4的k4和k8。另外,pcafbrd识别h4kac8/h4kac20和h3kac14/h3kac9。尽管结构相似,乙酰化赖氨酸(kac)结合偏好也十分类似,通过敲除研究表明pcaf和gcn5在全局组蛋白乙酰化和基因表达中仍然具有不同的功能。研究发现,pcaf的功能失调与癌症、hiv感染和神经炎症相关。
尽管如此,目前对pcaf与各种疾病的联系还是知之甚少,因此,开发靶向pcaf的小分子抑制剂,比如pcaf溴结构域的抑制剂,对研究pcaf的生物学功能十分必要,同时也为后续靶向pcaf治疗疾病提供了潜在的先导化合物。
技术实现要素:
本发明的目的在于提供一种式(ⅰ)所示的新化合物或其药学上可接受的盐、晶型或溶剂合物在制备pcaf溴结构域抑制剂中的应用。
本发明提供了式(a)所示的化合物或其药学上可接受的盐、晶型、溶剂合物:
其中:
w选自n、c;y选自n、s、o、c;
r1、r2、r3、r4各自独立地选自氢、取代或未取代的c2-c6烯基、取代或未取代的c1-c6烷基、取代或未取代的c2-c6炔基、取代或未取代的6-8元饱和杂环、取代或未取代的6-8元饱和碳环、取代或未取代的6-8元不饱和杂环、取代或未取代的6-8元不饱和碳环、取代或未取代的桥环;
其中,所述烯基、烷基、炔基上的取代基各自独立地选自:卤素、硝基、羟基、氨基、羧基、c2-c4烯基、c1-c4烷基、c2-c4炔基、碳环基、杂环基;
所述杂环、碳环、桥环上的取代基各自独立地选自:取代或未取代的c1-c4烷基、取代或未取代的c2-c4烯基、取代或未取代的
进一步地,
所述化合物的结构如式(i)所示:
其中:
a环选自取代或未取代的5-6元杂环或5-6元碳环,所述取代基选自卤素、硝基、羟基、羧基、c2-c4烯基、c1-c4烷基、c2-c4炔基、碳环基、杂环基;
r1选自氢、取代或未取代的c2-c6烯基、c1-c6烷基、c2-c6炔基;所述取代基选自卤素、硝基、羟基、羧基、c2-c4烯基、c1-c4烷基、c2-c4炔基、碳环基、杂环基;
r2选自取代或未取代的6-8元饱和杂环、6-8元饱和碳环、6-8元不饱和杂环、6-8元不饱和碳环或桥环;
其中,所述杂环、碳环上的取代基选自:取代或未取代的c1-c4烷基、取代或未取代的c2-c4烯基、取代或未取代的
所述桥环上的取代基选自:-co2r3、c1-c4烷基、
进一步地,
所述化合物的结构如式(ii)所示:
其中,x选自n或s;
ra选自卤素、硝基、羟基、羧基、c2-c4烯基、c1-c4烷基、c2-c4炔基、碳环基或杂环基;
r1选自氢、取代或未取代的c2-c6烯基、c1-c6烷基、c2-c6炔基;所述取代基选自卤素、硝基、羟基、羧基、c2-c4烯基、c1-c4烷基、c2-c4炔基、碳环基、杂环基;
r2选自取代或未取代的6-8元饱和杂环、6-8元饱和碳环、6-8元不饱和杂环、6-8元不饱和碳环或桥环;
其中,所述杂环、碳环上的取代基选自:取代或未取代的c1-c4烷基、取代或未取代的c2-c4烯基、取代或未取代的
所述桥环上的取代基选自:-co2r3、c1-c4烷基、
进一步地,
x选自n或s;ra选自氢或甲基。
进一步地,
r1选自取代或未取代的c2-c4烯基、c1-c4烷基、c2-c4炔基;所述取代基选自卤素、硝基、羟基、羧基、c2-c4烯基、c1-c4烷基、c2-c4炔基;
进一步地,
r1选自c3-c4烯基、c1-c2烷基。
进一步地,
r2选自取代或未取代的6-8元饱和杂环、6-8元饱和碳环、氮杂桥环;
其中,所述杂环、碳环上的取代基选自:取代或未取代的c1-c4烷基、取代或未取代的c2-c4烯基、取代或未取代的
或,所述桥环上的取代基选自:-co2r3、c1-c3烷基、
进一步地,
r2选自取代或未取代的的6-7元饱和杂环、7-8元饱和碳环、氮杂桥环;
其中,所述杂环、碳环上的取代基选自:取代或未取代的c1-c2烷基、c3烯基、取代或未取代的
或,所述氮杂桥环上的取代基选自:-co2r3、甲基、
进一步地,所述化合物的结构如式(iii)所示:
其中,rb、rc各自独立地选自氢、
或者,rb与rc连接成苯环或
进一步地,所述的化合物为:
进一步地,所述的化合物为:
本发明还提供了上述的化合物或其药学上可接受的盐、晶型、溶剂合物作为溴结构域抑制剂的用途。
进一步地,所述溴结构域为pcaf。
本发明还提供了一种治疗pcaf或gcn5介导的病症的药物,其特征在于:所述药物是由上述的化合物或其药学上可接受的盐、晶型、溶剂合物,加上药学上可接受的辅料制备而成。
通过试验证明,本发明制备的嘧啶酮衍生物对pcaf溴域具有较高的活性,特别是化合物2,18,20-29,其与pcaf溴结构域的kd值都在0.1μm左右。本发明制备的化合物与pcaf溴结构域的亲和力较高,其能够很强地结合pcaf溴结构域,并作为pcaf溴结构域抑制剂,抑制pcaf溴结构域与乙酰化赖氨酸相互作用。可以进一步作为潜在的治疗pcaf相关疾病或症状的药物,如癌症、hiv感染和神经炎症。
关于本发明的使用术语的定义:除非另有说明,本文中基团或者术语提供的初始定义适用于整篇说明书的该基团或者术语;对于本文没有具体定义的术语,应该根据公开内容和上下文,给出本领域技术人员能够给予它们的含义。
“取代”是指分子中的氢原子被其它不同的原子或分子所替换。
碳氢基团中碳原子含量的最小值和最大值通过前缀表示,例如,前缀ca~cb烷基表明任何含“a”至“b”个碳原子的烷基。因此,例如,c1~c4烷基是指包含1~4个碳原子的烷基。
术语“药学上可接受的”是指某载体、运载物、稀释剂、辅料,和/或所形成的盐通常在化学上或物理上与构成某药物剂型的其它成分相兼容,并在生理上与受体相兼容。
术语“盐”和“可药用的盐”是指上述化合物或其立体异构体,与无机和/或有机酸和碱形成的酸式和/或碱式盐,也包括两性离子盐(内盐),还包括季铵盐,例如烷基铵盐。这些盐可以是在化合物的最后分离和纯化中直接得到。也可以是通过将上述化合物,或其立体异构体,与一定数量的酸或碱适当(例如等当量)进行混合而得到。这些盐可能在溶液中形成沉淀而以过滤方法收集,或在溶剂蒸发后回收而得到,或在水介质中反应后冷冻干燥制得。本发明中所述盐可以是化合物的盐酸盐、硫酸盐、枸橼酸盐、苯磺酸盐、氢溴酸盐、氢氟酸盐、磷酸盐、乙酸盐、丙酸盐、丁二酸盐、草酸盐、苹果酸盐、琥珀酸盐、富马酸盐、马来酸盐、酒石酸盐或三氟乙酸盐。
本发明所述药学上可接受的辅料,是指除活性成分以外包含在剂型中的物质。它具有一定生理活性,但该成分的加入不会改变上述药物组合物在疾病治疗过程中的主导地位,而仅仅发挥辅助功效,这些辅助功效仅仅是对该成分已知活性的利用,是医药领域惯用的辅助治疗方式。若将上述辅助性成分与本发明药物组合物配合使用,仍然属于本发明保护的范围。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
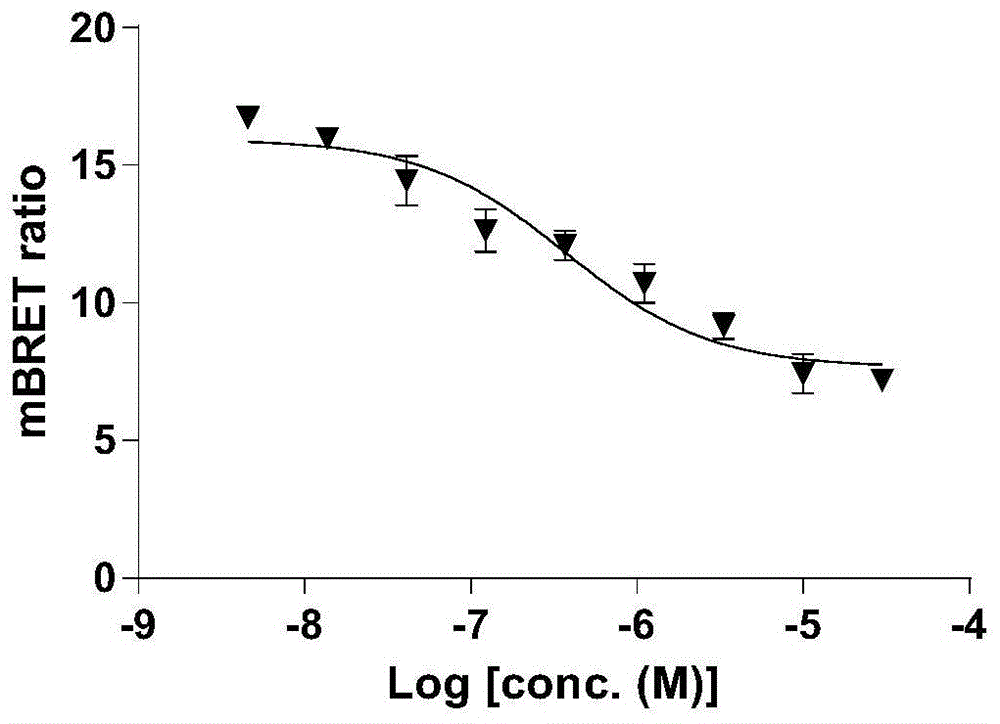
图1为在hek293t细胞中本发明制备的化合物18的浓度与mbret比率的关系图。
具体实施方式
材料:实施例中所使用的合成原料均购买自聚成都慧化工、吉安特、上海药明览博等公司。纯化用过柱机为biotageisoleraone低压液相快速纯化系统,高效液相色谱实验在waters2695hplc系统上进行操作,1hnmr和13cnmr谱由brukerav-400核磁仪器测量记录,高分辨质谱由agilent1200-g6410a质谱仪测量记录。
实施例1、本发明化合物1的合成
(1)2-氯-3-甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮的合成
步骤i.将2,4-二氯-5h-吡咯并[3,2-d]嘧啶(13.25g,133mmol)加入到200ml1mnaoh溶液中并在100℃下搅拌16小时。冷却至室温后,用3nhcl将深棕色溶液酸化至ph5。通过过滤收集沉淀物到烧结玻璃漏斗上,用水(2×50ml)洗涤,真空干燥,得到2-氯-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮(20.3g,120mmol,90%),为棕色固体。
1hnmr(400mhz,dmso-d6)δ12.81(s,1h),12.25(s,1h),7.41(t,j=3.0hz,1h),6.35(dd,j=2.8,2.0hz,1h).
步骤ii.将化合物2-氯-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮(20.3g,120mmol),boc酸酐(28.7g,132mmol),三乙胺(13.3g,132mmol)和dmap(500mg,2.25mmol)悬浮在150mldmf中。将混合物在室温下搅拌过夜。然后加入450ml水,用柠檬酸将所得溶液酸化至ph=6。通过过滤收集沉淀,用水(2×50ml)洗涤,真空干燥,得到2-氯-4-氧代-3h,4h,5h-吡咯并[3,2-d]嘧啶-5-羧酸酯(26.6g,98.6mmol,82.4%),为棕色固体。
1hnmr(400mhz,dmso-d6)δ13.07(s,1h),7.85(d,j=3.5hz,1h),6.55(d,j=3.5hz,1h),1.58(s,9h)。
步骤iii.在0℃下,将nah(60%,1.9g,47.5mmol)分批加入到搅拌的2-氯-4-氧代-3h,4h,5h-吡咯并[3,2-d]嘧啶-5-羧酸酯(8.7g,32.3mmol)的无水dmf(100ml)溶液中。20分钟后,加入碘甲烷(6.67g,47mmol),在40℃反应过夜。冷却至室温后,将混合物小心地用水稀释并用乙酸乙酯萃取。向合并的有机相中加入三氟乙酸并再搅拌5小时,然后减压除去溶剂。通过柱色谱纯化残余物,得到2-氯-3-甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮(2.7g,14.7mmol),为白色固体。
1hnmr(400mhz,dmso-d6)δ12.28(s,1h),7.43(t,j=2.9hz,1h),6.35(t,j=2.2hz,1h),3.62(s,3h).13cnmr(101mhz,dmso-d6)δ154.30,142.50,141.19,129.18,116.20,102.98,32.96.
(2)本发明化合物1的合成
将(r)-1-甲基哌啶-3-胺二盐酸盐(500mg,2.67mmol),2-氯-3-甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮(300mg,1.63mmol)和n,n-二异丙基乙胺(1.2mg,9.36mmol)溶于nmp。然后将反应加热至150℃并在该温度下搅拌2小时。冷却至室后,将混合物用乙酸乙酯和水稀释。将双相溶液用乙酸乙酯萃取两次。将合并的有机物用盐水洗涤,用无水mgso4干燥,并真空浓缩。通过柱色谱纯化残余物,得到目标化合物1。
化合物1:(r)-3-甲基-2-((1-甲基哌啶-3-基)氨基)-3,5-二氢-4h-吡咯并[3,2-d]嘧啶-4-酮(23mg,0.088mmol,5.4%),为白色固体。
实施例2、本发明化合物2的合成
(1)(3r,5r)-1-甲基-5-苯基哌啶-3-胺二盐酸盐的合成
步骤i.将(r)-1-甲基哌啶-3-胺二盐酸盐(500mg,2.67mmol),2-氯-3-甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮(300mg,1.63mmol)和n,n-二异丙基乙胺(1.2mg,9.36mmol)溶于nmp。然后将反应加热至150℃并在该温度下搅拌2小时。冷却至室后,将混合物用乙酸乙酯和水稀释。将双相溶液用乙酸乙酯萃取两次。将合并的有机物用盐水洗涤,用无水mgso4干燥,并真空浓缩。通过柱色谱纯化残余物,得到目标化合物(r)-3-甲基-2-((1-甲基哌啶-3-基)氨基)-3,5-二氢-4h-吡咯并[3,2-d]嘧啶-4-酮(23mg,0.088mmol,5.4%),为白色固体。
步骤ii.向吡啶-2-甲酸(11.1g,130mmol)的二氯甲烷(250ml)溶液中加入(3r)-3-[(吡啶-2-基)酰氨基]哌啶-1-羧酸叔丁酯(25.0g,125),hatu(50.0g,131.5mmol)和n,n-二异丙基乙胺(15.0g,155mmol)。将混合物在室下搅拌过夜,并在减压下浓缩。将残余物溶于乙酸乙酯(200ml)中并用0.05mhcl(2×100ml)和饱和nahco3水溶液洗涤(2×100ml)。将有机层真空浓缩,并通过柱色谱纯化,得到化合物(3r)-3-(吡啶-2-酰氨基)哌啶-1-羧酸叔丁酯(32.1g,107mmol,84.3%),为白色固体。1hnmr(400mhz,dmso-d6)δ8.64(dt,j=4.7,1.3hz,1h),8.55(d,j=8.2hz,1h),8.10–7.97(m,2h),7.61(ddd,j=7.4,4.8,1.5hz,1h),3.96–3.43(m,3h),3.26–2.77(m,2h),1.93–1.79(m,1h),1.79–1.58(m,2h),1.57–1.20(m,10h).手性hplc(chiralpakie-h柱子,4.6mm×25cm,20%异丙醇/正己烷,1ml/min):rt=25.86min,>99%ee.
步骤iii.向装有磁力搅拌子的压力瓶(250ml)中加入化合物(3r)-3-(吡啶-2-酰氨基)哌啶-1-羧酸叔丁酯(7.2g,23.6mmol),碘苯(24.1g,117.89mmol),碳酸银(6.5g,23.6mmol),醋酸钯(529mg,2.36mmol),2,6-二甲基苯甲酸(885mg,5.9mmol)和60ml叔丁醇。将容器用氩气充满,用卷边盖密封,并加热至120℃。24小时后,将反应容器从油浴中取出,冷却至室温,并将二氯甲烷(60ml)加入到反应混合物中。将混合物充分搅拌10分钟,过滤除去固体。减压浓缩滤液,通过柱色谱纯化,得到目标化合物(3r,5r)-3-苯基-5-(吡啶-2-酰氨基)哌啶-1-羧酸叔丁酯(6.91g,18.1mmol,76.8%),为白色固体。1hnmr(400mhz,dmso-d6)δ8.74–8.62(m,2h),8.10–7.96(m,2h),7.61(ddd,j=7.4,4.7,1.4hz,1h),7.38–7.20(m,5h),4.17–3.91(m,3h),2.91–2.63(m,3h),2.08–1.92(m,2h),1.43(s,9h).手性hplc(chiralpakie-hcolumn,4.6mm×25cm,20%乙醇/正己烷,1ml/min):rt=31.52min,>99%ee.
(2)本发明化合物2的合成
将(3r,5r)-1-甲基-5-苯基哌啶-3-胺二盐酸盐(344mg,1.31mmol),2-氯-3-甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮(200mg,1.09mmol)和n,n-二异丙基乙胺(183mg,1.42mmol)溶于nmp。然后将反应加热至150℃并在该温度下搅拌2小时。冷却至室后,将混合物用乙酸乙酯和水稀释。将双相溶液用乙酸乙酯萃取两次。将合并的有机物用盐水洗涤,用无水mgso4干燥,并真空浓缩。通过柱色谱纯化残余物,得到目标化合物2。
化合物2:3-甲基-2-{[(3r,5r)-1-甲基-5-苯基哌啶-3-基]氨基}-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮(53mg,0.157mmol,14.4%),为白色固体。
1hnmr(400mhz,dmso-d6)δ11.37(s,1h),7.36–7.13(m,5h),7.11(t,j=2.9hz,1h),6.01(t,j=2.5hz,1h),5.97(d,j=7.7hz,1h),4.22–4.10(m,1h),3.31(s,3h),3.07(dd,j=10.4,4.1hz,1h),2.92–2.78(m,2h),2.20(s,3h),2.04(dd,j=12.0,4.2hz,1h),1.91–1.75(m,2h),1.57(q,j=12.1hz,1h).13cnmr(101mhz,dmso-d6)δ154.48,149.57,144.80,143.97,128.88,127.80,127.47,126.86,112.40,101.18,62.49,60.33,48.62,46.14,41.62,37.11,27.72.hrmsm/z338.1985(m+h+,c21h25n5o3,requires337.1903).手性hplc(chiralpakie-hcolumn,4.6mm×25cm,25%异丙醇/正己烷,1ml/min):rt=16.53min,>99%ee.
实施例3-7、本发明化合物3-7的合成
按照实施例2类似的方法制备了实施例3-7,表征数据如下:
实施例8、本发明化合物8的合成
在室温下向搅拌的化合物7的二氯甲烷溶液中加入三氟乙酸。反应完成后,减压除去溶剂,将残余物碱化并纯化,得到化合物8,为白色固体。
1hnmr(400mhz,dmso-d6)δ11.41(s,1h),7.15(d,j=2.8hz,1h),6.02(d,j=2.8hz,1h),5.84(d,j=8.2hz,1h),4.28–4.12(m,1h),3.37(s,3h),3.29–3.23(m,2h),2.19(td,j=11.7,5.9hz,2h),2.10–1.97(m,1h),1.56(tt,j=12.8,4.2hz,2h),1.50–1.41(m,1h),1.39–1.25(m,4h).13cnmr(101mhz,dmso-d6)δ154.51,149.66,145.00,127.69,112.30,101.02,45.23,43.68,32.69,32.23,27.70,14.54.hrmsm/z288.1827(m+h+,c21h25n5o3,requires287.1746).
实施例9、本发明化合物9的合成
以实施例8类似的制备方法制得化合物9。
1hnmr(400mhz,dmso-d6)δ11.40(s,1h),7.14(d,j=2.8hz,1h),6.00(d,j=2.8hz,1h),5.81(d,j=7.7hz,1h),4.82(tq,j=12.2,6.4hz,1h),3.35(s,3h),3.18–3.13(m,2h),2.05–1.86(m,3h),1.85–1.60(m,7h).13cnmr(101mhz,dmso-d6)δ154.52,149.66,144.96,127.67,112.31,101.24,47.31,45.40,38.01,30.43,27.67,21.03.hrmsm/z288.1819(m+h+,c21h25n5o3,requires287.1746).
实施例10、本发明化合物10的合成
向搅拌的化合物8(100mg,0.35mmol)和三乙胺(61mg,0.6mmol)的乙腈溶液中加入(r)-2-苯基环氧乙烷(60mg,0.5mmol)。将混合物在70℃下反应过夜。冷却至室温后,将混合物减压浓缩,残余物通过柱色谱纯化,得到化合物10。
化合物10:3-甲基-2-{[(1r,3r,5s)-9-[(2r)-2-羟基-2-苯乙基]-9-氮杂双环[3.3.1]壬烷-3-基]氨基}-3h-4h,5h-吡咯并[3,2-d]嘧啶-4-酮,58%收率,为白色固体。1hnmr(400mhz,dmso-d6)δ11.38(s,1h),7.44–7.29(m,4h),7.27–7.20(m,1h),7.15(t,j=2.9hz,1h),6.05(t,j=2.4hz,1h),5.81(d,j=8.3hz,1h),4.89(s,1h),4.57(dd,j=7.8,5.1hz,1h),4.42–4.27(m,1h),3.37(s,3h),3.14–2.96(m,2h),2.79(dd,j=13.1,5.1hz,1h),2.68(dd,j=13.0,7.8hz,1h),2.40–2.19(m,2h),2.16–2.00(m,1h),1.89–1.63(m,2h),1.49–1.31(m,3h),1.08–0.94(m,2h).13cnmr(101mhz,dmso-d6)δ154.53,149.73,145.05,128.24,127.73,127.14,126.57,112.28,101.11,71.39,61.31,51.48,49.95,43.34,32.34,27.71,26.78,26.33,14.22.hrmsm/z408.2405(m+h+,c23h29n5o2,requires407.2321).
实施例11、本发明化合物11的合成
与实施例10类似的方法,由化合物9(100mg,0.75mmol)和(r)-2-溴-1-(吡啶-2-基)乙-1-醇(162mg,0.8mmol)制备得到化合物11。
化合物11:3-甲基-2-{[(1r,3r,5s)-9-[(2s)-2-羟基-2-(吡啶-2-基)乙基]-9-氮杂双环[3.3.1]壬烷-3-基]氨基}-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮,产率为47%,白色固体。
1hnmr(400mhz,dmso-d6)δ11.38(s,1h),8.57–8.43(m,1h),7.79(td,j=7.7,1.9hz,1h),7.53(d,j=7.8hz,1h),7.25(dd,j=7.4,4.9hz,1h),7.15(t,j=2.9hz,1h),6.07(t,j=2.4hz,1h),5.80(d,j=8.3hz,1h),5.10(s,1h),4.62(dd,j=7.9,4.1hz,1h),4.39–4.26(m,1h),3.37(s,3h),3.13–2.96(m,3h),2.70(dd,j=13.1,7.9hz,1h),2.29(dp,j=16.2,5.1hz,2h),2.15–2.01(m,1h),1.86–1.67(m,2h),1.47–1.33(m,3h),1.00(d,j=12.8hz,2h).13cnmr(101mhz,dmso-d6)δ163.80,154.53,149.72,148.66,145.03,136.80,127.73,122.45,121.03,112.26,101.12,72.86,59.56,51.48,49.98,43.31,32.38,27.71,26.71,26.28,14.22.hrmsm/z409.2359(m+h+,c22h28n6o2,requires408.2274).
实施例12-17、本发明化合物12-17的合成
(1)制备各中间体:
化合物12的中间体制备:
使用制备2-氯-3-甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮所述的方法,由2-氯-4-氧代-3h,4h,5h-吡咯并[3,2-d]嘧啶-5-羧酸酯(2.0g,7.42mmol)和碘乙烷(1.5g,9.65mmol)制备2-氯-3-乙基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮,51%收率,为白色固体。
1hnmr(400mhz,dmso-d6)δ12.29(s,1h),7.43(t,j=2.9hz,1h),6.35(dd,j=2.9,2.0hz,1h),4.24(q,j=7.1hz,2h),1.26(t,j=7.1hz,3h).
化合物13的中间体制备:
使用制备2-氯-3-甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮所述的方法,由2-氯-4-氧代-3h,4h,5h-吡咯并[3,2-d]嘧啶-5-羧酸酯(2.0g,7.42mmol)和3-溴丙-1-烯(1.17g,9.65mmol)制备2-氯-3-(丙-2-烯-1-基)-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮,49%收率,为白色固体。
1hnmr(400mhz,dmso-d6)δ12.33(s,1h),7.46(t,j=2.9hz,1h),6.38(t,j=2.4hz,1h),6.02–5.90(m,1h),5.20(dq,j=10.5,1.6hz,1h),5.02(dq,j=17.1,1.7hz,1h),4.83(dt,j=4.9,1.8hz,2h).
化合物14的中间体制备:
使用制备2-氯-3-甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮所述的方法,由2-氯-4-氧代-3h,4h,5h-吡咯并[3,2-d]嘧啶-5-羧酸酯(2.0g,7.42mmol)和4-溴丁-1-烯(1.30g,9.65mmol)制备3-(丁-3-烯-1-基)-2-氯-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮,34%收率,为白色固体。
1hnmr(400mhz,dmso-d6)δ12.29(s,1h),7.44(t,j=2.9hz,1h),6.35(dd,j=2.9,2.0hz,1h),5.90–5.80(m,1h),5.09–5.00(m,2h),4.32–4.22(m,2h),2.45(q,j=7.1hz,2h).
化合物15的中间体制备:
使用制备2-氯-3-甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮所述的方法,以15%(2.0g,7.42mmol)和1-溴丁-2-烯(1.30g,9.65mmol)制备3-(丁-2-烯-1-基)-2-氯-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮,39%收率,为白色固体。
1hnmr(400mhz,dmso-d6)δ12.31(s,1h),7.45(t,j=3.0hz,1h),6.36(dd,j=2.8,2.0hz,1h),5.64–5.52(m,2h),4.81–4.70(m,2h),1.80–1.72(m,1h),1.68–1.62(m,2h).
化合物16的中间体制备:
在0℃下,将nah(60%在矿物油中,400mg,10.0mmol)分批加入到搅拌的2-氯-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮(1.2g,7.08mmol)的无水dmf(30ml)溶液中。20分钟后,加入碘甲烷(2.27g,16.0mmol)。将混合物在60℃下反应5小时。冷却至室温后,将反应混合物用水稀释并用乙酸乙酯萃取。减压浓缩合并的有机相,残余物通过柱色谱(pe/ea10:1-2:1)纯化,得到2-氯-3,5-二甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮(1.09g,78.2%),为白色固体。
1hnmr(400mhz,dmso-d6)δ7.43(d,j=2.9hz,1h),6.30(d,j=2.9hz,1h),3.98(s,3h),3.58(s,3h).
化合物17的中间体制备:
使用制备2-氯-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮所述方法,由2,4-二氯噻吩并[3,2-d]嘧啶(2.0g,9.75mmol)制备2-氯-3h,4h-噻吩并[3,2-d]嘧啶-4-酮(1.73g,9.27mmol,95%),为黄色固体。
使用制备2-氯-3,5-二甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮所述的方法,由2-氯-3h,4h-噻吩并[3,2-d]嘧啶-4-酮(1.73g,9.27mmol)和碘甲烷(1.8g,12.7mmol)制备2-氯-3-甲基-3h,4h-噻吩并[3,2-d]嘧啶-4-酮(1.43g,两步产率73%),为黄色固体。
1hnmr(400mhz,dmso-d6)δ8.24(d,j=5.2hz,1h),7.37(d,j=5.2hz,1h),3.64(s,3h).
(2)化合物12-17的制备
以上述各中间体为原料,利用与实施例2中步骤(2)相似的方法制备化合物12-17,化合物表征信息如下表
化合物18-32使用以下通用合成路线制备:
实施例18、本发明化合物18的合成
(1)中间体2的制备
向装有磁力搅拌棒的压力瓶(100ml)中加入化合物中间体1(2.5g,8.19mmol),碳酸银(2.26g,8.19mmol),pd(oac)2(184mg,0.82)。毫摩尔),6-碘-2,3-二氢-1,4-苯并二恶英(5.0g,19.1mmol),2,6-二甲基苯甲酸(307mg,2.05mmol)和30ml叔丁醇。将容器用氩气冲洗,用卷边盖密封并加热至120℃。24小时后,将反应容器从油浴中取出,冷却至室温,并将二氯甲烷(50ml)加入到反应混合物中。将混合物充分搅拌10分钟,过滤除去固体,再用二氯甲烷(50ml)冲洗。将合并的滤液减压浓缩,残余物通过柱色谱纯化,得到中间体2。
中间体2:(3r,5r)-3-(2,3-二氢-1,4-苯并二氧杂环己烯-6-基)-5-(吡啶-2-酰氨基)哌啶-1-羧酸叔丁酯(2.36g,5.37mmol,65.6%),为白色固体。
1hnmr(400mhz,dmso-d6)δ8.73–8.60(m,2h),8.08–7.97(m,2h),7.61(ddd,j=7.4,4.7,1.5hz,1h),6.83–6.68(m,3h),4.32–4.16(m,4h),4.09(d,j=12.2hz,1h),3.99–3.87(m,2h),2.01–1.86(m,2h),1.42(s,9h).手性hplc(chiralpakie-hcolumn,4.6mm×25cm,30%etoh/hexane,1ml/min):rt=28.43min,>99%ee.
(2)中间体3的制备
步骤i.向搅拌的中间体2(2.3g,5.23mmol)的二氯甲烷溶液中加入三氟乙酸(4ml)。将所得混合物在室下搅拌4小时。然后减压除去溶剂,将粗产物再溶于水(50ml)中。用15%水溶液将溶液碱化至ph10。用naoh(80ml×3)萃取naoh。将合并的有机层用无水na2so4干燥,过滤,并真空浓缩,得到n-[(3r,5r)-5-(2,3-二氢-1,4-苯并二氧杂环己烯-6-基)哌啶-3-吡啶-2-甲酰胺(1.45g,4.27mmol,81.6%),为浅黄色固体,其不经进一步纯化在下一步直接使用。
1hnmr(400mhz,dmso-d6)δ8.68–8.59(m,1h),8.45(d,j=8.7hz,1h),8.08–7.92(m,2h),7.60(ddd,j=7.4,4.8,1.5hz,1h),6.76(d,j=8.1hz,1h),6.72–6.62(m,2h),4.31–4.10(m,4h),4.01–3.88(m,1h),3.17(d,j=3.6hz,1h),3.07–2.95(m,1h),2.94–2.84(m,1h),2.69–2.58(m,1h),2.48–2.38(m,2h),2.33(t,j=11.7hz,1h),2.01–1.91(m,1h),1.77(q,j=12.1hz,1h).
步骤ii.搅拌的n-[(3r,5r)-5-(2,3-二氢-1,4-苯并二氧杂环己烯-6-基)哌啶-3-基]吡啶-2-甲酰胺的溶液(1.45g)加入37%w/v甲醛(0.42ml),4.27mmol)和冰醋酸(0.1ml)的甲醇(50ml)溶液。然后分批加入三乙酰氧基硼氢化钠(2.0g,9.44mmol)(每20分钟0.5g)。最后加入2小时后,真空除去溶剂,将残余物在乙酸乙酯和水之间分配。将双相溶液用乙酸乙酯萃取两次。然后将合并的有机物用盐水洗涤两次,用na2so4干燥,过滤并浓缩。通过柱色谱纯化残余物,得到中间体3。
中间体3:n-[(3r,5r)-5-(2,3-二氢-1,4-苯并二氧杂环己烯-6-基)-1-甲基哌啶-3-基]吡啶-2-甲酰胺(1.1g,3.11mmol,72.9%),为白色固体。
1hnmr(400mhz,dmso-d6)δ8.64(dt,j=4.9,1.3hz,1h),8.53(d,j=8.7hz,1h),8.07–7.93(m,2h),7.60(ddd,j=7.6,4.7,1.5hz,1h),6.81–6.66(m,3h),4.28–4.17(m,4h),4.15–4.02(m,1h),2.91(dd,j=10.1,4.1hz,1h),2.83–2.72(m,2h),2.21(s,3h),2.01–1.76(m,3h),1.67(q,j=12.0hz,1h).
(3)中间体4的制备
将化合物中间体3(1.1g,3.11mmol)悬浮在100ml圆底烧瓶中的i-proh(40ml)中。加入naoh(1.24g,31.1mmol)。将反应混合物在85℃下搅拌18小时。然后减压除去溶剂,加入水(50ml)。将溶液用乙酸乙酯(50ml×2)萃取,经na2so4干燥,过滤,并除去溶剂,得到中间体4。
中间体4:(3r,5r)-5-(2,3-二氢-1,4-苯并二氧杂环己烯-6-基)-1-甲基哌啶-3-胺(593mg,2.39mmol,76.7%),为浅黄色固体无需进一步纯化。
1hnmr(400mhz,dmso-d6)δ6.75(d,j=8.1hz,1h),6.71–6.60(m,2h),4.28–4.13(m,4h),2.84–2.59(m,4h),2.15(s,3h),1.89–1.78(m,1h),1.67(t,j=10.7hz,1h),1.59–1.28(m,3h),1.04(q,j=12.0hz,1h).
(4)化合物18的制备
用2-氯-3-甲基-3h,4h,5h-吡咯并[3,2-d]嘧啶-4-酮(200mg,1.09mmol)和中间体4(325mg,1.31mmol)处理n,n-二异丙基乙胺(183mg,1.42mmol)在nmp(5ml)中的溶液。将所得混合物加热至150℃并在该温度下搅拌2小时。冷却至室后,将混合物用水稀释并用乙酸乙酯萃取。将合并的有机相用盐水洗涤,用na2so4干燥,并真空浓缩。通过柱色谱纯化残余物,得到化合物18。
化合物18:2-{[(3r,5r)-5-(2,3-二氢-1,4-苯并二恶英-6-基)-1-甲基哌啶-3-基]氨基}-3-甲基-3h,4h,5h-pyrrolo[3,2-d]嘧啶-4-酮(53mg,134mmol,12.3%),为白色固体。
1hnmr(400mhz,dmso-d6)δ11.42(s,1h),7.15(t,j=2.9hz,1h),6.82–6.69(m,3h),6.05(t,j=2.4hz,1h),5.98(d,j=7.8hz,1h),4.27–4.13(m,5h),3.35(s,3h),3.09(dd,j=10.7,4.3hz,1h),2.90–2.76(m,2h),2.21(s,3h),2.02(d,j=10.2,6.4hz,1h),1.89–1.77(m,2h),1.55(q,j=12.2hz,1h).13cnmr(101mhz,dmso-d6)δ154.46,149.55,144.79,143.63,142.31,137.10,127.77,120.08,117.31,115.95,112.40,101.17,64.54,64.44,62.73,60.33,48.55,46.12,40.82,37.17,27.70.hrmsm/z396.2035(m+h+,c21h25n5o3,requires395.1957).手性hplc(chiralpakie-hcolumn,4.6mm×25cm,i-proh/hexane/etn3=30:70:0.14,1ml/min):rt=31.54min,>99%ee.
实施例19-32、本发明化合物19-32的合成
以实施例18类似的方法制备化合物19-32,化合物表征信息如下表:
以下通过试验例证明本发明制备的化合物的有益效果。
试验例1、本发明化合物对pcaf溴域蛋白的活性表征
(1)试验方法
本发明使用等温滴定量热法(itc)和差示扫描荧光法(dsf)评估本发明制备的化合物对pcaf溴结构域的活性
等温滴定量热实验使用microcalitc200微量热仪(malverninstruments)进行亲和力kd值的测定。所有测试均在25℃下,使用25mmhepes(ph7.5),300mmnacl,0.5mmtcep的缓冲液体系。在实验之前,将化合物直接在相同批次的缓冲液中稀释。每次实验都是反向滴定实验(注射器中吸入pcaf溴域蛋白和样品池中注入小分子)。初始滴定0.4μl蛋白,然后每隔3分钟滴定2μl蛋白,连续19次。滴定方案中,第一次滴定(通常为0.4μl)是为了在滴定之前除去注射器中捕获的气泡。从每个实验中减去背景稀释热。使用δg=δh-tδs=-rtlnka计算热力学参数,其中kd=1/ka。δg,δh和δs分别是自由能,焓和熵的变化。在数据分析中使用的是独立单点结合模型。
差示扫描荧光实验使用bio-radcfx96rt-pcr仪进行热位移δtm的测定。dsf测试时进行三次独立实验,在10mmhepesph7.5,500mmnacl的缓冲体系中,pcaf溴域蛋白的终浓度为2μm,待测试化合物终浓度为10μm,并以1:1000的稀释度添加syproorange染料(thermofisherscientific),样品池的溶液总体积为20μl体积,dmso终浓度控制在0.1%。测试时首先将样品在25℃下平衡3分钟;然后以1℃/min的速度从25℃加热至95℃。使用cfxmaestro软件记录原始荧光数据,并按照文献方法计算热熔温度变化。
(2)试验结果
实验测定的最终化合物对pcaf溴域的活性如下:
备注:
a化合物1的dsf测试浓度为20μm;
bpcaf溴域itckd(μm):<0.2,表示亲和力很好;pcaf溴域itckd(μm):0.2~1,表示亲和力较好;pcaf溴域itckd(μm):>1,表示亲和力较差。
试验结果表明,本发明制备的嘧啶酮衍生物对pcaf溴域具有较高的活性,其与pcaf溴结构域的亲和力较高,特别是化合物2,18,20-29,其与pcaf溴结构域的kd值都在0.1μm左右(亲和力数值越小,化合物结合亲和力越高,活性越好)。
试验例2、本发明化合物对pcaf溴域的化学活性表征
(1)试验方法
选择上述实验例1中活性较好的化合物,进一步做了均相时间分辨荧光(htrf)生物化学活性测试。以2017年牛津大学报道l-moses为阳性对照。
实验使用cisbioepigeneousbindingdomainkitb(62bdbpeg)试剂盒,gst-pcaf溴域和生物素化的底物46,进行htrf测定。生物素化的底物46由p.e.brennan博士(牛津大学)提供。将4μlgst-pcaf溴域(100nm),2μl待测试化合物,4μl化合物46(500nm),5μlsa-xl665(250nm)和5μl1×gstab-eu3+加入96孔板(cisbio66pl96025),然后将96孔板密封并在室温下孵育15小时。使用cytationhybridmulti-modereader仪器记录读数,其中激发滤光片为337nm,荧光测量为620和665nm(积分延迟为60μs,积分时间为400μs),根据拟合的曲线计算半数抑制浓度(ic50)。
(2)试验结果
htrf测试活性结果见下表:
在htrf测试中,化合物2,6,18,20-29的半数抑制浓度(ic50)全都小于100nm,其中化合物18的ic50达到了7nm,活性达到了同靶点世界最好化合物同一水平。2017年牛津大学报道l-moses为pcaf的高效选择性抑制剂,在此,l-moses作为阳性对照,在htrf实验中测得的ic50为36nm,本专利中的化合物18活性比l-moses好5倍。
试验例3、本发明制备的化合物在细胞上对pcaf溴域的活性评价
(1)试验方法
化合物18是上述化合物中对pcaf活性最好的一个,选择其在细胞上对pcaf溴域的活性使用nanobret实验测定。
将hek293t细胞(4×105/ml)置于6孔板中,并用组蛋白h3.3-halotag和pcaf-纳米荧光素酶(promega)共转染。转染20小时后,将细胞消化,收集并交换到含有4%fbs并且不含酚红的dmem培养基中。将细胞密度调整至2×105/ml,然后在不存在(空白对照)或存在100nmnanobret618荧光配体(promegan1661)的情况下重新接种到96孔测定白板(corningcostar#3917)中。将培养基稀释过的化合物或dmso(载体对照)以指定浓度加入96孔板中。之后,将96孔板在5%co2存在下于37℃孵育18小时。使用培养基将nanobretnano-glo底物(promegan1661)稀释100倍,然后向每个样品孔中加入25μl。使用配备470/80nm和610/60nm滤光片的thermoscientificvarioskanlux在10分钟内记录读数。校正的bret比率计算如下公式:nanobret校正比率=配体(610nm/470nm)-空白对照(610nm/470nm)bret比率表示为millibret单位(mbu),其中1mbu对应于校正的bret比率乘以1000。
(2)试验结果
如图1所示,化合物18在hek293t细胞中可以剂量依赖性置换组蛋白h3.3-halotag与全长pcaf-nanoluc的结合,其ic50为376nm,表明化合物18能够通过细胞膜并在细胞内靶向pcaf。
上述试验例证明,本发明制备的化合物与pcaf溴结构域的亲和力较高,其能够很强地结合pcaf溴结构域,并作为pcaf溴结构域抑制剂,抑制pcaf溴结构域与乙酰化赖氨酸相互作用,可以进一步作为潜在的治疗pcaf相关疾病或症状的药物,如癌症、hiv感染和神经炎症。
综上所述,本发明提供了一种式(ⅰ)所示的化合物或其药学上可接受的盐、晶型、溶剂合物。所述化合物可用作溴结构域的抑制剂,抑制pcaf溴结构域与乙酰化赖氨酸相互作用,可以进一步作为潜在的治疗pcaf相关疾病或症状的药物,如癌症、hiv感染和神经炎症。
- 还没有人留言评论。精彩留言会获得点赞!